Lampiran 3.Gambar biji kelor (Moringa oleifera Lam.)
Biji kelor yang terdapat di dalam buah
Lampiran 4. (Lanjutan)
Serbuk biji kelor
Lampiran 4. Hasil pemeriksaan mikroskopik serbuk simplisia biji kelor Hasil pemeriksaan mikroskopik serbuk simplisia biji kelor (perbesaran 10x40)
Keterangan :
1. Minyak atsiri
2. Sklerenkim
3. Parenkim
4. Serat sklerenkim
Lampiran 5. (lanjutan)
Hasil pemeriksaan pengecatan gram untuk masing masing bakteri
1 2
Keterangan :
1. bakteriEscherichia coli
Lampiran6.Perhitungan penetapan kadar air simplisia biji kelor
a. Berat sampel = 5,074 g
Volume I = 1,05 ml
Volume II = 1,15 ml
Kadar air = 1,15-1,05
5,074 x 100% = 1,970%
b. Berat sampel = 5,069 g
Volume I = 1,15 ml
Volume II = 1,25 ml
Kadar air
=
1,25-1,155,069 x 100% = 1,972%
c. Berat sampel = 5,075 g
Volume I = 1,25 ml
Volume II = 1,45 ml
Kadar air = 1,45-1,25
5,075 x 100% = 3,940%
Kadar air rata-rata = (1,970 + 1,972 + 3,94 )%
3 = 2,627%
Kadar air =
Volume II - Volume ILampiran 6.Perhitungan penetapankadar sari larutdalam air simplisia biji kelor
Kadar sari = Berat sari Berat sampel x
100
Lampiran 7.Perhitungan penetapankadar sarilarutdalam etanol simplisia biji kelor
Kadar sari = Berat sari Berat sampel x
100
Lampiran 8.Perhitungan penetapankadarabu total simplisia biji kelor
a. Berat sampel = 2,121 g
Berat abu = 0,1117 g
Kadar abu = 0,1262
2,0041 x 100 % = 6,29 %
b. Berat sampel = 2,0006 g
Berat abu = 0,094 g
Kadar abu = 0,094
2,006 x 100% = 4,685%
c. Berat sampel = 2,005 g
Berat abu = 0,134 g
Kadar abu = 0,134
2,0050 x 100% = 6,683%
Kadar abu total rata-rata = (6,29 + 6,71 + 6,08)%
3 = 5,735% Kadar abu total= Berat abu
Lampiran 9.Perhitungan penetapankadarabu tidaklarutdalamasam simplisia
Sampel I Berat sampel = 2,004 g
Berat abu = 0,0461 g
Kadar abu = 0,0461
2,004 x 100% = 2,30 %
Sampel II Berat sampel = 2,006 g
Berat abu = 0,0296 g
Kadar abu = 0,0296
2,006 x 100% = 1,475%
Sampel III Berat sampel = 2,005 g
Berat abu = 0,031 g
Kadar abu = 0,0316
2,0050 x 100% = 1,576 %
Kadar abu yang tidaklarutdalamasam rata-rata
=
(2,30 + 1,475 + 1,576)%3 = 1,78%
Kadar abu yang tidaklarutdalamasam
=
Berat abuLampiran 10. Bagan kerja penelitian
Dikeluarkan bijinya
Dicuci, ditiriskan, dan dikeringkan
ditimbang berat basahnya
disimpan dalam wadah yang tertutup rapat sebelum digunakan
Biji kelor
Simplisia Biji
Simplisia
Karakterisasi Skrining fitokimia Ekstraksi
• kadar air
• kadar sari larut dalam air • kadar sari larut dalam
Lampiran 10. (Lanjutan)
dimasukkan ke dalam wadah tertutup
direndam dalam cairan penyari etanol selama 3 jam
dimasukkan massa kedalam perkolator
ditutup mulut perkolator , dibiarkan selama 24 jam
dibuka kran perkolator, dibiarkan cairan perkolat menetes dengan kecepatan 1ml/menit
ditampung dalam botol
dipindahkan kedalam bejana bertutup
dihentikan percolator apabila 500 mg cairan perkolat terakhir, diuapkan diatas penangas air dan tidak meninggalkan sisa
dipekatkan denganrotaryevaporator Perkolat
Ekstrak kental (67,89 g)
senyawa golongan:
Skrining fitokimia Uji aktivitas antibakteri 500 g serbuk simplisia
• Konsentrasi Hambat Minimum
Lampiran 10. (Lanjutan)
diambil dengan jarum ose steril
ditanam pada media nutrient agar miring
diinkubasi pada suhu 37oC selama 24 jam
disuspensikan dalam 10 ml media nutrient broth steril
diukur kekeruhan suspensi bakteri
menggunakan spektrofotometer visible pada panjang gelombang 580 nm sampai diperoleh nilai transmitan 25%
ditambahkan 5 ml media nutrient broth ke
dalam tabung reaksi
dimasukkan 0,1 mL inokulum ke dalam
tabung reaksi
dihomogenkan
dimasukkan larutan uji 0,1 mL kedalam cawan petri
ditambahkan 15 mL media NA (Nutrient Agar)
dihomogenkan
didiamkan selama 10-15 menit
diinkubasi pada suhu 37oC selama 18 - 24 jam
Hasil dinyatakan sebagai Konsentrasi
Lampiran 11Hasil uji dilusi dari setiap konsentrasi pada masing masing bakteri.
A B
C D
Keterangan
A : Hasil uji dilusi dari setiap konsentrasi pada masing masing bakteri. B : Hasil uji dilusi untuk bakteri Staphylococcus aureus
C :Hasil uji dilusi untuk bakteri Escherichia coli.
DAFTAR PUSTAKA
Cowan. (1999). Plant Product As Antimicrobial Agents. Oxford: Miamy University. Halaman 331.
Depkes RI. (1980). Materia Medika Indonesia. Jilid IV. Cetakan I. Jakarta: Direktorat Jendral Pengawasan Obat dan Makanan. Halaman 94-98.
Depkes RI. (1995). Materia Medika Indonesia. Jilid VI. Cetakan VI. Jakarta: Direktorat Jendral Pengawasan Obat dan Makanan. Halaman 247-251, 199-304, 321-325.
Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan RI. Halaman 9, 33.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan RI. Halaman 855, 896, 898, 1035.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 1, 10-11.
Dwidjoseputro.(1978). Dasar- Dasar Mikrobiologi.Jakarta : Penerbit Djambatan. Halaman 15-17.
Dzen, S.M., Santoso, S., Roekistiningsih., dan Winarsih S. (2003). Bakteriologi Medik. Malang: Bayumedia Publishing. Halaman 31-32, 120.
Eilert U, Wolters B, Nadrtedt A. (1981). The antibiotic principle of seeds of Moringa oleifera and Moringa stenopetala.Planta. Med 42: 55–61.
Farnsworth, N. R. (1966). Biological and Phytochemical Screening of Plants, Journal of Pharmaceutical Sciences. Volume 55.Number 3. Chicago: Reheis Chemical Company. Halaman 262-264.
Ferawaty, A.S., Agus, S., dan Delianis, P. (2012).Potensi Antibakteri Ekstrak Rumput Laut Terhadap Bakteri Penyakit Kulit Pseudomonas aerufinosa, Staphlococcus epidermis dan Micrococcus luteus.Journal of Marine Research.1(2):152-160.
Guether, E. 1987.Minyak Atsiri. Jakarta: Universitas Jakarta. Halaman 21-23.
Harborne, J. B. (1987). Phytochemical Method. Terbitan Kedua. Penerjemah: Kosasih Padmawinata dan Iwang Soediro. Metode Fitokimia. Bandung: Penerbit ITB. Halaman 147.
915-Holt, G.J., Kneg, N.R., Sneath, A.H., Starley, T.J, Witirams, T.S. (1988). Ninth edition.Bergey’s Manual Od Determinative Bacteriology. London: Williams & Wilkins Company. Halaman 187.
Kiswandono, A.A. (2008). Pengaruh Proses Maserasi & Refluks pada Daun dan Biji Kelor (Moringa oleifera Lam.)Terhadap Identifikasi dan Rendemen Senyawa Bioaktif yang dihasilkan. Medan: Universitas Trikarya. Halaman 45-48.
Krisnadi, D. (2012). E-Book Kelor Super Nutrisi. Diakses: 10 Februari 2015. http: www.kelorina.com. Halaman 25, 29, 56-57.
Kurniasih.(2013).Khasiat dan Manfaat Daun Kelor. Yogyakarta: Pustaka Baru Press. Halaman 166-169.
Lay, W.B. (1994). Analisis Mikrobiologi di Laboratorium. Jakarta: PT. Raja Grafindo Persada. Halaman71-73.
Madduluri, S., Rao, B. K., dan Taram, S. B. (2013).In Vitro Evaluation of Antibacterial Activity of Five Indigenous Plants Extract Againts Five Bacterial Pathogens of Human. International Journal of Pharmacy and Pharmaceuticals Science.5(4): 683-684.
Madsen M, Schlundt J, Omer El-FE. (1987). Effect of water coagulation by seeds of Moringa oleifera on bacterial concentration.J Trop Med Hyg.90: 101– 109.
Moyo, B. (2012). Antimicrobial activities of Moringa oleifera Lam leaf extracts. African Journal of Biotechnology 11(11): 2797-2802.
Olsen A. (1987). Low technology water purification by bentonite clay and Moringa oleifera seed flocculation as performed in Sudanese villages: effects on Schistosoma mansoni cercariae. Water Res. 21: 517–522.
Oxoid. (1982). The Oxoid Manual of Culture Media, Ingredients and Other Laboratory Service. Edisi ke-5. Basingstoke: Oxoid Ltd. Halaman 20.
Palada MC, Changl LC .(2003). Suggested cultural practices for Moringa.International Cooperators’ Guide AVRDC. AVRDC pub # 03– 545 www.avrdc.org. Palada MC, Changl LC. 2003. Suggested cultural practices for Moringa. International Cooperators’ Guide AVRDC. AVRDC
Pratiwi, S.T. (2008). Mikrobiologi Farmasi. Jakarta: Penerbit Erlangga. Halaman 105 117, 140-142.
Rosmarkam, A., dan Yuwono, N.W. (2002).Ilmu Kesuburan Tanah. Yogyakarta: Kanisius. Halaman 37, 43, 63.
Stefanovic, O & Comic, L. (2012).Synergistic Antibacteria Interaction Between Melissa offinalis Extract and Antibiotics. Journal Of Apllied Pharmaceutical Science. Halaman 1-5
Supardi, I dan Sukamto. (1999). Mikrobiologi dalam Pengolahan dan Keamanan Pangan.Bandung : Penerbit Alumni. Halaman 138-141; 175-177; 182-184.
Suriawiria.(2003). Aneka Manfaat Kelor Diakses
Tanggal 29 Oktober 2015. Halaman 2-4
Sutherland, J.P., Folkard, G.K., Mtawali, M.A. and Grant, M.A. (1994).Moringa Oleifera as a Natural Coagulant.Paper 20th WWEDC Confrence Affordable Water Supply And Sanitation. Srilangka: Colombo. Halaman 1-2
Tilong, A.D. (2012). Ternyata Kelor Penakluk Diabetes. Yogyakarta: DIVA Press. Halaman 10–14.
Tim Mikrobiologi FK Universitas Brawijaya. (2003). Bakteriologi Medik. Cetakan Pertama. Malang: Bayu Media Publisher. Halaman 12, 59.
Todar, K. (2008). Staphylococcus aureus and Staphylococcal Disease.USA : Wisconsin, Madison. Available from: textbookofbakteriology.net/staph.html. Halaman 6-8.
Trease, G.E. and Evans, W. C. (1983).Pharmacognosy.Twelfth Edition. London: Bailiere Tindal. Halaman 527-544.
Volk, W.A. dan Wheeler, M.F. (1993).Mikrobiologi Dasar. Jilid I. Alih Bahasa: Markam. Jakarta: Erlangga. Halaman 33-40; 218-219.
BAB III
METODE PENELITIAN
3.1 Tempat Pelaksanaan Penelitian
Penelitian ini dilaksanakan di Laboratorium Farmakognosi dan
Laboratorium Mikrobiologi Fakultas Farmasi Universitas Sumatera Utara pada
bulan September – November.
3.2 Metode Penelitian
Penelitian ini dilakukan dengan metode eksperimental. Metode penelitian
meliputi pengumpulan sampel, pembuatan simplisia, pemeriksaan karakteristik
simplisia, pembuatan ekstrak etanol dari simplisia secara perkolasi, pengujian
golongan senyawa kimia terhadap simplisia dan ekstrak etanol biji kelor,
pembuatan larutan uji ekstrak etanol biji kelor dengan berbagai konsentrasi dan
pengujian aktivitas antibakteri dari ekstrak etanol biji kelor terhadap bakteri gram
positif yaitu Staphylococcus aureus dan bakteri gram negatif yaitu Escherichia
coli.
3.3 Alat dan Bahan 3.2.1 Alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas,
alumunium foil, autoklaf (Fison), blender, bunsen, cawan petri, desikator,
inkubator (Memmert), jarum ose, kapas steril, kertas perkamen, laminar airflow
pipet (Eppendorf), neraca analitik (Metler AE 200), oven (Gallenkomp), penangas
air, pipet tetes, rotary evaporator, spatula, seperangkat alat destilasi,
spektrofotometer visible (Dynamika Halo Vis-10).
3.2.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah amil alkohol,
alfa-naftol, asam asetat glasial, asam sulfat, asam klorida, aquadest, besi (III)
klorida, bismuth (III) nitrat, etanol 96%, eter, iodium, isopropanol, kalium iodida,
kloralhidrat, kloroform, metanol, natrium hidroksida, natrium klorida, natrium
sulfat anhidrat, raksa (II) klorida, serbuk magnesium, serbuk zinkum, simplisia biji
kelor (Moringa oleifera), timbal (II) asetat.
3.2.3 Bakteri Uji
Bakteri yang digunakan adalah Staphylococcus aureus ATCC 6538dan
Escherichia coli ATCC 8939.
3.4 Penyediaan Sampel 3.4.1 Pengambilan sampel
Sampel yang digunakan dalam penelitian ini adalah biji kelor yang
dikeringkan yang berasal dari Jl. Mamyay Pasar I Tembung Tambak Rejo
Kelurahan Kenangan Baru, Kabupaten Deli Serdang, Provinsi Sumatera Utara.
3.4.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan oleh Pusat Penelitian Biologi, Lembaga
3.4.3 Pengolahan sampel
Sampel yang telah diperoleh, dibersihkan dari kotoran-kotoran dicuci
dengan air ledeng yang mengalir, ditiriskan dan ditimbang berat basahnya. Sampel
dikeringkan di lemari pengering dengan suhu 400C hingga kering lalu ditimbang
sebagai berat kering. Selanjutnya simplisia diblender dan disimpan dalam kantung
plastik.
3.5 Pemeriksaan Karakterisasi Simplisia 3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan terhadap serbuk simplisia biji kelor
dengan mengamati bentuk, bau, rasa dan warna.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia biji
kelor.Serbuk simplisia ditaburkan di atas objek glass yang telah ditetesi dengan
larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian diamati di bawah
mikroskop.
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode azeotropi (destilasi toluena).
Cara penetapan: kedalam labu alas bulat dimasukkan 200 ml toluena dan 2 mL air
suling, lalu didestilasi selama 2 jam. Toluena dibiarkan mendingin selama 30
menit dan dibaca volume air pada tabung penerima dengan ketelitian 0,05 mL,
kemudian kedalam labu tersebut dimasukkan 5 g simplisia yang telah ditimbang
seksama, lalu dipanaskan hati-hati selama 15 menit. Kecepatan tetesan diatur lebih
kecepatan tetesan hingga 4 tetes tiap detik.Setelah semua air terdestilasi, bagian
dalam pendingin dibilas dengan toluena yang telah jenuh.Destilasi dilanjutkan
selama 5 menit, kemudian tabung penerima dibiarkan mendingin sampai suhu
kamar, sehingga air dan toluena memisah sempurna. Volume air dibaca dengan
ketelitian 0,05 mL. Selisih kedua volume air yang dibaca sesuai dengan
kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung
dalam persen (WHO., 1998).
3.5.4 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk simplisia direndam selama 24 jam dalam 100 mL
air-kloroform (2,5 mL air-kloroform dalam akuades sampai 1 liter) dengan menggunakan
botol bersumbat sambil sekali-kali dikocok selama 6 jam pertama, kemudian
dibiarkan selama 18 jam dan disaring. Sebanyak 20 mL filtrat diuapkan hingga
kering dalam cawan yang berdasar rata yang telah dipanaskan dan ditara.Residu
dipanaskan dalam oven pada suhu 105°C sampai diperoleh bobot tetap (Depkes
RI., 1995).
3.5.5 Penetapan kadar sari larut dalam etanol
Sebanyak 5 g serbuk simplisia direndam selama 24 jam dalam 100 mL
etanol 95% dengan menggunakan botol bersumbat sambil sekali-kali dikocok
selama 6 jam pertama, kemudian dibiarkan selama 18 jam dan disaring. Sebanyak
20 mL filtrat diuapkan hingga kering dalam cawan yang berdasar rata yang telah
dipanaskan dan ditara.Residu dipanaskan dalam oven pada suhu 105°C sampai
diperoleh bobot tetap (Depkes RI., 1995).
3.5.6 Penetapan kadar abu total
dimasukkan kedalam kurs porselin yang telah dipijar dan ditara, kemudian
diratakan. Kurs porselin bersama isinya dipijarkan perlahan-lahan hingga arang
habis, dinginkan, ditimbang sampai diperoleh bobot yang tetap (Depkes RI.,
1995).
3.5.7 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh pada penetapan kadar abu total dididihkan dengan 25
mL asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, kemudian disaring dengan kertas saring, lalu dicuci dengan air
panas. Residu dan kertas saring dipijarkan sampai diperoleh bobot tetap,
didinginkan dan ditimbang sampai diperoleh bobot tetap (Depkes RI., 1995).
3.6 Pembuatan Larutan Pereaksi 3.6.1 Pereaksi Dragendorff
Sebanyak 8 g bismuth (II) nitrat ditimbang, kemudian dilarutkan dalam 20
mL asam nitrat pekat. Sebanyak 27,2 g kalium iodida ditimbang dan dilarutkan
dalam 50 mL air suling. Kedua larutan dicampurkan dan didiamkan sampai
memisah sempurna.Larutan yang jernih diambil dan diencerkan dengan air suling
hingga 100 mL (Depkes RI., 1980).
3.6.2 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam 20 mL air suling, kemudian
ditambahkan sedikit demi sedikit 2 g iodium dan dicukupkan dengan air suling
3.6.3 Pereaksi Mayer
Sebanyak 1,36 g raksa (II) klorida, dilarutkan dalam 60 mL air suling,
kemudian pada wadah lain sebanyak 5 g kalium iodida lalu dilarutkan dalam 10
mL air suling. Kedua larutan dicampurkan dan ditambahkan air suling hingga
diperoleh larutan 100 mL (Depkes RI., 1980).
3.6.4 Pereaksi Molisch
Sebanyak 3 g alfa-naftol ditambahkan beberapa tetes etanol kemudian
dilarutkan dalam asam nitrat 0,5 N hingga 100 mL (Ditjen POM., 1979).
3.6.5 Pereaksi asam klorida 2 N
Sebanyak 17 mL asam klorida pekat diencerkan dalam air suling hingga
100 ml (Ditjen POM., 1979).
3.6.6 Pereaksi asam sulfat 2 N
Sebanyak 5,4 mL asam sulfat pekat diencerkan dengan air suling hingga
100 ml (Ditjen POM., 1979).
3.6.7 Pereaksi natrium hidroksida 2 N
Sebanyak 8,002 g kristal natrium hidroksida dilarutkan dalam air suling
hingga 100 mL (Ditjen POM., 1979).
3.6.8 Pereaksi Lieberman-Burchard
Sebanyak 20 bagian asam asetat anhidrat dicampurkan dengan 1 bagian
asam sulfat pekat dan 50 bagian kloroform, harus dibuat baru (Harborne, 1987).
3.6.9 Pereaksi besi (III) klorida 1% (b/v)
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling hingga 100 mL
3.6.10 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air suling bebas
karbondioksida hingga 100 mL (Ditjen POM., 1979).
3.6.11 Pereaksi kloralhidrat
Sebanyak 50 g kloralhidrat dilarutkan dalam 20 mL air suling (Depkes RI.,
1995).
3.7 Uji Golongan Senyawa Kimia
Skrining fitokimia serbuk simplisia meliputi pemeriksaan alkaloid,
glikosida, steroid/triterpenoid, flavonoid, saponin, tanin dan glikosida antrakinon.
3.7.1 Pemeriksaan alkaloid
Sebanyak 0,5 g serbuk simplisia ditambahkan 1 mL asam klorida 2 N dan
9 mL air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan
disaring. Filtrat dipakai untuk uji alkaloid sebagai berikut:
a. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Mayer
akan terbentuk endapan menggumpal berwarna putih atau kuning.
b. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi
Bouchardat, akan terbentuk endapan berwarna coklat sampai kehitaman.
c. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi
Dragendorff, akan terbentuk endapan berwarna merah atau jingga.
Alkaloid positif jika terjadi endapan atau kekeruhan paling sedikit dua dari
3.7.2 Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia, disari dengan 30 mL campuran etanol 96%
dengan air suling (7:3) direfluks selama 10 menit, didinginkan dan disaring. Pada
20 mL filtrat ditambahkan 25 mL air suling dan 25 mL timbal (II) asetat 0,4 M,
dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 mL campuran
isopropanol dan kloroform (2:3), dilakukan berulang sebanyak 3 kali. Kumpulan
sari pelarut organik ditambahkan natrium sulfat anhidrat, disaring, kemudian
diuapkan pada temperatur tidak lebih dari 50°C, sisanya dilarutkan dalam 2 mL
metanol. Larutan sari air dimasukkan kedalam tabung reaksi selanjutnya diuapkan
di atas penangas air, pada sisa ditambahkan 2 mL air dan 5 tetes larutan pereaksi
molish, ditambahkan hati-hati 2 mL asam sulfat pekat melalui dinding tabung,
terbentuk cincin ungu pada batas kedua cairan menunjukkan adanya glikosida
(Depkes RI., 1995).
3.7.3 Pemeriksaan flavonoid
Sebanyak 10 g serbuk simplisia ditambahkan 10 mL air panas, dididihkan
selama 5 menit dan disaring dalam keadaan panas, kedalam 5 mL filtrat
ditambahkan 0,1 g serbuk magnesium dan 1 mL asam klorida pekat dan 2 mL amil
alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna
merah atau kuning jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.7.4 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 mL air suling lalu
disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil
sebanyak 2 mL dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1 %.Jika
3.7.5 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukkan dalam tabung reaksi,
ditambahkan 10 mL air panas, didinginkan kemudian dikocok kuat-kuat selama 10
detik, jika terbentuk buih setinggi 1 sampai 10 cm yang stabil tidak kurang dari 10
menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N
menunjukkan adanya saponin (Depkes RI., 1995).
3.7.6 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g serbuk simplisia direndam dengan 20 mL eter selama 2 jam,
disaring, filtrat diuapkan dalam cawan penguap dan pada sisanya ditambahkan 20
tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat (pereaksi
Lieberman-Burchard). Apabila terbentuk warna ungu atau merah yang berubah menjadi biru
kehijauan menunjukkan adanya steroida/triterpenoida (Harborne, 1987).
3.8 Pembuatan Ekstrak Etanol Biji Kelor
Sampel yang telah kering sebanyak 500 g kemudian diblender sampai
menjadi serbuk simplisia. Dimasukkan ke dalam bejana tertutup dan direndam
selama 3 jam dengan pelarut etanol 96%. Pindahkan massa sedikit demi sedikit
kedalam perkolator sambil ditekan hati-hati, ulangi dengan cairan penyari
secukupnya sampai cairan mulai menetes dan diatas simplisia masih terdapat
selapis cairan penyari. Tutup perkolator, biarkan selama 24 jam.Biarkan cairan
menetes dengan kecepatan 1mL/menit.Tambahkan berulang ulang cairan penyari
secukupnya sehingga selalu terdapat selapis cairan penyari diatas simplisia, hingga
diperoleh 80 bagian perkolat.Prosedur penampungan perkolat dilakukan sampai
sisa (Ditjen POM., 1979).Perkolat yang diperoleh dipekatkan dengan
menggunakan rotary evaporator pada temperatur ± 40°C sampai diperoleh ekstrak
kental.Sisa penguapan penetapan dilakukan dengan menguapkan 3g – 5g diatas
tangas air.
3.9 Sterilisasi Alat
Alat-alat yang digunakan dalam uji aktivitas antibakteri ini, disterilkan
terlebih dahulu sebelum dipakai.Alat-alat gelas disterilkan di dalam oven pada
suhu 170°C selama 1-2 jam.Media disterilkan di autoklaf pada suhu 121°C selama
15 menit. Jarum ose dan pinset disterilkan dengan cara dibakar dengan nyala
bunsen (Lay, 1994).
3.10 Pembuatan Media
3.10.1 Pembuatan media nutrient agar (NA) Komposisi:
Lab-lemco powder 1,0 g
Yeast extract 2,0 g
Peptone 5,0 g
Sodium chloride 5,0 g
Agar 15 g
Cara Pembuatan:
Sebanyak 28 g media nutrient agar ditimbang dan dimasukkan kedalam
sampai larut.Disterilkan di dalam autoklaf pada suhu 121°C selama 15 menit
(Oxoid, 1982).
3.10.2 Pembuatan nutrient broth(NB) Komposisi :
Lab-lemco powder 1,0 g
Yeast extract 2,0 g
Peptone 5,0 g
Sodium chloride 5,0 g
Cara pembuatan:
Sebanyak 13,0 g media nutrient broth yang sudah jadi ditimbang dan
dilarutkan dengan air suling 1000 mL, lalu dipanaskan sampai larut sempurna.
Media dimasukkan dalam erlenmeyer steril yang bertutup dan disterilkan dalam
autoklaf pada suhu 121oC selama 15 menit (Oxoid, 1982).
3.10.3 Pembuatan agar miring
Sebanyak 3 mL media nutrient agar cair, yang telah dibuat dimasukkan ke
dalam tabung reaksi, kemudian diletakkan pada sudut kemiringan 30-45o dan
dibiarkan hingga media memadat, kemudian disimpan di lemari pendingin (Lay,
1994).
3.11 Pembiakan Bakteri
3.11.1 Pembuatan stok kultur bakteri Staphylococcus aureus dan Escherichia coli
Satu ose bakteri Staphylococcus aureus dan Escherichia coli diambil
agarmiring dengan cara menggores, setelah itu diinkubasi dalam inkubator pada
suhu 35-37°C selama 18-24 jam (Ditjen POM., 1995).
3.11.2 Pembuatan inokulum bakteri Staphylococcus aureus dan Escherichia coli
Dari stok kultur bakteri Staphylococcus aureus dan Escherichia coli yang
telah tumbuh diambildengan jarum ose steril lalu disuspensikan dalam tabung
yang berisi 10 mL larutan nutrient broth. Diukur kekeruhan larutan dengan
menggunakan alat spektrofotometer visible pada panjang gelombang 580 nm
hingga diperoleh transmitan 25-27 % (Ditjen POM., 1995).
3.12 Pembuatan Larutan Uji Ekstrak Etanol Biji Kelor dengan Berbagai Konsentrasi
Ditimbang sebanyak 2,5 g ekstrak etanol biji kelor dilarutkan dengan
pelarut DMSO hingga 5 mL. Konsentrasi larutan uji ekstrak etanol adalah 500
mg/mL.Dibuat pengenceran sampai diperoleh larutan uji ekstrak etanol dengan
konsentrasi (400, 300, 200, 100, 75, 50, dan 25) mg/mL menggunakan pelarut
akuades steril.
3.13 Pengujian Aktivitas Antibakteri Ekstrak Etanol Biji Kelor 3.13.1 Penentuan KHM (Kadar Hambat Minimum)
Larutan uji ekstrak biji kelor yang dipakai terdiri dari konsentrasi (500,
400, 300, 200, 100, 75, 50, dan 25) mg/mL. Dari masing-masing konsentrasi
tersebut diambil sebanyak 0,1mL lalu dimasukkan ke dalam tabung reaksi steril
yang telah berisi nutrient broth (NB) masing masing 5 mL, kemudian diberi label
dipersiapkan sebelumnya dengan menggunakan mikropipet lalu dimasukkan ke
dalam masing masing tabung setelah berisi larutan uji. Masing masing tabung
tersebut diinkubasi pada suhu 37°C selama 24 jam pada inkubator dan diamati
kekeruhan yang terjadi dengan membandingkan tabung-tabung tesebut dengan
kontrol untuk menentukan nilai KHM. Tabung dengan kekeruhan yang mulai
tampak jernih untuk setiap kelompok perlakuan merupakan KHM yaitu
konsentrasi hambat minimal ekstrak atau larutan uji diukur dengan menggunakan
alat spektrofotometer visible pada panjang gelombang 580 nm hingga diperoleh
transmitan.
3.13.2 Penentuan KBM (Kadar Bunuh Minimum)
Penentuan KBM dilakukan dengan cara pada masing-masing tabung uji
dilusi tersebut yang telah diinkubasi selama 24 jam. Kemudian ditanamkan
kedalam media agar (nutrient agar).Metode yang digunakan adalah metode sebar
untuk bakteri Staphylococcus aureus dan Escherichia coli.Penentuan Kadar Bunuh
Minimum ini dilakukan untuk melihat ada tidaknya pertumbuhan koloni bakteri
pada masing masing tabung uji yang mengalami kekeruhan dan dibandingkan
dengan kontrol.Kontrol yang digunakan adalah kontrol ekstrak, kontrol media, dan
kontrol bakteri.Diamati pertumbuhan bakteri berdasarkan koloni yang tumbuh
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan oleh Herbarium Bogoriense, Bidang
Botani, Pusat Penelitian dan Pengembangan Biologi, Lembaga Ilmu Pengetahuan
Indonesia (LIPI), Bogor, Jalan Raya Jakarta–Bogor Km.46, Cibinong.Disebutkan
bahwa tumbuhan yang digunakan adalah biji tumbuhan kelor (Moringa oleifera
Lam.), suku Moringaceae Lampiran 1, halaman 46.
4.2 Pemeriksaan Karakterisasi 4.2.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik pada simplisia biji kelor diperoleh bentuknya
yang menciut, berwarna coklat keputihan, tidak berbau dan berasa kelat.
4.2.2 Pemeriksaan mikroskopik
Hasil pemeriksaan mikroskopik terhadap serbuk simplisia biji kelor
menunjukkan adanya parenkim dengan minyak atsiri, sklerenkim, berkas
pembuluh.
4.2.3 Pemeriksaan karakterisasi simplisia
Hasil pemeriksaan karakterisasi serbuk simplisia biji kelor dapat dilihat
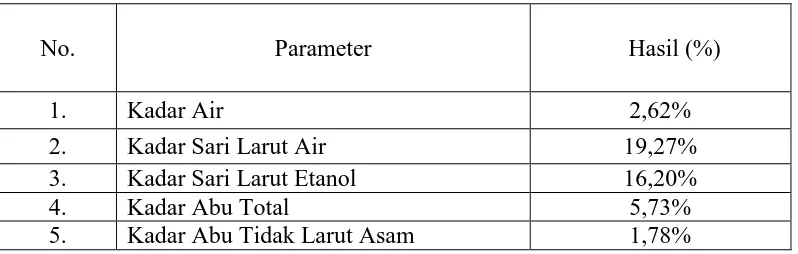
Tabel 4.1 Hasil pemeriksaan karakterisasi serbuk simplisia Biji Kelor
Penetapan kadar air pada simplisia dilakukan untu mengetahui jumlah air
yang terkandung dalam simplisia yang digunakan. Kadar air simplisia ditetapkan
untuk menjaga kualitas simplisia karena kadar air berkaitan dengan kemungkinan
jamurkapang. Hasil penetapan kadar air diperoleh lebih kecil dari 10% yaitu
2,62%. Kadar air yang melebihi 10% dapat menjadi media yang baik untuk
pertumbuhan mikroba, keberadaan jamur atau serangga, serta mendorong
kerusakan mutu simplisia (Trease, 1983 ; WHO.,1992).
Penetapan kadar sari dilakukan menggunakan dua pelarut, yaitu air dan
etanol. Penetapan kadar sari larut air adalah untuk mengetahui kadar senyawa
kimia bersifat polar yang terkandung di dalam simplisia, sedangkan kadar sari
larut dalam etanol dilakukan untuk mengetahui kadar senyawa larut dalam etanol,
baik polar maupun non polar.
Hasil karakterisasi simplisia biji kelor menunjukkan kadar sari yang larut
dalam air sebesar 19,27%, sedangkan kadar sari yang larut dalam etanol adalah
sebesar 16,20%. Hasil penetapan kadar sari menunjukkan bahwa kadar sari larut
dalam air lebih besar daripada kadar sari larut dalam etanol, hal ini menunjukkan
saponin, dan flavonoid sedangkan senyawa senyawa yang dapat larut dalam etanol
adalah glikosida, steroid, dan flavonoid (Depkes RI, 1986).
Penetapan kadar abu dimaksudkan untuk mengetahui kandungan mineral
internal (abu fisiologis) yang berasal dari jaringan tanaman itu sendiri yang
terdapat di dalam sampel (Ditjen POM, 2000; WHO, 1992). Kadar abu tidak larut
asam untuk menunjukkan jumlah silikat, khususnya pasir yang ada pada simplisia
dengan cara melarutkan abu total dalam asam klorida (WHO., 1992). Penetapan
kadar abu pada simplisia biji kelor menunjukkan kadar abu total sebesar 5,73%
dan kadar abu tidak larut asam sebesar 1,78%.
4.3 Ekstraksi Biji Kelor
Hasil perkolasi dari 500 g serbuk simplisia biji kelor dengan pelarut
etanol 96%, dipekatkan dengan menggunakan rotary evaporator dan diuapkan
maka diperoleh ekstrak kental 87,89 g (rendemen 17,57%).Ekstrak etanol yang
diperoleh, dilakukan skrining fitokimia dan kemudian diuji aktivitas antibakteri
terhadap bakteri Staphylococcus aureus dan Escherichia coli
4.4 Skrining Fitokimia
Skrining fitokimia kimia terhadap simplisia dan ekstrak biji kelor
dilakukan untuk mendapatkan informasi golongan senyawa metabolit sekunder
yang terdapat di dalamnya. Adapun pemeriksaan yang dilakukan meliputi
pemeriksaan golongan senyawa alkaloid, flavonoid, glikosida, saponin, tanin dan
Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol biji kelor dapat
dilihat pada Tabel 4.2.
Tabel 4.2 Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol biji kelor No. Parameter Serbuk Simplisia Ekstrak Etanol
1. Alkaloid + +
Keterangan: (+) positif = mengandung golongan senyawa (-) negatif = tidak mengandung golongan senyawa
Pada serbuk simplisia biji kelor (Moringa oleifera Lam.) yang
ditambahkan pereaksi Molish dan asam sulfat pekat akan terbentuk cincin
berwarna ungu pada batas cairan menunjukkan adanya glikosida. Hasil skrining
fitokimia menunjukkan bahwa ekstrak etanol biji kelor mengandung golongan
senyawa kimia berupa steroid/triterpenoid, flavonoid, saponin, dan glikosida.
metabolit sekunder tersebut memiliki aktivitas antibakteri dengan mekanisme kerja
yang berbeda-beda.
Senyawa fenol dan polifenol merupakan kelompok metabolit sekunder
terbesar yang memiliki aktivitas antibakteri, mempunyai gugus hidroksil yang
melekat pada senyawa aromatik. Letak dan jumlah gugus hiroksil pada senyawa
fenol mempengaruhi toksisitas mikroorganisme (Stefanovic, et al., 2012).
Kombinasi senyawa fenol dapat memberikan efek sinergis dan menambah reaksi
antibakteri lebih baik dibandingkan dengan senyawa tunggal. Senyawa fenol pada
konsentrasi rendah mempengaruhi aktivitas enzim, sedangkan pada konsentrasi
Menurut Robinson (1995), flavonoid merupakan senyawa kimia yang
memiliki potensi sebagai antibakteri. Flavonoid merupakan kelompok senyawa
fenol yang mempunyai kecenderungan untuk mengikat protein, sehingga
mengganggu proses metabolisme bakteri, selain itu flavonoid juga berfungsi
sebagai antibakteri dengan cara membentuk senyawa kompleks terhadap protein
ekstraseluler sehingga mengganggu integritas membran sel bakteri.
Mekanisme terpenoid sebagai antibakteri adalah bereaksi dengan porin
(protein transmembran) pada membran luar dinding sel bakteri, membentuk ikatan
polimer yang kuat sehingga mengakibatkan rusaknya porin. Senyawa terpenoid
mudah larut dalam lipid, sifat inilah yang mengakibatkan senyawa ini mudah
menembus dinding sel bakteri gram positif dan gram negatif (Ferawaty, 2012).
Saponin termasuk kedalam kelompok antibakteri yang mengganggu
permeabilitas membran sel bakteri. Mekanisme kerja saponin sebagai antibakteri
adalah menurunkan tegangan permukaan sehingga mengakibatkan naiknya
permeabilitas atau kebocoran sel dan mengakibatkan senyawa intraseluler akan
keluar dari sel (Madduluri, et al., 2013).
4.5 Uji Aktivitas Antibakteri Ekstrak Etanol Biji Kelor
Uji antimikroba menggunkan metode dilusi tabung meliputi dua tahap
untuk menunjukkan efek antimikroba, yaitu KHM dan KBM (Dzen et al., 2003).
Menurut Fereira, et al., 2002 metode dilusi telah dilakukan untuk mengamati
aktivitas antibakteri , karena bahan coba langsung berkontak dengan
mikroorganisme dan langsung diperoleh nilai KHM (Konsentrasi Hambat
37°C selama 24 jam dan KBM (Konsentrasi Bakterisidal Minimal) dari bahan dan
ditanamkan pada petri yang telah berisi media Nutrient Agar (NA) sehingga hasil
penelitian akan lebih representatif. Kadar Bunuh Minimum (KBM)
didefinisikansebagai konsentrasi terendah yang mampumembunuh seluruh
pertumbuhan bakteri danditetapkan pada konsentrasi yang memberikan zona jernih
tanpa pertumbuhan mikroba pada media Agar dengan pengamatan secara
visual.Aktivitas suatu zat antimikroba dalam menghambat pertumbuhan atau
membunuh mikroorganisme tergantung pada konsentrasi antimikroba tersebut
(Tim Mikrobiologi FK Brawijaya, 2003).
Pengujian daya antibakteri dilakukan dengan mengamati
perubahankekeruhan pada tiap konsentrasi bahan coba yaitu 500 400, 300, 200,
100, 75, 50, dan 25 (mg/mL).Penetapan konsentrasi dilakukan dengan metode
dilusi yaitu berdasarkan media cair menggunakan tabung reaksi.Perubahan yang
terjadi ditandai dengan hasil biakan mulai tampak jernih dan ditentukan sebagai
KHM.KHM ditentukan dari konsentrasi pada tabung reaksi yang mulai jernih.
Jernih karena mikroorganisme tumbuh baik dipermukaan dan tidak mempengaruhi
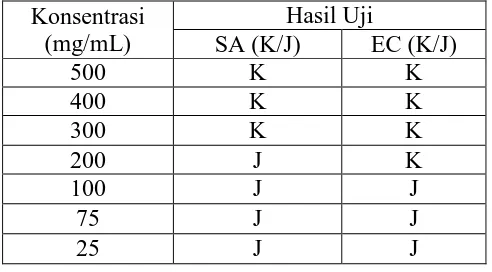
Tabel 4.3 Hasil Uji Aktivitas Antibakteri terhadap Escherichia coli dan Staphylococcus aureus dengan Metode Dilusi untuk menentukan konsentrasi hambat minimum
Tabel 4.4 Hasil % Transmitan Sampel Uji Ekstrak dalam Berbagai Konsentrasi
Penelitian yang dilakukan Moyo, et al., (2012) daun kelor memiliki
aktivitas antimikroba terhadap beberapa bakteri Gram negatif diantaranya adalah
Escherichia coli.Daun kelor mengandung senyawa metabolit sekunder seperti
minyak atsiri, polifenol, dan saponin yang memiliki potensi sebagai antibakteria
Minyak atsiri bekerja dengan mendenaturasi protein ekstraseluler sehingga
mengganggu pembentukan dinding sel, merusak membran sel secara langsung,
dan mempunyai aktifitas antibakteri, karena senyawa ini mampu membentuk
kompleks lipid. Kerusakaan membran sel bakteri dapat menyebabkan
terganggunya transport nutrisi yang melalui membran sel. Sehingga sel bakteri
mengalami kekurangan nutrisi yang diperlukan dalam proses pertumbuhan bakteri
(Guether, 1987).
Konsentrasi bunuh minimum diambil dari konsentrasi larutan uji yang
keruh.Keruh ini disebabkan oleh matinya mikroorganisme yang terdapat didalam
tabung sehingga mengubah warna awal dari media itu sendiri yaitu NB (Nutrient
Broth). Konsentrasi keruh tersebut ditanamkan pada media agar (NA) dan dilihat
tidak adanya pertumbuhan koloni bakteri.Konsentrasi bunuh minimum (KBM)
pada media agar (NA) yang dilakukan dengan metode sebar, pada konsentrasi 400
mg/mL untuk bakteri Escherichia coli hasil yang diperoleh adalah tidak terdapat
pertumbuhan koloni. Ini berarti bahwa konsentrasi bunuh minimum (KBM) yang
diperoleh adalah 400 mg/mL.Sedangkan pada bakteri Staphylococcusaureus tidak
adanya pertumbuhan koloni adalah pada konsentrasi 500 mg/mL yang
menandakan bahwa konsentrasi bunuh minimumnya adalah 500 mg/mL.
A B
Keterangan :
A. Konsentrasi bunuh minimum adalah 500 mg/mL untuk bakteri Staphylococcus aureus
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Hasil penelitian yang dilakukan terhadap biji kelor (Moringa oleifera
Lam.)diperoleh kesimpulan:
a) Pemeriksaan karakteristik serbuk simplisia biji kelor diperoleh kadar air
2,62%, kadar sari larut dalam air 19,27%, kadar sari yang larut dalam etanol
16,20%, kadar abu total 5,73% dan kadar abu yang tidak larut dalam asam
1,78%.
b) Pemeriksaan skrining fitokimia serbuk simplisia dan ekstrak etanol biji
kelor menunjukkan adanya kandungan senyawa kimiaflavonoid, glikosida,
saponin, alkaloid dan steroid/triterpenoid.
c) Uji aktivitas antibakteri menunjukkan bahwa konsentrasi hambat minimum
dan konsetrasi bunuh minimum ekstrak etanol biji kelor terhadap
Staphylococcus aureus adalah pada konsentrasi 200 mg/mL dan
Escherichia colipada konsentrasi 100 mg/mL diamati pada tabung reaksi
yang mulai jernih. Kadar bunuh minimum (KBM) untuk Escherichia coli
adalah 400 mg/mL dan kadar bunuh minimum (KBM) untuk
Staphylococcus aureus adalah 500 mg/mL
5.2 Saran
Diharapkan kepadapeneliti selanjutnya untuk dapat melakukan formulasi
BAB II
TINJAUAN PUSTAKA
2.1Uraian Tumbuhan
Uraian tubuhan meliputi, sistematika tumbuhan, nama daerah, nama asing,
morfologi tumbuhan, penggunaan tumbuhan, serta daerah tumbuh.
2.1.1 Sistematika Tumbuhan
Adapun klasifikasi tanaman kelor menurut (Krisnadi, 2012) adalah sebagai
berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Kelas : Dicotyledoneae
Ordo : Brassicales
Famili : Moringaceae
Genus : Moringa
Spesies : Moringa oleifera Lam.
Nama lokal : Kelor
2.1.2 Nama Daerah
Menurut Kurniasih (2013), ada beberapa sebutan nama untuk tamanan
kelor di beberapa daerah, antara lain: Sunda dan Melayu : Kelor, Sulawesi : Kero,
wori, kelo, atau keloro, Madura: Maronggih, Aceh: Murong, Ternate: Kelo,
2.1.3 Nama Asing
Menurut Krisnadi (2013), kelor dikenal di banyak negara dengan nama
yang berbeda-beda, berikut ini nama-nama kelor di berbagai negara yaitu: Benin:
Kpashima, Burkina Faso: La-Banyu, Cameroon: Paizlava, Chad: Kag n’dongue,
Etiophia: Shelagda, India: Sajna, Myanmar: Dandalonbin, Laos: B’Loum,
Malaysia: Kelur, Brazil: Cedra, Inggris: Drumstick tree, Spanyol: Moringa.
2.1.4 Morfologi Tumbuhan
Tanaman ini berupa semak atau pohon dan mempunyai umur panjang
(perenial). Batangnya berkayu, tegak, berwarna putih kotor, berkulit tipis dengan
permukaan kasar dan mudah patah. Hal ini dikarenakan jenis kayunya lunak dan
memiliki kualitas rendah. Buahnya berbentuk panjang sekitar 20 – 60 cm, ketika
masih muda berwarna hijau, namun setelah tua warnanya berubah menjadi cokelat,
biji berbentuk bulat berwarna cokelat kehitaman dengan sayap biji ringan,
sedangkan kulit biji mudah dipisahkan sehingga meninggalkan biji yang berwarna
putih (Tilong, 2012).
2.1.5 Kegunaan Tumbuhan
Seiring dengan menyebarnya informasi tentang manfaat dan khasiat
tanaman kelor, kelor mulai dibudidayakan untuk diambil polongnya yang dapat
dimakan (Kurniasih, 2013).
Sebagian masyarakat mengenal tanaman kelor sebagai obat tradisional.
Namun ada pula yang hanya mengenalnya sebagai tanaman biasa saja. Kelor
tumbuh dengan cepat dan mudah untuk diolah. Di beberapa negara, tanaman kelor
diolah dalam bentuk makanan seperti tepung daun kelor, bubur, sirop, teh daun
Biji kelor berkhasiat mangatasi muntah atau mual. Biji kelor yang masak
dan kering mengandung pterigospermin yang pekat hingga bersifat germisida.
Biji tua kelor yang dicampur dengan kulit jeruk dan buah pala dapat menjadi
stimulan, stomakhikum, karminatum, dan diuretikum.Biji kelor juga berkhasiat
antitumor, antiinflamasi, mengobati kutil dan penyakit kulit ringan, sariawan,
lambung, demam, dan rematik.Sedangkan biji tua dengan kulit biji kelor bisa
digunakan untuk penjernih air sebagai pengendap atau koagulan (Tilong, 2012).
Ekstrak biji memberikan efek perlindungan yang menurunkan lipid
peroksida hati, antihipertensi, senyawa isothiocyanate thiokarbamate dan glikosids
telah diisolasi dari fraksi etil asetat dari ekstrak etanol polong kelor. Pengolahan
biji dilakukan untuk penggunaan penjernih air, campuran kosmetik dan pembuatan
minyak kelor (Krisnadi, 2012; Kurniasih, 2013).
2.1.6 Daerah Tumbuh
Kelor (Moringa oleifera Lam.) merupakan tanaman perdu yang tinggi
pohonnya dapat mencapai 10 meter, tumbuh subur mulai dari dataran rendah
sampai ketinggian 1000 meter di atas permukaan laut. Juga dapat tumbuh dengan
baik pada berbagai jenis tanah kecuali tanah berlempung berat dan menyukai pH
tanah netral sampai sedikit asam (Kurniasih, 2013).
Tanaman kelor tidak hanya dapat tumbuh dan berkembang di India dan
Indonesia saja, tetapi juga di kawasan tropis lainnya di dunia. Kondisi lahan dan
pemeliharaan akan mempengaruhi kandungan unsur hara. Kandungan unsur hara
dalam tanaman berbeda-beda, tergantung pada jenis hara, jenis tanaman,
kesuburan tanah atau jenis tanah, dan pengelolaan tanaman (Kurniasih, 2013;
Secara umum, menurut Kurniasih (2013) parameter lingkungan yang
dibutuhkan tanaman kelor untuk tumbuh dengan baik adalah sebagai berikut:
• Iklim : tropis atau subtropis
• Ketinggian : 0-2000 meter dpl
• Suhu : 25-35°C
• Curah hujan : 250 mm-2000 mm per tahun
• Tipe tanah : berpasir atau lempung berpasir
• pH tanah : 5-9
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak larut menggunakan pelarut cair. Simplisia
yang diekstraksi mengandung senyawa aktif yang dapat larut dan senyawa yang
tidak dapat larut seperti serat, karbohidrat, protein dan lain-lain. Senyawa aktif
yang terdapat dalam berbagai simplisia dapat digolongkan kedalam golongan
minyak atsiri, alkaloida, flavonoida dan lain-lain. Mengetahui senyawa aktif yang
dikandung simplisia akan mempermudah pemilihan pelarut dengan cara yang tepat
(Ditjen POM., 2000).
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat
aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai,
kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang
tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan
2.2.1 Metode ekstraksi
Menurut Ditjen POM (2000), ada beberapa metode ekstraksi yaitu:
1. Cara dingin
Ekstraksi dengan cara dingin terdiri dari:
a. Maserasi
Maserasi adalah proses pengekstraksian simplisia dengan menggunakan
pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruang
(kamar). Maserasi kinetik berarti dilakukan pengadukan yang kontinu
(terus-menerus). Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah
dilakukan penyaringan maserat pertama dan maserat selanjutnya..
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna (exhaustive extraction) yang umumnya dilakukan pada temperatur
ruang. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi antara,
tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) terus menerus
sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan.
2. Cara panas
Ekstraksi dengan cara panas terdiri dari:
a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan
adanya pendingin balik. Umumnya pada metode ini dilakukan pengulangan proses
pada residu pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi
b. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang
umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan
jumlah pelarut relatif konstan dengan adanya pendingin balik.
c. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur ruangan (kamar), yaitu secara umum dilakukan pada temperatur
40-50°C.
d. Infudasi
Infudasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90oC selama 15 menit.
e. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90oC selama 30 menit.
2.3 Bakteri
2.3.1Uraian umum
Nama bakteri berasal dari kata “bakterion” dari bahasa Yunani yang berarti
tongkat atau batang, sekarang nama itu dipakai untuk menyebut sekelompok
mikroorganisme yang bersel satu, berkembangbiak dengan pembelahan diri serta
demikian kecilnya sehingga hanya tampak dengan mikroskop (Dwidjoseputro,
1978). Spesies bakteri dapat dibedakan berdasarkan morfologi (bentuk), komposisi
kimia (umumnya dideteksi dengan reaksi kimia), kebutuhan nutrisi, aktivitas
Ada empat macam fase pertumbuhan mikroorganisme menurut Pratiwi
(2008), yaitu fase lag, fase log (fase esksponensial), fase stasioner, dan fase
kematian.
1. Fase lag
Fase lag merupakan fase adaptasi, yaitu fase penyesuaian mikroorganisme
pada suatu lingkungan baru. Ciri fase lag adalah tidak adanya peningkatan jumlah
sel, yang ada hanyalah peningkatan ukuran sel. Lama fase lag tergantung pada
kondisi dan jumlah awal mikroorganisme dan media pertumbuhan. Bila sel- sel
mikroorganisme diambil dari kultur yang sama sekali berlainan, maka yang sering
terjadi adalah mikroorganisme tersebut tidak mampu tumbuh dalam kultur.
2. Fase log (fase esksponensial)
Fase ini merupakan fase dimana mikroorganisme tumbuh dan membelah
pada kecepatan maksimum, tergantung pada genetika mikroorganisme, sifat
media, dan kondisi pertumbuhan. Sel baru terbentuk dengan laju konstan dan
massa yang bertambah secara eksponensial. Hal yang dapat menghambat laju
pertumbuhan adalah bila satu atau lebih nutrisi dalam kultur habis, sehingga hasil
metabolisme yang bersifat racun akan tertimbun dan menghambat pertumbuhan.
3. Fase stationer
Pada fase ini, pertumbuhan mikroorganisme terhenti dan terjadi
keseimbangan antara jumlah sel yang membelah dengan jumlah sel yang mati.
Terdapat kehilangan sel yang lambat karena kematian diimbangi oleh
pembentukan sel- sel baru melalui pertumbuhan dan pembelahan dengan nutrisi
yang dilepaskan oleh sel- sel yang mati karena mengalami lisis.
Pada fase ini, jumlah sel yang mati meningkat. Faktor penyebabnya adalah
ketidaktersediaan nutrisi dan akumulasi produk buangan yang toksik.
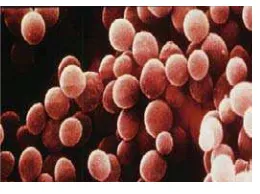
2.3.2Staphylococcus aureus
Staphylococcus aureus termasuk dalam suku Micrococcaceae, merupakan
bakteri gram positif, berbentuk bulat (kokus) atau oval dengan diameter sekitar 1
μm, terdapat tunggal dan berpasangan, secara khas membelah diri pada lebih dari
satu bidang sehingga membentuk gerombolan yang tidak teratur dan menyerupai
buah anggur. Staphylococcus aureus tidak membentuk spora dan termasuk
anaerob fakultatif. Tumbuh lebih cepat dan lebih banyak dalam keadaan aerobik.
Staphylococcus aureus adalah bakteri mesofil dengan suhu pertumbuhan optimum
37oC. Staphylococcus aureushidup sebagai saprofit di dalam saluran-saluran
pengeluaran lendir dari tubuh manusia dan hewan seperti hidung, mulut,
tenggorokan dan dapat pula dikeluarkan pada waktu batuk atau bersin (Supardi
dan Sukamto, 1999).
Gambar 2.Staphylococcus aureus (Todar, 2008)
Menurut Holt (1988), sistematika dari bakteri Staphylococcus aureus yaitu:
Divisi : Schizophyta
Kelas : Schizomycetes
Suku : Micrococcaceae
Genus : Staphylococcus
Spesies : Staphylococcus aureus
muntah, diare, mual, kejang dan kram pada abdominal serta sakit kepala
(ICMSF, 1996).
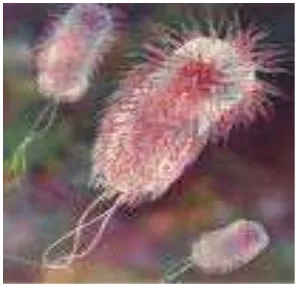
2.3.3Escherichia coli
Bakteri Escherichia coli umumnya merupakan flora normal saluran
pencernaan tubuh manusia dan hewan. Escherichia coli merupakan bakteri gram
negative berbentuk batang, tidak berkapsul, umumnya mempunyai fimbria dan
bersifat motile. Sel Escherichia coli mempunyai ukuran panjang 2,0-6,0 μm dan
lebar 1,1-1,5 μm, tersusun tunggal, berpasangan, dengan flagella peritikus
(Supardi dan Sukamto, 1999).
Gambar 1 Escherichia coli (Todar, 2008)
Menurut Holt (1988), sistematika dari bakteri Escherichia coli adalah
sebagai berikut:
Divisi : Schizophyta
Suku : Enterobacteriaceae
Genus : Escherichia
Spesies : Escherichia coli
Escherichia coli dapat memproduksi enterotoksin. Organ sasaran
enterotoksin adalah usus kecil dan menyebabkan diare sebagai akibat dari
pengeluaran cairan dan elektrolit (Tim Mikrobiologi FK Brawijaya, 2003).
2.4 Faktor-faktor Pertumbuhan dan Perkembangan Bakteri
Pertumbuhan dan perkembangan bakteri dipengaruhi oleh beberapa faktor
seperti zat makanan (nutrisi), temperatur, oksigen dan pH (Pratiwi, 2008).
1. Zat makanan (nutrisi)
Kebanyakan bakteri memerlukan zat-zat anorganik seperti garam-garam
yang mengandung Na, K, Mg, Fe, Cl, S, dan P, sedang beberapa spesies tertentu
masih membutuhkan tambahan mineral seperti Mn dan Mo (Dwijoseputro,1978).
2. Temperatur
Proses pertumbuhan bakteri tergantung pada reaksi kimiawi dan laju reaksi
kimia yang dipengaruhi oleh temperatur. Pada temperatur yang sangat tinggi akan
terjadi denaturasi protein yang bersifat ireversibel, sedang pada temperatur yang
sangat rendah aktivitas enzim akan berhenti. Pada temperatur pertumbuhan
optimal akan terjadi kecepatan pertumbuhan optimal dan dihasilkan jumlah sel
yang maksimal. Menurut Pratiwi, 2008 maka bakteri dapat diklasifikasikan
sebagai berikut:
a. Bakteri psikofil, yaitu bakteri yang dtumbuh pada temperature maksimal
b. Bakteri psikrofil fakultatif, yaitu bakteri yang tumbuh pada temperatur
maksimal 300C, optimal 20-300C,serta dapat tumbuh pada 00C.
c. Bakteri termofil, yaitu bakteri yang tumbuh pada temperatur minimal 450C,
optimal 55-600C, optimal 55-650C, maksimal pada temperatur 1000C.
d. Bakteri mesofil, yaitu bakteri yang dapat tumbuh pada temperatur minimal
15-200C, maksimal 450C, optimal pada 20-450C.
3. Oksigen
Berdasarkan kebutuhan oksigen, dikenal mikroorganisme yang bersifat
aerob dan anaerob. Mikroorganisme aerob memerlukan oksigen untuk bernafas,
sedangkan mikroorganisme anaerob tidak memerlukan oksigen, adanya oksigen
justru akan menghambat pertumbuhannya (Pratiwi, 2008).
4. pH
pH merupakan indikasi penurunan ion hydrogen, peningkatan dan
penurunan konsentrasi ion hydrogen dapat menyebabkan timbulnya ionisasi
gugus-gugus dalam protein, asam amino, dan karboksilat. Hal ini dapat
menyebabkan denaturasi protein yang mengganggu pertumbuhan sel.
Mikroorganisme asidofil tumbuh pada kisaran pH 1,0-5,5; mikroorganisme
neutrofil tumbuh pada kisaran pH 5,5-8,0; mikroorganisme alkalofil tumbuh pada
pH 8,5-11,5 sedangkan mikroorganisme alkalofil eksterm tumbuh pada pH kisaran
≥10.
2.5 Morfologi Bakteri
Berdasarkan morfologinya bakteri dapat dibedakan atas tiga bagian yaitu:
Basil adalah bakteri yang mempunyai bentuk batang atau silinder dan
membelah dalam satu bidang, berpasangan ataupun bentuk rantai pendek atau
panjang.
Basil dapat dibedakan atas:
- Monobasil yaitu basil yang terlepas satu sama lain dengan kedua ujung tumpul.
- Diplobasil yaitu basil yang bergandeng dua dan kedua ujungnya tumpul.
- Streptobasil yaitu basil yang bergandengan panjang dengan kedua ujung tajam.
Adapun contoh bakteri dengan bentuk basil yaitu Eschericia coli, Bacillus
anthracis, Salmonella typhimurium, Shigella dysentriae (Pelczar, et al., 1988).
b. Bentuk kokus
Kokus adalah bakteri yang bentuknya seperti bola-bola kecil, ada tunggal
dan ada yang berpasang-pasangan.
Bentuk kokus ini dapat dibedakan atas:
- Diplokokus yaitu kokus yang bergandeng dua.
- Tetrakokus yaitu kokus yang mengelompok empat.
- Stafilokokus yaitu kokus yang mengelompok dan membentuk anggur.
- Streptokokus yaitu kokus yang bergandengan panjang menyerupai rantai.
- Sarsina yaitu kokus yang mengelompok seperti kubus.
Adapun Contoh bakteri dengan bentuk kokus yaitu Staphylococcus aureus,
Sarcina luten, Diplococcus pneumonia (Volk and Wheeler, 1993).
c.Bentuk spiral
Spiral apat dibedakan atas:
- Spiral yaitu menyerupai spiral atau lilitan.
- Spirochaeta yaitu menyerupai bentuk spiral, bedanya dengan spiral dalam
kemampuannya melenturkan dan melengkukkan tubuhnya sambil bergerak.
Adapun Contoh bateri dengan bentuk spiral yaitu Vibrio cholerae,
Spirochaeta palida (Volk and Wheeler, 1993).
2.6 Pengujian Aktivitas Antimikroba
Pengukuran aktivitas antimikroba dapat dilakukan dengan metode difusi
atau dengan metode dilusi.
a. Metode dilusi
Metode ini digunakan untuk mengukur kadar hambat minimum (KHM)
dan kadar bunuh minimum (KBM). Cara yang dilakukan yaitu dengan membuat
seri pengenceran agen antimikroba pada media yang telah ditambahkan dengan
mikroba uji. Larutan uji agen antimkroba pada kadar terkecil yang terlihat jernih
tanpa adanya pertumbuhan mikroba uji ditetapkan sebagai KHM. Larutan yang
ditetapkan sebagai KHM tersebut selanjutnya dikultur ulang pada media tanpa
penambahan mikroba uji ataupun agen antimikroba, dan diinkubasi selama 18 – 24
jam. Media yang tetap terlihat jernih setelah diinkubasi ditetapkan sebagai KBM
(Pratiwi, 2008).
b. Metode difusi agar
Metode yang paling sering digunakan yaitu metode difusi agar, lazimnya
dikenal dengan sebutan test Kirby & Bauer. Disc yang agen antimiroba diletakkan
pada media agar yang telah ditanami oleh mikroorganisme yang akan berdifusi
mikroorganisme oleh agen antimikroba pada pertumbuhan media agar (Pratiwi,
2008).
c. Turbidimetri
Turbidimetri merupakan metode yang cepat untuk menghitung jumlah
bakteri dalam suatu larutan menggunakan spektrofotometer.Bakteri menyerap
cahaya sebanding dengan volume total sel (ditentukan oleh ukuran dan
jumlah).Ketika mikroba bertambah jumlahnya, semakin besar ukurannya dalam
biakan cair maka terjadi peningkatan kekeruhan dalam biaka.Kekeruhan dapat
disebut optical density (absorpsi cahaya, biasanya diukur pada panjang gelombang
BAB I PENDAHULUAN
1.1 LATAR BELAKANG
Berbagai macam penyakit disebabkan oleh bakteri ditemukan di Indonesia
terutama disebabkan oleh kurangnya kebersihan. Penanganan penyakit yang
disebabkan oleh bakteri selama ini lebih banyak menggunakan obat – obat sintetik
dengan berbagai efek samping yang ditimbulkan. Oleh sebab itu perlu adanya
pengobatan alternatif dengan memanfaatkan bahan-bahan alamiah di sekitar kita.
Pemanfaatan tanaman obat merupakan warisan nenek moyang sejak dulu kala.
Eksplorasi dan budidaya tanaman obat terus dikembangkan dengan tujuan jangka
panjang mengurangi impor bahan baku obat sintetik demi menghemat devisa
negara. Salah satu tanaman yang berkhasiat obat adalah kelor(Kiswandono, 2008).
Di Indonesia daun kelor muda banyak dimanfaatkan sebagai bahan sayuran
oleh sebagian besar penduduk kampung atau desa. Tanaman kelor juga sudah
dikenal luas di lingkungan pedesan sebagai tanaman obat berkhasiat (IKAPI,
2008).
Masyarakat mulai memanfaatkan bagian-bagian tanaman kelor dalam
bentuk segar maupun kering yang kemudian diolah berdasarkan peruntukannya,
misalnya simplisia biji kelor yang dimanfaatkan untuk campuran kosmetik dan
pembuatan minyak kelor (Kurniasih, 2013).
Biji kelor berkhasiat mangatasi muntah atau mual. Biji kelor yang masak
dan kering mengandung pterigospermin yang pekat hingga bersifat
terhadap bakteri Gram positif dan negative.Pterygospermin sebagai senyawa aktif
dalam kelor yang menyebabkan reaksi anti bakteri.Pterygospermin merupakan
senyawa yang tidak stabil, mempunyai titik didik rendah, dan dengan mudah dapat
berubah menjadi benzil isotiosianat (BIT).4-(α-L-rhamnopyranosyloxy)benzyl
isothiocyanate, pterygospermin, dan 4-(α-L-rhamnopyranosyloxy) benzyl
glucosinolate merupakan senyawa antimikroba (Eilert et al. dalam Fahey, 2005).
Penelitian yang dilakukan Moyo, et al. (2012) biji kelor memiliki aktivitas
antimikroba terhadap beberapa bakteri Gram negatif diantaranya adalah
Escherichia coli.Biji kelor mengandung senyawa metabolit sekunder seperti
minyak atsiri, polifenol, dan saponin yang memiliki potensi sebagai antibakteria
dan antifungal.Fuglie (2001) menyatakan bahwa biji kelor (M. oleifera Lamk.)
mengandung saponin 5% dan triterpenoid 5%. Polifenol dan saponin telah
diketahui dapat merusak sel bakteri dengan cara menghambat sintesis protein dan
merusak membran sel.
Tanaman kelormerupakan tanaman paling kaya nutrisi, vitamin, mineral,
anti-oksidan tertinggi dan asam amino esensial lengkap (Krisnadi,
2012).Kelebihan biji kelor sebagai koagulan dibanding koagulan kimia yang biasa
digunakan seperti tawas adalah kemampuannya untuk mengendapkan berbagai ion
logam terlarut dan bakteri-bakteri berbahaya yang diperoleh di lingkungan sekitar
kita (Suriawiria, 2003).
Biji kelor mengandung senyawa bioaktif rhamnosyloxy-benzil-isotiosianat,
yang mampu menetralisir partikel-partikel lumpur serta logam yang terkandung
sangat potensial digunakan sebagai koagulan alami untuk membersihkan air layak
minum (Sutherland, 1994).
Hasil penelitian Madsen dan Dchulundt serta Grabow, dkk., menunjukkan
bahwa serbuk biji kelor mampu menumpas bakteri Escherichia coli, Streptocoocus
faecalis dan Salmonella typymurium, sehingga di Afrika biji kelor dimanfaatkan
untuk mendeteksi pencemaran air oleh bakteri-bakteri. Menurut Faizi, et al.,
(1998) Thiokarbamat dan glikosida isotiosianat telah diisolasi dari fraksi etil asetat
dari ekstrak etanol biji kelor. Biji kelor memiliki protein spesifik untuk melindungi
kulit dan rambut dan juga memiliki khasiat sebagai antibakteri( Olsen, 1987;
Madsen, et al., 1987).
Pembuatan ekstrak etanol dari simplisia secara perkolasi, uji golongan
senyawa kimia terhadap simplisia, pembuatan larutan uji ekstrak etanol dengan
berbagai konsentrasi, serta uji aktivitas antibakteri ekstrak etanol biji kelor
terhadap bakteri Gram positif (Staphylococcus aureus) dan Gram negatif
(Escherichia coli) dengan metode dilusi. Karakteristik simplisia biji kelor
dilakukan sesuai dengan prosedur penetapan kadar dan pengujian yang tertera
dalam FHI (Farmakope Herbal Indonesia) (Kemenkes RI., 2011).
Berdasarkan uraian diatas, maka dilakukan penelitian uji aktivitas
antibakteri ekstrak etanol biji kelor (Moringa oleifera L.) terhadap bakteri
Staphylococcus aureus dan Escherichia coli dengan metode dilusi dengan
perhitungan Kadar Hambat Minimal (KHM) dan Kadar Bunuh Minimal (KBM) .
1.2 Perumusan Masalah
a) golongan senyawa kimia apa saja yang terdapat pada biji kelor?
b) berapakah konsentrasi hambat minimum dan konsetrasi bunuh minimum ekstrak
etanol biji kelor yang mempunyai aktivitas antibakteri terhadap bakteri
Staphylococcus aureus dan Escherichia coli dengan metode dilusi?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas maka hipotesis penelitian ini adalah:
a) golongan senyawa kimia yang terdapat di dalam biji kelor adalah glikosida,
steroid/triterpenoid, flavonoid, alkaloid,tanin dan saponin.
b) ekstrak etanol biji kelor mempunyai aktivitas antibakteri terhadap bakteri
Staphylococcus aureus dan Escherichia coli dengan cara menentukan konsentrasi
hambat minimum (KHM) dan konsentrasi bunuh minimum (KBM).
1.4 Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah:
a) untuk mengetahui karakteristik simplisia biji kelor.
b) untuk mengetahui golongan senyawa kimia yang terdapat di dalam biji kelor.
c) untuk mengetahui konsentrasi hambat minimum (KHM) dan konsentrasi bunuh
minimum ekstrak etanol biji kelor terhadap bakteri Staphylococcus aureus dan
1.5 Manfaat Penelitian
Manfaat penelitian yang dilakukan yaitu sebagai informasi tentang
karakteristik simplisia, golongan senyawa kimia dan aktivitas antibakteri dari
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL BIJI KELOR (Moringa oleifera Lam.) TERHADAP BAKTERI Staphylococcus aureus DAN
Escherichia coli
ABSTRAK
Kelor (Moringa oleifera Lam.) merupakan tanaman yang sangat bernilai bagi tubuh, karena tingginya kandungan nutrisi dan mineral serta bermanfaat bagi kesehatan. Biji kelor berkhasiat mangatasi muntah atau mual. Biji kelor yang masak dan kering mengandung pterigospermin yang pekat hingga bersifat germisida. Pterigospermin menunjukkan aktivitas antibakteri terhadap bakteri
Gram positif dan negatif Biji buah kelor juga mengandung senyawa bioaktif rhamnosyloxy-benzil-isothiocyanate, yang mampu menetralisir partikel-partikel lumpur serta logam. Kemampuannya untuk mengendapkan berbagai ion logam terlarut dan bakteri-bakteri berbahaya seperti bakteri Escherichia coli, Streptocoocus faecalis dan Salmonella typymurium.
Penelitian ini dilakukan untuk mengetahui aktivitas antibakteri ekstrak etanol biji kelor (Moringa oleifera Lam.) terhadap bakteri Staphylococcus aureus dan Escherichia coli dengan metode dilusi untuk mengetahui Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM).
Hasil karakterisasi simplisia meliputi kadar air 2,62%, kadar sari yang larut dalam air 19,27%, kadar sari yang larut dalam etanol 16,20%, kadar abu total 5,73% dan kadar abu yang tidak larut dalam asam 1,78%. Hasil skrining fitokimia terhadap serbuk simplisia biji diperoleh adanya senyawa golongan steroid/triterpen, flavonoid, glikosida, alkaloid dan saponin.
Hasil uji ekstrak biji kelor memiliki aktivitas antibakteri untuk menghambat bakteri Staphylococcus aureus dan Escherichia coli dengan konsentrasi hambat minimum masing masing adalah 200 mg/mL dan 100 mg/mL serta konsentrasi bunuh minimum untuk bakteri Staphylococcus aureus dan Escherichia coli adalah 500 mg/mL dan 400 mg/mL dilihat dari tidak adanya pertumbuhan koloni pada media agar pada masing masing bakteri.
ANTIBACTERIAL ACTIVITY TEST OF ETHANOL EXTRACT OF MORINGA SEEDS (Moringa oleifera Lam.) AGAINST Staphylococcus
aureus AND Escherichia coli
ABSTRACT
Kelor, Moringa oleifera Lam. (Moringaceae) is a highly valued plant for
whole body, because it has a high nutritional value. Moringa seeds contain
bioactive compounds rhamnosyloxy - benzyl - isothiocyanate , which is able to neutralize the particles of mud as well, so it could potentially be used as a natural coagulant to clean water . Its ability to precipitate many metal ions dissolved and harmful bacteria such as Escherichia coli , and Salmonella typymurium
Streptocoocus faecalis .
This study aims to determine and tesing antibacterial activity moringa seed (Moringa oleifera Lam.) ethanol extract Against Staphylococcus aureus and
Escherichia coli with liquid dilution method in the calculation of minimum
inhibitory concentration (MIC) and minimum bactericidal concentration (MBC). The result of simplex characterization obtained water value of 2.62% , the water soluble extract value content 19.27 % , the ethanol soluble extract value 16.20 % , the total ash content of 5.73% and the total ash value and the acid insoluble ash value 1.78 % . The result ofphytochemical screening is steroids / triterpenes, flavonoids, glycosides, alkaloids and saponins.
It was concluded that the extract of moringa seeds have antibacterial activity to inhibit the bacterium Staphylococcus aureus and with the minimum inhibitory concentration (MIC ) is 200 mg / mL Escherichia coli the concentration is 100 mg / mL and minimum bactericidal concentration (MBC) from each bacteries are 500 mg / mL and 400 mg / mL can be showed from agar media (Nutrient agar) that there is no growth in.
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL BIJI
KELOR (Moringa oleifera Lam.) TERHADAP Escherichia coli
DAN Staphylococcus aureus
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara