EKSTRAKSI KOLAGEN DARI KULIT IKAN GABUS
(C
hanna striata
) SERTA APLIKASINYA UNTUK SKRINING
DAN KARAKTERISASI KOLAGENASE BAKTERI ASAL INDONESIA
ANDI RAHMAYANTI R.
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis berjudul Ekstraksi Kolagen dari Kulit Ikan Gabus (Channa striata) serta Aplikasinya untuk Skrining dan Karakterisasi Kolagenase Bakteri Asal Indonesia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
Andi Rahmayanti R.
ANDI RAHMAYANTI R. Ekstraksi kolagen dari kulit ikan gabus (Channa striata) serta aplikasinya untuk skrining dan karakterisasi kolagenase isolat bakteri asal Indonesia. Dibimbing oleh MAGGY THENAWIDJAJA SUHARTONO dan BUDIATMAN SATIAWIHARDJA.
Sumber utama kolagen pada umumnya berasal dari tulang sapi dan babi. Namun, penggunaan tulang sapi dan babi sebagai sumber kolagen mulai menimbulkan kebimbangan dikalangan produsen karena merebaknya penyakit sapi gila dan beberapa unsur agama yang tidak memperbolehkan penggunakan babi sebagai sumber kolagen. Oleh karena itu, pemanfaatan limbah dari organisme perairan seperti tulang, kulit, dan sisik ikan mulai diminati. Salah satu orgasnime perairan air tawar yang diperkirakan mampu menjadi alternatif sumber kolagen adalah ikan gabus, dimana bagian yang paling berpotensi sebagai sumber kolagen dari ikan gabus adalah kulit. Kolagen yang diperoleh selanjutnya digunakan untuk menyeleksi bakteri asal Indonesia yang diduga memiliki aktivitas kolagenolitik. Karakterisasi kolagenase isolat terpilih kemudian dilakukan untuk mengetahui kondisi optimal kerja enzim.
Berdasarkan metode ekstraksi kolagen, kolagen yang diperoleh dari kulit ikan gabus tergolong ke dalam Water Soluble Collagen (WSC) dan Acid Soluble Collagen (ASC) dengan berat molekul di atas 97 kDa. Kadar protein yang diperoleh pada WSC dan ASC berturut-turut adalah 0.048 – 0.092 mg/ml dan 0.546 – 1.323 mg/ml. ASC yang diperoleh kemudian ditambahkan ke dalam media pertumbuhan dari sepuluh jenis isolat bakteri asal Indonesia. Hasil skrining kesepuluh isolat bakteri menggunakan metode zimografi menunjukkan hasil positif untuk deteksi aktivitas kolagenase.
Salah satu isolat, yaitu Bacillus licheniformis F11.4 kemudian ditumbuhkan pada media yang diperkaya dengan kolagen sebesar 15% dan diinkubasi pada kondisi yang sama dengan proses skrining. Kolagenase Bacillus licheniformis F11.4 memiliki berat molekul 15 kDa dengan suhu optimum pada 400C dan pH optimum pada pH 8-9. Aktivitas kolagenase dihambat oleh PMSF (phenylmethanesulfonyl fluoride) (1mM) sedangkan penambahan CoCl2 mampu
meningkatkan aktivitasnya. Penambahan ZnCl2 (5mM), MgCl2 (5mM), NaCl
(5mM), dan NaSO4 (5mM) memberikan efek yang minimum terhadap aktivitas
kolagenase Bacillus licheniformis F11.4. Kolagenase Bacillus licheniformis F11.4 mampu menghidrolisis substrat kolagen ASC yang ditandai dengan terbentuknya pita-pita protein baru setelah proses inkubasi. Nilai Km dan Vmax kolagenase berturut-turut adalah 0.36 mg/ml dan 182.11 U/min yang mengindikasikan kolagenase bekerja aktif pada konsentrasi substrat rendah.
ANDI RAHMAYANTI R. Collagen extraction from snake-head fish (Channa striata) skin and its application for screening and characterization of collagenase from Indonesian bacteria isolates. Supervised by MAGGY THENAWIDJAJA SUHARTONO and BUDIATMAN SATIAWIHARDJA.
The major sources of collagen come from bovine and pig. However, the uses of collagen from bovine present more concerns due to the outbreaks of mad cow disease. Moreover, there are religious elements which do not accept pig as source of collagen. Therefore, alternative sources of collagen, especially from aquatic animals waste, is getting more popular. Snake-head fish is one of the freshwater organism which can be an alternative source of collagen. Fish skin is a part of snake-head fish which is potential as source of collagen. The collagen was used for screening collagenolytic activity from indigenous Indonesian bacteria.
According to the extraction method of collagen, the collagen was divided into Water Soluble Collagen (WSC) and Acid Soluble Collagen which have molecular weight higher than 97 kDa. Protein content of WSC and ASC was found 0.048 – 0.092 mg/ml and 0.546 – 1.323 mg/ml, respectively. The ASC was added into medium growth of ten Indonesian bacteria then the screening was performed using zimography analysis. Zimography showed the positive collagenolytic activity for all of bacteria tested.
Bacillus licheniformis F11.4 was cultured in growth medium which contain 15% ASC and incubated at the same condition with screening step. The collagenase showed apparent molecular weight of 15 kDa with optimal temperature and pH were 400C and pH 8-9, respectively. The activity of collagenase was inhibited by PSMF (1 mM) while CoCl2 (5mM) slightly
increased its activity. However ZnCl2 (5mM), MgCl2 (5mM), NaCl (5mM), and
NaSO4 have minimum effect. The collagenase from Bacillus licheniformis F11.4
was capable of hydrolyzing collagen from snake-head fish skin. New peptides were formed as a result of substrates incubation with collagenase. The Km and
Vmax of the enzyme were 0.36 mg/ml and 182.11 U/min, respectively, indicating
an active form of enzyme.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
EKSTRAKSI KOLAGEN DARI KULIT IKAN GABUS
(C
hanna striata
) SERTA APLIKASINYA UNTUK SKRINING
DAN KARAKTERISASI KOLAGENASE BAKTERI ASAL INDONESIA
ANDI RAHMAYANTI R.
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2014
Tesissebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Nama : Andi Rahmayanti R.
NRP : F251110191
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Maggy T. Suhartono Ketua
Dr Ir Budiatman Satiawihardja, MSc Anggota
Diketahui oleh
Ketua Program Studi Ilmu Pangan
Prof Dr Ir Ratih Dewanti-Hariyadi, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian:
(tanggal pelaksanaan ujian tesis)
Tanggal Lulus:
(tanggal penandatanganan tesis oleh Dekan Sekolah
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala karena dengan rahmat dan bantuan-Nya maka karya ilmiah dengan judul ekstraksi kolagen dari kulit ikan gabus (Channa striata) serta aplikasinya untuk skrining dan karakterisasi kolagenase bakteri asal Indonesia yang dilakukan mulai bulan Maret 2013 hingga November 2013 ini dapat diselesaikan.
Dalam penyusunan tesis ini penulis mengucapkan terima kasih kepada : 1. Orang tua tercinta Andi Ramli dan Andi Nurhayati, adik-adik tercinta Andi
Rachmat Fajrin dan Andi Rezky Annisa yang selalu mendukung dan mencurahkan kasih sayang dan doanya.
2. Prof Dr Ir Maggy T. Suhartono selaku ketua komisi pembimbing atas bimbingan, saran, dan diskusi dalam penyelesian tesis ini.
3. Dr Ir Budiatman Satiawihardja, MSc selaku anggota komisi pembimbing atas bimbingan, saran, dan diskusi dalam penyelesian tesis ini.
4. Prof Dr Ratih Dewanti-Hariyadi, MSc selaku ketua Program Studi Ilmu Pangan.
5. Direktorat Jenderal Pendidikan Tinggi Kementrian Pendidikan dan Kebudayaan melalui pemberian beasiswa unggulan tahun 2012.
6. Kementrian Riset dan Teknologi (Ristek) atas bantuan dana penelitian melalui dana Insentif Riset SINas 2013.
7. Bapak Raymond R. Tjandrawinata, PhD, MS, MBA dan seluruh staf Dexa Laboratories of Biomolecular Sciences (DLBS) yang telah membantun dan memfasilitasi peneliti selama melakukan riset.
Ungkapan terima kasih juga penulis sampaikan kepada pihak-pihak lain yang membantu dalam penyelesian tesis ini yang tidak dapat penulis sebutkan satu per satu. Penulis berharap semoga tulisan ini dapat bermanfaat.
Bogor, September 2014
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
1 PENDAHULUAN
Latar Belakang 1
Rumusan Masalah 2
Tujuan Penelitian 3
Hipotesis 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA
Ikan Gabus 3
Kolagen 5
Ekstraksi Kolagen 6
Isolat Bakteri Penghasil Protease 7
Kolagenase 8
3 METODE PENELITIAN
Waktu dan Tempat 10
Bahan 10
Alat 11
Metodologi 12
Metode Penelitian 12
Prosedur Analisis 13
4 HASIL DAN PEMBAHASAN
Ekstraksi Kolagen 18
Skrining Isolat Penghasil Kolagenase 22
Karakterisasi Kolagenase Bacillus licheniformis F11.4 24 5 SIMPULAN DAN SARAN
Simpulan 32
Saran 33
DAFTAR PUSTAKA 33
1 Karakteristik kolagen dari beberapa jenis ikan 7 2 Karakteristik kolagenase dari beberapa bakteri 9
3 Jenis isolat asal Indonesia 11
4 Hasil analisa kadar protein ekstrak kolagen 19
5 Hasil skrining isolat penghasil kolagenase 23
DAFTAR GAMBAR
1 Ikan Gabus 4
2 Persentase hasil rata-rata dari proses penyiangan ikan 4 3 Diagram alir ekstraksi kolagen, (A) Ekstraksi kolagen mengikuti metode
Yuniarti (2010); (B) Ekstraksi kolagen dengan memodifikasi metode Nagai
and Suzuki (2000). 14
4 SDS-PAGE ekstrak kolagen dari ikan gabus 20
5 SDS-PAGE kolagen beberapa jenis ikan 20
6 Analisa kadar asam amino kolagen 21
7 Zimogram isolat penghasil kolagenase 23
8 SDS-PAGE kolagenase dari Bacillus licheniformis F11.4 25 9 SDS-PAGE kolagenase Bacillus licheniformis F11.4 pada berbagai substrat 26 10 Pengaruh suhu terhadap aktivitas kolagenase Bacillus licheniformis F11.4 27 11 Pengaruh pH terhadap aktivitas kolagenase Bacillus licheniformis F11.4 28 12 Stabilitas kolagenase Bacillus licheniformis F11.4 29 13 Pengukuran parameter kinetika enzim kolagenase murni dari Bacillus
licheniformis F11.4 dengan Lieweaver-Burk plot 30
14 Pengaruh ion logam dan inhibitor terhadap aktivitas kolagenase Bacillus
licheniformis F11.4 32
DAFTAR LAMPIRAN
1 Kurva standar penentuan kadar protein dengan metode Bradford 38
2 Kurva standar penentuan aktivitas enzim 39
3 Komposisi gel pemisah dan gel penahan SDS-PAGE dan Zimogram 39 4 Kurva standar penentuan berat molekul kolagenase 40 5 Kurva standar penentuan berat molekul peptida kolagen 40 6 Kurva standar penentuan berat molekul kasein dan fibrinogen 41 7 Kurva standar penentuan berat molekul peptida kasein dan peptida fibrinogen 41
8 Kromatogram standar asam amino 42
9 Kromatogram Water Soluble Collagen (WSC) 42
1 PENDAHULUAN
Latar Belakang
Kolagen merupakan salah satu jenis protein yang banyak terdapat pada tulang, gigi, dan kulit makhluk hidup. Secara luas kolagen banyak digunakan untuk perawatan anti-penuaan dini, bedah plastik, kemasan edible, suplemen, dan biomaterial untuk produk kosmetik dan gelatin (food grade). Sumber utama kolagen komersial umumnya berasal dari tulang sapi dan babi. Namun, penggunaan tulang sapi mulai menimbulkan kebimbangan dikalangan produsen karena merebaknya Bovine Spongiform Encephalopathy (BSE), Transmissible Spongiform Encephalopathy (TSE) dan Foot and Mouth Disease (FMD). Selain itu, terdapat unsur agama yang tidak memperbolehkan penggunaan babi sebagai sumber kolagen. Oleh karena itu, diperlukan suatu bahan alternatif yang dapat dijadikan sebagai sumber kolagen, salah satunya adalah limbah organisme perairan. Limbah dari organisme perairan seperti tulang, kulit, dan sisik ikan diketahui banyak mengandung kolagen (Guillen et al. 2002). Kolagen dari kulit ikan (food grade) diketahui mampu diabsorpsi lebih baik di dalam tubuh manusia dan sering digunakan dalam bidang bioteknologi.
Ikan gabus (Channa striata) adalah organisme perairan air tawar dari famili
Channidae yang memiliki nilai ekonomis. Ikan gabus memiliki kadar albumin yang cukup tinggi, yaitu 6.22% (Carvallo 1998) sehingga sangat baik untuk dikonsumsi bagi pasien penderita hipoalbumin. Tingginya kadar albumin pada daging ikan gabus menyebabkan ekstrak daging ikannya banyak digunakan sebagai obat sedangkan kulit dan tulangnya berakhir sebagai limbah. Pada periode 1998 – 2008 angka kenaikan tangkapan ikan gabus dari perairan umum adalah 2.75% per tahun. Sedangkan pada tahun 2009-2010 angka tangkapan ikan gabus pada perairan umum meningkat menjadi 21.79% (Kementrian Kelautan dan Perikanan, 2010). Selain itu, budidaya ikan gabus di keramba juga mengalami peningkatan dari tahun 2004 yang hanya sebesar 4.250 ton menjadi 5.535 ton pada tahun 2008 (Fadli 2010). Adanya kenaikan hasil tangkapan dan budidaya ikan gabus per tahunnya menjadikan limbah ikan gabus sangat potensial sebagai sumber kolagen.
Kolagen merupakan protein dengan tiga rantai peptida yang bergabung membentuk struktur triple helix. Struktur triple helix kolagen sangat sulit untuk dipecah dan hanya sebagian kecil enzim yang memiliki kemampuan memecahnya. Salah satu enzim yang telah dilaporkan memiliki kemampuan memecah struktur
Sumber kolagenase telah banyak diketahui melalui beberapa penelitian diantaranya penggunaan mikroba dan organ dalam ikan. Penggunaan mikroba lebih banyak diminati karena sifatnya yang mudah ditumbuhkan, proses isolasi mudah, proses produksi cepat, dan ramah lingkungan. Mikroba yang telah dilaporkan memiliki kemampuan untuk memproduksi kolagenase berasal dari golongan Bacillus, Clostridium dan Streptomyces. Kemampuan suatu bakteri dalam menghasilkan kolagenase dapat diketahui dengan menumbuhkannya pada media yang diperkaya kolagen dan melalui serangkaian analisis.
Terdapat mikroba-mikroba asal Indonesia yang memiliki aktivitas proteolitik tinggi dan diduga memiliki kemampuan untuk menghasilkan kolagenase. Diantaranya adalah bakteri Bacillus licheniformis F11.1 dan Bacillus licheniformis F11.4 yang merupakan hasil mutasi dari Bacillus licheniformis F11 dan diperoleh dari Palembang, Sumatera Selatan. Isolat Sw diisolasi dari limbah kulit udang, Bacillus sp. MTS dan isolat Bacillus sp. TPS2d diisolasi dari tanah belerang gunung Tangkuban Perahu, serta Stenotropomonas sp., Bacillus sp., dan isolat G diisolasi dari makanan khas Indonesia oncom. Oleh karena itu, diperlukan skrining untuk mengetahui mikroba asal Indonesia yang memiliki potensi menghasilkan kolagenase. Skrining dilakukan dengan menumbuhkan masing-masing mikroba pada media yang diperkaya dengan kolagen, dimana kolagen yang digunakan adalah hasil ekstraksi dari kulit ikan gabus. Selanjutnya akan dilakukan karakterisasi kolagenase dari isolat terpilih.
Rumusan Masalah
Sumber utama kolagen berasal dari tulang sapi dan babi. Namun, merebaknya Bovine Spongiform Encephalopathy (BSE), Transmissible Spongiform Encephalopathy (TSE) dan foot and mouth disease (FMD) mulai menimbulkan kebimbangan dikalangan produsen. Disisi lain, kolagen yang berasal dari ikan mengandung kadar protein di atas 80 % dan 18 jenis asam amino, dimana tujuh diantaranya esensial. Oleh karena itu, pemanfaatan limbah hasil perairan mulai diminati sebagai alternatif sumber kolagen. Salah satu organisme perairan yang limbahnya dapat dijadikan sebagai alternatif penghasil kolagen adalah ikan gabus.
Struktur triple helix kolagen sangat sulit dipecah dan hanya sebagian enzim yang memiliki kemampuan untuk memecahnya. Salah satu enzim yang dilaporkan mampu memecah kolagen adalah kolagenase. Mikroba merupakan salah satu sumber penghasil kolagenase. Informasi mengenai mikroba penghasil kolagenase dapat diketahui melalui skrining mikroba yang memiliki latar belakang sebagai penghasil enzim proteolitik. Bacillus licheniformis F11.1, Bacillus licheniformis
sp., Bacillus sp., dan isolat G merupakan hasil isolasi dari makanan tradisional khas Indonesia oncom diketahui memiliki aktivitas protease tinggi. Diperkirakan diantara bakteri proteolitik yang digunakan terdapat isolat yang memiliki kemampuan memecah domain triple heliks dari kolagen.
Kolagenase dapat digunakan untuk hidrolisis kolagen sehingga menghasilkan peptida kolagen yang memiliki aktivitas biologi. Pada aplikasi kolagenase tersebut, dibutuhkan informasi mengenai karakteristik enzim dan kondisi kerja yang optimum. Oleh karena itu, diperlukan karakterisasi terhadap kolagenase ekstraseluler dari isolat terpilih serta kemampuan degradasi kolagen oleh enzim sehingga penggunaannya dapat dimaksimalkan.
Tujuan Penelitian
Ekstraksi kolagen dari kulit ikan gabus serta aplikasinya sebagai substrat untuk skrining isolat penghasil kolagenase dan karakterisasi kolagenase ekstraseluler dari isolat terpilih.
Hipotesis
Kulit ikan gabus dapat dijadikan sebagai sumber kolagen. Selain itu, kolagen hasil ekstraksi dari kulit ikan gabus dapat digunakan untuk skriningisolat penghasil kolagenase, dimana bakteri akan ditumbuhkan pada media yang diperkaya dengan kolagen.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah diperoleh kolagen dari kulit ikan gabus sehingga mampu menjadi salah satu sumber kolagen alternatif. Selain itu, diperoleh isolat penghasil kolagenase dan informasi mengenai karakteristik kolagenase ekstraseluler yang dihasilkan.
2 TINJAUAN PUSTAKA
Ikan Gabus (Channa striata)
Ikan gabus (Channa striata) merupakan jenis ikan dari famili Channidae
Ikan Gabus diketahui mengandung protein dan mineral yang penting untuk tubuh. Kadar protein ikan gabus lebih tinggi dibandingkan dengan kadar protein pada ikan bandeng, ikan mas, dan ikan kakap yang mencapai 25,5%. Selain itu, Carvallo (1998) melaporkan bahwa kadar albumin ikan gabus mencapai 6,22% dan daging ikannya mengandung mineral seng sebesar 1,74 mg/100 gram. Selama ini, ikan gabus telah dikenal luas oleh masyarakat sebagai makanan yang mampu mempercepat proses penyembuhan luka, terutama bagi ibu pasca melahirkan.
Gambar 1. Ikan Gabus
Ikan gabus (Channa striata) mengandung protein larut, yaitu protein yang mudah dihilangkan ketika ekstraksi, protein stroma jaringan ikat, dan protein sarkoplasma. Protein sarkoplasma juga disebut miogen, dimana yang termasuk didalamnya adalah albumin, mioalbumin, mioprotein, globulin-X, dan miostromin. Albumin, mioalbumin, dan mioprotein merupakan protein yang mudah larut dalam air. Sedangkan globulin dan miostromin merupakan protein yang sukar larut dalam air tetapi mudah larut dalam larutan asam atau basa lemah.
Gambar 2. Persentase hasil rata-rata dari proses penyiangan ikan
dagingnya (Oosten 1969). Komponen protein pada kulit ikan terbagi atas protein fibril dan protein globular. Protein fibril meliputi kolagen, keratin, dan elastin, sedangkan protein globular meliputi albumin dan globulin.
Kolagen
Kolagen merupakan salah satu protein yang banyak terdapat pada kulit, tulang, dan gigi makhluk hidup. Kolagen terdiri dari tiga rantai polipeptida besar dan berulang. Komposisi asam amino dari kolagen cenderung didominasi oleh glisin, prolin, hidroksiprolin dan alanin. Selain itu, komposisi asam amino dan karakteristik fisikokimia kolagen sangat bervariasi dan bergantung pada jaringan. Kandungan kolagen pada ikan sangat bervariasi dan tergantung pada spesies ikan. (Hema et al. 2013). Kandungan kolagen pada kulit ikan yang telah dilaporkan bervariasi pada beberapa jenis ikan, yaitu pada ikan mas sekitar 41.30% (Duan et al. 2009), ikan lele 12.8% (Singh et al. 2011), dan ikan tuna 13,97% (Hema et al.
2013).
Kolagen memainkan peranan yang sangat penting di dalam pembentukan jaringan dan organ, terlibat di dalam berbagai fungsi biologis sel seperti pembelahan, pertahanan, dan diferensiasi sel. Karena fungsi biologis tersebut penggunaan kolagen dalam industri, khususnya dalam bidang medis, berkembang sangat pesat. Kolagen tidak hanya memainkan peranan penting di dalam perkembangan suatu jaringan tetapi juga telah banyak digunakan sebagai bahan baku untuk makanan, kosmetik, dan reagen eksperimental.
Aplikasi kolagen sangat luas di bidang industri kulit, kosmetik, biomedis, dan pangan. Pada bidang farmasi, kolagen banyak digunakan untuk pemulihan luka, suplemen, pengobatan anti-kanker dan sebagai bahan pembuatan kapsul (Singh et al. 2011). Sedangkan pada pangan, kolagen digunakan untuk memproduksi kemasan edible dalam industri daging, misalnya sosis dan salami. Kolagen memiliki struktur yang unik sehingga pemanfaatannya sangat luas di bidang industri. Karakteristik dari kolagen diantaranya adalah memiliki daya tarik kuat, sifat antigenitas rendah, bioresorbability, kompatibilitas yang baik, mampu menginduksi proses koagulasi darah, memiliki efek terhadap penyembuhan luka, dan mudah dimurnikan (Aberoumand 2011).
Sumber kolagen yang banyak digunakan pada berbagai bidang sejauh ini masih sangat terbatas dan lebih banyak berasal dari hewani, diantaranya adalah kulit dan tulang sapiatau babi. Namun, seiring dengan merebaknya penyakit sapi gila dan penggunaan babi yang tidak diperbolehkan di beberapa daerah, alternatif sumber kolagen dari organisme perairan mulai diminati. Sumber kolagen dari organisme perairan diketahui memiliki kandungan kolagen yang cukup tinggi (Guillen et al. 2002). Penelitian yang memanfaatkan organisme perairan sebagai sumber kolagen telah banyak dilakukan, diantaranya ialah penelitian pada
Tachysurus maculatus (Bama et al. 2010), Sepiella inermis (Shanmugan et al.
2012), Catostylus tagi (Calejo et al. 2008), Chiloscyllium punctatum
(Kittiphattanabawon et al. 2010), dan Pangasianodon hypophthalmus (Singh et al.
Terdapat sekitar 27 tipe kolagen, dimana setiap tipenya dapat digolongkan lagi menjadi dua, yaitu fibril dan non-fibril. Kolagen tipe I, II, III, dan IV termasuk ke dalam golongan fibril, sedangkan yang lainnya merupakan golongan non-fibril. Kolagen tipe I banyak ditemukan pada kulit, pembuluh darah, organ tubuh dan tulang, kolagen tipe III merupakan komponen serat reticular, dan kolagen tipe IV terdapat pada membran sel. Kolagen tipe V banyak tersebar pada jaringan konektif, sedangkan kolagen tipe II dan XI merupakan kolagen spesifik tulang rawan (Barrow dan Shahidi 2008).
Kolagen tipe I ditemukan pada kulit, tendon, dan tulang (Muyonga et al.
2004). Setiap tipe kolagen dikarakterisasi berdasarkan banyaknya asam amino prolin, Gly-X-Y termasuk formasi dari triple helix dimana X dan Y lebih sering terdeteksi sebagai prolin ataupun hidroksiprolin. Berdasarkan beberapa hasil penelitian diketahui bahwa kulit dan sisik ikan yang merupakan limbah memiliki kandungan kolagen yang cukup tinggi. Ikan mas (Cyprinus carpio) diketahui memiliki kandungan kolagen yang tinggi pada kulitnya, yaitu 41.30%, pada sisik sebesar 1.35%, dan pada tulangnya sebesar 1.06% (Duan et al. 2009). Selain itu, Singh et al. (2011) melaporkan isolasi kolagen type I yang berasal dari kulit ikan
Pangasianodon hypophthalmus.
Karakteristik fisiko-kimia dari kolagen berbeda dan bergantung pada setiap jaringan, misalnya kulit, insang, dan otot ikan. Kolagen ikan sangat sensitif terhadap panas jika dibandingkan dengan kolagen yang berasal dari mamalia disebabkan oleh kadar hidroksiprolin yang rendah (4-10%) dan sangat mudah mengalami cross linking (Hema et al. 2013). Kolagen ikan ditemukan memiliki dua rantai α, biasanya dikenal dengan α-1 dan α-2. Kedua rantai tersebut memiliki berat molekul yang hampir sama. Kedua rantai tersebut dapat dipisahkan menggunakan SDS-PAGE berdasarkan afinitasnya terhadap SDS. Umumnya, rantai α-2 memiliki mobilitas dan afinitas yang tinggi terhadap SDS jika dibandingkan dengan rantai α-1 (Hema et al. 2013).
Ekstraksi Kolagen
Limbah yang dihasilkan di bidang pengolahan ikan sangat besar dan umumnya memiliki kandungan kolagen yang tinggi. Bahan baku yang sering dijadikan sebagai sumber kolagen berasal dari sapi dan babi. Kolagen memiliki karakteristik fisik yang berbeda berdasarkan sumbernya. Misalnya, kolagen yang berasal dari sapi dan babi akan memiliki karakteristik yang berbeda dengan kolagen yang diekstrak dari organisme perairan. Umumnya, kolagen yang berasal dari ikan sensitif terhadap panas (Sato et al. 1989)
Tabel 1. Karakteristik kolagen dari beberapa jenis ikan
Keterangan: ASC (Acid Soluble Collagen), PSC (Pepsin Soluble Collagen). Untuk ekstraksi kolagen menggunakan metode pepsin-digestion, kolagen diekstrak selama 24 jam pada suhu 40C sebelum diendapkan dengan NaCl 0.5M (Takeshi 2003). Ekstraksi kolagen dari limbah organisme perairan seperti kulit, tulang, dan sirip berlangsung selama 3 hari menggunakan asam asetat 0.5M. Berdasarkan hasil penelitian Takeshi (2003) bahwa ekstraksi kolagen selama 3 hari dengan asam asetat 0.5M belum sepenuhnya mampu melarutkan kulit ikan. Oleh karena itu, residu hasil ektraksi akan diekstrak kembali menggunakan asam asetat 0.5M selama 2 hari. Rendemen yang diperoleh dari hasil ekstraksi beberapa jenis ikan berbeda-beda, misalnya untuk ikan lele diperoleh rendemen sebesar 5,1% (Singh et al. 2011) , ikan tuna sebesar 13.97% (Hema et al. 2013), dan ikan hiu sebesar 8.96% (Hema et al. 2013).
Isolat Bakteri Penghasil Protease
Bacillus sp. MTS merupakan bakteri yang memiliki kemampuan dalam mendegradasi bulu ayam utuh. Bakteri Bacillus sp. MTS adalah bakteri mesofilik yang diisolasi dari tanah belerang gunung Tangkuban Perahu Bandung-Jawa Barat dan tumbuh pada kodisi pH 7.5 dan suhu 370C. Bakteri ini dilaporkan memiliki kemampuan dalam menghasilkan enzim-enzim ekstraseluler yang mampu menghidrolisis berbagai substrat protein seperti tepung bulu ayam, sarang laba-laba, kasein, albumin, gelatin, hemoglobin, fibrinogen, dan elastin (Ariesandi, 2007).
14580. Analisis genetik yang meliputi sejumlah loci penyandi enzim degradatif ekstraseluler, operon degS – degU pada pengaturan sejumlah enzim, seperti locus
pga yang menyandikan sintesis asam poliglutamat juga dilakukan. Pencarian menggunakan Blastp menunjukkan hasil 99 hingga 100% sama dengan Bacillus licheniformis dengan satu kekecualian, yaitu chiA (Waldeck et al. 2006).
Pada bakteri Bacillus licheniformis F11 dilakukan mutasi dengan menghilangkan operon pembentukan poliglutamat (∆pga) yang merupakan dinding sel bakteri (kapsul) menghasilkan Bacillus licheniformis F11.1 (∆chiA, ∆pga). Bacillus licheniformis F11.1 menghasilkan aktivitas protease yang lebih tinggi dibandingkan dengan Bacillus licheniformis F11. Hal tersebut disebabkan pada Bacillus licheniformis F11.1 sudah tidak memiliki kapsul sebagai penghalang difusi yang mempengaruhi persediaan oksigen dan sekresi enzim ekstraseluler (Hoffmann et al. 2010). Bacillus licheniformis F11 umumnya memiliki dua gen kitinase, yaitu chiA dan chiB yang menyandi enzim kitinase. Keberadaan enzim kitinase akan menghasilkan kitin dengan berat molekul rendah sehingga gen penyandi chiA dan chiB harus dihilangkan. Bacillus licheniformis
F11.1 secara alamiah terjadi mutasi sehingga tidak memiliki chiA ternyata dapat digunakan dalam hidrolisis protein limbah udang, tetapi tidak efisien untuk produksi kitin secara besar-besaran. Hal ini disebabkan masih adanya gen kitinase
chiB yang berpengaruh negatif pada produksi kitin. Pada Bacillus licheniformis
F11.1 dilakukan mutasi lagi dengan menghilangkan gen chiB sehingga dihasilkan
Bacillus licheniformis F11.4, yaitu bakteri yang operon pembentukan poliglutamat (∆pga) dan chiBA sudah tidak ada (Hoffmann, 2010).
Isolat TPS2d merupakan isolat yang diisolasi dari tanah disekitar kawah domas, Tangkuban Perahu. Isolat TPS2d mampu tumbuh dan memproduksi protease ekstraseluler yang ditandai dengan terbentuknya zona bening pada media padat yang diperkaya susu skim. Hasil pengamatan secara mikroskopis menunjukkan bahwa isolat TPS2d merupakan bakteri gram positif yang berbentuk batang. Berdasarkan hasil reaksi biokimia, diketahui bahwa isolat TPS2d mampu memanfaatkan glukosa, xylosa, arabinosa dan ramnosa serta mampu menghidrolisis O-nitrofenil -d-alaktosida (ONPG) dan gelatin. Hasil analisa sekuens DNA gen penyandi 16S rRNA menunjukkan bahwa isolat TPS2d merupakan golongan Bacillus dan memiliki tingkat kemiripan paling tinggi dengan Bacillus caldotenax (Wahyuntari 2001).
Kolagenase
Kolagenase merupakan enzim yang mampu memecah domain triple helix
mengandung Zn dan membutuhkan kalsium untuk kestabilannya. Metalokolagenase merupakan anggota dari Matrix Metalloprotease (MMP) dengan berat molekul yang bervariasi mulai dari 30 hingga 150 kDa (Daboor et al.
2010). Selain itu, metalokolagenase merupakan enzim ekstraselular yang terlibat dalam pembentukan kembali matriks ekstraseluler, jenis enzim ini telah banyak dipelajari dari berbagai jaringan mamalia, bakteri, dan bisa ular (Park et al. 2002).
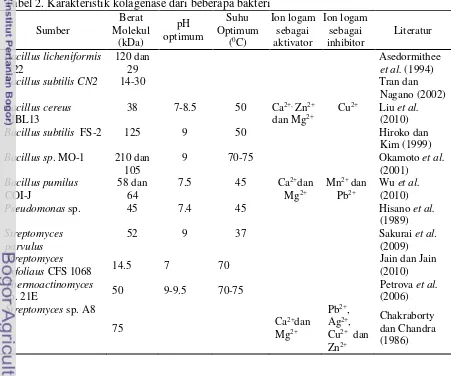
Kolagenase yang berasal dari bakteri memiliki kemampuan untuk menghidrolisis kolagen, baik kolagen yang larut air maupun kolagen yang tidak larut air. Aktivitas katalitik dari kolagenase yang sangat baik menyebabkan aplikasi kolagenase di berbagai bidang industri sangat luas. Kolagenase banyak digunakan sebagai pengempuk daging, dimana yang bertanggung jawab terhadap sifat liat dari daging adalah kolagen (Daboor et al. 2010). Meskipun aplikasi kolagenase cukup berkembang dalam bidang industri makanan, kolagenase umumnya banyak diaplikasikan dalam industri medis. Kolagenase dalam bidang medis banyak digunakan sebagai obat untuk luka bakar, mengurangi jaringan yang luka, dan berperan penting di dalam kesuksesan transplantasi suatu organ. Tabel 2. Karakteristik kolagenase dari beberapa bakteri
Sumber
Bacillus subtilis CN2 14-30 Tran dan
Chung (2004) melaporkan mengenai mekanisme degradasi kolagen oleh kolagenase. Melalui penelitian secara in vitro, kolagenase MMP-1 (E200A) diaplikasikan pada dua jenis substrat, yaitu kolagen utuh tipe 1 (kolagen fibril dari kulit dan tulang hewan) dan gelatin. Hasil menunjukkan bahwa aktivitas yang lebih tinggi diperoleh ketika kolagenase diaplikasikan pada kolagen dibandingkan gelatin, sehingga membuktikan bahwa kolagenase lebih efektif bekerja pada kolagen yang belum terdenaturasi. Kolagenase dapat memecah tripolipeptida pada suhu 370C bahkan 100C dan 40C walaupun lebih sedikit kolagen yang terpecah. Kolagenase disintesis sebagai pro-enzim dan disekresikan sebagai pro-enzim inaktif yang mengandung propeptida, domain katalitik, bagian yang kaya akan prolin dan domain C-terminal hemopexin (Hpx). Pemecahan triple-helix kolagen oleh MMP-1 (kolagenase 1) yang dilaporkan oleh Clark dan Cawston (1989) membutuhkan domain C-terminal Hpx (hemopexin). Domain katalitik dalam keadaan sendiri masih memiliki aktivitas proteolitik pada peptida dan protein non-kolagen tetapi tidak dapat memecah non-kolagen.
Sumber kolagenase selain berasal dari organ dalam ikan, juga diketahui banyak yang berasal dari beberapa jenis bakteri. Penelitian mengenai isolasi kolagenase dari bakteri juga telah banyak dipublikasikan. Beberapa bakteri yang mampu menghasilkan kolagenase adalah Bacillus subtilis FS-2 (Nagano dan To 1999), Bacillus subtilis CN2 (Tran dan Nagano 2002), Bacillus sp. MO-1 (Okamoto et al. 2001), Bacillus subtilis ASI.398 (Riu et al. 2009), Bacillus pumilus CoI-J (Wu et al. 2010), Streptomyces sp. Strain 3B (Petrova et al. 2006) dan Streptomyces parvulus (Sakurai et al. 2009).
3 BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret 2013 hingga November 2013. Penelitian dilakukan di Dexa Laboratories of Biomolecular Science (DLBS) dan Laboratorium Mikrobiologi dan Biokimia Pusat Penelitian Sumberdaya Hayati dan Bioteknologi Institut Pertanian Bogor.
Bahan
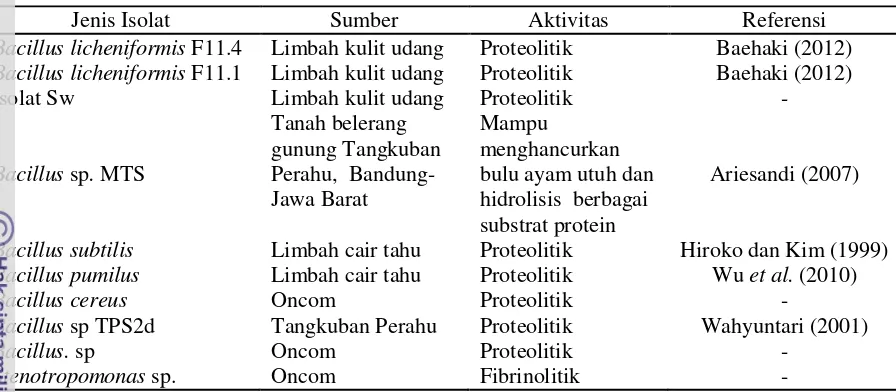
Tabel 3. Jenis isolat asal Indonesia
Jenis Isolat Sumber Aktivitas Referensi
Bacillus licheniformis F11.4 Limbah kulit udang Proteolitik Baehaki (2012)
Bacillus licheniformis F11.1 Limbah kulit udang Proteolitik Baehaki (2012)
Isolat Sw Limbah kulit udang Proteolitik -
Bacillus sp. MTS
Bacillus subtilis Limbah cair tahu Proteolitik Hiroko dan Kim (1999)
Bacillus pumilus Limbah cair tahu Proteolitik Wu et al. (2010)
Bacillus cereus Oncom Proteolitik -
Bacillus sp TPS2d Tangkuban Perahu Proteolitik Wahyuntari (2001)
Bacillus. sp Oncom Proteolitik -
Stenotropomonas sp. Oncom Fibrinolitik -
Bahan-bahan kimia yang digunakan untuk ekstraksi kolagen antara lain adalah etanol, NaOH, CH3COOH, NaCl, dan tris (hidroxymethyl) aminomethane.
Bahan yang digunakan untuk produksi dan pengukuran aktivitas kolagenase adalah media Luria Broth (LB), buffer kalium fosfat, amonium sulfat teknis, natrium karbonat, pereaksi folin ciocalteau, asam trikloro asetat dan L-tyrosin (H-Tyr-OH). Bahan kimia untuk karakterisasi kolagenase adalah larutan Bradford, buffer sitrat, buffer asetat, buffer kalium fosfat, buffer tris-HCl, CaCl2, ZnCl2,
MgCl2, CoCl2, EDTA, NaCl, NaSO4 dan PMSF (phenylmethanesulfonyl fluoride).
Standar berat molekul yang digunakan dalam gel elektroforesis SDS-PAGE adalah fosforilase b (97 kDa), bovine serum albumin (66,0 kDa), ovalbumin (45,0 kDa), carbonic anhydrase (30 kDa), tripsin inhibitor (20 kDa). Reagen lain yang digunakan untuk SDS-PAGE dan Zimogram adalah Coomasie brilliant blue R-250, akrilamid, bisakrilamid, TEMED, amonium persulfat, -merkaptoetanol, SDS (sodium dodecyl sulfate), asam asetat glasial, gliserol, bromphenol blue, metanol, tween, gliserol dan glisin. Reagen yang digunakan pada analisa kadar asam amino kolagen adalah HCl, AccQ-Fluor Borate, reagen fluor A, dan standar internal AABA
Alat
Metodologi
Penelitian ini dilaksanakan dalam beberapa tahap yang terdiri dari: 1) Ekstraksi kolagen untuk media produksi kolagenase. Bahan baku yang digunakan adalah kulit ikan gabus. Ekstraksi menggunakan dua metode, yaitu mengikuti metode Yuniarti (2010) untuk memperoleh kolagen larut air dan modifikasi metode Nagai dan Suzuki (2000) untuk memperoleh kolagen larut asam, 2) Skrining isolat penghasil kolagenase dengan menumbuhkan isolat pada media yang diperkaya kolagen dari kulit ikan gabus, 3) karakterisasi kolagenase dari isolat terpilih.
Metode Penelitian
Ekstraksi Kolagen
Tahapan ekstraksi kolagen berdasarkan metode Yuniarti (2010) dan metode Nagai dan Suzuki (2000) yang telah dimodifikasi dapat diketahui pada Gambar 2. Pembuatan Inokulum (Baehaki et al. 2012)
Tahapan awal dari skrining isolat penghasil kolagenase adalah pembuatan inokulum. Pembutan inokulum dilakukan dengan menumbuhkan masing-masing isolat pada media Luria Broth (LB) hingga optical density (OD) mencapai 0.8. Inkubasi dilakukan pada suhu 370C dengan agitasi sebesar 120 rpm. Pengukuran
optical density (OD) dilakukan pada panjang gelombang 600 nm. Skrining Isolat Penghasil Kolagenase (Baehaki et al. 2012)
Skrining dilakukan dengan menambahkan 10% inokulum yang memiliki OD 0.8 pada media Luria broth (LB) + kolagen 5% (kadar protein sebesar 0.546 mg/ml). Inkubasi dilakukan selama 40 jam pada pH 7, suhu 370C, dan agitasi sebesar 120 rpm. Setelah 40 jam dilakukan pemisahan sel melalui proses sentrifugasi dengan kecepatan 7500 rpm selama 15 menit pada suhu 40C.
Supernatan yang diperoleh merupakan ekstrak kasar enzim. Selanjutnya dilakukan analisis zimogram pada supernatan dari masing-masing isolat.
Karakterisasi Kolagenase (Baehaki et al. 2012)
secara kontinyu pada suhu 40C. Selanjutnya dilakukan sentrifugasi dengan
kecepatan 7500 rpm selama 30 menit pada suhu 40C. Presipitat yang diperoleh dilarutkan dalam buffer fosfat 20 mM pada pH optimum dengan perbandingan 1:2 (b/v). Kolagenase yang digunakan dalam karakterisasi adalah kolagenase kasar dan kolagenase semi murni (hasil pengendapan menggunakan amonium sulfat). Karakterisasi kolagenase meliputi penentuan suhu dan pH optimum, stabilitas panas dan pH, inhibitor ion logam, parameter kinetik, dan berat molekul enzim.
Prosedur Analisis
Analisis Kadar Protein (Bradford 1976)
Analisis protein digunakan untuk menentukan konsentrasi protein enzim dan larutan kolagen. Larutan Bradford dibuat dengan cara melarutkan 100 mg
coomasie brilliant blue G-250 dalam etanol 95%. Setelah itu, ditambahkan asam fosfat 85% sebanyak 100 ml kemudian larutan diencerkan hingga 1 liter. Larutan selanjutnya disaring dengan kertas saring. Larutan standar segar dibuat menggunakan protein BSA (bovine serum albumin) fraction V. Sebanyak 100 mg BSA ditimbang kemudian ditambahkan aquades sebesar 25 ml. Larutan kemudian dikocok pelan-pelan, setelah larut, diencerkan sampai 50 ml. Konsentrasi akhir larutan stok untuk standar ini adalah 2 mg/ml. Langkah selanjutnya adalah sebanyak 0.1 ml sampel dimasukkan ke dalam tabung reaksi yang bersih. Selanjutnya 2 ml pereaksi Bradford ditambahkan ke dalam masing-masing tabung reaksi. Blanko dibuat dengan mencampurkan 0.1 ml aquades dan direaksikan dengan 2 ml pereaksi Bradford. Inkubasi dilakukan pada kondisi gelap selama 10 menit kemudian masing-masing campuran diukur absorbansinya pada panjang gelombang 595 nm.
Analisis Zimogram (Choi et al. 2001)
(A)
(B)
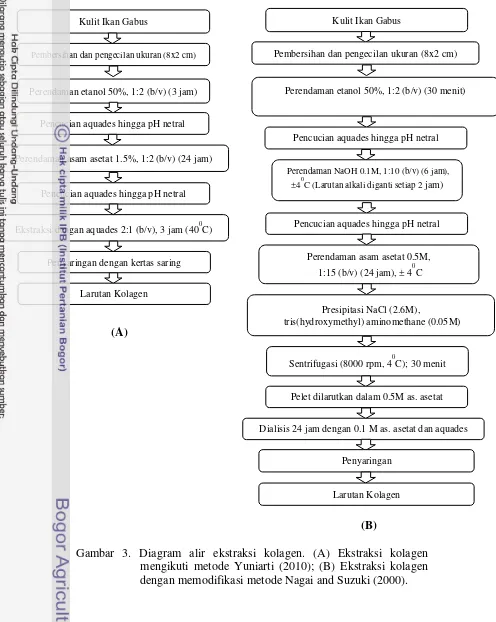
Gambar 3. Diagram alir ekstraksi kolagen. (A) Ekstraksi kolagen mengikuti metode Yuniarti (2010); (B) Ekstraksi kolagen dengan memodifikasi metode Nagai and Suzuki (2000).
Kulit Ikan Gabus
Pembersihan dan pengecilan ukuran (8x2 cm)
Perendaman etanol 50%, 1:2 (b/v) (3 jam)
Pencucian aquades hingga pH netral
Perendaman asam asetat 1.5%, 1:2 (b/v) (24 jam)
Pencucian aquades hingga pH netral
Ekstraksi dengan aquades 2:1 (b/v), 3 jam (400C)
Penyaringan dengan kertas saring
Larutan Kolagen
Kulit Ikan Gabus
Pembersihan dan pengecilan ukuran (8x2 cm)
Perendaman etanol 50%, 1:2 (b/v) (30 menit)
Pencucian aquades hingga pH netral
Perendaman NaOH 0.1M, 1:10 (b/v) (6 jam), ±40C (Larutan alkali diganti setiap 2 jam)
Pencucian aquades hingga pH netral
Perendaman asam asetat 0.5M, 1:15 (b/v) (24 jam), ± 40C
Presipitasi NaCl (2.6M),
tris(hydroxymethyl) aminomethane (0.05M)
Sentrifugasi (8000 rpm, 40C); 30 menit
Pelet dilarutkan dalam 0.5M as. asetat
Dialisis 24 jam dengan 0.1 M as. asetat dan aquades
Penyaringan
Pengukuran Aktivitas Kolagenase (Modifikasi Bergmeyer et al. 1983)
Sebanyak 50 µl kolagenase direaksikan dengan 250 µl substrat dan 250 µl buffer fosfat 0.05 M pH 8. Campuran reaksi diinkubasi pada suhu 370C selama 15 menit, kemudian ditambahkan 0.2 M TCA (Trichloroacetic Acid). Selanjutnya larutan diinkubasi pada suhu 370C selama 10 menit, dilanjutkan dengan sentrifugasi pada kecepatan 10.000 g selama 10 menit. Bagian supernatant diambil sebanyak 500 µl dan ditambahkan ke dalam tabung reaksi yang berisi Na2CO3 0.4
M, kemudian ditambahkan pereaksi folin Ciocalteau dengan pengenceran (1:2) dan diinkubasi pada suhu 370C selama 20 menit. Setelah inkubasi dilakukan sentrifugasi pada kecepatan 5000 g selama 5 menit. Supernatan kemudian diukur menggunakan spektrofotometer pada panjang gelombang 578 nm. Tirosin digunakan sebagai standar. Aktivitas kolagenase dihitung dengan satuan unit per ml. Aktivitas kolagenase dihitung dengan rumus:
U/ml = � � � � �
Keterangan:
A = Konsentrasi tirosin equivalen (µl)
B = Total volume awal (enzim, substrat, buffer, dan TCA) dalam ml E = Volume enzim yang ditambahkan
t = Waktu inkubasi (menit)
V = Volume supernatant yang diambil (µl)
Satu unit aktivitas kolagenase didefinisikan sebagai jumlah enzim yang dapat menghasilkan satu µmol produk per menit pada kondisi pengukuran. Aktivitas spesifik diukur berdasarkan hasil perbandingan antara aktivitas kolagenase dengan konsentrasi protein enzim. Aktivitas relatif merupakan hasil perbandingan antara aktivitas enzim pada sampel tertentu dengan aktivitas tertinggi pada semua sampel pada saat pengukuran.
Analisis Kadar Asam Amino Kolagen (WATCP 1993)
AccQ-Fluor Borate dan 20µl reagent fluor A kemudian diamkan selama 1 menit. Inkubasi dilakukan selama 10 menit pada suhu 550C sebelum disuntikkan pada HPLC. Kolom yang digunakan adalah AccQtag column. Temperatur running 370C dengan acetonitril 60% sebagai fase gerak. Laju alir yang diatur sebesar 1
ml/menit dengan volume penyuntikan sebanyak 5 µl. Detektor yang digunakan adalah flourescense. Kadar asam amino dihitung menggunakan rumus:
Kadar asam amino (mg/kg) =
� � � � ℎ� � � � �� � � � ℎ
Penentuan Berat Molekul (Modifikasi Laemmli 1970)
Penentuan berat molekul kolagen dan kolagenase dilakukan menggunakan SDS-PAGE (Sodium Duodesil Gel Electrophoresis). Berat molekul kolagen diukur dengan cara sampel sebanyak 50 ml dikeringbekukan. Sebanyak 1 mg sampel yang telah dikeringbekukan dilarutkan dengan SDS 10% kemudian dipanaskan selama 1 jam pada suhu 850C. Selanjutnya, ditambahkan buffer sampel dengan perbandingan 4:1 (v/v) dan dipanaskan selama 5 menit. Sebanyak 12 µl sampel dimasukkan ke dalam sumur-sumur pada gel akrilamid.
Penentuan berat molekul kolagenase dilakukan dengan cara mencampur enzim dan buffer sampel dengan perbandingan 4:1 (v/v) dan dipanaskan selama 5 menit. Sebanyak 18 µl sampel enzim dimasukkan ke dalam sumur-sumur pada gel akrilamid. Konsentrasi gel pemisah yang digunakan sebesar 7.5% untuk kolagen dan 12% untuk kolagenase sedangkan gel penahan sebesar 4%. Elektroforesis dilakukan pada tegangan 70 volt / 400 mA selama 2 hingga 3 jam. Setelah elektroforesis, gel direndam dengan larutan pewarna (methanol 45%, asam asetat 10%, dan Coomasie brilliant blue R-250 0.06%) selama 1 jam sambil digoyang konstan. Destaining dilakukan dengan merendam gel dengan larutan peluntur (asam asetat 10% dan metanol 10%) hingga diperoleh pita-pita protein dengan latar belakang putih. Standar berat molekul protein yang digunakan adalah fosforilase b (97 kDa), bovine serum albumin (66,0 kDa), ovalbumin (45,0 kDa),
carbonic andhidrase (30 kDa), dan tripsin inhibitor (20 kDa). Penentuan Suhu dan pH Optimum (Baehaki et al. 2012)
Stabilitas Panas dan pH (Baehaki et al. 2012)
Stabilitas panas enzim diuji dengan cara kolagenase diinkubasi pada suhu 400C masing-masing selama 20, 40, dan 60 menit. Selanjutnya, dilakukan pengukuran aktivitas kolagenase secara kuantitatif menggunakan modifikasi metode Bergmeyer et al. (1983) Pengujian stabilitas pH kolagenase dilakukan dengan menginkubasi kolagenase pada pH 8 masing-masing selama 20, 40, dan 60 menit pada suhu optimum. Pengukuran aktivitas kolagenase secara kuantitatif menggunakan modifikasi metode Bergmeyer et al. (1983).
Pengaruh Inhibitor dan Ion Logam (Baehaki et al. 2012)
Pengaruh ion logam terhadap aktivitas enzim dilakukan dengan menggunakan beberapa ion logam, yaitu CoCl2, CaCl2, MgCl2, MnCl2, ZnCl2,
NaSO4 dan NaCl. Reaksi diawali dengan penambahan substrat, kemudian
ditambahkan ion logam dan buffer hingga konsentrasi akhir 5 mM. Selain itu, aktivitas kolagenase juga diuji dengan menambahkan EDTA dan PMSF (phenylmethanesulfonyl fluoride). Reaksi diawali dengan menambahkan substrat dan buffer kemudian reagen kimia hingga konsentrasi akhir 5 mM untuk EDTA dan 1 mM untuk PMSF. Aktivitas kolagenase diukur secara kuantitatif menggunakan modifikasi metode Bergmeyer et al. (1983).
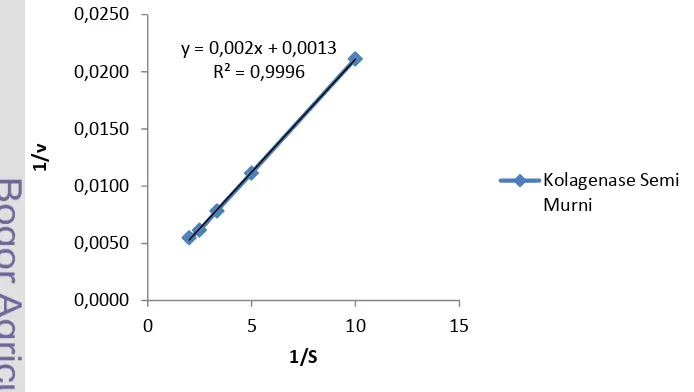
Nilai Km dan Vmax (Baehaki et al. 2012)
Penentuan Km dan Vmax dilakukan dengan mengukur aktivitas kolagenase pada konsentrasi substrat yang berbeda (0.1 – 0.5 mg/ml). Hubungan antara aktivitas dan konsentrasi protein substrat dibuat persamaan linier dengan
Lineweaver-Burk plot untuk mengetahui nilai Km dan Vmaxenzim.
Pola Peptida
4 HASIL DAN PEMBAHASAN
Ekstraksi Kolagen
Ekstraksi kolagen dari kulit ikan gabus (Channa striata) menggunakan dua metode, yaitu metode A dan B. Ekstrak kolagen yang diperoleh menggunakan metode A merupakan kolagen larut air (Water Soluble Collagen) sedangkan pada metode B merupakan kolagen larut asam (Acid Soluble Collagen). Tahap awal ekstraksi kolagen pada kedua metode adalah perendaman di dalam etanol 50% untuk menghilangkan komponen lemak yang terkandung pada kulit ikan. Etanol merupakan pelarut non-polar yang sangat mudah melarutkan minyak dan lemak. Pada metode A dilakukan perendaman di dalam asam asetat 1.5% selama 24 jam untuk mengembangkan kulit sehingga memudahkan proses ekstraksi. Ektraksi menggunakan aquades dan berlangsung pada suhu 400C. Pada metode B
dilakukan perendaman di dalam NaOH 0.1 M selama 6 jam setelah tahap awal. Perendaman di dalam NaOH 0.1 M bertujuan untuk menghilangkan komponen non-kolagen. Perendaman dengan NaOH mengakibatkan struktur kolagen mengembang akibat adanya air yang berpenetrasi. Hal tersebut mengakibatkan komponen-komponen non-kolagen yang pada awalnya terperangkap di dalam matriks kolagen dapat dengan mudah terlepas (Jaswir et al. 2011). Untuk melarutkan kolagen, kulit yang telah diberi perlakuan NaOH direndam dalam asam asetat 0.5bM selama 24 jam. Perendaman kulit ikan di dalam asam asetat mengakibatkan kulit ikan akan mengembang. Hal tersebut disebabkan adanya penetrasi air ke dalam struktur kulit, adanya asam asetat juga membantu meningkatkan ion H+ sehingga mendukung air dapat masuk ke serat kolagen. Pada tahapan ini, kolagen tidak larut sepenuhnya. Hal tersebut disebabkan rendahnya solubilitas kolagen. Untuk mengendapkan kolagen yang terlarut dalam asam asetat maka dilakukan penambahan NaCl sebelum proses sentrifugasi. Pada metode B keseluruhan proses ekstraksi berlangsung pada suhu ± 40C. Hal tersebut dilakukan untuk mencegah terjadinya denaturasi kolagen selama proses ekstraksi. Takeshi (2003) menyatakan bahwa ekstraksi kolagen dari sisik ikan berlangsung pada suhu rendah untuk mereduksi terjadinya fragmentasi.
Tabel 4. Hasil analisa kadar protein ekstrak kolagen
Metode Jenis Ikan Kadar Protein (mg/ml)
Tipe Kolagen
A Ikan Gabus (Channa striata) 0.048 – 0.092 WSC
B Ikan Gabus (Channa striata) 0.546 – 1.323 ASC
Keterangan: Metode A (Yuniarti 2010), Metode B (Modifikasi Nagai and Suzuki 2000); WSC (Water Soluble Collagen), ASC (Acid Soluble Collagen).
Kadar protein ASC dari kulit ikan gabus jauh lebih rendah dibandingkan dengan ASC yang diekstrak dari kulit ayam (5.60 mg/ml) sedangkan kadar protein ASC dari kulit ikan gabus hampir setara dengan ASC yang diekstrak dari ekor tikus, yaitu 1.05 mg/ml. Kadar protein WSC yang diperoleh dari kulit ikan gabus juga jauh lebih rendah jika dibandingkan dengan kulit ayam yang mencapai 5.61 mg/ml (Quereshi et al. 2010; Siriwardane 2008).
Elektroforesis Kolagen
Untuk mengetahui berat molekul kolagen dari masing-masing ekstrak dilakukan SDS-PAGE. Konsentrasi gel pemisah yang digunakan adalah 7.5% dan gel penahan 4%. Kolagen dari tendon sapi digunakan sebagai standar. Hasil analisa SDS-PAGE kolagen masing-masing ekstrak dapat dilihat pada Gambar 4. SDS-PAGE (Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis) merupakan suatu teknik pemisahan protein berdasarkan berat molekulnya. Pada analisa SDS-PAGE, semua protein dibuat bermuatan negatif. SDS yang ditambahkan menyebabkan protein terdenaturasi dan akan berikatan dengan molekul protein sehingga mencegah terjadinya interaksi protein dan protein. Selama proses elektroforesis, kompleks SDS-protein akan bergerak menuju kutub positif. Matriks berpori pada gel poliakrilamid kemudian memisahkan kompleks SDS-protein berdasarkan berat molekulnya (Rehm 2006). Berat molekul protein dapat ditentukan dengan menggunakan protein baku yang telah diketahui berat molekulnya dan membandingkan dengan nilai mobilitas relatif (Rf) yang diperoleh (Suhartono 1989).
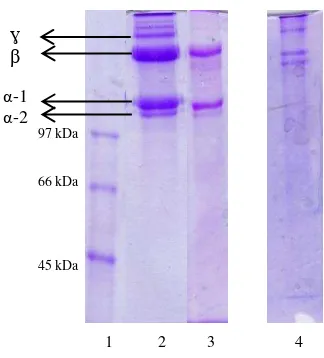
Gambar 4 menunjukkan bahwa kolagen yang diperoleh menggunakan metode ekstraksi WSC dan ASC memiliki berat molekul diatas 97 kDa. Kolagen hasil ekstraksi dari kulit ikan gabus merupakan kolagen tipe 1 karena terdapat dua strukur α, yang sering disebut dengan (α-1) dan (α-2). Hema et al. (2013) menyatakan bahwa kolagen tipe I mengandung dua struktur α yang identik, yaitu α-1 dan α-2. Kedua struktur α pada kolagen ikan dapat dipisahkan dengan SDS-PAGE berdasarkan perbedaan afinitasnya terhadap SDS, dimana α-2 memiliki afinitas yang lebih tinggi terhadap SDS dibandingkan dengan α-1. Muyonga et al.
(2004) menyatakan bahwa kolagen tipe I ditemukan pada kulit, tendon dan tulang.
Acid Soluble Collagen (ASC) yang diekstrak dari kulit ikan gabus mengandung struktur dibandingkan Water Soluble Collagen (WSC). Namun, kolagen yang diperoleh dari kedua metode tersebut mengandung struktur . Ketebalan intensitas pita protein struktur menunjukkan tingginya jumlah kolagen yang mengalami cross linking. Komponen dan menunjukkan molekul kolagen yang mengalami
Gambar 4. Elektroforesis ekstrak kolagen dari ikan gabus. Gel pemisah sebesar 7.5 % dan gel penahan 4% Marker (1), ASC (2), WSC (3), dan kolagen dari tendon sapi (4).
(A) (B) (C) (D) Gambar 5. Elektroforesis kolagen beberapa jenis ikan. Konsentrasi gel pemisah
7.5% dan gel penahan 4%. (A) Ikan Gabus (penelitian ini); (B) Ikan Tuna dan Salmon (Sung et al. 2011); (C) ikan lele (Singh et al.
2011); (D) Ikan lele (Bama et al. 2010).
Gambar 5 menunjukkan perbandingan hasil SDS PAGE kolagen dari kulit ikan gabus dan kolagen dari beberapa jenis ikan. Gambar 5 menunjukkan bahwa pola hasil SDS-PAGE kolagen dari setiap jenis ikan memiliki kesamaan, yaitu terdapat struktur α dan . Kedua struktur tersebut memiliki berat molekul yang tinggi, dimana struktur α memiliki berat molekul dengan kisaran 100-130 kDa sedangkan struktur memiliki berat molekul yang berkisar pada 200-250 kDa. Struktur α-1 menunjukkan intesitas pita protein yang lebih tebal dibandingan dengan α-2. Perbedaan spesies ikan menyebabkan variasi jumlah kolagen pada jaringan tubuhnya. Variasi jumlah kolagen tersebut mampu merefleksikan
swimming behavior dan mempengaruhi karakteristik tekstur otot dari setiap jenis ikan (Montero et al. 1990 dalam Hema et al. 2013).
ɣ
α-1 α-2
97 kDa 66 kDa
45 kDa
1 2 3 4
Kadar Asam Amio Kolagen
Pengujian kadar asam amino masing-masing kolagen dilakukan menggunakan High Performance Liquid Chromatography (HPLC) detektor
fluorosence. HPLC merupakan suatu teknik analisa yang digunakan untuk memisahkan dan mengidentifikasi suatu komponen. Pada analisa menggunakan HPLC, sampel diinjeksikan ke dalam fase gerak. Komponen yang interaksinya kurang kuat dengan fase diam akan keluar dari kolom lebih dahulu dan komponen yang kuat interaksinya akan keluar belakangan. Setiap komponen yang keluar dari kolom akan dideteksi oleh detektor dan divisualisasikan dalam bentuk kromatogram. Kolom yang digunakan adalah AccQtag (3.9 x 150 mm) yang merupakan kolom reversed-phase dimana fase diamnya bersifat hidrofobik. Fase gerak yang digunakan adalah asetonitril 60% dengan laju alir 1 ml/menit, dan volume penyuntikan sebesar 5µl. Fase gerak yang digunakan adalah pelarut semi-polar yang mampu melarutkan komponen ionik dan non-semi-polar. Asetonitril merupakan pelarut yang memiliki reaktivitas rendah terhadap senyawa kimia dan viskositasnya rendah.
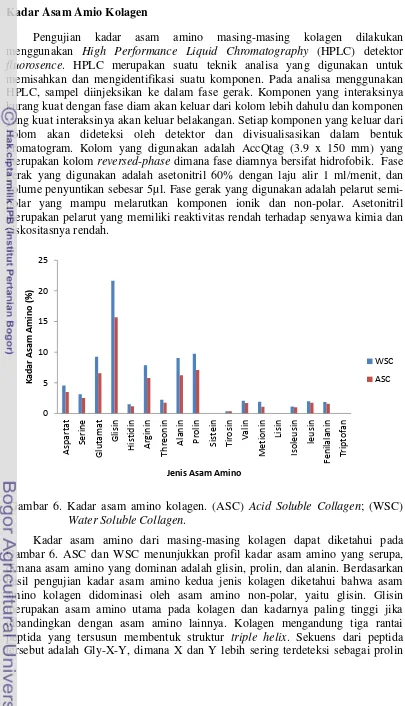
Gambar 6. Kadar asam amino kolagen. (ASC) Acid Soluble Collagen; (WSC)
Water Soluble Collagen.
dan hidroksiprolin (Daboor et al. 2010). Hasil analisa juga menunjukkan bahwa terdapat tujuh asam amino esensial yang terdeteksi pada kedua jenis kolagen, yaitu histidin, threonin, valin, metionin, isoleusin, leusin, dan fenilalanin.
Kadar asam amino glisin untuk WSC dan ASC berturut-turut adalah 21.65% dan 15, 69%. Kadar gilisin untuk ASC cenderung jauh lebih rendah dibandingkan dengan WSC. Disamping itu, kadar glisin ASC ikan gabus juga jauh lebih rendah jika dibandingkan dengan kandungan glisin yang diperoleh pada ikan tuna, ikan hiu, dan ikan lele yang berada pada kisaran 30% (Hema et al. 2013; Singh et al.
2011). Kadar asam amino prolin dan alanin ASC ikan gabus juga cenderung lebih rendah dibandingkan dengan ikan tuna, ikan hiu, dan ikan lele. Kandungan prolin dan alanin ASC ikan gabus sebesar 7.09% dan 6.21% sedangkan pada ikan tuna, ikan hiu dan ikan lele berada pada kisaran 9-12% untuk prolin dan 11-12% untuk alanin (Hema et al. 2013; Singh et al. 2011).
Skrining Isolat Penghasil Kolagenase
Isolat yang digunakan untuk skrining mikroba penghasil kolagenase adalah
Bacillus licheniformis F11.4 dan F11.1, Bacillus subtilis, Bacillus pumilus, Bacillus sp. TPS2d, Bacillus sp. MTS, Bacillus cereus, Bacillus sp.,
Stenotropomonas sp. dan isolat Sw. Kesepuluh isolat ditumbuhkan pada media yang diperkaya kolagen. Kolagen yang ditambahkan pada media sebesar 5% dan dalam bentuk kasar. Supernatan bebas sel hasil fermentasi kemudian dianalisa zimogram untuk mengetahui mikroba penghasil kolagenase. Pada analisa zimogram, gel pemisah 10% dikopolimerasi dengan 1 ml kolagen. Kolagen yang digunakan adalah ASC (Acid Soluble Collagen). Hasil skrining isolat penghasil kolagenase dengan metode zimogram dapat dilihat pada Gambar 7.
Gambar 7 dan Tabel 5 menunjukkan bahwa semua isolat memiliki kemampuan kolagenolitik. Hal tersebut dibuktikan dengan terbentuknya pita-pita berwarna bening pada gel akrilamid yang telah dikopolimerasi dengan kolagen (ASC). Diantara kesepuluh isolat tersebut terdapat beberapa isolat yang memiliki kemampuan kolagenolitik paling tinggi berdasarkan intensitas pita bening yang terbentuk, yaitu Streptropomonas sp., isolat Sw dan Bacillus licheniformis F11.4.
Bacillus pumilus dan Bacillus subtilis merupakan kontrol positif. Penambahan kolagen pada media pertumbuhan dapat menginduksi mikroba untuk menghasilkan fraksi pemecah kolagen, dengan kata lain kolagen yang ditambahkan pada media pertumbuhan kesepuluh jenis isolat tersebut berperan sebagai inducer. Kolagenase yang dihasilkan merupakan suatu respon terhadap kehadiran kolagen di dalam media pertumbuhan. Berdasarkan hal tersebut kolagenase yang dihasilkan oleh kesepuluh isolat bakteri tidak tergolong enzim konstitutif. Enzim konstitutif merupakan golongan enzim yang dapat diproduksi tanpa bergantung terhadap kehadiran suatu substrat tertentu. Terdapat kemiripan fraksi kolagenase yang dihasilkan dari isolat yang berbeda. Fraksi kolagenase yang dihasilkan oleh Bacillus subtilis memiliki kesamaan dengan fraksi dari isolat Sw, sehingga terdapat kemungkinan bahwa isolat Sw yang belum teridentifikasi merupakan Bacillus subtilis. Selain itu, fraksi kolagenase yang dihasilkan oleh
Bacillus pumilus memiliki kemiripan dengan fraksi kolagenase dari Bacillus sp.
Tabel 5. Hasil skrining isolat penghasil kolagenase
Jenis Isolat Sumber Aktivitas
Kemampuan Menghasilkan
Kolagenase
Bacillus licheniformis F11.4 Limbah kulit udang Penghasil Protease √
Bacillus licheniformis F11.1 Limbah kulit udang Penghasil Protease √
Isolat Sw Limbah kulit udang Penghasil Protease √
Bacillus sp. MTS Tanah belerang gunung Tangkuban Perahu, Bandung- Jawa Barat
Mampu menghancurkan bulu ayam utuh dan hidrolisis berbagai substrat protein
√
Bacillus subtilis Limbah cair tahu Penghasil Protease √
Bacillus pumilus Limbah cair tahu Penghasil Protease √
Bacillus cereus Oncom Penghasil Protease √
Bacillus sp. TPS2d Tangkuban Perahu Penghasil Protease √
Bacillus. sp Oncom Penghasil Protease √
Stenotropomonas sp. Oncom Fibrinolitik √
Gambar 7. Zimogram isolat penghasil kolagenase. Gel pemisah sebesar 10% dan gel penahan 4%. (F11.1) Bacillus licheniformis F11.1; (BP) Bacillus pumilus; (11) Streptropomonas sp.; (Sw) Isolat Siswa; (MTS) Bacillus
sp. MTS; (G) Bacillus cereus; (Tps2d) Bacillus sp TPS2d; (BS)
Bacillus subtilis; (J) Bacillus sp.
Deteksi aktivitas enzim melalui analisa zimogram merupakan suatu teknik elektroforesis menggunakan akrilamid, SDS (Sodium duodesil sulfat) dan substrat. Pada metode ini enzim akan menghidrolisis substrat, dalam hal ini kolagen, pada gel akrilamid dengan menginkubasi gel pada suhu dan pH yang sesuai dengan aktivitas enzim. Daya katalitik enzim pada metode ini divisualisasikan dengan merendam gel ke dalam larutan pewarna coomasie briliant blue hingga terbentuk fraksi atau pita bening (Baehaki et al. 2012).
Karakterisasi Kolagenase Bacillus lichenifromis F11.4 Pola Peptida dan Elektroforesis Kolagenase
Berdasarkan hasil skrining diketahui bahwa kesepuluh isolat yang digunakan potensial sebagai penghasil kolagenase. Salah satu isolat, yaitu Bacillus licheniformis F11.4 kemudian ditumbuhkan pada media yang diperkaya dengan kolagen (ASC) sebesar 15% dan diinkubasi pada kondisi yang sama dengan proses skrining. Kolagenase yang diperoleh kemudian dianalisa berat molekulnya dan kemampuannya memecah kolagen dengan metode SDS-PAGE. Hasil analisa berat molekul kolagenase dan kemampuan memecah substrat kolagen dengan metode SDS-PAGE dapat dilihat pada Gambar 8. Kolagenase dari Bacillus licheniformis F11.4 dipilih untuk dikarakterisasi disebabkan bakteri Bacillus licheniformis F11.4 merupakan suatu bakteri yang unik. Bacillus licheniformis
F11.4 adalah hasil mutasi dari bakteri Bacillus licheniformis F11 yang memiliki aktivitas protease tinggi akan tetapi kehilangan aktivitas kitinasenya (Waldeck et al. 2006). Hasil mutasi Bacillus licheniformis F11, yaitu penghilangan gen chiA
dan chiB, menghasilkan Bacillus licheniformis F11.4 yang kehilangan operon pembentukan poliglutamat (∆pga) dan chiBA (Hoffmann et al. 2010). Selain itu,
Bacillus lichenifornis F11.4 merupakan golongan bakteri gram positif yang sifatnya tidak patogen, sedangkan Streptropomonas sp. merupakan bakteri gram negatif dan telah dilaporkan bersifat patogen.
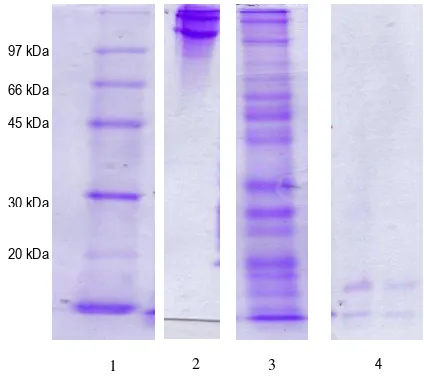
Gambar 8 menunjukkan bahwa berat molekul kolagenase Bacillus licheniformis F11.4 adalah 15 kDa. Pada Gambar 8 kolagen hasil ekstraksi dari ikan gabus, kolagenase, serta kompleks ASC dan kolagenase dianalisa menggunakan SDS-PAGE dengan gel pemisah sebesar 12%. Tujuan penggunaan gel pemisah 12% adalah untuk melihat pola pemecahan kolagenase terhadap kolagen. Oleh karena itu, pada line 2 dari Gambar 8, pita kolagen yang dihasilkan tidak sama dengan pita kolagen pada gel pemisah 7.5% (Gambar 4; line 2). Hasil inkubasi ASC dan kolagenase Bacillus licheniformis F11.4 menunjukkan terbentuknya pita-pita baru. Pita-pita baru tersebut menunjukkan bahwa kolagenase mampu menghidrolisis kolagen (ASC) dari kulit ikan gabus. Pita-pita dominan yang terbentuk memiliki ukuran berat molekul yang lebih kecil dibandingkan kolagen, yaitu 62, 51, 44, 37, 32, dan 25 kDa. Hasil SDS-PAGE peptida kolagen juga menunjukkan bahwa terjadi penurunan intesitas ketebalan pita pada struktur α. Hal tersebut menunjukkan bahwa kolagenase dari Bacillus licheniformis F11.4 memiliki kemampuan memecah struktur α dari kolagen
(ASC).
Mekanisme hidrolisis kolagen oleh kolagenase Bacillus licheniformis F11.4 belum sepenuhnya diketahui. Namun, berdasarkan hasil penelitian pada kolagenase dari Clostridium histolyticum diketahui bahwa kolagenase memiliki domain katalitik yang mengandung Zn dan tergolong ke dalam metaloprotease. Selain itu, kolagenase dari Clostridium histolyticum memiliki dua domain lain yang dikenal dengan Collagen Binding Domain (CBD) dan Polycystic Kidney Disease-like Domain (PKD) (Fields 2013). Ketiga domain tersebut sangat berperan aktif di dalam hidrolisis molekul kolagen. Collagen Binding Domain
struktur triple helix akan tetapi tidak berikatan atau menempel pada bagian molekul kolagen, sedangkan domain katalitik merupakan bagian dari molekul kolagenase yang akan menempel pada molekul kolagen dan selanjutnya akan memotong kolagen pada titik-titik tertentu (Brandstetter dan Eckhard 2011).
Gambar 8. SDS-PAGE kolagenase dari Bacillus licheniformis F11.4. Gel pemisah sebesar 12% dan gel penahan 4%. Marker (1); Kolagen B (2); Kompleks ASC (Acid Soluble Collagen) dan kolagenase
Bacillus licheniformis F11.4 (3); Kolagenase Bacillus licheniformis F11.4.
Berat molekul kolagenase dari sumber yang berbeda telah banyak diteliti, diantaranya kolagenase dengan ukuran 125 kDa dari B.subtilis FS-2 (Hiroko dan Kim 1999); 120 dan 29 kDa dari B.licheniformis N22 (Asdornnithee et al. 1994); 42.8 kDa dari Bacillus cereus (Sela et al. 1998); 58.64 kDa dari B.pumilus (Wu et al. 2010); 33 dan 19.8 kDa dari Pseudomonas sp. (Hisano et al. 1989). Variasi dari berat molekul kolagenase disebabkan oleh proteolisis dari molekul kolagenase yang lebih besar (Bond dan Wart 1984), dimana enzim yang diamati pada penelitian ini merupakan bentuk terkecil dari molekul enzim.
Gambar 9 menunjukkan bahwa enzim ekstraseluler dari Bacillus licheniformis F11.4 mampu menghidrolisis substrat lain selain kolagen, yaitu fibrinogen dan kasein. Hal tersebut menunjukkan bahwa terdapat fraksi-fraksi kolagenase Bacillus licheniformis F11.4 yang mampu menghidrolisis fibrinogen dan kasein. Namun, keberadaan kolagen pada media pertumbuhan mampu menginduksi fraksi-fraksi protease yang lebih aktif terhadap kolagen. Aktivitas fibrinolitik yang diperoleh dari kolagenase ini sangat penting untuk membuka peluang aplikasi kolagenase sebagai trombolyticagent pada bidang medis.
Kemampuan memecah fibrinogen dan kasein oleh kolagenase Bacillus licheniformis ditunjukkan dengan terbentuknya pita-pita baru dengan berat molekul yang lebih kecil. Hasil SDS-PAGE fibrinogen menunjukkan bahwa terdapat dua pita dominan dari fibrinogen yang memiliki berat molekul 63 dan 56 kDa. Kedua pita tersebut masing-masing terdeteksi sebagai rantai α dan . Setelah
97 kDa
66 kDa 45 kDa
30 kDa
20 kDa
4 2 3
97 kDa 66 kDa
45 kDa
30 kDa
20 kDa
proses inkubasi dengan kolagenase Bacillus licheniformis F11.4 dan fibrinogen terbentuk pita-pita baru dengan berat molekul 49, 41 dan 38 kDa. Pada kasein terdapat tiga band dominan yang memiliki berat molekul 45, 38 dan 34 kDa. Proses inkubasi kasein dan kolagenase Bacillus licheniformis F11.4 menghasilkan peptida baru dengan ukuran berat molekul yang lebih kecil, yaitu 22, 20, 18, 16, 15 dan 14 kDa.
Gambar 9. SDS-PAGE kolagenase Bacillus licheniformis F11.4 pada berbagai substrat. Gel pemisah sebesar 12% dan gel penahan 4%. Marker (1); Fibrinogen (2); Kompleks kolagenase dan fibrinogen (3); Kasein (4); Kompleks kolagenase dan kasein (5).
Suhu Optimum
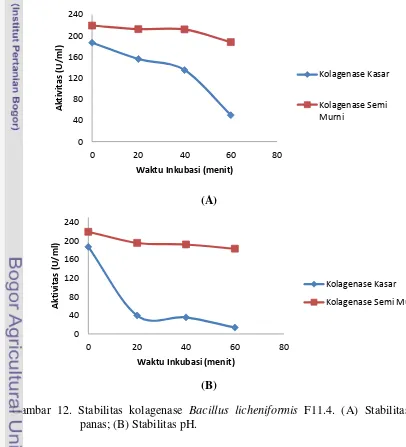
Penentuan suhu optimum kolagenase Bacillus licheniformis F11.4 dilakukan dengan mereaksikan kolagenase dengan kolagen ASC pada berbagai tingkatan suhu. Umumnya enzim memiliki aktivitas maksimum pada suhu tertentu, aktivitas enzim akan semakin meningkat dengan bertambahnya suhu hingga suhu optimum tercapai. Setelah itu, kenaikan suhu lebih lanjut akan menurunkan aktivitas enzim. Peningkatan aktivitas kolagenase pada suhu 400C hingga 500C dikarenakan terjadi peningkatan energi kinetik kolagen dan kolagenase. Hal tersebut menyebabkan energi untuk menempelkan enzim pada substrat bertambah sehingga jumlah enzim yang bereaksi dengan substrat meningkat per unitnya. Sebaliknya, terjadinya penurunan aktivitas kolagenase seiring meningkatnya suhu inkubasi disebabkan kolagenase mengalami denaturasi. Denaturasi pada kolagenase menyebabkan kolagenase kehilangan bentuknya sehingga kolagen tidak dapat terikat pada sisi katalitik enzim. Gambar 10 menunjukkan pengaruh suhu terhadap aktivitas kolagenase kasar dan kolagenase semi murni dari Bacillus licheniformis F11.4.
Kolagenase Bacillus licheniformis F11.4 memiliki suhu optimum pada 400C
hingga 500C yang digolongkan ke dalam termostabil moderat. Suhu optimum kolagenase Bacillus licheniformis F11.4 sedikit lebih tinggi dibandingkan dengan kolagenase dari Streptomyces parvulus, yaitu 370C (Sakurai et al. 2009). Suhu
optimum kolagenase Bacillus licheniformis F11.4 lebih rendah dibandingkan
3
2 4 5