YUNITA SITI MARDHIYYAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
AKTIVITAS ANTIOKSIDAN SERTA INHIBISI LIPASE DAN
α
-AMILASE PADA TEMPE DENGAN PENGASAMAN SPONTAN
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
*Dengan ini saya menyatakan bahwa tesis berjudul Aktivitas Antioksidan serta Inhibisi Lipase dan α-Amilase pada Tempe dengan Pengasaman Spontan dan Pengasaman dengan Penambahan Asidulan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2016
Yunita Siti Mardhiyyah NIM F251130051
*
RINGKASAN
YUNITA SITI MARDHIYYAH. F251130051. Aktivitas Antioksidan serta Inhibisi Lipase dan α-Amilase pada Tempe dengan Pengasaman Spontan dan Pengasaman dengan Penambahan Asidulan. Di bawah bimbingan C. HANNY WIJAYA dan MADE ASTAWAN
Pengubahan energi dari asupan pangan berlebih yang berdampak pada obesitas dapat ditekan dengan inhibisi enzim pencernaan seperti lipase dan α -amilase. Asupan pangan yang kaya akan antioksidan diperlukan sebagai alternatif pencegahan komplikasi penyakit degeneratif yang disebabkan oleh obesitas. Kedelai dilaporkan mengandung komponen bioaktif seperti protein, saponin, isoflavon dengan kemampuan fisiologis aktif tersebut. Sekitar 50% dari kedelai di Indonesia diolah menjadi tempe. Pengolahan menjadi tempe dilaporkan mampu meningkatkan kemampuan fisiologis aktif dari kedelai.
Inovasi pengasaman dengan penambahan asidulan telah dilakukan untuk mempercepat proses pengasaman dan mengatasi kegagalan dalam pengasaman spontan (fermentasi bakteri asam laktat). Proses pengolahan kedelai menjadi tempe dan metode pengasaman diduga akan memberikan perbedaan kandungan gizi dan kemampuan fisiologis aktif. Oleh karena itu, tujuan dari penelitian ini adalah mengevaluasi aktivitas fisiologis aktif (antioksidan, inhibisi lipase dan α -amilase) tempe yang dibuat dengan pengasaman spontan dan pengasaman dengan penambahan asidulan.
Penelitian terdiri atas dua tahap. Penelitian tahap satu yaitu penyiapan kedelai dan pembuatan tempe dengan berbagai cara pengasaman menggunakan Rancangan Acak Lengkap dan analisis komposisi kimianya (proksimat, total isoflavon daidzein dan genistein). Terdapat empat jenis sampel yang akan dibuat, yaitu kedelai rebus (S) sebagai sampel kontrol tanpa proses pengasaman dan fermentasi, tempe dengan pengasaman spontan (fermentasi BAL) atau tempe N (natural fermentation), tempe dengan penambahan asidulan asam laktat (tempe L), tempe dengan penambahan asidulan GDL (tempe G). Data dianalisis dengan analisis ragam (ANOVA) dengan uji lanjut Tukey pada taraf kepercayaan 95%.
Penelitian tahap dua merupakan pembuatan ekstrak dan analisis kemampuan bioaktif ekstrak yang dilakukan menggunakan Rancangan Acak Lengkap Faktorial dengan dua jenis faktor yaitu jenis sampegl (kedelai rebus atau S, tempe N, tempe L, tempe G) dan cara ekstraksi (maserasi MeOH 50% dan perebusan dalam air). Analisis ekstrak meliputi aktivitas antioksidan, inhibisi lipase dan α -amilase serta dilakukan perhitungan nilai IC50 dan EC50. Analisis komponen bioaktif ekstrak berupa total protein terlarut, total saponin, total fenol, daidzein dan genistein. Data nilai EC50 aktivitas antioksidan, nilai IC50 inibisi lipase, nilai IC50 inibisi α-amilase, total protein terlarut, total saponin, total fenol, daidzein, dan genistein dianalisis dengan analisis ragam (ANOVA) dengan uji lanjut Tukey pada taraf kepercayaan 95%. Hubungan kemampuan fisiologis aktif (aktivitas antioksidan, inhibisi lipase dan α-amilase) dengan kandungan komponen bioaktif ekstrak dianalisis menggunakan korelasi Pearson.
kedelai terikat dengan baik oleh miselium dan tidak terburai ketika terpotong. Hasil analisis kandungan proksimat menunjukkan perbedaan kadar lemak, protein, abu kedelai dan tempe dan juga antartempe. Terjadi peningkatan kadar lemak, protein pada tempe dibandingkan kedelai, namun terjadi penurunan kadar abu tempe dibanding kedelai. Adapun tempe dengan pengasaman asidulan (tempe L dan G) memiliki kadar air lebih rendah dibandingkan tempe dengan pengasaman spontan (tempe N). Perbedaan lama perendaman menjadi penyebab hal tersebut. Komponen isoflavon daidzein dan genistein tempe meningkat dibandingkan kedelai (16.4 mg/100 g bk dan 16.7 mg/100 g bk), dengan kandungan tertinggi terdapat pada tempe G yaitu berturut-turut daidzein dan genistein yaitu 50.2 mg/100 g bk dan 45.5 mg/100 g bk.
Perbedaan cara ekstraksi dan sampel menghasilkan kandungan total fenol, total protein terlarut dan total saponin yang berbeda signifikan antarekstrak. Ekstrak metanol 50% menunjukkan kandungan total fenol dan saponin yang tinggi, sedangkan ekstrak air menunjukkan kandungan total protein terlarut yang tinggi. Secara umum pada kedua jenis ekstrak (metanol 50% dan air), terjadi peningkatan total fenol dan total protein pelarut pada ekstrak tempe dibandingkan ekstrak kedelai, namun terjadi penurunan total saponin ekstrak tempe dibandingkan ekstrak kedelai. Ekstrak ketiga jenis tempe memiliki total saponin yang tidak berbeda signifikan. Kandungan total protein terlarut berturut meningkat pada ekstrak tempe L, tempe N dan tempe G. Adapun kandungan total fenol pada ekstrak tempe N lebih rendah dibandingkan ekstrak tempe dengan pengasaman asidulan (tempe L dan G). Antarekstrak tempe pengasaman asidulan (tempe L dan G) memiliki kadar total fenol yang tidak berbeda signifikan.
Aktivitas antioksidan dan inhibisi α-amilase tempe lebih tinggi dan signifikan dibandingkan dengan kedelai. Tempe dan kedelai tidak memiliki perbedaan yang nyata pada aktivitas inhibisi lipase. Antara tempe pengasaman spontan (tempe N), tempe pengasaman asidulan asam laktat (tempe L) dan tempe pengasaman asidulan GDL (tempe G) tidak memiliki perbedaan yang nyata pada aktivitas antioksidan, inhibisi lipase dan α-amilase. Semua tempe menunjukkan aktivitas antioksidan moderat dengan nilai EC50 8.4-19.1 mg/mL, aktivitas inhibisi lipase yang tinggi dengan nilai IC50 0.2-6.3 mg/mL, dan aktivitas inhibisi amilase yang rendah dengan nilai IC50 555-1114 mg/mL. Komponen protein terlarut diduga berperan dalam aktivitas inhibisi lipase, demikian juga komponen fenolik berperan dalam aktivitas antioksidan. Aktivitas inhibisi α-amilase berkorelasi kuat positif dengan aktivitas antioksidan. Proses pengasaman fermentasi spontan maupun penambahan asidulan dapat digunakan untuk menghasilkan tempe dengan kemampuan fisiologis aktif antioksidan dan inhibisi lipase sehingga berpotensi untuk dikembangkan sebagai pangan fungsional dalam penanganan obesitas.
SUMMARY
YUNITA SITI MARDHIYYAH. F251130051. Antioxidant Activity, Lipase and
α-Amilase Inhibiton of Soybean Tempe Produced by Spontaneous Acidification and Acidifcation with Acidulant Addition. Supervised by C. HANNY WIJAYA and MADE ASTAWAN
Energy conversion from over food intake that caused obesity could be reduced through inhibition of disgestive enzyme such as lipase and α-amylase. High antioxidant food intake also needed to prevent degenerative disesseas that caused by obesity. Soybean has been reported having bioactive compounds such as protein, saponin and isoflavon that show physiological active properties. About 50% of soybean in Indonesian has been processed to be tempe. Tempe processing is also reported to increase the physiological active properties of soybean.
Utilization of acidulants in soybean acidification has been promoted to accelerate soybean acidification time and overcome the fail acidification process on spontaneous soybean acidification. Tempe production from soybean and variuous soybean acidification could promote different nutritious content, bioactive compound content and physicologycal activities. Hence, the aim of this research was to evaluate physicological activities (lipase inhibition, α-amylase inhibition and antioxidant activity) of tempe that produced from spontaneous acidification and asidulant utilization.
The research consists of two steps. The first step was soybean preparation and tempe production with some acidification process with completely randomize design and followed by chemical composition analysis (proximate, total daidzein and genistein isoflavones). There were four samples; they were boiled soybean (S) as control without acidification and fermentation process, spontaneous acidification (fermentation) tempe (N tempe), lactic acid acidulant addition tempe (L tempe), and GDL acidulant addition tempe (G tempe). One-way analysis of
variance followed by Tukey’s multicomparison test was used for comparing
proximate and isoflavone data among treatments at significant p<0.05.
The second step research was extraction and phychysological active analyses with factorial experiment of completely randomize design with two kinds of factors (kind of samples: S, N tempe, L tempe, G tempe and extraction methods: MeOH 50% maseration and boiling water extraction). All eight-extracts were analysed for antioxidant activity lipase and α-amylase inhibition followed by IC50 and EC50 calculation. The bioactive compound analyses were total soluble protein, total saponin, total phenol, daidzein and genistein content. Further,
one-way analysis of variance followed by Tukey’s multicomparison test was used for
comparing the results among treatments. Differences were considered significant at p<0.05. Pearson correlation was used to analyses the correlation between the bioactivities and the compounds in extracts.
The result indicated that three kind of acidification produced tempe that same with common tempe product: full mycelium growth that bounded soybeans
well and the soybean didn’t fall when being sliced. Macronutrinet analysis
to soybean. In the other hand, ash content of tempe was lower compared to soybean. Acidulant acidification tempe (L and G tempe) had lower moisture content than spontaneous acidification tempe (N tempe). Different length of soaking time was suspected being the reason for those phenomena. Daidzein and genistein isoflavone of tempe were increase compared to soybean (16.4 mg/100 g db and 16.7 mg/100 g db, respectively), with the highest content of isoflavone was in G tempe with value daidzein and genistein were 50.2 mg/100 g db and 45.5 mg/100 g db, respectively.
Variance of extraction ways and samples showed different total phenolic compound, total soluble protein and total saponin between all extracts. 50% methanol extract showed high total phenolic compound and total saponin, while water extract was high in total soluble protein content. There were increasing value of total phenolic compound and total soluble protein content in tempe extracts compared to soybean extracts, but there were decreasing value of total saponin in tempe extracts compared to soybean extracts. All there tempe extracts had total saponin value that not significantly different. Total soluble protein was increased with order as follows L tempe, N tempe and G tempe. Meanwhile, total phenolic content of N tempe extract was lower than acidulant acidification tempe extract (L and G tempe). Both acidulant acidification tempe extract (L and G tempe) have total phenolic content that not significantly different.
Antioxidant activity and α-amylase inhibition acitivity of tempe samples were significantly higher than soybean. No significantly difference of lipase inhibition acitivity of soybean and tempe samples. Moreover, no significantly difference of antioxidant activity, α-amylase inhibition acitivity and lipase inhibition acitivity among all tempe samples (N tempe, L tempe and G tempe). All tempe showed moderate antioxidant activity with EC50 was 8.4-19.1 mg/mL, high lipase inhibition with IC50 was 0.2-6.3 mg/mL, and low α-amylase inhibition with IC50 was 555-1114 mg/mL. Total soluble protein compound might contributed in lipase inhibition activity, and total phenolic compound might contributed in antioxidant activity. α-Amylase inhibition activity was positively strong coreelated with antioxidant activity. It was concluded that either spontaneous acification or acidulants utilization could be use to produced tempe with high lipase inhibition and antioxidant activity that potential to be developed as functional food for combating obesity.
© Hak Cipta Milik IPB, Tahun 2016 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
YUNITA SITI MARDHIYYAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
AKTIVITAS ANTIOKSIDAN SERTA INHIBISI LIPASE DAN
α
-AMILASE PADA TEMPE DENGAN PENGASAMAN SPONTAN
Judul Tesis : Aktivitas Antioksidan serta Inhibisi Lipase dan
α-Amilase pada Tempe dengan Pengasaman Spontan dan Pengasaman dengan Penambahan Asidulan
Nama : Yunita Siti Mardhiyyah
NIM : F251130051
Disetujui oleh: Komisi Pembimbing
Prof. Dr. Ir. C. Hanny Wijaya, M Agr Ketua
Prof. Dr. Ir. Made Astawan, MS Anggota
Diketahui oleh:
Ketua Program Studi Ilmu Pangan
Dr. Ir. Harsi Dewantari Kusumaningrum
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc. Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Sholawat dan salam selalu tercurah kepada Nabi Muhammad SAW. Tema yang dipilih dalam penelitian yang dilaksanakan Juli 2014 s.d November 2015 ini ialah perbedaan proses produksi tempe dan pengaruhnya pada aktivitas fisiologis aktif, dengan judul Aktivitas Antioksidan serta Inhibisi Lipase dan α-Amilase pada Tempe dengan Pengasaman Spontan dan Pengasaman dengan Penambahan Asidulan.
Penulisan karya ilmiah ini tidak terlepas dari doa dan bantuan banyak pihak. Oleh karena itu penulis sampaikan terima kasih yang sebesar-besarnya kepada: 1. Ibu tercinta Prof. Dr. Ir. C. Hanny Wijaya, M. Agr selaku dosen ketua komisi
pembimbing yang telah membimbing penelitian dan tugas akhir, tak pernah lelah menasehati, menanamkan berbagai nilai kehidupan, menegur jika salah dan menjadi ibu yang sangat peduli bagi kesuksesan hidup para CHWers. 2. Bapak Prof. Dr. Ir. Made Astawan, MS selaku dosen anggota komisi
pembimbing yang telah membimbing, menasehati, berbagi cerita dan mengarahkan dalam penelitian dan penyelesaian tugas akhir.
3. Ibu Dr. Ir. Endang Prangdimurti, M.Si sebagai penguji luar komisi dan Dr. Ir. Harsi D. Kusumaningrum selaku Ketua Jurusan Program Studi Ilmu Pangan IPB, yang telah memberikan masukan pada saat ujian sidang tesis
4. Prof Jun Kawabata and Dr Eisuke Kato from Food Biochemistry Laboratory, Graduate School of Agriculture Hokkaido University Japan as my supervisor in Hokkaido Univeristy for my PARE student exchange program started Augustus 2014 until Februari 2015. I would like to thank for their advice and guidance during the reseach in Japan and for their correction on the publication journal.
5. Pemerintah RI melalui beasiswa pendidikan master dalam negeri LPDP 2013-2015 sehingga penulis dapat menempuh pendidikan pascasarjana di IPB. 6. Ayah Mardi Wiyono, ibu Siti Halimah, adik Yanu Rahmawati dan keluarga
besar di Gresik dan Madiun yang selalu sabar menanti kelulusan dan tiada kenal memberi semangat hidup.
7. Bu Dede Adawiyah, Bu Sri, Mas Iman, Meutia dan Raudhah yang menjadi tim dalam uji sensori teh hijau Jepang CRC-Seafast sehingga menjadikan waktu dalam penantian tesis lebih bermakna.
8. Teman kos Az-Zukhruf (Mbak Nawa, Iza, Mbak Juli, Mbak Ulfa, Mbak Icha, Nurul, dll), teman sepengajian Al Khidmah Bogor, keluarga besar CHWers (Edo, Mbak Monita, Mbak Atika, Siti, Mbak Kamil, Bu Maria, Mbak Ayu, Nicky dll), teman-teman PARE periode Summer School Agustus-September 2014, teman-teman PPI Hokkaido Jepang, teman-teman awardee LPDP-IPB, teman-teman BSC 2013/2014, teman-teman IPN 2013 dan taklupa keluarga kecil Arafah (Mbak Irul, Muji, Mas Bayu, Mbak Yuni, Kak Yusnita, Windi, Om Musa, Robba dan Wahyu) atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2016
DAFTAR ISI
DAFTAR TABEL xv
DAFTAR GAMBAR xv
DAFTAR LAMPIRAN xvi
1 PENDAHULUAN 1
Latar belakang 1
Rumusan Masalah 2
Tujuan 3
Hipotesis 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 3
Aktivitas Antioksidan 3
Aktivitas Inhibisi Lipase 4
Aktivitas Inhibisi α-Amilase 5
Pengasaman Kedelai pada Produksi Tempe 8
3 METODE 9
Waktu dan Tempat 9
Bahan 9
Alat 9
Tahapan Penelitian 9
Penelitian Tahap 1 10
Penelitian Tahap 2 13
Rancangan Penelitian 16
Analisis Data 16
4 HASIL DAN PEMBAHASAN 17
Kandungan Zat Gizi Kedelai dan Tempe 19
Kandungan Isoflavon Genistein dan Daidzein pada Kedelai dan Tempe 21
Kandungan Komponen Bioaktif Ekstrak 22
Aktivitas Fisiologis Ekstrak Kedelai dan Tempe 26
Aktivitas Antioksidan 26
Aktivitas Inhibisi Enzim Lipase 28
Aktivitas Inhibisi Enzim α-Amilase 29
Hubungan Aktivitas Fisiologis dan Kandungan Komponen Bioaktif Ekstrak 32
5 SIMPULAN DAN SARAN 33
Simpulan 33
Saran 34
DAFTAR PUSTAKA 34
LAMPIRAN 41
DAFTAR TABEL
Komponen bioaktif dengan aktivitas inhibisi berbagai enzim lipase 7 Komponen bioaktif dengan aktivitas inhibisi berbagai enzim α
-amilase 7
Nilai pH dari kedelai dan air perendam 17
Hasil analisis proksimat dari tempe dan kedelai rebus* 19
Kandungan komponen bioaktif dari ekstrak kedelai dan tempe 23 Kandungan daidzein dan genistein dari ekstrak kedelai dan tempe 25 Korelasi Pearson dari kemampuan fisiologis aktif (Nilai IC50 dan
Jalur metabolisme lemak dalam pencernaan (Yuliana et al. 2010) 4 Jalur metabolisme karbohidrat dalam pencernaan (Yuliana et al.
2010) 6
Tahapan kerja penelitian 11
Tahapan proses penyiapan kedelai dan produksi tempe 12
Tempe dengan berbagai proses pengasaman (a) Pengasaman fermentasi spontan atau tempe N, (b) Pengasaman dengan asidulan asam laktat atau tempe L, (c) Pengasaman dengan asidulan GDL atau tempe G, (d) Penampang luar ketiga tempe. 18 Kandungan daidzein dan genistein pada tempe N, tempe L, tempe G
dan kedelai (mg/100 g (bk)). Angka dengan huruf berbeda menunjukkan perbedaan nyata (p<0.05) menggunakan uji
Tukey antarsampel pada tiap jenis isoflavon. 22
Nilai EC50 aktivitas antioksidan dari ekstrak kedelai dan tempe. Angka dengan huruf berbeda (p-q: ekstrak, a-b: sampel) menunjukkan perbedaan nyata (p<0.05) menggunakan uji
Tukey antarsampel pada tiap jenis ekstrak. 26
Nilai IC50 inhibisi lipase dari ekstrak kedelai dan tempe. Angka dengan huruf berbeda (p-q: ekstrak, a: sampel) menunjukkan perbedaan nyata (p<0.05) menggunakan uji Tukey antarsampel
pada tiap jenis ekstrak. 28
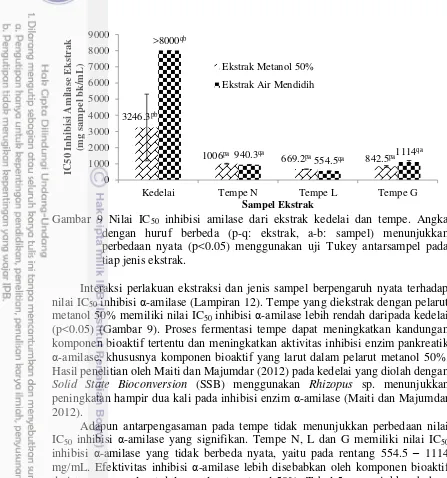
Nilai IC50 inhibisi amilase dari ekstrak kedelai dan tempe. Angka dengan huruf berbeda (p-q: ekstrak, a-b: sampel) menunjukkan perbedaan nyata (p<0.05) menggunakan uji Tukey antarsampel
DAFTAR LAMPIRAN
1 2 3 4 5 6 7 8 9 10
11 12 13
Hasil Uji Statistik pH Air dan Kedelai 42
Hasil Uji Statistik Proksimat Tempe dan Kedelai 44
Hasil Uji Statistik Daidzein dan Genistein Tempe dan Kedelai 45 Hasil Uji Statistik Komponen Bioaktif Ekstrak Tempe dan Kedelai 47
Kurva Standar Sovine Serum Albumin (BSA) 50
Kurva Standar Saponin 50
Kurva Standar Asam Galat 51
Kurva Standar Daidzein dan Genistein 51
Kurva Inhibisi Lipase dan Amilase Ekstrak 51
Perhitungan EC50 Aktivitas Antioksidan dengan GraphPad Prism 6
Demo 53
Perhitungan IC50 Inhibisi Lipase dengan GraphPad Prism 6 Demo 57 Perhitungan IC50 Inhibisi Amilase dengan GraphPad Prism 6 Demo 60
1
PENDAHULUAN
Latar belakang
Obesitas atau kegemukan merupakan permasalahan gizi yang diyakini sebagai faktor utama pemicu berbagai penyakit degeneratif seperti diabetes melitus, Penyakit Jantung Koroner (PJK), hipertensi, dan permasalahan sendi (Bray 2002). WHO (2014) mencatat 65% penduduk dunia berstatus overweight dan obesitas yang memiliki resiko kematian lebih tinggi daripada penderita kekurangan gizi. Faktor pola konsumsi pangan, seperti konsumsi berlebih makanan yang kaya lemak dan karbohidrat, menjadi penyebab obesitas selain kurangnya berolahraga (Bray 2002). Strategi penanganan obesitas melalui penghambatan pengubahan energi dari asupan pangan berlebih seperti inhibisi enzim pencernaan merupakan salah satu alternatif yang cukup menjanjikan (Yuliana et al. 2010), seperti inhibisi enzim lipase, α-amilase dan juga glukosidase. Komplikasi masalah obesitas dan berbagai penyakit degeratif perlu diimbangi dengan asupan bahan pangan kaya antioksidan (Winarno dan Kartawidjajaputra 2007).
Kedelai dilaporkan mengandung berbagai komponen bioaktif (protein, saponin, isoflavon) yang memiliki kemampuan fisiologis aktif dalam penanganan obesitas termasuk aktivitas inhibisi lipase, inhibisi α-amilase, dan antioksidan (Tsukamoto dan Yoshiki 2006; Maiti dan Majumdar 2012). Di Indonesia, 50% kedelai diolah menjadi tempe (Astawan 2009). Tempe dibuat melalui beberapa tahapan yang dapat dikelompokkan menjadi dua tahapan utama yaitu perlakuan pendahuluan untuk penyiapan kedelai dan fermentasi kapang (Astuti 1996). Perlakuan pendahuluan meliputi pengasaman atau perendaman, pengupasan kulit dan pemasakan. Nout dan Kiers (2005) menyatakan bahwa terdapat dua jenis fermentasi pada pembuatan tempe yaitu fermentasi kapang dan fermentasi bakteri (BAL) saat perendaman biji kedelai yang mengakibatkan pengasaman pada kedelai. Proses pengasaman merupakan salah satu proses penting dalam penyiapan kedelai sehingga menstimulus pertumbuhan kapang Rhizopus sp yang optimum.
Konsumsi tempe rata-rata per orang per tahun di Indonesia diduga sekitar 6.45 kg (Astawan 2009). Tempe disukai karena nilai gizi yang tinggi, flavor yang menyenangkan dan bermanfaat bagi kesehatan sehingga mulai banyak juga dikembangkan di luar negeri. Namun, tingginya permintaan tempe juga menimbulkan permasalahan lingkungan akibat pembuangan limbah air rendaman kedelai pada produksi tempe. Oleh karena itu guna mengatasi permasalahan lingkungan, mempercepat proses pengasaman dan mengatasi kegagalan dalam pengasaman tradisional yang terjadi secara spontan (fermentasi bakteri asam laktat) telah dilakukan beberapa pendekatan khususnya pada proses pengasaman atau perendaman kedelai menggunakan asidulan.
limbah air rendaman kedelai (Wijaya 2014). Air rendaman dengan asidulan GDL dapat digunakan kembali atau sistem back slopping, sehingga menghemat penggunaan air (Utama 2014). Inovasi ini diharapkan dapat memberikan proses pembuatan tempe yang lebih cepat dan ramah lingkungan.
Perbedaan proses pembuatan tempe, khususnya pada tahapan pengasaman, yaitu fermentasi spontan atau penambahan asidulan, diduga akan memberikan perbedaan kandungan gizi, komponen bioaktif dan kemampuan fisiologis aktifnya. Penelitian Seumahu et al. (2012) menunjukkan bahwa perbedaan metode produksi tempe memberikan peluang perbedaan mikroba yang ada dan berperan selama proses fermentasi tempe. Perbedaan mikroorganisme akan menentukan perbedaan aktivitas proteolitik, lipolitik dan glikolitik sehingga lebih lanjut akan memberikan perbedaan biokonversi asam lemak, asam amino, gula sederhana dan komponen lain (Caplice et al. 1999).
Penelitian terkait manfaat kedelai dan tempe telah banyak dilakukan, namun belum banyak yang membahas terkait aktivitas fisiologis kedelai dan tempe dalam penanganan obesitas melalui inhibisi lipase, inhibisi amilase dan juga sebagai sumber antioksidan. Proses pengolahan kedelai menjadi tempe dan juga metode pengasaman kedelai yang berbeda juga diduga akan berpengaruh pada kandungan gizi dan kemampuan fisiologis aktif. Oleh karena itu, tujuan dari penelitian ini adalah mengevaluasi kemampuan inhibisi lipase, inhibisi α-amilase serta aktivitas antioksidan pada tempe yang dibuat dengan pengasaman spontan dan pengasaman dengan penambahan asidulan.
Rumusan Masalah
Permasalahan obesitas yang semakin marak di dunia dan juga di Indonesia dapat ditangani salah satunya dengan inibisi enzim pencernaan, seperti lipase dan
3
Tujuan
Mengevaluasi aktivitas fisiologis aktif (antioksidan, inhibisi lipase dan α -amilase) tempe yang dibuat dengan pengasaman spontan dan pengasaman dengan penambahan asidulan.
Hipotesis
Kedelai dan tempe memiliki perbedaan kandungan komponen bioaktif (total protein terlarut, total fenol dan saponin) sehingga memiliki kemampuan fisiologis aktif kedelai dan tempe (aktivitas antioksidan, inhibisi lipase, dan inhibisi α -amilase) yang berbeda. Pengasaman spontan dan pengasaman dengan penambahan asidulan akan memberikan kemampuan fisiologis aktif yang berbeda pada tempe. Tempe pengasaman asidulan asam laktat dan tempe pengasaman asidulan GDL akan memiliki kemampuan fisiologis aktif yang berbeda.
Manfaat Penelitian
Memperkaya bukti mengenai manfaat tempe bagi kesehatan terutama potensinya sebagai pangan fungsional yang dapat digunakan dalam penanganan obesitas melalui inhibisi lipase dan α-amilase. Hasil penelitian juga akan memberikan alternatif proses produksi tempe, khususnya pilihan pada proses pengasaman dengan penambahan asidulan (asam laktat dan GDL) berdasarkan informasi perbedaan kemampuan fisiologis aktif dari tempe yang dihasilkan.
2
TINJAUAN PUSTAKA
AktivitasAntioksidan
Antioksidan dalam sistem biologis tubuh berperan dalam penanganan stres oksidatif sehingga dapat meningkatkan daya tahan tubuh dan mencegah komplikasi berbagai penyakit degeneratif. Klaim produk pangan fungsional salah satunya merupakan sumber antioksidan. Berbagai bahan pangan telah diteliti dan diketahui merupakan sumber antioksidan yang tinggi, termasuk kedelai dan tempe (Gyorgy et al. 1964; Hoppe et al. 1997; Hubert et al.2008; Astawan et al. 2013). Tempe yang diekstrak dengan air pada suhu 100°C selama 10 menit menunjukkan aktivitas antioksidan 12-32 mg ekstrak/ml (IC50 dengan pengujian DPPH) dan total fenol sejumlah 10-23 mg GAE/g ekstrak (Koh et al. 2012). Maiti dan Majumdar (2012) menyebutkan bahwa aktivitas antioksidan pada kedelai berhubungan dengan kemampuan inhibisi α-amilase.
asam amino bebas, peptida dan juga komponen fenolik. Sheih et al. (2000) menambahkan bahwa hanya sepertiga dari aktivitas antioksidan tempe yang berasal dari isoflavon, adapun sisanya berasal dari peptida hasil proteolisis protein kedelai karena fermentasi mikroba. Penelitian lainnya oleh Hoppe et al. (1997) menyatakan bahwa kemampuan antioksidan dari tempe juga disebabkan karena sinergisme komponen asam amino pada tempe yang dibebaskan selama fermentasi oleh R. oligosporus dengan keberadaan tokoferol.
Aktivitas Inhibisi Lipase
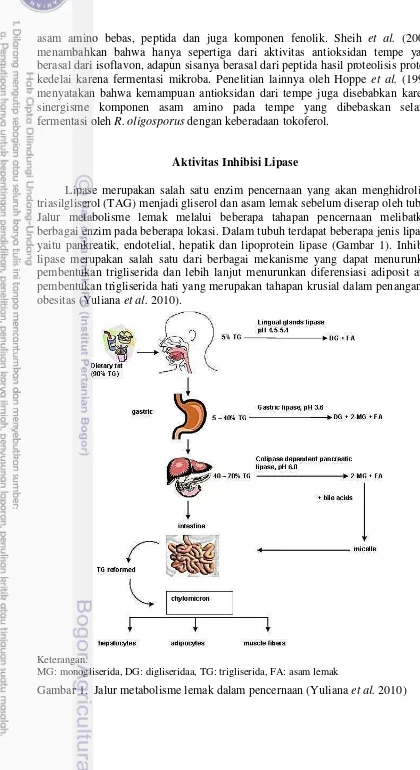
Lipase merupakan salah satu enzim pencernaan yang akan menghidrolisis triasilgliserol (TAG) menjadi gliserol dan asam lemak sebelum diserap oleh tubuh. Jalur metabolisme lemak melalui beberapa tahapan pencernaan melibatkan berbagai enzim pada beberapa lokasi. Dalam tubuh terdapat beberapa jenis lipase, yaitu pankreatik, endotelial, hepatik dan lipoprotein lipase (Gambar 1). Inhibisi lipase merupakan salah satu dari berbagai mekanisme yang dapat menurunkan pembentukan trigliserida dan lebih lanjut menurunkan diferensiasi adiposit atau pembentukan trigliserida hati yang merupakan tahapan krusial dalam penanganan obesitas (Yuliana et al. 2010).
Keterangan.
MG: monogliserida, DG: digliseridaa, TG: trigliserida, FA: asam lemak
5
Inhibisi enzim pankreatik lipase (EC 3.1.1.3) merupakan mekanisme yang utama dilakukan pada pengujian aktivitas antiobesitas (Lunagariya et al. 2014). Saat ini hanya Orlistat yang telah disetujui oleh FDA (Food and Drug Administration) Amerika Serikat, TPD (Therapeutic Products Directorate) di Kanada, dan EMEA (European Medicines Agency) sebagai antiobesitas melalui inhibisi pankreatik lipase dan pankreatik gastrointestinal. Penggunaan Orlistat sebagai obat antiobesitas memberikan efek samping yang kurang disukai. Orlistat memberikan efek samping berupa feses cair, inkonsisten, berminyak, flatulensi, defisiensi vitamin larut lemak, dan kram perut (Kaila dan Raman 2008). Oleh karena itu, penelitian terkait komponen alami dari tanaman yang memiliki aktivitas inhibisi lipase menjadi topik yang menarik karena umumnya memiliki efek samping yang lebih rendah/tidak ada dan lebih murah dibandingkan komponen sintetik (Grover et al. 2002).
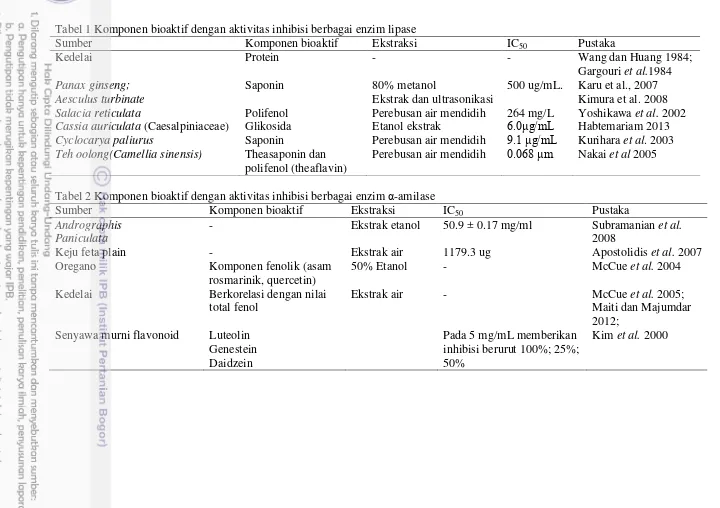
Penelitian terkait komponen bioaktif yang menghambat kerja enzim lipase (Tabel 1) telah banyak dipublikasikan. Komponen yang berperan dalam inhibisi enzim lipase dapat berupa saponin, polifenol dan juga protein.
Aktivitas Inhibisi α-Amilase
Enzim α-amilase (EC 3.2.1.1) merupakan salah satu enzim kunci dalam
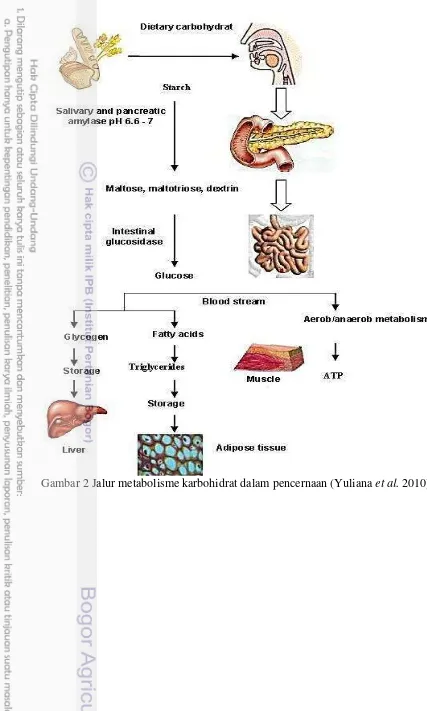
pencernaan dan penyerapan karbohidrat. Enzim α-amilase memecah pati menjadi oligosakarida atau disakarida (maltosa, maltotriosa, dekstrin) sebelum lebih lanjut dicerna oleh glukosidase dan diserap tubuh dalam bentuk glukosa (monosakarida). Jumlah konsumsi karbohidrat berlebih mendorong pembentukan adiposit lemak (Gambar 2). Oleh karena itu penghambatan metabolisme lemak melalui inhibisi amilase atau glukosidase dapat memberikan manfaat dalam penanganan obesitas (Yuliana et al. 2010).
Salah satu obat yang dikenal memperlambat pencernaan karbohidrat seperti menginhibisi enzim α-glukosidase dan α-amilase adalah acarbose (Inzucchi et al. 2012). Penggunaan acarbose memberikan efek samping yang kurang disukai sehingga mendorong penelitian terkait komponen alami inhibitor enzim karbohidrase. Efek samping penggunaan acarbose berupa gangguan pencernaan seperti kembung, perut tidak nyaman, diare dan flatulensi (Cheng dan Fantus 2005). de Sales et al. (2002) melaporkan bahwa terdapat sekitar 800 spesies tanaman yang memiliki kemampuan inhibisi enzim pencernaan karbohidrat. Beberapa komponen bioaktif dari tanaman yang seperti oregano (McCue et al. 2004), tanaman obat Ayurvedic India seperti biji Linum usitatisumum dan daun Morus alba (Sudha P et al. 2011) dan juga kedelai (McCue et al. 2005; Maiti dan Majumdar 2012) dapat menginhibisi enzim amilase.
Kelompok besar komponen bioaktif turunan tamanan seperti alkaloid, glikosida, galaktomanan gum, polisakarida, hipoglikan, peptidoglikan, guanidin, steroid, glikopeptida, dan terpenoid memiliki kemampuan antihiperglikemia (Mentreddy 2007). Penelitian terkait komponen bioaktif yang menginhibisi enzim
7
Tabel 1 Komponen bioaktif dengan aktivitas inhibisi berbagai enzim lipase
Sumber Komponen bioaktif Ekstraksi IC50 Pustaka
Kedelai Protein - - Wang dan Huang 1984;
Gargouri et al.1984 Panax ginseng;
Aesculus turbinate
Saponin 80% metanol
Ekstrak dan ultrasonikasi
500 ug/mL. Karu et al., 2007 Kimura et al. 2008
Salacia reticulata Polifenol Perebusan air mendidih 264 mg/L Yoshikawa et al. 2002
Cassia auriculata (Caesalpiniaceae) Glikosida Etanol ekstrak 6.0 g/mL Habtemariam 2013
Cyclocarya paliurus Saponin Perebusan air mendidih λ.1 g/mL Kurihara et al. 2003
Teh oolong(Camellia sinensis) Theasaponin dan polifenol (theaflavin)
Perebusan air mendidih 0.068 m Nakai et al 2005
Tabel 2 Komponen bioaktif dengan aktivitas inhibisi berbagai enzim α-amilase
Sumber Komponen bioaktif Ekstraksi IC50 Pustaka
Andrographis Paniculata
- Ekstrak etanol 50.9 ± 0.17 mg/ml Subramanian et al.
2008
Keju feta plain - Ekstrak air 1179.3 ug Apostolidis et al. 2007
Oregano Komponen fenolik (asam
rosmarinik, quercetin)
50% Etanol - McCue et al. 2004
Kedelai Berkorelasi dengan nilai
total fenol
Ekstrak air - McCue et al. 2005;
Maiti dan Majumdar 2012;
Senyawa murni flavonoid Luteolin
Genestein Daidzein
Pada 5 mg/mL memberikan inhibisi berurut 100%; 25%; 50%
Kim et al. 2000
Pengasaman Kedelai pada Produksi Tempe
Perendamam kedelai dalam pembuatan tempe merupakan tahapan penting karena memiliki beberapa fungsi yaitu: (1) membantu pengupasan kulit kedelai; (2) membantu penyerapan air yang dibutuhkan pada fermentasi kapang; (3) fermentasi BAL menginduksi proses pengasaman yang terjadi secara alami dan akan menurunkan pH kedelai menjadi 4.5-5.0; (4) penghambatan pertumbuhan mikroba lain yang mengganggu pertumbuhan kapang (Steinkraus 1983). Secara tradisional proses perendaman ini dilakukan selama 12-24 jam, sampai terjadi pertumbuhan bakteri asam laktat, yang ditandai dengan timbulnya busa dan air rendaman yang berbau asam. Sumber utama pertumbuhan mikrooganisme pada pengasaman kedelai adalah biji kedelai (Mulyowidarso 1989).
Asam laktat merupakan jenis asam yang dominan sebagai hasil proses fermentasi bakteri pada perendaman kedelai untuk membuat tempe. Nout dan Kiers (2005) menyebutkan bahwa setelah perendaman kedelai selama 24 jam pada suhu 30°C, asam organik yang ditemukan adalah asam laktat (2.1% w/v air rendaman), asam asetat (0.3% w/v air rendaman), dan asam sitrat (0.5% w/v air rendaman). de Reu et al. (1995b) menyebutkan bahwa perbedaan asam organik pada saat perendaman kedelai akan menyebabkan perbedaan pertumbuhan kapang Rhizopus sp.
Steinkraus (1983) mengemukakan bahwa di negara-negara subtropis pengasaman kedelai dalam pembuatan tempe dapat dilakukan dengan perendaman dalam larutan asam laktat 0.85% selama 2 jam pada suhu 25°C dan 30 menit pada suhu 100°C. Asam organik lain (selain asam laktat) yang juga dapat digunakan adalah asam asetat dan asam propionat (Nout dan Kiers 2005). De Reu et al. (1995) melaporkan bahwa di Belanda, setelah penghilangan kulit dan kotoran, proses hidrasi kedelai dilakukan dengan perebusan, pengukusan atau perendaman semalam dengan penambahan asam laktat 0-5% (b/v) atau asam asetat (<0-25% (b/v)) untuk mengontrol pertumbuhan bakteri pembusuk. Penggunaan asam laktat dalam pembuatan tempe juga telah dilakukan pada tempe kacang hijau. Sejumlah 60 g kacang hijau direndam dalam 500 mL air destila yang telah diasamkan dengan asam laktat dengan perbandingan 1:5 (v/v) selama 18 jam pada suhu 30°C (Starzynska-Janiszewska et al. 2014).
9
3
METODE
Waktu dan Tempat
Penelitian dilakukan dari bulan Juli 2014 – November 2015. Penyiapan sampel (kedelai dan tempe) dilakukan di Dramaga, IPB. Pengujian inhibisi lipase
dan α-amilase dilakukan di Laboratorium Biokimia Pangan Universitas Hokkaido Jepang. Adapun analisis lain dilakukan di Laboratorium Kimia Pangan, Laboratorium Biokimia Pangan, dan Laboratorium Analisis Pangan Institut Pertanian Bogor.
Bahan
Kedelai yang digunakan merupakan kedelai impor dari Amerika dengan merek dagang Tiga Roda yang dibeli dari KOPTI-Koperasi Pengrajin Tempe Indonesia, Bogor Indonesia. Tempe dibuat di Dramaga Bogor dengan air yang digunakan selama proses merupakan air PDAM Kabupaten Bogor. Kultur campuran atau laru tempe RAPRIMA digunakan sebagai inokulum juga diperoleh dari KOPTI Bogor. Bubuk GDL (diperoleh dari PT. Halim Sakti Pertama) dan larutan asam laktat (aq) (Kanto Chem. Co., Inc.) digunakan sebagai asidulan pada pengasaman kedelai.
Alat
Analisis pH pada kedelai dan air rendaman diukur dengan pH meter Orion Model 410A. Analisis isoflavon menggunakan kolom HPLC InertSustain C18 (Φ4.6x250 mm) dari GL Science Inc. (Tokyo, Japan). Pengukuran absorbansi dilakukan dengan microplate reader Synergy ™ MX (BioTek Instruments Inc., Winooski, United States) dan spektrofotometer Shimadzu 2450.
Tahapan Penelitian
Penelitian Tahap 1
Penelitian tahap 1 merupakan proses penyiapan kedelai, pembuatan tempe dan analisisnya. Penelitian dimulai dengan pembuatan kedelai rebus (S) dan tempe dengan tiga cara pengasaman dilanjutkan dengan analisis pH, analisis proksimat, serta analisis isoflavon tempe dan kedelai.
Penyiapan Kedelai dan Pembuatan Tempe
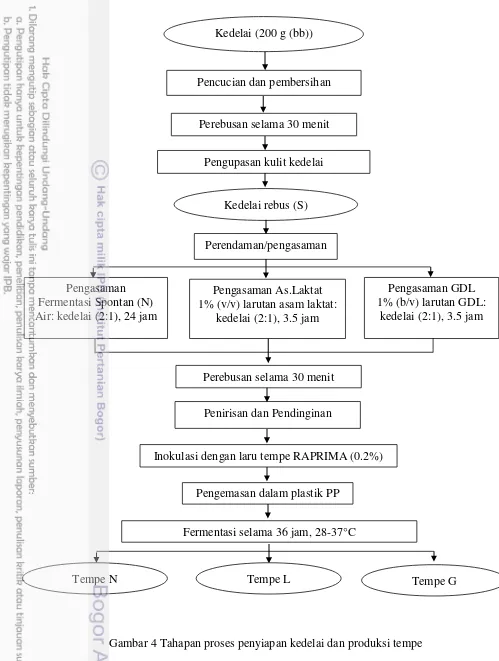
Kedelai dibersikan dan direbus selama 30 menit, kemudian dikupas kulit arinya secara manual dan kemudian dibagi menjadi empat bagian. Kedelai rebus ini atau sampel S kemudian dikukus selama 15 menit dan siapa dikeringkan. Tiga bagian lainnya diolah lebih lanjut menjadi tempe dengan berbagai proses pengasaman. Pengasaman spontan (fermentasi BAL) atau tempe N (natural fermentation) didasarkan pada metode Utama (2014) atau sesuai dengan prosedur pembuatan tempe tradisional di pengrajin tempe Lumajang. Pengasaman dengan penambahan asidulan asam laktat (selanjutnya disebut tempe L) berdasarkan formulasi pada Nout dan Kiers (2005), dan pengasaman dengan penambahan asidulan GDL (selanjutnya disebut tempe G) berdasarkan Wijaya et al. (2008). Diagram alir penyiapan kedelai dan pembuatan tempe ditunjukkan pada Gambar 4.
Analisis pH
Analisis pH dengan pH meter (pH meter Orion Model 410A) dari air rendaman kedelai dan kedelai dilakukan sebelum dan setelah perendaman. Analisis pH kedelai dilakukan dengan menghancurkan atau melumat kedelai dengan mortar dan disuspensikan dengan akuades 1:1 (w/w).
Pengeringan Sampel
Sampel (kedelai rebus dan tempe matang 36 jam fermentasi) disiapkan dalam keadaan kering untuk dianalisis. Tempe matang dikukus selama 15 menit (untuk menghentikan proses fermentasi), dipotong dengan ketebalan 2 mm, dan dikeringkan dengan pengering udara kabinet pada suhu 50°C selama 8 jam bersama dengan kedelai rebus yang juga telah dikukus 15 menit. Sampel kemudian dihaluskan dengan penghalus kering sampai menjadi bubuk dan disimpan pada suhu 4°C sampai digunakan pada tahapan penelitian selanjutnya.
Analisis Proksimat
11
Gambar 3 Tahapan kerja penelitian Kedelai
Perebusan dan Pengupasan Kulit
Kedelai Rebus (S)
Pengeringan dan Penepungan
Sampel (4 buah)
Analisis pH
Analisis Proksimat dan Isoflavon
Ekstraksi
Maserasi 50% Metanol Perebusan Air Mendidih
Ekstrak sampel (8 buah) Tempe Pengasaman
Fermentasi Spontan (N)
Tempe Pengasaman Asidulan Asam
Laktat (L)
Tempe Pengasaman Asidulan GDL (G) Pembuatan Tempe dengan Berbagai Pengasaman
Analisis Kemampuan Fisiologis Aktif dan Komponen Bioaktif Penelitian Tahap 2
Penelitian Tahap 1
Gambar 4 Tahapan proses penyiapan kedelai dan produksi tempe Kedelai (200 g (bb))
Pencucian dan pembersihan
Perebusan selama 30 menit
Pengupasan kulit kedelai
Perendaman/pengasaman
Tempe N Pengasaman Fermentasi Spontan (N) Air: kedelai (2:1), 24 jam
Pengasaman As.Laktat 1% (v/v) larutan asam laktat:
kedelai (2:1), 3.5 jam
Pengasaman GDL 1% (b/v) larutan GDL:
kedelai (2:1), 3.5 jam
Pengemasan dalam plastik PP Perebusan selama 30 menit
Penirisan dan Pendinginan
Inokulasi dengan laru tempe RAPRIMA (0.2%)
Fermentasi selama 36 jam, 28-37°C Kedelai rebus (S)
13
Analisis Kandungan Isoflavon
Kandungan total isoflavon bebas dianalisis dengan metode Wang et al. (1990). Sebanyak 1.5 gram tepung tempe hasil pengeringan ditimbang di dalam labu Erlenmeyer 50 ml, lalu ditambahkan sebanyak 6 ml HCl 1M dan 24 ml asetonitril. Sampel distirer selama 30 menit, kemudian didiamkan beberapa menit hingga mengendap. Sebanyak 1 ml supernatan diambil dan disaring dengan filter membran 0.45 mikron, dan sampel siap untuk dianalisis dengan HPLC. Standar yang digunakan adalah daidzein dan genistein, dengan kisaran konsentrasi yang digunakan yaitu 0.3125 hingga 10 ug/ml. Persamaan regresi linear untuk daidzein yaitu y = 30974x + 5354.3 dengan nilai R2 sebesar 0.9974, sedangkan persamaan regresi linear untuk genistein yaitu y = 41700x + 2963.4 dengan nilai R2 sebesar 0.9997. HPLC yang digunakan adalah Shimadzu LC-60 menggunakan UV Detector (UV-VIS Detector SPD-10 APV) β54 nm dengan kolom Zorbax Eclipse XDB-C18 Analytical (4.6 mm x 150 mm) dan laju aliran 1mL/menit dan running time 10 menit. Fase gerak yang digunakan adalah metanol : ammonium asetat 1mM (6:4). Bila larutan sampel terlalu pekat, dapat diencerkan dengan menambahkan fase geraknya.
Cara perhitungan : Kadar isoflavon bebas
Penelitian Tahap 2
Penelitian tahap kedua merupakan tahapan inti penelitian yang berupa pengujian kemampuan fisiologis aktif kedelai dan tempe. Sampel kedelai dan tempe diekstrak untuk mendapatkan komponen bioaktifnya dan diuji kemampuan fisiologis aktifnya secara in vitro. Ekstraksi dilakukan untuk mendapat berbagai komponen bioaktif dari kedelai dan tempe, mulai dari polifenol sampai dengan protein. Terdapat dua proses ekstraksi yang akan dilakukan pada penelitian ini yaitu (1) perendaman atau maserasi dalam larutan metanol 50% selama 2x24 jam dan (2) perebusan dalam air mendidih selama 20 menit. Pengujian aktivitas fisiologis ekstrak terdiri atas analisis aktivitas antioksidan, inhibisi enzim pankreatik lipase dan inhibisi pankreatik α-amilase. Analisis dilakukan pada delapan sampel (empat jenis olahan kedelai dan dua jenis ekstraksi). Analisis komponen bioaktif ekstrak terdiri atas analisis total fenol (metode Folin), total saponin (reaksi vanilin dan asam sulfat), total protein terlarut (metode Bradford) dan analisis isoflavon (HPLC).
Ekstraksi
Ekstrak kasar (maserasi dan perebusan) kemudian disaring vakum melewati kertas penyaring atau filter paper (Whatman No. 5C, 70 mm) dan dikeringkan menggunakan vacum rotary evaporator pada suhu 30°C. Residu pengeringan kemudian dilarutkan kembali ke dalam larutan pengekstrak (dibuat larutan stok yang pekat) sebelum dianalisis aktivitasnya.
Analisis Aktivitas Antioksidan dengan metode DPPH
Analisis aktivitas antioksidan pada ekstrak tempe dan kedelai dilakukan berdasarkan metode Puchalska et al. (2014) dengan modifikasi. Sebanyak 1 ml larutan ekstrak sampel dicampur dengan 1 ml DPPH 0.2 mM dalam metanol, campuran tersebut kemudian dikocok dan dibiarkan pada suhu ruang dalam kondisi gelap selama 30 menit. Adapun kontrol negatif adalah 1 mL larutan DPPH 0.2 mM ditambahkan 1 ml metanol. Kontrol positif yang digunakan adalah L-ascorbic acid. Absorbansi diukur pada panjang gelombang 517 nm. Pengujian dilakukan dalam tiga kali ulangan untuk setiap sampel pada tiga konsentrasi dan dilakukan penghitungan EC50. Aktivitas antioksidan dihitung dengan persamaan berikut.
(
)
Analisis Inhibisi Enzim Pankreatik Lipase
Analisis inhibisi enzim pankreatik lipase dilakukan berdasarkan modifikasi metode Kato et al. (2013). Larutan emulsi dibuat dari L-α-lesitin (Sigma–Aldrich; P4279, 5 mg), triolein (32 mg), dan sodium taurokolat (10 mg) dalam Tris buffer (Tris 10 mM, NaCl 149 mM, CaCl2 1.3 mM, pH 8.0, 9.0 mL) digunakan sebagai substrat. Enzim pankreatik lipase anak babi (Sigma, L3126, 4.5 mg) dilarutkan dalam larutan Tris buffer dan digunakan sebagai larutan enzim (dibuat segera setiap pengujian). Substrat (100 µL) dan sampel (50 µL, dilarutkan dalam DMSO 50%) diinkubasi dalam test-tube plastik 1.5 ml pada suhu 37°C selama 5 menit.
Reaksi dimulai dengan penambahan larutan enzim (50 µL) dan dilanjutkan dengan inkubasi selama 30 menit pada suhu 37°C. Reaksi kemudian dihentikan dengan penambahan Orlistat konsentrasi tinggi (0.5 µg/mL, 50 µL), kemudian asam lemak bebas (asam oleat) yang berhasil dihirolisis oleh lipase diekstrak menggunakan larutan heksan (600 µL). Larutan kemudian dikocok, dan lapisan heksan (300 µL) dikeringkan, dilarutkan dalam larutan 100% DMSO (100 µL), dan asam oleat yang berhasil dihidrolisis dikuantifikasi dengan tes kit NEFA C-test Wako (Wako Pure Chem. Ind. Ltd), dan diukur absorbansi larutan pada panjang gelombang 550 nm. Orlistat (IC50 = 0.22 µM) digunakan sebagai kontrol positif. Pengujian dilakukan dalam dua kali ulangan untuk setiap sampel pada berbagai konsentrasi dan dilakukan penghitungan IC50. Aktivitas enzim dihitung dengan persamaan berikut.
(
)
Analisis Inhibisi Enzim Pankreatik α-Amilase
15
diinkubasi dengan 150 µL larutan enzim α-amilase (0.5 unit/mL dilarutkan dalam 20 mM larutan buffer sodium fosfat, pH 6.9, dan mengandung 6.7 mM NaCl) dalam test tube plastik 1.5 ml, selama 15 menit pada suhu 37°C. Setelah pre-inkubasi, ke dalam larutan campuran tersebut kemudian ditambahkan dengan 250 µL dari larutan 1% pati dan diinkubasi pada suhu 37°C selama 15 menit. Reaksi kemudian dihentikan dengan perebusan di dalam air mendidih selama 1 menit. Filtrasi melewati cosmosil (7SC18-OPN, Nacalai tesque 37842-11) dengan kolom
(Φ0.5 x β cm) dilakukan, kemudian 100 µL dari filtrat kemudian ditambah dengan 2 mL pereaksi asam dinitrosalisilat (DNS) dan dipanaskan dalam air mendidih selama 15 menit. Absorbansi kemudian diukur pada panjang gelombang 540 nm. Acarbose (IC50 = 5 µM) digunakan sebagai kontrol positif. Pengujian dilakukan dalam dua kali ulangan untuk setiap sampel pada berbagai konsentrasi dan dilakukan penghitungan IC50. Aktivitas enzim dihitung dengan persamaan berikut.
(
)
Analisis Total Saponin
Kandungan total saponin dianalisis dengan modifikasi metode Xi et al. (2008). Sejumlah 100 uL sampel dicampur dengan vanilin (8% b/v, 0.25 mL) dan asam sulfat (72% b/v, 2.5 mL). Campuran kemudian diinkubasi pada suhu 60°C selama 10 menit, didinginkan dengan air mengalir selama 10 menit dan dibaca absorbansinya pada panjang gelombang 538 nm. Saponin murni (Art. 7695, Merck) digunakan sebagai standar dan kandungan total saponin dinyatakan sebagai ekuivalen saponin (g/g tempe (bk)).
Analisis Total Fenol
Kandungan total fenol dianalisis dengan modifikasi metode Koh et al. (2012). Sejumlah 0.5 mL sampel dicampur dengan 2.5 ml larutan Folin (1:10 dalam akuades) dan didiamkan selama 5 menit. Sejumlah 4 mL larutan Na2CO3 7.5% (b/v) kemudian ditambahkan, divorteks, dan dibiarkan pada suhu ruang dalam kondisi gelap selama 1 jam dan dibaca absorbansinya panjang gelombang 765 nm. Adapun kontrol negatif adalah 0.5 mL akuades. Asam galat digunakan sebagai standar dan kandungan total fenol dinyatakan sebagai ekuivalen asam galat (mg GAE/g tempe (bk)).
Analisis Kandungan Isoflavon
Kandungan total isoflavon bebas dianalisis dengan metode Wang et al. (1990). Sejumlah 1 ml ekstrak metanol 50% dan air disaring dengan filter membran 0.45 mikron, dan sampel siap untuk dianalisis dengan HPLC. Standar yang digunakan adalah daidzein dan genistein. Instrumen HPLC yang digunakan adalah Shimadzu LC-60 menggunakan UV Detector (UV-VIS Detector SPD-10
Cara perhitungan : Kadar isoflavon bebas
Rancangan Penelitian
Rancangan Acak Lengkap dengan variabel perlakuan sampel digunakan pada penelitian tahap satu. Terdapat empat jenis sampel yaitu kedelai rebus tanpa proses pengasaman dan fermentasi (S), tempe dengan pengasaman spontan (N), tempe dengan penambahan asidulan asam laktat (L), dan tempe dengan penambahan asidulan GDL (G).
Penelitian tahap dua merupakan analisis kemampuan bioaktif ekstrak dan dilakukan dengan Rancangan Acak Lengkap Faktorial dua faktor. Faktor pertama adalah jenis sampel terdiri dari 4 taraf yaitu kedelai rebus (S), tempe dengan pengasaman spontan (N), tempe dengan penambahan asidulan asam laktat (L), dan tempe dengan penambahan asidulan GDL (G). Faktor kedua adalah jenis perlakuan ekstraksi dengan 2 taraf yaitu maserasi dalam larutan MeOH 50% dan perebusan dalam air mendidih.
Analisis Data
Rancangan Acak Lengkap digunakan pada analisis pH, proksimat dan isoflavon dari kedelai dan tempe. Data yang didapat kemudian dianalisis menggunakan analisis ragam (ANOVA) dan dilanjutkan dengan uji lanjut Tukey jika terdapat perbedaan yang signifikan pada taraf kepercayaan 95% antarperlakuan sampel.
Nilai IC50 pada inhibisi lipase dan α-amilase diestimasi berdasarkan kurva dose-response metode log(inhibitor) vs. normalized response-Variable slope sedangkan metode log(agonist) vs. normalized response-Variable slope digunakan untuk menentukan EC50 aktivitas antioksidan menggunakan software GraphPad Prism 6 Demo.
Data hasil analisis komponen bioaktif ekstrak (total fenol, total saponin dan total protein terlarut) dan kemampuan fisiologis aktif ekstrak (EC50 aktivitas antioksidan serta IC50 inhibisi lipase dan α-amilase) yang didapat kemudian dianalisis menggunakan analisis ragam (ANOVA) dan dilanjutkan dengan uji lanjut Tukey jika terdapat perbedaan yang signifikan pada taraf kepercayaan 95% antarperlakuan pada kedua faktor (ekstrak dan sampel).
17
4
HASIL DAN PEMBAHASAN
Nilai pH Pengasaman Kedelai
Kedelai dilaporkan mengandung berbagai komponen bioaktif yang memiliki kemampuan fisiologis aktif seperti antikanker, pencegahan osteoporosis, dan menurunkan resiko PJK (Isanga dan Zhang 2008). Tempe merupakan olahan kedelai yang sangat popular di Indonesia. Proses pembuatan tempe dimulai dengan tahapan penyiapan kedelai yang terdiri atas pembersihan, pengupasan kulit ari dan pengasaman. Penelitian ini menunjukkan bahwa berbagai perlakuan pengasaman mampu memberikan hasil kondisi asam pada kedelai yang dibutuhkan untuk pertumbuhan Rhizopus sp (Tabel 3).
Tabel 3 Nilai pH dari kedelai dan air perendam
Jenis kolom yang sama menunjukkan perbedaan nyata (p<0.05) menggunakan analisis Tukey.
Penurunan pH kedelai dari 6.8 menjadi asam (4.5-5.0) diperlukan untuk menyediakan kondisi pertumbuhan yang sesuai untuk kapang tempe, menyeleksi mikroba yang tumbuh, dan menghambat pertumbuhan bakteri patogen (Nout dan Kiers 2005). Nahas (1988) menunjukkan pada medium ekstrak kedelai dengan nilai pH 4-7 yang ditumbuhkan kapang tempe didapatkan pertumbuhan kapang Rhizopus oligosporus optimum pada pH 5.5. Nout dan Kiers (2005) juga menunjukkan bahwa pada kedelai yang tidak diasamkan akan tumbuh mikroba kontaminan yang bersifat patogen seperti Staphylococcus sp dan Bacillus sp. Oleh karena itu, kondisi asam pada kedelai harus didapatkan sebelum tahap fermentasi kapang.
sangat dipengaruhi oleh lingkungan, namun semua hasil penelitian menunjukkan bahwa asam laktat merupakan asam dominan.
Kondisi pengasaman spontan di daerah tropis dengan suhu rata-rata 30°C selain memberikan peluang pertumbuhan mikroba yang melimpah dan sesuai (khususnya BAL) juga memberi peluang pertumbuhan bakteri patogen. Perendaman dalam waktu lama (24 jam) dan kondisi lingkungan yang sesuai memungkinkan tumbuhnya mikroorganisme lain secara spontan seperti Enterobactericea, khamir, dan juga mikroba kontaminan seperti Klebsiella pneumonia, dan lain-lain (Nout dan Kiers 2005). Lebih lanjut, Mulyowidarso et al. (1998) mendapatkan bahwa pada perendaman kedelai pada suhu 37°C dan 30°C selama 24 jam selain menunjukkan pertumbukan BAL, juga menunjukkan pertumbuhan Enterobactericeae yang akan turun jumlahnya setelah 12 jam
perendaman. Bahkan, perendaman suhu 20°C (daerah subtropis),
Enterobactericeae akan terus tumbuh sampai 36 jam perendaman. Oleh karena itu, pengasaman dengan penambahan asidulan juga perlu dipertimbangkan sebagai alternatif pada pembuatan tempe, khususnya pada daerah subtropis ataupun daerah dingin di Indonesia.
Asidulan seperti asam laktat dan GDL dilarutkan dalam air sebelum perendaman dengan kedelai, sehingga pH air perendam menjadi sangat asam. Proses difusi asam (proton H+) akan terjadi selama perendaman ke dalam kotiledon kedelai, dan juga dibantu dalam proses pemasakan/perebusan. Walaupun terdapat perbedaan signifikan pada kedelai dengan pengasaman asidulan asam laktat (p<0.05) (Tabel 3), namun semua jenis pengasaman menghasilkan tempe dengan penampakan visual yang baik (Gambar 5).
(a) (b)
(c) (d)
19
Gambar 5 menunjukkan bahwa ketiga jenis pengasaman kedelai menghasilkan tempe dengan pertumbuhan miselium yang penuh, mengikat semua kedelai dan menutupi permukaan kedelai. Pengamatan fisik ini menunjukkan bahwa tempe yang dihasilkan normal dan sesuai deskripsi tempe kedelai (BSN 2009, CAC 2013).
Pada penelitian ini hanya dilakukan pengukuran pH sebelum proses fermentasi kapang, akan tetapi tidak dilakukan pengukuran pH tempe. Proses fermentasi tempe akan menaikkan pH kedelai dari asam menjadi netral (Nout dan Kiers 2005). Hal ini terjadi akibat pemecahan protein menjadi asam amino bebas dan bahkan juga lebih lanjut membentuk senyawa amonia sehingga pH menjadi naik. Peneliti menyarankan untuk melakukan pengukuran pH tempe pada penelitian berikutnya agar diketahui apakah perbedaan asidulan yang menunjukkan perbedaan keasaman kedelai awal (Tabel 3) juga akan berdampak pada pH akhir tempe. Informasi ini juga diperlukan dalam keterkaitan karakteristik tempe (pH) dan kualitas tempe. Pengujian karakteristik tempe lainnya selain pH dapat meliputi warna, kekerasan, dan organoleptik (rasa dan aroma).
Kandungan Zat Gizi Kedelai dan Tempe
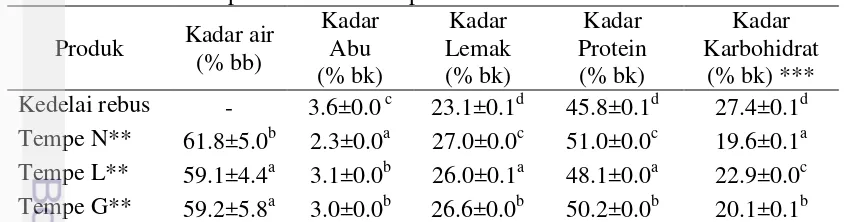
Hasil analisis komponen gizi atau proksimat dari kedelai dan tempe dapat dilihat pada Tabel 4. Proses pengolahan kedelai menjadi tempe memberikan perbedaan komposisi zat gizi tempe dibanding kedelai. Berbagai proses pengasaman juga memberikan hasil komposisi zat gizi yang berbeda.
Perlakuan pengasaman berpengaruh nyata terhadap kadar air tempe (p<0.05). Tempe dengan kedelai pengasaman spontan memiliki kadar air tertinggi dibandingkan dua tempe pengasaman dengan asidulan. Hal ini terjadi akibat proses perendaman yang lama (24 jam) memberikan penetrasi air ke dalam biji kedelai lebih banyak dibandingkan pada pengasaman dengan asidulan (3.5 jam). Astawan et al. (2013) menyebutkan bahwa proses perendaman berpengaruh terhadap penetrasi air ke dalam matriks biji, berpengaruh terhadap pengembangan biji dan kadar air tempe.
Tabel 4 Hasil analisis proksimat dari tempe dan kedelai rebus*
Produk Kadar air
*Data yang disajikan dalam bentuk rata-rata±standar deviasi. Angka dengan huruf yang berbeda dalam kolom yang sama menunjukkan perbedaan nyata (p<0.05) menggunakan analisis Tukey **Tempe N: tempe dengan kedelai pengasaman spontan, Tempe L: tempe dengan kedelai pengasaman dengan asidulan asam laktat, Tempe G: tempe dengan kedelai pengasaman dengan asidulan GDL.
Kedua jenis tempe dengan pengasaman asidulan tidak menunjukkan perbedaan nyata pada kadar air (p>0.05). Hal ini karena waktu perendaman yang sama pada kedua pengasaman asidulan, yaitu 3.5 jam. Waktu perendaman yang relatif singkat menyebabkan penetrasi air yang kurang sehingga kadar airnya relatif rendah dibandingkan tempe pengasaman fermentasi spontan. Walaupun demikian, kadar air ketiga jenis tempe ini masih dalam rentan standar, yaitu dibawah 65% (BSN 2009, CAC 2013).
Dibandingkan semua jenis tempe, tempe dengan kedelai pengasaman spontan memiliki kandungan mineral atau kadar abu paling rendah (2.4 % bk) dan berbeda nyata (p<0.05). Semakin lama waktu perendaman maka komponen mineral yang terlarut air rendaman lebih tinggi pada tempe pengasaman fermentasi spontan. Selain faktor lama perendaman, adanya faktor pencucian pada kedelai pada pengasaman alami sebelum perebusan kedua juga menjadi faktor hilangnya komponen mineral. Fennema (1996) menyebutkan bahwa kandungan mineral dalam bahan pangan tidak dapat rusak oleh panas, cahaya, agen pengoksidasi dan pH yang ekstrim. Namun hilangnya mineral lebih disebabkan oleh pencucian atau pemisahan fisik.
Kadar abu menunjukkan kandungan komponen anorganik, seperti mineral yang terdapat pada kedelai dan tempe. Proses pengolahan kedelai menjadi tempe menurunkan kadar abu dari 3.6% (bk) menjadi 2.3-3.1% (bk). Pernurunan kadar abu in terjadi akibat pelarutan komponen anorganik selama pencucian, perebusan dan juga proses fermentasi. Tempe N memiliki kadar abu terendah dibandingkan kedua tempe lainnya, proses pencucian berulang setelah perendaman memungkinkan kehilangan komponen (termasuk mineral) lebih tinggi dibandingkan tempe dengan pengasaman asidulan yang tidak mengalami pencucian setelah perendaman. Pada tempe L dan G, tidak terdapat perbedaan yang signifikan pada kadar abu (p>0.05). Proses perebusan kedua menggunakan air rendaman (tidak ada pencucian) meminimalisir kehilangan mineral selama pencucian sehingga kadar abunya tinggi. Adapun jika dibandingkan dengan standar tempe (BSN 2009), kadar abu ketiga tempe sudah sesuai yaitu maksimal 4.28% (bk). Astawan et al. (2013) mendapatkan kadar abu tempe dari berbagai jenis kedelai yaitu 2.14-2.72% (bk).
21
(pengukuran total N dengan metode Kjeldhal disebabkan oleh total N yang terukur pada tempe tidak hanya berasal dari kedelai, namun juga matriks mikroorganisme yang tumbuh di tempe, seperti miselium kapang, bakteri dan juga khamir.
Tempe pengasaman spontan memiliki kadar protein lebih tinggi dibandingkan tempe dengan pengasaman asidulan (Tabel 4). Peneliti menduga terjadi perbedaan pertumbuhan dan jumlah mikrooganisme dari ketiga jenis tempe, yaitu tempe N memiliki pertumbuhan mikroorganisme tertinggi diikuti tempe G dan tempe L. Seumahu et al. (2012) menunjukkan bahwa perbedaan metode produksi tempe memberikan peluang perbedaan mikroba yang ada dan berperan selama proses fermentasi tempe. Proses fermentasi spontan (tempe N) memberikan peluang pertumbuhan dan jumlah mikrooganisme yang lebih tinggi sehingga kadar protein totalnya meningkat.
Fenomena serupa juga didapatkan pada hasil kadar lemak. Ketiga jenis tempe memiliki kadar lemak (26-27 % bk) lebih tinggi dibandingkan kedelai (Tabel 4). Fenomena peningkatan kadar lemak pada tempe juga dapat dijelaskan seperti peningkatan kadar protein tempe, yaitu karena adanya penurunan prosentase pada komponen lainnya dan juga akibat adanya komponen mikroorganisme pada tempe yang terukur lemaknya. Namun, ketiga nilai kadar lemak tempe berada di bawah standar tempe (BSN 2009) yaitu minimal 28.57% (bk). Adapun jika dibandingkan dengan standar tempe regional CODEX, kadar lemak pada ketiga jenis tempe sudah termasuk standar yaitu minimal 7% (bb) atau 20% (bk) (CAC 2013). Peneliti lain juga mendapatkan nilai kadar lemak yang serupa dengan penelitian ini yaitu 21.73% (Haron dan Raob 2014) dan 22.13% (Bavia et al. 2012).
Kandungan Isoflavon Genistein dan Daidzein pada Kedelai dan Tempe
Gambar 6 Kandungan daidzein dan genistein pada tempe N, tempe L, tempe G dan kedelai (mg/100 g (bk)). Angka dengan huruf berbeda menunjukkan perbedaan nyata (p<0.05) menggunakan uji Tukey antarsampel pada tiap jenis isoflavon.
Penelitian ini mendapatkan kadar daidzein tempe 42.8-50.2 mg/100 g tempe (bk) dan genistein 41.9-45.5 mg/100 g tempe, dan serupa dengan beberapa penelitian sebelumnya. Haron et al. (2009) memperoleh hasil total isoflavon aglikon 54 mg/100 g tempe (bk) dengan jumlah daidzein dan genistein yang hampir sama yaitu 26±6 mg dan 28±11 mg. Efriwati dan Nuraida (2013) mendapatkan kandungan genistein tempe ialah 9.4-10.0 mg/100 g tempe (bk) dan daidzein 93.4-101.2 mg/100 g tempe (bk).
Tempe dengan pengasamani spontan dan penggunaan asidulan menunjukkan perbedaan yang signifikan pada kadar isoflavon tempe (Gambar 6). Tempe G memiliki kadar daidzein dan genistein lebih tinggi daripada tempe L (p<0.05). Peneliti menduga terdapat perbedaan aktivitas biokonversi isoflavon terikat menjadi isoflavon bebas pada tempe N, tempe L dan tempe G dengan aktivitas tertinggi terdapat pada tempe G sehingga tempe G memiliki kadar isoflavon tertinggi. Pengamatan visual selama fermentasi tempe, didapatkan tempe G menunjukkan suhu yang lebih panas dibandingkan tempe N dan L serta hal ini diduga sebagai indikasi aktivitas mikroorganisme yang lebih tinggi. Kusuma (2015) melaporkan bahwa tempe pengasaman GDL menunjukkan proses fermentasi lebih cepat dibandingkan tempe pengasaman spontan.
Kandungan Komponen Bioaktif Ekstrak
Proses ekstraksi sampel dilakukan untuk mengevaluasi perbedaan kemampuan fisiologis aktif dari tempe pada inhibisi lipase, inhibisi α-amilase dan aktivitas antioksidan. Dua jenis metode ekstraksi digunakan untuk memastikan ekstraksi dan beberapa komponen pada produk kedelai mulai dari polifenol sampai protein. Kedelai rebus juga diekstrak sebagai control produk tanpa proses fermentasi.
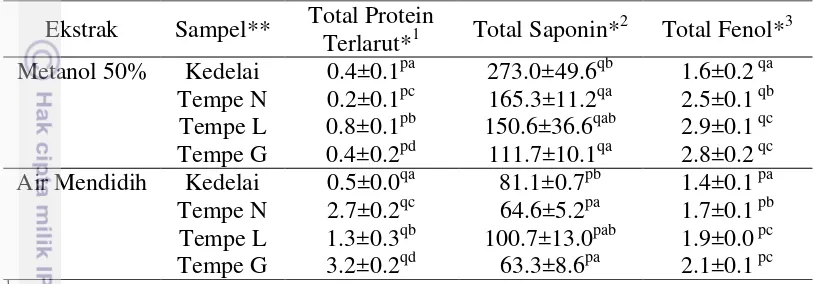
Perlakuan esktraksi dan jenis sampel mempengaruhi total protein terlarut yang terekstrak. Ekstrak air mendidih menunjukkan total protein terlarut lebih tinggi dibandingkan ekstrak metanol 50% (Tabel 5). Hal ini diduga karena komponen protein yang ada pada kedelai dan tempe menunjukkan polaritas yang
16.4a
Kedelai rebus Tempe N Tempe L Tempe G
23
tinggi sehingga larut pada pelarut yang sangat polar seperti air. Selain itu, proses pemanasan selama ekstraksi air juga diduga membantu pelarutan komponen protein kecil/peptida ke dalam air. Penelitian sebelumnya juga banyak menggunakan air untuk mengekstrak peptida dari kedelai dan produk olahannya (Gibbs et al. 2004; Kwon et al. 2011). Adapun komponen peptida yang larut air ini merupakan jenis peptida netral dan basa (Gibbs et al. 2004; Handoyo dan Morita 2006).
Tabel 5 Kandungan komponen bioaktif dari ekstrak kedelai dan tempe
Ekstrak Sampel** Total Protein
Terlarut*1 Total Saponin* 2
Total Fenol*3
Metanol 50% Kedelai 0.4±0.1pa 273.0±49.6qb 1.6±0.2 qa
Tempe N 0.2±0.1pc 165.3±11.2qa 2.5±0.1 qb
Tempe L 0.8±0.1pb 150.6±36.6qab 2.9±0.1 qc
Tempe G 0.4±0.2pd 111.7±10.1qa 2.8±0.2 qc
Air Mendidih Kedelai 0.5±0.0qa 81.1±0.7pb 1.4±0.1 pa
Tempe N 2.7±0.2qc 64.6±5.2pa 1.7±0.1 pb
Tempe L 1.3±0.3qb 100.7±13.0pab 1.9±0.0 pc
Tempe G 3.2±0.2qd 63.3±8.6pa 2.1±0.1 pc
1
Data dalam satuan mg BSA/g sampel (bk)
2
Data dalam satuan mg saponin /g sampel (bk)
3
Data dalam satuan mg GAE/g sampel (bk)
*Data yang disajikan dalam bentuk rata-rata±standar deviasi. Perbedaan huruf (p-q: ekstrak, a-d: sampel) pada kolom yang sama menunjukkan perbedaan yang nyata (p<0.05) menggunakan analisis Tukey
**Tempe N: tempe dengan kedelai pengasaman spontan, Tempe L: tempe dengan kedelai pengasaman dengan asidulan asam laktat, Tempe G: tempe dengan kedelai pengasaman dengan asidulan GDL.
Total protein terlarut pada tempe lebih tinggi daripada kedelai (Tabel 5) dan berbeda nyata antartempe. Hal ini karena adanya reaksi enzimatis (proteolisis) dari kapang Rhizopus sp yang memecah protein kedelai, khususnya -conglycinin menjadi protein larut air (de Reu et al. 1995a). Tempe L memiliki kadar protein terlarut terendah dan kemudian meningkat pada tempe N dan G (tertinggi) seperti ditunjukkan pada Tabel 5. Hal ini menunjukkan bahwa reaksi proteolitik terjadi lebih cepat pada tempe G dibandingkan tempe lainnya, sehingga dihasilkan komponen protein terlarut (protein berukuran kecil) lebih banyak pada waktu fermentasi yang sama. Kondisi proteolitik kapang ini dipengaruhi oleh lingkungan tumbuh, salah satunya kadar asam. de Reu et al. (1995b) mendapatkan penurunan kadar asam laktat 1.7% (b/v) pada pengasaman dengan kultur homofermentatif BAL mengakibatkan waktu lag Rhizopus oligosporus lebih pendek dibandingkan pada pengasaman yang dipercepat dengan air rendaman sebelumnya dengan kadar asam laktat 2.1% (b/v).
berbeda dan hasil reaksi proteolitik juga berbeda. Kusuma (2015) melaporkan bahwa tempe pengasaman GDL menunjukkan proses fermentasi lebih cepat dibandingkan tempe pengasaman spontan. Adapun tempe L diduga memiliki pertumbuhan kapang lebih lambat dibandingkan tempe N dan G sehingga pemecahan proteinnya lebih terlambat pada waktu yang sama sehingga total protein terlarutnya sedikit. Ekstrak tempe L mengandung komponen protein terlarut berukuran besar (hidrofobik) lebih banyak dibandingkan tempe N dan G, ditunjukkan pada ekstrak metanol 50% (Tabel 5).
Faktor jenis kapang yang tumbuh juga berpengaruh dalam total protein terlarut tempe. Walaupun seluruh sampel tempe menggunakan inokulum yang sama, namun diduga masih terdapat perbedaan jenis dan atau jumlah mikroba yang tumbuh akibat perbedaan proses pengolahan. Baumann dan Bisping (1995) melaporkan terdapat 36 strain dari genus Rhizopus yang berhasil diisolasi dari tempe Indonesia dengan kemampuan proteolitik yang berbeda. Strain dengan kemampuan proteolitik tinggi memberikan kemampuan membebaskan asam amino lima kali lebih tinggi daripada strain standar.
Perbedaan jenis ekstrak dan sampel mempengaruhi signifikan kadar total saponin ekstrak (Tabel 5). Ekstraksi dengan metanol 50% menunjukkan kadar total saponin lebih tinggi dibandingkan dengan air mendidih. Komponen saponin merupakan komponen yang mudah larut dalam pelarut organik, seperti metanol. Perbedaan sampel juga menunjukkan perbedaan yang signifikan pada total saponin ekstrak, kedelai rebus memiliki total saponin tertinggi dibandingkan tempe N, L dan G (Tabel 5). Adapun perlakuan pengasaman antartempe tidak menunjukkan perbedaan total saponin yang signifikan. Penurunan nilai total saponin pada ekstrak tempe dibandingkan kedelai terjadi karena tahapan proses produksi tempe yang melibatkan pemanasan, fermentasi dan dan kontak air yang lebih tinggi (pencucian, perebusan) dibandingkan kedelai sehingga saponin akan larut/hilang selama proses pengolahan kedelai (Lai et al. 2013).
Perbedaan jenis ekstrak dan sampel berpengaruh nyata pada kadar total fenol ekstrak (Tabel 5). Ekstrak metanol 50% menunjukkan total fenol yang lebih tinggi dibandingkan ekstrak air. Hal ini sejalan dengan Hsu et al. (2010) yang menyatakan bahwa komponen fenolik (isoflavon) lebih mudah terekstrak menggunakan pelarut seperti metanol dan asetonitril, sedangkan komponen protein/peptida terlarut pada pelarut yang lebih polar seperti air.
Komponen fenolik tempe lebih tinggi daripada kedelai (Tabel 5), khususnya pada kedua tempe dengan pengasaman asidulan (tempe L dan G) menunjukkan kadar total fenol lebih tinggi dibandingkan tempe N. Mikroba pada fermentasi tempe menghasilkan berbagai enzim, seperti -glukosidase yang akan melepaskan gugus gula dari isoflavon glikosida dan meningkatkan bioavaibilitas (Yoe dan Ewe 2014). Proses fermentasi mampu meningkatkan jumlah isoflavon aglikon tempe dibandingkan kedelai (Hutabarat et al. 2001). Dey dan Kuhad (2014) menunjukkan 2-8 kali peningkatan total fenol dari serealia yang difermentasi Rhizopus sp. Selain itu, proses pemanasan dan kombinasi asam yang terjadi selama perebusan kedua pada tempe G dan L juga diduga berperan dalam pelepasan komponen fenolik dari kedelai.