EFEK KONSUMSI CAMPURAN KARAGENAN DAN FOS
TERHADAP PROLIFERASI LIMFOSIT DAN JUMLAH BAKTERI
ASAM LAKTAT USUS TIKUS
NIKEN SULASTRI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TUGAS AKHIR DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tugas akhir Efek Konsumsi Campuran Karagenan dan FOS Terhadap Proliferasi Limfosit dan Jumlah Bakteri Asam Laktat Usus Tikus adalah karya saya sendiri di bawah bimbingan Prof. Dr. Ir. Fransiska R. Zakaria, M.Sc., dan Dr. Ir. Harsi D. Kusumaningrum, dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tugas akhir ini.
ABSTRACT
NIKEN SULASTRI. Effect of Consumption of Carragennan and FOS Mixtured on Lymphocyte Proliferation and Growth of Lactic Acid Bacteria in the Colon of Rats. Under supervising of FRANSISKA ZAKARIA RUNGKAT and HARSI D. KUSUMANINGRUM
Fructo -oligosaccharides (FOS) and carragennan are indigestable carbohydrates preferentially fermented by lactic acid bacteria (bifidobacteria and lactobacilli) and selectively stimulates their growth. Bifidobacteria and lactobacilli are able to stimulate both nonspesific and spesific immune responses and by so have a potential to improve host health.
The aim of this research is to study the effect of supplementation of a mixture of carragennan and FOS to stimulate growth of lactic acid bacteria and thereby allow immune modulation.
Ten Sprague Dawley rats were randomly divided into two groups; the first group (A), served as the control group were feed the unsupplemented pelet for 21 days. The second group (B) were feed the same unsupplemented pelet for 7 days and got supplemented pelet with FOS 4.08% and carragennan 0.92%, for another 14 days. At the end of the feeding, rats were sacrificed and the spleen were removed asceptically and cultivated for lymphocyte cell isolation. After that, digesta in colon were removed and used for lactic acid bacteria enumeration
EFEK KONSUMSI CAMPURAN KARAGENAN DAN FOS
TERHADAP PROLIFERASI LIMFOSIT DAN JUMLAH BAKTERI
ASAM LAKTAT USUS TIKUS
NIKEN SULASTRI
Tugas Akhir
Sebagai salah satu syarat untuk memperoleh gelar Magister Profesi Teknologi Pangan pada Departemen Ilmu dan Teknologi Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tugas Akhir : Efek Konsumsi Campuran Karagenan dan FOS Terhadap Proliferas i Limfosit dan Jumlah Bakteri Asam Laktat Usus Tikus
Nama Mahasiswa : Niken Sulastri
NIM : F 242040105
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Fransiska R. Zakaria, M.Sc Dr. Ir. Harsi D. Kusumaningrum Ketua Anggota
Diketahui,
Ketua Program Studi Magister Dekan Sekolah Pascasarjana Profesi Teknologi Pangan
Dr. Ir. Lilis Nuraida, M.Sc. Dr. Ir. Khairil Anwar Notodiputro, MS
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan atas segala karunia-Nya sehingga karya ilmiah ini berhasilkan diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan 5 – 29 Oktober 2005 ini adalah pangan fungsional, dengan judul Efek Konsumsi Campuran Karagenan dan FOS Terhadap Proliferasi Limfosit dan Jumlah Bakteri Asam Laktat Usus Tikus.
Terima kasih penulis ucapkan kepada Ibu Prof. Dr. Ir. Fransiska Z. Rungkat, M.Sc. dan Ibu Dr. Ir. Harsi D. Kusumaningrum selaku pembimbing, yang telah banyak memberi saran. Pimpinan PT Inmarindotama dan rekan -rekan kerja, yang telah memberikan dukungan dan bantuan selama masa studi program magister profesi ini. Di samping itu, penghargaan penulis sampaikan kepada staf Laboratorium Mikrobiologi SEAFAST, staf Laboratorium Biokimia Pangan Fateta-IPB, staf Laboratorium Terpadu FKH-IPB dan staf Administrasi Program Magister Profesi Teknologi Pangan, yang telah membantu kelancaran penelitian dan pengumpulan data. Ungkapan terima kasih juga disampaikan kepada keluarga serta seluruh teman, atas segala doa dan kasih sayangnya.
Semoga karya ilmia h ini bermanfaat.
Bogor, April 2006
RIWAYAT HIDUP
Penulis dilahirkan di Surakarta pada tanggal 5 Maret 1970 sebagai anak bungsu dari pasangan Bambang Susanto (Alm) dan Sri Hartati.
Tahun 1989 penulis lulus dari SMA Negeri III Surakarta dan pada tahun yang sama lulus seleksi masuk Universitas Gadjah Mada, Fakultas Teknologi Pertanian, Jurusan Pengolahan Hasil Pertanian serta menamatkannya pada tahun 1995.
DAFTAR ISI
Pengaruh Bakteri Asam Laktat………. 16
METODOLOGI ………. 17
Bahan dan Alat ……….17
Metodologi Penelitian ……… 17
HASIL DAN PEMBAHASAN ……….23
Ransum Hewan Percobaan ………... 23
Penanganan Hewan Percobaan ………... 27
Proliferasi Sel Limfosit ……… 29
Bakteri Asam Laktat ……… 32
SIMPULAN DAN SARAN ……….. 38
Simpulan………... 38
Saran ……….38
DAFTAR PUSTAKA...……… 39
DAFTAR TABEL
Halaman 1. Aplikasi inulin dan FOS dalam produk makanan dan minuman…….………... .7 2. Kandungan nutrisi dalam ransum tikus………..19 3. Penambahan berat badan tikus selama penelitian : tahap adaptasi, tahap per- lakuan dan penambahan berat badan total………..……. ..28 4. Nilai absorbansi sel limfosit tanpa mitogen tikus kelompok A (kontrol)
dan tikus kelompok B (perlakuan) ……… ……….30 5. Nilai indeks stimulasi (IS) proliferasi sel B tikus kelompok A (kontrol)
dan kelompok B (tambahan ransum karagenan 0.92% dan FOS 4.08%)……. ..31 6. Jumlah koloni BAL dalam kolon transversal tikus kelompok A (kontrol)
dan kelompok B (tambahan ransum karagenan 0.92% dan FOS 4.08%)……. ..34 7. Jumlah rata-rata koloni BAL dalam kolon tikus dan nilai IS rata-rata
DAFTAR GAMBAR
Halaman
1. Struktur kappa, iota dan lambda karagenan……… .4
2. Struktur gel kappa dan iota karagenan dengan kation……….... .4
3. Proses produksi inulin dan oligofruktosa ……… ..5
4. Struktur kimia inulin dan oligofruktosa…...………... .6
5. Jalur fermentasi glukosa oleh BAL…...………...11
6. Jalur metabolis Bifidobakteri dan enzim yang berperan.………...12
7. Nilai indeks stimulasi (IS) rata-rata proliferasi sel B tikus kelompok A (kontrol) dan kelompok B (tambahan ransum karagenan 0.92% dan FOS 4.08%) ………..……… ……32
8. Jumlah rata-rata BAL dalam kolon tikus kelompok A (kontrol) dan tikus kelompok B (tambahan ransum karagenan 0.92% dan FOS 4.08%)…... ……..34
EFEK KONSUMSI CAMPURAN KARAGENAN DAN FOS
TERHADAP PROLIFERASI LIMFOSIT DAN JUMLAH BAKTERI
ASAM LAKTAT USUS TIKUS
NIKEN SULASTRI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TUGAS AKHIR DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tugas akhir Efek Konsumsi Campuran Karagenan dan FOS Terhadap Proliferasi Limfosit dan Jumlah Bakteri Asam Laktat Usus Tikus adalah karya saya sendiri di bawah bimbingan Prof. Dr. Ir. Fransiska R. Zakaria, M.Sc., dan Dr. Ir. Harsi D. Kusumaningrum, dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tugas akhir ini.
ABSTRACT
NIKEN SULASTRI. Effect of Consumption of Carragennan and FOS Mixtured on Lymphocyte Proliferation and Growth of Lactic Acid Bacteria in the Colon of Rats. Under supervising of FRANSISKA ZAKARIA RUNGKAT and HARSI D. KUSUMANINGRUM
Fructo -oligosaccharides (FOS) and carragennan are indigestable carbohydrates preferentially fermented by lactic acid bacteria (bifidobacteria and lactobacilli) and selectively stimulates their growth. Bifidobacteria and lactobacilli are able to stimulate both nonspesific and spesific immune responses and by so have a potential to improve host health.
The aim of this research is to study the effect of supplementation of a mixture of carragennan and FOS to stimulate growth of lactic acid bacteria and thereby allow immune modulation.
Ten Sprague Dawley rats were randomly divided into two groups; the first group (A), served as the control group were feed the unsupplemented pelet for 21 days. The second group (B) were feed the same unsupplemented pelet for 7 days and got supplemented pelet with FOS 4.08% and carragennan 0.92%, for another 14 days. At the end of the feeding, rats were sacrificed and the spleen were removed asceptically and cultivated for lymphocyte cell isolation. After that, digesta in colon were removed and used for lactic acid bacteria enumeration
EFEK KONSUMSI CAMPURAN KARAGENAN DAN FOS
TERHADAP PROLIFERASI LIMFOSIT DAN JUMLAH BAKTERI
ASAM LAKTAT USUS TIKUS
NIKEN SULASTRI
Tugas Akhir
Sebagai salah satu syarat untuk memperoleh gelar Magister Profesi Teknologi Pangan pada Departemen Ilmu dan Teknologi Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tugas Akhir : Efek Konsumsi Campuran Karagenan dan FOS Terhadap Proliferas i Limfosit dan Jumlah Bakteri Asam Laktat Usus Tikus
Nama Mahasiswa : Niken Sulastri
NIM : F 242040105
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Fransiska R. Zakaria, M.Sc Dr. Ir. Harsi D. Kusumaningrum Ketua Anggota
Diketahui,
Ketua Program Studi Magister Dekan Sekolah Pascasarjana Profesi Teknologi Pangan
Dr. Ir. Lilis Nuraida, M.Sc. Dr. Ir. Khairil Anwar Notodiputro, MS
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan atas segala karunia-Nya sehingga karya ilmiah ini berhasilkan diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan 5 – 29 Oktober 2005 ini adalah pangan fungsional, dengan judul Efek Konsumsi Campuran Karagenan dan FOS Terhadap Proliferasi Limfosit dan Jumlah Bakteri Asam Laktat Usus Tikus.
Terima kasih penulis ucapkan kepada Ibu Prof. Dr. Ir. Fransiska Z. Rungkat, M.Sc. dan Ibu Dr. Ir. Harsi D. Kusumaningrum selaku pembimbing, yang telah banyak memberi saran. Pimpinan PT Inmarindotama dan rekan -rekan kerja, yang telah memberikan dukungan dan bantuan selama masa studi program magister profesi ini. Di samping itu, penghargaan penulis sampaikan kepada staf Laboratorium Mikrobiologi SEAFAST, staf Laboratorium Biokimia Pangan Fateta-IPB, staf Laboratorium Terpadu FKH-IPB dan staf Administrasi Program Magister Profesi Teknologi Pangan, yang telah membantu kelancaran penelitian dan pengumpulan data. Ungkapan terima kasih juga disampaikan kepada keluarga serta seluruh teman, atas segala doa dan kasih sayangnya.
Semoga karya ilmia h ini bermanfaat.
Bogor, April 2006
RIWAYAT HIDUP
Penulis dilahirkan di Surakarta pada tanggal 5 Maret 1970 sebagai anak bungsu dari pasangan Bambang Susanto (Alm) dan Sri Hartati.
Tahun 1989 penulis lulus dari SMA Negeri III Surakarta dan pada tahun yang sama lulus seleksi masuk Universitas Gadjah Mada, Fakultas Teknologi Pertanian, Jurusan Pengolahan Hasil Pertanian serta menamatkannya pada tahun 1995.
DAFTAR ISI
Pengaruh Bakteri Asam Laktat………. 16
METODOLOGI ………. 17
Bahan dan Alat ……….17
Metodologi Penelitian ……… 17
HASIL DAN PEMBAHASAN ……….23
Ransum Hewan Percobaan ………... 23
Penanganan Hewan Percobaan ………... 27
Proliferasi Sel Limfosit ……… 29
Bakteri Asam Laktat ……… 32
SIMPULAN DAN SARAN ……….. 38
Simpulan………... 38
Saran ……….38
DAFTAR PUSTAKA...……… 39
DAFTAR TABEL
Halaman 1. Aplikasi inulin dan FOS dalam produk makanan dan minuman…….………... .7 2. Kandungan nutrisi dalam ransum tikus………..19 3. Penambahan berat badan tikus selama penelitian : tahap adaptasi, tahap per- lakuan dan penambahan berat badan total………..……. ..28 4. Nilai absorbansi sel limfosit tanpa mitogen tikus kelompok A (kontrol)
dan tikus kelompok B (perlakuan) ……… ……….30 5. Nilai indeks stimulasi (IS) proliferasi sel B tikus kelompok A (kontrol)
dan kelompok B (tambahan ransum karagenan 0.92% dan FOS 4.08%)……. ..31 6. Jumlah koloni BAL dalam kolon transversal tikus kelompok A (kontrol)
dan kelompok B (tambahan ransum karagenan 0.92% dan FOS 4.08%)……. ..34 7. Jumlah rata-rata koloni BAL dalam kolon tikus dan nilai IS rata-rata
DAFTAR GAMBAR
Halaman
1. Struktur kappa, iota dan lambda karagenan……… .4
2. Struktur gel kappa dan iota karagenan dengan kation……….... .4
3. Proses produksi inulin dan oligofruktosa ……… ..5
4. Struktur kimia inulin dan oligofruktosa…...………... .6
5. Jalur fermentasi glukosa oleh BAL…...………...11
6. Jalur metabolis Bifidobakteri dan enzim yang berperan.………...12
7. Nilai indeks stimulasi (IS) rata-rata proliferasi sel B tikus kelompok A (kontrol) dan kelompok B (tambahan ransum karagenan 0.92% dan FOS 4.08%) ………..……… ……32
8. Jumlah rata-rata BAL dalam kolon tikus kelompok A (kontrol) dan tikus kelompok B (tambahan ransum karagenan 0.92% dan FOS 4.08%)…... ……..34
LAMPIRAN
Halaman
1. Perhitungan penambahan karagenan dan FOS dalam ransum tikus…... ……...43
2. Jadwal kegiatan lapangan : pemberian pakan tikus…... ………...43
3. Penimbangan berat badan tikus (gram) : tahap adaptasi, tahap perlakuan, dan penambahan berat badan total………...…... ……...44
4. Analisis sidik ragam penambahan berat badan tikus selama tahap perlakuan (14 hari)………..…... ………...45
5. Penimbangan berat ransum (gram) yang dikonsumsi tikus/hari …... ………...45
6. Hasil absorbansi proliferasi limfosit …………... ………..46
7. Analisis sidik ragam nilai IS proliferasi limfosit sel B tikus.... ……….47
8. Hasil analisis jumlah BAL dalam kolon tikus... ………47
9. Analisis sidik ragam jumlah koloni BAL dalam usus tikus... ………...49
PENDAHULUAN
Latar Belakang
Kesadaran masyarakat akan kesehatan, nutrisi dan diet akhir -akhir ini semakin meningkat. Masyarakat sadar bahwa pola hidup sehat, termasuk diet, dapat berperan penting untuk mencegah penyakit dan memperbaiki status kesehatan manusia, sehingga mereka dapat memilih cara untuk memelihara kesehatannya, mencegah atau mengobati penyakit. Upaya mencegah penyakit dan memperbaiki status kesehatan dipilih oleh masyarakat, terutama karena mahalnya biaya perawatan di rumah sakit. P ola hidup yang kurang sehat seperti pengobatan dengan antibiotik, terpapar polutan, stres dan konsumsi makanan tinggi protein dan lemak tetapi rendah serat, akan berpengaruh nyata pada status kesehatan manusia.
Kecenderungan ini membuka pasar baru untuk kelompok makanan yang popular dengan seb utan pangan fungsional. Aspek kesehatan yang paling dijanjikan dari mengkonsumsi pangan fungsional adalah peningkatan sistem imunitas tubuh. Pangan fungsional adalah makanan yang dirancang tidak hanya untuk memenuhi kebutuhan dasar akan energi, makronutrien (karbohidrat, protein, lemak) dan mikronutrien (vitamin dan mineral) tetapi juga memberi manfaat tambahan secara nutrisional dan fisiologi bagi konsumen (Schmild dan Labuza, 2000). Kelompok pangan fungsional yang berkembang pesat saat ini adalah jenis pangan berserat (dietary fiber).
digunakan sebagai salah satu variasi jenis makanan yang dapat memenuhi kebutuhan tubuh akan serat.
Bentuk serat pangan beragam dan mempunyai fungsi yang berbeda dalam sistem pencernaan. Salah satu bentuk serat pangan pangan adalah serat pangan larut air seperti pektin, gum, mannan, alginat, oligosakarida, yang merupakan substrat yang dapat difermentasi oleh Bifidobacteria dan Lactobacilli, dan disebut sebagai prebiotik (Gibson, 2000). Jenis prebiotik yang kini populer termasuk oligosakarida dari fruktosa (frukto-oligosakarida) dan galaktosa (oligosacharida galactosyl).
Frukto-olig osakarida (FOS) sebagai prebiotik, akan menstimulir pertumbuhan bakteri asam laktat (BAL) dalam kolon (Gibson, 2000). Telah banyak penelitian yang menunjukkan bahwa peningkatan jumlah dan aktivitas BAL dalam kolon berkorelasi erat dengan peningkatan status kesehatan karena BAL sebagai probiotik mempunyai karakteristik melakukan kolonisasi, multiplikasi dalam saluran kolon dan membangun sistem imun. Pangan fungsional yang mengandung probiotik dan prebiotik telah diketahui dapat meningkatkan sistem imunitas. Untuk memperoleh fungsi serat pangan sebagai prebiotik dan dapat membangun sistem imun, maka perlu suplementasi makanan yang terancang dengan baik.
Tujuan
Mempelajari fungsi karagenan dan frukto-oligosakarida sebagai penstimulir pertumbuhan bakteri asam laktat dan dapat meningkatkan respon imunitas.
Manfaat
TINJAUAN PUSTAKA
Serat Pangan
Serat pangan adalah polisakarida tumbuhan dan lignin yang tidak dapat dihidrolisis oleh enzim pencernaan manusia (Miller, 2002). Komponen mayoritas serat pangan adalah polisakarida non-pati, antara lain lignin, selulosa, hemiselulosa, pektin, gum, polisakarida dari rumput laut dan polisakarida dari bakteri (Sardesai, 2003 ; Linden dan Lorient, 1999 ). Sumber serat pangan, antara lain gandum (whole wheat dan wheat bran), biji-bijian kering, kedelai, buah dan sayur yang secara alami mengandung serat dengan jumlah yang bervar iasi (Sardesai, 2003).
Serat pangan berdasar kemampuan fisiko-kimia, dibedakan menjadi dua (Linden dan Lorient, 1999) yaitu (1) serat larut air (pektin, galaktomanan, polisakarida dari rumput laut, oligosakarida) dan (2) serat tak larut (biopolimer dindin g tanaman : lignin). Serat larut air akan digunakan sebagai substrat oleh beberapa jenis mikroflora kolon menjadi asam lemak rantai pendek (ALRP), CO2,
H2 dan CH4, dapat mempengaruhi sistem metabolisme karbohidrat dan lemak
dalam tubuh. Efek konsumsi serat tak larut air akan mempengaruhi peningkatan berat feses, meningkatkan laksasi dan waktu transit feses dalam kolon menjadi lebih pendek (Sardesai, 2003).
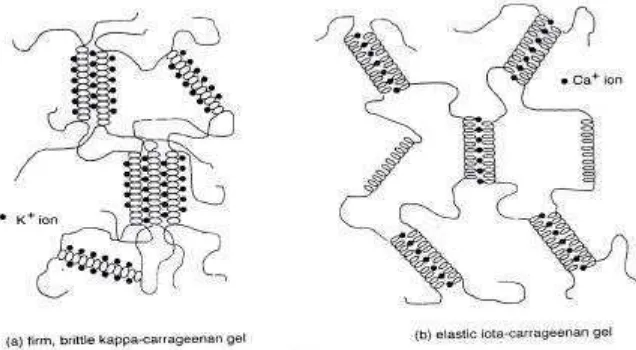
Gambar 1. Struktur kappa, iota dan lambda karagenan (Imeson, 2000)
Karagenan dapat digunakan sebagai pengental dan mampu membentuk gel dengan tingkat tekstur yang bervariasi, lembut dan elastis hingga keras dan brittle. Semua jenis karagenan larut dalam air panas (terlarut sempurna pada temperatur 800C), hanya lambda dan garam sodium-kappa dan iota, akan larut dalam air dingin , kemudian dilanjutkan dengan pendinginan (40-600C) akan membentuk struktur 3 dimensi (crosslinked) tergantung dari jenis kation yang tersedia, seperti K+, Na+ atau Ca2+ (Gambar 2) (Imeson, 2000). Aplikasi karagenan untuk puding (dessert), pie filling, produk dari susu, es krim, jeli (water jelly) dan produk daging-ikan (Nussinovitch, 1997).
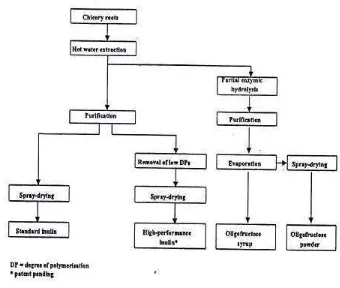
Oligosakarida adalah gula yang tersusun dari 2-20 unit sakarida, disebut sebagai polisakarida rantai pendek. Beberapa buah -buahan dan sayuran secara alami mengandung oligosakarida, namun dapat pula diproduksi secara komersil dengan hidrolisa polisakarida atau melalui proses enzimatik. Golongan oligosakarida, antara lain laktolusa, frukto-oligosakarida, galakto-oligosakarida, soya-bean oligosakarida, laktosukrosa, isomalto-oligosakarida, glucooligosakarida, xylo oligosakarida dan palatinose (Gibson, 2000). Frukto -oligosakarida (FOS) adalah -oligosakarida yang tersusun dari 2 atau lebih unit fruktosa (fruktan), membentuk ikatan ß(2-1). Umumnya FOS diperoleh dari inulin yang merupakan bentuk glikan dari beberapa jenis tumbuhan, seperti bawang, asparagus, dahlia, Jerusalem artichoke, umbi chicory, gandum (wheat, rye, barley) dan pisang. Jenis tumbuhan yang paling banyak mengandung inulin (>15%) adalah Jerusalem artichoke, dahlia dan umbi chicory, dig unakan untuk produksi industrial (Franck, 2000). Tahapan proses produksi inulin dan oligofruktosa, adalah sebagai berikut (Gambar 3) :
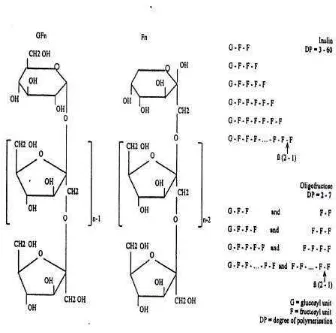
FOS yang diperoleh dari inulin mengandung GFn dan Fn (G=unit glukosil,
F=unit fruktosil dan n=jumlah unit fruktosil yang saling berikatan) sebanyak 2-7 (Gambar 4).Fruktan inulin adalah jenis karbohidrat yang tidak dapat dicerna atau dihidrolisis oleh enzim pencernaan mamalia, akan difermentasi oleh mikroflora kolon (Franck, 2000 ; Southgate, 2001).
Gambar 4. Struktur kimia inulin dan oligofruktosa (Franck, 2000)
Inulin, dapat dikombinasikan dengan bahan penyusun makanan yang lain karena inulin mempunyai sifat tidak berasa (netral), tingkat kemanisan 10% dari sukrosa, dapat digunakan sebagai pengganti lemak , membentuk struktur gel yang spesifik dan mempunyai tingkat kelarutan yang rendah dalam air, maksimum sebanyak 10% pada temperatur ruang (Franck, 2000).
sehingga dikombinasikan dengan pemanis seperti aspartam dan acesulfam K akan menghasilkan tingkat manis yang menyerupai sukrosa, dan dapat membantu meningkatkan rasa buah (Franck, 2000).
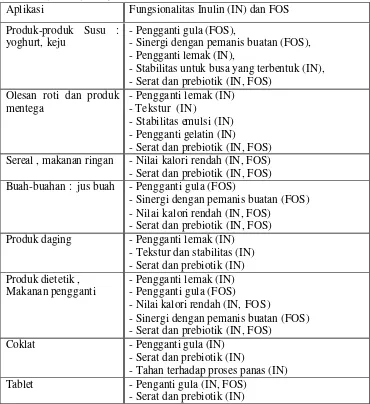
Aplikasi inulin dan FOS dalam beberapa jenis produk makanan dan minuman (Tabel 1) mempunyai fungsi ganda, yaitu dapat meningkatkan kualitas organoleptik dan meningkatkan komposisi nutrisi dalam produk tersebut (Franck, 2000).
Tabel 1. Aplikasi inulin dan FOS dalam produk makanan dan minuman (Franck, 2000)
Aplikasi Fungsionalitas Inulin (IN) dan FOS Produk-produk Susu :
yoghurt, keju
- Pengganti gula (FOS),
- Sinergi dengan pemanis buatan (FOS), - Pengganti lemak (IN),
- Stabilitas untuk busa yang terbentuk (IN), - Serat dan prebiotik (IN, FOS)
Olesan roti dan produk
- Serat dan prebiotik (IN, FOS) Sereal , makanan ringan - Nilai kalori rendah (IN, FOS) - Serat dan prebiotik (IN, FOS) Buah-buahan : jus buah - Pengganti gula (FOS)
- Sinergi dengan pemanis buatan (FOS) - Nilai kalori rendah (IN, FOS)
- Serat dan prebiotik (IN, FOS) Produk daging - Pengganti lemak (IN)
- Tekstur dan stabilitas (IN) - Serat dan prebiotik (IN) Produk dietetik ,
Makanan pengganti
- Pengganti lemak (IN) - Pengganti gula (FOS)
- Nilai kalori rendah (IN, FOS)
- Sinergi dengan pemanis buatan (FOS) - Serat dan prebiotik (IN, FOS)
Coklat - Pengganti gula (IN) - Serat dan prebiotik (IN)
- Tahan terhadap proses panas (IN) Tablet - Penganti gula (IN, FOS)
Prebiotik
Prebiotik adalah komponen makanan yang tidak dapat dicerna oleh sistem pencernaan manusia tetapi dapat menstimulasi pertumbuhan dan aktivitas terhadap satu atau lebih bakteri kolon secara selektif dan dapat meningkatkan status kesehatan inang. Prebiotik akan efektif jika (1) tidak terhidrolisis atau terserap di dalam sistem pencernaan bagian atas, dan (2) hasil fermentasi selektif dari mikroflora usus, akan menyeimbangkan komposisi mikroflora usus menjadi lebih sehat (Gibson, 2000).
Serat pangan larut air, salah satunya oligosakarida adalah kandidat prebiotik karena merupakan bahan pangan yang dapat masuk ke dalam kolon dan difermentasi secara selektif oleh bakteri yang hidup dalam kolon, tersedia sebagai substrat untuk mikroflora kolon (Mogensen , 2000). Fermentasi prebiotik oleh mikroflora kolon menghasilkan gas hidrogen, CH4, karbondioksida dan asam
lemak rantai pendek (Gallaher, 2000). Enzim yang berperanan dalam proses fermentasi FOS dalam kolon adalah enzim ß-fruktosidase dari bifidobakteri (Brassart dan Schiffrin, 2000).
Inulin dan FOS secara selektif dapat menstimulasi pertumbuhan mikroflora kolon, terutama bifidobakteri telah dibuktikan melalui beberapa penelitian secara in vitro, uji studi pada hewan dan uji klinis pada manusia. Uji klinis pada manusia melibatk an 100 sukarelawan terdiri dari pria, wanita, dewasa muda dan manula dengan rancangan studi yang beragam selama 1 hingga 9 minggu masa suplementasi dengan diet terkontrol atau diet tidak terkontrol. Para responden yang mengkonsumsi inulin atau FOS sebanyak 5-20 g/hari, menunjukkan perubahan mayoritas pada komposisi bifido bakteri dalam kolon yang meningkat secara signifikan (Franck, 2000).
Efek peningkatan selektif terhadap populasi bifidobakteri dalam kolon memberikan kemungkinan implikasi untuk pencegahan dan perawatan terhadap infeksi usus, seperti inflamasi usus, sindrom iritasi usus dan diare (Franck, 2000).
Fusobacteria ; (2) perubahan pH kolon, penurunan pH kolon akan membantu pertumbuhan bifidobakteri dan menekan pertumbuhan bakteri patogen secara umum; (3) produksi asal lemak rantai pendek (ALRP) akan menyebabkan turunnya pH kolon, berfungsi sebagai zat antimikroba dan sebagai substrat sel kolon, asam yang dihasilkan dari fermentasi berupa asam asetat, laktat, b utirat dan propionat; (4) produksi imuno stimulan, telah dilakukan penelitian bahwa Bifidobacteria menghasilkan metabolit yang bersifat menekan pertumbuhan bakteri patogen .
Probiotik
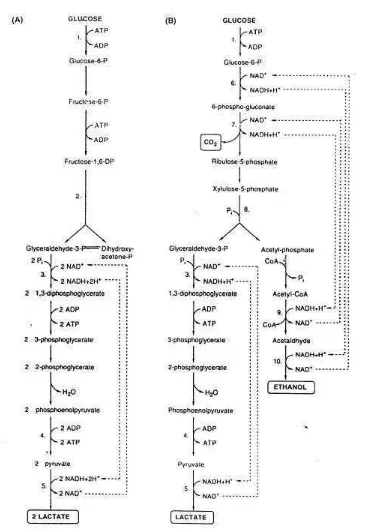
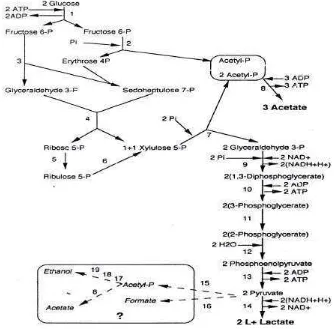
Probiotik adalah mikroba hidup yang dikonsumsi sebagai komponen pangan dan berguna untuk kesehatan. Spesies mikroba yang umum digunakan sebagai probiotik adalah Lactobacillus, Bifidobacteri, Enterococcus, Sacharomyces dan Lactococcus (Gibson, 2000). Dalam kolon terdapat Lactobacilli 104-109 /ml atau /gram dan Bifidobactrium spp 108-1011 / ml atau /gram (Salminen et. al, 1998). Keseimbangan mikroflora dalam usus, terutama bakteri asam laktat, berkorelasi erat dengan peningkatan status kesehatan dan menstimulir sistem imun (Mitsuoka, 1987). Bakteri asam laktat (BAL) sebagai prob iotik mempunyai karakteristik melakukan kolonisasi, multiplikasi di saluran usus dan membangun sistem imun (Salminen et.al, 1998). BAL dapat menstimulasi sistem imun, terutama respon imun mukosal (Brassart dan Schiffrin, 2000), memproduksi imunoglobulin, interleukin dan meningkatkan aktivitas fagositik atau makrofag (Sandholm, 2000). BAL adalah bakteri gram positif, nonspora, sel berbentuk batang atau bulat, katalase negatif, bersifat anaerob tetapi toleran terhadap kondisi aerobik, dan menghasilkan asam laktat sebagai hasil utama dari fermentasi karbohidrat. Klasifikasi BAL dalam beberapa genera berdasarkan morfologi, metoda fermentasi glukosa, pertumbuhan pada temperatur yang berbeda, konfigurasi asam laktat yang dihasilkan, kemampuan untuk tumbuh pada kondisi konsentrasi garam yang tinggi, dan tahan terhadap asam atau alkalis.
gula yang khusus berbeda dengan genera BAL yang lain . Genera terbesar dalam BAL adalah Lactobacillus yang paling tahan terhadap kondisi asam (Axelsson, 1998).
Bifidobakteri bersifat gram positif, nonspora, hasil fermentasi berupa asam laktat dan sam asetat dengan perbandingan 3 :1 (Gambar 6), anaerob namun beberapa spesies masih toleran terh adap sejumlah oksigen. Bifidobakteri mempunyai jalur fermentasi gula melalui glukosa-6-phosphatase dan fruktosa-6-phosphatase, yang merupakan jalur spesifik Bifidobakteri dalam memfermentasi gula. Hal lain yang membedakan Bifidobakteri dari BAL adalah Bifidobakteri dapat menggunakan garam ammonium sebagai sumber nitrogen dan menghasilkan L(+) asam laktat. Bentuk L (+) secara fisiologis akan lebih langsung digunakan dalam metabolisme tubuh manusia (Axelsson, 1998).
Respon Imun
Respon imun merupakan interaktif kelompok dari berbagai jenis sel imunokompeten yang bekerja sama dalam proses identifikasi dan eliminasi mikroba patogen dan zat-zat berbahaya lainnya yang masuk ke dalam tubuh. Semakin baik respon imun tubuh, semakin baik status kesehatan seseorang (Roitt, 1991).
Respon imun dibedakan dalam respon imun spesifik dan nonspesifik. Respon imun nonspesifik timbul sebagai reaksi terhadap serangan mikroba patogen dan zat asing lainnya melalui fagositosis oleh neutrofil dan monosit (makrofag), barier kimia melalui sekresi internal dan eksternal (lisozim dalam mukus jaringan, air mata, laktoperoksidase dalam saliva) protein darah (interferon, sistem kinin dan komplemen) dan sel Natural Killer (NK) (Parslow, 1997).
Respon imun spesifik meliputi respon imun seluler dan humoral. Leukosit, khususnya limfosit berperan penting dalam respon imun spesifik. Respon imun seluler memberikan pertahanan terhadap mikroba intra dan ekstraseluler melalui sekresi limfokin seperti interferon dan interleukin. Sedangkan respon imun humoral memberi pertahanan melalui produksi antibodi terhadap antigen spesifik . Sel B berperan dalam respon imun humoral dan sel T berfungsi dalam sistem imun seluler (Roitt, 1991).
Respon imun dapat diukur dengan indikator jumlah atau aktivitas sel imunokompeten dan molekul larut yang diproduksi sel tersebut (Parslow, 1997). Jumlah dan aktivitas sel limfosit dapat diukur dengan metode kultur sel secara in vitro atau uji aktivitas proliferasi (Zakaria et.al, 2003).
Proliferasi Limfosit
untuk mengeliminasi beragam antigen yang masuk ke dalam tubuh (Roitt, 1991). Terdapat tiga kelompok limfosit yang masing-masing dibedakan berdasarkan fungsinya, yaitu sel T, sel B dan sel NK. Sel T dan sel B memiliki reseptor pada permukaan yang mampu mengenal antigen tertentu, sedangkan sel NK tidak mempunyai reseptor untuk mengenal antigen (Kresno, 1996).
Sel T adalah leukosit non fagositik yang berasal dari sel hematopoetik di sumsum tulang belakang, namun migrasi ke organ timus dan menjadi dewasa. Di dalam organ timus, sel T sangat cepat membelah diri dan dalam proses pendewasaannya mengalami deferensiasi menjadi 3 populasi utama atau subsetnya, yaitu sel Thelper (Th), sel Tsupresor (Ts), dan Tcytotoxic (Tc). Masing-masing populasi sel T tersebut mengekspresikan penanda permukaan atau Cluster Determinan (CD) berupa molekul glikoprotein yang berbeda-beda. Subset Th mengekspresikan molekul glikoprotein permukaan CD4, sedangkan sel Tc ditandai oleh glikoprotein CD8. Molekul CD3 adalah molekul glikoprotein petanda submembran semua subset sel T. Molekul petanda yang berbeda mencirikan subset sel T dan dapat digunakan untuk identifikasi subset limfosit T (Roitt, 1991).
Sel T memiliki molekul T Cell Antigen Receptor (TCR) yang dapt mengenali epitop suatu antigen melalui kerjasama dengan molekul protein permukaan pada Antigen Presenting Cell (APC) yaitu Major Histocompatibility Complex (MHC). Sel T terkativasi oleh antigen spesifik sehingga terstimulasi untuk berproliferasi dan berdiferensiasi menjadi sel T memori dan berbagai sel T efektor yang mensekresi berbagai limfokin. Limfokin tersebut berpengaruh pada aktivasi sel B, sel Tc, sel-sel fagositik, sel NK dan sel lain yang terlibat dalam respon imun. Sel Th berperan dalam imunitas seluler, dan membantu sel B dalam produksi antibodi (Roitt, 1991).
untuk dapat memberikan respon terhadap rangsangan antigenik dengan cara pembelahan dan diferensiasi menjadi sel plasma dibawah kontrol sitokin, khususnya limfokin yang disekresi oleh sel T (Roitt, 1991).
Sel NK adalah salah satu populasi sel nul karena sel tersebut tidak memiliki reseptor antigen pada permukaan seperti sel B dan sel T, tetapi memiliki reseptor untuk C3 (komplemen) dan fragmen molekul antibodi (Fc) (Kresno, 1996).
Sel NK berfungsi sebagai sel efektor sitolitik yang dapat menyerang dan melisis sel target, yaitu sel abnormal seperti sel neoplastik (tumor dan tumor ganas), sel terinfeksi patogen seluler (virus dan bakteri) dan sel normal yang tidak dewasa (immature cell). Sel NK dapat melisis sel target yang dilapisi antibodi-antitumor karena mempunyai reseptor untuk antibodi dengan terminal karboksil (Roitt, 1991). Sel target dilisis secara spontan oleh sel NK, tidak tergantung pasa molekul MHC II, dengan cara melepaskan faktor sitotoksik berupa sitolisisn atau perforin. Sel NK dapat mengenali sel tumor atau terinfeksi virus karena sel tersebut mengekspresikan molekul glikoprotein pada permukaannya yang membedakan dari sel normal (Roitt, 1991).
Proliferasi limfosit merupakan fungsi biologis mendasar limfosit, yaitu proses diferensiasi dan pembelahan (mitosis) sel. Limfosit adalah sel tunggal yang bertahan baik saat dikultur dalam media sed erhana dan secara konsisten tetap dalam tahap diam dan tidak membelah sampai ditambahkan mitogen. Respon proliferasi kultur limfosit digunakan untuk menggambarkan fungsi limfosit dan status imun individu (Zakaria et.al, 2003). Kemampuan limfosit untuk berp roliferasi atau membentuk klon menunjukkan secara tidak langsung kemampuan respon imunologik. Bila sel dikultur dengan senyawa mitogen, maka limfosit akan berproliferasi secara tidak spesifik. Jika limfosit dikultur dengan antigen spesifik, maka kemampuan limfosit untuk merespon secara spesifik dapat diukur (Zakaria et.al, 1992).
yang terbentuk proporsional terhadap jumlah sel (James et.al, 1994). Perhitungan sel dapat pula dilakukan dengan metode tryphane blue, menggunakan prinsip penyerapan zat warna melalui membran sel, pewarna tryphane blue hanya dapat mewarnai jika membran sel rusak sehingga dapat digunakan untuk membedakan sel hidup dan mati atau rusak. Sel hidup tidak akan berwarna (terang) dan berbentuk bulat, sedangkan sel mati akan berwarna biru dan mengkerut.
Kultur sel digunakan untuk mengembangbiakan sel di luar tubuh (in vitro). Biakan sel atau jaringan ini dimaksudkan untuk mempelajari sifat sel di luar tubuhnya. Akan tetapi kultur sel masih mempunyai kekurangan yaitu hilangnya spesifitas sel, karena awalnya (in vivo) sel bekerja secara terintegritas dalam satu jaringan, sedangkan dalam kultur sel terpisah-pisah. Untuk mempertahankannya, kondisi kultur harus dibuat semirip mungkin dengan keadaan lingkungan awal di dalam tubuh (Freshney, 1994). Sel memerlukan media penumbuh yang dapat membuat sel tersebut bertahan hidup, berkembang dan berdiferensiasi. Jumlah dan kualitas media menentuk an jumlah sel yang dapat ditumbuhkan dalam kultur. Pemilihan media harus didasarkan pada kebutuhan sel yang ditumbuhkan dan disesuaikan dengan tujuan studi yang menggunakan sel tersebut. Media biasa dilengkapi dengan serum (5 -20%) untuk menunjang pertumbuhan sel di luar tubuh (Malole, 1990). Sel limfosit membutuhkan O2 untuk bertahan hidup.
Kondisi rendah O2 dapat mendorong proses proliferasi tetapi pertumbuhannya
tidak berlangsung lama dalam kondisi anaerob. Suhu kultur dipertahankan 370C dengan konsentras i CO2 5% dan O2 95% untuk mensesuaikan keadaan dalam
tubuh. Temperatur juga mempengaruhi pH melalui peningkatan CO2 pada
temperatur rendah serta melalui perubahan ionisasi dan pH dari buffer. Ketebalan media kultur dapat mempengaruhi difusi oksigen ke dala m sel, oleh karena itu ketebalannya berkisar antara 2-5 mm. Antibiotik ditambahkan dalam media untuk mencegah terjadinya kontaminasi (Freshney, 1994).
Pengaruh Bakteri Asam Laktat
Hasil metabolit fermentasi Bifidobakteri yang berupa asam organik (asam asetat dan asam laktat) berfungsi sebagai senyawa antimikroba. Asam tersebut akan mengkondisikan kolon dalam keadaan asam sehingga dapat membantu mengendalikan pertumbuhan bakteri nonacidophilic secara umum. Sedangkan Lactobacilli dapat menstimulasi respon imun inang, baik secara spesifik dan non spesifik, mempunyai peranan yang penting dalam mekanisme pertahanan mukosal (Brassart dan Schiffrin, 2000).
Sistem pertahanan mukosal saluran pencernaan terbagi menjadi 2, yaitu (1) perbandingan yang berlawanan, antara populasi BAL dengan patogen dan (2) respon imun mukosal dari inang, berupa pertahanan non spesifik. Respon imun mukosal menghasilkan antigen spesifik imunoglobulin (Ig) yaitu IgA. Saat mencapai lumen usus, IgA akan mengenali dan mengikat antigen atau patogen spesifik, sehingga memberikan imunitas alami yang kompleks dan dapat mencegah interaksi antigen (bakteri, virus dan toksin) dengan permukaan mukosal (Brassart dan Schiffrin, 2000).
METODOLOGI
Bahan dan Alat
Bahan utama yang digunakan di dalam penelitian ini adalah karagenan (tipe XPB-48A, Degussa) dan frukto-oligosakarida (Fibrulose-F97, Cosucra).
Bahan-bahan kimia yang digunakan untuk proliferasi limfosit adalah alkohol 70 %, histopaque, media RPMI-1640 (Gibco BRL), NH4Cl 0.85%, Phospat
Buffered Saline (Sigma Chemical, USA), antibiotik gentamycin, lipopolisakarida (LPS) Salmonella typhii (Sigma Chemical, USA), Fetal Bovine Serum (FBS)(Sigma Chemical, USA), tryphan blue (Wako, Jepang), HCl-isopropanol 0.04N, aquabidest, aquadest, dan MTT (3(4,5-dimethylthiaazol-2,5-diphenyl-tetrazolium bromide)) (Sigma Chemical, USA).
Bahan-bahan kimia yang digunakan untuk enumerasi BAL adalah de Mann Rogosa Sharpe (MRS) Agar (OXOID), larutan pengencer yang digunakan adalah laturan garam fisiologis (NaCl 0.85%) dan alkohol 70%.
Hewan percobaan yang digunakan adalah tikus varietas Sprague-Dawley berumur sekitar 1-1,5 bulan dengan berat badan sekitar 120-140 gram. Tikus tersebut diperoleh dari Fakultas Peternakan, IPB, Bogor.
Alat-alat yang digunakan di dalam penelitian ini adalah syringe 5 dan 20 ml, pipet pasteur steril, tabung sentr ifuse steril 15 dan 50 ml, mikropipet, mikrotip, mikropipet, microplate steril dengan 96 sumur, membran filter steril 0.2 µm, sentrifugator, laminar flow, hemacytometer, mikroskop, inkubator (5 % CO2,
RH 95 %, suhu 37 oC), microplate reader, cawan petri steril dan Stomacher Bag .
Metode Penelitian
Penelitian ini dibagi menjadi 3 tahap, yaitu (1) persiapan ransum tikus dan penanganan hewan percobaan, (2) proliferasi limfosit tikus dan (3) enumerasi BAL dalam kolon tikus.
1. Persiapan Ransum Tikus dan Penanganan Hewan Percobaan a. Persiapan Ransum Tikus
mengandung karagenan 0.98% dan FOS 4.02%. Besarnya tambahan kandungan karagenan dan FOS dalam ransum tikus dihitung berdasarkan persentase kandungan total serat dalam prototipe produk, yaitu jeli dengan prebiotik (L ampiran 1). Kandungan nutrisi ransum kontrol mengacu pada ransum tikus standar menurut American Institute of Nutrition (1976) (Tabel 2).
Tabel 2. Kandungan nutrisi dalam ransum tikus
Zat gizi Ransum
Karbohidrat (maizena) 50.0 49.5 55.5
Air 10.5 10.5 10.0
Pelet kering tanpa tambahan serat larut (uji di SUCOFINDO)
b
Pelet kering dengan tambahan karagenan dan FOS (uji SUCOFINDO)
c
Ransum tikus standar menurut American Institute of Nutrition (1976)
b. Penanganan Hewan Percobaan
Seluruh tikus percobaan (10 ekor) terlebih dahulu melalui tahapan adaptasi selama 7 hari dan setiap ekor diberi pakan dan minum yang sama, yaitu ransum kontrol dan air minum. Pemberian ransum dan air minum dilakukan secara ad libitum.
Setelah masa adaptasi selesai, dilanjutkan pemberian ransum kontrol selama 14 hari untuk tikus kelompok A dan ransum perlakuan selama 14 hari untuk tikus kelompok B. Pemberian ransum (kontrol dan perlakuan) serta air minum dilakukan secara ad libitum.
Selama masa adaptasi dan percobaan, masing-masing tikus dalam kelompok A dan B ditimbang ber at badannya setiap 3 hari.
2. Proliferasi Limfosit
a. Isolasi Limfosit (Subekti, 1997, yang dimodifikasi)
Tikus pada hari ke-22 dimatikan dengan cara pemutusan tulang belakang, lalu limfa diambil secara steril dan diletakkan dalam cawan steril. Kemudian ditambah 5 ml PBS (Phosphat Buffer Saline) steril, limfa digerus dan disaring untuk mendapatkan limfosit. Tahap ini dilakukan di dalam laminar flow hood steril.
Sel-sel darah merah yang ada dilisis dengan NH4Cl 0.85%,
selanjutnya limfosit dicuci sebanyak 2 kali dengan media RPMI-1640 dengan cara sentrifugasi pada 1000 rpm selama 10 menit. Supernatan dibuang dan dilakukan pencucian kembali. Tahap selanjutnya adalah menghitung jumlah sel limfosit per ml yang telah diisolasi.
b. Penghitungan Sel
Sebelum dilakukan kultur sel limfosit, terlebih dahulu dilakukan penghitungan sel limfosit dengan menggunakan pewarna tryphan blue. 50 µl sel ditempatkan ke dalam sumur microplate dan ditambahkan tryphan blue ke dalamnya. Penghitungan sel limfosit dilakukan dengan menggunakan hemasitometer di bawah mikroskop dengan perbesaran 400 kali.
hemasitometer dapat dilakukan dengan menggunakan rumus sebagai berikut :
N = A x FP x 104 sel/ml
Keterangan : N = jumlah sel limfosit/ml
A = jumlah sel hidup rata -rata per bidang pandang (0,1 mm3)
FP = faktor pengenceran
c. Proliferasi Limfosit dengan Metode MTT (Puspaningrum, 2003) Jumlah sel limfo sit dari masing -masing tikus ditepatkan menjadi 2 x 106 sel/ml dengan media sintetik RPMI-1640. Ke dalam tiap sumur microplate dimasukkan 100 µl suspensi sel dari masing-masing sampel. Kemudian ditambahkan 80 µl larutan mitogen LPS S. typh ii 25 µg/ml masing-masing dalam 3 sumur, sehingga diperoleh konsentrasi dalam kultur 10 µg/ml konsentrasi LPS di tiap -tiap sumur. Sebagai kontrol hanya ditambahkan media RPMI-1640. Selanjutnya ditambahkan ke masing-masing sumur 20 µl FBS sehingga volume total tiap sumur berisi 200 µl kultur. Kultur diinkubasi selama 48 jam dalam inkubator bersuhu 37oC dengan kandungan atmosfer yang mengandung 5 % CO2 dan RH 95 %.
Pengujian aktivitas proliferasi sel limfosit ini dilakukan dengan menggunakan metode MTT. Sebelum masa in kubasi berakhir, 6 jam sebelumnya ke dalam masing-masing sumur ditambahkan 10 µl pewarna MTT 0.5 % dan diinkubasi kembali pada kondisi yang sama selama 6 jam. Pada akhir masa inkubasi, ditambahkan 80 µl HCl-isopropanol 0.04 N, setelah itu dilakukan pembacaan sel dengan alat Microplate Reader pada panjang gelombang 570 nm. Nilai indeks stimulasi (IS) dapat dihitung dengan persamaan seperti berikut ini :
3. Enumerasi BAL Kolon Tikus (Fardiaz, 1989)
Potongan transversal kolon tikus diletakkan dalam cawan petri steril dan ditimbang (5 gram), kemudian disemprot dengan larutan garam fisiologis 0.85% (45 gram). Kolon tikus dibelah, bersama dengan larutan garam fisiologis dimasukkan ke dalam Stomacher Bag (60 detik, kecepatan : normal) untuk mendapatkan sampel larutan digesta usus.
HASIL DAN PEMBAHASAN
Ransum Hewan Percobaan
Asupan nutrisi yang lengkap meliputi karbohidrat, lemak, protein, air, vitamin dan mineral sangat penting bagi pertumbuhan makhluk hidup agar seluruh sistem kekebalan tubuhnya dapat berfungsi dengan baik. Aktivitas fungsi imunitas sangat tergantung pada kandungan nutrisi dalam makanan (Zakaria, 1996).
Ransum untuk tikus kelompok A (kontrol) berupa pelet yang mengandung karbohidrat, protein, lemak , vitamin, mineral dan serat kasar, sebagai ransum kontrol dan diberikan ad libitum selama 7 hari untuk masa adaptasi, kemudian dilanjutkan dengan pemberian jenis ransum yang sama selama 14 hari sebagai kontrol untuk masa perlakuan . Sedangkan tikus kelompok B diberi ransum kontrol selama 7 hari dan dilanjutkan dengan pemberian ransum perlakuan yang mengandung tambahan serat larut 5%, terdiri dari 0.92 % karagenan dan 4.08% FOS (inulin) sebagai sumber prebiotik selama 14 hari. Dengan terpenuhinya asupan gizi, mengacu pada ransum tikus standar menurut American Institute of Nutrition (1976) dan adanya penambahan serat larut (karagenan dan FOS) maka diharapkan aktivitas fungsi imunitas tikus dapat meningkat.
Analisis kadar protein pada penelitian ini dilakukan dengan metode Kjeldahl-mikro. Metode ini merupakan metode analisis kadar protein dalam bahan makanan secara tidak langsung, karena yang diukur adalah kadar nitrogennya. Kekurangan dari metode ini adalah komponen non protein yang mengandung nitrogen juga akan terukur, namun metode ini masih sering digunakan dan cukup teliti untuk pengukuran kadar protein dalam bahan makanan (Winarno, 1995). Pada penelitian ini digunakan kasein sebagai sumber protein pakan.
antibodi yang disekresi dan afinitas antibodi. Kekurangan asam amino esential pada diet akan menyebabkan penurunan kekebalan humoral maupun seluler (Zakaria, 1996). Bahkan asam amino non esensial dapat menjadi asam amino esensial pada kondisi tertentu, asam amino non esensial glutamin, dapat menjadi esensial pada saat terjadi inflamasi dan juga penting bagi proliferasi sel, terutama sel imun (Newsholme, 2003).
Oleh karena pentingnya kecukupan dan keseimbangan protein dan asam amino-asam amino esensial bagi tubuh, terutama berkaitan dengan sistem imunitas maka kecukupan protein dalam pakan tikus percobaan sangat penting.
Metode pengukuran kadar lemak yang digunakan adalah metode soxhlet dengan pelarut lemak hexan. Sumber lemak yang digunakan dalam penelitian ini berasal dari miny ak jagung yang kaya akan asam lemak linoleat, asam oleat, asam palmitat dan sedikit asam lemak ? -3 (a-linoleat), asam stearat, asam arakhidonat dan asam palmitat (Belitz, 1999).
Lemak dibutuhkan oleh tubuh sebagai sumber energi, sumber asam lemak -asam lemak esensial, pelarut vitamin serta pelarut komponen larut lemak lainnya. Kekurangan asam lemak esensial pada tubuh akan mengganggu sistem imun. Efek modulator asam lemak meliputi perubahan fungsi membran yang terkait erat dengan komposisi asam lemak pada membran. Ketersediaan asam lemak tersebut akan berpengaruh nyata pada komposisi dan fungsi membran sel imun. Sel imun berperan dalam sistem kekebalan tubuh melalui kontak membran dengan transduksi signal, ekspresi petanda permukaan dan aktivitas seluler (Robinson et.al, 2001).
Selain penting bagi sistem kekebalan tubuh, asam lemak juga penting dalam proses penyerapan vitamin A, D, E dan vitamin K, serta senyawa larut lemak lainnya seperti karotenoid. Lemak akan menstimulir sekresi asam empedu dan lipase, asam empedu akan mengemulsikan lemak dan senyawa-senyawa larut lemak lainnya agar mudah dihidrolisis oleh lipase dan diserap oleh usus halus (Boileau et.al, 1999).
komponen struktural jaringan dan fungsi utamanya adalah untuk mempromosikan proses biokimia dan fisiologis yang penting untuk hidup (Sardesai, 2003).
Vitamin dibagi menjadi 2 kelompok, yaitu (1) vitamin larut lemak, meliputi vitamin A, D, E, dan K ; (2) vitamin larut air, terdiri dari vitamin C dan B (Winarno, 1995). Vitamin larut lemak (A,D, E, K) , banyak terdapat dalam minyak ikan dan biji-bijian sumber minyak. Vitamin ini akan diserap oleh tubuh melalui usus halus, bersama-sama dengan lemak dan dapat disimpan dalam hati atau jaringan-jaringan lemak, sehingga tidak perlu dikonsumsi setiap hari (Sardesai, 2003 ; Winarno, 1995). Sedangkan vitamin larut air (C dan B), dapat bergerak bebas dalam badan, darah dan limfa (Winarno, 1995) serta ikut terekskresi dalam urine dengan jumlah yang sedikit dan tidak dapat disimpan dalam tubuh, maka jenis vitamin larut air ini harus dikonsumsi lebih sering untuk mencegah kekurangan, kecuali untuk vitamin B12 (Sardesai, 2003).
Menurut Sardesai, 2003, fungsi vitamin dalam tubuh, antara lain untuk (1) ekspresi informasi genetik (vitamin A untuk diferensiasi sel epitel), (2) transkripsi spesifik mRNA sebagai kode penting untuk sintesis protein yang bertanggung jawab untuk penyerapan kalsium (vitamin D), (3) melindungi seluler lemak dari serangan radikal bebas (vitamin E), (4) modifikasi post-translasional protein, melibatkan karboksilasi residu glutamat (vitamin K), (5) mengurangi jumlah logam berat sehingga sistem enzim dapat berfungsi sebagai alat transport molekuler oksigen (vitamin C), dan (6) sebagai komponen co-enzym yang berperanan vital bagi seluruh sistem metabolisme sel (vitamin B dan vitamin K).
Unsur mineral dikenal sebagai zat anorganik atau kadar abu. Dalam proses pembakaran, bahan -bahan organik terbakar tetapi zat -zat anorganik tidak terbakar , karena itulah disebut sebagai abu (Winarno, 1995). Fungsi mineral untuk bahan penyusun tulang dan gigi, sebagai elektrolit dan sebagai konstituen enzim. Mineral dibagi menjadi 2 kelompok, yaitu (1) unsur makro, seperti kalsium, kalium, fosfor, natrium, magnesium dan klor, yang terdapat dalam tubuh dengan jumlah yang cukup besar, serta (2) unsur dalam jumlah yang sedikit, disebut trace element, seperti besi, seng, tembaga, mangan, dan iodium (Sardesai, 2003).
Karbohidrat (C6H12O6)n adalah substansi kimia yang dominan, yang dapat
oleh tubuh dengan fungsi utama sebagai sumber energi, jumlah kalori yang dapat dihasilkan sebanyak 4 kkal/gram, bila dibandingkan dengan protein dan lemak, karbohidrat merupakan sumber kalori yang murah, selain itu beberapa golongan karbohidrat menghasilkan serat pangan yang berguna bagi tubuh (Winarno, 1995) . Jaringan tubuh dapat menggunakan sumber energi yang beragam tetapi otak dan sel darah merah sangat memilih jenis sumber energi yang digunakan. Sel darah merah tergantung sepenuhnya pada glikolisis dan otak menggunakan glukosa, namun dapat juga sebagian menggunakan keton dalam tubuh (Sardesai, 2003).
Fungsi lain karbohidrat selain sebagai sumber energi, antara lain untuk mencegah timbulnya ketosis, pemecahan protein yang berlebihan, kehilangan mineral dan membantu metabolisme lemak serta protein (Winarno, 1995).
Sumber karbohidrat utama dalam makanan adalah serealia dan umbi-umbian. Karbohidrat dalam makanan berupa gula sederhana, heksosa, pentosa maupun karbohidrat dengan berat molekul yang tinggi seperti pati, pektin, selulosa dan lignin. Misalnya kandungan pati dalam beras = 78.3%, jagung = 72.4%, singkong = 34.6% dan talas = 40% (Winarno, 1995). Dalam penelitian ini digunakan pati jagung (maizena) sebagai sumber karbohidrat dalam ransum tikus.
Serat pangan yang ditambahkan dalam ransum tikus berupa serat kasar atau serat tak larut berupa selulosa , dalam ransum standar dan serat larut air berupa karagenan dan FOS dalam ransum perlakuan. Besarnya persentase tambahan karagenan dan FOS dalam ransum perlakuan dihitung berdasarkan persentase kandungan serat dalam prototipe produk, yaitu jeli dengan prebiotik. Konsumsi FOS sebanyak 4 g/hari selama 14 hari dapat memberikan efek bifidogenik dalam usus (Rao, 1999) maka dalam prototipe jeli-prebiotik, dosis FOS tersebut dibagi dalam 3 kali sajian. Dalam 1 cup jeli (80 gram / saji) mengandung serat total sebanyak 1.63 g yang terdiri dari 0.30 g dari serat karagenan (metode enzimatic gravimetri, SUCOFINDO) dan 1.33 g dari FOS (metode AOAC no. 997.08 – Fructan Method) . Komposisi tersebut dikonversikan terhadap kandungan serat (5%) dalam pakan standar tikus.
FOS sebagai komponen pangan prebiotik telah dibuktikan melalui uji model in vitro, studi pada hewan dan uji klinis pada manusia. Semua hasil uji tersebut menunjukkan terjadinya perubahan terhadap jumlah koloni bakteri di kolon yang bermanfaat bagi kesehatan inang. FOS yang tersusun dari 2 atau lebih fruktan dengan ikatan ß(2-1), merupakan jenis ikatan yang tidak dapat dihidrolisis oleh enzim usus mamalia sehingga FOS dapat melewati mulut, lambung dan usus halus tanpa perubahan bentuk atau metabolisme, tetapi FOS akan masuk kolo n dan difermentasi oleh bakteri kolon sebagai prebiotik (Franck, 2000).
Penanganan Hewan Percobaan
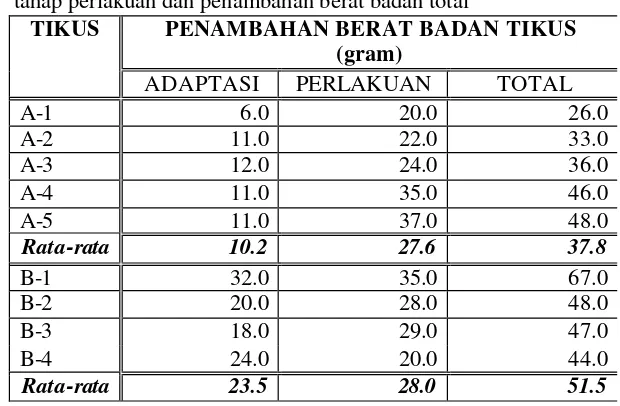
Tikus dalam penelitian ini, dikelompokkan menjadi 2, yaitu kelompok kontrol (kelompok A) dan kelompok perlakuan (kelompok B). Masing-masing kelompok tikus melalui tahap adaptasi selama 7 hari dengan pemberian ransum dan air minum secara ad libitum. Tahap adaptasi ini dilakukan agar masing-masing tikus diharapkan dalam kondis i yang sama sebelum diberi ransum perlakuan untuk penelitian. Selama tahap adaptasi, tikus kelompok A dan kelompok B, masing -masing mengalami peningkatan berat badan, sebesar 10.2 gram dan 23.5 gram (Tabel 3).
Kemudian dilanjutkan dengan tahap perlakuan selama 14 hari, tikus kelompok A diberi ransum kontrol dan air minum secara ad libitum, tikus kelompok B diberi ransum perlakuan dan air minum secara ad libitum. Banyaknya ransum kontrol dengan kandungan serat kasar 5% yang dikonsumsi oleh tikus kelompok A, rata-rata/hari/ekor = 9.0 gram dan peningkatan berat badan rata-rata sebesar 27.8 gram (ditimbang pada akhir tahap perlakuan). Sedangkan tikus kelompok B yang diberi ransum perlakuan dengan tambahan serat larut berupa karagenan 0.92% dan FOS 4.08% (tanpa serat kasar), mengalami peningkatan berat badan rata-rata sebesar 28.0 gram dan banyaknya ransum perlakuan yang dikonsumsi oleh tikus kelompok B/hari (rata-rata) = 7.1 gram.
menunjukkan nilai P>0.05, berarti peningkatan berat badan kedua kelompok tikus tersebut tidak berbeda nyata.
Serat kasar berupa selulosa yang diberikan dalam ransum termasuk dalam jenis serat tak larut air. Serat tersebut akan menyerap air seperti spon, kapasitas menyerap airnya besar sehingga massa feses meningkat dan waktu transit feses dalam kolon menjadi lebih singkat, memberi efek laksatif (Gallaher, 2000 ; Oakenfull, 2001). Sedangkan serat larut air dalam ransum (karagenan dan FOS) menyerap air dengan terbentuknya gel yang merupakan matriks tiga dimensi polisakarida dan serat tersebut akan digunakan seb agai substrat untuk fermentasi oleh mikroflora kolon sehingga pertumbuhan mikroflora kolon meningkat, akibatnya massa feses juga meningkat, waktu transit feses dalam kolon menjadi lebih singkat, berarti serat larut air dapat memberi efek laxative (Gallaher, 2000 ; Oakenfull, 2001). Namun serat larut air karena mampu membentuk gel maka memberi efek penundaan pengosongan lambung, sifat ini tidak dimiliki oleh jenis serat yang lain (Sardesai, 2003). Hal ini menjelaskan data hasil penelitian di atas, bahwa tikus kelompok A dengan ransum kontrol (serat kasar) memakan ransum dalam jumlah yang lebih banyak daripada banyaknya ransum perlakuan (serat larut air : karagenan dan FOS) yang dimakan oleh tikus kelompok B.
Tabel 3. Penambahan berat badan tikus selama penelitian : tahap adaptasi, tahap perlakuan dan penambahan berat badan total
PENAMBAHAN BERAT BADAN TIKUS (gram)
TIKUS
ADAPTASI PERLAKUAN TOTAL
Proliferasi Sel Limfosit
Proliferasi merupakan fungsi fisiologis mendasar limfosit, yaitu proses diferensiasi dan pembelahan (mitosis) sel. Limfosit adalah sel tunggal yang bertahan baik saat dikultur dalam media sederhana dan secara konsisten tetap dalam tahap diam serta tidak membelah sampai ditambahkan mitogen (Zakaria et.al, 2003).
Aktivitas respon imun spesifik terhadap partikel dan senyawa asing yang masuk dalam tubuh dimulai dari proses proliferasi limfosit . Proses ini akan menghasilkan sel-sel dan mediator larut yang bersifat imunokompeten, oleh karena itu aktivitas proliferasi yang dikultur dapat menggambarkan status imun (kekebalan) individu tersebut (Cambier, 1987).
Proliferasi terjadi karena adanya kontak antara membran sel limfosit dengan senyawa antigen atau molekul aktivator yang lain. Antigen atau mitogen merupakan perantara yang mampu menginduksi pembelahan sel, baik sel B maupun sel T dalam persentase yang tinggi (Cambier, 1987).
Di dalam penelitian ini digunakan mitogen Lipopolisakarida (LPS) bakteri untuk mengaktivasi sel B tikus (sistem imun humoral) dan melihat pengaruh konsumsi karagenan-FOS dalam mens timulasi proliferasi limfosit sel B.
Sel B adalah sel yang daapt membentuk immunoglobulin dan merupakan 5-15% dari limfosit dalam sirkulasi darah (Kresno, 1996). Sel B perawan yang terasang oleh antigen, dengan bantuan sel Thelper (Th) akan mengalami proses
perkembangan melalui 2 jalur yaitu berdiferensiasi menjadi sel plasma yang membentuk immunoglobulin (sel B dewasa) dan membelah lalu kembali istirahat sebagai sel B memori. Bila sel B memori terstimulasi dengan antigen yang sama, maka akan mengalami proliferasi lebih cepat membentuk sel plasma untuk membentuk antibodi spesifik (Roitt, 1991). Satu sel plasma dapat mensekresi beribu-ribu molekul antibodi setiap detik (Lanier, 1991)
reader untuk mengukur nilai absorbansi. Semakin tinggi nilai absorbansi maka semakin tinggi pula nilai indeks stimulasi (IS) yang menandakan jumlah sel hidup limfosit pun semakin banyak dan semakin tinggi aktivitasnya (Cambier, 1987).
Hasil penelitian ini menunjukkan bahwa tikus kelompok B yang mendapat ransum tambahan karagenan dan FOS, nilai absorbansi sel limfosit tanpa mitogen lebih besar dari sel limfosit kelompok A (T abel 4), jumlah sel hidup limfosit tikus kelompk B lebih banyak dari tikus kelompok A. Secara statistik t-Test, peningkatan tersebut sangat signifikan (P<0.05).
Tabel 4. Nilai absorbansi sel limfosit tanpa mitogen tikus kelompok A (kontrol) dan tikus kelompok B (perlakuan)
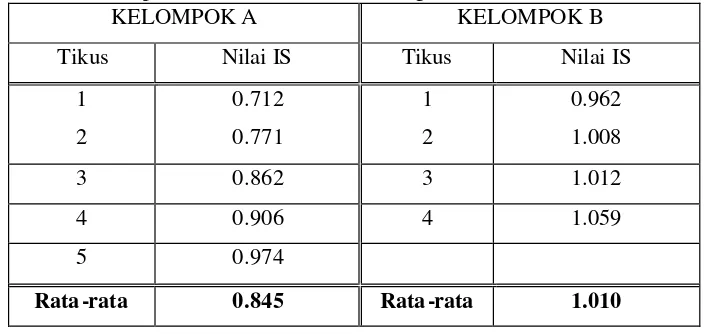
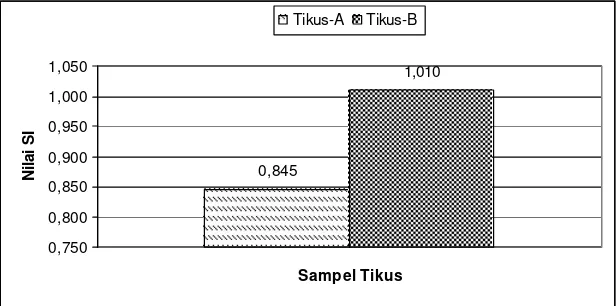
Untuk melihat lebih jauh aktivitas sel limfosit jika ditambahkan mitogen untuk mengaktivasi sel limfosit tipe B (Tabel 5) dan hasilnya menunjukkan bahwa berdasarkan hasil analisis statistik dengan t-Test : Two sample assuming equal variances (P(T=t) one-tail = 0.01), pada tikus kelompok B yang memperoleh ransum tambahan karagenan 0.92% dan FOS 4.08% dengan nilai IS rata-rata sebesar 1.010 menunjukkan peningkatan secara nyata (p<0.05) jika dibandingkan dengan nilai IS rata-rata tikus kelompok A (kontrol) sebesar 0.845. Selisih nilai IS rata-rata antara tikus kelompok A (kontrol) dengan tikus kelompok B (perlakuan) adalah 0.175.
KELOMPOK A KELOMPOK B
Tikus Absorbansi Tikus Absorbansi
1 0.495 1 0.849
2 0.533 2 0.815
3 0.435 3 0.772
4 0.426 4 0.695
5 0.528
Tabel 5. Nilai indeks stimulasi (IS) proliferasi sel B tikus kelompok A (kontrol) dan kelompok B (tambahan ransum karagenan 0.92% dan FOS 4.08%)
KELOMPOK A KELOMPOK B
Tikus Nilai IS Tikus Nilai IS
1 0.712 1 0.962
2 0.771 2 1.008
3 0.862 3 1.012
4 0.906 4 1.059
5 0.974
Rata -rata 0.845 Rata -rata 1.010
Hal ini menunjukkan bahwa pemberian tambahan karagenan sebesar 0.92% dan FOS sebesar 4.08% dalam ransum tikus, memberikan pengaruh secara nyata dalam meningkatkan aktivasi kerja sel limfosit B. Dengan demikian dapat juga menstimulasi sistem kekebalan humoral dan akhirnya dapat meningkatkan kemampuan sel B dalam membentuk antibodi (Cambier, 1987).
0,845
Gambar 7. Nilai Indeks Stimulasi (IS) rata-rata proliferasi sel B tikus kelompok A (kontrol) dan kelompok B (tambahan ransum karagenan 0.92% dan FOS 4.08%)
Bakteri Asam Laktat
Bakteri asam laktat (BAL) yang berperanan penting dalam saluran pencernaan adalah Lactobacillus dan Bifidobacterium. BAL sebagai probiotik mempunyai karakteristik melakukan kolonisasi dalam saluran usus, multiplikasi di saluran usus dan membangun sistem imun (Salminen et.al, 1998). BAL dalam usus akan berfungsi untuk melawan bakteri patogen, menstimulasi imunitas usus-berhubungan dengan jaringan limfoid, innate immunity melawan infeksi, memproduksi vitamin B dan mengurangi jumlah lemak dalam darah (Brassart dan Schiffrin, 2000).
Untuk menstimulasi pertumbuhan bifidobakteri dalam kolon direkomendasikan mengkonsumsi karbohidrat yang tidak tercerna (indigestable carbohydrat) sebagai substrat yang akan difermentasikan oleh BAL, disebut sebagai prebiotik.
Proses fermentasi substrat prebiotik oleh BAL dapat melalui ja lur fermentasi homolaktik dengan hasil utama berupa asam laktat dan jalur fermentasi heterolaktik dengan hasil berupa asam asetat, etanol , karbondioksida, selain asam laktat (Axelsson, 1998). Metabolit fermentasi berupa asam organik (asetat dan laktat) sebagai senyawa anti mikroba, karena asam organik tersebut akan mengkondisikan kolon dalam keadaan asam sehingga dapat membantu untuk mengendalikan pertumbuhan bakteri nonacidophilic secara umum. Selain itu, Lactobacilli dap at menstimulasi respon imunitas inang, baik secara spesifik dan non spesifik, mempunyai peranan penting dalam mekanisme pertahanan mukosal (Brassart dan Schiffrin, 2000).
Permukaan mukosal saluran pencernaan (gastro intestinal) secara luas berhadapan dengan bagian luar lingkungan yang banyak mengandung bakteri patogen dan merupakan tempat pertama terjadinya infeksi pada mamalia. Sistem pertahanan mukosal aluran pencernaan terbagi menjadi 2, yaitu : (1) perbandingan yang berlawanan, antara BAL dengan patogen, (2) respon imun mukosal dari inang, berupa pertahanan non spesifik antigen (Brassart dan Schiffrin, 2000).
Dari hal-hal yang telah disebutkan di atas, maka dapat dikatakan bahwa prebiotik mungkin, meningkatkan pertahanan mukosal dan mencegah infeksi usus dengan (1) memodifikasi komposisi atau aktivitas metabolik mikroflora usus sehingga jumlah koloni BAL lebih besar daripada jumlah koloni bakteri patogen dan (2) mengatur respon imun inang untuk melawan bakteri patogen (Brassart dan Schiffrin, 2000).
Tabel 6. Jumlah koloni BAL dalam kolon transerval tikus kelompok A (kontrol) dan kelompok B (tambahan ransum karagenan 0.92% dan FOS 4.08%)
Untuk kolonisasi Bifidobakteri harus memenuhi 2 syarat, yaitu (1) harus dapat melakukan multiplikasi , hal ini tergantung pada substrat yang tersedia sebagai nutrisi dan kondisi potensial redoks untuk pertumbuhan, dan (2) harus mampu melekat atau berada dalam kolon dan menghindarkan aksi yang mendorong lepas dari mukus (Ballongue, 1998). Syarat akan nutrisi, dalam penelitian ini, dipenuhi dengan adanya karagenan dan FOS yang dapat dicerna oleh mikroflora usus hingga 95 – 100% (Woods dan Gorbach, 2001). Namun tahap inkubasi dalam penelitian ini dengan kondisi aerob menyebabkan BAL dan bifidobakteri yang bersifat anaerob tidak dapat tumbuh secara optimal, yang dapat hidup dan tumbuh hanya strain BAL serta bifidobakteri yang bersifat aerotoleran (Ballongue, 1998), sehingga kolonisasi BAL dalam kolon tikus dengan tambahan nutrisi prebiotik dalam ransum, tidak berbeda nyata dengan kolonisasi BAL dalam kolon tikus tanpa tambahan nutrisi prebiotik dalam ransumnya.
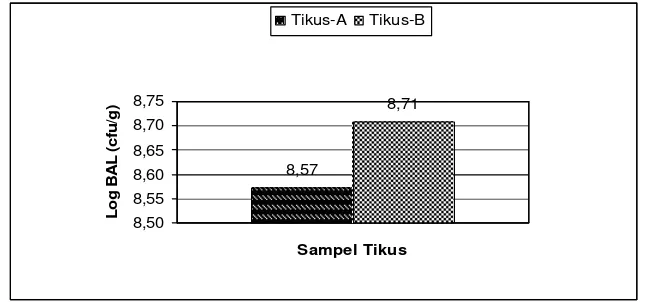
8,57
Gambar 8. Jumlah rata-rata BAL dalam kolon tikus kelompok A (kontrol) dan tikus kelompok B (tambahan ransum karagenan 0.92% dan FOS 4.08%)
KELOMPOK A KELOMPOK B
Tiga tipe respon bifidobakteri dalam perubahan dari kondisi anaerob menjadi kondisi aerob (Ballongue, 1998) yaitu, (1) pertumbuhan aerob tanpa akumulasi hidrogen peroksida : B. bifidum relatif aerotoleran , membentuk sedikit hidrogen peroksida dari oksidasi NADH ; (2) Pertumbuhan terbatas dengan akumulasi hidrogen p eroksida : akumulasi hidrogen peroksida akan bersifat toksik terhadap enzim utama yang berperan dalam metabolisme gula oleh bifidobakteri, yaitu fructose-6-phosphate phosphoketolase (F6PPK) ; dan (3) tidak ada pertumbuhan tanpa akumulasi hidrogen peroksida : strain bifidobakteri hanya membutuhkan sedikit potensial redoks untuk pertumbuhan dan fermentasi.
Absorbsi endogenous oksigen oleh bifidobakteri , berhubungan dengan ketersediaan NADH oksidase, akan berperan, bahkan saat tidak ada glukosa dan muncul secara langsung tergantung pada jumlah polisakarida yang terakumulasi dalam sel. Seluruh strain akan mengalami akumulasi H2O2 dan akan direduksi
oleh enzim NADH-peroksidase, yang aktivitasnya beragam tergantung strain. Strain yang sangat sensitif terhadap oksigen, aktivitas NADH -peroksidase lemah, akibatnya terjadi akumulasi H2O2 yang bersifat toksik (Gambar 9). Kemungkinan
lain terjadinya penghambatan multiplikasi karena adanya oksigen aktif seperti superoksida (Ballongue, 1998).
Mekanisme BAL sebagai probiotik dalam meningkatkan sekresi antibodi belum diketahui secara pasti meskipun sudah banyak teori yang diajukan, dan studi yang dilakukan dengan B. longum, diimplan ke dalam tubuh tikus yang sebelumnya telah diimplan E. coli dengan dosis sub -lethal (E.coli dapat ditemukan dalam organ hati, limfa, ginjal dan paru-paru dalam tubuh tikus tersebut). Setelah 1 minggu, tikus tersebut dapat bertahan hidup dan E. coli tidak ditemukan dalam organ hati, limfa, ginjal dan paru -paru, meskipun masih ditemukan E. coli dalam jumlah yang banyak dalam kolon tikus tersebut. B.longum mampu memberi efek imunitas humoral dan imunitas seluler (Yamazaki et.al, 1985).
Menurut Ouwehand et.al (1999), BAL menstimulasi sistem imun melalui peptidoglikan dalam dinding selnya. Glukan yang merupakan komponen dinding sel probiotik, sebagai imunostimulan yang potensial. Glukan akan menstimulasi makrofag untuk menghasilkan interleukin sehingga aktivitas proliferasi sel limfosit akan meningkat. Kemudian sel limfosit akan berdiferensiasi menjadi sel B dan sel T, sel B akan menghasilkan antibodi.
Studi lain yang mempelajari mekanisme BAL terhadap aktivitas anti tumor pada manusia yang mengkonsumsi Lactobacillus casei secara oral, menunjukkan peningkatan sistem imun. Sampel limfosit dari darah peripheral menunjukkan peningkatan sel Thelper (Th) dan sel NK, sedangkan sel Tsupresor (Ts)menurun
(Isolauri et.al, 1998). Sel Th berperan dalam imunitas seluler dan membantu sel B dalam produksi antibodi (Roitt, 1991). Sel NK berfungsi sebagai sel efektor sitolitik yang dapat menyerang dan melisis sel target, yaitu sel abnormal, yaitu sel neoplastik (tumor dan tumor ganas), sel terinfeksi patogen seluler (virus dan bakteri) dan sel normal yang tidak dewasa (immature cell). Penurunan sel Ts sangat penting bagi peningkatan aktivitas sel Th dan sel B karena sel Ts berperan menekan aktivitas sel B dan sel T yang lain (Roitt, 1991).
lain (selulosa, wheat bran, oat bran) yang diberikan pada tikus dan ALRP diukur pada cecum tikus tersebut (Gallaher, 2000).
Absorbsi ALRP dari lumen ke mesentrik dan portal darah, akan meningkat sebanding dengan peningkatan produksi ALRP dari fermentasi polisakarida dengan dinding sel yang larut air akan mendukung hasil ALRP yang lebih banyak daripada dinding sel tak larut air , seperti lignin atau selulosa (Lewis et.al, 2001).
Teori tersebut diatas menjelaskan hasil penelitian yang memberikan peningkatan signifikan nilai IS proliferasi sel limfosit tipe B tikus kelompok B (tambahan karagenan 0.92% dan FOS 4.08% dalam ransumnya), walaupun peningkatan jumlah koloni BAL dalam kolon tikus kelompok B tidak berbeda nyata (Tabel 7). Tersedianya substrat FOS yang difermentasi oleh BAL dan menghasilkan metabolit ALRP, diduga ALRP berperan sebagai stimulator sistem imun dan harus diukur seberapa banyak ALRP yang dihasilkan sehingga dapat meningkatkan sistem imunitas.
Tabel 7. Jumlah rata-rata koloni BAL dalam kolon tikus dan nilai IS rata-rata sel B limfosit tikus
Tikus Parameter
kelompok A kelompok B BAL (log CFU/g)
rata-rata
8.57a 8.71a
Nilai IS rata-rata Sel B Limfosit
0.845b 1.010b
SIMPULAN DAN SARAN
Simpulan
1. Penambahan karagenan 0.92%dan FOS 4.08% dalam ransum tikus tidak menaikkan secara signifikan jumlah koloni BAL dalam kolon tikus (P>0.05). 2. Peningkatan nilai Indeks Stimulasi (IS) proliferasi sel B limfosit yang berbeda
nyata (P<0.05) pada tikus dengan ransum yang mengandung karagenan 0.92% dan FOS 4.08%.
Saran
1. Perlu dilakukan studi pengukuran terhadap ALRP yang merupakan hasil metabolit fermentasi serat larut air sebagai prebiotik oleh BAL dan mekanisme ALRP dalam meningkatkan respon imunitas.
DAFTAR PUSTAKA
Axelsson, L. 1998. Lactic Acid Bacteria : Classification and Physiology. Dalam : Salminen, S. dan von Wright, A. (eds.). Lactic Acid Bacteria : Microbiology and Functional Aspects. 2nd ed. Marcel Dekker, Inc. New Yo rk.
Ballongue, J. 1998. Bifidobacteria and Probiotic Action. . Dalam : Salminen, S. dan von Wright, A. (eds.). Lactic Acid Bacteria : Microbiology and Functional Aspects. 2nd ed. Marcel Dekker, Inc. New York.
Belitz, H. D. dan Grosh, W. 1999. Food Chemistry. Springer Verlag Berlin Heidelberg. New York.
Boileau, T.W.M., A.C. More dan J.W Erdman Jr. 1999. Carotenoids and Vitamin A. Dalam : Papas, A.M. (eds.). Antioxidants Status, Diet, Nutrition and Health. CRC Press. London.
Brassart, D. dan E. J. Schiffrin. 2000. Pre- and Probiotics. Dalam : Schmild, M.K. dan T. P. Labuza. (eds.). Essentials of Functional Foods. An Aspen Publication, Gaithersburg, Maryland.
Cambier, J. C. 1987. B-Lymphocyte Differentiation. CRC Press, Inc. Boca Raton. Florida.
Fardiaz, S. 1989. Mikrobiologi Pangan. Bogor : PAU Pangan dan Gizi, IPB. Franck, A. M. E. 2000. Inulin and Oligofructose. Dalam : Gibson, G. dan F.
Angus. (eds.). LFRA Ingredients Handbook : Prebiotics and Probiotics. LFRA Limited. Randalls Road, Leathershead, England.
Fresney, R. I. (eds.). 1994. Animal cell culture : a practical approach. IRL Press. Oxford, Washington D.C.
Gallaher, D .D. 2000. Dietary Fiber and Its Physiological Effects. . Dalam : Schmild, M.K. dan T. P. Labuza. (eds.). Essentials of Functio nal Foods. An Aspen Publication, Gaithersburg, Maryland.
Gibson, G. 2000. Introduction. Dalam : Gibson, G. dan F. Angus. (eds.). LFRA Ingredients Handbook : Prebiotics and Probiotics. LFRA Limited. Randalls Road, Leathershead, England.
Imerson, A. 2000. Carrageenan. Dalam : Phillips, G. O. dan P. A. Williams. (eds.). Handbook of Hydrocolloids. Woodhead Publishing Ltd. England. Isolauri, E., E. Salminen, dan S. Salminen. 1998. Lactic Acid Bacteria and