SKRIPSI
STUDI KARAKTERISTIK FISIKOKIMIA DAN KAPASITAS ANTIOKSIDAN
TEPUNG TEMPE KACANG KOMAK (
Lablab purpureus
(L.) Sweet)
SRI HARNANI
F24053076
2009
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
STUDI KARAKTERISTIK FISIKOKIMIA DAN KAPASITAS ANTIOKSIDAN
TEPUNG TEMPE KACANG KOMAK (
Lablab purpureus
(L
.
) Sweet)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pertanian
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
SRI HARNANI
F24053076
2009
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
FAKULTAS TEKNOLOGI PERTANIAN
STUDI KARAKTERISTIK FISIKOKIMIA DAN KAPASITAS ANTIOKSIDAN
TEPUNG TEMPE KACANG KOMAK (
Lablab purpureus
(L) Sweet)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pertanian
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
SRI HARNANI
F24053076
Dilahirkan pada tanggal 29 November 1986
Di Medan, Sumatera Utara
Tanggal lulus: Mei 2009
Menyetujui,
Bogor, Mei 2009
Dr. Nugraha Edhi Suyatma, STP, DEA Arif Hartoyo, STP, Msi
Dosen Pembimbing I Dosen Pembimbing II
Mengetahui,
Dr. Ir. Dahrul Syah, MSc.
Sri Harnani. F24053076. Studi Karakteristik Fisikokimia dan Kapasitas Antioksidan Tepung Tempe Kacang Komak (Lablab purpureus (L.) Sweet). Pembimbing: Dr. Nugraha Edhi Suyatma, STP, DEA dan Arif Hartoyo, STP, M.Si. 2009.
RINGKASAN
Kedelai merupakan biji-bijian yang memiliki banyak manfaat dan khasiat terhadap kesehatan manusia. Keistimewaan tersebut menjadikan permintaan konsumen terhadap kedelai sangat tinggi, sedangkan produksi dalam negeri masih rendah. Untuk memenuhi permintaan tersebut, pemerintah melakukan impor kedelai dalam jumlah besar. Oleh karena itu, diperlukan eksplorasi terhadap kacang-kacangan lain sebagai alternatif pengganti kedelai yang salah satunya adalah kacang komak.
Penelitian ini bertujuan mengetahui karakteristik fisikokimia, nutrisi, dan kapasitas antioksidan tepung tempe kacang komak (Lablab purpureus (L.) Sweet) serta potensi tempe kacang komak sebagai pangan fungsional. Penelitian ini terdiri atas penelitian pendahuluan meliputi pembuatan tempe dan tepung tempe kacang komak dan penelitian utama meliputi analisis proksimat, analisis sifat fisik, analisis komponen karbohidrat, dan analisis kapasitas antioksidan tepung tempe kacang komak.
Hasil analisis proksimat tepung tempe kacang komak menunjukkan kadar protein sebesar 30.62%, lemak 0.97%, karbohidrat 67.43%, air 9.43%, dan abu 0.98%; sedangkan hasil analisis proksimat tepung kacang komak sebagai kontrol yaitu kadar protein sebesar 21.81%, lemak 0.64%, karbohidrat 73.33%, air 13.06%, dan abu 4.05%. Kadar lemak dan protein tepung tempe kacang komak lebih tinggi daripada tepung kacang komak (p< 0.05). Sedangkan kadar karbohidrat, air, dan abu tepung tempe kacang komak lebih rendah daripada tepung kacang komak (p< 0.05).
Tepung tempe kacang komak mengandung 5.03% pati, 10.54% serat kasar, 21.27% serat pangan (17.87% serat pangan tidak larut dan 3.90% serat pangan terlarut), dan 22.10% pati resisten. Sedangkan tepung kacang komak mengandung 14.79% pati, 15.85% serat kasar, 27.20% serat pangan (23.30% serat pangan tidak larut dan 3.90% serat pangan terlarut), dan 10.32% pati resisten. Kadar pati dan serat pangan mengalami penurunan karena proses pengolahan kacang komak menjadi tempe. Proses pengolahan kacang komak menjadi tempe juga dapat meningkatkan nilai pati resisten.
tepung tempe kacang komak tidak berbeda nyata dari tepung kacang komak (p< 0.05).
Hasil pengukuran kapasitas antioksidan dengan metode DPPH tepung tempe kacang komak adalah ekstrak air sebesar 964.50, etil asetat sebesar 143.00, dan kloroform-metanol sebesar 530.20 AEAC. Sedangkan hasil pengukuran pada tepung kacang komak yaitu ekstrak air sebesar 206.70, etil asetat sebesar 109.20 dan kloroform-metanol sebesar 28.60 AEAC. Tepung tempe kacang komak memiliki kapasitas antioksidan yang lebih tinggi daripada tepung kacang komak pada ketiga ekstrak (p< 0.05).
Hasil pengukuran kapasitas antioksidan dengan metode kemampuan mereduksi (metode Baku) dari tepung tempe kacang komak adalah ekstrak air sebesar 0.52, etil asetat sebesar 0.27, dan kloroform-metanol sebesar 0.31. Hasil pengukuran pada tepung kacang komak adalah ekstrak air sebesar 0.31, ekstrak etil asetat sebesar 0.19, dan ekstrak kloroform sebesar 0.20. Kapasitas antioksidan tepung tempe kacang komak lebih tinggi dibandingkan tepung kacang komak (p< 0.05) pada ketiga ekstrak.
Hasil pengukuran kadar total fenol tepung tempe kacang komak adalah ekstrak air sebesar 3251.10 ppm, ekstrak etil asetat sebesar 1223.33 ppm, dan ekstrak kloroform-metanol sebesar 3174.21 ppm. Sedangkan hasil pengukuran total fenol pada tepung kacang komak adalah ekstrak air sebesar 502.95 ppm, ekstrak etil asetat sebesar 801.91 ppm, dan ekstrak kloroform-metanol sebesar 673.33 ppm. Total fenol tepung tempe kacang komak lebih tinggi dibandingkan tepung kacang komak (p<0.05) pada ketiga ekstrak.
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 29 November 1986 di Medan, Sumatera Utara. Penulis adalah puteri kedua dari pasangan Bapak Suroso dan Ibu Syafridah.
Penulis menempuh pendidikan di SD Negeri 060791 Medan Area pada tahun 1993-1999, pendidikan sekolah lanjutan tingkat pertama di SLTP Negeri 23 Medan pada tahun 1999-2000 kemudian pindah di SLTP Negeri 19 Pekanbaru pada tahun 2000-2002, dan pendidikan sekolah lanjutan tingkat atas di SMU Negeri 1 Pekanbaru pada tahun 2002-2005. Pada tahun 2004, penulis melanjutkan pendidikan tinggi di Institut Pertanian Bogor (IPB) pada Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian yang diterima melalui jalur USMI.
Selama kuliah di Departemen Ilmu dan Teknologi Pangan, penulis terlibat dalam organisasi Badan Eksekutif Mahasiswa KM pada Badan Struktural dari Divisi Sosling pada periode 2005-2006. Selain itu, penulis juga terlibat dalam organisasi DKM Al Fath Fateta pada periode 2007-2009. Penulis juga aktif dalam beberapa kegiatan kepanitiaan seperti Indonesian Food Expo dan Open House Mahasiswa Baru IPB.
KATA PENGANTAR
Penulis mengucapkan puji syukur kehadirat Allah SWT atas segala rahmat dan kasih sayang-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini adalah tempe kacang komak dengan judul “Studi Karakteristik Fisikokimia dan Kapasitas Antioksidan Tepung Tempe Kacang Komak (Lablab purpureus (L.) Sweet)”.
Penulisan skripsi ini tidak terlepas dari bantuan banyak pihak. Penulis mengucapkan terima kasih dan penghargaan yang sebesar-besarnya kepada:
1. Bapak Dr. Nugraha Edhi Suyatma, STP, DEA sebagai dosen pembimbing I, atas segala bimbingan, nasehat, dan arahan yang telah diberikan kepada penulis selama perkuliahan serta dalam pelaksanaan penelitian dan penulisan..
2. Arif Hartoyo, STP, M.Si. sebagai dosen pembimbing II, atas segala bimbingan, nasehat, dan arahan yang telah diberikan kepada penulis selama pelaksanaan penelitian dan penulisan.
3. Dra. Suliantari, MS sebagai dosen penguji atas kesediaannya menjadi dosen penguji dan atas saran serta masukannya kepada penulis.
4. Orang tua penulis (Bapak Suroso dan Ibi Syafridah) serta kakak dan kedua adikku.
5. Rekan-rekanku di tim kacang komak (nita, ella, dan anggun) atas kerjasama dan bantuannya selama ini.
6. Sahabat-sahabatku, Lina, Oby, Ze’, Retno, Ike, Mike, Susan, Galih, Fitri, Reriel, Siska, Icha, dan temen-temen ITP lainnya, atas persahabatannya yang indah selama ini.
7. Teti, Wiwi, Pita, Rizma, Tiwi, Mbak Yuyun, Wening, Dini, Sulis, Eti, Nada, Merry, dan seluruh penghuni Pondok Sabrina serta ibu kost atas segala dukungan dan bantuannya.
8. Teman-teman di DKM Al Fath, Yeni, Nana, T Neng, atas semua dukungan, bantuan, serta ilmu yang sangat berguna bagi penulis.
Pak Taufik, terima kasih atas bantuan, saran, dan kerja samanya selama penelitian
10. Dosen-dosen, staff, dan karyawan di Departemen Ilmu dan Teknologi Pertanian yang telah memberikan banyak ilmu yang berguna bagi penulis.
11. Seluruh mahasiswa ITP angkatan 40, 41, dan 42 atas segala dukungan dan kerjasamanya.
12. Dan semua pihak yang telah membantu yang tidak bisa disebutkan satu persatu.
Penulis menyadari bahwa skripsi ini memiliki banyak kekurangan. Oleh karena itu, penulis mengharapkan saran dan kritik untuk perbaikan selanjutnya. Semoga tulisan ini bermanfaat bagi pembaca dan menjadi amal shalih bagi penulis
Bogor, Mei 2009
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN ... 3
II. TINJAUAN PUSTAKA ... 4
A. KACANG KOMAK ... 4
B. FERMENTASI ... 6
C. KARAKTERISTIK FISIKOKIMIA ... 9
1. Warna ... 9
2. Densitas Kamba ... 10
3. Aktivitas Air ... 11
4. Serat Pangan ... 13
5. Pati ... 14
6. Pati Resisten ... 16
D. KAPASITAS ANTIOKSIDAN ... 17
E. KOMPONEN FENOLIK ... 19
III. METODOLOGI PENELITIAN ... 22
A. BAHAN DAN ALAT ... 22
B. METODE PENELITIAN ... 22
IV. HASIL DAN PEMBAHASAN ... 35
A. TEMPE KACANG KOMAK ... 35
B. TEPUNG TEMPE KACANG KOMAK ... 37
C. KARAKTERISTIK FISIKOKIMIA TEPUNG ... 39
1. Proksimat Tepung Tempe Kacang Komak……… 39
a. Kadar Protein ... 39
c. Kadar Karbohidrat ... 40
d. Kadar Air ... 41
e. Kadar Abu ... 41
2. Sifat Fisik Tepung Tempe Kacang Komak ……… 42
a. Derajat Kecerahan Warna ... 42
b. Aktivitas Air ... 44
c. Indeks Penyerapan Air (IPA) dan Indeks Kelarutan Air (IKA) ... 44
d. Densitas Kamba ... 45
3. Komponen Karbohidrat Tepung Tempe Kacang Komak …. 46 a. Total Pati ... 46
b. Serat Pangan ... 47
c. Pati Resisten ... 48
D. KAPASITAS ANTIOKSIDAN TEPUNG TEMPE KACANG KOMAK... 49
1. Kapasitas Antioksidan Tepung Tempe kacang Komak dengan Metode DPPH ……….. 49
2. Kapasitas Antioksidan Tepung Tempe kacang Komak dengan Metode Baku ……… 51
3. Total Fenol ………... 52
V. KESIMPULAN DAN SARAN ... 54
A. KESIMPULAN ... 54
B. SARAN ... 54
DAFTAR PUSTAKA ... 55
SKRIPSI
STUDI KARAKTERISTIK FISIKOKIMIA DAN KAPASITAS ANTIOKSIDAN
TEPUNG TEMPE KACANG KOMAK (
Lablab purpureus
(L.) Sweet)
SRI HARNANI
F24053076
2009
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
STUDI KARAKTERISTIK FISIKOKIMIA DAN KAPASITAS ANTIOKSIDAN
TEPUNG TEMPE KACANG KOMAK (
Lablab purpureus
(L
.
) Sweet)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pertanian
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
SRI HARNANI
F24053076
2009
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
FAKULTAS TEKNOLOGI PERTANIAN
STUDI KARAKTERISTIK FISIKOKIMIA DAN KAPASITAS ANTIOKSIDAN
TEPUNG TEMPE KACANG KOMAK (
Lablab purpureus
(L) Sweet)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pertanian
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
SRI HARNANI
F24053076
Dilahirkan pada tanggal 29 November 1986
Di Medan, Sumatera Utara
Tanggal lulus: Mei 2009
Menyetujui,
Bogor, Mei 2009
Dr. Nugraha Edhi Suyatma, STP, DEA Arif Hartoyo, STP, Msi
Dosen Pembimbing I Dosen Pembimbing II
Mengetahui,
Dr. Ir. Dahrul Syah, MSc.
Sri Harnani. F24053076. Studi Karakteristik Fisikokimia dan Kapasitas Antioksidan Tepung Tempe Kacang Komak (Lablab purpureus (L.) Sweet). Pembimbing: Dr. Nugraha Edhi Suyatma, STP, DEA dan Arif Hartoyo, STP, M.Si. 2009.
RINGKASAN
Kedelai merupakan biji-bijian yang memiliki banyak manfaat dan khasiat terhadap kesehatan manusia. Keistimewaan tersebut menjadikan permintaan konsumen terhadap kedelai sangat tinggi, sedangkan produksi dalam negeri masih rendah. Untuk memenuhi permintaan tersebut, pemerintah melakukan impor kedelai dalam jumlah besar. Oleh karena itu, diperlukan eksplorasi terhadap kacang-kacangan lain sebagai alternatif pengganti kedelai yang salah satunya adalah kacang komak.
Penelitian ini bertujuan mengetahui karakteristik fisikokimia, nutrisi, dan kapasitas antioksidan tepung tempe kacang komak (Lablab purpureus (L.) Sweet) serta potensi tempe kacang komak sebagai pangan fungsional. Penelitian ini terdiri atas penelitian pendahuluan meliputi pembuatan tempe dan tepung tempe kacang komak dan penelitian utama meliputi analisis proksimat, analisis sifat fisik, analisis komponen karbohidrat, dan analisis kapasitas antioksidan tepung tempe kacang komak.
Hasil analisis proksimat tepung tempe kacang komak menunjukkan kadar protein sebesar 30.62%, lemak 0.97%, karbohidrat 67.43%, air 9.43%, dan abu 0.98%; sedangkan hasil analisis proksimat tepung kacang komak sebagai kontrol yaitu kadar protein sebesar 21.81%, lemak 0.64%, karbohidrat 73.33%, air 13.06%, dan abu 4.05%. Kadar lemak dan protein tepung tempe kacang komak lebih tinggi daripada tepung kacang komak (p< 0.05). Sedangkan kadar karbohidrat, air, dan abu tepung tempe kacang komak lebih rendah daripada tepung kacang komak (p< 0.05).
Tepung tempe kacang komak mengandung 5.03% pati, 10.54% serat kasar, 21.27% serat pangan (17.87% serat pangan tidak larut dan 3.90% serat pangan terlarut), dan 22.10% pati resisten. Sedangkan tepung kacang komak mengandung 14.79% pati, 15.85% serat kasar, 27.20% serat pangan (23.30% serat pangan tidak larut dan 3.90% serat pangan terlarut), dan 10.32% pati resisten. Kadar pati dan serat pangan mengalami penurunan karena proses pengolahan kacang komak menjadi tempe. Proses pengolahan kacang komak menjadi tempe juga dapat meningkatkan nilai pati resisten.
tepung tempe kacang komak tidak berbeda nyata dari tepung kacang komak (p< 0.05).
Hasil pengukuran kapasitas antioksidan dengan metode DPPH tepung tempe kacang komak adalah ekstrak air sebesar 964.50, etil asetat sebesar 143.00, dan kloroform-metanol sebesar 530.20 AEAC. Sedangkan hasil pengukuran pada tepung kacang komak yaitu ekstrak air sebesar 206.70, etil asetat sebesar 109.20 dan kloroform-metanol sebesar 28.60 AEAC. Tepung tempe kacang komak memiliki kapasitas antioksidan yang lebih tinggi daripada tepung kacang komak pada ketiga ekstrak (p< 0.05).
Hasil pengukuran kapasitas antioksidan dengan metode kemampuan mereduksi (metode Baku) dari tepung tempe kacang komak adalah ekstrak air sebesar 0.52, etil asetat sebesar 0.27, dan kloroform-metanol sebesar 0.31. Hasil pengukuran pada tepung kacang komak adalah ekstrak air sebesar 0.31, ekstrak etil asetat sebesar 0.19, dan ekstrak kloroform sebesar 0.20. Kapasitas antioksidan tepung tempe kacang komak lebih tinggi dibandingkan tepung kacang komak (p< 0.05) pada ketiga ekstrak.
Hasil pengukuran kadar total fenol tepung tempe kacang komak adalah ekstrak air sebesar 3251.10 ppm, ekstrak etil asetat sebesar 1223.33 ppm, dan ekstrak kloroform-metanol sebesar 3174.21 ppm. Sedangkan hasil pengukuran total fenol pada tepung kacang komak adalah ekstrak air sebesar 502.95 ppm, ekstrak etil asetat sebesar 801.91 ppm, dan ekstrak kloroform-metanol sebesar 673.33 ppm. Total fenol tepung tempe kacang komak lebih tinggi dibandingkan tepung kacang komak (p<0.05) pada ketiga ekstrak.
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 29 November 1986 di Medan, Sumatera Utara. Penulis adalah puteri kedua dari pasangan Bapak Suroso dan Ibu Syafridah.
Penulis menempuh pendidikan di SD Negeri 060791 Medan Area pada tahun 1993-1999, pendidikan sekolah lanjutan tingkat pertama di SLTP Negeri 23 Medan pada tahun 1999-2000 kemudian pindah di SLTP Negeri 19 Pekanbaru pada tahun 2000-2002, dan pendidikan sekolah lanjutan tingkat atas di SMU Negeri 1 Pekanbaru pada tahun 2002-2005. Pada tahun 2004, penulis melanjutkan pendidikan tinggi di Institut Pertanian Bogor (IPB) pada Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian yang diterima melalui jalur USMI.
Selama kuliah di Departemen Ilmu dan Teknologi Pangan, penulis terlibat dalam organisasi Badan Eksekutif Mahasiswa KM pada Badan Struktural dari Divisi Sosling pada periode 2005-2006. Selain itu, penulis juga terlibat dalam organisasi DKM Al Fath Fateta pada periode 2007-2009. Penulis juga aktif dalam beberapa kegiatan kepanitiaan seperti Indonesian Food Expo dan Open House Mahasiswa Baru IPB.
KATA PENGANTAR
Penulis mengucapkan puji syukur kehadirat Allah SWT atas segala rahmat dan kasih sayang-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini adalah tempe kacang komak dengan judul “Studi Karakteristik Fisikokimia dan Kapasitas Antioksidan Tepung Tempe Kacang Komak (Lablab purpureus (L.) Sweet)”.
Penulisan skripsi ini tidak terlepas dari bantuan banyak pihak. Penulis mengucapkan terima kasih dan penghargaan yang sebesar-besarnya kepada:
1. Bapak Dr. Nugraha Edhi Suyatma, STP, DEA sebagai dosen pembimbing I, atas segala bimbingan, nasehat, dan arahan yang telah diberikan kepada penulis selama perkuliahan serta dalam pelaksanaan penelitian dan penulisan..
2. Arif Hartoyo, STP, M.Si. sebagai dosen pembimbing II, atas segala bimbingan, nasehat, dan arahan yang telah diberikan kepada penulis selama pelaksanaan penelitian dan penulisan.
3. Dra. Suliantari, MS sebagai dosen penguji atas kesediaannya menjadi dosen penguji dan atas saran serta masukannya kepada penulis.
4. Orang tua penulis (Bapak Suroso dan Ibi Syafridah) serta kakak dan kedua adikku.
5. Rekan-rekanku di tim kacang komak (nita, ella, dan anggun) atas kerjasama dan bantuannya selama ini.
6. Sahabat-sahabatku, Lina, Oby, Ze’, Retno, Ike, Mike, Susan, Galih, Fitri, Reriel, Siska, Icha, dan temen-temen ITP lainnya, atas persahabatannya yang indah selama ini.
7. Teti, Wiwi, Pita, Rizma, Tiwi, Mbak Yuyun, Wening, Dini, Sulis, Eti, Nada, Merry, dan seluruh penghuni Pondok Sabrina serta ibu kost atas segala dukungan dan bantuannya.
8. Teman-teman di DKM Al Fath, Yeni, Nana, T Neng, atas semua dukungan, bantuan, serta ilmu yang sangat berguna bagi penulis.
Pak Taufik, terima kasih atas bantuan, saran, dan kerja samanya selama penelitian
10. Dosen-dosen, staff, dan karyawan di Departemen Ilmu dan Teknologi Pertanian yang telah memberikan banyak ilmu yang berguna bagi penulis.
11. Seluruh mahasiswa ITP angkatan 40, 41, dan 42 atas segala dukungan dan kerjasamanya.
12. Dan semua pihak yang telah membantu yang tidak bisa disebutkan satu persatu.
Penulis menyadari bahwa skripsi ini memiliki banyak kekurangan. Oleh karena itu, penulis mengharapkan saran dan kritik untuk perbaikan selanjutnya. Semoga tulisan ini bermanfaat bagi pembaca dan menjadi amal shalih bagi penulis
Bogor, Mei 2009
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN ... 3
II. TINJAUAN PUSTAKA ... 4
A. KACANG KOMAK ... 4
B. FERMENTASI ... 6
C. KARAKTERISTIK FISIKOKIMIA ... 9
1. Warna ... 9
2. Densitas Kamba ... 10
3. Aktivitas Air ... 11
4. Serat Pangan ... 13
5. Pati ... 14
6. Pati Resisten ... 16
D. KAPASITAS ANTIOKSIDAN ... 17
E. KOMPONEN FENOLIK ... 19
III. METODOLOGI PENELITIAN ... 22
A. BAHAN DAN ALAT ... 22
B. METODE PENELITIAN ... 22
IV. HASIL DAN PEMBAHASAN ... 35
A. TEMPE KACANG KOMAK ... 35
B. TEPUNG TEMPE KACANG KOMAK ... 37
C. KARAKTERISTIK FISIKOKIMIA TEPUNG ... 39
1. Proksimat Tepung Tempe Kacang Komak……… 39
a. Kadar Protein ... 39
c. Kadar Karbohidrat ... 40
d. Kadar Air ... 41
e. Kadar Abu ... 41
2. Sifat Fisik Tepung Tempe Kacang Komak ……… 42
a. Derajat Kecerahan Warna ... 42
b. Aktivitas Air ... 44
c. Indeks Penyerapan Air (IPA) dan Indeks Kelarutan Air (IKA) ... 44
d. Densitas Kamba ... 45
3. Komponen Karbohidrat Tepung Tempe Kacang Komak …. 46 a. Total Pati ... 46
b. Serat Pangan ... 47
c. Pati Resisten ... 48
D. KAPASITAS ANTIOKSIDAN TEPUNG TEMPE KACANG KOMAK... 49
1. Kapasitas Antioksidan Tepung Tempe kacang Komak dengan Metode DPPH ……….. 49
2. Kapasitas Antioksidan Tepung Tempe kacang Komak dengan Metode Baku ……… 51
3. Total Fenol ………... 52
V. KESIMPULAN DAN SARAN ... 54
A. KESIMPULAN ... 54
B. SARAN ... 54
DAFTAR PUSTAKA ... 55
DAFTAR TABEL
Halaman Tabel 1. Komposisi Kimia Kacang Komak... 6 Tabel 2. Komposisi Asam Amino Kacang Komak... 6 Tabel 3. Hasil Analisis Proksimat Tepung Kacang Komak dan Tepung
Tempe Kacang Komak... 39 Tabel 4. Karakteristik Fisik Tepung Kacang Komak dan Tepung Tempe
Kacang Komak... 42 Tabel 5. Komponen Karbohidrat Tepung Kacang Komak dan Tepung
DAFTAR GAMBAR
Halaman Gambar 1. Visualisasi Tanaman Kacang Komak (Lablab purpureus
(L.) Sweet) ... 4 Gambar 2. Kacang Komak (Lablab purpureus (L.) Sweet)... 5 Gambar 3. Hubungan Kecepatan Reaksi dengan awBahan Pangan
(Labuza,1971)... ... 13 Gambar 4. Struktur kimia komponen fenolik... 19 Gambar 5. Radikal fenoksi yang mengalami resonansi delokalisasi elektron.... 20 Gambar 6. Skema pembuatan tempe kacang komak... 23 Gambar 7. Skema pembuatan tepung tempe kacang komak... 24 Gambar 8. Visualisasi Tempe pada Percobaan Kedua... 35 Gambar 9. Visualisasi Tempe Kacang Komak pada Percobaan Ketiga... 36 Gambar 10. Visualisasi Tempe Kacang Komak... 37 Gambar 11. Visualisasi Tepung Tempe Kacang Komak ... 38 Gambar 12. Visualisasi tepung kacang komak (a) dan tepung tempe
kacang komak (b) ... 43 Gambar 13. Kapasitas Antioksidan dengan Metode DPPH... 50 Gambar 14. Perbandingan Kapasitas Antioksidan dengan Metode Baku... 51 Gambar 15. Perbandingan Total Fenol dari Tiga Ekstrak pada Tepung
DAFTAR LAMPIRAN
Halaman Lampiran 1. Penentuan Kadar Protein dengan Metode Kjeldahl ... 61 Lampiran 2. Penentuan Kadar Lemak dengan Metode Soxhlet... 62 Lampiran 3. Penentuan Kadar Air dengan Metode Gravimetrik... 63 Lampiran 4. Penentuan Kadar Abu dengan Metode Tanur... 64 Lampiran 5a. Penentuan Kadar Serat Pangan Tidak Larut (IDF) dengan Metode
Enzimatik-Gravimetrik... 65 Lampiran 5b. Penentuan Kadar Serat Pangan Terlarut (SDF) dengan Metode
Enzimatik-Gravimetrik... 66 Lampiran 5c. Penentuan Kadar Total Serat Pangan (TDF) dengan Metode
Enzimatik-Gravimetrik... 67 Lampiran 6. Penentuan Kadar Pati dengan Metode Hidrolisis Asam... 68 Lampiran 7. Penentuan Kadar Pati Resisten dengan Metode
Enzimatik-Gravimetrik... 69 Lampiran 9. Penentuan Indeks Penyerapan Air (IPA) dan
Indeks Kelarutan Air (IKA)... 70 Lampiran 10. Penentuan Kapasitas Antioksidan dengan Metode DPPH... 71 Lampiran 11a. Penentuan Kadar Total Fenol Ekstrak Air... 72 Lampiran 11b. Penentuan Kadar Total Fenol Ekstrak Air... 73 Lampiran 11c. Penentuan Kadar Total Fenol Ekstrak Air... 74 Lampiran 12. Analisis Paired T-test Proksimat Sampel... 75 Lampiran 13. Analisis Paired T-test Karakteristik Fisikokimia Sampel... 80 Lampiran 14. Analisis Paired T-test Komponen Karbohidrat... 86 Lampiran 15. Analisis Paired T-test Kapasitas Antioksidan dengan Metode
DPPH ... 89 Lampiran 15. Analisis Paired T-test Kapasitas Antioksidan dengan Metode
I. PENDAHULUAN
A. LATAR BELAKANG
Dewasa ini kedelai menjadi salah satu bahan pangan harian yang banyak dikonsumsi oleh masyarakat Indonesia. Kedelai merupakan biji-bijian yang memiliki banyak manfaat dan khasiat terhadap kesehatan tubuh. Keunggulan-keunggulan kedelai meliputi kandungan protein, mineral, vitamin, dan serat pangan yang cukup tinggi. Bagi vegetarian yang tidak mengonsumsi daging maka kedelai merupakan alternatif sebagai meat of soil (Syarif et al., 1999).
Keunggulan-keunggulan tersebut menyebabkan konsumsi kedelai tinggi sehingga permintaan pasar terhadap kedelai juga tinggi. Di sisi lain, produksi kedelai dalam negeri masih rendah sehingga tidak mampu memenuhi kebutuhan dalam negeri. Menurut Adisarwanto dan Wudianto (1998), salah satu faktor penyebab rendahnya produksi kedelai di Indonesia adalah kedelai merupakan tanaman yang manja atau penuh resiko, di antaranya yaitu pertumbuhan kedelai sangat peka terhadap perubahan lingkungan, banyak hama yang menyerang tanaman kedelai, serta tanaman kedelai memerlukan ketersediaan air yang cukup. Sehingga cukup sulit untuk meningkatkan produksi kedelai.
Oleh karena itu, untuk memenuhi kebutuhan kedelai dalam negeri, pemerintah melakukan impor kedelai. Hal ini sangat mengkhawatirkan karena akan mengakibatkan ketergantungan terhadap kedelai impor. Kestabilan perekonomian Indonesia akan terganggu apabila terjadi kenaikan harga kedelai dunia yang tinggi seperti yang terjadi tahun 2008 lalu. Kenaikan harga kedelai di pasaran dunia mengakibatkan beberapa industri kecil (UKM) pengolahan kedelai mengalami kebangkrutan. Hal tersebut dapat mengancam ketahanan pangan Indonesia seperti krisis pangan yang telah terjadi di beberapa negara lain.
dalam. Seperti penelitian yang dilakukan di China dalam mengeksplorasi kacang-kacangan lokal (indigenous) yang tumbuh di China seperti Phaseolus angularis, Phaseolus calcaratus, dan Dolichos lablab. Ketiga kacang-kacangan tersebut telah ditelusuri memiliki sumber protein, asam-asam amino essensial, serat pangan, dan pati yang sangat potensial (Chau et al., 1997). Indonesia pun kemungkinan besar memiliki sumber protein dari kacang-kacangan lain, selain kedelai, yang tumbuh subur di wilayah negara ini yang belum dieksplorasi.
Salah satu kacang-kacangan yang berpotensi sebagai sumber protein nabati seperti kedelai adalah kacang komak. Penelitian-penelitian sebelumnya membuktikan bahwa kacang komak memiliki karakter fraksi protein dan sifat fungsional yang hampir sama dengan kacang kedelai. Khodijah (2003) menyatakan bahwa pola elektroforesis fraksi protein globulin 7S dan 11S kacang komak hampir sama dengan pola elektroforesis kacang kedelai. Suwarno (2003) juga menyatakan bahwa sifat fungsional isolat protein kacang komak dan kacang kedelai memiliki banyak kesamaan yaitu daya serap air, daya serap minyak, dan daya emulsi isolat yang tidak berbeda nyata. Sampai saat ini kacang komak belum dieksplorasi lebih dalam. Produktivitas kacang komak lebih tinggi daripada kedelai yaitu sebesar 6-10 ton per hektar, sedangkan produktivitas kedelai rata-rata hanya sebesar 1,3 ton per hektar. Dengan potensi kacang komak yang begitu besar, kacang komak diharapkan dapat menjadi bahan pangan subtitusi kedelai karena kacang komak dapat tumbuh subur di wilayah Indonesia.
adalah kapasitas antioksidan. Tempe kedelai diketahui memiliki kandungan antioksidan yang tinggi (Syarif et al.,1999)..
Tempe juga dapat dibuat dari kacang-kacangan selain kedelai, salah satu kacang-kacangan yang berpotensi adalah kacang komak. Pembuatan tempe kacang komak, selain untuk mengurangi impor, juga berperan dalam melancarkan program diversifikasi pangan yang bahan bakunya berasal dari dalam negeri.
B. TUJUAN PENELITIAN
II. TINJAUAN PUSTAKA
A. KACANG KOMAK
Kacang komak (Lablab purpureus (L.) Sweet ) merupakan tanaman yang tumbuh di daerah tropis dan berasal dari Asia yang kemudian dibawa ke Afrika. Kacang komak (Lablab purpureus (L.) Sweet) diklasifikasikan ke dalam subkelas Rosidae, ordo Fabales, famili Fabaceae dan genus Lablab adans. Kacang komak memiliki bunga yang berwarna ungu atau putih (Allen dan Allen, 1981).
Kacang komak dibudidayakan di daerah tropik dan subtropik, terutama India, Asia Tenggara, Mesir, dan Sudan. Kacang komak diketahui memiliki varietas yang berbeda di berbagai tempat di dunia, sehingga namanya bermacam-macam seperti Dolichos lablab, Country bean, Dolichos bean, Lablab vulgaris, Lubia bean, Lablab niger, Hierba de Conejo, Frijol jacinto, Poroto japones, India butter bean, dan lain-lain (Murphy dan Colucci, 1999). Visualisai kacang komak dapat dilihat pada Gambar 1.
Gambar 1. Visualisasi Tanaman Kacang Komak (Lablab purpureus (L.) Sweet)
terhadap kekeringan dan beradaptasi dengan baik pada lahan kering dengan curah hujan rata-rata 200-2500 mm/tahun (Duke, 1983).
Di Asia Tenggara, kacang komak populer sebagai sayuran polong muda atau digunakan dalam sayur kari. Biji muda kacang komak yang masih hijau dimakan setelah direbus atau disangrai. daun, pucuk, dan perbungaan kacang komak dimanfaatkan sebagai kacang-kacangan, dan sebagai “dhal” (Maesen dan Somaatmadja, 1993). Di beberapa daerah di Indonesia seperti di Bondowoso, Situbondo, dan Probolinggo, kacang komak sering digunakan sebagai campuran nasi beras. Kacang komak berpotensi menggantikan sebagian atau seluruh kacang kedelai pada pembuatan produk pangan berbasis kacang kedelai. Tempe, tauco, kecap, tepung komposit, makanan bayi, dan konsentrat protein adalah produk yang dapat dihasilkan dari kacang komak (Utomo et al.,1999). Gambar 2 menunjukkan visualisasi kacang komak.
Gambar 2. Kacang Komak (Lablab purpureus (L.) Sweet)
Tabel 1. Komposisi Kimia Kacang Komak per 100 gr bahan
Komponen Biji kering Kulit (polong) Daun
Kalori (kal) 334 30 31
Protein (g) 21.5 3.1 2.4
Lemak (g) 1.2 0.3 0.4
Karbohidrat (g) 61.4 8.2 6.1
Serat (g) 6.8 1.9 6.7
Abu (g) 3.8 0.9 1.4
Ca (mg) 98 75 120
P (mg) 345 50 57
Fe (mg) 3.9 1.2 17
Sumber: Duke (1983)
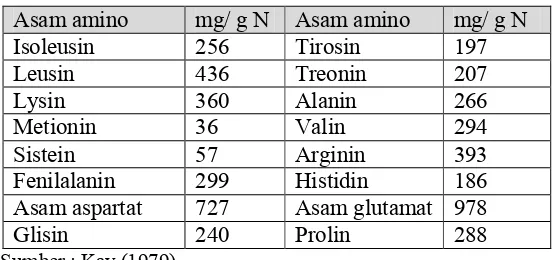
Komposisi asam amino kacang komak juga cukup baik seperti terlihat pada Tabel 2. Kadar protein kacang komak sebesar 21.5 % dengan susunan asam amino yang mendekati pola protein kedelai yaitu kurang mengandung asam amino yang mengandung belerang (metionin dan sistein), tetapi kaya akan asam amino lisin sehingga dapat dipakai sebagai suplemen dalam pembuatan bahan makanan campuran yang tersusun atas kacang-kacang yang umumnya kekurangan lisin (Martoyuwono, 1984).
Tabel 2. Komposisi Asam Amino Kacang Komak
Asam amino mg/ g N Asam amino mg/ g N
Isoleusin 256 Tirosin 197
Leusin 436 Treonin 207
Lysin 360 Alanin 266
Metionin 36 Valin 294
Sistein 57 Arginin 393
Fenilalanin 299 Histidin 186 Asam aspartat 727 Asam glutamat 978
Glisin 240 Prolin 288
Sumber : Kay (1979)
B. FERMENTASI
akibat dari pemecahan kandungan-kandungan bahan tersebut (Winarno et al., 1980)
Tempe adalah produk pangan yang sangat populer di Indonesia yang diolah dengan proses fermentasi kedelai dalam waktu tertentu menggunakan jamur Rhizopussp. atau yang sering disebut dengan nama ragi tempe. Selain itu, terdapat pula makanan serupa tempe yang tidak berbahan kedelai yang juga disebut tempe. Tempe dibagi menjadi dua golongan besar menurut bahan dasarnya, yaitu tempe berbahan dasar Legume dan tempe berbahan dasar bukan Legume. Legume adalah tanaman kacang-kacangan berkeping dua (Syarif et al.,1999).
Selain tempe dari kedelai, jenis tempe yang lainnya adalah tempe koro benguk (dari biji kara benguk, Mucuna pruriens L.D.C. var. utilis), tempe gude (dari kacang gude, Cajanus cajan), tempe gembus (dari ampas kacang gude pada pembuatan pati), tempe kacang hijau (dari kacang hijau), tempe kacang kecipir (dari kecipir, Psophocarpus tetragonolobus), tempe kara pedang (dari biji kara pedang, Canavalia ensiformis), tempe lupin (dari lupin, Lupinus angustifolius), tempe kacang merah (dari kacang merah, Phaseolus vulgaris), tempe kacang tunggak (dari kacang tunggak, Vigna unguiculata), tempe kara (dari kara kratok, Phaseolus lunatus), tempe kacang komak (dari kacang komak, Lablab purpureus (L) Sweet), dan tempe menjes (dari kacang tanah dan kelapa) (Syarif et al., 1999). Di Amerika Serikat telah dilakukan penelitian terhadap tempe yang terbuat dari jagung, barley, dan beberapa jenis biji-bijian lain. Di antara bermacam-macam tempe itu yang lazim disebut tempe adalah tempe kedelai. Tempe lain disebut dengan menyertakan nama bahan bakunya (Sarwono, 2002).
bermacam-macam seperti tepung terigu, beras, jagung, atau umbi-umbian (Syarif et al., 1999).
Berdasarkan atas tingkat kemurniannya, inokulum atau laru tempe dapat dibedakan atas: inokulum murni tunggal, inokulum campuran, dan inokulum murni campuran. Adapun perbedaannya adalah pada jenis dan banyaknya mikroba yang terdapat dan berperan dalam laru tersebut (Kusumaningrum et al., 2007).
Mikroba yang sering dijumpai pada laru tempe adalah kapang jenis Rhizopus oligosporus, atau kapang dari jenis Rhizophus oryzae. Sedangkan pada laru murni campuran selain kapang Rhizopus oligosporus, dapat dijumpai pula kultur murni Klebsiella. Selain bakteri Klebsiella, ada beberapa jenis bakteri yang berperan pula dalam proses fermentasi tempe diantaranya adalah: Bacillus sp., Lactobacillus sp., Pediococcussp., Streptococcus sp., dan beberapa genus bakteri yang memproduksi vitamin B12. Adanya bakteri Bacillus sp pada tempe merupakan kontaminan, sehingga hal ini tidak diinginkan (Sumanti, 2008).
Masing-masing varietas dari kapang Rhizopus berbeda reaksi biokimianya, hal ini terutama disebabkan adanya perbedaan dari enzim yang dihasilkan. Pektinase hanya disintesis oleh Rhizopus arrhizus dan Rhizopus stolonifer. Sedangkan enzim amilase disintesa oleh Rhizopus oligosporus dan Rhizopus oryzae tetapi tidak disintesa oleh Rhizopus arrhizus (Syarif et al., 1999). Fermentasi tempe dengan biakan biakan/kultur tunggal pada umumnya tidak tahan lama jika dibandingkan dengan tempe pasar yang menggunakan biakan/kultur campuran (Arbianto, 1976).
Kapang yang tumbuh pada kedelai menghidrolisis senyawa-senyawa kompleks menjadi senyawa sederhana yang mudah dicerna oleh manusia. Tempe kaya akan serat, kalsium, vitamin B dan zat besi. Berbagai macam kandungan dalam tempe mempunyai nilai obat, seperti antibiotika untuk menyembuhkan infeksi dan antioksidan pencegah penyakit degeneratif (Sumanti, 2008).
aktivitas proteolitik kapang akan diuraikan menjadi asan-asam amino, sehingga nitrogen terlarutnya akan mengalami peningkatan. Kedelai yang telah difermentasi menjadi tempe akan lebih mudah dicerna. Selama proses fermentasi karbohidrat dan protein akan dipecah oleh kapang menjadi bagian-bagian yang lebih mudah larut, mudah dicerna dan ternyata bau langu dari kedelai juga akan hilang (Syarif et al., 1999).
Selain perubahan-perubahan zat gizi, pada proses fermentasi kedelai menjadi tempe juga terjadi penurunan zat anti gizi serta penurunan total padatan (Hermana, 1983)
Tempe merupakan sumber yang baik untuk memenuhi kebutuhan gizi dan membina kesehatan tubuh karena banyak mengandung asam amino esensial, asam lemak esensial, serat dan vitamin B kompleks (Sarwono, 2002). Fermentasi pada kedelai dapat meningkatkan vitamin B12, B2, B6, asam pantotenat, asam nikotinat, dan asam folat. Jumlah vitamin B12dalam 100 g tempe sudah mencukupi kebutuhan harian vitamin B12pada pria dewasa (Sumi dan Yatagai, 2006).
C. KARAKTERISTIK FISIKOKIMIA TEPUNG TEMPE KACANG
KOMAK 1. Warna
Tiga aspek penting dalam penerimaan makanan adalah warna, rasa, dan tekstur. Para ahli berpendapat bahwa warna adalah faktor terpenting dalam hal penerimaan karena jika produk tidak terlihat menarik, maka konsumen akan menolak produk tersebut dan tidak akan memperhatikan faktor lainnya (Francis, 2003 di dalam Nielsen, 2003).
Sistem warna Hunter L a b memiliki tiga atribut yaitu L, a, dan b. Nilai L menunjukkan kecerahan atau gelap sampel dan memiliki skala dari 0 sampai 100 dimana 0 menyatakan sampel sangat gelap dan 100 menyatakan sampel sangat cerah. Nilai a menunjukkan derajat merah atau hijau sampel, dimana a positif menunjukkan warna merah dan a negatif menunjukkan warna hijau. Nilai a memiliki skala dari -80 sampai 100. Nilai b menunjukkan derajat kuning atau biru, dimana b positif menunjukkan warna kuning dan b negatif menunjukkan warna biru. Nilai b memiliki skala dari -70 sampai 70 (Francis, 1999).
Pengukuran warna tepung kacang komak ini dilakukan dengan alat Minolta Chroma Meters CR-310. Prinsip dari Minolta Chroma Meters adalah pengukuran perbedaan warna melalui pantulan cahaya oleh permukaan sampel (Hutching, 1999). Chromameter adalah suatu alat untuk analisis warna secara terstimulus untuk mengukur warna yang dipantulkan oleh suatu permukaan. Data pengukuran yang diperoleh dapat berupa nilai absolut maupun nilai selisih dengan warna standar (Anonim,1997).
Selain menggunakan Chromameter, pengukuran warna dapat juga dilakukan dengan menggunakan Whiteness Meter. Whiteness meter mengukur tingkat warna putih dari contoh tepung-tepungan.Prinsip pengukuran alat ini adalah melalui pengukuran indeks refleksi (reflective index) dari permukaan contoh dengan sensor foto dioda. Semakin putih contoh, maka cahaya yang dipantulkan semakin banyak (Faridah et al., 2008).
2. Densitas Kamba(ρA)
Densitas merupakan salah satu sifat fisik bahan pangan. Sebagian besar partikel makanan memiliki densitas padat sekitar 1.4-1.5 g/cm3. Densitas produk berbentuk bubuk (food powder) dipengaruhi oleh komposisinya (Wirakartakusumah, et al., 1992).
dengan volume wadah. Porositas merupakan bagian yang tidak ditempati oleh partikel atau bahan padatan. Bubuk bersifat compressible sehingga densitas kambanya diberi sifat-sifat tambahan, seperti loose bulk density, tapped bulk density(setelah getaran), atau densitas yang kompak/ compact density(densitas setelah dimampatkan) (Wirakartakusumahet al., 1992).
Menurut Wirakartakusumah et al. (1992), nilai densitas dari berbagai makanan berbentuk bubuk umumnya antara 0.3-0.8 g/cm3. Hal ini menunjukkan bahwa makanan berbentuk bubuk memiliki porositas yang tinggi, yaitu sekitar 40-80%.
Sebagian besar makanan berbentuk bubuk akan menjadi kohesif, yaitu gaya tarik-menarik antar partikelnya relatif tinggi terhadap berat partikel. Densitas kamba dari jenis pangan ini dipengaruhi oleh beberapa faktor yang saling berhubungan, yaitu intensitas gaya tarik-menarik antar partikel, ukuran partikel, dan jumlah dari titik yang berhubungan. Perubahan densitas kamba dapat menyebabkan perubahan dari sifat-sifat bubuk (Wirakartakusumahet al.,1992).
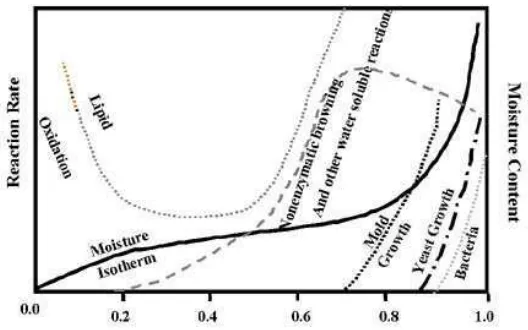
3. Aktivitas Air (aw)
Aktivitas air adalah jumlah air bebas yang tersedia dan dapat digunakan untuk pertumbuhan mikroorganisme dalam pangan. Jenis mikroorganisme yang berbeda akan membutuhkan air dalam jumlah yang berbeda pula untuk pertumbuhannya. Tiap organisme memiliki nilai aw minimum untuk mendukung pertumbuhannya.
Tipe II adalah molekul-molekul air yang membentuk ikatan hidrogen dengan molekul air lain, terdapat dalam bentuk mikrokapiler dan sifatnya agak berbeda dari air murni. Air jenis ini lebih sukar dihilangkan dan penghilangannya akan mengakibatkan penurunan aw. Bila sebagian air ini dihilangkan, pertumbuhan mikroba dan reaksi-reaksi kimia yang bersifat merusak bahan pangan, seperti reaksi browning, hidrolisis, atau oksidasi lemak akan dikurangi. Jika air tipe II ini dihilangkan seluruhnya, kadar air bahan akan berkisar antara 3-7% , dan kestabilan optimum bahan pangan akan tercapai, kecuali pada produk-produk yang dapat mengalami oksidasi akibat adanya kandungan lemak tidak jenuh.
Tipe III adalah air yang secara fisik terikat dalam jaringan matriks bahan, seperti pada membran, kapiler, serat, dan lain-lain. Air tipe III inilah yang sering disebut sebagai air bebas. Air tipe ini mudah diuapkan dan dapat dimanfaatkan untuk pertumbuhan mikroba dan media bagi reaksi-reaksi kimiawi. Bila air tipe III ini diuapkan sepenuhnya, kandungan air bahan berkisar antara 12-25% dengan aw sekitar 0.008 tergantung dari jenis bahan dan suhunya.
Tipe IV adalah air yang tidak terikat dalam jaringan suatu bahan atau air murni dengan sifat-sifat air biasa dan keaktifan penuh (Winarno, 1997).
Gambar 3. Hubungan Kecepatan Reaksi dengan awBahan Pangan (Labuza, 1971)
Selain pembagian tipe-tipe air di atas, air juga dibedakan menjadi air imbibisi dan air kristal. Air imbibisi merupakan air yang masuk dalam bahan pangan dan akan menyebabkan pengembangan volume, tetapi air ini bukan merupakan komponen penyusun bahan tersebut. Air kristal adalah air yang terikat pada semua bahan, baik pangan maupun non-pangan yang berbentuk kristal, seperti gula, garam, CuSO4 dan lain-lain (Winarno, 1997).
Kandungan air dalam bahan pangan mempengaruhi daya tahannya terhadap serangan mikroba yang dinyatakan dengan aw. Berbagai mikroorganisme memiliki aw minimum agar dapat tumbuh dengan baik, misalnya bakteri membutuhkan aw minimum 0.90, khamir 0.80-0.90, dan kapang 0.60-0.70 (Winarno, 1997).
4. Serat Pangan
mucilage. Oleh karena itu, serat pangan pada umumnya merupakan karbohidrat atau polisakarida. Berbagai jenis mkanan nabati umumnya banyak mengandung serat pangan (Winarno, 1992).
Serat kasar (crude fibre) tidak identik dengan serat pangan (dietary fibre). Serat kasar adalah residu dari bahan pangan yang telah diperlakukan dengan asam dan alkali mendidih (Faridah et al., 2008). Menurut Van Soest dan Robertson (1977) bahwa analisa serat kasar tidak dapat menunjukkan nilai serat makanan yang sebenarnya, sebab sekitar 20-50% selulosa, 50-80% lignin, dan 80-85% hemiselulosa hilang selama analisis.
Serat pangan dibagi atas dua bagian menurut kelarutannya terhadap air (suhu 90oC). yaitu serat pangan tidak larut (insoluble dietary fibre, IDF) dan serat pangan terlarut (soluble dietary fibre, SDF). Serat pangan tidak larut terdiri atas selulosa, lignin, dan beberapa fraksi hemiselulosa. Sedangkan serat pangan terlarut terdiri atas pektin, gum, musilase, dan beberapa hemiselulosa (Schneeman, 1987). Kedua jenis serat tersebut memiliki efek fisiologis yang berbeda terhadap kesehatan manusia. Serat pangan terlarut dapat menurunkan kolesterol darah, menurunkan resiko penyakit jantung, dan menurunkan resiko kanker kolon. Selulosa, hemiselulosa, dan lignin yang terdapat pada feses mampu menyerap air lebih banyak sehingga dapat mencegah konstipasi (Hill, 1974).
Serat pangan dapat menurunkan kadar kolesterol dalam darah dengan mekanisme yang melibatkan asam empedu. Pasien dengan konsumsi serat yang tinggi dapat mengeluarkan lebih banyak asam empedu, sterol, dan lemak yang dikeluarkan bersama feses. Serat-serat pangan tersebut ternyata mampu mencegah terjadinya penyerapan kembali asam empedu, kolesterol, dam lemak (Winarno, 1992).
5. Pati
unik, karena secara umum terdiri dari campuran dua polimer, polisakarida rantai lurus, amilosa, dan polisakarida rantai bercabang, amilopektin (Kadlec et al., 2001).
Pati merupakan homopolimer glukosa dengan ikatan -glikosidik. Berbagai macam pati tidak sama sifatnya, tergantung dari panjang rantai C-nya, serta apakah lurus atau bercabang rantai molekulnya. Pati terdiri dari dua fraksi yang dapat dipisahkan dengan air panas. Fraksi terlarut disebut amilosa dan fraksi tidak larut disebut amilopektin (Winarno, 1992).
Amilosa mempunyai struktur lurus dengan ikatan
-(1,4)-D-glukosa, sedangkan amilopektin mempunyai cabang dengan ikatan -(1,6)-D-glukosa (Winarno, 1992). Berat molekul amilopektin lebih besar dari pada amilosa, yaitu sebesar 105-106kD sedangkan rata-rata berat molekul amilosa adalah 104kD. Hal tersebut membuat luas permukaan per molekul amilopektin lebih besar daripada amilosa sehingga lebih mudah diakses oleh enzim amilolitik. Sedangkan amilosa memiliki rantai glukosa yang lurus yang terikat kuat dengan sesamanya (rantai glukosa dari amilosa yang lain) oleh ikatan hidrogen sehingga sulit dipenetrasi oleh enzim amilolitik (Leach, 1965.). Peranan perbandingan amilosa dan amilopektin terlihat pada serealia, seperti beras. Semakin kecil kandungan amilosa atau semakin tinggi kandungan amilopektinnya, maka semakin pulen nasi tersebut (Winarno, 1992).
6. Pati Resisten
Berry (1986) mengklasifikasikan pati menjadi tiga jenis berdasarkan respon pati tersebut ketika diinkubasi dengan enzim. Jenis pati pertama adalah Rapidly Digestible Starch (RDS) yaitu pati yang dapat dihidrolisis sepenuhnya oleh enzim amylase menjadi molekul-molekul glukosa dalam 20 menit. Jenis pati kedua dalah Slowly Digestible Starch yaitu pati yang dapat sepenuhnya dihidrolisis oleh enzim amylase namun mmmbutuhkan waktu yang lebih lama. Jenis pati ketiga adalah Resistant Starchatau Pati Resisten yaitu pati yang resisten (tahan) terhadap hidrolisis enzim amylase dan enzim pululanase secara in vitro. Pati resisten tidak terhidrolisis setelah 120 menit inkubasi (Englyst et al., 1992).
Pari resisten didefinisikan sebagai sejumlah pati dan produk pencernaan pati yang tidak mengalami penyerapan di usus halus (Thompson, 2007).
Englyst (1996) menyatakan bahwa terdapat tiga tipe pati resisten: Pati resisten tipe I yaitu pati yang sulit dipenetrasi oleh enzim pencernaan karena adanya hambatan fisik, misalnya pati dalam biji utuh atau partikel yang besar. Pati resiten Tipe II yaitu pati yang memiliki daya cerna yang rendah secara alami pada sumber pati tertentu seperti pati pada kentang dan pisang mentah, dan pati jagung dengan kadar amilosa yang tinggi (High Amilose Maize). Pati resiten Tipe III yaitu pati resisten yang dihasilkan karena reasosiasi fisik, atau retrogradasi amilosa, oleh proses pengolahan dengan panas. Selanjutnya Pati resisten tipe IV yaitu pati yang menjadi resisten karena modifikasi kimia. Pati resisten tipe III (retrograded starch) dapat dibentuk dari hasil proses pangan (food processing) (Czukor et al., 2001).
hidrogen yang mampu menggabungkan butir pati yang membengkak menjadi semacam jaring-jaring membentuk mikrokristal, yang disebut dengan proses retrogradasi (Rubatzky dan Yamaguchi, 1998). Amilosa pati ini membentuk pati resisten Tipe III yang stabil terhadap panas, sangat kompleks, dan tahan enzim amylase (Sajilataet al., 2006).
Sama halnya seperti pada serat pangan, pati resiten tidak dapat diserap oleh usus halus sehingga dapat langsung menuju kolon. Di kolon pati resisten akan difermentasi menghasilkan asam-asam lemak rantai pendek (Short Chain Fatty Acids) seperti asetat, propionat, dan butirat. Selain itu, pati resisten dapat bersifat prebiotik yang akan memelihara keseimbangan mikroflora (probiotik) pada kolon (Thompson, 2007).
D. KAPASITAS ANTIOKSIDAN
Oksidasi merupakan proses yang sangat penting dalam kehidupan manusia dan juga dapat merugikan manusia. Oksigen yang sangat vital bagi kehidupan manusia, sebagian kecil akan diubah menjadi radikal bebas hidroksil yang bersifat sangat reaktif sehingga dapat merusak membrane sel, inti sel, dan mengakibatkan kerusakan beberapa jaringan, serta mengakibatkan penuaan dini (Syarif et al.,1999).
Radikal bebas adalah atom atau molekul yang memiliki elektron yang tidak berpasangan yang dapat menarik elektron dari senyawa lain sehingga akan terbentuk radikal bebas baru (Syarif et al., 1999). Reaksi tersebut akan terjadi terus-menerus dalam tubuh yang akan menimbulkan berbagai kerusakan yang menyebabkan berbagai penyakit.
radikal yang terbentuk, selanjutnya menjadi inisiator pada proses peroksidasi lipid, sehingga menyebabkan kerusakan jaringan tubuh (Zakaria et al., 1996).
Antioksidan adalah zat yang dapat melawan pengaruh bahaya dari radikal bebas atau Reactive Oxygen Species (ROS) yang terbentuk sebagai hasil dari metabolisme oksidatif yaitu hasil dari reaksi-reaksi kimia dan proses metabolic yang terjadi dalam tubuh (Goldberg, 2003). Senyawa antioksidan dapat berfungsi sebagai penangkap radikal bebas, pembentuk kompleks dengan logam-logam prooksidan, dan berfungsi sebagai senyawa pereduksi (Andlauer et al., 1998).
Antioksidan dapat digolongkan menjadi antioksidan primer ( chain-breaking antioxidant) dan antioksidan sekunder (preventive antioxidant) (Gordon, 1990). Antioksidan primer dapat bereaksi dengan radikal lipid dan mengubahnya menjadi bentuk yang lebih stabil. Senyawa yang termasuk dalam kelompok antioksidan primer adalah vitamin E (tokoferol), vitamin C (asam askorbat), -karoten, glutation, dan sistein (Taher, 2003).
Antioksidan sekunder berfungsi sebagai antioksidan pencegah yaitu menurunkan kecepatan inisiasi dengan berbagai mekanisme, seperti melalui pengikatan ion-ion logam, penangkapan oksigen, dan penguraian hidropeksida menjadi produk-produk nonradikal. Contoh antioksidan sekunder antara lain turunan asam fosfat, asam askorbat, senyawa karoten, sterol, fosfolipid, dan produk-produk reaksi Maillard (Gordon, 1990).
Metode aktivitas kemampuan mereduksi digunakan untuk menentukan antioksidan total pada sampel (Kardono dan Dewi, 1998). Aktivitas antioksidan diukur sebagai kemampuan mereduksi Kalium Ferri Sianida. Pengukuran aktivitas kemampuan mereduksi menggunakan spektrofotometer pada panjang gelombang 700 nm. Absorbansi yang tinggi menunjukkan kemampuan mereduksi yang tinggi (Yang et al., 2000).
E. KOMPONEN FENOLIK
Senyawa fenol meliputi berbagai senyawa yang berasal dari tumbuhan yang memiliki cirri yang sama yaitu cincin aromatik yang mengandung satu atau dua gugus hidroksil (Harborne, 1987). Senyawa fenol diantaranya adalah senyawa fenol sederhana seperti monofenol dengan satu cincin benzen (3-etilfenol,3,4-dimetilfenol) yang banyak ditemukan pada kacang-kacangan, grup asam hidroksi sinamat, (asam ferulat dan kafeat), flavonoid dan glikosidanya (katekin, proantosianin, antosianidin, dan flavanol) dan tannin yang merupakan senyawa fenol yang kompleks dengan berat molekul yang tinggi (Jhonson, 2001). Senyawa fenol cenderung mudah larut dalam air karena umumnya berikatan dengan gula sebagai glukosida (Harborne, 1987).
Gambar 4. Struktur kimia komponen fenolik
Senyawa fenol pada kacang-kacangan terdiri dari senyawa fenol sederhana dan kompleks. Kacang-kacangan mengandung campuran beberapa senyawa fenol yang dapat berfungsi sinergis dengan komponen lain dan berfungsi sebagai antioksidan dan pencegah berbagai penyakit (Meskin et al., 2002).
dan karsinogenesis. Selain itu, polifenol juga memiliki sifat antioksidatif dan antitumor.
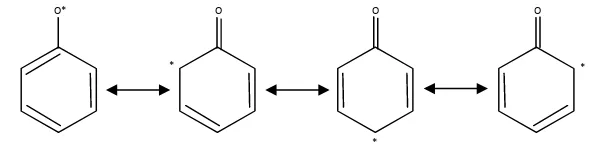
Senyawa fenolik antioksidan (AH) dapat menghambat reaksi oksidasi lemak dengan mendonorkan atom hirogen (H) pada radikal lemak (ROO*). Mekanisme reaksinya sebagai berikut:
ROO* + AH ROOH + A* RO* + AH ROH + A*
[image:43.612.179.481.402.477.2]Senyawa fenolik antioksidan merupakan donor antioksidan yang baik. Hal tersebut dikarenakan Senyawa fenolik antioksidan tidak menjadi senyawa radikal setelah mendonorkan atom H pada senyawa radikal. Senyawa fenolik antioksidan akan tetap dalam keadan stabil yang disebut radikal fenoksi karena adanya resonansi delokalisasi elektron (Shahidi dan Marian, 1995). Mekanisme delokalisasi elektron tidak berpasangan pada radikal fenoksi dapat dilihat pada Gambar 5.
Gambar 5. Radikal fenoksi yang mengalami resonansi delokalisasi elektron (Shahidi dan Marian, 1995)
Uji kadar fenol berdasarkan pada prinsip reaksi oksidasi-reduksi dengan menggunakan reagen Folin-Ciocalteau. Reagen Folin-Ciocalteau merupakan campuaran asam fosfomolibdat dan asam fosfotungstat. Antioksidan dapat mereduksi reagen sehingga terbentuk kompleks warna biru (kromatogen) dengan absorbansi maksimum pada panjang gelombang 745-750 nm (Nollet, 1996).
Uji kadar polifenol memiliki kelebihan, yaitu dapat menghitung secara kuantitatif semua grup fenolik seperti quercetin, antosianin, dan fenolik
O* O
* O
* O
III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
Bahan-bahan yang akan digunakan dalam penelitian ini adalah: kacang komak, laru tempe, dan bahan-bahan kimia untuk berbagai analisis. Kacang komak diperoleh Probolinggo, Jawa Timur. Sedangkan laru tempe yang digunakan ragi tempe merk “RAPRIMA” yang diproduksi oleh PT. Aneka Fermentasi Industri, Bandung-Jawa Barat. Bahan-bahan kimia yang akan digunakan untuk menganalisis proksimat dan kapasitas antioksidan tepung tempe kacang komak adalah kertas saring, K2SO4, HgO, H2SO4pekat, NaOH-Na2S2O3, indikator methylen blue, HCl, pelarut n-Heksana, etanol, pelarut etil asetat, kloroform, metanol, DPPH, buffer asetat, asam askorbat, buffer fosfat, kalium ferri sianida (K3Fe(CN)6), trikloroasetat (TCA) 10%, larutan FeCl30.1%, Na2CO310 %, Folin Ciocalteau 50%, dan asam galat.
Alat-alat yang digunakan dalam penelitian ini adalah tampah, wadah plastik, wadah pengemas, sendok kayu, oven pengering, pisau, penggiling Hammer Mill, wadah, plastik pembungkus, cawan aluminium, cawan porselen, neraca analitik, desikator, batu didih, soxlet, labu kjeldahl mikro, pHmeter, tanur, buret, sudip, Chroma meter, tabung sentrifuse, ayakan, sentrifuse, whiteness meter, Aw meter, pH meter, neraca, labu pemisah, alat refluks, freeze dryer, alat ekstraksi, labu pemisah, sentrifuse, pH meter, alat penggiling, spektrofotometer, alat vorteks dan alat-alat gelas.
B. METODE PENELITIAN 1. Penelitian Pendahuluan
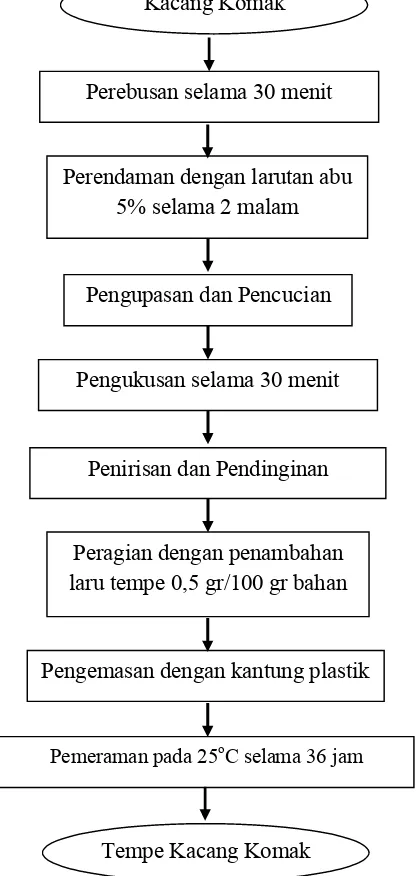
Perebusan selama 30 menit
Perendaman dengan larutan abu 5% selama 2 malam
Pengemasan dengan kantung plastik
Pemeraman pada 25oC selama 36 jam
a. Pembuatan Tempe Kacang Komak
Pembuatan tempe kacang komak dilakukan dengan memodifikasi mengikuti prosedur pada Syarif et al. (1999). Proses pembuatan tempe kacang komak ditunjukkan pada Gambar 6.
[image:46.612.232.440.191.629.2]
Gambar 6. Skema pembuatan tempe kacang komak Pengupasan dan Pencucian
Pengukusan selama 30 menit
Penirisan dan Pendinginan
Peragian dengan penambahan laru tempe 0,5 gr/100 gr bahan
Kacang Komak
b. Pembuatan Tepung Tempe Kacang Komak
Pembuatan tepung tempe kacang komak mengikuti prosedur yang telah dilakukan oleh Satrio (1992). Diagram alir proses pembuatan dapat dilihat pada Gambar 7 di bawah ini.
[image:47.612.223.453.176.431.2]
Gambar 7. Skema pembuatan tepung tempe kacang komak
2. Penelitian Utama
Penelitian pada tahap ini akan dimulai dengan menganalisis karakteristik fisikokimia dan kapasitas antioksidan dari tepung tempe kacang komak.
1. Analisis Karakteristik Fisikokimia Tepung Tempe Kacang Komak. 1.1. Analisis Proksimat Tepung Tempe Kacang Komak
1.1.1. Kadar Air (Apriyantono et al., 1989)
Cawan aluminium dikeringkan dalam oven pada suhu 100 oC selama 15 menit, lalu didinginkan dalam desikator selama 10 menit. Ditimbang cawan dengan neraca analitik (a gram). Ditimbang sampel dengan neraca analitik sebanyak 5 gram (b gram). Dikeringkan dalam
Pemotongan (1x2x0.5 cm3)
Blansir (100oC) selama 20 menit
Pengeringan dengan oven (50oC) selama 12 jam
Penggilingan dengan Pin Disc Mill Tempe Kacang Komak
oven pada suhu 100 oC selama kurang lebih 6 jam, didinginkan dalam desikator kemudian ditimbang (c gram). Dikeringkan kembali dalam oven selama 15-30 menit, lalu ditimbang kembali. Pengeringan diulangi hingga diperoleh berat sampel yang relatif konstan (berat dianggap konstan jika selish berat sampel kering yang ditimbang ≤0.000γ gram).
Kadar air (basis kering) = ( )x100% a
c a c b
Keterangan : b = bobot sampel (g)
c = bobot sampel dan cawan sesudah dikeringkan (g) a = bobot cawan kosong (g)
1.1.2. Kadar Protein (Apriyantono et al., 1989)
Sampel sebanyak 100 m (a mg) dimasukkan ke dalam labu Kjeldahl 100 ml, lalu ditambahkan 2.0 gram K2SO4, 40 mg HgO dan 2.5 ml H2SO4 pekat. Setelah itu didestruksi sampai cairan berwarna hijau jernih. Dibiarkan sampai dingin, lalu ditambahkan sedikit air suling dan 8-10 ml NaOH-Na2S2O3 pekat sampai warna coklat kehitaman, lalu didestilasi. Hasil destilasi ditampung dalam erlenmeyer yang berisi 5 ml H3BO3dan indikator merah metil serta metil biru, lalu dititrasi dengan HCl 0,02 N hingga titik akhir.
% N = a Vb Vs) (
x N HClx 14.007x 100 %
% Protein = % N x 6,25
Ket : Vs = volum HCl 0.02 N yang digunakan untuk mentitrasi sampel Vb = volum HCl 0.02 N yang digunakan untuk mentitrasi blanko A = bobot sampel (dalam mg)
Nilai 6.25 = faktor konversi untuk kacang-kacangan (legume)
1.1.3. Kadar Abu (Apriyantono et al., 1989)
ditimbang (b gram). Setelah itu dimasukkan ke dalam tanur pada suhu 600°C selama 4 - 5 jam. Sampel lalu dimasukkan ke dalam desikator dan ditimbang (c gram). Pengabuan diulangi hingga diperoleh berat sampel yang relatif konstan (berat dianggap konstan jika selish berat sampel kering yang ditimbang ≤0.0003 gram).
% kadar abu = x100% a
b c
Ket : a = bobot sampel awal (gram)
b = bobot cawan kosong kering (gram)
c = bobot cawan yang berisi residu abu hasil pengabuan (gram)
1.1.4. Kadar Lemak (AOAC, 1984)
Labu lemak yang akan digunakan dalam alat ekstraksi soxhlet dikeringkan di dalam oven, lalu didinginkan di dalam desikator kemudian ditimbang ( a gram). Ditimbang 2 g sampel (b gram) di dalam gelas piala, ditambahkan 30 ml HCl 25% dan 20 ml air serta beberapa batu didih. Ditutup gelas piala yang dengan gelas arloji dan dididihkan selama 15 menit (larutan sampel). Disaring larutan sampel dengan kertas saring dalam keadaan panas dan didicuci dengan air panas hingga tidak bereaksi asam lagi.
Kertas saring yang digunakan untuk menyaring larutan sampel dikeringkan berikut isinya pada suhu 100-105oC (kertas saring sampel). Dimasukan kertas saring sampel ke dalam kertas pembungkus sampel yang telah dilengkapi kapas dibagian ujungnya kemudian dibentuk menjadi bentuk tabung (timbel). Timbel tersebut diekstrak dengan heksana selama 2-3 jam pada suhu kurang lebih 80oC. Selanjutnya, labu lemak yang berisi lemak hasil ekstraksi dipanaskan di dalam oven pada suhu 100-105°C. Setelah itu didinginkan di dalam desikator, kemudian ditimbang (c gram).
% lemak = x100% b
a c
Ket : a = bobot labu lemak kosong (gram) b = bobot sampel awal (gram)
c = bobot labu lemak yang berisi lemak hasil ekstraksi lemak (gram)
1.1.5. Kadar Karbohidrat (by difference)
Kadar karbohidrat (%) = 100 % - % ( kadar protein + lemak + air + abu)
1.2. Total Colour Difference ( Angulo-Bejarano et al., 2008)
Warna permukaan sampel dapat diukur menggunakan Chroma meter. Alat dikalibrasi terlebih dahulu sebelum digunakan. Masukkan sampel tepung ke dalam wadah sampel yang telah disediakan. Letakkan measuring head pada contoh yang akan diukur, dan tekan “MEASURE’ atau tekan tombol pada measuring head. Lakukan pengukuran sebanyak tiga kali. Catat/cetak hasil pengukuran dengan berbagai sistem notasi.
Parameter yang diukur adalah L, a, dan b. Kemudian ΔE ditentukan menggunakan referensi yaitu 97,63, 0,78, dan -2,85. ΔE dihitung dengan persamaan :
ΔE = [(ΔL)2+(Δa)2+(Δb)2
]1/2, dimana ΔL=Lstd-Lsampel ; Δa=astd-asampel ;
Δb=bstd-bsampel.
1.3. Indeks Penyerapan Air (IPA) dan Indeks Kelarutan Air (IKA) (Metode Sentrifugasi Anderson, dikutip oleh Muchtadi, 1988))
hati-hati ke dalam wadah lain, sedangkan tabung sentrifus beserta isinya dipanaskan dalam oven.
Tabung diletakkan dalam oven yang diatur pada suhu 50oC selama 25 menit. Akhirnya tabung residu ditimbang untuk menentukan berat air yang terserap (a gram). Dari supernatan yang diperoleh, diambil sampel sebanyak 2 ml (Vs) dan dimasukkan ke dalam cawan timbang yang telah diketahui beratnya. Cawan dimasukkan ke dalam oven dan dikeringkan pada suhu 110oC samapi semua air menguap. Setelah itu didinginkan dan ditimbang (d gram) untuk mengetahui berat padatan kering yang terdapat dalam supernatan.
IPA = c b
a
IKA = Vs
d
Ket : a = bobot air yang terserap (gram) b = bobot air (gram)
c = bobot bahan terlarut (gram)
d = bobot bahan dalam 2 ml larutan (gram)
Vs = volum sampel yang digunakan (sebesar 2 ml)
1.4. Derajat Putih (Whiteness) (Faridah et al., 2008)
Pengukuran derajat putih menggunakan alat KETT Digital Whitenessmeter Model C-100. Sampel ditempatkan dalam cawan sampel dengan jumlah sedikit melebihi bibir cawan. Cawan berisi sampel ditempatkan ke dalam wadah sampel. Seimbangkan suhu sampel di atas tempat pengukuran, sehingga alat menyala. LED akan menampilkan nilai derajat putih dan nomor urutan pengukuran. Standar menggunakan MgO dengan nilai 81.6.
Nilai derajat putih sampel = 100% BaSO4 putih derajat Nilai
putih derajat Nilai
1.5. Aktivitas Air (Aw)
Pengukuran aktivitas air (Aw) dilakukan dengan menggunakan alat Aw meter “Shibaura Aw meter WA-360”. Alat dikalibrasi dengan NaCl jenuh yang memilki Aw 0,7547; 0,7529 dan 0,7509 yang berturut-turut pada suhu 20,25 dan 29oC dengan cara memasukan NaCl jenuh tersebjut dalam wadah Aw dapat dibaca setelah ada tulisan “completed” di layar. Bila Aw yang terbaca tidak tepat 0,750 maka bagian switch diputar samapai mencapai tepat 0,750. Pengukuran Aw sampel dilakukan dengan cara yang sama dengan kalibrasi alat yaitu sampel dimasukkan dalam wadah Aw meter. Nilai Aw dan suhu pengukuran akan terbaca setelah ada tulisan “completed” di layar.
1.6. Densitas Kamba (Bulk Density) ( Angulo-Bejarano et al. 2008)
Sampel ditempatkan pada silinder stainless stell yang telah diketahui volumenya sampai penuh. Pengisian dilakukan sebanyak tiga kali dan timbang berat sampel yang mengisi ruang silinder. Densitas tepung ditentukan dengan membagi antara berat sampel dengan volume silinder.
1.7. Analisis Serat pangan (AOAC, 1995)
Untuk residu, sampel dicuci dengan 2x10 ml etanol 95% dan 2x10 ml aseton. Kemudian dikeringkan dalam oven suhu 100oC selama 5 jam. Kemudian ditimbang whatman 40 yang berisi residu kering (D1). Lalu diabukan menggunakan tanur suhu 500oC selama semalam. Hasil pengabuan ditimbang (I1).
Untuk filtrat, volum filtrat diatur sampai 100 ml dengan aquades. Lalu ditambahkan 400 ml etanol 95% hangat (suhu 60oC). Lalu sampel diendapkan selama 1 jam. lalu endapan disaring dengan whatman 42. Kemudian dicuci dengan 2x10 ml etanol 78% dan 2x10 ml aseton. Residu endapan dikeringkan dengan oven 100oC selama 5 jam, Kemudian ditimbang (D2). Lalu diabukan dengan menggunakan tanur suhu 500oC selama semalam. Kemudiaan ditimbang (I2).
Serat pangan total (TDF) ditentukan dengan menjumlahkan nilai serat pangan tidak larut (IDF) dan serat pangan terlarut (SDF). Nilai blanko untuk IDF dan SDF diperoleh dengan cara yang sama tanpa menggunakan sampel.
% IDF = ((D1-I1-B1)/w) x 100% % SDF = ((D2-I2-B2)/w) x 100% % Serat pangan (TDF) = % IDF + %SDF
1.8. Analisis Serat Kasar (Apriyantono et al., 1989)
Sampel dihaluskan sehingga dapat melalui saringan 1 mm dan diaduk merata. Sampel ditimbang sebanyak 2 gram dan diekstraksi lemak dengan metode Soxlhet. Pindahkan sampel ke dalam erlenmeyer, kemudian tambahkan 0.5 gram asbes yang telah dipijarkan, 3 tetes zat anti buih, dan 200 ml H2SO4(1.25 g H2SO4pekat/100 ml = 0.255 N H2SO4). Tutup dengan pendingin balik dan didihkan selama 30 menit dengan terkadang digoyang-goyangkan.
Saring suspensi dengan kertas saring dan residu yang tertinggal dengan Erlenmeyer dicuci dengan air mendidih. Residu dalam kertas saring dicuci hingga air cucian tidak bersifat asam lagi (uji dengan kertas lakmus). Kemudian residu dari kertas saring dipindahkan secara kuantitatif ke dalam Erlenmeyer. Residu yang tersisa dicuci dengan 200 ml larutan NaOH (1.25 g NaOH/100 ml = 0.313 N NaOH) sampai emua residu masuk ke dalam Erlenmeyer. Didihkan kembali dengan pendingin balik sambil terkadang digoyang-goyangkan selama 30 menit.
Saring suspensi dengan kertas saring yang telah diketahui beratnya sambil dicuci dengan larutan K2SO4 10%. Cuci kembali residu pada kertas saring dengan air mendidih, kemudian dengan alkohol 95% sekitar 15 ml. Keringkan kertas saring dengan isinya pada 110oC sampai diperoleh berat konstan (1-2 jam), dinginkan dalam desikator dan timbang. Berat residu yang diperoleh adalah berat serat kasar, setelah dikurangi berat asbes yang digunakan.
1.9. Total Pati (Apriyantono et al., 1989 yang Dimodifikasi)
ditambahkan dengan 5 m anthrone 0,1% (dilarutkan 0,1 gr Anthrone dalam 100 ml asam sulfat pekat). Sampel diinkubasi dalam penangas air pada suhu 100oC selama 12 menit. Kemudian, sampel didinginkan dalam air mengalir. Sampel diukur absorbansinya pada panjang gelombang 630 nm.
Untuk standar digunakan larutan glukosa murni 2 mg/ml. Pati diukur sebagai glukosa dengan faktor konversi dari glukosa menjadi pati sebesar 0,9.
1.10. Pati Resisten (AOAC, 1995)
Sebanyak 0.5 gram (a gram) sampel dilarutkan dengan 25 ml buffer fosfat 0.08 M (pH 6.0) dalam gelas piala 250 ml, lalu ditutup dengan aluminium foil. Kemudian ditambahkan 0.2 ml enzim termamyl, lalu campuran diinkubasi dalam penangas air suhu 95oC selama 30 menit. Campuran diaduk lembut setiap interval 5 menit. Kemudian sampel didinginkan sampai suhu ruang. Kemudian datur pH campuran hingga 4.5 dengan 5 ml larutan HCl 0.275 N dan ditambahkan 0.5 ml enzim amiloglukosidase lalu diinkubasi dalam penangas air bergoyang dengan suhu 60oC selama 30 menit. Setelah didinginkan sampai suhu ruang, pH campuran diatur menjadi 7.5 dengan menambahkan 5 ml larutan NaOH 0.325 N, lalu ditambahkan 0.05 ml enzim protease (40 mg protease/50 ml buffer fosfat pH 6.0) dan campuran diinkubasi dalam penangas air bergoyang pada suhu 60oC selama 30 menit.
Setelah inkubasi selesai, larutan disentrifuse 3000 rpm selama 10 menit. Setelah itu diambil bagian pelet. Kemudian pelet dicuci dua kali dengan etanol 80% dan air dest