ABSTRAK
ISOLASI DAN KARAKTERISASI SENYAWA ALKALOID SPONS CALLYSPONGIA SP. PERAIRAN BIAK PAPUA
Oleh
FAJRIA FAIZA
Isolasi, karakterisasi dan uji bioaktivitas senyawa alkaloid dari spons telah dilakukan. Hasil uji bioaktivitas terhadap tiga jenis spons menunjukkan bahwa spons Callyspongia sp. B05H87 dari Biak Papua memiliki aktivitas paling baik sebagai antibakteri. Senyawa metabolit sekunder spons diisolasi berdasarkan uji bioaktivitas dengan beberapa tahap kromatografi. Hasil isolasi diperoleh senyawa bioaktiv F35B199 sebanyak 25 mg (0,00003%) dan dianalisis menggunakan Kromatografi Lapis Tipis (KLT) dengan eluen metanol : air (9:1) dan plat C18. Senyawa divisualisasi menggunakan pereaksi Dragendorff dan menunjukkan bercak jingga pada nilai Rf 0,7 yang diidentifikasi sebagai senyawa alkaloid. Interpretasi spektrum inframerah menunjukkan adanya gugus hidroksi (O─H) pada 3356 cm-1, alkana C─H pada 2916 cm-1, 2854 cm-1, alkena C=C pada 1604 cm-1 dan gugus metil ─CH3 pada 779 cm-1. Sedangkan interpretasi adanya gugus amina siklik dari senyawa alkaloid terlihat serapan amina tersier pada 1249 cm-1. Analisis spektrofotometer ultraviolet-tampak menunjukkan serapan maksimum dari transisi pada 227 nm dan transisi pada 259 nm. Hasil uji bioaktivitas senyawa F35B199 menunjukkan aktivitas zona hambat terhadap pertumbuhan bakteri Staphylococcus aureus pada konsentrasi 100 µg.
ISOLATION AND CHARACTERIZATION OF ALKALOID COMPOUND FROM SPONGE CALLYSPONGIA SP. BIAK PAPUA
By
FAJRIA FAIZA
Isolation, characterization and bioactivity tests of alkaloid compound from sponge have been carried out. The result of bioactivity test toward three types of sponges showed that sponge Callyspongia sp. B05H87 from Biak Papua has the greatest antibacterial activity. The secondary metabolite was isolated based on bioactivity tests with several steps chromatography. The result of isolation acquired 25 mg (0.00003%) of bioactive substance F35B199 and analyzed using Thin Layer Chromatography (TLC) with eluent methanol : water (9:1) and C18 plate. The compound visualized with Dragendorff’s reagent and showed an orange spot on the value Rf 0,7 indicated as an alkaloid compound. Interpretation of infrared spectrum indicated the presence of hydroxyl groups (O─H) at 3356 cm-1, alkane C─H at 2916 cm-1
, 2854 cm-1, alkene C=C at 1604 cm-1 and methyl groups ─CH3 at 779 cm-1. While the interpretation of cyclic amine as N tertiary from alkaloid compound seen at 1249 cm-1. Ultraviolet-Visible spectrophotometer analysis exhibited maximum absorption of transition at 227 nm and transition of at 259 nm. The result of bioactivity test of F35B199 showed inhibition zone against the growth of Staphylococcus aureus at dose 100 µg.
ISOLASI DAN KARAKTERISASI SENYAWA ALKALOID SPONS CALLYSPONGIA SP. PERAIRAN BIAK PAPUA
Oleh
FAJRIA FAIZA
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS
pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas lampung
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Braja Sakti Lampung Timur, pada tanggal 11 Juni 1992. Penulis merupakan anak ketiga dari empat bersaudara dan merupakan buah hati dari pasangan Bapak H. Ali Bashar S.Pdi. dan Ibu Hendarwaty A. yang diberi nama Fajria Faiza. Penulis menyelesaikan studi di Taman Kanak-Kanak (TK) Pertiwi Way Jepara Lampung Timur pada tahun 1997, Sekolah Dasar (SD) Negeri 3 Way Jepara pada kelas satu tahun 1998, kemudian pindah dan menyelesaikan pendidikan sekolah dasar di Sekolah Dasar (SD) Pertiwi Teladan Kota Metro pada tahun 2004, Sekolah Menengah Pertama (SMP) Negeri 1 Metro pada tahun 2007 dan Sekolah Menengah Atas (SMA) Negeri 1 Metro pada tahun 2010. Penulis kemudian terdaftar sebagai mahasiswa Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung melalui jalur SNMPTN (Seleksi Nasional Masuk Perguruan Tinggi Negeri) pada tahun 2010.
Selama menjadi mahasiawa, penulis pernah mendapatkan beasiswa Peningkatan Prestasi Akademik (PPA) pada tahun ajaran 2011/2012. Penulis dalam
amanah yang dipercayakan kepada penulis :
1. Unit Kegiatan Mahasiswa Bina Seni (UKMBS) Universitas Lampung sebagai anggota bidang seni rupa pada tahun 2010-2011.
2. Unit Kegiatan Pers Mahasiswa Natural FMIPA sebagai anggota pada tahun 2010-2011.
3. Anggota Muda Rohani Islam (Amar ROIS) FMIPA 2010-2011. 4. Kader Muda HIMAKI (KAMI) FMIPA pada tahun 2010-2011.
5. Himpunan Mahasiswa Kimia (HIMAKI) FMIPA sebagai anggota bidang Sains dan Penalaran Ilmu Kimia pada tahun 2011-2012.
6. Himpunan Mahasiswa Kimia (HIMAKI) sebagai sekretaris bidang Sains dan Penalaran Ilmu Kimia pada tahun 2012-2013.
PERSEMBAHAN
Dengan mengharapkan ridho Allah dan rahmat-Nya, skripsi ini
penulis sembahkan kepada:
a.
Kedua orangtua
b.
Pembimbing
“
Barang siapa menempuh suatu jalan untuk menuntut ilmu,
niscaya Allah memudahkan baginya dengan (ilmu) itu jalan
menuju surga
”
(HR. Muslim)
“
Barang siapa yang memudahkan urusan saudaranya di
dunia, niscaya Allah akan memudahkan urusannya didunia
dan di akhirat”
(HR. Muslim)
“
Hendaklah kalian berlaku jujur, karena kejujuran itu
menunjukkan kepada kebaikan, dan kebaikan itu
menunjukkan jalan menuju surga
”
(HR. Bukhari)
“
Sesungguhnya orang-orang yang bertaqwa mendapat
kemenangan”
(QS. An-Nab
a’: 31)
“
Ketahuilah bahwa hanya dengan mengingat Allah, hati akan
tenang”
(QS. Ar-
Ra’d : 28)
Assalamualaikum Wr. Wb.
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi ini. Shalawat serta salam senantiasa penulis haturkan kepada Nabi Muhammad SAW semoga senantiasa menjadi suri tauladan bagi penulis.
Skripsi dengan judul “Isolasi dan Karakterisasi Senyawa Alkaloid Spons
Callyspongia sp. perairan Biak Papua” adalah salah satu syarat yang harus dipenuhi untuk memperoleh gelar Sarjana Sains Universitas Lampung.
Penyusunan skripsi ini tidak terlepas dari jasa baik segenap pihak baik moral maupun spiritual, baik berupa bimbingan, motivasi dan doa yang senantiasa berguna bagi penulis hingga saat ini dan di masa yang akan datang.
Ucapan terima kasih penulis haturkan kepada:
2. Bapak Dr. Eng. Suripto Dwi Yuwono, M.T. selaku pembahas pertama dan Ketua Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam yang telah memberikan saran maupun kritik dalam menyelesaikan skripsi ini. 3. Bapak Mulyono, Ph.D. selaku pembahas kedua yang telah memberikan
masukan, baik saran maupun kritik kepada penulis untuk kesempurnaan tulisan dan penelitian penulis.
4. Ibu Dian Septiani M.Si., selaku Pembimbing Akademik dalam menyelesaikan masa studi penulis di Jurusan Kimia.
5. Bapak Prof. Suharso, Ph.D., selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam.
6. Seluruh dosen dan karyawan Jurusan Matematika yang telah memberikan ilmu dan pembelajaran selama masa studi penulis.
7. Kedua orangtua, Ayah H. Ali Bashar S.Pdi. dan Bunda Hendarwaty A. tercinta yang senantiasa memberikan kasing sayang, cinta, doa, nasihat, air mata serta dorongan semangat yang tulus kepada penulis.
8. Saudara kandung, Kak atu Muhammad Azizi S.Kom., Titah Suci Nur Amalia S.Si dan adik Atika Rahmawati tersayang yang senantiasa menemani dan memberikan doa serta dorongan semangat kepada penulis.
9. Sahabat-sahabat, Mira Olivia, Sifa Kusuma Wardani, Surtini Karlina Sari, Lolita Napatilova Albert Kahar, Silvana Maya Pratiwi, Ely Setiawati, Onilia Muliwarni, Kristi Arina dan Aryanti atas persaudaraan, kebersamaan, kehangatan dalam suka maupun duka yang telah dilewati bersama penulis. 10.Teman terbaik, Tandao Jumadi Abdillah yang senantiasa memberikan
Silvina, Rini Handayani, Rina Rachmawati Sutisna, Desi Meriyanti, Fauziyah Mu’Min Shiddiq, Lailatul Hasanah, Widya Afriliani, Rahmat Kurniawan,
M. Nurul Fajri, Agung Supriyanto, M. Prasetyo Ersa, Ruli Prayetno, serta teman kimia 2010 yang telah pindah jurusan, Yussi Fitria, Putri Rahmatika, Aditya Putra P., Ucep Saifulloh, Maria Anggraini dan Sunarmo atas
kebersamaan, kekeluargaan dan perjuangan hingga menyelesaikan studi sarjana.
12.Keluarga besar Laboratorium Terpadu dan Sentra Inovasi Teknologi
Universitas Lampung atas pengalaman dan pembelajaran yang telah penulis dapatkan selama ini.
13.Teman-teman kos Pondok Ratu Kampung Baru Unila, kos 3R Sukarame dan teman-teman Kuliah Kerja Nyata atas kekeluargaan dan kebersamaan selama ini.
14.Seluruh keluarga besar Sidi Muhammad Amin / Nyai’ Hamimah dan Datuk Abdul Gani / Siti Nur Aisyah atas doa dan dukungan moril kepada penulis. 15.Semua pihak yang tidak dapat penulis sebutkan satu persatu atas
Semoga Allah SWT membalas atas kebaikan yang telah diberikan kepada penulis. Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, akan tetapi penulis berharap semoga skripsi ini dapat berguna dan bermanfaat bagi kita semua. Amin.
Wassalamualaikum Wr. Wb.
DAFTAR ISI
2.5 Spektrofotometri Inframerah ... 15
2.6 Spektrofotometri Ultraviolet-Tampak ... 18
iv
3.3.2 Bakteri Escherichia coli dan Staphylococcus aureus ... 26
3.3.3 Preparasi Pereaksi ... 26
3.3.4 Partisi ... 27
3.3.5 Analisis Kromatografi Lapis Tipis (KLT) ... 27
3.3.6 Fraksinasi Senyawa Alkaloid Menggunakan Kromatografi Kolom ... 28
3.3.7 Uji Bioaktivitas Senyawa Bioaktif Terhadap Pertumbuhan Bakteri ... 28
3.3.8 Analisis Kromatografi Cair Kinerja Tinggi ... 29
3.3.9 Analisis Spektrofotometri Inframerah ... 29
3.3.10 Analisis Spektrofotometri Ultraviolet-Tampak ... 29
IV. HASIL DAN PEMBAHASAN... 30
4.1 Uji Bioaktivitas pada Beberapa Ekstrak Spons ... 30
4.2 Sampel Spons ... 32
4.3 Analisis Awal Kromatografi Lapis Tipis Spons B05H87 ... 32
4.4 Partisi ... 34
4.5 Uji Bioaktivitas Ekstrak Spons dan Fraksi Spons Hasil Partisi ... 37
4.6 Pemisahan Senyawa Alkaloid dengan Kromatografi Kolom .... 38
4.7 Kromatografi Kolom Fraksi Metanol ... 42
4.8 Analisis Kromatografi Cair Kinerja Tinggi (KCKT) Fraksi F29B411 dan F29B421 ... 45
4.9 Uji Bioaktivitas Fraksi F29B411 dan Fraksi F29B421 ... 46
4.10 Pemurnian Fraksi F29B421 ... 48
4.11 Analisis Spektrofotometri Inframerah ... 50
4.12 Analisis Spektrofotometri Ultraviolet-Tampak ... 51
DAFTAR TABEL
Tabel Halaman 1. Keterangan hasil uji bioaktivitas pada beberapa sampel spons ... 31 2. Keterangan hasil uji bioaktivitas tiga fraksi hasil partisi ... 38 3. Keterangan hasil uji bioaktivitas fraksi F29B411 dan fraksi
ix
DAFTAR LAMPIRAN
DAFTAR GAMBAR
Gambar Halaman
1. Bentuk dan struktur tubuh spons ... 6
2. Bentuk tubuh spons (a) Spons berbentuk vas, Callyspongia plicifera, Belize (b) spons tabung, Callyspongia sp., Wakatobi ... 7
3. Kelompok senyawa alkaloid, (1) 2-feniletilamin, (2) meskalin, (3) nikotin, (4) anabasin, (5) piperin, (6) cusparin, (7) anhalamin dan (8) bufotenin ... 9
4. Beberapa jenis senyawa alkaloid yang berhasil diisolasi dari spons dan memiliki aktivitas antibakteri, (9) agelasine B, (10) agelasine C, (11) agelasine D, (12) dysidionid A, (13) cyclic bis-1,3-dialkilpiridium, (14) cyclostelletamines A ... 10
5. Penampang kromatografi lapis tipis ... 13
6. Struktur senyawa, (15) ecionine A, (16) ecionine B, (17) 1-hidroksi-deoksiamphimedine dan (18) deoksibromopetrosamine ... 17
7. Spektrofotometer Ultraviolet-Tampak ... 19
8. Energi relative orbital molekul ... 20
9. Penampang Escherichia coli ... 21
10. Dinding sel Staphylococcus aureus ... 24
11. Hasil uji bioaktivitas antibakteri pada beberapa sampel spons ... 31
12. Spons Callyspongia sp. ... 32
vii
14. Partisi ekstrak metanol, menggunakan (a) pelarut n-heksan (lapisan atas) dan metanol (lapisan bawah), (b) pelarut metanol (lapisan
atas) dan diklorometan (lapisan bawah) ... 35 15. Hasil analisis KLT fraksi n-heksan, visualisasi dengan (a) serium
sulfat, (b) Dragendorff... 35 16. Hasil analisis KLT fraksi diklorometan, visualisasi dengan
(a) serium sulfat, (b) Dragendorff ... 36 17. Hasil analisis KLT fraksi metanol, menggunakan : a. plat silika dan
visualisasi dengan (i) serium sulfat dan (ii) Dragendorff, b. plat
C18 dan visualisasi dengan (i) serium sulfat dan (ii) Dragendorff ... 37 18. Hasil uji bioktivitas antibakteri fraksi hasil partisi ekstrak spons
terhadap bakteri resisten Escherichia coli ... 37 19. Hasil analisis KLT kromatografi kolom fraksi metanol,
menggunakan : a.pelarut air dan visualisasi dengan (i) serium sulfat dan (ii) Dragendorff, b. pelarut metanol dan visualisasi dengan (i) serium sulfat dan (ii) Dragendorff ... 39 20. Hasil analisis KLT kromatografi kolom fraksi ke-6, menggunakan
pelarut metanol dan visualisasi dengan Dragendorff ... 40 21. Hasil analisis KLT menggunakan plat silika dan visualisasi
Dragendorff pada percobaan: (a) saponin, (b) hidrolisis ... 41 22. Partisi ekstrak metanol menggunakan pelarut etil asetat (lapisan
atas) dan pelarut metanol (lapisan bawah) ... 41 23. Hasil analisis KLT : a.fraksi metanol dan visualisasi dengan (i)
serium sulfat dan (ii) Dragendorff, b. fraksi etil asetat dan
visualisasi dengan (i) serium sulfat dan (ii) Dragendorff ... 42 24. Hasil analisis KLT dengan variasi metanol:air : (a) 9:1, (b) 4:1,
(c) 3:1 ... 43 25. a. Fraksi (i) pertama (ii) kedua (iii) ketiga, b. hasil analisis KLT
fraksi (i) pertama (ii) kedua (iii) ketiga ... 44 26. Hasil analisis KLT : a.fraksi pertama (i) ekstrak diklorometan :
metanol (ii) ekstrak air, b. fraksi kedua (i) ekstrak diklorometan :
kedua (i) F33B361 (ii) F33B382 ... 49 31. Hasil analisis KLT senyawa F35B199. Senyawa divisualisasi
dengan : (a) Dragendorff, (b) lampu UV... 50 32. Spektrum inframerah senyawa F35B199 ... 50 33. Spektrum UV senyawa F35B199 ... 52 34. Hasil uji bioktivitas antibakteri F35B199 terhadap bakteri
I. PENDAHULUAN
1.1 Latar Belakang
Indonesia sebagai negara kepulauan terbesar di dunia, merupakan salah satu negara yang memiliki sumber kekayaan alam laut dan sangat potensial untuk dimanfaatkan. Luas perairan Indonesia, mencapai 5,8 juta km2 dan memiliki garis pantai sepanjang 81.000 km. Secara geografis, Indonesia terletak pada posisi strategis dengan posisi silang di antara dua benua, Benua Australia dan Benua Asia serta berada di antara dua samudera, Samudera Hindia dan Samudera Pasifik. Wilayah kedaulatan dan yuridiksi Indonesia terbentang dari 6°08' LU hingga 11°15' LS dan 94°45' BT hingga 141°05' BT (Lemhannas, 2013).
Karakteristik perairan Indonesia yang sangat spesifik, menimbulkan
Spons adalah hewan metazoa multiseluler dan tergolong ke dalam filum Porifera. Spons memiliki perbedaan struktur dengan metazoan lainnya, karena seluruh tubuh spons terbentuk dari sistem pori, saluran dan ruang-ruang (Kozloff, 1990). Hewan ini hidup dengan menetap pada suatu habitat pasir, batu-batuan atau pada karang-karang mati di dalam laut. Dalam mencari makanan, hewan ini aktif mengisap dan menyaring air melalui seluruh permukaan tubuhnya. Konsistensi tubuh spons pada umumnya elastis seperti busa karet, tetapi ada beberapa jenis yang keras dan agak rapuh. Tubuh spons ini diperkokoh oleh suatu kerangka spikula yang mengandung kalsium karbonat atau silika dan didukung oleh kerangka serat-serat keratin atau spongin (Amir dan Budiyanto, 1996).
Spons dikenal kaya akan sumber metabolit sekunder yang memiliki beragam aktivitas biologis, seperti inhibitor enzim, antivirus, antijamur, antimikroba, antiinflamasi dan antitumor. Umumnya senyawa yang berhasil diisolasi dari spons merupakan senyawa metabolit sekunder yang dikeluarkan tubuh spons akibat adaptasi spons terhadap lingkungan, makanan dan predatornya (Dai et al., 2010; Joseph and Sujatha, 2011).
3
Spongia sp. di perairan Lombok (Aoki et al., 1998). Sebagai contoh lain, β-sitosterol, steroid , terpenoid dan flavonoid yang diisolasi dari konstituen semi
polar dan polar dalam pelarut kloroform dan etil asetat dari spons Petrosia alfiani, suatu spesies yang endemik di perairan kepulauan Spermonde, Sulawesi Selatan (Usman et al., 2012). Senyawa alkaloid alkilpiperidin tetrasiklik (Arai et al., 2009), makrosiklik alkaloid (Arai et al., 2011) dari spons Haliclona sp. dan alkaloid diterpen dari spons genus Agelas (Arai et al., 2014), diidentifikasi sebagai anti-dorman mikobakteri.
Berdasarkan kajian hasil penelitian di atas, dapat diketahui bahwa komponen senyawa yang dihasilkan oleh spons berbeda-beda, tergantung pada jenis spons dan setiap senyawa yang dihasilkan memiliki fungsi bioaktivitas yang berbeda-beda pula. Senyawa metabolit yang telah berhasil diisolasi dari spons antara lain berasal dari golongan steroid, terpenoid, poliketida dan alkaloid. Namun dari beberapa golongan senyawa tersebut, alkaloid merupakan golongan senyawa yang memiliki potensi besar sebagai sumber senyawa bioaktif karena hampir semua senyawa alkaloid bersifat toksik dan memiliki kemampuan
farmakologik lebih besar dibandingkan dengan golongan lain (Grube et al., 2007).
1.2 Tujuan Penelitian
Tujuan penelitian ini adalah,
a. Mengisolasi senyawa alkaloid hasil metabolit sekunder spons Callyspongia sp.
b. Mengkarakterisasi senyawa alkaloid yang diperoleh c. Menguji aktivitas biologi sebagai antibakteri
1.3 Manfaat Penelitian
II. TINJAUAN PUSTAKA
2.1 Spons
Spons adalah hewan metazoa multiseluler, yang tergolong ke dalam filum
Porifera. Porifera berasal dari bahasa latin yaitu porus berarti pori dan fer berarti membawa. Spons atau Porifera memiliki fungsi jaringan dan organ yang masih sangat sederhana, seluruh tubuh spons terbentuk dari sistem pori, saluran dan ruang-ruang (Kozloff, 1990). Hewan ini hidupnya menetap pada suatu habitat pasir, batu-batuan atau juga pada karang-karang mati di dalam laut. Dalam mencari makanan, hewan ini aktif mengisap dan menyaring air melalui seluruh permukaan tubuhnya. Air masuk kedalam spons melalui pori-pori dan keluar melalui lubang besar yang disebut oskulum. Melalui pori-pori dan saluran-saluran inilah air diserap oleh sel khusus yang dinamakan sel leher, sebagian besar menyerupai cambuk yang disebut dengan koanosit (Amir dan Budiyanto, 1996).
Gambar 1. Bentuk dan struktur tubuh spons (Schaffer, 2009)
7
a b
Gambar 2. Bentuk tubuh spons: (a) spons berbentuk vas, Callyspongia plicifera, Belize,(b) spons tabung, Callyspongia sp., Wakatobi
(www.ryanphotographic.com)
2.2 Senyawa Alkaloid
Senyawa alkaloid merupakan salah satu senyawa metabolit sekunder yang dapat dihasilkan oleh organisme, termasuk spons. Senyawa metabolit sekunder merupakan senyawa yang tidak esensial bagi pertumbuhan organisme dan ditemukan dalam bentuk yang beragam antar organisme satu dan organisme lainnya. Senyawa metabolit sekunder, biasanya digunakan organisme untuk berinteraksi dengan lingkungannya. Pada umumnya, senyawa metabolit sekunder yang telah diisolasi memiliki aktivitas biologi terhadap suatu sel atau
mikroorganisme. Sifat biologis ini, dapat menghambat bahkan membunuh sel atau mikroorganisme dengan merusak sistem metabolisme di dalam tubuh (Wink, 1999).
dalam air, namun adapula alkaloid larut dalam etanol, eter, kloroform dan pelarut lainnya (Saxena, 2007).
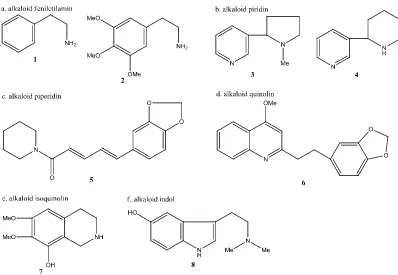
Klasifikasi alkaloid secara dasar dapat dibagi menjadi beberapa kelompok, diantaranya kelompok alkaloid feniletilamin seperti 2-feniletilamin (1) dan meskalin (2), alkaloid pirolidin, alkaloid piridin seperti nikotin (3) dan anabasin (4), alkaloid piperidin seperti piperin (5), alkaloid quinolin seperti cusparin (6), alkaloid isoquinolin seperti anhalamin (7), alkaloid penantren, alkaloid imidazol, alkaloid indol seperti bufotenin (8) dan kelompok alkaloid terpen dan steroid (Gambar 3). Perlu dicatat bahwa, beberapa alkaloid yang berbeda diperoleh dari organisme yang sama sering memiliki struktur kimia yang
mirip dan kesamaan sifat kimia. Alkaloid tidak memiliki penamaan tata nama
yang sistematis, biasanya hanya menambahkan “in” diakhir penamaan senyawa
9
Gambar 3. Kelompok senyawa alkaloid, (1) 2-feniletilamin, (2) meskalin, (3) nikotin, (4) anabasin, (5) piperin, (6) cusparin, (7) anhalamin, (8) bufotenin (Popl, 1990)
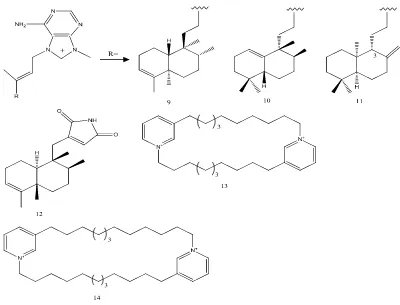
Beberapa senyawa alkaloid yang mengandung nitrogen heterosiklik juga banyak ditemukan pada spons laut. Senyawa alkaloid diterpen, agelasine B (9), C (10) dan agelasine D (11) dari spons genus Agelas (Arai et al., 2014), diidentifikasi sebagai anti-dorman mikobakteri. Selain itu beberapa senyawa antibakteri, alkaloid dysidionid A (12) dari spons Dysidea sp. diidentifikasi sebagai
antibakteri Staphylococcus aureus yang resisten terhadap methicillin (Jiao et al., 2014), cyclic bis-1,3-dialkilpiridium (13) dari spons Haliclona sp. (Lee et al., 2012) dan senyawa alkaloid cyclostellettamines A (14) dari spons
Gambar 4. Beberapa jenis senyawa alkaloid yang berhasil diisolasi dari spons dan memiliki aktivitas antibakteri, (9) agelasine, B (10) agelasine C, (11) agelasine D, (12) dysidionid A, (13) cyclic
bis-1,3-dialkilpiridium, (14) cyclostellettamines A (Arai et al., 2014; Jiao et al., 2014; Lee et al.; Oliviera et al., 2006)
2.3 Ekstraksi
Ekstraksi adalah proses penarikan komponen atau zat aktif suatu simplisia dengan menggunakan pelarut tertentu. Prinsip ekstraksi didasarkan pada distribusi zat terlarut dengan perbandingan tertentu antara dua pelarut yang tidak saling
11
Metode ekstraksi yang digunakan dalam penelitian ini adalah ekstraksi cair-cair. Ekstraksi cair-cair merupakan metode ekstraksi yang didasarkan pada sifat kelarutan komponen target dan distribusinya dalam dua pelarut yang tidak saling bercampur. Senyawa polar akan terbawa dalam pelarut polar, senyawa semipolar akan terbawa dalam pelarut semipolar dan senyawa nonpolar akan terbawa dalam pelarut nonpolar (Poole, 2009; Williamson and Masters, 2010).
Ekstraksi cair-cair merupakan teknik ekstraksi yang paling sederhana, cukup dengan menambahkan pelarut pengekstraksi yang tidak saling bercampur, kemudian dilakukan pengocokan sehingga terjadi distribusi zat terlarut di antara kedua pelarut (Poole, 2009; Williamson and Masters, 2010). Dalam hal ini, pemisahan zat yang polar dan nonpolar dapat dilakukan dengan partisi zat dalam corong pisah. Pengocokan bertujuan memperluas area permukaan kontak di antara kedua pelarut sehingga pendistribusian zat terlarut di antara keduanya dapat berlangsung dengan baik. Syarat pelarut untuk ekstraksi cair-cair adalah memiliki kepolaran yang sesuai dengan bahan yang diekstraksi dan harus terpisah setelah dilakukan pengocokan (Harvey, 2000).
2.4 Kromatografi
2.4.1 Kromatografi Lapis Tipis
Kromatografi lapis tipis (KLT) bertujuan untuk menentukan jumlah komponen campuran dan mengidentifikasi komponen. Selain itu, hasil analisis KLT dapat mengetahui kondisi yang tepat pada saat pemisahan dengan kromatografi kolom atau kromatografi cair kinerja tinggi (KCKT), seperti pemilihan eluen yang akan digunakan (Johnson dan Stevenson, 1991).
Pada kromatografi lapis tipis, fasa diam yang sering digunakan adalah silika gel, C18, tanah diatom, selulosa dan lain-lain yang mempunyai ukuran butir sangat kecil berkisar 0,063-0,125 mm. Sedangkan untuk fasa gerak digunakan pelarut-pelarut organik yang sesuai, bahkan beberapa campuran pelarut dapat digunakan untuk mendapatkan pemisahan terbaik (Grinberg, 1990; Hostettman et al., 1995; Sherma and Fried, 2003).
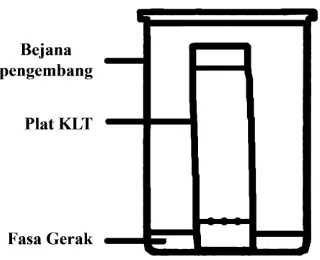
Pada pelaksanaan kromatografi lapis tipis, larutan cuplikan atau sampel ditotolkan pada plat dengan pipet mikro atau injektor paling sedikit 0,5 μL. Setelah kering, plat dikembangkan dengan fasa gerak sampai pada batas tertentu. Proses
13
untuk menampakkan bercak adalah dengan cara pencacahan radioaktif dan fluorosensi sinar ultraviolet. Sherma and Fried, 2003).
Gambar 5. Penampang kromatografi lapis tipis (Ahluwalia and Raghay, 1997)
Data hasil analisis KLT adalah nilai Rf (Retention Factor atau Faktor Retensi) yang berguna dalam identifikasi senyawa. Nilai Rf senyawa murni dapat dibandingkan dengan nilai Rf senyawa standar. Nilai Rf dapat didefinisikan sebagai jarak yang ditempuh oleh senyawa dari titik asal dibagi dengan jarak yang ditempuh oleh pelarut dari titik asal (Gandjar dan Abdul, 2007). Nilai Rf
dikatakan baik apabila 0<Rf<1. Harga Rf ini bergantung pada beberapa
parameter yaitu sistem pelarut, suhu dan adsorben (ukuran butir, kandungan air, ketebalan), jumlah bahan yang ditotolkan pada plat (Khopkar, 2002). Hasil dari metode KLT, akan mengarahkan untuk dilakukannya fraksinasi lebih lanjut dalam pemisahan suatu komponen dari sampel.
2.4.2 Kromatografi Kolom
mengalir melalui kolom ini disebabkan oleh gaya gravitasi (Poole, 2009; Williamson and Masters, 2010).
Pada kolom kromatografi akan terjadi kesetimbangan antara zat terlarut yang di adsorbsi adsorben dan pelarut yang mengalir melewati kolom, sehingga terjadi pola pemisahan dari masing-masing komponen senyawa yang kemudian dapat ditampung menurut pola pemisahannya. Selain itu, ukuran partikel fasa diam akan mempengaruhi aliran pelarut melewati kolom. Fasa diam dengan ukuran partikel lebih kecil biasanya digunakan dalam kromatografi flash, sedangkan ukuran partikel besar digunakan dalam kromatografi kolom gravitasi (Heftmann, 1983).
15
2.4.3 Kromatografi Cair Kinerja Tinggi (KCKT)
Teknik pemisahan senyawa pada sistem kromatografi lapis tipis dan kromatografi kolom merupakan teknik konvensional yang umum banyak dilakukan dalam pemurnian suatu senyawa. Biaya operasional yang cukup murah menjadikan metode ini banyak digunakan sebagai tahap awal dalam pemurnian. Sedangkan Kromatografi Cair Kinerja Tinggi (KCKT) merupakan teknik kromatografi secara instrumental dengan efisiensi waktu dan tingkat kemurnian senyawa yang akan diisolasi secara cepat dan maksimal (Meurant, 2011).
Metode kromatografi cair kinerja tinggi mempunyai prinsip kerja yang sama dengan metode kromatografi kolom, dimana proses pemisahan senyawa terjadi akibat adanya keseimbangan distribusi antara zat terlarut (sampel) yang di adsorbsi adsorben dan pelarut yang mengalir melewati kolom. Perbedaan dalam sistem KCKT ini adalah proses pemisahan komponen sampel di dalam kolom dilakukan pada sistem tekanan tinggi, tingkat ukuran partikel fasa diam yang diperkecil dan tingkat sensitifitas pemisahan dapat digunakan beberapa macam detektor dan dapat diganti. Metode kromatografi cair kinerja tinggi sangat efisien untuk memisahkan berbagai senyawa walaupun tidak langsung memisahkan seluruh senyawa yang tercampur (Huber, 2011; Meurant, 2011).
2.5 Spektrofotometri Inframerah
menyebabkan terjadinya getaran (vibrasi) ikatan kovalen. Hampir semua senyawa organik memiliki ikatan kovalen yang berbeda-beda, sehingga menghasilkan jenis vibrasi dan serapan yang berbeda-beda pula pada suatu spektrum inframerah (Silverstein dkk., 1986).
Pada umumnya spektrum inframerah dibedakan menjadi tiga daerah. Daerah bilangan gelombang tinggi antara 4000-1200 cm-1 (2-7 µm) yang disebut daerah gugus fungsi karakteristik frekuensi tarik untuk gugus fungsi penting, seperti C=O, OH dan NH. Daerah frekuensi menengah, yakni antara 1200-900 cm-1 (7-11 µm) sebagai daerah sidik jari (fingerprint), yang mengabsorpsi secara lengkap dan umumnya kombinasi dari interaksi vibrasi. Setiap molekul memberikan fingerprint yang unik. Sedangkan daerah antara 900-650 cm-1 (11-15 μm) menunjukkan klasifikasi umum dari molekul yang terbentuk dari absorbansi, seperti cincin benzen tersubstitusi. Adanya absorbansi pada daerah bilangan gelombang rendah dapat memberikan data yang baik akan adanya senyawa aromatik. Selain itu adanya intensitas absorbansi di daerah frekuensi rendah juga menunjukkan adanya karakteristik senyawa dimer karboksilat, amina, atau amida (Coates, 2000).
17
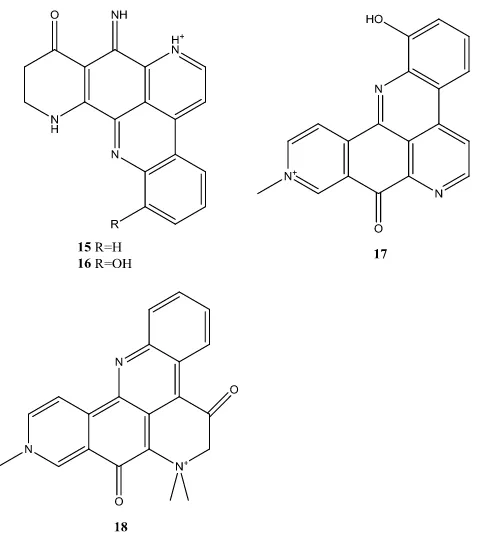
vibrasi N tersier pada daerah sekitar 1201 cm-1, senyawa ecionine B (16)
dikarakterisasi memiliki vibrasi ulur O-H pada daerah sekitar 3410 cm-1, vibrasi C=O pada 1674 cm-1 serta N tersier pada daerah sekitar 1203 cm-1 (Barnes et al., 2010). Selain itu, senyawa 1-hidroksi-deoksiamphimedine (17) menunjukkan karakterisasi vibrasi ulur gugus O-H pada daerah sekitar 3382 cm-1, vibrasi ulur C-H pada derah sekitar 2854 nm dan 2925 cm-1, vibrasi N tersier pada daerah 1200 cm-1 dan vibrasi metil pada daerah sekitar 700-800 cm-1 dan senyawa debromopetrosamine (18) menunjukkan karakterisasi vibrasi ulur O-H pada daerah sekitar 3063 cm-1, vibrasi C=O pada daerah sekitar 1682, N tersier pada daerah 1206 cm-1 (Wei et al., 2010). Struktur dari senyawa-senyawa tersebut dapat dilihat pada Gambar 6.
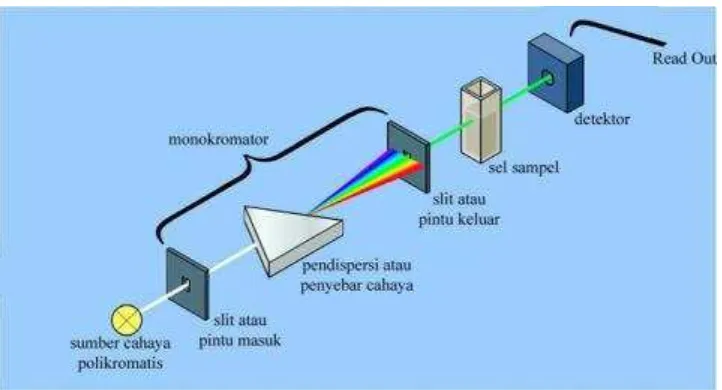
spektroskopi yang memakai sumber radiasi elektromagnetik pada panjang gelombang sinar ultraviolet (UV) sampai sinar tampak. Sinar ultraviolet mempunyai panjang gelombang antara 200-400 nm, sementara sinar tampak mempunyai panjang gelombang 400-800 nm (Owen, 2000). Komponen-komponen spektrofotometer UV-tampak meliputi sumber sinar, monokromator, wadah sampel, detektor dan rekorder. Cahaya dihasilkan oleh lampu sumber, lampu tungsten untuk daerah tampak dan deuterium untuk daerah ultraviolet. Lampu tersebar pada panjang gelombang konstituen di
monokromator. Monokromator memecah radiasi polikromatis dengan pita energi yang lebar yang dihasilkan sumber radiasi menjadi radiasi dengan pita energi yang lebih sempit atau menjadi radiasi monokromatis. Sampel dalam
19
Gambar 7. Spektrofotometer Ultraviolet-Tampak (Owen, 2000)
Konsentrasi dari analit di dalam larutan dapat ditentukan dengan mengukur absorban pada panjang gelombang tertentu menggunakan hukum Lambert-Beer. Hukum Lambert-Beer dinyatakan dalam rumus sebagai berikut,
A = ε. b. c
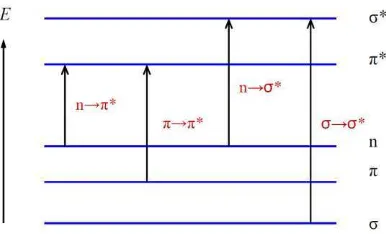
Gambar 8. Energi relatif orbital molekul (Sudjadi, 1985)
Beberapa senyawa alkaloid yang telah berhasil diisolasi dan dikarakterisasi menggunakan spektrofotometer UV-tampak yaitu, senyawa ecionine A (15) menunjukkan karakterisasi UV (MeOH) max (log ε)μ 215 (4.23), 228 (4.26), 284 (4.00), 319 (3.70), 376 (3.80), 443 (3.28) nm dan senyawa ecionine B (16) menunjukkan karakterisasi UV (MeOH) max(log ε)μ 211 (3.66), 235 (3.74), 286 (3.48), 321 (3.20), 382 (3.20), 447 (3.00) nm (Barnes et al., 2010). Selain itu senyawa 1-hidroksi-deoksiamphimedine (17) menunjukkan karakterisasi UV
(MeOH) max (log ε) 204 (4.51), 246 (4.35), 286 (4.16), 392 (3.92) nm dan
senyawa debromopetrosamine (18) menunjukkan karakterisasi UV (MeOH) max
(log ε) 216 (4.49), 282 (4.74), 374 (3.38), 592 (3.15) nm (Wei et al., 2010).
2.7 Antibakteri
Senyawa antibakteri merupakan senyawa alami maupun kimia sintetik yang dapat membunuh atau menghambat pertumbuhan mikroorganisme. Cara kerja
21
Antibakteri dapat diklasifikasikan menjadi bakteriostatik, bakteriosidal, dan bakteriolisis. Bakteriostatik secara berkala sebagai penghambat sintesis protein dan berfungsi sebagai pengikat ribosom. Bakteriosidal mengikat kuat pada sel target dan tidak hilang melalui pengenceran, sehingga tetap dapat membunuh sel. Beberapa bakteriosidal merupakan bakteriolisis, yakni membunuh sel dengan terjadinya lisis pada sel dan mengeluarkan komponen sitoplasmanya. Target penting antibiotik terhadap bakteri yaitu ribosom, dinding sel, membran sitoplasma, enzim biosintesis lemak, serta replikasi dan transkripsi DNA (Madigan et al., 2009).
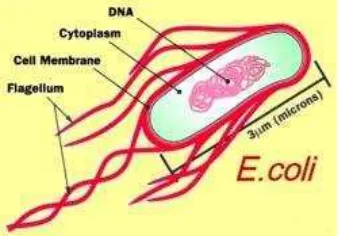
2.7.1 Bakteri Escherichia coli
Escherichia coli adalah bakteri gram negatif berbentuk batang tidak berkapsul. Bakteri ini umumnya terdapat dalam pencernaan manusia dan hewan. Sel Escherichia coli mempunyai ukuran panjang 2-6 µm, tersusun tunggal,
berpasangan dan berflagel. Escherichia coli tumbuh pada suhu antara 10-45 ˚C,
dengan suhu optimum 37 ˚C. Sedangkan pH optimum untuk pertumbuhan E.coli
sekitar 7-7,5, dengan pH minimum pada pH 4 dan maksimum pada pH 9.
bila berpindah dari habitatnya yang normal kebagian lain dalam inang, misalnya, E. coli di dalam usus masuk ke dalam saluran kandung kemih kelamin. Hal ini dapat menyebabkan sistitis, yaitu suatu peradangan pada selaput lendir pada organ tersebut (Melliawati, 2009).
Infeksi oleh E. coli dapat diobati menggunakan sulfonamida, ampisilin, sefalosporin, kloramfenikol, tetrasiklin dan aminoglikosida. Namun telah dilaporkan bahwa E. coli resistensi terhadap beberapa antibiotik tersebut (Ganiswarna, 1995). Untuk menanggulangi terjadinya resistensi pada suatu bakteri, maka diperlukan pengobatan antibakteri yang lain. Resistensi dapat terjadi oleh ekspresi gen. Resistensi menghasilkan perubahan bentuk pada gen bakteri yang disebabkan oleh 2 proses genetik dalam bakteri. Pertama, mutasi dan seleksi (evolusi vertikal). Evolusi vertikal didorong oleh prinsip seleksi alam. Mutasi spontan pada kromosom bakteri memberikan resistensi terhadap suatu populasi bakteri. Pada lingkungan tertentu bakteri yang tidak termutasi (nonmutan) mati, sedangkan bakteri yang termutasi (mutan) menjadi resisten, kemudian tumbuh dan berkembang biak. Kedua, perubahan gen antar galur dan spesies (evolusi horizontal), evolusi horizontal yaitu pengambil alihan gen resistensi dari organisme lain.
23
yang dilakukan untuk pengobatan berbagai jenis penyakit infeksi adalah dengan pemberian antibiotik. Jenis antibiotik yang paling banyak digunakan adalah betalaktam. Meningkatnya penggunaan antibiotik betalaktam, memacu
meningkatnya resistensi bakteri terhadap antibiotik tersebut. Mekanisme utama resistensi bakteri yakni dengan menghasilkan enzim betalaktamase, yang berperan memotong cincin betalaktam, sehingga aktivitas antibakterinya hilang
(Jawetz et al., 1995).
2.7.2 Bakteri Staphylococcus aureus
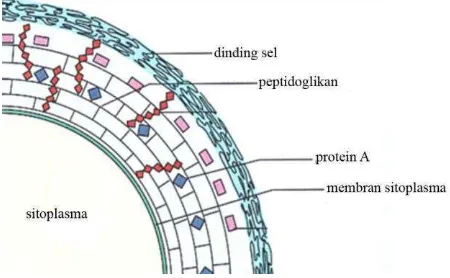
Staphylococcus aureus adalah bakteri gram positif dengan diameter 0,5─1,5 μm dan menggerombol seperti anggur. S. aureus bersifat anaerob fakultatif, tidak motil, tidak menghasilkan spora, katalase positif dan optimum hidup pada suhu 37˚C. Terdapat ± 32 spesies jenis bakteri Staphylococcus, namun spesies
S. aureus merupakan jenis bakteri yang paling banyak diteliti. Staphylococcus aureus umumnya ditemukan di lingkungan (tanah, air dan udara) dan ditemukan pada kulit manusia (hidung, wajah, vagina). Pada tubuh manusia, S. aureus diasosiasikan dengan beberapa kondisi patologi, seperti bisul, jerawat atau meningitis (Harris et al., 2002; Honeyman et al., 2006).
2002; Honeyman et al., 2006; John, 2013). Dinding sel bakteri Staphylococcus aureus dapat dilihat pada Gambar 10.
III. METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Desember 2014 hingga April 2015 di Laboratorium Terpadu dan Sentra Inovasi Teknologi (LT SIT) Universitas Lampung. Analisis Kromatografi Cair Kinerja Tinggi (KCKT) dan
spektrofotometer ultraviolet-tampak di LT SIT Universitas Lampung. Analisis inframerah di Laboratorium Kimia Organik Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Gajah Mada.
3.2 Alat dan Bahan
Alat-alat yang digunakan pada penelitian ini, yaitu alat-alat yang sering digunakan pada laboratorium, neraca analitik, seperangkat rotary evaporator, satu set
perlengkapan Kromatografi Lapis Tipis (KLT) dengan plat silika dan plat C18, lampu UV, satu set perlengkapan kromatografi kolom, jarum ose, lampu spritus, pinset, mikropipet, ring, laminar air flow, inkubator, autoclave, kromatografi cair kinerja tinggi, spektrofotometer ultraviolet-tampak dan spektrofotometer
inframerah.
3.3 Prosedur Penelitian
3.3.1 Sampel Spons
Sampel spons yang digunakan pada penelitian ini adalah ekstrak metanol spons B05H87 dengan jenis Callyspongia sp. yang berasal dari perairan Biak Papua dan disimpan sebagai stok di Laboratorium Terpadu dan Sentra Inovasi Teknologi Universitas Lampung.
3.3.2 Bakteri Escherichia coli dan Staphylococcus aureus
Bakteri resisten Escherichia coli dan Staphylococcus aureus didapatkan dari stok RSUD Abdul Moeloek Bandar Lampung dan dibiakkan di LT SIT Universitas Lampung.
3.3.3 Preparasi Pereaksi
Pada analisis KLT akan digunakan beberapa pereaksi, yaitu Dragendorff dan serium sulfat. Pereaksi Dragendorff dibuat dengan melarutkan 1,7 gram bismut nitrat dan 20 gram asam tartarat dalam 80 mL aquades (A). Pada wadah lain, sebanyak 16 gram kalium iodida dilarutkan dalam 10 mL akuades (B). Pereaksi Dragendorff dibuat dengan melarutkan 2 gram asam tartarat dalam 10 mL
27
serium sulfat dibuat dengan mereaksikan larutan serium (IV) sulfat 10% dengan asam sulfat 15% dengan perbandingan 1:1 (Jork et al., 1990).
3.3.4 Partisi
Pada penelitian ini, ekstrak spons dipartisi sebanyak dua kali. Pertama, ekstrak kasar spons dipartisi dalam campuran pelarut metanol dan n-heksan. Larutan dikocok beberapa kali dalam corong pisah, lalu didiamkan hingga terbentuk dua fraksi. Masing-masing fraksi dipisahkan dan dilakukan pengulangan partisi metanol dengan diklorometan. Ketiga fraksi hasil pemisahan yang diperoleh dipekatkan dengan rotary evaporator hingga didapatkan fraksi kering lalu ditentukan berat kuantitatif dari masing-masing ekstrak. Partisi ekstrak spons yang kedua yaitu menggunakan pelarut etil asetat dan metanol.
3.3.5 Analisis Kromatografi Lapis Tipis (KLT)
yang digunakan sebagai fasa diam dan elusi dilakukan secara tepat dengan
perbandingan sistem pelarut yang sesuai. Keberadaan komponen dari fraksi yang diperoleh dimonitor kembali dengan metode KLT. Fraksi yang memiliki nilai Rf yang sama akan digabungkan menjadi satu fraksi. Fraksi positif alkaloid dan memiliki kelimpahan paling besar akan ditetapkan sebagai sampel analisis lanjutan, kemudian dimurnikan.
3.3.7 Uji Bioaktivitas Senyawa Bioaktif Terhadap Pertumbuhan Bakteri
Uji antibakteri dilakukan dengan metode difusi agar menggunakan ring. Medium nutrient agar (NA) steril dituang secara aseptis ke dalam cawan petri dan
dibiarkan menjadi padat sebagai lapisan dasar. Kemudian media NA cair yang telah diinokulasi bakteri uji dituang di atas media NA yang telah memadat, lalu diratakan dan dibiarkan setengah padat sebagai lapisan pembenihan (Mbah et al., 2012).
29
3.3.8 Analisis Kromatografi Cair Kinerja Tinggi (KCKT)
Kemurnian senyawa hasil kromatografi kolom dianalisis menggunakan
kromatografi cair kinerja tinggi. Senyawa hasil kromatografi kolom dipekatkan dengan rotary evaporator dan selanjutnya dilarutkan dengan eluen metanol. Analisis KCKT tersebut menggunakan kolom C18, detektor Photo Dioda Aray (PDA) dengan fasa gerak metanol : air (9:1). Hasil KCKT ini berupa
kromatogram yang selanjutnya dianalisis berdasarkan puncak-puncak yang terbentuk.
3.3.9 Analisis Spektrofotometri Inframerah
Karakterisasi gugus fungsi pada sampel digunakan spektrofotometer inframerah. Pada spektrofotometer inframerah, senyawa digerus bersama KBr hingga homogen,
kemudian dikempa hingga menjadi pelet KBr. Spektrum inframerah yang terbentuk
selanjutnya dianalisis berdasarkan ilmu dasar karakterisasi gugus-gugus fungsi senyawa dalam spektrofotometer inframerah.
3.3.10 Analisis Spektrofotometri Ultraviolet-Tampak
5.1 Kesimpulan
Dari hasil penelitian yang telah dilakukan, dapat disimpulkan bahwa:
1. Spons Callyspongia sp. mengandung senyawa alkaloid yang mempunyai aktivitas antibakteri Staphylococcus aureus pada konsentrasi 100 µg. 2. Analisis inframerah menunjukkan bahwa senyawa alkaloid mengandung
gugus amina tersier pada 1249.87 cm-1, alkena pada 1604.77 cm-1, metil pada 779.24 cm-1 dan gugus hidroksi pada 3356.14 cm-1.
3. Analisis ultraviolet-tampak menunjukkan bahwa senyawa alkaloid memiliki serapan ikatan terkonjugasi alkena ( ) pada 227 nm dan amina ( ) pada 259 nm.
5.2 Saran
Berdasarkan hasil penelitian, penelitian selanjutnya disarankan untuk melakukan analisis struktur lebih lanjut terhadap senyawa alkaloid hasil isolasi menggunakan 1
56
DAFTAR PUSTAKA
Ahluwalia V. K. and S. Raghay. 1997. Comprehensive Experimental Chemistry. New Age International. P:31.
Alam G., P. Astuti, D. Sari, S. Wahyuono and M. T. Hamman. 2005. Structure Elucidation of Bioactive Compounds Isolated from Sponge Petrosia sp. Collected Bunaken bat Menado. Indo J. Chem. 5(2). P:177-181.
Amir I. dan A. Budiyanto. 1996. Mengenal Spons Laut (Demospongiae) Secara Umum. Oseana. Vol. XXI. No. 2. Hal:15-31.
Aoki S., K. Dexin, S. Hideaki, S. Yoshihiro, S. Toshiyuki, A. Setiawan, and M. Kobayashi. 2006. Aaptamin a Spongean Alkaloid Activates p21 Promoter in a p53 Independent Manner. Biochemical and Biophysical Research Communications. 34(2). P:101-106.
Aoki S., Y. Yoshioka, Y. Miyamoto, K. Higuchi, A. Setiawan, N. Murakami, Z.S. Chen, T. Sumizawa, S. Akiyama, and M. Kobayashi. 1998. Agosterol A, a Novel Polyhydroxylated Sterol Acetate Reversing Multidrug Resistance from a Marine Sponge of Spongia sp. Tetrahedron Letters. 39(35). P:6303-6306.
Arai M., L. Liu, T. Fujimoto, A. Setiawan and M. Kobayashi. 2011. DedA Protein Relates to Action-Mechanism of Halicyclamine A, a Marine Spongean Macrocyclic Alkaloid, as an Anti-dormant Mycobacterial Substance. Marine Drugs. 9(6). P:984-993.
Arai M., S. Ishida, A. Setiawan and M. Kobayashi. 2009. Haliclonacyclamines, Tetracyclic Alkylpiperidine Alkaloids, as Anti-dormant Mycobacterial Substances from a Marine Sponge of Haliclona sp. Chem Pharm Bull. Vol.57. No.10. P:1136-8.
Ecionine A and B, Two new Cytotoxic Pyridoacridine Alkaloids from The Australian Marine Sponge, Ecionemia geodides. Australia
Bear Springs Blossom Nature Conservation Group Inc. 2006. Escherchia coli. www.nature-education.org. Diakses pada tanggal 3 Desember 2014. Burke L., K. Reytar, M. Spalding dan A. Perry. 2012. Menengok Kembali
Terumbu Karang yang Terancam di Segitiga Terumbu Karang. World Resources Institute. Diterjemahkan oleh Wiyanto Suroso.
Carballeria, N. M. and M. Pagan. 2001. New Metoxy Fatty Acids From The Carribean Sponge Callyspongia fallax. J. Nat Prod. 64. P:620-623. Chen Y., Y. Peng, C. Gao and R. Huang. 2014. A New Diketopiperazine from
South China Sea Marine Sponge Callyspongia sp. P:1010-1014. Coates J. 2000. Interpretation of Infrared Spectra, a Practical Approach.
Encyclopedia of Analytical Chemistry. R.A. Meyers. P:10815-10837. Corolado J., D. Munoz, D. Marquez, M. E. Marquez, J. Lopez, O. P. Thomas and
A. Martinez. 2013. Triterpenoid Saponins from The Carribean Marine Sponge Ectyoplasia ferox. Molecules.Vol.18. P2598-2610.
Dai J., A. Sorribas, W. Y. Yoshida, M. Kelly and Philip. 2011. Xestosaprols from The Indonesian Marine Sponge Xestospongia sp. National Institute of Healt Public Access. Hawai.
Diaa, T.A., S. A. Lamiaa and A. Z. Hani. 2013. Bioactive Compounds from The Res Sea Marine Sponge Hyrtios Species. J. Marine Drugs. P:1061-1070.
Foudah A., S. Jain, B. A. Busnena and K. A. El Sayed. 2013. Optimization of Marine Triterpene Sipholenols as Inhibitors of Breast Cancer Migration and Invasion. The American Chemical Society and American Sociaty of Pharmacognosy.
Gandjar G. I. dan A. Rohman. 2007. Kimia Farmasi Analisis. Pustaka Pelajar. Yogyakarta. Hal:219.
Ganiswarna S. G. 1995. Farmakologi dan Terapi. Ed. 4. UI-Fakultas Kedokteran. Jakarta.
58
Grube, A., M. Assman, E. Lichte, F. Sasse, J. R. Pawlik and M. Ko’ck. 2007. Bioactive Metabolites from the Caribbean Sponge Aka coralliphagum. Journal Natural Product. 70. P:504-509.
Harborne J.B. 1996. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Diterjemahkan oleh Kosasih Padmawinata dan Iwang Soediro. ITB. Bandung.
Harris L. G., S.J. Foster and R. G. Richards. 2002. An Introduction Staphylococcus aureus and Techniques for Identifying and
Quantifying S. aureus Adhesins in Relation to Biomaterials : Review. AO Research. Vol.4. P:39-60.
Harvey D. 2000. Modern Analytical Chemistry. New York. McGraw-Hill Comp. Heftman E. 1983. Fundamental and Application of Chromatographic and
Electrophoretic Methods. Elsevier Scientific Publishing Company. Amsterdam. P:139-160.
Honeyman A., H. Friedman and M. Bendinelli. 2006. Staphylococcus aureus Infection and Disease. Springer Science and Business Media. P:1,35. Hostettman K., M. Hostettman dan A. Marston. 1995. Cara Kromatografi
Preparatif Penggunaan Pada Senyawa Bahan Alam. Alih Bahasa oleh Kosasih Padmawinata. ITB. Bandung. Hal:1-38.
Huang R. M., W. Ma, D. Juan-De, Z. Xue-feng, T. Xu, J. K. Lee, X. Yang, Shi-Hai and Y. Liu. 2010. A New 1,4-Diazepine from South China Sea Marine Sponge Callyspongia sp. Molecules Journal. 15. P:871-877. Huber J. F. K. 2011. Instrumentation for High Performance Liquid
Chromatography. Journal of Chromatography Library. Elsevier. P:163.
Ibrahim M. R. S., C. C. Min, F. Teuscher, R. Ebel, C. Kakoschke, W. Lin, V. Wray, R. E. Ebel and P. Proksch. 2010. Callyaerins A-F and H, new Cytotoxic Cyclic Peptides from the Indonesian Marine Sponge Callyspongia aerizusa. Vol.18. Bioorganic and Medicinal Chemistry. P:4947-4956.
Ichsan A. dan A. Budiyanto. 1996. Mengenal Spons Laut (Demospongiae) Secara Umum. Oseana. Volume XXI. No. 2. Hal:15-31.
Activity from the South China Sea Sponge Dysidea sp. Marine Drugs. 19. P:18025-18032.
John. 2010. Sponges. www.ryanphotographic.com. Diakses pada tanggal 3 Desember 2014.
John R. 2013. Staphylococcus aureus mastitis: Have We Learned Anything In The Last 50 Years. USANMC Regional Meeting Proceedings. Middleton University of Missouri Columbia. Missouri.
Jompa, J. 2009. Peluang dan Tantangan Pengelolaan Terumbu Karang Indonesia: CTI dan COREMAP. Makassar.
Joseph B and Sujatha. 2011. Pharmacologically Important Natural products from Marine Sponges. Journal of Natural Products. Vol. 4. P:05-12. Jork H., W. Funk, W. Fischer and H. Wimmer. 1990. Thin-Layer
Chromatography Reagents and Detection Methods. Germany. Vol.1. Khopkar S.M. 2002. Konsep Dasar Kimia Analitik. Diterjemahkan oleh A.
Saptorahardjo. Universitas Indonesia. Jakarta. Hal:84-311. Kobayashi M., K. Higuchi, N. Mukarami, H. Tajima and S. Aoki. 1997.
Callystatin A, A Potent Cytotoxic Polyketida from The Marine Sponge Callyspongia. Tett Lett. 38. P:2859-2862.
Kozloff, EN. 1990. Invertebrates. Saunders College Publishing. Hal:73–92. Lee Y., K. H. Jang, J. Jeon, W. Yang, C. J. Sim, K. Oh and J. Shin. 2012. Cyclic
Bis-1,3-Dialkylpyridiniums from The Sponge Haliclona sp. Marine Drugs. 10. P:2126-2137.
Lemhannas. 2013. Pemanfaatan Sumber Daya Laut Guna Meningkatkan Perekonomian Rakyat Dalam Rangka Meningkatkan Ketahanan Ekonomi Nasional. Jurnal Kajian Lemhannas. Jakarta. Edisi 16. Hal:4-5.
Madigan T.D., J.M. Martinko and J. Parker. 2009. Brock Biology of
60
Mbah J.A., M.N. Ngemenya, A.L. Abawah, S.B. Babiaka, L.N. Nyongbela, K.D. lemuh and S.M. Efange. 2012. Bioassay-guide Discovery of
Antibacterial Agents : In vitro Screening of Peperomia vulcanica, Peperomica fernandopoioana and Scleria stiriatinux. Journal Annals of Clinical Microbiology and Antimicrobial. 11:10.
McMurry, J. 2010. Organic Chemistry. Brooks/Cole, Cengage Learning. United States. Eight edition.
Melliawati, R. 2009. Escherchia coli dalam Kehidupan Manusia. BioTrends. Vol.4. No.1.
Mozaix. 2011. Spektrofotometer masa. gusnil45mind.wordpress.com. Diakses pada tanggal 5 Januari 2014.
Owen, T. 2000. Fundamentals of Modern UV-Visible Spectroscopy. Agilent Technologies. Jerman.
Pelczar M.J. dan Chan. 2005. Dasar-Dasar Mikrobiologi. Diterjemahkan oleh Hadioetomo. UI-Press. Jakarta.
Poole, C. 2009. Handbook of Method and Instrumentation in Separation Science. Vol 1. Academic Press. P:72.
Popl. 1990. Chomatographic Analysis of Alkaloids. CRC Press. P:664. Proksch P., R. Ebel, R. A. Edrada, V. Wray and K. Steube. 2003. Sponges
(Porifera), Bioactive Natural Products from Marine Invertebrates and Associated Fungi. Vol. 3. P:117-142.
Sastrohamidjojo H. 2001. Dasar-Dasar Spektroskopi. Liberty. Yogyakarta. Hal :35-50.
Saxena P. B. 2007. Chemistry of Alkaloids. Discovery Publishing House. P:338 Schaffer M. W. 2009. Invertebrates. Spring. Chapter 33.
Sherma J. and F. Bernard. 2003. Handbook of Thin Layer Chromatography. CRC Press. P:62.
Shirouzu T., K. Watari, M. Ono, K. Koizumi, I. Saiki, C. Tanaka, R. W. M. van Soest and T. Miyamoto. 2013. Structure, Synthesis and Biological of a-C-10 Bisacetylenic Alcohol from a Marine Sponge Callyspongia sp. J Nat Prod. 76(7). P:1337-1342.
Usman H., R. Bahar, E. Yohanes, Rahmawaty and A. Ahmad. 2012. Isolation, Chemical Characterization, and Bioactivity of Secondary Metabolites With Polar Constituents of Petrossian alfiani Sponges. Makassar. Volk, W. A. dan M. F. Wheeler. 1993. Mikrobiologi Dasar Jilid I. Diterjemahkan
oleh Markham. Edisi V. Erlangga. Jakarta.
Wei X., T. S. Bugni, M. K. harper. I. T. Saldoval, E. J. Manos, J. Swift, R. M. V. Wagoner, D. A. Jones and C. M. Ireland. 2010. Evaluation of
Pyridoacridine Alkaloids in a Zebrafish. Marine Drugs. Vol.8. P:1769-1778.
Williamson K. and K. Masters. 2010. Macroscale and Microscale Organic Experiments. Cengage Learning. P:131.
Wink, M. 1999. Functions of Plant Secondary Metabolites and Their Exploitation in Biotechnology. Taylor and Francis. P:1-3.