'
() )
engolahan limbah cair dengan proses kimia merupakan salah satu bagian
yang sangat penting dalam proses pengolahan limbah cair. Namun dalam
suatu sistem pengolahan limbah cair yang lengkap sebenarnya proses yang
terjadi meliputi ketiga proses, yaitu fisika, kimia dan biologi. Bahkan pada proses
fisika dan biologi pun didalamnya sering terjadi proses kimia secara bersamaan.
Untuk menanggulangi bahan pencemar anorganik, proses kimia umumnya menjadi
dominan dalam proses pengolahan limbah.
Untuk limbah yang mengandung COD (Chemical Oxygen Demand) tinggi,
jelas proses pengolahannya adalah proses kimia. Unit$unit sistem pengolahan dalam
proses kimia sebenarnya dapat pula disebut dengan reaktor, karena dalam proses
kimia umumnya selalu terjadi reaksi kimia dimana bahan pencemar dan bahan
penetral bereaksi sempurna untuk berubah menjadi senyawa baru yang tidak
berbahaya lagi.
Arah pembangunan nasional di Indonesia dalam sepuluh tahun terakhir ini
ditekankan pada sektor industri. Di setiap daerah, perkembangan sektor industri
sangat bergantung pada kondisi dan potensi alamnya, serta harus dilihat pula dari
peluang aspek pemasarannya. Peningkatan jumlah industri dimanapun adanya pasti
akan menghasilkan dampak positif maupun negatif. Akibat positif jelas terlihat dari
peningkatan PDRB daerah dan akibat negatif yang utama adalah berasal dari limbah
yang dihasilkannya. Banyak industri yang sudah berproduksi namun masih belum
mempunyai unit pengolahan limbahnya. Akibat selanjutnya adalah pencemaran
lingkungan dan masyarakatlah yang akan menjadi korbannya.
Limbah tidak hanya diproduksi oleh pabrik atau industri, tetapi masyarakat
juga merupakan penghasil limbah yang jumlahnya secara umum jauh lebih besar
dari pada jumlah limbah industri. Dengan demikian semakin banyaklah masalah
pencemaran yang sulit ditanggulangi sebagai akibat dari meningkatnya jumlah
limbah yang dibuang bebas ke alam lingkungan kita. Sebagai contoh, limbah cair
yang dibuang dan masuk ke badan air tanpa pengolahan yang sesuai dengan
standar yang berlaku.
Sayangnya hal ini tidak diikuti dengan ketentuan dan penegakkan hukum
yang tegas. Di lain pihak pemerintah belum cukup menyediakan fasilitas dan sarana
pengolahan limbah yang memadai. Oleh karena itu sebagai salah satu upaya untuk
menanggulangi masalah pencemaran limbah, pemerintah dan masyarakat harus
bersama berpartisipasi aktif dalam rangka meningkatkan sumber daya manusia
(human resource quality), khususnya bagi mereka yang terlibat dalam program$
program penanggulangan pencemaran limbah.
Secara umum limbah cair dapat digolongkan menjadi dua jenis, yaitu limbah
cair domestik dan limbah cair industri. Limbah cair domestik adalah limbah cair yang
keluar dari perumahan, gedung/tempat usaha/pertokoan dan perkantoran.
Sementara itu limbah cair industri adalah limbah cair yang keluar dari industri/pabrik.
Selama bertahun$tahun berbagai metode pengolahan air limbah telah banyak
dikembangkan.
Pada kebanyakan situasi, umumnya menggunakan kombinasi atau urutan dari
beberapa metode yang telah dikembangkan sebelumnya. Digunakannya suatu
urutan metode tertentu sangat tergantung pada kualitas air baku serta kualitas air
olahan yang diinginkan. Pada prinsipnya metode proses pengolahan air limbah dapat
digolongkan menjadi 3 jenis proses, yaitu proses fisika, proses kimia dan proses
biologi. Walaupun seringkali dalam suatu pengolahan ketiga proses ini
Pada bab berikut akan dibahas mengenai pengolahan limbah cair yang
khusus dengan proses kimia. Proses$proses yang akan dibahas adalah proses yang
telah umum diterapkan di instalasi$instalasi pengolahan limbah cair. Juga akan
ditampilkan teori$teori yang mendasari terjadinya setiap proses pengolahan serta
peralatan$peralatan yang umum digunakan.
Banyak instalasi pengolahan limbah menerapkan ketiga metode secara
berurutan untuk memperoleh produk akhir yang optimal dan memenuhi standar atau
syarat yang berlaku. Tetapi biasanya pengolahan air limbah dengan proses kimia
seringkali dipadukan dengan proses secara fisika dan gabungan dari keduanya
*
'
(
$
(
'
%'%
$
engolahan limbah cair secara kimia yang sering diterapkan adalah
disinfeksi, pengendapan materi terlarut (presipitasi), koagulasi (destabilisasi)
koloid, oksidasi dan ion exchange. Proses disinfeksi pada industri,
umumnya untuk menghambat pertumbuhan micro$organisme dalam pipa$pipa, pada
industri makanan untuk menghambat pertumbuhan bakteri. Proses presipitasi pada
industri untuk pelunakan air, penghilangan besi dan penghilangan ion terlarut seperti
PO4$3 dan logam berat. Koagulasi diterapkan untuk destabilisasi partikel koloid yang
umumnya juga terdapat pada air limbah. Oksidasi kimia seperti khlorinasi dan
ozonisasi, diterapkan untuk menghilangkan atau memecah ion$ion seperti Fe+2, Mn+2
dan CN$.
Disinfeksi adalah istilah untuk proses penghancuran organisme penyebab
penyakit, sementara itu sterilisasi adalah istilah untuk proses total penghancuran
semua organisme. Dalam proses disinfeksi pada pengolahan air limbah terjadi
pemaparan antara bahan penghancur dengan organisme. Pada umumnya terjadi
penghancuran virus, bakteri dan protozoa yang terdapat dalam air. Beberapa metode
disinfeksi yaitu :
(1) Penambahan zat kimia;
(2) Penggunaan materi fisik, seperti panas dan cahaya;
Metode yang paling banyak digunakan adalah metode penambahan bahan
kimia. Penggunaan zat khlor (khlorinasi) merupakan cara yang paling banyak
digunakan, namun kekurangan dari sistem ini adalah dapat menghasilkan senyawa
carcinogen seperti trihalomethane dan chloroform. Sistem lain yang sering pula
digunakan adalah penggunaan ozone, namun kekurangan sistem ini ialah tidak
meninggalkan sisa konsentrasi untuk mencegah organisme tumbuh kembali. Kedua
proses masing$masing mempunyai kekurangan, sehingga dalam penerapannya
sangat tergantung pada kondisi.
Khlorinasi banyak digunakan pada pengolahan dan penyediaan air domestik,
disamping itu sering pula digunakan pada air limbah yang telah diolah. Zat khlor
merupakan zat pengoksidasi, oleh karena itu jumlah khlor yang dibutuhkan
tergantung pada konsentrasi organik dan zat NH3$N dalam air yang diolah.
Kebutuhan zat khlor untuk air limbah rata$rata 40 hingga 60 mgr/l. Pada umumnya
zat khlor dimasukkan ke dalam air dalam bentuk gas Cl2, khlor dioksida (ClO2),
sodium hipokhlorit (NaOCl) dan calsium hipokhlorit Ca(OCl)2. Khlor bentuk calcium
hipokhlorit lebih banyak digunakan dari pada bentuk gas, karena penanganannya
lebih mudah.
Apabila khlor dalam bentuk gas ditambahkan ke dalam air limbah, akan terjadi
2 reaksi yaitu reaksi hidrolisa dan reaksi ionisasi. Pada reaksi hidrolisa terbentuk
hipokhlorit (HOCl) dan pada reaksi ionisasi terbentuk ion (OCl$). Reaksi
keseimbangannya sebagai berikut:
Reaksi hidrolisa : Cl2 + H2O → HOCl + H+ + Cl$
Sisa khlor didefinisikan sebagai jumlah (HOCl) dan OCl$ , biasanya digunakan
pula sebagai ukuran keefektifan khlor. Jumlah sisa khlor sebagai standar pada
sistem penyediaan air adalah 0,5 – 1,0 gr/m3. Sisa khlor dapat digunakan pula
sebagai ukuran jumlah khlor yang masih ada. Dari ketiga bentuk hasil reaksi, bentuk
(HOCl) merupakan bentuk yang paling efektif sebagai disinfektan.
Reaksi hipokhlorit dengan amonia menghasilkan senyawa khloramin dan gas
nitrogen (N2) serta oksida nitrogen (N2O).
Reaksi yang terjadi adalah sebagai berikut :
HOCl + NH3 → NH2Cl (monochloramine) + H2O
HOCl + NH2Cl → NHCl2 (dichloramine) + H2O
HOCl + NHCl2 → NCl3 (nitrogen trichloride) + H2O
Reaksi$reaksi tersebut sangat tergantung pada pH, temperatur, waktu kontak
dan rasio awal antara chlorine dengan amonia. Pada umumnya senyawa yang paling
dominan adalah monochloramine dan dichloramine. Chlorine yang ada dalam
senyawa$senyawa tersebut disebut chlorine terikat yang tersedia. Chloramine
!
Breakpoint khlorinasi adalah angka pada saat jumlah khlor cukup untuk
menghasilkan sisa khlor bebas. Terdapat 4 tahap yang terlibat dalam hal ini, yaitu:
Tahap 1 : zat$zat yang mudah teroksidasi, yaitu Fe2+, H2S dan zat$zat organik
bereaksi terlebih dahulu menghasilkan khlorida.
Tahap 2 : terbentuk senyawa chloramine dan chloroorganik
Tahap 3 : penambahan khlor selanjutnya akan mengoksidasi senyawa$senyawa
di tahap 2, menghasilkan N2O, khlorida, dan N2, reaksinya sebagai berikut :
NH2Cl + NHCl2 + HOCl → N2O + 4 HCl
2 NH2Cl + HOCl → N2 + H2O + 3 HCl
Tahap 4 : tahap breakpoint, semua chloramine dan sebagian besar senyawa
chloroorganik telah dioksidasi. Penambahan khlor selanjutnya akan
menghasilkan sisa khlor bebas (HOCl) dan (OCl$).
"#
Ozon (O3) adalah suatu bentuk allotropik oksigen yang diproduksi dengan
cara melewatkan oksigen kering atau udara dalam suatu medan listrik (5000 –
20.000 V; 50 – 500 Hz). Ozon bersifat tidak stabil, merupakan gas berwarna biru
yang sangat toksik dengan bau seperti rumput kering. Ozon adalah oksidator kuat
yang sangat efisien untuk disinfeksi. Sebagaimana oksigen, kelarutan ozon dalam air
cukup rendah dan karena sifatnya yang tidak stabil maka disinfeksi dengan ozon
Pengolahan disinfeksi dengan ozon jauh lebih mahal dari pada disinfeksi
dengan khlor, namun ozon memberi keuntungan yaitu dapat menghilangkan warna.
Dalam hal ini pengolahan air dengan filtrasi dan ozonisasi dapat menghasilkan
kualitas air yang setara dengan proses koagulasi, sedimentasi, filtrasi dan khlorinasi.
Oleh karena ozon tidak memberikan sisa, maka dalam sistem distribusi tidak akan
terdapat ozon sehingga akan timbul masalah dengan adanya pertumbuhan kembali
mikroorganisme yang disertai masalah bau dan warna. Pertumbuhan mikro$
organisme dalam sistem perpipaan dapat diatasi dengan penambahan khlor dosis
rendah setelah proses ozonisasi. Pada pengolahan limbah industri ozon dapat
digunakan untuk mengoksidasi zat$zat yang non$biodegradable.
Terdapat dua macam ozonizer :
1. Tipe plate dengan elektroda datar dan isolator gelas (glass dielectrics);
2. Tipe tabung dengan elektroda silinder koaksial (cylindrical electrodes coaxial)
dan isolator gelas silinder.
Sisi yang mempunyai tegangan tinggi didinginkan dengan konveksi (pemindahan
panas dengan sirkulasi), sedangkan sisi yang bertegangan rendah didinginkan
dengan air. Udara dilewatkan diantara elektroda$elektroda dan terozonisasi oleh
tegangan listrik yang ada diantara udara tersebut. Produksi ozon biasanya sampai 4
% berat udara yang dilewatkan dengan kebutuhan energi sekitar 25 kwh/kg ozon
yang dihasilkan.
$
%
Berbagai bentuk radiasi dapat dijadikan disinfeksi yang efektif. Radiasi ultra
violet (UV) telah bertahun$tahun digunakan untuk pengolahan air skala kecil. Reaksi
disinfeksi UV pada panjang gelombang sekitar 254 nm merupakan radiasi yang
sangat kuat apabila organisme benar$benar terpapar oleh radiasi. Oleh karena itu
reflektor yang dilapisi metal dengan waktu pemaparan beberapa detik, namun energi
yang diperlukan cukup tinggi yaitu sekitar 10 – 20 watt/m3/jam. Keuntungan disinfeksi
dengan UV antara lain : pemeliharaan minimum, tidak menimbulkan dampak bau
dan rasa, tidak menimbulkan bahaya apabila terjadi overdosis. Sedangkan
kelemahannya antara lain: tidak memiliki residu disinfeksi, biaya mahal dan
memerlukan klarifikasi air lebih sempurna.
!
Pemisahan zat anorganik terlarut tertentu dapat dilakukan dengan
penambahan suatu reagen yang sesuai untuk merubah anorganik terlarut menjadi
presipitat/endapan, sehingga dapat dipisahkan dengan cara pengendapan /
sedimentasi. Tingkat pemisahan yang dapat dicapai tergantung pada nilai kelarutan
senyawa yang dihasilkan dan hal ini biasanya dipengaruhi oleh beberapa faktor
seperti pH dan temperatur.
Reaksi presipitasi/pengendapan beberapa zat anorganik dan hasil$hasil
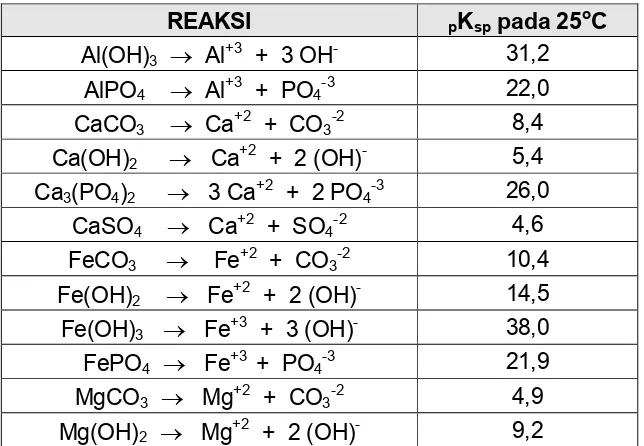
[image:10.612.146.468.480.703.2]terlarutnya dapat dilihat pada tabel berikut.
Tabel 1. Reaksi Presipitasi Dan Harga Konstanta Kesetimbangannya.
& ' ! !! (
Al(OH)3 → Al+3 + 3 OH$ 31,2
AlPO4 → Al+3 + PO4$3 22,0
CaCO3 → Ca+2 + CO3$2 8,4
Ca(OH)2 → Ca+2 + 2 (OH)$ 5,4
Ca3(PO4)2 → 3 Ca+2 + 2 PO4$3 26,0
CaSO4 → Ca+2 + SO4$2 4,6
FeCO3 → Fe+2 + CO3$2 10,4
Fe(OH)2 → Fe+2 + 2 (OH)$ 14,5
Fe(OH)3 → Fe+3 + 3 (OH)$ 38,0
FePO4 → Fe+3 + PO4$3 21,9
MgCO3 → Mg+2 + CO3$2 4,9
Proses presipitasi banyak diterapkan dalam pengolahan limbah industri,
misalnya untuk memisahkan metal$metal yang tidak dikehendaki, misalnya
penghilangan kesadahan dan penghilangan phosphat.
Kesadahan adalah istilah yang digunakan pada air yang mengandung kation
penyebab kesadahan. Pada umumnya kesadahan disebabkan oleh adanya logam$
logam atau kation$kation yang bervalensi 2, seperti Fe, Sr, Mn, Ca dan Mg, tetapi
penyebab utama dari kesadahan adalah kalsium (Ca) dan magnesium (Mg).
Kesadahan dalam air sangat tidak dikehendaki baik untuk penggunaan rumah
tangga maupun untuk penggunaan industri. Bagi air rumah tangga tingkat
kesadahan yang tinggi mengakibatkan konsumsi sabun lebih banyak karena sabun
jadi kurang efektif akibat salah satu bagian dari molekul sabun diikat oleh unsur
Ca/Mg. Bagi air industri unsur Ca dapat menyebabkan kerak pada dinding peralatan
sistem pemanasan sehingga dapat menyebabkan kerusakan pada peralatan industri,
dan disamping itu dapat menghambat proses pemanasan. Kesadahan dapat
dihilangkan dengan dua cara yaitu melalui proses presipitasi dengan kapur dan soda
abu ( Na2CO3) atau disebut juga proses kapur soda, dan melalui sistem ion
exchange.
Kesadahan air dapat dibedakan atas 2 macam, yaitu kesadahan sementara
(temporer) dan kesadahan tetap (permanen). Kesadahan sementara disebabkan
oleh garam$garam karbonat (CO32$) dan bikarbonat (HCO3$) dari kalsium dan
magnesium, kesadahan ini dapat dihilangkan dengan cara pemanasan atau dengan
pembubuhan kapur soda. Kesadahan tetap disebabkan oleh adanya garam$garam
khlorida (Cl$) dan sulfat (SO42$) dari kalsium dan magnesium. Kesadahan ini disebut
juga kesadahan non karbonat yang tidak dapat dihilangkan dengan cara
!)
Pada proses ini tujuannya adalah untuk membentuk garam$garam kalsium
dan magnesium menjadi bentuk garam$garam yang tidak larut, sehingga dapat
diendapkan dan dapat dipisahkan dari air. Bentuk garam kalsium dan magnesium
yang tidak larut dalam air adalah :
$ Kalsium Karbonat (CaCO3)
$ Magnesium Hidroksida (Mg(OH)2)
Untuk menghilangkan kesadahan sementara kalsium, ditambahkan kapur.
Reaksi yang terjadi :
Ca(HCO3)2 + Ca(OH)2
⇄
2 CaCO3 ↓ + 2 H2OUntuk menghilangkan kesadahan tetap kalsium, ditambahkan soda abu.
Reaksi yang terjadi :
CaSO4 + Na2CO3
⇄
CaCO3↓ + Na2SO4CaCl2 + Na2CO3
⇄
CaCO3↓ + 2 NaClUntuk menghilangkan kesadahan magnesium sementara, ditambahkan kapur.
Tahap 1 :
Mg(HCO3)2 + Ca(OH)2
⇄
MgCO3 + CaCO3↓ + 2 H2OTahap 2 :
Untuk menghilangkan kesadahan magnesium tetap ditambahkan kapur + soda abu
Tahap 1 :
MgCl2 CaCl2
+ Ca(OH)2
⇄
Mg(OH)2↓ +MgSO4 CaSO4
Tahap 2 :
CaCl2 NaCl
+ Na2CO3
⇄
CaCO3 ↓ +CaSO4 Na2SO4
!
Pada tahun 1960 $ an alkyl benzene sulfonate (ABS) yang nonbiodegradable
telah digantikan dengan linear alkyl sulfonate (LAS) yang biodegradable. Namun
kekurangannya bagian hidrophilik dari LAS mengandung grup phosphat, sehingga
proses biodegradasi mengeluarkan phosphat ke dalam larutan.yang dapat
menimbulkan proses eutrophication. Oleh karena itu phosphat dihilangkan dengan
Fe+3, Al+3 atau Ca+2. Proses penghilangan phosphat sama dengan proses
pelunakan. Pemilihan ion pengendap tergantung pada pH air limbah.
Pengendapan dengan alum adalah sebagai berikut :
Al2(SO4)3 + 2 PO4$3
⇄
2 AlPO4↓ + 3 SO4$2Pengendapan dengan kapur adalah sebagai berikut :
!
*
Proses presipitasi digunakan pula pada pengendapan logam$logam,
disamping itu pada pengendapan sulfat dan fluor. Pengendapan sulfat dilakukan
dengan sistem presipitasi dingin gypsum CaSO4.2H2O. Pada proses ini ditambahkan
ion Ca2+ dalam bentuk kapur atau CaCl2. Reaksi kimianya adalah sebagai berikut :
SO42$ + Ca2+ + 2 H2O
⇄
CaSO4.2H2O ↓Untuk pengendapan zat fluor ditambahkan CaCl2, reaksi kimianya adalah
sebagai berikut :
2 F$ + Ca2+
⇄
CaF2↓Pada pengendapan logam biasanya dalam bentuk hidroksida, dengan cara
menetralkan efluent yang bersifat asam. Kondisi pH yang optimum untuk presipitasi
logam berkisar antara 7 – 10,5 .
)
Koagulasi adalah proses destabilisasi partikel koloid dengan cara
penambahan senyawa kimia yang disebut koagulan. Koloid mempunyai ukuran
tertentu sehingga gaya tarik menarik antara partikel lebih kecil dari pada gaya tolak
menolak akibat muatan listrik. Pada kondisi stabil ini penggumpalan partikel tidak
terjadi dan gerakan Brown menyebabkan partikel tetap berada sebagai suspensi.
Melalui proses koagulasi terjadi destabilisasi, sehingga partikel$partikel koloid
bersatu dan menjadi besar. Dengan demikian partikel$partikel koloid yang pada
awalnya sukar dipisahkan dari air, setelah proses koagulasi akan menjadi kumpulan
partikel yang lebih besar sehingga mudah dipisahkan dengan cara sedimentasi,
Bahan kimia yang sering digunakan untuk proses koagulasi umumnya
diklasifikasikan menjadi tiga golongan, yakni Zat Koagulan, Zat Alkali dan Zat
Pembantu Koagulan. Zat koagulan digunakan untuk menggumpalkan partikel$partikel
padat tersuspensi, zat warna, koloid dan lain$lain agar membentuk gumpalan partikel
yang besar (flok). Sedangkan zat alkali dan zat pembantu koagulan berfungsi untuk
mengatur pH agar kondisi air baku dapat menunjang proses flokulasi, serta
membantu agar pembentukan flok dapat berjalan dengan lebih cepat dan baik.
)
Pemilihan zat koagulan harus berdasarkan pertimbangan, antara lain jumlah
dan kualitas air yang akan diolah, kekeruhan air baku, metode filtrasi serta sistem
pembuangan lumpur endapan. Koagulan yang sering dipakai antara lain Aluminium
Sulfat (alum), Ferry Chloride dan Poly Aluminium Chloride (PAC). Di samping itu ada
senyawa polimer tertentu yang dapat dipakai bersama$sama dengan senyawa
koagulan lainnya.
) ) ) + ) ,- + " , . / "
Alum merupakan bahan koagulan yang banyak dipakai untuk pengolahan air
karena harganya murah, flok yang dihasilkan stabil serta cara pengerjaannya mudah.
Garam aluminium Sulfat jika ditambahkan kedalam air dengan mudah akan larut dan
bereaksi dengan HCO3$ menghasilkan aluminium hidroksida yang mempunyai
muatan positip. Sementara itu partikel$parikel koloidal yang terdapat dalam air baku
biasanya bermuatan negatip dan sukar mengendap karena adanya gaya tolak
menolak antar partikel koloid tersebut. Dengan adanya hidroksida aluminium yang
bermuatan positip maka akan terjadi tarik menarik antara partikel koloid yang
bermuatan negatip dengan partikel aluminium hidroksida yang bermuatan positip
sehingga terbentuk gumpalan partikel yang makin lama makin besar dan berat dan
Selain partikel$partikel koloid juga partikel zat organik tersuspensi, zat
anorganik, bakteri dan mikroorgaisme yang lain dapat bersama$sama membentuk
gumpalan partikel (flok) yang akan mengendap bersama$sama. Jika alkalinitas air
baku tidak cukup untuk dapat bereaksi dengan alum, maka dapat ditambahkan kapur
(lime) atau soda abu agar reaksi dapat berjalan dengan baik.
Reaksi kimianya secara sederhana dapat ditunjukkan sebagai berikut :
Al2(SO4)3.18 H2O + 3 Ca(HCO3)2 → 2 Al(OH)3 + 3 Ca(SO4) + 6 CO2 + 18 H2O
Al2(SO4)3.18 H2O + 3 Ca(HCO3)2 → 2 Al(OH)3 + 3 CaSO4 + 6 CO2 + 18 H2O
Al2(SO4)3.18 H2O + 3 Mg(HCO3)2 → 2 Al(OH)3 + 3 MgSO4 + 6 CO2 + 18 H2O
Al2(SO4)3.18 H2O + 6 Na(HCO3) → 2 Al(OH)3 + 3 Na2SO4 + 6 CO2 + 18 H2O
Al2(SO4)3.18 H2O + 3 Na2(CO3) → 2 Al(OH)3 + 3 Na2SO4 + 18 H2O
Al2(SO4)3.18 H2O + 6 Na(OH) → 2 Al(OH)3 + 3 Na2SO4 + 3 CO2 + 18 H2O
Al2(SO4)3.18 H2O + 3 Ca(OH)2 → 2 Al(OH)3 + 3 CaSO4+ 18 H2O
Aluminium sulfat atau alum, diproduksi dalam bentuk padatan atau dalam
bentuk cair. Alum ini banyak dipakai karena harganya relatip murah dan efektif untuk
air baku dengan kekeruhan yang tinggi serta sangat baik untuk dipakai bersama$
sama dengan zat koagulan pembantu. Dibandingkan dengan koagulan dari garam
besi, alum tidak menimbulkan pengotoran yang serius pada dinding bak. Salah satu
kekurangannya yakni flok yang terjadi lebih ringan dari pada flok yang dihasilkan
koagulan garam besi dan selang pH operasi lebih sempit yakni 5,5 $ 8,5. Alum padat
mempunyai berat jenis sekitar 1,62 dan dalam bentuk butiran kasar mempunyai
berat jenis semu (apparent density) + 0,5. Sedangkan untuk butiran halus
mempunyai berat jenis semu 0,6 $ 0,7. Alum padat umumnya dipakai dalam bentuk
larutan dengan konsentrasi 5 $ 10 % untuk skala kecil dan untuk skala besar 20 $ 30
Akhir$akhir ini alum cair banyak digunakan karena cara pengerjaannya
maupun transportasinya mudah. Tetapi pada suhu yang rendah dan konsentrasi
yang tinggi akan terjadi pengkristalan Al2O3 yang menyebabkan penyumbatan pada
perpipaan. Oleh karena itu, untuk pemakaian alum cair, konsentrasi Al2O3 harus
diatur pada konsentrasi tertentu, biasanya sekitar 8 $ 8,2 %.
) - +0/ , + " , + " , / "
Merupakan garam rangkap Amonium Aluminium Sulfat. Kelarutan dalam air
memerlukan waktu lebih lama dari pada Alum dan daya koagulasinya lebih rendah.
Penggunaanya biasanya terbatas untuk instalasi kecil dan untuk air baku dengan
kekeruhan yang tidak begitu tinggi. Misalnya untuk kolam renang, industri kecil dan
lainnya. Pembubuhannya dapat dilakukan dengan cara sederhana yakni dengan alat
bubuh tipe pot (pot type feeder). Amonia Alum diletakkan dalam suatu bejana, lalu air
dilewatkan kedalam bejana tesebut sehingga sebagian alum larut. Selanjutnya
larutan yang terjadi diinjeksikan ke air baku.
) ) - 0 "
Sodium Aluminat dibuat dengan melarutkan Al2O3 ke dalam larutan NaOH.
Daya koagulasinya tidak begitu kuat. Dapat bersifat sebagai koagulan dan zat alkali
serta efektif untuk menghilangkan zat warna. Sering digunakan untuk pengolahan air
boiler dan jarang digunakan untuk pengolahan air minum. Biasanya digunakan
bersama$sama dengan alum karena dapat membentuk flok dengan cepat. Reaksi
kimia antara Sodium Aluminat dengan alum dan karbon dioksida adalah sebagai
berikut :
6 NaAlO2 + Al2(SO4)3.18H2O → 8 Al(OH)3 + 3 Na2SO4 + 18 H2O + 6 H2O
1 ) ) + !! ,
Secara komersial Ferro sulfat diproduksi dalam bentuk kristal berwarna hijau
atau butiran (granular) untuk pembubuhan kering dengan kandungan Fe(S04) kira$
kira 55 %. Ferro Sulfat bereaksi dengan alkalinitas alami tetapi dibanding reaksi
antara alum dengan HCO $ , lebih lambat. Biasanya digunakan bersama$sama
dengan kapur (lime) untuk menaikkan pH, sehingga ion ferro terendapkan dalam
bentuk ferri hidroksida, Fe(OH)3 . Ferrous Sulfate ini kurang sesuai untuk
menghilangkan warna, akan tetapi sangat baik untuk pengolahan air yang
mempunyai alkalinitas, kekeruhan dan DO yang tinggi. Kondisi pH yang sesuai yakni
antara 9,0 $ 11,0.
Reaksinya adalah sebagai berikut :
2 Fe(SO4).7 H2O + 2 Ca(HCO3)2 + 1/2 O2 → 2 Fe(OH)3 + 4 CO2 + 2 Ca(SO4) + 13 H2O
2 Fe(SO4).7 H2O + 2 Ca(OH)2 + 1/2 H2O → 2 Fe(OH)3 + 2 Ca(SO4) + 13 H2O
Proses ini biasanya lebih murah dibandingkan dengan alum, tetapi penggunaan dua
macam bahan mengakibatkan prosesnya lebih sulit. Disamping itu pengolahan air
dengan menggunakan ferro sulfat dan kapur dapat memperbesar kesadahan air.
( !!
Cara ini merupakan metode lain dari penggunaan ferro sulfat sebagai
koagulan. Dalam proses ini khlorine ditambahkan untuk mengoksidasi ferro sulfat
menjadi ferri sulfat. Reaksinya adalah sebagai berikut :
3 Fe(SO4) + 1,5 Cl2 → Fe2(SO4)3 + FeCl3 + 13 H2O
Secara teoritis 1,0 lb khlorine dapat mengoksidasi 7,8 lb copperas. Tetapi untuk
mendapatkan hasil yang baik pembubuhan khlorine biasanya sedikit berlebih dari
2 1 - 1 / "
Ferri khlorida dan ferri sulfat merupakan bahan koagulan dengan nama
dagang bermacam$macam. Dapat bereaksi dengan bikarbonat (alkalinitas) atau
kapur. Reaksinya adalah sebagai berikut :
2 FeCl3 + 3 Ca(HCO3)2 → 2 Fe(OH)3 + CaCl2 + 21 H2O
2 FeCl3 + 3 Ca(OH)2 → 2 Fe(OH)3 + 3 CaCl2
Keuntungan dari koagulan garam ferric antara lain, yakni proses koagulasi
dapat dilakukan pada selang pH yang lebih besar, biasanya antara pH 4 $ 9. Flok
yang terjadi lebih berat sehingga cepat mengendap, serta efektif untuk
menghilangkan warna, bau dan rasa.
3 * ) ) + ,
Poly Aluminium Chloride (PAC) merupakan bentuk polimerisasi kondensasi
dari garam aluminium, berbentuk cair dan merupakan koagulan yang sangat baik.
Mempunyai dosis yang bervariasi dan sedikit menurunkan alkalinitas. Daya
koagulasinya lebih besar dari pada alum dan dapat menghasilkan flok yang stabil
walaupun pada suhu yang rendah serta pengerjaannyapun mudah.
Dibandingkan dengan Aluminium Sulfat, PAC mempunyai beberapa kelebihan
yakni kecepatan pembentukan floknya cepat dan flok yang dihasilkan mempunyai
kecepatan pengendapan yang besar yakni 3 $ 4,5 cm/menit, dan dapat menghasilkan
flok yang baik meskipun pada suhu rendah. Dari segi teknik dan ekonomi, alum
biasanya dipakai pada saat kondisi air baku yang normal, sedangkan poly aluminium
chloride dipakai pada saat temperatur rendah atau pada saat kekeruhan air baku
)
)
Pada saat kekeruhan air baku tinggi, misalnya setelah hujan, pada saat
musim dingin ataupun pada saat permintaan produksi meningkat, maka jika
memakai zat koagulan saja sering kali pembentukan flok kurang baik. Untuk
mengatasi hal tersebut yaitu dengan memakai koagulan pembantu sehingga
pembentukan flok berjalan dengan lebih baik.
Pemilihan jenis zat koagulan pembantu harus dapat menghasilkan flok yang
baik / stabil dan tidak berbahaya ditinjau dari segi kesehatan. Disamping itu juga
harus ekonomis serta pengerjaannya mudah. Sebagai bahan koagulan pembantu
yang sering dipakai, yakni silika aktif (activated silic acid) dan sodium alginat (sodium
alginic acid). Pada keadaan biasa/normal dosis silika aktif yakni 1 $ 5 ppm sebagai
SiO2 dan untuk sodium alginat yakni antara 0,2 $ 2 ppm.
)
Partikel$partikel pengotor dalam air baku yang mempunyai ukuran dengan
diameter 10$2 mm dapat dipisahkan dengan cara pengendapan biasa tanpa bahan
kimia. Tetapi untuk partikel yang sangat halus dengan ukuran lebih kecil 10$2 mm dan
juga partikel$partikel koloid sulit untuk dipisahkan dengan pengendapan tanpa bahan
kimia serta masih tetap lolos jika disaring dengan saringan pasir cepat.
Oleh karena itu di dalam sistem pengolahan air dengan saringan pasir cepat,
proses koagulasi sangat penting agar partikel koloid yang sulit mengendap tadi dapat
digumpalkan sehingga membentuk grup partikel yang lebih besar dan berat yang
dengan cepat dapat diendapkan atau disaring. Untuk itu perlu bak koagulasi untuk
Proses koagulasi dibagi menjadi dua tahap. Pertama yaitu koagulasi partikel$
partikel kotoran menjadi flok$flok yang masih halus/kecil dengan cara pengadukan
cepat segera setelah koagulan dibubuhkan. Tahap ini disebut dengan pencampuran
cepat dan prosesnya dilakukan pada bak pencampur cepat (mixing basin). Tahap
selanjutnya adalah proses pertumbuhan flok agar menjadi besar dan stabil, yaitu
dengan cara pengadukan lambat pada bak flokulator. Proses tersebut dinamakan
flokulasi. Dengan demikian untuk proses koagulasi$flokulasi diperlukan dua buah bak
yakni untuk bak pencampur cepat dan bak flokulator.
4
!)
!
Bak pencampur cepat harus dilengkapi dengan alat pengaduk cepat agar
bahan kimia (koagulan) yang dibubuhkan dapat bercampur dengan air baku secara
cepat dan merata. Oleh karena kecepatan hidrolisa koagulan dalam air besar, maka
diperlukan pembentukan flok$flok halus dari koloid hidroksida yang merata dan
secepat mungkin sehingga dapat bereaksi dengan partikel$partikel kotoran
membentuk flok yang lebih besar dan stabil. Untuk itu diperlukan pengadukan yang
cepat. Ada dua cara pengadukan yang dapat dipakai, yaitu pengadukan dengan
energi yang ada dalam air itu sendiri dan pengadukan dengan energi yang didapat
dari luar.
) & ' )
Dapat dilakukan dengan cara aliran dalam bak/kolam dengan sekat horizontal
maupun vertikal (baffled flow type). Atau dapat juga dengan membuat aliran turbulen
dalam sistem perpipaan dengan kecepatan aliran di atas 1,5 m/detik. Selain cara
tersebut di atas dapat juga dilakukan dengan Parshall flume ataupun dengan cara
) & 5 )
Cara yang paling umum dipakai yaitu dengan flush mixer yang berupa motor
dengan alat pengaduk berupa baling$baling (propeler) maupun paddle, dengan
kecepatan rotasi lebih kecil 1,5 m/detik. Waktu pengadukan standar antara 1 $ 5
menit. Cara yang lain yaitu dengan mendifusikan koagulan ke dalam air baku dengan
pompa difusi (diffusion pump).
( "
Bahan kimia oksidant seperti oksigen, Khlorine, permanganat, ozon dan
hidrogen peroksida digunakan sebagai zat pengoksidasi pada proses pengolahan air
limbah. Oksidasi dengan khlor telah dibahas pada pembahasan khlorinasi, tiga
proses reaksi oksidasi penting lainnya adalah penghilangan besi, mangan dan
sianida.
Pada pengolahan air limbah industri, sering dijumpai kandungan sianida yang
biasanya terdapat pada buangan industri ekstraksi emas dan perak atau pada
industri pelapisan logam. Ion sianida (CN$) bersifat racun, oleh karena itu harus
dihilangkan terlebih dahulu sebelum buangan dialirkan ke perairan terbuka atau
badan air.
Metode yang umum dipakai adalah oksidasi dengan Cl2 atau NaOCl. Apabila
digunakan Cl2, perlu ditambahkan NaOH, reaksinya adalah sebagai berikut :
CN$ + 2 NaOH + Cl2 → CNO$ + 2 NaCl + H2O
Reaksi oksidasi CN$ dengan NaOCl adalah sebagai berikut :
Reaksi diatas berlangsung pada keadaan pH alkali yaitu antara 8,5 dan 11. Apabila
pH lebih kecil dari 7, cyanate terhidrolisa sebagai berikut :
CNO$ + 2 H+ + H2O → NH4+ + CO2
Penambahan Cl2 pada pH sedikit basa terjadi oksidasi CNO$ menjadi N2 dan CO2,
reaksinya sebagai berikut :
2 CNO$ + 3 Cl2 + 4 NaOH → N2 + 2 Cl$ + 4 NaCl + 2 H2O + 2 CO2
2
)
'
+'
&64
,
Proses ion exchange dilakukan untuk menghilangkan ion$ion yang tidak
diinginkan seperti Ca+2, Mg+2, Fe+2 dan NH4+ . Media penukar adalah fasa padat
terbuat dari bahan mineral atau resin sintetik yang terdiri dari ion bergerak yang
menempel pada grup fungsional tetap, yang dapat bersifat asam atau basa. Pada
proses penukaran, ion bergerak ditukar dengan ion terlarut yang terdapat dalam air.
Sebagai contoh Ca+2 ditukar dengan Na+ atau SO4$2 ditukar dengan Cl$.
Bahan penukar ion pada awalnya menggunakan bahan yang berasal dari
alam yaitu greensand yang biasa disebut zeolit. Zeolit biasa digunakan untuk
menghilangkan kesadahan dan menghilangkan ion amonium. Zeolit yang digunakan
untuk pelunakan adalah aluminosilicates komplek dengan ion bergeraknya ion
sodium. Untuk penghilangan amonium digunakan zeolit clinoptilolite, disamping itu
terdapat pula zeolit sintetis.
Pada saat ini bahan$bahan tersebut sudah diganti dengan bahan yang lebih
efektif yang disebut resin penukar ion. Resin penukar ion umumnya terbuat dari
partikel cross$linked polystyrene. Sistem penukar ion biasanya diterapkan pada
Reaksi penukar ion untuk zeolit dan resin adalah sebagai berikut :
Untuk zeolit alam (Z) :
Ca+2 Ca+2
Na2 Z + Mg+2 → Mg+2 Z + 2 Na+
Fe+2 Fe+2
Untuk resin sintetis (R):
$ Penukar kation asam kuat :
RSO3H + Na+ → RSO3Na + H+
2 RSO3Na + Ca+2 → (RSO3)2Ca + 2 Na+
$ Penukar kation asam lemah :
RCOOOH + Na+ → RCOONa + H+
RCOONa + Ca+ → (RCOONa)2Ca + 2 Na+2
$ Penukar anion basa kuat :
RR’3NOH + Cl$ → RR’3NCl + OH$
2 RR’3NCl + SO4$2→ (RR3N)2SO4 + 2 Cl$
$ Penukar anion basa lemah :
RNH3OH + Cl$ → RNH3Cl + OH$
2
Setelah proses penukar ion beroperasi beberapa waktu, akan terjadi
kejenuhan dan pada kondisi seperti ini tercapai keseimbangan dengan air baku.
Untuk itu perlu dilakukan regenerasi. Pada proses regenerasi senyawa asli garam
yang berperan sebagai ion bergerak (mobile ion) dikontakkan dengan resin yang
telah jenuh, maka keseimbangan akan cenderung bergeser ke kondisi asli. Pada
proses pelunakan air dan proses penukar kation lainnya, regenerasi biasanya
menggunakan garam dapur (NaCl).
Contoh reaksi regenerasi dengan garam dapur :
Ca Ca
R + 2 NaCl → Na2R + Cl2
Mg Mg
2
!
)
Kemampuan resin dalam menghilangkan kesadahan disebut sebagai
kapasitas penukaran. Angka kapasitas dapat ditetapkan melalui pengukuran jumlah
kesadahan yang dapat dihilangkan oleh satuan volume resin atau satuan berat resin,
misalnya 1 kg CaCO3 per 1 m3 resin. Angka kapasitas dapat pula sebagai jumlah
ekivalen kation atau anion yang dapat ditukar per unit berat penukar ion.
Pada umumnya kapasitas penukar resin berkisar antara 2 sampai 10 eq/kg
resin. Kapasitas penukar zeolit berkisar antara 0,05 sampai 0,1 eq/kg zeolit.
Pengukuran lain adalah jumlah garam yang diperlukan untuk regenerasi per
+
'
$
$
%
)
'
(
$
(
ntuk menentukan desain unit instalasi pengolahan air limbah di suatu
wilayah diperlukan beberapa hal yang perlu dipertimbangkan, yaitu :
Periode desain
Daerah layanan
Pemilihan lokasi
Penduduk yang dilayani
Peraturan yang mengkontrol limbah cair dan standar efluent
Karakteristik limbah cair
Tingkat pengolahan
Pemilihan proses
Pemilihan peralatan
Tata letak dan profil hidrolik
Kebutuhan energi dan sumber$sumber lainnya.
Analisa ekonomi
Pengkajian aspek lingkungan
Umumnya desain pengolahan limbah cair direncanakan untuk lebih dari 10
tahun, sehingga kapasitas pengolahan dapat memenuhi untuk pertambahan volume
limbah cair pada waktu yang akan datang. Menurut petunjuk perencanaan dari
program konstruksi, periode desain dapat dibagi dalam beberapa tahap yaitu 10, 15
dan 30 tahun tergantung dari jumlah debit limbah cair.
Daerah pelayanan tergantung dari daerah yang akan dilayani. Hal ini
dilakukan untuk pengolahan limbah cair perkotaan. Untuk pelayanan industri atau
komersil ditentukan dengan melihat dahulu jenis atau kegiatan proses, serta jumlah
limbah cairnya yang akan diolah. Pemilihan lokasi untuk pembangunan fasilitas
pengolahan limbah cair terutama untuk yang berkapasitas besar perlu
mempertimbangkan badan air penerima, tata guna tanah baik secara ekonomi,
sosial, lingkungan dan batasan teknologi.
Jumlah penduduk yang dilayani menentukan jumlah debit limbah cair rumah
tangga yang akan diolah. Jumlah debit limbah cair diperkirakan kurang lebih 70 %
dari jumlah penyediaan air bersih. Penentuan peningkatan jumlah penduduk dapat
dilakukan dengan memperkirakan beberapa metode, misalnya metode aritmetik dan
geometrik.
Ada beberapa peraturan yang berhubungan dengan limbah cair dan
menyatakan standar efluent yang diijinkan. Peraturan tersebut adalah KEPMEN
LK.No.51/MENLH/10/1995 tentang Baku Mutu Limbah Cair bagi Kegiatan Industri;
KEPMEN LK.No.51/MENLH/10/1995 tentang Baku Mutu Limbah Cair bagi Kegiatan
Hotel; KEPMEN LK.No.51/MENLHh/12/1995 tentang Baku Mutu Limbah Cair bagi
Kegiatan Rumah Sakit. Berdasarkan peraturan ini maka desain pengolahan
diarahkan untuk mencapai standard efluen limbah cair yang diijinkan.
Karakteristik tergantung dari sumber limbah cair, seperti limbah cair dari
rumah tangga, industri dan daerah komersil. Selama musim hujan, jumlah debit
limbah cair berubah pada limbah rumah tangga (bila dipengaruhi infiltrasi air hujan).
Jumlah debit akan menentukan kapasitas desain, dimana data yang diperlukan
dalam perencanaan adalah debit minimum, rata$rata dan maksimum pada musim
hujan ataupun kemarau. Parameter kimia yang menentukan desain pengolahan
limbah cair adalah BOD5, total suspended solid, total nitrogen, phospor dan bahan
Tingkat pengolahan ditentukan dari karakteristik influen dan kualitas efluen.
Kualitas efluen disesuaikan dengan jenis penampungan akhir, misalnya efluen
dialirkan ke sungai atau saluran irigasi. Kualitas efluen harus sesuai dengan
persyaratan yang telah ditentukan sehingga aman untuk lingkungan. Pemilihan
peralatan disesuaikan dengan standard desain, prosedur desain dan asumsi desain
yang telah ditetapkan. Selain itu pertimbangan ekonomi juga menentukan pemilihan
jenis peralatan.
Pemilihan tata letak harus dipertimbangkan secara detail, seperti kondisi
topographi, area yang tersedia, jalan akses, kondisi banjir dan rencana perluasan.
Dengan terbatasnya sumber alam untuk memenuhi kebutuhan energi, maka dalam
desain pengolahan perlu dipertimbangkan jenis energi yang akan digunakan sesuai
dengan lokasi pengolahan limbah cair. Sumber$sumber lainnya seperti bahan kimia
yang dibutuhkan untuk pengolahan perlu dipilih yang tepat dengan unit pengolahan
dan lokasi daerah sehingga penyediaan bahan kimia dapat tersedia setiap saat.
Analisa biaya harus dilakukan seekonomis mungkin untuk menetapkan bahwa
unit pengolahan cocok dan sesuai dengan pengolahan limbah cair yang dibutuhkan.
Pengkajian aspek lingkungan dapat dilakukan dengan melakukan analisa dampak
lingkungan (AMDAL) sesuai dengan peraturan yang telah ditetapkan. Dengan
adanya AMDAL maka diharapkan dampak adanya unit instalasi pengolahan limbah
cair terhadap lingkungan bisa dihilangkan.
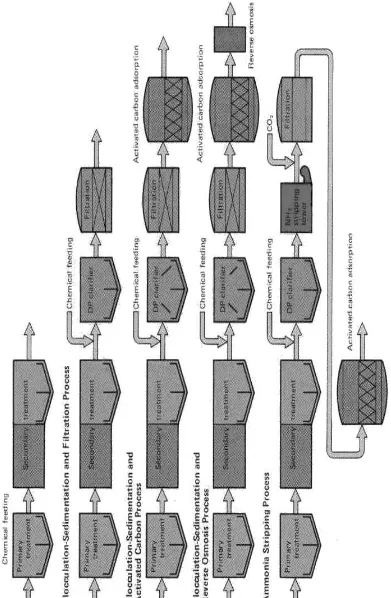
Teknologi pengolahan limbah cair untuk buangan industri yang diterapkan
terdiri dari kombinasi beberapa macam proses tergantung dari jenis buangannya.
Proses fisika dan kimia untuk mengolah limbah non organik, seperti limbah cair
industri pertambangan, pelapisan logam atau pemurnian logam. Sebagai contohnya,
misalnya pada Industri kimia dan logam. Limbah cair industri ini berupa partikel dan
larutan tersuspensi, sehingga digunakan proses fisika dan kimia dengan
menggunakan proses koagulasi dengan bahan kimia dan kemudaian proses
Koagulan dengan komposisi ferrosulfat dan kapur paling baik digunakan untuk
mereduksi bahan pencemar, sehingga buangan akhirnya memenuhi standar yang
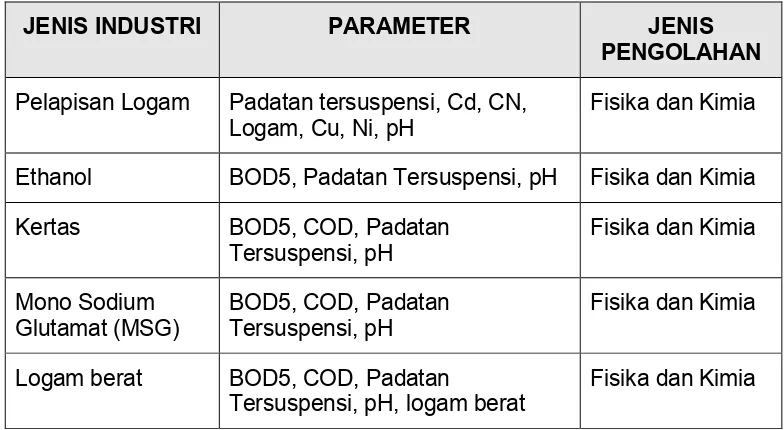
ditetapkan. Pada tabel berikut dapat dilihat beberapa contoh jenis industri dengan
[image:29.612.109.501.202.417.2]kemungkinan bahan$bahan pencemarnya dan jenis pengolahan yang dibutuhkan.
Tabel 2. Karakteristik Limbah Cair Industri Dan Jenis Pengolahannya
7&0' '0 $ 8 ' 5&8& 7&0'
&09" / 0
Pelapisan Logam Padatan tersuspensi, Cd, CN,
Logam, Cu, Ni, pH
Fisika dan Kimia
Ethanol BOD5, Padatan Tersuspensi, pH Fisika dan Kimia
Kertas BOD5, COD, Padatan
Tersuspensi, pH
Fisika dan Kimia
Mono Sodium Glutamat (MSG)
BOD5, COD, Padatan Tersuspensi, pH
Fisika dan Kimia
Logam berat BOD5, COD, Padatan
Tersuspensi, pH, logam berat
,
' ) )
alam praktek pengolahan air limbah kebanyakan proses$proses kimia
digabungkan, dipadukan dan diakomodasi dalam satu kesatuan dengan
proses fisika, yaitu yang dikenal dengan nama Physico$Chemical
Treatment. Beberapa keuntungan pengolahan air limbah dengan Physico$Chemical
Treatment adalah dapat mengurangi suspended solid dan BOD cukup tinggi, dapat
mengurangi phosphat sampai 70$90%, proses pengolahannya mempunyai toleransi
terhadap temperatur, material beracun dan aliran yang tidak kontinyu, dan unit
pengolahan membutuhkan ruang yang lebih kecil dibandingkan dengan unit
pengolahan biologi. Kerugiannya adalah membutuhkan investasi yang tinggi, operasi
butuh energi cukup tinggi dan banyak menghasilkan lumpur.
-
)%
1. Lucjan Pawlowski, ! " # $ % # % # & #
# #', First Edition, Pergamon Press, New York, 1980.
2. Degremont, % # # # ( ' Sixth Edition, Lavoisier Publishing,
Paris, 1991.
3. Mark J. Hammer, % # % # & # ! Second Edition, John
Wiley & Sons, New York, 1986.
4. Tsukishima Kikai Co., Ltd., ) * # % # + % # % # # #'
$
(A) (B)
(C) (D)
KK.. (E)
[image:32.612.102.535.68.694.2]KKK. (F)
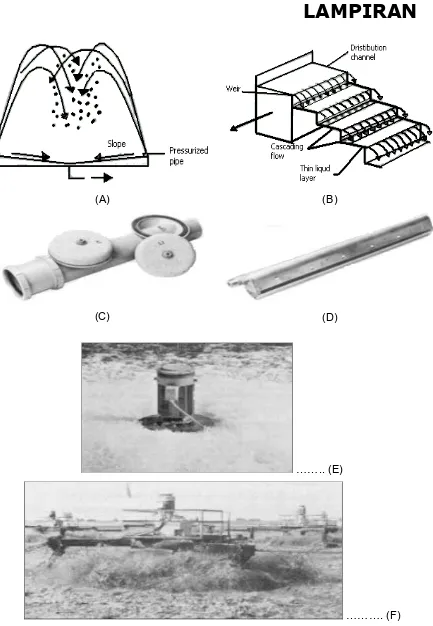
Gambar 3. Diagram Alir Suatu Unit Proses Flotasi
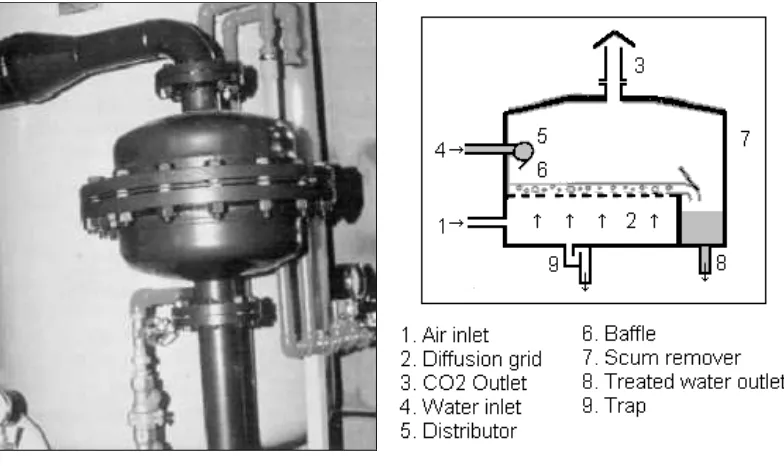
Gambar 4. $ Injeksi Udara Tertekan Melalui Bafel Pencampur
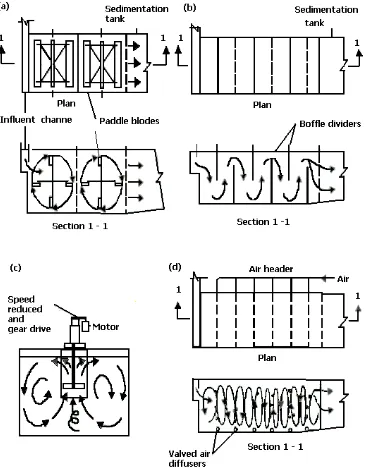
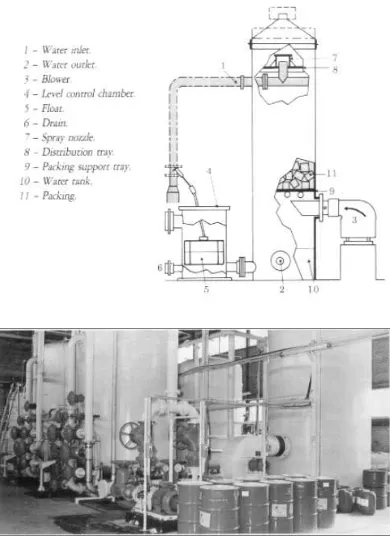
[image:34.612.107.499.406.639.2]Gambar 6. Bak Pengendapan Lumpur Dimana Terjadi Proses Koagulasi Dan
Flokulasi Secara Kimiawi
Gambar 7 : Fasilitas Proses Aerasi Dimana Terjadi Oksidasi Dan Degradasi
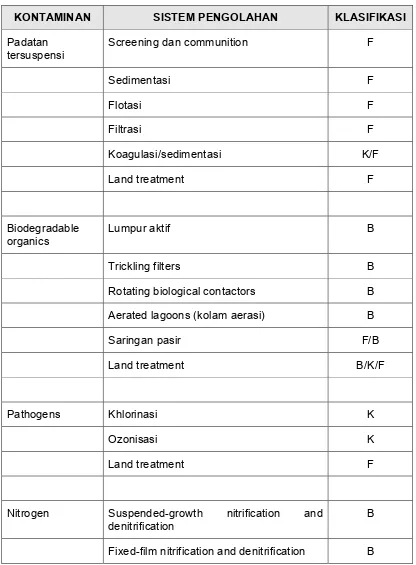
[image:36.612.113.501.441.637.2]Tabel 3. Sistem Pengolahan Untuk Menghilangkan Materi
Pencemar Dalam Air Limbah
"08 5'0 0 ' 8&5 &09" / 0 '1' '
Padatan tersuspensi
Screening dan communition F
Sedimentasi F
Flotasi F
Filtrasi F
Koagulasi/sedimentasi K/F
Land treatment F
Biodegradable organics
Lumpur aktif B
Trickling filters B
Rotating biological contactors B
Aerated lagoons (kolam aerasi) B
Saringan pasir F/B
Land treatment B/K/F
Pathogens Khlorinasi K
Ozonisasi K
Land treatment F
Nitrogen Suspended$growth nitrification and
denitrification
B
Tabel 3. Sistem Pengolahan Untuk Menghilangkan Materi
Pencemar Dalam Air Limbah (lanjutan)
"08 5'0 0 ' 8&5 &09" / 0 '1' '
Ammonia stripping K/F
Ion Exchange K
Breakpoint khlorinasi K
Land treatment B/K/F
Phospor Koagulasi garam logam/sedimentasi K/F
Koagulasi kapur/sedimentasi K/F
Biological/Chemical phosphorus removal B/K
Land treatment K/F
Refractory organics
Adsorpsi karbon F
Tertiary ozonation K
Sistem land treatment F
Logam berat Pengendapan kimia K
Ion Exchange K
Land treatment F
Padatan inorganik terlarut
Ion Exchange K
Reverse Osmosis F
Tabel 4. Jumlah Air Limbah Yang Dibuang Ke Badan Air Di Jakarta
(Sebagai Satu Studi Kasus Dan Bahan Perbandingan)
WILAYAH
JUMLAH AIR LIMBAH YANG DIBUANG (m3/hari) Jumlah Limbah
Spesifik (m3/ha.hari)
DOMISTIK PERKANTORAN
KOMERSIAL
INDUSTRI TOTAL
Jakarta Pusat 179.432 (78,0) 45.741 (19,9) 4.722 (2,1) 229.895 46,6
Kondisi Utara 143.506 (68,6) 20.622 (9,9) 45.188 (21,6) 209.316 15,0
Saat ini Barat 210.790 (79,2) 35.770 (13,4) 19.424 (7,3) 265.984 20,6
(1987) Selatan 247.350 (85,1) 35.146 (12,1) 8.015 (2,8) 290.511 19,9
Timur 256.947 (80,2) 35.372 (11,0) 28.088 (8,8) 320.407 17,1
TOTAL 1.038.025 (78,9) 172.651 (13,1) 105.437 (8,0) 1.316.113 20,2
Jakarta Pusat 253.756 (67,0) 121.227 (32,0) 3.906 (1,0) 378.889 76,8
Kondisi Utara 266.233 (57,0) 60.298 (13,1) 135.485 (29,3) 462.016 33,1
akan Barat 398.882 (76,6) 86.312 (16,6) 35.718 (6,9) 520.912 40,4
Datang Selatan 468.354 (84,0) 87.205 (15,6) 3.328 (0,4) 557.887 38,2
(2010) Timur 495.461 (74,1) 93.891 (14,0) 79.194 (11,8) 668.546 35,6
TOTAL 1.882.686 (72,7) 448.933 (17.3) 256.631 (9,9) 2.588.250 39,7
7
Tabel 5 : Jumlah Beban Polusi Yang Dibuang Ke Badan Air Di Jakarta
(Sebagai Satu Studi Kasus Dan Bahan Perbandingan)
WILAYAH BEBAN POLUSI (Kg/hari) Beban
PolusiSpesifik (kg/ha.hari)
DOMISTIK PERKANTORAN
KOMERSIAL
INDUSTRI TOTAL
Jakarta Pusat 42.433 (76,9) 10.568 (19,1) 2.192 (4,0) 55.191 11,2
Kondisi Utara 34.159 (57,0) 4.763 (8,0) 20.970 (35,0) 59.892 4,3
saat ini Barat 49.827 (74,3) 8.264 (12,3) 9.017 (13,4) 67.108 5,2
(1987) Selatan 58.361 (83,1) 8.120 (11,6) 3.721 (5,3( 70.202 4,8
Timur 60.486 (74,0) 8.173 (10,0) 13.037 (16,0) 81.696 4,4
TOTAL 245.264 (73,4) 39.888 (12,0) 48.937 (14,6) 334.089 5,1
Jakarta Pusat 57.216 (65,7) 28.004 (32,2) 1.806 (2,1) 87.026 17,6
Kondisi Utara 60.604 (44,2) 13.929 (10,1) 62.615 (45,7) 137.148 9,8
akan Barat 89.917 (71,1) 19.937 (15,8) 16.505 (13,1) 126.359 9,8
datang Selatan 105.354 (83,2) 20.144 (15,9) 1.075 (0,9) 126.573 8,7
(2010) Timur 111.121 (65,6) 21.687 (12,8) 36.599 (21,6) 169.407 9,0
TOTAL 424.212 (65,7) 103.701 (16,0) 118.600 (18,3) 646.513 9,9
7