ABSTRACT
PRETREATMENT AND ENZYMATIC HIDROLISIS OPTIMATIONS OF CACAO POD FOR BIOETHANOL PRODUCTION
By Sucihati
Cacao pod - solid waste of cacao plantation - contains high lignocellulose which can be utilized as raw material of bioethanol production. The lignocellulose consisted of 31.25% cellulose, 48.64% hemicellulose, and 20.11% lignin. The cacao pod should be pretreated for degrading its lignin and hydrolyzed its holocellulose into reduced sugar before converting it into bioethanol with Saccharomyces cerevisiae.
Obtained data were collected, tabulated, and analyzed statistically to determine the optimum condition of pretreatment and the optimum condition of hydrolysis. The optimum condition of pretreatment was submersion cacao pod into 1.59 M NaOH solution at 121oC for 30 minutes. This condition yielded lignin decreasing from 14.32% to 0.60%, hemicellulose decreasing from 21.59% to 0.54%, and cellulose increasing from 15.94% to 35.05%. Mean while, the optimum condition of hydrolysis was submersion 10% (w/v) cacao pod holocellulose into 30 FPU cellulase enzyme solution at 50oC and pH 4.8 for 18 hours. This condition yielded reduced sugar at a concentration of 2.54 g/L. After fermentation with 10% (v/v) Saccharomyces cerevisiae at 30oC for 72 hours, the reduced sugar yielded 0.33% (v/v) bioethanol.
ABSTRAK
OPTIMASI PROSES PERLAKUAN AWAL BASA DAN HIDROLISIS ENZIMATIS KULIT KAKAO (Theobroma cacao L.) UNTUK
MEMPRODUKSI BIOETANOL
Oleh Sucihati
Kulit kakao merupakan salah satu limbah padat pertanian yang dapat digunakan sebagai bahan baku produksi bioetanol karena kandungan lignoselulosanya yang tinggi. Lignoselulosa kulit kakao terdiri atas 31,25% selulosa, 48,64% hemiselulosa dan 20,11% lignin. Kulit kakao perlu diberi perlakuan awal untuk menghilangkan komponen lignin dan dihidrolisis dengan enzim selulase untuk menghidrolisis holoselulosa menjadi gula reduksi yang kemudian difermentasi dengan Saccharomyces cerivisiae menjadi bioetanol.
Tujuan penelitian ini yaitu untuk mendapatkan kondisi optimum proses perlakuan awal dan hidrolisis enzimatis kulit kakao. Gula reduksi yang dihasilkan kemudian difermentasi dengan Saccharomycess cerevisiae menjadi bioetanol. Pada perlakuan awal, kulit kakao direndam dalam 0, 0,5 1,0 , 1,5 dan 2,0 M larutan NaOH pada suhu 121oC selama 15 dan 30 menit untuk menurunkan komponen lignin. Setelah dikeringkan, holoselulosa kulit kakao hasil perlakuan awal sebanyak 5, 10, 15, 20% (b/v) dihidrolisis menjadi gula reduksi dengan 0, 10, 20 dan 30 FPU enzim selulase pada suhu 50oC dan pH 4,8 selama 18 jam. Setelah waktu hidrolisis selesai, filtrat diambil dan konsentrasi gula reduksi diukur.
optimum yaitu 2,54 g/L. Setelah difermentasi dengan 10% (v/v) Saccharomyces cerivisiae pada suhu 30oC selama 72 jam, 2,54 g/L gula reduksi hasil hidrolisis tersebut menghasilkan 0,33% (v/v) bioetanol.
OPTIMASI PROSES PERLAKUAN AWAL BASA DAN HIDROLISIS ENZIMATIS KULIT KAKAO (Theobroma Cacao L.) UNTUK
MEMPRODUKSI BIOETANOL
Oleh SUCIHATI
Tesis
Sebagai Salah Satu Syarat untuk Mencapai Gelar MAGISTER SAINS
Pada
Program Pascasarjana Magister Teknologi Industri Pertanian Fakultas Pertanian Universitas Lampung
PROGRAM PASCA SARJANA
MAGISTER TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Tanjungkarang, pada tanggal 25 September 1979 sebagai anak ketiga dari empat bersaudara dari pasangan Bapak Hi. Taufiq Burhan dan Hj. Ervina Sunarya , S.H. (Almh.). Penulis telah menikah dengan Giska Stiawan, S.T., M.TA pada tanggal 22 September 2006 dan dikarunia dua orang anak yang bernama M. Lazuardy Hariscika dan Nisrina Amiracika.
Penulis menyelesaikan pendidikan pada jenjang Taman Kanak-kanak di TK. Trisula Rawa Laut pada tahun 1985, Sekolah Dasar (SD) Negeri Teladan 2 Rawa Laut pada tahun 1991, Sekolah Menegah Pertama (SMP) di SMP Negeri 4 Bandar Lampung pada tahun 1994, dan Sekolah Menengah Umum (SMU) Negeri 3 Bandar Lampung pada tahun 1997.
Pada bulan Juli tahun 1997, penulis diterima sebagai mahasiswa Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam (MIPA) Universitas Lampung melalui jalur PMKA dan menyelesaikan program sarjana pada bulan Juni 2003. Sejak bulan Desember 2003 penulis diterima sebagai PNS di lingkungan Kementeriaan Perindustrian RI, sebagai staf pengajar pada sekolah binaan Kementerian Perindustrian RI, SMK SMTI Bandar Lampung.
Kupersembahkan karya ini untuk :
Papa dan Mama (almh.) tersayang yang selalu mendoakan untuk keberhasilan
hidupku
&
SANWACANA
Bismillaahirrahmaanirrahiim,
Sujud dan puji syukur penulis hanturkan kepada Allah SWT yang telah begitu banyak memberikan nikmat-Nya sehingga penulis dapat menyelesaikan penulisan tesis yang berjudul Optimasi Proses Perlakuan Awal Basa dan Hidrolisis Enzimatis Kulit Kakao (Theobroma cacao L.) Untuk Memproduksi Bioetanol.
Tesis ini disusun berdasarkan kegiatan penelitian yang dilaksanakan pada bulan Juli 2013 sampai dengan Desember 2013 di Laboratorium Analisis dan Biokimia, Jurusan Teknologi Hasil Pertanian, Fakultas Pertanian, Universitas Lampung. Selama Penyusunan tesis ini tentunya banyak pihak yang telah memberikan bantuan. Oleh sebab itu, pada kesempatan ini penulis ingin menyampaikan ucapan terima kasih kepada:
1. Ir. Sutikno, M.Sc., Ph.D., selaku pembimbing pertama atas kesediaanya memberikan bimbingan, pengarahan, motivasi dan nasihat kepada penulis sampai selesainya tesis ini dan untuk kesuksesan kehidupan penulis selanjutnya.
3. Dr. Sri Hidayati, S.T.P., M.P., selaku penguji tesis atas segala pengarahan dan masukannya serta bantuannya kepada penulis sehingga penulis dapat menyelesaikan tesis ini.
4. Ir. Neti Yuliana, M.Si., Ph.D. selaku Ketua Program Studi Magister Teknologi Industri Pertanian, Fakultas Pertanian, Universitas Lampung atas motivasi dalam penyelesaian tesis ini.
5. Papa (Hi. Taufiq Burhan) dan Mama Hj. Ervina Sunarya, S.H (Almh.) tercinta atas segala dukungan, kasih sayang, serta doa yang selalu terucap ditiap sujudnya untukku.
6. Suamiku (Giska Stiawan, S.T, M.TA) dan anak-anakku (M. Lazuardy Hariscika dan Nisrina Amiracika) tercinta atas segala dukungan, perhatian, pengertian, kasih sayang dan doa yang selalu terucap untuk keberhasilanku. 7. Seluruh staf pengajar (dosen) pada Program Studi Magister Teknologi Industri
Pertanian, Fakultas Pertanian, Universitas Lampung atas ilmu dan nasehat yang telah diberikan kepada penulis.
8. Ayah (Hi. M. Taslim) dan emak Hj. Nurbaiti (Almh.) atas do’anya untuk keberhasilanku.
9. Kakak & adikku tercinta ; uti Okhe, kyai Imam, Udo dan Arif untuk motivasi dan doa yang diberikan untuk keberhasilan penulis.
11.Kepala SMK-SMTI Bandar Lampung, Drs. Heri Purnomo, M.Pd dan rekan-rekan SMK-SMTI Tanjungkarang (Mb isti, Te leli, April, Kristin, Tria, Pirma, Maning, Mira, Arum, Yani dan Nur) atas semangat dan bantuan yang diberikan kepada penulis
12.Para staf di Laboratorium THP Mbak Untari, Mas Joko, Mbak Desi, Mas Midi dan Mas Hanafi atas bantuan yang telah diberikan kepada penulis.
Penulis menyadari bahwa tesis ini masih jauh dari kesempurnaan, namun penulis berharap semoga karya hebat ini dapat bermanfaat bagi kita semua. Amin...
Bandar Lampung, 17 Juni 2014 Penulis
DAFTAR ISI
2. Analisis gula reduksi (Metode Nelson – Somogyi dalam
Sudarmadji, 1984) ... 27
a. Penyiapan Kurva Standar ... 27
b. Penentuan Kadar Gula Reduksi Pada Contoh ... 28
c. Cara Pembuatan Reagensia ... 28
3. Kadar Bioetanol ... 29
IV. HASIL DAN PEMBAHASAN ... 30
A. Perlakuan Awal dengan NaOH ... 30
1. Kadar lignin ... 30
2. Kadar Hemiselulosa ... 33
3. Kadar Selulosa ... 36
B. Hidrolisis Enzimatis dengan Enzim Selulase ... 38
C. Fermentasi Hidrolisat Kulit Kakao... 44
V. SIMPULAN DAN SARAN ... 46
A. Simpulan ... 46
B. Saran ... 46
DAFTAR PUSTAKA ... 48
iii
DAFTAR TABEL
Tabel Halaman
1. Komposisi kimia kulit kakao ... 8 2. Hasil pengamatan kadar lignoselulosa kulit kakao sebelum pretreatment.... 53 3. Hasil pengamatan kadar lignoselulosa kulit kakao setelah pretreatment
dengan berbagai konsentrasi NaOH pada suhu 121oC selama 15 dan 30 menit (Ulangan 1) ... 53 4. Hasil pengamatan kadar lignoselulosa kulit kakao setelah pretreatment dengan berbagai konsentrasi NaOH pada suhu 121oC selama 15 dan 30
menit (Ulangan 2) ... 54 5. Hasil pengamatan kadar lignoselulosa kulit kakao setelah pretreatment
dengan berbagai konsentrasi NaOH pada suhu 121oC selama 15 dan 30
9. Uji homogen ragam data transformasi kadar lignin Bartlett’s Test ... 59
10. Data pengamatan kadar hemiselulosa (%) ulangan 1 -3 ... 60
11. Uji homogen ragam data kadar hemiselulosa (Bartlett test) ... 61
12. Data transformasi kadar hemiselulosa (data ditransformasi dengan √X) ... 62 13. Uji homogen ragam data transformasi kadar hemiselulosa
iv
16. Data transformasi kadar selulosa (data ditransformasi dengan √X) ... 66
17. Uji homogen ragam data transformasi kadar selulosa (Bartlett test) ... 67
18. Uji polinomial ortogonal kadar lignin (%) ... 68
19. Uji polinomial ortogonal kadar hemiselulosa (%) ... 69
20. Uji polinomial ortogonal kadar selulosa (%) ... 70
21. Hasil pengukuran absorbansi berbagai konsentrasi glukosa untuk pembuatan kurva standar ... 71
22. Pengamatan kadar gula reduksi kulit kakao setelah dihidrolisis menggunakan berbagai konsentrasi enzim selulase (ulangan ke-1) ... 72
23. Pengamatan kadar gula reduksi kulit kakao setelah dihidrolisis menggunakan berbagai konsentrasi enzim selulase (ulangan ke-2) ... 73
24. Pengamatan kadar gula reduksi kulit kakao setelah dihidrolisis menggunakan berbagai konsentrasi enzim selulase (ulangan ke-3) ... 74
25. Rekapitulasi kadar gula reduksi (g/L) ulangan 1 -3 ... 75
26. Data transformasi hidrolisis (data ditransformasi dengan √(X+0,5) ) ... 76
27. Uji homogen ragam data transformasi kadar gula reduksi (Bartlett test) ... 77
28. Analisis ragam data transformasi hidrolisis ... 78
29. Analisis ragam data kadar lignin ( metode GLM) ... 78
30. Analisis ragam data kadar hemiselulosa (metode GLM) ... 79
31. Analisis ragam data kadar selulosa (metode GLM) ... 79
32. Yield gula reduksi terhadap larutan hidrolisis kulit kakao ... 80
33. Yield gula reduksi terhadap selulosa kulit kakao ... 80
34. Hasil pengukuran kadar etanol hasil fermentasi kulit kakao menggunakan 10% Saccharomycess cerevisiae pada suhu 300C selama 72 jam (ulangan 1 -3 ) ... 80
35. Yield etanol terhadap kadar gula reduksi kulit kakao ... 81
v 9. Fermentasi hasil hidrolisis kulit kakao... 27
10. Hubungan kadar lignin kulit kakao dan konsentrasi NaOH setelah dipanaskan pada suhu 121oC selama 15 dan 30 menit ... 32
11. Reaksi lignin dengan gugus OH- dari NaOH pada proses delignifikasi... 32
12. Hubungan kadar hemiselulosa kulit kakao dan konsentrasi NaOH setelah dipanaskan pada suhu 121oC selama 15 dan 30 menit ... 35
13. Hubungan kadar selulosa kulit kakao dan konsentrasi NaOH setelah dipanaskan pada suhu 121oC selama 15 dan 30 menit... 38
14. Hubungan kadar gula reduksi kulit kakao (g/L) dan konsentrasi substrat setelah dihidrolisis dengan berbagai konsentrasi enzim pada suhu 50oC selama 18 jam ... 40
15. Mekanisme hidrolisis selulosa oleh enzim selulase... 42
16. Mekanisme hidrolisis selulosa oleh enzim β-glukosidase... 42
vi
18. Grafik uji kenormalan data lignin ... 82
19. Grafik uji kehomogenan data lignin (Levent’s Test) ... 82
20. Grafik uji kenormalan data hemiseluloa ... 83
21. Grafik uji kehomogenan ragam data hemiselulosa (Leven’s Test ) ... 83
22. Grafik uji kenormalan data selulosa ... 84
23. Grafik uji kehomogenan ragam data selulosa (Leven’s Test) ... 84
24. Pengeringan kulit kakao ... 85
25. Kulit kakao setelah dikeringkan menggunakan oven ... 85
26. Kulit kakao setelah pengecilan ukuran ... 86
27. Kulit kakao setelah pretreatment pada suhu 1210C ... 86
28. Penyaringan kulit kakao pada proses analisis kadar lignoselulosa ... 87
29. Hasil pengenceran enzim selulase (10 FPU, 20 FPU dan 30 FPU) ... 87
30. Sampel yang akan diukur absorbansinya ... 88
31. Persiapan analisis kadar gula reduksi kulit kakao setelah hidrolisis ... 88
32. Kulit kakao yang telah pretreatment dan dilanjutkan ke tahap hidrolisis .. 89
33. Kemasan enzim selulase ... 89
34. Spektrofotometer yang digunakan untuk mengukur absorbansi sampel ... 90
35. Hasil fermentasi hidrolisat kulit kakao ... 90
1
I. PENDAHULUAN
A. Latar Belakang dan Masalah
Kebutuhan Bahan Bakar Minyak (BBM) saat ini meningkat. Pada tahun 2010 pemakaian BBM sebanyak 388.241 ribu barel perhari dan meningkat menjadi 394.052 ribu barel per hari pada tahun 2011 (Anonim, 2012). Sementara itu, Produksi BBM menurun setiap tahunnya. Produksi BBM pada tahun 2010, yaitu sebanyak 329.249 ribu barel per hari turun menjadi 163.633 ribu barel per hari pada tahun 2011 (Anonim, 2012). Hal inilah yang menyebabkan Indonesia harus mengimpor BBM sebesar 230.419 ribu barel perhari pada tahun 2011.
Cadangan minyak bumi Indonesia saat ini ketersediaannya sangat terbatas karena kuantitas minyak bumi pada lapisan bumi semakin menipis akibat dari eksploitasi terus menerus dan sifat dari bahan bakar minyak itu sendiri yang sulit untuk di perbaharui. Oleh sebab itu, pemerintah telah mencanangkan penggunaan energi alternatif pada Peraturan Menteri Energi Dan Sumberdaya Mineral No. 32 Tahun 2008 tentang Pentahapan Kewajiban Pemakaian Bahan Bakar Nabati (BBN). Salah satu energi alternatif yang banyak dikembangkan saat ini adalah bioetanol.
2
2011). Perkembangan penelitian bioetanol sampai tahap ini sudah memasuki dua generasi yaitu generasi pertama dan generasi kedua. Bioetanol generasi pertama menggunakan bahan baku pati sebagai substrat fermentasi, namun Pemanfaatan bioetanol berbasis pati-patian dikhawatirkan akan menggangu kestabilan pangan, mengingat Indonesia belum cukup mandiri untuk memenuhi kebutuhan pangannya sendiri. Persaingan bahan baku untuk kebutuhan pangan dan energi tidak akan terhindarkan karena pangan dan energi merupakan 2 kebutuhan utama manusia yang saling terkait. Untuk mengatasi polemik tersebut maka dikembangkan bioetanol generasi kedua yang menggunakan limbah padat agroindustri sebagai bahan bakunya.
Buah kakao (Theobroma cacao L.) terdapat cukup banyak di Indonesia. Menurut BPS dalam artikel Berita Industri Kemenperin, pada tahun 2012 produksi kakao Indonesia mencapai 700.000 ton (Anonim, 2013). Sama halnya dengan limbah hasil panen dan pengolahan pertanian lainnya, kulit atau cangkang buah kakao belum dimanfaatkan secara optimal. Selama ini, cangkang buah kakao hanya digunakan sebagai pakan ternak setelah melalui tahapan bioproses. Menurut Siswoputranto, 1983, buah kakao umumnya terdiri dari 73,73% bagian kulit (pod kakao), 24,40% biji (umumnya dalam1 buah kakao terdiri dari 30–40 butir biji kakao) dan 2% plasenta (merupakan kulit ari pembungkus biji kakao).
3
kulit kakao yang memiliki kadar selulosa sebesar 31,25% maka jumlah selulosa yang dapat dimanfaatkan sebagai bahan baku pembuatan bioetanol yaitu sebanyak ± 219 ton pertahun.
Bioetanol generasi kedua diproduksi melalui 4 tahap. Tahapan tersebut yaitu tahap perlakuan awal, tahap hidrolisis, tahap fermentasi, dan tahap destilasi. Tahap perlakuan awal dan hidrolisis merupakan dua tahapan yang paling penting dan paling mempengaruhi jumlah bioethanol yang dihasilkan. Oleh sebab itu, untuk menghasilkan bioetanol dari kulit kakao yang optimal perlu dilakukan langkah optimasi proses perlakuan awal untuk menghilangkan lignin dan proses hidrolisis untuk menghasilkan kadar gula reduksi yang maksimal.
B. Tujuan Penelitian
Tujuan dari penelitian ini adalah :
1. Untuk mendapatkan kondisi optimum perlakuan awal bahan baku kulit kakao agar dapat menurunkan kadar lignin secara maksimal.
2. Untuk mendapatkan kondisi hidrolisis enzimatis yang optimum agar menghasilkan kadar gula reduksi yang maksimal.
3. Untuk memfermentasi gula reduksi hasil perlakuan awal dan hidrolisis terbaik dengan Saccharomyces cerevisiae menjadi bioetanol.
C. Kerangka Pemikiran
4
(pretreatment) untuk melarutkan lignin yang terdapat pada substrat biomassa yang mengandung lignoselulosa (Sumada,2011) sampai dengan tahap fermentasi sehingga diharapkan dapat menghasilkan kadar bioetanol yang maksimal
1. Optimasi Perlakuan Awal Dengan NaOH
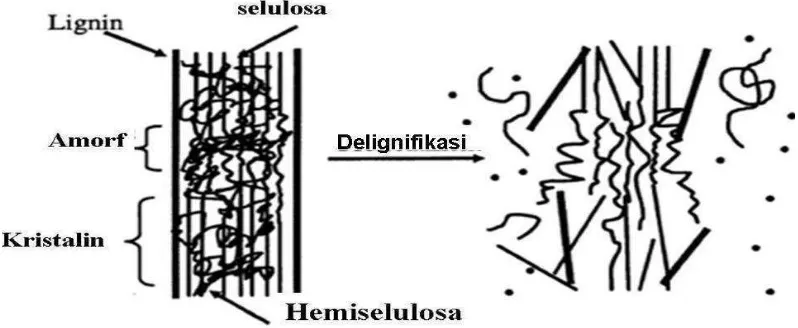
Bahan lignoselulosa umumnya merupakan limbah agroindustri yang berasal dari proses pengolahan hasil pertanian. Bahan-bahan lignoselulosa umumnya terdiri dari selulosa, hemiselulosa dan lignin. Lignoselulosa merupakan bahan yang amat rapat, sehingga pada kondisi biasa bersifat inert dan tidak dapat ditembus oleh air maupun enzim (Soerawidjaja, 2008).
Tahapan terpenting pada produksi bioetanol dari biomassa yang mengandung lignosellulosa adalah pada pretreatment atau perlakuan awal yang dikenal juga dengan istilah delignifikasi. Proses pretreatment dilakukan untuk mengkondisikan bahan-bahan lignosellulosa baik dari segi struktur dan ukuran dengan memecahkan dan menghilangkan kandungan lignin dan hemiselulosa, merusak struktur kristal dari sellulosa serta meningkatkan porositas bahan (Sun and Cheng, 2002). Perlakuan awal yang biasa digunakan adalah kombinasi dari teknik kimia dan fisik. Penggunaan asam atau basa yang dikombinasikan dengan pemanasan diketahui mampu melepaskan lignin dari struktur lignoselulosa sehingga menghasilkan hemiselulosa dan selulosa yang dilindungi oleh komponen lignin. Pada penelitian Septiyani (2011), delignifikasi menggunakan NaOH 1 M pada suhu 1210C selama 15 menit mampu melepas 86% lignin pada ikatan lignosellulosa ampas tebu.
5
pada suhu 121oC selama 15 dan 30 menit. Setelah komponen lignin terurai maka selulosa dan hemiselulosa dapat dilanjutkan pada tahap hidrolisis enzimatis.
2. Optimasi Hidrolisis Enzimatis
Hidrolisis enzimatis merupakan proses hidrolisis (pelepasan ikatan β (1-4) pada selulosa) dengan memanfaatkan aktivitas enzim selulase. Proses hidrolisis dipengaruhi oleh beberapa faktor, yaitu kualitas dan konsentrasi substrat, metode perlakuan awal yang diaplikasikan, aktivitas enzim dan kondisi proses hidrolisis seperti pH, suhu dan adanya inhibitor. Konsentrasi substrat biasanya sekitar 10% (padatan tidak larut air), dosis enzim 10–20 FPU/g selulosa, dan konsentrasi khamir pada tahap fermentasi adalah 1,50–3 g/L selama 72 jam (Sun dan Cheng, 2002).
Berdasarkan faktor-faktor yang mempengaruhi proses hidrolisis, maka pada penelitian ini kulit kakao dihidrolisis menggunakan selulase 0, 10, 20 dan 30 FPU pada konsentrasi substrat 5, 10, 15 dan 20 % (b/v) pada suhu 50oC selama 15 menit. Kondisi hidrolisis yang optimum kemudian dilanjutkan ketahap fermentasi hidrolisat kulit kakao menggunakan stater Saccharomyces cerevisiae dengan konsentrasi 10 % untuk menghasilkan kadar etanol yang optimal.
D. Hipotesis
Hipotesis dari penelitian ini yaitu :
6
2. Kondisi optimum hidrolisis kulit kakao hasil perlakuan awal basa yaitu hidrolisis 15% (b/v) substrat kulit kakao hasil perlakuan awal basa dengan 30 FPU enzim selulase pada suhu 50oC selama 18 jam.
3. Kondisi optimum didapatkan melalui perlakuan awal dengan NaOH dan hidrolisis menghasilkan gula reduksi yang kemudian difermentasi dengan Saccharomycess cerevisiae untuk menghasilkan bioetanol.
7
II. TINJAUAN PUSTAKA
A. Buah Kakao
Buah kakao (Gambar 1) umumnya terdiri dari 73,63% bagian kulit (pod kakao), 24,37% biji (umumnya dalam satu buah kakao terdiri dari 30-40 butir biji kakao) dan 2% plasenta (merupakan kulit ari pembungkus biji kakao) (Siswoputranto, 1983) .
Gambar 1. Buah kakao (Anonim, 2008)
Komponen limbah buah kakao terbesar berasal dari kulit buahnya atau biasa disebut dengan kulit kakao. Sama halnya dengan limbah hasil panen dan pengolahan pertanian lainnya, kulit atau cangkang buah kakao belum dimanfaatkan secara optimal. Selama ini, cangkang buah kakao hanya digunakan sebagai pakan ternak setelah melalui tahapan bioproses. Petani kakao belum
a. Biji dan pulp
b. Kulit
c. Plasenta b
8
terpikir untuk memanfaatkan limbah cangkang kakao untuk dijadikan produk lain, seperti bahan baku energi alternatif.
Kulit kakao merupakan bagian mesokarp atau dinding buah kakao yang mencakup kulit terluar sampai daging buah sebelum kumpulan biji. Pod buah kakao merupakan bagian terbesar dari buah kakao. Komposisi kimia pod kakao dapat dilihat pada Tabel 1.
Tabel 1. Komposisi kimia kulit kakao
No Komponen Persen (%)
1 Kadar air 12,96
2 Kadar lemak 1,11
3 Kadar abu 11,10
4 Kadar protein 8,75
5 Kadar karbohidrat 16,27
6 Kadar lignin 20,11
7 Kadar selulosa 31,25
8 Kadar Hemisellulosa 48,64
Sumber : Ashadi, 1988
Kulit kakao merupakan limbah lignoselulosa. Lignoselulosa atau serat kasar terdiri atas tiga penyusun utama, yaitu selulosa (31,25%), hemiselulosa (48,64%), dan lignin (20,11%) (Ashadi, 1988), yang saling terikat erat membentuk satu kesatuan (Gambar 2). Ketiga komponen tersebut diuraikan di bawah ini.
9
1. Lignin
Lignin adalah senyawa yang tahan terhadap hidrolisis dan menghambat kerja enzim selulase karena membentuk kompleks dengan selulosa dan hemiselulosa sehingga diharapkan serendah mungkin kandungan lignin pada substrat (Apriyantono et al., 1988). Lignin adalah komplek polimer hidrokarbon dengan komponen senyawa alifatik dan aromatik. Lignin terdiri dari monomer-monomer yang berasal dari beberapa macam cincin substitusi phenil propana. Brown (1979) mengatakan bahwa lignin merupakan polimer aromatik kompleks dengan bobot molekul kira-kira 11.000 yang dibentuk oleh tiga dimensi polimerisasi.
Secara fisis lignin berwujud amorf (tidak berbentuk) sehingga menyebabkan lignin sulit untuk dianalisis dengan sinar-X. Lignin berwarna kuning cerah dengan bobot jenis berkisar antara 1,3-1,4 bergnatung pada sumber lignin. Indeks refraksi lignin sebesar 1,6. Lignin bila dipanaskan tidak dapat mencair, tetapi melunak (Kirk and Othmer, 1952). Pada suhu tinggi, lignin dapat mengalami perubahan struktur dengan membentuk asam format, metanol, asam asetat, aseton, vanilin dan lainnya (Judoamidjojo, dkk., 1992).
Lignin bersifat tidak larut dalam kebanyakan pelarut organik. Lignin yang melindungi selulosa bersifat tahan terhadap hidrolisis yang disebabkan oleh adanya ikatan alkali dan ikatan eter (Judoamidjojo, dkk., 1992).
10
Gambar 3. Struktur lignin (Isro’i, 2008)
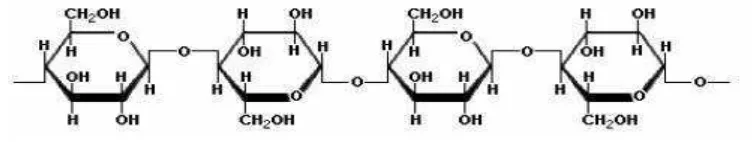
2. Hemiselulosa
Hemiselulosa sering diartikan sebagai selulosa dengan bobot molekul
rendah. Polisakarida poliosa merupakan istilah untuk membedakan selulosa
11
Hemiselulosa selalu dikelompokkan berdasarkan residu gula utama yang menyususun rangkanya, seperti: xylan, mannan, galactan, dan glucan, dengan
xylan dan mannan adalah gugus utama dari hemiselulosa (Gambar 4). Molekul hemiselulosa sering bercabang dengan rantai induk β – 1,4 dan rantai samping
yang relatif pendek, tidak membentuk mikrofibril namun membentuk ikatan hidrogen dengan selulosa
Gambar 4. Struktur hemiselulosa (Isro’i, 2008)
Hemiselulosa mirip dengan selulosa yang merupakan polimer gula, akan tetapi berbeda dengan selulosa yang hanya tersusun dari glukosa. Hemiselulosa tersusun dari bermacam-macam jenis gula, monomer gula penyusun hemiselulosa terdiri dari monomer gula berkarbon 5 (C-5) dan 6 (C-6), misalnya: xylosa, mannose, glukosa, galaktosa, arabinosa, dan sejumlah kecil ramnosa, asam glukoronat dan asam galaturonat.
12
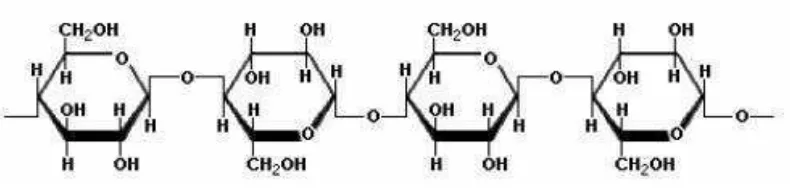
3. Selulosa
Selulosa merupakan komponen utama penyusun dinding sel tanaman dan hampir tidak pernah ditemui dalam keadaan murni di alam melainkan berkaitan dengan lignin dan hemiselulosa membentuk lignoselulosa (Lynd et al., 2005). Beberapa ciri-ciri dari struktur selulosa yang berdasarkan pada karakteristik kimia yang dimiliki adalah dapat mengembang (swelling) jika direaksikan dengan hidroksi logam alkali, garam-garam dalam larutan basa kuat dan senyawa amina. Senyawa amina yang lazim digunakan untuk mengembangkan ikatan selulosa yaitu NaOH (Irawadi, 1990).
Rantai selulosa terdiri dari satuan glukosa anhidrida yang saling berikatan melalui ataom karbon pertama dan keempat, Ikatan yang terjadi adalah ikatan β
-1,4-glikosidik. Rumus bangun selulosa dapat dilihat pada gambar 5.
Gambar 5. Struktur selulosa (Achamdi, 1989)
Selulosa terdiri atas 15-14.000 unit molekul glukosa Rantai panjang selulosa terhubung secara bersama melalui ikatan hidrogen dan gaya van der Waals (Fessenden, 1990). Panjang molekul selulosa ditentukan oleh jumlah unit glukan di dalam polimer, disebut dengan derajat polimerisasi. Derajat polimerasi (DP) selulosa tergantung pada jenis tanaman dan umumnya dalam kisaran 2.000-27.000 unit glukan.
13
pada serat selulosa dapat dipecah menjadi monomer glukosa dengan cara hidrolisis asam atau enzimatis. Glukosa yang dihasilkan dari hidrolisis selulosa selanjutnya dapat difermentasi menjadi etanol.
B. Produksi Bioetanol Generasi Kedua
Bioetanol adalah etanol yang dibuat dari biomass yang mengandung komponen monosakarida yang didapat dari pati atau selulosa. Bioetanol dapat dibuat dari berbagai bahan hasil pertanian. Secara umum bahan baku bioetanol dapat dibagi dalam 3 golongan yaitu:
Bahan yang mengandung turunan gula (sakarin): molase (tetes tebu), nira
kelapa, nira nipah dan lain-lain.
Bahan yang mengandung pati: ubi dahlia, tapioka, kentang, gamdum, ganyong
dan lain-lain; dan
Bahan yang mengandung sellulosa: jerami padi, batang pisang, ampas tebu
dan beberapa limbah pertanian lainnya (Prihandana dkk., 2007)
14
Proses pembuatan bioetanol dengan bahan baku yang mengandung lignoselulosa melalui empat proses utama; yaitu perlakuan awal, hidrolisis, fermentasi, dan pemisahan serta pemurniaan produk etanol (Mosier, et al., 2005), yang masing-masing akan diuraikan di bawah ini.
1. Perlakuan Awal
Proses perlakuan awal dilakukan untuk mengkondisikan bahan-bahan lignoselulosa baik dari segi struktur dan ukuran dengan menghilangkan kandungan lignin, merusak struktur kristal dari selulosa serta memperluas permukaan substrat (Sun and Cheng, 2002). Delignifikasi dapat dilakukan secara fisik dan kimiawi atau kombinasi dari keduanya.
Menurut Fridia (1989), proses delignifikasi merupakan perlakuan pendahuluan terhadap bahan baku untuk menurunkan kadar lignin sehingga mempermudah pelepasan hemiselulosa. Perlakuan awal yang efisien harus dapat membebaskan struktur kristal dari selulosa dan memperluas daerah amorf serta membebaskan dari kadar lignin. Bahan lignoselulosa yang telah mendapatkan perlakuan awal akan mengalami penyusutan kadar lignin dan meningkatkan kandungan selulosa.
15
2. Hidrolisis Enzimatis
Hidrolisis enzimatis adalah proses pemecahan sellulosa dan hemisellulosa menjadi monosakarida (glukosa dan xylosa) dengan menggunakan enzim yang selanjutnya akan difermentasi menjadi etanol. Keuntungan hidrolisis enzimatis dibandingkan hidrolisis asam, antara lain: tidak terjadi degradasi gula hasil hidrolisis, kondisi proses yang lebih lunak (suhu rendah, pH netral), berpotensi memberikan hasil yang tinggi, dan biaya pemeliharaan peralatan relatif rendah karena tidak ada bahan yang korosif (Hamelinck, Hooijdonk, and Faaij, 2005).
Faktor-faktor yang mempengaruhi proses hidrolisis enzimatis adalah metode perlakuan awal yang digunakan, aktivitas enzim dan kondisi proses hidrolisis seperti suhu, pH dan adanya inhibitor, kualitas dan konsentrasi substrat (Taherzadeh dan Karimi, 2007).
Enzim adalah katalis yang sangat spesifik yang membantu terjadinya reaksi-reaksi kimia dalam sistem biologis. Selulase merupakan enzim yang memutuskan ikatan glikodisik β-1,4 didalam selulosa, selubiosa dan turunan selulosa lainnya.
Tiga enzim utama yang terdapat dalam enzim selulase adalah endoglukonase, eksoglukonase dan selobiase. Mekanisme reaksi yang dikatalisis oleh enzim selulase tersebut adalah :
1. Endoglukonase menghidrolisis ikatan β-1,4-glikosidik secara acak pada daerah amorf selulosa menghasilkan glukosa, selobiosa dan selodekstrin. 2. Hidrolisis serat selulosa menjadi sakarida yang lebih sederhana oleh
ekso-sellulosa.
16
3. Fermentasi
Fermentasi adalah suatu proses perubahan kimia pada substrat organik, baik karbohidrat, protein, lemak atau lainnya melalui kegiatan katalis biokimia yang dikenal sebagai enzim dan dihasilkan oleh jenis mikroba spesifik (Prescott dan Dunn, 1959). Dalam proses fermentasi, gula akan dikonversi menjadi etanol dan gas karbondioksida. Persamaan reaksi fermentasinya:
C6H12O6 → 2 CH3CH2OH + 2 CO2
Glukosa Etanol Karbondioksida
Produksi etanol dari substrat gula oleh khamir S. cerevisiae merupakan proses fermentasi dengan kinetika sangat sederhana karena hanya melibatkan satu fasa pertumbuhan dan produksi. Pada fase tersebut glukosa diubah secara simultan menjadi biomasa, etanol dan CO2. Parameter yang mengendalikan pertumbuhan dan metabolisme khamir dalam keadaan anaerobik yaitu konsentrasi gula dan etanol. Secara kinetik glukosa berperan ganda, pada konsentrasi rendah (kurang dari 1g/l) merupakan substrat pembatas, sedangkan pada konsentrasi tinggi (lebih dari 300g/l) akan menjadi penghambat.
Menurut Kunaepah (2008), fermentasi dipengaruhi oleh beberapa faktor yaitu : 1. Substrat
17
2. Suhu
Suhu fermentasi mempengaruhi lama fermentasi karena pertumbuhan mikroba dipengaruhi suhu lingkungan fermentasi. Menurut Fardiaz (1992), Saccharomyces cerevisiae memiliki kisaran suhu pertumbuhan antara 20-300C.
3. pH
Derajat keasaman (pH) merupakan salah satu faktor penting yang mempengaruhi pertumbuhan Saccharomyces cerevisiae. Menurut Roukas (1994), kisaran pH untuk pertumbuhan Saccharomyces cerevisiae yaitu pada pH 3,5-6,5. Sedangkan menurut Elevri dan Putra (2006), pH optimum untuk produksi etanol oleh Saccharomyces cerevisiae yaitu pada pH 4,5. 4. Jenis mikroba
Khamir merupakan jenis mikroba yang sering digunakan dalam fermentasi alkohol, seperti Saccharomycess cerevisiae. Mikroba/enzym yang digunakan untuk fermentasi harus mempunyai beberapa syarat sebagai berikut :
- Mempunyai kemampuan untuk memfermentasi karbohidrat yang cocok secara cepat.
- Bersifat membentuk flokulasi dan sedimentasi.
- Mempunyai genetik yang stabil (tidak mudah mengalami mutasi) - Toleran terhadap alkohol yang tinggi (antara 14-15%)
18
5. Oksigen
Pada permulaan proses fermentasi, khamir memerlukan oksigen untuk pertumbuhannya. Setelah terjadi akumulasi CO2, reaksi berubah menjadi anaerob. (Prescott dan Dunn, 1981).
Saccharomyces cerevisiae merupakan mikroorganisme bersel tunggal yang sangat dikenal masyarakat luas sebagai ragi roti. Ragi roti ini selain digunakan dalam pembuatan makanan dan minuman ,juga digunakan dalam industri etanol.
Saccharomyces cerevisiae merupakan khamir uniseluler yang memiliki sel berbentuk ellipsoid atau silindir dengan ukuran 5-20 mikron, bersifat nonpatogenik dan nontoksik. Saccharomyces cerevisiae merupakan organisme fakultatif anaerob yang dapat menggunakan baik sistem aerob maupun anaerob untuk memperoleh energi dari pemecahan glukosa.
Saccharomyces cerevisiae banyak digunakan dalam produksi etanol dari berbagai sumber bahan berkarbohidrat. Saccharomyces cerevisiae dapat memproduksi etanol dalam jumlah besar dan mempunyai toleransi terhadap alkohol yang tinggi dan dapat menghasilkan alkohol dalam jumlah yang besar (Elveri dan Putra, 2006).
19
III. BAHAN DAN METODE
A. Waktu dan Tempat
Penelitian ini dilaksanakan di Laboratorium Analisis Hasil Pertanian, Jurusan Teknologi Hasil Pertanian Fakultas Petanian Universitas Lampung dan Laboratorium SMK-SMTI Bandar Lampung pada bulan Juli sampai dengan Desember 2013.
B. Bahan dan Alat
Bahan baku yang digunakan sebagai sampel berupa limbah agroindustri kulit kakao yang diperoleh dari Desa Jambu, Kecamatan Kedondong, Kabupaten Pesawaran dan bahan kimia yang terdiri dari enzim sellulase (Sqzyme CS P-acid cellulase), Natrium Hidroksida (NaOH), air suling, asam sulfat (H2SO4), ragi roti (merk: Fermipan), Natrium thiopospat, Natrium bikarbonat, natrium karbonat anhidrat, CuSO4.5H2O, amonium molibdad Na2HAsO4.7H2O produksi PT. Merck diperoleh dari Jurusan Teknologi Hasil Pertanian, Fakultas Pertanian Unila.
20
GC 2010 Shimadzu dengan menggunakan detektor FID dan kolom semi polar yang berisi 5% diphenyl dan 95% dimethyl polysiloxane.
C. Metode Penelitian
Penelitian ini dilakukan dalam 3 tahap, yaitu tahap perlakuan awal dengan NaOH, tahap hidrolisis enzimatis, dan tahap fermentasi, yang masing-masing diuraikan di bawah ini.
1. Tahap Perlakuan Awal Dengan NaOH
Penelitian dilakukan secara faktorial dalam Rancangan Acak Kelompok Lengkap (RAKL) dengan tiga kali ulangan. Faktor pertama yaitu waktu pemanasan yang terdiri atas 2 taraf yaitu 15 dan 30 menit. Faktor kedua yaitu konsentrasi NaOH yang terdiri atas 5 taraf, yaitu 0, 0,5, 1,0, 1,5, dan 2,0 M. Data komposisis lignoselulosa dianalisis dengan sidik ragam untuk mendapatkan penduga ragam galat dan ada tidaknya perbedaan antar perlakuan. Data yang diperoleh dianalisis lebih lanjut dengan polinomial ortogonal.
2. Tahap Hidrolisis
21
3. Tahap Fermentasi
Larutan gula reduksi hasil terbaik pada tahap hidrolisis difermentasi menggunakan Saccharomyces cerevisiae dengan konsentrasi 10% dan diinkubasi
pada suhu 300C selama 72 jam yang dilakukan sebanyak 3 kali ulangan. Setelah fermentasi kadar etanolnya ditentukan dengan menggunakan kromatografi gas dan dibahas secara deskriptif.
D. Pelaksanaan Penelitian 1. Persiapan Bahan Baku
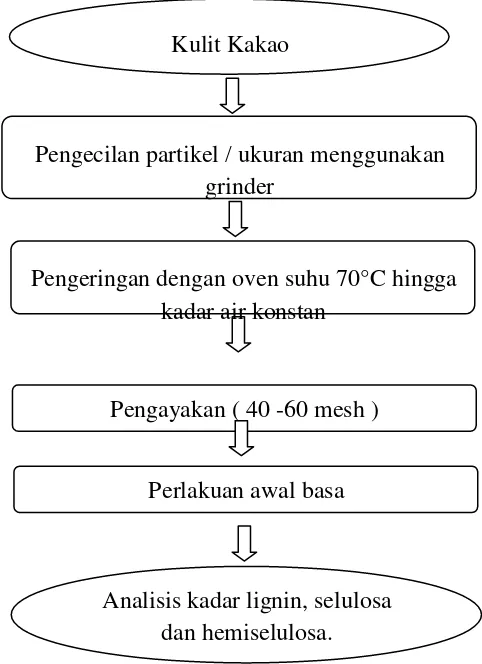
Sampel kulit kakao yang digunakan adalah kulit kakao dari buah yang telah tua. Kulit kakao dikecilkan ukurannya dan dikeringkan menggunakan oven
pada suhu 700 C hingga kadar air konstan. Selanjutnya kulit kakao yang telah halus diayak menggunakan screen 40-60 mesh dan disimpan dalam kondisi kering pada suhu ruang sampai dengan akan digunakan pada proses perlakuan awal (Gambar 6). Kulit kakao sebelum diberi perlakuan awal terlebih dahulu dilakukan analisis kadar selulosa, hemiselulosa dan lignin.
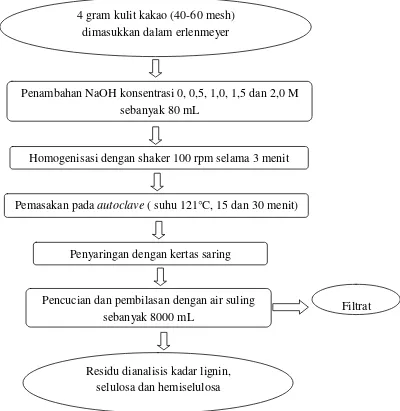
2. Perlakuan awal dengan NaOH
Kulit kakao ditimbang sebanyak 4 gram dan dimasukkan ke dalam erlenmeyer ukuran 100 ml, lalu diberi larutan NaOH dengan konsentrasi 0, 0,5, 1,
22
dikeringkan dalam oven pada suhu 600C selama 24 jam (Gambar 7) dan dianalisa kadar selulosa, hemiselulosa dan lignin menggunakan metode chesson dalam
Datta (1981).
Kulit Kakao
Pengecilan partikel / ukuran menggunakan grinder
Pengeringan dengan oven suhu 70°C hingga kadar air konstan
Pengayakan ( 40 -60 mesh )
Perlakuan awal basa
Analisis kadar lignin, selulosa dan hemiselulosa.
Gambar 6. Persiapan bahan baku ( Samsuri et al., 2007, yang dimodifikasi)
.
3. Hidrolisis Enzimatis Kulit Kakao
Sebanyak 2, 4, 6, dan 8 gram residu kulit kakao hasil perlakuan awal dengan NaOH yang terbaik dimasukkan ke dalam erlenmeyer 100 mL dan ditambahkan buffer citrat 33,6 mL pH 4,8 dan ditambahkan enzim selulase sebanyak 6,4 mL dengan masing-masing konsentrasi 0,10,20 dan 30 FPU.
23
(Gambar 8). Filtrat kulit kakao yang telah dihidrolisis tersebut dianalisis kadar gula reduksi menggunakan Metode Nelson-Somogyi dalam Sudarmadji, 1984.
4 gram kulit kakao (40-60 mesh) dimasukkan dalam erlenmeyer
Penambahan NaOH konsentrasi 0, 0,5, 1,0, 1,5 dan 2,0 M sebanyak 80 mL
Homogenisasi dengan shaker 100 rpm selama 3 menit
Pemasakan pada autoclave ( suhu 121°C, 15 dan 30 menit)
Penyaringan dengan kertas saring
Pencucian dan pembilasan dengan air suling
sebanyak 8000 mL Filtrat
Residu dianalisis kadar lignin, selulosa dan hemiselulosa
Gambar 7. Perlakuan awal basa (Septiyani, 2011, yang dimodifikasi)
4. Fermentasi Hidrolisat Kulit Kakao a. Persiapan Kultur Antara
24
Larutan tersebut di sterilisasi menggunakan autoklaf pada suhu 1210C selama 15 menit. Larutan yang telah disterilisasi sebanyak 10 mL dituang ke dalam tabung reaksi ukuran 20 mL lalu didinginkan dalam keadaan miring hingga memadat dalam kondisi steril (Suh et al., 2007).
Ragi Saccharomycess cerevisiae sebanyak 1 gram dilarutkan dalam 10 mL air suling dan dihomogenkan menggunakan vortex. Sebanyak 1 mL larutan ragi
diinokulasikan pada media agar miring lalu diinkubasi pada suhu 300C selama 48 jam. Sebanyak 3 loop ragi dari media agar miring diinokulasikan pada larutan media YPD 5% steril kemudian diinkubasi pada suhu 300C selama 48 jam. Larutan tersebut disebut kultur antara dan akan diinokulasikan pada kultur kerja yang berisi filtrat hasil hidrolisis kulit kakao.
b. Fermentasi Kulit Kakao
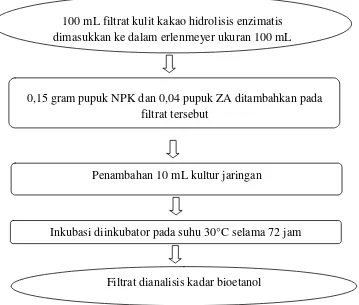
Sebanyak 100 mL filtrat hasil hidrolisis kulit kakao terbaik ditambahkan 0,15 gram pupuk NPK dan 0,04 gram pupuk ZA, kemudian dipasteurisasi di dalam oven pada suhu 800C selama 10 menit lalu didinginkan hingga suhu ruang. Sebanyak 10 mL kultur antara (media YPD 5%) diinokulasikan ke dalam larutan filtrat tersebut lalu ditutup dengan sumbat kapas dan aluminium foil kemudian diinkubasi pada suhu 300C selama 72 jam. Hidrolisat 10 mL yang telah difermentasi dicentrifuse 1000 rpm selama 10 menit, lalu dianalisis kadar etanolnya menggunakan alat Gas Chromatography (Gambar 9).
D. Pengamatan
1. Komponen lignin, selulosa dan hemiselulosa (Datta, 1981)
25
yang telah diberi perlakuan awal NaOH. Kulit kakao dikeringkan dalam oven pada suhu 70oC sampai kadar airnya maksimal 5%. Kulit kakao sebanyak 1 g dimasukan dalam Erlenmayer 250 ml dan diberi penambahan air suling sebanyak 150 ml lalu dipanaskan dengan menggunakan hot plate suhu 100oC selama 2 jam. Setelah itu, sampel disaring dengan kertas saring dan residu dicuci dengan air suling dengan penambahan air suling sampai dengan volume filtrat 300 ml lalu keringkan residu dengan oven pada suhu 105oC sampai dengan berat konstan (berat a). Residu (a) dimasukkan ke dalam Erlenmeyer 250 ml lalu ditambahkan H2SO4 1 N sebanyak 150 ml. Residu dipanaskan dengan hot plate suhu 100oC selama 1 jam, kemudian disaring dan residu dicuci dengan air suling sampai dengan volume filtrat 300 ml dan dikeringkan dengan suhu 105oC sampai berat konstan (berat b).
Residu (b) dimasukkan ke dalam Erlenmeyer 250 ml dengan penambahan H2SO4 72% sebanyak 10 ml lalu residu (b) direndam dan biarkan selama 4 jam pada suhu ruang, kemudian residu (b) diberi penambahan H2SO4 1 N sebanyak 150 ml dan dipanaskan pada suhu 100oC selama 2 jam. Lalu sampel tersebut disaring dengan penambahan air suling sampai dengan volume filtrat 400 ml dan dikeringkan dalam oven pada suhu 105oC sampai berat konstan (berat c). Setelah didapat berat c, maka dilakukan pengukuran kadar abu dengan memasukkan residu (c) ke dalam furnace suhu 600oC selama 4 jam lalu ditimbang untuk mendapatkan berat d.
Kadar hemiselulosa, selulosa dan lignin dapat dihitung dengan rumus berikut :
26
Selulosa (%)
b - c
x100 Berat Sampel
Lignin (%) c - d x100
Berat Sampel
Masing-masing 2,4,6 dan 8 gram residu kulit kakao dimasukkan ke dalam
erlenmeyer 100 mL.
Penambahan buffer citrat 33,6 mL ke dalam erlenmeyer
Penambahan enzim selulase 6,4 mL dengan konsentrasi 10, 20 dan 30 FPU
Inkubasi pada shaker waterbath 200 rpm pada suhu 500C selama 18 jam
Penyaringan dengan kertas saring Residu
40 mL filtrat siap dianalisis kadar gula reduksi
27
100 mL filtrat kulit kakao hidrolisis enzimatis dimasukkan ke dalam erlenmeyer ukuran 100 mL
0,15 gram pupuk NPK dan 0,04 pupuk ZA ditambahkan pada filtrat tersebut
Penambahan 10 mL kultur jaringan
Inkubasi diinkubator pada suhu 30°C selama 72 jam
Filtrat dianalisis kadar bioetanol
Gambar 9. Fermentasi hasil hidrolisis kulit kakao
2. Analisis Gula Reduksi (Metode Nelson – Somogyi dalam Sudarmadji, 1984)
a. Penyiapan Kurva Standar
28
dingin sehingga suhu tabung mencapai 25oC. Setelah dingin 1 ml reagensia Arsenomolybdat ditambahkan dan digojog sampai semua endapan CuSO4 yang ada larut kembali. Setelah semua endapan CuSO4 larut sempurna, 7 ml air suling ditambahkan kedalam tabung tersebut dan digojog sampai homogen. Absorbansi masing-masing larutan tersebut ditera pada panjang gelombang 540 nm dengan menggunakan alat spektrofotometer. Kemudian kurva standar dibuat untuk menunjukkan hubungan antara konsentrasi glukosa dan Absorbansi (Sudarmadji dkk, 1984).
b. Penentuan Kadar Gula Reduksi Pada Contoh
Filtrat hasil hidrolisis kulit kakao yang terbaik diambil sebanyak 1 ml dan dimasukkan kedalam tabung reaksi, kemudian ditambahkan reagensia Nelson sebanyak 1 ml dan selanjutnya diperlakukan seperti pada penyiapan kurva standar di atas. Jumlah gula reduksi ditentukan dengan mengukur absorbansi sampel pada spektrofotometer. Data absorbansi tersebut dikonversi ke konsentrasi gula reduksi dengan memasukkan data absorbansi ke persamaan kurva standar (Y=a+bx) dengan Y adalah absorbansi sampel dan x adalah kadar gula reduksinya.
c. Cara Pembuatan Reagensia
Reagensia Nelson :
29
Reagensia Nelson A dan 1 bagian Reagensia Nelson B. Reagensia Arsenomolybdat :
Sebanyak 25 g ammonium molybdat dilarutkan dalam 450 ml air suling dan ditambahkan 25 ml asam sulfat pekat. Larutkan pada gelas piala 3 g Na2HAsO4. 7H2O dalam 25 ml air suling. Kemudian larutan ini dituang kedalam larutan yang pertama. Simpan dalam botol berwarna coklat dan diinkubasi pada
suhu 37oC selama 24 jam.
3. Kadar Bioetanol
46
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan penelitian yang telah dilakukan, maka dapat disimpulkan beberapa hal sebagai berikut :
1. Kondisi optimum perlakuan awal kulit kakao yaitu perendaman dalam larutan NaOH 1,5 M pada suhu 121oC selama 30 menit. Kondisi optimum ini menghasilkan penurunan lignin dari 24,32% menjadi 0,60%, penurunan hemiselulosa dari 21,59% menjadi 9,54%, dan peningkatan selulosa dari 15,94% menjadi 35,05%.
2. Kondisi optimum hidrolisis holoselulosa kulit kakao yaitu hidrolisis 10% (b/v) holoselulosa kulit kakao dengan 30 FPU enzim selulase pada suhu 50oC selama 18 jam. Kondisi ini menghasilkan gula reduksi sebesar 2,54 g/L.
3. Fermentasi gula reduksi hasil hidrolisis kulit kakao (2,54 g/L) dengan Saccharomyces cerivisiae 10% pada suhu 30oC selama 72 jam menghasilkan etanol sebesar 0,33% (v/v).
B. Saran
47
DAFTAR PUSTAKA
Achmadi, S.S. 1989. Kimia Kayu. Diktat PAU Ilmu Hayati. Industri Pertanian Bogor.
Anonim. 2008. Industri Coklat Mati Suri. http://www.davomas.com. Diakses pada tanggal 7 Februari 2008.
Anonim. 2012. Produksi Minyak Bumi. Direktorat Jendral Migas.
http://www.migas.esdm.go.id. Diakses pada tanggal 14 Desember 2012. Anonim. 2013. Pemerintah Genjot Industri Kakao. Kemenperin.
http://www.Kemenperind.go.id. Diakses Pada Tanggal 5 Februari 2013. Apriyantono, A.D. Fardiaz, N.L Puspitasari, Sedarnawati dan S. Budiyanto.
1988. Petunjuk Laboratorium Analisis Pangan. IPB Bogor.
Arnata, I.W. 2009. Pengembangan Alternatif Teknologi Bioproses Pembuatan Bioetanol dari Ubi Kayu Menggunakan Trichoderma viride, Aspergillus niger dan Saccharomyces cerevisiae. Tesis Master. Bogor : Program Studi Teknologi Industri Pertanian, Program Pasca Sarjana, Institut Pertanian Bogor.
Ashadi, R.W. 1988. Pembuatan Gula Cair dari Pod Kakao Dengan Menggunakan Asam Sulfat, Enzim, Serta Kombinasi Keduanya. Skripsi. Fakultas teknologi Pertanian, IPB, Bogor.
Bayer, E.A., Chanzy, H., Lamed, R. and Shoham Y. 1998. Cellulose, Cellulases and Cellulosomes. Curr Opin Struc Biol. Vol:8. Hal:548–557
Brown, R.D. 1979. Hydrolisis of Cellulose : Mechanism of Enzimatic and Acid Catalysis Advances in Chemistry series 18. American Chemical Society, Washington.
Clark, T. dan K. L. Mackie. 1984. Fermentation Inhibition in Word Hydrolisates Derived from the Softwood Pinus Radiate. J. Chem. Biotechnol. Vol.34B Hal : 101-110.
Daud, M., Syafi’i, W. dan Syamsu, K. 2012. Pemanfaatan Batang Kelapa Sawit (Elaeis guineensis Jacq) Menjadi Bioetanol Dengan Perlakuan Pendahuluan Menggunakan Proses Kraft. Tesis. Institut Pertanian Bogor. Jawa Barat
Elevri,P.A. dan Putra, S.R. 2006. Produksi Etanol Menggunakan Saccharomyces Cerevisiae yang Diamobilisasi Dengan Agar Batang. Akta Kimindo Vol. 1 No. 2. Hal : 105-114. Institut Teknologi Surabaya.
Fakhira, J. 2010. Hidrolisis Enzimatis Pod Kakao (Theobroma cacao L. ) Untuk Produksi Etanol. Tesis. Institut Pertanian Bogor.
Fao. 2005. The Nature of Lignocellulosics and Their Pretreatment For Enzymatis Hydrolysis, Adv. Biochem. Eng. 158 – 187.
Fardiaz, S. 1992. Mikrobiologi Pangan 1. Gramedia Pustaka utama, Jakarta. Fengel, D. and G. Wegener. 1995. Wood: Chemistry, ultrastructure, reactions.
Walter de Gruyter & Co., Berlin.
Fessenden. 1999. Kimia Organik Jilid II. Penerbit Erlangga. Jakarta.
Fridia, T. 1989. Pengaruh Cara Delignifikasi Terhadap Sakarifikasi Limbah Lignoselulosik. Skripsi. Fakultas Teknologi Pertanian. IPB Bogor. Foody, B., J. S. Tolan and J.D. Bernstein. 1999. Pretreatment Proccess for
Conversion of Cellulose to Fuel Ethanol. U.S. Pat. No. 6.090.595.
Gunam I.B.W., Antara N. S., dan Anggraeni A.A.M.D. 2009. Pemanfaatan Limbah Lignoselulosa Sebagai Bahan Baku Pembuatan Bioetanol Dengan Teknik sel terimobilisasi. Denpasar: Laporan Penelitian Hibah strategis Nasional, Universitas Udayana.
Gunam, I., Wartini, N., Anggreni, A. dan Suparyana,P. 2011. Delignifikasi Ampas Tebu dengan Larutan Natrium Hidroksida Sebelum Proses Sakaraifikasi Secara Enzimatis Menggunakan Enzim Selulase Kasar Dari Aspergillus niger FNU 6018. LIPI Press. Vol: 34.
Hamelinck C.N., Hooijdonk G.V., and Faaij A.P.C. 2005. Ethanol From Lignocellulosic Biomass: Techno-Economic Performance In Short-, Middle and Long-Term. Biomass and Bioenergy, 28: 384 -410.
Ishihara, T., Putri, F.A., Ismail, A.R. and Khoo, K.C. 1991. Enzymatic saccharification of oil palm trunks. Journal of Tropical Forest Science vol :3. Hal : 356–360.
Isro’i. 2008. Produksi Bioetanol Berbahan Baku Biomassa Lignoselulosa.
Irawadi, TT. 1990. Kajian Hidrolisis Limbah Lignoselulosa dari Industri Pertanian. J. Tek. Ind. Pert. 8 (3) : 124 -134.
Judoamidjojo, R.M., E.G. Said dan L. Hartoto. 1989. Biokonversi. Departemen Pendidikan dan Kebudayaan, Direktorat Pendidikan Tinggi. Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor. Bogor.
Judoamidjojo, M., A.A. Darwia, dan E.G. Sa’id. 1992. Teknologi Fermentasi.
Edisi 1. Rajawali Press, Jakarta.
Jung, Y., Kim, I., Kim, J., Oh, K., Han, J., Choi, I dan Kim, K. 2011. Ethanol Production from Oil Palm Trunks Treated With Aqueous Ammonia and Cellulase. Bioresource Technology vol : 102. Hal : 7307-7312
Kirk R.E. and D.F. Othmer. 1952. Encyclopedia of Chemical Technology. Vol.8. Pp.327-338. The Interscience Encyclopedia, Inc., New York.
Kunaepah, U. 2008. Pengaruh Lama Fermentasi dan Konsentrasi Glukosa terhadap Aktivitas Antibakteri, Polifenol Total dan Mutu Kimia Kefir Susu Kacang Merah.
Lim, M., Wirtanto, E.dan Masyithah,Z. 2012. Kajian Karakteristik Dan Pengaruh Nisbah Pereaksi, Ph Awal Reaksi Dan Suhu Reaksi Terhadap Berat Rendemen Natrium Lignosulfonat. Jurnal Teknik Kimia USU, Vol. 1. Lynd, LR., van Zyl, WH., McBride, JE., Laser, M. 2005. Consolidated
bioprocessing of cellulosic biomass: anupdate. Current Opinion in Biotechnology. Vol :16. Hal: 577-583.
Mangunwidjaja, D dan Suryani.A. 1994. Technology Bioproses. Penebar Swadaya, Jakarta
Masykuri. 2001. Analisis Kualitatif Terhadap Etanol Hasil Fermentasi Susu Kerbau Lumpur dengan Kromatografi Gas. Fakultas Peternakan. Universitas Diponegoro. Semarang.
Mosier, N. And Hendrickson, R. 2005. Features Of Promising Technologies For Pretreatment Of Lignocellulosic Biomass, Bioresource Technology. Hal. 673-686.
Oktaveni. 2009. Lignin Terlarut Asam dan Delignifikasi pada Tahap Awal Proses Pulping Alkali. Skripsi. Institut Pertanian Bogor. Jawa Barat Oshima, M. 1965. Wood Chemistry Proccess Engineering Aspect. Noyes
Prihandana, R., Kartika N., Praptiningsih G., Adinurani, Dwi S., Sigit S., dan Roy H. 2007. Bioetanol Ubi Kayu Bahan Bakar Masa Depan. Agro Media Pustaka, Jakarta.
Prescot, S.C and G Dunn. 1959. Industrial Microbiology. The AVI Publishing, Company Inc, Westport-Connectitut.
Prescot, S.C and G Dunn.1981. Industrial Microbiology. Mc Graw-Hill Book Co. Ltd., New York.
Purnawan, 2011. Pemanfaatan Limbah Serat Industri Tepung Sagu aren Sebagai Bahan Baku Pembuatan Kertas (Pulp) Dengan Proses Delignifikasi. Jurnal Teknologi Technoscientia vol 4 No.1. Institut Sains dan Teknologi Akprind, Yogyakarta.
Rabinovich, M., Melnick, M.S. and Bolobova, A.V. 2002. The Structure and Mechanism of Action of Cellulolytic Enzymes. Biochemistry (Moscow). vol:67. Hal:850-871.
Rosgaard. L, Andric. P, Dam, J.K., Pedersen. S and Meyer, A.S. 2007. Effect of Substrate Loading on Enzimatic Hydrolisis and Viscosity of Pretreatment Barley Straw. Appl Biochem Biotechnology. US National Library of Medicine.
Roukas, T. 1994. Continuous Ethanol Productions from Carob Pod Extract by Immobilized Saccharomycess cerevisiae in a Packed Bed Reactor. J. Chem. Technology biotechnol., 59; 387-393
Samah, O., Sias, S., Hua, Y., dan Hussin, N. 2011. Production of Ethanol from Cocoa Pod Hydrolysate. ITB Journal of Science. 43A(2):87-94.
Samsuri, M., Gozan, M., Mardias, R., Baiquni, Hermansyah, Wijanarko, Prasetya dan Nasikin. 2007. Pemanfaatan Selulosa Ampas tebu untuk produksi Etanol Melalui Sakarifikasi dan fermentasi Serentak dengan Enzim Xylanase. Makara Teknologi. 11(1):17-24.
Siswoputranto, Y.S. 1983. Prospek Percoklatan Dunia dan Kepentingan
Silverstein,R., Chen,Y., Ratna, R., Shivappa, S., Boyette, M.D. and Osborne,J. 2007. A Comparison of Chemical Pretreatment Methods for Improving Saccharification of Cotton Stalks. Elsiever. Bioresource technology. Vol :98. hal : 3000–3011
Sjostrom, E. 1995. Kimia Kayu : Dasar-Dasar dan Penggunaan. Terjemahan. Yogyakarta : Gajah Mada University Press.
Soerawidjaja, Tatang H., 2008. Teknologi BBN Generasi 2 dan Prospeknya di Indonesia. Lokakarya Operasionalisasi Permen ESDM No.32 Tahun 2008. Dewan Riset Nasional. Jakarta 1-2 Desember 2008.
Soerawidjaja, Tatang H. 2008. Tanaman Perkebunan Energi dan Bahan Bakar Nabati Generasi 2: Bahan Ajar Teknologi Kemurgi.
Somogyi, M. 1952. Notes on Sugar Determination Journal of Biological Chemistry vol. 200, No. 1, 19-23.
Steinfeld, J. I., Francisco, J.S. dan Hase, W. L. 1989. Chemical Kinetics and Dynamics. Prentice-Hall. New Jersey
Sudarmadji, S., Bambang, H., dan Suhardi. 1984. Prosedur Analisa untuk Bahan Makanan dan Pertanian edisi ketiga. Liberty. Yogyakarta.
Sudiyani, Y., Muryanto, Barlianti,V., Triwahyuni, E., Aristiawan, Y., Risanto,L., dan Hermiati, E. 2013. Pemanfaatan Limbah Biomassa Industri Kelapa Sawit Untuk Produksi Bioetanol Generasi 2 Dan Co-Products. Pusat Penelitian Kimia-Lembaga Ilmu Pengetahuan Indonesia (PUSPIPTEK). Tangerang.
Sumada, K., Tamara, E. Dan Alqani, F. 2011. Kajian Proses Isolasi Α - Selulosa
Dari Limbah Batang Tanaman Manihot Esculenta Crantz Yang Efisien. Jurnal Teknik Kimia UPN “Veteran” Jawa Timur. Vol.5, No.2 : 434. Sun, Y., and Cheng, J. 2002. Hydrolysis of Lignocellulosis Materials for Ethanol
Production: A Review, Bioresource Technology. Vol.83.
Taherzadeh, M.J., and Karimi, K. 2007. Acid-Based Hydrolysis Processes for Ethanol from Lignocellulosic Materials : A review. BioResources 2 (3) : 472-499.
Xiao Z, Zhang X, Gregg DJ and Saddler JN. 2004. Effects of Sugar Inhibition on Cellulases and Beta-Glucosidase During Enzymatic Hydrolysis of Softwood Substrates. Biochemical Biotechnology. Vol:26. Hal 113-116 Xu, J., Chen, Y., Jay J., Ratna R., Shivappa, S and Joseph , C. 2011.