KEMAMPUAN BAKTERI KITINOLITIK ASAL RIZOSFER TANAMAN KARET DALAM MENGENDALIKAN JAMUR AKAR PUTIH PADA
BIBIT KARET
SKRIPSI
OLEH
FRICO SITUMEANG 110805067
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
KEMAMPUAN BAKTERI KITINOLITIK ASAL RIZOSFER TANAMAN KARET DALAM MENGENDALIKAN JAMUR AKAR PUTIH PADA
BIBIT KARET
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
OLEH
FRICO SITUMEANG 110805067
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
i
PERSETUJUAN
Judul : Kemampuan Bakteri Kitinolitik Asal Rizosfer
Tanaman Karet Dalam MengendalikanJamur Akar Putih Pada Bibit Karet
Kategori : Skripsi
Nama : Frico Situmeang
Nomor Induk Mahasiswa : 110805067
Program Studi : Sarjana (S1) Biologi
Departemen : Biologi
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universtas Sumatera Utara
Disetujui di Medan, September 2015
Komisi Pembimbing :
Pembimbing 2, Pembimbing 1,
Dra. Isnaini Nurwahyuni, M.Sc NIP. 196005231985022001
Prof. Dr. Dwi Suryanto, M.Sc NIP.196404091994031003
Disetujui Oleh
Departemen Biologi FMIPA USU Ketua,
ii
PERNYATAAN
KEMAMPUAN BAKTERI KITINOLITIK ASAL RIZOSFER TANAMAN KARET DALAM MENGENDALIKAN JAMUR AKAR PUTIH PADA
BIBIT TANAMAN KARET
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, September
iii
PENGHARGAAN
Puji syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa atas kasih dan anugerahNya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Kemampuan Bakteri Kitinolitik Asal Rizosfer Tanaman Karet Dalam Mengendalikan Jamur Akar Putih Pada Bibit Karet”, Skripsi ini dibuat sebagai salah satu syarat untuk meraih gelar Sarjana Sains pada Fakultas MIPA USU Medan.
Pada kesempatan ini penulis mengucapkan terimakasih kepada orang tua terkasih dan terbaik ayahanda Beslin Situmeang dan ibunda Desnaria Manalu yang selalu memberikan doa, semangat, perhatian, kasih sayang dan pengorbanan yang begitu besar kepada penulis. Kepada Kakak Immi Oyani Situmeang, kedua Adik Ariska Situmeang dan Kusenarigo Situmeang yang selalu memberikan dukungan semangat dan perhatian kepada penulis.
Terimakasih penulis sampaikan kepada Bapak Prof. Dr. Dwi Suryanto M.Sc. selaku pembimbing I dan Ibu Dra. Isnaini Nurwahyuni M. Sc. selaku pembimbing II yang telah banyak meluangkan waktu, tenaga dan pikiran selama masa penelitian dan penulisan skiripsi ini. Ucapan terimakasih juga penulis ucapkan kepada Ibu Dr. It Jamilah M. Sc. dan Ibu Dra. Nunuk Priyani M. Sc. selaku dosen penguji yang telah memberikan banyak masukan dan arahan dalam penyempurnaan penulisan skripsi ini. Bapak Prof. Dr. Ing. Ternala Alexander Barus M. Sc. selaku dosen pembimbing akademik yang telah memberikan nasehat dan semangat selama masa perkuliahan. Ibu Dr. Nursahara Pasaribu M. Sc. selaku ketua Departemen Biologi FMIPA USU. Ibu Nurhasni Muluk, Bang Erwin dan Ibu Rosalina Ginting selaku staf pegawai Departemen Biologi FMIPA USU.
Penulis juga menyampaikan terimakasih kepada Tanoto Foundation Scholarship yang memberikan hibah dalam pengerjaan penelitian ini. Balai penelitian karet Sei Putih Kab. Deli Serdang yang telah banyak memberikan masukan dalam pengejaan penelitian ini.
iv
terimakasih atas kerja samanya selama di bangku perkuliahan. Teman-teman di LCE (Languange and Culutural Exchange) terimakasih sudah memberikan semangat dan menghiasi hari-hari penulis dalam penulisan skripsi ini. Rekan-rekan tentor di Bimbingan belajar Sony Sugema College atas pengertian yang diberikan selama pengerjaan penelitian dan penulisan skripsi ini.
Akhirnya dengan penuh ketulusan dan kerendahan hati, penulis menyadari bahwa skiripsi ini masih jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang berisfat membangundemi kesempurnaan skiripsi ini. Atas partisipasi dan dukungannya penulis ucapkan terimakasih.
Medan, September 2015
v
KEMAPUAN BAKTERI KITINOLITIK ASAL RIZOSFER TANAMAN KARET DALAM MENGENDALIKAN JAMUR AKAR PUTIH PADA
BIBIT KARET
ABSTRAK
Pembudidayaan tanaman karet dapat dihambat oleh adanya serangan penyakit. Penyakit tanaman karet disebabkan oleh Rigidoporus lignosus yang menyerang akar tanaman karet sedangkan Colletortrichum dan Corynespora menyerang daun tanaman karet. Penelitian ini bertujuan untuk menguji kemampuan bakteri kitinolitik dari peneltian sebelumnya yang diisolasi dari rizosfer tanaman karet dalam menghambat pertumbuhan R. lignosus Corynespora dan Colletrotrichum secara in vitro serta melihat kemampuannya dalam menurunkan serangan R.lignosus pada bibit tanaman karet secara in vivo. Isolat bakteri kitinolitik dengan kode isolat FS 4 dan FS 7 digunakan dalam penelitian ini. Hasil penelitian menunjukkan bahwa kedua isolat mampu menghambat pertumbuhan jamur patogen. Isolat FS 7 merupakan isolat dengan diameter zona hambat yang lebih tinggi. Diameter zona hambat pada R. lignosus 21.35 mm, Corynespora 17 mm dan Colletotrichum 21.5. Sedangakan isolat bakteri kitinolitik kode FS 4 terhadap R. lignosus, Corynespora dan Colletotrichum diameter zona hambat masing-masing 14.5 mm, 14.5 mm dan 20.15. Pada uji in vivo dilakukan dengan dua perlakuan. Perlakuan I adalah pemberian bakteri kitinolitik satu hari setelah inokulasi jamur patogen pada akar tanaman karet sedangkan perlakuan II aplikasi bakteri kitinolitik 30 hari setelah inokulasi jamur patogen. Kontrol positif inokulasi jamur patogen tanpa pemberian bakteri kitinolitik sedangkan kontrol negatif tidak diberikan bakteri kitinolitik ataupun jamur patogen. Hasil penelitian menunjukkan bakteri kitinolitik mampu menurunkan serangan R. lignosus pada bibit tanaman karet. Perlakuan I intensitas serangan dengan pemberian bakteri FS 4 sebesar 0% dan FS 7 sebesar 5 %. Pada perlakuan II dengan pemberian bakteri FS 4 intensitas serangan awal 40% dan intensitas serangan akhir 30 sedangakan FS 7 intensitas serangan awal 30% dan intensitas serangan akhir 30%. Kontrol negatif tidak menunjukkan adanya serangan penyakit sedangkan kontrol positif intensitas serangan sebsar 65 %. Penurunan intensitas serangan pada isolat bakteri FS 4 sebesar 83.33 % dan FS 7 33.33 %.
vi
THE ABILITY OF CHITINOLYTIC BACTERIA FROM RUBBER PLANT RHIZOSPHERE TO CONTROL WHITE ROOT DISEASE IN RUBBER
SEEDLINGS
ABSTRACT
Cultivation of rubber plant is inhibited by diseases. The diseases attacks rubber plants caused by Rigidiporus lignosus which damages rubber roots while Colletotrichum and Corynespora cause leaf diseases. The purpose of this study was to examine the ability of chitiniolytic bacteria which was isolated from rhizosphere of rubber plants in previous study to inhibit R. lignosus, Corynespora and Colletotrichum growth by in vitro study. In vivo study was to examine its ability to control white root disease caused by R. lignosus in rubber seedlings. Rhizospere chitinolytic bacterial isolates which had FS 4 and FS 7 code were used in this study. The result showed that both of isolates had abilities in inhibiting pathogenic fungal growth which FS 7 isolate showed higher inhibition zone. Inhibition zone of R. lignosus, Colletotrichum, Corynespora were 21.35 mm 17 mm, and 21. 5 mm, while inhibition zone of rhizospehere chitinolytic bacteria FS 4 code were 14.5 mm, 14.5 mm and 20.15 mm respectively. The study of in vivo was conducted using two treatments. The first treatment was application of chitinolytic bacteria one day after pathogenic fungi had been inoculated while second treatment was applied by chitinolytic bacterial 30 days after pathogenic fungi had been inoculated. Positive control was inoculation of pathogenic fungi without application of chitinolytic bacterial, while negative control was not applied by neither chitinolytic bacteria nor pathogenic fungi. The result showed a decline of disease intensity in rubber seedlings. The first treatment exhibited that the diseases intensity of R. lignosus was 0% for FS 4 and 5% for FS 7 while second treatment reduced from 40% to 15% for FS 4 and 30% to 20% for FS 7. Negative control did not show diseases while diseases intensity of positive control was 65%. Decreasing of disease intensity was 83.33% for FS 4 and 33.33% for FS 7 isolate.
vii
DAFTAR ISI
Halaman
PERSTUJUAN i
PERNYATAAN ii
PNGHARGAAN iii
ABSTRAK v
ABSTRACT vi
DAFTAR ISI vii
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN x
BAB 1 PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Permasalahan 2
1.3 Tujuan Penelitian 3
1.4 Hipotesis 3
1.5 Manfaat Penelitian 3
BAB 2 TINJAUAN PUSTAKA
2.1 Tanaman Karet (Hevea brasiliensis) 4
2.2 Bakteri Rizosfer 5
2.3 Penyakit Pada Tanaman Karet 5
A. Serangan Infeksi Jamur Rigidoporus lignosus
B. Jamur Akar Putih ( R. lignosus) 6
C. Penyakit Pada Daun Tanaman Karet 8
2.4 Potensi Bakteri Kitinolitik Rizofer Sebagai Agen Pengendali Hayati
10
BAB 3 METODE PENELITIAN
3.1 Waktu dan Tempat 11
3.2 Isolasi Jamur Patogen Tanaman Karet 11
3.3 Uji Antagonis Bakteri Rizosfer Terhadap Colletotrichum dan Corynespora
11
3.4 Pengamatan Stuktur Hifa Abnormal Jamur Patogen 12 3.5 Uji Potensi Bakteri Kitinolitik Rizosfer Terhadap Serangan
JAP Pada BibitTanaman Karet Secara In vivo
12
3.6 Pengamatan Intensitas Serangan dan Luas Serangan R.lignosus pada Bibit Tanaman Karet
13
3.7 Reisolasi Jamur Patogen R. lignosus dan Bakteri Kitinolitik Rizosfer
14
BAB 4 HASIL DAN PEMBAHASAN
4.1 Isolasi jamu patogen pada tanaman karet 16
4.2 Uji antagonis bakteri kitinolitik rizosfer terhadap jamur patogen
17
4.3 Pengamatan hifa abnormal jamur patogen 19
4.4 Uji potensi bakteri kitinolitik rizosfer terhadapserangan JAP pada bibit tanaman karet secara in vivo
viii
4.5 Intensitas serangan dan luas serangan JAP pada bibit karet 20 4.6 Pengaruh infeksi JAP terhadap pertambahan tinggi tanaman
dan jumlah daun
23
4.7 Reisolasi JAP dari akar tanaman karet dan bakteri kitinolitik dari media tanam
26
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 27
5.2 Saran 27
DAFTAR PUSTAKA LAMPIRAN
ix
DAFTAR GAMBAR
Gambar Judul Halaman
2.1 Serangan jamur akar putih pada tanaman karet 7
2.2 Serangan jamur patogen pada daun tanaman karet 8
3.3 Uji antagonis bakteri kitinolitik terhadap jamur patogen
12
4.1 Hasil isolasi jamur patogen tanaman karet 16
4.2 Uji antagonis bakteri kitinolitik 17
4.3 Hasil uji antagonis bakteri kitinolitik rizosfer terhadap jamur patogen
18
4.4 Hifa abnormal pada jamur patogen 19
4.5 Hasil infeksi R. lignosus pada akar bibit karet 20
4.6 Perbandingan nilai intensitas serangan R. lignosus pada masing-masing perlakuan
21
4.7 Luas serangan R. lignosus pada bibit tanaman karet 22
4.8 Pertambahan rata-rata tiggi batang setelah 60 hari masa perlakuan
23
4.9 Pertambahan rata-rata jumlah daun setelah 60 hari masa perlakuan
23
x
DAFTAR LAMPIRAN
Lampiran Judul Halaman
1.1 Komposisi Medium MGMK Padatdan Cara Pembuatannya
27
1.2 Pembuatan larutan koloidal Kitin 28
2 Alur Kerja Uji Antagonis 29
3 Alur kerja Pengamatan Hifa Abnormal 29
4 Proses penginfeksian JAP dan bibit tanaman karet 30
v
KEMAPUAN BAKTERI KITINOLITIK ASAL RIZOSFER TANAMAN KARET DALAM MENGENDALIKAN JAMUR AKAR PUTIH PADA
BIBIT KARET
ABSTRAK
Pembudidayaan tanaman karet dapat dihambat oleh adanya serangan penyakit. Penyakit tanaman karet disebabkan oleh Rigidoporus lignosus yang menyerang akar tanaman karet sedangkan Colletortrichum dan Corynespora menyerang daun tanaman karet. Penelitian ini bertujuan untuk menguji kemampuan bakteri kitinolitik dari peneltian sebelumnya yang diisolasi dari rizosfer tanaman karet dalam menghambat pertumbuhan R. lignosus Corynespora dan Colletrotrichum secara in vitro serta melihat kemampuannya dalam menurunkan serangan R.lignosus pada bibit tanaman karet secara in vivo. Isolat bakteri kitinolitik dengan kode isolat FS 4 dan FS 7 digunakan dalam penelitian ini. Hasil penelitian menunjukkan bahwa kedua isolat mampu menghambat pertumbuhan jamur patogen. Isolat FS 7 merupakan isolat dengan diameter zona hambat yang lebih tinggi. Diameter zona hambat pada R. lignosus 21.35 mm, Corynespora 17 mm dan Colletotrichum 21.5. Sedangakan isolat bakteri kitinolitik kode FS 4 terhadap R. lignosus, Corynespora dan Colletotrichum diameter zona hambat masing-masing 14.5 mm, 14.5 mm dan 20.15. Pada uji in vivo dilakukan dengan dua perlakuan. Perlakuan I adalah pemberian bakteri kitinolitik satu hari setelah inokulasi jamur patogen pada akar tanaman karet sedangkan perlakuan II aplikasi bakteri kitinolitik 30 hari setelah inokulasi jamur patogen. Kontrol positif inokulasi jamur patogen tanpa pemberian bakteri kitinolitik sedangkan kontrol negatif tidak diberikan bakteri kitinolitik ataupun jamur patogen. Hasil penelitian menunjukkan bakteri kitinolitik mampu menurunkan serangan R. lignosus pada bibit tanaman karet. Perlakuan I intensitas serangan dengan pemberian bakteri FS 4 sebesar 0% dan FS 7 sebesar 5 %. Pada perlakuan II dengan pemberian bakteri FS 4 intensitas serangan awal 40% dan intensitas serangan akhir 30 sedangakan FS 7 intensitas serangan awal 30% dan intensitas serangan akhir 30%. Kontrol negatif tidak menunjukkan adanya serangan penyakit sedangkan kontrol positif intensitas serangan sebsar 65 %. Penurunan intensitas serangan pada isolat bakteri FS 4 sebesar 83.33 % dan FS 7 33.33 %.
vi
THE ABILITY OF CHITINOLYTIC BACTERIA FROM RUBBER PLANT RHIZOSPHERE TO CONTROL WHITE ROOT DISEASE IN RUBBER
SEEDLINGS
ABSTRACT
Cultivation of rubber plant is inhibited by diseases. The diseases attacks rubber plants caused by Rigidiporus lignosus which damages rubber roots while Colletotrichum and Corynespora cause leaf diseases. The purpose of this study was to examine the ability of chitiniolytic bacteria which was isolated from rhizosphere of rubber plants in previous study to inhibit R. lignosus, Corynespora and Colletotrichum growth by in vitro study. In vivo study was to examine its ability to control white root disease caused by R. lignosus in rubber seedlings. Rhizospere chitinolytic bacterial isolates which had FS 4 and FS 7 code were used in this study. The result showed that both of isolates had abilities in inhibiting pathogenic fungal growth which FS 7 isolate showed higher inhibition zone. Inhibition zone of R. lignosus, Colletotrichum, Corynespora were 21.35 mm 17 mm, and 21. 5 mm, while inhibition zone of rhizospehere chitinolytic bacteria FS 4 code were 14.5 mm, 14.5 mm and 20.15 mm respectively. The study of in vivo was conducted using two treatments. The first treatment was application of chitinolytic bacteria one day after pathogenic fungi had been inoculated while second treatment was applied by chitinolytic bacterial 30 days after pathogenic fungi had been inoculated. Positive control was inoculation of pathogenic fungi without application of chitinolytic bacterial, while negative control was not applied by neither chitinolytic bacteria nor pathogenic fungi. The result showed a decline of disease intensity in rubber seedlings. The first treatment exhibited that the diseases intensity of R. lignosus was 0% for FS 4 and 5% for FS 7 while second treatment reduced from 40% to 15% for FS 4 and 30% to 20% for FS 7. Negative control did not show diseases while diseases intensity of positive control was 65%. Decreasing of disease intensity was 83.33% for FS 4 and 33.33% for FS 7 isolate.
BAB 1 PENDAHULUAN
1.1Latar belakang
Tanaman karet (Hevea brasiliensis Muell. Arg) merupakan salah satu jenis tanaman yang banyak dibudidayakan oleh masyarakat Indonesia.Tanaman ini memiliki peran yang cukup penting sebagai penghasil komoditi ekspor yang merupakan sumber devisa negara bagi perekonomian masyarakat Indonesia (Lubis, 2002). Pengembangan industri karet memberi manfaat dalam peningkatan pendapatan petani, masyarakat, dan negara (Kusdiana, 2011). Sehubungan dengan peranannya yang penting masyarakat Indonesia hingga saat ini masih terus meningkatkan pembudidayaan tanaman karet. Menurut BPS (2013) menyatakan bahwa perkembangan luas perkebunan karet di Indonesia pada tahun 2013 diperkirakan sebesar 3,55 juta hektar dengan produksi karet sekitar 3,56 juta ton/tahun.
Budidaya tanaman karet mempunyai hambatan yaitu serangan penyakit yang merugikan petani karet karena penurunan produksi karet dan biaya dalam pengendalian penyakit tersebut (Muharni & Widjajanti, 2011). Salah satu penyakit penting yang menyerang tanaman karet adalah penyakit jamur akar putih (JAP) yang disebabkan oleh cendawan Rigidoporus lignosus (Farid et al. 2006; Holliday 1996; Ilahang et al. 2006). Adanya serangan cendawan ini menjadi salah satu pembatas yang menyebabkan terjadinya penurunan produksi karet di Indonesia (Nugroho, 2010). Tanaman karet yang terserang JAP memiliki gejala awal berupa busuknya akar tanaman yang menyebabkan tanaman mudah roboh dan daun tanaman yang terserang akan menguning dan gugur yang selanjutnya diikuti oleh matinya ranting tanaman (Nugroho, 2010). Selain jamur akar putih terdapat jamur patogen penginfeksi daun tanaman karet yaitu Corynespora dan Colletotrichum yang menyebabkan daun busuk dan gugur dari ranting tanaman karet (Evueh & Ogbebor, 2008; Jayasinghe & Fernando, 2009; Manju et al. 2014).
2
memiliki efek negatif terhadap kesehatan manusia, menyisahkan residu yang menyebabkan pencemaran lingkungan, serta terbunuhnya organisme yang bukan target (Soytong et al. 2005; Haggag & Moamed 2007; Leelavathi & Reena 2014). Untuk menghindari efek negatif dari penggunaan senyawa kimia ini diperlukan pengendalian secara biologi sebagai metode alternatif dalam mengendalikan serta menghambat penyebaran penyakit tersebut (Kaewchai & Soytong, 2010; Suryanto et al. 2014).
Secara alami agen pengendali hayati jamur patogen tersebut terdapat didalam tanah (rhizosfer). Agen pengendali hayati tersebut salah satunya adalah bakteri kitinolitik yang berperan dalam mendegradasi dinding sel jamur yang pada akhirnya menyebabkan kematian pada jamur patogen tersebut. Menurut Albouvette et al (2006) terdapat mikroorganisme antagonis yang selalu berinteraksi dengan berbagai penyakit tanaman di dalam tanah yang berperan penting sebagai agen pengendali hayati pada penyakit tanaman. Bakteri kitinolitik dari penelitian sebelumnya (Situmeang et al, 2014) yang diisolasi dari rizosfer tanaman karet memiliki potensi dalam menghambat R. lignosus secara in vitro. Dua isolat isolat yang diberi kode FS 4 dan FS 7 memiliki zona hambat tertinggi. Oleh sebab itu perlu dilakukan penelitian lebih lanjut untuk megetahui potensi bakteri kitinolitik rizosfer dalam menghambat pertmbuhan jamur patogen pada tanaman karet R. lignosus Corynespora, Colletotrichum secara in vitro dan kemampuannya dalam menghambat pertumbuhan jamur akar putih (Rigidoporus lignosus) pada bibit tanaman karet secara in vivo untuk mendapatkan agen pengendali hayati yang lebih baik.
1.2 Permasalahan
3
merupakan alternatif terbaik dalam mengendalikan perkembangan penyakit tanaman yang disebabkan oleh beberapa jenis jamur patogen. Untuk itu perlu dilakukan penelitian untuk mengetahui kemampuan bakteri kitinolitik rizosfer tanaman karet dalam menghambat pertumbuhan jamur patogen pada tanaman karet.
1.3 Tujuan Penelitian
Tujuan dari penelitian ini ialah untuk:
1. mengetahui potensi bakteri kitinolitik rizosfer tanaman karet dalam mengendalikan jamur patogen tanaman karet R. lignosus, Corynepora dan Colletotrichum secara in vitro.
2. mengetahui potensi bakteri kitinolitik rizosfer tanaman karet dalam menghambat pertumbuhan R. lignosus penyebab penyakit jamur akar putih pada bibit tanaman karet secara in vivo
1.4 Hipotesis
1. Isolat bakteri kitinolitik rizosfer tanaman karet mampu menghambat pertumbuhan jamur patogen tanaman karet Rigidoporus lignosus, Corynespora, Colletotrichum secara in vitro
2. Isolat bakteri kitinolitik rizosfer tanaman karet mampu menghambat pertumbuhan Rigidoporus lignosus penyebab jamur akar putih pada bibit tanaman karet
1.5 Manfaat Penelitian
BAB 2
TINJAUAN PUSTAKA
2. 1 Tanaman Karet (Hevea brasiliensis)
Tanaman karet (Hevea brasiliensis) merupakan pohon yang tumbuh tinggi dan berbatang cukup besar. Tinggi pohon dewasa mencapai 15–25 m. Batang tanaman biasanya tumbuh lurus dan memiliki percabangan yang tinggi di atas. Di beberapa kebun karet ada kecenderungan arah tumbuh tanamannya agak miring ke arah utara. Batang tanaman ini mengandung getah yang dikenal dengan nama lateks (Nazarrudin & Paimin, 2006). Pertumbuhan tanaman karet sangat baik pada daerah beriklim tropis, seperti daratan Amerika, Brazil, Sri Lanka, Malyasia, Thailand termasuk Indonesia. Hampir daerah di Indonesia, termasuk daerah yang tergolong kurang subur, karet dapat tumbuh baik dan menghasilkan lateks.
Sesuai dengan habitat aslinya di Amerika Selatan, terutama di Brazil yang beriklim tropis, karet juga cocok ditanam di daerah–daerah tropis lainnya. Daerah tropis yang baik ditanami karet mencakup luasan antara 15° LU sampai 10° LS. Suhu harian yang diinginkan tanaman karet rata–rata 25°C–30°C. Apabila dalam jangka waktu panjang suhu harian rata–rata kurang dari 20°C, maka tanaman karet tidak cocok di tanam di daerah tersebut. Pada daerah yang suhunya terlalu tinggi, pertumbuhan tanaman karet juga tidak optimal (Setiawan, 2000). Tanaman karet dapat tumbuh dengan baik pada ketinggian antara 1-600 m dari permukaan laut. Curah hujan yang cukup tinggi antara 2000–2500 mm setahun. Akan lebih baik apabila curah hujan merata sepanjang tahun (Nazarrudin & Paimin, 2006).
5
Sumatera Utara, baik di perkebunan milik negara, swasta maupun yang diusahakan oleh rakyat. Pohon karet atau disebut juga rambung banyak diusahakan oleh masyarakat baik dengan sistem monokultur maupun secara agroforestry.
2.2 Bakteri Rizosfer
Konsep rizosfer pertama kali dikemukakan oleh Hilltner yang menjelakan bahwa riosfer adalah tanah yang berada disekitar perakaran tanaman dimana pertumbuhan mikroba dipengaruhi oleh aktivitas akar tanaman (Sivasakhti et al. 2013). Populasi mikroorganisme di rizosfer biasanya lebih banyak dan beragam pada rizosfer dibandingkan pada tanah bukan rizosfer. Kehadiran sejumlah populasi organisme baik yang bersifat antagonis, patogen, maupun saprofit dapat menambah keragaman spesies di dalam komunitas alami tanaman. Mikroorganisme yang dapat hidup pada daerah rizosfer sangat sesuai digunakan sebagai agen pengendalian hayati, mengingat bahwa rizosfer adalah daerah utama dimana akar tumbuhan terbuka terhadap patogen. Jika terdapat mikroorganisme antagonis pada daerah ini, patogen akan berhadapan selama menyebar dan menginfeksi akar (Hasanudin, 2003).
2.3 Penyakit Tanaman Karet A. Jamur Akar Putih (JAP)
Pada perkebunan tanaman karet Jamur Akar Putih merupakan penyakit umum dan yang paling merugikan pada tanaman karet.Penyakit ini adalah penyakit yang utama pada tanaman karet yang ditemukan pada sebagian besar area perkebunan didunia termasuk Indonesia, India, Malaysia, Sri Lanka, Thailand Afrika barat dan Afrika Tengah. Pada beberapa negara penyakit ini adalah penyebab kerugian terbesar pada tanaman karet (Kawchai & Soytong, 2010; Jayasurya & Thennakon, 2007).
6
Klotzsch, meskipun sekarang cendawan tersebut masih sering dikenal 5 dengan nama Fomes lignosus (Klotzsch) Bres.
Tanaman karet yang terserang JAP memiliki gejala awal berupa membusuknya akar tanaman yang diserang, sehingga tanaman mudah roboh. Selain itu tanaman yang terserang juga menampakkan gejala sekunder berupa bertambah banyaknya ranting dan berbuah lebih awal dari tanaman yang sehat, sehingga tanaman terlihat lebih rimbun. Daun tanaman yang terserang selanjutnya akan menguning dan gugur yang selanjutnya diikuti oleh matinya ranting tanaman (Nugroho, 2010).
Penyakit jamur akar putih dapat mengakibatkan kematian pada tanaman. Tanaman berumur dua sampai enam tahun sangat rentan terhadap penyakit ini. Pada umumnya tanaman umur tiga tahun akan mati dalam waktu enam bulan, dan tanaman enam tahun akan mati dalam waktu 12 bulan setelah terjadinya infeksi, hal ini tergantung kepada banyaknya bibit penyakit (patogen) yang terdapat dalam tanah. Penyakit akar putih sering menimbulkan kerusakan pada areal pertanaman yang terdapat banyak tunggul atau sisa akar kayu, bekas tanaman tua atau bekas hutan primer, atau tanah gembur dan berpasir (Situmorang & Budiman 2003).
Penyakit jamur akar putih menyebar di perkebunan karet daerah tropik terutama Indonesia. Penyakit ini dijumpai di dataran rendah, dataran tinggi, dan di daerah beriklim basah dan kering dengan keparahan penyakit yang berbeda. Daerah yang sering mengalami serangan skala berat adalah Riau, Sumatera Barat, dan Kalimantan Barat, serangan skala sedang adalah Nanggro Aceh Darussalam, Sumatera Utara, Jambi, sebagian Sumatera Selatan, sebagian Bengkulu, dan sebagian Lampung; dan serangan skala ringan adalah Jawa Barat, Jawa Tengah, Jawa Timur, Kalimantan Selatan, Kalimantan Tengah, dan Kalimantan Timur (Situmorang et al. 2006).
B. Serangan Infeksi Jamur Akar Putih
7
yang menyerang akar tanaman pada tanaman karet. R. lignosus tergolong ke dalam tipe epidemik penyakit monosiklik. Penyakit monosiklik adalah penyakit yang menyebabkan kehilangan produksi yang sangat tinggi, atau yang dapat mematikan tanaman hanya dengan satu siklus infeksi per siklus tanaman (Sinaga 2004).
Gambar 2.1 Serangan jamur akar putih pada tanaman karet: A. Akar tumbang akibat serangan JAP. B. Akar terinfeksi JAP (1. Hifa JAP).
Jamur akar putih menjadi penyakit yang sangat penting karena penyebabnya memiliki kisaran inang yang luas. Selain menyerang karet, jamur akar putih dapat menyerang teh, kopi, kakao, kelapa sawit, mangga, nangka, ubi kayu, jati, cengkeh, duwet, lamtoro, sengon, dadap, nibung, kapur barus, cemara, kayu besi, meranti, rasamala, walikukun, kesambi, randu alas, kumpas, akasia, Ficus spp., dan Agzelia sp. Jamur akar putih juga dapat menyerang pupuk hijau, seperti Tephrosia spp. dan Crotalaria spp. Tanaman penutup tanah kacangan yang menjalar (legume creeping cover, LCC) juga rentan terhadap jamur akar ini (Semangun, 2008). Serangan patogen R. lignosus menyebabkan akar menjadi busuk dan umumnya ditumbuhi rizomorf cendawan. Gejala tampak pada daun; daun-daun yang semula tampak hijau segar berubah menjadi layu, berwarna kusam, dan akhirnya kering (Pawirosoemardjo, 2004).
C.Penyakit Pada Daun Tanaman Karet
Daun adalah organ yang sangat penting pada tanaman karena daun merupakan tempat berlangsungya proses fotosintesis. Serangan berbagai jenis
1
8
patogen dapat menyebabkan penyakit dan mengganggu proses fisioogis tanaman sehingga menurunkan hasil fotosintesis serta menggangu proses pertumbuhan dan perkemangan tanaman. Pada tanaman karet terdapat beberapa jenis jamur patogen yang dapat menginfeksi daun dan menurunkan prodksi karet yaitu Corynespora dan Colletotrichum. Jamur patogen tanaman Corynespora menyebabkan bercak daun dan membusuknya batang, buah, biji dan bunga pada berbagai tanaman inang (Fernando et al., 2010). Colletotrichum adalah penyebab gugurnya daun pada tanaman karet, tidak hanya pada daun tanaman karet yang sudah tua jamur tersebut juga menyerang bibit tanaman karet. Selain tanaman karet Colletotrichum juga menyerang daun tanaman lainnya seperti Mangifera indica (Jayasinghe & Fernando, 2009) Theobroma cacao (Suryanto et al, 2014).
Gambar 2.2 Serangan jamur patogen pada daun tanaman karet: A. Daun terserang Corynespora sp., B. Daun terserang Colletotrichum sp., (1. Simtom Corynespora sp., 2. Simtom Colletotrichum sp.,)
2.4 Potensi Bakteri Kitinolitik Rizofer Sebagai Agen Pengendali Hayati Pengendalian jamur patogen tanaman dapat dilakukan dengan menggunakan agen pengendali hayati. Agen pengendali hayati mikroba lebih aman digunakan karena sedikit kemungkinan merugikan lingkungan dan mempunyai prospek yang baik, sehingga menjadi pilihan alternatif dari penggunaan pestisida (Kobayashi et al. 2002). Kesempatan untuk menemukan agen biokontrol untuk jamur patogen sangat besar. Mengingat bahwa Indonesia merupakan salah satu negara yang memiliki biodiversitas sangat besar, sehingga menyediakan banyak sumberdaya
A B
1
9
alam hayati yang tak ternilai harganya, dari bakteri hingga jamur, tumbuhan, dan hewan. Pencarian isolat dan jenis organisme yang potensial untuk digunakan dalam bidang industri, pertanian, dan kesehatan merupakan pekerjaan yang harus terus dilakukan (Suryanto, 2009).
Di dalam tanah secara alami terdapat mikroorganisme yang berpotensi dalam menekan perkembangan patogen. Sebagian besar mikroorganisme antagonis tersebut hidup sebagai saprofit. Keberadaan mikroorganisme merupakan potensi besar untuk digunakan sebagai agen pengendali hayati. Mikroorganisme kitinolitik adalah mikroorganisme yang dapat mendegradasi kitin dengan menggunakan enzim kitinase. Mikroorganisme ini dapat diperoleh dari berbagai sumber seperti rizosfer, filosfer, tanah atau lingkungan air seperti laut, danau atau limbah udang dan sebagainya. Selain lingkungan mesofil, mikroorganisme kitinolitik juga dapat diisolasi dari lingkungan termofilik seperti sumber air panas, daerah geotermal dan lain-lain (Herdyastuti et al. 2009).
Bakteri kitinolitik dapat digunakan dalam pengendalian hama dan penyakit tanaman. Mikroba kitinolitik dapat ditapis dengan menggunakan medium mengandung kitin. Mikroba diisolasi dari contoh dengan menggunakan medium garam koloidal kitin disesuaikan dengan kondisi lingkungan darimana isolat berasal. Pembentukan halo di sekitar koloni sebagai hasil degradasi kitin (Suryanto & Munir, 2006). Bakteri kitinolitik adalah bakteri penghasil enzim kitinase yang berperan dalam mendegradasi kitin menjadi N-asetilglokosamin. Organisme pendegradasi kitin umumnya berasal dari kelompok mikroorganisme diantaranya adalah dari kelompok bakteri (Suzuki, 1999).
10
BAB 3
METODOLOGI PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan November 2014 sampai dengan Juli 2015, di Laboratorium Mikrobiologi dan Laboratorium Kultur Jaringan Tumbuhan, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara.
3.2 Isolasi Jamur Patogen Tanaman Karet
Akar tanaman karet yang terserang R. lignosus dan daun yang nenunjukkan gejala serangan jamur Corynespora dan Colletotrichum diambil dari lapangan, dibilas dengan akuades steril dan disterilkan bagian permukaanya dengan alkohol 70 %, kemudian dipotong dengan ukuran 1 x 1 cm. Masing-masing sumber isolat diletakkan pada media PDA steril. Kultur diinkubasi pada suhu 25 oC selama 48 jam. Koloni jamur yang terbentuk, diamati dan dibuat biakan murninya.
3.4 Uji antagonis Bakteri Rizosfer Terhadap Jamur Patogen Tanaman Karet R. lignosus, Corynespora, Collettotrichum Secara In vitro
12
antagonis bakteri ditunjukkan dengan adanya penghambatan pertumbuhan jamur yang ditandai dengan terbentuknya zona hambat. Pengamatan pengukuran zona hambat dimulai dari hari kedua sampai hari kedelapan. Alur kerja uji antagonis bakteri kitinolitik dengan jamur patogen (Lampiran 2 hal 35) (Suryanto, 2006).
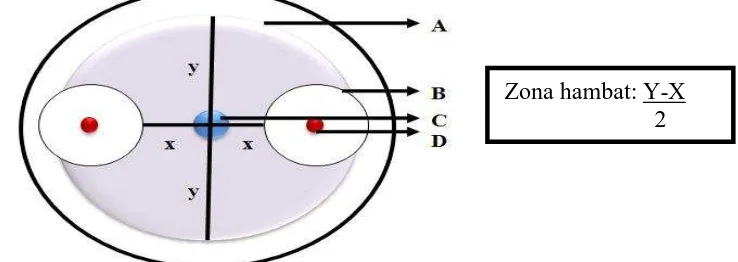
Gambar 3.3 Uji antagonis bakteri kitinolitik terhadap jamur patogen: A. Koloni jamur; B. Zona hambat bakteri kitinolitik terhadap koloni jamur; C. Titik tengah jamur diletakkan; D. Koloni bakteri kitinolitik; x. Diameter koloni jamur yang terhambat pertumbuhannya; y. Diameter koloni jamur normal.
3.5 Pengamatan Struktur Hifa Abnormal Jamur Patogen
Pengamatan dilakukan dengan dua cara yaitu secara makroskopis dan mikroskopis. Pengamatan secara makroskopis dilakukan dengan cara mengamati dan mengukur zona hambat bakteri kitinolitik rizosfer pada koloni fungi patogen (Suryanto et al., 2012). Pengamatan secara mikroskopis dilakukan dengan cara memotongujung hifa jamur patogenpada media MGMK berbentuk block square, kemudian diletakkan pada gelas objek dan diamati di bawah mikroskop, (alur kerja pengamatan hifa abnormal Lampiran 3 hal 35) Abnormalitas pertumbuhan hifa fungi patogen diamati berupa pembengkokan ujung hifa, hifa pecah, hifa berbelah, hifa bercabang, hifa lisis dan hifa tumbuh kerdil (Lorito et al.1992).
3.6 Uji Potensi Bakteri Kitinolitik Rizosfer Terhadap Serangan JAP Pada Bibit Tanaman Karet Secara In vivo
Isolat bakteri FS 4 dan FS 7 disubkultur ke media MGMK dan diinkubasi pada suhu 25-30 °C selama 72 jam. Biakan bakteri diambil dengan mengunakan jarum ose dan diinokulasikan ke dalam tabung reaksi berisi 10 ml akuades steril. Suspensi dihomogenkan dengan vortex dan diukur kerapatan sel sampai mencapai
13
≈108 CFU/ml. Bibit tanaman karet yang digunakan dalam penelitian ini diperoleh dari balai penelitian karet Sei putih dengan umur 3-4 bulan (Lampiran 4 halaman 36). Pengujian secara in vivo pengendalian serangan JAPpada bibit tanaman karet dilakukan dengan dua perlakuan. Perlakuan I dengan pemberian bakteri kitinolitik rizosfer satu hari setelah pemberian inokulum jamur patogen (preventif) sedangkan perlakuan II dengan pemberian bakteri kitinolitik 30 hari setelah pemberian inokulum jamur patogen (kuratif). Kontrol positif adalah tanaman karet yang diberikan R. lignosus sedangkan kontrol negatif tidak diberikan R. lignosus maupun bakteri kitonolitik. Inokulasi jamur patogen dilakukan dengan menyediakan potongan akar tanaman karet dengan panjang 5-10 cm yang sudah terserang JAP dan sudah dipenuhi hifa R. lignosus dan diletakkan pada media tanam dengan jarak kira-kira 5 cm dari akar bibit tanaman karet. Pemberian bakteri kitinolitik rizosfer dilakukan dengan menyiapkan 10 ml suspensi bakteri kitinolitik rizosfer dengan kerapatan ≈108 CFU/ml disiram pada permuakaan tanah hingga merata. Pengamatan dilakukan setiap 7 hari sekali selama 60 hari dimulai dari hari ketujuh setelah inokulasi jamur patogen (Rahmiati 2013). Perlakuan dibuat seperti dalam Tabel 1.1
Tabel 1.1 Uji penghambatan dan pengendalian R. lignosus secara in vivo Rigidoporuslignosus Bakteri Kitinolitik Rizosfer
Kontrol Negatif - -
Kontrol positif + -
Perlakuan I + +
Perlakuan II + +
Keterangan:
+ : Pemberian R. lignosus atau bakteri kitinolitik rizosfer. - : Tanpa pemberian R. lignosus atau bakteri kitinolitik rizosfer.
3.7 Pengamatan Intensitas Serangan dan Luas Serangan R. lignosus pada Bibit Tanaman Karet
14
karet, intensitas serangan dapat dihitung dengan menggunakan rumus Boggie & Person (1988) sebagai berikut.
I= ⅀ (n x v) x 100% N x Z
Keterangan:
I : intensitas serangan
n : jumlah tanaman dari berbagai kategori serangan (skala 1, 2, 3, 4) N : jumlah akar tanman yang diamati
Z : nilai skor tertinggi
V : nilai skoring serangan penyakit tiap individu tanaman Nilai kategori serangan sebagai berikut:
0 : tanaman sehat, akar tanaman bebas patogen
1 : permuakaan akar tanaman telah ditumbuhi hifa jamur
2 : kulit akar tanaman telah terinfeksi, dan terjadi perubahan warna pada kulit akar
3 : bagian kulit dan akar tanaman telah terinfeksi oleh patogen
4 : tanaman hampir mati karena jaringan akar tanaman telah membusuk (Pawirosoemardjo dan Purwantara, 1985)
Luas serangan jamur ditentukan dengan rumus:
Keterangan: A: Luas serangan
n: jumlah tanaman yang terserang spesies patogen N: jumlah seluruh tanaman yang diamati.
3.8 Reisolasi Jamur Patogen R. lignosus dan Bakteri Kitinolitik Rizosfer Reisolasi jamur patogen penyebab jamur akar putih pada tanaman karet dan bakteri kitinolitik dari media tanam bertujuan untuk memastikan bahwa penyakit tersebut disebabkan oleh R. lignosus serta melihat isolat bakteri kitinolitik, yang diberikan dan yang ada di media tanam. Reisolasi jamur dan bakteri ini dilakukan
15
dengan metode Radu & Kqueen (2002) dengan sedikit modifikasi. Bagian akar tanaman yang memiliki gejala terinfeksi jamur R. lignosus dipotong dengan panjang ± 1 cm dan dicuci dengan air mengalir selama 20 menit. Selanjutnya permukaan akar tanaman disterilisasi dengan merendam secara berurutan dalam etanol 75% selama 2 menit, sodium hypoklorit 5,3% selama 5 menit dan etanol 75% slama 30 detik, selanjutnya dibilas dengan akuades steril sebayak 2 kali, lalu dikeringanginkan kemudian diisolasi di media PDA. Kultur diinkubasi pada suhu ruang selama ± 3 hari. Koloni jamur yang tumbuh selanjutnya dimurnikan, dan diamati struktur hifanya dengan menggunakan mikroskop.
BAB 4
HASIL DAN PEMBAHASAN
4.1 Isolasi Jamur Patogen Pada Tanaman Karet
Isolasi jamur patogen pada tanaman karet diperoleh 3 jenis jamur yang menyerang tanaman karet yaitu Rigidoporus lignosus, Corynespora sp., dan Colletotrichum sp. Jamur R. lignosus diisolasi dari akar tanaman karet yang terinfeksi JAP sementara Corynespora, dan Colletotrichum diisolasi dari daun yang terinfeksi yang menunjukkan simtom penyakit. Jamur patogen dimurnikan pada media Potato Dextrosa Agar seperti yang dapat dilihat pada Gambar 4.1. Warna koloni jamur R. lignosus adalah putih, hifa tumbuh secara horizontal dan warna koloni jamur Corynespora adalah hijau kecoklatan sedangkan Colletotrichum putih kemerahan dan hifa tumbuh secara horizontal.
Gambar 4.1 Hasil isolasi jamur patogen tanaman karet A. Sumber isolat (→1. Hifa R. lignosus 2. Simtom Corynespoora 3. Simtom Colletotrichum dan B. biakan murni jamur patogen (1. Isolat R. lignosus, 2. Corynespora, 3. Colletotrichum).
[image:30.595.115.510.364.601.2]17
dapat menyebabkan penyakit pada bibit tanaman karet. Jamur ini juga dapat menyerang daun karet yang masih muda maupun yang sudah tua (Situmorang & Budiman, 1984). Keberhasilan infeksi patogen tersebut ditunjukkan oleh gejala nekrosis yang spesifik pada tulang-tulang daun yang mengakibatkan pengguguran daun sehingga tanaman meranggas (Suwarto, 2003).
Colletotrichum juga merupakan salah satu jamur penyebab penyakit gugur daun pada tanaman karet. Peyakit ini tidak hanya menyerang tanaman yang sudah tua tetapi penyakit ini juga banyak ditemukan pada tanaman karet yang masih muda (Rao, 1965; Webster dan Bauklkwill, 1989). Selain tanaman karet Colletotrichum juga dapat menyerang tanaman lainnya seperti mangga (Jayasinghe dan Fernando, 2009) tanaman cabai (Firdausyi, 2005), tanaman kakao (Suryanto et al. 2014).
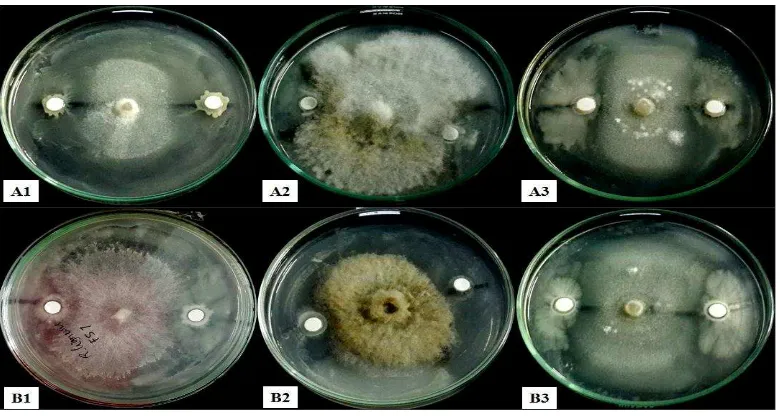
4.2 Uji Antagonis Bakteri Kitinolitk Rizosfer Terhadap Jamur Patogen Bakteri kitinolitik rizosfer menghambat pertumbuhan beberapa jamur patogen R. lignosus, Corynespora Colletotrichum yang dilakukan secara in vitro pada media MGMK (Gambar 4.2). Pengukuran zona hambat bakteri kitinolitik rizosfer terhadap jamur patogen dilakukan pada hari ke-4, ke-6 dan ke-8.
[image:31.595.116.506.455.663.2]18
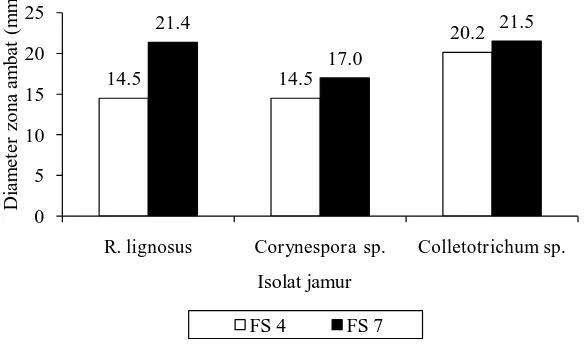
[image:32.595.154.447.197.370.2]Kemampuan bakteri kitinolitik rizosfer dalam menghambat pertumbuhan jamur patogen ditandai dengan adanya zona hambat pada koloni jamur patogen, berupa cerukan penipisan elevasi pada daerah pertemuan koloni bakteri dengan jamur. Diameter zona hambat pada masing-masing isolat bakteri kitinolitik berbeda-beda pada beberapa jamur patogen yang disajikan pada Gambar 4.3.
Gambar 4.3 Hasil uji antagonis bakteri kitinolitik rizosfer terhadap jamur patogen
Isolat bakteri FS 7 memiliki kemampuan antagonis yang lebih tinggi terhadap masing-masing jamur patogen. Pada hari ke-8 bakteri ini mampu menghasilkan zona hambat sebesar 21,35 mm, 17 mm dan 21,5 mm terhadap R. lignosus, Corynespora, dan Colletotrichum, sedangkan pada isolat bakteri FS 4 menghasilkan zona hambat sebesar 14,5 mm, 14,5 mm dan 20,15 mm terhadap jamur patogen. Besarnya diameter zona hambat berbeda pada masing-masing isolat. Peningkatan besarnya zona hambat terjadi di tiap hari pengamatan. Perbedaan ini disebabkan karena adanya perbedaan enzim kitinase yang dihasilkan pada masing-masing isolat (Kobayashi et al. 2002; Metclafe et al. 2002). Kemampuan bakteri kitinolitik dalam menghambat jamur patogen dapat disebabkan oleh adanya senyawa anti fungal dan enzim hidrolitik seperti kitinase dan glukanase yang dihasilkan oleh bakteri kitinolitik yang dapat merusak dinding sel jamur patogen (Ferniah et al. 2011). Menurut Kim et al. (2008) bakteri kitinolitik mulai menghasilkan enzim kitinase pada hari ke-3. Zona hambat akan terus meningkat selama masa inkubasi sampai pada hari ke-7 atau lebih. Hal ini mengindikasikan bahwa pada masa inkubasi enzim kitinase masih dihasilkan dan berdufusi ke dalam media dan mendegradasi hifa jamur tersebut. Beberapa hal
14.5 14.5 20.2 21.4 17.0 21.5 0 5 10 15 20 25
R. lignosus Corynespora sp. Colletotrichum sp.
D ia m et er z o n a am b at ( m m ) Isolat jamur
19
yang mempengaruhi variasi zona hambat dapat disebabkan oleh kespesifikan spesies bakteri kitinolitik, perbedaan aktivitas kitinase, komposisi kitin pada miselia fungi, laju pertumbuhan bakteri dan fungi dan senyawa anti fungal lainnya
(Annand dan Reddy 2009; Benhamou et al. 1990; Gohel et al. 2006).
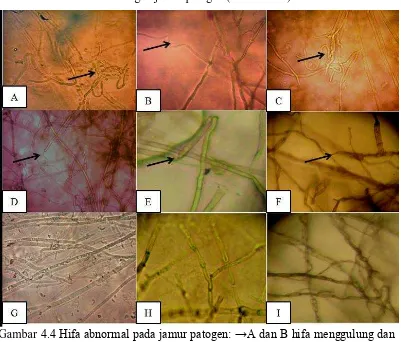
4.3 Pengamtan Hifa Abnormal Jamur Patogen
[image:33.595.115.516.275.617.2]Pengamatan hifa abnormal dilakukan pada hari ke delapan. Adanya abnormalitas hifa jamur patogen disebabkan oleh adanya mekanisme antagonis antara bakteri kitinolitik dengan jamur patogen (Gambar 4.4).
Gambar 4.4 Hifa abnormal pada jamur patogen: →A dan B hifa menggulung dan hifa bengkok pada R. lignosus karena bakteri FS 7, C dan D, hifa bengkok dan hifa lisis pada R. lignosus karena bakteri FS 4, E, hifa bengkok Colletotrichum karena bakteri FS 4. F, hifa lisis pada Corynespora karena bakteri FS 7. G, H dan I hifa normal R. lignosus, Corynespora dan Colletotrichum.
20
Rabeeth et al. 2010; Gohel et al. 2006). Pertumbuhan miselium jamur patogen terhambat dapat disebabkan karena adanya penipisan dan kerusakan pada dinding hifa jamur patogen
4.4 Uji Potensi Bakteri Kitinolitik Rizosfer Terhadap Serangan JAP Pada Bibit Tanaman Karet Secara In vivo
Pengujian kemampuan bakteri kitinolitik rizosfer dalam menghambat pertumbuhan jamur patogen secara in vivo hanya dilakukan pada jamur R. liginosus penyebab jamur akar putih. R. lignosus merupakan jamur yang paling berbahaya dan merugikan dibandingkan Corynespora dan Colletotrichum. Oleh sebab itu aplikasi bakteri kitinolitik rizosfer dalam mengendalikan serangan penyakit pada tanaman karet hanya dilakukan pada serangan penyakit JAP.
Dalam menginfeksi akar bibit tanaman karet digunakan akar tanaman yang sudah terinfeksi oleh R. lignosus sebagai sumber inokulum. Menurut Semangun (2008) basidiospora pada tubuh buah tidak dapat menimbulkan infeksi pada pohon karet yang sehat. Oleh karena itu penelitian ini menggunakan akar tanaman karet sebagai sumber inokulum dalam menginfeksi tanaman sehat yang dapat dilihat pada Gambar 4.5.
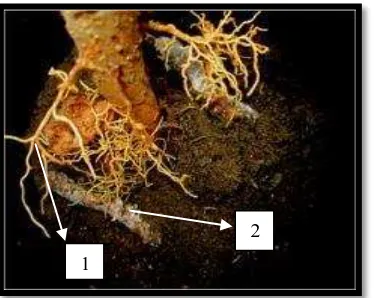
Gambar 4.5 Hasil infeksi dari R. lignosus pada akar bibit karet: 1. Akar, 2. Miselium R. lignosus
4.5 Intensitas Dan Luas Serangan JAP Pada Bibit Tanaman Karet
Hasil pengamatan intensitas serangan pada masing-masing perlakuan menunjukkan bahwa bakteri kitinolitik rizosfer mampu menurunkan serangan R. lignosus pada bibit tanaman karet (perhitungan intensitas serangan Lampiran 5
1
[image:34.595.219.406.457.606.2]21
halaman 37). Intensitas serangan dan pengurangan intensitas serangan pada masing-masing perlakuan diilihat pada Gambar 4.6
Gambar 4.6 Perbandingan nilai intensitas serangan R. lignosus pada masing-masing perlakuan
Berdasarkan Gambar 4.6 isolat bakteri FS 4 lebih efektif dalam menurunkan serangan R. lignosus pada bibit tanaman karet. Intensitas serangan pada bakteri kitinolitik FS 4 pada perlakuan I (pemberian bakteri kitinolitik satu hari setelah inokulasi R. lignosus) menunjukkan tidak ada serangan penyakit (0%) sampai pada pengamatan hari ke-60 sedangkan perlakuan II (pemberian bakteri kitinolitik setelah 30 hari inokulasi jamur patogen R. lignosus)intensitas serangan awal 40% yang diamati pada hari ke-30 dan serangan akhir 15% yang diamati pada hari ke-60. Intensitas serangan pada FS 7 perlakuan I pada pengamatan hari ke-60 sebesar 5% sedangkan perlakuan II intensitas serangan awal yang diamati pada hari ke-30 sebsar 30% dan intensitas serangan akhir 20% pada pengamatan hari ke-60. Isolat FS 4 ialah isolat bakteri kitinolitik rizosfer yang menurunkan intensitas serangan lebih tinggi yaitu sebesar 83,3% sedangkan FS 7 hanya mampu menurunkan serangan sebesar 33,3%. Bakteri FS 4 lebih mampu menurunkan serangan JAP secara in vivo dapat disebabkan oleh beberapa faktor
0 0 0 5
40 15 30 20 65 0 83.33 33.33 0 10 20 30 40 50 60 70 80 90 100 Hari ke-30 hari ke-60 Hari ke-30 Hari ke-60 Kontrol (+) Kontrol (-)
FS 4 FS 7
In te n si ta s se ra n ga n (% ) Perlakuan
[image:35.595.116.505.141.413.2]22
diantaranya faktor lingkungan, pertumbuhan sel bakteri serta diasumsikan bahwa bakteri FS 4 pada uji in vivo lebih banyak menghasilkan senyawa yang bukan kitinase tetapi glukanase yang berperan penting dalam melisiskan dinding sel hifa jamur patogen tersebut. Dinding sel jamur juga tidak hanya terdiri dari kitin saja tetapi juga terdiri dari senyawa yang lain seperti α-1,3 gukan yang berikatan dengan kitin dalam struktur amorf oleh karena itu kitinase dan α-1,3 glukanase berperan penting dalam melisiskan dinding sel (Gohel et al. 2006).
Pengamatan intensitas serangan akhir pada hari ke-60 menunjukkan bahwa serangan penyakit R. lignosus pada bibit tanaman karet di tiap perlakuan masih dapat diturunkan dengan pemberian bakteri kitinolitik rizosfer pada media tanam. Hal ini menujukkan bahwa bakteri kitinolitik rizosfer dapat menghasilkan enzim kitinase yang merusak dinding sel jamur patogen sehingga pertumbuhan R. lignosus dapat terhambat. Jika dibandingkan dengan kontrol positif nilai intensitas serangan akhir ialah sebesar 65% dimana hifa jamur R. lignosus dapat tumbuh dan berkembang pada akar tanaman karet sementara pada kontrol negatif tidak ditemukan adanya hifa R. lignosus pada akar tanaman karet.
[image:36.595.156.464.502.682.2]Pada uji lapangan bahwa bibit tanaman karet terserang penyakit dengan persentase luas serangan sebesar 80-100 % kecuali pada kontrol negatif. persentase luas serangan R. lignosus pada bibit tanaman karet seperti pada Gambar 4. 7
Gambar 4. 7 Luas serangan R. lignosus pada bibit tanaman karet 0 20 80 80 100 0 0 20 40 60 80 100 120
FS 4 FS 7 kontrol (+) kontrol (-)
L ua s se ra n ga n (% ) Perlakuan
23
Pengamatan luas serangan R. lignosus dilakukan untuk melihat kemampuan R. lignosus dalam menginfeksi akar bibit tanaman karet. Perlakuan II diamati pada hari ke-30 sedangkan pada perlakuan I, kontrol negatif dan kontrol positif diamati pada hari ke-60. Luas serangan tertinggi terdapat pada kontrol positif sebesar 100%. Hal ini disebabkan karena pada kontrol positif tidak diberikan isolat bakteri kitinolitik yang dapat mengendalikan serangan JAP, sehingga tanaman karet dengan mudah terinfeksi R. lignosus.
4.6 Pengaruh Infeksi JAP Terhadap Pertamahan Tinggi Tanaman dan Jumlah Daun
[image:37.595.126.505.374.668.2]Serangan penyakit JAP pada akar bibit tanaman karet mempengaruhi pertumbuhan tanaman. Infeksi R. lignosus pada akar tanaman karet dapat mempengaruhi rata-rata pertambahan tinggi batang tanaman (Gambar 10) serta pertambahan rata-rata jumlah daun.
Gambar 4.8 Pertambahan rata-rata tiggi batang setelah 60 hari masa perlakuan.
Pertambahan tinggi batang tanaman tertinggi dicapai pada pemberian isolat FS 7 yaitu sebesar 6.8 cm pada perlakuan I dan 4 cm pada perlakuan II,
5 6.8 2.8 4 0.58 1.2 0 1 2 3 4 5 6 7 8
FS 4 FS 7 kontrol (+) kontrol (-)
R at a-ra ta pe rt am b ah an t in ggi t an am an ( cm ) Perlakuan
24
sedangkan pada pemberian isolat FS 4 pada perlakuan I sebesar 5 cm dan perlakuan II sebesar 2.8 cm. Hal ini menunjukkan bahwa bakteri FS 7 memiliki kemampun yang lebih tinggi dalam menghasilkan senyawa yang dapat mempercepat pertumbuhan tanaman dari pada menghasilkan enzim kitinolitik ataupun senyawa antifungal lainnya. Jika dibandingkan pada kontrol positif rata-rata pertambahan tinggi tanaman terkecil yaitu sebesar 0,58 cm dan kontrol negatif sebesar 1,2 cm. Hal ini mengindikasikan R. lignosus mampu mengganggu aktivitas pertumbuhan tanaman karet. Infeksi patogen di akar tanaman akan mengakibatkan terhambatnya fungsi jaringan pembuluh yaitu xilem sehingga menggangu jalur masuknya unsur hara dan air menuju ke bagian daun.
[image:38.595.159.478.462.722.2]Adanya variasi tinggi tanaman pada masing-masing perlakuan juga disebakan oleh peran bakteri kitinolitik pada media tanaman. Tanaman menyeleksi bakteri yang dapat memberikan kontribusi untuk pertumbuhannya dengan mengeluarkan senyawa eksudat. Kolonisasi bakteri rizosfer pada akar tanaman dapat menghasilkan plant growth promoting rhizobacteria (PGPR) seperti pada bakteri dari genus Bacillus, pseudomonas selain memiliki aktivitas antagonis terhadapat pitopatogen juga dapat menghasilkan substansi dalam merangsang pertumbuhan tanaman (Sivasakthi et al. 2014).
Gambar 4. 9 Pertambahan rata-rata jumlah daun setelah 60 hari masa perlakuan. 3.6 5.8 2.8 2.2 0 1.6 0 1 2 3 4 5 6 7
FS 4 FS 7 kontrol (+) kontrol (-)
R at a-ra ta pe rt am b ah an jum la h da un Perlakuan
25
Perbedaan pertambahan rata-rata jumlah daun bibit tanaman karet pada msing-masing perlakuan. Pada pemberian isolat bakteri kitinolitik rizosfer pada FS 7 pertambahan rata-rata jumlah daun tertnggi pada perlakuan I sebesar 5,8 dan pada perlakuan II 2,2, sedangkan pada pemberian isolat bakteri kitinolitik rizosfer FS 4 pada perlakuan I sebesar 3,6 dan pada perlakuan II 2,8. Jika dibandingkan pada kontrol positif tidak mengalami pertambahan jumlah daun, dan pada kontrol negatif sebesar 1,6. Pertambahan jumlah daun kontrol positif, kontrol negatif, serta perlakuan I dan II menunjukkan adanya pertambahan jumlah daun yang bervariasi. Perbedaan pertambahan jumlah daun yang bervariasi pada masing-masing perlakuan disebabkan oleh aktivitas jamur patogen yang mengganggu pertumbuhan tanaman. Dan adanya peran bakteri kitinlitik dalam menekan pertumbuhan JAP pada tanaman karet, selain itu bakteri kitinolitik juga mampu menghasilkan suatu senyawa seperti hormon yang dapat membantu pertumbuhan tanaman karet.
Beberapa bakteri antagonis dapat berkontribusi dalam pertumbuhan tanaman. Menurut Suryanto et al. (2012) beberapa bakteri kitinolitik seperti Enterobacter sp. BK 15 yang diaplikasikan pada bibit cabai yang terinfeksi Fussarium menghasilkan tinggi dan berat kering terbesar pada perlakuan. Serta genus Bacillus kelompok rhizobakteria antagonis juga menunjukkan peningkatan pertumbuhan dan hasil panen pada tanaman tomat (Hernandes-Suarez et al. 2011).
4.7 Risolasi JAP Dari Akar Tanaman Karet dan Bakteri Kitinolitik Dari Media Tanam
26
Gambar 4. 10 Hasil reisolasi R. lignosus dari akar bibit tanaman karet: (1. Isolat R. lignosus 2. Biakan murni R. lignosus).
Reisolasi R. lignosus pada akar yang terinfeksi JAP menunjukkan persamaan ciri dengan isoat R. lignosus sebelumnya. Warna koloni jamur putih dan pertumbuhan hifa secara horizontal. Bagian akar tanaman yang terinfeksi JAP menunjukkan miselium R. lignosus melekat kuat pada permukaan akar tanaman dan akan mengalami pembusukan, tekstur rapuh dan mudah patah. Mekanisme infeksi penyakit JAP melalui 3 tahap, yaitu penetrasi, kolonisasi, dan degradasi. Jamur R.lignosus menginfeksi tanaman dengan cara penetrasi pada bagian perakaran tanaman inang di dalam tanah, hifa berkembang dan mengeluarkan enzim ekstraseluler (Basuki dan Sinulingga,1996).
1 2
27
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesmpulan
Dari penelitian yang dilakukan dapat disimpulkan bahwa:
1. Isolat bakteri kitinolitik rizosfer FS 4 dan FS 7 mampu menghambat jamur patogen R. lignosus, Corynespora, Colletotrichum secara in vitro. Isolat bakteri FS 7 memiliki zona hambat yang lebih tinggi yaitu sebesar 21. 35 mm, 17 mm dan 21. 5 mm sedangkan FS 4 sebesar 14.5 mm, 14. 5 mm dan 20.5 mm pada masing- masing isolat.
2. Isolat bakteri kitinolitik mampu menurunkan serangan JAP pada bibit tanaman karet. Isolat bakteri bakteri FS 4 merupakan isolat bakteri kitinolitik rizosfer dengan penurunan intensitas serangan yang lebih tinggi yaitu sebesar 83.33 % sedangkan FS 7 sebesar 33.33 %. Perlakuan I atau preventif lebih efektif dalam mengendalikan pertumbuhan R. lignosus dibandingkan perlakuan II atau kuratif.
5.2 Saran
28
DAFTAR PUSTAKA
Alabouvette C, Olivian C, Steinberg C (2006). Biological control of Plant diseases: The Europan Situatuin. Review. Europan Journal Plant Pathology. 114:329-341.DOI 10.1007/s10658-005-0233-0.
Anand S, Reddy J. 2009. Biocontrol potential of Trichoderma sp. Against plant
pathogens. International Journal Agricultural Science. 1(2): 30-39.
Anitha, A. Rabeeth, M. 2010. Degradation of Fungal Cell Walls of Phytopathogenic Fungi by Lytic Enzyme of Streptomyces griseus. African Journal of Plant Science. 4(3): 61-66.
Basuki, & Sinulingga, W. (1996). Penyakit akar putih pada tanaman karet: Gejala penyakit, pengendalian hayati dan saran-saran pengendalian penyakit. Warta Pusat Penelitian Karet, 15(2), 87-95.
Benhamou N, Joosten MHAJ, De Wit PJGM. 1990. Subcellular localization of chitinase and of its potential substrate in tomato root tissues infected by Fusarium oxysporum f. sp. radicis-lycopersici. Plant Physiology 92:1108-1120.
Boggie, L. M., & Person, H. (1988). Plant roots and their environment. Development in agricultural and manage forest. Uppsala Sweden.
Evueh, G. A dan Ogbebor, N. O, 2008. Use of Phylloplane Fungi as Biocontrol Agent Against Colletotrichum Leaf Disease of Rubber (Hevea brasiliensis Muell. Arg.). African Journal of Biotechnology 7(15): 2569-2572.
Farid A. M, Lee S. S, Maziah Z, Rosli H, and Norwati M. 2006. Root Rot in Tree species other than Acacia. Di dalam: Potter et al., editor. Heart rot and root rot in tropical Acacia plantations. Proceedings of a Workshop Held; Yogyakarta, 7-9 February 2006. Canberra: ACIAR Proceedings. 124: hlm 60-66.
Farid, A. H, Lee, S. S, Maziah , Z & Pantanayah M. 2009. Phatogenicity of Rigidoporus microporus and Phellinus noxius Against Four Major Plantation Tree Species in Pensular Malaysia. Journal of Tropical Forest Science 21 (4): 289-298.
Fernando, T. H. P. S. Jayasinghe, C. K, Wijesundera, R. L. C. Silva, W. P. K, Nishantha, E. A. D. N, 2010. Evaluation of Screening Methods Against Corynespora Leaf Fall disease of Rubber (Hevea brasiliensis). Journal of Plant Diseases and Protection. 117(1): 24-29.
29
Firdayasuri, 2005. Peningkatan Peran Bakteri Bacillus Subtilis Untuk Mengendalikan Penyakit Antraknosa (Colletotrichum Capsici) Pada Cabai Merah Dengan Penambahan Tepung. Skripsi: Universitas Jember.
Gohel, V. Singh, A,Vimal, M. Ashwini, P. Chhatpar, H. S. 2006. Bioprospecting and Antifungal Potential of Chitinolytic Microorganisms. African Journal Biotechnology. 5(2): 54-72.
Haggag, W.M. And Mohamed, H.A.A. (2007). Biotechnological Aspects Of Microorganisms Used In Plant Biological Control. American-Eurasian Journal of Sustainable Agriculture. 1(1): 7-12.
Hasanuddin, G. E. 2003. Peningkatan Peranan Mikroorganisme dalam Sistem Pengendalian Penyakit Tumbuhan Secara Terpadu. Medan, Indonesia: USU Digital Library.
Herdyastuti, N. Raharjo T. J. Mudasir and Matsjeh, S. 2009. Kitinase dan Mikroorganisme kitinolitik: Isolasi, Karakterisasi dan manfaatnya. Indonesia Journal of Chemistry. 9(1): 37-47.
Hernandez-Suarez, M., F.D. Hernandez-Castillo, G. Gallegos-Morales, R.H. Lira-Saldivar and R. Rodriguez-Herrera et al., 2011. Biocontrol of Soil Fungi in Tomato with Microencapsulates Containing Bacillus subtilis. American. Journal Agricultural Biological. Sciences 6: 189195.DOI:10.3844/ajabssp. 2011.189.195.
Holliday, P. 1996. Pioneer of Root Disease Control in Hevea rubber. Mycologist 10(2):66-68.
Ilahang, Budi, Wibawa G, Joshi L. 2006. Status Dan Pengendalian Penyakit Jamur Akar Putih Pada Sistem Wanatani Berbasis Karet Unggul Di Kalimantan Barat. Lokakarya Nasional Jamur Akar Putih; Pontianak, 30 November 2006. Hlm: 1-11.
Jayasinghe, C. K dan Fernando, T. H. P. S, 2009. First Report of Colletotrichum acutatum on Mangifera indica in Sri Lanka. Ceylon Journal of Science. 38(1):31-34.
Jayasurya, K. E. Thennakon, B. I. 2007. Biological Control of Rigidoporus microporus The Cause of White Root Disease in Rubber. Ceylon Journal of Science. 36(1): 9-16.
30
Kaewchai & Soytong, 2010 Application Of Biofungicides Against Rigidoporus Microporus Causing White Root Disease Of Rubber Trees. Journal Of Agricultular Technology 6(2). 349-363.
Kamil, Z. Rizk, M. Saleh and M. Moustafa, S. 2007. Isolation and Identification of Rhizospher Soil Chitinolytic Bacteria and Their Potential in Antifungal Biocontrol. Global Journal of Molecular Science. 2(2): 57-66.
Kim, Y.C. Jung, H. Kim, K.Y. Park, S.K (2008). An effective Biocontrol Bioformulation Against Phytophthorra Blight of Pepper Using Growth Mixtures of Combined Chitinolytic Bacteria Under Different Field Conditions. European Journal Pathology. 120: 373-382. DOI 10.1007/s 10658-007-9227-4.
Kobayashi D. Y. Reedy, R. M, Bick,J. A and Oudemans, P. V. 2002. Characterization Of A Chitinase Gene From Stenotrophomonas Maltophilia Strain 34S1 And Its Involvement In Biological Control. Application Environmental Microbiology 68: 1047-1054.
Kusdiana, A. P. 2011. Eksplorasi Dan Identifikasi Cendawan Antagonis Terhadap Rigidoporus lignosus Penyebab Jamur Akar Putih Pada Karet. [Skripsi]. Bogor: Institut Pertanian Bogor.
Leelavathi, M. S. Vani, L and Reena, P. 2014. Antimicrobial Activity Of Trichoderma Harzianum Against Bacteria And Fungi. International Journal of Microbiology, Applied Sciences. 3(1): 96-103.
Lorito, M. G. E. Harman, C. K. Hayes, R.M. Broadway., S.L. Tronsmo., Woo & A. DiPietro. 1992. Chitinolytic Enzymes Produced by Trichoderma harzianum: Antifungal Activity or Purified Endochitinase and Chitobiosidase Phytopathology. 83:302- 307.
Lubis, I. F. 2002. Pengaruh Pemberian Kompos Alang-Alang (Imperata cylindrica) Dengan Inokulasi Trichoderma viride Terhadap Perkembangan Infeksi Jamu Akar Putih (Rigidoporus lignosus) Dan Pertumbuhan Bibit Karet (Hevea brasiliensis Muell Arg.). [Skripsi]. Bogor: Institut Pertanian Bogor.
Manju, M. J, Benagi, V. I, Shankarappa, T. H, Kuruvilla, J, and Sabu P. I. Antifungal Activity of Some Biological Agents Against Corynespora cassicola) Causing Corynespora Leaf Fall Disease of Rubber (Hevea brasiliensis Muelll. Arg.). Indian Journal of Advances in Plants Research, 1(6):30-32
31
Muharni & Wijajanti, 2011. Skrining Bakteri Kitinolitik Antagonis Terhadap Pertumbuhan Jamur Akar Putih (Rigidoporus lignosus) dari Rizosfir Tanaman Karet. Jurnal Penelitian Sains. 14 (10): 51-56
Nugroho. 2010. Karakterisasi Biologi Isolat-Isolat Rigidoporus microporus Pada Tanaman Karet (Hevea brasiliensis) Asal Cilacap. [Skripsi]. Solo: Universitas Sebelas Maret.
Pawirosoemardjo & Purwantara. 1985. Pengujian Fungisida Bayleton 2 PA Terhadap Rigidoporus microporus (Klotszch) imazeki Dalam Kondisi Laboratorium dan Rumah Kaca Balai Penelitian Perkebunan Bogor, hal:8.
Pawirosoemardjo, S. 2004. Manajemen pengendalian penyakit penting dalam upaya mengamankan target produksi karet nasional tahun 2020. Di dalam: Situmorang et al., editor. Strategi Pengelolaan Penyakit Tanaman Karet untuk Mempertahankan Potensi Produksi Mendukung Industri Perkaretan Indonesia Tahun 2020. Prosiding Pertemuan Teknis; Palembang, 6-7 Oktober 2004. Palembang: Pusat Penelitian Karet. hlm 21-45.
Rajarathanam S. Shashrieka & Bano Z. 1998. Biodegradative and Biosynthetic Capacities of Mushrooms. Present and Future Strategies. Critical Reviews in Biotechnology 18: 23–91.
Semangun. 2008. Penyakit-Penyakit Tanaman Perkebunan di Indonesia. Gadjah Mada University Press: Yogyakarta
Setiawan, H.D., A Andoko. 2005. Petunjuk Lengkap Budidaya Karet(edisi revisi). Agromedia Pustaka. Jakarta
Sinaga M.S. 2004. Strategi Pengelolaan Penyakit Penting Tanaman Karet di Indonesia Pada masa Mendatang. Prosiding Pertemuan Teknis; Palembang, 6- 7 Oktober 2004. Palembang: Pusat Penelitian Karet. hlm 11-20.
Shakir, M. A. Bano, A. Arshae, M. 2012. Short Communication Rhizosphere Bacteria Containing ACC-deaminase Conferred Drought Tolerance in Wheat Grown Under Semi-arrid Climate. Soil Environmental. 31(1): 108-112.
Situmorang A, Budiman A. 2003. Penyakit Tanaman Karet dan Pengendaliannya. Palembang: Pusat Penelitian Karet, Balai Penelitian Sembawa.
32
Sivasakthi, S. Usharani, G and Saranraj, P. 2014. Biocontrol Potentiality of Plant Growth Promoting Bacteria (PGPR) – Pseudomonas Fluorescens and Bacillus subtilis. African Journal of Agricltural Research. 9 (16).
Soytong, K., Srinon, W., Rattanacherdchai, K. Kanokmedhakul, S. and Kanokmedhakul, K. (2005). Application of Antagonistic Fungi to Control Anthracnose Disease of Grape. Journal of Agriculture Technology 1(1): 33-41.
Suwarto, 2003. Produksi dan Inaktivasi In vitro Toksi Isolat Corynespora Cassicola Asal Daun Karet. Thesis: IPB.
Suryanto D, & Munir E. 2006. Potensi Isolat Bakteri Lokal Untuk Pengendalian Hayati Jamur. Prosiding Seminar Hasil-Hasil Penelitian USU. 2006. Medan. Hlm 15- 25.
Suryanto, D. 2009. Prospek Keanekaragaman Hayati Mikroba (Microbial Bioprospecting) Sumatera Utara. Pidato Pengukuhan Jabatan Guru Besar Tetap dalam Bidang Mikrobiologi. Medan: FMIPA USU.
Suryanto, D. Irawati, N. Munir, E. 2011. Isolation and Characterization of Chitinolytic Bacteria and Their Potential to Inhibit Plant Pathogenic Fungi. Microbiology Indonesia. 5(3): 144-148.
Suryanto, D. Wibowo, R. H. Siregar, E. B. M. Munir, E. 2012. A Posibility of Chitinolytic Bacteria Utilization to Control Basal Stems Disease Caused by Ganoderma boninense in Oil Palm Seedling. African Journal of Microbiology Research. 6(9): 2053-2059.
Suryanto, D. Wahyuni, S. Siregar, E. B. M. Munir, E. 2014. Utilization of Chitinolytic Bacterial Isolates to Control Antharacnose of Cocoa Leaf Caused by Colletotrichum gloeospoiroides. African Journal of Biotechnology. 15(15): 1631-1637.
33
LAMPIRA N
Lampiran 1.1 Komposisi Medium MGMK Padatdan Cara Pembuatannya
• K2HPO4 0,7 g
• KH2PO4 0,3 g
• MgSO4.7H2O 0,5 g
• FeSO4.7H2O 0,01 g
• ZnSO4 0,001 g
• MnCl2 0,001 g
• Koloidal kitin 12,5% (b/v) 72,7 ml
• Agar 20 g
• pH 6,8
Cara Pembuatan
34
Lampiran 1.2 Pembuatan Koloidal Kitin Dengan Cara Hidrolisis Parsial (Rodriquez-Kabana et al. 1983)
Dihaluskan
Dilarutkan dalam 180 ml 10 N
HCl sambil diaduk dengan pengaduk magnetic stirer
s selama 1,5- 2 jam.
Dituang kedalam Erlenmeyer yang berisi 2 liter air
Dibiarkan semalam kemudian bagian yang bening dipisahkan dari endapannya.
Dicuci sampai pH suspensi kitin antara 5,5 – 6,8 Diambil 10 ml kemudian dikeringkan pada suhu 80oC
Dihitung berat keringnya 20 g serbuk kitin
Suspensi kitin
Endapan Bagian bening
35
Lampiran 2 Alur Kerja Uji Antagonis
Diinokulasikan pada bagian tengah media MGMK
Diteteskan 0.1 ml suspense bakteri kitinolitik pada cakram standar Oxoid. Diletakkan dengan jarak tanam 3.5 cm dari inokulum jamur
Diinkubasi pada suhu 28-30oC elama lima hari
Diukurzonahambat yang terbentuk
Lampiran 3 Alur kerja Pengamatan Hifa Abnormal
Dipotong ujung hifa yang terhambat pada media MGMK berbentuk kotak
Diletakkanpadagelasobjek
Diamati adanya abnomalitas pertumbuhan hifa (loritaet al, 1992).
Biakan jamur patogen
Hasil
Biakan jamur patogen
36
Lampiran 4 proses Penginfeksian JAP dan bibit Tanaman Karet
Proses infeksi tanaman karet Tanaman karet kontrol positif
Tanaman karet Perlakuan Tanaman karet infeksi JAP skala 1
37
Lampiran 5 Perhitungan Intensitas Serangan Kontrol positif
Ulangan 1: Skala 2 Ulangan 1:Skala 3 Ulangan 1:Skala 3 Ulangan 1: Skala 3 Ulangan 1: Skala 2 Intensitas Serangan I:⅀(2x2)+ (3x3) 4x5
I: 13 x 100 % 20
I: 65 %
Kontrol negatif: 0%
Perlakuan I
Intensitas serangan pada FS 4: 0 Intensitas serangan pada FS 5: 5 %
Perlakuan II
FS 4
Intensitas serangan awal Ulangan 1: 2
Ulangan 2:1 Ulangan 3:2 Ulangan 4:3 Ulangan 5:0
I:⅀(2x1) +( 2x 3) + (1x0) 4x5
I: 2+6 x 100 % 20
I: 40 %
Intensitas serangan akhir Ulangan 1: 1
Ulangan 2: 0 Ulangan 3: 1 Ulangan 4: 1 Ulangan 5: 0
I:⅀ (2x0) + (3x1) : 4x5
I: 3 x 100 % 20 I: 15 %
Penurunan intensitas serangan : I.S awal- I.S akhir x 100 % Total tanaman
: 40-15 x 100 % 30
: 83.33 % FS 7 Intensitas serangan awal
Ulangan 1: 0 Ulangan 2: 1 Ulangan 3: 2 Ulangan 4: 1 Ulangan 5: 2
I:⅀ (1x0) + (2x1)+ (2x2) : 4x5
I: 6 x 100 % 20 I: 30 %
Intensitas serangan akhir
Ulangan 1: 0 Ulangan 2: 0 Ulangan 3: 1 Ulangan 4: 1 Ulangan 5: 2
I:⅀ (2x0) + (2x1)+ (1x2) 4x5
I: 4 x 100 % 20 I: 20 %
Penurunan intensitas serangan : I.S awal- I.S akhir x 100 % Total tanaman
: 30-20 x 100 % 30
: 33.33 %
Luas Serangan (A): n/N x 100% FS 4 Perlakuan I
A: 0/5 x 100% : 0%
FS 4 Perlakuan II A: 4/5 x 100% A: 80%
FS 7 Perlakuan I A: 1/5 X 100% A: 20%