Tanaman
Berenuk
(
Crescentia
cujete
L).
Dibimbing
oleh
ELLY
SURADIKUSUMAH dan SURYANI.
Penelitian ini bertujuan menentukan fraksi teraktif antibakteri ekstrak kulit
batang tanaman berenuk, menentukan nilai konsentrasi hambat minimum (KHM)
dan konsentrasi bunuh minimum (KBM) dari fraksi teraktif tersebut, dan
mengidentifikasi kandungan fitokimianya. Uji pendahuluan antibakteri ekstrak
metanol kasar dan fraksi hasil partisinya (fraksi
n
-heksana, etil asetat, dan air)
dilakukan dengan metode difusi cakram terhadap bakteri
Staphylococcus aureus
(Gram positif) dan
Escherichia coli
(Gram negatif). Hasilnya
menunjukkan bahwa
hanya ekstrak metanol, fraksi
n
-heksana, dan fraksi etil asetat yang memiliki
aktivitas sebagai antibakteri, dan aktivitas tertinggi ditunjukkan oleh fraksi
n
-heksana. Fraksinasi lanjutan fraksi
n
-heksana menggunakan kromatografi kolom
silika gel (elusi gradien) menghasilkan 10 fraksi. Semua fraksi menunjukkan
aktivitas antibakteri, dan aktivitas tertinggi ditunjukkan oleh fraksi II. Fraksi
terakstif tersebut menunjukkan persentase inhibisi terhadap bakteri
S. aureus
dan
E. coli
masing-masing 35.86% dan 63.01%. Nilai KHM fraksi teraktif terhadap
bakteri
S. aureus
dan
E. coli
ialah 0.2 dan 0.1 mg/mL, dan nilai KBM terhadap
kedua bakteri masing-masing 10 dan 5 mg/mL. Berdasarkan uji fitokimia,
senyawa aktif yang terkandung dalam fraksi teraktif adalah golongan steroid dan
alkaloid. Dengan demikian, dapat disimpulkan bahwa senyawa golongan steroid
dan alkaloid dalam kulit batang berenuk berpotensi sebagai antibakteri.
ABSTRACT
AHMAD YANI. Fractionation of Antibacterial Active Components from Berenuk
(
Crescentia
cujete
L)
Stem
Bark
Extract.
Supervised
by
ELLY
SURADIKUSUMAH and SURYANI.
1
PENDAHULUAN
Bakteri merupakan mikroorganisme prokariotik yang khas, bersel tunggal, dan tidak mengandung struktur yang terbatasi membran di dalam sitoplasmanya (Pelczar dan Chan 1986). Ukurannya yang mikro dan mudah berkembang biak menyebabkan bakteri tersebar hampir di setiap tempat dan dapat tumbuh di wilayah dengan kondisi umum hingga ekstrim. Bakteri juga dapat tumbuh dan berkembang biak dengan baik di permukaan kulit dan di dalam tubuh manusia maupun hewan.
Bakteri ada yang bersifat patogen dan ada pula yang nonpatogen. Bakteri patogen merupakan bakteri yang berpotensi menyebabkan infeksi ataupun penyakit, baik dalam jumlah yang sedikit ataupun saat jumlahnya melebihi normal. Sementara itu, bakteri nonpatogen merupakan bakteri yang tidak berpotensi menyebabkan infeksi penyakit tertentu pada manusia ataupun hewan inangnya.
Beragamnya bakteri patogen yang dapat menyebabkan infeksi ataupun penyakit telah memacu penggunaan antibiotik sebagai obat utama. Antibiotik bekerja secara spesifik pada proses tertentu dalam daur hidup bakteri. Sistem mekanisme resistensi terhadap antibiotik mungkin dilakukan oleh bakteri sasaran sehingga mutasi pada bakteri mungkin dapat terjadi dan memungkinkan munculnya strain bakteri yang kebal terhadap antibiotik. Hal ini menyebabkan antibiotik biasanya diberikan dalam dosis yang menyebabkan bakteri segera mati dalam jangka waktu cukup lama agar tidak terjadi mutasi pada bakteri. Namun demikian, pemberian dosis yang tinggi dalam jangka waktu cukup lama terkadang memberikan efek samping yang tidak diinginkan dalam tubuh.
Penggunaan antibiotik sintetik maupun semi-sintetik umumnya memiliki efek samping tertentu yang tidak diharapkan, terutama apabila antibiotik tersebut digunakan secara terus-menerus. Oleh karena itu, penelitian-penelitian mengenai zat antibakteri alami terus dilakukan. Hingga saat ini, banyak penelitian yang dilakukan untuk mencari senyawa-senyawa metabolit sekunder dari tumbuhan yang memiliki aktivitas antibakteri.
Produk bahan alam seperti metabolit sekunder, baik senyawa murni maupun dalam bentuk ekstrak, memiliki peluang untuk dikembangkan dalam dunia pengobatan. Senyawa bahan alam tersebut memiliki efek terapis yang signifikan terhadap bakteri,
jamur, maupun virus yang bersifat patogen terhadap hewan dan manusia. Efek terapis yang ditimbulkan juga lebih aman tanpa efek samping (Parthasarathy et al. 2009).
Salah satu tanaman yang berpotensi dikembangkan dalam dunia pengobatan adalah berenuk (Crescentia cujete Linn). Berenuk merupakan tanaman perdu tropis yang berkhasiat sebagai obat berbagai penyakit. Daun berenuk dalam pengobatan tradisional digunakan untuk mengobati luka baru dan menurunkan hipertensi. Daun mudanya ditumbuk dan dijadikan pengkompres untuk sakit kepala dan luka. Sementara daging buahnya digunakan untuk mengobati diare, flu, bronkhitis, batuk, asma, dan uretritis (Heyne 1987).
Uji fitokimia yang dilakukan oleh Ogbuagu (2008) memberikan informasi bahwa daging buah berenuk mengandung alkaloid, flavonoid, saponin, tanin, dan polifenol. Kandungan alkaloid, saponin, tanin, dan polifenolnya berpotensi sebagai zat antibakteri. Rasadah dan Houghton (1988) juga menyimpulkan adanya potensi antibakteri dari kulit kayu, batang, dan akar tanaman famili Bignoniaceae, termasuk
Crescentia cujete Linn. Oleh karena itu, tanaman berenuk ini memiliki fungsi sebagai antibakteri.
Penelitian ini bertujuan menentukan fraksi teraktif antibakteri ekstrak kulit batang tanaman berenuk, menentukan nilai konsentrasi hambat minimum (KHM) dan konsentrasi bunuh minimum (KBM) dari fraksi teraktif tersebut, dan mengidentifikasi kandungan fitokimianya.
TINJAUAN PUSTAKA
Berenuk
PENDAHULUAN
Bakteri merupakan mikroorganisme prokariotik yang khas, bersel tunggal, dan tidak mengandung struktur yang terbatasi membran di dalam sitoplasmanya (Pelczar dan Chan 1986). Ukurannya yang mikro dan mudah berkembang biak menyebabkan bakteri tersebar hampir di setiap tempat dan dapat tumbuh di wilayah dengan kondisi umum hingga ekstrim. Bakteri juga dapat tumbuh dan berkembang biak dengan baik di permukaan kulit dan di dalam tubuh manusia maupun hewan.
Bakteri ada yang bersifat patogen dan ada pula yang nonpatogen. Bakteri patogen merupakan bakteri yang berpotensi menyebabkan infeksi ataupun penyakit, baik dalam jumlah yang sedikit ataupun saat jumlahnya melebihi normal. Sementara itu, bakteri nonpatogen merupakan bakteri yang tidak berpotensi menyebabkan infeksi penyakit tertentu pada manusia ataupun hewan inangnya.
Beragamnya bakteri patogen yang dapat menyebabkan infeksi ataupun penyakit telah memacu penggunaan antibiotik sebagai obat utama. Antibiotik bekerja secara spesifik pada proses tertentu dalam daur hidup bakteri. Sistem mekanisme resistensi terhadap antibiotik mungkin dilakukan oleh bakteri sasaran sehingga mutasi pada bakteri mungkin dapat terjadi dan memungkinkan munculnya strain bakteri yang kebal terhadap antibiotik. Hal ini menyebabkan antibiotik biasanya diberikan dalam dosis yang menyebabkan bakteri segera mati dalam jangka waktu cukup lama agar tidak terjadi mutasi pada bakteri. Namun demikian, pemberian dosis yang tinggi dalam jangka waktu cukup lama terkadang memberikan efek samping yang tidak diinginkan dalam tubuh.
Penggunaan antibiotik sintetik maupun semi-sintetik umumnya memiliki efek samping tertentu yang tidak diharapkan, terutama apabila antibiotik tersebut digunakan secara terus-menerus. Oleh karena itu, penelitian-penelitian mengenai zat antibakteri alami terus dilakukan. Hingga saat ini, banyak penelitian yang dilakukan untuk mencari senyawa-senyawa metabolit sekunder dari tumbuhan yang memiliki aktivitas antibakteri.
Produk bahan alam seperti metabolit sekunder, baik senyawa murni maupun dalam bentuk ekstrak, memiliki peluang untuk dikembangkan dalam dunia pengobatan. Senyawa bahan alam tersebut memiliki efek terapis yang signifikan terhadap bakteri,
jamur, maupun virus yang bersifat patogen terhadap hewan dan manusia. Efek terapis yang ditimbulkan juga lebih aman tanpa efek samping (Parthasarathy et al. 2009).
Salah satu tanaman yang berpotensi dikembangkan dalam dunia pengobatan adalah berenuk (Crescentia cujete Linn). Berenuk merupakan tanaman perdu tropis yang berkhasiat sebagai obat berbagai penyakit. Daun berenuk dalam pengobatan tradisional digunakan untuk mengobati luka baru dan menurunkan hipertensi. Daun mudanya ditumbuk dan dijadikan pengkompres untuk sakit kepala dan luka. Sementara daging buahnya digunakan untuk mengobati diare, flu, bronkhitis, batuk, asma, dan uretritis (Heyne 1987).
Uji fitokimia yang dilakukan oleh Ogbuagu (2008) memberikan informasi bahwa daging buah berenuk mengandung alkaloid, flavonoid, saponin, tanin, dan polifenol. Kandungan alkaloid, saponin, tanin, dan polifenolnya berpotensi sebagai zat antibakteri. Rasadah dan Houghton (1988) juga menyimpulkan adanya potensi antibakteri dari kulit kayu, batang, dan akar tanaman famili Bignoniaceae, termasuk
Crescentia cujete Linn. Oleh karena itu, tanaman berenuk ini memiliki fungsi sebagai antibakteri.
Penelitian ini bertujuan menentukan fraksi teraktif antibakteri ekstrak kulit batang tanaman berenuk, menentukan nilai konsentrasi hambat minimum (KHM) dan konsentrasi bunuh minimum (KBM) dari fraksi teraktif tersebut, dan mengidentifikasi kandungan fitokimianya.
TINJAUAN PUSTAKA
Berenuk
2
Gambar 1 Tanaman Berenuk. Berenuk umum dijumpai di daerah tropis. Tanaman ini merupakan jenis tanaman dikotil berbunga yang berasal dari Amerika Tengah dan Selatan. Tanaman ini termasuk tanaman perdu dengan tinggi sekitar 6-10 m, berdaun hijau sepanjang tahun, dan memiliki kayu yang kuat dengan warna putih kehitaman. Sistem daun tanaman berenuk cukup sederhana dengan bentuk majemuk, menyirip, lonjong, bertepi rata, ujung daun membulat, pangkal daun meruncing, dan bertangkai pendek. Berenuk memiliki bunga tunggal yang muncul dari cabang dan ranting dengan kelopak berbentuk corong. Buahnya berwarna hijau kekuningan berbentuk bulat besar dengan diameter mencapai 20 cm. Buah berenuk termasuk buah tunggal dengan kulit buah yang kuat dan keras. Di dalamnya terdapat pulp dengan biji berukuran kecil-kecil yang menempel pada pulp (Michael 2004).
Kandungan kimia daging buah berenuk yang telah dilaporkan antara lain alkaloid, flavonoid, saponin, tanin, polifenol, vitamin A, C, E, niasin, riboflavin, thiamin, karbohidrat, dan mineral-mineral yang mencakup natrium, kalium, kalsium, fosfor, dan magnesium. Sementara itu, bagian daun, kulit batang, dan akarnya mengandung saponin dan polifenol (Ogbuagu 2008).
Berenuk berkhasiat mengobati berbagai macam penyakit sehingga sering digunakan dalam pengobatan tradisional. Batang, daun, buah, dan akarnya sering digunakan sebagai obat pencahar, diare, obat diuretik, otitis, analgesik, dan antiinflamasi (Morton 1981, Michael 2004). Pulpnya bila dicampur dengan daun Lignum vitae telah digunakan untuk pengobatan diabetes. Pulpnya yang belum matang juga telah digunakan untuk penyembuhan sakit kepala, batuk, pneumonia, antipiretik, dan pencahar. Di Afrika bagian tenggara, buah berenuk dapat dimakan pada bagian pulpnya dan diyakini dapat mengobati demam, tetanus dan kejang-kejang, muntah-muntah, menstruasi tidak lancar, dan
gangguan prostat (Burkill 1985, Morton 1981). Di beberapa daerah di Indonesia, berenuk juga telah digunakan dalam pengobatan tradisional. Di Sulawesi Tenggara, kulit batang berenuk direbus untuk obat diabetes (Rahayu et al. 2006). Daun berenuk dalam pengobatan tradisional di Jawa digunakan untuk mengobati luka baru dan menurunkan hipertensi. Daun mudanya ditumbuk dan dijadikan pengkompres untuk sakit kepala dan membersihkan luka baru. Sementara daging buahnya digunakan untuk mengobati diare, flu, bronkhitis, batuk, asma, dan uretritis (Heyne 1987).
Bakteri
Bakteri merupakan sel prokariotik yang khas, bersel tunggal, dan mengandung struktur yang tidak dibatasi membran di dalam sitoplasmanya. Bakteri memiliki diameter 0.5-1.0 µm dan panjangnya 1.5-2.5 µm. Sel-sel individu bakteri dapat berbentuk bola, batang, atau spiral (heliks) (Pelczar dan Chan 1986).
Berdasarkan komposisi dinding selnya, bakteri dibedakan menjadi dua, yaitu bakteri Gram positif dan Gram negatif. Bakteri Gram positif adalah bakteri yang memiliki lapisan peptidoglikan (molekul yang tersusun atas asam amino dan gula) yang tebal. Tebalnya peptidoglikan ini menyebabkan bakteri tahan terhadap sifat osmosis yang dapat memecah sel bakteri tersebut. Lapisan peptidoglikan pada bakteri Gram negatif lebih tipis tetapi memiliki membran luar yang tebal sehingga bersama-sama dengan peptidoglikan membentuk mantel pelindung yang kuat untuk sel (McKanne dan Kandel 1996).
Bakteri uji merupakan bakteri yang digunakan dalam pengujian sifat antibakteri suatu senyawa tertentu sehingga senyawa tersebut dapat diketahui memiliki aktivitas antibakteri atau tidak. Bakteri yang umum digunakan mencakup salah satu dari jenis bakteri Gram positif dan Gram negatif.
Entero-bacteriaceae, dan Basillaceae. Namun demikian, bakteri ini jauh lebih tahan terhadap tekanan lingkungan, seperti suhu, garam, dan kekeringan dibandingkan dengan jenis bakteri lain (Buckle et al. 1985).
S. aureus merupakan penyebab berbagai infeksi yang bernanah dan bersifat toksik pada manusia dan hewan. Bakteri ini pada manusia menyebabkan pneumonia (infeksi paru-paru), osteomyelitis (radang tulang), sinusitis, tonsilitis (radang amandel), abses (penimbunan nanah akibat infeksi bakteri), dan endokarditis. S. aureus pada hewan menyebabkan penyakit seperti mastitis (pembengkakan payudara) pada sapi, pustular dermatitis (radang kulit) pada anjing, serta abses pada semua spesies termasuk unggas (Jawetz et al. 2004). Infeksi yang disebabkan oleh S. aureus juga dapat menyebabkan meningitis (radang selaput otak). Penyakit-penyakit tersebut tidak jarang dapat menyebabkan kematian meskipun telah dilakukan terapi dengan antibiotik. Hal ini terutama disebabkan oleh strain S. aureus
yang telah bermutasi, contohnya strain
methicillin-resistant Staphylococcus aureus
(MRSA) (Rybak dan LaPlante 2005).
Salah satu penyebab masuknya S. aureus
ke dalam tubuh adalah melalui makanan yang tercemar oleh bakteri tersebut sehingga menyebabkan infeksi saluran pencernaan, diare, bahkan diare akut yang disebabkan enterotoksin yang dihasilkan bakteri tersebut (Rybak dan LaPlante 2005).
Sumber: hartokofiles.wordpress.com. Gambar 2 Staphylococcusaureus.
Escherichia coli termasuk ke dalam famili Enterobacteriaceae. Golongan bakteri ini merupakan kelompok besar dari bakteri Gram negatif, tidak berspora, dan berbentuk batang kecil. Kelompok ini memiliki sifat khas, yaitu mampu tumbuh secara aerobik maupun anaerobik fakultatif pada beraneka macam karbohidrat (Buckle et al. 1985).
E. coli pada umumnya merupakan mikrob yang secara normal terdapat pada saluran pencernaan hewan dan manusia. Bakteri ini memiliki panjang 2.0-6.0 µm dan lebar
1.1-1.5 µm. Suhu optimum bakteri ini adalah 37°C. Beberapa strain bakteri ini dapat menyebabkan gastroentritis pada manusia dan hewan ternak, diare, dan infeksi saluran kemih (Jawetz et al. 2004).
Sumber: www.jpnn.com. Gambar 3 Escherichiacoli.
Antibakteri
Zat antibakteri adalah zat yang dapat mengganggu pertumbuhan atau metabolisme bakteri (Pelczar dan Chan 1986). Berdasarkan aktivitasnya, zat antibakteri dibedakan menjadi dua kelompok, yaitu antibakteri bakteriostatik yang bekerja menghambat populasi bakteri tetapi tidak mematikan bakterinya; dan antibakteri bakterisida yang bekerja dengan membunuh bakteri. Umumnya terdapat transisi antara kerja bakteriostatik dan bakterisida. Ada beberapa antibakteri yang bersifat bakteriostatik dapat berubah menjadi bakterisida jika digunakan dalam dosis tinggi (Schunack et al. 1990).
Zat antibakteri yang digunakan untuk membasmi bakteri patogen penyebab penyakit infeksi pada manusia harus memiliki sifat toksisitas selektif yang tinggi. Artinya, obat tersebut harus bersifat sangat toksik untuk bakteri tetapi relatif atau bahkan tidak toksik terhadap inang (Gan et al. 1980).
4
Ekstraksi
Ekstraksi merupakan prosedur untuk memperoleh kandungan senyawa organik dari jaringan tumbuhan (Harborne 1987). Ekstraksi dapat diartikan juga sebagai cara untuk memisahkan campuran beberapa zat menjadi komponen-komponen yang terpisah (Winarno
et al. 1973). Kelarutan zat dalam pelarut bergantung pada kepolarannya. Zat yang polar hanya larut dalam pelarut polar, dan sebaliknya. Dalam ekstraksi, diperhatikan juga selektivitas pelarut, kemampuan untuk mengekstraksi komponen sasaran, toksisitas, kemudahan untuk diuapkan, dan harga pelarut (Harborne 1987).
Metode ekstraksi yang umum digunakan antara lain maserasi, soxhletasi, penggodokan (refluks), ekstraksi cair-cair (partisi), dan ekstraksi ultrasonik. Metode ekstraksi yang digunakan dalam penelitian ini adalah maserasi dan ekstraksi cair-cair.
Maserasi merupakan proses pengambilan komponen target yang dilakukan dengan cara merendam serbuk simplisia dalam pelarut yang sesuai dalam jangka waktu tertentu. Isi sel akan larut karena adanya perbedaan konsentrasi antara larutan di dalam sel dan di luar sel. Larutan dengan konsentrasi tinggi akan terdesak keluar dan diganti oleh pelarut dengan konsentrasi rendah (proses difusi). Peristiwa tersebut berulang sampai terjadi keseimbangan konsentrasi antara larutan di luar sel dan di dalam sel. Selama proses maserasi, sesekali dilakukan pengadukan dan juga dilakukan penggantian pelarut. Residu yang diperoleh dipisahkan kemudian filtratnya diuapkan (Sudjadi 1986). Metode maserasi memiliki kelebihan antara lain sederhana, relatif murah, tidak memerlukan peralatan yang rumit, dan dapat menghindari kerusakan komponen senyawa yang tidak tahan panas karena metode ini dilakukan tanpa proses pemanasan. Kelemahan metode ini antara lain membutuhkan waktu yang cukup lama dan menggunakan jumlah pelarut yang banyak sehingga tidak efektif dan efisien (Meloan 1999).
Ekstraksi cair-cair merupakan metode ekstraksi yang didasarkan pada sifat kelarutan komponen target dan distribusinya dalam dua pelarut yang tidak saling bercampur. Senyawa polar akan terbawa dalam pelarut polar, senyawa semipolar akan terbawa dalam pelarut yang semipolar, dan senyawa nonpolar akan terbawa dalam pelarut nonpolar. Ekstraksi cair-cair bertahap merupakan teknik ekstraksi cair-cair yang paling sederhana,
cukup dengan menambahkan pelarut pengekstraksi yang tidak saling bercampur kemudian dilakukan pengocokan sehingga terjadi distribusi zat terlarut di antara kedua pelarut (Khopkar 2002). Dalam hal ini, pemisahan zat yang polar dan nonpolar dapat dilakukan dengan ekstraksi cair-cair (partisi) dalam corong pisah. Pengocokan bertujuan memperluas area permukaan kontak di antara kedua pelarut sehingga pendistribusian zat terlarut di antara keduanya dapat berlangsung dengan baik. Syarat pelarut untuk ekstraksi cair-cair adalah memiliki kepolaran yang sesuai dengan bahan yang diekstraksi dan harus terpisah setelah pengocokan (Harvey 2000).
Kromatografi Kolom dan Kromatografi Lapis Tipis
Metode pemisahan atau yang umum dikenal sebagai fraksinasi merupakan proses pemisahan komponen suatu ekstrak menjadi kelompok-kelompok senyawa yang memiliki kemiripan karakteristik secara kimia. Fraksinasi akan berjalan dengan tepat apabila menggunakan pelarut yang paling baik dan sesuai dalam pemisahan senyawa-senyawa yang difraksinasi. Metode fraksinasi yang paling umum digunakan adalah kromatografi kolom dan kromatografi lapis tipis. Kromatografi kolom adalah salah satu metode kromatografi untuk analisis kualitatif dan kuantitatif senyawa kimia. Kromatografi kolom bertujuan memurnikan dan mengisolasi komponen dari suatu campurannya. Kromatografi jenis ini menggunakan suatu kolom kaca yang berisi fase diam di dalamnya (Day dan Underwood 2001).
dengan satu jenis pelarut ataupun elusi gradien dengan beberapa jenis pelarut sesuai dengan peningkatan kepolarannya (Harvey 2000).
Hasil pemisahan dengan kromatografi kolom dapat dianalisis lebih lanjut meng-gunakan kromatografi lapis tipis (KLT). Kromatografi lapis tipis (KLT) merupakan metode kromatografi adsorpsi yang meng-gunakan sebuah lapis tipis silika atau alumina yang seragam pada sebuah lempeng gelas atau logam yang keras sebagai fase diam. Fase diam KLT seringkali mengandung zat yang dapat berpendar dalam sinar ultraviolet. Fase gerak yang digunakan pada KLT merupakan pelarut atau campuran pelarut yang sesuai (Houghton & Raman 1998). Data hasil KLT diberikan dalam bentuk nilai Rf senyawa dalam sistem pelarut tertentu. Nilai Rf dihitung berdasarkan pergerakan zat relatif terhadap garis depan pelarut dalam sistem KLT dan dihitung melalui perbandingan jarak tempuh zat dengan jarak tempuh garis depan pelarut.
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan adalah peralatan gelas, neraca analitik, oven, penguap putar, inkubator, autoklaf, pipet mikro, laminar air flow biosafety, jarum ose, pengaduk magnet, lempeng pemanas, spektrometer sinar tampak (Spectronic 20D+), pelat mikro 96-sumur,
mikroplate reader BIO-RAD Model 680 XR, pipa kapiler, bejana kromatografi, dan kolom.
Bahan-bahan yang digunakan adalah simplisia serbuk kulit batang tanaman berenuk, metanol, akuadestilata, n-heksana, etil asetat, diklorometana, dimetil sulfoksida (DMSO), FeCl3 1%, anhidrida asam asetat, kloroform, NH4OH, dietil eter, pereaksi Lieberman-Burchard, serbuk Mg, amil alkohol, H2SO4 2 M, pereaksi Dragendorff, Meyer, dan Wagner, HCl pekat, silika gel G60 (Merck 230-400 mesh), pelat silika gel G60 F254 (Merck), alumunium foil, agar nutrien (Nutrient Agar, NA), kaldu nutrien (Nutrient Broth, NB), larutan NaCl fisiologis 0.85%, isolat bakteri Staphylococcus aureus (Gram positif) dan Escherichia coli (Gram negatif) tipe liar, kertas cakram (Whatman No.1 diameter 6.0 mm), dan antibiotik amoksisilin.
Metode
Metode penelitian mengikuti diagram alir pada Lampiran 1 yang meliputi penyiapan sampel, penentuan kadar air, ekstraksi bagian tanaman, ekstraksi cair-cair, uji aktivitas antibakteri, penentuan eluen terbaik dengan KLT, fraksinasi menggunakan kromatografi kolom, penentuan KHM dan KBM fraksi teraktif, dan analisis fitokimia.
Penyiapan Sampel
Bagian kulit batang segar tanaman berenuk dikumpulkan dari daerah Babakan Lio, Darmaga, Bogor, pada minggu kedua bulan April 2010. Bahan segar tanaman dicuci, dipotong kecil-kecil, dikering-udarakan, kemudian digiling hingga diperoleh simplisia serbuk. Simplisia serbuk selanjutnya disimpan dalam wadah kedap udara.
Penentuan Kadar Air Simplisia Berenuk Cawan porselin dicuci bersih dan dikeringkan di dalam oven bersuhu 105°C selama 30 menit. Selanjutnya cawan didinginkan dalam eksikator selama 30 menit, kemudian ditimbang bobot kosongnya. Sebanyak 3 g sampel dimasukkan ke dalam cawan dan dikeringkan di dalam oven pada suhu 105°C selama 2x24 jam. Cawan beserta isinya didinginkan dalam eksikator sekitar 30 menit kemudian ditimbang. Proses pengeringan dan penimbangan diulang kembali sampai diperoleh bobot konstan. Penentuan kadar air dilakukan sebanyak tiga kali ulangan.
Kadar air (%) = A – B x 100% A
Keterangan:
A = bobot bahan sebelum dikeringkan (g) B = bobot bahan setelah dikeringkan (g)
Ekstraksi
5
dengan satu jenis pelarut ataupun elusi gradien dengan beberapa jenis pelarut sesuai dengan peningkatan kepolarannya (Harvey 2000).
Hasil pemisahan dengan kromatografi kolom dapat dianalisis lebih lanjut meng-gunakan kromatografi lapis tipis (KLT). Kromatografi lapis tipis (KLT) merupakan metode kromatografi adsorpsi yang meng-gunakan sebuah lapis tipis silika atau alumina yang seragam pada sebuah lempeng gelas atau logam yang keras sebagai fase diam. Fase diam KLT seringkali mengandung zat yang dapat berpendar dalam sinar ultraviolet. Fase gerak yang digunakan pada KLT merupakan pelarut atau campuran pelarut yang sesuai (Houghton & Raman 1998). Data hasil KLT diberikan dalam bentuk nilai Rf senyawa dalam sistem pelarut tertentu. Nilai Rf dihitung berdasarkan pergerakan zat relatif terhadap garis depan pelarut dalam sistem KLT dan dihitung melalui perbandingan jarak tempuh zat dengan jarak tempuh garis depan pelarut.
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan adalah peralatan gelas, neraca analitik, oven, penguap putar, inkubator, autoklaf, pipet mikro, laminar air flow biosafety, jarum ose, pengaduk magnet, lempeng pemanas, spektrometer sinar tampak (Spectronic 20D+), pelat mikro 96-sumur,
mikroplate reader BIO-RAD Model 680 XR, pipa kapiler, bejana kromatografi, dan kolom.
Bahan-bahan yang digunakan adalah simplisia serbuk kulit batang tanaman berenuk, metanol, akuadestilata, n-heksana, etil asetat, diklorometana, dimetil sulfoksida (DMSO), FeCl3 1%, anhidrida asam asetat, kloroform, NH4OH, dietil eter, pereaksi Lieberman-Burchard, serbuk Mg, amil alkohol, H2SO4 2 M, pereaksi Dragendorff, Meyer, dan Wagner, HCl pekat, silika gel G60 (Merck 230-400 mesh), pelat silika gel G60 F254 (Merck), alumunium foil, agar nutrien (Nutrient Agar, NA), kaldu nutrien (Nutrient Broth, NB), larutan NaCl fisiologis 0.85%, isolat bakteri Staphylococcus aureus (Gram positif) dan Escherichia coli (Gram negatif) tipe liar, kertas cakram (Whatman No.1 diameter 6.0 mm), dan antibiotik amoksisilin.
Metode
Metode penelitian mengikuti diagram alir pada Lampiran 1 yang meliputi penyiapan sampel, penentuan kadar air, ekstraksi bagian tanaman, ekstraksi cair-cair, uji aktivitas antibakteri, penentuan eluen terbaik dengan KLT, fraksinasi menggunakan kromatografi kolom, penentuan KHM dan KBM fraksi teraktif, dan analisis fitokimia.
Penyiapan Sampel
Bagian kulit batang segar tanaman berenuk dikumpulkan dari daerah Babakan Lio, Darmaga, Bogor, pada minggu kedua bulan April 2010. Bahan segar tanaman dicuci, dipotong kecil-kecil, dikering-udarakan, kemudian digiling hingga diperoleh simplisia serbuk. Simplisia serbuk selanjutnya disimpan dalam wadah kedap udara.
Penentuan Kadar Air Simplisia Berenuk Cawan porselin dicuci bersih dan dikeringkan di dalam oven bersuhu 105°C selama 30 menit. Selanjutnya cawan didinginkan dalam eksikator selama 30 menit, kemudian ditimbang bobot kosongnya. Sebanyak 3 g sampel dimasukkan ke dalam cawan dan dikeringkan di dalam oven pada suhu 105°C selama 2x24 jam. Cawan beserta isinya didinginkan dalam eksikator sekitar 30 menit kemudian ditimbang. Proses pengeringan dan penimbangan diulang kembali sampai diperoleh bobot konstan. Penentuan kadar air dilakukan sebanyak tiga kali ulangan.
Kadar air (%) = A – B x 100% A
Keterangan:
A = bobot bahan sebelum dikeringkan (g) B = bobot bahan setelah dikeringkan (g)
Ekstraksi
awal, dengan faktor koreksi berupa kadar air sampel yang digunakan.
Ekstraksi Cair-Cair Ekstrak Kulit Batang Tanaman Berenuk
Ekstrak metanol kulit batang sebanyak 5 g ditambahkan dengan 100 mL akuadestilata dan dimasukkan ke dalam corong pisah. Larutan kemudian ditambah n-heksana dengan perbandingan 1:1 v/v dan diekstraksi. Fraksi n-heksana dipisahkan dan fraksi air diekstraksi kembali dengan jenis dan jumlah pelarut yang sama sampai diperoleh fraksi n -heksana dari 3 kali pengulangan ekstraksi. Fraksi air yang masih tersisa kemudian diekstraksi kembali dengan pelarut etil asetat dengan perbandingan 1:1 v/v. Fraksi etil asetat dipisahkan dan ekstraksi diulang kembali dengan jenis dan jumlah pelarut yang sama sampai diperoleh fraksi etil asetat dari 3 kali pengulangan ekstraksi. Ketiga macam fraksi yang dihasilkan, yaitu fraksi n-heksana, etil asetat, dan air kemudian dipekatkan dengan penguap putar. Rendemen ekstrak dihitung dengan membandingkan bobot ekstrak yang diperoleh terhadap bobot sampel awal.
Pembuatan Media Agar Nutrien
MediaAgarMiring. Sebanyak 1.15 g NA dilarutkan dalam 50 mL akuadestilata, dipanaskan, dan diaduk dengan pengaduk magnet hingga homogen. Larutan kemudian dimasukkan ke dalam tabung reaksi. Setiap tabung reaksi diisi dengan 5 mL larutan sehingga diperoleh 10 tabung media. Tabung-tabung ini kemudian ditutup dengan kapas dan alumunium foil. Media disterilisasi dengan autoklaf pada tekanan 1.5 atm dengan suhu 121°C selama 15 menit. Tabung-tabung dimiringkan dan media dibiarkan mengeras kemudian diinkubasi selama 24 jam dalam suhu ruang. Setelah mengeras, media siap digunakan sebagai tempat pengembangbiakan bakteri uji.
Media Agar Cawan Petri. Serbuk NA sebanyak 3.45 g dilarutkan dalam 150 mL akuadestilata, dipanaskan, dan diaduk dengan pengaduk magnet hingga homogen. Media disterilisasi dengan autoklaf pada tekanan 1.5 atm dengan suhu 121°C selama 15 menit. Media siap dicampur dengan suspensi bakteri dan dituang ke dalam cawan Petri. Setiap cawan Petri berisi 20 mL media yang telah dikulturisasi.
Pembuatan Suspensi Bakteri
Bakteri uji yang telah dibiakkan pada media agar miring NA diregenerasi dengan cara diambil satu ose dan disuspensikan ke dalam tabung reaksi berisi 5 mL larutan NaCl fisiologis steril. Suspensi kemudian diinkubasi selama 18 jam pada suhu 37C. Rapatan optis (optical density, OD) suspensi bakteri diukur dengan spektrofotometer tampak pada 620 nm. Bila nilai OD bernilai >1.0, suspensi bakteri yang digunakan untuk kulturisasi pada media cawan Petri adalah sebanyak 50 µL untuk setiap 20 mL media. Bila nilai OD bernilai <1.0, suspensi bakteri yang di-gunakan untuk kulturisasi pada media cawan Petri adalah sebanyak 100 µL untuk setiap 20 mL media.
Pengujian Aktivitas Antibakteri
Pengujian aktivitas antibakteri dilakukan terhadap isolat E. coli dan S. aureus tipe liar dengan metode difusi cakram (Metode Kirby-Bauer). Suspensi bakteri sebanyak 1 mL dicampurkan ke dalam 200 mL media. Campuran diaduk dengan kecepatan 100-200 rpm kemudian dituang ke dalam satu cawan Petri untuk setiap 20 mL. Media yang telah dikulturisasi dibiarkan mengeras pada suhu ruang.
Pengujian dilakukan dengan menyiapkan ekstrak metanol kasar dan fraksi hasil partisi dengan konsentrasi 20 mg/mL dalam DMSO. Cakram steril berdiameter 6.0 mm dibasahi larutan ekstrak dan diletakkan di atas permukaan agar. Larutan DMSO digunakan sebagai kontrol negatif, sedangkan kontrol positifnya adalah amoksisilin 1% (b/v) dalam DMSO. Cawan Petri kemudian diinkubasi terbalik selama 24 jam pada suhu 37°C. Diameter daerah hambat yang dihasilkan diukur dengan jangka sorong. Ekstrak hasil partisi yang menunjukkan aktivitas tertinggi digunakan untuk analisis selanjutnya, yaitu fraksinasi dengan kromatografi kolom.
Penentuan Eluen Terbaik
7
dan metanol. Noda yang dihasilkan dari proses elusi masing-masing eluen diamati di bawah lampu UV pada λ 254 dan 366 nm. Eluen yang menghasilkan noda terbanyak dan terpisah dipilih sebagai eluen terbaik.
Fraksinasi dengan Kromatografi Kolom Fraksinasi dilakukan dengan kolom kemas menggunakan silika gel sebanyak 15 g. Diameter kolom yang digunakan sebesar 1 cm dengan tinggi kolom 20 cm. Sampel berupa ekstrak n-heksana kulit batang sebanyak 1.65 g diaplikasikan ke dalam kolom. Pemisahan komponen dilakukan dengan proses elusi gradien sesuai dengan peningkatan komposisi kepolaran menggunakan kombinasi eluen terbaik yang diperoleh. Eluat ditampung setiap 5 mL dalam tabung reaksi yang telah diberi nomor kemudian diuji dengan KLT menggunakan eluen terbaik. Noda pemisahan dideteksi di bawah lampu UV dengan λ 254 nm dan 366 nm. Eluat dengan nilai Rf dan pola KLT yang hampir sama digabungkan sebagai satu fraksi. Setiap fraksi dipekatkan kemudian dihitung rendemennya. Semua fraksi yang diperoleh digunakan untuk analisis tahap selanjutnya, yaitu uji antibakteri untuk menentukan fraksi teraktif dari ekstrak.
Penentuan Fraksi Teraktif Antibakteri Penentuan fraksi teraktif dilakukan dengan metode pengenceran menggunakan pelat mikro 96-sumur. Media yang digunakan adalah kaldu nutrien (NB) 1.3% (b/v). Media steril (95 µL), sampel (100 µL) atau kontrol (100 µL), dan suspensi bakteri (5 µL) diisikan ke dalam setiap sumur. Konsentrasi sampel yang digunakan adalah 1 mg/mL dalam DMSO. Kontrol positif yang digunakan adalah amoksisilin 0.005% (b/v), sementara kontrol negatif yang digunakan adalah DMSO. Pelat mikro diinkubasi selama 24 jam pada suhu 37°C, kemudian serapannya diukur menggunakan microplate reader pada panjang gelombang 480 nm. Fraksi yang menunjukkan aktivitas antibakteri (persentasi inhibisi) terbesar dipilih sebagai fraksi teraktif, untuk kemudian ditentukan nilai KHM dan KBM-nya.
Inhibisi (%) = B - [(S1– S0)] x 100% B
B : Serapan blanko (medium dan bakteri) S1 : Serapan medium dan bakteri dengan
penam-bahan sampel
S0 : Serapan medium dengan penambahan sampel
Penentuan Konsentrasi Hambat Minimum dan Konsentrasi Bunuh Minimum
Penentuan KHM dilakukan dengan metode pengenceran seperti pada penentuan fraksi teraktif. Konsentrasi fraksi teraktif disiapkan melalui pengenceran bertingkat, dengan konsentrasi 20.00, 10.00, 5.00, 2.00, 1.00, 0.50, 0.20, 0.10, 0.05, dan 0.02 mg/mL dalam DMSO. Kontrol positif yang digunakan adalah amoksisilin dengan konsentrasi 0.005 mg/mL. Pelat mikro selanjutnya diinkubasi selama 24 jam pada suhu 37°C, kemudian diukur dengan microplate reader. Konsentrasi terendah ekstrak dan kontrol positif yang tidak menunjukkan tanda pertumbuhan bakteri yang dapat diamati ditetapkan sebagai KHM. Setelah itu, 10 µL dari setiap sumur yang tidak menghasilkan tanda pertumbuhan bakteri pada pengukuran KHM disubkulturisasi ke 200 µL media baru yang steril. Konsentrasi terendah yang tidak menghasilkan tanda pertumbuhan bakteri pada media baru ditetapkan sebagai KBM (Batubara et al. 2009).
Uji Fitokimia
Uji fitokimia dilakukan terhadap ekstrak metanol kasar, ekstrak teraktif hasil ekstraksi cair-cair, dan fraksi teraktif hasil pemisahan dengan kromatografi kolom.
Uji Flavonoid. Sampel sebanyak 0.1 g ditambah 10 mL air panas, dididihkan selama 5 menit, kemudian disaring. Filtrat sebanyak 10 mL ditambahkan 0.5 g serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol. Campuran dikocok kuat. Uji positif ditandai dengan timbulnya warna merah, kuning, atau jingga pada lapisan amil alkohol.
Uji Saponin dan Tanin. Sampel sebanyak 0.1 g dilarutkan dengan 10 mL akuadestilata kemudian dididihkan selama 5 menit. Campuran disaring dan filtrat dibagi ke dalam 2 tabung reaksi. Bagian pertama digunakan untuk uji saponin; filtrat didiamkan sampai agak dingin kemudian dikocok kuat sampai timbul busa. Bila busa stabil dalam 10 menit, maka filtrat positif mengandung saponin. Bagian kedua digunakan untuk uji tanin; filtrat ditambahkan FeCl3 1%. Bila dihasilkan warna hijau, biru, atau hitam, maka filtrat positif mengandung tanin.
8
kuat kemudian lapisan asamnya dipindahkan ke tabung reaksi yang lain. Lapisan asam ini diteteskan pada pelat tetes dan ditambahkan pereaksi Meyer, Wagner, dan Dragendorff. Uji positif apabila terbentuk endapan dengan warna berturut-turut putih, cokelat, dan merah jingga.
Uji Triterpenoid dan Steroid. Sampel sebanyak 0.1 g dilarutkan dalam 25 mL etanol panas, disaring, dan residu ditambahkan dietil eter. Filtrat ditambahkan 3 tetes anhidrida asam asetat dan 1 tetes asam sulfat pekat secara berurutan. Larutan dikocok perlahan dan dibiarkan beberapa menit. Uji positif ditandai dengan munculnya warna merah atau ungu untuk triterpenoid dan hijau atau biru untuk steroid.
HASIL DAN PEMBAHASAN
Kadar Air Simplisia Berenuk Penentuan kadar air bertujuan mengetahui kandungan air pada sampel sebagai persen bahan keringnya, mengoreksi rendemen hasil ekstraksi, dan juga mengetahui masa simpan serbuk kering sampel. Suatu sampel dikatakan baik dan dapat disimpan dalam jangka waktu yang lama apabila memiliki kadar air <10% karena pada tingkat kadar air tersebut sampel relatif terhindar dari pencemaran yang disebabkan oleh mikrob penyebab kerusakan sampel (Winarno 1995). Pada penelitian ini, kadar air serbuk kering kulit batang berenuk diperoleh sebesar 11.87% (b/b) (Lampiran 2) Kadar air yang diperoleh bernilai >10%. Hal ini menunjukkan bahwa kandungan air pada serbuk kulit batang cukup tinggi sehingga sampel tidak baik disimpan dalam jangka waktu yang lama. Oleh karena itu, dalam penelitian ini, simplisia serbuk kulit batang langsung diekstraksi dua hari setelah simplisia serbuk diperoleh.
Analisis Hasil Ekstraksi
Ekstraksi serbuk kulit batang dilakukan dengan metode maserasi. Maserasi merupakan metode ekstraksi dengan cara perendaman dalam jangka waktu tertentu dengan pelarut yang sesuai. Metode ini merupakan metode sederhana yang dapat digunakan untuk mengekstrak komponen bahan alam dalam sampel yang tidak tahan maupun tahan terhadap pemanasan sehingga dapat menghindari kerusakan komponen senyawa yang tidak tahan terhadap pemanasan (Meloan 1999).
Bobot serbuk kulit batang yang dimaserasi adalah sebanyak 150 g. Maserat dan residu dipisahkan dengan penyaringan kemudian maserat dipekatkan dengan penguap putar. Rendemen ekstrak kulit batang diperoleh sebesar 28.37% (b/b kering) (Lampiran 3).
Ekstrak metanol kulit batang kemudian dilarutkan dalam air dan diekstraksi cair-cair menggunakan n-heksana dan etil asetat. Prinsip dasar ekstraksi cair-cair yaitu proses kontak antara pelarut yang satu dan yang lainnya yang tidak saling bercampur dan memiliki densitas yang berbeda sehingga akan terbentuk dua fasa beberapa saat setelah penambahan dan pengocokan pelarut dalam corong pisah. Hal ini menyebabkan terjadinya perpindahan massa dari pelarut asal ke pelarut pengekstrak (Mirwan dan Ariono 2009). Komponen polar akan terdistribusi pada air, komponen semipolar akan terdistribusi pada etil asetat, dan komponen nonpolar akan terdistribusi pada n-heksana.
Bobot ekstrak metanol kulit batang yang digunakan untuk ekstraksi cair-cair adalah 5.02 g. Rendemen fraksi n-heksana, etil asetat, dan air yang diperoleh berturut-turut sebesar 2.57% (b/b), 4.33% (b/b), dan 92.71% (b/b) (Lampiran 4).
Aktivitas Antibakteri
Aktivitas antibakteri ekstrak metanol kasar kulit batang berenuk dan semua fraksi hasil partisi diuji dengan metode difusi cakram. Keempat ekstrak disiapkan dengan konsentrasi 20 mg/mL dalam DMSO. Kontrol positif yang digunakan adalah amoksisilin 1% (b/v) dalam DMSO.
Aktivitas antibakteri dari ekstrak ditunjukkan dengan dihasilkannya daerah hambat pada medium yang telah dikulturisasi. Semakin luas daerah hambat yang dihasilkan, kekuatan antibakteri tersebut semakin besar. Diameter daerah hambat diukur menggunakan jangka sorong. Data yang diperoleh disajikan berupa nilai rerata dan simpangan bakunya.
8
kuat kemudian lapisan asamnya dipindahkan ke tabung reaksi yang lain. Lapisan asam ini diteteskan pada pelat tetes dan ditambahkan pereaksi Meyer, Wagner, dan Dragendorff. Uji positif apabila terbentuk endapan dengan warna berturut-turut putih, cokelat, dan merah jingga.
Uji Triterpenoid dan Steroid. Sampel sebanyak 0.1 g dilarutkan dalam 25 mL etanol panas, disaring, dan residu ditambahkan dietil eter. Filtrat ditambahkan 3 tetes anhidrida asam asetat dan 1 tetes asam sulfat pekat secara berurutan. Larutan dikocok perlahan dan dibiarkan beberapa menit. Uji positif ditandai dengan munculnya warna merah atau ungu untuk triterpenoid dan hijau atau biru untuk steroid.
HASIL DAN PEMBAHASAN
Kadar Air Simplisia Berenuk Penentuan kadar air bertujuan mengetahui kandungan air pada sampel sebagai persen bahan keringnya, mengoreksi rendemen hasil ekstraksi, dan juga mengetahui masa simpan serbuk kering sampel. Suatu sampel dikatakan baik dan dapat disimpan dalam jangka waktu yang lama apabila memiliki kadar air <10% karena pada tingkat kadar air tersebut sampel relatif terhindar dari pencemaran yang disebabkan oleh mikrob penyebab kerusakan sampel (Winarno 1995). Pada penelitian ini, kadar air serbuk kering kulit batang berenuk diperoleh sebesar 11.87% (b/b) (Lampiran 2) Kadar air yang diperoleh bernilai >10%. Hal ini menunjukkan bahwa kandungan air pada serbuk kulit batang cukup tinggi sehingga sampel tidak baik disimpan dalam jangka waktu yang lama. Oleh karena itu, dalam penelitian ini, simplisia serbuk kulit batang langsung diekstraksi dua hari setelah simplisia serbuk diperoleh.
Analisis Hasil Ekstraksi
Ekstraksi serbuk kulit batang dilakukan dengan metode maserasi. Maserasi merupakan metode ekstraksi dengan cara perendaman dalam jangka waktu tertentu dengan pelarut yang sesuai. Metode ini merupakan metode sederhana yang dapat digunakan untuk mengekstrak komponen bahan alam dalam sampel yang tidak tahan maupun tahan terhadap pemanasan sehingga dapat menghindari kerusakan komponen senyawa yang tidak tahan terhadap pemanasan (Meloan 1999).
Bobot serbuk kulit batang yang dimaserasi adalah sebanyak 150 g. Maserat dan residu dipisahkan dengan penyaringan kemudian maserat dipekatkan dengan penguap putar. Rendemen ekstrak kulit batang diperoleh sebesar 28.37% (b/b kering) (Lampiran 3).
Ekstrak metanol kulit batang kemudian dilarutkan dalam air dan diekstraksi cair-cair menggunakan n-heksana dan etil asetat. Prinsip dasar ekstraksi cair-cair yaitu proses kontak antara pelarut yang satu dan yang lainnya yang tidak saling bercampur dan memiliki densitas yang berbeda sehingga akan terbentuk dua fasa beberapa saat setelah penambahan dan pengocokan pelarut dalam corong pisah. Hal ini menyebabkan terjadinya perpindahan massa dari pelarut asal ke pelarut pengekstrak (Mirwan dan Ariono 2009). Komponen polar akan terdistribusi pada air, komponen semipolar akan terdistribusi pada etil asetat, dan komponen nonpolar akan terdistribusi pada n-heksana.
Bobot ekstrak metanol kulit batang yang digunakan untuk ekstraksi cair-cair adalah 5.02 g. Rendemen fraksi n-heksana, etil asetat, dan air yang diperoleh berturut-turut sebesar 2.57% (b/b), 4.33% (b/b), dan 92.71% (b/b) (Lampiran 4).
Aktivitas Antibakteri
Aktivitas antibakteri ekstrak metanol kasar kulit batang berenuk dan semua fraksi hasil partisi diuji dengan metode difusi cakram. Keempat ekstrak disiapkan dengan konsentrasi 20 mg/mL dalam DMSO. Kontrol positif yang digunakan adalah amoksisilin 1% (b/v) dalam DMSO.
Aktivitas antibakteri dari ekstrak ditunjukkan dengan dihasilkannya daerah hambat pada medium yang telah dikulturisasi. Semakin luas daerah hambat yang dihasilkan, kekuatan antibakteri tersebut semakin besar. Diameter daerah hambat diukur menggunakan jangka sorong. Data yang diperoleh disajikan berupa nilai rerata dan simpangan bakunya.
sebagai antibakteri sangat kuat (Suryawiria 1978).
Pengujian aktivitas antibakteri dilakukan terhadap dua jenis isolat bakteri, yaitu S. aureus (Gram positif) dan E. coli (Gram negatif). Kedua jenis bakteri tersebut dipilih karena merupakan bakteri yang paling umum dijumpai sebagai penyebab beberapa penyakit pada manusia dan hewan, juga penyebab kerusakan pada beberapa jenis bahan pangan.
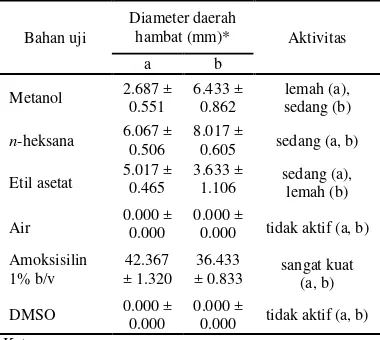
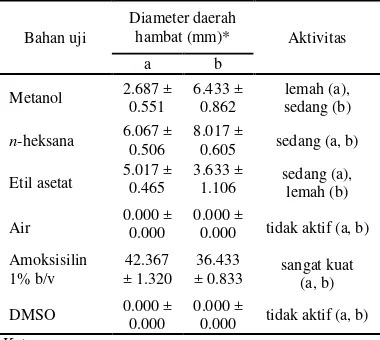
Hasil pengujian aktivitas antibakteri disajikan dalam Tabel 1. Tabel tersebut menunjukkan diameter daerah hambat yang dihasilkan oleh setiap ekstrak. Berdasarkan tabel, terlihat bahwa ekstrak metanol memiliki aktivitas antibakteri yang lebih besar terhadap
E. coli dibandingkan terhadap S. aureus.Dari ketiga macam fraksi hasil partisi, fraksi n -heksana memiliki rerata aktivitas paling besar terhadap kedua bakteri. Kontrol positif amoksisilin 1% (b/v) memberikan aktivitas yang sangat besar terhadap bakteri S. aureus
dan E. coli, dengan diameter daerah hambat yang dihasilkan berturut-turut 42.367 mm dan 36.433 mm sehingga dikategorikan sebagai antibakteri dengan aktivitas yang sangat kuat.
Tabel 1 Aktivitas antibakteri ekstrak kulit batang berenuk
Bahan uji
Diameter daerah
hambat (mm)* Aktivitas
a b
Metanol 2.687 ± 0.551
6.433 ± 0.862
lemah (a), sedang (b)
n-heksana 6.067 ± 0.506
8.017 ±
0.605 sedang (a, b) Etil asetat 5.017 ± 0.465 3.633 ± 1.106 sedang (a),
lemah (b)
Air 0.000 ± 0.000 0.000 ± 0.000 tidak aktif (a, b) Amoksisilin
1% b/v
42.367 ± 1.320
36.433
± 0.833 sangat kuat (a, b)
DMSO 0.000 ± 0.000 0.000 ± 0.000 tidak aktif (a, b) Keterangan:
a: Staphylococcus aureus b: Escherichiacoli
*: nilai rerata 3 kali ulangan berikut simpangan bakunya Kontrol negatif DMSO dan ekstrak air tidak memberikan aktivitas pada kedua jenis bakteri uji. Berdasarkan Tabel 1 juga terlihat bahwa aktivitas antibakteri ekstrak masih kurang kuat dibandingkan kontrol positif, meskipun konsentrasi kontrol positif yang digunakan dalam pengujian hanya sebesar seperempat dari konsentrasi ekstrak yang diuji. Namun demikian, secara umum ekstrak tetap
dapat dikategorikan memiliki aktivitas antibakteri.
Struktur dinding sel S. aureus dan bakteri Gram positif lainnya hampir sama, yaitu memiliki lapisan peptidoglikan yang tebal dan khas. Struktur dinding sel E. coli dan bakteri Gram negatif lainnya juga hampir sama, yaitu memiliki lapisan peptidoglikan yang lebih tipis dengan membran luar yang sedikit lebih tebal dibanding bakteri Gram positif. Oleh karena hasil pengujian menunjukkan bahwa ekstrak kulit batang berenuk memiliki aktivitas antibakteri baik terhadap S. aureus
maupun E. coli, maka dapat dikatakan ekstrak kulit batang berenuk juga dapat bekerja sebagai antibakteri terhadap jenis bakteri Gram positif dan negatif lainnya, mengingat adanya kemiripan struktur dinding sel antarsesama bakteri dalam satu golongan Gram. Dengan demikian, ekstrak kulit batang berenuk memiliki spektrum antibakteri yang luas.
Berdasarkan hasil pengujian tersebut, ekstrak n-heksana kulit batang kemudian dipilih sebagai ekstrak teraktif yang digunakan untuk analisis tahap selanjutnya, yaitu fraksinasi menggunakan kromatografi kolom.
Hasil Penentuan Eluen Terbaik dengan Kromatografi Lapis Tipis (KLT) Ekstrak n-heksana kulit batang berenuk dianalisis dengan KLT menggunakan fase diam silika G60 F254 dari Merck untuk menentukan komposisi eluen terbaik yang akan digunakan untuk fraksinasi meng-gunakan kromatografi kolom. Beberapa pelarut yang digunakan sebagai eluen adalah
10
Gambar 4 Profil kromatogram fraksi n-heksana kulit batang dengan berbagai eluen: nheksana (1), diklorometana (2), kloroform (3), etil asetat (4), aseton (5), metanol (6),dan eluen campuran etil asetat:diklorometana 7:3, 4:1, dan 9:1 (7, 8, dan 9).
Gambar 4 menunjukkan bahwa eluen tunggal diklorometana menghasilkan 5 noda namun belum terpisah dengan baik. Sementara itu, etil asetat menghasilkan 5 noda yang cukup terpisah namun noda yang dihasilkan masih ada yang terlalu dekat dengan garis depan eluen sehingga profil pemisahannya belum cukup baik. Dengan demikian, dicari komposisi eluen campuran antara diklorometana dan etil asetat dengan tujuan agar mampu memisahkan noda-noda dengan lebih baik. Berdasarkan hasil pencarian eluen campuran terbaik, diperoleh komposisi eluen etil asetat:diklorometana 9:1 sebagai eluen terbaik karena menurut Skoog
et al. (2004), eluen terbaik adalah eluen yang menghasilkan jumlah noda terbanyak dan terpisah. Data lengkap hasil analisis pemilihan eluen terbaik dengan KLT untuk ekstrak n -heksana kulit batang disajikan dalam Lampiran 5. Hasil analisis KLT kemudian dijadikan dasar penggunaan etil asetat dan diklorometana sebagai eluen pada proses fraksinasi dan pengelompokan fraksi hasil pemisahan ekstrak n-heksana kulit batang berenuk.
Fraksinasi dengan Kromatografi Kolom Pemisahan secara kromatografi kolom bertujuan mengetahui jumlah fraksi dari komponen-komponen kimia yang dapat terpisah untuk kemudian dinalisis kandungan senyawa aktifnya (Hayani 2007). Pemisahan ekstrak n-heksana kulit batang berenuk dilakukan dengan elusi gradien menggunakan komposisi eluen campuran etil asetat dan diklorometana sesuai peningkatan kepolaran. Elusi gradien ini diharapkan dapat
memisahkan komponen-komponen ekstrak dengan lebih baik.
Fraksi-fraksi yang terpisah dan keluar dari kolom ditampung setiap 5 mL pada tabung reaksi. Hasil fraksinasi ekstrak n-heksana kulit batang ditampung ke dalam 86 tabung reaksi yang berbeda kemudian dilakukan pengelompokan fraksi menggunakan KLT. Berdasarkan hasil pengelompokan fraksi diperoleh 10 fraksi. Masing-masing fraksi menunjukkan komponen yang berbeda yang ditunjukkan oleh pola Rf yang berbeda pula (Lampiran 6).
Fraksi Teraktif Antibakteri
Fraksi teraktif diketahui dengan cara menguji aktivitas antibakteri setiap fraksi hasil kromatografi kolom dengan konsentrasi masing-masing sebesar 1 mg/mL. Aktivitas antibakteri dilihat dari persentase inhibisi yang dihasilkan oleh masing-masing fraksi terhadap kedua jenis bakteri uji. Oleh karena semakin besar persentase inhibisi menunjukkan semakin besar pula aktivitas antibakteri, maka fraksi yang menunjukkan persentase inhibisi terbesar dipilih sebagai fraksi teraktif.
Hasil penentuan fraksi teraktif ditunjukkan pada Gambar 5. Berdasarkan gambar, terlihat bahwa fraksi teraktif hasil kromatografi kolom fraksi n-heksana kulit batang adalah fraksi II. Hal ini ditunjukkan dengan nilai persentase inhibisinya yang paling tinggi diantara fraksi-fraksi lainnya, yaitu sebesar 35.86% terhadap bakteri S. aureus dan 63.01% terhadap bakteri
E. coli. (Lampiran 7).
Gambar 5 Rerata persentase inhibisi hasil fraksinasi kromatografi kolom dengan elusi gradien terhadap bakteri S. aureus ( ) dan E. coli ( ). Kiri ke kanan: Fraksi I s.d. X dan kontrol positif amoksisilin 0.005%. Berdasarkan hasil tersebut, fraksi II diduga mengandung komponen yang paling aktif
0 10 20 30 40 50 60 70
I II III IV V VI VII VIII IX X Am
sebagai antibakteri. Oleh karena itu, fraksi II dipilih untuk analisis tahap selanjutnya, yaitu penentuan KHM dan KBM.
Konsentrasi Hambat Minimum dan Konsentrasi Bunuh Minimum Konsentrasi hambat minimum (KHM) merupakan konsentrasi terendah ekstrak yang tidak menunjukkan tanda pertumbuhan bakteri yang dapat teramati. Sementara itu, konsentrasi bunuh minimum (KBM) merupakan konsentrasi terendah ekstrak yang tidak menghasilkan tanda pertumbuhan bakteri setelah subkulturisasi kedua pada media steril yang baru (Batubara et al. 2009).
Hasil pengujian menunjukkan bahwa fraksi teraktif kulit batang berenuk memiliki nilai KHM terhadap bakteri S. aureus dan E. coli masing-masing sebesar 0.20 dan 0.10 mg/mL (Lampiran 8). Nilai KBM fraksi teraktif terhadap kedua bakteri tersebut masing-masing bernilai 10.00 dan 5.00 mg/mL (Lampiran 9). Dengan demikian, pada konsentrasi sebesar 0.20 dan 0.10 mg/mL, fraksi teraktif ekstrak n-heksana kulit batang berenuk telah mampu menghambat pertumbuhan bakteri S. aureus dan E. coli; dan pada konsentrasi 10.00 dan 5.00 mg/mL, fraksi teraktif telah mampu membunuh kedua jenis bakteri uji tersebut.
Hasil Uji Fitokimia
Uji fitokimia merupakan uji kualitatif yang digunakan untuk mengetahui kandungan senyawa metabolit sekunder yang terdapat dalam sampel. Dalam penelitian ini, uji fitokimia dilakukan terhadap ekstrak metanol kasar, ekstrak teraktif hasil partisi, dan fraksi teraktif hasil fraksinasi dengan kromatografi kolom.
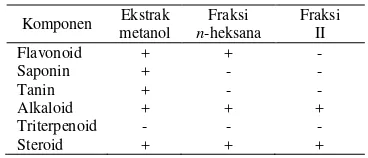
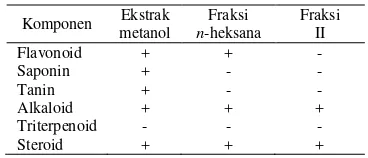
Hasil uji fitokimia terhadap ekstrak metanol, ekstrak teraktif, dan fraksi teraktif kulit batang berenuk ditunjukkan pada tabel berikut.
Tabel 2 Hasil uji fitokimia
Komponen Ekstrak metanol
Fraksi
n-heksana
Fraksi II
Flavonoid + + -
Saponin + - -
Tanin + - -
Alkaloid + + +
Triterpenoid - - -
Steroid + + +
Keterangan:
+ : terdeteksi komponen - : tidak terdeteksi komponen
Berdasarkan uji fitokimia, diketahui bahwa fraksi teraktif ekstrak n-heksana kulit batang berenuk mengandung senyawa golongan alkaloid dan steroid. Golongan alkaloid dikenal karena toksisitasnya, namun tidak semua senyawa alkaloid bersifat toksik. Beberapa diantaranya telah digunakan sebagai obat analgesik, antiplasmodik, dan memiliki efek bakterisidal (Ogbuagu 2008). Steroid juga merupakan senyawa metabolit sekunder yang telah dikenal berfungsi sebagai penolak serangga dan serangan mikroba (Harborne 1987).
Mekanisme kerja alkaloid sebagai antibakteri diprediksi melalui penghambatan sintesis dinding sel yang akan menyebabkan lisis pada sel sehingga sel akan mati (Lamothe
et al. 2009). Variasi kerentanan organisme uji dapat diakibatkan oleh faktor intrinsik yang berkaitan dengan permeabilitas permukaan sel terhadap ekstrak (Suffredini et al. 2004). Steroid dapat berinteraksi dengan membran fosfolipid sel yang bersifat impermeabel terhadap senyawa-senyawa lipofilik sehingga menyebabkan integritas membran menurun, morfologi membran sel berubah, dan akhirnya dapat menyebabkan membran sel rapuh dan lisis (Bangham dan Horne 2006).
Adanya komponen asing dalam membran juga dapat menyebabkan pembentukan dinding sel akan terhalangi atau terbentuk dinding sel yang rapuh, yang selanjutnya akan menyebabkan lisis dan kematian sel (Morin dan Gorman 1995). Ketidakstabilan pada dinding sel dan membran sitoplasma bakteri menyebabkan fungsi permeabilitas selektif, fungsi pengangkutan aktif, dan pengendalian susunan protein dari sel bakteri menjadi terganggu. Gangguan integritas sitoplasma berakibat pada lolosnya makromolekul dan ion dari sel. Dengan demikian, sel bakteri menjadi kehilangan bentuk dan terjadilah lisis (Pelczar dan Chan 1986).
SIMPULAN DAN SARAN
Simpulan
11
sebagai antibakteri. Oleh karena itu, fraksi II dipilih untuk analisis tahap selanjutnya, yaitu penentuan KHM dan KBM.
Konsentrasi Hambat Minimum dan Konsentrasi Bunuh Minimum Konsentrasi hambat minimum (KHM) merupakan konsentrasi terendah ekstrak yang tidak menunjukkan tanda pertumbuhan bakteri yang dapat teramati. Sementara itu, konsentrasi bunuh minimum (KBM) merupakan konsentrasi terendah ekstrak yang tidak menghasilkan tanda pertumbuhan bakteri setelah subkulturisasi kedua pada media steril yang baru (Batubara et al. 2009).
Hasil pengujian menunjukkan bahwa fraksi teraktif kulit batang berenuk memiliki nilai KHM terhadap bakteri S. aureus dan E. coli masing-masing sebesar 0.20 dan 0.10 mg/mL (Lampiran 8). Nilai KBM fraksi teraktif terhadap kedua bakteri tersebut masing-masing bernilai 10.00 dan 5.00 mg/mL (Lampiran 9). Dengan demikian, pada konsentrasi sebesar 0.20 dan 0.10 mg/mL, fraksi teraktif ekstrak n-heksana kulit batang berenuk telah mampu menghambat pertumbuhan bakteri S. aureus dan E. coli; dan pada konsentrasi 10.00 dan 5.00 mg/mL, fraksi teraktif telah mampu membunuh kedua jenis bakteri uji tersebut.
Hasil Uji Fitokimia
Uji fitokimia merupakan uji kualitatif yang digunakan untuk mengetahui kandungan senyawa metabolit sekunder yang terdapat dalam sampel. Dalam penelitian ini, uji fitokimia dilakukan terhadap ekstrak metanol kasar, ekstrak teraktif hasil partisi, dan fraksi teraktif hasil fraksinasi dengan kromatografi kolom.
Hasil uji fitokimia terhadap ekstrak metanol, ekstrak teraktif, dan fraksi teraktif kulit batang berenuk ditunjukkan pada tabel berikut.
Tabel 2 Hasil uji fitokimia
Komponen Ekstrak metanol
Fraksi
n-heksana
Fraksi II
Flavonoid + + -
Saponin + - -
Tanin + - -
Alkaloid + + +
Triterpenoid - - -
Steroid + + +
Keterangan:
+ : terdeteksi komponen - : tidak terdeteksi komponen
Berdasarkan uji fitokimia, diketahui bahwa fraksi teraktif ekstrak n-heksana kulit batang berenuk mengandung senyawa golongan alkaloid dan steroid. Golongan alkaloid dikenal karena toksisitasnya, namun tidak semua senyawa alkaloid bersifat toksik. Beberapa diantaranya telah digunakan sebagai obat analgesik, antiplasmodik, dan memiliki efek bakterisidal (Ogbuagu 2008). Steroid juga merupakan senyawa metabolit sekunder yang telah dikenal berfungsi sebagai penolak serangga dan serangan mikroba (Harborne 1987).
Mekanisme kerja alkaloid sebagai antibakteri diprediksi melalui penghambatan sintesis dinding sel yang akan menyebabkan lisis pada sel sehingga sel akan mati (Lamothe
et al. 2009). Variasi kerentanan organisme uji dapat diakibatkan oleh faktor intrinsik yang berkaitan dengan permeabilitas permukaan sel terhadap ekstrak (Suffredini et al. 2004). Steroid dapat berinteraksi dengan membran fosfolipid sel yang bersifat impermeabel terhadap senyawa-senyawa lipofilik sehingga menyebabkan integritas membran menurun, morfologi membran sel berubah, dan akhirnya dapat menyebabkan membran sel rapuh dan lisis (Bangham dan Horne 2006).
Adanya komponen asing dalam membran juga dapat menyebabkan pembentukan dinding sel akan terhalangi atau terbentuk dinding sel yang rapuh, yang selanjutnya akan menyebabkan lisis dan kematian sel (Morin dan Gorman 1995). Ketidakstabilan pada dinding sel dan membran sitoplasma bakteri menyebabkan fungsi permeabilitas selektif, fungsi pengangkutan aktif, dan pengendalian susunan protein dari sel bakteri menjadi terganggu. Gangguan integritas sitoplasma berakibat pada lolosnya makromolekul dan ion dari sel. Dengan demikian, sel bakteri menjadi kehilangan bentuk dan terjadilah lisis (Pelczar dan Chan 1986).
SIMPULAN DAN SARAN
Simpulan
fraksi teraktif sebagai antibakteri. Nilai KHM fraksi teraktif, yaitu sebesar 0.20 dan 0.10 mg/mL terhadap bakteri S. aureus dan E. coli, dengan nilai KBM terhadap kedua bakteri masing-masing sebesar 10.00 dan 5.00 mg/mL. Berdasarkan uji fitokimia, dapat disimpulkan bahwa senyawa aktif yang terkandung dalam fraksi teraktif adalah golongan alkaloid dan steroid.
Saran
Penelitian lebih lanjut perlu dilakukan untuk memurnikan dan menentukan senyawa aktif yang terkandung dalam fraksi II dari fraksi hasil partisi n-heksana kulit batang berenuk. Dengan demikian, dapat diteliti lebih lanjut aktivitas antibakteri dari senyawa yang terkandung dalam fraksi teraktif tersebut.
DAFTAR PUSTAKA
Bangham AD, Horne RW. 1962. Action of saponins on biological cell membranes.
Nature 196: 952-953.
Batubara I, Mitsunaga T, Ohashi H. 2009. Screening antiacne potency of medicinal plants: antibacterial, lipase inhibition, and antioxidant activities. J. Wood. Sci 55: 230-235.
Buckle KA et al. 1985. Ilmu Pangan. Purnomo H, Adiono, penerjemah. Jakarta: UI Press.
Burkill HM. 1985. The Useful Plants of Tropical West Africa 2nd Ed. London: Kew Royal Botanical Garden.
Day RA, Underwood AL. 2001. Analisis Kimia Kuantitatif. Ed ke-6. Sopyan I, penerjemah. Jakarta: Erlangga. Terjemahan dari: Quantitative Analysis. Dwidjoseputro. 1990. Dasar-Dasar
Mikro-biologi. Ed ke-11. Jakarta: Djam-batan. Gan S et al. 1980. Farmakologi dan Terapi.
Ed ke-2. Jakarta: Bagian Farmakologi Fakultas Kedokteran Universitas Indonesia.
Harborne JB. 1987. Metode Fitokimia:
Penuntun Cara Modern Menganalisa
Tumbuhan. Padmawinata K, penerjemah. Bandung: Penerbit ITB. Terjemahan dari:
Phytochemical Methods: A Guide to Modern Techniques of Plant Analysis.
Harvey D. 2000. Modern Analytical Chemistry. New York: McGraw-Hill. Hlm 547-549.
Hayani E. 2007. Pemisahan rimpang temukunci secara kromatografi kolom.
Buletin Teknik Pertanian 12(1): 35-37. Heyne K. 1987. Tumbuhan Berguna
Indonesia Jilid III. Terjemahan Balitbang Kehutanan. Jakarta: Departemen Kehutanan.
Houghton PJ, Raman A. 1998. Laboratory handbook for the Fractionation of Natural Ekstract. London: Chapman & Hall. hlm 94-96.
Jawetz E, Malnick JL, Adelberg EA. 2004.
Medical Microbiology. Ed. Ke-23. New York: McGraw-Hill.
Khopkar SM. 2003. Konsep Dasar Kimia Analitik. Jakarta: UI Press.
Lamothe RG et al. 2009. Plant antimicrobial agents and their effects on plant and human pathogens. Int. J. Mol. Sci 10: 3400-3419.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Padmawinata K, penerjemah. Bandung: ITB. Terjemahan dari:
Techniques of Flavonoid Identifications. McKanne L, Kandel J. 1996. Microbiology:
EssentialsandApplications. Ed ke-2. New York: McGraw Hill.
Meloan CE. 1999. Chemical Separation. New York: J Willey.
Michael A. 2004. Trees, Shrubs, and Lianas of West Africa Dry Zones. Gambia GMBH, MNHN: Grad Margraf.
Mirwan A, Ariono D. 2009. Dinamika tetes ekstraksi cair-cair dalam kolom isian dan tanpa isian. Prosiding Seminar Nasional Teknik Kimia Indonesia. Bandung.
Morin RB, Gorman M. 1995. Kimia dan Biologi Antibiotik β-Lactam. Ed ke-3. Mulyani S, penerjemah. Semarang: IKIP Semarang Press. Terjemahan dari
Chemistry and Biology of β-Lactam Antibiotics.
Morton JF. 1981. Atlas of Medicinal Plants of Middle America: Bahamas to Yucatan. Illinois: Springfield.
FRAKSINASI KOMPONEN AKTIF ANTIBAKTERI
EKSTRAK KULIT BATANG TANAMAN
BERENUK (
Crescentia cujete
L)
AHMAD YANI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
fraksi teraktif sebagai antibakteri. Nilai KHM fraksi teraktif, yaitu sebesar 0.20 dan 0.10 mg/mL terhadap bakteri S. aureus dan E. coli, dengan nilai KBM terhadap kedua bakteri masing-masing sebesar 10.00 dan 5.00 mg/mL. Berdasarkan uji fitokimia, dapat disimpulkan bahwa senyawa aktif yang terkandung dalam fraksi teraktif adalah golongan alkaloid dan steroid.
Saran
Penelitian lebih lanjut perlu dilakukan untuk memurnikan dan menentukan senyawa aktif yang terkandung dalam fraksi II dari fraksi hasil partisi n-heksana kulit batang berenuk. Dengan demikian, dapat diteliti lebih lanjut aktivitas antibakteri dari senyawa yang terkandung dalam fraksi teraktif tersebut.
DAFTAR PUSTAKA
Bangham AD, Horne RW. 1962. Action of saponins on biological cell membranes.
Nature 196: 952-953.
Batubara I, Mitsunaga T, Ohashi H. 2009. Screening antiacne potency of medicinal plants: antibacterial, lipase inhibition, and antioxidant activities. J. Wood. Sci 55: 230-235.
Buckle KA et al. 1985. Ilmu Pangan. Purnomo H, Adiono, penerjemah. Jakarta: UI Press.
Burkill HM. 1985. The Useful Plants of Tropical West Africa 2nd Ed. London: Kew Royal Botanical Garden.
Day RA, Underwood AL. 2001. Analisis Kimia Kuantitatif. Ed ke-6. Sopyan I, penerjemah. Jakarta: Erlangga. Terjemahan dari: Quantitative Analysis. Dwidjoseputro. 1990. Dasar-Dasar
Mikro-biologi. Ed ke-11. Jakarta: Djam-batan. Gan S et al. 1980. Farmakologi dan Terapi.
Ed ke-2. Jakarta: Bagian Farmakologi Fakultas Kedokteran Universitas Indonesia.
Harborne JB. 1987. Metode Fitokimia:
Penuntun Cara Modern Menganalisa
Tumbuhan. Padmawinata K, penerjemah. Bandung: Penerbit ITB. Terjemahan dari:
Phytochemical Methods: A Guide to Modern Techniques of Plant Analysis.
Harvey D. 2000. Modern Analytical Chemistry. New York: McGraw-Hill. Hlm 547-549.
Hayani E. 2007. Pemisahan rimpang temukunci secara kromatografi kolom.
Buletin Teknik Pertanian 12(1): 35-37. Heyne K. 1987. Tumbuhan Berguna
Indonesia Jilid III. Terjemahan Balitbang Kehutanan. Jakarta: Departemen Kehutanan.
Houghton PJ, Raman A. 1998. Laboratory handbook for the Fractionation of Natural Ekstract. London: Chapman & Hall. hlm 94-96.
Jawetz E, Malnick JL, Adelberg EA. 2004.
Medical Microbiology. Ed. Ke-23. New York: McGraw-Hill.
Khopkar SM. 2003. Konsep Dasar Kimia Analitik. Jakarta: UI Press.
Lamothe RG et al. 2009. Plant antimicrobial agents and their effects on plant and human pathogens. Int. J. Mol. Sci 10: 3400-3419.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Padmawinata K, penerjemah. Bandung: ITB. Terjemahan dari:
Techniques of Flavonoid Identifications. McKanne L, Kandel J. 1996. Microbiology:
EssentialsandApplications. Ed ke-2. New York: McGraw Hill.
Meloan CE. 1999. Chemical Separation. New York: J Willey.
Michael A. 2004. Trees, Shrubs, and Lianas of West Africa Dry Zones. Gambia GMBH, MNHN: Grad Margraf.
Mirwan A, Ariono D. 2009. Dinamika tetes ekstraksi cair-cair dalam kolom isian dan tanpa isian. Prosiding Seminar Nasional Teknik Kimia Indonesia. Bandung.
Morin RB, Gorman M. 1995. Kimia dan Biologi Antibiotik β-Lactam. Ed ke-3. Mulyani S, penerjemah. Semarang: IKIP Semarang Press. Terjemahan dari
Chemistry and Biology of β-Lactam Antibiotics.
Morton JF. 1981. Atlas of Medicinal Plants of Middle America: Bahamas to Yucatan. Illinois: Springfield.
13
(Crescentia cujete) fruit pulp. J. Food Tech 6(6): 267-270.
Parthasarathy S et al. 2009. Evaluation of antioxidant and antimicrobial activities of aqueous, methanolic, and alkaloid extracts from Mitragyna speciosa (Rubiaceae Family) leaves. Molecules 14: 3964-3974. Pelczar MJ, Chan ECS. 1986. Dasar-Dasar
Mikrobiologi 1. Ed ke-1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah. Jakarta: UI Press. Terjemahan dari Elements of Microbiology.
Rahayu M, Sunarti S, Sulistiarini D, Prawiroatmodjo S. 2006. Pemanfaatan tumbuhan obat secara tradisional oleh masyarakat lokal di Pulau Wawonii, Sulawesi Tenggara. Biodiversitas 7(3): 245-250.
Rasadah MA, Houghton PJ. 1998. Antimicrobial activity of some species of Bignoniaceae. ASEAN Review of
Biodiversity and Environmental
Conversation 3: 1-3.
Rybak MJ, LaPlante KL. 2005. Community Associated Methicillin-Resistant
Staphylococcus aureus. Pharmaco-therapy
25(1): 74-85.
Schunack W, Mayer K, Hawke M. 1990.
Senyawa Obat. Ed ke-2. Wattimena JR, penerjemah. Yogyakarta: Gajah Mada University Press. Terjemahan dari:
Medical Compound.
Skoog DA, Holler PJ, Nieman TA. 2004.
Principles of Instrumental Analysis. Ed ke-5. Philadelphia: Hartcaurt Brace. hlm 715-730.
Sudjadi. 1986. Metode Pemisahan. Yogyakarta: UGM Press.
Suffredini IB et al. 2004. Screening of antibacterial activity extracts obtained from plants native to Brazilian Amazon Rain Forest. Braz. J. Med. Ethnopharmacol 62: 183-193.
Suryawiria U. 1978. Mikroba Lingkungan.Ed ke-2. Bandung: Institut Teknologi Bandung.
BERENUK (
Crescentia cujete
L)
AHMAD YANI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
AHMAD YANI. Fraksinasi Komponen Aktif Antibakteri Ekstrak Kulit Batang
Tanaman
Berenuk
(
Crescentia
cujete
L).
Dibimbing
oleh
ELLY
SURADIKUSUMAH dan SURYANI.
Penelitian ini bertujuan menentukan fraksi teraktif antibakteri ekstrak kulit
batang tanaman berenuk, menentukan nilai konsentrasi hambat minimum (KHM)
dan konsentrasi bunuh minimum (KBM) dari fraksi teraktif tersebut, dan
mengidentifikasi kandungan fitokimianya. Uji pendahuluan antibakteri ekstrak
metanol kasar dan fraksi hasil partisinya (fraksi
n
-heksana, etil asetat, dan air)
dilakukan dengan metode difusi cakram terhadap bakteri
Staphylococcus a