PENDAHULUAN
Latar Belakang
Peningkatan populasi masyarakat berdampak pada tuntutan akan ketersediaan sumber pangan yang juga semakin meningkat. Hal tersebut merupakan peluang untuk mengembangkan potensi domba lokal di Indonesia. Domba lokal merupakan ternak yang memiliki sifat prolifik, yang mempunyai kemampuan melahirkan anak lebih dari satu ekor dalam sekali kelahiran. Akan tetapi menurut Tiesnamurti (1992), persentase kematian pada anak domba prasapih semakin meningkat seiring dengan semakin banyaknya jumlah anak yang dilahirkan. Hal tersebut merupakan suatu permasalahan dalam meningkatkan jumlah ternak domba lokal di Indonesia.
Pemberian asam lemak, terutama asam lemak tak jenuh dalam pakan sangat dibutuhkan oleh domba betina calon induk. Asam lemak tak jenuh rantai panjang EPA (asam eikosapentaenoat) dan AA (asam arakhidonat) merupakan prekursor dari prostaglandin, prostacycline, thromboxane, dan leukotriene. Prostaglandin memiliki peran yang penting dalam beberapa aspek reproduksi, antara lain ovulasi, estrus, kelangsungan hidup embrio dan proses kelahiran (Abayasekara dan Wathles, 1999). Wathes et al. (2007) menyatakan bahwa pemberian pakan yang mengandung asam lemak tak jenuh yaitu asam linoleat akan meningkatkan produksi prostaglandin endometrial dan plasenta pada domba, serta pemberian asam linolenat menurunkan level progesteron pada sapi. Prostaglandin yang diproduksi akan melisiskan corpus luteum (CL), sehingga level progesteron menurun. Pada saat tersebut, hipotalamus akan mensekresikan folicle stimulating hormone (FSH) yang akan mengakibatkan berkembangnya folikel di ovarium. Perkembangan folikel mengakibatkan diproduksinya hormon estrogen, yang akan mempercepat birahi pada domba. Penambahan minyak dalam pakan akan turut meningkatkan kandungan lemak pakan, yang berfungsi untuk mencukupi kebutuhan ternak akan pemberian sumber energi (Parakkasi, 1999). Pada domba betina, pemberian energi yang cukup sangat penting dalam meningkatkan bobot badan yang akan berdampak pada percepatan pencapaian bobot dewasa kelamin. Kekurangan energi pada ternak muda akan menghambat pertumbuhan dan pencapaian dewasa kelamin (Sudarman et al., 2008).
linoleat (Ducket et al., 2002), sementara minyak ikan lemuru mengandung 20,72% asam linolenat dan 22,83% asam eikosapentanoat (EPA) (Yogaswara, 2008). Pada hewan ruminansia yang memiliki sistem pencernaan fermentatif, terjadi proses biohidrogenasi oleh mikroorganisme rumen, yang mengubah asam lemak tak jenuh (sempurna maupun sebagian) dari pakan menjadi asam lemak jenuh (Parakkasi, 1999). Untuk mencegah terjadinya biohidrogenasi oleh mikroba rumen maka perlu dilakukan proteksi terhadap pakan yang diberikan (Tiven et al., 2011).
Pemberian lemak pada pakan ruminansia perlu diperhatikan, karena menurut Adawiah et al. (2007), lemak yang tinggi akan mengganggu sistem fermentasi dan populasi mikroba dalam rumen. Proses biohidrogenasi asam lemak tak jenuh menjadi asam lemak jenuh di dalam rumen juga diduga akan merubah pola fermentasi dalam rumen. Terganggunya sistem dan berubahnya pola fermentasi di rumen juga dikhawatirkan dapat menyebabkan produk fermentasi VFA dan NH3 dalam rumen ikut terhambat. Jalč et al. (2006) menyebutkan bahwa penggunaan lemak dalam pakan ruminansia perlu diwaspadai karena lemak dapat memberikan efek negatif yaitu membatasi sintesis yang dilakukan oleh mikroba rumen. Pemberian minyak ke dalam pakan dapat digunakan untuk menilai efisiensi penggunaan nitrogen (N), apakah energi yang dibutuhkan oleh ternak telah tercukupi ataukah ternak harus merombak protein tubuhnya menjadi sumber energi. Kecukupan asam lemak esensial yang termasuk dalam asam lemak tak jenuh juga harus diperhatikan karena McDonald et al. (2002) menyatakan bahwa defisiensi asam lemak tak jenuh dalam pakan dapat menurunkan nilai retensi N dalam tubuh. Adanya N yang tersimpan dalam tubuh diharapkan dapat menghasilkan pertambahan bobot badan yang akan mempercepat bobot dewasa kelamin. Oleh karena itu, perlu dilakukan suatu pengamatan mengenai pengaruh pemberian sumber asam lemak tak jenuh yang berbeda terhadap populasi protozoa dan produk fermentasi dalam rumen, besarnya ekskresi turunan purin (alantoin) dalam urin, dan neraca N dalam tubuh.
Tujuan
TINJAUAN PUSTAKA
Domba Lokal
Domba lokal merupakan domba asli Indonesia yang mempunyai daya adaptasi yang baik terhadap iklim tropis dan makanan yang kualitasnya rendah, serta dapat beranak sepanjang tahun (FAO, 2002). Menurut Blakely dan Bade (1998), domba dapat diklasifikasikan sebagai berikut:
Kingdom : Animalia (hewan)
Phylum : Chordata (hewan bertulang belakang) Kelas : Mammalia (hewan menyusui)
Ordo : Artiodactyla (hewan berkuku genap) Family : Bovidae
Genus : Ovis Spesies : Ovis aries
Domba memiliki sifat prolifik, yaitu mempunyai kemampuan melahirkan anak hingga empar ekor dalam satu kali kelahiran (Inounu, 1991). Sifat-sifat prolifik pada domba menurut Tiesnamurti (1992) tercantum pada Tabel 1.
Tabel 1. Sifat-sifat Domba Prolifik
Sifat Tunggal Kembar Dua Kembar > 3
Rata-rata bobot lahir (kg) 2,6 1,8 1,2
Rata-rata bobot sapih per ekor (kg) 15,2 10,3 8,1
Kematian prasapih (%) 10 17 30
Laju pertumbuhan prasapih (g/e/h) 130 95 75
Laju pertumbuhan lepas sapih (g/e/h) 119 124 135
Umur pubertas betina (hari) 359,1 359,2 312
Rata-rata bobot badan setahun (kg) 25 20 18
Sumber: Tiesnamurti (1992)
harian sebesar 59,03±12,57 g/e/h. Terdapat tiga jenis domba lokal di Indonesia, yaitu domba Javanese thin-tailed (domba ekor tipis), Javanese fat-tailed (domba ekor gemuk), dan domba priangan atau dikenal juga sebagai domba garut.
Domba Ekor Tipis
Domba ekor tips banyak ditemukan di Jawa Barat. Bobot rata-rata domba ekor tipis betina dewasa sekitar 20 kg, tetapi dengan banyak variasi. Domba yang diternakkan di dataran tinggi lebih tinggi bobotnya (rata-rata 27 kg) dibandingkan dengan domba yang diternakkan di daerah dataran rendah (rata-rata 16 kg) pada jenis ini. Tinggi pundak dari seekor domba betina dewasa sekitar 55 cm. Kebanyakan dari jenis domba ini berwarna putih dengan bercak gelap (Gatenby, 1991).
Domba ekor tipis memiliki sifat prolifik, sehingga induk dapat menghasilkan keturunan yang banyak dalam waktu yang singkat. Jumlah anak per kelahiran secara alami pernah dicatat sampai enam ekor, dan di peternakan kembar dua dan kembar tiga merupakan hal yang umum (Gatenby, 1991).
Domba Ekor Gemuk
Domba ekor gemuk (DEG) ditemukan di Jawa Tengah dan Jawa Timur dan di beberapa pulau lain di bagian tengah dan barat Indonesia. Domba ini sedikit lebih besar daripada jenis ekor tipis, memiliki wol yang sangat sedikit, dan mempunyai ekor yang gemuk dan panjang. Diduga domba ini dibawa oleh pedagang dari Pakistan atau Timur Tengah. Warna bulu normal adalah putih. Baik domba betina maupun domba jantan keduanya tidak bertanduk (Gatenby, 1991).
Yusran dan Komarudin-Ma’sum (1990) menyatakan bahwa berat badan induk DEG di saat kawin berkisar antara 19–33 kg, dengan umur induk yang kawin 1–4 tahun. Proporsi induk yang beranak kembar dua atau lebih meningkat dari 34,2% pada waktu beranak pertama naik menjadi 55,9% pada waktu beranak ketiga. Pada penelitian tersebut juga diperoleh rata-rata jumlah anak per kelahiran per induk untuk induk-induk DEG berkisar antara 1,0 ekor sampai 2,4 ekor dengan rata-rata 1,7 ekor; sehingga cenderung terjadi tipe kelahiran kembar dua.
Domba Garut
besar, memiliki telinga sangat kecil, dan sering berwarna hitam (Gatenby, 1991). Nurasa (2006) memperoleh hasil rataan lama birahi pada domba garut adalah 33,96±15,32 jam dengan angka service per conception (SPC) sebesar 1,53±0,73. Laju ovulasi pada penelitian tersebut sebesar 2,05±1,06 buah/ekor. Jumlah ovum yang terbuahi adalah 94,23%±6,56% dengan daya hidup embrio 89,23%±5,67%. Jumlah anak rata-rata dalam sekali kelahiran pada domba garut yaitu 1.63±0,85 ekor/induk dengan total bobot lahir 3,88±1,64 kg/induk.
Kebutuhan Pakan Domba
Nutrien atau zat-zat pakan adalah substansi kimia dalam bahan pakan ternak yang dapat dimanfaatkan untuk hidup pokok dan bila ketersediaannya cukup, maka digunakan untuk pertumbuhan, gerak dan kerja oleh otot ternak, reproduksi, serta laktasi (Purbowati, 2001). Pakan pada hewan ruminansia terbagi atas konsentrat dan hijauan. Menurut Ensminger et al. (1990), konsentrat adalah pakan yang tinggi kandungan Beta-N dan rendah kandungan SK-nya, yaitu lebih rendah dari 18%.
Menurut Haryanto dan Djajanegara (1993), energi dan protein merupakan kebutuhan nutrisi utama yang harus terpenuhi secukupnya, setelah kebutuhan bahan kering terpenuhi. Kebutuhan energi tergantung pada ukuran ternak, status fisiologis ternak, dan kondisi lingkungan, sementara protein penting untuk efisiensi penggunaan energi dan untuk pertumbuhan otot (Purbowati, 2001).
Menurut Prakoso et al. (2009), untuk dapat memberikan produk yang efisien dan optimal pada ternak domba, diperlukan imbangan protein kasar (PK) dan total digestible nutrients (TDN) yang tepat dalam pakan. Menurut Haryanto dan Djajanegara (1993), kebutuhan PK dan TDN untuk domba yang digemukkan adalah 14%–15% dan 45%–65%. Sementara Umberger (1997) menyebutkan bahwa untuk domba berbobot badan 13,5–31,5 kg yang sedang digemukkan memiliki kebutuhan PK sebesar 15% serta domba berbobot badan 22,5–33,75 kg memiliki kebutuhan TDN sebesar 70%–75%.
Bahan Pakan
Rumput Lapang
Hijauan merupakan pakan utama sumber serat bagi ternak ruminansia. Hijauan yang umum digunakan sebagai pakan ternak terdiri atas leguminosa dan rumput. Menurut Maulidina (2011), rumput lapang merupakan campuran dari beberapa jenis rumput lokal yang tumbuh alami dan mudah didapat, tetapi memiliki daya produksi dan kualitas nutrien yang rendah. Komposisi zat makanan rumput lapang berdasarkan bahan kering dapat dilihat pada Tabel 1.
Tabel 2. Kandungan Nutrien Rumput Lapang Berdasarkan Bahan Kering
Nutrien Komposisi*
---%BK---
Abu (%) 6,46
Protein Kasar (%) 8,78
Lemak Kasar (%) 1,83
Serat Kasar (%) 27,78
Bahan Ekstrak Tanpa Nitrogen (%) 55,15
Keterangan: *Hasil analisis Laboratorium PAU IPB
Bungkil Kelapa
Salah satu manfaat dari upaya pembudidayaan tanaman kelapa adalah untuk memproduksi minyak kelapa yang berasal dari daging buah, yang menghasilkan hasil samping berupa bungkil kelapa. Bungkil kelapa diperoleh dari sisa kopra setelah proses pengepresan. Berdasarkan prosesnya, bungkil kelapa dibedakan menjadi bungkil kelapa yang diekstraksi dengan uap air dan tekanan (bungkil kelapa expeller) dan bungkil kelapa yang diekstraksi dengan pelarut organik (bungkil kelapa solvent) (Hamid et al., 1999).
Bungkil kelapa merupakan bahan baku pakan yang tergolong sebagai sumber protein. Bungkil kelapa mengandung bahan kering 90,6%; protein kasar 23,38%; lemak kasar 6,5%; kalsium 0,01%; dan 0,66% fosfor (Sinurat et al., 1998).
antara lain asam lemak jenuh (0,54% C6; 7,88% C8; 6,43% C10; 48,96% C12; 18,51% C14; 8,46% C16; dan 2,75% C18) serta asam lemak tak jenuh (5,18% C18:1 dan 1,15% C18:2).
Jordan et al. (2006) melaporkan bahwa terjadi penurunan gas metan harian (P<0,001) ketika dihitung per liter per hari maupun per kg konsumsi bahan kering dan nilai GE (gross energy) rata-rata yang lebih besar dengan penambahan bungkil kelapa dan minyak kelapa suling. Konsentrat dari bungkil kelapa menghasilkan fraksi NDF dan ADF lebih besar karena tingginya konsentrasi NDF (649 g/kg BK) dan ADF (331 g/kg BK) pada bungkil kelapa.
Onggok
Onggok merupakan hasil samping berupa padatan dari industri pengolahan ubi kayu (Manihot esculenta Crantz) menjadi tepung tapioka. Onggok memiliki kandungan kadar air 12,73%; abu 9,1%; serat kasar 8,1%; protein kasar 2,5%; lemak kasar 1%; dan karbohidrat 65,9% (Kurniadi, 2010) serta 0,31% kalsium dan 0,05% fosfor (Wizna et al., 2008). Menurut Dixon (1986), onggok merupakan suatu bahan pakan yang mengandung gula dan pati yang mudah terfermentasi, yang akan memenuhi kebutuhan mikroorganisme rumen secara cepat setelah pemberian pakan, sehingga onggok termasuk sumber energi yang tergolong karbohidrat mudah terpakai (readily available carbohydrate/RAC).
Menurut FSANZ (2004), asam sianida (HCN) yang terdapat pada onggok dapat menyebabkan rendahnya kebuntingan, menurunkan bobot fetus, bobot lahir yang dihasilkan rendah, kematian anak yang tinggi, dan rusaknya fungsi tiroid. Tetapi penggunaan onggok dalam ransum mampu menurunkan biaya ransum (Rasyid, 1996) karena harganya murah, tersedia cukup dalam jumlah banyak, mudah didapat, dan tidak bersaing dengan kebutuhan manusia.
Urea
dalam ransum memiliki keuntungan karena harganya yang relatif murah untuk setiap unit protein ekuivalen (N 6,25), sehingga memungkinkan biaya pembuatan ransum yang relatif murah pula. Faktor konversi dari N ke protein kasar adalah konsentrasi N dikalikan dengan 6,25; karena protein rata-rata mengandung 16% N (Freer dan Dove, 2002). Urea megandung 46,7% N yang setara dengan 291,875% protein kasar (46% nitrogen 6,25). Penggunaan urea sebagai bahan pakan ternak maksimal 1% dari ransum atau 5% dari konsentrat, atau jangan menggunakan urea melebihi ¼ bagian dari seluruh kebutuhan N untuk ransum pertumbuhan. Selain itu, hendaknya pemberian urea disertai dengan penambahan mineral (Parakkasi, 1999).
Penggunaan urea dapat pula merugikan dan menyebabkan keracunan jika penggunaannya tidak semestinya. Tanda-tanda klinis keracunan urea antara lain kesukaran respirasi, salivasi, tetani urat daging, dan kadar urea atau amonia yang tinggi dalam darah (Parakkasi, 1999).
Minyak Jagung
Minyak jagung adalah minyak yang berasal dari lembaga biji jagung (Zea mays L) yang telah mengalami proses pemurnian dengan atau tanpa penambahan bahan tambahan yang diizinkan (SNI, 1998).
Menurut Ducket et al. (2002), minyak jagung merupakan sumber asam lemak tak jenuh (Poly Unsaturated Fatty Acid/PUFA) yang tinggi, dengan konsentrasi sebesar 86,05%. Komposisi asam lemak pada minyak jagung terdiri dari asam lemak jenuh yakni 10,59% asam palmitat; 1,96% asam stearat; 0,43% asam arakhidat; 0,14% asam beheneat; dan 0,18% asam tetrakosanoat; serta asam lemak tak jenuh antara lain 0,1 asam palmitoleat; 27,27% asam oleat; 57,47% asam linoleat; 0,97% asam linolenat; 0,24% asam eikosenoat; dan sebanyak 0,22% merupakan asam lemak yang tidak teridentifikasi.
Minyak Ikan Lemuru
Minyak ikan lemuru merupakan hasil samping yang cukup banyak dari industri pengalengan ikan dan kaya akan asam lemak tidak jenuh dan omega-3 yang baik untuk kesehatan (Sudarman et al., 2008). Minyak ikan lemuru (Sardinella lemuru) merupakan sumber asam lemak tak jenuh ganda (Poly Unsaturated Fatty Acid/PUFA) yang mengandung 21,95% asam arakhidonat (Hartati, 2008). Sementara hasil penelitian dari Yogaswara (2008), menunjukkan bahwa ikan lemuru mengandung 90,88% asam lemak tak jenuh, antara lain 19,77% asam oleat; 22,89% asam linoleat; 20,72% asam linolenat; 22,83% asam eikosapentanoat (eicosapentaenoic acid/EPA); dan 4,67% asam dekosahexanoat (decosahexaenoic acid/DHA) dengan kandungan lemak sebesar 36,48%.
Doreau dan Chilliard (1997) mengemukakan bahwa pemberian 200 gram minyak ikan dalam sekali pemberian per hari tidak berpengaruh terhadap pola fermentasi rumen, sedangkan pemberian 400 gram minyak ikan merubah produk akhir fermentasi rumen (rasio asetat dan propionat).
Asam Lemak
Asam lemak adalah asam monokarboksilat yang berantai lurus dengan rantai asam mulai dari C1 sampai C3 (yang biasanya tidak terdapat dalam lemak tapi ditemukan sebagai hasil hidrolisis dari lemak) dan atom C4 (yang terdapat dalam lemak) (Barus, 2006).
Klasifikasi asam lemak dapat didasarkan pada beberapa hal. Menurut ada atau tidaknya ikatan rangkap pada rantai atom C, asam lemak dibedakan atas asam lemak jenuh (Saturated Fatty Acid/SFA), asam lemak tidak jenuh tunggal (Mono Unsaturated Fatty Acid/MUFA), dan asam lemak tidak jenuh ganda (Poly Unsaturated Fatty Acid/PUFA). Jika didasarkan atas panjang pendeknya rantai, asam lemak terdiri atas asam lemak rantai pendek (Short Chain Fatty Acid/SCFA), asam lemak rantai sedang (Medium Chain Fatty Acid/MCFA), serta asam lemak rantai panjang (Long Chain Fatty Acid/LCFA). Berdasarkan isomer geometriknya terdapat isomer cis dan trans dari UFA (Barus, 2006).
asam kaprilat (C8:0), asam kaprat (C10:0), asam laurat (C12:0), asam miristat (C14:0), asam palmitat (C16:0), dan asam stearat (C18:0) (McDonald et al., 2002). Asam lemak tak jenuh dikenal memiliki peran yang penting dan positif yang berkaitan dengan aspek reproduksi (Abayasekara dan Wathles, 1999). Asam lemak yang diklasifikasikan sebagai asam lemak tak jenuh antara lain asam palmitoleat (C16:1), asam oleat (C18:1), asam linoleat (C18:2), asam α-linolenat (C18:3), asam arakhidonat (C20:4), asam timnodonat (eicosapentaenoat) (C20:5), serta asam docosahexaenoat (C22:5) (McDonald et al., 2002).
Asam lemak esensial adalah asam lemak yang tidak dapat disintesis oleh tubuh ternak, sehingga harus terdapat dalam pakan ternak. Contoh dari asam lemak esensial adalah asam linolet, asam linolenat, dan asam arakhidonat. Struktur dari asam lemak dapat dilihat pada Gambar 1.
O R - C - OH
Gambar 1. Struktur Asam Lemak (McDonald et al., 2002)
Penelitian dari Encinias et al. (2004) mendapatkan hasil peningkatan daya tahan hidup anak domba yang induknya disuplementasi oleh 5,7% biji safflower yang mengandung asam linoleat tinggi. Lebih banyak anak domba yang dilahirkan oleh induk yang disuplementasi oleh level biji safflower yang lebih rendah (2,8%) yang mengalami kematian akibat kelaparan dan pneumonia.
Sistem Pencernaan Ruminansia
rumen), dan hirolisis (proses pencernaan oleh enzim-enzim hewan induk semang (Puastuti, 2005).
Ternak ruminansia memiliki sistem pencernaan yang lebih kompleks dibandingkan ternak non-ruminansia, karena memiliki empat buah perut, yaitu perut handuk (rumen), perut jala (retikulum), perut buku atau perut kitab (omasum), dan perut sejati (abomasum). Retikulum merupakan bagian dimana bolus pakan masuk dari kerongkongan dan memiliki kemampuan berkontraksi yang memungkinkan pencampuran dan pergerakan pakan menuju rumen, regurgitasi digesta dari rumen kembali ke mulut, dan pengeluaran isi omasum. Rumen adalah bagian yang terbesar dari keempat kompartemen. Rumen berfungsi sebagai tempat penyimpanan, tempat proses fermentasi, dan tempat hunian bagi populasi mikroba yang jumlahnya besar dan beragam. Omasum merupakan perut yang mengeluarkan air dan mineral dari ingesta sebelum mencapai abomasum, walaupun aktivitas pencernaan yang terjadi di sini cukup sedikit. Abomasum dikatakan sebagai perut sejati, karena abomasum memiliki fungsi yang serupa dengan perut pada hewan non-ruminansia (NRC, 2007).
Metabolisme Lemak
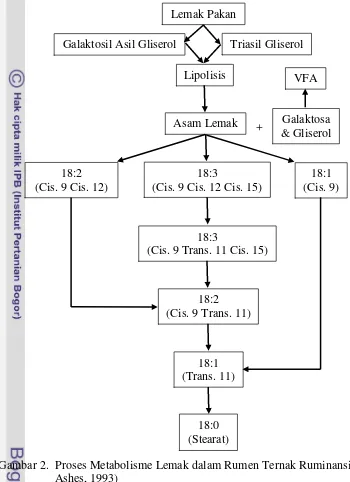
Pada ternak ruminansia, lemak pakan di dalam rumen akan mengalami proses lipolisis dan biohidrogenasi. Menurut NRC (2007), langkah awal perubahan lipida pakan dalam rumen adalah proses hidrolisis ikatan ester oleh enzim lipolitik mikroba yang melepaskan gliserol dan asam lemak bebas (free fatty acid/FFA). Gliserol kemudian dimetabolis oleh mikroorganisme dalam rumen menjadi untuk menghasilkan VFA.
Galaktosil Asil Gliserol Triasil Gliserol Lipolisis
Asam Lemak Galaktosa & Gliserol
18:3
(Cis. 9 Cis. 12 Cis. 15) 18:2
(Cis. 9 Cis. 12)
18:1 (Cis. 9)
18:3
(Cis. 9 Trans. 11 Cis. 15)
18:2 (Cis. 9 Trans. 11)
18:1 (Trans. 11)
18:0 (Stearat)
sebagai hasil dari proses biohidrogenasi tidak lengkap (NRC, 2007). Skema proses metabolisme lemak dalam rumen ternak ruminansia dapat dilihat pada Gambar 2.
+
Gambar 2. Proses Metabolisme Lemak dalam Rumen Ternak Ruminansia (Scott dan Ashes, 1993)
Menurut NRC (2007), bakteri merupakan mikroorganisme yang paling bertanggung jawab untuk proses biohidrogenasi di dalam rumen. Beberapa faktor dari pakan yang mempengaruhi proses biohidrogenasi antara lain rasio konsentrat:hijauan dalam pakan, kandungan nitrogen pakan, umur hijauan, spesies hijauan, metode panen dan pengolahan, dan penambahan ionophore.
Kebanyakan lipida di dalam pakan memasuki lacteal dalam bentuk chylomicron, yang memasuki pembuluh darah vena melalui saluran thorac. Bagian dari triasilgliserol pakan sangat sedikit yang dihidrolisis menjadi gliserol dan asam berbobot molekul rendah dan kemudian langsung diserap ke aliran darah. Chylomicron yang beredar lalu diserap oleh hati dan triasilgliserol dihidrolisis. Asam lemak yang dihasilkan oleh mikroba rumen, bersama dengan asam lemak bebas diserap dari darah oleh hati, lalu dimasukkan kembali ke aliran darah dalam bentuk lipoprotein dan dibawa menuju ke berbagai organ dan jaringan (McDonald et al., 2002).
Proteksi terhadap Lemak
Proses biohidrogenasi yang terjadi di dalam saluran pencernaan ruminansia mengakibatkan semua lipida pakan yang memasuki duodenum didominasi oleh asam lemak jenuh, yang menyebabkan lemak ruminansia menjadi lebih keras dan meningkatkan resiko penyakit kardiovaskular pada konsumennya. Untuk mencegah terjadinya biohidrogenasi oleh mikroba rumen terhadap asam lemak tidak jenuh maka perlu dilakukan proteksi terhadap pakan yang diberikan (Tiven et al., 2011). Lemak yang diproteksi dapat menghindari efek negatif lemak pada mikroba rumen dan memasok asam lemak esensial pada pascarumen (Adawiah et al., 2007).
Ada beberapa metode yang dapat digunakan dalam melakukan proteksi terhadap lemak, antara lain proteksi dengan formaldehida (Tiven et al., 2011), proteksi dengan sabun mineral (Adawiah et al., 2007), dan proteksi dengan campuran garam karboksilat kering (CGKK) (Tasse, 2010). Hasil yang diperoleh pada proses proteksi menggunakan CGKK (Tasse, 2010) adalah peningkatan konsentrasi VFA total dan penurunan konsentrasi amonia.
Protozoa
dalam rumen bervariasi, tergantung jenis ransum yang dimakan ternak induk semang (Erwanto, 1995).
Menurut Freer dan Dove (2002), protozoa adalah mikrobiota rumen yang terbesar, anaerob obligatif, motil, dan mikroba eukariotik. Protozoa ciliata merupakan protozoa yang terbanyak, dan family Ophryoscolecidae adalah ciliata utama di rumen, dengan lebih dari 100 spesies (Freer dan Dove, 2002).
Menurut Brock dan Madigan (1991), protozoa lebih menggemari substrat yang mudah difermentasi seperti pati dan gula, walaupun protozoa juga menghidrolisis selulosa dan menghasilkan produk fermentasi seperti asam asetat, asam butirat, asam laktat, CO2, dan H2.
Protozoa mengandung 55% protein kasar, dan susunan asam aminonya tidak dipengaruhi oleh ransum (Parakkasi, 1999). Sementara menurut Dehority (2004), nilai biologis, kecernaan sejati, dan utilisasi protein netto protozoa rumen masing-masing sebesar 82%, 87%–91%, dan 71%.
Hasil penelitian dari Adawiah et al. (2007) menunjukkan bahwa suplementasi 1,5% minyak jagung dan 1,5% minyak ikan menghasilkan populasi protozoa sebanyak 6,5×104 sel/ml dan 10,4×104 sel/ml. Populasi protozoa dari domba yang diberi perlakuan minyak ikan yang diproteksi oleh sabun kalsium adalah 8×104 sel/ml. Menurut Tiven et al. (2001), minyak dapat berperan sebagai agen defaunasi bagi protozoa dalam rumen. Menurut Adawiah et al. (2007), penurunan jumlah populasi protozoa dalam rumen disebabkan karena protozoa tidak dapat memproduksi enzim lipolisis. Lemak yang diberikan akan menyelimuti protozoa dan tidak dapat dirombak, sehingga tegangan permukaan dalam sel protozoa lebih rendah dibandingkan dengan luar sel, yang berakibat protozoa mengalami lisis (Adawiah et al., 2007).
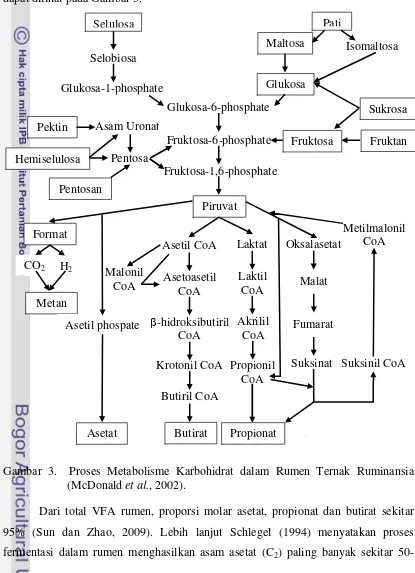
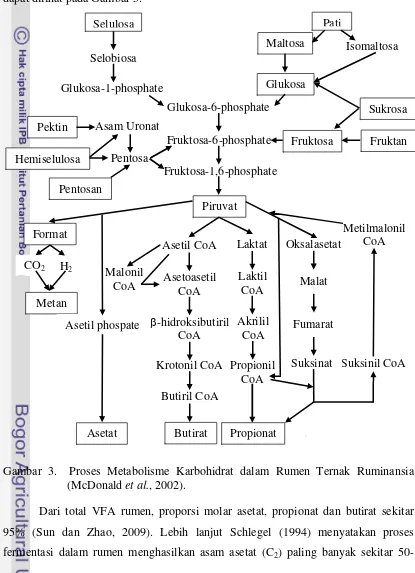
Selulosa Pati fermentasi dalam rumen digunakan sebagai sumber energi utama pada ternak ruminansia. Skema proses metabolisme karbohidrat dalam rumen ternak ruminansia dapat dilihat pada Gambar 3.
Gambar 3. Proses Metabolisme Karbohidrat dalam Rumen Ternak Ruminansia (McDonald et al., 2002).
50-70%, diikuti oleh asam propionat (C3) berkisar antara 17-21%, asam butirat (C4) diproduksi sekitar 14-20% dari VFA total, serta asam valerat (C5) dan asam format hanya terbentuk dalam jumlah kecil.
Menurut McDonald et al. (2002), di dalam rumen karbohidrat pakan dipecah melalui dua tahap. Tahap pertama adalah proses pencernaan karbohidrat kompleks menjadi gula-gula sederhana, seperti glukosa, fruktosa, dan pentosa yang dihasilkan oleh enzim ekstraselular mikroba. Tahap kedua, gula-gula sederhana tersebut kemudian didegradasi, sehingga menghasilkan hasil akhir utama dari proses pencernaan karbohidrat dalam rumen, antara lain VFA (asam asetat, asam propionat, dan asam butirat), CO2 (karbon dioksida), serta CH4 (metana). Selain dihasilkan dari pencernaan karbohidrat, VFA juga dapat dihasilkan dari deaminasi asam amino, yakni asam isobutirat yang dihasilkan dari valine, asam valerat dari proline, asam 2-metilbutirat dari isoleucine, serta asam 3-metil butirat dari leucine (McDonald et al., 2002).
Parakkasi (1999) menyatakan bahwa sebagian besar VFA langsung diserap melalui dinding rumen; hanya sedikit asetat, beberapa propionat, dan sebagian besar butirat yang termetabolisme dalam dinding rumen. Lebih lanjut McDonald et al. (2002) merinci sekitar 75% dari total VFA yang diproduksi akan diserap langsung oleh retikulo-rumen yang lalu masuk ke dalam darah, sekitar 20% diserap di abomasum dan omasum, dan sekitar 5% sisa dari total VFA diserap di usus halus.
Konsentrasi VFA yang dihasilkan di dalam rumen sangat bervariasi, dipengaruhi oleh pakan ternak dan waktu setelah pemberian pakan (McDonald et al., 2002). Konsentrasi VFA total yang mencukupi untuk pertumbuhan mikroba rumen sebesar 80-180 mM (Fathul dan Wajizah, 2010). Pemberian konsentrat yang tinggi akan meningkatkan proporsi propionat, sementara pemberian hijauan akan meningkatkan proporsi asetat (McDonald et al., 2002).
Proses biohidrogenasi asam lemak tak jenuh dapat merubah pola fermentasi yang terjadi di dalam rumen. Proses biohidrogenasi yang terjadi berdampak pada penambahan hidrogen pada ikatan rangkap dari asam lemak tak jenuh untuk mengubahnya menjadi ikatan tunggal dalam bentuk asam lemak jenuh (McDonald et al., 2002). Inkorporasi (penggabungan) dua buah atom hidrogen ke asam lemak tak jenuh dapat menurunkan suplai hidrogen yang dibutuhkan oleh archaea methanogen untuk membentuk metan, sehingga asam lemak tak jenuh dapat dijadikan sebagai suplementasi dalam pakan yang dapat menurunkan emisi gas metan dari proses enteric fermentation ternak ruminansia. Penurunan gas metan diharapkan dapat meningkatkan kadar VFA dalam rumen karena kehilangan energi dalam proses fermentasi dapat dikurangi serta meningkatkan efisiensi penggunaan energi.
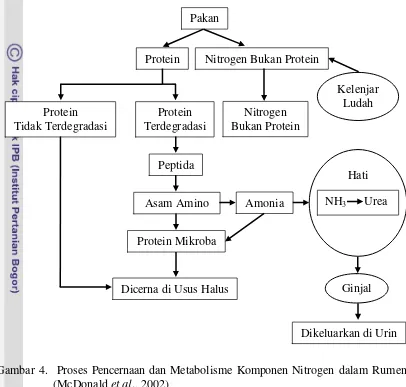
Amonia (NH3)
Protein yang berasal dari pakan dipecah menjadi peptida dan asam amino oleh mikroorganisme dalam rumen. Beberapa asam amino kemudian dipecah menjadi asam organik, amonia, dan CO2.
Kadar amonia dalam rumen merupakan petunjuk antara proses degradasi dan proses sintesis protein oleh mikroba rumen. Jika pakan defisien akan protein atau jika proteinnya tahan terhadap proses degradasi, maka konsentrasi amonia dalam rumen akan rendah dan pertumbuhan mikroba rumen akan rendah, yang menyebabkan terganggunya pemecahan karbohidrat (McDonald et al., 2002).
Menurut Ørskov (1992), efisiensi pemanfaatan NH3 untuk sintesis protein di dalam rumen tergantung pada ketersediaan energi. Apabila terjadi kekurangan energi maka protein akan berlebihan dan tidak dapat dimanfaatkan oleh mikroba rumen. Soepranianondo (2005) menyatakan bahwa 60% protein pakan akan diubah menjadi amonia N, sedangkan 40% akan diteruskan ke abomasum dan usus halus untuk dicerna dan diabsorbsi dan sebagian dibuang ke feses.
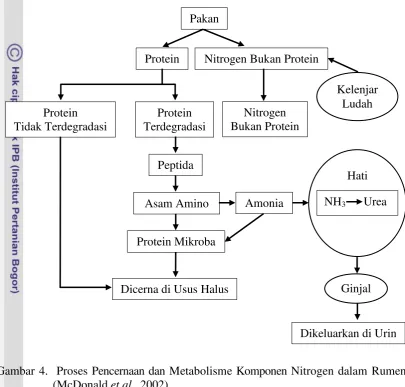
setelah pemberian pakan, laju penyerapan oleh dinding rumen, level dan laju degradasi protein, dan penyerapan oleh mikroorganisme. Skema proses metabolisme komponen nitrogen dalam tubuh ternak ruminansia dapat dilihat pada Gambar 4.
Gambar 4. Proses Pencernaan dan Metabolisme Komponen Nitrogen dalam Rumen (McDonald et al., 2002)
Hasil penelitian dari Adawiah et al. (2007) menunjukkan bahwa konsentrasi amonia yang didapatkan dari ransum perlakuan yang diberikan minyak jagung dan minyak ikan pada domba adalah 8,3±0,6 mM dan 8,0±2,6 mM. Perlakuan minyak ikan yang diproteksi dalam bentuk sabun mineral yang ditambahkan dengan kalsium menghasilkan NH3 sebesar 9,3±3,8 mM.
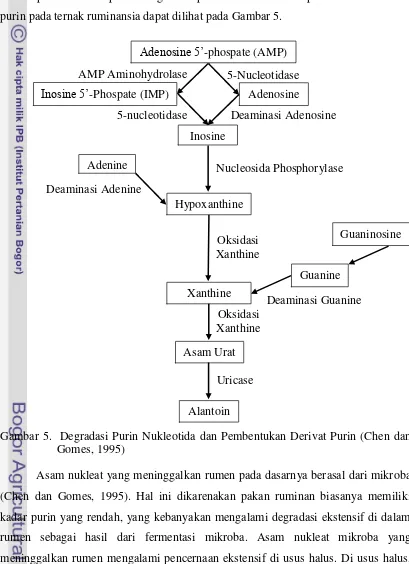
Alantoin Urin
Menurut Chen et al. (1992), purin merupakan asam amino bersifat basa yang terdapat di dalam inti sel mikroba yang terdapat dalam digesta yang masuk ke dalam usus halus. McDonald et al. (2002), menyatakan asam nukleat adalah senyawa
Protein Nitrogen Bukan Protein
Protein Tidak Terdegradasi
Protein Terdegradasi
Peptida
Asam Amino Amonia
Protein Mikroba Pakan
Nitrogen Bukan Protein
Dicerna di Usus Halus
Hati NH3 Urea
Kelenjar Ludah
Ginjal
5-Nucleotidase penyimpan informasi genetik. Protein dari organisme sel tunggal seperti bakteri rumen mengandung banyak asam nukleat (80-160 g/kg BK bakteri) (McDonald et al., 2002). Salah satu senyawa yang dihasilkan dalam proses hidrolisis asam nukleat adalah purin. Skema proses degradasi purin nukleotida dan pembentukan derivat purin pada ternak ruminansia dapat dilihat pada Gambar 5.
Gambar 5. Degradasi Purin Nukleotida dan Pembentukan Derivat Purin (Chen dan Gomes, 1995)
Asam nukleat yang meninggalkan rumen pada dasarnya berasal dari mikroba (Chen dan Gomes, 1995). Hal ini dikarenakan pakan ruminan biasanya memiliki kadar purin yang rendah, yang kebanyakan mengalami degradasi ekstensif di dalam rumen sebagai hasil dari fermentasi mikroba. Asam nukleat mikroba yang meninggalkan rumen mengalami pencernaan ekstensif di usus halus. Di usus halus,
purin nukleotida dihidrolisis menjadi purin nukleosida dan basa bebas. Kedua bentuk dapat diabsorbsi dari usus. Purin nukleosida dan basa bebas yang diserap dari lumen usus mengalami degradasi serta pemanfaatan di mukosa usus. Purin asam nukleat yang diabsorbsi didegradasi dan diekskresikan di urin sebagai derivatnya, antara lain hypoxanthine, xanthine, asam urat, dan alantoin. Ekskresi derivat purin berhubungan langsung dengan absorbsi purin (Chen dan Gomes, 1995). Menurut Arora (1989), sintesis protein mikroba tergantung pada kecepatan absorpsi amonia, kecepatan pemecahan nitrogen pakan, kebutuhan mikroba akan asam amino, kecepatan bahan keluar dari rumen, dan jenis fermentasi mikroba berdasarkan jenis pakan.
Ekskresi derivat purin di urin ruminansia dapat digunakan untuk mengestimasi suplai protein mikroba rumen ke tubuh ternak (Chen et al., 1990). Hal tersebut dapat dilakukan dengan melakukan perhitungan (Chen dan Gomes, 1995) terhadap absorpsi purin mikroba (X) melalui derivat purin yang diekskresikan (Y) dengan hubungan berupa: Y = 0,84 X + (0,150 W0,75 e-0,25X). Selanjutnya N mikroba yang mengalir dalam usus dihitung dari nilai purin yang diabsorpsi (X) berdasarkan persamaan: N Mikroba = X × 70 = 0,727 X.
0,116 × 0,83 × 1000
Neraca Nitrogen (N) pada Ruminansia
Neraca N digunakan untuk mengevaluasi apakah N dalam pakan yang diberikan ke ternak telah cukup untuk memenuhi kebutuhan ternak ataukah ternak harus merombak jaringan tubuhnya untuk memenuhi kebutuhan sebagai konsekuensi atas kehilangan pada proses pencernaan pakan. Keseimbangan (neraca) N dapat pula digunakan untuk menentukan kebutuhan protein ternak untuk mencukupi hidup pokok, pertumbuhan dan produksi, serta dapat digunakan untuk mengetahui kualitas protein atau nilai biologis protein pakan (Purbowati, 2001). Imbangan N dapat dipakai untuk menentukan kebutuhan protein guna keperluan pertumbuhan (Tahuk et al., 2008). Takaran minimal protein yang memberi retensi maksimal untuk pertumbuhan ternak dalam prinsip imbangan N adalah kebutuhan protein bagi ternak (Tillman et al., 1991).
makanan yang tidak di absorbsi serta N yang berasal dari tubuh seperti sel-sel epitel usus yang rusak (Parakkasi, 1999). Peningkatan laju deposisi protein (N) dalam jaringan pada ternak sangat dipengaruhi oleh suplai protein (N) ransum (Rimbawanto dan Iriyanti, 2000). Meningkatnya konsumsi N tidak selalu disertai dengan peningkatan bobot badan terutama jika energi dalam ransum rendah (Parakkasi, 1999).
MATERI DAN METODE
Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Lapang (Kandang) B Ilmu Nutrisi Ternak Daging dan Kerja, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor. Analisis kimia dilaksanakan di Laboratorium Ilmu Nutrisi Ternak Daging dan Kerja; Laboratorium Biokimia, Fisiologi dan Mikrobiologi Nutrisi; Laboratorium Ilmu Nutrisi dan Ternak Perah, Fakultas Peternakan; serta Laboratorium Pusat Antar Universitas (PAU), Institut Pertanian Bogor. Penelitian dilaksanakan dari bulan Juli 2011 sampai Maret 2012.
Materi
Ternak Percobaan
Ternak yang digunakan adalah 12 ekor domba lokal betina lepas sapih berumur sekitar 2-3 bulan dengan bobot badan rata-rata 9,32±2,28 kg. Domba yang digunakan adalah domba milik Laboratorium Lapang B Ilmu Nutrisi Ternak Daging dan Kerja, yang merupakan persilangan antara domba lokal asal Unit Pendidikan dan Penelitian Peternakan Jonggol (UP3J), Fakultas Peternakan, Institut Pertanian Bogor yang berada di daerah Jonggol, Jawa Barat dengan domba garut. Domba UP3J sendiri merupakan persilangan dari domba garut dengan domba ekor tipis. Contoh domba penelitian ditunjukkan pada Gambar 6.
Kandang
Kandang yang digunakan dalam penelitian adalah kandang individu sebanyak dua belas buah, berukuran 125 55 110 cm3 yang dilengkapi dengan tempat pakan dan tempat air minum dari bahan plastik. Alas kandang dibuat dari kayu papan, antar satu kayu papan dengan yang lainnya diberikan jarak ±2 cm. Hal tersebut dimaksudkan agar kotoran yang dikeluarkan oleh ternak dapat jatuh ke tempat penampungan yang berada di bawah bangunan kandang. Suhu dan kelembaban rata-rata di dalam kandang pada pagi hari sebesar 21,5 ºC dan 91% serta pada siang hari 33,5 ºC dan 46%.
Pada minggu-minggu awal penelitian di beberapa kandang individu, alas kayu papan tersebut ditutupi oleh rerumputan kering untuk mencegah kaki domba yang berukuran kecil tidak terperosok ke dalam alas kayu papan. Pada minggu akhir penelitian, yaitu saat pengambilan sampel feses dan urin, digunakan kandang panggung. Tempat pakan dan minum juga dinaikkan menyesuaikan kondisi ketinggian kandang panggungnya. Kandang yang digunakan pada penelitian ditunjukkan pada Gambar 7.
Gambar 7. Kandang Penelitian Alat dan Bahan
destilasi uap, labu erlenmeyer, cawan Conway, alat-alat titrasi, counting chamber, Vortex, alkohol bath, spektrofotometer, serta labu Kjeldahl.
Bahan yang digunakan dalam penelitian ini antara lain HgCl2; H2SO4 7%; H2SO4 15%, NaOH 0,5 N; Phenol Pthalin; HCl 0,5 N; larutan Na2CO3 jenuh; larutan asam borat berindikator; vaselin; H2SO4 0,005 N; Tryphan Blue Formaline Salin (TBFS); NaOH 0,5 M; HCl 0,5 M; Penylhydrazine; HCl pekat; potassium; Selenium mixture; H2SO4 pekat; NaOH 40%; H3BO3 2%; Brom Cresol Green-Methyl Red; HCl 0,1 N; es batu; aquades; serta air. Contoh peralatan yang digunakan di lapang dan di laboratorium ditunjukkan pada Gambar 8.
(a) (b) (c)
(d) (e)
Gambar 8. Perlengkapan Penelitian berupa: (a) timbangan digital, (b) timbangan gantung kapasitas 50 kg, (c) cawan Conway, (d) peralatan destilasi uap, (e) peralatan titrasi.
Pakan
ransum tercantum pada Tabel 3 dan kandungan nutrien zat makanan tercantum pada Tabel 4.
Tabel 3. Komposisi Bahan Pakan
Bahan Pakan Perlakuan
M0 MJ MIL MILT
---%BK---
Rumput 30,00 30,00 30,00 30,00
Onggok 17,00 17,00 17,00 17,00
Bungkil Kelapa 50,50 49,00 49,00 49,00
CaCO3 1,50 1,50 1,50 1,50
Garam 0,25 0,25 0,25 0,25
Premix 0,15 0,15 0,15 0,15
Urea 0,60 0,60 0,60 0,60
Minyak Jagung - 1,50 - -
Minyak Ikan Lemuru - - 1,50 -
Minyak Ikan Terproteksi - - - 1,50
Keterangan: M0 = pakan kontrol (tanpa minyak); MJ = pakan yang mengandung 1,5% minyak jagung; MIL = pakan yang mengandung 1,5% minyak ikan lemuru;
MILT = pakan yang mengandung 1,5% minyak ikan lemuru terproteksi.
Tabel 4. Kandungan Nutrien Pakan Perlakuan (Konsentrat + Hijauan)
Kandungan Nutrien Ransum Penelitian
M0 MJ MIL MILT
---%BK---
Abu 8,68 7,70 8,08 7,53
Protein Kasar 18,27 16,79 16,33 16,32
Lemak Kasar 3,84 5,21 6,37 9,33
Serat Kasar 14,91 15,50 15,24 15,03
Beta-N 54,30 54,81 53,98 51,80
Total Digestible Nutrien* 72,47 74,82 74,07 74,07
Keterangan: Hasil analisis Laboratorium PAU, IPB (2012). *) Perhitungan TDN menurut Wardeh (1981). M0 = pakan kontrol (tanpa minyak);
MJ = pakan yang mengandung 1,5% minyak jagung; MIL = pakan yang mengandung 1,5% minyak ikan lemuru;
Metode
Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Acak Kelompok (RAK) dengan 4 perlakuan dan 3 ulangan. Pengelompokan pada penelitian ini didasarkan pada bobot badan domba, yakni bobot badan besar (11,80 ± 1,82 kg), bobot badan sedang (9,15 ± 0,53 kg), dan bobot badan kecil (7,00 ± 0,33 kg). Model matematik yang digunakan adalah sebagai berikut (Steel dan Torrie, 1993):
Yij = µ + i+ βj + ij
Keterangan:
Yij = Nilai pengamatan pada perlakuan ke-i dan ulangan ke-j = Nilai rataan umum
i = Pengaruh perlakuan ke-i βj = Pengaruh kelompok ke-j
ij = Pengaruh galat perlakuan ke-i dan ulangan ke-j
Prosedur Pemeliharaan
Pemeliharaan domba dilakukan selama ±3 bulan. Sebelum digunakan domba ditimbang terlebih dahulu, untuk mendapatkan bobot badan awal sebelum perlakuan. Domba ditimbang setiap dua minggu sekali agar diketahui perubahan bobot badannya. Konsentrat diberikan setiap pagi, sementara hijauan berupa rumput lapang diberikan dua jam setelah pemberian konsentrat dan sore hari. Pakan yang diberikan 3% dari bobot badan, tetapi seiring bertambahnya bobot badan maka konsumsi ransum dinaikkan sampai 4%. Konsumsi dan sisa pakan ditimbang setiap hari.
Pengambilan Cairan Rumen
Pengumpulan Sampel Urine
Pengambilan sampel dilakukan dengan menggunakan penampungan urin yang dipasang pada bagian bawah tiap kandang panggung ternak. Sampel urin ditampung dengan menggunakan wadah yang telah ditetesi H2SO4 7% sekitar 10 ml untuk mencegah terjadinya penguapan nitrogen (N). Koleksi urin dilakukan selama tiga hari. Urin yang telah terkumpul lalu dikompositkan dan diambil sampel untuk kemudian disimpan dalam freezer dan dapat digunakan sebagai contoh dan dianalisis kandungan N dan alantoinnya.
Pengukuran Populasi Protozoa Rumen (Ogimoto dan Imai, 1981)
Populasi protozoa dihitung berdasarkan pewarnaan dengan larutan Tryphan Blue Formaline Salin (TBFS). Tahapan perhitungan adalah cairan rumen dicampur dengan larutan TBFS dengan perbandingan 1:1. Dua tetes campuran tersebut ditempatkan pada counting chamber setebal 0,2 mm, luas kotak terkecil 0,0625 mm2. Perhitungan jumlah protozoa dilakukan dengan mikroskop pada pembesaran 100 kali. Protozoa per ml cairan rumen dihitung dengan rumus:
Protozoa/ml cairan rumen = 1×1000×C×FP 0,2×0,00625×16×5
Keterangan: C = jumlah protozoa terhitung dalam counting chamber FP = faktor pengenceran
Pengukuran Konsentrasi VFA (Steam Destilation Methode)
dengan HCl 0,5 N sampai warna titrat berubah dari merah menjadi merah muda seulas. Konsentrasi VFA total yang dihasilkan dihitung dengan menggunakan rumus: mM VFA total = (a b) N HCl
Keterangan: a = volume titran blangko b = volume titran contoh
Pengukuran Konsentrasi NH3 (Conway Micro Diffusion Methode)
Pengukuran konsentrasi amonia (NH3) dilakukan menurut metode mikro difusi Conway (Department of Dairy Science, 1966). Sebelum sampel diletakkan dalam cawan Conway, terlebih dahulu bibir cawan diolesi dengan vaselin. Sampel supernatan diambil sebanyak 1 ml, kemudian ditempatkan pada salah satu ujung cawan Conway. Sebanyak 1 ml larutan Na2CO3 jenuh ditempatkan pada ujung lain dari cawan Conway yang berseberangan dengan supernatan. Sebanyak 1 ml larutan asam borat berindikator ditempatkan dalam bagian yang terletak di tengah cawan Conway. Cawan Conway yang telah diolesi vaselin ditutup rapat hingga tidak ada udara yang masuk. Larutan Na2CO3 dicampurkan dengan supernatan hingga merata, yakni dengan cara cawan tersebut digoyang–goyangkan dan dimiringkan. Setelah itu dibiarkan selama 24 jam dalam suhu kamar. Setelah 24 jam cawan tersebut dibuka. Asam borat berindikator dititrasi dengan H2SO4 0,005 N hingga terjadi perubahan warna dari biru menjadi merah. Hasil titrasi dicatat dan konsentrasi amonia (NH3) dihitung dengan mengggunakan rumus:.
N NH3 (mM) = ml H2SO4 N H2SO4 1000
Pengukuran Alantoin Urin (Chen dan Gomes, 1995)
menit. Sebanyak 3 ml HCl pekat dan 1 ml potassium ditambahkan. Absorbansi dibaca pada 522 nm setelah 20 menit.
Analisis Konsentrasi Nitrogen (AOAC, 1980)
Sampel kering sebanyak 0,25 g ditempatkan dalam labu Kjeldahl dan ditambahkan 0,25 g Selenium mixture dan 20 ml H2SO4 pekat. Selanjutnya dilakukan destruksi (pemanasan dalam keadaan mendidih) selama 1 jam hingga larutan jernih. Setelah dingin, larutan tersebut ditambahkan aquadest hingga 120 ml. Sebanyak 5 ml sampel diambil dan 10 ml NaOH 40%, lalu didestilasi. Hasil destilasi tersebut ditampung dalam labu erlenmeyer yang berisi campuran antara 10 ml H3BO3 2% dan 2 tetes indicator Brom Cresol Green-Methyl Red yang berwarna merah muda. Setelah volume hasil destilat mencapai 40 ml dan berwarna hijau kebiruan, destilasi dihentikan. Hasil destilasi dititrasi dengan HCl 0,1 N hingga berwarna merah muda. Perlakuan yang sama juga dilakukan terhadap blanko. Kadar nitrogen total dihitung dengan rumus:
% Kadar N =
100%
Keterangan: S = volume titran sampel (ml); B = volume titran blanko (ml); w = bobot sampel kering (mg). Pengukuran Konsumsi Nitrogen
Konsumsi Bahan Kering × % Protein Kasar Pakan Konsumsi Nitrogen (g/e/h) =
6,25 Konsumsi Nitrogen Konsumsi Nitrogen (g/kg BB0,75/h) =
Bobot Badan0,75 Pengukuran Nitrogen Feses
Feses yang Keluar × % Protein Kasar Feses Nitrogen Feses (g/e/h) =
6,25 Nitrogen Feses Nitrogen Feses (g/kg BB0,75/h) =
Pengukuran Nitrogen Urin
Nitrogen Urin (g/e/h) = % N Urin × Volume Urin × Berat Jenis Urin
Nitrogen Urin Nitrogen Urin (g/kg BB0,75/h) =
Bobot Badan0,75 Pengukuran Nitrogen Tercerna
Nitrogen Tercerna (g/e/h) = Konsumsi Nitrogen Nitrogen Feses Nitrogen Tercerna
Nitrogen Tercerna (g/kg BB0,75/h) =
Bobot Badan0,75 Pengukuran Kecernaan Nitrogen
Nitrogen Tercerna Kecernaan Nitrogen (%) =
Konsumsi Nitrogen Pengukuran Retensi Nitrogen
Retensi Nitrogen (g/e/h) = Konsumsi Nitrogen Nitrogen Feses Nitrogen Urin Retensi Nitrogen
Retensi Nitrogen (g/kg BB0,75/h) =
Bobot Badan0,75
Perhitungan Ekskresi Derivat Purin (Chen dan Gomest, 1995)
Ekskresi Alantoin Ekskresi Derivat Purin (mmol/l) =
0,85
Perhitungan Efisiensi Pemanfaatan Nitrogen (Sun dan Zhao, 2009)
Retensi Nitrogen
Efisiensi Pemanfaatan Nitrogen (%) = × 100% Konsumsi Nitrogen
Perlakuan
Perlakuan yang diberikan pada domba yaitu pemberian berbagai macam minyak sebagai sumber asam lemak tak jenuh. Perlakuan yang diberikan antara lain: M0 = Pakan kontrol (tanpa minyak)
MILT = Pakan yang mengandung 1,5% minyak ikan lemuru terproteksi Peubah yang diamati
1. Populasi Protozoa Rumen 2. Pengukuran Konsentrasi VFA 3. Pengukuran Konsentrasi NH3 4. Pengukuran Alantoin Urin 5. Analisis Konsentrasi Nitrogen 6. Pengukuran Konsumsi Nitrogen 7. Pengukuran Nitrogen Feses 8. Pengukuran Nitrogen Tercerna 9. Pengukuran Kecernaan Nitrogen 10. Pengukuran Nitrogen Urin 11. Pengukuran Retensi Nitrogen: 12. Perhitungan Ekskresi Derivat Purin 13. Efisiensi Pemanfaatan Nitrogen
Analisis Data
HASIL DAN PEMBAHASAN
Populasi Protozoa
Protozoa merupakan jenis mikroorganisme yang menempati populasi kedua terbesar di dalam rumen. Berdasarkan hasil sidik ragam, tidak ada pengaruh yang nyata (P>0,05) antar perlakuan terhadap populasi protozoa dalam rumen. Populasi protozoa yang dihasilkan dari perlakuan dapat dilihat pada Tabel 5.
Tabel 5. Populasi Protozoa Dalam Rumen Perlakuan
Total Protozoa ( 104 sel/ml )
M0 9,10
MJ 6,92
MIL 7,31
MILT 12,95
SEM 1.37
Keterangan: M0 = pakan kontrol (tanpa minyak),
MJ = pakan yang mengandung 1,5% minyak jagung, MIL = pakan yang mengandung 1,5% minyak ikan lemuru,
MILT = pakan yang mengandung 1,5% minyak ikan lemuru terproteksi. SEM = standard error of mean
Populasi protozoa dalam rumen yang tidak berbeda secara nyata menandakan bahwa pemberian minyak yang berbeda sebagai sumber asam lemak tak jenuh pada level 1,5% memiliki pengaruh yang sama terhadap populasi protozoa dalam rumen. Populasi protozoa yang diperoleh pada penelitian ini antara 6,92–12,95 (×104 sel/ml), masih rendah dibandingkan standar populasi protozoa menurut Ogimoto dan Imai (1981) yang menyatakan populasi protozoa optimal adalah 105–106 sel/ml. Populasi protozoa pada penelitian ini sejalan dengan populasi protozoa yang diperoleh oleh Adawiah et al. (2007), yakni 6,5–10,4 (×104 sel/ml). Hasil yang diperoleh Zain et al. (2008) menunjukkan bahwa penggunaan minyak jagung mampu mengeliminasi protozoa rumen secara signifikan sampai 11,72% dari 1,45 105 sel/ml menjadi 1,28
Fermentabilitas
Volatile Fatty Acid (VFA)
Pengaruh perlakuan terhadap konsentrasi VFA dalam rumen yang tertera di Tabel 6 menunjukkan bahwa perlakuan berbagai jenis minyak yang digunakan pada penelitian ini sangat nyata mempengaruhi produksi VFA dalam rumen (P<0,01). Rataan produksi VFA pada perlakuan MJ dan MIL sangat berbeda nyata (P<0,01) meningkat dibandingkan dengan M0 dan MILT. Hal ini menggambarkan bahwa pemberian MJ dan MIL dapat meningkatkan efisiensi metabolisme energi di dalam rumen. Menurut Sutardi (1997), penggunaan minyak jagung dalam ransum menghasilkan efisiensi penggunaan energi (VFA) sebesar 81% dan gas CH4 sebesar 20,8%. Hartati (1998) juga menyatakan konsentrasi VFA total meningkat secara linear apabila ransum mendapat penambahan minyak ikan lemuru. Rataan produksi VFA pada penelitian ini berkisar dari 110,24–171,49 mM. Rataan yang dihasilkan masih berada dalam kisaran normal, sesuai dengan pernyataan Fathul dan Wajizah (2010) yang mengatakan bahwa konsentrasi VFA total yang mencukupi untuk pertumbuhan mikroba rumen adalah 80–180 mM.
Tabel 6. Produksi VFA dan NH3 Dalam Rumen
Parameter Perlakuan SEM
M0 MJ MIL MILT
VFA (mM) 118,59c 171,49a 141,42b 110,24c 8,40
NH3 (mM) 6,49 7,48 6,90 5,47 0,48
Rasio VFA/NH3 18,40 25,66 21,28 21,19 1,53
Keterangan: M0 = pakan kontrol (tanpa minyak),
MJ = pakan yang mengandung 1,5% minyak jagung, MIL = pakan yang mengandung 1,5% minyak ikan lemuru,
MILT = pakan yang mengandung 1,5% minyak ikan lemuru terproteksi. SEM = standard error of mean
Rataan dengan superskrip huruf kecil dalam baris yang sama menunjukkan perbedaan yang nyata (P<0,05)
rumen. Zain et al. (2008) menyatakan bahwa penggunaan minyak jagung sebagai agen defaunasi mampu mengeliminasi protozoa rumen dari 1,45 105 sel/ml menjadi 1,28 105 sel/ml dan mengakibatkan peningkatan populasi bakteri rumen dari 8,80 1010 koloni/ml menjadi 11,40 1010 koloni/ml, atau naik sebesar 29,5%. Menurut Fathul dan Wajizah (2010), bertambahnya jumlah bakteri rumen sebanyak satu milyar sel/ml akan meningkatkan produk VFA sebanyak 0,1592 mM. Jumlah bakteri mempengaruhi produk VFA sebanyak 85%, sedangkan sebanyak 15% oleh faktor lain.
Produksi VFA pada MJ nyata lebih tinggi (P<0,05) daripada VFA yang diproduksi oleh MIL. Tingginya VFA yang diperoleh oleh MJ dibandingkan MIL sesuai dengan penelitian yang dilakukan oleh Adawiah et al. (2007), yang mendapatkan nilai VFA pada ransum yang diberi minyak jagung lebih tinggi 10 mM dibandingkan yang diberi minyak ikan ((MJ = 105±28 mM; MIL = 95±23 mM). Lebih tingginya konsentrasi VFA yang dihasilkan oleh MJ dibandingkan MIL diduga disebabkan selain karena populasi protozoa yang dihasilkan perlakuan MIL lebih rendah dari yang dihasilkan perlakuan MJ (Tabel 5), namun dapat juga disebabkan oleh konsumsi pakan domba. Konsumsi bahan kering konsentrat MJ (348,05 g/e/h) cenderung lebih tinggi dibandingkan konsumsi bahan kering konsentrat MIL (336,59 g/e/h) (Ici, 2012). Konsumsi yang cenderung lebih rendah dengan pemberian MIL dibandingkan dengan MJ mungkin disebabkan oleh bau amis dari MIL yang kurang disukai oleh ternak.
rumen sabun garam karboksilat itu belum mencair karena sabun yang terbentuk berupa kristal padat dan kompak tersebut mudah mencair pada pH 3. Pada kondisi lingkungan yang netral seperti rumen, sabun dapat melewati rumen tanpa mengganggu aktifitas rumen. Saat melewati omasum sampai usus halus (yang memiliki pH 4-3) sabun akan terurai menjadi asam lemak bebas. Selanjutnya asam lemak diserap melalui usus halus untuk digunakan sebagai energi (Joseph, 2007). Penurunan kadar VFA pada lemak yang diproteksi juga dilaporkan oleh Tiven et al. (2011), yang melaporkan terjadinya penurunan terhadap kadar asetat, propionat, butirat, serta total VFA pada perlindungan sumber lemak dari crude palm oil (CPO) dengan formaldehida.
Amonia (NH3)
Amonia (NH3) merupakan sumber nitrogen utama yang penting untuk sintesis protein mikroba. Pemberian berbagai minyak sebagai sumber asam lemak di pakan yang tertera pada Tabel 6 tidak mempengaruhi konsentrasi NH3 dalam rumen secara nyata (P>0,05). Hal tersebut menandakan bahwa pemberian minyak yang berbeda sebagai sumber asam lemak tak jenuh pada level 1,5% memiliki pengaruh yang sama dalam proses degradasi protein dalam rumen, sehingga tidak mempengaruhi pasokan nitrogen untuk mikroba rumen.
Kadar NH3 yang dihasilkan oleh domba yang diberi minyak lemuru yang diproteksi cenderung menghasilkan nilai NH3 yang terendah. Konsentrasi NH3 pada minyak lemuru terproteksi sejalan dengan yang hasil penelitian Tiven et al. (2011), yang mendapatkan kenaikan level formaldehida sebagai agen perlindungan terhadap CPO menyebabkan kadar amonia mengalami penurunan. Hal tersebut karena partikel minyak dikelilingi oleh ikatan antara protein dengan formaldehida. Ikatan tersebut tidak terpecah pada kondisi pH yang netral (6–7) di dalam rumen, sehingga minyak tidak mengganggu aktivitas fermentasi di dalamnya.
NH3 tersebut diduga disebabkan sumber protein utama yang dipakai pada penelitian ini adalah bungkil kelapa sebesar 49%–50,50% dari total ransum. Hal tersebut dikarenakan menurut Sampath (1990), bungkil kelapa tergolong sebagai bahan pakan dengan kandungan undegradable dietary protein (UDP) tinggi, yakni 70%–81%, dengan nilai rata-rata yakni 76% dari protein kasar. Protein sulit terdegradasi (UDP) merupakan protein pakan yang tidak terdegradasi dalam rumen sehingga menjadi protein bypass lalu sampai ke usus halus untuk diserap. Hal tersebut sesuai dengan pernyataan McDonald et al. (2002) yang menyatakan jika protein pakannya sulit didegradasi dalam rumen, maka konsentrasi NH3 dalam rumen akan rendah.
Penelitian ini menggunakan onggok sebagai sumber karbohidrat yang mudah terfermentasi. Ranjhan (1977) menyatakan bahwa peningkatan jumlah karbohidrat yang mudah difermentasi akan mengurangi produksi NH3, karena terjadi kenaikan penggunaan NH3 untuk pertumbuhan protein mikroba. Kondisi yang ideal adalah sumber energi tersebut difermentasi sama cepatnya dengan pembentukan NH3, dengan cara menyediakan karbohidrat nonstruktural atau readily available carbohydrate (RAC) dan nitrogen secara seimbang (Syahrir et al., 2009). Diharapkan pada saat NH3 terbentuk, terdapat produk fermentasi asal karbohidrat (VFA) yang akan digunakan sebagai sumber kerangka karbon dari asam amino protein mikroba yang prekursor utamanya berasal dari NH3. Mikroba rumen memiliki kemampuan untuk mengubah urea sebagai sumber non protein nitrogen (NPN) menjadi protein, karena ketika memasuki rumen urea segera dihidrolisis menjadi NH3 oleh enzim urease dari bakteri (McDonald et al., 2002).
Rasio VFA dan Amonia (NH3)
Menurut Prayuwidayati dan Widodo (2007), rasio antara VFA terhadap NH3 mempengaruhi kecukupan kebutuhan mikroba rumen untuk metabolisme optimal di dalam rumen. Pada penelitian Prayuwidayati dan Widodo (2007), didapatkan rasio VFA dan NH3 sebesar 9,75–14,55. Rasio antara VFA dan NH3 yang dihasillkan dari penelitian ini berkisar antara 18,40–25,66. Rasio pada penelitian ini lebih tinggi jika dibandingkan hasil Prayuwidayati dan Widodo (2007). Hal tersebut dikarenakan konsentrasi VFA yang dihasilkan pada penelitian ini (110,24–171,49 mM) lebih tinggi dibandingkan hasil Prayuwidayati dan Widodo (2007) (70,00–90,00 mM), sementara konsentrasi NH3 yang dihasilkan (5,47–7,48 mM) lebih rendah dibandingkan konsentrasi NH3 yang dihasilkan Prayuwidayati dan Widodo (2007) yang berkisar antara 5,84–9,36 mM. Konsentrasi VFA yang tinggi sementara konsentrasi NH3 yang rendah diduga mengurangi efisiensi pembentukan protein mikroba, karena banyak tersedianya kerangka karbon bagi pembentukan protein mikroba tidak diimbangi dengan sumber nitrogen utama bagi sintesis protein mikroba.
Alantoin
Alantoin dapat digunakan untuk memperkirakan produksi protein mikroba rumen, karena alantoin dikeluarkan oleh ternak dalam jumlah yang lebih konstan dari derivat purin lainnya (Orellana-Boero et al., 2001). Lebih lanjut Chen dan Gomes (1995) menyatakan bahwa dalam 100% derivat purin yang diekskresikan di urin, 85%-nya merupakan senyawa alantoin. Kadar alantoin dalam urin yang dihasilkan dari perlakuan dapat dilihat pada Tabel 7.
Tabel 7. Rataan Alantoin Domba Perlakuan
Parameter Perlakuan SEM
M0 MJ MIL MILT
Ekskresi Alantoin (mmol/l) 0,19 0,15 0,17 0,25 0,02 Ekskresi Derivat Purin (mmol/l) 0,22 0,18 0,20 0,30 0,02
Keterangan: M0 = pakan kontrol (tanpa minyak),
MJ = pakan yang mengandung 1,5% minyak jagung, MIL = pakan yang mengandung 1,5% minyak ikan lemuru,
Pada Tabel 7, alantoin yang diekskresikan oleh domba tidak dipengaruhi secara nyata (P>0,05) perlakuan sumber asam lemak tak jenuh yang diberikan. Ekskresi alantoin yang tidak berbeda secara nyata menandakan bahwa pemberian minyak yang berbeda sebagai sumber asam lemak tak jenuh pada level 1,5% masih termasuk dalam level yang aman dan memiliki pengaruh yang sama terhadap proses pembentukan derivat purin pada ternak. Walaupun tidak berbeda secara statistika, namun pemberian sumber asam lemak tak jenuh cenderung menurunkan ekskresi alantoin dibandingkan kontrol. Hal tersebut sesuai dengan pernyataan Jalč et al. (2006) yang menyatakan pemberian lemak yang tinggi dapat membatasi sintesis yang dilakukan oleh mikroba rumen. Asam lemak tidak jenuh memiliki efek toksik bagi bakteri.
Nilai kisaran yang didapatkan dari penelitian ini (0,15–0,25 mmol/l) lebih rendah dibandingkan penelitian Nurlaela (2006) yang membandingkan derivat purin antara domba dan kambing lokal, dengan nilai yang diperoleh pada alantoin domba lokal adalah 0,22–0,24 mM. Perbedaan nilai ekskresi alantoin ini diduga karena kecepatan bahan keluar dari rumen, kecepatan absorpsi amonia, kecepatan pemecahan nitrogen pakan, dan jenis fermentasi mikroba berdasarkan jenis pakannya. Besarnya mikroba yang tersedia untuk ternak kemungkinan sangat dipengaruhi oleh tingkat pemberian pakan (Chen et al., 1992).
Neraca Nitrogen (N)
Konsumsi Nitrogen (N)
Hasil pengukuran konsumsi nitrogen (N) dapat dilihat pada Tabel 8. Ransum perlakuan yang diberikan tidak memberikan pengaruh yang nyata (P>0,05), saat nilainya dihitung per gram per ekor per hari maupun per bobot badan metabolis terhadap konsumsi N ternak percobaan.
konsumsi protein domba lokal betina sebesar 72,87±15,92 g/e/h. Jika konsumsi protein tersebut dikonversikan menjadi konsumsi N, akan dihasilkan nilai konsumsi N sebesar 11,66±2,55 g/e/h. Nilai tersebut serupa dengan yang dihasilkan dari penelitian tersebut.
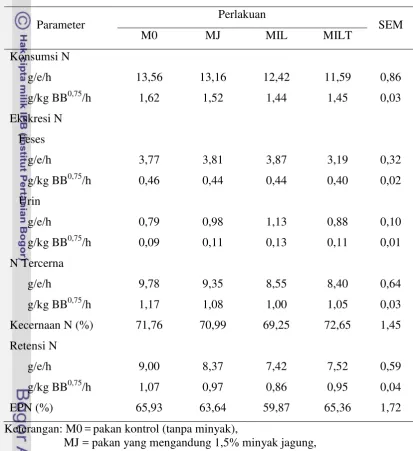
Tabel 8. Nilai Neraca Nitrogen Domba Perlakuan
Parameter Perlakuan SEM
M0 MJ MIL MILT
Konsumsi N
g/e/h 13,56 13,16 12,42 11,59 0,86
g/kg BB0,75/h 1,62 1,52 1,44 1,45 0,03
Ekskresi N Feses
g/e/h 3,77 3,81 3,87 3,19 0,32
g/kg BB0,75/h 0,46 0,44 0,44 0,40 0,02
Urin
g/e/h 0,79 0,98 1,13 0,88 0,10
g/kg BB0,75/h 0,09 0,11 0,13 0,11 0,01
N Tercerna
g/e/h 9,78 9,35 8,55 8,40 0,64
g/kg BB0,75/h 1,17 1,08 1,00 1,05 0,03
Kecernaan N (%) 71,76 70,99 69,25 72,65 1,45
Retensi N
g/e/h 9,00 8,37 7,42 7,52 0,59
g/kg BB0,75/h 1,07 0,97 0,86 0,95 0,04
EPN (%) 65,93 63,64 59,87 65,36 1,72
Keterangan: M0 = pakan kontrol (tanpa minyak),
MJ = pakan yang mengandung 1,5% minyak jagung, MIL = pakan yang mengandung 1,5% minyak ikan lemuru,
MILT = pakan yang mengandung 1,5% minyak ikan lemuru terproteksi. SEM = standard error of mean, EPN = efisiensi pemanfaatan N.
nilai konsumsi N didapatkan dari hasil perkalian antara konsumsi N dengan 0,16; yang merupakan kandungan N rata-rata dalam protein. Jika dilihat dari kandungan protein kasar hasil analisis laboratorium, pola konsumsi N dalam gram per ekor per hari mengikuti pola kandungan protein kasar ransum, walaupun hasilnya tidak berbeda secara statistika. Konsumsi N tertinggi penelitian ini diperoleh oleh domba kontrol, dengan kandungan protein kasar yang tertinggi. Sementara konsumsi N terendah diperoleh domba MILT, dengan kandungan protein kasar yang terendah. Tidak berbeda nyatanya konsumsi N dapat disebabkan karena tidak berbedanya konsumsi bahan kering yang diperoleh. Rataan konsumsi bahan kering yang didapatkan antara lain M0 458,09 g/e/h; MJ 482,91 g/e/h; MIL 470,48 g/e/h; dan MILT 437,78 g/e/h (Ici, 2012).
Nitrogen (N) Feses
Perlakuan yang diberikan tidak menimbulkan perbedaan yang nyata (P>0,05) terhadap jumlah N dalam feses dihitung per gram per ekor per hari maupun per bobot badan metabolis ternak (Tabel 8). Ekskresi N dalam feses yang tidak berbeda pada penelitian ini menunjukkan bahwa pemberian minyak yang berbeda sebagai sumber asam lemak tak jenuh pada level 1,5% memiliki pengaruh yang sama terhadap proses pencernaan nitrogen ternak.
Kandungan N dalam feses yang dihasilkan dalam penelitian ini yaitu 3,19– 3,87 g/e/h. Kandungan N tersebut masih berada dalam kisaran kadar N yang dikeluarkan dari feses domba lokal betina pada penelitian Khoerunnisa (2006) yang membandingkan metabolisme N antara domba dan kambing lokal, yakni 3,05±1,25 g/e/h.
perlakuan MIL, dan 0,72% pada perlakuan MILT dari konsumsi bahan kering domba. Hal tersebut diduga karena pemakaian bungkil kelapa sebagai bahan yang sulit didegradasi dalam pakan penelitian ini. Swanson et al. (2000) yang melaporkan adanya kecenderungan untuk kehilangan N melalui feses lebih banyak pada tambahan yang lambat didegradasi dibandingkan dengan tambahan yang cepat didegradasi.
Nitrogen (N) Urin
Berdasarkan hasil sidik ragam, tidak ada pengaruh yang nyata (P>0,05) terhadap nilai nitrogen (N) urin per gram per ekor per hari atau per bobot badan metabolis dari perlakuan yang diberikan. Ekskresi N dalam urin yang tidak berbeda pada penelitian ini menunjukkan bahwa pemberian minyak yang berbeda sebagai sumber asam lemak tak jenuh pada level 1,5% memiliki pengaruh yang sama terhadap proses metabolisme nitrogen ternak. Nitrogen yang diekskeresikan dalam urin tertera di Tabel 8.
Pengeluaran N melalui urin memiliki korelasi linier dengan tingkat konsumsi ransum dan pengeluaran N feses (Smith et al., 1992). Hasil samping dari proses metabolisme protein di dalam tubuh dikeluarkan di urin dalam bentuk kreatinin, amonia, asam amino, urea, (Banerjee, 1982), dan derivat purin (asam urat, alantoin, xanthine, dan hipoxanthine) (Chen dan Gomes, 1995). Menurut Roy (1970), faktor-faktor yang mempengaruhi kadar N dalam urin antara lain tingkat konsumsi N, penyerapan nitrogen dalam tubuh, sumber N, tingkat protein ransum, koefisen cerna protein, bentuk fisik dan macam bahan pakan, tingkat energi ransum, serta fase pertumbuhan ternak.
Kecernaan Nitrogen (N)
Nilai nitrogen (N) tercerna per gram per ekor atau per bobot badan metabolis serta nilai kecernaan N yang diperoleh pada penelitian ini tidak berbeda nyata (P>0,05). Hal tersebut menandakan bahwa pemberian minyak yang berbeda sebagai sumber asam lemak tak jenuh pada level 1,5% memiliki pengaruh yang sama terhadap proses pencernaan nitrogen ternak.
Kecernaan N dipengaruhi oleh ransum perlakuan yang diberikan, karena McDonald et al. (2002) menyebutkan bahwa kecernaan protein tergantung pada banyaknya kandungan protein di dalam pakan. Secara lengkap nilai N yang tercerna dan persentase kercernaan N disajikan pada Tabel 8. Dari tabel tersebut diketahui bahwa nilai kecernaan N berkisar antara 69,25%–72,65%. Hasil tersebut serupa dengan yang dilaporkan oleh Khoerunnisa (2006), yang menyatakan bahwa kecernaan protein pada domba lokal betina memiliki nilai 69,45%±6,53%.
Retensi Nitrogen (N)
Retensi nitrogen N merupakan selisih perhitungan antara N yang dikonsumsi dengan N yang diekskresikan melalui feses dan urin. Perhitungan retensi N dapat digunakan untuk menilai kualitas pakan yang diberikan, apakah pakan tersebut telah memenuhi kebutuhan hidup pokok bagi ternak ataukah ternak harus merombak N yang berada di jaringan tubuhnya untuk menutupi kekurangan dari pakan.
Pengaruh ransum perlakuan terhadap retensi N disajikan pada Tabel 8, yang menunjukkan ransum perlakuan berpengaruh tidak nyata (P>0,05) mempengaruhi N yang teretensi dalam tubuh ternak. Retensi N yang tidak berbeda pada penelitian ini menunjukkan bahwa pemberian minyak yang berbeda sebagai sumber asam lemak tak jenuh pada level 1,5% memiliki pengaruh yang sama terhadap proses pemanfaatan nitrogen dalam tubuh ternak.
mungkin dapat menjadi suatu indikator bahwa level 1,5% penambahan sumber asam lemak tak jenuh masih kurang untuk kebutuhan ternak. Tidak berbedanya nilai retensi N menandakan defisiensi tersebut tidak terlalu besar. Menurut McDonald et al. (2002), defisiensi asam lemak tak jenuh dalam pakan dapat menurunkan nilai retensi nitrogen dalam tubuh. Hal tersebut dikarenakan MJ yang banyak mengandung asam linoleat dan asam linolenat serta MIL yang banyak mengandung asam arakhidonat, merupakan prekursor dari prostaglandin yang berfungsi dalam penyerapan nutrien (Adawiah et al., 2006). Khoerunnisa (2006) mendapatkan nilai retensi N bagi ternak domba lokal berjenis kelamin betina yakni 8,00±1,23 g/e/h. Pada penelitian ini didapatkan nilai retensi N domba yang diberi perlakuan tidak berbeda dari retensi N yang diperoleh Khoerunnisa (2006), yakni antara 7,42–9,00 g/e/h.
Pemberian minyak sebagai sumber asam lemak tak jenuh dalam pakan dapat digunakan untuk menilai efisiensi penggunaan N. Pemberian lemak yang tinggi kalorinya akan meningkatkan kandungan energi di dalam pakan. Jika energi yang terdapat dalam pakan telah cukup untuk memenuhi kebutuhan hidup pokok dan produksi ternak, maka ternak dapat mendepositkan nitrogen dan nutrien lainnya ke dalam jaringan tubuh. Namun jika energi dalam pakan masih kurang untuk memenuhi kebutuhan ternak, kemungkinan ternak akan merombak protein tubuhnya menjadi sumber energi.
perlu merombak jaringan tubuh untuk memenuhi kebutuhannya sebagai konsekuensi atas kehilangan pada proses pencernaan (Purbowati, 2001). Ternak mengalami penyimpanan protein di dalam jaringan, yang ditandai dengan adanya peningkatan bobot badan harian pada domba perlakuan sebagai akibat dari penambahan urat daging atau deposit lemak tubuh, serta mengalami pertumbuhan jaringan baru.
Gambar 9. Regresi dari Retensi N dan N Konsumsi
Kemapuan ternak untuk meretensi N ke dalam jarimgan tubuh dipengaruhi oleh pasokan protein dan energi dalam pakan. Adanya proses deposisi nutrien ke dalam jaringan tubuh merupakan suatu indikator terjadinya pertumbuhan ternak yang ditandai dengan adanya pertambahan bobot badan harian (PBBH). Adawiah et al. (2006) melaporkan adanya peningkatan bobot badan yang disebabkan oleh peningkatan retensi N ternak dan efisiensi penggunaan lemak. Nilai PBBH yang dihasilkan dari penelitian ini antara lain 84,98 g/e/h (M0); 88,64 g/e/h (MJ); 82,05 g/e/h (MIL); dan 81,32 g/e/h (MILT) (Nopita, data belum dipublikasikan). Walaupun hasil pengujian statistika menunjukkan pengaruh yang tidak nyata (P>0,05) baik terhadap nilai N yang teretensi ataupun PBBH ternak, namun terdapat kecenderungan tidak terdapat pola hasil yang sama antara retensi N dengan PBBH. Perlakuan yang cenderung memiliki nilai retensi N tertinggi (MJ) tidak menghasilkan PBBH yang tertinggi, dan perlakuan yang cenderung memiliki nilai retensi N terendah (MIL) tidak lantas menghasilkan PBBH yang terendah pula. Hal tersebut diduga disebabkan oleh perbedaan kebutuhan energi dan protein untuk keperluan hidup pokok. Nutrien yang dibutuhkan untuk keperluan produksi dapat dimanfaatkan jika keperluan nutrien untuk hidup pokoknya sudah terpenuhi. Purbowati (2001) menyatakan bahwa hasil pengurangan N dalam pakan dengan N
Y = 0,632 X + 0,070
Retensi N
(g/e/h)
yang hilang selama pencernaan merupakan N yang tersedia untuk hidup pokok dan produksi. Adanya nitrogen yang tersimpan dalam tubuh dapat menghasilkan pertambahan bobot badan yang akan mempercepat bobot dewasa kelamin. Hasil penelitian dari Puastuti (2005) menunjukkan bahwa nilai retensi yang positif, antara 9,2–11,8 g/e/h menghasilkan pertambahan bobot badan harian sebesar 92–151 g/e/h. Efisiensi Penggunaan Nitrogen (Efficiency N Utilization/EPN)
KESIMPULAN DAN SARAN
Kesimpulan
Pakan dengan penambahan minyak jagung dan minyak ikan lemuru sebagai sumber asam lemak tidak jenuh pada level 1,5% mampu memperbaiki nilai VFA, tanpa mengganggu produksi amonia dan populasi protozoa dalam rumen, alantoin urin, serta neraca nitrogen dalam tubuh.
Saran
FERMENTABILITAS, POPULASI PROTOZOA, ALANTOIN
URIN, DAN NERACA NITROGEN DOMBA LOKAL
CALON INDUK YANG DIBERI SUMBER
ASAM LEMAK TAK JENUH BERBEDA
SKRIPSI
DARA OKTI SARI
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
FERMENTABILITAS, POPULASI PROTOZOA, ALANTOIN
URIN, DAN NERACA NITROGEN DOMBA LOKAL
CALON INDUK YANG DIBERI SUMBER
ASAM LEMAK TAK JENUH BERBEDA
SKRIPSI
DARA OKTI SARI
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN