MORFOLOGI, MOLEKULER DAN SENYAWA AKTIF
TANAMAN SAMBILOTO
(Andrographis paniculata (Burm.f.) Wallich Ex Ness)
JUWARTINA IDA ROYANI
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul “Pengaruh
Irradiasi Sinar Gamma Cobalt 60 Terhadap Perubahan Karakter Morfologi, Molekuler dan Senyawa Aktif Tanaman Sambiloto (Andrographis paniculata
(Burm.f.) Wallich Ex Ness)” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Bogor, Agustus 2012
ABSTRACT
JUWARTINA IDA ROYANI. Pengaruh Irradiasi Sinar Gamma Cobalt 60 Terhadap Perubahan Karakter Morfologi, Molekuler dan Senyawa Aktif Tanaman Sambiloto (Andrographis paniculata (Burm.f.) Wallich Ex Ness). Supervisor AGUS PURWITO and WAHONO SUMARYONO
Sambiloto (Andrographis paniculata (Burm.f.) Wallich Ex Ness) is a medicinal plant that became the pre-eminent national and prospective to be developed in Indonesia. Self pollination from sambiloto affected of the low of genetic variation. Irradiation is one strategy that can be used to increase the genetic diversity for economically important characters and improve the content of the active compounds in medicinal plants. One method to increase the genetic diversity is by using irradiation. The change of mutan character in medicinal plants by irradiation can be detected by morphological and molecular. Detection of characters change by morphology character is done by observing changes in phenotype, while in molecular character can be done at the DNA level by PCR analysis. The aim of this research was to change mutan character of sambiloto plants by irradiaton with gamma rays on morphology and molecular character. Seeds of sambiloto in clean plastic were irradiated in Cobalt 60 Gamma Chamber machine with dose treatment were: 0, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 125, 150, 175, 200, 225, 250, 275 and 300 Gy. Morphological observation was performed on sambiloto mutan in M1V0, M1V1, M1V2 and M1V3 generations. Analysis of molecular mutant by 10 primers of ISSR was used to obtain DNA profiles. Detection of pytochemical profiles has been done by HPLC method. The
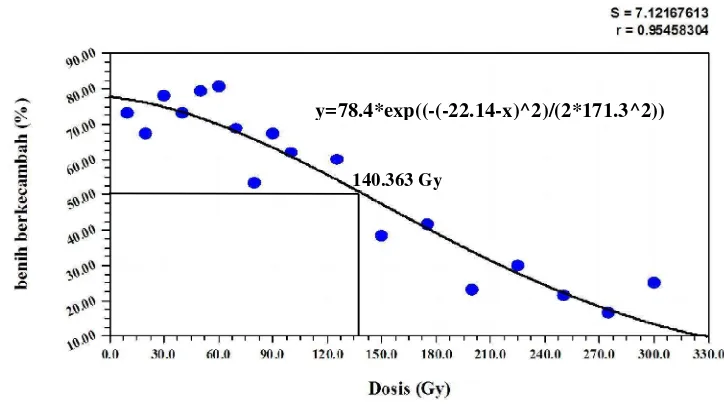
result of LD50 analyzed by using CurveExpert 1.3 was obtained 140.363 Gy.
There were morphological changes between irradiated plants and control. Analysis of varians showed significant result of some observed character. Analysis of DNA profiles showed 5 primers can distinguish changes of DNA profiles, 4 primers showed the same number and size bands and 1 primer could not amplified. Analysis of genetic similarity obtained 6 groups with genetic distance 0.79-1.00. Analysis of chemichal profiles using HPLC showed different
andrographolide content ranged from 6.5%-10.9%. More higher doses showed
more high andrographolide content. Phytochemical profiles showed 3 mutants
had additional peakcompared to control.
Keywords: Andrographis paniculata, gamma Cobalt 60, DNA profiles,
RINGKASAN
JUWARTINA IDA ROYANI. Pengaruh Irradiasi Sinar Gamma Cobalt 60 Terhadap Perubahan Karakter Morfologi, Molekuler dan Senyawa Aktif Tanaman Sambiloto (Andrographis paniculata (Burm.f.) Wallich Ex Ness). Pembimbing AGUS PURWITO, and WAHONO SUMARYONO
Sambiloto (Andrographis paniculata (Burm.f.) Wallich Ex Ness, 2n=28) adalah salah satu tanaman obat yang menjadi unggulan nasional dan diprioritaskan serta prospektif untuk dikembangkan di Indonesia. Kebutuhan sambiloto untuk industri obat tradisional (IOT) di Indonesia mencapai 33.47 ton simplisia kering atau setara dengan 709.60 ton terna basah pertahun. Produksi tanaman obat sambiloto pada tahun 2009 menurut BPS (2012) adalah sebesar 4 334 768 kg. Diperkirakan kebutuhan sambiloto ini akan terus meningkat seiring
dengan peningkatan nilai pertumbuhan tahunan (annual growth rate) pasar dunia
untuk pengobatan herbal antara 5-15%.
Penyerbukan dari sambiloto adalah penyerbukan sendiri, yang berakibat pada keragaman genetik tanaman sambiloto yang rendah. Pemuliaan atau perbaikan mutu tanaman adalah salah satu strategi yang dapat digunakan untuk mempertinggi keragaman genetik dan meningkatkan kandungan senyawa aktif pada tanaman obat. Pemuliaan tanaman menghendaki adanya variasi genetik dari sifat tanaman yang bermutu yang dapat berguna untuk perbaikan sifat tanaman. Salah satu metode untuk meningkatkan keragaman adalah dengan irradiasi yang terbukti dapat menghasilkan mutan. Mutasi disebabkan perubahan materi genetik yang pada umumnya dapat diekspresikan pada fenotif tanaman dan diturunkan ke generasi selanjutnya secara genetik.
Induksi mutasi merupakan metode yang paling mudah dalam menciptakan variabilitas genetik dibandingkan dengan metode pemuliaan yang lainnya. Mutasi dengan menggunakan irradiasi pengion merupakan salah satu pilihan yang paling banyak digunakan untuk membentuk mutan. Hal ini disebabkan karena kemudahan aplikasinya dan kekuatan daya tembusnya dalam menembus jaringan tanaman. Pengaruh irradiasi sinar gamma secara biologi didasarkan pada interaksi dengan atom atau molekul dalam sel, terutama air untuk membentuk radikal bebas. Radikal bebas ini dapat merusak atau memodifikasi komponen yang penting pada sel tanaman dan telah dilaporkan berakibat pada perubahaan tanaman baik secara morfologi, anatomi, biokimia dan fisiologi tanaman, bergantung pada dosis irradiasi yang diberikan.
Tujuan dari penelitian ini adalah untuk mendapatkan mutan tanaman sambiloto dengan menggunakan irradiasi dengan sinar gamma Cobalt 60.
Hasil yang didapatkan adalah semakin tinggi dosis yang diberikan menyebabkan semakin rendah daya germinasi biji yang tumbuh. Angka letal dosis irradiasi (LD50) berada pada dosis 140.363 Gy. Deteksi secara morfologi terjadi
beberapa perubahan karakter morfologi dari karakter asalnya. Perubahan morfologi yang sangat nyata terlihat pada karakter bagian daun dibandingkan bagian yang lainnya. Deteksi secara molekuler didapatkan hasil dari 10 primer ISSR yang digunakan 5 primer polimorfik, 4 monomorfik dan 1 primer tidak dapat mengamplifikasi DNA genom sambiloto. Dari data dendogram mendapatkan 6 kelompok besar dengan masing-masing kelompok terbagi atas sub kluster dengan jarak genetik dari 0.79 sampai dengan 1.00. Deteksi secara fitokimia didapatkan data bahwa semakin tinggi dosis yang diberikan semakin tinggi kadar andrographolide yang dihasilkan. Kadar andrographolide berada pada kisaran 6.5%-10.9%. Adanya perbedaan profil fitokimia pada mutan sambiloto DB60, DG70 dan DG275 kemungkinan menghasilkan senyawa baru jika dibandingkan dengan profil fitokimia tanaman sambiloto kontrol. Dari penelitian ini terdapat peningkatan kadar andrographolide sampai dengan 1.66% dibandingkan dengan kontrol, hal ini didapat jika tanaman diperbanyak secara ex vitro.
©Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan
karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh Karya
PENGARUH IRRADIASI SINAR GAMMA COBALT 60
TERHADAP PERUBAHAN KARAKTER
MORFOLOGI, MOLEKULER DAN SENYAWA AKTIF
TANAMAN SAMBILOTO
(Andrographis paniculata (Burm.f.) Wallich Ex Ness).
JUWARTINA IDA ROYANI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada Mayor Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA
INSTITUT PETANIAN BOGOR
PERSEMBAHAN
Dengan (air hujan) it u Dia m enumbuhkan unt uk kamu t anam- t anaman, zait un,
kur m a, anggur, dan segala m acam buah- buahan. Sungguh, pada yang dem ikian it u
benar - benar t erdapat t anda (kebesar an Allah) bagi or ang yang ber pikir
(Al- Qur an Sur at An- Nahl ayat 1 1 ).
Kat akanlah: "Kalau sekir anya laut an m enjadi t int a unt uk (menulis) kalim at - kalim at
Tuhanku, sungguh habislah laut an itu sebelum habis (dit ulis) kalimat - kalimat Tuhanku,
meskipun Kami dat angkan t am bahan sebanyak it u (pula)
(Al- Qur an Sur at Al- Kahfi ayat 1 0 9 ).
Kar ya t ulis ini penulis per sembahkan buat per kem bangan ilm u penget ahuan dan
kem ajuan saint ifikasi t anam an obat di Indonesia.
Secar a khusus penulis hat ur kan kar ya kecil ini buat dua put r aku RAKHA & RAZ AN:
be alw ays posit ive t hinking, remember w ho ABOVE, looked down in st epping, and be
PRAKATA
Tiada daya dan upaya selain dari pertolongan Allah SWT pemilik dan tempat kembali semua makhlukNya. Alhamdulillah, puji syukur penulis panjatkan ke hadirat Allah SWT atas kemudahan, kelancaran dan berkah yang selalu diberikan sehingga penulis dapat menyelesaikan penelitian tesis ini. Tesis ini dibuat sebagai salah satu syarat untuk memperoleh gelar Magister Sains dengan judul Pengaruh Irradiasi Sinar Gamma Cobalt 60 Terhadap Perubahan Karakter
Morfologi, Molekuler dan Senyawa Aktif Tanaman Sambiloto (Andrographis
paniculata (Burm.f.) Wallich Ex Ness).
Dalam penulisan tesis ini banyak bantuan dan dukungan dari berbagai pihak yang telah penulis dapatkan untuk itu penulis mengucapkan terimakasih dan penghargaan yang setinggi-tinginya kepada:
1. Dr. Ir. Agus Purwito, MSc. Agr. dan Prof. Dr. Wahono Sumaryono, Apt. selaku pembimbing yang telah memberikan bimbingan, pengarahan, bantuan, dukungan, kemudahan dan doa dalam menyelesaikan tesis ini.
2. Dr. Ir. Trikosoemaningtyas, MSc. selaku Ketua Mayor Program Pemuliaan
dan Bioteknologi Tanaman di Departemen AGH IPB, yang telah memberikan kemudahan dan dorongan bagi studi saya di IPB.
3. Dr. Ir. Dewi Sukma, MSi. dan Dr. Ir. Darda Effendi, MS. sebagai penguji tesis, yang telah banyak memberikan masukan, saran dan perbaikan demi sempurnanya tesis ini.
4. Pimpinan Kementerian Negara Riset dan Teknologi yang telah memberikan
beasiswa dan kesempatan kepada penulis untuk mengikuti pendidikan magister di IPB serta Pimpinan Balai Pengkajian Bioteknologi, BPPT yang telah memberikan kesempatan dan fasilitas kepada penulis untuk melakukan penelitian ini.
5. Kepada suamiku tercinta Dudi Hardianto, S.Si, M.Si, Apt. dan dua buah hati
kami (Rakha & Razan) yang telah memberikan semangat, dorongan, kesabaran dan pengertiannya sampai terselesaikannya tesis ini.
6. Kepada Dr. rer. nat Anis Mahsunah, MEng, Dwi Rizkyanto Utomo, Amd,
Tim Riset Tanaman Obat, Staf dan teknisi Laboratorium Mikropropagasi, Pilot Plant Propagasi Tanaman, Laboratorium Teknologi Gen, dan Laboratorium Recovery Balai Pengkajian Bioteknologi BPPT, teman-teman PBT 2009 serta Ir. Sri Wahyuni dari Balittro
7. Dan semua pihak yang tidak bisa penulis sebutkan satu persatu yang telah membantu dalam menyelesaikan penelitian ini, semoga segala kebaikan yang telah diberikan mendapatkan pahala berlipat dari Allah SWT.
Tesis ini masih kurang dari sempurna untuk itu kritik dan saran penulis harapkan demi kesempurnaan tesis ini. Akhir kata penulis berharap agar tesis ini dapat bermanfaat bagi perkembangan ilmu pengetahuan terutama mendukung saintifikasi dan kemajuan tanaman obat di Indonesia, serta dapat menginspirasi penelitian selanjutnya, dan membawa keberkahan dunia dan akhirat. Aamiin Ya Robbal Aalamiin.
RIWAYAT HIDUP
Penulis dilahirkan di Magelang pada tanggal 10 Januari 1973, sebagai anak terakhir dari pasangan Lettu POM Much Djamil (Alm) dan Hj. Siti Dawamah (Almh). Penulis menikah dengan Dudi Hardianto, S.Si, MSi, Apt dan dikaruniai dua putra yaitu Rakha Aiman Mumtaz dan Razan Ahmad Yazid Ilmany.
Penulis menyelesaikan pendidikan Sarjana di Jurusan Biologi Universitas Brawijaya Malang pada tahun 1998. Sejak tahun 1999 sampai sekarang penulis bekerja sebagai peneliti di Instansi Badan Pengkajian dan Penerapan Teknologi dengan spesifikasi penelitian di bidang bioteknologi tanaman. Pada tahun 2003 penulis berkesempatan mendapatkan pelatihan kultur jaringan tanaman kehutanan di Tuscia University Viterbo Italia. Pada tahun 2009 penulis mendapatkan kesempatan melanjutkan pendidikan S2 pada Mayor Pemuliaan dan Bioteknologi Tanaman Departeman Agronomi dan Hortikultura atas beasiswa dari Kementrian Negara Riset dan Teknologi.
Pada penelitian tesis ini karya tulis ilmiah yang telah dipublikasikan berjudul “Pengaruh Irradiasi Sinar Gamma Cobalt 60 terhadap Karakter
Morfologi Tanaman Obat Sambiloto (Andrographis paniculata (Burm.f.) Wallich
Ex Ness)” dalam Prosiding Seminar Nasional POKJANAS TOI XLII yang
diselenggarakan di Bandung pada tanggal 16-17 Mei 2012 dan Molecular
Analysis of Sambiloto Mutants (Andrographis paniculata (Burm.f.) Wallich Ex
Ness) Induced by Gamma Radiation dalam Prosiding the 5th International
Biotechnology Conference yang diselenggarakan di Lombok pada tanggal 4-7 Juli
DAFTAR ISI
Halaman
DAFTAR TABEL………. xiii
DAFTAR GAMBAR………... xiv
DAFTAR LAMPIRAN………. xv
1. PENDAHULUAN 1.1. Latar Belakang………... 1
1.2. Tujuan Penelitian………….………... 5
1.3. Hipotesis……….……… 5
2. TINJAUAN PUSTAKA 2.1. Botani dan Taksonomi Tanaman Sambiloto……….…. 7
2.2. Efek Farmakologi Sambiloto………. 10
2.3. Perbaikan Mutu Tanaman Obat………. 14
2.4. Irradiasi Sinar Gamma pada Tanaman Obat………... 15
2.5. Deteksi Mutan Hasil Irradiasi……….……… 19
2.5.1. Deteksi Perubahan Morfologi Mutan……… 20
2.5.2. Deteksi Perubahan Profil DNA Mutan………. 20
2.5.3. Deteksi Perubahan Profil Fitokimia Mutan……….…. 21
3. METODE PENELITIAN 3.1. Waktu dan Tempat Penelitian………... 24
3.2. Bahan dan Alat Penelitian………. 24
3.3. Prosedur Penelitian……… 25
3.3.1. Irradiasi Biji Sambiloto………... 26
3.3.2. Penghitungan Letal Dosis Irradiasi (LD50)………….. 26
3.3.3. Penanaman dan Perbanyakan Sambiloto Hasil Irradiasi……… 26
3.3.4. Deteksi Perubahan Mutan secara Morfologi………… 27
3.3.5. Deteksi Perubahan Profil DNA Mutan dengan Penanda Molekuler……….………….. 27
3.3.6. Deteksi Perubahan Profil Fitokimia Mutan dengan HPLC... 29
4. HASIL DAN PEMBAHASAN 4.1. Pengaruh Irradiasi pada Germinasi Biji Sambiloto…….……... 31
4.2. Pengaruh Irradiasi pada Karakter Morfologi Generasi M1V0-M1V3……….. 32
4.2.2. Pertumbuhan Tanaman Sambiloto Generasi M1V0…. 36
4.2.3. Pertumbuhan Tanaman Sambiloto Generasi M1V1…. 38
4.2.4. Pertumbuhan Tanaman Sambiloto Generasi M1V2…. 39
4.2.5. Pertumbuhan Tanaman Sambiloto Generasi M1V3…. 41
4.3. Perubahan Profil DNA Mutan Sambiloto Generasi M1V2…… 42
4.4. Perubahan Profil Fitokimia Mutan Tanaman Sambiloto Generasi M1V4………... 47
5. KESIMPULAN DAN SARAN 5.1. Kesimpulan……….……… 54
5.2. Saran……….……….. 54
DAFTAR PUSTAKA……….……… 56
LAMPIRAN………..……….. 65
DAFTAR TABEL
Halaman
1 Produksi tanaman obat-obatan di Indonesia ………. 2
2 Perubahan karakter pada tanaman sambiloto hasil irradiasi pada
generasi M1V0, M1V1 dan M1V2……… 33
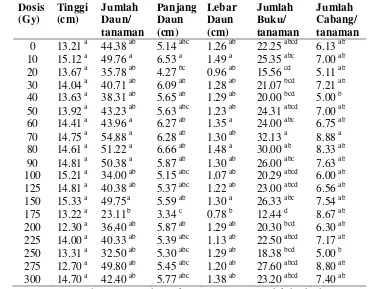
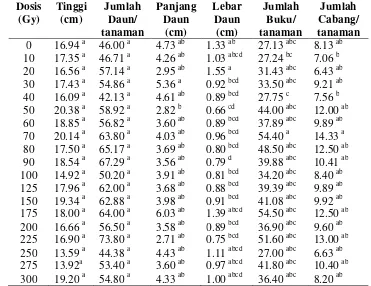
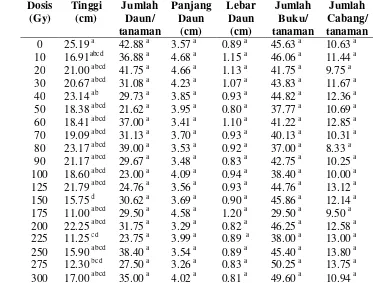
3 Nilai tengah beberapa peubah pada tanaman sambiloto yang berasal
dari biji hasil irradiasi pada generasi M1V0 umur 10 MST………….. 37
4 Nilai tengah beberapa peubah pada tanaman sambiloto yang berasal
dari biji hasil irradiasi pada generasi M1V1 umur 8 MST..………….. 38
5 Nilai tengah beberapa peubah pada tanaman sambiloto yang berasal
dari biji hasil irradiasi pada generasi M1V2 umur 8 MST..………….. 40
6 Nilai tengah beberapa peubah pada tanaman sambiloto yang berasal
dari biji hasil irradiasi pada generasi M1V3 umur 8 MST..………….. 41
7 Total jumlah, ukuran dan pita polimorfik DNA tanaman sambiloto
DAFTAR GAMBAR
Halaman
1 Tanaman Sambiloto………... 7
2 Bunga, biji dan kapsul buah tanaman sambiloto……… 9
3 Struktur kimia dari 4 komponen utama diterpenoid yang terdapat
pada tanaman sambiloto: andrographolide, dehydroandrographolide,
deoxyandrographolide dan neoandrographolide ………... 10
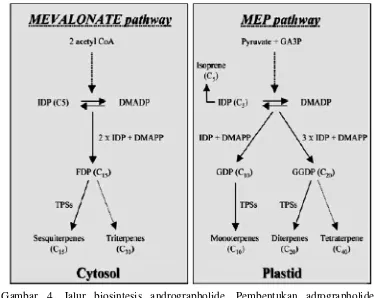
4 Jalur biosintesis andrographolide. Pembentukan adrographolide
melalui jalur MVA dan jalur MEP/DXP di sitosol dan plastid……….. 13
5 Jalur diterpen yang dihasilkan dari oxido GGDP/GGPP
menghasilkan senyawa andrographolide………... 13
6 Pengaruh seluler secara langsung dan tidak langsung irradiasi pada
makromolekul………. 16
7 Kerangka kerja penelitian………... 25
8 Kurva Gaussian Model dari benih berkecambah tanaman sambiloto
setelah irradiasi sinar gamma ..……….. 31
9 Perubahan karakter morfologi tanaman sambiloto hasil irradiasi
sinar gamma pada beberapa generasi...………. 34
10 Tanaman sambiloto hasil irradiasi pada generasi M1V0
berumur 10 MST……… 37
11 Tanaman sambilot hasil irradiasi pada generasi M1V1
berumur 8 MST………. 39
12 Tanaman sambiloto hasil perbanyakan ex vitro pada generasi
M1V2 berumur 5 MST……… 40
13 Elektroforegram DNA genom mutan sambiloto……… 42
14 Elektroforegram DNA profil tanaman sambiloto hasil irradiasi
dengan 5 primer………..……… 45
15 Dendogram tanaman sambiloto hasil irradiasi sinar gamma dari data biner ISSR dengan menggunakan
klustering UPGMA……… 46
17 Kadar andrographolide pada 4 mutan (DB60, DG70, DG275 dan
DK300) dan kontrol (DN)……….. 49
18 Kromatogram hasil HPLC dari ekstrak metanol pada 4 mutan tanaman sambiloto DB60, DG70, DG275 dan DK300
DAFTAR LAMPIRAN
Halaman
1 Sequence primer ISSR yang digunakan………. 66
2 Tahapan isolasi DNA genom daun tanaman sambiloto………. 67
3 Analisa variasi (ANOVA) pada mutan tanaman sambiloto
generasi M1V0-M1V3………... 88
4 Data pertumbuhan tanaman sambiloto hasil irradiasi secara ex vitro… 72
5 Data kuantitatif dan kemurnian DNA genom mutan sambiloto……… 73
6 Data biner pola pita pada 32 mutan sambiloto dengan
5 primer ISSR... 74
7 Jarak genetik 32 mutan tanaman sambiloto hasil irradiasi……… 75
1.
PENDAHULUAN
1.1. Latar Belakang
Sampai saat ini World Health Organization (WHO) memperkirakan
bahwa kurang lebih 4 milyar penduduk dunia (± 80%) masih percaya pada
pengobatan tradisional (plant-based traditional medicine), seperti penggunaan
tanaman herba untuk pengobatan (Abdel-Hady et al. 2008). Dilaporkan telah
terjadi peningkatan penggunaan tanaman obat sebesar 4-10% selama dekade
90-an di Amerika maupun di Eropa. B90-anyak obat-obat90-an modern y90-ang sekar90-ang
digunakan berasal dan dikembangkan dari tanaman obat. WHO mencatat terdapat
119 jenis bahan aktif obat modern yang berasal dari tanaman obat (Suganda
2002). Dari data diketahui bahwa ada 500 juta resep yang ditulis oleh dokter di
Amerika dan 125 juta diantaranya adalah obat-obatan yang berasal dari bahan
aktif yang diisolasi dan dikembangkan dari tanaman (Leaman 2001). Menurut
Sekretariat Convention on Biological Diversity, penjualan global produk herbal
mencapai US$ 60 miliar pada tahun 2000 (Xiaorui 2003). Omzet penjualan
fitofarmaka Indonesia baru mencapai US$ 100 juta per tahun. Hal ini berarti,
kontribusi ekspor fitofarmaka Indonesia lebih kurang sekitar 0,22% (Anonim
2005).
Sambiloto (Andrographis paniculata (Burm.f.) Wallich Ex Ness) disebut
juga “King of bitters” adalah salah satu tanaman obat yang menjadi unggulan
nasional (Ditjen POM 2001) dan diprioritaskan serta prospektif untuk
dikembangkan di Indonesia (Kintoko 2006). Subramanian et al. (2012) bahkan
menuliskan bahwa sambiloto adalah a bitter plant with a sweet future untuk
menggambarkan prospektifnya tanaman obat ini. Tanaman ini tumbuh secara
alami di Asia Tenggara yaitu India (dan Sri Lanka), Pakistan dan Indonesia tetapi
dibudidayakan secara ekstensif di China dan Thailand, timur dan barat India, serta
Mauritius (Mishra et al. 2007).
Komponen utama senyawa aktif sambiloto adalah andrographolide yang
secara farmakologi berfungsi sebagai hepatoproteksi, gastroproteksi, anti-alergi,
anti-virus, antipiretic, vermicidal, anti-jerawat, analgesik, anti-inflammatory,
anti-hyperglycemic dan hypoglycemic, anti-diare, trombolityc disamping dapat juga
digunakan untuk peningkatan imunitas/immunomodulator (Mishra et al. 2007;
Jarukamjorn & Nemoto 2008; Akbar. 2011; Chowdhury. 2012). Penelitian yang
telah dilakukan di Bastyr University USA, bahkan menemukan aktivitas anti HIV
pada andrographolide tanaman sambiloto yang didapatkan dari Indonesia (Otake
et al. 1995).
Tabel 1. Produksi tanaman obat-obatan di Indonesia
Tahun
Jahe Laos/
Lengkuas Kencur Kunyit Temulawak Temuireng Sambiloto
(Kg) (Kg) (Kg) (Kg) (Kg) (Kg) (Kg)
2003 125,386,480 24,588,226 19,527,111 30,707,451 11,761,984 4,490,430 231,024
2004 104,788,634 24,298,854 22,609,057 40,467,232 16,666,504 6,174,186 566,956
2005 125,827,413 36,292,530 35,478,405 82,107,401 22,582,041 7,724,957 2,150,885
2006 177,137,949 44,369,523 47,081,020 112,897,776 21,359,086 5,607,046 2,656,234
2007 178,502,542 41,619,147 48,366,947 117,463,680 40,800,834 8,186,185 1,298,974
2008 154,963,886 50,092,846 38,531,160 111,258,884 23,740,105 8,817,235 7,716,432
2009 122,181,084 59,332,313 43,635,311 124,047,450 36,826,340 7,584,022 4,334,768
2010 107,734,608 58,961,844 29,638,127 107,375,347 26,671,149 7,140,926 3,845,063
2011 93,177,128 57,976,777 33,958,377 85,153,447 24,062,576 6,164,693 3,287,386
(Sumber: BPS 2012)
Kebutuhan sambiloto untuk industri obat tradisional (IOT) di Indonesia
mencapai 33.47 ton simplisia kering atau setara dengan 709.60 ton terna basah
pertahun (Sunardi 2008). Menurut BPS (2012) angka produksi tanaman obat
sambiloto mulai tercatat pada tahun 2003. Produksi tanaman sambiloto pada tahun
2011 adalah sebesar 3 287 386 kg. Produksi ini menurun dibandingkan pada tahun
2008 yaitu 7 716 432 kg (Tabel 1). Sedangkan menurut Bahar (2012) target
produksi tanaman sambiloto tahun 2011-2012 mengalami peningkatan sebesar
4.13% dari semula adalah 8 489 ton menjadi 8 840 ton. Diperkirakan kebutuhan
sambiloto ini akan terus meningkat seiring dengan peningkatan nilai pertumbuhan
tahunan (annual growth rate) pasar dunia untuk pengobatan herbal antara 5-15%
(Xiaorui 2003).
Pada kondisi di alam keragaman genetik sambiloto sangatlah rendah (Sabu
Pandey & Mandal. 2010; Wijarat et al. 2012) hal ini disebabkan karena sambiloto
bersifat menyerbuk sendiri atau self pollination (Latoo et al. 2006; Wijarat et al.
2012). Disamping rendahnya keragaman genetik sambiloto, kadar senyawa aktif
andrographolide di alam juga sangat rendah. Kandungan senyawa aktif
andrographolide pada tanaman sambiloto yang diisolasi dari beberapa lokasi yang
berbeda rata-rata berkisar antara 0.95%-2% berat kering (Sabu et al. 2001; Raina
et al. 2007; Patarapanich et al. 2007; Sharma, et al. 2009). Kandungan tersebut
bergantung pada lokasi penanaman (letak geografi), musim tanam, genotipe
tanaman dan variasi somaklonal (Koobkokkruad et al. 2008).
Pemuliaan atau perbaikan mutu tanaman adalah salah satu strategi yang
dapat digunakan untuk mempertinggi keragaman genetik dan meningkatkan
kandungan senyawa aktif pada tanaman obat. Pemuliaan tanaman menghendaki
adanya variasi genetik dari sifat tanaman yang bermutu yang dapat berguna untuk
perbaikan sifat tanaman (Novak & Brunner 1992). Pemuliaan mutasi adalah
teknik pemuliaan yang dapat menghasilkan variabilitas pada populasi yang
mengalami mutasi, melalui perubahan secara genetik sifat genotipe dan fenotipe,
yang dapat digunakan untuk seleksi yang efektif pada sifat-sifat tanaman yang
diinginkan (Tah et al. 2008). Mutasi dapat menyebabkan perubahan materi
genetik yang pada umumnya dapat diekspresikan pada fenotipe tanaman dan
diturunkan ke generasi selanjutnya secara genetik. Induksi mutasi merupakan
metode yang paling mudah dalam menciptakan variabilitas genetik dibandingkan
dengan metode pemuliaan yang lainnya (Minn et al. 2008). Pemuliaan mutasi
merupakan salah satu alternatif terbaik untuk mempertinggi keragaman genetik
tanaman sambiloto sekaligus mencari sifat-sifat unggul/superior yang dapat di
seleksi untuk menghasilkan varietas sambiloto dengan kadar andrographolide
yang tinggi dan karakter tanaman dengan sifat unggul yang lainnya.
Mutasi dengan menggunakan irradiasi pengion merupakan salah satu
pilihan yang paling banyak digunakan untuk membentuk mutan. Hal ini
disebabkan karena kemudahan aplikasinya dan kekuatan daya tembusnya dalam
menembus jaringan tanaman (Anwar et al. 2004). Sinar gamma adalah mutagen
yang mempunyai energi radiasi yang dapat menyebabkan kerusakan pada ikatan
menghasilkan kerusakan pada tingkat kromosom, gen dan berakhir dengan
kematian sel (Xiang et al. 2002). Pengaruh irradiasi sinar gamma secara biologi
didasarkan pada interaksi dengan atom atau molekul dalam sel, terutama air untuk
membentuk radikal bebas (Borzouei et al. 2010). Radikal bebas ini dapat merusak
atau memodifikasi komponen yang penting pada sel tanaman dan telah dilaporkan
berakibat pada perubahaan tanaman baik secara morfologi, anatomi, biokimia dan
fisiologi tanaman, bergantung pada dosis irradiasi yang diberikan. Perubahan
karakter tersebut meliputi perubahan tinggi tanaman, proliferasi sel, peningkatan
germinasi, pertumbuhan sel, aktivitas enzim, ketahanan terhadap cekaman
lingkungan, peningkatan hasil dan kualitas, ukuran tanaman, waktu pembungaan,
pemasakan buah, warna buah, serta kompatibelnya sel pada kondisi lingkungan
ekstrim sampai dengan peningkatan senyawa aktif (Ahloowalia & Maluszynski
2001; Kiong et al. 2008).
Penelitian irradiasi pada tanaman sambiloto yang pernah dilaporkan
bertujuan untuk mengetahui kualitas higienis hasil ekstraksi dari herba serta
dekontaminasi mikroba pada simplisia sambiloto (Timpraser et al. 2003;
Chobkarjing 2004; Mamatha et al. 2010) dengan pemakaian dosis berkisar antara
5-25 kGy. Lattoo et al. (2006) juga melakukan irradiasi dengan sinar gamma pada
sambiloto dengan dosis 2 kRad yang bertujuan untuk mendapatkan jantan steril.
Mutasi gen yang terjadi tanpa ekspresi fenotipe yang terlihat biasanya
tidak dapat dikenali. Untuk dapat mengenali mutasi gen yang terjadi berbagai
metode telah diaplikasikan untuk mendeteksi pengaruh mutagen pada tanaman.
Pada tanaman obat perubahan sifat dan karakter mutan dapat dideteksi secara
morfologi, molekuler dan fitokimia. Secara morfologi deteksi dilakukan dengan
mengamati perubahan fenotipe, seperti tinggi tanaman, bentuk daun, bentuk
batang serta perubahan morfologi yang terjadi pada mutan dibandingkan dengan
kontrol.
Deteksi secara molekuler dapat dilakukan pada tingkat DNA dengan
menggunakan penanda molekuler. Penanda molekuler sangat akurat karena dapat
memberikan informasi polimorfik, sebagai komposisi genetik yang unik pada
masing-masing spesies, yang tidak tergantung pada umur dan kondisi fisiologi
penanda molekuler dapat memperlihatkan perbedaan antar aksesi pada tingkat
DNA dan memberikan informasi secara langsung, dapat dipercaya dan efisien
untuk konservasi dan pemeliharaan plasma nutfah (Babaei et al. 2010).
Deteksi secara fitokimia dapat dilakukan terhadap perubahan komponen
senyawa aktif yang terkandung dalam tanaman obat tersebut dibandingkan dengan
kontrol. Pada mutan tanaman obat selain terjadi perubahan genotipe diharapkan
terjadi juga perubahan profil senyawa aktif yang terkandung didalamnya. Dari
penelitian ini diharapkan mutan-mutan yang nantinya terbentuk dapat
meningkatkan keragaman genetik dan senyawa aktif pada sambiloto.
Pada penelitian kali ini akan dilakukan irradiasi terhadap biji tanaman
sambiloto. Perubahan pertumbuhan yang terjadi pada biji sambiloto yang
diirradiasi dan diperbanyak secara vegetative pada generasi selanjutnya akan
dideteksi secara morfologi, molekuler dan fitokimia. Deteksi secara morfologi
dilakukan dengan mengamati perubahan fenotipe yang muncul dibandingkan
kontrol, secara molekuler deteksi dilakukan untuk mengetahui perubahan profil
DNA dengan menggunakan penanda molekuler Inter Simple Sequence Repeat
(ISSR) dan secara fitokimia deteksi dilakukan untuk mengetahui perubahan profil
fitokimia dan peningkatan kadar andrographolide dengan menggunakan HPLC.
1.2. Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk
1. Meningkatkan variasi genetik dan mendapatkan klon sambiloto dengan
kandungan senyawa aktif tinggi dengan perlakuan irradiasi sinar gamma
cobalt 60.
2. Mengetahui perubahan karakter morfologi, profil molekuler dan profil
fitokimia pada mutan tanaman sambiloto.
1.3. Hipotesis
Hipotesis dalam penelitian ini adalah bahwa perlakuan dengan variasi
dosis radiasi sinar gamma Cobalt 60 pada biji sambiloto dapat mengakibatkan
karakter pada mutan. Perubahan karakter mutan yang dihasilkan dapat dideteksi
2. TINJAUAN PUSTAKA
2.1. Botani dan Taksonomi Tanaman Sambiloto
Tanaman sambiloto (Andrographis paniculata (Burm.f.) Wallich Ex Ness)
disebut juga “King of bitters” adalah salah satu tanaman obat yang menjadi
unggulan nasional (Ditjen POM 2001) dan diprioritaskan serta prospektif untuk
dikembangkan di Indonesia (Kintoko 2006). Subramanian et al. (2012) bahkan
menuliskan bahwa sambiloto adalah a bitter plant with a sweet future untuk
menggambarkan prospektifnya tanaman obat ini. Tanaman sambiloto berasal dari
semenanjung India dan Sri Lanka (Lattoo et al. 2006; Mishra et al. 2007;
Jarukamjorn & Nemoto 2008). Tanaman ini tumbuh secara alami di Asia
Tenggara yaitu India (dan Sri Lanka), Pakistan dan Indonesia tetapi
dibudidayakan secara ekstensif di China dan Thailand, timur dan barat India, serta
Mauritius (Mishra et al. 2007). Tanaman ini kemudian menyebar ke daerah tropis
Asia hingga sampai di Indonesia.
Gambar 1. Tanaman Sambiloto
Di India, sambiloto dahulu adalah tumbuhan liar yang digunakan untuk
mengobati penyakit disentri, diare, atau malaria. Saat ini tanaman sambiloto
sangat bernilai untuk sistem pengobatan tradisional di India seperti pengobatan
telah disusun paling sedikit dalam 26 formula Ayurvedic (Lattoo et al. 2006). Di
China dalam Traditional Chinese Medicine (TCM), sambiloto diketahui penting
sebagai tanaman cold property dan digunakan sebagai penurun panas serta
membersihkan racun-racun di dalam tubuh (Mishra et al. 2007). Di Thailand,
semenjak tahun 1999 sambiloto telah dijadikan sebagai salah satu tanaman yang
termasuk dalam The National List of Essential Drug (Jarumkajorn & Nemoto
2008). Di Indonesia Departemen Kesehatan melalui Ditjen POM (2001) telah
memasukkan tanaman sambiloto dalam 9 tanaman obat unggulan yang prospektif
untuk dikembangkan.
Adapun klasifikasi secara taksonomi dari tanaman sambiloto adalah:
Kingdom : Plantae, Plants;
Subkingdom : Tracheobionta, Vascular plants
Super division : Spermatophyta, Seed plants
Division : Angiosperma
Class : Dicotyledonae
Sub class : Gamopetalae
Series : Bicarpellatae
Order : Personales
Tribe : Justicieae
Family : Acanthaceae
Genus : Andrographis
Species : paniculata (Mishra et al. 2007)
Sambiloto dapat tumbuh di semua jenis tanah sehingga tanaman ini
terdistribusi luas di belahan bumi. Habitat aslinya adalah tempat-tempat terbuka
yang teduh dan agak lembab, seperti kebun, tepi sungai, pekarangan, semak, atau
rumpun bambu. Sambiloto dapat tumbuh di dataran rendah sampai dengan
ketinggian 700 m dpl (Mishra et al. 2007).
Deskripsi secara botani tanaman sambiloto merupakan tanaman tahunan,
herba semusim, bentuk tanaman lurus bercabang dengan tinggi berkisar antara
30-110 cm. Batang berkayu berbentuk bulat, berwarna hijau tua, dengan cabang
dengan banyak cabang (monopodial) berbentuk segiempat (kwadrangularis)
dengan nodus yang membesar (Mishra et al. 2007; Jarumkajorn & Nemoto.
2008).
Daun tunggal sederhana, letak berhadapan bersilang, bertangkai pendek,
berbentuk pedang (lanset) dengan tepi rata (integer), pangkal runcing, ujung
meruncing dan permukaannya halus, berwarna hijau, permukaan atas berwarna
hijau tua, bagian bawah berwarna hijau muda, panjangnya 2-12 cm, dan lebar 1-3
cm (Mishra et al. 2007; Subramanian et al. 2012).
Perbungaan rasemosa yang bercabang membentuk malai, keluar dari ujung
batang atau ketiak daun. Bunganya berwarna putih keunguan, berbentuk jorong
(bulan panjang) dengan pangkal dan ujungnya yang lancip, dengan 5 kalix, bentuk
tabung dengan panjangnya berkisar antara 6 mm (Mishra et al. 2007). Tanaman
berbunga dalam waktu 90-120 hari setelah germinasi.
Gambar 2. Bunga, biji dan kapsul buah tanaman sambiloto
Kapsul dari tanaman memanjang, linear-oblong, panjangnya 1–2 cm dan
lebarnya 2–5 mm. Biji sangat kecil, dengan bentuk subquadrate dengan jumlah
1-5 buah (Mishra et al. 2007). Di Australia bunga dan buah ditemukan antara bulan
Nopember sampai bulan Juni, sedang di Indonesia bunga dan buah dapat
ditemukan sepanjang tahun. Di India, bunga dan buah bisa dijumpai pada bulan
Oktober atau antara Maret sampai Juli.
Sambiloto merupakan tanaman menyerbuk sendiri atau self pollination
genetik sambiloto yang sangat rendah (Sabu et al. 2001; Maison et al. 2005;
Sakuanrungsirikul et al. 2008; Latoo et al. 2008; Pandey & Mandal. 2010; Wijarat
et al. 2012).
2.2. Efek Farmakologi Sambiloto
Sambiloto mengandung senyawa bioaktif yaitu diterpen lakton, flavanoid
(Akbar 2011) dan polifenol (Chao & Lin. 2010). Ekstraksi dengan menggunakan
etanol atau methanol dari tanaman utuh, daun dan stem menghasilkan 20 lebih
senyawa diterpen dan lebih dari 10 senyawa flavanoid. Pada analisa senyawa
diterpen didapatkan 4 komponen utama senyawa yang paling dominan dan berasa
pahit (Yang et al. 2012) yaitu andrographolide, dehydroandrographolide,
deoxyandrographolide dan neoandrographolide (Gambar 3), yang juga merupakan
komponen senyawa aktif utama pada sambiloto.
Gambar 3. Struktur kimia dari 4 komponen utama diterpenoid yang terdapat pada
tanaman sambiloto: andrographolide, dehydroandrographolide,
deoxyandrographolide dan neoandrographolide (Yang et al. 2012).
Secara farmakologis tanaman sambiloto memiliki kisaran fungsi yang
sangat luas yaitu sebagai hepatoproteksi, gastroproteksi, anti alergi, anti-virus,
antipiretic, vermicidal, anti-jerawat, analgesik, anti-inflammatory, anti-bakteri,
anti-malaria, antityphoid, anti-kanker, anti-atherosclerotic, anti-hyperglycemic
dan hypoglycemic, anti-diare, trombolityc, disamping dapat juga digunakan untuk
peningkatan imunitas/ immunomodulator (Mishra et al. 2007; Jarukamjorn &
Sambiloto juga menjadi obat menakjubkan pada tahun 1919 karena dapat menjadi
obat utama pada saat terjadi epidemik influenza yang terjadi secara global
(Sharma et al. 2009). Penelitian yang telah dilakukan di Bastyr University USA,
bahkan telah menemukan aktivitas anti HIV pada andrographolide yang di isolasi
dari tanaman sambiloto yang berasal dari Indonesia (Otake et al. 1995).
Andrographolide (C20H30O5) mudah larut dalam methanol, etanol, piridin,
asam asetat dan aseton dan sukar larut dalam eter dan air. Titik leleh dari senyawa
andrographolide adalah 228o-230oC, spektrum UV pada etanol dengan
maksimal adalah 223 nm (Wongkittipong et al. 2000). Pada tanaman sambiloto
kandungan andrographolide terakumulasi paling banyak di daun yaitu sebesar
2,39% sedangkan paling rendah ditemukan di biji (Sharma et al. 1992).
Konsentrasi andrographolide paling tinggi ditemukan pada saat sebelum tanaman
berbunga, semakin awal maka semakin bagus untuk dipanen.
Kandungan andrographolide pada tanaman sambiloto yang diisolasi dari
beberapa lokasi yang berbeda rata-rata berkisar antara 0.95%-2% berat kering
(Sabu et al. 2001; Raina et al. 2007; Patarapanich et al. 2007; Sharma, et al. 2009;
Pandey & Mandal 2010; Mamatha 2011). Kandungan tersebut bergantung pada
lokasi penanaman (letak geografi), musim tanam, genotipe tanaman dan variasi
somaklonal (Koobkokkruad et al. 2008; Pandey & Mandal 2010). Penelitian yang
dilakukan oleh Bhan et al (2006) mendapatkan kadar andrographolide yang
bervariasi pada saat dipanen pada bulan yang berbeda. Dari penelitian ini
diketahui kadar andrographolide berkisar antara 5%-7% yang dipanen pada bulan
September sampai November. Kadar andrographolide juga didapatkan bervariasi
ketika dianalisa pada tahap pertumbuhan yang berbeda (Parasher et al. 2011) yaitu
berkisar antara 0.25%-3.02% yang diukur pada umur 30-120 hari. Semakin lama
tahap pertumbuhan sambiloto maka kadar andrographolide yang didapatkan juga
semakin tinggi (120 hari).
Andrographolide merupakan golongan dari diterpenlakton. Sebagai bagian
dari golongan diterpen andrographolide mengikuti jalur biosintesis dari terpenoid.
Semua golongan terpenoid disintesis melalui kondensasi isopentenil diphosphate
(IDP/IPP) dan Allylic isomer dimethyl allyl diphosphate (DMADP/DMAPP).
Dijelaskan oleh Jha et al. (2011) jalur MVA terjadi di dalam sitosol sedangkan
jalur MED/DXP terjadi di dalam plastida. IDP/IPP dan DMADP/DMAPP
disintesis melalui jalur 2-methylerythritol 4-phosphate (MEP) melalui
deoxy-D-xylullose 5-phosphatase dalam plastida. IDP/IPP juga disintesis di sitosol melalui
jalur mevalonat.
Urutan penambahan kepala ke ekor pada unit IDP/IPP ke
DMADP/DMAPP menghasilkan prenyl diphosphates geranyl diphosphate (GDP),
farnesyl diphosphate (FDP) dan geranylgeranyl diphosphate (GGDP/GGPP). Tiga
komponen ini yang menjadi prekursor untuk sintesis monoterpen, sesquiterpen
dan diterpen. Secara umum GDP dan GGDP/GGPP dalam pastida digunakan
sebagai substrat untuk biosintesis monoterpen dan diterpen seangkan FDP di
sitosol digunakan untuk biosintesis sesquiterpen.
Penelitian yang dilakukan oleh Srivastava dan Akhila (2010)
menghasilkan jalur biosintesis andrographoide mengikuti 2 jalur yaitu jalur MVA
(jalur asam mevalonat) dan jalur MEP/DXP (jalur methylerythritol phosphate).
Pada jalur MEP/DXP didapatkan akumulasi andrographolide yang lebih banyak
jika dibandingkan dengan jalur MVA. Aharoni et al. 2006 menambahkan bahwa
pada jalur MEP/DXP, IDP/IPP dan DMADP/DMAPP membentuk 2 rantai, rantai
pertama menghasilkan GDP yang selanjutnya akan menghasilkan senyawa
monoterpen (C10), sedangkan rantai kedua berupa GGDP/GGPP bercabang
menghasilkan senyawa diterpen (C20) dan tetraterpen (C40) (Gambar 4).
Srivastava dan Akhila (2010) menambahkan bahwa jalur diterpen yang dihasilkan
dari oxido GGDP/GGPP menghasilkan senyawa andrographolide (Gambar 5).
Penelitian dari Jha et al (2011) mendapatkan hasil bahwa
3-hydroxy-3-methylglutaryl-coenzyme A reductase (hmgr) adalah salah satu enzim kunci yang
berperan pada akumulasi kandungan andrographolide dan klorofil pada tanaman
Gambar 4. Jalur biosintesis andrographolide. Pembentukan adrographolide melalui jalur MVA dan jalur MEP/DXP di sitosol dan plastida (Aharoni et al. 2006).
Gambar 5. Jalur diterpen yang dihasilkan dari oxido GGDP/GGPP menghasilkan senyawa andrographolide (Srinivastava & Akhila. 2010; Jha et al. 2011)
2.3. Perbaikan Mutu Tanaman Obat
Pemuliaan atau perbaikan mutu tanaman adalah salah satu strategi yang
dapat digunakan untuk mempertinggi keragaman genetik dan meningkatkan
kandungan senyawa aktif pada tanaman obat. Teknik pemuliaan tanaman secara
konvensional dan bioteknologi dapat diterapkan pada tingkat genetik untuk
perbaikan mutu dan konsistensi obat-obatan herbal agar dapat dibudidayakan dan
juga untuk memodifikasi potensi farmasi dan toksisitasnya (Canter et al. 2005).
Pemuliaan tanaman menghendaki adanya variasi genetik dari sifat tanaman yang
bermutu yang dapat berguna untuk perbaikan sifat tanaman tersebut (Novak &
Brunner 1992).
Pemuliaan mutasi adalah teknik pemuliaan yang dapat menghasilkan
variabilitas pada populasi yang mengalami mutasi, melalui perubahan secara
genetik sifat genotipe dan fenotipe yang dapat digunakan untuk seleksi yang
efektif pada sifat-sifat yang diinginkan (Tah 2008). Mutasi menurut Van Harten
(1998) didefinisikan sebagai perubahan pada tingkat hereditas terhadap materi
genetik, yang tidak disebabkan oleh peristiwa rekombinasi atau segregasi.
Perubahan materi genetik yang terjadi pada umumnya dapat diekspresikan pada
fenotipe tanaman dan diturunkan ke generasi selanjutnya secara genetik.
Strategi utama dari pemuliaan mutasi adalah untuk meningkatkan varietas
yang adaptif dengan merubah 1 atau 2 karakter yang utama (Ahloowalia &
Maluszynski 2001). Karakter tersebut meliputi perubahan tinggi tanaman,
proliferasi sel, peningkatan germinasi, pertumbuhan sel, aktivitas enzim,
ketahanan terhadap cekaman lingkungan, peningkatan hasil dan kualitas, ukuran
tanaman, waktu pembungaan, pemasakan buah, warna buah, serta kompatibelnya
sel pada kondisi lingkungan ekstrim sampai dengan peningkatan senyawa aktif
(Ahloowalia & Maluszynski 2001; Kiong et al. 2008).
Induksi mutasi merupakan metode yang paling mudah dalam menciptakan
variabilitas genetik dibandingkan dengan metode pemuliaan yang lainnya (Minn
et al. 2008). Induksi mutasi dapat diasumsikan sebagai dimensi baru, tidak hanya
pada perbaikan tanaman tetapi juga eksplorasi biologi (Ahloowalia &
Maluszynski 2001). Peningkatan nilai mutasi dengan menggunakan induksi
penting pada pemuliaan tanaman (Hoang et al. 2009). Mutasi somatik terjadi jika
sel mutan terus melakukan pembelahan, secara individual dan akan mengandung
bagian dari jaringan dengan genotipe yang berbeda dengan sel normal. Hal ini
termasuk terjadinya perubahan kariotipe, mutasi titik, pidah silang somatik dan
pertukaran kromatik, perubahan organela DNA, amplifikasi DNA, insersi atau
eksisi dari elemen loncat dan segregasi dari pre-existing kimera (Thohirah et al
2009).
Mutasi dengan menggunakan irradiasi pengion merupakan salah satu
pilihan yang paling banyak digunakan untuk membentuk mutan. Hal ini
disebabkan karena kemudahan aplikasinya dan kekuatan daya tembusnya dalam
menembus jaringan tanaman (Anwar et al. 2004). Saat ini mutasi dapat
dihubungkan dengan perubahan urutan DNA untuk beberapa sifat tanaman dan
untuk pembuatan peta molekuler yang tetap pada struktural dan fungsional
genomik pada tanaman (Ahloowalia & Maluszynski 2001). Pemuliaan mutasi
merupakan salah satu alternatif terbaik untuk mempertinggi keragaman genetik
tanaman sambiloto sekaligus mencari sifat-sifat unggul yang dapat di seleksi
untuk menghasilkan varietas sambiloto dengan kadar andrographoide yang tinggi
dan sifat unggul yang lainnya. Generasi M1 merupakan generasi heterogen
dimana setiap tanaman akan membawa mutasi yang berbeda (Thohirah et al
2009). Pengaruh secara genetik atau mutasi dapat merubah material genetik dan
akan diteruskan dari generasi M1 ke generasi selanjutnya.
2.4. Iradiasi Sinar Gamma pada Tanaman Obat
Radiasi sinar gamma sangat penting pada pemuliaan mutasi dan
mutagenesis yang dapat digunakan untuk membentuk karakter tanaman dan
meningkatkan variasi genetik (Kiong et al. 2008). Mutagenesis berperan penting
dalam menghasilkan mutan baru dengan perbaikan kualitas yang dapat
meningkatkan metabolit yang dinilai penting secara komersial (Sanada 1986).
Sinar gamma adalah mutagen yang mempunyai energi radiasi yang dapat
menyebabkan kerusakan pada ikatan kovalen atau ikatan hidrogen pada
molekul/biomolekul di sel yang dapat menghasilkan kerusakan pada tingkat
irradiasi sinar gamma secara biologi didasarkan pada interaksi dengan atom atau
molekul dalam sel, terutama air untuk membentuk radikal bebas (Borzouei et al.
2010). Radikal bebas ini dapat merusak atau memodifikasi komponen yang
penting pada sel tanaman dan telah dilaporkan berakibat pada perubahaan
tanaman baik secara morfologi, anatomi, biokimia dan fisiologi tanaman,
bergantung pada dosis irradiasi yang diberikan. Pengaruh dari sinar gamma
termasuk pada perubahan struktur sel dan metabolisme sel seperti dilasi membran
tilakoid, perubahan fotosintesis, modulasi sistem antioksidatif dan akumulasi
komponen fenolik (Wi et al. 2007). Irradiasi sinar gamma juga dapat
menyebabkan modulasi pada pola protein dengan cara menginduksi keberadaan
atau kehilangan beberapa pita protein (Hegazi & Hamideldin 2010).
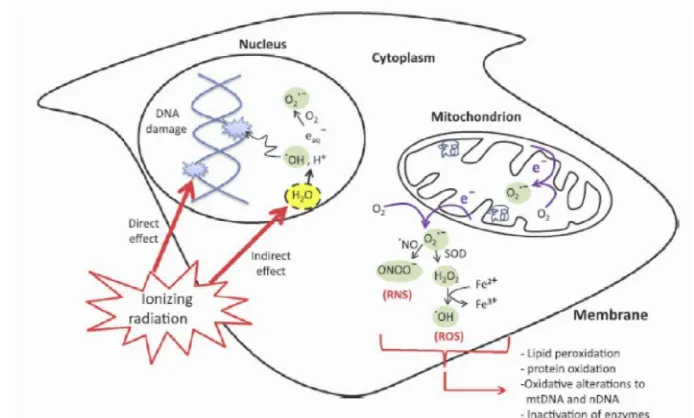
Gambar 6. Pengaruh seluler secara langsung dan tidak langsung irradiasi pada makromolekul (Azzam et al. 2012).
Radiasi dapat menyebabkan peningkatan produksi Reactive Oxygen
Spesies (ROS) melalui hidrolisis air atau pemutusan ikatan makromolekul yang
lain (Vandenhove et al 2010). ROS, seperti radikal superoksida (O2.-), radikal
hidroksil (-OH) dan hidrogen peroksida (H2O2) dan oksigen tunggal yang
terbentuk dari radiolisis air, yang dapat menyebabkan kerusakan pada tingkat
seluler (Alikamanoglu et al. 2011; El-Beltagi et al 2011). Secara ekstrim radikal
[image:34.612.143.490.313.522.2]pemutusan untai DNA, yang dapat menyebabkan degradasi fotolitik karena
terjadinya oksidasi dan kerusakan struktur membram karena terjadinya
peroksidasi (Alikamanoglu et al. 2011). Adanya radiolisis air karena radiasi sinar
gamma juga menyebabkan perubahan kimia dari protein yang disebabkan karena
terjadinya fragmentasi, cross linking, agregasi dan oksidatif yang disebabkan oleh
radikal oksigen yang terbentuk tersebut (Lee et al 2005). ROS sangat reaktif pada
lipid membram, protein dan DNA. ROS diketahui dapat mengaktifkan sinyal
nitrogenmonoksida (NO) dan NADPH oksidase seperti enzim yang diketahui
dapat menyebabkan oksidatif (Zhang & Bjorn. 2009; Vandenhove et al 2010).
ROS dipercaya juga sebagai penyebab utama stress injuries dan kerusakan seluler
secara cepat (El-Beltagi et al 2011).
Kunci utama radiasi bahan tanaman adalah pada dosis radiasi, yang
merupakan jumlah energi radiasi yang diserap bahan tanaman. Unit penghitungan
dosis radiasi dahulu mempergunakan satuan rad, saat ini adalah Gray (Gy) sesuai
dengan unit dalam sistem internasional (SI). Satu Gy sama dengan serapan dari 1
Joule energi per kilogram produk yang diirradiasi, dimana 1 rad = 10-2 Gy atau 1 Gy= 100 rad. Pada penerapannya dosis irradiasi dibagi dalam tiga kategori yaitu
dosis tinggi (> 10 kGy), medium (1-10 kGy) dan rendah (<1 kGy). Dosis tinggi
biasanya digunakan untuk sterilisasi produk makanan dan dosis rendah digunakan
untuk menginduksi mutasi pada bahan berupa biji. Dosis berkisar 60-70 Gy telah
banyak diaplikasikan pada biji tanaman seperti, padi, gandum, jagung, kacang
(Van Harlen 1998; Ahloowalia & Maluszynski 2001). Stimulasi pengaruh
irradiasi sinar gamma dosis rendah kemungkinan menyebabkan terjadinya
stimulasi pembelahan sel atau elongasi sel dan perubahanan proses metabolisme
yang mengakibatkan sintesis fitohormon atau asam nukleat (Nassar et al. 2004).
Hegasi & Hamideldin (2010) mengatakan bahwa pada dosis yang rendah
untaian DNA yang panjang akan terpisah menjadi untaian kecil, sedangkan pada
dosis tinggi untaian DNA akan terpisah menjadi untaian panjang dan kecil.
Ditambahkan oleh Zeid et al (2001), bahwa jalur dari radiasi gamma dosis rendah
kemungkinan menyebabkan peningkatan aktivasi enzim dan embrio muda yang
menghasilkan peningkatan pembelahan sel yang berakibat tidak hanya pada
irradiasi dosis rendah (1-10 Gy) juga telah dilaporkan dapat meningkatkan kadar
artemisin pada Artemisia annua (Koobkoooruad et al. 2008).
Irradiasi menggunakan sinar gamma telah terbukti secara ekonomis dan
lebih efektif bila dibandingkan dengan irradiasi yang lain. Hal ini disebabkan
karena aplikasinya mudah dan penetrasinya yang kuat sehingga dapat digunakan
untuk perbaikan tanaman (Anwar et al. 2004). Aplikasi radiasi pada tanaman telah
banyak dilakukan dengan berbagai tujuan diantaranya adalah untuk peningkatan
produktifitas tanaman (Khan & Khan. 2010), peningkatan produksi minyak
(Nassar et al. 2004) serta perakitan tanaman tahan penyakit dan toleran terhadap
kadar garam (Khodary 2004; Beltagi et al. 2006; El Sayed et al. 2007; Hoang et
al. 2009).
Sampai saat ini penelitian tentang irradiasi pada tanaman obat mulai
banyak dilaporkan. Pada awalnya irradiasi pada tanaman obat lebih banyak
digunakan untuk mengetahui kualitas higienis hasil ekstraksi dari herba
(Chmielewski & Migdal 2005), dekontaminasi dan disinfeksi mikroba pada
simplisia (Timpraser et al. 2003; Phianphak et al. 2007), seperti pada tanaman
obat Camellia sinensis (Fanaro et al. 2009) dan Turnera diffusa Wild (Camaro et
al. 2008). Dosis irradiasi yang biasa digunakan untuk dekontaminasi dan
disinfeksi mikroorganisme biasanya tinggi (kGy). Pada tanaman sambiloto
irradiasi dengan tujuan untuk mengetahui kualitas higienis hasil ekstraksi dari
herba dan dekontaminasi serta disinfeksi mikroba pada simplisia juga telah
dilaporkan (Timpraser et al. 2003, Chobkarjing 2004; Mamatha et al. 2010)
dengan dosis pemakaian berkisar antara 5-25 kGy.
Perkembangan penggunaan teknik irradiasi pada tanaman obat juga mulai
digunakan untuk perbaikan mutu tanaman. Penelitian yang telah dilaporkan
diantaranya adalah untuk peningkatan produksi shikonin pada Lithospermum
erythrorhizon S (Chung et al. 2006), menginduksi perubahan biokimia pada
tanaman obat Orthosiphon stamineus (Kiong et al. 2008), peningkatan senyawa
alkaloid pada tanaman obat Atropa belladonna L (Abdel-Hady et al. 2008),
peningkatan kandungan artemisinin pada Artemisia annua (Koobkoooruad et al.
2008), peningkatan kandungan minyak pada tanaman obat Thevetia (Adeogun and
(Moghaddam et al. 2011). Pada tanaman sambiloto, irradiasi untuk tujuan
perbaikan mutu tanaman telah dilaporkan oleh Lattoo et al (2006), dengan
melakukan pembuatan jantan mandul menggunakan irradiasi sinar gamma dengan
dosis 2 kRad. Sampai saat ini penelitian tentang peningkatan senyawa aktif
tanaman sambiloto dengan irradiasi belum pernah dilaporkan.
2.5. Deteksi Mutan Hasil Irradiasi
Mutan yang terbentuk perlu diseleksi melalui beberapa generasi
pertumbuhan biji atau propagasi secara vegetatif. Pada tanaman yang diperbanyak
melalui biji mutan resesif biasanya diseleksi pada generasi kedua (M2) atau ke
tiga (M3) setelah perlakuan irradiasi. Pada tanaman yang diperbanyak secara
vegetatif beberapa siklus dari propagasi diperlukan untuk mendapatkan
homo-histont atau ‘dissolve’ kimera dan mendapatkan mutan yang solid (Ahloowalia &
Maluszynski 2001). Pada perbanyakan mutan secara vegetatif, generasi M1V0
merupakan populasi generasi tanaman mutan (M, kependekan dari ’Mutan’) yang
belum diperbanyak secara vegetatif (V0). Tanaman generasi M1V1 merupakan
populasi tanaman hasil perbanyakan vegetatif pertama (V1) dari mutan generasi
pertama (M1). Sedangkan tanaman generasi M1V2 adalah populasi tanaman hasil
perbanyakan vegetatif dari M1V1, demikian seterusnya sehingga didapatkan
generasi M1V3 (Aisyah et al. 2009).
Mutasi gen yang terjadi tanpa ekspresi fenotipe yang terlihat biasanya tidak
dapat dikenali. Untuk dapat mengenali mutasi gen yang terjadi berbagai metode
telah diaplikasikan untuk mendeteksi pengaruh mutagen pada tanaman. Pada
tanaman obat perubahan sifat dan karakter mutan dapat dideteksi secara
morfologi, molekuler dan fitokimia.
Secara morfologi deteksi dilakukan dengan mengamati perubahan fenotipe,
seperti tinggi tanaman, bentuk daun, bentuk batang serta perubahan morfologi
yang terjadi pada mutan dibandingkan dengan kontrol. Deteksi secara molekuler
dilakukan untuk mengetahui perubahanan profil DNA hal ini dapat dilakukan
dengan menggunakan penanda molekuler. Sedangkan deteksi secara fitokimia
dapat dilakukan terhadap perubahan komponen senyawa aktif yang terkandung
obat selain terjadi perubahan genotipe diharapkan terjadi juga perubahan karakter
senyawa aktif yang terkandung didalamnya.
2.5.1. Deteksi Perubahan Morfologi Mutan
Perubahan fenotipe atau morfologi mutan dari hasil irradiasi biasanya
beraneka ragam bentuk tergantung dosis yang digunakan. Pada mutan yang
terbentuk, perubahan morfologi menjadi tanda awal untuk mengetahui pengaruh
mutasi pada tanaman tersebut. Perubahan ini dapat terjadi pada seluruh bagian
tanaman, baik berupa daun, bunga, batang, dan akar. Perubahan warna dan bentuk
bunga, tanaman kerdil atau tanaman menjadi besar (giant) dan fenotipe baru yang
terbentuk menjadi nilai komersial yang dapat diseleksi menjadi varietas baru
(Ahloowalia & Maluszynski 2001).
Banyak mutan menjadi tanaman kerdil, yang justru menjadi tanda spesifik
bagi hasil tertentu, seperti pada mutan padi Calrose 76 yang dikeluarkan di
California, yang berkontribusi besar pada produksi padi di USA, mempunyai ciri
tanaman yang semi kerdil (Ahloowalia & Maluszynski 2001). Pada tanaman hias,
pengaruh mutasi sangat terlihat secara morfologi, perubahan warna bunga, bentuk
dan ukuran bunga yang mudah di seleksi dan menjadi nilai lebih secara komersial.
Pada mutan tanaman krisan selain terjadi variasi ukuran dan bentuk bunga,
perubahan warna juga ditemukan (Lamseejan et al. 2000). Pembentukan mutan
kerdil juga telah ditemukan pada tanaman Cynodon dactylon (Lu et al. 2009) dan
pisang (Suprasana et al. 2008).
2.5.2. Deteksi Perubahan Profil DNA Mutan
Deteksi perubahan profil DNA mutan dapat dilakukan dengan
mengunakan penanda molekuler. Penanda molekuler didefinisikan sebagai bagian
dari segmen DNA yang mewakili perbedaan pada tingkat genom (Agarwal et al.
2008). Penanda molekuler secara langsung dapat membandingkan perubahan
genotipe pada tingkat DNA. Penanda molekuler sangat akurat karena dapat
memberikan informasi polimorfik, sebagai komposisi genetik yang unik pada
masing-masing spesies, yang tidak tergantung pada umur dan kondisi fisiologi
memperlihatkan perbedaan antar aksesi pada tingkat DNA dan memberikan
informasi secara langsung, dapat dipercaya dan efisien untuk konservasi dan
pemeliharaan plasma nutfah dibandingkan analisa secara morfologi (Babaei et al.
2010).
Teknik Inter Simple Sequence Repeat (ISSR) adalah teknik berbasis PCR
yang telah dilaporkan oleh Zietkiewicz et al. (1994), yang melibatkan amplifikasi
segmen DNA diantara daerah perulangan 2 mikrosatelit yang identik dengan
orientasi pada arah berlawanan menggunakan primer yang didisain dari daerah
inti mikrosatelit. Teknik ini menggunakan primer mikrosatelit, panjangnya sekitar
16-25 bp dari pengulangan di-nukleotida, tri-nukleotida, tetra-nukleotida atau
penta-nukleotida pada target genom multi lokus (Vijayan et al. 2005). Teknik
penanda DNA ISSR ini adalah penanda ideal untuk pemetaan genetik dan
populasi disebabkan karena berlimpah ruah dan tingginya nilai polimorfik
diantara individu dan populasi yang genotipenya berdekatan (Hadia et al. 2008).
Kelebihan dari teknik ISSR dibandingkan dengan teknik yang lain adalah
lebih efisien, sederhana pengoperasiannya, akurat, biaya murah, prosesnya cepat,
tinggi polimorfik yang didapat, stabil, dapat dipercaya dan mudah diulang
(Vijayan et al. 2005; Zhou et al. 2007; Hussein et al. 2008; Su et al. 2008).
Teknik ISSR mendeteksi polimorfik pada lokus mikrosatelite dan
inter-mikrosatelite tanpa terlebih dahulu mengetahui urutan DNA (Hussein et al. 2005)
dengan syarat susunan basa yang berulang tersebut mewakili secara luas dan
menyebar diseluruh genom (Wahyuni et al. 2004).
2.5.3. Deteksi Perubahan Profil Fitokimia Mutan
Untuk mengetahui perubahan senyawa aktif pada mutan hasil irradiasi
dapat diketahui dengan melakukan analisa profil perubahan senyawa aktif
tanaman tersebut. Banyak metode yang telah digunakan untuk mendeteksi profil
fitokimia yang berubah pada mutan tanaman obat. Kromatografi Lapis Tipis
(TLC) dan Kromatografi (HPLC) telah menjadi prosedur standar untuk
mengidentifikasi senyawa aktif tanaman obat.
Pada tanaman sambiloto ekstraksi kandungan senyawa aktif secara
ekstraksi ultrasonic (Subramanian et al. 2012). Di beberapa Negara Asia dimana
sambiloto dijual secara komersial, berbagai metode digunakan untuk memastikan
tingkat standarisasi dari andrographolide, metode yang digunakan diantaranya
adalah thin layer chromatography, ultraviolet spectrophotometry, liquid
chromatography, teknik volumetric dan colorimetric serta HPLC. Metode-metode
tersebut merupakan metode yang paling baik dan dapat diandalkan untuk
mengetahui profil andrograpolide secara kuantitatif dan kualitatif (Aromdee et al.
2005; Mishra et al. 2007).
Umumnya, ekstraksi andrographolide dilakukan dengan menggunakan
metanol atau air, kemudian ekstrak difraksinasi lebih lanjut dengan
metanol-kloroform, dichlorometan dan/atau petroleum eter atau heksana sesuai dengan
fraksi andrographolide atau gugus yang diinginkan (Mishra et al. 2007). Metode
HPLC dan HPTLC lebih sering digunakan untuk analisa quantitatif
andrographolide karena merupakan metode kromatografi cair sederhana yang
telah dapat digunakan untuk penentuan 3 komponen andrographolide utama yaitu
didehydroandrographolide, andrografolide dan neoandrographolide dengan
deteksi UV pada panjang gelombang 230 nm (Mishra et al. 2007).
Teknik HPLC merupakan pengembangan dari teknik kromatografi dengan
fasa gerak cairan dan fasa diam cairan atau padat. Kelebihan dari teknik HPLC
adalah mampu memisahkan molekul-molekul dari suatu campuran, mudah
melaksanakannya, kecepatan analisis dan kepekaan yang tinggi, dapat dihindari
terjadinya dekomposisi/kerusakan bahan yang dianalisis, resolusi yang baik, dapat
digunakan bermacam-macam detektor, kolom dapat digunakan kembali, dan
mudah melakukan "sample recovery".
Untuk meningkatkan resolusi, kolom HPLC dikemas dengan partikel yang
berukuran kecil (3, 5, 10 m) dengan distribusi ukuran sempit. Laju aliran dan
ukuran kolom dapat disesuaikan untuk meminimalkan pelebaran pita (Ngan.
2005). Pemilihan pelarut dan kondisi eluen (gradien atau isokratik) bergantung
pada campuran masing-masing komponen dan kandungan yang diinginkan.
Kebanyakan elusi yang digunakan adalah elusi gradien. Elusi gradien
merupakan solven organik yang dibentuk dari campuran dua macam eluen, eluen
mengandung solven organik (bufer A) dan yang satunya terdiri dari konsentrasi
tinggi dari solven didalam air (bufer B). Tetapi kandungan solven organik kedua
eluen tersebut identik (Chobkarjing. 2004). Detektor yang biasa digunakan dalam
sistem HPLC adalah ultraviolet/visible (UV/Vis), indeks bias (RI), evaporative
light-scattering (ELS), MS dan detektor fluoresensi (Ngan. 2005). Elusi isokratik
adalah elusi dimana fase gerak masuk dalam kolom dalam kondisi tetap. Pada
elusi isokratik kondisi kromatografi dijaga tetap konstan melalui sejumlah
penelitian. Hal ini yang mendasari konstruksi dasar dari sistem kromatografi pada
3. METODE PENELITIAN
3.1. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Maret 2011-Juni 2012. Tempat
penelitian untuk perlakuan irradiasi dilakukan di Pusat Aplikasi Teknologi Isotop
dan Radiasi-Badan Tenaga Nuklir Nasional (PATIR-BATAN), untuk deteksi
mutan secara morfologi, molekuler dan fitokimia dilaksanakan di Pilot Plant
Propagasi Tanaman, Laboratorium Teknologi Gen dan Laboratorium Recovery
Balai Pengkajian Bioteknologi, Badan Pengkajian dan Penerapan Teknologi
(BPPT) di Kawasan PUSPIPTEK Serpong Tangerang.
3.2. Bahan dan Alat Penelitian
Bahan yang digunakan adalah biji sambiloto koleksi dari Balai Penelitian
Tanaman Obat dan Aromatik (BALITTRO) aksesi Kanigoro Karanganyar. Bahan
yang digunakan untuk penanaman biji sambiloto berupa polibag ukuran 15x15
cm, pupuk kandang, tanah dan sekam bakar dengan perbandingan (1:1:1/v:v:v)
dan hormon perakaran serta sungkup.
Bahan yang digunakan untuk isolasi dan amplifikasi DNA berupa buffer
Cetyltrimethylammonium bromide (CTAB), merkaptoetanol, Poly Vynil Poly
Pyrrolidone (PVPP), larutan chloroform: isoamilalkohol (CIAA), 5M NaCl, 80%
etanol, Tris EDTA, RNAse, pewarna Sybersafe, gel agarose, buffer tris-HCl, 10
primer ISSR yaitu SBLT2, SBLT3, SBLT5, SBLT8, SBLT13, SBLT14,
SBLT15, SBLT17, SBLT18 dan SBLT19 (Lampiran 2), taq DNA polymerase
(dreamtaq dari Fermentas), MgCl, buffer PCR, dNTP dan air bebas DNAse &
RNAse. Bahan yang digunakan untuk ekstraksi dan analisa profil fitokimia adalah
metanol (HPLC grade), air demineral, asetonitril, asam folat, standar
andrographolide (Sigma).
Alat yang digunakan dalam penelitian adalah Gamma Chamber Cobalt
60, mortal dan pestle, waterbath, sentrifuse, vortex, mikropipet, Polymerase
Chain Reaction (PCR), mesin nanodrop, peralatan elektroforesis, shaker
(HPLC Alliance 2695 (Waters) with Photodiode Array Detector 2996 (Waters))
dan Kolom C-18.
3.3. Prosedur Penelitian
Kerangka kerja pada penelitian ini dapat dilihat pada Gambar 7, dengan
tahapan kerja adalah sebagai berikut: irradiasi biji sambiloto, germinasi dan
penghitungan letal dosis irradiasi, penanaman bibit sambiloto hasil irradiasi,
deteksi perubahan mutan secara morfologi, deteksi perubahan profil DNA mutan,
dan deteksi perubahan profil fitokimia mutan.
Gambar 7. Kerangka kerja penelitian Biji Sambiloto
Irradiasi dengan Sinar Gamma Cobalt 60
Germinasi & Penghitungan LD50
Penanaman bibit sambiloto
deteksi secara morfologi
pengamatan morfologi
subkultur generasi M1V1-M1V3
deteksi profil DNA
Isolasi DNA mutan
Amplifikasi DNA dengan primer ISSR
deteksi profil fitokimia
ekstraksi daun mutan
penentuan profil fitokimia
3.3.1. Irradiasi Biji Sambiloto
Biji sambiloto dimasukkan dalam plastik klip bersih dan diirradiasi pada
mesin Gamma Chamber 4000A menggunakan sumber radiasi berupa Cobalt 60.
Perlakuan dosis yang digunakan adalah dosis 0, 10, 20, 30, 40, 50, 60, 70, 80, 90,
100, 125, 150, 175, 200, 225, 250, 275, dan 300 Gy.
3.3.2. Penghitungan Letal Dosis Irradiasi (LD50)
Biji sambiloto hasil irradiasi sebanyak 100 biji direndam dalam larutan
bakterisida dan fungisida 2 gr/L selama 24 jam. Biji dicuci bersih menggunakan
air sampai larutan bakterisida dan fungisida tidak tersisa. Biji yang telah bersih
ditanam pada pot tray dengan menggunakan media sekam bakar, pupuk kandang
dan tanah dengan perbandingan 1:1:1 (v/v/v). Pertumbuhan biji diamati dan
dihitung letal dosis radiation (LD50) berdasarkan persentase 50% kematian
tanaman pada 4 minggu setelah tanam (MST). Data yang didapat dianalisa
menggunakan analisa CurveExpert 1.3 untuk menentukan LD50.
3.3.3. Penanaman dan Perbanyakan Sambiloto Hasil Irradiasi
Sebanyak 30 tanaman sambiloto hasil irradiasi (generasi M1V0) berumur
6 minggu setelah tanam dipindah dalam polibag berukuran 15x15 cm
<