MADE MITHA PRAMESWARI
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Dr. Agus Kartono dan Dr. Akhiruddin Maddu
Sejumlah fakta memprediksikan bahwa imunoterapi dengan sitokin
interleukin-2 (IL-2) dapat mendorong sistem imun di dalam tubuh manusia untuk
melawan sel-sel tumor. Sel CD4
+T adalah sel-sel yang menyusun respon imun di
dalam tubuh manusia. Sel CD4
+T menggunakan sitokin-sitokin sebagai
mekanisme sinyal untuk menstimulasi respon imun tubuh untuk pertumbuhan,
pembelahan dan diferensiasi sel tersebut. Karena sel-sel tumor muncul sebagai
‘sel sendiri’, sistem imun tubuh tidak dapat merespon secara efektif untuk
membunuh sel tumor tersebut, tetapi terapi imun seluler adoptif dengan IL-2 dapat
secara potensial mengembalikan atau menaikkan efek-efek imun tubuh untuk
membunuh sel tumor. Penelitian ini mengilustrasikan suatu model matematika
dinamika interaksi antara sel tumor, sel efektor-imun dan IL-2. Usaha-usaha ini
dapat menjelaskan kedua osilasi-osilasi tumor pendek seperti kekambuhan tumor
jangka panjang. Saya kemudian mengeksplor efek-efek terapi imun seluler adoptif
pada model dan menggambarkan dibawah keadaan apa tumor dapat dieliminasi.
MADE MITHA PRAMESWARI
G74051242
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Fisika
Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
NRP
:
G74051242
Disetujui,
Pembimbing 1
Pembimbing 2
Dr. Agus Kartono
NIP. 19700421 199903 1 002 NIP. 19660907 198802 1 006
Dr. Akhiruddin Maddu
Diketahui,
Ketua Departemen Fisika
FMIPA IPB
NIP. 19660907 198802 1 006
Dr. Akhiruddin Maddu
RIWAYAT HIDUP
Penulis mempunyai nama lengkap Made Mitha
Prameswari. Penulis dilahirkan di Jakarta pada tanggal
23 Februari 1986 dari pasangan Bapak I Gede Ketut
Sudjisnu dan Ibu Putu Lestari. Penulis merupakan putri
kedua dari tiga bersaudara.
KATA PENGANTAR
Segala puja dan puji syukur penulis panjatkan kehadirat Tuhan Yang Maha
Esa karena berkat segala rahmat-Nya yang tiada terkira penulis akhirnya dapat
menyelesaikan skripsi yang berjudul ”Kinematika Imunoterapi Pada Tumor”
ini dengan sebaik-baiknya. Skripsi ini dibuat demi untuk memenuhi syarat akhir
untuk memperoleh gelar Sarjana Sains. Skripsi ini mulai dilaksanakan pada bulan
September 2010 dan selesai kira-kira pada bulan Desember 2010. Penelitian ini
dilaksanakan di Laboratorium Fisika Teori dan Komputasi Departemen Fisika
Fakultas Matematika dan Ilmu pengetahuan Alam, Institut Pertanian Bogor.
Penelitian ini meliputi kegiatan penelusuran literatur, pembuatan program, analisis
output, pengolahan data, dan penyusunan laporan.
Ucapan terima kasih pertama-tama penulis ucapkan kepada orang tua penulis
atas doa-doa beliau yang tiada habisnya kepada penulis; semoga Beliau selalu
dilindungi dan dilimpahi rahmatya oleh Tuhan Yang Maha Kuasa. Terima kasih
juga penulis sampaikan kepada Bapak Dr. Agus Kartono dan Bapak Dr.
Akhiruddin Maddu atas bimbingan serta ilmunya selama ini sehingga skripsi ini
dapat terselesaikan dengan baik. Terakhir penulis ingin menyampaikan ucapan
terima kasih kepada kakak Teguh Puja Negara, selaku mahasiswa Fisika angkatan
39, atas bantuannya sehingga penulis dapat memenuhi tugas yang diberikan
dengan baik. Serta kepada seluruh pihak yang telah membantu, yang tidak bisa
disebutkan satu-persatu di sini, penulis ucapkan banyak terima kasih.
Penulis menyadari skripsi ini masih jauh dari kesempurnaan. Oleh karena itu
kritik dan saran yang bersifat membangun penulis harapkan demi kemajuan ilmu
pengetahuan di masa mendatang.
Bogor, Desember 2010
DAFTAR ISI
Halaman
DAFTAR TABEL... iv
DAFTAR GAMBAR... .... v
DAFTAR LAMPIRAN... vi
BAB 1 PENDAHULUAN... 1
1.1 Latar Belakang... 1
1.2 Tujuan Penelitian... 1
1.3 Hipotesis... 1
1.4 Rumusan Masalah... ... 1
BAB 2 TINJAUAN PUSTAKA... 1
2.1 Peran TGF-β dalam Pertumbuhan Tumor... 1
2.2 Immunoterapi Tumor-Tumor dengan Sitokin dan siRNA... 2
2.3 Model Tumor Agresif... 3
2.4 Penaksiran Parameter... 4
2.5 Parameter dalam Perawatan dan Pertumbuhan Tumor... 5
BAB 3 BAHAN DAN METODE... 6
3.1 Waktu dan Tempat Penelitian... 6
3.2 Metode Penelitian... 6
BAB 4 HASIL DAN PEMBAHASAN... 6
4.1 Immunoterapi pada Tumor dengan IL-2... 6
4.2 Tumor-Tumor Pasif (tidak memproduksi TGF-β)... 7
4.3 Tumor Agresif (memproduksi TGF-β)... 9
4.4 Arti Biologi... 10
1 Definisi Tumor... 10
2 Pertumbuhannya... 10
3 Perluasannya... 11
4 Kekambuhan... 11
BAB 5 KESIMPULAN DAN SARAN... .. 11
5.1 Kesimpulan... 11
5.2 Saran... 12
DAFTAR PUSTAKA... 12
DAFTAR TABEL
Halaman
Tabel 1. Daftar nilai-nilai parameter yang digunakan dalam ODE
Pertumbuhan tumor dan sumber-sumbernya……….... 4
Tabel 2. Menunjukkan stabilitas sel tumor keadaan-keadaan tetap
berbeda menurut antigenisitas c menyoroti
DAFTAR GAMBAR
Halaman
Gambar 1. Sebuah model untuk rangkaian kejadian-kejadian
molekular yang diasosiasikan dengan siRNA untuk
meredam TGF-
β
RNA…... 2
Gambar 2. Sebuah simulasi numerik model persamaan-
persamaan (1)-(5) memplot densitas sel tumor terskala
versus waktu untuk mendeteksi tumor (
c
= 5 × 10
-6) pada
laju produksi TGF-
β
,
p
4, meningkat... 5
Gambar 3. Diagram bifurkasi menunjukkan perubahan-perubahan
dalam jumlah dan stabilitas dari keadaan-keadaan tetap
terkait dengan densitas sel tumor terskala (x) pada
laju produksi TGF-
β
yang berubah-ubah... 5
Gambar 4. Diagram bifurkasi yang dicirikan oleh satu bifurkasi
Hopf pada
p
4= 2.84... 6
Gambar 5. Grafik-grafik simulasi numerik model persamaan-
persamaan (1)-(5) memplot volume sel tumor versus
waktu untuk mendeteksi tumor ketika antigenisitas
DAFTAR LAMPIRAN
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Pada saat ini, perjuangan untuk menemukan cara penyembuhan yang efektif dan permanen untuk tumor terus dilakukan oleh para ilmuwan, sehingga banyak kemajuan yang telah dibuat dalam menemukan informasi baru pada pengobatan yang berhasil untuk mengurangi bahkan menghentikan sel tumor. Tidak berfungsi sistem imun tubuh untuk melawan tipe sel tumor merupakan masalah yang sangat mendasar untuk terus diteliti.1
Sel tumor diturunkan dari satu atau beberapa sel normal yang telah melalui transformasi menjadi sel yang membahayakan. Sebuah sel yang telah mengalami mutasi menghasilkan sel tumor yang lebih mudah dikenali sebagai benda asing (dengan kata lain lebih antigenik) daripada sel yang berbeda hanya sedikit dari sel sehat..
1
Respon tubuh terhadap imun pada dasarnya berupa proses pengenalan dan eliminasi. Jika salah satu atau kedua proses ini terganggu maka akan terjadi gangguan seperti autoimun, hipersensitif. Ketika ada antigen masuk, sistem imun merespon lalu mengeliminasi benda asing. Kegagalan eliminasi menyebabkan patologis.
Respon imun adaptif bergantung pada empat sel efektor utama untuk mengeliminasi atau memperlambat pertumbuhan tumor: dua tipe sel T, sel fagositik, dan sel pembunuh. Sel fagositik dan sel pembunuh alami dapat mengidentifikasi dan menghancurkan sel-sel tumor dengan mengenali target sel-sel T sitotoksik di dalam sel tumor.
2
Kekuatan respon imun tubuh memberi pengaruh besar terhadap keberhasilan atau kegagalan dalam pembunuhan sel-sel tumor.1
Respon imun tubuh pada sel tumor bergantung pada seberapa besar antigenik sel tumor tersebut. Terlihat bahwa ketidakmampuan sistem imun tubuh untuk membunuh tumor, karena sel-sel tumor dapat mengelak dari pengawasan imun tubuh, sehingga ini memberikan inspirasi untuk mencari metode terapi yang mendorong imun tubuh dapat mengenali sel-sel tumor tersebut. Metode imunoterapi membantu menstimulasi dan meningkatkan reaksi daya tahan tubuh, serta menekan secara maksimal efek racun dengan kemoterapi dan radioterapi.
2
Model kemudian dikembangkan dengan
memasukkan perawatan siRNA yang dapat mengurangi pengaruh asing dalam sel-sel tumor.
1.2 Tujuan
Penelitian ini bertujuan untuk meneliti tingkat imunoterapi pada tumor dengan
menggunakan metode numerik dan
menganalisis seberapa besar peran antigen mampu menstimulasi sistem imun tubuh.
1.3 Hipotesis
Perilaku grafik pertumbuhan sel-sel tumor mengikuti pola pertumbuhan sigmoid (huruf S) yaitu kelajuan densitas sel tumor terskala terhadap waktu awalnya linier kemudian eksponen lalu menuju konstan.3 Setelah diberi obat grafik laju berbentuk huruf L atau pelana kuda, yaitu awalnya tinggi kemudian menurun, lalu berhenti.
1.4 Rumusan Masalah
1. Bagaimana perbandingan respon tumor terhadap metode injeksi sitokin (IL-2)
dengan siRNA dalam keampuhan
strategi perlakuan imunoterapi ini ?
2. Bagaimana hasil perbandingan
menggunakan perawatan dengan yang tanpa perawatan ?
3. Bagaimana solusi numerik model
imunoterapi pada tumor menggunakan metode ODE45 ?
4. Apa pengaruh variabel antigenisitas tumor, c di sel efektor dan Interleukin-2 terhadap keampuhan imunoterapi ?
BAB 2
TINJAUAN PUSTAKA
2.1 Peran TGF- β dalam
Pertumbuhan Tumor
Ketika secara efektif sistem imun tubuh menggunakan pro-radang dan anti-radang sitokin dalam merespon patogen, sel tumor mengembangkan cara untuk menghindari efek ini secara langsung atau menghambat peningkatan sitokin. Sel tumor dapat menghindari pendeteksian imun tubuh dengan mengeluarkan faktor-faktor yang bersifat menekan imun, seperti: interleukin-10 (IL-interleukin-10), prostaglandin E2 (PGE-2), dan faktor pertumbuhan-pergantian bentuk-beta (TGF-β).
Tiga elemen penghambat yang tercakup di atas dalam model matematika dapat diwakilkan hanya pada satu penghambat saja, yaitu fokus penghambat TGF-β, karena secara intensif TGF-β bersifat menekan
dengan sifat angiogeniknya. Dengan membalas sifat-sifat pembangkit imuno IL-2 dan menyelubungi tumor dari pengenalan
sistem imun, TGF-β menghambat
pergerakan dan perluasan CTLs (sel T sitotoksik) dan sel-sel B (yang memproduksi antibodi) dan mengurangi ekspresi antigen, sehingga mencegah pembunuhan sel tumor.
TGF-β dapat hadir dalam sel tumor dan sel sehat dan memainkan peran yang bermanfaat dalam penyembuhan luka normal, peradangan, dan pertumbuhan perangsang angiogenesis (pembentukan pembuluh darah baru).
4
5
Walaupun TGF-β dapat meningkatkan pertumbuhan sel sehat dan kegunaannya, produksi TGF-β oleh sel tumor sangat menantang sistem imun melalui peningkatan angiogenesis dan dapat meningkatkan pertumbuhan tumor secara metastasis.6
TGF-β tidak diproduksi secara
konsisten diantara semua sel tumor. Percobaan telah menunjukkan bahwa sel tumor yang kecil (yang mana menerima banyak bahan gizi dari jaringan di sekelilingnya) memproduksi sedikit atau tidak TGF-β. Pada umumnya, sel tumor yang besar mengeluarkan TGF-β dan bergantung dengan pertumbuhan efek-efek perangsangannya, seperti pada sifat-sifat penekan imun tubuh.
7
Perbedaan ini membantu untuk mengenal konsep bahwa sel tumor dapat ‘mengganti’, ini untuk menyatakan sifat-sifat penekan imun (dengan kata lain memproduksi TGF-β) pada tingkat tertentu
dengan mengumpulkan
perubahan-perubahan genetik yang mengubah ekspresi gen.
7
Untuk melawan tertekannya imun oleh sel tumor, para peneliti juga mempertimbangkan strategi pengobatan baru yang dikenal sebagai terapi pencampuran RNA (siRNA) sederhana.
2.2 Immunoterapi Tumor-Tumor dengan Sitokin dan siRNA
Terapi pengobatan tumor yang cukup membahayakan telah diterapkan sekarang ini adalah kemoterapi dan radiasi, sedangkan terapi pengobatan secara imunoterapi termasuk yang tidak membahayakan. Terapi pengobatan yang terakhir adalah untuk mendorong respon imun tubuh yang cukup untuk membantu tubuh dalam melawan tumor.
Pendekatan terapi pengobatan imunoterapi untuk menyerang tumor yang fokus pada transfer adoptif dari non-spesifik
ex vivo dengan menstimulasi tuan rumah limfosit (seperti limfosit mengaktifkan sel pembunuh (LAK) dan infiltrasi limfosit tumor (TIL)). Jumlah produksi TGF-β oleh sel tumor berhubungan dengan tingkatan penyakit dan muatan tumor, ini menjelaskan mengapa sel tumor diperlakukan dalam banyak studi imunoterapi bisa memproduksi cukup TGF-β untuk menghambat aktivitas LAK atau sel-sel.6
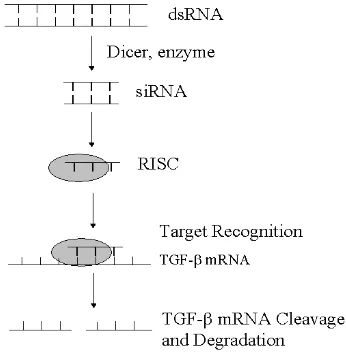
Perlakuan siRNA menyertakan pengiriman awal dobel-untai RNA (dsRNA) ke dalam sel-sel tumor (lihat Gambar 1). Enzim Dicer kemudian memotong dsRNA ke dalam 21-23 nukleotida-segmen-segmen panjang yang dikenal sebagai siRNA, ini menunjukkan bahwa sekali terikat dengan RNA-kompleks peredam terinduksi (RISC), dapat mengenai TGF-β mRNA.
Dengan demikian, pendekatan-pendekatan baru menggunakan terapi-terapi kombinasi harus diterapkan.
8
Rangkaian antisens siRNA mendeteksi untaian mRNA komplementer yang menjadi TGF-β dalam sel-sel tumor. RISC mengikat dan membelah
mRNA untuk mencegah protein TGF-β
diproduksi. Sebuah model untuk dinamika molekuler ditunjukkan pada Gambar 1.
Gambar 1. Sebuah model untuk rangkaian kejadian-kejadian molekular yang diasosiasikan dengan siRNA untuk meredam TGF-β RNA.1
Walaupun belum dites secara in vivo, perlakuan siRNA sebaiknya menyediakan cara-cara yang dapat memblokir penciptaan
produk gen TGF-β. Pada akhirnya,
perlakuan siRNA bekerja untuk
menghambat ekspresi TGF-β dengan
secara negatif mengatur perkembangbiakan sel dan memimpin massa tumor yang besar. Namun, beberapa kekurangan yang ada yang bisa membatasi keefektifan dari strategi pengobatan ini, mencakup jalan masuk lokasi target siRNA pada TGF-β mRNA.9
Secara ideal, terapi sitokin (misalnya terapi IL-2) dapat diatur dalam kombinasi dengan strategi-strategi penawaran, seperti siRNA, untuk menghambat produksi dan efek-efek yang bersifat menekan imun dari TGF-β.
6
Riset dan percobaan lebih lanjut dengan terapi-terapi kombinasi ini bisa menyediakan solusi efektif dalam menujukan efek-efek yang bersifat menekan imun TGF-β.
2.3 Model Tumor Agresif
Untuk memodelkan kejadian-kejadian yang digambarkan di atas, model matematika dibangun dari model yang telah dipublikasikan sebelumnya1
)
(
t
E
yang menggambarkan laju pertumbuhan sel-sel efektor, ; sel-sel tumor,
T
(
t
)
; danIL-2,
I
(
t
)
. Pada penelitian ini, model digabung dengan efek-efek perangsang pertumbuhan dan efek-efek yang bersifat menekan imun TGF-β dengan menetapkan variabel baru,S
(
t
)
. + − + + − + = S q S q p I g EI E S cT dt dE 2 1 1 1 1 1 γ µ
16 , (1) S g ST p T g aET K T rT dt dT + + + − − = 3 2 2 1 , (2) I S T g ET p dt dI 2 4 3 ) 1 ( ) ( + +α −µ = , (3) S T T p dt dS 3 2 2 c 2 4 µ τ + − = , (4) dengan kondisi-kondisi awal:
0 ) 0 ( E E = 0 ) 0 ( T T = 0 ) 0 ( I I = 0 ) 0 ( S
S = . (5) Dalam persamaan (1), sel-sel efektor diasumsikan untuk direkrut pada lokasi tumor sebagai hasil langsung dari kehadiran sel-sel tumor. Parameter c, antigenisitas tumor, mengukur kemampuan sistem imun untuk mengenal sel-sel tumor. Antigenisitas ditunjukkan untuk menjadi parameter
bifurkasi utama1 mengatur dinamika kesetimbangan. Produksi TGF-β telah ditunjukkan untuk mengurangi ekspresi antigen, dengan demikian membatasi tingkat pengerahan, diukur oleh parameter penghambat γ.
Bagian kedua mewakili kehilangan sel-sel efektor karena kematian sel-sel, dan bagian ketiga, bagian perkembangbiakan, menegaskan perkembangbiakan sel efektor bergantung atas kehadiran sitokin IL-2 dan berkurang ketika sitokin TGF-β hadir.
4
Bentuk-bentuk Michaelis-Menten dari komponen-komponen dari bagian perkembangbiakan dapat diperoleh dengan mempertimbangkan ikatan IL-2 dan TGF-β pada permukaan sel efektor penerima-penerima rangsang, melibatkan hukum aksi massa, dan menggunakan asumsi-asumsi keadaan kuasi-tetap biasa. Oleh karena itu,
p1 adalah laju maksimum dari
perkembangbiakan sel efektor dalam ketiadaan TGF-β, g1 dan q2 adalah
konstanta-konstanta saturasi-setengah, dan
q1 adalah laju maksimum dari efek
anti-berkembangbiak TGF-β.
Persamaan (2) menggambarkan pertumbuhan populasi tumor dan bagian pertama mewakili dinamika pertumbuhan logistik dengan laju pertumbuhan hakiki r
dan kapasitas pembawa K dalam ketiadaan sel-sel efektor dan TGF-β. Model bagian kedua, penurunan populasi tumor disebabkan oleh pembersihan imun. Bagian ini diturunkan sehingga laju bersih imun-terimbas kematian sel tumor
1 T g aE + 2
bertambah sebagai akibat meningkatnya populasi sel, tetapi berkurang ketika populasi tumor meningkat. Parameter a
mengukur kekuatan respon imun pada sel-sel tumor dan, seperti yang diharapkan, ditunjukkan untuk menjadi parameter bifurkasi.1
Bagian ketiga dalam (2) menjelaskan peningkatan pertumbuhan dari sel-sel tumor dalam kehadiran TGF-β. TGF-β dikenal untuk menstimulasi pertumbuhan tumor dengan mengembangkan angiogenesis dan meningkatkan persediaan darah intra-tumoral.
5
Dengan demikian, dalam kehadiran
TGF-β, ukuran tumor bisa melebihi
kapasitas pembawanya. Kinetika Michaelis-Menten, dimana p
2 adalah laju maksimum
dari perkembangbiakan yang meningkat dan
menunjukkan respon terbatas sel-sel tumor pada pemicu pertumbuhan sitokin ini.
Kinetika IL-2 digambarkan dalam persamaan (3). Bagian pertama mewakili produksi IL-2 yang mana diproduksi pada laju maksimal dari p3 dalam kehadiran
sel-sel efektor distimulasi oleh interaksi mereka dengan sel-sel tumor. Dalam ketiadaan
TGF-β, proses pembatasan sendiri ini dengan koefisien saturasi-setengah, g4. Kehadiran
TGF-β menghambat produksi IL-2 dalam cara yang tidak kompetitif, dimana
parameter α adalah ukuran dari hambatan.10
2
µ
Akhirnya, mewakili laju peluruhan IL-2.
Persamaan keempat menggambarkan laju perubahan penekan sitokin TGF-β. Bukti eksperimen memberi kesan bahwa TGF-β diproduksi dalam jumlah yang sangat kecil ketika tumor-tumor cukup kecil untuk menerima bahan gizi yang banyak dari jaringan sekelilingnya. Betapapun, ketika populasi tumor tumbuh cukup besar, sel-sel tumor menderita dari kekurangan oksigen dan memulai untuk memproduksi TGF-β dalam rangka merangsang angiogenesis dan untuk menghindarkan respon imun sekali pertumbuhan tumor mulai lagi. Perubahan dalam produksi TGF-β diperagakan oleh bagian pertama dalam (4). Disini, p4
c
τ
adalah laju maksimum produksi TGF-β dan adalah populasi sel tumor kritis pada mana penggantian terjadi. Laju peluruhan TGF-β diwakili oleh µ3.16
2.4 Penaksiran Parameter
Ada beberapa parameter-parameter yang mana menengahi interaksi-interaksi tuan rumah-tumor digambarkan oleh persamaan-persamaan (1-4).
Tabel 1 menjabarkan nilai-nilai dasar dari parameter-parameter model yang digunakan dalam simulasi-simulasi numerik. Nilai-nilai untuk parameter-parameter dimana S(t)≡0dihadirkan oleh D.
Kirschner1 yang digunakan secara langsung. Parameter p2 diasumsikan bahwa kehadiran
TGF-β dapat menaikkan laju
perkembangbiakan bersih sel-sel tumor pada jumlah 50% (selama tidak ada data yang tersedia), nilai g3 pada awalnya diambil
untuk menjadi sama dengan g1. Jangkauan
p4 terdaftar dalam Tabel 1 diambil dari
penelitian-penelitian yang telah dilakukan oleh T.S. Tzai et al.,11 dimana level-level pengeluaran TGF-β oleh sinar γ iradiasi dan
yang non iradiasi sel-sel tumor MBT-2 tipe-ganas diukur. Nilai-nilai untuk parameter-parameter q1 dan q2 mewakili efek-efek
yang bersifat menekan imun TGF-β yang diperkirakan dari percobaan-percobaan yang diberikan oleh C.I. Hsieh et al.,12 dimana penghambatan perkembangbiakan dari sel-sel leukimia T murni oleh sel-sel yang mengeluarkan TGF-β diukur.
Tabel 1. Daftar nilai-nilai parameter yang digunakan dalam ODE pertumbuhan tumor dan sumber-sumbernya
a
Rata-rata nilai-nilai diperkirakan oleh [14, 15]
b
Nilai ini diberikan dalam [1] mempunyai satuan-satuan 1/waktu; nilai ini
Parameter Nilai Nomor Pustaka
1
µ
0.03 days-1 [14, 15]a1
p
0.1245 days-1 [14]1
g
2 × 107 lpg [1]
c 0 - 0.035 days-1 [1]
1
q
0.1121 days-1 [12]2
q
2 × 106l
pg [12]
r
0.18 days-1 [1]K
1 × 109ml
cells [15]
a 1 day-1 [1]
2
g
1 × 105ml
cells [1]
2
p
0.27 days-13
g
1 × 103ml pg 3
p
5 days cell pg × [1]b 4g
1 × 103ml
cells [1]
2
µ
10 days-1 [1]α
1 × 10-3pg
l [10]
3
µ
10 days-1c
τ
1 × 106ml
cells [13]
4
p
0 – 3 × 108 days lpg
×
didapatkan dengan mengasumsikan kejenuhan IL-2 pada ≈ 2 × 108 pg/l dan rata-rata densitas sel 2 × 108 sel-sel/l.
Penelitian oleh S.C. McKarns10
c
τ
menyatakan susunan TGF-β ekspresi dari
IL-2 dan nilai α diperkirakan dari
eksperimen-eksperimen mereka pada efek-efek TGF-β pada pengeluaran IL-2 oleh
splenosit dan thymosit. Akhirnya, berdasar pada penggantian angiogenik yang terjadi ketika 106 sel hadir, ini berdasarkan pada observasi-observasi eksperimental oleh J. Folkman13 yang menunjukkan bahwa tumor hanya dapat tumbuh pada bahan ukuran gizinya terbatas dengan diameter sekitar 1-2 mm (dan mengandung O(106) sel) tanpa permulaan dari persediaan darah mereka sendiri.
2.5 Parameter dalam perawatan dan pertumbuhan tumor
Tiga gambar berikut (Gambar 2, 3, dan 4) melukiskan hasil-hasil berbeda ketika meningkatnya laju maksimum dari produksi
TGF-β (p4) untuk bermacam nilai
antigenisitas (c), dan hambatan antigenik (γ). Di atas nilai-nilai parameter yang bervariasi ini, kita mengharapkan untuk melihat hasil-hasil yang sangat berbeda untuk kontrol tumor.
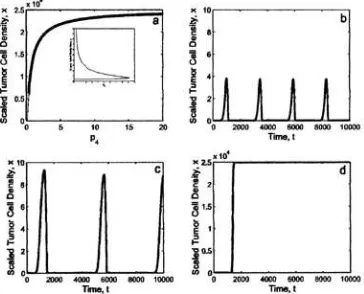
Gambar 2. Sebuah simulasi numerik model persamaan-persamaan (1)-(5) memplot densitas sel tumor terskala versus waktu untuk mendeteksi tumor (c = 5 × 10-6) pada laju produksi TGF-β, p4, meningkat.1
Dalam gambar 2, nilai c adalah sangat kecil (5 × 10-6), mencegah deteksi tumor oleh tuan rumah sistem imun. Ini menghasilkan pertumbuhan tumor yang cepat (bahkan dalam ketiadaan TGF-β, lihat Tabel 2) yang mana secara cepat mendekati lingkungan pembawa kapasitas. Untuk semua nilai-nilai p4 lebih besar dari nol,
pertumbuhan tumor bahkan melampaui kapasitas pembawa normal yang ada dalam
ketiadaan TGF-β. Semua nilai γ
menghasilkan pertumbuhan tidak terkendalikan dalam kasus ini.16 Gambar ini menghasilkan kurva jenis sigmoid. Perilaku ini awalnya linier dengan laju kecil kemudian eksponensial lalu laju berubah menjadi konstan.
Gambar 3. Diagram bifurkasi menunjukkan perubahan-perubahan dalam jumlah dan stabilitas dari keadaan-keadaan tetap terkait dengan densitas sel tumor terskala (x) pada laju produksi TGF-β yang berubah-ubah.
Gambar 3 (c = 0.002) menunjukkan nilai menengah c pada mana pertumbuhan tumor tak terkontrol ditekan pada tingkat produksi TGF-β beragam Sebagai gantinya, ada perubahan kritis dalam tingkah laku tumor ketika nilai p4 meningkat ke bifurkasi
Hopf (p4 = 0.12) (Gambar 3a).
Bifurkasi Hopf terjadi ketika p4=0.1205.
Garis tipis mengacu pada perilaku tumor tidak stabil sedang garis tebal mengacu pada perilaku tumor stabil untuk nilai c = 0.002. Keadaan tetap tumor-sekarang adalah tidak stabil untuk nilai-nilai kecil p4
Catat bahwa untuk beberapa nilai p ,
menghasilkan sebuah limit siklus, digolongkan oleh getaran- getaran yang menggambarkan periode-periode waktu yang dihabiskan dekat kapasitas pembawa diikuti oleh periode dormansi. Setelah mencapai bifurkasi Hopf, keadaan tetap stabil muncul mewakili sebuah massa tumor yang besar (Gambar 3d).
4
ada tiga keadaan tetap yang mungkin. Tingkah laku yang digolongkan keadaan tetap stabil akan berkuasa dalam kasus-kasus ini. Dalam Gambar 3, kita menggunakan γ = 10. Penurunan γ mewajibkan level yang lebih tinggi dari produksi TGF-β (p4) untuk
Gambar 4. Diagram bifurkasi yang dicirikan oleh satu bifurkasi Hopf pada p4 = 2.84.
Pada gambar 4 garis tipis merupakan perilaku tak stabil dan garis tebal mengacu pada perilaku tumor stabil untuk nilai antigenisitas c = 0.0035. Sisipan menyoroti perubahan-perubahan dalam stabilitas dekat
p4 = 0. Grafik-grafik sisanya adalah
simulasi-simulasi numerik model persamaan-persamaan (1)-(5), memberikan densitas sel tumor per waktu sebagai p4
meningkat ke nilai-nilai berikut: (b) p4= 0
(c) p4 = 2.84 (d) Semua p4
Akhirnya, Gambar 4 (c = 0.0035) mewakili nilai terendah c pada mana sistem imun dapat pada awalnya mengontrol tumor. Tingkah laku digolongkan oleh osilasi-osilasi teredam yang menurunkan ke keadaan tetap yang rendah, dan tumor dapat digambarkan sebagai tidak aktif. Bagaimanapun, sebagaimana p
> 2.84.
4 menaikkan
masa lalu bifurkasi Hopf (p4 = 2.85, Gambar
4a), sistem imun tidak lagi berhasil dalam mengalahkan tumor, dan massa tumor besar lagi digolongkan tingkah laku tumor dekat kapasitas pembawa (Gambar 4d).
BAB 3
BAHAN DAN METODE
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Laboratorium Fisika Komputasi, Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor dari bulan September 2010 sampai dengan Januari 2011.
3.2 Metode Penelitian
Penelitian ini berdasarkan analisis jurnal A Mathematical Model of Tumor-Immune Evasion and siRNA Treatment yang ditulis oleh Denise Kirschner, T.L. Jackson dan J.C. Arciero. Model ini
menjelaskan inklusi dari mekanisme penggantian angiogenik untuk aktivitas TGF-β. Model memprediksi bahwa kenaikan laju produksi TGF-β untuk nilai-nilai yang layak dari antigenisitas tumor meningkatkan pertumbuhan tumor dan kemampuannya untuk lepas dari deteksi tuan rumah.
BAB 4
HASIL DAN PEMBAHASAN
4.1 Imunoterapi pada Tumor dengan IL-2 Penelitian mencoba mensimulasikan pengobatan yang berfungsi mendorong kapasitas sistem imunitas tubuh untuk memerangi kanker. Imunoterapi mencoba untuk menggunakan sitokin yaitu stimulasi protein yang diproduksi, dilepaskan dan digunakan oleh sel-sel, untuk meninggikan aktivitas selular. Sitokin paling efektif adalah interleukin-2 (IL-2). IL-2 merupakan interleukin untuk pertumbuhan T-sel dan membedakan antara sel sehat dan sel tumor. Sel-sel ini yang mengatur reaksi imun. Penelitian mempertimbangkan terapi imun untuk diadopsi oleh terapi imun selular dan/atau pengiriman IL-2 pada tempat tumor apakah secara terpisah atau dalam kombinasi. Dengan demikian, dalam model (1)-(4), dipertimbangkan apakah kedua s1
dan s2 menjadi non-zero dimana laju s1
mewakili sel-sel LAK atau TIL tambahan ke tempat tumor dan laju s2
Imunoterapi mengacu pada
penggunaan sitokin yang biasanya
bersamaan dengan ACI (adoptive cellular immunotherapy). Karena sel tumor mulai sebagai sendiri sistem kekebalan tidak merespon dengan efektif. ACI mengacu pada injeksi sel kekebalan tubuh yang ditanamkan yang emiliki reaktivitas ke dalam sejumlah besar tumor. Hal ini dapat mengambil dua pendekatan.
mewakili penambahan interleukin-2 ke tempat tumor.
1 Terapi LAK. Sel-sel ini diambil dari penanaman in vitro dengan konsentrasi IL-2 yang tinggi dari sekitar leukosit darah yang dikeluarkan pasien. LAK kemudian disuntikkan kembali pada tempat tumor. LAK dianggap menjadi sel-sel pembunuh alami.
. diaktifkan. Mereka disuntikkan kembali
ke tempat tumor pasien.
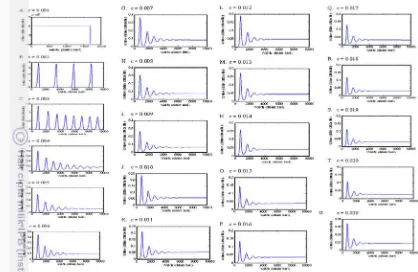
Penelitian ini mengeksplor masing-masing dari terapi-terapi ini secara terpisah dan kemudian mengkombinasikan efek-efek keduanya. Dari analisis atas gambar 5 dari E sampai gambar U dapat disimpulkan bahwa semakin tinggi nilai antigenisitas c maka nilai laju densitas sel tumor konstan menjadi semakin rendah dan waktu yang diperlukan pada nilai konstannya akan semakin pendek. Demikian sebaliknya pada gambar A sampai D yaitu dengan semakin rendah nilai antigenisitas c maka nilai volume sel tumor konstan akan semakin tinggi dan waktu yang diperlukan pada nilai ini akan semakin panjang.
Ketika c meningkat, amplitude dan periode siklus batas berkurang, menyebabkan besarnya tumor dan waktu yang dihabiskan mendekati puncak berkurang. Ini menghasilkan ukuran tumor yang lebih kecil dan waktu penyembuhan yang lebih capat. Gambar yang tersedia mengikuti pelana kuda atau huruf L. Ketika
γ tingkat hambatan meningkat, besarnya p4
dimana bifurkasi Hopf terjadi, berkurang. Dengan kata lain, lebih besar kemampuan TGF- β untuk mengurangi ekspresi antigen. Ringkasnya karena tumor agresif
menghambat produksi IL-2, mengurangi ekspresi antigen, dan mempromosikan pertumbuhan tumor, tidak ada nilai c antara 5x10-6 dan 0.0032 mampu secara permanen memberikan cara pada tumor tidur yang mencapai tumor pasif. Seperti hasil yang menyatakan bahwa peran c, p4
Pada bagian ini, tumor-tumor pasif didefinisikan tidak secara aktif memproduksi
TGF-β dalam rangka meningkatkan
pertumbuhannya dan mengelakkan deteksi imun. Mulai dengan nilai antigenisitas tumor sekecil c= 0.0001, status tunggal, tetap dan tidak stabil ada untuk tumor pasif. Dalam hal ini, solusinya dicirikan dengan osilasi yang terus menerus dan merespon pada periode tumor. Konsentrasi sel mendekati kapasitas yang membawa dan periode dormansi menjadi lebih panjang. Bifurkasi Hopf menandai akhir dari osilasi-osilasi yang terus menerus dan munculnya status tetap
yang stabil. Analisis numerik dari
persamaan-persamaan model dalam ketiadaan penekan imun dan kemampuan-kemampuan yang merangsang pertumbuhan sel-sel tumor (
dan γ adalah signifikan.
4.2 Tumor-Tumor Pasif (tidak memproduksi TGF-β)
0 ) (t =
S ) dilaporkan oleh D.
Kirschner.1 Sebagaimana laporan
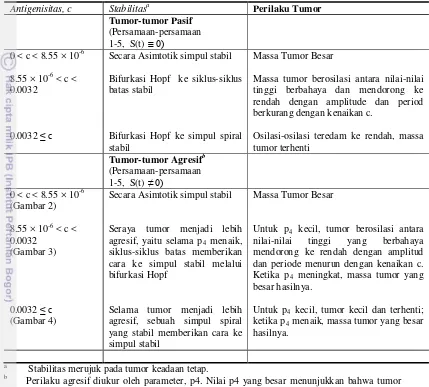
Tabel 2. Menunjukkan stabilitas sel tumor keadaan-keadaan tetap berbeda menurut antigenisitas tumor, c, menyoroti tiga daerah kepentingan.
a
Stabilitas merujuk pada tumor keadaan tetap. b
sebelumnya merupakan titik awal untuk model baru di penelitian ini, ringkasan singkat dari hasil-hasil diberikan diatas.
Perilaku agresif diukur oleh parameter, p4. Nilai p4 yang besar menunjukkan bahwa tumor dengan giat memproduksi TGF- β dalam rangka mempromosikan pertumbuhannya sendiri dan untuk menekan respon imun.
Tabel 2 menunjukkan bagaimana jumlah dan stabilitas sel tumor keadaan-keadaan tetap berbeda menurut antigenisitas tumor, c, menyoroti tiga daerah kepentingan. Dalam jangkauan nilai-nilai yang pertama (0 <c < 8.55 × 10-6
Dalam jangkauan yang kedua, (8.55 × 10
) keadaan tetap stabil tunggal bersesuaian dengan massa tumor besar yang bertumbuh sangat dekat dengan kapasitas pembawanya. Oleh karena itu, tumor telah dengan berhasil mengelakkan pengenalan imun dengan menyatakan antigen-antigen yang mana sulit untuk dideteksi sebagai benda asing.
-6
Antigenisitas, c
< c < 0.0032), siklus batas stabil mengindikasi bahwa tumor menyisihkan porsi waktu dekat dengan kapasitas pembawanya dan kemudian tergeletak terhenti (massa menuju ke nol) untuk periode waktu yang lain. Ketika c menaik, besaran dan periode osilasi-osilasi menurun, menghasilkan ukuran tumor yang lebih kecil dan waktu pemulihan yang lebih cepat. Jangkauan nilai-nilai yang terakhir (0.0032 <
c) memulai pada bifurkasi Hopf diikuti oleh kemunculan simpul spiral yang stabil. Osilasi-osilasi teredam yang diproduksi disini mendorong kearah tumor keras yang kecil bahwa, walaupun tidak pernah
Stabilitasa Perilaku Tumor Tumor-tumor Pasif
(Persamaan-persamaan 1-5, S(t) ≡ 0)
0 < c < 8.55 × 10-6
8.55 × 10-6 < c < 0.0032
0.0032 ≤ c
Secara Asimtotik simpul stabil
Bifurkasi Hopf ke siklus-siklus batas stabil
Bifurkasi Hopf ke simpul spiral stabil
Massa Tumor Besar
Massa tumor berosilasi antara nilai-nilai tinggi berbahaya dan mendorong ke rendah dengan amplitude dan period berkurang dengan kenaikan c.
Osilasi-osilasi teredam ke rendah, massa tumor terhenti
Tumor-tumor Agresif (Persamaan-persamaan b
1-5, S(t) ≠ 0) 0 < c < 8.55 × 10
(Gambar 2) -6
8.55 × 10-6
(Gambar 3) < c < 0.0032
0.0032 ≤ c (Gambar 4)
Secara Asimtotik simpul stabil
Seraya tumor menjadi lebih agresif, yaitu selama p4 menaik, siklus-siklus batas memberikan cara ke simpul stabil melalui bifurkasi Hopf
Selama tumor menjadi lebih agresif, sebuah simpul spiral yang stabil memberikan cara ke simpul stabil
Massa Tumor Besar
Untuk p4 kecil, tumor berosilasi antara nilai-nilai tinggi yang berbahaya mendorong ke rendah dengan amplitud dan periode menurun dengan kenaikan c. Ketika p4 meningkat, massa tumor yang besar hasilnya.
seluruhnya dibersihkan, dapat digambarkan sebagai inaktif. Selama waktu ketika populasi sel tumor berosilasi dengan puncak hampir sembilan puluh persen dari kapasitas pembawanya, itu sangat mungkin bahwa tuan rumah tidak akan bertahan pada tingkatan ini cukup lama untuk tumor untuk meraih masa istirahat. Sebab itu, kita tidak dapat menganggap tuan rumah akan mampu menunggu sistem imun untuk memperoleh masa istirahat.
Disamping, sementara analisis ini menunjukkan hasil-hasil mungkin untuk tumor pasif. Dalam gambar 5 dengan kenaikan c sebesar 0.001 (kenaikan terjadi dari gambar A sampai gambar T) bisa menjadi baik jika c nilainya cukup besar, itu harus juga diakui bahwa hasil dapat menjadi secara mantap kurang menjanjikan jika tumornya agresif dan mulai memproduksi
TGF-β untuk mempertinggi
pertumbuhannya dan mengelakkan pengawasan imun.
4.3 Tumor Agresif (memproduksi TGF-β) Kita selanjutnya memeriksa kasus tumor sebagai pengganggu agresif dari respon imun tubuh. Untuk melakukannya, kita mempertimbangkan efek pada model
ketika TGF-β diperkenalkan, ini
menyebabkan kenaikan pertumbuhan tumor dari angiogenesis dan peningkatan kemampuan tumor untuk melepaskan deteksi oleh sistem imun karena sifat-sifat penekan imun. Walaupun penambahan
TGF-β pada model menunjukkan secara kualitatif tingkah laku paralel dengan model asli oleh
D. Kirschner,1 beberapa perbedaan
kuantitatif penting juga terjadi. Sebagai contoh, massa tumor yang besar bertumbuh dekat kapasitas pembawanya akan akhirnya terjadi untuk semua tumor-tumor pada beberapa nilai p4, dengan mengabaikan level
antigenisitas. Tingkah laku ini pada hakekatnya berbeda dari tumor-tumor pasif, yang mana hanya mengalami pertumbuhan tumor tak terkendalikan untuk nilai-nilai c di bawah 8.55 × 10-6. Ini menunjukkan hasil nyata bahwa tumor-tumor agresif bahkan lebih bersifat merusak pada tuan rumahnya daripada tumor-tumor pasif dan akan mungkin sekali lebih sulit untuk kontrol.
Tidak seperti kasus tumor-tumor pasif, pertumbuhan tumor tak terkontrol pada atau dekat dengan kapasitas pembawanya mencirikan tingkah laku dari semua tumor agresif.
16
Keadaan tetap tumor-sekarang adalah tidak stabil untuk nilai-nilai kecil p4
Catat bahwa untuk beberapa nilai p
, menghasilkan sebuah limit siklus, digolongkan oleh getaran-getaran yang menggambarkan periode-periode waktu diluangkan dekat kapasitas pembawa diikuti oleh masa-masa istirahat. Setelah mencapai bifurkasi Hopf, keadaan tetap stabil muncul mewakili sebuah massa tumor yang besar (Gambar 3d).
4 ada
tiga keadaan tetap yang mungkin. Tingkah laku yang menggolongkan keadaan tetap stabil akan berkuasa dalam kasus-kasus ini. Dalam Gambar 3, kita menggunakan γ = 10. Penurunan γ mewajibkan level yang lebih tinggi dari produksi TGF-β (p4) untuk
menghasilkan tingkah laku yang sama. c = 0.0035 mewakili nilai terendah c pada mana sistem imun dapat pada awalnya mengontrol tumor. Tingkah laku digolongkan oleh osilasi-osilasi teredam yang menurunkan ke keadaan tetap yang rendah, dan tumor dapat digambarkan sebagai tidak aktif. Bagaimanapun, sebagai p4 menaikkan masa
lalu bifurkasi Hopf (p4
Tiga kurva yang berbeda menggambarkan prilaku untuk peningkatan tingkat produksi TGF-β. Lebih banyak tumor agresif yang memerlukan respon kekebalan lebih kuat dibandingkan tumor yang kurang agresif. Selanjutnya, ketika membandingkan hasil ini dengan yang saya dapatkan dengan perawatan, saya menyimpulkan bahwa ada tingkat realistis dari respon kekebalan (dalam mencakup a = 0.1 sampai 0.3) dengan nilai penting c dimana tubuh dapat sebagian dalam mengendalikan tumor untuk berbagai tingkat
produksi TGF-β. Karenanya saya
menyelidiki pendekatan imunoterapi pengganti yang menggunakan siRNA untuk menekan produksi TGF-β memberikan sel yang sesekali pasif sesekali agresif dan karenanya mengembalikan keberhasilan imunoterapi tradisional.
= 2.85) (Gambar 4a) sistem imun tidak lagi berhasil dalam mengalahkan tumor, dan massa tumor besar lagi menggolongkan tingkah laku tumor dekat kapasitas pembawa (Gambar 4d).
Dua konsep utama yang diselidiki adalah antigenisitas (c) dan penggunaan imunitas selular adoptif (s1). Diagram
dari perawatan, tumor tetap besar dan stabil. Untuk tumor antigenic rendah tetapi jumlah yang lebih besar dari ketidakstabilan perawatan yang ada dimana keadaan tumor besar atau keadaan tumor bebas menerima stabilitas.
Jika perawatan meningkat ke tingkat yang sangat tinggi kemudian tumor dapat dibersihkan. Untuk tumor yang menunjukkan antigenisitas sedang ke tinggi ada dua kasus. Jika imunoterapi sedikit adalah masukan kedalam sistem, kemudian situasi pada dasarnya tetap sama dengan tidak ada perawatan. Tetapi, dengan imunoterapi sedang ke tinggi, tumor dapat dibersihkan.
Konsep utama pada penelitian ini adalah antigenisitas c dan penggunaan IL-2 (s2).
Diagram cabang dua dalam Gambar 2 menunjukkan pengaruh komparatif. Penggunaan konsentrasi rendah IL-2 menghasilkan secara kualitatif hasil yang sama seperti dengan tidak ada perawatan IL-2 (lihat Gambar 1). Bagaimanapun, jumlah besar yang digunakan IL-2 bersama dengan setiap tingkat antigenisitas menghasilkan hasil yang menarik. Disini, tumor dibersihkan tetapi sistem kekebalan tumbuh tidak mengikat ketika konsentrasi IL-2 mencapai nilai status tetap. Pertumbuhan tak terkendali (Gambar 2) dari sistem kekebalan tubuh ini merupakan suatu keadaan yang merugikan tubuh. Efek samping dari perawatan dengan peningkatan dosis IL-2 adalah kebocoran sindrom kapiler (atau sindrom kebocoran vascular). Sindrom ini disebabkan berbagai peristiwa aktivasi IL-2 yang diinduksi. Hal ini dapat berarti bahwa untuk nilai-nilai IL-2 yang digunakan diatas pertumbuhan yang tidak mengikat dari sel efektor kekebalan tubuh dapat mempengaruhi sel yang dapat menggambarkan efek samping yang merugikan terlihat dalam kanker pasien yang menerima imunoterapi.
4.4 Arti Biologi
Hasil di atas menghadirkan beberapa interpretasi biologis yang menarik. Untuk hasil perawatan, kebanyakan korelasi signifikan adalah antara antigenisitas dari tumor bersamaan dengan jenis perawatan yang digunakan. Penelitian ini akan memfokuskan pembahasan pada hubungan tersebut secara detail.
1 Definisi Tumor
Tumor merupakan sekelompok sel-sel abnormal yang terbentuk hasil proses pembelahan sel yang berlebihan dan tak terkoordinasi. Dalam bahasa medisnya, Tumor dikenal sebagai NEOPLASIA. Neo berarti baru, plasia berarti
pertumbuhan/pembelahan, jadi
NEOPLASIA mengacu pada pertumbuhan sel yang baru, yang berbeda dari pertumbuhan sel-sel di sekitarnya yang normal. Yang perlu diketahui, sel tubuh secara umum memiliki 2 tugas utama yaitu melaksanakan aktivitas fungsional nya serta berkembang biak dengan membelah diri. Namun pada sel Tumor yang terjadi adalah hampir semua energi sel digunakan untuk aktivitas berkembang biak semata. Fungsi perkembangbiakan ini diatur oleh inti sel (nucleus), akibatnya pada sel Tumor dijumpai inti sel yang membesar karena tuntutan kerja yang meningkat.
Dari pengertian tumor diatas, Tumor dibagi mejadi 2 golongan besar yaitu Tumor jinak (benign) dan Tumor ganas (malignant) atauyang popular dengan sebutan Kanker. Terdapat perbedaan sifat yang nyata diantara
dua jenis tumor ini dan memang
membedakannya merupakan tuntutan wajib bagi praktisi medis. Perbedaan utama di antara keduanya adalah bahwa tumor ganas lebih berbahaya dan fatal sesuai dengan kata ‘ganas’ itu sendiri. Gambarannya begini, walaupun tumor ganas atau kanker itu berada pada jaringan di kaki, hal itu dalam tahap lanjut dapat mengakibatkan kematian. Tumor jinak hanya dapat menimbulkan kematian secara langsung terkait dengan lokasi tumbuhnya yang membahayakan misalnya tumor di leher yang dapat menekan saluran napas. Terdapat beberapa sifat yang membedakan antara tumor jinak dan ganas.
2 Pertumbuhannya
yang kotor dan tidak kunjung sembuh dengan pengobatan bahkan bertambah luas.
3 Perluasannya
Tumor jinak tumbuh secara ekspansif atau mendesak, tetapi tidak merusak struktur jaringan sekitarnya yang normal. Hal ini dikarenakan tumor jinak memiliki kapsul yang membatasi antara bagian sel-sel tumor yang abnormal dengan sel-sel normal. Sebaliknya pada Tumor ganas (kanker)yang memang tak berkapsul Tumor ganas (kanker) ini tumbuhnya infiltratif atau menyusup sembari merusak jaringan disekitarnya. Pertumbuhan semacam ini pertama kali ditemukan oleh Hippocrates – bapak ilmu kedokteran – dan beliau menamakan sebagai cancer (bahasa latin dari kepiting) karena menurutnya proses infiltratif seperti demikian menyerupai bentuk capit kepiting. Akibat proses infiltratif tersebut, maka jaringan disekitar tumor ganas seringkali rusak, dan jika jaringan yang diinfiltrasi itu berupa pembuluh darah maka tumor jenis ini dapat menimbulkan gejala perdarahan. Contohnya, pada kanker paru salah satu gejalanya adalah batuk darah.
4 Kekambuhan
Tumor jinak umumnya dengan dioperasi secara tepat jarang untuk kambuh lagi.Tumor ganas (kanker) memiliki kekambuhan lebih tinggi dikarenakan proses pembedahannya sulit untuk benar-benar tuntas dikarenakan memang jaringan abnormal ini tidak berkapsul sehingga sulit untuk dibedakan dan dipisahkan dari jaringan normal sekitarnya yang sudah diinfiltrasi. Selain itu tumor ganas tahap lanjut umumnya penyebaran sudah lebih luas bahkan sudah bermetasasis jauh sehingga operasi adalah tidak mungkin menyembuhkan lagi karena sel-sel ganas sudah ada hampir di setiap bagian tubuh.
.
Perawatan dengan siRNA bekerja untuk menghambat dengan mentargetkan sekuensi mRNA yang mendorong pada sintesisnya, memberika solusi yang mungkin untuk masa tumor yang besar. Meskipun demikian beberapa kekurangan yaitu dapat diaksesnya tempat target siRNA pada TGF-β mRNA. Idealnya terapi IL-2 dapat digunakan dalam gabungan dengan strategi netralisasi, seperti siRNA, untuk menghambat produksi dan pengaruh supresif kekebalan dari TGF-β. Penggunaan dosis siRNA sehari-hari (selama tujuh hari
berturut-turut) pada interval waktu yang tepat mendorong pada perilaku tumor osilasi yang dapat dikendalikan.
17
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Penelitian ini menyelidiki efek-efek dari sitokin interleukin-2 pada dinamika imun tumor. Dalam dinamika ini, peran kunci dimainkan oleh antigenisitas tumor. Untuk tumor dengan antigen rendah, sistem imun tidak bisa membersihkan tumor; sementara, untuk tumor dengan antigen tinggi, pengurangan ke tumor nonaktif yang kecil adalah skenario kasus yang paling baik. Jika tumor mempunyai antigenisitas rendah ke menengah, siklus-siklus ini secara relatif panjang (dalam orde 8 sampai 10 tahun) dengan amplitudo yang besar dan tumor berada dalam inaktif sampai beberapa periode. Ini bisa menjelaskan bahwa keadaan kambuh jangka panjang dari tumor. Jika tumor mempunyai antigenisitas medium ke tinggi periode, siklus-siklus pendek dengan amplitude-amplitude yang kecil (Gbr. 1 dan 2). Kesehatan aktivasi sistem imun bermain peran dalam kecenderungan waktu tertentu dilihat dari siklus-siklus tersebut (Gbr. 3). Sebagai contoh, ketika respon imun bertambah (dengan kata lain meningkat), perioda dan amplitudo siklus-siklus batas menurun, mendorong ke arah keadaan tumor berhenti. Perlu dicatat bahwa siklus-siklus batas stabil ini belum diamati dalam model-model sebelumnya dari interaksi antara tumor dan sistem imun.
Perluasan-perluasan alami dari model ini adalah sebagai berikut. Pertama, sebuah metode dasar mekanis dari model terapi imun dibutuhkan. Versi perbaikan bisa termasuk sebuah bagian sumber bergantung waktu untuk terapi imun. Juga, IL-2 hanya satu dari selusin sitokin termasuk dalam dinamika selular dari respon sistem imun ke invasi tumor. Kami berencana untuk meneliti bagaimana sitokin-sitokin lain seperti Interferon-γ, IL-10, dan IL-12 mempengaruhi dinamika sistem. Dinamika-dinamika ini bisa termasuk mekanisme-mekanisme umpan balik positif dan negatif sejak, sebagai contoh, IL-10 menyetel bawah produksi sitokin oleh makrofage teraktivasi. Akhirnya, sebuah model termasuk efek-efek gabungan terapi imun
dengan kemo- dan/atau radio terapi
hasil-hasil yang didapat disini untuk tujuan menuntun percobaan-percobaan klinis.
5.2 Saran
Pertanyaan alami yang muncul dari pembelajaran di atas adalah, apa yang mempengaruhi periode dari solusi-solusi periodik ini? Kami dengan demikian
menarik dalam bagaimana
parameter-parameter kunci, bernama antigenisitas (c) dan respon imun (a), mempengaruhi periode siklus-siklus limit yang didiskusikan di atas; dan kami menghadirkan diagram bifurkasi 2-parameter. Secara khusus, Gbr. 3 menunjukkan bagaimana parameter-parameter a dan c mempengaruhi periode siklus limit. Tiap kurva dalam Gbr. 3 mewakili periode tetap siklus limit. Catat bahwa untuk c tetap, sebuah kenaikan dalam a (respon imun) menyebabkan penurunan dalam period (dan dengan demikian amplitud) dari siklus limit. Jika a menaik cukup kemudian kami melalui Bifurkasi Hopf dan siklus limit menghilang. Dalam kasus ini volume tumor kecil dan terhenti.
Dalam kasus tanpa perlakuan (contohnya s1 = s2 = 0), model tidak mengijinkan pembersihan lengkap tumor. Pada akhirnya kami sekarang mempelajari peran dalam meningkatkan respon imun melalui immunoterapi.
DAFTAR PUSTAKA
1 D. Kirschner dan J.C. Panetta. Modelling immunotherapy of the tumor-immune interaction. J. Mathem. Biol., 37:235-252, 1998.
2 Hudiono. (2010). Imunologi dasar.
http://aviramadani.blogspot.com/20 10/05/imunologi-dasar.html. [8 Mei 2010]
3 Douglas J. S. In Vitro predictors of clinical response in patients receiving interleukin-2-based immunotherapy. Current Opinion in Oncology, 5: 1055 1058, 1993.
4 S. Wojtowicz-Praga. Reversal of tumor-induced immunosuppresion: A new approach to cancer therapy. J. Immunol., 20:165-177, 1997.
5 M.A. Nash et al. The role of cytokines in both the normal and malignant
ovary. Endoc. Rel. Cancer, 6:93-107., 1999.
6 W.M. Kast et al. Effects of TGF- β on the immune system: Implications for cancer immunotherapy.
Leukemia, 13:1188-1199, 1999.
7 F. Paillard. Immunosuppression
mediated by tumor cells: A challenge for immunotherapeutic approaches. Hum. Gene Ther., 11:657-658, 2000.
8 C. Lipardi, Q. Wei, dan B.M. Paterson. RNAi as random degradative PCR:siRNA primers convert mRNA into dsRNAs that are degraded to generate new siRNAs. Cell, 107:297-307., 2001.
9 T. Holen et al. Positional effects of short interfering RNAs targeting the human coagulation trigger tissue factor. Nucleic Acids Res., 30:1757-1766, 2002.
10 S.C. McKarns dan N.E. Kaminski. TGF-β differentially regulates IL-2 expression and [3H]-thymidine incorporation in CD3ε mAb- and CD28 mAb-activated splenocytes
and thymocytes. Immunopharmacology, 48:101-115,
2000.
11 T.S. Tzai, A.L. Shiau, L.L. Liu, dan C.L. Wu. Immunization with TGF-β antisense oligonucleotide-modified autologous tumor vaccine enhances the antitumor immunity of MBT-2 tumor-bearing mice trough upregulation of MHC Class I and Fas expressions. Anit-cancer Res., 20:1557-1562, 2000.
12 C.I. Hsieh, D.S. Chen, dan L.H. Hwang. Tumor-induced immunosuppression: A barrier to immunotherapy of large tumors by cytokine-secreting tumor vaccine. Hum. Gene Ther., 11:681-692, 2000.
14 V.A. Kuznetsov and I.A. Makalkin. Nonlinear dynamics of immunogenic tumors: Parameter estimation and global bifurcation analysis. Bullet. Mathem. Bio., 56:295-321, 1994.
15 R.J. DeBoer, P. Hogeweg, H.F.J Dullens, R.A. De Weger, and W. Den Otter. Macrophage T lymphocyte interactions in the anti-tumor immune response: A mathematical model. J. Immonol., 134:2748-2757, 1985.
16 J.C. Arciero, T.L. Jackson, dan D.E. Kirschner. A Mathematical model of Tumor-Immune evasion and siRNA treatment. Discrete and Continuous Dynamical Systems-Series B., 39-58, 2004.
17 Anonim. (2009). Obat kanker alami:
Tumor dan definisinya.
.
Lampiran 1 Diagram Alir Penelitian
Penelusuran Literatur
Analisis atas jurnal Modeling
Immunotherapy of the Tumor – Immune
Interaction oleh Denise Kirschner, J.C.
Arciero, dan T.L. Jackson
Proses pembuatan program berdasarkan
analisis jurnal
Memasukkan material-material
parameter berdasarkan program
Kesimpulan dan Saran
Analisis hasil pembuatan program
Lampiran 2 Program Matlab untuk memanggil Fungsi persamaan 1-4 dengan nilai awal c adalah 0,001 dan S adalah nol
%System of ordinary differential equaion that describe(non-dimensi)
%Effector cells,Tumor cells, IL-2 %Author: Arciero et al.(2004)
function dy=tum35(t,y) dy=zeros(3,1);
dy(1)=0.001*y(2)-0.003*y(1)+(y(1)*y(3)/(1+y(3)))*0.01245; dy(2)=0.018*y(2)*(1-y(2)/10000)-0.1*y(1)*y(2)/(1+y(2)); dy(3)=0.0025*y(1)*y(2)/(0.01+y(2))-y(3);
Lampiran 3 Program matlab untuk membuat grafik fungsi A sampai U
%Program Arciero et al.(2004),Figure 3
clc;clear all; to=[0,10000];
yo=[0.000001,0.000001,0.000001]; [t y]=ode45('tum35',to,yo); figure(1);
plot(t,y(:,2));