TELAAH EFEKTIVITAS
Streptomyces
spp. DALAM
MENGHAMBAT
Xanthomonas campestris
pv.
acaciae
PADA
TANAMAN AKASIA
GARMITA FEBRIANI WIDANINGSIH
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
GARMITA FEBRIANI WIDANINGSIH. Telaah Efektivitas Streptomyces spp. dalam Menghambat Xanthomonas campestris pv. acaciae pada Tanaman Akasia. Dibimbing oleh YULIN LESTARI dan ANJA MERYANDINI.
Streptomyces spp. merupakan salah satu bakteri antagonis yang dapat dimanfaatkan sebagai pengendali hayati mikrob patogen tanaman karena menghasilkan senyawa antimikrob. Penelitian ini bertujuan menapis kemampuan Streptomyces spp. isolat indigenus dalam menghambat
Xanthomonas campestris pv. acaciae secara in vitro dan in planta. Delapan isolat yang digunakan yaitu PS4-16, LSW05, LBR05, LBR02, SSW02, SR01, SR02, dan SR03. Hasil uji in vitro
menggunakan koloni langsung menunjukkan bahwa empat dari delapan isolat tersebut mempunyai daya hambat cukup baik. Isolat SR02 memiliki daya hambat terbesar yaitu 20 mm disusul oleh isolat LSW05, PS4-16, dan LBR02 yang memiliki zona hambat masing-masing sebesar 8 mm, 5 mm, dan 3,5 mm. Keempat isolat dilakukan uji lanjut menggunakan filtrat kultur. Hasilnya diperoleh dua isolat dengan zona penghambatan cukup baik yaitu isolat PS4-16 dan SR02 dengan diameter zona bening sebesar 12,5 cm dan 6,5 cm pada hari kelimabelas. Uji in planta kedua isolat tersebut pada tanaman akasia (Acacia crassicarpa) yang diinokulasi
Xanthomonas campestris pv. acaciae menunjukkan bahwa SR02 dan PS4-16 mampu menekan intensitas penyakit masing-maing sebesar 9,14 % dan 11,71 % dibanding kontrol yaitu sebesar 24,03 % dan bakterisida komersial sebesar 14 % pada 7 minggu setelah tanam. Perlakuan
Streptomyces spp. juga terbukti mampu meningkatkan tinggi, diameter batang, dan bobot kering tanaman dibandingkan dengan kontrol. Hal ini mengindikasikan bahwa isolat Streptomyces spp. SR02 dan PS4-16 berpotensi untuk dikembangkan sebagai agens pengendali hayati terhadap bakteri hawar daun pada akasia.
ABSTRACT
GARMITA FEBRIANI WIDANINGSIH. The Study of Streptomyces spp. Effectiveness in Inhibiting Xanthomonas campestris pv. acaciae on Acacia Plant. Under direction of YULIN LESTARI and ANJA MERYANDINI.
Streptomyces spp. is one of the bacterial antagonists that can be used as biological control of plant microbial pathogens, since they produce antimicrobial compounds. This study was aimed to screen the capability of indigenous isolates of Streptomyces spp. in inhibiting Xanthomonas. campestris pv. acaciae in vitro and in planta assays. Eight isolates used were PS4-16, LSW05, LBR05, LBR02, SSW02, SR01, SR02, and SR03. Four out of the eight tested isolates had various inhibitory capability. The colony of SR02 showed the greatest inhibitory activity which was 20 mm diameter of clear zone followed by LSW05, PS4-16, and LBR02 which have inhibitory zone of 8 mm, 5 mm, and 3.5 mm respectively. Based on their crude extract assay PS416 and SR02 produced inhibitory activity 12,5 cm and 6,5 cm. Furthermore those two isolates were applied on
Acacia crassicarpa which was inoculated with pathogenic bacteria Xantomonas campestris pv.
Acacia. The result showed SR02 and PS4-16 capable of suppressing disease intensity by 9.14% and 11.71% respectively compared to the control treatment 24.03% and bactericidal agent by 14% at 7 weeks old plant after planting. Application of Streptomyces spp. were also able to increase more plant height, shoot diameter and plant dry weight compared with controls. This indicates that Streptomyces spp. PS4-16 and SR02 have potency to be developed as biological control agents against bacterial blight on acacia leaves.
TELAAH EFEKTIVITAS
Streptomyces
spp. DALAM
MENGHAMBAT
Xanthomonas campestris
pv.
acaciae
PADA
TANAMAN AKASIA
GARMITA FEBRIANI WIDANINGSIH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Telaah Efektivitas
Streptomyces
spp. dalam Menghambat
Xanthomonas
campestris
pv. a
caciae
pada Tanaman Akasia.
Nama : Garmita Febriani Widaningsih
NRP : G34061546
Disetujui
Dr. Ir. Yulin Lestari
Dr. Anja Meryandini MS.
NIP 19620710 198803 2 002 NIP 19620327 198703 2 001
Diketahui
Ketua Departemen Biologi
Dr. Ir. Ence Darmo Jaya Supena, M.Si.
NIP 19641002 198903 1 002
Tanggal Lulus:
PRAKATA
Alhamdulillahirabbill’alamin segala puji dan syukur kehadirat Allah SWT atas segala
rahmat dan karunia-Nya, sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang berjudul
“Telaah Efektivitas Streptomyces spp. dalam Menghambat Xanthomonas campestris pv. acaciae
pada Tanaman Akasia” ini dilaksanakan sejak bulan Mei 2010 hingga April 2011 di Laboratorium Mikrobiologi Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam dan rumah kaca Departemen Silvikultur Fakultas Kehutanan Institut Pertanian Bogor. Penelitian ini bertujuan menapis kemampuan Streptomyces spp. isolat indigenus dalam menghambat Xanthomonas campestris pv. acaciae secara in vitro dan in planta.
Terima kasih penulis ucapkan kepada Ibu Dr. Ir. Yulin Lestari dan Dr. Anja Meryandini MS. atas bimbingan dan motivasi kepada penulis selama pelaksanaan penelitian ini. Penulis juga menyampaikan terimakasih kepada Ibu Heni dan Bapak Jaka selaku teknisi Laboratorium Mikrobiologi IPB, Pak Budi dari Balai Teknologi Perbenihan Bogor, Bu Ratih dan Pak Puji yang selalu memberi masukan dan nasihat pada penulis serta Pak Atang selaku penanggung jawab rumah kaca Silvikultur yang telah banyak membantu penulis selama penelitian berlangsung. Ungkapan terima kasih juga disampaikan kepada seluruh keluarga, papa, mama, kakak, dan adikku tercinta atas segala doa dan semangat yang diberikan. Terima kasih pula atas dukungan yang diberikan oleh sahabat-sahabatku (Sitkom, Sari, Tera, Upik, Evi, Anggi, Ismeri, Dedy, Izzan, Kamal, Deny, Ipul dan Vandra), teman di laboratorium Mikrobiologi, dan teman-teman di Biologi 43, teman-teman-teman-teman Liqo, serta teman-teman-teman-teman seperjuangan di BEM KM IPB GENERASI INSPIRASI yang tidak dapat penulis sebutkan satu persatu.
Semoga karya ilmiah ini dapat bermanfaat. Amin.
Bogor, Juni 2011
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 3 Februari 1988 dari Bapak Edi Garmadi dan Ibu Herawati Ningsih. Penulis merupakan putri kedua dari tiga bersaudara. Tahun 2006 penulis lulus dari SMA Islam As-Syafi’iyah Sukabumi dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih mayor Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, serta minor Gizi Masyarakat, Fakultas Ekologi Manusia.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum Perkembangan Hewan periode 2008/2009, praktikum Fisiologi Tumbuhan periode 2009/2010, praktikum Anatomi dan Morfologi Tumbuhan periode 2009/2010, praktikum Fisiologi Prokariot periode 2009/2010 dan Biologi Dasar TPB mulai dari periode 2008/2009 hingga periode 2010/2011. Penulis juga pernah memenangi berbagai lomba diantaranya ialah Juara I lomba musabaqah hifdzil
qur’an cabang MTQ tingkat IPB (2007), Penerima hibah DIKTI tingkat nasional untuk Program
Kreativitas Mahasiswa (PKM-Artikel Ilmiah tahun 2008, PKM-Penelitian tahun 2008 dan 2009 dan PKM-Pengabdian Masyarakat tahun 2009), serta menjadi finalis dari lomba karya tulis tingkat MIPA bidang pengabdian masyarakat (PIPA) di IPB tahun 2010.
Penulis juga aktif dalam kegiatan organisasi Badan Eksekutif Mahasiswa sejak periode 2007/2008 hingga 2009/2010, dengan jabatan tertinggi sebagai Sekretaris Menteri Budaya, Olahraga, dan Seni BEM KM IPB periode 2009/2010. Penulis juga pernah menjabat sebagai Ketua Gedung (Lurah) Asrama A2 TPB-IPB periode 2006/2007. Di samping itu, penulis juga pernah aktif dalam kegiatan organisasi LDK-DKM Al-Hurriyah IPB (tahun ajaran 2007/2008 dan 2008/2009), dan Rohis Biologi 43 (tahun ajaran 2007/2008 hingga 2009/2010). Penulis
berkesempatan menjalani Praktik Lapangan dengan judul “Potensi Mikrob Tanah dari berbagai
daerah di Indonesia sebagai Agen Biofertilizer” di Laboratorium Mikrobiologi Biologi, Lembaga
Ilmu Pengetahuan Indonesia (LIPI) Cibinong pada tahun 2009.
Beasiswa yang pernah penulis peroleh selama masa perkuliahan antara lain beasiswa Bantuan Belajar Mahasiswa (BBM) periode 2008/2009 dan beasiswa Yayasan Karya Salemba Empat (KSE) periode 2009/2010 hingga sekarang (lulus).
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... ... 1
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 1
Peremajaan Isolat ... 2
Penapisan Isolat Streptomyces spp. Penghambat Pertumbuhan Xanthomonas campestris pv. acaciae secara in vitro ... 2
Uji Kemampuan Penghambatan Streptomyces spp. terhadap Xanthomonas campestris pv. acaciae secara in planta ... 2
HASIL Peremajaan Isolat ... 3
Penapisan Isolat Streptomyces spp. Penghambat Pertumbuhan Xanthomonas campestris pv. acaciae secara in vitro ... 4
Uji kemampuan Penghambatan Streptomyces spp. terhadap Xanthomonas campestris pv. acaciae secara in planta ... 6
PEMBAHASAN... ... ... 8
SIMPULAN DAN SARAN Simpulan... 10
Saran... 10
DAFTAR PUSTAKA ... 10
DAFTAR TABEL
Halaman
1 Kemampuan penghambatan Streptomyces spp.terhadap Xanthomonas
campestris pv. acaciae menggunakan koloni langsung... 5
2 Kemampuan penghambatan Streptomyces spp.terhadap Xanthomonas
campestris pv. acaciae menggunakan filtrat kultur…..………..…... 5
3 Pengaruh perlakuan Streptomyces terhadap diameter batang
tanaman Akasia umur 7 MST…... 6
4 Pengaruh perlakuan Streptomyces terhadap bobot kering tanaman Akasia
umur 7 MST... 6
DAFTAR GAMBAR
Halaman
1 Morfologi koloni isolat Streptomyces spp. (LSW 05, SSW02, LBR02, LBR05, SR02, dan SR03) yang ditumbuhkan pada media agar-agar ISP2 dan (PS4-16
dan SR01) pada media Oatmeal agar umur 15 hari ...… 4
2 Kemampuan penghambatan Streptomyces spp. terhadap X. campestris pv. acaciae
pada media NA inkubasi 24-48 jam………...………... 4
3 Kemampuan penghambatan Streptomyces spp. terhadap X. campestris pv. acaciae
umur 15 hari pada media NA inkubasi 24-48 jam………... 4
4 Biomassa sel Streptomyces hari ke 5, 10,15, dan 20………. 5
5 Pengaruh perlakuan kombinasi Streptomyces, X. campestris, dan bakterisida
terhadap intensitas penyakit pada tanaman akasia umur 3-7 MST…... 7
6 Pengaruh perlakuan kombinasi Streptomyces, X. campestris, dan bakterisida
terhadap tinggi tanaman akasia umur 2-7 MST... ... 7
DAFTAR LAMPIRAN
Halaman
1 Komposisi media agar-agar YDC (Yeast Dextrose CaCO3)...… 14
2 Komposisi media agar-agar International Streptomyces Project No.2 (ISP2)... 14
3 Komposisi media agar-agar Oatmeal (OM)... 14
4 Komposisi media International Streptomyces Project (ISP) 4... 14
5 Biomassa sel Streptomyces spp. isolat terpilih... 14
6 Pengaruh perlakuan Streptomyces terhadap intensitas penyakit... 15
7 Pengaruh perlakuan Streptomyces terhadap tinggi tanaman... 15
PENDAHULUAN
Tanaman akasia termasuk kedalam suku leguminosae, memiliki lebih dari 1300 spesies dan terdistribusi di daerah tropik dan sub tropik. Kayu akasia banyak digunakan untuk perabot rumah tangga seperti pintu, bingkai jendela serta menjadi bahan baku utama dalam industri kertas. Beberapa jenis akasia yang paling banyak di tanam di wilayah asia adalah Acacia auriculiformis Cunn. Ex Benth., A.mangium Willd., A. crassicarpa
Cunn. Ex Benth., dan A. aulacocarpa Cunn. Ex Benth (Prosea 1995).
Hambatan rendahnya produksi kayu akasia di daerah tropis dapat disebabkan oleh penyakit karat daun, embun tepung, rebah semai, dan busuk akar (Old et al. 2000). Pada saat di persemaian, tanaman akasia terutama
A. crassicarpa juga dapat terserang penyakit hawar daun bakteri yang disebabkan
Xanthomonas campestris pv. acaciae.
Penyakit ini merupakan penyakit baru pada pembibitan tanaman A. crassicarpa khususnya ditemukan di pembibitan tanaman akasia di daerah Riau (Ernawati 2008).
A. crassicarpa merupakan tanaman tropis yang tumbuh cepat dengan kemampuan adaptasi yang tinggi dan merupakan tanaman pemfiksasi nitrogen. Di alam, akasia ini dapat hidup pada tanah yang memiliki drainase yang buruk sampai tanah kering (Gunn & Midgley 1991). A. crassicarpa memiliki tinggi antara 25-30 meter dengan biji berwarna hitam memanjang. Daun akasia memiliki dua jenis bentuk, ketika dalam masa juvenil daunnya akan membentuk daun majemuk bipinnate,
sedangkan pada masa dewasa akan muncul filodia (Bhattacharrya & Johri 1998).
Pengendalian penyakit tanaman saat ini lebih ditekankan pada pengendalian agen hayati yakni penggunaan organisme antagonis untuk menekan jumlah, aktivitas, dan penyebaran patogen. Namun penelitian mengenai upaya pengendalian A. crassicarpa
masih sangat sedikit dilaporkan. Salah satu anggota aktinomiset yang telah diteliti dan digunakan sebagai pengendali penyakit tanaman adalah Streptomyces (Prapagdee et.al
2008), yang dimanfaatkan berdasarkan kemampuannya dalam menghasilkan senyawa antimikrob.
Aktinomiset dikenal sebagai sumber utama beragam senyawa bioaktif diantaranya adalah senyawa antimikrob yang dapat digunakan sebagai agen biokontrol patogen tanaman
(Holtsmark et.al 2006; Alina & Susilowati 2008). Anggota terbesar Aktinomiset ialah genus Streptomyces. Streptomyces merupakan bakteri berfilamen dengan diameter 0.5-1.0 µm, aerob, gram positif, dan bereproduksi dengan spora yang dihasilkan miselium aerial (Holt et al 1994). Streptomyces memiliki siklus hidup yang kompleks dan mampu menghasilkan dan mensekresi metabolit sekunder, senyawa bioaktif seperti antibiotik, enzim, dan inhibitor enzim. Streptomyces
biasanya hidup di tanah dan merupakan dekomposer penting karena dapat menguraikan bahan organik serta tahan terhadap keadaan stres lingkungan seperti kekeringan dan kekurangan makanan dengan membentuk spora (Cao et al. 2004).
Penelitian yang telah dilakukan menunjukkan bahwa beberapa isolat indigenus Streptomyces spp. diketahui mampu menghasilkan senyawa antimikrob (Lestari 2006), seperti menghambat serangan bakteri patogen Ralstonia solanacearum pada cabai (Muthanas 2004) dan X. axonopodis pada kedelai (Andri 2004). Yuan & Crawford (1995) juga melaporkan kemampuan
Streptomyces dalam menghambat cendawan patogen tanaman yakni Phytium ultimum dan Rhizoctonia solani. Streptomyces isolat indigenus juga dilaporkan mampu menghambat serangan S. Rolfsii pada tomat (Yusniawati 2009; Sasono 2010). Namun demikian kajian tentang kemampuan
Streptomyces spp. dalam mengendalikan X. campestris pv. acaciae patogen tanaman akasia belum banyak dilakukan. Berdasarkan kemampuan Streptomyces spp. isolat indigenus tersebut dalam menghasilkan senyawa antimikrob, maka kajian potensi
Streptomyces spp. isolat indigenus terhadap
Xanthomonas campestris pv. acaciae yang menyerang tanaman akasia penting untuk dilakukan. Tujuan penelitian ini adalah menapis kemampuan Streptomyces spp. isolat indigenus dalam menghambat
Xanthomonas campestris pv. acaciae secara
in vitro dan in planta.
BAHAN DAN METODE
Waktu dan Tempat
Peremajaan Isolat Bakteri
Bakteri X. campestris pv. acaciae sebagai patogen target berasal dari koleksi Dr. Ir. Giyanto, M.Si. diremajakan pada media agar-agar Yeast Dextrose CaCO3(YDC) (Lampiran
1) dan diinkubasi pada suhu 27-28o C selama dua hari. Pengukuran kerapatan bakteri dihitung dengan menggunakan metode cawan sebar dan dengan bantuan alat spektrofotometri pada panjang gelombang 620 nm. Streptomyces spp. isolat indigenus yang digunakan yaitu PS4-16, LSW 05, LBR 05, LBR 02, SSW 02, SR01, SR02, dan SR03 merupakan koleksi Laboratorium Mikrobiologi IPB. Isolat-isolat tersebut diremajakan pada media agar-agar
International Streptomyces Project (ISP) no 2 (Lampiran 2) dan media Oatmeal (OM) (Lampiran 3). Inkubasi dilakukan pada suhu ruang selama 10-15 hari.
Produksi Filtrat dan Biomassa
Streptomyces spp.
Produksi filtrat kultur dilakukan dengan menggunakan media ISP No. 4 (Lampiran 4) yang diinkubasi diatas mesin penggoyang dengan kecepatan 125 rpm pada suhu ruang. Selanjutnya kultur disentrifugasi pada kecepatan 8000 rpm selama 10 menit. fltrat kultur yang diperoleh digunakan untuk esei antagonis pada hari ke 5,10,15, dan 20.
Pengukuran biomassa Streptomyces spp. yang ditumbuhkan pada media ISP 4 dilakukan pada hari ke 5, 10, 15 dan 20. Biakan yang telah disentrifugasi, kemudian disaring dengan menggunakan kertas saring untuk memisahkan pelet dan supernatannya. Pelet dikeringkan didalam oven selama 24 jam pada temperatur 70oC dan ditimbang bobotnya.
Penapisan Isolat Streptomyces spp. Penghambat Pertumbuhan X. campestris
pv. acaciae secara in vitro.
Penapisan isolat penghasil senyawa antibakteri dilakukan secara kualitatif dengan uji antagonis menggunakan metode dual culture. Pertama-tama dilakukan uji menggunakan sel Streptomyvces spp. secara langsung. Isolat Streptomyces spp. yang ditumbuhkan pada media agar-agar ISP No.2 diambil dengan sedotan steril berdiameter 5 mm lalu diletakkan pada media uji Nutrient Agar (NA) semisolid yang telah memadat diatas media NA solid (Over lay) dan sudah mengandung isolat bakteri X. campestris pv. acaciae dengan konsentrasi minimal 106/ml, kemudian diinkubasi selama 24-48 jam pada
suhu ruang dan diamati zona hambat yang terbentuk. Isolat dengan zona hambat sangat jernih dan memiliki kemampuan penghambatan kuat terhadap bakteri patogen target dipilih untuk diuji lebih lanjut aktivitas penghambatan filtrat kulturnya yang mengacu pada metode Kirby Bauer (Madigan et al.
2006). Isolat Streptomyces spp. diinokulasikan kedalam media ISP4 cair. Cakram kertas steril berdiameter 8 mm ditetesi 15 µl filtrat kultur
Streptomyces spp, kemudian diletakkan pada permukaan media NA semisolid yang telah memadat diatas media NA solid dan sudah mengandung bakteri patogen target dengan konsentrasi minimal 106/ml, diinkubasi pada suhu ruang, dan diamati zona hambat yang terbentuk setelah 24-48 jam. Kontrol negatif menggunakan media ISP 4 steril. Besar diameter zona hambat diukur berdasarkan diameter seluruh zona yang terbentuk dikurangi diameter cakram kertas (8 mm). Penilaian daya penghambatan mengacu pada Suriawiria (1973). Kedua uji antagonis diatas dilakukan sebanyak dua kali pengulangan.
Uji Kemampuan Penghambatan
Streptomyces spp. terhadap X. campestris
pv. acaciae secara in planta.
Biji akasia (Acacia crassicarpa) diperoleh dari Balai Penelitian Teknologi Perbenihan, Bogor. Biji tersebut kemudian disterilisasi permukaan menggunakan alkohol 70% selama 30 detik kemudian dibilas dengan air steril sebanyak dua kali. Selanjutnya dilakukan pemecahan masa dormansi biji dengan cara merendam benih akasia pada air mendidih selama 30 detik, kemudian ditiriskan lalu direndam dalam air dingin selama 24 jam. Setelah itu biji diberi perlakuan Streptomyces spp. dengan cara
seed coating. Kultur isolat Streptomyces spp disentrifugasi dengan kecepatan 4000 rpm selama 20 menit. Dua gram massa sel
tujuh minggu setelah tanam dengan mengukur parameter berupa tinggi tanaman, diameter tanaman, intensitas penyakit, dan bobot kering tanaman.
Rancangan Percobaan
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan dua faktor, dan diulang sebanyak 5 kali
a. Faktor pertama yaitu pemberian agens yang terdiri atas 3 macam aplikasi
A0: tanpa agens A1: agens SR02 A2: agens PS4-16
A3: bakterisida (Agrept WP 20)
b. Faktor kedua yaitu pemberian bakteri patogen X. campestris pv. acaciae yang terdiri atas 2 macam aplikasi
B0: tanpa bakteri patogen B1: dengan bakteri patogen
Parameter yang diamati Tinggi Tanaman
Tinggi tanaman diukur setiap satu minggu setelah tanam, diukur 1 cm dari leher akar sampai titik tumbuh tertinggi semai pada pucuk batang.
Diameter Batang dan Bobot Kering Tanaman
Diameter batang diukur pada minggu terakhir (tujuh minggu) setelah tanam, menggunakan alat ukur yaitu jangka sorong (caliper). Bobot kering tanaman juga dilakukan pada 7 MST dengan cara menghitung bobot tanaman yang sebelumnya disimpan dalam oven selama 72 jam pada suhu 70 oC.
Intensitas Penyakit
Pengamatan benih A. crassicarpa
dilakukan terhadap intensitas penyakit. Data intensitas penyakit tersebut kemudian dihitung dengan menggunakan rumus Ernawati (2008):
IP =
IP= Intensitas Penyakit
n = Banyaknya daun yang diamati dari tiap kategori serangan v = Nilai skala dari tiap kategori serangan
Z = Nilai skala dari tiap kategori serangan tertinggi
N = Banyak daun yang diamati
Intensitas serangan atau keparahan penyakit ditetapkan melalui skoring sebagai berikut:
0 = tidak ada gejala
1 = 1 - 25% permukaan daun terinfeksi 2 = 26 - 50% permukaan daun terinfeksi 3 = 51 - 75% permukaan daun terinfeksi 4 = 76 - 100% permukaan daun terinfeksi
Analisis data
Untuk menguji pengaruh perlakuan terhadap respon yang diamati pada uji in planta dilakukan analisis sidik ragam dengan menggunakan program SPSS 16. Beda nyata antara perlakuan diuji dengan metode Duncan pada taraf nyata 5%.
HASIL
Peremajaan Streptomyces spp.
Hasil peremajaan delapan isolat
Streptomyces spp. pada media agar-agar ISP2 dan Oatmeal Agar selama 10-14 hari masa inkubasi pada suhu ruangan menunjukkan semua isolat dapat tumbuh baik ditandai dengan adanya sporulasi dan pembentukan miselium aerial. Kedelapan isolat tersebut yaitu PS4-16, LSW 05, LBR 05, LBR 02, SSW 02, SR01, SR02, dan SR03 yang merupakan anggota aktinomiset. Gambar 1 memperlihatkan beberapa contoh hasil peremajaan isolat Streptomyces spp. yang memiliki keragaman morfologi koloni dan warna miselia. Isolat LSW05 dan SR01 memiliki miselia berwarna putih, LBR02, LBR05, SSW02, dan SR03 menunjukkan miselia berwarna coklat keabuan, PS4-16 menunjukkan miselia bewarna putih kemerahan, sedangkan isolat SR02 menunjukkan miselia berwarna hitam.
Pembentukan miselia aerial dan sporulasi merupakan salah satu tahap yang penting dalam siklus hidup Streptomyces (Abe et al.
Koloni Streptomyces juga memberikan bau yang spesifik karena adanya geosmin.
Gambar 1 Morfologi koloni isolat
Streptomyces spp. (LSW 05, SSW02, LBR02, LBR0 5, SR02, dan SR03) yang ditumbuhkan pada media agar-agar ISP2 dan (PS4-16 dan SR01) pada media Oatmeal agar umur 15 hari.
Penapisan Isolat Streptomyces spp. Penghambat Pertumbuhan X. campestris
pv. acaciae secara in vitro.
Kedelapan isolat menghasilkan daya hambat yang berbeda-beda pada uji dengan menggunakan sel secara langsung. Isolat
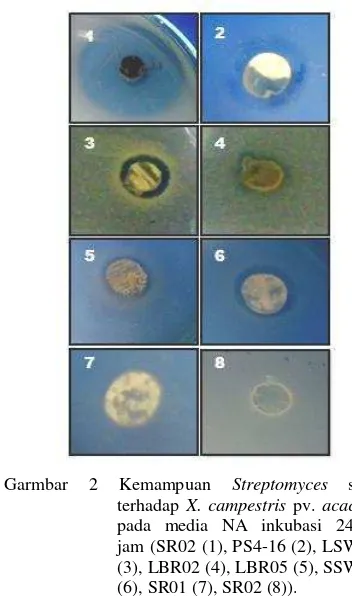
Streptomyces dengan kode isolat SR02 memiliki daya hambat terbesar yaitu sebesar 20 mm dengan daya penghambatan sangat kuat disusul oleh isolat LSW05 yang memiliki zona hambat sebesar 8 mm dengan daya penghambatan sedang. Terdapat 2 jenis isolat yaitu SR01 dan SR03 yang tidak menghasilkan zona hambat sama sekali (Tabel 1). Kemampuan masing-masing isolat dalam menghambat bakteri patogen dapat dilihat pada Gambar 2. Daya penghambatan merujuk pada Suriawiria (1973).
Empat isolat yang mampu menghasilkan zona hambat kuat dipilih yaitu PS4-16, LSW05, LBR02, dan SR02 untuk uji penghambatan menggunakan filtrat kultur.
Garmbar 2 Kemampuan Streptomyces spp. terhadap X. campestris pv. acaciae
pada media NA inkubasi 24-48 jam(SR02 (1), PS4-16 (2), LSW05 (3), LBR02 (4), LBR05 (5), SSW02 (6), SR01 (7), SR02 (8)).
Isolat PS4-16 menunjukkan daya hambat cukup baik pada hari kelima sebesar 8,5 mm dan mengalami peningkatan pada hari kesepuluh sebesar 11 mm, pada hari kelimabelas sebesar 12,5 mm, dan pada hari keduapuluh menurun menjadi sebesar 10 mm. Isolat SR02 menghasilkan zona hambat pada hari kesepuluh, kelimabelas dan keduapuluh masing-masing sebesar 3,5 mm, 6,5 mm, dan 7 mm. Isolat LSW05 hanya menghasilkan zona hambat pada hari kelimabelas yaitu sebesar 4,5 mm. Isolat yang tidak menghasilkan zona hambat sama sekali ditunjukkan oleh LBR02 (Tabe1 2 dan Gambar 3).
Gambar 3 Kemampuan penghambatan
Tabel 1. Kemampuan Penghambatan Streptomyces spp.terhadap Xanthomonas campestris pv. acaciae
menggunakan koloni langsung.
Tabel 2. Kemampuan penghambatan Streptomyces spp. terhadap pertumbuhan Xanthomonas campestris pv. acaciae menggunakan filtrat kultur.
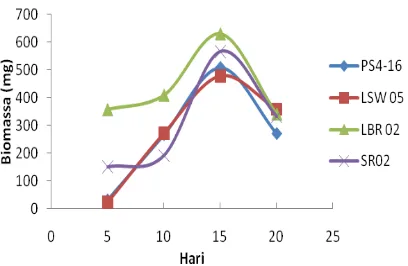
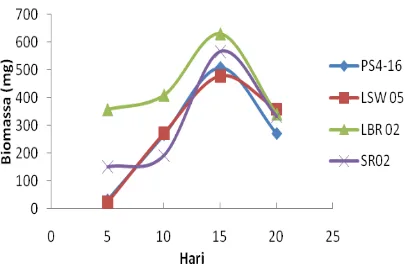
Biomassa sel Streptomyces spp. pada hari ke 5,10,15, dan 20 (Gambar 4) menunjukkan bahwa semua isolat memiliki jumlah biomassa sel tertinggi pada hari ke-15 dan kemudian turun pada hari ke-20. Rata-rata biomassa terbanyak dimiliki oleh isolat LBR02 yaitu sebesar 630 mg (Lampiran 5). Namun demikian banyaknya biomassa tidak selalu diikuti peningkatan kemampuan penghambatan terhadap bakteri patogen akan besar, hal ini dapat dilihat meskipun LBR 02 memiliki jumlah biomassa yang banyak tapi tidak menghasilkan zona hambat pada uji aktivitas filtrat kultur sebab biomassa sel tidak terlibat langsung dalam uji aktivitas kultur.
Gambar 4 Pertumbuhan Streptomyces pada hari ke 5, 10,15, dan 20.
No. Kode Isolat
Daya Hambat ( Zona bening) (mm)
R1 R2 Rata2
(mm) Daya (mm) Daya (mm)
1 LBR 02 3 ++ 4 ++ 3,5
2 PS4-16 6 + 4 + 5
3 LBR 05 2 + 3 ++ 2,5
4 SR01 - - - - -
5 SR02 22 ++++ 18 ++++ 20
6 SR03 - - - - -
7 LSW 05 7 +++ 9 +++ 8
8 SSW 02 3 ++ 3 ++ 3
No Kode Isolat
Daya Hambat (zona bening) (mm)
Hari ke-
5 10 15 20
(mm) Daya (mm) Daya (mm) Daya (mm) Daya
1 PS4-16 8,5 +++ 11 +++ 12,5 ++++ 10 ++
2 LSW 05 - - - - 4,5 + - -
3 LBR 02 - - - -
4 SR02 - - 3,5 ++ 6,5 + 7 ++
tanda minus (-) menunjukkan tidak mampu menghasilkan zona hambat
Kemampuan Penghambatan Streptomyces
spp. terhadap Xanthomonas campestris pv. acaciae secara in planta.
Intensitas Penyakit
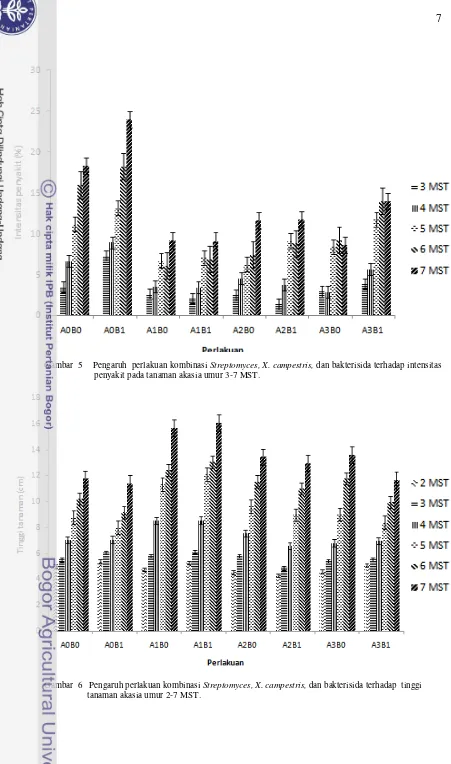
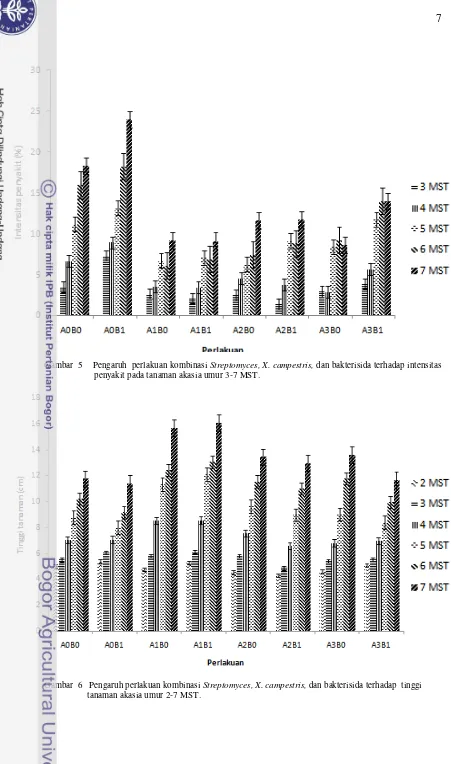
Gejala awal penyakit mulai tampak pada tanaman 3 MST (minggu setelah tanam). Intensitas penyakit (IP) pada masing-masing perlakuan disetiap waktu pengamatan terus mengalami peningkatan hingga 7 MST dengan laju peningkatan yang bervariasi. Namun perlakuan Streptomyces spp.mampu menurunkan intensitas penyakit pada tanaman dibandingkan perlakuan lainnya walaupun tidak signifikan (Gambar 5). Berdasarkan uji statistik terdapat perbedaan antar perlakuan. Intensitas penyakit tertinggi terjadi pada perlakuan A0B1, sedang terendah pada perlakuan A1B1. Perlakuan yang hanya diberi patogen (A0B1) (Kontrol positif) memiliki intensitas penyakit terbesar yaitu sebesar 24,03% pada 7 MST. Hal ini berbeda dengan perlakuan A1B1 dan A2B1 yang memiliki intensitas penyakit masing-masing sebesar 9,14% dan 11,71% lebih kecil dari perlakuan kontrol (Lampiran 6).
Tinggi Tanaman
Tinggi tanaman mulai diukur pada 2 MST. Perlakuan agens antagonis Streptomyces menunjukkan kemampuan dalam meningkatkan tinggi tanaman akasia pada semua periode pengamatan. Tanaman akasia yang diberi perlakuan Streptomyces dan bakterisida lebih tinggi bila dibandingkan tanaman kontrol walaupun tidak secara nyata (Gambar 6). Isolat SR02 mampu meningkatkan tinggi tanaman lebih baik sebesar 25% pada perlakuan A1B0 dan 29,1% pada perlakuan A1B1 dibandingkan kontrol yaitu pada 7 MST. Begitupula dengan perlakuan menggunakan isolat PS4-16 menunjukkan peningkatan tinggi tanaman lebih baik dibandingkan kontrol walaupun kurang signifikan ( Lampiran 7).
Diameter batang
Diameter batang diukur setelah panen yaitu 7 MST. Hasil pengamatan pengaruh agens antagonis Streptomyces terhadap diameter batang tanaman akasia menunjukkan perlakuan A2B1 menghasilkan diameter batang lebih besar dibandingkan perlakuan lainnya yaitu sebesar 12,6 mm. Diameter batang terkecil diperoleh perlakuan A0B1 yaitu sebesar 7,59 mm (Tabel 3).
Tabel 3 Pengaruh perlakuan Streptomyces terhadap diameter batang akasia umur 7 MST.
Keterangan : Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%
Bobot Kering Tanaman
Bobot kering tanaman juga diukur setelah panen yaitu saat tanaman berumur 7 MST. Perlakuan Streptomyces spp. mampu meningkatkan bobot kering tanaman dibandingkan kontrol (Tabel 4). Bobot kering tertinggi diperoleh dengan perlakuan A1B0 sebesar 194,36 mg. Perlakuan ini meningkatkan bobot kering tanaman mencapai 42,4 % bila dibandingkan dengan kontrol positif (117,96 mg). Peningkatan bobot kering tanaman yang diberi perlakuan
Streptomyces berbanding terbalik dengan intensitas penyakit. Tanaman kontrol dengan tingkat intensitas penyakit paling tinggi menghasilkan bobot kering paling rendah.
Tabel 4 Pengaruh perlakuan Streptomyces terhadap Bobot kering tanaman akasia umur 7 MST.
Perlakuan Bobot Kering Tanaman (mg) A0B0 111,96±19,3a A0B1 117,44±30,1a A1B0 194,36±51,5b A1B1 186,1±37,6b A2B0 164,1±16,5b A2B1 181,22±67,8b A3B0 164,82±12,1b A3B1 111,8±17,5a Keterangan : Angka yang diikuti oleh huruf yang
sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%.
Gambar 5 Pengaruh perlakuan kombinasi Streptomyces, X. campestris, dan bakterisida terhadap intensitas penyakit pada tanaman akasia umur 3-7 MST.
PEMBAHASAN
Pengujian antagonis isolat Streptomyces
spp. terhadap bakteri patogen target dengan menggunakan sel secara langsung merupakan penapisan awal untuk mendapatkan isolat yang memiliki kemampuan dalam menghambat pertumbuhan Xanthomonas campestris pv. acaciae. Hasil uji antagonis kedelapan isolat Streptomyces spp. menunjukkan sebanyak enam isolat mampu menghambat bakteri patogen. Hal ini ditunjukkan dengan terbentuknya zona bening di sekitar koloni Streptomyces spp. Namun demikian, enam isolat Streptomyces yang diujikan memiliki daya hambat yang beragam (Tabel 1). Isolat LSW05 dan SR02 memiliki daya hambat kuat yang ditunjukkan dengan zona hambat sebesar 7-22 mm, sedangkan empat isolat lainnya yaitu PS4-16, LBR02, LBR05, dan SSW02 memiliki zona hambat berkisar 2-6 mm. Adanya zona bening mengindikasikan bahwa isolat tersebut mampu menghasilkan senyawa yang berfungsi sebagai antimikrob. Senyawa yang dihasilkan diduga merupakan mekanisme pertahanan Streptomyces dalam berkompetisi dengan mikroorganisme lain untuk memperoleh nutrisi (Atlas & Bartha 1997).
Terjadinya perbedaan penghambatan pertumbuhan bakteri patogen dengan menggunakan sel Streptomyces spp. secara langsung dibandingkan dengan filtrat kultur kemungkinan disebabkan antara lain oleh jenis dan jumlah senyawa antimikrob yang dihasilkan, konsentrasi dan kualitas dari senyawa mikrob yang dihasilkan (Mc-Manus & Stocwell 2001). Dibandingkan dengan menggunakan koloni isolat Streptomyces, aktivitas filtrat kultur rata-rata mempunyai kemampuan penghambatan lebih kecil. Hal ini mungkin disebabkan pada uji aktivitas filtrat kultur hanya 15 µl supernatan yang digunakan dalam pengujian sehingga konsentrasi senyawa antibakteri yang terkandung dalam filtrat kemungkinan cukup rendah. Disamping itu kandungan beragam komponen media juga dapat berpengaruh terhadap aktivitas penghambatan. Tingkat penghambatan terhadap bakteri target semakin bertambah dengan semakin tingginya konsentrasi zat bioaktif di dalam filtrat (Syefianah 2000). Hwang et al. (2001) juga melaporkan bahwa semakin tinggi konsentrasi filtrat semakin tinggi daya hambat yang dihasilkan. Penurunan aktivitas penghambatan yang terjadi pada uji filtrat kultur juga dapat
disebabkan oleh adanya perbedaan masing-masing sel dalam merespon kondisi lingkungan (media produksi), sehingga biomassa dan senyawa aktif yang dihasilkan dapat berbeda tergantung pada kemampuan masing-masing sel. Keempat isolat
Streptomyces spp. menghasilkan 100-600 mg massa sel/25 ml media produksi (ISP4). Schlegel dan Schmidt (1994) mengemukakan bahwa biomassa bakteri ditentukan oleh jenis, jumlah nutrien, dan kondisi pertumbuhan yang digunakan oleh bakteri tersebut. Jenis dan jumlah nutrisi yang cukup akan digunakan oleh sel bakteri untuk pertambahan biomassa, sedangkan pada kondisi pertumbuhan dengan jumlah nutrisi terbatas pertumbuhan sel menjadi lambat dan akan menstimulir sel untuk memproduksi metabolit sekunder.
Streptomyces spp. yang diaplikasikan ke tanaman akasia secara tidak nyata mampu menekan tingkat keparahan penyakit serta meningkatkan tinggi tanaman, diameter batang, dan bobot kering tanaman. Dari hasil yang telah dilakukan isolat SR02 dan PS4-16 mempunyai aktivitas antibakteri yang mampu menekan mikrob patogen secara in planta
melalui mekanisme penghambatan yang kemungkinan berbeda. Senyawa bioaktif yang dihasilkan isolat SR02 diduga lebih efektif dibandingkan isolat PS4-16 sehingga kemampuannya lebih tinggi dalam menekan intensitas penyakit. Setiap mikrob antagonis memiliki mekanisme tersendiri dan dapat mempunyai lebih dari satu mekanisme penghambatan. Streptomyces liydicus WYEC 108 misalnya, dapat menghambat pertumbuhan fungi tular tanah karena memiliki beberapa mekanisme, yaitu mampu mengkolonisasi akar lebih baik daripada patogen, bersifat antibiosis, mempunyai aktivitas mikroparasitisme, dan menghasilkan selulase (Lichatowich 2006).
Streptomyces spp. isolat SR02 dan PS4-16 terbukti mampu menghambat pertumbuhan mikrob patogen. Secara in vitro kemampuan terbaik ditunjukkan oleh isolat SR02 begitupun pada uji in planta isolat SR02 memiliki kemampuan lebih baik dibandingkan isolat PS4-16. Perbedaan kemampuan isolat
Streptomyces diduga disebabkan oleh keragaman senyawa bioaktif yang dihasilkan.
dihasilkan isolat SR02 diduga lebih efektif dibandingkan isolat PS4-16 sehingga kemampuannya lebih tinggi dalam menekan intensitas penyakit dan meningkatkan tinggi tanaman.
Aplikasi isolat SR02 dan PS4-16 juga diduga lebih baik dalam menakan intensitas penyakit serta meningkatkan tinggi, diameter dan bobot kering tanaman bila dibandingkan dengan penggunaan bakterisida yaitu Agrept WP 20. Agrept WP 20 adalah salah satu jenis bakterisida yang mengandung bakteri yang mampu mengendalikan bakteri patogen pada tanaman. Streptomisin yang terkandung dalam Agrept WP 20 berpengaruh terhadap perkembangan bakteri karena akan berikatan dengan ribosom bakteri dan mencegah sintesis protein, pembentukan rantai peptida dan pengenalan triplet-triplet yang normal (Semangun 2006). Kandungan Streptomisin
yang terdapat pada Agrept WP 20 seharusnya dapat mengatasi penyakit pada tanaman akasia. Namun pada penelitian ini pemberian bakterisida kurang memberikan hasil yang baik. Hal ini mungkin dikarenakan dosis yang diberikan hanya sedikit yaitu hanya seperempat dosis yang dianjurkan sehingga hasil yang didapatkan kurang maksimal.
Cara aplikasi agen hayati pengendali patogen dapat mempengaruhi keefektifannya. Banyak aplikasi yang bisa digunakan diantaranya penyiraman, penyemprotan, dan
seed coating. Metode seed coating adalah metode pelapisan benih yang dilakukan sebelum perkecambahan biji. Dengan cara aplikasi agens hayati melalui benih diharapkan dapat melindungi benih selama perkecambahan sampai pertumbuhannya melalui kolonisasi akar. Beberapa hasil penelitian melaporkan bahwa metode pelapisan benih merupakan salah satu cara aplikasi yang terbaik. El-abyad et al. (1993) menyatakan bahwa pelapisan benih tomat dengan spora Streptomyces spp. sangat efektif mengendalikan patogen pada tanaman berumur 42 dan 63 hari setelah tanam. Yuan & Crawford (1995) menyatakan bahwa perlakuan benih dengan S. liydicus WYEC108 dapat menekan intensitas serangan patogen hingga 40-70% pada 96 jam setelah tanam, sedangkan intensitas serangan patogen mencapai 70-100% pada 24-48 jam setelah tanam pada benih yang tidak diberi perlakuan. Sasono (2010) dalam penelitiannya juga menyimpulkan bahwa perlakuan seed coating
dengan Streptomyces spp. isolat LSW05 merupakan perlakuan terbaik dalam
meningkatkan tinggi tanaman, bobot dan jumlah buah pada tanaman tomat.
Berdasarkan hasil uji antagonis terhadap tingg tanaman akasia menunjukkan bahwa mikrob antagonis dapat meningkatkan tinggi tanaman akasia. Hal ini dikarenakan agens antagonis kemungkinan mampu menghasilkan hormon pertumbuhan sehingga tanaman menjadi lebih tinggi dibanding kontrol. Mekanisme peningkatan pertumbuhan oleh bakteri bisa terjadi dengan beberapa cara diantaranya merangsang pembentukan akar lateral (Vasudevan et al. 2002) dan menghasilkan hormon pertumbuhan seperti IAA (Indole Acetic Acid) (Vonderwell et al. 2001), auksin (Khalid et al. 2004) dan sitokinin. Kemampuan mikrob dalam menghasilkan hormon pertumbuhan tersebut dipengaruhi oleh jenis isolat serta kemampuannya dalam mengkonversi L-triptofan yang terkandung dalam media produksi menjadi IAA (Patten & Glick 2002). L-triptofan merupakan senyawa asam amino yang berperan sebagai prekursor dalam pembentukan IAA. Ketersedian prekursor yang cocok adalah salah satu faktor primer sekresi metabolit sekunder dari mikrob (Manulis et al. 1994). Hormon pertumbuhan yang dihasilkan oleh bakteri dapat dimanfaatkan oleh tanaman untuk meningkatkan pertumbuhan tanaman. Bakteri penghasil IAA yang diisolasi dari rizosfer tanaman Brassica dapat meningkatkan tinggi tanaman hingga mencapai 56,5%, diameter batang 1,0%, jumlah cabang 35,7% dibanding dengan kontrol yang tidak diinokulasi rizobakteria (Asghar et al. 2002).
Beberapa penelitian terkait kemampuan
Streptomyces dalam menghasilkan hormon pertumbuhan juga telah banyak dilaporkan. Yusniawati (2009) dalam penelitiannya mengemukakan bahwa Streptomyces
merupakan agen hayati yang tergolong mikrooorganisme pemacu pertumbuhan tumbuhan. Lebih lanjut Agrios (1995) menyatakan bahwa kemampuan Streptomyces
selain sebagai agen hayati juga dapat menghasilkan hormon pertumbuhan atau disebut Plant Growth Promoting Bacteria
Salah satu isolat yang digunakan pada penelitian ini telah terbukti mampu menghasilkan hormon pertumbuhan IAA. Yusepi (2011) menyatakan bahwa uji aktivitas aktinomiset endofit terhadap tanaman padi terbukti dapat menghasilkan Asam Indol Asetat (IAA). Hasil penelitian tersebut menunjukkan bahwa aktinomiset isolat indigenus PS4-16 menghasilkan IAA dengan konsentrasi 82 ppm serta mampu meningkatkan pertumbuhan dan tinggi pada tanaman padi.
Berdasarkan hasil pengukuran diameter batang dan bobot kering tanaman terlihat agens antagonis memberikan pengaruh nyata terhadap diameter batang dan bobot kering tanaman A. crassicarpa pada 7 MST. Perlakuan Streptomyces spp. menunjukkan hasil lebih baik dibandingkan kontrol. Terdapat kecenderungan bahwa tanaman yang diinfeksi oleh bakteri patogen memiliki bobot kering dan tinggi tanaman lebih besar dibandingkan tanaman yang tidak diinfeksi oleh bakteri patogen. Hal ini kemungkinan terjadi akibat dihasilkannya senyawa hormon pertumbuhan oleh masing-masing mikrob antagonis yang memacu tanaman untuk tumbuh lebih besar sehingga bobot kering tanamanpun lebih besar. Selain itu kemungkinan terdapat mekanisme kompetisi dan antibiosis yang membuat Streptomyces
bekerja lebih keras pada tanaman yang diinfeksi oleh patogen. Romeiro et al. 1997 menyatakan kemampuan Streptomyces dalam menghambat patogen tanaman dikarenakan adanya mekanisme antibiosis dan peningkatan ketahanan sistemik tanaman melawan patogen tanaman. Djatmiko et al. (2007) juga melaporkan Streptomyces spp. (S4) mampu menekan R. solanacearum dengan cara antibiosis dan mekanisme penghambatan secara bakteriostatik. Berdasarkan data yang diperoleh dalam penelitian ini jelas menunjukkan bahwa isolat Streptomyces spp. isolat indigenus efektif dalam menghambat pertumbuhan mikrob patogen Xanthomonas campestris pv. acaciae.
SIMPULAN DAN SARAN
Simpulan
Sebanyak delapan isolat Streptomyces
spp. memiliki aktivitas penghambatan yang beragam secara in vitro. Empat isolat (LBR02, LSW05, SR02, dan PS4-16) memiliki aktivitas penghambatan yang baik terhadap
mikrob antagonis X. campestris pv. acaciae.
Berdasarkan hasil uji in planta, Streptomyces
yang diaplikasikan mampu menekan intensitas penyakit dan meningkatkan tinggi, diameter dan bobot kering tanaman. Isolat SR02 memiliki kemampuan terbaik dalam menghambat mikrob patogen baik secara in vitro maupun in planta.
Saran
Perlu telaah karakterisasi senyawa bioaktif yang dihasilkan oleh Streptomyces isolat SR02 dan PS4-16 serta uji kemampuannya dalam mengahsilkan hormon pertumbuhan. Selain itu perlu dikaji cara pemberian inokulum seperti penyiraman dan penyemprotan untuk mengetahui metode yang lebih efektif dalam mengendalikan
Xanthomonas campestris pv. acaciae serta pemberian dosis bakterisida yang tepat di pembibitan Acacia crassicarpa.
DAFTAR PUSTAKA
Abe H, Natsume M, Kawaide H. 2005. Regulating subtences in plants and microorganism. J Biochem 25: 190-195.
Agrios BN. 1995. Ilmu Penyakit Tumbuhan. Ed ke-3. Munzir B, penerjemah: UGM Press. Terjemahan dari: Plant Pathology.
Alina dan Susilowati. 2008. Aktivitas Penghambatan Bakteriosin dari Aktinomiset terhadap Bakteri Patogen tanaman Pangan. J Lit Pertan 27: 125-128.
Andri. 2004. Kajian Potensi Streptomyces spp. PS1-4 sebagai Penghasil Senyawa Bioaktif Pengendali Patogen Tanaman Kedelai [Skripsi]. Bogor Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
Aryantha INP, Lestari DP, Pangesti NPD. 2004. Potensi isolat bakteri penghasil IAA dalam peningkatan pertumbuhan kecambah kacang hijau pada kondisi hidroponik. J Mikrobiol Indones 9 43-46.
Atlas RM. 1997. Di dalam: Parks LC, editor.
Handbookof Microbiological Media.
Ed ke-2. New York: CRC Press INC. Bhattacharrya B dan Johri BM. 1998.
Flowering Taxonomy and Phylogeny.
New Delhi: Narosa Publishing House. Cao L, Qiu Z, You J, Tan J, Zhou S. 2004. Isolation and characterization of endophytic
Streptomyces strains from surface-tomato (Lycopersicon esculentum) roots. J Microbiol 39: 425-430. Dobbelaere S, Vanderleyden J and Okon Y.
2003. Plant growth-promoting effects of diazotrophs in the rhizosphere.
Crit RevPlant Sci 22: 107-249.
Djatmiko HA, Arwiyanto T, Hadisutrisno B, Sunaminto BH. 2007. Potensi tiga genus bakteri dari tiga rizosfer tanaman sebagai agensia pengendali hayati penyakit lincat. J Lit Pertan. 9: 40-47.
El-Abyad MS, El-Sayed MA, El-Shanshoury AR, El-Sabbagh MS. 1993. Towards the biological control of fungal and bacterial diseases of tomato using antagonistic Streptomyces spp. J Plant Soil 149: 185-195.
Ernawati. 2008. Karakterisasi Fenotipik dan Molekular Bakteri serta Penyakit Hawar Daun pada Bibit Acacia crassicarpa. [Disertasi]. Bogor: Program Pascasarjana Institut Pertanian Bogor.
Gunn BV dan Midgley SJ. 1991. Genetic resources and tree improvement. Proceedings of an international workshop Bangkok, Thailand, 11-15 Februari 1991.
Holt JG et. al.1994. Bergeys manual of Determinative Bacteriology. Ed. 9. Philadelphia: Walt Company
Holtsmark LD, V.G.H Eitsjnsk and M.B. Brurberg. 2006. Purifivation, Characterzation and Gene Secuence of Michigan by The Tomato Patogen
Appl Environ Microbiol 72: 5814-5821.
Hwang BK, Lee JY, Kim BS, Lim SW, Moon SS. 2001. Isolation and in vivo and in vitro antifungal activity of phenylacetic acid and sodium phenylacetate from Streptomyces humidus. Appl Environ Microbial
67: 3739-3745.
Khalid A, Arshad M, Zahir ZA. 2004. Screening plant growth-promoting
rhizobacteria for improving growth and yield of wheat. APP Microb 96: 473-475.
Khamna S, Yokota A, Peberdy JF, Lumyong S. 2010. Indole-3-acetic acid production by Streptomyces sp. isolated from some Thai medicinal plant rhizosphere soils. EurAsia J Bio Sci 4: 23-32.
Lestari Y. 2006. Identification of Indigenous
Streptomyces spp. Producing Antimicrobial Compounds. J Mikrobiol Indones 11: 99-101. Lichatowich T. 2006. The plant growth
enhancing and biocontrol mechanisms of Streptomyces lidicus
WYEC 108 and its use in nursery and greenhouse production. http://www.rngr.net/nurseries/publica tions/proceedings (29 Des 2010). Madigan MT, Martinko JM, Parker J 2006.
Brock: Biology of Mikroorganims.
New Jersey American: Prentice Hall. Manulis S, Shafrir H, Epetein E, Lichter A,
Barash I. 1994. Biosynthesis of acetic acid via indole-3-acetamide pathway in Streptomyces
spp. Microbiology 140: 1045-1050. Mc-Manus, Stocwell VO. 2001. Antibiotic
use for plant diseases management in the United States. Online. Plant Health Progress.
Miyadoh S. 1997. Morphology and Phylogeny of Actinomycetes. Atlas of Actinomycetes. The Society for Actinomycetes Japan.
Muthanas I. 2004. Potensi Streptomyces sp. Sebagai Agen Pengendali Raltsonia solanacearum pada Tanaman Cabai. [Thesis]. Departemen Biologi Institut Pertanian Bogor.
Old KM, Lee SS, Sharma JK, Zi QY. 2000. A Manual of Disease of Tropical Acacias in Australia, South East Asia and India. Jakarta: Center for International Forestry Research. Patten CL, Glick BR. 2002. Role of
Pseudomonas putida indole acetic acid in development of the host plant root system. Appl Environ Microbiol
68 (3) 3795-3801.
Prapagdee, Kuekulvong, Mongkolsuk. 2008. Antifungal Potensial of Extracellular Metabolites Produced by
Streptomyces against
Phytopathogenic fungi. Int J Biol Sci
Prosea. 1995. Plant Resources of South East Asia and India. Bogor: Prosea Foundation.
Romeiro RS, Moura AB, Matsouka K, Fernandes MC. 1997. Actinomycetes selected for biological control of tomato wilt (Raltsonia solanacearum) and growth promotion after seed microbialization
Biol Cont 23: 245-253.
Sasono A. 2010. Pemanfaatan Streptomyces
spp. sebagai agen pengendalian hayati mikrob patogen pada tanaman tomat (Solanum lycopersicum) [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor. Schlegel HG, Schmidt K. 1994. Mikrobiologi
Umum. Baskoro RMT, penerjemah. Yogyakarta: UGM-Press. Terjemahan dari: Allgemeine Mikrobiologi 6.
Semangun. 2006. Penyakit-penyakit Tanaman Pangan di Indonesia. Yogyakarta: Gadjah Mada University Press. Suriawiria U. 1973. Mikroflora penghasil
aktivitas anti bakteri didalam sampel tanah dari beberapa tempat di Jawa Barat. Acta Pharmaceutica. 4: 10-17. Syefianah. 2000. Antibiosis isolat
Streptomyces sp. terhadap patogen kedelai Bacillus subtilis dan
Xanthomonas campestris pv. glycine
[Skripsi]. Bogor: Fakultas
Matematika dan ilmu Pengetahuan Alam Institut Pertanian Bogor. Vasudevan P, Reddy MS, Kavitha S,
Velusamy P, Paulraj RSD, et al. 2002. Role of biological preparations in enhancement of rice seedling growth and grain yield. Curr Sci 83: 1140-1143.
Vonderwell JD, Enebak SA, Samuelson LJ. 2001. Influence of two plant growth promoting rhizobacteria on loblol pine root respiration and IAA activity. Forest Science 47: 197-202. Yuan CM&Crawford DL. 1995.
Characterization of Streptomyces lydius as a biocontrol against Fungal root and Seed Root. Appl Environ Microbiol 61: 3119-3128.
Yusepi. 2011. Kemampuan Aktinomiset Endofit dalam Meningkatkan Pertumbuhan Tanaman Padi (Oryza sativa L.) melalui Aktivitas Asam Indol Asetat [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
Yusniawati DR. 2009. Potensi Streptomyces
spp. sebagai penghambat cendawan patogen tular tanah Sclerotium rolfsii
Lampiran 1. Komposisi media YDC ( Yeast Dextrose CaCO3) (stok satu liter).
Komposisi bahan Jumlah yang dibutuhkan
Yeast extract 10 g
CaCO3 20 g
Glukosa 20 g
Pure agar 18 g
Lampiran 2. Komposisi media ISP2 agar (YMA) (stok satu liter).
Komposisi bahan Jumlah yang dibutuhkan
Yeast extract 4 g
Malt extract 10 g
Glukosa 4 g
Pure agar 18 g
Ket : Media ISP2 cair tidak menggunakan komposisi pure agar
Lampiran 3. Komposisi media OM (Oatmeal Agar) (stok satu liter).
Komposisi bahan Jumlah yang dibutuhkan
Oatmeal 60 g
Pure agar 12,5 g
Lampiran 4. Komposisi media International Streptomyces Project (ISP) 4 cair
No Jenis Bahan Jumlah (g) per liter media
1 Soluble Strach 10
2 CaCO3 2
3 (NH4)2SO4 2
4 K2HPO4 1
5 MgSO4.7H2O 1
6 NaCl 1
7 FeSO4.7H2O 0,001
8 MnCl2.7H2O 0,001
9 ZnSO4.7H2O 0,001
Lampiran 5. Biomassa sel Streptomyces spp. isolat terpilih.
No Isolat
Biomassa sel (mg)
Hari
5 10 15 20
1 PS4-16 31,9 266,9 507,8 270,3
2 LSW 05 22,2 271,8 478,2 357,3
3 LBR 02 357,4 409,3 630,0 341,3
Lampiran 6. Pengaruh perlakuan Streptomyces terhadap intensitas penyakit.
Perlakuan Intensitas penyakit (%)
3 MST 4 MST 5 MST 6 MST 7 MST
A0B0 3,5±0,8b 6,64±1,3c 11,21±2,2bcd 15,97±0,6bc 18,35±1,8c
A0B1 7,35±2,9c 8,94±2,7d 13,17±1,3d 18,22±3,6c 24,03±4,1d
A1B0 2,66±0,6ab 3,53±0,4a 6,7±1,8a 6,1±1,6a 9,17±2,1a
A1B1 2,1±1,1ab 3,44±0,8a 7,1±1,7a 6,86±2,3a 9,14±1,2a
A2B0 2,52±1,0ab 4,52±1,7ab 6,27±0,8a 7,42±2,6a 11,63±2,5ab
A2B1 1,4±0,5a 3,75±0,9ab 9,12±1,1abc 8,81±4,3a 11,71±5,4ab
A3B0 2,94±0,6ab 2,87±0.0a 8,43±2,6ab 9,21±2,2a 8,65±1,6a
A3B1 3,91±1,5b 5,66±1,5bc 11,71±3,2cd 14,02±1,7b 14±1,1b Keterangan : Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda
nyata berdasarkan uji Duncan pada taraf 5%
Lampiran 7. Pengaruh perlakuan Streptomyces terhadap tinggi tanaman.
Perlakuan Tinggi tanaman (cm)
2 MST 3 MST 4 MST 5 MST 6 MST 7 MST
A0B0 5,03±0,9 5,5±0,9 7,03±0,8a 8,79±1,4a 10,2±0,6ab 11,75±1,1a
A0B1 5,37±1,4 6,04±1,4 7,05±1,1a 7,98±1,1a 9,14±1,4a 11,37±2,1a
A1B0 4,73±0,4 5,8±0,4 8,53±0,6b 11,32±1,5b 12,41±1,6cd 15,67±2,3bc
A1B1 5,29±0,5 6,11±0,4 8,54±0,7b 12,11±0,9b 13,04±1,1d 16,05±1,4c
A2B0 4,52±0,6 5,78±0,4 7,55±0,5ab 9,62±1,7a 11,53±1,1bcd 13,44±1,6ab
A2B1 4,29±1,1 4,85±1,1 6,55±1,0a 8,94±1,6a 10,99±1,8abc 12,95±1,6a
A3B0 4,58±1,3 5,41±1,4 6,79±1,1a 9±0,8a 11,75±0,4bcd 13,58±1,8ab
A3B1 5,05±0,7 5,52±0,6 6,96±0.6a 8,41±0,9a 9,96±1,6ab 11,63±1,5a Keterangan : Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda
Lampiran 8 Penilaian kekuatan daya penghambatan terhadap bakteri patogen merujuk pada Suriawiria (1973).
++++ : Kenampakan sangat jelas, diameter ≥10 mm : Kenampakan jelas, diameter ≥ 15 mm : Kenampakan cukup jelas, diameter ≥ 20 mm
+++ : Kenampakan sangat jelas, diameter 5-9 mm : Kenampakan jelas, diameter 10-14 mm : Kenampakan cukup jelas, diameter 15-19 mm
: Kenampakan samar, diameter ≥ 20 mm
++ : Kenampakan sangat jelas, diameter 3-4 mm : Kenampakan jelas, diameter 5-9 mm
: Kenampakan cukup jelas, diameter 10-14 mm : Kenampakan samar, diameter 15-19 mm : Kenampakan sangat samar, diameter ≥ 20 mm
+ : Kenampakan sangat jelas, diameter 1-2 mm : Kenampakan jelas, diameter < 15 mm : Kenampakan cukup jelas, diameter 1-10 mm : Kenampakan samar, diameter 3-5 mm : Kenampakan sangat samar, diameter 5-20 mm
ABSTRAK
GARMITA FEBRIANI WIDANINGSIH. Telaah Efektivitas Streptomyces spp. dalam Menghambat Xanthomonas campestris pv. acaciae pada Tanaman Akasia. Dibimbing oleh YULIN LESTARI dan ANJA MERYANDINI.
Streptomyces spp. merupakan salah satu bakteri antagonis yang dapat dimanfaatkan sebagai pengendali hayati mikrob patogen tanaman karena menghasilkan senyawa antimikrob. Penelitian ini bertujuan menapis kemampuan Streptomyces spp. isolat indigenus dalam menghambat
Xanthomonas campestris pv. acaciae secara in vitro dan in planta. Delapan isolat yang digunakan yaitu PS4-16, LSW05, LBR05, LBR02, SSW02, SR01, SR02, dan SR03. Hasil uji in vitro
menggunakan koloni langsung menunjukkan bahwa empat dari delapan isolat tersebut mempunyai daya hambat cukup baik. Isolat SR02 memiliki daya hambat terbesar yaitu 20 mm disusul oleh isolat LSW05, PS4-16, dan LBR02 yang memiliki zona hambat masing-masing sebesar 8 mm, 5 mm, dan 3,5 mm. Keempat isolat dilakukan uji lanjut menggunakan filtrat kultur. Hasilnya diperoleh dua isolat dengan zona penghambatan cukup baik yaitu isolat PS4-16 dan SR02 dengan diameter zona bening sebesar 12,5 cm dan 6,5 cm pada hari kelimabelas. Uji in planta kedua isolat tersebut pada tanaman akasia (Acacia crassicarpa) yang diinokulasi
Xanthomonas campestris pv. acaciae menunjukkan bahwa SR02 dan PS4-16 mampu menekan intensitas penyakit masing-maing sebesar 9,14 % dan 11,71 % dibanding kontrol yaitu sebesar 24,03 % dan bakterisida komersial sebesar 14 % pada 7 minggu setelah tanam. Perlakuan
Streptomyces spp. juga terbukti mampu meningkatkan tinggi, diameter batang, dan bobot kering tanaman dibandingkan dengan kontrol. Hal ini mengindikasikan bahwa isolat Streptomyces spp. SR02 dan PS4-16 berpotensi untuk dikembangkan sebagai agens pengendali hayati terhadap bakteri hawar daun pada akasia.
ABSTRACT
GARMITA FEBRIANI WIDANINGSIH. The Study of Streptomyces spp. Effectiveness in Inhibiting Xanthomonas campestris pv. acaciae on Acacia Plant. Under direction of YULIN LESTARI and ANJA MERYANDINI.
Streptomyces spp. is one of the bacterial antagonists that can be used as biological control of plant microbial pathogens, since they produce antimicrobial compounds. This study was aimed to screen the capability of indigenous isolates of Streptomyces spp. in inhibiting Xanthomonas. campestris pv. acaciae in vitro and in planta assays. Eight isolates used were PS4-16, LSW05, LBR05, LBR02, SSW02, SR01, SR02, and SR03. Four out of the eight tested isolates had various inhibitory capability. The colony of SR02 showed the greatest inhibitory activity which was 20 mm diameter of clear zone followed by LSW05, PS4-16, and LBR02 which have inhibitory zone of 8 mm, 5 mm, and 3.5 mm respectively. Based on their crude extract assay PS416 and SR02 produced inhibitory activity 12,5 cm and 6,5 cm. Furthermore those two isolates were applied on
Acacia crassicarpa which was inoculated with pathogenic bacteria Xantomonas campestris pv.
Acacia. The result showed SR02 and PS4-16 capable of suppressing disease intensity by 9.14% and 11.71% respectively compared to the control treatment 24.03% and bactericidal agent by 14% at 7 weeks old plant after planting. Application of Streptomyces spp. were also able to increase more plant height, shoot diameter and plant dry weight compared with controls. This indicates that Streptomyces spp. PS4-16 and SR02 have potency to be developed as biological control agents against bacterial blight on acacia leaves.
PENDAHULUAN
Tanaman akasia termasuk kedalam suku leguminosae, memiliki lebih dari 1300 spesies dan terdistribusi di daerah tropik dan sub tropik. Kayu akasia banyak digunakan untuk perabot rumah tangga seperti pintu, bingkai jendela serta menjadi bahan baku utama dalam industri kertas. Beberapa jenis akasia yang paling banyak di tanam di wilayah asia adalah Acacia auriculiformis Cunn. Ex Benth., A.mangium Willd., A. crassicarpa
Cunn. Ex Benth., dan A. aulacocarpa Cunn. Ex Benth (Prosea 1995).
Hambatan rendahnya produksi kayu akasia di daerah tropis dapat disebabkan oleh penyakit karat daun, embun tepung, rebah semai, dan busuk akar (Old et al. 2000). Pada saat di persemaian, tanaman akasia terutama
A. crassicarpa juga dapat terserang penyakit hawar daun bakteri yang disebabkan
Xanthomonas campestris pv. acaciae.
Penyakit ini merupakan penyakit baru pada pembibitan tanaman A. crassicarpa khususnya ditemukan di pembibitan tanaman akasia di daerah Riau (Ernawati 2008).
A. crassicarpa merupakan tanaman tropis yang tumbuh cepat dengan kemampuan adaptasi yang tinggi dan merupakan tanaman pemfiksasi nitrogen. Di alam, akasia ini dapat hidup pada tanah yang memiliki drainase yang buruk sampai tanah kering (Gunn & Midgley 1991). A. crassicarpa memiliki tinggi antara 25-30 meter dengan biji berwarna hitam memanjang. Daun akasia memiliki dua jenis bentuk, ketika dalam masa juvenil daunnya akan membentuk daun majemuk bipinnate,
sedangkan pada masa dewasa akan muncul filodia (Bhattacharrya & Johri 1998).
Pengendalian penyakit tanaman saat ini lebih ditekankan pada pengendalian agen hayati yakni penggunaan organisme antagonis untuk menekan jumlah, aktivitas, dan penyebaran patogen. Namun penelitian mengenai upaya pengendalian A. crassicarpa
masih sangat sedikit dilaporkan. Salah satu anggota aktinomiset yang telah diteliti dan digunakan sebagai pengendali penyakit tanaman adalah Streptomyces (Prapagdee et.al
2008), yang dimanfaatkan berdasarkan kemampuannya dalam menghasilkan senyawa antimikrob.
Aktinomiset dikenal sebagai sumber utama beragam senyawa bioaktif diantaranya adalah senyawa antimikrob yang dapat digunakan sebagai agen biokontrol patogen tanaman
(Holtsmark et.al 2006; Alina & Susilowati 2008). Anggota terbesar Aktinomiset ialah genus Streptomyces. Streptomyces merupakan bakteri berfilamen dengan diameter 0.5-1.0 µm, aerob, gram positif, dan bereproduksi dengan spora yang dihasilkan miselium aerial (Holt et al 1994). Streptomyces memiliki siklus hidup yang kompleks dan mampu menghasilkan dan mensekresi metabolit sekunder, senyawa bioaktif seperti antibiotik, enzim, dan inhibitor enzim. Streptomyces
biasanya hidup di tanah dan merupakan dekomposer penting karena dapat menguraikan bahan organik serta tahan terhadap keadaan stres lingkungan seperti kekeringan dan kekurangan makanan dengan membentuk spora (Cao et al. 2004).
Penelitian yang telah dilakukan menunjukkan bahwa beberapa isolat indigenus Streptomyces spp. diketahui mampu menghasilkan senyawa antimikrob (Lestari 2006), seperti menghambat serangan bakteri patogen Ralstonia solanacearum pada cabai (Muthanas 2004) dan X. axonopodis pada kedelai (Andri 2004). Yuan & Crawford (1995) juga melaporkan kemampuan
Streptomyces dalam menghambat cendawan patogen tanaman yakni Phytium ultimum dan Rhizoctonia solani. Streptomyces isolat indigenus juga dilaporkan mampu menghambat serangan S. Rolfsii pada tomat (Yusniawati 2009; Sasono 2010). Namun demikian kajian tentang kemampuan
Streptomyces spp. dalam mengendalikan X. campestris pv. acaciae patogen tanaman akasia belum banyak dilakukan. Berdasarkan kemampuan Streptomyces spp. isolat indigenus tersebut dalam menghasilkan senyawa antimikrob, maka kajian potensi
Streptomyces spp. isolat indigenus terhadap
Xanthomonas campestris pv. acaciae yang menyerang tanaman akasia penting untuk dilakukan. Tujuan penelitian ini adalah menapis kemampuan Streptomyces spp. isolat indigenus dalam menghambat
Xanthomonas campestris pv. acaciae secara
in vitro dan in planta.
BAHAN DAN METODE
Waktu dan Tempat
PENDAHULUAN
Tanaman akasia termasuk kedalam suku leguminosae, memiliki lebih dari 1300 spesies dan terdistribusi di daerah tropik dan sub tropik. Kayu akasia banyak digunakan untuk perabot rumah tangga seperti pintu, bingkai jendela serta menjadi bahan baku utama dalam industri kertas. Beberapa jenis akasia yang paling banyak di tanam di wilayah asia adalah Acacia auriculiformis Cunn. Ex Benth., A.mangium Willd., A. crassicarpa
Cunn. Ex Benth., dan A. aulacocarpa Cunn. Ex Benth (Prosea 1995).
Hambatan rendahnya produksi kayu akasia di daerah tropis dapat disebabkan oleh penyakit karat daun, embun tepung, rebah semai, dan busuk akar (Old et al. 2000). Pada saat di persemaian, tanaman akasia terutama
A. crassicarpa juga dapat terserang penyakit hawar daun bakteri yang disebabkan
Xanthomonas campestris pv. acaciae.
Penyakit ini merupakan penyakit baru pada pembibitan tanaman A. crassicarpa khususnya ditemukan di pembibitan tanaman akasia di daerah Riau (Ernawati 2008).
A. crassicarpa merupakan tanaman tropis yang tumbuh cepat dengan kemampuan adaptasi yang tinggi dan merupakan tanaman pemfiksasi nitrogen. Di alam, akasia ini dapat hidup pada tanah yang memiliki drainase yang buruk sampai tanah kering (Gunn & Midgley 1991). A. crassicarpa memiliki tinggi antara 25-30 meter dengan biji berwarna hitam memanjang. Daun akasia memiliki dua jenis bentuk, ketika dalam masa juvenil daunnya akan membentuk daun majemuk bipinnate,
sedangkan pada masa dewasa akan muncul filodia (Bhattacharrya & Johri 1998).
Pengendalian penyakit tanaman saat ini lebih ditekankan pada pengendalian agen hayati yakni penggunaan organisme antagonis untuk menekan jumlah, aktivitas, dan penyebaran patogen. Namun penelitian mengenai upaya pengendalian A. crassicarpa
masih sangat sedikit dilaporkan. Salah satu anggota aktinomiset yang telah diteliti dan digunakan sebagai pengendali penyakit tanaman adalah Streptomyces (Prapagdee et.al
2008), yang dimanfaatkan berdasarkan kemampuannya dalam menghasilkan senyawa antimikrob.
Aktinomiset dikenal sebagai sumber utama beragam senyawa bioaktif diantaranya adalah senyawa antimikrob yang dapat digunakan sebagai agen biokontrol patogen tanaman
(Holtsmark et.al 2006; Alina & Susilowati 2008). Anggota terbesar Aktinomiset ialah genus Streptomyces. Streptomyces merupakan bakteri berfilamen dengan diameter 0.5-1.0 µm, aerob, gram positif, dan bereproduksi dengan spora yang dihasilkan miselium aerial (Holt et al 1994). Streptomyces memiliki siklus hidup yang kompleks dan mampu menghasilkan dan mensekresi metabolit sekunder, senyawa bioaktif seperti antibiotik, enzim, dan inhibitor enzim. Streptomyces
biasanya hidup di tanah dan merupakan dekomposer penting karena dapat menguraikan bahan organik serta tahan terhadap keadaan stres lingkungan seperti kekeringan dan kekurangan makanan dengan membentuk spora (Cao et al. 2004).
Penelitian yang telah dilakukan menunjukkan bahwa beberapa isolat indigenus Streptomyces spp. diketahui mampu menghasilkan senyawa antimikrob (Lestari 2006), seperti menghambat serangan bakteri patogen Ralstonia solanacearum pada cabai (Muthanas 2004) dan X. axonopodis pada kedelai (Andri 2004). Yuan & Crawford (1995) juga melaporkan kemampuan
Streptomyces dalam menghambat cendawan patogen tanaman yakni Phytium ultimum dan Rhizoctonia solani. Streptomyces isolat indigenus juga dilaporkan mampu menghambat serangan S. Rolfsii pada tomat (Yusniawati 2009; Sasono 2010). Namun demikian kajian tentang kemampuan
Streptomyces spp. dalam mengendalikan X. campestris pv. acaciae patogen tanaman akasia belum banyak dilakukan. Berdasarkan kemampuan Streptomyces spp. isolat indigenus tersebut dalam menghasilkan senyawa antimikrob, maka kajian potensi
Streptomyces spp. isolat indigenus terhadap
Xanthomonas campestris pv. acaciae yang menyerang tanaman akasia penting untuk dilakukan. Tujuan penelitian ini adalah menapis kemampuan Streptomyces spp. isolat indigenus dalam menghambat
Xanthomonas campestris pv. acaciae secara
in vitro dan in planta.
BAHAN DAN METODE
Waktu dan Tempat
Peremajaan Isolat Bakteri
Bakteri X. campestris pv. acaciae sebagai patogen target berasal dari koleksi Dr. Ir. Giyanto, M.Si. diremajakan pada media agar-agar Yeast Dextrose CaCO3(YDC) (Lampiran
1) dan diinkubasi pada suhu 27-28o C selama dua hari. Pengukuran kerapatan bakteri dihitung dengan menggunakan metode cawan