STUDI TENTANG NILAI PRODUKTIVITAS PRIMER DI
PANGURURAN PERAIRAN DANAU TOBA
SKRIPSI
GOKMAN SINURAT
040805044
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
STUDI TENTANG NILAI PRODUKTIVITAS PRIMER DI PANGURURAN PERAIRAN DANAU TOBA
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhu syarat mencapai gelar Sarjana Sains
GOKMAN SINURAT
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENGHARGAAN
Puji dan syukur saya panjatkan kepada Tuhan Yesus Kristus atas berkat dan kasih karunia-Nya saya dapat menyelesaikan hasil penelitian yang berjudul “Studi Tentang
Nilai Produktivitas Primer di Pangururan Perairan Danau Toba”, yang
merupakan salah satu syarat untuk memperoleh gelar Sarjana Biologi di Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
Pada kesempatan ini saya mengucapkan terimakasih sebesar-besarnya kepada Prof. Dr. Ing. Ternala A. Barus, M.Sc, dan Mayang Sari Yeanny, S.Si, M.Si. selaku dosen pembimbing saya yang telah banyak memberikan bimbingan dan arahan kepada saya selama menyelesaikan penelitian dan penyusunan hasil penelitian ini. Terimakasih juga saya ucapkan kepada Prof. Dr. Retno Widhiastuti M.S. selaku dosen penguji saya yang telah memberikan masukan dan bimbingan kepada saya dan juga kepada Etti Sartina Siregar, S.Si, M.Si. selaku dosen penguji sekaligus dosen pembimbing akademik saya yang telah banyak memberikan dorongan dan arahan kepada saya. Ucapan terimakasih juga saya sampaikan kepada Prof. Dr. Dwi Suryanto, M.Sc. dan Dra. Nunuk Priyani, M.Sc. sebagai ketua dan sekretaris Departemen Biologi dan juga semua dosen pengajar serta pegawai Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
Terima kasih yang sebesar-besarnya buat Ayahanda J. Sinurat dan Ibunda Alm. D.Br. Sitanggang yang telah memberikan cinta dan kasih serta dukungan selama dari kecil sampai saya dewasa. Ungkapan yang sebesar-besarnya juga saya ucapkan kepada Abang saya yang saya banggakan Pdt. Zending Sinurat S.Th dan Hottua Sinurat yang selama ini mendukung dan membimbing saya baik secara moril dan materil sehingga saya dapat menyelesaikan perkuliahan saya di Universitas Sumatera Utara.
Secara khusus saya ucapkan banyak terima kasih kepada sahabat terkasih saya Rista Hartiwi Sitepu yang selalu mendukung, memberi semangat dan memberikan bantuan yang begitu besar kepada saya selama ini, juga kepada sahabat terdekat saya selama perkuliahan Yourik Saragih dan Fransisco Sibarani yang selalu mendukung dan memberikan semangat.
ABSTRAK
Penelitian tentang “Studi Tentang Nilai Produktivitas Primer di Pangururan Perairan Danau Toba” telah dilakukan pada bulan februari 2009. Penelitian ini bertujuan untuk mengetahui nilai produktivitas primer di Pangururan Perairan Danau Toba serta untuk mengetahui hubungan antara faktor abiotik (fisik-kimia) dan biotik (kelimpahan fitoplankton) perairan terhadap nilai produktivitas primer di Pangururan Perairan Danau Toba. Penentuan titik penelitian dilakukan dengan metoda Purposive Random Sampling. Pengambilan sampel dilakukan pada empat satsiun penelitian dan masing-masing stasiun terdiri dari 3 kedalaman yakni 0 meter (permukaan), 4 meter dan 8 meter dengan 2 ulangan pada masing-masing kedalaman. Penentuan kedalaman ini berdasarkan pada batas penetrasi cahaya. Nilai produktivitas primer diukur dengan menggunakan metode winkler, botol terang dan botol gelap. Sedangkan pengukuran klorofil a dilakukan dengan menggunakan spektrofotometer.
Dari hasil penelitian diperoleh nilai produktivitas primer yang berkisar antara 75,072 sampai 300,288 mgC/m3/hari dengan rata-rata tertinggi diperoleh pada stasiun I dan terendah pada stasiun IV. Dari hasil uji statistik diketahui bahwa nilai produktivitas primer antar stasiun dan antar kedalaman tidak berbeda signifikan. Berdasarkan hasil analisis korelasi diketehui bahwa produktivitas primer berkorelasi sangat rendah hingga sedang terhadap faktor fisik kimia. Produktivitas primer berkorelasi rendah terhadap klorofil a dan berkorelasi sedang terhadap kelimpahan fitoplankton.
The Study of Primary Productivity in Lake Toba, Pangururan
ABSTRACT
The research about “ The Study of Primary Productivity in Lake Toba, Pangururan” was done in February 2009. The aim of this research was to investigate the value of primary productivity in lake toba, Pangururan and it’s relation with the value of physic-chemistry factors of water (abiotic) and the abundance of phytoplankton (biotic). The sampling station was determinated by Purposive Randome Sampling Method. Samples were collected from 4 sampling stations and devided into 3 deepness, they are 0 metres (surface), 4 metres, and 8 metres by 2 restarting treatments in each depth. The determination of 3 depths were based on the penetration of light. The value of primary productivity was measured by the Winkler method with light and dark bottles. While the concentration of chlorofill a was measured by using spectrophotometer.
The result showed that the value of primary productivity ranged from 75,072 to 300,288 mgC/m3/day with the highest value obtained at station I and the lowest value at station IV. According to statistical test obtained that there is no significance diffrence of primary productivity value between stations and between deepness. While the correlation analysis showed the correlation between primary productivity and physic-chemistry factors ranged from very low to medium value. Correlation analysis also showed the primary productivity correlated in low value with chlorofill a, and correlated in medium value with the abundance of phytoplankton.
DAFTAR ISI
halaman
Lembar Persetujuan i
Lembar Pernyataan ii
Penghargaan iii
Abstrak v
Abstract vi
Daftar Isi vii
Daftar Tabel viii
Daftar Gambar ix
Daftar Lampiran x
Bab 1. Pendahuluan
1.1 Latar Belakang 1
1.2 Permasalahan 2
1.3 Tujuan Penelitian 2
1.4 Hipotesis 3
1.5 Manfaat Penelitian 3
Bab 2. Tinjauan Pustaka
2.1 Ekosistem Danau 4
2.2 Produktivitas Primer 5
2.3 Pengukuran Produktivitas Primer 7
2.4 Klorofil a 8
2.5 Fitoplankton 9
2.6 Faktor Fisik Kimia Perairan 10
Bab 3. Bahan dan Metoda
3.1 Waktu dan Tempat 16
3.2 Deskripsi Area 16
3.3 Metoda Penelitian 18
3.4 Pengukuran Nilai Produktivitas Primer 18
3.5 Pengukuran Konsentrasi Klorofil a 19
3.6 Pengukuran Faktor Fisik Kimia Perairan 19
3.7 Analisis Data 22
Bab 4. Hasil dan Pembahasan
4.1Nilai Produktivitas Primer, Konsentrasi Klorofil a, Kelimpahan Fitoplankton, dan Faktor Fisik Kimia Perairan
24 4.2 Uji Statistik Nilai Produkt ivitas Primer antar Stasiun 34 4.3 Uji Statistik Nilai Produkt ivitas Primer antar Kedalaman 35
4.4 Analisis Korelasi 36
Bab 5. Kesimpulan dan Saran 38
5.1 Kesimpulan 38
5.2 Saran 38
DAFTAR TABEL
halaman Tabel 3.1 Alat dan Satuan Dalam Pengukuran Faktor Fisik
kimia Perairan 21
Tabel 4.1 Nilai Produktivitas Primer, Konsentrasi Klorofil a, Kelimpahan Fitoplankton, dan Faktor Fisik Kimia Perairan Pada Setiap Stasiun Penelitian di
Pangururan Perairan Danau Toba 24
Tabel 4.2 Uji Statistik Nilai Produkt ivitas Primer Antar Stasiun 34 Tabel 4.3 Uji Statistik Nilai Produktivitas Primer Antar
Kedalaman 35
Tabel 4.4 Nilai Korelasi Antara Faktor Fisik Kimia Perairan Dengan Produktivitas Primer Dari Setiap Stasiun
Penelitian 36
Tabel 4.5 Interval Koefisien dan Tingkat Hubungan untuk
Korelasi Pearson 36
DAFTAR GAMBAR
halaman Gambar 1 Grafik kadar Oksigen Terlarut Pada setiap kedalaman
masing-masing stasiun 28
Gambar 2 Grafik nilai BOD5 pada setiap kedalaman
masing-masing stasiun 29
Gambar 3 Grafik nilai pH pada setiap kedalaman masing-masing
stasiun 30
Gambar 4 Grafik nilai kejenuhan oksigen pada setiap kedalaman
masing-masing stasiun 31
Gambar 5 Grafik Nilai kadar nitrat pada setiap kedalaman
masing-masing stasiun 32
Gambar 6 Grafik nilai kadar fosfat pada setiap kedalaman
DAFTAR LAMPIRAN
halaman Lampiran A Bagan Kerja Metode Winkler untuk Mengukur
Kelarutan Oksigen (DO) 41
Lampiran B Nilai Oksigen Terlarut Maksimum (mg/l) Pada
Berbagai Besaran Temperatur Air 42
Lampiran C Bagan Kerja Metode Winkler untuk Mengukur BOD5 43
Lampiran D Bagan Kerja Kandungan Nitrat (NO3-) 44
Lampiran E Bagan Kerja Analisis Fosfat (PO43-) 45
Lampiran F Bagan Kerja Pengukuran Absorban Klorofil a 46
Lampiran G Nilai Konsentrasi Klorofil a 47
Lampiran H Nilai Oksigen Terlarut (DO) botol terang dan botol
gelap setelah perendaman selama 6 jam 48
Lampiran I Contoh Hasil Perhitungan 49
Lampiran J Hasil Analisis Laboratorium Nitrat dan Fosfat 50 Lampiran K Hasil Analisis Laboratorium H2S 51
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Lebih kurang tiga perempat bagian dari permukaan bumi tertutup air. Dari segi ekosistem kita dapat membedakan air tawar, air laut, dan air payau. Dari ketiga ekosistem perairan tersebut, air laut dan air payau merupakan bagian yang terbesar, yaitu lebih dari 97%. Sisanya adalah air tawar yang justru dibutuhkan oleh manusia dan banyak jasad hidup lainnya untuk keperluan hidupnya (Barus, 2004, hlm: 2).
Produktivitas primer adalah laju pembentukan senyawa organik yang kaya energi dari senyawa anorganik. Energi yang diperlukan agar ekosistem perairan dapat berfungsi hampir seluruhnya bergantung pada aktivitas fotosintesis tumbuhan yang salah satunya adalah fitoplankton. Fotosintesis hanya dapat berlangsung bila intensitas cahaya yang sampai ke suatu sel alga lebih besar daripada suatu intensitas tertentu. Hal ini berarti bahwa fitoplankton yang produktif hanya terdapat pada lapisan air teratas dimana cahaya cukup bagi berlangsungnya fotosintesis. Semua tumbuhan mengandung klorofil agar dapat berfotosintesis, kadar klorofil dalam suatu volume air tertentu merupakan suatu ukuran bagi biomassa tumbuhan yang terdapat di dalam air. Banyaknya klorofil yang terdapat dalam tumbuhan bergantung pada waktu dan intensitas cahaya matahari (Nybakken, 1992, hlm: 54).
Nilai produktivitas primer sangat dipengaruhi oleh konsentrasi klorofil a, intentensitas cahaya matahari, dan faktor fisik kimia lainnya serta faktor biologi (kelimpahan fitoplankton). Sampai sejauh ini informasi mengenai produktivitas primer di Pangururan Perairan Danau Toba masih belum diketahui, sehingga perlu dilakukan penelitian di lokasi tersebut.
1.2 Permasalahan
Permasalahan dalam penelitian ini adalah bagaimanakah produktivitas primer di Pangururan perairan Danau Toba dan korelasinya terhadap faktor fisik-kimia dan faktor biotik.
1.3. Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah:
a. Untuk mengetahui nilai produktivitas primer di Pangururan Perairan Danau Toba. b. Untuk mengetahui hubungan antara faktor abiotik (fisik-kimia) dan biotik
1.4 Hipotesis
a. Terdapat perbedaan nilai produktivitas primer pada setiap lokasi penelitian dan juga pada setiap kedalaman.
b. Terdapat korelasi antara faktor abiotik (fisik-kimia) dan faktor biotik (kelimpahan fitoplankton) dengan nilai produktivitas primer
1.5 Manfaat Penelitian
a. Memberikan informasi mengenai tingkat produktivitas primer di Pangururan Perairan Danau Toba.
BAB 2
TINJAUAN PUSTAKA
2.1 Ekosistem Danau
Hanya 3% air dimuka bumi ini yang termasuk air tawar. Sebagian besar (kira-kira 99%) dari air tawar membeku dalam glasier dan es. Sisanya terdapat dalam danau, kolam, sungai, dan aliran yang merupakan habitat untuk komunitas hayati. Danau terbagi atas tiga zona utama, masing-masing dengan ciri komunitas organisme. Tepian danau disebut dengan zona litoral. Pada daerah ini cahaya matahari sampai pada dasar danau. Produsen di zona litoral adalah tumbuhan yang berakar samapi di dasar danau dan juga algae yang menempel pada tumbuhan atau pada substrat padat lainnya. Zona limnetik merupakan lapisan air terbuka dan disini masih dapat terjadi produksi primer. Makin kedalam terdapat zona limnetik, jumlah cahaya yang tersedia untuk proses fotosintesis makin berkurang sampai pada kedalaman dengan laju fotosintesis produsen menjadi sama dengan laju respirasinya. Pada tahapan ini tidak terjadi produktivitas bersih. Zona limnetik lebih dangkal dalam air keruh daripada air jernih. Kehidupan dalam zona limnetik didominasi oleh mikroorganisme terapung, disebut sebagai plankton, dan hewan yang berenang secara aktif, yang disebut dengan nekton. Produsen dalam ekosistem ini adalah fitoplankton. Konsumen primer mencakup crustaceae terapung mikroskopik dan rotifera (Kimball, 1992, hlm: 975).
a. Lapisan (zona) eufotik, yaitu lapisan yang masih mendapat cukup cahaya matahari.
b. Lapisan kompensasi, yaitu lapisan dengan intensitas cahaya sebesar 1% dari intensitas cahaya permukaan.
c. Lapisan profundal, yaitu lapisan di bawah lapisan kompensasi, dengan intensitas cahaya sangat kecil atau bahkan tidak ada cahaya (afotik).
Selanjutnya, menurut Effendi (2003, hlm:33) berdasarkan perbedaan panas pada setiap kedalaman (dalam perbedaan suhu), strativikasi kolom air pada perairan tergenang dibagi menjadi tiga, yaitu:
a. Epilimnion, yaitu lapisan bagian atas perairan. Lapisan ini merupakan bagian yang hangat, dengan suhu yang relatif konstan atau perubahan suhu secara vertikal sangat kecil.
b. Termoklin atau metalimnion, yaitu lapisan di bawah epilimnion. Pada lapisan ini, perubahan suhu dan panas secara vertikal relatif besar; setiap penambahan kedalaman 10 meter terjadi penurunan suhu sekurang-kurangnya 1 oC.
c. Hipolimnion, yaitu lapisan dibawah metalimnion. Lapisan ini merupakan lapisan yang lebih dingin, ditandai oleh perbedaan suhu secara vertikal yang relatif kecil. Massa air pada lapisan ini bersifat stagnan, tidak mengalami pencampuran, dan memiliki densitas yang lebih besar.
Danau dapat diklasifikasikan berdasarkan produksi bahan organiknya. Danau oligotrofik merupakan danau yang dalam dan tidak banyak mengandung nutrien. Danau eutrofik merupakan danau yang umumnya lebih dangkal, dan kandungan nutrien pada airnya tinggi (Campbell, 2000, hlm: 279).
2.2 Produktivitas Primer
Meskipun demikian, intensitas sinar dan suhu yang ekstrim cenderung memiliki pengaruh menghambat laju fotosintesis. Fotosintesis mempengaruhi penyerapan energi radiasi dan karbondioksida serta pelepasan oksigen. Tanpa adanya sinar matahari, fotosintesis tertahan namun pernafasan akan tetap berlanjut. Dengan adanya sinar, proses fotosintesis dan respirasi terjadi serentak. Fakta-fakta ini digunakan untuk mencari cara pengukuran produksi primer. Produksi primer adalah jumlah karbon organik yang dihasilkan dan produktivitas primer adalah laju produksi, yaitu jumlah per satuan waktu (Michael, 1984, hlm: 366-367).
Produktivitas primer adalah kecepatan terjadinya fotosintesis atau pengikatan karbon. Proses fotosintesis ini terjadi baik di darat, permukaan dan dalam air tawar serta air laut (Romimohtarto & Juwana, 2001, hlm: 310-311). Dalam proses fotosintesis ini diperlukan zat hijau daun yang disebut klorofil. Proses ini menggunakan dua macam bahan, yaitu air dan karbondioksida. Setelah langkah pertama, yaitu mengubah energi cahaya menjadi energi kimia selesai, energi kimia dapat dipindah-pindahkan ke dalam berbagai bahan kimia. Berbagai macam organisme dapat menyempurnakan pemindahan ini. Tetapi hanya produsen yang dapat mengerjakan langkah pertama tadi (Soemarwoto et al.,1980, hlm: 8-9).
Dalam proses fotosintesis yang dilakukan oleh tumbuhan hijau, 6 molekul karbondioksida (CO2) dan 6 molekul air (H2O) diolah menjadi satu molekul gula
glukosa. Gula glukosa merupakan salah satu bentuk zat organik. Dalam proses ini dihasilkan juga 6 molekul oksigen (O2). Reaksi fotosintesis ini adalah:
cahaya matahari
6CO2 + 6H2O C6H12O6 + 6O2 klorofil
Reaksi ini berjalan dengan menggunakan energi cahaya matahari. Karna tumbuhan hijau dapat memproduksi bahan organik dari bahan anorganik, yaitu CO2 dan H2O,
tumbuhan hijau disebut produsen (Soemarwoto, 1994, hlm: 26-27). Selain energi kimia tersebut, fotosintesis juga menghasilkan Okosigen (O2). Gas O2 adalah esensial
dalam air juga ditopang oleh fotosintesis. Fotosintesis dilakukan oleh plankton, yaitu tumbuhan bersel satu yang melayang dalam air (Resosoedarmo, 1992, hlm: 31-34).
Sinar matahari berperan penting dalam proses fotosintesis. Apa saja yang mempengaruhi sinar matahari akan mempengaruhi proses fotosintesis. Di daerah katulistiwa, di mana panjang siang dan malam hampir sama sepanjang tahun maka faktor musim seperti yang terjadi di daerah sedang dan kutub tidak berpengaruh. Tetapi perubahan siang dan malam sangat berpengaruh secara berkala. Cuaca dapat mempengaruhi produktivitas primer melalui tutupan awan, angin dan secara tidak langsung melalui suhu. Awan dapat mengurangi penembusan cahaya ke permukaan
laut dan mengurangi kecepatan proses produktivitas primer (Romimohtarto & Juwana, 2001, hlm: 311-312).
2.3 Pengukuran Produktivitas Primer
Untuk mengukur produktivitas primer digunakan metode botol terang-gelap. Biasanya metode analisis oksigen yang digunakan adalah metoda Winkler. Berdasarkan nilai-nilai kadar oksigen akhir dalam botol terang dan botol gelap (setelah direndam dalam air untuk beberapa lama), dan nilai kadar oksigen awal (yaitu kadar oksigen dalam kedua botol sebelum digantungkan dalam perairan), laju fotosintesis dalam kedua botol dapat dihitung. Bagi botol terang nilai yang diperoleh adalah fotosintesis bersih atau kelebihan fotosintesis terhadap respirasi. Nilai yang diperoleh botol gelap adalah jumlah oksigen yang dikonsumsi oleh respirasi. Fotosintesis kotor adalah nilai yang diperoleh dengan menambahkan jumlah oksigen yang dikonsumsi untuk respirasi dengan fotosintesis bersih. Sudah barang tentu baik nilai fotosintesis bersih maupun fotosintesis kotor akan berbeda pada setiap kedalaman yang berbeda, karena nilai-nilai intensitas cahaya matahari berubah menurut kedalaman, sedangkan fotosintesis dipengaruhi oleh intensitas cahaya matahari (Nybakken, 1992, hlm: 55).
Dua terokan yang diambil dari air yang tergenang dan mengandung plankton ditekap di dalam botol kaca. Kedua botol tersebut digantungkan dalam kolam pada kedalaman yang sama dengan kedalaman pengambilan contoh air. Salah satu botol itu mula-mula dibungkus dengan kertas aluminium agar isi botol tersebut berada sama sekali dalam kegelapan, sehingga yang terjadi hanya pernafasan (tetapi tidak terjadi fotosintesis) oleh plankton. Dalam botol terang atau botol yang tidak dibungkus terjadilah pernafasan dan fotosintesis selama ada cahaya. Perlu kiranya untuk menentukan jumlah oksigen awal yang terlarut dalam air dengan cara mengambil sampel air kemudian menganalisisnya. Botol tersebut diambil setelah 24 jam dan dicatat suhunya. Kandungan oksigen dalam setiap botol diukur dengan metoda winkler.
2.4 Klorofil a
Klorofil berasal dari bahasa Yunani, yang terdiri dari dua suku kata, yaitu chloros berarti hijau dan phyllum yang berarti daun. Klorofil menangkap kekuatan hidup atau energi matahari dan digunakan untuk membelah molekul H2O menjadi unsur H dan
O2, kemudian menggabungkannya antara unsur H dengan gas CO2 dan dihasilkan gula
atau karbohidrat. Dari proses fotosintesis ini juga dihasilkan hasil sampingan berupa gas O2 (Wirosaputro,1998,hlm: 8).
yang peka mengukur cahaya yang melewati larutan tersebut. Dengan mengulangi proses ini dengan memakai cahaya monokromatik sambil merentang seluruh spektrum yang kasat mata, maka mungkin untuk menggambar spektrum absorbsi. Perhatikan baik bahwa baik klorofil a maupun klorofil b paling kuat menyerap cahaya di bagian merah dan ungu . Cahaya hijau yang paling sedikit diserap. Karena itu bila cahaya putih menyinari struktur-struktur yang mengandung klorofil, seperti misalnya daun, maka sinar hijau dipantulkan, dan hasilnya ialah struktur-struktur tersebut tampak hijau (Kimball,1992, hlm: 975).
Proses fotosintesis berlangsung dalam kloroplas, suatu organel yang terdapat di dalam sel tumbuhan hijau. Kloroplas memiliki membran. Dua lapisan membran atau pembungkus mengelilingi suatu ruang pusat yang besar yang dinamai stroma. Stroma mengandung beberapa banyak enzim larut yang berbeda yang berfungsi untuk menggabungkan sebagian organik. Pada stroma, membran juga membentuk granum. Setiap granum terdiri dari satu timbunan kantung atau ceper yang dinamai tilakoid. Granum dihubungkan antara satu sama lain oleh lamela stroma. Klorofil ada pada membran granum, dan menjadikannya sistem penyimpanan energi bagi kloroplas. Setiap tilakoid berbentuk seperti kantung. Pergerakan ion-ion dari ruang ini melintasi membran tilakoid dipercaya penting dalam proses sintesis. Klorofil tidak menyerap panjang gelombang cahaya dengan banyak. Karena itu, cahaya ini dipantulkan ke mata dan kita melihat klorofil sebagai suatu pigmen hijau (Mader, 1995, hlm: 98-99).
2.5 Fitoplankton
lapisan perairan yang mendapat cahaya matahari yang dibutuhkan untuk proses fotosintesis (Barus, 2004, hlm: 26).
Peran utama fitoplankton dalam ekosistem air tawar adalah sebagai produsen primer. Sebagai produsen, fitoplankton merupakan makanan bagi komponen ekosistem lainnya khususnya ikan. Posisinya di dasar piramida makanan mempertahankan kesehatan lingkungan air. Bila ada gangguan terhadap fitoplankton, maka seketika komunitas lain akan terpengaruh. Komposisi fitoplankton bergantung pada kualitas air, karena itu jenis alga tertentu dapat digunakan sebagai indikator
eutrofikasi air. Keasaman air juga mempengaruhi kelimpahan fitoplankton ( Monk et al, 2000, hlm: 174).
Plankton adalah organisme yang terapung atau melayang-layang di dalam air yang pergerakannya relatif passif (Suin, 2002, hlm: 118). Kemampuan berenang organisme-organisme planktonik demikian lemah sehingga pergerakan mereka sangat dikuasai oleh gerakan-gerakan air (Nybakken, 1992, hlm: 36). Plankton merupakan organisme perairan pada tingkat (tropik) pertama dan berfungsi sebagai penyedia energi. Secara umum plankton dapat dibagi menjadi dua golongan, yakni: fitoplankton, yang merupakan golongan tumbuhan, umumnya mempunyai klorofil (plankton nabati) dan zooplankton (golongan hewan) atau plankton hewani (Wibisono, 2005, hlm: 155).
2.6 Faktor Fisik Kimia Perairan
a. Suhu
matahari, pertukaran panas antara air dengan udara sekelilingnya dan juga dipengaruhi oleh faktor kanopi (penutupan vegetasi) dari pepohonan yang tumbuh di tepi. Kenaikan temperatur atau suhu di dalam badan air dapat menyebabkan penurunan kadar oksigen terlarut (Suriawiria 2005, hlm : 84).
Menurut Kinne (1960) dalam Supriharyono ( 2000, hlm: 22) kenaikan suhu di atas kisaran toleransi organisme dapat meningkatkan laju metabolisme, seperti pertumbuhan, reproduksi, dan aktivitas organisme. Kenaikan laju metabolisme dan aktivitas ini berbeda untuk setiap spesies, proses, dan level atau kisaran suhu.
b. Penetrasi Cahaya
Cahaya yang masuk ke dalam air diserap oleh air itu sendiri, oleh zat terlarut dan oleh butir-butir (terutama fitoplankton) dalam suspensi. Menurut teori, cahaya tidak dapat diserap secara keseluruhan di dalam air, tetapi pada kedalaman dimana intensitas cahaya hanya 1% dari intensitas pada permukaan air merupakan kedalaman dimana pernafasan dan fotosintesis fitoplankton mencapai keseimbangan. Kedalaman ini disebut titik kompensasi dan lapisan diatasnya disebut zona eufotik. Kedalaman zone ini banyak tergantung kondisi danau. Misalnya, kadar zat hara yang tinggi mengakibatkan populasi fitoplankton yang tinggi. Pada gilirannya, fitoplankton itu
mengakibatkan naungan dan mengurangi perembesan cahaya (Whitten, 1987; hlm: 212).
c. Intensitas Cahaya
Faktor cahaya yang masuk kedalam air akan mempengaruhi sifat-sifat optis dari air. Sebagian cahaya matahari tersebut akan diabsorbsi dan sebagian lagi akan dipantulkan keluar dari permukaan air. Dengan bertambahnya kedalaman lapisan air intensitas cahaya tersebut akan mengalami perubahan yang signifikan baik secara kualitatif maupun secara kuantitatif. Batas akhir penetrasi cahaya disebut sebagai titik akhir kompensasi cahaya, yaitu titik pada lapisan air dimana cahaya matahari mencapai nilai minimum yang menyebabkan proses asimilasi dan respirasi berada dalam keseimbangan. Dapat juga diartikan bahwa pada titik kompensasi cahaya ini,
konsentrasi karbondioksida dan oksigen berada dalam keadaan relatif konstan (Barus, 2004; hlm, 43).
d. Derajat Keasaman (pH)
Derajat keasaman air biasanya dimanfaatkan untuk menentukan indeks pencemaran dengan melihat tingkat keasaman atau kebasaan (Asdak, 1995, hlm: 535). Nilai pH yang ideal bagi kehidupan organisme akuatik pada umumnya terdapat antara 7 – 8,5. Kondisi perairan yang bersifat sangat asam atau sangat basa akan membahayakan kelangsungan hidup organisme karena akan menyebabkan terjadinya gangguan metabolisme dan respirasi (Barus, 2004, hlm: 61).
Pengukuran pH air dapat dilakukan dengan cara kalorimeter, dengan kertas pH, atau dengan pH meter. Pengukurannya tidak begitu berbeda dengan pengukuran pH tanah. Yang perlu diperhatikan dalam pengukuran pH air adalah cara pengambilan sampelnya harus benar sehingga pH yang diperoleh benar (Suin, 2002, hlm: 54).
e. Oksigen Terlarut
tekanan atmosfer. Semakin besar suhu dan ketinggian serta semakin kecil tekanan atmosfer, kadar oksigen terlarut semakin kecil. Semakin tinggi suatu tempat dari permukaan air laut, tekanan atmosfer semakin rendah. Kadar oksigen terlarut juga berfluktuasi secara harian dan musiman, tergantung pada percampuran dan pergerakan massa air, aktivitas fotosintesis, respirasi, dan limbah yang masuk ke badan air. Sumber oksigen terlarut dapat berasal dari difusi oksigen yang terdapat di atmosfer (sekitar 35%) dan aktivitas fotosintesis oleh tumbuhan air dan fitoplankton. Difusi oksigen kedalam air dapat terjadi secara langsung pada kondisi air diam (stagnant). Diperairan danau, oksigen lebih banyak dihasilkan oleh fotosintesis algae yang banyak terdapat pada lapisan epilimnion. Pada perairan tergenang yang dangkal dan banyak ditumbuhi tanaman air pada zona litoral, keberadaan oksigen lebih banyak dihasilkan oleh aktivitas fotosintesis tumbuhan air (Effendi, 2003, hlm: 76).
Schworbel (1987) dalam Barus, (2004, hlm: 58) menyatakan bahwa nilai oksigen terlarut di suatu perairan mengalami fluktuasi harian maupun musiman. Fluktuasi ini selain dipengaruhi oleh perubahan temperatur juga dopengaruhi oleh aktivitas fotosintesis dari tumbuhan yang menghasilkan oksigen. Nilai oksigen terlarut di perairan sebaiknya berkisar antara 6 – 8 mg/l. Selanjutnya, menurut Wardana (1995, hlm: 77) pertumbuhan organisme air tersebut. Kandungan oksigen terlarut minimum 2 mg/l O2, sudah cukup mendukung kehidupan organisme perairan secara
normal.
f. Kejenuhan Oksigen
Disamping pengukuran konsentrasi oksigen terlarut, biasanya dilakukan pengukuran terhadap tingkat kejenuhan oksigen dalam air. Hal ini dimaksudkan untuk lebih mengetahui apakah nilai kejenuhan oksigen tersebut merupakan nilai yang maksimum atau tidak. Untuk dapat mengukur tingkat kejenuhan oksigen suatu contoh air, maka disamping mengukur konsentrasi oksigen terlarut dalam mg/l, diperlukan
g. Biochemical Oxygen Demand (BOD5)
Biochemical oxygen demand adalah jumlah oksigen yang dibutuhkan oleh mikroorganisme dalam memecah bahan-bahan organik. Penguraian bahan organik melalui proses oksidasi oleh mikroorganisme di dalam lingkungan air merupakan suatu proses alamiah yang mudah terjadi apabila air lingkungan mengandung oksigen yang cukup (Wardhana, 1995, hlm: 77). Menurut Jeffries dan Mills (1996) dalam Effendi, (2003, hlm: 125) perairan alami memiliki nilai BOD antara 0,5-7,0 mg/l. Perairan yang memiliki nilai BOD lebih dari 10 mg/l di anggap mengalami pencemaran
Menurut Michael (1984, hlm: 134), uji BOD dilakukan untuk membantu menduga kemungkinan penurunan oksigen yang disebabkan oleh penguraian oksidatif dalam air, dengan demikian air merupakan sarana untuk mengukur kandungan organik suatu sistem perairan.
h. Nitrat dan Fosfat
Nitrat (NO3) adalah bentuk utama nitrogen di perairan alami dan merupakan nutrien
Fosfat merupakan bentuk fosfor yang dapat dimanfaatkan oleh tumbuhan. Karakteristik fosfor sangat berbeda dengan unsur-unsur lain. Fosfor merupakan unsur yang esensial bagi tumbuhan tingkat tinggi dan algae, sehingga unsur ini menjadi faktor pembatas bagi tumbuhan dan algae akuatik serta sangat mempengaruhi tingkat produktivitas perairan. Menurut Jones dan Bachmann (dalam Effendi, 2003) menyatakan bahwa adanya korelasi positif antara kadar fosfor total dengan klorofil a. Sumber alami fosfor di perairan adalah pelapukan batuan mineral dan dekomposisi bahan organik. Sumber antropogenik fosfor adalah limbah industri dan domestik, yakni fosfor yang berasal dari detergen. Kadar fosfor yang diperkenankan bagi kepentingan air minum adalah 0,2 mg/l dalam bentuk fosfat (PO4). Kadar fosfor pada
perairan alami berkisar antara 0,005-0,02 mg/l (Effendi, 2003, hlm: 158).
BAB 3
BAHAN DAN METODA
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Pebruari 2009 di perairan Danau Toba di daerah Kecamatan Pangururan Kabupaten Toba Samosir. Daerah Pangururan ini merupakan daerah yang ditempati oleh jumlah penduduk yang padat. Di perairan Pangururan ini terdapat berbagai aktivitas masyarakat seperti persinggahan kapal, PDAM, pasar tradisional dan perairan ini juga digunakan oleh masyarakat sebagai sumber air minum dan sebagai objek wisata.
3.2 Deskripsi Area
Stasiun I
b. Stasiun II
Stasiun ini tertletak di Kecamatan Pangururan Kabupaten Toba Samosir yang secara geografis terletak pada 02o36’21.2”LU dan 098o41’26.5”BT. Daerah ini merupakan daerah penangkaran ikan (keramba) dan banyak terdapat tumbuhan eceng gondok (Eichornia sp.)
c. Stasiun III
d. Stasiun IV
Stasiun ini tertletak di Kecamatan Pangururan Kabupaten Toba Samosir yang secara geografis terletak pada 02o34’1.01”LU dan 098o41’23.2”BT. Daerah ini merupakan daerah kontrol yang tidak terdapat aktivitas.
3.3 Metoda Penelitian
Penelitian dilaksanakan pada bulan Pebruari 2009. Penentuan lokasi dilakukan dengan metode “Purposive Random Sampling”, yaitu dengan menentukan empat stasiun pengamatan. Pengambilan sampel dilakukan pada tiga kedalaman yaitu pada permukaan (0 meter), kedalaman 4 meter, dan kedalaman 8 meter dengan masing-masing kedalaman dibuat 2 ulangan pada setiap stasiun pengamatan. Pengambilan sampel pada setiap kedalaman ini didasarkan pada batas penetrasi cahaya yaitu pada kedalaman 8 meter.
3.4 Pengukuran Nilai Produktivitas Primer
Masing-masing botol tersebut diberi label dan ditandai dengan kedalaman serta ulangannya. Untuk memperoleh sampel air dari kedalaman 4 meter dan 8 meter dilakukan dengan menggunakan lamnot. Sampel air yang diperoleh kemudian dimasukkan kedalam botol winkler kemudian ditutup rapat dan dilakban. lalu diikat dengan tali dimana ukuran tali disesuaikan berdasarkan kedalaman setiap masing-masing sampel. Sebelum perendaman botol dilakukan, DO awal masing-masing-masing-masing sampel setiap kedalaman harus dihitung terlebih dahulu. Perendaman botol-botol winkler dimulai pada pukul 09.00WIB hingga pukul 12.00WIB. Setelah 6 jam lamanya, botol-botol yang sudah direndam diangkat kembali kemudian diukur nilai DO akhir dan dihitung nilai produktivitas primernya.
3.5 Pengukuran konsentrasi Klorofil a
Untuk pengukuran konsentrasi klorofil a, sampel air diambil sebanyak 1000 ml dari setiap kedalaman 0 meter, 4 meter, dan 8 meter pada keempat stasiun pengamatan. Kemudian sampel air dibawa ke laboratorium dan diukur konsentrasi
klorofil a dengan menggunakan spektrofotometer. Bagan kerja terlampir (Lampiran F).
3.6 Pengukuran Faktor Fisik-Kimia Perairan
Faktor fisik-kimia yang diukur adalah suhu, penetrasi cahaya, intensitas cahaya, pH, Oksigen Terlarut (DO), kejenuhan oksigen, Biochemical Oxygen Demand (BOD), kandungan Fospat, kandungan Nitrat, dan kandungan H2S
a. Suhu (oC)
b. Penetrasi Cahaya (m)
Penetrasi cahaya diukur dengan menggunakan keping secchi. Keping secchi dibenamkan ke dalam air hingga tidak terlihat dari permukaan, kemudian diukur kedalaman penetrasi cahaya berdasarkan panjang tali berskala yang masuk ke dalam air.
c. Intensitas Cahaya
Untuk mengukur intensitas cahaya dilakukan dengan menggunakan Lux meter. Nilai yang tertera pada alat tersebut adalah nilai dari intensitas cahaya yang masuk kebadan perairan.
d. pH (Derajat Keasaman)
Derajat keasaman diukur dengan menggunakan pH meter, yaitu dengan memasukkan pH meter ke dalam sampel air yang didapat dari tiap kedalaman hingga angka yang ditampilkan pada alat konstan.
e. Oksigen Terlarut/DO (mg/l)
Untuk mengukur oksigen terlarut dilakukan dengan menggunakan metode Winkler. Sampel air dari setiap kedalaman diambil dan dimasukkan ke dalam botol Winkler, kemudian dilakukan pengukuran dengan penambahan dan titrasi beberapa zat. Bagan kerja terlampir (Lampiran A).
f. Kejenuhan Oksigen
g. BOD5 (Biochemical Oxygen Demand)
Untuk mengukur BOD5 juga dilakukan dengan metode Winkler. Namun,
sampel air dari setiap kedlaman terlebih dahulu diinkubasi pada suhu 200C selama lima hari. Kemudian, diukur nilai oksigen yang terlarut dengan metode Winkler. Nilai tersebut dianggap sebagai nilai DO akhir. Kadar BOD5 akan diketahui setelah
mengurangkan DO awal dengan DO akhir. Bagan kerja terlampir (Lampiran C).
h. Kadar Nitrat dan Fosfat
Pengukuran kadar fosfat dan nitrat dilakukan dengan menggunakan Spektrofotometer. Bagan kerja terlampir (Lampiran D dan E).
i. Kadar H2S
Pengukuran H2S dilakukan dengan menggunakan Spektrofotometer.
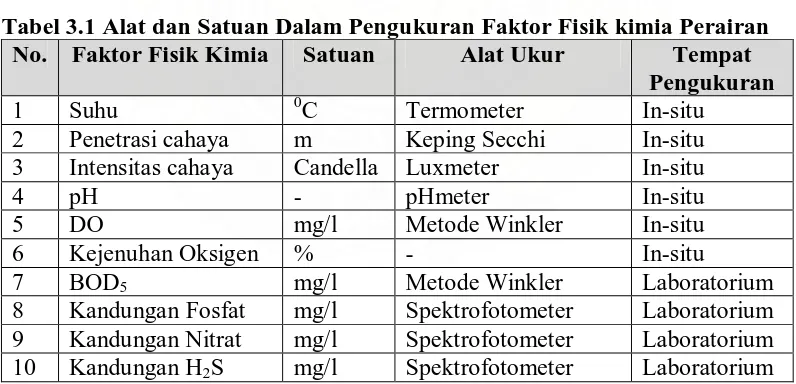
Tabel 3.1 Alat dan Satuan Dalam Pengukuran Faktor Fisik kimia Perairan
No. Faktor Fisik Kimia Satuan Alat Ukur Tempat
Pengukuran
1 Suhu 0C Termometer In-situ
2 Penetrasi cahaya m Keping Secchi In-situ 3 Intensitas cahaya Candella Luxmeter In-situ
4 pH - pHmeter In-situ
5 DO mg/l Metode Winkler In-situ
6 Kejenuhan Oksigen % - In-situ
7 BOD5 mg/l Metode Winkler Laboratorium
3.7 Analisis Data
Data yang diperoleh akan diolah dengan menghitung nilai tingkat kejenuhan oksigen, produktivitas primer perairan, konsentrasi klorofil a fitoplankton, analisis variasi (uji F) dan korelasi.
a. Kejenuhan oksigen
Harga kejenuhan oksigen (%) dapat dihitung dengan menggunakan rumus sebagai berikut:
Temperature. Tabel nilai oksigen terlarut maksimum terlampir (Lampiran B).
(Barus, 2004, hlm: 59)
b. Produktivitas primer
Cara yang umum dipakai dalam mengukur produktivitas primer suatu perairan adalah dengan menggunakan botol gelap dan botol terang. Produktivitas primer dapat diukur sebagai produktivitas kotor dan atau produktivitas bersih. Hubungan diantara keduanya dapat dinyatakan sebagai:
Produktivitas bersih (PN) = Produktivitas kotor (PG) – Respirasi (R)
R = [O2] awal - [O2] akhir pada botol gelap
Pg = [O2] akhir pada botol terang - [O2] akhir pada botol gelap
c. Konsentrasi Klorofil a
Konsentrasi klorofil a dapat dihitung dengan rumus sebagai berikut: Klorofil a (mg/m3) = (11.0) (2,43) (A1–A2) (V1/V2)/d
Dengan catatan:
11,0 adalah koefisien absorbsi 2,43 adalah faktor koreksi
A1 adalah absorban klorofil a dan pheophytin sampel
A2 adalah absorban yang diberi HCl
V1 adalah volume ekstrak aseton (liter)
V2 adalah volume sampel yang disaring (m3)
d adalah diameter kuvet (cm)
Nilai A1 dan A2 terlebih dahulu dikoreksi dengan mengurangkan dari absorban blanko
730 nm (Soegianto, 2004, hlm: 22).
d. Analisis Varian (uji F) dan Analisis korelasi
BAB 4
HASIL DAN PEMBAHASAN
4.1 Nilai Produktivitas Primer, Konsentrasi Klorofil a, Kelimpahan Fitoplankton, dan Faktor Fisik Kimia Perairan
Dari hasil penelitian yang telah dilakukan, diperoleh nilai produktivitas primer, konsentrasi klorofil a, kelimpahan fitoplankton, dan faktor fisik kimia perairan pada setiap stasiun pengamatan seperti pada tabel 4.1.
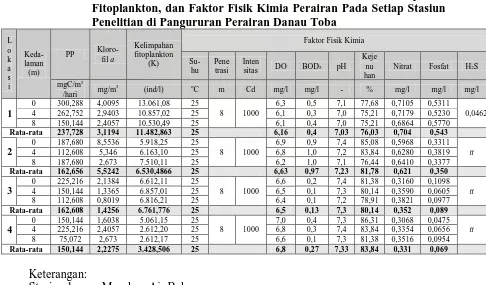
Tabel 4.1 Nilai Produktivitas Primer, Konsentrasi Klorofil a, Kelimpahan Fitoplankton, dan Faktor Fisik Kimia Perairan Pada Setiap Stasiun Penelitian di Pangururan Perairan Danau Toba
L
Faktor Fisik Kimia
Su-
Stasiun 1 = Masukan Air Belerang Stasiun 2 = Keramba Ikan
Stasiun 3 = PDAM
Dari hasil penelitian yang telah dilakukan diperoleh bahwa nilai produktivitas primer pada masing-masing stasiun penelitian berkisar antara 75,072 – 300,288 mgC/m3/hari. Nilai produktivitas primer tertinggi terdapat pada stasiun I yaitu pada permukaan dengan nilai sebesar 300,288 mgC/m3/hari dan nilai produktivitas primer terendah terdapat pada stasiun IV yaitu pada kedalaman 8 meter dengan nilai sebesar 75,072 mgC/m3/hari. Dari data yang diperoleh, diketahui bahwa nilai rata-rata produktivitas primer tertinggi terdapat pada stasiun I dengan nilai sebesar 237,728 mgC/m3/hari dan nilai rata-rata terendah terdapat pada stasiun IV dengan nilai sebesar 150,144 mgC/m3/hari. Tingginya nilai produktivitas primer pada stasiun I dapat disebabkan kandungan nutrisi yang tinggi (nitrat dan fosfsat) dan juga faktor fisik-kimia perairan lainnya yang sangat mendukung bagi kehidupan fitoplankton, dimana hasil proses fotosintesis fitoplankton merupakan laju produktivitas primer. Dari data yang diperoleh diketahui bahwa nilai kelimpahan fitoplankton tertinggi terdapat pada stasiun I. Tingginya kelimpahan fitoplankton pada stasiun inilah menyebabkan laju produktivitas primer lebih tinggi yang didukung oleh keadaan kandungan nutrisi yang tinggi. Nilai produktivitas primer terendah yang terdapat pada stasiun IV dapat disebabkan kandungan nutrisinya yang rendah sehingga kurang mendukung kehidupan fitoplankton yang melakukan fotosintesis. Dari data yang diperoleh diketahui bahwa nilai kelimpahan fitoplankton terendah terdapat pada stasiun IV sehingga laju produktivitas primernya juga lebih rendah.
Dari hasil pengukuran terhadap nilai konsentrasi klorofil a diketahui bahwa nilai konsentrasi klorofil a dari setiap stasiun penelitian berkisar antara 0,8019 – 8,5536 mg/m3. Nilai konsentrasi klorofil a tertinggi terdapat pada stasiun II yaitu pada permukaan dengan nilai sebesar 8,5536 mg/m3 dan nilai konsentrasi klorofil a terendah terdapat pada stasiun III yaitu pada kedalaman 8 meter dengan nilai sebesar 0,8019 mg/m3. Dari data yang diperoleh diketahui bahwa nilai rata-rata tertinggi konsentrasi klorofil a terdapat pada stasiun II dengan nilai sebesar 5,5242 mg/m3 dan nilai rata-rata konsentrasi klorofil a terendah terdapat pada stasiun III dengan nilai sebesar 1,4256 mg/m3.
fitoplankton, dan bahkan berbeda pada individu-individu dari spesies yang sama, karena kandungan klorofil bergantung pada kondisi individu. Tingginya konsentrasi klorofil a pada stasiun II dapat disebabkan jenis fitoplankton pada stasiun ini memilki konsentrasi klorofil a yang paling banyak, walaupun kelimpahan fitoplankton pada stasiun II ini lebih rendah dibandingkan dengan stasiun I. Konsentrasi klorofil a yang lebih rendah pada stasiun I dibandingkan dengan stasiun II dapat disebabkan adanya kadar H2S pada stasiun I, sehingga dengan adanya kadar H2S yang bersifat toksik
selama inkubasi sampel dari lokasi penelitian hingga ke laboratorium dapat merusak klorofil jenis fitoplankton tertentu karena kondisi dengan perairan alaminya sudah berbeda. Menurut Guderian (1995) dalam Firdaus dan Nasir (1995) H2S pada
konsentrasi yang tinggi dapat menimbulkan kerusakan akut seperti klorosis dan nekrosis atau kematian. Pada konsentrasi 0,0035 ml -1,0 ml, dapat menyebabkan robeknya membran kloroplas sehingga klorofil rusak. Nilai rata-rata konsentrasi klorofil a yang rendah pada stasiun III dapat disebabkan karena pada stasiun ini terdapat pompa penyedotan air PDAM sehingga saat pengambilan sampel klorofil a keberadaan fitoplankton sedikit dan mengakibatkan konsentrasi klorofil a yang terukur juga sangat rendah. Faktor lain yang menyebabkan rendahnya konsentrasi klorofil a pada stasiun III ini dapat disebabkan jenis fitoplankton yang diperoleh memiliki jumlah klorofil a yang sedikit.
Klorofil a merupakan salah satu parameter yang sangat menentukan produktivitas primer di perairan. Sebaran dan tinggi rendahnya konsentrasi klorofil a sangat terkait dengan kondisi lingkungan suatu perairan. Beberapa parameter fisik-kimia yang mengontrol dan mempengaruhi sebaran klorofil a adalah intensitas cahaya, nutrien (terutama nitrat dan fosfat ). Perbedaan parameter fisik-kimia tersebut secara langsung merupakan penyebab bervariasinya produktivitas primer di beberapa tempat perairan (Sverdrup et al., 1961 dalam Tarumingkeng, 2002).
permukaan air sampai kedalaman 8 meter ini dapat juga disebabkan oleh pencampuran air yang merata serta tidak ditemukannya tumbuhan air di permukaan yang menghalangi cahaya matahari tembus ke badan air.
Menurut Effendi (2003, hlm: 57) suhu suatu badan air dipengaruhi oleh musim,
lintang, waktu dalam hari, ketinggian dari permukaan laut, sirkulasi udara, penutupan awan, dan aliran serta kedalaman badan air. Perubahan suhu berpengaruh terhadap proses fisika, kimia, dan biologi badan air. Suhu juga sangat berperan dalam mengendalikan kondisi ekosistem perairan. Selanjutnya, menurut Brehm & Meijering (1990 dalam Barus, 2004, hlm: 44-45) pola suhu ekosistem akuatik dipengaruhi oleh berbagai faktor seperti intensitas cahaya matahari, pertukaran panas antara air dengan udara dan juga dipengaruhi oleh faktor kanopi (penutupan vegetasi) dari pepohonan yang tumbuh di tepi.
Penetrasi cahaya yang diperoleh pada masing-masing stasiun penelitian memiliki penetrasi cahaya yang relatif sama yaitu 8 meter. Panjangnya penetrasi cahaya yang diproleh cukup dalam, hal ini terjadi karena kejernihan air yang cukup baik dan tidak adanya tumbuhan air di permukaan sehingga cahaya matahari dapat masuk secara maksimal ke dalam air. Sedangkan intensitas cahaya yang diukur pada setiap stasiun diperoleh dengan nilai yang sama yaitu 1000 candella. Intensitas cahaya yang diperoleh ini merupakan nilai maksimum karena pengukurannya dilakukan pada saat penyinaran matahari yang maksimum dan tanpa adanya penutupan oleh awan.
Menurut Effendi (2003, hlm: 59-60), kecerahan air (penetrasi cahaya) tergantung pada warna dan kekeruhan. Kecerahan merupakan ukuran transparansi perairan. Nilai kecerahan sangat dipengaruhi oleh keadaan cuaca, waktu pengukuran, kekeruhan, dan padatan tersuspensi. Pengukuran kecerahan sebaiknya dilakukan pada saat cuaca cerah.
7
Stasiun I Stasiun II Stasiun III Stasiun IV
(D
O
) mg/
lite
r
0 meter 4 meter 8 meter Rata-rata
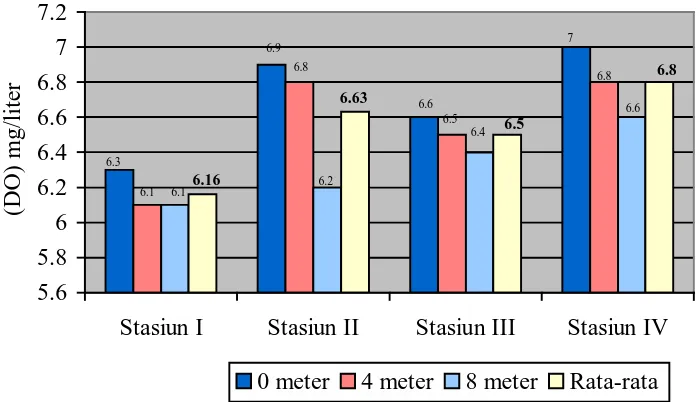
Gambar 1. Grafik kadar Oksigen Terlarut Pada setiap kedalaman masing-masing stasiun
Dari grafik kadar oksigen di atas diketahui bahwa nilai tertinggi oksigen terlarut terdapat pada stasiun IV yaitu pada permukaan dengan nilai sebesar 7,0 mg/l air dan terendah terdapat pada stasiun I pada kedalaman 4 meter dan 8 meter dengan nilai yang sama yaitu sebesar 6,1 mg/l air. Dari data yang diperoleh, diketahui bahwa nilai rata-rata oksigen terlarut tertinggi terdapat pada stasiun IV dengan nilai sebesar 6,8 mg/l air dan nilai rata-rata oksigen terlarut terendah terdapat pada stasiun I dengan nilai sebesar 6,16 mg/l air. Kadar oksigen terlarut yang tinggi pada stasiun IV dapat diakibatkan karena stasiun ini merupakan daerah kontrol yang bebas dari aktivitas masyarakat sehingga kondisi perairan di daerah ini tidak terganggu dan masih baik. Oksigen yang terlarut dalam air berasal dari kontak langsung dari udara dan hasil fotosintesis tumbuh-tumbuhan yang ada dalam air. Oksigen terlarut dalam air dari udara dapat terjadi karena adanya difusi langsung dan gelombang permukaan air oleh aksi angin dan arus turbulen.
Secara keseluruhan, kadar oksigen terlarut pada setiap stasiun masih mendukung kelangsungan hidup organisme air. Nilai oksigen terlarut di perairan sebaiknya berkisar antara 6 – 8 mg/l (Barus, 2004, hlm: 58). Menurut Welch (1963) dalam Soedarti et al. (2006), kadar oksigen terlarut yang produktif bagi organisme
Berdasarkan hasil pengukuran terhadap BOD5 pada masing-masing stasiun
penelitian maka diperoleh grafik penyebarannya seperti berikut:
0.9
Stasiun I Stasiun II Stasiun III Stasiun IV
B
0 meter 4 meter 8 meter Rata-rata
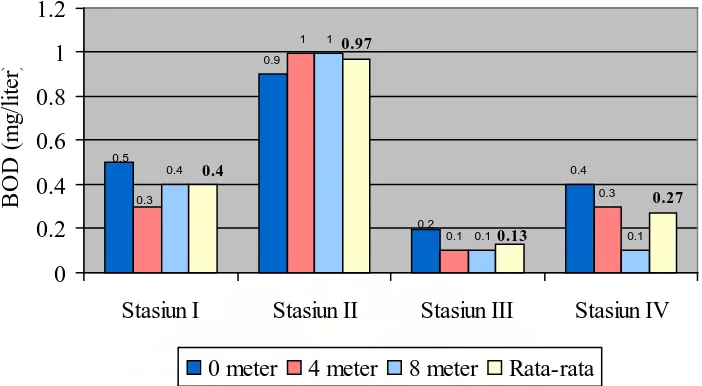
Gambar 2. Grafik nilai BOD5 pada setiap kedalaman masing-masing stasiun
Dari hasil penelitian yang telah dilakukan diperoleh bahwa nilai BOD5
tertinggi terdapat pada stasiun II pada kedalaman 4 meter dan 8 meter dengan nilai yang sama yaitu sebesar 1 mg/l air dan terendah terdapat pada stasiun III pada kedalaman 4 meter dan 8 meter dengan nilai yang sama yaitu sebesar 0,1 mg/l air. Dari data yang diperoleh, diketahui bahwa nilai rata-rata BOD5 tertinggi terdapat pada
stasiun II dengan nilai sebesar 0,97 mg/l air dan nilai rata-rata BO5 terendah terdapat
pada stasiun III dengan nilai sebesar 0,13 mg/l air. Nilai BOD5 yang tinggi pada
stasiun II dapat disebabkan karena stasiun ini merupakan daerah keramba ikan dimana sisa-sisa makanan ikan (pelet) akan terakumulasi di badan perairan. Sisa-sisa makanan ikan ini merupakan bahan organik yang harus dioksidasi lagi oleh mikroorganisme. Tingginya bahan organik yang harus dioksidasi oleh mikroorganisme akan membutuhkan oksigen yang tinggi pula di dalam air sehingga nilai BOD5 menjadi
tinggi.
Berdasarkan hasil pengukuran terhadap nilai pH pada masing-masing stasiun penelitian maka diperoleh grafik penyebarannya seperti berikut:
7.1
Stasiun I Stasiun II Stasiun III Stasiun IV
pH
0 meter 4 meter 8 meter Rata-rata
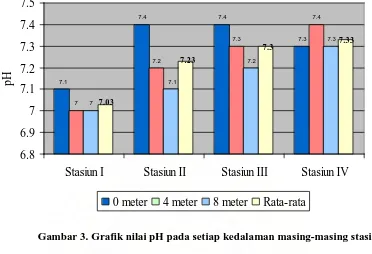
Gambar 3. Grafik nilai pH pada setiap kedalaman masing-masing stasiun
Dari grafik pH di atas diketahui bahwa nilai pH bervariasi pada setiap stasiun penelitian yang berkisar antara 7,0 – 7,4. Nilai pH tertinggi terdapat pada stasiun II, stasiun III, dan stasiun IV dengan nilai yang sama yaitu sebesar 7,4. Pada stasiun II dan III, pH tertinggi terdapat pada permukaan sedangkan pada stasiun IV nilai pH tertinggi terdapat pada kedalaman 4 meter. Dari data yang diperoleh diketahui bahwa nilai rata-rata pH tertinggi terdapat pada stasiun IV dengan nilai sebesar 7,33 dan nilai rata-rata pH terendah terdapat pada stasiun I yaitu sebesar 7,03.
Menurut Barus (2004, hlm: 61 – 63) nilai pH menyatakan nilai konsentrasi ion hidrogen dalam suatu larutan. Nilai pH yang ideal bagi kehidupan organisme air pada umumnya terdapat antara 7 sampai 8,5. Derajat keasaman air biasanya dimanfaatkan untuk menentukan indeks pencemaran dengan melihat tingkat keasaman atau kebasaan (Asdak, 1995, hlm: 535).
83.84
Stasiun I Stasiun II Stasiun III Stasiun IV
K
0 meter 4 meter 8 meter Rata-rata
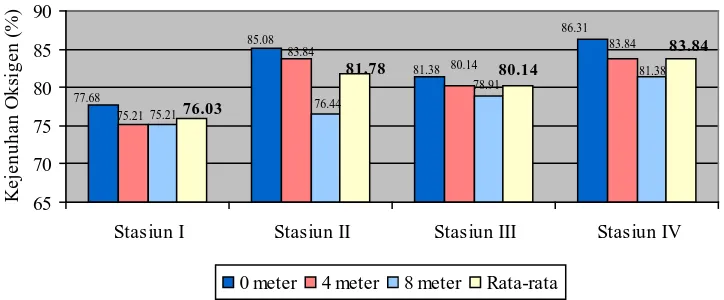
Gambar 4. Grafik nilai kejenuhan oksigen pada setiap kedalaman masing-masing stasiun
Dari grafik kejenuhan oksigen di atas dapat diketahui bahwa nilai kejenuhan oksigen tertinggi terdapat pada stasiun IV yaitu pada kedalaman 0 meter (permukaan) dengan nilai sebesar 86,31% dan terendah terdapat pada stasiun I yaitu pada kedalaman 4 dan 8 meter dengan nilai yang sama sebesar 75,21%. Nilai rata-rata kejenuhan oksigen tertinggi terdapat pada stasiun IV yaitu sebesar 83,84% dan terendah terdapat pada stasiun I dengan nilai sebesar 76,03%. Nilai kejenuhan oksigen menggambarkan kondisi oksigen yang terdapat di dalam badan air. Semakin tinggi nilai kejenuhan oksigen maka semakin kecil defisit oksigen dalam badan air tersebut dan sebaliknya. Nilai kejenuhan oksigen yang tinggi yang terdapat pada stasiun IV dapat diakibatkan karena nilai kadar organik yang rendah. Hal ini dapat dilihat bahwa nilai kadar nitrat dan kadar fosfat yang paling rendah terdapat pada stasiun IV. Rendahnya nilai kejenuhan oksigen pada stasiun I disebabkan oleh banyaknya senyawa organik yang terdapat di badan air. Dari data yang diperoleh, diketahui bahwa nilai kadar organik (nitrat dan fosfat) tertinggi terdapat pada stasiun I. Senyawa organik yang terakumulasi dalam air mengakibatkan pemakaian oksigen menjadi bertambah sehingga terjadi defisit oksigen.
Berdasarkan hasil pengukuran terhadap nilai kadar nitrat pada masing-masing stasiun penelitian maka diperoleh grafik penyebarannya seperti berikut:
0.7105
Stasiun I Stasiun II Stasiun III Stasiun IV
N
0 meter 4 meter 8 meter Rata-rata
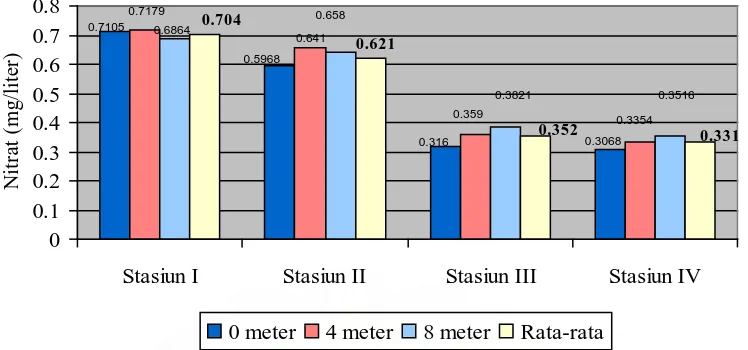
Gambar 5. Grafik Nilai kadar nitrat pada setiap kedalaman masing-masing stasiun
Dari grafik kadar nitrat di atas dapat diketahui bahwa nilai kadar nitrat berkisar antara 0,3068 mg/l – 0,7179 mg/l. Nilai kadar nitrat tertinggi terdapat pada stasiun I yaitu pada kedalaman 4 meter dengan nilai sebesar 0,7179 mg/l dan terendah terdapat pada stasiun IV pada kedalaman 0 meter dengan nilai sebesar 0,3068 mg/l. Nilai rata-rata kadar nitrat tertinggi terdapat pada stasiun I dengan nilai sebesar 0,704 mg/l air dan nilai rata-rata terendah terdapat pada stasiun IV dengan nilai sebesar 0,331 mg/l. Tingginya nilai nitrat pada stasiun I dapat disebabkan karena pada stasiun ini terdapat masukan aliran air belerang dan merupakan daerah objek wisata pemandian air panas. Limbah domestik yang berasal dari pemandian air panas mengalir ke badan air yang membawa berbagai bahan organik. Selain itu, sehari sebelum penelitian dilakukan terjadi hujan deras sehingga membawa berbagai unsur-unsur mineral dan bahan organik masuk ke badan perairan. Kadar nitrat yang rendah yang terdapat pada stasiun IV dapat disebabkan karena stasiun ini merupakan daerah yang bebas dari aktivitas masyarakat sehingga tidak banyak pasokan limbah yang mengandung bahan organik dari luar yang meningkatkan kadar nitrat. Perairan oligotrofik memiliki kadar nitrat antara 0 – 1 mg/l (Effendi, 2003, hlm: 155).
0.3819
Stasiun I Stasiun II Stasiun III Stasiun IV
F
0 meter 4 meter 8 meter Rata-rata
Gambar 6. Grafik nilai kadar fosfat pada setiap kedalaman masing-masing stasiun
Dari hasil penelitian yang telah dilakukan diperoleh nilai kadar fosfat dari setiap stasiun berkisar antara 0,0475 mg/l – 0,5770 mg/l. Nilai kadar fosfat tertinggi terdapat pada stasiun I yaitu pada kedalaman 8 meter dengan nilai sebesar 0,5770 mg/l dan terendah terdapat pada stasiun IV pada kedalaman 0 meter dengan nilai sebesar 0,0475 mg/l air. Dari data yang diperoleh, diketahui bahwa nilai rata-rata tertinggi terdapat pada stasiun I dengan nilai sebesar 0,543 mg/l dan terendah terdapat pada stasiun IV dengan nilai 0,069 mg/l. Nilai fosfat yang tinggi pada stasiun I dapat disebabkan adanya masukan air dari sungai air belerang dan sebelum penelitian terjadi hujan sehingga bahan-bahan organik masuk ke badan perairan yang meningkatkan kadar fosfat. Nilai fosfat yang rendah pada stasiun IV dapat disbabkan bahwa stasiun ini merupakan daerah yang bebas dari aktivitas sehingga tidak ada masukan bahan organik seperti fosfat.
Menurut Effendi (2003, hlm: 158 -160) sumber alami fosfor diperairan adalah pelapukan batuan mineral. Selain itu, juga berasal dari dekomposisi bahan organik. Selanjutnya, penambahan konsentrasi fosfat sangat dipengaruhi oleh adanya masukan limbah industri penduduk dan aliran sungai malalui drainase dan aliran air hujan (Alaerts, 1987, hlm: 234).
Hasil pengukuran yang dilakukan terhadap kandungan H2S, diketahui bahwa
kandungan H2S hanya terdapat pada stasiun I dengan nilai 0,0462 mg/l sedangkan
yang terdapat pada stasiun I berasal dari masukan air belerang dari pegunungan disekitarnya. Pada stasiun II, stasiun III, dan stasiun IV kadar H2S tidak terdeteksi
karena pada ketiga stasiun tersebut tidak terdapat sumber masukan air belerang.
Di perairan, sulfur berikatan dengan ion hidrogen (H+) dan oksigen (O2). Pada
pH 9, sebagian besar sulfur berada dalam bentuk ion hidrogen sulfida (HS-). Pada kondisi ini, jumlah hidrogen sulfida (H2S) sangat sedikit. Pada pH 5, sekitar 99%
sulfur terdapat dalam bentuk H2S. H2S bersifat mudah larut, toksik, dan menimbulkan
bau seperti telur busuk. Oleh karena itu, toksisitas H2S meningkat dengan penurunan
nilai pH (Effendi, 2003, hlm: 139–141).
4.2 Uji Statistik Nilai Produktivitas Primer antar Stasiun
Dari uji statistik yang telah dilakukan, maka diperoleh nilai F yang menunjukkan tingkat kesamaan atau perbedaan yang signifikan antar stasiun seperti pada tabel 4.2.
Tabel 4.2 Uji Statistik Nilai Produktivitas Primer Antar Stasiun
Sumber
Variasi Nilai Total Perlakuan
Derajat Bebas
Nilai Rata-rata
Fhitung Sig.
Antar Stasiun 28883.502 3 9627.834
1.289 0.305
Galat 149348.837 20 7467.442
Total 178232.339 23 -
Dari hasil uji analisis varian diketahui bahwa produktivitas primer antar stasiun tidak berbeda signifikan. Hal ini dapat disebabkan faktor fisik dan kimia perairan (pH, oksigen terlarut, suhu, BOD5, nitrat, dan fosfat) masih dalam kisaran
4.3. Uji Statistik Nilai Produktivitas Primer antar Kedalaman
Dari uji analisis varian yang telah dilakukan, maka diperoleh nilai F yang menunjukkan tingkat kesamaan atau perbedaan yang signifikan antar kedalaman seperti pada tabel 4.3.
Tabel 4.3 Uji Statistik Nilai Produktivitas Primer Antar Kedalaman
Sumber Variasi Nilai Total
Perlakuan
Derajat Bebas
Nilai
Rata-rata Fhitung Sig.
Antar Stasiun 29587.977 2 14793.989
2.090 0.149
Galat 148644.362 21 7078.303
Total 178232.339 23 -
Dari hasil uji analisis varian diketahui bahwa produktivitas primer antar kedalaman tidak berbeda signifikan. Hal ini dapat disebabkan faktor fisik dan kimia perairan (pH, oksigen terlarut, suhu, BOD5, nitrat, dan fosfat) masih dalam kisaran
batas toleransi yang masih mendukung bagi kehidupan fitoplankton yang melakukan fotosintesis, sehingga laju produktivitas primer antar kedalaman tidak berbeda signifikan.
4.4 Analisis Korelasi
Untuk mengetahui hubungan antar faktor fisik kimia perairan dengan produktivitas primer setiap stasiun penelitian, maka nilai dari kedua variabel ini dikorelasikan dengan menggunakan analisis korelasi Pearson yang dilakukan secara komputerisasi menggunakan SPSS 16. Hasil korelasi dari kedua variabel tersebut adalah sebagai berikut:
Tabel 4.4 Nilai Korelasi Antara Faktor Kimia dan Biologi Perairan Dengan Produktivitas Primer Dari Setiap Stasiun Penelitian
DO BOD5
Kejenuhan O2
pH Nitrat Fosfat Klorofil a Kfitoplankton
(ind/l) Produktivitas
primer -0,274 0,120 - 0,286 -0,191 0,398 0,422 0,320 0,594
Keterangan:
Dari hasil analisis korelasi diperoleh bahwa produktivitas primer berkorelasi positif terhadap BOD5, kadar nitrat, kadar fosfat, klorofil a, dan kelimpahan
fitoplankton, sedangkan DO, kejenuhan oksigen, dan pH berkorelasi negatif terhadap produktivitas primer.Nilai (+) menunjukkan adanya hubungan korelasi searah antara faktor fisik kimia air dengan produktivitas primer, yang artinya semakin tinggi nilai faktor fisik-kimia perairan, semakin tinggi pula produktivitas primer dan sebaliknya.
Menurut Sugiyono (2004, hlm: 183) koefisien korelasi dapat di bagi menjadi beberapa tingkatan seperti pada Tabel 4.5.
Tabel 4.5 Interval Koefisien dan Tingkat Hubungan untuk Korelasi Pearson
Interval Koefisien Tingkat Hubungan
0,00 – 0, 199 Sangat rendah
0,20 – 0,399 Rendah
0,40 – 0,599 Sedang
0,60 – 0,799 Kuat
0,80 – 1,000 Sangat kuat
Berdasarkan Tabel 6 dapat diketahui bahwa nilai faktor fisik-kimia peraiaran berkorelasi antara sangat rendah hingga sedang terhadap produktivitas primer. Faktor fisik-kimia yang berkorelasi sangat rendah terhadap produktivitas primer adalah BOD5 dan pH, yang berkorelasi rendah adalah oksigen terlarut (DO), kejenuhan
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian yang telah dilakukan maka diperoleh kesimpulan sebagai berikut: 1. Nilai rata-rata tertinggi produktivitas primer antar stasiun terdapat pada stasiun
I dengan nilai sebesar 237,728 mgC/m3/hari dan terendah pada stasiun IV dengan nilai sebesar 150,144 mgC/m3/hari.
2. Nilai produktivitas primer tertinggi antar kedalaman terdapat pada stasiun I di kedalaman 0 meter (permukaan) dengan nilai sebesar 300,288 mgC/m3/hari dan terendah pada stasiun IV di kedalaman 8 meter dengan nilai sebesar 75,072 mgC/m3/hari.
3. Nilai rata-rata tertinggi konsentrasi klorofil a terdapat pada stasiun II dengan nilai sebesar 5,5242 mg/m3 dan terendah terdapat pada stasiun III dengan nilai sebesar 1,4256 mg/m3.
4. Berdasarkan uji analisis varian (uji F), tidak terdapat perbedaan signifikan produktivitas primer baik antar stasiun maupun antar kedalaman.
5. Berdasarkan hasil analisis korelasi, diketahui bahwa produktivitas primer dengan faktor fisik-kimia memiliki korelasi yang berkisar antara sangat rendah hingga sedang.
5.2 Saran
1. Perlu dilakukan penelitian terhadap produktivitas primer siang dan malam hari sehingga dapat diketahui rata-rata produktivitas primer per hari.
DAFTAR PUSTAKA
Alaerts, G. & Sri, S. 1987. Metode Penelitian Air. Surabaya: Usaha Nasional.
Asdak, C. 1995. Hidrologi & Pengelolaan Daerah Aliran Sungai. Fakultas Pertanian PPSDAL. Yogyakarta:UGM Press.
Barus, T. A. 2004. Pengantar Limnologi Studi Tentang Ekosistem Sungai & Danau. Medan: USU-Press.
Campbell, Reece & Mitchell. 2000. Biologi. Edisi ke-5. Jilid ke-3. Jakarta: Erlangga. Effendi, H. 2003. Telaah Kualitas Air. Yogyakarta: Penerbit Kanisius.
Firdaus, (1995) dalam http://www.scribd.com/doc/13095034/b030107.
Kimball, J. W. 1992. Biologi Umum. Edisi ke-5. Jilid ke-2. Jakarta: Penerbit Erlangga. Mader, S. S. 1995. Biologi: Evolusi, Keanekaragaman dan Lingkungan. Malaysia:
Dewan Bahasa & Pustaka Kuala Lumpur.
Michael, P. 1984. Metode Ekologi Untuk Penyelidikan Lapangan dan Laboratorium. Penerjemah: Yanti, R. Koestoer. Jakarta: UI Press.
Monk, K. A., Yance De Fretes, Gayatri, Reksodihardjo, Lilley. 2000. Ekologi Nusa Tenggara dan Maluku. Seri Ekologi Ind. Buku V. Jakarta: Prenhallindo.
Nybakken, J. W. 1992. Biologi Laut Suatu Pendekatan Ekologis. Penerjemah: H. Muhammad Eidman. Jakarta: PT. Gramedia.
Resosoedarmo, S., Kartawanita K., Soegianto A. 1992. Pengantar Ekologi. PT. Bandung: Remaja Rosdakarya.
Romimohtarto, K. & Juwana, S. 2001. Biologi Laut Ilmu Pengetahuan Tentang Biota Laut. Jakarta: Penerbit Djambatan.
Soedarti, T., Aristiana J., Soegianto A. 2006. Diversitas Fitoplakton Pada Ekosistem Perairan Waduk Sutami, Malang. Jurnal Penelitian Hayati: 11 Jurusan Biologi FMIPA Universitas Airlangga. Surabaya: Airlangga University Press.
Soegianto, A. 2004. Metoda Pendugaan Pencemaran Perairan Dengan Indikator Biologis. Surabaya: Airlangga University Press.
Soemarwoto, I., Gandjar I., Guhardja E., Nasoetion A. H., Soemartono S. S., Somadikarta L. K. 1980. Biologi Umum 1. Jakarta: Penerbit PT. Gramedia Pustaka Utama.
Soemarwoto, O. 1994. Ekologi Lingkungan Hidup dan Pembangunan. Jakarta: Penerbit Djambatan.
Sugiyono, 2004, dalam http:// dspace.widyatama.ac.id/ bitstream/ handle / 10364 / 604 / bab3. pdf ? sequence = 5
Supriharyono. 2000. Pelestarian dan Pengelolaan Sumber Daya Alam di Wilayah Tropis. Jakarta: PT. Gramedia Pustaka Utama.
Suriawiria, U. 2005. Air Dalam Kehidupan Dan Lingkungan Yang Sehat. Bandung: P.T. Alumni.
Tarumingkeng. 2002. Hubungan Antara Klorofil a dan Ikan Pelagis dengan Kondisi Oseanografi di Perairan Utara Irian Jaya. Bogor: Institut Pertanian Bogor. Wardhana, W. A. 1995. Dampak Pencemaran Lingkungan. Yogyakarta: Andi Offset. Whitten, A. J., Sengli, J. D., Jazanul, A. & Nazaruddin, H. 1987. Ekologi Ekosistem
Sumatera. Yogyakarta: Gadjah Mada University Press.
Wibisono, M. S. 2005. Pengantar Ilmu Kelautan. Jakarta: PT. Gramedia Widiasarana Indonesia.
Lampiran A. Bagan Kerja Metode Winkler untuk Mengukur Kelarutan Oksigen (DO)
Sampel Air
1 ml MnSO4
1 ml KOH-KI dikocok didiamkan
Sampel Dengan Endapan Putih/Coklat
1 ml H2SO4
dikocok didiamkan Larutan Sampel
Berwarna Coklat
diambil sebanyak 100 ml ditetesi Na2S2O3 0,0125 N
Sampel Berwarna
Kuning Pucat
ditambahkan 5 tetes amilum Sampel Berwarna
Biru
Dititrasi dengan Na2S2O3 0,0125N
Sampel Bening
Dihitung volume Na2S2O3 yang
terpakai (= nilai DO awal) Hasil
Lampiran C. Bagan Kerja Metode Winkler untuk Mengukur BOD5
Sampel Air
Sampel Air Sampel Air
diinkubasi selama 5 hari
pada temperatur 20 0C dihitung nilai DO awal dihitung nilai DO akhir
DO Akhir DO Awal
Keterangan:
· Penghitungan nilai DO awal dan DO akhir sama dengan penghitungan nilai DO
. Nilai BOD = Nilai DO awal – Nilai DO akhir
Lampiran D. Bagan Kerja Kandungan Nitrat (NO3-)
5 ml sampel air
1 ml NaCl (dengan pipet volum) 5 ml H2SO4 75%
4 tetes Brucine Sulfat Sulfanic Acid
Larutan
Dipanaskan selama 25 menit suhu 95 oC
Larutan
Didinginkan
Diukur dengan spektrofotometer pada = 410
nm
Hasil
(Konsentrasi Nitrat)
Lampiran E. Bagan Kerja Analisis Fosfat (PO43-)
5 ml sampel air
2 ml Amstrong Reagen 1 ml Ascorbic Acid
Larutan
Dibiarkan selama 20 menit
Diukur dengan spektrofotometer pada = 880 nm
Hasil
(konsentrasi Fosfat)
Lampiran F. Bagan Kerja Pengukuran Absorban Klorofil a
1000 ml sampel air
Disaring dengan kain kasa
Hasil filtrasi
Dipindahkan ke dalam lumpang Ditambah 5 ml aseton
Digiling dengan alu
Dituang ke dalam tabung sentrifus
Dicuci kain kasa penyaring filtrat dengan 5 ml aseton Dituang ke dalam tabung sentrifus yang sama
Ekstrak aseton dalam tabung sentrifus
Didiamkan selama 0,5 – 1 jam
Disetrifus dengan kecepatan 1500 rpm/speed selama 5 menit Dituang ke dalam kuvet
Ekstrak aseton dalam kuvet
Diukur absorban klorofil a dengan spektrofotometer pada panjang gelombang 665 nm & 730 nm
Dipindahkan ke dalam tabung sentrifus
Ekstrak dalam tabung sentrifus
Ditambah 0.1 ml HCl 4 N Disentrifus selama 30 detik Dipindah ke dalam kuvet
Ekstrak dalam kuvet
Diukur absorban klorofil a dengan spektrofotometer pada panjang gelombang 665 nm & 730 nm
Lampiran G. Nilai Konsentrasi Klorofil a
Stasiun Panjang gelombang ( ) Kedalaman
Lampiran H. Nilai Oksigen Terlarut (DO) botol terang dan botol gelap setelah perendaman selama 6 jam
Stasiun I Stasiun II Stasiun III Stasiun IV
Lampiran I. Contoh Hasil Perhitungan
1. Produktivitas Primer Perairan Pada Stasiun I Kedalaman 0 meter (Permukaan) PG = 6,6 – 6,2 = 0,4
R = 6,3 – 6,2 = 0,1
PN = 0,4 – 0,1 = 0,3 x 375,36 = 112,608 mg C/m3
Hasil di atas merupakan nilai produktivitas primer selama 6 jam. Karna lama penyinaran matahari dalam 1 hari adalah selama 12 jam, maka untuk memperoleh nilai produktivitas primer per hari nilai di atas harus dikali dua.
PN = 112,608 mg C/m3 x 2 = 225,216 mg C/m3
2. Konsentrasi Klorofil a Pada Stasiun I Kedalaman 0 meter (Permukaan) Kons. Klorofil a = (11.0).( 2,43).(0,017-0,002).(10 ml/ 10 m3) / 1