Lampiran 1.
Lampiran 3. Serbuk Simplisia Rumput Laut Gracilaria verrucosa (Hudson) Papenfus
Gambar 2. Serbuk Simplisia Rumput Laut Gracilaria verrucosa (Hudson) Papenfus
dengan Proses Pemutihan
Gambar 3. Serbuk Simplisia Rumput Laut Gracilaria verrucosa (Hudson) Papenfus
Lampiran 4.
Lampiran 5.
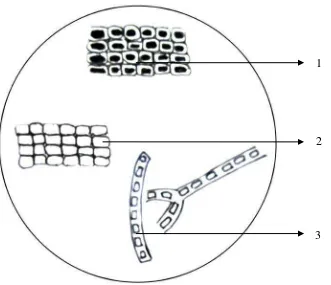
Gambar 5. Mikroskopik Serbuk Simplisia Rumput Laut Gracilaria verrucosa (Hudson) Papenfus pada Pembesaran 10 x 40
Keterangan : 1. Sel parenkim berisi pigmen merah 2. Sel parenkim
3. Sel propagule
1
2
Lampiran 6. Perhitungan Penetapan Kadar Air Simplisia Rumput Laut Gracilaria
verrucosa (Hudson) Papenfus
a. Berat sampel = 5,014 g Volume air = 0,4 ml
b. Berat sampel = 5,045 g Volume air = 0,4 ml
Lampiran 7. Perhitungan Penetapan Kadar Sari yang Larut dalam Air Simplisia Rumput Laut Gracilaria verrucosa (Hudson) Papenfus
a. Berat simplisia = 5, 021 g
Berat sari = 0,039 g
b. Berat simplisia = 5,041 g
Berat sari = 0,033 g
c. Berat simplisia = 5,038 g
Berat sari = 0,031 g
Lampiran 8. Perhitungan Penetapan Kadar Sari yang Larut dalam Etanol Simplisia Rumput Laut Gracilaria verrucosa (Hudson) Papenfus
a. Berat simplisia = 5, 023 g
Berat sari = 0,013 g
b. Berat simplisia = 5,048 g
Berat sari = 0,007 g
c. Berat simplisia = 5,027 g
Berat sari = 0,008 g
Lampiran 9. Perhitungan Penetapan Kadar Abu Total Simplisia Rumput Laut Gracilaria verrucosa (Hudson) Papenfus
a. Berat simplisia = 2, 006 g
Berat abu = 0,158 g
b. Berat simplisia = 2,024 g
Berat abu = 0,165 g
3. Berat simplisia = 2,014 g
Lampiran 10. Perhitungan Penetapan Kadar Abu yang Tidak Larut Asam Simplisia Rumput Laut Gracilaria verrucosa (Hudson) Papenfus
a. Berat simplisia = 2, 006 g
Berat abu = 0,016 g
b. Berat simplisia = 2,024 g
Berat abu = 0,019 g
c. Berat simplisia = 2,014 g
Berat abu = 0,016 g
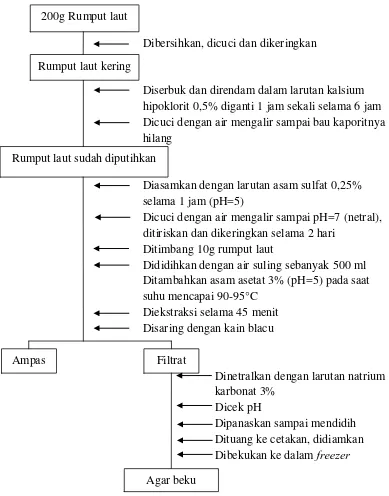
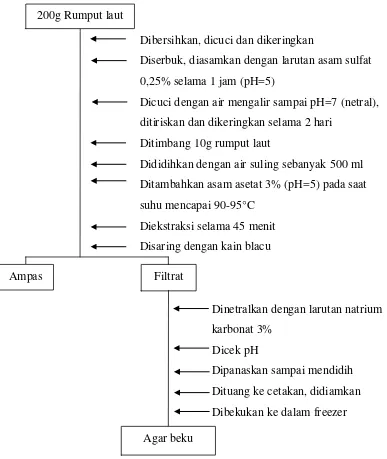
Lampiran 11. Bagan Isolasi Agar dengan Proses Pemutihan
Dibersihkan, dicuci dan dikeringkan
Diserbuk dan direndam dalam larutan kalsium hipoklorit
Dicuci dengan air mengalir sampai bau kaporitnya hilang
0,5% diganti 1 jam sekali selama 6 jam
Diasamkan dengan larutan asam sulfat 0,25% selama 1 jam (pH=5)
Dicuci dengan air mengalir sampai pH=7 (netral), ditiriskan dan dikeringkan selama 2 hari
Ditimbang 10g rumput laut
Dididihkan dengan air suling sebanyak 500 ml Ditambahkan asam asetat 3% (pH=5) pada saat suhu mencapai 90-95°C
Diekstraksi selama 45 menit Disaring dengan kain blacu
Dinetralkan dengan larutan natrium karbonat 3%
Dipanaskan sampai mendidih Dicek pH
Dituang ke cetakan, didiamkan Dibekukan ke dalam freezer
Gambar 6. Bagan Isolasi Agar dengan Proses Pemutihan 200g Rumput laut
Rumput laut kering
Rumput laut sudah diputihkan
Ampas Filtrat
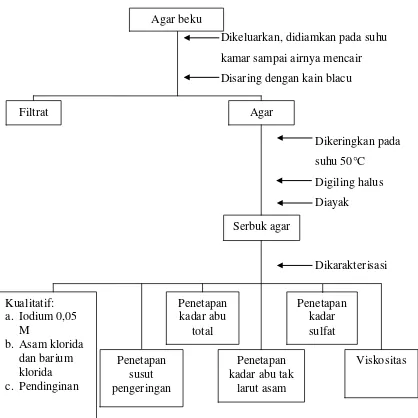
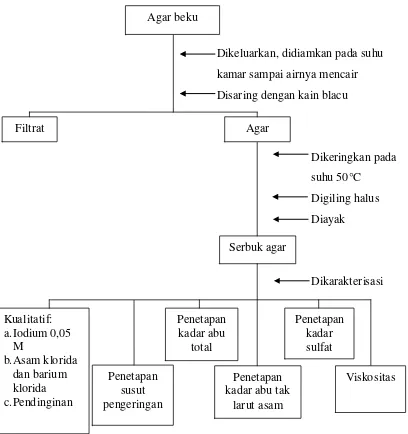
Lampiran 11. (Lanjutan) Bagan Isolasi Agar dengan Proses Pemutihan
Dikeluarkan, didiamkan pada suhu kamar sampai airnya mencair Disaring dengan kain blacu
Dikeringkan pada suhu 50°C
Digiling halus Diayak
Dikarakterisasi
Lampiran 12. Perhitungan Rendemen Agar dengan Proses Pemutihan
I. Bobot sampel mula-mula = 10,013 g Bobot hasil ekstraksi = 2,609 g
II. Bobot sampel mula-mula = 10,003 g Bobot hasil ekstraksi = 2,987 g
III. Bobot sampel mula-mula = 10,026 g Bobot hasil ekstraksi = 3,066 g
IV. Bobot sampel mula-mula = 10,002 g Bobot hasil ekstraksi = 3,085 g
Lampiran 12. (Lanjutan) Perhitungan Rendemen Agar dengan Proses Pemutihan
VI. Bobot sampel mula-mula = 10,011 g Bobot hasil ekstraksi = 3,339 g
Lampiran 13. Bagan Isolasi Agar tanpa Proses Pemutihan
Dibersihkan, dicuci dan dikeringkan
Diserbuk, diasamkan dengan larutan asam sulfat 0,25% selama 1 jam (pH=5)
Dicuci dengan air mengalir sampai pH=7 (netral), ditiriskan dan dikeringkan selama 2 hari
Ditimbang 10g rumput laut
Dididihkan dengan air suling sebanyak 500 ml Ditambahkan asam asetat 3% (pH=5) pada saat suhu mencapai 90-95°C
Diekstraksi selama 45 menit Disaring dengan kain blacu
Dinetralkan dengan larutan natrium karbonat 3%
Dipanaskan sampai mendidih Dicek pH
Dituang ke cetakan, didiamkan Dibekukan ke dalam freezer
Gambar 8. Bagan Isolasi Agar tanpa Proses Pemutihan
Ampas Filtrat
Lampiran 13. (Lanjutan) Bagan Isolasi Agar tanpa Proses Pemutihan
Dikeluarkan, didiamkan pada suhu kamar sampai airnya mencair Disaring dengan kain blacu
Dikeringkan pada
Lampiran 14. Perhitungan Rendemen Agar tanpa Proses Pemutihan
I. Bobot sampel mula-mula = 10,001 g Bobot hasil ekstraksi = 2,656 g
II. Bobot sampel mula-mula = 10,002 g Bobot hasil ekstraksi = 2,950 g
III. Bobot sampel mula-mula = 10,001 g Bobot hasil ekstraksi = 3,069 g
IV. Bobot sampel mula-mula = 10,004 g Bobot hasil ekstraksi = 3,072 g
Lampiran 14. (Lanjutan) Perhitungan Rendemen Agar tanpa Proses Pemutihan
VI. Bobot sampel mula-mula = 10,009 g Bobot hasil ekstraksi = 3,318 g
Lampiran 15. Serbuk Agar Hasil Isolasi
Gambar 10. Serbuk Agar Hasil Isolasi dengan Proses Pemutihan
Lampiran 16. Hasil Identifikasi Agar Hasil Isolasi
I. Menggunakan Pereaksi Iodium 0,05 M a. Agar dengan Proses Pemutihan
A B
b. Agar Tanpa Proses Pemutihan
C D
Lampiran 16. (Lanjutan) Hasil Identifikasi Agar Hasil Isolasi
II. Menggunakan Pereaksi Asam Klorida dan Barium Klorida a. Agar dengan Proses Pemutihan
b. Agar Tanpa Proses Pemutihan
A B
C D
Keterangan : A dan C: Sebelum pemberian pereaksi asam klorida dan barium klorida
Lampiran 16. (Lanjutan) Hasil Identifikasi Agar Hasil Isolasi
III.Metode Pendinginan
a. Agar dengan Proses Pemutihan
A
b. Agar Tanpa Proses Pemutihan
Lampiran 17. Perhitungan Penetapan Susut Pengeringan Agar Hasil Isolasi dengan Proses Pemutihan
Keterangan:
W1 = Bobot botol timbang dan sampel sebelum pengeringan dikurangi bobot botol timbang
W2 = Bobot botol timbang dan sampel setelah pengeringan dikurangi bobot botol timbang
I. W1 = 0,516 g W2 = 0,471 g
II. W1 = 0,509 g W2 = 0,465 g
Lampiran 18. Perhitungan Penetapan Susut Pengeringan Agar Hasil Isolasi tanpa Proses Pemutihan
Keterangan:
W1 = Bobot botol timbang dan sampel sebelum pengeringan dikurangi bobot botol timbang
W2 = Bobot botol timbang dan sampel setelah pengeringan dikurangi bobot botol timbang
I. W1 = 0,523 g W2 = 0,477 g
II. W1 = 0,526 g W2 = 0,483 g
Lampiran 19. Perhitungan Penetapan Kadar Abu Total Agar Hasil Isolasi dengan Proses Pemutihan
I. Berat abu = 0,026g
Berat sampel = 0,554g
II. Berat abu = 0,025 g
Berat sampel = 0,550g
III. Berat abu = 0,026g
Lampiran 20. Perhitungan Penetapan Kadar Abu Total Agar Hasil Isolasi tanpa Proses Pemutihan
I. Berat abu = 0,025g
Berat sampel = 0,531g
II. Berat abu = 0,023g
Berat sampel = 0,511g
III. Berat abu = 0,026g
Lampiran 20 . Perhitungan Penetapan Kadar Abu Tak Larut Asam Agar Hasil Isolasi dengan Proses Pemutihan
I. Berat abu = 0,003g
Berat sampel = 0,554g
II. Berat abu = 0,002g
Berat sampel = 0,550g
III. Berat abu = 0,003g
Berat sampel = 0,536g
Lampiran 21. Perhitungan Penetapan Kadar Abu Tak Larut Asam Agar Hasil Isolasi tanpa Proses Pemutihan
I. Berat abu = 0,003g
Berat sampel = 0,532g
II. Berat abu = 0,003g
Berat sampel = 0,550g
III. Berat abu = 0,003g
Berat sampel = 0,557g
Lampiran 22. Perhitungan Penetapan Kadar Sulfat Agar Hasil Isolasi dengan Proses Pemutihan
I. Berat abu = 0,024g
Berat sampel = 1,007g
II. Berat abu = 0,024g
Berat sampel = 1,010g
III. Berat abu = 0,025g
Lampiran 23. Perhitungan Penetapan Kadar Sulfat Agar Hasil Isolasi tanpa Proses Pemutihan
I. Berat abu = 0,025g
Berat sampel = 1,026g
II. Berat abu = 0,028g
Berat sampel = 1,043g
III. Berat abu = 0,027g
Lampiran 24. Perhitungan Viskositas Agar Hasil Isolasi dengan Proses Pemutihan
Nomor spindel = 1 atau 61
Kecepatan = 12
Faktor = 5
Viskositas (dalam centipoise (Cps)) = Pembacaan x Faktor
I. Pembacaan = 2
Faktor = 5
Viskositas = 2 x 5 = 10 Cps II. Pembacaan = 2
Faktor = 5
Viskositas = 2 x 5 = 10 Cps III. Pembacaan = 2
Faktor = 5
Lampiran 25. Perhitungan Viskositas Agar Hasil Isolasi tanpa Proses Pemutihan
Nomor spindel = 1 atau 61
Kecepatan = 12
Faktor = 5
Viskositas (dalam centipoise (Cps)) = Pembacaan x Faktor
I. Pembacaan = 2
Faktor = 5
Viskositas = 2 x 5 = 10 Cps II. Pembacaan = 2
Faktor = 5
Viskositas = 2 x 5 = 10 Cps III. Pembacaan = 2
Faktor = 5
Lampiran 26. Bagan Pengujian Pertumbuhan Bakteri
Diambil dengan jarum ose
Disuspensikan dalam 10 ml larutan Nutrient Broth Diukur kekeruhan larutan pada panjang gelombang 580 nm sampai diperoleh transmitan 25%
Dipipet 0,1 m l ke dalam cawan petri
Dituang 15 ml NA steril cair (±45°C), dihomogenkan,
dibiarkan memadat
Diinkubasi pada suhu 35°C selama 18-24 jam
Diamati homogenitas pertumbuhannya pada cawan petri
Dicuci kaca objek dengan alkohol 70%, difiksasi Diteteskan 1 tetes akuades pada kaca objek Diambil koloni bakteri hasil inkubasi dari cawan petri dengan jarum ose steril, disuspensikan, difiksasi
Ditambahkan 1 tetes gentian violet
Ditambahkan 1 tetes larutan lugol, diratakan, difiksasi
Dicuci kaca objek dengan alkohol 70% sampai tetesan terakhir tidak berwarna, dikeringkan
Ditetesi 1 tetes safranin, biarkan 15-30 detik, dicuci larutan safranin dengan akuades steril, difiksasi Ditetesi dengan 1 tetes minyak imersi
Diamati di bawah mikroskop pada pembesaran 100x
Lampiran 27. Hasil Pengujian Pertumbuhan Bakteri Staphylococcus aureus
A B
C D
E F
Keterangan : A & B : Media Nutrient Agar Standar
C & D : Media agar dengan proses pemutihan dan nutrient broth (F1
E & F : Media agar dengan proses pemutihan dan beef powderserta peptone (F
)
Lampiran 27. (Lanjutan) Hasil Pengujian Pertumbuhan Bakteri Staphylococcus aureus
G H
I J
Keterangan : G & H : Media agar tanpa proses pemutihan dan nutrient broth (F3
I & J : Media agar tanpa proses pemutihan dan beef )
powder serta peptone (F4)
Lampiran 28. Hasil Pengujian Pertumbuhan Bakteri Eschericia coli
A B
C D
E F
Keterangan : A & B : Media Nutrient Agar Standar
C & D : Media agar dengan proses pemutihan dan nutrient broth (F1
E & F : Media agar dengan proses pemutihan dan beef powder serta peptone (F
)
Lampiran 28. (Lanjutan) Hasil Pengujian Pertumbuhan Bakteri Eschericia coli
G H
I J
Keterangan : G & H : Media agar tanpa proses pemutihan dan nutrient broth (F3
I & J : Media agar tanpa proses pemutihan dan beef )
Lampiran 29. Hasil Pewarnaan Gram dan Pengamatan Bakteri Staphylococcus aureus secara Mikroskopik
A B
C D
E F
Keterangan : A & B : Media Nutrient Agar Standar
C & D : Media agar dengan proses pemutihan dan nutrient Broth (F1
E & F : Media agar dengan proses pemutihan dan beef powder serta peptone (F
)
Lampiran 29. (Lanjutan) Hasil Pewarnaan Gram dan Pengamatan Bakteri Staphylococcus aureus secara Mikroskopik
G H
I J
Keterangan : G & H : Media agar tanpa proses pemutihan dan nutrient broth (F3
I & J : Media agar tanpa proses pemutihan dan beef )
Lampiran 30. Hasil Pewarnaan Gram dan Pengamatan Bakteri Eschericia coli secara Mikroskopik
A B
C D
E F
Keterangan : A & B : Media Nutrient Agar Standar
C & D : Media agar dengan proses pemutihan dan nutrient broth (F1
E & F : Media agar dengan proses pemutihan dan beef )
DAFTAR PUSTAKA
Abdullah, A. (2004). Pengaruh Penambahan Khitosan terhadap Mutu Agar Bakto. Skripsi. Fakultas Perikanan dan Ilmu Kelautan IPB. Bogor.
Anggadiredja, J.T., Zatnika A., Purwoto, H., dan Istini, S. (2006). Rumput Laut. Jakarta: Penebar Swadaya. Hal. 48-52.
Angkasa, W.I., Purwoto, H., dan Anggadiredja, J.T. (2011). Teknik Budidaya Rumput Laut. Rumput Laut. Tanggal akses: 18 Juli 2014.
Armisen, R. and Galatas, F. (2000). Agar in Hand Book of Hydrocolloid. Cambridge: Woodhead Publishing Limited. Hal. 33-37.
Aslan, L.M. (1998). Budidaya Rumput Laut. Yogyakarta: Penerbit Kanisius. Hal. 11-19.
Beisher, L. (1991). Microbiology in Practice. A self Instructional Laboratory Course. New York: Ed Harper Collins Publisher. Hal. 31.
Dawes, C.J. (1981). Marine Botany. Florida: A Wiley Interscience Publication. Hal. 41, 213.
Distantina, S., Devinta, R.A. dan Lidya, E.F. (2008). Pengaruh Konsentrasi dan Jenis Larutan Perendaman terhadap Kecepatan Ekstraksi dan Sifat Gel Agar-Agar dari Rumput Laut Gracilaria verrucosa. Jurnal Rekayasa Proses. Tanggal akses: 24 Desember 2013.
Distantina, S., Fadilah, Rochmadi, Fahrurrozi, M., dan Wiratni. (2010). Proses Ekstraksi Karagenan dari Eucheuma cottonii. Rekayasa Kimia dan Proses. Tanggal akses: 24 Desember 2013.
Depkes RI. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 657, 712, 746.
Depkes RI. (1995). Farmakope Indonesia. Edisi Keempat. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 69, 848, 1124.
Ditjen POM. (1978). Materia Medika Indonesia. Jilid II. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 150-156.
Dwidjoseputro. (1998). Dasar-Dasar Mikrobiologi. Jakarta: Penerbit D. Jambatan. Hal. 35-38.
Irawati, A. (1994). Pengaruh Jumlah Air dan Waktu Ekstraksi terhadap Rendemen dan Mutu Tepung Agar-Agar dari Rumput Laut Gracilaria sp. Skripsi. Program Studi Pengolahan Hasil Perikanan Fakultas Perikanan IPB. Tanggal akses: 1 April 2014.
Irianto, K. (2006). Mikrobiologi Menguak Dunia Mikroorganisme. Jilid Satu. Bandung: Penerbit Yrama Widya. Hal. 16-18, 21-22.
Jawetz, E. (1986). Mikrobiologi untuk Profesi Kesehatan. Edisi XVI. Diterjemahkan oleh Gerard Bonang. Jakarta: EGC Press. Hal. 336-384. Jawetz, E., Menick, J.L., dan Adelberg, E.A. (2001). Mikrobiologi Kedokteran.
Edisi Kedua puluh. Jakarta: Penerbit ECG. Hal. 211, 249
Junaidi, R. (2006). Kajian Penggunaan NaOCl dan Kaporit pada Pemucatan Natrium Alginat dari Rumput Laut Cokelat (Sargassum polycystum). Skripsi. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Tanggal akses: 3 Maret 2014.
Kadi, A. (2004). Potensi Rumput Laut di Beberapa Perairan Pantai Indonesia. Oseana. 29 (4) : 25 – 26.
Lay, B.W. (1996). Analisis Mikroba di Laboratorium. Jakarta: Raja Grafindo Persada. Hal. 57-58, 109.
Melliawati, R. (2009). Eschericia coli dalam Kehidupan Manusia. Bio Trends. 4:1. Tanggal akses: 19 Mei 2014
Murdinah, Dina, F., dan Subaryono. (2008). Pembuatan Bakto Agar dari Rumput Laut Gelidium rigidum untuk Media Tumbuh bagi Mikroorganisme. Jurnal Pascapanen dan Bioteknologi Kelautan dan Perikanan. 1 : 3. Tanggal akses: 9 November 2013.
Murdinah, Siti, N.K.A, Nurhayati dan Subaryono. (2012). Membuat Agar dari Rumput Laut Gracilaria sp. Jakarta: Penebar Swadaya. Hal. 12, 21, 24-27. Oxoid. (1998). The Oxoid Manual. Edisi 8. Hal. 179. Tanggal akses: 28 Agustus
2014.
Pelczar, M.J., dan Chan, E.C.S. (2006). Dasar-Dasar Mikrobiologi. Jakarta: Penerbit UI Press. Hal. 138-140.
Pratiwi, S.T. (2008). Mikrobiologi Farmasi. Yogyakarta: Penerbit Erlangga. Hal: 18, 106-108, 112-114, 144.
Pusat Penelitian dan Pengembangan Perikanan. (1991). Teknologi Pasca Panen Rumput Laut. Jakarta: Departemen Kelautan. Hal. 111.
Ramadhani, A. (2012). Karakterisasi Simplisia dan Isolasi serta Identifikasi Agar-Agar dari Rumput Laut Gracilaria verrucosa (Hudson) Papenfus. Skripsi. Medan: Fakultas Farmasi USU.
Romimohtarto, K., dan Juwana, S. (2001). Biota Laut: Ilmu Pengetahuan Tentang Biota Laut. Jakarta: Penerbit Djambatan. Hal. 410.
Stanier, R.Y., Adelberg, E.A. dan Ingraham, J.L. (1982). Dunia Mikroba I. Penerjemah: Agustin Wydia. Jakarta: Penerbit Bhratara Karya Aksara. Hal. 23-25.
Trono, G.C., dan Ganzon, F.E.T. (1988). Philippine Seaweeds. Manila: National Book Store, Inc. Hal. 174-175.
WHO. (1992). Quality Control Methods for Medicinal Plant Materials. Geneva: World Health Organization. Hal. 31.
BAB III
METODE PENELITIAN
Metode penelitian yang dilakukan adalah metode eksperimental. Tahap penelitian meliputi karakterisasi simplisia; isolasi agar; karakterisasi agar yaitu uji kualitatif, penetapan susut pengeringan, penetapan kadar abu total, penetapan kadar abu tak larut asam, penetapan kadar sulfat, nilai viskositas; pembuatan media pertumbuhan bakteri, pengujian mikrobiologi yaitu dengan uji kualitatif untuk melihat homogenitas pertumbuhannya di cawan petri dengan teknik penuangan pada bakto agar hasil isolasi yang dibandingkan dengan bakto agar komersial dengan menumbuhkan bakteri Staphylococcus aureus dan bakteri Eschericia coli dengan penambahan nutrient broth dan beef powder serta peptone, pewarnaan Gram dan pengamatan mikroskopik bakteri. Penelitian dilakukan di Laboratorium Farmakognosi, Laboratorium Mikrobiologi, Laboratorium Farmasi Fisik, Fakultas Farmasi, Universitas Sumatera Utara.
3.1 Alat-Alat
pipet mikro, seperangkat alat destilasi penetapan kadar air, spatula dan termometer.
3.2 Bahan-Bahan
Bahan-bahan yang digunakan pada penelitian ini adalah talus rumput laut Gracilaria verrucosa (Hudson) Papenfus, air suling, asam asetat, asam klorida, asam sulfat, bakteri Eschericia coli (ATCC 25922), bakteri Staphylococcus aureus
(ATCC 25923), barium klorida, beef powder, etanol 70%, etanol 96%, gentian violet, hidrogen peroksida, iodium, kalsium hipoklorit, minyak imersi, natrium karbonat, Nutrient Agar (Oxoid), nutrient broth, peptone, safranin dan toluene.
3.3 Penyiapan Simplisia
3.3.1 Pengumpulan Bahan Tumbuhan
Pengumpulan bahan dilakukan secara purposif yaitu tanpa membandingkan dengan tumbuhan dari daerah lain. Bahan tumbuhan yang digunakan adalah talus rumput laut Gracilaria verrucosa (Hudson) Papenfus yang diperoleh dari tambak Bapak Rusdi Agin, desa Sei Meran, dusun Sei Tiram, kecamatan Pangkalan Susu, kabupaten Langkat, provinsi Sumatera Utara dan dilakukan pada bulan Juli 2013. Gambar talus segar rumput laut dapat dilihat pada Lampiran 1, halaman 58.
3.3.2 Identifikasi Bahan Tumbuhan
Gracilaria verrucosa (Hudson) Papenfus. Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 2, halaman 59.
3.3.3 Pembuatan Simplisia Rumput Laut
Sampel yang telah diperoleh, dibersihkan dari kotoran dan sisa-sisa karang yang melekat lalu dicuci dengan air mengalir sampai bersih, ditiriskan dan ditimbang beratnya. Sampel dikeringkan, di lemari pengering hingga kering, dimana jika simplisia tersebut diremas akan hancur, kemudian ditimbang sebagai berat kering. Berat kering adalah 660 g. Simplisia diblender sampai menjadi serbuk, kemudian serbuk simplisia disimpan dalam kantung plastik. Gambar serbuk simplisia dapat dilihat pada Lampiran 3, halaman 60.
3.4 Pembuatan Pereaksi (Depkes RI, 1979) 3.4.1 Larutan Asam Asetat 3% (v/v)
Larutan asam asetat sebanyak 3 ml dicampurkan ke dalam air suling, dicukupkan sampai 100ml.
3.4.2 Larutan Asam Klorida 0,2 N (v/v)
Larutan asam klorida 12 N sebanyak 1,66 ml dicampurkan ke dalam air suling, dicukupkan sampai 100ml.
3.4.3 Larutan Asam Sulfat 0,25% (v/v)
Larutan asam sulfat sebanyak 2,5 ml dicampurkan ke dalam air suling, dicukupkan sampai 1000ml.
3.4.4 Larutan Barium Klorida 6,1% (b/v)
3.4.5 Larutan Iodium 0,05 M
Iodium sebanyak 6,345 g dilarutkan dalam larutan 9 g kalium iodida yang telah dicampur dalam 100ml air suling, lalu diencerkan dengan air suling dicukupkan sampai 1000ml.
3.4.6 Larutan Hidrogen Peroksida 10% (v/v)
Larutan hidrogen peroksida 50% dilarutkan ke dalam air suling dicukupkan sampai 500ml.
3.4.7 Larutan Kalsium Hipoklorit 0,5% (v/v)
Kalsium hipoklorit sebanyak 5 g dilarutkan ke dalam air suling dicukupkan sampai 1000ml.
3.4.8 Larutan Natrium Karbonat 3% (b/v)
Natrium karbonat sebanyak 3 g dilarutkan ke dalam air suling dicukupkan sampai 100ml.
3.5 Pemeriksaan Karakteristik Simplisia 3.5.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik simplisia dilakukan dengan mengamati bentuk talus, bentuk percabangan dan warna talus. Gambar simplisia dapat dilihat pada Lampiran 4, halaman 61.
3.5.2 Pemeriksaan Mikroskopik
3.5.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen). Alat terdiri dari labu alas bulat 500ml, alat penampung, pendingin, tabung penyambung dan tabung penerima.
Cara penetapan:
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu alas bulat, didestilasi selama 2 jam. Toluen didinginkan dan volume air pada tabung penerima dibaca. Sebanyak 5 gram serbuk simplisia yang telah ditimbang seksama dimasukkan ke dalam labu, lalu dipanaskan hati-hati selama 15 menit. Toluen yang mulai mendidih, kecepatan tetesannya diatur, kurang lebih 2 tetes tiap detik, hingga sebagian besar air tersuling. Kecepatan penyulingan dinaikkan hingga 4 tetes tiap detik. Toluen yang telah 2 jam didestilasi, dibiarkan mendingin, bagian dalam pendingin dibilas dengan toluen yang telah dijenuhkan. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin sampai suhu kamar. Air dan toluen telah memisah sempurna, selanjutnya volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO,1992). Perhitungan kadar air dapat dilihat pada Lampiran 6, halaman 63.
3.5.4 Penetapan Kadar Sari yang Larut dalam Air
dan ditara. Sisa dipanaskan pada suhu 105ºC sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan (Depkes RI, 1995). Perhitungan kadar sari yang larut dalam air dapat dilihat pada Lampiran 7, halaman 64.
3.5.5 Penetapan Kadar Sari yang Larut dalam Etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100ml etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105 ºC sampai bobot tetap. Kadar dalam persen sari yang larut dalam etanol 96% dihitung terhadap bahan (Depkes RI, 1995). Perhitungan kadar sari larut dalam etanol dapat dilihat pada Lampiran 8, halaman 65.
3.5.6 Penetapan Kadar Abu Total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama dimasukan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pijaran dilakukan pada suhu 600ºC selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995). Perhitungan kadar abu total dapat dilihat pada Lampiran 9, halaman 66. 3.5.7 Penetapan Kadar Abu Tak Larut dalam Asam
asam dihitung terhadap bahan (Depkes RI, 1995). Perhitungan kadar abu tidak larut asam dapat dilihat pada Lampiran 10, halaman 67.
3.6 Isolasi Agar dengan Proses Pemutihan
Metode isolasi agar dari rumput laut dilakukan melalui tahap-tahap berikut (Ramadhani, 2012):
3.6.1 Tahap Praekstraksi
Praekstraksi meliputi 2 tahap yaitu pemutihan dan pengasaman.
Caranya : rumput laut yang sudah kering diblender, kemudian direndam dalam larutan kalsium hipoklorit 0,5% sambil berkali-kali diaduk dan larutan kalsium hipoklorit diganti 1 jam sekali selama 6 jam, kemudian dicuci bersih dengan air yang mengalir sampai bau kalsium hipoklorit hilang, ditiriskan dan dikeringkan di oven selama dua hari. Rumput laut yang telah kering, diasamkan dengan larutan asam sulfat 0,25% selama satu jam lalu dicuci dengan air mengalir. Pencucian dilakukan sampai pH = 7 (pH netral) lalu ditiriskan, kemudian dikeringkan di lemari pengering selama dua hari sampai benar-benar kering.
3.6.2 Tahap Ekstraksi
Ekstraksi menggunakan perlakuan pH dan waktu yang optimal dari penelitian sebelumnya yaitu pH = 5 dan waktu ekstraksi selama 45 menit.
Hasil ekstraksi disaring dengan kain blacu dan diperas secara perlahan-lahan. Ampas dibuang dan filtrat ditampung dalam gelas beker, lalu segera dinetralkan dengan penambahan natrium karbonat 3%. Pengecekan pH dilakukan dengan menggunakan indikator universal. Filtrat dipanaskan sampai mendidih kemudian dituang ke dalam cetakan. Agar yang berada di dalam cetakan didiamkan beberapa menit hingga memadat, kemudian dibekukan selama 7 jam dalam freezer.
3.6.4 Tahap Pengeringan dan Penggilingan
Agar yang telah beku dikeluarkan dan dibiarkan pada suhu kamar sampai air mencair lalu diperas dengan kain blacu secara perlahan-lahan. Air perasan dibuang sedangkan agar diletakkan di atas aluminium foil dan dikeringkan dalam oven pada suhu 50ºC. Agar yang telah kering akan berupa lembaran-lembaran, kemudian dipotong-potong dan digiling dengan blender, lalu diayak. Berat agar ditimbang dan dimasukkan ke dalam wadah. Bagan isolasi agar dapat dilihat pada Lampiran 11, halaman 68 dan 69. Perhitungan rendemen agar dapat dilihat pada Lampiran 12, halaman 70 dan 71.
3.7 Isolasi Agar tanpa Proses Pemutihan
Metode isolasi agar dari rumput laut dilakukan melalui tahap-tahap berikut (Ramadhani, 2012):
3.7.1 Tahap Praekstraksi
Praekstraksi meliputi 1 tahap yaitu pengasaman.
3.7.2 Tahap Ekstraksi
Ekstraksi menggunakan perlakuan pH dan waktu yang optimal dari penelitian sebelumnya yaitu pH = 5 dan waktu ekstraksi selama 45 menit.
Caranya : serbuk simplisia rumput laut ditimbang sebanyak 10 g, dimasukkan dalam gelas beker, ditambahkan air suling sebanyak 500ml lalu didihkan di atas hot plate. Asam asetat 3% ditambahkan pada saat mendidih (suhu 90-100ºC) untuk memperoleh pH 5, diekstraksi selama 45 menit. Percobaan dilakukan sebanyak dua kali. Pengecekan pH dilakukan dengan menggunakan indikator universal. Pada proses ekstraksi dilakukan pengadukan setiap 10 menit.
3.7.3 Tahap Pencetakan dan Pendinginan
Hasil ekstraksi disaring dengan kain blacu dan diperas secara perlahan-lahan. Ampas dibuang dan filtratnya ditampung dalam gelas beker, lalu segera dinetralkan dengan penambahan natrium karbonat 3%. Pengecekan pH dilakukan dengan menggunakan indikator universal. Filtrat dipanaskan sampai mendidih kemudian dituang ke dalam cetakan. Agar yang berada di dalam cetakan didiamkan beberapa menit hingga memadat, kemudian dibekukan selama 7 jam dalam freezer.
3.7.4 Tahap Pengeringan dan Penggilingan
Lampiran 13, halaman 72 dan 73. Perhitungan rendemen agar dapat dilihat pada Lampiran 14, halaman 74 dan 75.
3.8 Pemeriksaan Karakteristik Agar 3.8.1 Pemeriksaan Organoleptis
Pemeriksaan agar hasil isolasi secara organoleptis meliputi bentuk/konsistensi, warna dan bau yang diamati secara visual. Gambar serbuk agar dapat dilihat pada Lampiran 15, halaman 76.
3.8.2 Identifikasi Agar Hasil Isolasi secara Kualitatif
Pemeriksaan agar yang telah diperoleh diidentifikasi secara kualitatif sebagai berikut (Depkes RI, 1995):
a. Serbuk agar sebanyak 100 mg dilarutkan ke dalam 50 ml air suling dan dipanaskan, dibiarkan sampai dingin pada suhu kamar. Sebanyak 1 ml diambil dari larutan ini dan ditambahkan 3 ml air suling dan iodium 0,05 M sehingga terjadi warna coklat diantara kedua lapisan cairan. Larutan akan berwarna kuning pucat jika cairan dikocok.
b. Serbuk agar sebanyak 100 mg dilarutkan ke dalam 50 ml air suling dan dipanaskan, dibiarkan sampai dingin pada suhu kamar. Sebanyak 5 ml diambil, dilarutkan dalam 0,5 ml asam klorida dan dipanaskan di atas penangas air selama 30 menit, lalu ditambahkan 1 ml barium klorida
tangas air, tidak mencair pada suhu dibawah 80ºC. Hasil uji kualitatif dapat dilihat pada Lampiran 16, halaman 77-79.
3.8.3 Penetapan Susut Pengeringan Agar Hasil Isolasi
Sebanyak 1 g serbuk agar ditimbang seksama dalam botol timbang dangkal bertutup yang sebelumnya telah dipanaskan pada suhu 105ºC selama 30 menit dan telah ditara. Zat diratakan dalam botol timbang hingga merupakan lapisan setebal 5-10 mm, dimasukkan ke dalam lemari pengering, tutupnya dibuka lalu dikeringkan pada suhu 105ºC hingga bobot tetap. Botol dibiarkan dalam keadaan tertutup mendingin sebelum setiap pengeringan di dalam eksikator hingga suhu kamar. Susut pengeringan dihitung terhadap bahan awal (Ditjen POM, 1978). Perhitungan susut pengeringan dapat dilihat pada Lampiran 17 dan 18, halaman 80 dan 81.
3.8.4 Penetapan Kadar Abu Total Agar Hasil Isolasi
Sebanyak 2 g serbuk agar yang telah digerus dan ditimbang seksama dimasukan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pijaran dilakukan pada suhu 600ºC selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan (Depkes RI, 1995). Perhitungan penetapan kadar abu total dapat dilihat pada Lampiran 19 dan 20, halaman 82 dan 83.
3.8.5 Penetapan Kadar Abu Tak Larut Asam Agar Hasil Isolasi
asam dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995). Perhitungan penetapan kadar abu tak larut asam dapat dilihat pada Lampiran 21 dan 22, halaman 84 dan 85.
3.8.6 Penetapan Kadar Sulfat Agar Hasil Isolasi
Menurut Pusat Penelitian dan Pengembangan Perikanan (1991), kadar sulfat ditentukan dengan cara sebagai berikut: serbuk agar ditimbang sebanyak 1 g dan dimasukkan ke dalam erlenmeyer, kemudian ditambahkan 50 ml asam klorida 0,2 N kemudian direfluks selama 1 jam. Sebanyak 20 ml larutan hidrogen peroksida 10% ditambahkan dan refluks dilanjutkan selama 5 jam sampai larutan benar-benar jernih. Larutan kemudian dipindahkan ke dalam gelas beker dan dipanaskan sampai mendidih sambil terus diaduk. Sebanyak 10 ml barium klorida
3.8.7 Viskositas Agar Hasil Isolasi
10% ditambahkan, kemudian endapan yang terbentuk disaring dengan kertas Whatman no.1 dan dicuci dengan air suling mendidih hingga bebas klorida. Kertas saring dikeringkan ke dalam oven, kemudian diabukan pada suhu 900ºC sampai diperoleh abu berwarna putih. Abu didinginkan dalam desikator kemudian ditimbang sampai berat konstan. Perhitungan penetapan kadar sulfat dapat dilihat pada Lampiran 23 dan 24, halaman 86 dan 87.
3.9 Sterilisasi Alat
Alat-alat yang digunakan dalam uji pertumbuhan bakteri, disterilkan terlebih dahulu sebelum dipakai. Alat-alat gelas disterilkan didalam oven pada suhu 170°C selama 1 jam. Media disterilkan di autoklaf pada suhu 121°C selama 15 menit. Jarum ose dan pinset dengan lampu bunsen (Lay,1996).
3.10 Pembuatan Media 3.10.1 Beef Powder Cara pembuatan:
Sebanyak 60 g daging sapi dicuci sampai bersih dengan air mengalir, kemudian diblender halus dan dikeringkan dalam oven pada suhu 60°C. Serbuk daging sapi yang sudah kering, diblender halus kemudian diayak. Hasil ekstrak daging sapi sebanyak 25 g.
3.10.2 Media Nutrient Broth (NB)
Komposisi : ‘Lab – Lemco’ Powder 1,0 g Yeast extract 2,0 g
Peptone 5,0 g
NaCl 5,0 g
Cara pembuatan:
Sebanyak 13 g sediaan NB ditimbang, disuspensikan kedalam air suling 1000 ml, lalu dipanaskan sampai larut sempurna. Media dimasukkan ke dalam erlenmeyer dan disterilkan di dalam autoklaf pada suhu 121°C selama 15 menit (Oxoid, 1998).
3.10.3 Media Nutrient Agar (NA) Standar
Peptone 5,0 g
NaCl 5,0 g
Agar 15,0 g
Cara pembuatan :
Sebanyak 2,8 g sediaan NA ditimbang, disuspensikan ke dalam air suling 100 ml, lalu dipanaskan sampai larut sempurna. Media dimasukkan ke dalam erlenmeyer dan disterilkan di dalam autoklaf pada suhu 121°C selama 15 menit (Oxoid, 1998).
3.10.4 Media Agar Formula I (F1
Komposisi : Nutrient Broth 13,0 g )
Agar (dengan pemutihan) 15,0 g Cara pembuatan:
Sebanyak 2,3 g sediaan NA ditimbang, disuspensikan ke dalam air suling 100 ml, lalu dipanaskan sampai larut sempurna. Media dimasukkan ke dalam erlenmeyer dan disterilkan di dalam autoklaf pada suhu 121°C selama 15 menit (Oxoid, 1998).
3.10.5 Media Agar Formula II (F2
Komposisi : Beef powder 3,0 g
)
Peptone 5,0 g
Agar (dengan pemutihan) 15,0 g Cara pembuatan:
3.10.6 Media Agar Formula III (F3
Komposisi : Nutrient Broth 13,0 g )
Agar (tanpa pemutihan) 15,0 g Cara pembuatan:
Sebanyak 2,3 g sediaan NA ditimbang, disuspensikan ke dalam air suling 100 ml, lalu dipanaskan sampai larut sempurna. Media dimasukkan ke dalam erlenmeyer dan disterilkan di dalam autoklaf pada suhu 121°C selama 15 menit (Oxoid, 1998).
3.10.7 Media Agar Formula IV (F4
Komposisi : Beef powder 3,0 g
)
Peptone 5,0 g
Agar (tanpa pemutihan) 15,0 g Cara pembuatan:
Sebanyak 2,8 g sediaan NA ditimbang, disuspensikan ke dalam air suling 100 ml, lalu dipanaskan sampai larut sempurna. Media dimasukkan ke dalam erlenmeyer dan disterilkan di dalam autoklaf pada suhu 121°C selama 15 menit (Oxoid, 1998).
3.11 Pembuatan Agar Miring
3.12 Pembuatan Stok Kultur Bakteri
Koloni bakteri diambil dengan menggunakan jarum ose steril, lalu ditanam pada media NA miring dengan cara menggores. Stok kultur bakteri diinkubasi dalam inkubator pada suhu 35-37oC selama 18-24 jam (Depkes RI, 1995).
3.13 Penyiapan Inokulum Bakteri
Koloni bakteri diambil dari stok kultur dengan jarum ose steril lalu disuspensikan dalam tabung reaksi yang berisi 10 ml larutan NB. Kekeruhan larutan diukur pada panjang gelombang 580 nm sampai diperoleh transmitan 25% (Depkes RI, 1995).
3.14 Metode Pengujian Mikrobiologi 3.14.1 Pengujian Pertumbuhan Bakteri
Sebanyak 0,1 ml inokulum dimasukkan ke dalam cawan petri, kemudian ditambahkan 15 ml media NA steril yang telah dicairkan dan ditunggu hingga suhu mencapai 45oC, dihomogenkan dan dibiarkan sampai media memadat.
Bakteri diinkubasi pada suhu ±35O
3.14.2 Pewarnaan Gram
C selama 18-24 jam. Pengujian dilakukan sebanyak
dua kali (Depkes RI, 1995). Bagan hasil pengujian pertumbuhan bakteri dapat dilihat pada Lampiran 27, halaman 90. Gambar hasil pengujian pertumbuhan bakteri dapat dilihat pada Lampiran 28 dan 29, halaman 91-93.
tetes gentian violet ditambahkan, kemudian tambahkan 1 tetes larutan lugol, ratakan lalu keringkan dengan cara difiksasi. Kaca objek dicuci dengan alkohol 70% sampai tetesan terakhir tidak berwarna, lalu dikeringkan. Sebanyak 1 tetes safranin ditambahkan, biarkan 15-30 detik, dicuci larutan safranin dengan akuades steril, keringkan dengan cara difiksasi (Waluyo, 2010).
3.14.3 Pengamatan Mikroskopik Bakteri
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Pusat Penelitian
Oseanografi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Jakarta, Indonesia yaitu jenis Gracilaria verrucosa (Hudson) Papenfus, divisi Rhodophyta, kelas
Florideophyceae, bangsa Gracilariales, suku Gracilaraceae, marga Gracilaria.
4.2 Hasil Karakterisasi Simplisia
Hasil karakteristik yang diperoleh mempunyai sedikit perbedaan dengan hasil karakterik yang telah dilakukan sebelumnya oleh Ramadhani (2012). Hal ini kemungkinan disebabkan karena adanya perbedaan lokasi pengumpulan bahan tumbuhan serta proses pembuatan simplisia yaitu pada pencucian dan pengeringan.
Hasil pemeriksaan makroskopis simplisia Gracilaria verrucosa (Hudson) Papenfus yaitu simplisia berupa talus dengan ujung mengecil, percabangan berseling tidak beraturan, berwarna coklat kemerahan dan sedikit berbau.
Tabel 3.1 Hasil Karakterisasi Simplisia Rumput Laut Gracilaria verrucosa (Hudson) Papenfus
No. Parameter Hasil karakterisasi
(Ramadhani, 2012)
Hasil karakterisasi (Hasanah, 2014) 1 Pemeriksaan makroskopis −Talus dengan
ujung mengecil 2 Pemeriksaan mikroskopis −Sel-sel parenkim
−Sel-sel parenkim
4 Penetapan kadar sari larut dalam air
3,53 % 3,91 %
5 Penetapan kadar sari larut dalam etanol
0,63 % 0,93 %
6 Penetapan kadar abu total 5,14 % 8,04 %
7 Penetapan kadar abu tidak larut asam
0,55 % 0,84 %
sari yang larut dalam air lebih tinggi daripada kadar sari yang larut dalam etanol, hal ini disebabkan rumput laut mengandung karbohidrat yang cukup tinggi (Ramadhani, 2012).
Penetapan kadar abu total dilakukan untuk mengetahui kadar senyawa anorganik dalam simplisia, misalnya logam kalium; kalsium; natrium; plumbum, sedangkan penetapan kadar abu tidak larut dalam asam dilakukan untuk mengetahui kadar senyawa yang tidak larut dalam asam, misalnya silika (Gunawan, dkk., 1995).
4.3 Hasil Isolasi Agar
Tabel 4.2 Hasil Rendemen Agar dari Rumput Laut Gracilaria verrucosa
Molekul agar terdiri dari dua komponen utama, yaitu agarosa dan agaropektin. Agarosa merupakan komponen agar yang netral dan bertanggung jawab dalam peningkatan kekuatan gel (Dawes, 1981). Agar-agar mudah terhidrolisis oleh asam, karena ikatan β-1,4 yang terdapat pada agarosa sangat peka terhadap serangan asam (Irawati, 1994).
Waktu pendidihan yang terlalu lama dapat mengakibatkan degradasi hidrolitik yang berlebihan, meskipun pada proses normal degradasi hidrolitik tidak dapat dihindari seluruhnya (Irawati, 1994). Pada umumnya, proses pemasakan rumput laut berlangsung selama 45 menit atau kadang-kadang sampai 2-4 jam, tergantung teknik pengadukannya (Winarno, 1990).
4.4 Hasil Karakterisasi Agar
Hasil organoleptis agar hasil isolasi dengan proses pemutihan mempunyai warna putih kekuningan, bau spesifik agar dan bentuknya serbuk halus. Sedangkan agar hasil isolasi tanpa proses pemutihan mempunyai warna kuning kecoklatan, bau spesifik agar dan bentuknya serbuk kasar.
positif terhadap semua perlakuan (Depkes RI, 1995). Hasil karakterisasi agar dapat dilihat pada Tabel 4.3 berikut ini.
Tabel 4.3 Hasil Karakterisasi Agar dari Rumput Laut Gracilaria verrucosa (Hudson) Papenfus
No. Parameter Persyaratan
Hasil karakterisasi agar 3 Penetapan kadar abu tak larut
asam
≤ 1% 0,49% 0,56%
4 Penetapan kadar sulfat ≤ 1,78% 0,99% 1,06%
5 Nilai viskositas (cps) 2-10 cps 2 cps 2 cps
Hasil penetapan susut pengeringan untuk agar dengan proses pemutihan adalah 8,71% sedangkan agar tanpa proses pemutihan adalah 8,46%, yang memenuhi syarat yang ditetapkan oleh Farmakope Indonesia (1995) yang menyatakan susut pengeringan agar tidak lebih dari 20,0%. Hasil penetapan kadar abu total agar dengan proses pemutihan adalah 4,70%, sedangkan agar-agar tanpa proses pemutihan adalah 4,73%. Maka, agar yang dihasilkan telah memenuhi standar mutu agar bakto menurut ISO 9001 (Jamilah, 2013) yaitu kadar abu kurang dari 6,5%. Kadar abu bakto agar tidak boleh lebih besar dari standar, karena nilai kadar abu yang berlebihan dapat menghambat bakteri yang ditumbuhkan pada media tersebut (Murdinah, dkk., 2008).
proses pengolahan dan dicerminkan oleh adanya kontaminasi logam berat yang tidak larut asam dalam suatu produk. Kadar abu tak larut asam bakto agar telah memenuhi standar supreme marine chemical yaitu kurang dari 1% (Murdinah, dkk., 2008).
Kadar sulfat dari agar dengan proses pemutihan adalah 0,99%, sedangkan agar tanpa proses pemutihan adalah 1,06%. Kadar sulfat dalam penelitian ini memenuhi syarat kadar sulfat bakto agar komersial yaitu 1,78%. Analisis kadar sulfat menggunakan metode hidrolisis dilanjutkan pengendapan sulfat sebagai barium sulfat (Distantina, dkk, 2010). Pada proses pembuatan bakto agar dilakukan penambahan alkali sehingga kadar sulfatnya menjadi rendah karena penambahan alkali dapat mengurangi kadar ester sulfat pada C6 rantai galaktosa (Murdinah, dkk., 2008).
Nilai viskositas baik dari agar dengan proses pemutihan maupun yang tanpa proses pemutihan mempunyai nilai viskositas 10 centipoices. Menurut Winarno (1990), larutan 1% dan 1,5% agar pada suhu 45ºC, mempunyai viskositas 2-10 centipoices.
4.5 Hasil Pengujian Mikrobiologi
Pengujian mikrobiologi dilakukan dengan uji kualitatif yang terlihat dari homogenitas pertumbuhannya di cawan petri ketika ditambahkan nutrisi didalamnya serta pengamatan bakteri secara mikroskopik.
Hasil pengujian ini menunjukkan kemampuan yang baik dalam menumbuhkan, baik bakteri Staphylococcus aureus (mewakili Gram positif) dan bakteri Eschericia coli (mewakili Gram negatif) pada media agar hasil isolasi yang dibandingkan dengan media agar standar dengan teknik penuangan.
Pada pengamatan bakteri secara mikroskopik, jumlah bakteri Staphylococcus aureus maupun Eschericia coli dari media agar dengan proses pemutihan yaitu media agar formula I (F1) dan media agar formula II (F2), lebih sedikit dibandingkan media agar tanpa proses pemutihan yaitu media agar formula III (F3) dan media agar formula IV (F4). Hal ini kemungkinan terjadi karena kurang bersihnya proses pencucian untuk menghilangkan bau kaporit pada serbuk simplisia rumput laut yang diputihkan. Klorin (chlorine, Cl2
Staphylococcus aureus maupun Eschericia coli dari media dengan penambahan nutrient broth yaitu media agar formula I (F1) dan media agar formula III (F3), lebih banyak daripada dari media dengan penambahan beef powder serta peptone yaitu media agar formula II (F2) dan media agar formula IV (F4
Pertumbuhan bakteri juga ditunjukkan dari pengamatan bakteri secara mikroskopik. Pewarnaan Gram dilakukan terhadap bakteri yang telah diinkubasi selama 18-24 jam. Warna dan bentuk bakteri dilihat pada mikroskop dengan pembesaran 100 kali. Dari hasil pengamatan mikroskopik, Eschericia coli berwarna merah dan berbentuk batang, sedangkan Staphylococcus aureus berwarna ungu dan berbentuk menyerupai buah anggur.
). Hal ini kemungkinan disebabkan karena nutrient broth lebih lengkap nutrisinya daripada beef powder serta peptone sehingga dapat menumbuhkan bakteri lebih baik. Nutrisi merupakan faktor kimia yang mempengaruhi pertumbuhan mikroorganisme yang diperlukan untuk biosintesis dan pembentukan energi (Pratiwi, 2008).
Bakteri Eschericia coli merupakan bakteri Gram negatif yang mempunyai bentuk bulat cenderung ke batang panjang, biasanya berukuran 0,5-1,5 μm (Melliawati, 2009). Bakteri Staphylococcus aureus merupakan bakteri Gram positif berbentuk bulat berdiameter 0,7-1,2 μm, tersusun dalam kelompok-kelompok yang tidak teratur seperti buah anggur (Jawetz, et al., 1986).
terutama dinding sel kedua kelompok bakteri tersebut. Bakteri Gram positif berwarna ungu yang disebabkan komplek gentian violet-iodin yang masuk ke dalam sel bakteri tidak dapat tercuci oleh alkohol karena adanya peptidoglikan yang kokoh pada dinding sel. Sedangkan bakteri Gram negatif berwarna merah karena kompleks gentian violet-iodin dapat tercuci dan menyebabkan sel bakteri tampak transparan, yang akan berwarna merah setelah diberi safranin (Pratiwi, 2008).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan, diperoleh:
a. hasil karakteristik serbuk simplisia dari rumput laut Gracilaria verrucosa (Hudson) Papenfus yaitu pengamatan makroskopik; pengamatan mikroskopik; penetapan kadar air; penetapan kadar sari larut dalam air; penetapan kadar sari larut dalam etanol; penetapan kadar abu total dan penetapan kadar abu tak larut asam berbeda hasilnya dengan penelitian sebelumnya.
b. rendemen agar hasil isolasi dari rumput laut Gracilaria verrucosa (Hudson) Papenfus berbeda hasilnya dengan penelitian sebelumnya.
c. hasil karakteristik agar hasil isolasi dari rumput laut Gracilaria verrucosa (Hudson) Papenfus yaitu identifikasi agar; penetapan susut pengeringan; penetapan kadar abu total; penetapan kadar abu tak larut asam; penetapan kadar sulfat dan viskositas memenuhi persyaratan yang berlaku.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Morfologi rumput laut Gracilaria sp. tidak memiliki perbedaan antara akar, batang dan daun. Tanaman ini berbentuk batang yang disebut talus dengan berbagai bentuk percabangannya. Secara alami, Gracilaria sp. hidup dengan melekatkan holdfast pada substrat yang berupa pasir, lumpur, karang, kulit kerang, karang mati, batu maupun kayu, pada kedalaman sekitar 10 sampai 15 meter di bawah permukaan air (Angkasa, dkk., 2011).
Ciri-ciri dari Gracilaria verrucosa, yaitu talus silindris, licin dan berwarna kuning coklat atau kuning hijau. Percabangan berseling tidak beraturan, memusat ke arah pangkal. Cabang lateral memanjang menyerupai rambut, ukuran panjang sekitar 25 cm dengan diameter talus 0,5 - 1,5 mm (Anggadiredja, dkk., 2006).
2.1.1 Habitat dan Sebaran Rumput Laut
Rumput laut jenis Gracilaria sp. juga sudah dibudidayakan di beberapa daerah, seperti di sepanjang Pantai Utara Jawa, antara lain daerah Serang, Bekasi, Karawang, Indramayu, Brebes, Tegal, Pemalang, Jepara dan Lamongan. Di daerah Nusa Tenggara Barat, antara lain Sekotong, Lombok Barat dan Teluk Cempi, serta Dompu. Di daerah Sulawesi Selatan meliputi Jeneponto, Takalar, Maros, Bulukumba, Sinjai, Bone, Wajo dan Palopo. Selain itu, di daerah Lampung juga telah banyak dibudidayakan. Jenis Gracilaria yang telah dibudidayakan, antara lain Gracilaria verrucosa, Gracilaria chilensis, Gracilaria gigas dan Gracilaria lichenoides (Murdinah, 2012).
2.1.2 Perkembangbiakan Rumput Laut
Perkembangbiakan rumput laut dapat terjadi melalui dua cara, yaitu secara vegetatif dengan talus dan secara generatif dengan talus diploid yang menghasilkan spora. Perbanyakan secara vegetatif dikembangkan dengan cara stek, yaitu potongan talus yang kemudian tumbuh menjadi tanaman baru. Sementara, perbanyakan secara generatif dikembangkan melalui spora, baik alamiah maupun melalui budidaya. Pertemuan dua gamet membentuk zigot yang selanjutnya berkembang melalui pembelahan dalam sporogenesis menjadi gametofit (Anggadiredja, dkk., 2006).
Sifat-sifat oseanografi, seperti sifat kimia-fisika air dan substrat, macamnya substrat serta dinamika/pergerakan air, merupakan faktor-faktor yang sangat menentukan pertumbuhan Gracilaria sp. (Angkasa, dkk., 2011).
2.1.3 Sistematika Tumbuhan
a. Divisi : Rhodophyta b. Kelas : Florideophyceae c. Bangsa : Gracialariales d. Suku : Gracilariaceae e. Marga : Gracilaria
f. Jenis : Gracilaria verrucosa (Hudson) Papenfus 2.1.4 Nama Daerah
Gracilaria verrucosa dikenal dengan nama daerah bulung rambu (Bali) atau sango-sango (Sulawesi) (Anggadiredja, dkk., 2006).
2.2 Kandungan Kimia
Rumput laut Gracilaria verrucosa menghasilkan metabolit primer senyawa hidrokoloid yang disebut agar. Jenis rumput laut yang termasuk dalam kelas Rhodophyceae (alga merah) mengandung pigmen antara lain adalah klorofil a, klorofil d, α dan β karoten, lutein, zeaxanthin, fikosianin, dan fikoeritrin. Fikoeritrin merupakan pigmen yang dominan yang menyebabkan warna merah (Anggadiredja, dkk., 2006).
2.3 Agar
2.3.1 Struktur Agar
Agar terdiri atas dua fraksi polimer yaitu agarosa dan agaropektin. Fraksi agarosa merupakan polimer netral bebas sulfat mampu membentuk gel. Agarosa terdiri atas rantai D-galaktosa yang berikatan secara posisi α-1,4 dan posisi 3,6-anhidro-L-galaktosa dan rantai D-galaktosa yang berikatan secara β-1,4 dengan rantai 3,6-anhidro-L-galaktosa. Sementara itu, fraksi agaropektin merupakan polimer bermuatan mengandung sulfat sekitar 3-10% dan tidak mempunyai kemampuan untuk membentuk gel (Glicksman, 1983).
Struktur kedua jenis galaktan penyusun agar menurut ini diilustrasikan pada Gambar 2.1 berikut (Winarno, 1990):
a.
b.
Gambar 2.1. Struktur galaktan penyusun agar
Keterangan:
2.3.2 Sifat Fisiko-Kimia Agar
Sifat fisika dari agar yaitu tidak berbau atau berbau lemah, tidak berwarna sampai kuning pucat, bening. Agar dapat berbentuk gumpalan potongan memanjang dengan lebar 2 mm sampai 5 mm, kadang-kadang dalam bentuk kepingan, agak liat dan sukar dipatahkan (Depkes RI, 1995).
Agar tidak larut dalam air dingin, tetapi larut dalam air panas. Pada temperatur 32º-39° C berbentuk bekuan (solid) dan tidak mencair pada suhu di bawah 85º C (Aslan, 1998).
Agar sangat stabil dalam keadaan kering, tetapi pada suhu tinggi dan pH rendah agar akan mengalami degradasi yaitu pecahnya polimer galaktosa menjadi monomer yang sederhana (Winarno, 1990).
2.4 Tumbuhan Penghasil Agar
Agarophyte adalah kelompok rumput laut yang dapat digunakan sebagai bahan-bahan baku pembuatan agar. Sedangkan Agaroidophyte merupakan kelompok ganggang merah yang memproduksi senyawa yang mempunyai sifat seperti agar, tetapi dengan daya gelasi dan viskositas yang berbeda. Dari kelompok Agarophyte yang terkenal adalah spesies dari genus Gracilaria, Pterocladia sp., spesies Acanthopeltis japonica dan Ahnfeltia plicata (Aslan, 1998).
murah harganya, jenis rambukasang mampu menghasilkan agar tiga kali lipat dari jenis lainnya (Winarno, 1990).
Berbagai negara memiliki sumber rumput laut yang berbeda bagi produksi agar. Di Jepang, rumput laut utama yang digunakan dalam produksi agar adalah Gelidium amansii yang mengandung rendemen agar 25-30% dari berat kering. Di Amerika Serikat, untuk produksi agar digunakan ganggang Gelidium cartilaginerum sebagai bahan baku. Sedangkan di Filipina, agar-agar untuk makanan diproduksi dari Gracilaria verrucosa. Walaupun demikian, biasanya dalam produksi agar, ganggang yang digunakan tidak hanya ganggang sejenis, tetapi merupakan campuran dari beberapa jenis ganggang. Campuran yang biasanya dilakukan di Jepang dengan mutu produk yang baik adalah Gelidium amansii (45%), Gelidium japanicum (10%), Acanthopeltis (5%), Campylaephora (10 %), Gracilaria (15 %), Ceramium (5 %) dan Gelidium sp. (10%) (Winarno, 1990).
2.5 Penggunaan Agar
pangan dan sisanya 20% pada bidang non-pangan termasuk aplikasi yang berkaitan dengan farmasi dan bioteknologi (Armisen & Galatas, 2000).
Dalam industri pangan, agar digunakan sebagai bahan pengental pada industri es krim, jeli, permen dan pastry. Agar juga digunakan dalam pembuatan shorbat, es krim, dan keju untuk pembentukan emulsi/stabilizer. Di Jepang, agar digunakan sebagai fortifikasi untuk serat pangan sehingga lebih menguntungkan bagi kesehatan. Agar juga digunakan sebagai penjernih pada berbagai industri minuman seperti bir, anggur, kopi dan sebagai penstabil pada minuman cokelat. Pada konsentrasi 0,1-1%, agar biasa digunakan sebagai penstabil pada yoghurt, keju, permen dan produk bakery (Murdinah, dkk., 2012).
Pemanfaatan agar dalam industri nonpangan, antara lain untuk kebutuhan industri farmasi sebagai obat pencahar, pembungkus kapsul untuk antibiotik dan vitamin, atau campuran bahan pencetak contoh gigi. Dalam industri kosmetik agar dimanfaatkan dalam pembuatan krem, lotion, lipstik dan sabun. Pada industri tekstil, agar bermutu tinggi digunakan untuk melindungi kemilau sutera. Sementara pada industri kulit, agar berguna sebagai pengilap permukaan yang halus dan kekakuan kulit sebagai campuran pembuatan pelekat kayu lapis. Agar juga dimanfaatkan dalam pembuatan pelat film, pasta gigi, semir sepatu dan kertas. Selain dimanfaatkan pada industri-industri tersebut, agar juga bermanfaat dalam bidang bioteknologi dan mikrobiologi (Murdinah, dkk., 2012).
pada proses pemurnian dan isolasi protein. Agarosa merupakan matriks yang idela bagi difusi dan pergerakan elektrokinetik biopolimer, dan gelnya merupakan medium antikonveksi, yang secara biologi stabil dengan sifat ionik yang terkontrol (Murdinah, dkk., 2012).
Dalam dunia kromatografi, kolom yang berisi partikel gel agarosa sudah diproduksi komersial dan dipasarkan dengan merek dagang Sepharose (dari Pharmacia) dan Bio-Gel A (Bio-Rad). Agarosa tersebut telah digunakan secara luas sebagai media untuk pemisahan berat molekul dengan berat lebih dari 250.000 DA atau disebut kromatografi eksklusi dan untuk pemisahan campuran protein, virus dan ribosom (Murdinah, dkk., 2012).
Dalam bidang mikrobiologi, agar digunakan dalam bentuk bakto agar. Bakto agar merupakan agar yang telah dimurnikan dengan mereduksi kandungan pigmen, pengotor dan kandungan bahan-bahan asing (organik dan anorganik) serendah mungkin sehingga dapat mendukung pertumbuhan mikroba secara umum (Abdullah, 2004).
2.6 Cara Ekstraksi Agar di Berbagai Negara
Cara ekstraksi agar yang dilakukan berbeda-beda di berbagai negara yaitu: a. Di negara Selandia Baru
Ekstraksi agar dilakukan selama 4 jam pada suhu 95-100° C dan perendaman dilakukan selama 1 jam pada suhu 20-24°C dalam asam asetat 0,2% (Winarno, 1990).
b. Di negara Australia
Ekstraksi agar dilakukan selama 2-4 jam menggunakan larutan asam fosfat dengan pH 5 (Winarno, 1990).
c. Di negara Amerika Serikat
Ekstraksi agar dilakukan selama 6 jam menggunakan larutan asam fosfat dengan pH 6-8 (Winarno, 1990).
d. Di negara Filipina
Ekstraksi agar dilakukan selama 4 jam menggunakan air suling dan asam sulfat (Trono dan Fortes, 1988).
2.7 Sterilisasi
Sterilisasi merupakan suatu proses yang dilakukan untuk tujuan membunuh atau menghilangkan mikroorganisme yang tidak diinginkan pada suatu objek atau spesimen.
Cara-cara sterilisasi yaitu (Beisher, 1991): a. Sterilisasi dengan bahan kimia
b. Sterilisasi kering
Digunakan untuk alat-alat gelas misalnya cawan petri, tabung reaksi. Cara ini cocok untuk alat-alat gelas karena tidak ada pengembunan dan tetes air. c. Sterilisasi basah
Biasanya menggunakan uap panas bertekanan dalam autoklaf. Media biakan, larutan dan kapas dapat disterilkan dengan cara ini. Autoklaf merupakan suatu alat pemanas bertekanan tinggi, dengan meningkatnya suhu air maka tekanan udara akan bertambah dalam autoklaf yang tertutup rapat. Sejalan dengan meningkatnya tekanan di atas tekanan udara normal, titik didih air meningkat. Biasanya pemanasan autoklaf berada pada suhu 121° C selama 15 menit.
d. Filtrasi bakteri
Digunakan untuk mensterilkan bahan-bahan yang terurai atau tidak tahan panas. Metode ini didasarkan pada proses mekanik yaitu menyaring semua bakteri dari bahan dengan melewatkan larutan tersebut melalui lubang saringan yang sangat kecil.
e. Incenerasi
Sterilisasi dengan pemanasan atau pembakaran pada api langsung. Misalnya untuk sterilisasi jarum ose dan pinset.
2.8 Bakteri
mikroorganisme yang bersel satu, berbiak dengan pembelahan diri, serta demikian kecilnya sehingga hanya tampak dengan mikroskop (Dwidjoseputro, 1987).
Pertumbuhan dan perkembangan bakteri dipengaruhi oleh (Pratiwi ,2008): a. Temperatur
Pertumbuhan bakteri sangat dipengaruhi oleh temperatur. Setiap mikroorganisme mempunyai temperatur optimum yaitu temperatur di mana terjadi kecepatan pertumbuhan optimal dan dihasilkan jumlah sel yang maksimal. Temperatur yang terlalu tinggi dapat menyebabkan denaturasi protein sedangkan temperatur yang sangat rendah aktivitas enzim akan terhenti. Berdasarkan batas temperatur dibagi atas tiga golongan:
- Psikrofil, tumbuh pada temperatur -5 sampai 30oC dengan optimum 1 sampai 20o
- Mesofil, tumbuh pada temperatur 10 sampai 45 C.
o
C dengan optimum 20 sampai 40o
- Termofil, tumbuh pada termperatur 25 sampai 80 C.
pH optimum bagi kebanyakan bakteri terletak antara 6,5 dan 7,5. Namun ada beberapa mikroorganisme yang dapat tumbuh pada keadaan yang sangat asam atau alkali (Pelczar dan Chan, 2006).
c. Tekanan osmosis
baik untuk pertumbuhan sel adalah medium isotonis terhadap sel tersebut. Dalam larutan hipotonik air akan masuk ke dalam sel sehingga menyebabkan sel membengkak, sedangkan dalam larutan hipertonik air akan keluar dari sel sehingga membran plasma mengerut dan lepas dari dinding sel (plasmolisis) (Pratiwi, 2008; Lay, 1996).
d. Oksigen
Berdasarkan kebutuhan oksigen di kenal mikroorganisme di bagi menjadi 5 golongan yaitu (Pratiwi, 2008):
- Anaerob obligat, hidup tanpa oksigen, oksigen toksik terhadap golongan ini.
- Anaerob aerotoleran, tidak mati dengan adanya oksigen.
- Anaerob fakultatif, mampu tumbuh baik dalam suasana dengan atau tanpa oksigen.
- Aerob obligat, tumbuh subur bila ada oksigen dalam jumlah besar. - Mikroaerofilik, hanya tumbuh baik dalam tekanan oksigen yang
rendah. e. Nutrisi
Nutrisi merupakan substansi yang diperlukan untuk biosintesis dan pembentukan energi. Berdasarkan kebutuhannya, nutrisi dibedakan menjadi dua yaitu makroelemen (elemen yang diperlukan dalam jumlah banyak) dan mikroelemen (trace element yaitu elemen nutrisi yang diperlukan dalam jumlah sedikit) (Pratiwi, 2008).
2.8.1 Morfologi Bakteri
a. Golongan basil
Golongan basil berbentuk serupa tongkat pendek, silindris. Basil dapat bergandengan dua-dua, atau terlepas satu sama lain, yang bergandeng-gandengan panjang disebut streptobasil, yang dua-dua disebut diplobasil. b. Bentuk kokus
Golongan kokus merupakan bakteri yang bentuknya serupa bola-bola kecil. Golongan ini tidak sebanyak golongan basil. Kokus ada yang bergandeng-gandengan panjang serupa tali leher, disebut streptokokus, ada yang bergandengan dua-dua, disebut diplokokus, ada yang mengelompok berempat, disebut tetrakokus, kokus yang mengelompok serupa kubus disebut sarsina.
c. Golongan spiril
Golongan spiril merupakan bakteri yang bengkok atau berbengkok-bengkok serupa spiral. Bakteri ini tidak banyak terdapat, karena itu merupakan golongan yang paling kecil, jika dibandingkan dengan golongan kokus maupun golongan basil.
2.8.2 Bakteri Staphylococcus aureus
Sistematika bakteri Staphylococcus aureus menurut Bergey edisi ke-7 (Dwidjoseput ro, 1987) adalah sebagai berikut:
Staphylococcus aureus merupakan bakteri gram positif, aerob atau anaerob fakultatif berbentuk bola atau kokus berkelompok tidak teratur, diameter 0,8 – 1,0 μm, tidak membentuk spora dan tifak bergerak, koloni berwarna kuning. Bakteri ini tumbuh cepat pada suhu 370C tetapi paling baik membentuk pigmen pada suhu 20-250
2.8.3 Bakteri Escherichia coli
C. koloni pada pembenihan padat berbentuk bulat halus, menonjol dan berkilau membentuk berbagai pigmen. Bakteri ini terdapat pada kulit, selaput lendir, bisul dan luka. Dapat menimbulkan penyakit melalui kemampuannya berkembang biak dan menyebar luas dalam jaringan (Jawetz, 2001).
Sistematika bakteri Escherichia coli menurut Bergey edisi ke-7 (Dwidjoseputro, 1987) adalah sebagai berikut :
a. Divisi : Protophyta b. Kelas : Schizomycetes c. Bangsa : Eubacteriales d. Suku : Enterobacteriaceae e. Marga : Escherichia
f. Jenis : Escherichia coli
sebagai flora normal. Bakteri ini dapat menjadi patogen bila berada diluar usus atau dilokasi lain dimana flora normal jarang terdapat (Jawetz, 2001).
2.8.4 Fase Pertumbuhan Bakteri
Bakteri mengalami pertumbuhan yang dapat dibagi dalam 4 fase menurut (Pratiwi, 2008; Dwidjoseputro, 1998) yaitu:
1. Fase lag
Pada saat dipindahkan ke media yang baru, bakteri tidak langsung tumbuh dan membelah, meskipun kondisi media sangat mendukung untuk pertumbuhan. Bakteri biasanya akan mengalami masa penyesuaian untuk menyeimbangkan pertumbuhan.
2. Fase log
Selama fase ini, populasi meningkat dua kali pada interval waktu yang teratur. Jumlah koloni bakteri akan terus bertambah seiring lajunya aktivitas metabolisme sel.
3. Fase tetap
Pada fase ini terjadi kompetisi antara bakteri untuk memperoleh nutrisi dari media untuk tetap hidup. Sebagian bakteri mati sedangkan yang lain tumbuh dan membelah sehingga jumlah sel bakteri yang hidup menjadi tetap.
4. Fase kematian
Gambar 2.2. Kurva Fase Pertumbuhan Bakteri 2.8.5 Media Pertumbuhan Bakteri
Media biakan dapat dikelompokkan dalam beberapa kategori, yaitu: a. Berdasarkan asalnya, media dibagi atas:
1) Media sintetik
Media yang kandungan dan isi bahan yang ditambahkan diketahui secara terperinci. Contoh: glukosa, kalium fosfat, magnesium fosfat.
2) Media non-sintetik
Media yang kandungan dan isinya tidak diketahui secara terperinci dan menggunakan bahan yang terdapat di alam. Contohnya: ekstrak daging, pepton (Lay, 1996).
b. Berdasarkan kegunaannya, dapat dibedakan menjadi: 1) Media selektif
2) Media diferensial
Media ini digunakan untuk menyeleksi suatu mikroorganisme dari berbagai jenis dalam suatu lempengan agar.
3) Media diperkaya
Media ini digunakan untuk menumbuhkan mikroorganisme yang diperoleh dari lingkungan alami karena jumlah mikroorganisme yang ada terdapat dalam jumlah sedikit (Irianto, 2006).
c. Berdasarkan konsistensinya, dibagi atas (Irianto, 2006): 1) Media padat/ solid
2) Media semi solid 3) Media cair
2.8.6 Metode Isolasi Biakan Bakteri a. Cara gores
Ose yang telah steril dicelupkan ke dalam suspensi mikroorganisme yang diencerkan, lalu dibuat serangkaian goresan sejajar yang tidak saling menutupi di atas permukaan agar yang telah padat.
b. Cara sebar
Suspensi mikroorganisme yang telah diencerkan diinokulasikan secara merata dengan menggunakan hockey stick pada permukaan media padat. c. Cara tuang
2.8.7 Pewarnaan Gram
Mikroorganisme dapat dilihat dengan mikroskop biasa, tanpa diwarnai; yakni dengan cara-cara khusus misalnya menggunakan kondesor medan gelap. Tetapi pengamatan yang demikian lebih sulit dan tidak dapat dipakai untuk melihat bagian-bagian sel dengan seksama karena umumnya sel mikroorganisme bersifat transparan. Hal ini karena sitoplasma sel mikroba memiliki indeks bias yang hampir sama dengan indeks bias lingkungannya yang bersifat cair dan mikroba tidak mengabsorbsi atau membiaskan cahaya. Kontras antara sel dan latar belakangnya dapat diperjelas dengan cara mewarnai sel-sel mikroba tersebut dengan zat-zat warna (Waluyo, 2010).
Pewarnaan Gram memilahkan bakteri menjadi 2 kelompok, yakni bakteri Gram positif dan Gram negatif. Bakteri Gram positif berwarna ungu yang disebabkan kompleks warna kristal violet-iodium tetap dipertahankan meskipun diberi larutan pemucat. Sedangkan bakteri Gram negatif berwarna merah karena kompleks warna tersebut larut sewaktu pemberian larutan pemucat dan kemudian mengambil zat warna yang kedua yang berwarna merah. Perbedaan hasil dalam pewarnaan tersebut disebabkan perbedaan struktur, terutama dinding sel kedua kelompok bakteri tersebut. Karena kemampuannya membedakan suatu kelompok bakteri tertentu dengan kelompok lainnya, pewarnaan Gram juga disebut pewarnaan diferensial (Waluyo, 2010).
mencegah larutnya kompleks zat warna ungu kristal-iodium pada langkah pemucatan. Sedangkan bakteri Gram negatif memiliki kandungan lipid yang lebih tinggi pada dinding sel dan lipid tersebut dapat larut dalam alkohol dan aseton. Larutnya lipid oleh zat pemucat yang digunakan dalam pewarnaan Gram diduga memperbesar pori-pori dinding sel dan inilah penyebab proses pemucatan antara dinding sel Gram negatif lebih cepat (Waluyo, 2010).
BAB I PENDAHULUAN
1.1 Latar Belakang
Indonesia merupakan negara kepulauan yang memiliki keanekaragaman jenis rumput laut yang sangat tinggi. Hasil produksi rumput laut masih sebatas industri makanan dan bahan baku komoditi ekspor. Terdapat beberapa jenis dari marga rumput laut yang bernilai ekonomi dan beberapa yang dibudidaya yaitu Gracilaria, Gelidium, Gelidiopsis dan Hypnea (Kadi, 2004; Romimohtarto dan Juwana, 2001).
Rumput laut Gracilaria sp. termasuk kelompok Agarophyte yaitu rumput laut yang mengandung agar sebagai hasil metabolisme primer. Agar diproduksi dan dipasarkan dalam berbagai bentuk, antara lain tepung, kertas dan batang. Sebagian besar penggunaan agar adalah sebagai media pertumbuhan bakteri maupun jamur, yaitu dengan menambahkan zat-zat gizi tertentu (ingredient-ingredient) yang diperlukan untuk pertumbuhan bakteri dalam agar. Agar bersifat lebih baik daripada gelatin bila digunakan sebagai bahan pupukan mikroba, karena bakteri tidak dapat mencairkan gel agar, tetapi dengan mudah mencairkan gelatin menjadi larutan encer. Persyaratan mutu internasional (standar) bagi agar yang digunakan sebagai media pupukan mikroba yaitu kadar abu maksimum 5%, kadar organik asing maksimum 1% dan kadar abu tak larut asam maksimum 1% (Winarno, 1990).