KARAKTERISASI DAN SKRINING FITOKIMIA SIMPLISIA
SERTA UJI AKTIVITAS ANTIOKSIDAN
EKSTRAK RUMPUT LAUT
Gracilaria verrucosa
(Hudson)
Papenfus DENGAN METODE DPPH
SKRIPSI
OLEH:
HENDRA
NIM 101501114
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
KARAKTERISASI DAN SKRINING FITOKIMIA SIMPLISIA
SERTA UJI AKTIVITAS ANTIOKSIDAN
EKSTRAK RUMPUT LAUT
Gracilaria verrucosa
(Hudson)
Papenfus DENGAN METODE DPPH
SKRIPSI
Diajukan untuk Melengkapi Salah Satu Syarat untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi Universitas
Sumatera Utara
OLEH:
HENDRA
NIM 101501114
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
PENGESAHAN SKRIPSI
KARAKTERISASI DAN SKRINING FITOKIMIA SIMPLISIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK RUMPUT
LAUT
Gracilaria verrucosa
(Hudson) Papenfus DENGAN
METODE DPPH
OLEH: HENDRA NIM 101501114
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 28 Agustus 2014
Pembimbing I,
Dra. Aswita Hafni Lubis, M.Si., Apt. NIP 195304031983032001
Pembimbing II,
Dra. Suwarti Aris, M.Si., Apt. NIP 195107231982032001
Panitia Penguji,
Dr. Marline Nainggolan, M.S., Apt. NIP 195709091985112001
Dra. Aswita Hafni Lubis, M.Si., Apt. NIP 195304031983032001
Dra. Herawaty Ginting, M.Si., Apt. NIP 195112231980032002
Drs. Panal Sitorus, M.Si., Apt. NIP 195310301980031002
Medan, 28 Agustus 2014 Fakultas Farmasi
KATA PENGANTAR
Puji syukur kehadirat Tuhan Yang Maha Esa yang telah memberikan
karunia yang berlimpah sehingga penulis dapat menyelesaikan penyusunan skripsi
yang berjudul Karakterisasi dan Skrining Fitokimia Simplisia serta Uji Aktivitas
Antioksidan Ekstrak Rumput Laut Gracilaria verrucosa (Hudson) Papenfus
Dengan Metode DPPH. Skripsi ini diajukan untuk melengkapi salah satu syarat
untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera
Utara.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan
terima kasih yang sebesar-besarnya kepada Bapak Prof. Dr. Sumadio
Hadisahputra, Apt., selaku Dekan Fakultas Farmasi yang telah menyediakan
fasilitas kepada penulis selama perkuliahan di Fakultas Farmasi. Penulis juga
mengucapkan terima kasih kepada Ibu Dra. Aswita Hafni Lubis, M.Si., Apt., dan
Ibu Dra. Suwarti Aris, M.Si., Apt., yang telah membimbing penulis dengan penuh
kesabaran dan tanggung jawab, memberikan petunjuk dan saran-saran selama
penelitian hingga selesainya skripsi ini. Ucapan terima kasih juga penulis
sampaikan kepada Ibu Dr. Marline Nainggolan, M.S., Apt., selaku ketua penguji,
Ibu Dra. Herawaty Ginting, M.Si., dan Bapak Drs. Panal Sitorus, M.Si., Apt.,
selaku anggota penguji yang telah memberikan saran untuk menyempurnakan
skripsi ini, dan Ibu Aminah Dalimunthe, S.Si., M.Si., Apt., selaku dosen
penasehat akademik yang telah banyak membimbing penulis selama masa
Penulis juga mempersembahkan rasa terima kasih yang tak terhingga
kepada ibunda tercinta, Ng Kim Khiau, serta kakakku Cindy, Dewi Sutina dan
adikku Juwita Fitri, yang telah memberikan semangat dan kasih sayang yang tak
ternilai dengan apapun. Penulis juga mengucapkan terima kasih kepada teman-
teman mahasiswa/i Farmasi Stambuk 2010 yang selalu mendoakan dan memberi
dukungan serta semangat yang tiada henti.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih belum
sempurna, oleh karena itu penulis mengharapkan saran dan kritik yang
membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga
skripsi ini bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, Agustus 2014
Penulis,
Hendra
KARAKTERISASI DAN SKRINING FITOKIMIA SIMPLISIA SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK RUMPUT LAUT Gracilaria
verrucosa (Hudson) Papenfus DENGAN METODE DPPH
ABSTRAK
Rumput laut atau alga yang juga dikenal dengan nama seaweed merupakan bagian terbesar dari tanaman laut. Sejak zaman dahulu, rumput laut telah digunakan sebagai makanan dan obat-obatan. Rumput laut mengandung vitamin A, B1, B2, B6, B12, vitamin C dan beta karoten yang merupakan senyawa antioksidan yang dapat menangkal radikal bebas dan dapat mencegah berbagai macam penyakit. Tujuan penelitian ini adalah untuk mengetahui karakteristik simplisia, kandungan senyawa kimia, serta uji aktivitas antioksidan dari ekstrak etanol rumput laut dengan metode DPPH.
Karakterisasi dan skrining fitokimia dilakukan terhadap serbuk simplisia, selanjutnya serbuk simplisia diekstraksi secara perkolasi dengan etanol 96%. Masing-masing ekstrak dipekatkan dengan bantuan rotary evaporator dan dikeringkan menggunakan freeze dryer sehingga diperoleh ekstrak kental. Ekstrak diuji aktivitas antioksidan dengan menggunakan metode penangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil), dilakukan dengan mengukur absorbansi DPPH pada panjang gelombang 516 nm pada menit ke 30, 45 dan 60. Kemampuan antioksidan diukur sebagai penurunan absorbansi larutan DPPH setelah penambahan ekstrak.
Hasil karakteristik simplisia rumput laut diperoleh kadar air 5,31%, kadar sari yang larut dalam air 3,47%, kadar sari yang larut dalam etanol 0,72%, kadar abu total 8,3% dan kadar abu yang tidak larut dalam asam 0,61%. Hasil skrining fitokimia diperoleh bahwa rumput laut mengandung senyawa steroid/triterpenoid, glikosida, dan saponin. Hasil pengujian aktivitas antioksidan dalam meredam radikal bebas DPPH menunjukkan bahwa ekstrak etanol rumput laut dengan nilai Inhibitory Concentration (IC50) sebesar 685,68 µg/ml, 472,31 µg/ml dan
457,14 µg/ml tidak memiliki aktivitas antioksidan .
CHARACTERIZATION AND PHYTOCHEMICAL SCREENING TEST OF SIMPLEX AND ANTIOXIDANT ACTIVITIES OF Gracilaria verrucosa
(Hudson) Papenfus SEAWEED EXTRACT BY THE METHOD OF DPPH
ABSTRACT
Seaweed or algae are also known as seaweed is a major part of marine plants. Since ancient times, seaweed has been used as foods and medicines. Seaweed contain vitamin A, B1, B2, B6, B12, vitamin C and beta-carotene which are antioxidant compounds may ward off free radicals and can prevent various diseases. The purpose of this study was to determine the characterization of simplex, to determine the chemical compounds contained and to know the antioxidant activity of seaweed ethanol extracts using the method of DPPH.
Characterization and phytochemical screening was done toward powder of simplex, furthermore the powder of simplex was extracted by gradually percolation used solvents ethanol 96%.. Each of extract concentrated using rotary evaporatory and dried using a freeze dryer to obtain viscous extract. Extract was assayed the antioxidant activity used scavenging of free radical DPPH (1,1- diphenyl-2-picrylhydrazil) method, by measured the DPPH absorbance at a wavelength of 516 nm in the 30th, 45th and 60th minutes. Antioxidant capability was measured as a decrease in absorbance of DPPH solution after addition of extract.
The result of seaweed simplex characteristics obtained 5.31% level of water content, levels of water-soluble extract 3.47%, levels of ethanol-soluble extract 0.72%, total ash content 8.3% and ash content that does not dissolve in acid 0.61%. Phytochemical screening result obtained that seaweed contains compounds of steroids/ triterpenoids, glycosides, and saponins. Results of the antioxidant activities test in scavenging free radical DPPH showed that ethanol extract of the seaweed with a value of Inhibitory Concentration (IC50) of
685.68 µg/ml, 472.31 µg/ml and 457.14 µg/ml doesn’t have antioxidant activity.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar belakang ... 1
1.2 Perumusan masalah ... 5
1.3 Hipotesis ... 5
1.4 Tujuan penelitian ... 6
1.5 Manfaat penelitian ... 6
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian tumbuhan ... 6
2.1.1 Habitat dan sebaran rumput laut ... 6
2.1.3 Nama daerah ... 7
2.1.4 Morfologi tumbuhan ... 7
2.1.5 Perkembangbiakan rumput laut ... 7
2.2 Kandungan kimia ... 8
2.3 Ekstraksi ... 8
2.4 Radikal bebas ... 10
2.5 Antioksidan ... 11
2.5.1 Antioksidan alami ... 12
2.5.2 Vitamin C ... 13
2.5.3 Beta karoten ... 14
2.5.4 Vitamin E ... 15
2.5.5 Polifenol ... 16
2.6 Spektrofotometer UV-Visible ... 16
2.7 Penentuan aktivitas antioksidan dengan metode DPPH 17 2.7.1 Pelarut ... 20
2.7.2 Pengukuran absorbansi panjang gelombang ... 20
BAB III METODE PENELITIAN ... 21
3.1 Alat dan Bahan ... 21
3.2 Pengumpulan dan Pengolahan Bahan Tumbuhan ... 22
3.3 Pembuatan larutan pereaksi ... 23
3.3.1 Pereaksi asam klorida 2N ... 23
3.3.2 Pereaksi natrium hidroksida 2N ... 23
3.3.3 Pereaksi Bouchardat ... 23
3.3.5 Pereaksi Dragendorff ... 23
3.3.6 Pereaksi besi (III) klorida 1% ... 24
3.3.7 Pereaksi Liebermann-Burchard ... 24
3.3.8 Pereaksi Molish ... 24
3.3.9 Pereaksi timbal (II) asetat 0,4 N ... 24
3.3.10 Larutan pereaksi asam sulfat 2 N ... 24
3.3.11 Larutan pereaksi DPPH 0,5 mM ... 24
3.4 Karakterisasi simplisia ... 25
3.4.1 Pemeriksaan makroskopik ... 25
3.4.2 Pemeriksaan mikroskopik ... 25
3.4.3 Penetapan kadar air ... 25
3.4.4 Penetapan kadar sari yang larut dalam air ... 26
3.4.5 Penetapan kadar sari yang larut dalam etanol ... 26
3.4.6 Penetapan kadar abu total ... 27
3.4.7 Penetapan kadar abu tidak larut dalam asam ... 27
3.5 Skrining fitokimia ... 27
3.5.1 Pemeriksaan alkaloida ... 27
3.5.2 Pemeriksaan flavanoid ... 28
3.5.3 Pemeriksaan glikosida ... 28
3.5.4 Pemeriksaan Antrakinon ... 29
3.5.5 Pemeriksaan saponin ... 29
3.5.6 Pemeriksaan tannin ... 29
3.5.7 Pemeriksaan steroid/ triterpenoida ... 30
3.6 Pengujian kemampuan antioksidan dengan spektro-
fotometer Visibel ... 31
3.6.1 Prinsip metode penangkapan radikal bebas DPPH 31 3.6.2 Pembuatan larutan blanko ... 31
3.6.3 Penentuan panjang gelombang serapan maksimum 31 3.6.4 Pembuatan larutan induk ... 31
3.6.5 Pembuatan larutan uji ... 32
3.6.6 Penentuan persen peredaman ... 32
3.6.7 Penentuan nilai IC50 ... 32
BAB IV HASIL DAN PEMBAHASAN ... 34
4.1 Hasil identifikasi tumbuhan ... 34
4.2 Hasil Karakterisasi simplisia... 34
4.3 Hasil skrining fitokimia simplisia ... 36
4.4 Hasil pengujian antioksidan ... 37
4.4.1 Hasil panjang gelombang serapan maksimum .... 37
4.5 Hasil analisis aktivitas antioksidan ... 37
4.6 Hasil analisis peredaman radikal bebas DPPH oleh sampel uji ... 39
4.7 Analisis nilai IC50 (Inhibitory concentration) sampel uji 40 BAB V KESIMPULAN DAN SARAN ... 42
5.1 Kesimpulan ... 42
5.2 Saran ... 42
DAFTAR PUSTAKA ... 43
DAFTAR TABEL
Tabel Halaman
4.1 Hasil Skrining fitokimia simplisia rumput laut Gracilaria
verrucosa (Hudson) Papenfus ... 36
4.2 Hasil analisis peredaman radikal bebas oleh ekstrak etanol
rumput laut Gracilaria verrucosa (Hudson) Papenfus... 40
4.3 Hasil persamaan regresi linier yang diperoleh untuk ekstrak etanol rumput laut Gracilaria verrucosa (Hudson)
Papenfus ... 41
4.4 Nilai IC50 ekstrak etanol dari rumput laut Gracilaria
DAFTAR GAMBAR
Gambar Halaman
2.1 Rumus bangun vitamin C ... 14
2.2 Rumus bangun beta karoten ... 14
2.3 Rumus bangun vitamin E ... 15
2.4 Struktur dasar polifenol ... 16
2.5 Rumus bangun DPPH ... 18
2.6 Resonansi DPPH ... 19
2.7 Reaksi antara DPPH dengan atom H netral yang berasal dari antioksidan ... 19
4.1 Kurva serapan maksimum larutan DPPH 100 µg/ml dalam methanol secara spektrofotometri visibel ... 37
4.2 Hasil analisis aktivitas antioksidan ekstrak etanol rumput laut Gracilaria verrucosa (Hudson) Papenfus pada menit ke-30 ... 38
4.3 Hasil analisis aktivitas antioksidan ekstrak etanol rumput laut Gracilaria verrucosa (Hudson) Papenfus pada menit ke-45 ... 38
DAFTAR LAMPIRAN
Lampiran Halaman
1 Hasil Identifikasi rumput laut Gracilaria verrucosa
(Hudson) Papenfus ... 45
2 Gambar Rumput Laut dan serbuk simplisia Gracilaria
verrucosa (Hudson) Papenfus ... 46
3 Gambar Mikroskopik Rumput Laut Gracilaria
verrucosa (Hudson) Papenfus pada pembesaran 10 x 40 ... 48
4 Gambar Spektrofotometer UV-Visible
(Shimadzu UV-1800) ... 49
5 Bagan Penelitian ... 50
6 Bagan pengolahan bahan tumbuhan ... 51
7 Bagan Pembuatan Ekstrak Etanol Rumput Laut
Gracilaria verrucosa (Hudson) Papenfus dan penentuan
nilai IC50 ... 52
8 Hasil Pemeriksaan Karakteristik Serbuk Simplisia ... 53
9 Perhitungan Karakterisasi Simplisia ... 54
10 Hasil uji aktivitas antioksidan ekstrak rumput laut
Glacilaria verrucosa ... 59
11 Perhitungan nilai IC50 ... 62
KARAKTERISASI DAN SKRINING FITOKIMIA SIMPLISIA SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK RUMPUT LAUT Gracilaria
verrucosa (Hudson) Papenfus DENGAN METODE DPPH
ABSTRAK
Rumput laut atau alga yang juga dikenal dengan nama seaweed merupakan bagian terbesar dari tanaman laut. Sejak zaman dahulu, rumput laut telah digunakan sebagai makanan dan obat-obatan. Rumput laut mengandung vitamin A, B1, B2, B6, B12, vitamin C dan beta karoten yang merupakan senyawa antioksidan yang dapat menangkal radikal bebas dan dapat mencegah berbagai macam penyakit. Tujuan penelitian ini adalah untuk mengetahui karakteristik simplisia, kandungan senyawa kimia, serta uji aktivitas antioksidan dari ekstrak etanol rumput laut dengan metode DPPH.
Karakterisasi dan skrining fitokimia dilakukan terhadap serbuk simplisia, selanjutnya serbuk simplisia diekstraksi secara perkolasi dengan etanol 96%. Masing-masing ekstrak dipekatkan dengan bantuan rotary evaporator dan dikeringkan menggunakan freeze dryer sehingga diperoleh ekstrak kental. Ekstrak diuji aktivitas antioksidan dengan menggunakan metode penangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil), dilakukan dengan mengukur absorbansi DPPH pada panjang gelombang 516 nm pada menit ke 30, 45 dan 60. Kemampuan antioksidan diukur sebagai penurunan absorbansi larutan DPPH setelah penambahan ekstrak.
Hasil karakteristik simplisia rumput laut diperoleh kadar air 5,31%, kadar sari yang larut dalam air 3,47%, kadar sari yang larut dalam etanol 0,72%, kadar abu total 8,3% dan kadar abu yang tidak larut dalam asam 0,61%. Hasil skrining fitokimia diperoleh bahwa rumput laut mengandung senyawa steroid/triterpenoid, glikosida, dan saponin. Hasil pengujian aktivitas antioksidan dalam meredam radikal bebas DPPH menunjukkan bahwa ekstrak etanol rumput laut dengan nilai Inhibitory Concentration (IC50) sebesar 685,68 µg/ml, 472,31 µg/ml dan
457,14 µg/ml tidak memiliki aktivitas antioksidan .
CHARACTERIZATION AND PHYTOCHEMICAL SCREENING TEST OF SIMPLEX AND ANTIOXIDANT ACTIVITIES OF Gracilaria verrucosa
(Hudson) Papenfus SEAWEED EXTRACT BY THE METHOD OF DPPH
ABSTRACT
Seaweed or algae are also known as seaweed is a major part of marine plants. Since ancient times, seaweed has been used as foods and medicines. Seaweed contain vitamin A, B1, B2, B6, B12, vitamin C and beta-carotene which are antioxidant compounds may ward off free radicals and can prevent various diseases. The purpose of this study was to determine the characterization of simplex, to determine the chemical compounds contained and to know the antioxidant activity of seaweed ethanol extracts using the method of DPPH.
Characterization and phytochemical screening was done toward powder of simplex, furthermore the powder of simplex was extracted by gradually percolation used solvents ethanol 96%.. Each of extract concentrated using rotary evaporatory and dried using a freeze dryer to obtain viscous extract. Extract was assayed the antioxidant activity used scavenging of free radical DPPH (1,1- diphenyl-2-picrylhydrazil) method, by measured the DPPH absorbance at a wavelength of 516 nm in the 30th, 45th and 60th minutes. Antioxidant capability was measured as a decrease in absorbance of DPPH solution after addition of extract.
The result of seaweed simplex characteristics obtained 5.31% level of water content, levels of water-soluble extract 3.47%, levels of ethanol-soluble extract 0.72%, total ash content 8.3% and ash content that does not dissolve in acid 0.61%. Phytochemical screening result obtained that seaweed contains compounds of steroids/ triterpenoids, glycosides, and saponins. Results of the antioxidant activities test in scavenging free radical DPPH showed that ethanol extract of the seaweed with a value of Inhibitory Concentration (IC50) of
685.68 µg/ml, 472.31 µg/ml and 457.14 µg/ml doesn’t have antioxidant activity.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Indonesia sebagai negara kepulauan di perairan tropis diketahui memiliki
keanekaragaman jenis biota yang tinggi, termasuk keanekaragaman jenis alganya
(Atmadja, 1992). Rumput laut atau alga yang juga dikenal dengan nama seaweed
merupakan bagian terbesar dari tanaman laut. Sejak zaman dahulu, rumput laut
telah digunakan sebagai makanan dan obat-obatan (Winarno, 1990).
Sebagai sumber gizi, rumput laut memiliki kandungan karbohidrat (gula
atau vegetable gum), protein, sedikit lemak, polisakarida sulfat. Selain itu,
rumput laut juga mengandung vitamin-vitamin, seperti vitamin A, B1, B2, B6,
B12 dan C, betakaroten, serta mineral, seperti kalium, kalsium, fosfor, natrium,
zat besi dan iodium. Beberapa jenis rumput laut juga mengandung protein yang
cukup tinggi (Anggadiredja, dkk., 2011).
Ganggang merupakan salah satu sumber makanan yang mengandung
senyawa antioksidan. Jenis ganggang di Indonesia yang mempunyai nilai
ekonomis dan yang sering digunakan adalah ganggang merah karena
komposisinya sangat kompleks, yaitu: agar-agar, karagenan, furcelaran, klorofil,
karoten, fikobilin yang terdiri dari fikosianin dan fikoeritrin, protein, lemak, klor,
kalium, natrium, magnesium, belerang, silikon, fosfor, kalsium, besi, iodium dan
brom (Indriani, 1991). Terdapat beberapa senyawa antioksidan bersifat umum dan
unik dalam alga, yaitu vitamin E, karotenoid, polifenol, pikobiliprotein dan
Ganggang merah mengandung beberapa macam senyawa fenolik,
misalnya asam kafeat, asam ferulat dan asam vanilat (Sreenivasan et al, 2007).
Senyawa fenolik dapat bertindak sebagai antioksidan dengan cara membentuk
kelat dengan ion logam, mencegah pembentukan radikal bebas dan meningkatkan
antioksidan endogen (Jeyanthi et al, 2013).
Berdasarkan penelitian sebelumnya yang dilakukan Cynthia dkk, rumput
laut jenis Gracilaria verrucosa (Hudson) Papenfus bersifat aktif mempunyai
aktivitas anti inflamasi, aktivitas antioksidan, aktivitas allelofatik serta mampu
mengontrol gangguan pada gastrointestinal. Ekstrak Metanol dari rumput laut
Gracilaria verrucosa (Hudson) Papenfus menunjukkan aktivitas antioksidan
terhadap peredaman radikal DPPH dengan nilai IC50 sebesar 480 µg/ml (Cynthia
et al, 2011)
Antioksidan adalah zat yang dapat menetralisir radikal bebas dengan
memberikan elektronnya kepada molekul radikal radikal bebas sehingga tidak
lagi menjadi radikal bebas. Radikal bebas merupakan senyawa yang memiliki satu
atau lebih elektron yang tidak berpasangan dan bersifat sangat reaktif. Selain
terdapat di luar tubuh, radikal bebas juga secara normal dibentuk di dalam tubuh.
Radikal bebas terbentuk di dalam tubuh akibat produk sampingan proses
metabolisme ataupun karena tubuh terpapar radikal bebas melalui pernafasan
(Praptiwi, dkk., 2006).
Radikal bebas dalam jumlah kecil masih dapat ditoleransi, namun
berbahaya dalam jumlah yang berlebih. Radikal bebas akan merusak DNA,
protein dan lipid, perubahan ini dapat mempercepat proses penuaan bahkan
Di dalam tubuh kita terdapat sistem enzim (misalnya enzim superoksida
dismutase) yang dapat berperan sebagai antioksidan. Enzim ini dapat berperan
aktif dalam menanggulangi masalah radikal bebas. Jika di dalam tubuh jumlah
radikal bebas lebih banyak dari enzim yang terdapat dalam tubuh, saat itulah
tubuh memerlukan tambahan antioksidan dari luar tubuh (Kumalaningsih, 2006;
Kosasih, dkk., 2004).
Kebanyakan senyawa antioksidan yang diisolasi dari sumber alami adalah
berasal dari bahan tumbuhan yang dapat berupa senyawa fenolik atau polifenolik
seperti rempah-rempah, dedaunan, teh, buah-buahan, sayur-sayuran dan rumput
laut. Antioksidan sintetik yang dibuat dari bahan-bahan kimia yaitu butylated
hydroxyl toluene (BHT), butylated hydroxyanisole (BHA), TBHQ, PG dan
NDGA yang ditambahkan pada makanan untuk mencegah kerusakan lemak
(Kumalaningsih, 2006).
Beberapa metode pengukuran aktivitas antioksidan digunakan untuk
memonitor dan membandingkan aktivitas antioksidan bahan makanan. Salah satu
metode yang telah dikembangkan untuk menguji aktivitas antioksidan dari bahan
makanan adalah penggunaan radikal 1,1-diphenyl-2-picrylhydrazyl (DPPH).
DPPH merupakan suatu metode yang cepat, sederhana, dan murah untuk
mengukur kapasitas antioksidan melibatkan makanan. DPPH merupakan radikal
bebas yang stabil karena terdapat elektron yang tidak berpasangan, elektron yang
tidak berpasangan tersebut memberikan serapan maksimum pada 517 nm dan
berwarna ungu. Warnanya akan berubah dari ungu menjadi kuning lemah ketika
elektron tersebut berpasangan dengan atom hidrogen yang berasal dari antioksidan
Berdasarkan uraian di atas, maka penulis tertarik melakukan penelitian
untuk mengetahui karakterisasi dari simplisia, kandungan golongan senyawa
kimia dan kekuatan aktivitas antioksidan dari ekstrak etanol rumput laut
Gracilaria verrucosa (Hudson) Papenfus.
1.2 Perumusan masalah
Berdasarkan latar belakang tersebut, maka perumusan masalah dari penelitian
ini adalah:
a. Apakah karakteristik simplisia rumput laut Gracilaria verrucosa (Hudson)
Papenfus dapat diketahui?
b. Apakah kandungan golongan senyawa kimia dari rumput laut Gracilaria
verrucosa (Hudson) Papenfus?
c. Apakah ekstrak etanol dari rumput laut Gracilaria verrucosa (Hudson)
Papenfus memiliki aktivitas antioksidan dan berapa kekuatan aktivitas
antioksidan ekstrak etanol dari rumput laut Gracilaria verrucosa (Hudson)
Papenfus?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis dari penilitian ini
adalah:
a. Karakteristik simplisia rumput laut Gracilaria verrucosa (Hudson)
b. Kandungan golongan senyawa kimia dari rumput laut Gracilaria
verrucosa (Hudson) Papenfus dapat ditentukan dengan melakukan
skrining fitokimia.
c. Ekstrak etanol dari rumput laut Gracilaria verrucosa (Hudson) Papenfus
memiliki aktivitas antioksidan
1.4 Tujuan
Tujuan dari penelitian ini adalah:
a. Untuk menentukan karakteristik simplisia rumput laut Gracilaria
verrucosa (Hudson) Papenfus.
b. Untuk mengetahui golongan senyawa kimia dari rumput laut Gracilaria
verrucosa (Hudson) Papenfus.
c. Untuk mengetahui kekuatan aktivitas antioksidan dari ekstrak etanol
rumput laut Gracilaria verrucosa (Hudson) Papenfus.
1.5 Manfaat
Manfaat dari penelitian ini adalah:
a. Dapat digunakan sebagai acuan tentang karakteristik simplisia rumput laut
Gracilaria verrucosa (Hudson) Papenfus.
b. Dapat memberikan informasi mengenai golongan senyawa-senyawa kimia
yang terkandung dalam rumput laut Gracilaria verrucosa (Hudson)
Papenfus.
c. Dapat memberikan informasi mengenai aktivitas antioksidan dari ekstrak
BAB II
TINJAUAN PUSTAKA
2.1 Uraian tumbuhan
Rumput laut tergolong tumbuhan berderajat rendah, umumnya tumbuh
melekat pada substrat tertentu, tidak mempunyai akar, batang maupun daun sejati;
tetapi hanya menyerupai batang yang disebut talus. Rumput laut tumbuh di alam
dengan melekatkan dirinya pada karang, pasir, batu dan benda keras lainnya
(Anggadiredja, dkk., 2011).
2.1.1 Habitat dan sebaran rumput laut
Pertumbuhan rumput laut Glacilaria sp umumnya lebih baik di tempat
dangkal daripada di tempat dalam. Substrat tempat melekatnya dapat berupa batu,
pasir, lumpur dan karang, kebanyakan lebih menyukai intensitas cahaya yang
lebih tinggi. Suhu merupakan faktor penting untuk pertumbuhan dan pembiakan.
Suhu optimum untuk pertumbuhan adalah antara 20℃− 28℃ , tumbuh pada
kisaran kadar garam yang tinggi dan tahan sampai kadar garam 50 permil, dalam
keadaan basah dapat tahan hidup di atas permukaan air selama satu hari (Aslan,
1998).
Rumput laut Glacilaria sp mempunyai wilayah sebaran budidaya berada
di tambak-tambak di Pantai Utara Jawa (Serang, Bekasi, Karawang, Indramayu,
Cirebon, Brebes, Tegal, Pemalang, Jepara dan Lamongan), Nusa Tenggara Barat
(Sekotong, Lombok Barat dan Teluk Cempi Dompu), Sulawesi Selatan
(Jeneponto, Takalar, Maros, Bulukumba, Sinjai, Bone, Wadjo dan Palopo), serta
2.1.2 Sistematika tumbuhan
Berdasarkan hasil identifikasi LIPI, taksonomi rumput laut Glacilaria
verrucosa (Hudson) Papenfus diklasifikasikan sebagai berikut:
Divisi : Rhodophyta
Kelas : Rhodopyceae
Bangsa : Gigartinales
Suku : Glacilariaceae
Marga : Glacilaria
Jenis : Glacilaria verrucosa (Hudson) Papenfus
2.1.3 Nama daerah
Glacilaria verrucosa mempunyai berbagai nama daerah yaitu bulung
rambut (Bali) dan sango-sango (Sulawesi) (Anggadiredja, dkk., 2011).
2.1.4 Morfologi tumbuhan
Ciri-ciri yang dipunyai Glacilaria verrucosa yaitu talus berbentuk silindris,
licin, dan berwarna kuning-coklat atau kuning hijau. Percabangan berseling tidak
beraturan, memusat ke arah pangkal. Cabang lateral memanjang menyerupai
rambut, ukuran sekitar 25 cm dengan diameter talus 0,5-1,5 mm (Anggadiredja,
dkk., 2011).
2.1.5 Perkembangbiakan rumput laut
Faktor biologi utama yang menghambat produktivitas rumput laut yaitu
faktor persaingan dan pemangsa dari hewan herbivora. Faktor morbiditas dan
mortalitas rumput laut itu sendiri juga dapat disebabkan oleh penyakit akibat dari
yang buruk, serta tumbuhnya tanaman penempel (parasit) (Anggadiredja, dkk.,
2011).
Perkembangbiakan rumput laut dapat terjadi melalui dua cara, yaitu secara
vegetatif dengan talus dan secara generatif dengan talus diploid yang
menghasilkan spora. Perbanyakan secara vegetatif dikembangkan dengan cara
stek, yaitu potongan talus yang kemudian tumbuh menjadi tanaman baru.
Sementara, perbanyakan secara generatif dikembangkan melalui spora, baik
alamiah maupun melalui budidaya. Pertemuan dua gamet membentuk zygot yang
selanjutnya berkembang menjadi sporofit. Individu baru inilah yang
mengeluarkan spora dan berkembang melalui pembelahan dalam sporogenesis
menjadi gametofit (Anggadiredja, dkk., 2011).
2.2 Kandungan kimia
Rumput laut Glacilaria verrucosa merupakan jenis Glacilaria, yang
menghasilkan metabolit primer senyawa hidrokoloid yang disebut agar
(Anggadiredja, dkk, 2010). Jenis rumput laut yang termasuk dalam kelas
Rhodophyceae (alga merah) mengandung pigmen antar lain adalah klorofil a,
klorofil d, dan karoten, lutein, zeaxanthin, fikosianin dan fikoeritrin.
Fikoeritrin merupakan pigmen yang dominan yang menyebabkan warna merah
pada alga merah (Dawes, 1981).
2.3 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke
dalam golongan minyak atsiri, alkaloid, flavonoid dan lain-lain. Diketahuinya
senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut
dan cara ekstraksi yang tepat (DepKes RI, 2000).
Menurut Departemen Kesehatan RI (2000), beberapa metode ekstraksi
yang sering digunakan dalam berbagai penelitian antara lain yaitu:
A. Cara dingin
1. Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman
menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada
suhu kamar. Maserasi kinetik dilakukan dengan pengadukan yang kontinu.
Remaserasi dilakukan dengan pengulangan penambahan pelarut setelah dilakukan
penyarian maserat pertama dan seterusnya.
2. Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu
baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada suhu
kamar. Proses perkolasi terdiri dari tahapan pengembangan bahan, tahap maserasi
antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) yang terus-
menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan.
B. Cara panas
1. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan pelarut
pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas
2. Digesti
Digesti adalah proses penyarian simplisia dengan pengadukan secara
terus-menerus pada temperatur yang lebih tinggi dari suhu kamar, yaitu secara
umum dilakukan pada temperatur 40-50°C.
3. Sokletasi
Sokletasi adalah proses penyarian simplisia dengan menggunakan pelarut
yang selalu baru, yang umumnya dilakukan dengan alat khusus (menggunakan
alat Sokhlet) sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif
konstan dengan adanya pendingin balik.
4. Infundasi
Infundasi adalah proses penyarian simplisia dengan menggunakan pelarut
air pada temperatur 90°C selama waktu 15 menit.
5. Dekoktasi
Dekoktasi adalah proses penyarian simplisia dengan menggunakan pelarut air
pada temperatur 90°C selama 30 menit.
2.4 Radikal bebas
Radikal bebas adalah setiap molekul yang mengandung satu atau lebih
elektron yang tidak berpasangan. Radikal bebas sangat reaktif dan dengan mudah
menjurus ke reaksi yang tidak terkontrol menghasilkan ikatan silang dengan
DNA, protein, lipida, atau kerusakan oksidatif pada gugus fungsional yang
penting pada biomolekul. Perubahan ini akan menyebabkan proses penuaan.
Radikal bebas juga terlibat dan berperan dalam patologi dari berbagai penyakit
degeneratif lainnya (Silalahi, 2006). Radikal bebas dapat masuk dan terbentuk
dalam tubuh melalui pernafasan, kondisi lingkungan yang tidak sehat dan
makanan berlemak (Kumalaningsih, 2006).
2.5 Antioksidan
Antioksidan adalah senyawa yang mempunyai struktur molekul yang dapat
memberikan elektronnya kepada molekul radikal bebas dan dapat memutus reaksi
berantai dari radikal bebas (Kumalaningsih, 2006). Antioksidan atau reduktor
berfungsi untuk mencegah terjadinya oksidasi atau menetralkan senyawa yang
telah teroksidasi dengan cara menyumbangkan hidrogen dan atau elektron
(Silalahi, 2006).
Menurut Kumalaningsih (2006), antioksidan dapat dikelompokkan
menjadi 5 yakni:
a. Antioksidan primer
Antioksidan ini berfungsi untuk mencegah terbentuknya radikal bebas
yang baru karena dapat merubah radikal bebas yang ada menjadi molekul yang
berkurang dampak negatifnya, yaitu sebelum sempat bereaksi. Contohnya adalah
enzim superoksida dismutase (SOD) yang berfungsi sebagai pelindung hancurnya
sel-sel dalam tubuh karena radikal bebas.
b. Antioksidan sekunder
Antioksidan sekunder merupakan senyawa yang berfungsi menangkap
radikal bebas serta mencegah terjadinya reaksi berantai sehingga tidak terjadi
kerusakan yang lebih besar. Contohnya adalah vitamin E, vitamin C dan
c. Antioksidan tersier
Antioksidan tersier merupakan senyawa yang memperbaiki kerusakan sel-
sel dan jaringan yang rusak karena serangan radikal bebas, biasanya yang
termasuk kelompok ini adalah jenis enzim misalnya metionin sulfoksidan
reduktase yang dapat memperbaiki DNA dalam inti sel. Enzim tersebut
bermanfaat untuk perbaikan DNA pada penderita kanker.
d. Oxygen scavanger
Antioksidan yang termasuk oxygen scavanger mengikat oksigen sehingga
tidak mendukung reaksi oksidasi, misalnya vitamin C.
e. Chelators atau sequesstrants
Mengikat logam yang mampu mengkatalisis reaksi oksidasi misalnya
asam sitrat dan asam amino. Khasiat antioksidan untuk mencegah berbagai
penyakit akibat pengaruh oksidatif akan lebih efektif jika kita mengkonsumsi
sayur-sayuran dan buah-buahan yang kaya akan antioksidan dari berbagai jenis
daripada menggunakan antioksidan tunggal. Efek antioksidan lebih efektif
daripada suplemen antioksidan yang diisolasi (Silalahi, 2006).
2.5.1 Antioksidan alami
Sayur-sayuran dan buah-buahan kaya akan zat gizi (vitamin, mineral, serat
pangan) serta berbagai kelompok zat bioaktif lain yang disebut zat fitokimia. Zat
bioaktif ini bekerja secara sinergis, meliputi mekanisme enzim detoksifikasi,
peningkatan sistem kekebalan, pengurangan agregasi platelet, pengaturan sintesis
kolesterol dan metabolisme hormon, penurunan tekanan darah, antioksidan,
Senyawa antioksidan alami tumbuhan umumnya adalah senyawa fenolik
atau polifenolik yang dapat berupa golongan flavonoid, turunan asam sinamat,
kumarin dan tokoferol. Golongan flavonoid yang memiliki aktivitas antioksidan
meliputi flavon, flavonol, isoflavon, katekin, flavanon dan kalkon. Senyawa
antioksidan alami polifenolik dapat bereaksi sebagai pereduksi, penangkap radikal
bebas, pengkelat logam dan peredam terbentuknya singlet oksigen
(Kumalaningsih, 2006).
2.5.2 Vitamin C
Vitamin C atau asam askorbat mempunyai berat molekul 176,13 dengan
rumus molekul C6H8O6. Asam askorbat mengandung tidak kurang dari 99,0%
C6H8O6. Pemerian vitamin C adalah hablur atau serbuk putih atau agak kuning.
Oleh pengaruh cahaya lambat laun menjadi berwarna gelap. Dalam keadaan
kering stabil di udara, dalam larutan cepat teroksidasi. Melebur pada suhu lebih
kurang 190o. Kelarutan vitamin C mudah larut dalam air, agak sukar larut dalam
etanol, praktis tidak larut dalam kloroform, dalam eter dan dalam benzen (Ditjen
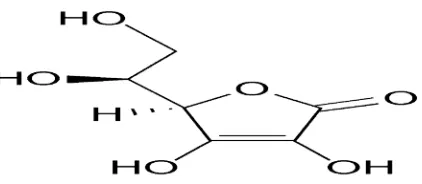
POM, 1995). Rumus bangun Vitamin C dapat dilihat pada Gambar 2.1.
Gambar 2.1 Rumus bangun vitamin C (Silalahi, 2006).
Vitamin C merupakan salah satu senyawa kimia yang mempunyai potensi
sebagai antioksidan dengan mendonorkan hidrogen dari gugus hidroksilnya
koroner, mencegah kanker, meningkatkan sistem kekebalan tubuh terhadap
infeksi dan virus serta dalam regenerasi vitamin E (Silalahi, 2006).
2.5.3 Betakaroten
Betakaroten merupakan salah satu provitamin A yang berperan sebagai
antioksidan dan dipercaya dapat menurunkan resiko penyakit jantung dan kanker.
Betakaroten terdapat pada aprikot, wortel dan mangga dan dengan mengkonsumsi
50 mg betakaroten tiap hari dalam menu makanan dapat mengurangi risiko
terkena penyakit jantung (Kosasih, 2004). Rumus bangun betakaroten dapat
dilihat pada Gambar 2.2.
Gambar 2.2 Rumus bangun betakaroten (Silalahi, 2006).
Betakaroten bekerja sebagai antioksidan dengan cara memperlambat fase
inisiasi. Pemberian vitamin A dalam dosis tinggi dapat bersifat toksis. Akan tetapi,
betakaroten dalam jumlah banyak mampu memenuhi kebutuhan vitamin A dan
selebihnya tetap sebagai betakaroten yang berfungsi sebagai antioksidan (Silalahi,
2006).
2.5.4 Vitamin E
Vitamin E terdiri dari struktur tokoferol, bersifat tidak larut dalam air tapi
larut dalam lemak atau minyak. Struktur molekul vitamin E di bawah
dengan mudah menyumbangkan atom hidrogen pada gugus hidroksil (OH) dari
struktur cincin ke radikal bebas sehingga radikal bebas menjadi tidak reaktif.
Dengan menyumbangkan hidrogen, vitamin E sendiri menjadi suatu radikal, tetapi
lebih stabil karena elektron yang tidak berpasangan pada atom oksigen mengalami
delokalisasi ke dalam struktur cincin aromatik (Silalahi, 2006).
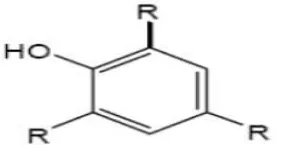
Gambar 2.3 Rumus bangun vitamin E (Silalahi, 2006).
2.5.5 Polifenol
Polifenol adalah kelompok zat kimia yang ditemukan pada tumbuhan. Zat
ini memiliki tanda khas yakni memiliki banyak gugus fenol dalam molekulnya.
Polifenol memiliki spektrum luas dengan sifat kelarutan pada suatu pelarut yang
berbeda-beda. Hal ini disebabkan oleh gugus hidroksil pada senyawa tersebut
yang dimiliki berbeda jumlah dan posisinya (Hattenschwiler, 2000). Struktur
dasar polifenol dapat dilihat pada Gambar 2.4.
Turunan polifenol sebagai antioksidan dapat menstabilkan radikal bebas
dengan melengkapi kekurangan elektron yang dimiliki radikal bebas, dan
menghambat terjadinya reaksi berantai dari pembentukan radikal bebas. Polifenol
merupakan komponen yang bertanggung jawab terhadap aktivitas antioksidan
dalam buah dan sayuran (Hattenschwiler, 2000).
2.6 Spektrofotometer UV-Visible
Prinsip kerja Spektrofotometer Visible adalah sinar/cahaya dilewatkan
melewati sebuah wadah (kuvet) yang berisi larutan, dimana akan menghasilkan
spektrum. Sebagian dari cahaya tersebut akan diserap dan sisanya akan dilewatkan.
Nilai absorbansi dari cahaya yang dilewatkan akan sebanding dengan konsentrasi
larutan di dalam kuvet. Alat ini menggunakan hukum Lambert Beer sebagai acuan
(Ewing, 1975).
Ahli kimia telah lama menggunakan warna sebagai bantuan dalam
mengenali zat-zat kimia. Spektrofotometri dapat dianggap sebagai perluasan suatu
pemeriksaan visual, yaitu dengan menggunakan alat untuk mengukur absorpsi
energi radiasi macam-macam zat kimia dan memungkinkan dilakukannya
pengukuran kualitatif dari suatu zat dengan ketelitian yang lebih besar (Day,
1994).
Spektrofotometer UV/Visibel pada dasarnya terdiri atas sumber sinar
monokromator, tempat sel untuk zat yang diperiksa, detektor, penguat arus dan
alat ukur atau pencatat. Panjang gelombang untuk sinar ultraviolet antara 200-400
nm sedangkan panjang gelombang untuk sinar tampak/visible antara 400-750 nm
2.7 Penentuan aktivitas antioksidan dengan metode DPPH
Metode untuk menentukan aktivitas antioksidan ada beberapa cara, yaitu:
(1). BCB Method (β-Carotene Bleaching Method) atau Metode Pemutihan β-
karoten, (2). DPPH (1,1-difenil-2- picrylhydrazil) Radical Scavenging Method
(Metode Pemerangkapan Radikal Bebas DPPH), (3). Thiobarbituric Acid-
Reactive Substance (TBARS) Assay, (4). ORAC Assay (Oxygen-Radical
Absorbance Capacity), (5). CUPRAC Assay (Cupric Reducing Antioxidant
Capacity), (6). FRAP Assay (Ferric Reducing Antioxidant Power), (7).
Determination of Conjugated Dienes, (8). Determination of Lipid Hydroperoxides
(De la Rosa, 2010).
Pada tahun 1922, Goldschmidt dan Renn menemukan senyawa berwarna
ungu radikal bebas stabil DPPH, yang sekarang digunakan sebagai reagen
kolorimetri untuk proses redoks. DPPH berwarna sangat ungu seperti KMnO4 dan
bentuk tereduksinya yaitu 1,1-difenil-2- picrylhydrazine (DPPH-H) yang
berwarna oranye-kuning. DPPH bersifat tidak larut dalam air (Ionita, 2005).
DPPH merupakan radikal bebas yang stabil pada suhu kamar dan sering
digunakan untuk mengevaluasi aktivitas antioksidan beberapa senyawa atau
ekstrak bahan alam. Interaksi antioksidan dengan DPPH baik secara transfer
elektron atau radikal hidrogen pada DPPH, akan menetralkan radikal bebas dari
DPPH dan membentuk DPPH tereduksi. Jika semua elektron pada radikal bebas
DPPH menjadi berpasangan, maka warna larutan berubah dari ungu tua menjadi
Perubahan ini dapat diukur sesuai dengan jumlah elektron atau atom hidrogen
yang ditangkap oleh molekul DPPH akibat adanya zat reduktor (Molyneux, 2004).
Metode DPPH merupakan suatu metode yang cepat, sederhana, dan murah
yang dapat digunakan untuk mengukur kemampuan antioksidan yang terkandung
dalam makanan. Metode DPPH dapat digunakan untuk sampel yang padat dan
juga dalam bentuk larutan dan berlaku untuk keseluruhan kapasitas antioksidan
sampel. Prinsipnya adalah elektron ganjil pada molekul DPPH memberikan
serapan maksimum pada panjang gelombang tertentu yang berwarna ungu. Warna
ini akan berubah dari ungu menjadi kuning lemah apabila elektron ganjil tersebut
berpasangan dengan atom hidrogen yang disumbangkan senyawa antioksidan.
Perubahan warna ini berdasarkan reaksi kesetimbangan kimia (Prakash, 2001).
Molyneux (2004), menyatakan bahwa suatu zat mempunyai sifat
antioksidan bila nilai IC50 kurang dari 200 ppm. Bila nilai IC50 yang diperoleh
berkisar antara 200-1000 ppm, maka zat tersebut kurang aktif namun masih
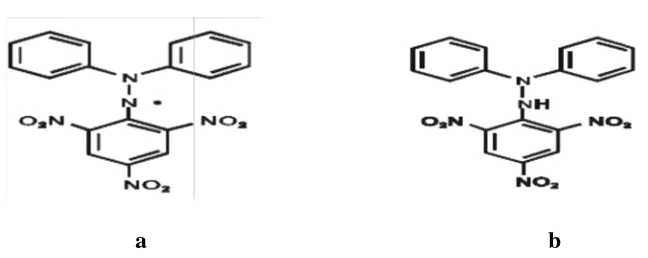
berpotensi sebagai zat antioksidan. Rumus molekul DPPH dapat dilihat pada
Gambar 2.5.
a b
Gambar 2.5 Rumus Bangun DPPH (Molyneux, 2004)
Keterangan:
DPPH merupakan radikal bebas yang stabil karena
dialaminya. Resonansi DPPH dan reaksi DPPH dengan atom
resonansi yang
H netral yang
berasal dari senyawa-senyawa yang bersifat antioksidan dapat dilihat pada
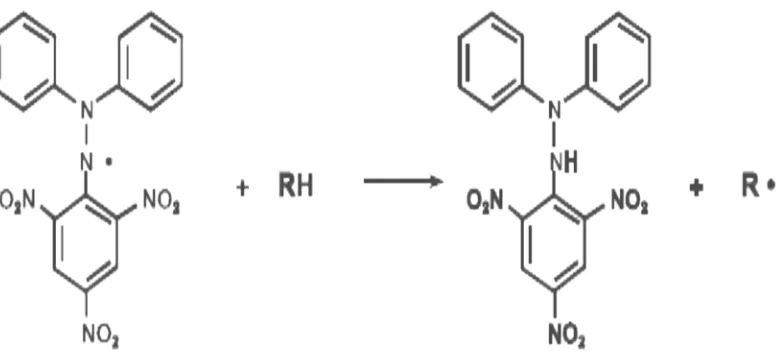
Gambar 2.6 dan Gambar 2.7.
Gambar 2.6 Resonansi DPPH (Molyneux, 2004)
Gambar 2.7 Reaksi antara DPPH dengan atom H netral yang berasal dari antioksidan (Molyneux, 2004).
Parameter yang dipakai untuk menunjukan aktivitas antioksidan adalah
menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat
antioksidan yang memberikan % penghambatan 50%. Zat yang mempunyai
aktivitas antioksidan tinggi, akan mempunyai harga EC50 atau IC50 yang rendah
(Molyneux, 2004).
2.7.1 Pelarut
Metode ini akan memberikan hasil yang baik dengan menggunakan pelarut
metanol atau etanol dan kedua pelarut ini tidak mempengaruhi dalam reaksi antara
sampel uji sebagai antioksidan dengan DPPH sebagai radikal bebas (Molyneux,
2004).
2.7.2 Pengukuran absorbansi panjang gelombang
Panjang gelombang maksimum (λmaks) yang digunakan dalam pengukuran
sampel uji sangat bervariasi. Menurut beberapa literatur panjang gelombang
maksimum untuk DPPH antara lain 515 nm, 516 nm, 517 nm, 518 nm, 519 nm
dan 520 nm. Pada prakteknya hasil pengukuran yang memberikan peak
maksimum itulah panjang gelombangnya yaitu sekitar panjang gelombang yang
BAB III
METODE PENELITIAN
Jenis penelitian yang dilakukan adalah penelitian eksperimental.
Metodologi penelitian meliputi pengumpulan dan preparasi bahan, karakterisasi
simplisia, pembuatan ekstrak etanol, skrining fitokimia dan uji aktivitas
antioksidan dengan metode aktivitas antiradikal bebas DPPH dengan
menggunakan alat spektrofotometer visibel.
3.1 Alat dan bahan
3.1.1 Alat-alat
Alat-alat yang digunakan terdiri dari: Alat alat gelas laboratorium
(Erlenmeyer, gelas beaker, gelas corong, gelas ukur, labu alas bulat, labu
tentukur, pendingin Liebig, tabung reaksi), penguap vakum putar (Heidolph VV
2000), freeze dryer (Modulyo/Edwards), desikator, gelas penutup, mikroskop,
krus porselin, krus tang, lemari pengering, neraca analitis (Vibra), object glass,
penangas air (Yenaco), pisau, timbangan, spektofotometer UV/Vis (Shimadzu
UV-1800) dan tanur (Gallenkamp)
3.1.2 Bahan-bahan
Bahan tumbuhan yang digunakan pada penelitian ini adalah rumput laut
Gracilaria verrucosa (Hudson) Papenfus. Bahan bahan kimia yang lainnya adalah
berkualitas pro analisis produksi Sigma: 1,1-diphenyl-2-picrylhydrazyl (DPPH);
produksi E-Merck: asam klorida pekat, asam sulfat pekat, asam asetat anhidrida,
kalium iodida, besi (III) klorida, timbal (II) asetat, kloralhidrat, kloroform,
isopropanol, natrium hidroksida dan amil alkohol.
3.2 Pengumpulan dan pengolahan bahan tumbuhan
3.2.1 Pengumpulan bahan tumbuhan
Bahan tumbuhan yang digunakan dalam penelitian ini adalah rumput laut
Gracilaria verrucosa (Hudson) Papenfus, yang diambil dari pertambakan Rusdi
Agin, Desa Sei Merah, Dusun Sei Tiram, Kecamatan Pangkalan Susu, Kabupaten
Langkat, Provinsi Sumatera Utara pada bulan September tahun 2013.
Pengambilan bahan tumbuhan dilakukan secara purposif yaitu tanpa
membandingkan dengan tumbuhan serupa dari daerah lain.
3.2.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Pusat Penelitian Oseanografi – LIPI,
Jakarta. Hasil determinasi menunjukan bahan tumbuhan adalah rumput laut
Gracilaria verrucosa (Hudson) Papenfus. Hasil identifikasi rumput laut dapat
dilihat pada Lampiran 1, halaman 45.
3.2.3 Pengolahan tumbuhan
Rumput laut Gracilaria verrucosa (Hudson) Papenfus yang baru diambil
dibersihkan dari kotoran, dicuci dengan air bersih, ditiriskan di atas kertas
perkamen, dirajang, kemudian ditimbang berat basahnya sebesar 5,2 kg,
selanjutnya dikeringkan di lemari pengering hingga kering dan mudah dipatahkan,
lalu ditimbang berat keringnya sebesar 1,15 kg, selanjutnya simplisia kering
3.3 Pembuatan pereaksi
3.3.1 Pereaksi asam klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling hingga
100 ml (Ditjen POM, 1979).
3.3.2 Pereaksi natrium hidroksida 2 N
Sebanyak 8,002 g natrium hidroksida dilarutkan dalam air suling bebas
karbon dioksida hingga 100 ml (Ditjen POM, 1979).
3.3.3 Pereaksi Bouchardat
Sebanyak 2 g iodium dan 4 g kalium iodida dilarutkan dalam air suling
hingga 100 ml (Ditjen POM, 1995).
3.3.4 Pereaksi Mayer
Sebanyak 1,569 g raksa (II) klorida dilarutkan dalam air suling hingga 60
ml. Pada wadah lain dilarutkan 5 g kalium iodida dalam 10 ml air suling.
Kemudian keduanya dicampurkan dan ditambahkan air suling hingga diperoleh
larutan 100 ml ( Ditjen POM,1995).
3.3.5 Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat dilarutkan dalam asam nitrat pekat 20 ml
kemudian dicampurkan dengan larutan kalium iodida sebanyak 27,2 g dalam 50
ml air suling. Campuran didiamkan sampai memisah sempurna. Larutan jernih
diambil dan diencerkan dengan air suling secukupnya hingga 100 ml (Ditjen
POM, 1995).
3.3.6 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling hingga 100 ml
3.3.7 Pereaksi Liebermann-Burchard
Campur secara perlahan 5 ml asam asetat anhidrida dengan 5 ml asam
sulfat pekat tambahkan etanol hingga 50 ml (Merck, 1978).
3.3.8 Pereaksi Molish
Sebanyak 3 g α-naftol dilarutkan dalam asam nitrat 0,5 N secukupnya
hingga diperoleh 100 ml larutan (Ditjen POM, 1979).
3.3.9 Pereaksi timbal (II) asetat 0,4 N
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air suling bebas
karbon dioksida secukupnya hingga 100 ml (Ditjen POM, 1995).
3.3.10 Larutan pereaksi asam sulfat 2 N
Sebanyak 5,5 ml asam sulfat pekat diencerkan dengan air suling hingga
diperoleh 100 ml (Ditjen POM, 1995).
3.3.11 Larutan Pereaksi DPPH 0,5 mM (Konsentrasi 200ppm)
Sebanyak 19,7 mg DPPH ditimbang, kemudian dilarutkan dalam metanol
hingga volume 100 ml (Molyneux, 2004).
3.4 Karakterisasi simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik,
pemeriksaan mikroskopik, penetapan kadar air, penetapan kadar sari yang larut
dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total
dan penetapan kadar abu yang tidak larut dalam asam.
3.4.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk luar dari
3.4.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia rumput laut
Gracilaria verrucosa (Hudson) Papenfus. Serbuk simplisia diletakkan pada kaca
objek yang berbeda yang telah ditetesi larutan kloralhidrat kemudian ditutup
dengan kaca penutup, dipanaskan dan diamati di bawah mikroskop.
3.4.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen).
Cara kerja :
Sebanyak 200 ml toluena dan 2 ml air suling dimasukkan ke dalam labu
alas bulat, didestilasi selama 2 jam. Setelah itu toluen dibiarkan mendingin
selama 30 menit dan volume air pada tabung penerima dibaca. Sebanyak 5 g
serbuk simplisia rumput laut Gracilaria verrucosa (Hudson) Papenfus yang telah
ditimbang seksama dimasukkan ke dalam labu, lalu dipanaskan hati-hati selama
15 menit. Setelah toluen mendidih, kecepatan tetesan diatur 2 tetes per detik,
sampai sebagian air terdestilasi, kemudian kecepatan destilasi dinaikkan hingga 4
tetes per detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas
dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima
dibiarkan dingin sampai suhu kamar. Setelah air dan toluen memisah sempurna,
volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air dibaca
dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air
dihitung dalam persen (WHO, 1992).
3.4.4 Penetapan kadar sari larut air
Sebanyak 5 g serbuk simplisia rumput laut Gracilaria verrucosa (Hudson)
air-kloroform (2,5 ml kloroform dalam air sampai 1 liter) dalam labu bersumbat
sambil sesekali dikocok selama 6 jam pertama, lalu dibiarkan selama 18 jam, lalu
disaring. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan dangkal
berdasar rata yang telah ditara, dan sisa dipanaskan pada suhu 105º C sampai
bobot tetap. Kadar sari larut dalam air dihitung terhadap bahan yang telah
dikeringkan (Ditjen POM, 1989).
3.4.5 Penetapan kadar sari larut etanol
Sebanyak 5 g serbuk simplisia rumput laut Gracilaria verrucosa (Hudson)
Papenfus yang telah dikeringkan di udara dimaserasi selama 24 jam dalam 100 ml
etanol 96% dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama,
kemudian dibiarkan selama 18 jam, lalu disaring cepat untuk menghindari
penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan
dangkal berdasar rata yang telah ditara dan sisa dipanaskan pada suhu 105ºC
sampai bobot tetap. Kadar sari larut dalam etanol dihitung terhadap bahan yang
telah dikeringkan (Ditjen POM, 1989).
3.4.6 Penetapan kadar abu total
Sebanyak 2 g serbuk simplisia rumput laut Gracilaria verrucosa yang
telah digerus dan ditimbang seksama dimasukkan dalam krus porselin yang telah
dipijar dan ditara, lalu diratakan. Krus dipijarkan pada suhu 600ºC sampai arang
habis, kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar
abu dihitung terhadap bahan yang telah dikeringkan (Ditjen POM, 1989).
3.4.7 Penetapan kadar abu tidak larut asam
Abu yang telah diperoleh dalam penetapan kadar abu total dididihkan
asam dikumpulkan, disaring melalui kertas saring bebas abu kemudian dicuci
dengan air panas. Residu dan kertas saring dipijarkan pada suhu 600ºC sampai
bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu tidak larut dalam
asam dihitung terhadap bahan yang dikeringkan (Ditjen POM, 1989).
3.5 Skrining fitokimia
Skrining fitokimia serbuk simplisia meliputi pemeriksaan alkaloida,
flavonoida, glikosida, antrakinon, saponin, tanin dan steroid/triterpenoid.
3.5.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g, ditambahkan 10 ml asam
klorida 0,2 N, dipanaskan di atas penangas air selama 10 menit, didinginkan dan
disaring. Filtrat yang diperoleh dipakai untuk uji alkaloid. Ke dalam 3 tabung
reaksi dimasukkan 0,5 ml filtrat.
Pada masing-masing tabung reaksi :
1. ditambahkan 2 tetes pereaksi Mayer
2. ditambahkan 2 tetes pereaksi Dragendorff
3. ditambahkan 2 tetes pereaksi Bouchardat
Alkaloid positif jika terjadi endapan atau kekeruhan pada dua dari tiga pereaksi di
atas (Ditjen POM, 1989).
3.5.2 Pemeriksaan flavonoida
Sebanyak 10 g serbuk ditambahkan 10 ml air panas, dididihkan selama 5
menit dan disaring dalam keadaan panas, ke dalam 5 ml filtrat ditambahkan 0,1 g
dan dibiarkan memisah. Flavonoida positif jika terjadi warna merah atau kuning
atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.5.3 Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g, lalu disari dengan 30 ml
campuran etanol 95% dengan air (7:3) dan 10 ml asam klorida 2 N, direfluks
selama 2 jam, didinginkan dan disaring. Diambil 20 ml filrat ditambahkan 25 ml
air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu
disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3),
dilakukan berulang sebanyak 3 kali. Sari air dikumpulkan dan diuapkan pada
temperatur tidak lebih dari 50٥C. Sisanya dilarutkan dalam 2 ml metanol. Larutan
metanol digunakan untuk percobaan berikut: 0,1 ml larutan percobaan dimasukan
dalam tabung reaksi dan diuapkan diatas penangas air. Pada sisa ditambahkan 2
ml air dan 5 tetes pereaksi Molish. Kemudian secara perlahan-lahan ditambahkan
2 ml asam sulfat pekat melalui dinding tabung, terbentuknya cincin berwarna
ungu pada batas kedua cairan menunjukkan ikatan gula (Ditjen POM, 1989).
3.5.4 Pemeriksaan antrakinon
Serbuk simplisia ditimbang sebanyak 0,2 g, ditambahkan 5 ml asam sulfat
2 N, dipanaskan sebentar, setelah dingin ditambahkan 10 ml benzen, dikocok dan
didiamkan. Lapisan benzen dipisahkan dan disaring. Dikocok lapisan benzen
dengan 2 ml NaOH 2 N, didiamkan. Lapisan air berwarna merah dan lapisan
benzen tidak berwarna menunjukkan adanya antrakinon (Ditjen POM, 1989).
3.5.5 Pemeriksaan saponin
Serbuk simplisia ditimbang sebanyak 0,5 g dan dimasukan ke dalam
kuat-kuat selama 10 detik. Terbentuk busa setinggi 1-10 cm yang stabil tidak
kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2
N menunjukkan adanya saponin (Ditjen POM, 1989).
3.5.6 Pemeriksaan tanin
Serbuk simplisia ditimbang sebanyak 1 g, dididihkan selama 3 menit
dalam 100 ml air suling lalu didinginkan dan disaring. Pada filtrat ditambahkan 1-
2 tetes peraksi besi (III) klorida 1%. Jika terjadi warna biru kehitaman atau hijau
kehitaman menunjukan adanya tanin (Farnsworth, 1966).
3.5.7 Pemeriksaan steroida/triterpenoida
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml n-heksan selama 2
jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan
beberapa tetes pereaksi Liebermann-Burchard. Timbulnya warna biru atau biru
hijau menunjukan adanya steroida, sedangkan warna merah, merah muda atau
ungu menunjukkan adanya triterpenoida (Harborne, 1987).
3.5.8 Pembuatan ekstrak etanol
Pembuatan ekstrak etanol dari rumput laut Gracilaria verrucosa (Hudson)
Papenfus dilakukan dengan cara perkolasi. Prosedur pembuatan ekstrak sebanyak
100 g serbuk simplisia dibasahi dengan etanol 96 % dan dibiarkan selama 3 jam,
kemudian dimasukkan ke dalam alat perkolator, lalu dituang cairan penyari etanol
sampai semua simplisia terendam dan terdapat selapis cairan penyari diatasnya,
mulut tabung perkolator ditutup dengan alumunium foil dan dibiarkan selama 24
jam, kemudian kran dibuka dan dibiarkan tetesan ekstrak mengalir dengan
kecepatan perkolat diatur 1 ml /menit, perkolat ditampung. Perkolasi dihentikan
Lieberman-Burchard, kemudian dipekatkan dengan alat penguap vakum putar
setelah itu di freeze dryer hingga diperoleh ekstrak kental. Bagan ekstraksi dapat
dilihat pada Lampiran 7, halaman 38 (Ditjen POM, 1979).
3.6 Pengujian kemampuan antioksidan dengan spektrofotometer visibel
3.6.1 Prinsip metode penangkapan radikal bebas DPPH
Kemampuan sampel uji dalam meredam DPPH (1,1-Diphenyl-2-Picryl-
hidrazyl) sebagai radikal bebas dalam larutan metanol (sehingga terjadi
peredaman warna ungu DPPH) dengan nilai IC50 (konsentrasi sampel uji yang
mampu meredam radikal bebas sebesar 50%) digunakan sebagai parameter untuk
menentukan aktivitas antioksidan sampel uji tersebut.
3.6.2 Pembuatan larutan blanko
Larutan DPPH 0,5 mM (konsentrasi 200 µg/ml) dipipet sebanyak 5 ml,
kemudian dimasukkan ke dalam labu tentukur 25 ml, dicukupkan volumenya
dengan metanol sampai garis tanda (konsentrasi 40 µg/ml).
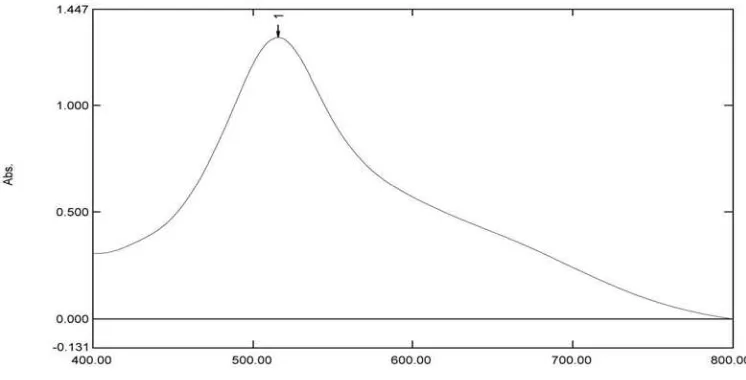
3.6.3 Penentuan panjang gelombang serapan maksimum
Larutan DPPH konsentrasi 40 µg/ml dihomogenkan dan diukur
serapannya pada panjang gelombang 400-800 nm. Gambar spektrofotometer dapat
dilihat pada Lampiran 4, halaman 49.
3.6.4 Pembuatan larutan induk
Sebanyak 25 mg ekstrak rumput laut Gracilaria verrucosa (Hudson)
Papenfus ditimbang kemudian dilarutkan dalam labu tentukur 25 ml dengan
metanol lalu volumenya dicukupkan dengan metanol sampai garis tanda
3.6.5 Pembuatan larutan uji
Larutan induk dipipet sebanyak 2,5 ml; 5 ml; 7,5 ml; 10 ml kemudian
masing-masing dimasukkan ke dalam labu tentukur 25 ml (untuk mendapatkan
konsentrasi 100 µg/ml, 200 µg/ml, 300 µg/ml, 400 µg/ml), kemudian dalam
masing-masing labu tentukur ditambahkan 5 ml larutan DPPH 0,5 mM
(konsentrasi 40 µg/ml) lalu volume dicukupkan dengan metanol sampai garis
tanda, didiamkan di tempat gelap, lalu diukur serapannya pada menit ke-30, 45
dan 60.
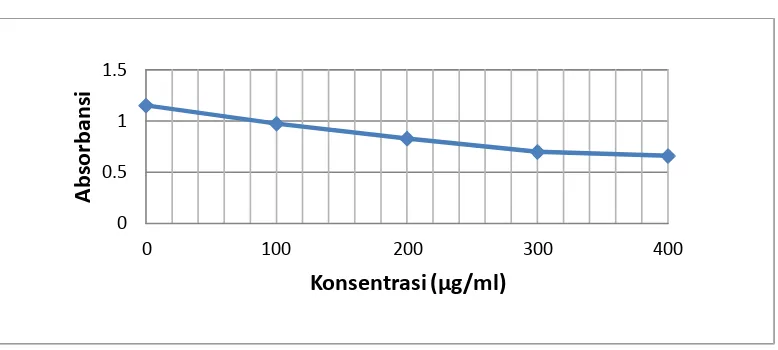
3.6.6 Penentuan persen peredaman
Kemampuan antioksidan diukur sebagai penurunan serapan larutan DPPH
(peredaman warna ungu DPPH) akibat adanya penambahan larutan uji. Nilai
serapan larutan DPPH sebelum dan sesudah penambahan larutan uji tersebut
dihitung sebagai persen peredaman.
% Peredaman = A kontrol − A sampel
A kontrol × 100%
Keterangan : A Kontrol = Absorbansi tidak mengandung sampel
A Sampel = Absorbansi sampel
3.6.7 Penentuan nilai IC50
Nilai IC50 merupakan bilangan yang menunjukkan konsentrasi sampel uji
(µg/ml) yang memberikan peredaman DPPH sebesar 50% (mampu meredam
proses oksidasi DPPH sebesar 50%). Nilai 0% berarti tidak mempunyai aktivitas
antioksidan, sedangkan nilai 100% berarti peredaman total dan pengujian perlu
dilanjutkan dengan pengenceran larutan uji untuk melihat batas konsentrasi
aktivitasnya. Hasil perhitungan dimasukkan ke dalam persamaan regresi dengan
(antioksidan) sebagai ordinatnya (sumbu Y). Hasil pengujian dapat dilihat pada
Lampiran 10, halaman 59-61 dan perhitungan IC50 dapat dilihat pada Lampiran
11, halaman 62-64.
Secara spesifik, suatu senyawa dikatakan sebagai antioksidan sangat kuat
jika nilai IC50 kurang dari 50 µg/ml, kuat untuk IC50 bernilai 50-100 µg/ml,
sedang jika IC50 bernilai 100-150 µg/ml, dan lemah jika IC50 bernilai 151-200
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil identifikasi tumbuhan
Hasil identifikasi yang dilakukan di Pusat Penelitian Oseanografi – LIPI,
Jakarta, menyatakan bahwa tumbuhan yang digunakan dalam penelitian ini adalah
rumput laut Gracilaria verrucosa (Hudson) Papenfus.
4.2 Hasil karakterisasi simplisia
4.2.1 Pemeriksaan makroskopik
Hasil pemeriksaan makroskopik simplisia rumput laut Gracilaria
verrucosa (Hudson) Papenfus adalah talus yang berkerut, serbuk berwarna kuning
kemerahan, tidak memiliki bau dan rasa yang khas. Percabangan yang berselang-
seling tidak beraturan dan memusat ke arah pangkal. Cabang lateral memanjang
menyerupai rambut. Gambar hasil pemeriksaan makroskopik dapat dilihat pada
Lampiran 2, halaman 46-47.
4.2.2 Pemeriksaan mikroskopik
Hasil pemeriksaan mikroskopik simplisia rumput laut Gracilaria
verrucosa (Hudson) Papenfus menunjukkan adanya sel-sel parenkim yang
berwarna merah dan sel-sel propagul. Gambar hasil pemeriksaan mikroskopik
dapat dilihat pada Lampiran 3, halaman 48.
4.2.3 Hasil pemeriksaan karakterisasi serbuk simplisia
Tabel hasil pemeriksaan karakterisasi simplisa dapat dilihat pada
laut Gracilaria verrucosa (Hudson) Papenfus diperoleh kadar air sebesar 5, 31%.
Kadar sari larut dalam air sebesar 3, 47%. Kadar sari yang larut dalam etanol
sebesar 0,72 %. Kadar abu total sebesar 8,3 %. Kadar abu tidak larut dalam asam
sebesar 0,61 %. Hasil penetapan kadar air simplisia telah memenuhi persyaratan
Materia Medika Indonesia yaitu tidak melebihi 10%. Kadar air yang melebihi
persyaratan memungkinkan terjadinya pertumbuhan jamur. Penetapan kadar sari
larut dalam air dilakukan untuk mengetahui kadar senyawa yang bersifat polar
sedangkan kadar sari larut dalam etanol untuk mengetahui senyawa yang terlarut
dalam etanol baik polar maupun non polar. Kadar sari yang larut dalam air lebih
besar dari kadar sari yang larut dalam etanol karena senyawa bersifat polar lebih
banyak larut di dalam pelarut air daripada etanol, dan senyawa yang tidak larut di
pelarut air akan larut di dalam pelarut etanol. Air dapat melarutkan zat lain yang
tidak diperlukan seperti gom, pati, protein, lemak, lendir dan lain-lain, hal ini yang
menyebabkan tingginya kadar sari yang larut dalam air dari tanaman yang
dilarutkan (Depkes, 1986).
Penetapan kadar abu dimaksudkan untuk mengetahui kandungan mineral
internal (abu fisiologis) yang berasal dari jaringan tanaman itu sendiri, dan
eksternal (abu non-fisiologis) yang merupakan residu dari luar seperti pasir dan
tanah yang terdapat di dalam sampel (Depkes, 2000; WHO, 1992). Penetapan
kadar abu total untuk mengetahui kadar zat anorganik yang ada pada simplisia,
sedangkan penetapan kadar abu yang tidak larut dalam asam untuk mengetahui
kadar zat anorganik yang tidak larut dalam asam. Kadar abu tidak larut asam
untuk menunjukkan jumlah silikat, khususnya pasir yang ada pada simplisia
4.3 Hasil skrining fitokimia
Penentuan golongan senyawa kimia rumput laut dilakukan untuk
mendapatkan informasi golongan senyawa metabolit sekunder yang terdapat di
dalamnya. Hasil pemeriksaan penentuan golongan senyawa kimia simplisia
rumput laut dapat dilihat pada Tabel 4.1 berikut ini:
Tabel 4.1 Hasil Skrining fitokimia simplisia rumput laut Gracilaria verrucosa (Hudson) Papenfus
No. Golongan Senyawa Hasil Skrining Fitokimia
1 Alkaloid -
2 Flavonoida -
3 Tanin -
4 Saponin +
5 Glikosida +
6 Antrakinon -
7 Steroida/ Triterpenoida +
Keterangan: (+) positif: mengandung golongan senyawa
(-) negatif: tidak mengadung golongan senyawa
Berdasarkan hasil pemeriksaan skrining fitokimia terhadap serbuk
simplisa rumput laut Gracilaria verrucosa (Hudson) Papenfus menunjukkan
adanya golongan senyawa saponin, steroida/triterpenoida dan glikosida. Senyawa-
senyawa tersebut bertindak sebagai penangkap radikal bebas karena gugus
hidroksil yang dikandungnya dapat mendonorkan hidrogen kepada radikal bebas
(Kumalaningsih, 2006; Silalahi, 2006). Hasil di atas menunjukkan bahwa
simplisia rumput laut Gracilaria verrucosa (Hudson) Papenfus memiliki potensi