ASTRISIA ARTANTI. F24050495. Pengaruh Prebiotik Inulin dan Fruktooligosakarida (FOS) terhadap Pertumbuhan Tiga Jenis Probiotik. Di bawah bimbingan Prof. Dr. Betty Sri Laksmi Jenie dan Dr. Ingrid S. Surono, MSc.
ABSTRAK
Perkembangan produk pangan fungsional semakin pesat seiring dengan meningkatnya gaya hidup masyarakat yang memusatkan perhatian pada makanan yang bermanfaat bagi kesehatan. Produk pangan fungsional yang turut berkembang adalah produk probiotik, prebiotik, serta sinbiotik. Jenis probiotik lokal yang telah banyak diteliti adalahE. faecium IS-27526 danL. plantarum IS-10506, isolat dari dadih susu fermentasi tradisional asal Sumatra Barat. Probiotik komersial yang umum dikonsumsi masyarakat adalahL. casei strain Shirota atas izin Yakult.
Penambahan probiotik ke dalam produk pangan seringkali ditunjang dengan prebiotik. Prebiotik yang umum digunakan adalah inulin dan fruktooligosakarida (FOS). Aplikasi prebiotik yang ditambahkan sebaiknya dapat mendukung pertumbuhan probiotik sehingga diperlukan pengujian terlebih dahulu untuk melihat interaksi di antara keduanya.
Penelitian ini bertujuan untuk mengetahui pengaruh prebiotik inulin dan FOS terhadap pertumbuhan probiotik E. faecium IS-27526, L. plantarum IS-10605 danL. casei strain Shirota, sehingga penelitian ini akan bermanfaat untuk aplikasi produk pangan khususnya produk sinbiotik, yaitu produk dengan gabungan probiotik dan prebiotik.
Pengaruh prebiotik dilihat dari pertumbuhan E. faecium IS-27526 pada empat jenis media, yaitu kontrol m-MRSB (MRSB tanpa glukosa), m-MRSB + Glukosa 1% (b/v), m-MRSB + Inulin 1% (b/v), dan m-MRSB + FOS 1% (b/v). Pengukuran pertumbuhan dari nilai absorbansi dan hitungan cawan (log cfu/ml), pH media, dan nilai Total Asam Tertitrasi (% asam laktat) media dilakukan setiap 4 jam selama 24 jam inkubasi pada 37oC. Pengujian pengaruh prebiotik terhadap
L. plantarum IS-10506 dan L. casei strain Shirota dilakukan dalam kontrol m-MRSB, m-MRSB + Inulin 1% (b/v), dan m-MRSB + FOS 1% (b/v) dengan pengukuran pH dan TAT (% asam laktat) setiap 4 jam selama 12 jam inkubasi pada suhu 37oC serta hitungan cawan (log cfu/ml) pada jam ke-0, 8, dan 12. Analisis statistik ANOVA (Analysis of Variance) dengan analisis lanjutan uji Tukey digunakan pada data hasil hitungan cawan, pH, dan TAT (% asam laktat).
Probiotik L. plantarum IS-10506 dapat memanfaatkan inulin dan FOS dilihat dari penurunan pH dan peningkatan nilai TAT (% asam laktat) media prebiotik dibanding kontrol m-MRSB. Pertumbuhan L. plantarum IS-10506 setelah inkubasi 12 jam pada kedua jenis prebiotik berbeda signifikan (p<0.05) dengan kontrol m-MRSB. L. plantarum IS-10506 tumbuh signifikan terbaik (p<0.05) pada media inulin (10.3 log cfu/ml) dibanding media lainnya. Pertumbuhan tertinggi pada prebiotik FOS ditunjukkan oleh L. plantarum IS-10506 dengan jumlah sel hidup sebesar 9.5 log cfu/ml. L. plantarum IS-10506 memanfaatkan inulin lebih baik karena dapat mencapai 9.5 log cfu/ml dalam waktu inkubasi 8 jam, sedangkan membutuhkan waktu 12 jam dalam media FOS.
L. caseistrain Shirota dapat memanfaatkan kedua jenis prebiotik dilihat dari peningkatan pertumbuhan, penurunan pH media, dan peningkatan nilai TAT (% asam laktat) media. Rata-rata pertumbuhan L. casei strain Shirota pada inulin berbeda signifikan (p<0.05) dengan kontrol, namun tidak berbeda dengan FOS. Pertumbuhan L. casei strain Shirota tertinggi (10.0 log cfu/ml) pada waktu inkubasi 12 jam terjadi dalam media inulin. Jumlah sel hidup L. casei strain Shirota dalam media FOS adalah 9.2 log cfu/ml.
I. PENDAHULUAN
A. Latar Belakang
Perkembangan produk pangan fungsional semakin pesat seiring dengan meningkatnya gaya hidup masyarakat yang memusatkan perhatian pada makanan yang bermanfaat bagi kesehatan. Produk pangan fungsional yang turut berkembang adalah produk probiotik, prebiotik, serta sinbiotik. Produk probiotik menguasai sekitar 60–70% pasar pangan fungsional (Holzapfel, 2005). Perkembangan produk probiotik dilatarbelakangi oleh perkembangan ilmu pengetahuan mengenai sistem pencernaan, adanya gejala penyakit akibat mikroba di usus, dan keinginan manusia untuk mendapat nutrisi yang baik (Shin et al., 1992). Pemenuhan keinginan tersebut dapat diperoleh dari penyeleksian mikroba yang berpotensi probiotik.
FAO/WHO (2001) menyatakan definisi dari probiotik adalah mikroorganisme hidup yang diasup dalam jumlah yang cukup sehingga dapat memberikan manfaat kesehatan bagi inang. Shortt (1999) menyatakan definisi serupa mengenai probiotik, yaitu mikroorganisme hidup yang memiliki keuntungan bagi manusia, khususnya dalam keseimbangan mikroflora usus. Shortt juga menjelaskan bahwa umumnya probiotik berasal dari bakteri asam laktat (BAL), walaupun tidak semua bakteri asam laktat merupakan probiotik. Ducluzeauet al. (1991) menyatakan beberapa probiotik yang umum dan aman digunakan antara lain Lactobacillus acidophilus, L. casei, Streptococcus lactis, Enterococcus faecium, Bifidobacterium adolescentis,danB. coagulans.
Salah satu jenis probiotik yang sudah banyak diteliti adalah E. faecium
imunoglobulin A (IgA) pada anak balita (Rieuwpassa, 2005). Konsumsi susu yang ditambahkan probiotik E. faecium IS-27526 secara signifikan dapat meningkatkan konsentrasi total serum IgA pada kaum lanjut usia dengan selang kepercayaan 95% (Rusilanti, 2006).
L. plantarum IS-10506, yang juga diperoleh dari isolasi dadih, telah diklaim sebagai probiotik dan terbukti dapat menghambat adesi patogen dan mampu berkolonisasi di permukaan usus (Collado et al., 2007a; 2007b). Probiotik lainnya yang sudah lama dikenal secara komersial adalah L. casei
strain Shirota dari yakult dan telah dikonsumsi masyarakat selama beberapa dekade. L. casei strain Shirota terbukti memberi efek kesehatan seperti meningkatkan sistem imun dengan meningkatkan aktivitas selNatural Killer
(NK) pada manusia bahkan pada perokok (Nagao et al., 2000; Morimoto et al., 2005). L. casei strain Shirota juga berpotensi menurunkan resiko kanker pada saluran kandung kemih (Ohashi, et al., 2002) dan mencegah tumor pada usus besar dan saluran pengeluaran (Ishikawaet al., 2005).
Penambahan probiotik ke dalam produk pangan seringkali dilakukan dengan penambahan prebiotik. Campuran keberadaan prebiotik dan probiotik, yang biasa disebut sebagai sinbiotik, dapat memberi manfaat bagi inang dengan mendukung ketahanan dan keberadaan asupan mikroba hidup dalam saluran pencernaan inang (Andersson et al., 2001 dalam FAO, 2007). Prebiotik adalah suatu bahan pangan yang tidak dapat dicerna di sepanjang jalur pencernaan manusia, namun bermanfaat menunjang pertumbuhan atau aktivitas bakteri menyehatkan di usus, termasuk probiotik. (Angus et al., 2005).
Prebiotik yang umum digunakan adalah inulin dan fruktooligosakarida (FOS) (Bouhnik et al., 1999). Produk pangan yang umumnya ditambahkan prebiotik adalah roti, cookies, makanan bayi, es krim, serta produk lainnya dengan tujuan meningkatkan kandungan serat dan beberapa manfaat kesehatan lain seperti kelancaran proses pencernaan.
perusahaan memproduksi serat dan oligosakarida sebagai prebiotik. FAO melaporkan pasar prebiotik di Eropa bernilai €87 juta pada tahun 2007 dan diramalkan bernilai € 179.7 juta di tahun 2010. Kemajuan pesat ini membutuhkan dukungan kejelasan manfaat prebiotik terhadap pertumbuhan probiotik.
Aplikasi prebiotik yang ditambahkan sebaiknya dapat mendukung pertumbuhan probiotik sehingga diperlukan pengujian terlebih dahulu untuk melihat interaksi di antara keduanya. Oleh karena itu, dibutuhkan adanya pengujian pengaruh prebiotik terhadap pertumbuhan probiotik.
Asupan inulin terbukti dapat mempengaruhi secara signifikan aktivitas probiotik dalam pertumbuhan dan performa pengasaman (Oliviera et al., 2009). Audisioet al. (2001) meneliti pertumbuhanE. faeciumCRL1385 isolat dari sistem pencernaan ayam dalam beberapa sumber karbon kompleks yang mengandung FOS. Penelitian terhadap prebiotik yang tepat untuk probiotik lokal seperti E. faecium IS-27526 danL. plantarum IS-10506 belum pernah dilaksanakan. Penambahan prebiotik inulin dan FOS memiliki peluang untuk dapat mempengaruhi pertumbuhan probiotik E. faecium IS-27526,
L.plantarumIS-10506, dan L.caseistrain Shirota.
B. Tujuan
Mengetahui pengaruh prebiotik inulin dan FOS terhadap pertumbuhan probiotik E. faecium IS-27526, L. plantarum IS-10605 dan L. casei strain Shirota.
C. Manfaat
Manfaat dari penelitian ini adalah dapat menjadi acuan pemilihan prebiotik yang dapat mendukung pertumbuhan probiotikE. faeciumIS-27526,
II. TINJAUAN PUSTAKA
A. PROBIOTIK
Probiotik adalah sediaan sel mikroba hidup yang memiliki pengaruh menguntungkan terhadap kesehatan dan kehidupan inangnya (Salminen et al., 1999). Efek positif dari aktivitas probiotik terbagi dalam tiga aspek, yaitu nutrisi, fisiologi, dan antimikroba. Aspek nutrisi berasal dari penyediaan enzim yang membantu metabolisme penyerapan laktosa (laktase), sintesis beberapa jenis vitamin (vitamin K, asam folat, piridoksin, asam pantotenat, biotin, dan riboflavin), serta dapat menghilangkan racun hasil metabolit komponen makanan di usus. Aspek fisiologis meliputi kemampuan untuk menjaga keseimbangan komposisi mikrobiota usus sehingga menekan resiko infeksi penyakit dan menstimulasi sistem kekebalan tubuh. Aspek kemampuan antimikroba dinyatakan melalui kemampuan memperbaiki ketahanan terhadap patogen (Naidu dan Clemens, 2000). Namun aktivitas terhadap patogen ini juga dapat berasal dari kemampuan adhesi yang dimiliki probiotik (Colladoet al., 2007b).
Probiotik menurut FAO/WHO (2001) adalah mikroorganisme hidup yang masuk dalam jumlah yang cukup sehingga dapat memberikan manfaat kesehatan bagi inang. Jumlah yang cukup yang dimaksud oleh FAO/WHO (2001) ini adalah 106-108 cfu/g dan diharapkan dapat berkembang menjadi 1012cfu/ g di dalam kolon.
International Dairy Federation (IDF) memberikan standar jumlah minimum probiotik hidup sebagai acuan adalah 106 koloni/ml pada produk akhir (Indratingsihet al., 2004). Jumlah probiotik hidup harus mampu untuk melewati kondisi lingkungan yang kurang menguntungkan, seperti terekspos asam lambung dan garam empedu, sehingga masih memiliki aktivitas fisiologis (Charteriset al., 1998).
non-fermentasi, seperti makanan formula bayi, jus buah, dan krim biskuit. Aplikasi probiotik ke dalam produk krim terbukti dapat meningkatkan IgA pada balita (Rieuwpassa, 2005). Produk yang mengandung probiotik dikategorikan sebagai pangan fungsional (Kneifel et al., 1999; Hoover, 2000) dan di Indonesia hal ini telah resmi dinyatakan dalam Peraturan Pangan Fungsional dari BPOM tahun 2005, namun belum secara spesifik dinyatakan regulasi dan jumlah minimal kandungannya.
Probiotik juga dapat menghambat bakteri patogen, melakukan metabolisme terhadap laktosa sehingga bermanfaat bagi penderita intoleran laktosa (Rusilanti, 2006). Efek positif dari konsumsi probiotik bagi kesehatan adalah mencegah diare karena dapat melawan rotavirus, menstimulasi sistem imun, mencegah pembengkakan usus (irritable bowel diseases), memberi manfaat bagi penderita intoleran laktosa, membantu mengatasi alergi, menurunkan resiko kanker, mencegah infeksi patogen di saluran pernapasan, mencegah konstipasi, dan menurunkan kadar kolesterol (Schmidet al., 2006).
Probiotik dapat merupakan mikroorganisme yang umum ditemukan dapat tumbuh di saluran pencernaan manusia maupun pada beberapa sumber pangan fermentasi yang umumnya merupakan Bakteri Asam Laktat atau BAL (Hamilton-Miller, 2003 dalam Hayouni et al., 2008). Kelompok bakteri yang umumnya hidup dalam saluran cerna manusia dapat dilihat pada Tabel 1. Tabel tersebut menunjukkan bahwa pada manusia normal terdapat lima kelompok bakteri utama, dengan kelompok terbesar adalahEnterococcus dan
Bacteroides. Tabel 1 menunjukkan isolasi dari feses telah mewakili mikroorganisme yang ada di dalam saluran pencernaan manusia karena jumlahnya tidak berbeda jauh. Perbedaan jumlah diakibatkan kondisi pH dan juga kemampuan menempel mikroorganisme dalam saluran pencernaan.
Tabel 1 Populasi rata-rata kelompok bakteri utama pada usus manusia
Kelompok Bakteri Jumlah Bakteri (log10CFU/ml) Jejunum Ileum Kolon Feses
Lactobacillus 3 5 6 6
Gram positif, tidak berspora, anaerob 2 2 5 6
Enterococcus 3 5 7 7
Enterobacteriaceae 3 4 6 8
(Sumber: Ray, 1996)
Pemberian klaim probiotik harus terlebih dahulu melalui seleksi pemenuhan syarat probiotik. Syarat yang harus dipenuhi oleh galur probiotik dapat dilihat pada Gambar 1.
Gambar 1 Kriteria strain probiotik (Saarelaet al.,2000dalamSurono, 2004b)
Shortt (1999) menyatakan bahwa probiotik pada umumnya berasal dari BAL, namun tidak semua BAL merupakan probiotik. Golongan BAL dinamakan demikian karena menghasilkan produk utama asam laktat dalam proses metabolismenya. Sumber karbohidrat difermentasi melalui jalur Embden-Meyerhoff Parnas (EMP) menghasilkan 2 molekul asam piruvat yang kemudian diubah menjadi 2 molekul asam laktat (Surono, 2004b). Proses fermentasi ini menghasilkan 2 molekul ATP sebagai sumber energi bagi BAL. Proses ini terjadi apabila tidak ada oksigen, sehingga proses glikolisis tidak dilanjutkan dengan fosforilasi oksidatif, namun perubahan asam piruvat menjadi asam laktat (Mandelstam dan McQuillen, 1989). Jalur fermentasi asam laktat dapat dilihat pada Gambar 2.
Aman di makanan & klinis
Asal manusia
Tahan asam & empedu
Melekat ke sel usus
Bertahan di saluran usus
Terbukti memberi efek kesehatan
Antagonis terhadap
patogen
Gambar 2 Jalur fermentasi asam laktat (www.rogers.k12.ar.us)
BAL adalah bakteri yang dapat bertahan pada kisaran pH yang luas, sehingga sebagai besar memenuhi klaim probiotik dengan syarat toleransi terhadap asam. Hal ini disebabkan bila probiotik masuk ke dalam saluran pencernaan manusia, maka probiotik harus bertahan dari pH asam lambung sekitar 2 (Almatsier, 2005). Mayes (1996) dalam Evanikastri (2003). menyatakan konsentrasi HCl sebesar 0.2 – 0.5% membuat pH lambung menjadi 1 apabila dalam keadaan benar-benar kosong.
Ketahanan BAL terhadap pH rendah karena kemampuannya mempertahankan pH internal lebih alkali dibanding pH eksternal serta dengan mempunyai membran sel yang lebih tahan terhadap kebocoran sel akibat terpapar pH rendah (Bender et al., 1996). Kepekaan bakteri terhadap asam dapat tergantung pada kerja simultan dari faktor-faktor tambahan lain, seperti aktivitas air, kadar garam, potensi redoks, perlakuan panas, dan lain-lain (Jenie, 1996).
Tabel 2 Probiotik yang umum dipakai
Bakteri Khamir
Lactobacillus bulgaricus L. acidophilus
L. paracasei
Streptococcus thermophillus Enterococcus faecium E. faecalis
Bifidobacterium pseudolongum B. thermophilum
B.breve B.bifidum Bacillus cereus B.toyoi B. subtilis
Saccharomyces cerevisiae S.boulardi
(Sumber: Leeet al., 1999 dalam Metzleret al., 2005) 1. Enterococcus faeciumIS-27526
Enterococcus merupakan kelompok spesies dalam genusStreptococcus, selain Lactococcus, Streptococcus, dan Vagococcus (Surono, 2004b). Klasifikasi ini berdasarkan gen 16S rRNA dalam bidang biologi molekuler. E. faeciumterdiri dariE. faecium, E. durans, E. hirae, E. mundtii, E. villorum, E. canis,danE. azikeevi (Salminenet al., 1999). Golongan enterokoki seringkali masih dikenal rancu antara fungsinya sebagai probiotik karena manfaat dan keberadaannya secara natural di saluran pencernaan manusia, berbanding dengan perannya yang dikenal sebagai patogen dan resisten terhadap antibiotik.
E. faeciumyang dikenal sebagai probiotik banyak ditemui pada saluran pencernaan hewan seperti babi, sapi, domba, dan ayam. JumlahE .faecalis di saluran pencernaan hewan sebesar 105 – 107 cfu / gram mengungguli jumlah
E.faecium yang hanya sejumlah 104 – 105 cfu/ gram. Selain itu E. faecium
banyak ditemukan pada makanan, khususnya produk daging olahan babi dan keju (Salminenet al., 1999).
Probiotik E. faecium adalah isolat asal dadih, yaitu produk fermentasi tradisional yang terbuat dari susu kerbau (Akuzawa dan Surono, 2002). Pada dadih terdapat pertumbuhan BAL dan salah satu strain yang diperoleh adalah
E. faecium IS-27526. Strain ini telah terbukti sebagai probiotik karena tahan asam lambung, garam empedu, dapat menempel di mukosa usus, dan dapat melawan bakteri patogen (Collado et al., 2007a; 2007b). Probiotik ini juga telah diidentifikasi secara molekuler dengan teknik Polymerase Chain Reaction.
E. faecium IS-27526 terbukti secara signifikan meningkatkan total serum imunoglobulin A (IgA) pada anak balita (Surono 2004a; Rieuwpassa 2005). Konsumsi susu yang ditambahkan dengan probiotikE. faeciumIS-27526 juga secara signifikan dapat meningkatkan konsentrasi total serum IgA pada kaum lanjut usia dengan selang kepercayaan 95% (Rusilanti, 2006).
2. Lactobacillus plantarumIS-10506
Lactobacillus plantarum termasuk salah satu spesiesLactobacillus yang diperoleh dari isolat beberapa makanan tradisional, misalnya saja dadih dan tempoyak. Bakteri ini juga sering ditemui pada pikel, sawi asin dan sauerkraut. Bakteri ini diketahui dapat menghambat pertumbuhan bakteri perusak makanan sehingga seringkali digunakan dalam pengawetan produk pangan. Efek antimikroba ini berasal dari produksi asam-asam organik dan salah satunya adalah asam laktat (Larsen et al., 1993). Asam laktat yang dihasilkan akan menurunkan pH dan menghasilkan penghambatan luas pada bakteri (Jenie, 1996).L. plantarummemiliki nilai pH minimum pertumbuhan 3.34 (Jay, 1996).
Kemampuan memfermentasi melibosa dan rafinosa membedakan L. plantarumdanL. casei. (Onoet al., 1992).
Koloninya berwarna putih atau kuning dan beberapa galur bersifat motil. Koloni bakteri ini dalam media agar mempunyai ciri - ciri bulat, licin, padat, putih, kadang-kadang kuning terang atau gelap, berdiameter 3 mm, bersifat anaerobik fakultatif. Bakteri ini dapat tumbuh pada suhu 15oC pada umumnya dan tidak dapat tumbuh pada suhu 45oC, dengan suhu optimalnya berkisar 30-35oC (Gilliland, 1986).
Strain L. plantarum IS-10506 merupakan hasil isolasi dari dadih yang telah terbukti sebagai probiotik. Penelitian yang telah dilakukan oleh Collado
et al.(2007b) menunjukkan kemampuanL. plantarumIS-10506 yang tertinggi di antara strain probiotik asal dadih lainnya dalam pengujianbacteriological adhesion to hydrocarbon(BATH) untuk melihat hidrofobisitas permukaan sel BAL dan dalam pengujian autoagregasi. Kemampuan autoagregasi ini merupakan faktor penting dalam kolonisasi di saluran pencernaan.
Kemampuan adhesi yang tinggi ini memperkuat klaim probiotik L. plantarumIS-10506 yang berdasarkan penelitian Colladoet al.(2007a) bahwa
L. plantarumIS-10506 memiliki kemampuan terbaik dalam interaksi melawan adesi patogen.
3. Lactobacillus caseistrain Shirota
Lactobacillus acidophillus dan Lactobacillus casei merupakan bakteri yang sering terdapat di usus manusia, mampu mencapai usus dan tetap berada di dalamnya, tahan bakteriosidal, getah lambung, dan cairan empedu (Yakult Honsha, 1990; Winarno, 2003). Speck (1978) menyatakan bahwa L. casei
dapat diisolasi dari saluran usus manusia dan Robinson (1981) menambahkan bahwaL. caseidapat diisolasi dari susu dan produk turunan susu.
berspora atau flagel, dan fakultatif anaerob. Bakteri ini hidup baik pada 15 – 41oC dan pH 3.5 atau lebih (Meutia, 2003).
L. casei strain Shirota termasuk homofermentatif yang memecah glukosa menjadi asam laktat 90% dengan sejumlah kecil asam sitrat, malat, asetat, suksinat, asetaldehid, diasetil, dan asetoin yang berperan dalam pembentukan flavor (Selamat, 1992).L. casei tidak memproduksi amonia dari arginin, dapat memfermentasi amigdalin, manitol, solobiosa, dan salisin. L. caseijuga tidak dapat memfermenrasi substrat melobiosa, rafinosa, rhamnosa, gliserol dan jarang memfermentasi inositol atau sorbosa (Robinson, 1981).
Konsumsi susu fermentasi dengan kandunganL. casei strain Shirota pada manusia memiliki potensi menurunkan resiko kanker kandung kemih (Ohashi et al., 2002). Penelitian lain dilakukan oleh Ishikawa et al. (2005) menunjukkan L.casei strain Shirota juga berpotensi mencegah kanker pada saluran kandung kemih pada studiin vivo.
Penelitian terkait peran L.casei strain Shirota pada sistem imun dilakukan oleh Nagao et al. (2000) yang menunjukkan bahwa asupan L. casei strain Shirota dapat meningkatkan aktivitas sel Natural Killer (NK) pada manusia. Penelitian lanjutan membuktikan bahwa aktivitas sel NK dapat ditingkatkan oleh L. casei strain Shirota pada manusia yang memiliki kebiasaan merokok (Morimotoet al., 2005).
B. PERTUMBUHAN BAKTERI
Gambar 3 Kurva pertumbuhan bakteri
Inokulum yang dipindahkan ke suatu media baru akan mengalami adaptasi terlebih dahulu pada kondisi media baru. Tahap yang disebut lag phase ini membutuhkan waktu sehingga pada kurva pertumbuhan terlihat stagnan. Media dengan nutrisi yang semakin lengkap akan mempercepat fase lag yang berarti mempercepat memasuki fase eksponensial (Lichstein, 1959 dalam Sokatch, 1969).
Sel bakteri kemudian memasuki tahap pembelahan biner dengan laju konstan. Fase pertumbuhan ini disebut sebagai fase eksponensial atau fase log, karena menunjukkan kenaikan dalam bentuk garis linear lurus dalam kurva pertumbuhan (Moat dan Foster, 1988). Pembelahan ini mengikuti pola geometrik yaitu dihasilkan 2n sel baru setelah melalui satuan waktu yang disebut sebagai waktu generasi. Kondisi ini juga disebut sebagai pertumbuhan seimbang, karena terjadi laju pertumbuhan dan aktivitas metabolik yang konstan (Pelczar dan Chan, 2008). Kondisi ini berlanjut hingga sumber karbon dan energi di lingkungan telah habis. Kondisi ini berbeda-beda pada kondisi substrat yang memberikan laju pertumbuhan yang berbeda pula (Sokatch, 1969).
1955). Fase pertumbuhan bakteri diakhiri dengan fase kematian ketika akhirnya jumlah sel yang mati melebihi jumlah terbentuknya sel baru.
Berbagai macam teknik dapat digunakan untuk mengukur pertumbuhan dan dapat dipilih aplikasi yang paling sesuai dengan tujuan pengukuran. Beberapa cara pengukuran pertumbuhan tersebut adalah pengukuran turbiditas, penghitungan total sel, penghitungan sel hidup (White, 1995).
Pengukuran tercepat yang sering diaplikasikan adalah pengukuran dengan metode turbiditas (kekeruhan) dengan spektrofotometer. Prinsip pengukurannya adalah mengukur jumlah cahaya yang dipantulkan organisme dalam sampel. Hasil yang diperoleh mewakili massa bakteri yang ada (Lay dan Hastowo, 1992).
Penghitungan total sel dilakukan dengan alat bantu electronic cell counting. Metode ini memiliki kelemahan yaitu sel hidup dan sel mati seluruhnya terhitung tanpa pembedaan. Selain itu, metode ini tidak memberikan performa baik pada populasi sel yang densitas selnya rendah, yaitu kurang dari 106sel/ml (White, 1995).
Penghitungan sel hidup dilakukan dengan melakukan pengenceran dan pencawanan dengan penambahan medium padat. Setiap sel hidup akan tumbuh membentuk satu koloni, sehingga jumlah sel hidup di awal dapat diketahui dengan menghitung jumlah koloni yang terbentuk. Metode ini paling umum dilakukan dalam pengujian mikrobiologi. Metode ini banyak digunakan karena memiliki kelebihan antara lain menghitung sel yang masih hidup, dapat menghitung beberapa mikroorganisme sekaligus, dapat digunakan untuk isolasi dan identifikasi karena koloni berasal dari mikroorganisme spesifik dengan penampakan pertumbuhan spesifik (Fardiaz, 1989b).
adalah adanya beberapa sel yang tidak dapat hidup dalam pencawanan secara efisien (viable but non culturable).
Sel viable but non culturable terjadi saat tumbuh di lingkungan penuh tekanan, sehingga membentuk subpopulasi sel dengan fenotip yang cenderung jauh dari rumus pembelahan biner 2n. Kondisi ini tidak dapat dideteksi jumlahnya dengan teknik tradisional pencawanan total koloni (Kell dan Young, 2000 dalam Hayouniet al., 2008).
Metode yang digunakan untuk menghitung viable but non culturable
adalah flow cytometry yang dinyatakan oleh Hewitt dan nebe-Von-Caron (2001) dalam Hayouni et al. (2008) sebagai alat pengukur populasi dalam waktu singkat.Flow cytometry merupakan teknik menghitung dan mengetahui partikel mikroskopik yang tersuspensi dalam suatu aliran fluida. Teknik ini memungkinkan analisis fisik maupun kimia dari multiparameter simultan pada sel tunggal melalui peralatan deteksi elektronik maupun optikal.
Penggunaanflow cytometry dilakukan oleh Hayouni et al. (2008) dalam analisis efek minyak esensial terhadap BAL. Metode ini dipilih karena memiliki keunggulan, yaitu cepat menganalisis data dalam jumlah besar, dapat membedakan sel hidup, mati, dan terluka (injured atau viable but non culturable), dan hasilnya berkorelasi dengan pengujian pencawanan.
C. PREBIOTIK
Prebiotik didefinisikan oleh Gibson dan Roberfroid (1995) dalam Surono (2004b) sebagai suatu bahan makanan yang tidak dapat dicerna yang memberikan manfaat positif bagi tubuh karena secara selektif menstimulir pertumbuhan dan aktivitas bakteri baik dalam usus besar. FAO (2007) menyatakan bahwa prebiotik adalah komponen pangan tak hidup yang memberi keuntungan kesehatan inang berasosiasi dengan memodulasi mikrobiota. Peraturan FAO (2007) juga menegaskan bahwa prebiotik bukan merupakan organisme ataupun obat, dapat dikarakterisasi secara kimia, dan aman (foodgrade). Bahan pangan prebiotik telah diklasifikasikan sebagai
Generally Recognized as Safe(GRAS).
Peraturan mengenai standar jumlah prebiotik yang dikonsumsi belum ada karena umumnya asupan prebiotik tergantung kepada kebiasaan penduduk suatu negara (FAO, 2007). Dosis konsumsi harian 5 – 8 g/hari dari FOS atau GOS memberikan efek prebiotik pada orang dewasa.
Venter (2007) menyatakan bahwa peraturan Foodstuffs Cosmetics and Disinfectans Act (Act No 54 of 1972) di Afrika Selatan menyatakan bahwa jumlah dan sumber prebiotik yang harus tercantum pada label suatu produk dengan klaim prebiotik adalah minimal 3 gram prebiotik per penyajian harian. Indonesia mengatur regulasi prebiotik dalam Peraturan Pangan Fungsional yang dikeluarkan oleh BPOM tahun 2005, namun regulasi jumlahnya masih belum dikeluarkan.
Reidet al., (2001) dalam Surono (2004b) menyarankan jumlah prebiotik yang efektif adalah 1 – 3 g per hari untuk anak-anak dan 5 – 15 g per hari untuk orang dewasa. Konsumsi prebiotik yang berlebih (lebih dari 20 gram per hari) dikhawatirkan memberi efek laksatif yaitu mempercepat pengeluaran pada sistem saluran pencernaan atau melunakkan sisa pencernaan (Bouhniket al.,1999).
tanaman seperti bawang, asparagus, pidsng, chicory, artichoke, dan beberapa oligosakarida pada kedelai. (Surono, 2004b). Prebiotik dapat diperoleh dengan beberapa cara, yaitu ektraksi langsung polisakarida alami dari tumbuhan, hidrolisis polisakarida alami, atau sistesis enzimatik dengan enzim hidrolase atau glikosil transferase yang mengkatalisis reaksi transglikosilasi hingga terbentuk oligosakarida sintetik dari mono serta disakarida (Grizard dan Barthomeuf, 1999).
Bahan pangan dapat diklasifikasikan sebagai prebiotik bila memenuhi persyaratan antara lain (1) tidak terhidrolisa atau terserap pada saluran pencernaan bagian atas sehingga dapat mencapai kolon tanpa perubahan struktur atau diekskresikan dalam feses; (2) berperan sebagai substrat yang secara selektif dapat menstimulir pertumbuhan bakteri yang menguntungkan pada kolon; (3) mengubah komposisi mikrobiota usus sehingga menguntungkan bagi kesehatan dengan menekan pertumbuhan bakteri patogen; (4) meningkatkan efek yang positif bagi kesehatan inang (Gibson, 1999).
Menurut Arief (2007), penelitian in vitro dan in vivo menunjukkan bahwa prebiotik tidak dicerna oleh enzim, tetapi difermentasi oleh bakteri anaerob dalam usus besar. Prebiotik yang telah difermentasi dalam usus besar menghasilkan asam lemak rantai pendek (short chain fatty acid /SCFA), menstimulasi pertumbuhan berbagai bakteri termasuk lactobacilli dan
bifidobacteria, dan dapat menghasilkan gas. Fortifikasi menggunakan
bifidobacteria/lactobacilli usus dengan prebiotik dapat memperbaiki efek perlindungan usus besar terhadap berbagai mikroorganisme patogen dalam usus.
isomalto-oligosakarida, gluko-isomalto-oligosakarida, xylo-oligosakarida. Bouhniket al., (1999) menyatakan bahwa prebiotik yang umum digunakan adalah inulin dan FOS.
Prebiotik (oligofruktosa) dapat meningkatkan pertumbuhan B. infantis
dan mampu menghasilkan senyawa seperti CO2, asam asetat, propionat,
butirat, laktat, dan suksinat yang dapat menghambatE. colidanC. perfringens
serta dapat menurunkan pH awal dari 7.0 menjadi 5.3 (Wang dan Gibson, 1994).
Prebiotik yang umum digunakan adalah FOS yang terbukti dapat difermentasi oleh bifidobacteria (Surono, 2004b). Asupan inulin terbukti dapat mempengaruhi secara signifikan aktivitas probiotik dalam pertumbuhan dan performa pengasaman (Oliviera et al., 2009). Audisio et al. (2001) meneliti pertumbuhan E. faecium CRL1385 isolat dari sistem pencernaan ayam dalam beberapa sumber karbon kompleks yang mengandung FOS.
Asupan prebiotik dari konsumsi harian tidak dapat memenuhi jumlah kebutuhan prebiotik yang berkhasiat menekan infeksi penyakit, sehingga konsumsi tambahan prebiotik menjadi penting untuk dilakukan (Daud, 2005). Konsumsi prebiotik memberikan beberapa manfaat, antara lain: (1) menghambat patogen melalui mekanisme langsung atau tidak langsung dengan memblok sisi reseptor pelekatan patogen pada mukosa usus dan secara tidak langsung dengan mendukung pertumbuhan probiotik (Rastall et al., 2005); (2) mencegah kanker usus; (3) meningkatkan penyerapan kalsium karena fermentasi prebiotik menjadi SCFA (Ouwehand, et al., 1999); (4) menurunkan kolesterol dengan memicu pertumbuhan probiotik atau BAL yang memproduksi enzim atau pengikatan kolesterol oleh membran (Surono, 2004b); (5) meningkatkan imunitas dengan meningkatkan pertumbuhan probiotik yang berinteraksi dengan sistem imun (Tzianabos, 2000).
D. INULIN
Inulin merupakan homopolimer fruktan yang diisolasi pertama kali dari tanaman Inula helenium. Inulin juga ditemukan pada chicory, dandelion, artichoke (Roberfroid, 2000). Inulin dapat diperoleh dari bawang merah, bawang daun, bawang putih, asparagus, pisang, gandum, barley (Tungland, 2000). Inulin juga dapat diektraksi dari umbi dahlia (Zaharanti, 2005).
Inulin tidak dapat dicerna oleh enzim pencernaan seperti α-amilase ataupun enzim penghidrolisis lainnya, yaitu sukrase, maltase, dan isomaltase baik pada pH rendah maupun tinggi (Okuet al., 1984). Inulin dapat sampai di usus dengan utuh sehingga dapat difermentasi probiotik.
Inulin adalah fruktan dengan ikatan β(2-1) antar monomer pada poli atau oligomernya. Terdapat unit glukosa pada ujungnya dengan ikatan α(1-2) dengan monomer fruktosa, sehingga membentuk sukrosa (Niness, 1999). Roberfroid (1999) menyatakan hal yang sama, bahwa fruktan tipe inulin memiliki komposisi β-D-fruktofuranosa yang saling terhubung dengan ikatan
β(2-1), dengan monomer pertama dari rantainya adalah residu β -D-glukopiranosil atauβ-D-fruktopiranosil.
Inulin hasil ekstrak dari chicoryumumnya memiliki jumlah total unit yang dinyatakan dalam derajat polimer (DP) yaitu sekitar 3 hingga 60, sehingga dapat dikatakan mengandung oligo dan polisakarida (Crittenden, 1999).
Gambar 4 Struktur kimia inulin (www.wikipedia.org)
Aplikasi inulin perlu diperhatikan karena derajat polimerisasi yang tinggi membuatnya larut sempurna di air panas, namun sedikit larut dalam air dingin maupun alkohol (Bergner, 1997). Aplikasi inulin dalam produk pangan telah dilakukan secara luas, tidak hanya sebagai prebiotik saja.
Inulin sering ditambahkan untuk pengganti lemak, sebagai bahan pengental, ataupun pemanis untuk produk bagi penderita diabetes. Inulin telah dilakukan ke dalam berbagai produk seperti produk susu dan turunannya, selai, roti dan produk panggangan, sereal sarapan, bahkan dalam bentuk tablet suplemen dengan tujuan untuk memperkaya kandungan serat serta berperan sebagai prebiotik (Franck dan Leenher, 2005).
E. FRUKTOOLIGOSAKARIDA (FOS)
Fruktooligosakarida, yang sering disebut FOS, merupakan kelas karbohidrat yang terkandung di beberapa tanaman secara alami. FOS dapat ditemukan pada bawang, artichoke, dan pisang. FOS umumnya digunakan sebagai pemanis pengganti sukrosa karena rendah kalori dalam produk seperti kue, roti, permen, produk susu, dan beberapa minuman (Trenev, 2000).
monomer fruktosa yang dihubungkan dengan ikatan glikosidik. Oligosakarida merupakan rantai gula dengan jumlah 3 – 20 unit (Manninget al., 2004).
FOS memiliki struktur GFn atau Fm, dengan huruf G menunjukkan satu terminal glukosa, F merupakan unit fruktosa, dan huruf n dan m menunjukkan banyaknya unit fruktosa dalam oligomer FOS (Niness, 1999). Antar unit fruktosa penyusunnya terdapat ikatan yang tidak dapat dipecah oleh enzim pencernaan, yaitu ikatanβ(2-1) (Rouzaud, 2007). FOS memiliki nilai DP yang lebih rendah dari inulin, yaitu berkisar antara 2 – 8 (De Leenheer dan Hoebregs, 1994 dalam Franck dan De Leenheer, 2005). Struktur FOS dapat dilihat pada Gambar 5.
Gambar 5 Struktur kimia fruktooligosakarida (FOS) (www.nutrition-partner.com)
FOS telah diteliti tidak terhidrolisis dan tidak diserap usus halus pada sistem pencernaan (Tsujiet al.dalam Tungland, 2000). FOS difermentasi oleh bakteri menghasilkan produk berupa asam laktat dan asam karboksilat rantai pendek lainnya (Roberfroid, 2000).
III.METODOLOGI PENELITIAN
A. BAHAN DAN ALAT PENELITIAN 1. Kultur
Kultur yang digunakan dalam penelitian ini adalah Enterococcus faecium IS-27526 (Genebank accession no. EF068251) dan Lactobacillus plantarumIS-10506 (GeneBankaccessionno. DQ860148) hasil isolasi dari dadih sertaLactobacillus caseistrain Shirota atas izin Yakult.
2. Bahan
Bahan–bahan yang digunakan dalam penelitian adalah media pertumbuhan deMann Rogosa Sharp Broth (MRSB) merk Oxoid dan
deMann Rogosa Sharp Agar (MRSA) merk Oxoid, m-MRSB yaitu MRSB modifikasi tanpa kandungan glukosa, prebiotik inulin (kemurnian > 90%) dan fruktooligosakarida atau FOS (kemurnian > 93.2%) dari PT Orafti Indonesia, serta glukosa, akuades, larutan pengencer buffer fosfat, alkohol, spiritus, NaOH 1N dan 0.1 N, buffer pH 4.0 dan pH 7.0, indikator fenolftalein (PP), serta indikatorbromcresol purple(BCP).
3. Alat
Alat-alat yang digunakan adalah pHmeter, spektrofotometer, autoklaf, inkubator 37°C, vorteks, mikropipet, neraca analitik, oven pengering, serta alat-alat gelas lainnya.
B. METODE PENELITIAN
Penelitian ini terbagi menjadi dua tahap. Tahap pertama meliputi penyegaran kultur yang digunakan menjadi kultur kerja dan pembuatan kurva pertumbuhan E. faecium IS-27526 untuk mengetahui waktu dan jumlah yang tepat untuk ditambahkan ke uji prebiotik.
sebagai pembanding dari probiotik komersial. Pengujian pembanding ini dilakukan dengan metode dan pengukuran yang sama.
1. Aktivasi Kultur dan Kurva Pertumbuhan a. Aktivasi Kultur
E. faecium IS-27526 merupakan strain isolat probiotik dari dadih yang disimpan dalam bentuk kultur kering pada suhu refrijerasi 7-10oC. Kultur kerja dibuat dengan menyegarkan kultur dengan melakukan tahapan aktivasi sebanyak tiga kali mengacu pada penelitian yang dilakukan oleh Ariella (2009).
E. faecium IS-27526 diambil 1 ose untuk disegarkan dalam 10 ml MRSB selama 24 jam pada suhu 37oC. Pemurnian kultur dilakukan dengan menggores kuadran pada MRSA yang telah ditambahkan dengan indikator bromcresol purple (BCP) di cawan petri steril. Hasil goresan diinkubasi dalam posisi cawan terbalik pada suhu 37oC selama 24 jam. Hasil pemurnian berupa koloni tunggal berwarna kuning yang berada pada area berwarna kuning pada cawan berisi MRSA. Koloni tunggal diambil 1 ose kemudian digores ke MRSA agar miring untuk diinkubasi pada 37oC selama 24 jam untuk dijadikan kultur kerja.
Kultur kerja dipastikan kemurniannya dengan melakukan pewarnaan gram untuk dilihat penampakannya di bawah mikroskop cahaya. Uji lain yang digunakan adalah uji katalase. Kedua perlakuan ini secara lebih lengkap terdapat pada Lampiran 1. Kultur BAL yang positif menampilkan warna ungu tanda gram positif dan tidak menunjukkan adanya gelembung udara sebagai hasil uji katalase yang negatif.
b. Kurva Pertumbuhan (modifikasi Ariella, 2009)
E. faecium IS-27526 dari MRS agar miring diaktifkan terlebih dahulu pada 10 ml MRSB dalam selang waktu 6 jam dalam inkubator 37oC, kemudian dilakukan pengujian kurva pertumbuhan dengan mengambil 2% (v/v) ke dalam 10 ml MRSB.
Pengukuran pertumbuhan E. faecium IS-27526 dilakukan dengan pengukuran absorbansi menggunakan alat spektrofotometer pada panjang gelombang 600 nm serta penghitungan jumlah totalE. faeciumIS-27526 yang tumbuh pada media MRSA dengan metode hitungan cawan. Pengukuran dilakukan dari jam ke-0 hingga jam ke-24 setiap 2 jam. Metode pengukuran kurva pertumbuhan dapat dilihat pada Lampiran 2.
2. Pengaruh Prebiotik terhadap PertumbuhanE. faeciumIS-27526 a. Persiapan Media
Media yang digunakan dalam pengujian pengaruh prebiotik adalah media modifikasi MRSB (m-MRSB). Media ini merupakan hasil modifikasi MRSB yang dibuat tanpa kandungan glukosa sebagai sumber karbon dalam media. Pembuatan media m-MRSB ini mengacu pada pembuatan media yang pernah dilakukan oleh Hana (2007).
Media m-MRSB 1 liter dipersiapkan dengan melarutkan Na-asetat.3H20 5 gram, MgSO4.7H2O 0.2 gram, MnSO4.4H2O 0.05 gram
dalam sejumlah akuades. Bubuk pepton 10 gram, lab lemco powder 8 gram, dan yeast extract 4 gram dilarutkan dalam sejumlah akuades. Larutkan K2HPO4 2 gram dalam akuades secara terpisah. Ketiga larutan
dicampur kemudian ditambahkan 1 ml Tween 80 hingga volume menjadi 1 liter dengan pelarut akuades. Larutan kemudian diaduk sambil dipanaskan, kemudian disterilisasi 1210C selama 15 menit
stok glukosa dan prebiotik 10% (b/v) diambil 1% (b/v) secara aseptis untuk ditambahkan ke dalam media m-MRSB pada pengujian.
b. Pengujian Aktivitas Prebiotik
Bakteri probiotik E. faecium IS-27526 yang tumbuh di agar miring diambil sejumlah 1 ose kemudian disegarkan terlebih dahulu ke dalam 10 ml MRSB dan diinkubasi pada suhu 37oC selama 6 jam. Setelah itu, diambil sejumlah 2% (v/v) kultur segar untuk dimasukkan ke dalam 10 ml MRSB kemudian diinkubasi pada suhu 37oC selama 8 jam untuk memperoleh kultur yang telah berada pada fase log atau eksponensial. Sebelum dimasukkan ke dalam media, absorbansi kultur dilihat terlebih
dahulu pada λ 600 nm untuk memperkirakan jumlahnya.
Kultur awal diambil 1% (v/v) kemudian dimasukkan ke dalam empat jenis media cair untuk pengujian aktivitas prebiotik. Media tersebut adalah MRSB, MRSB + Glukosa sebagai standar, m-MRSB dengan prebiotik yaitu m-m-MRSB + Inulin dan m-m-MRSB + FOS. Kandungan sumber karbon, baik dari glukosa maupun prebiotik, sejumlah 1% (b/v) dari total volume media. Inkubasi kultur dilakukan pada suhu optimum 37oC selama 24 jam (Huebneret al., 2007).
Pengukuran dilakukan dari jam ke-0 hingga jam ke-24 setiap 4 jam, meliputi pengukuran absorbansi, pH, Total Asam Tertitrasi (TAT) yang kemudian dihitung persen asam laktat, dan penghitungan jumlah sel hidup E. faecium IS-27526 dengan metode hitungan cawan. Perlakuan pengukuran secara rinci terlampir pada Lampiran 3.
Pengujian aktivitas prebiotik ini dilakukan dengan dua kali ulangan. Diagram alir pengujian pengaruh prebiotik terhadap pertumbuhan probiotikE. faeciumIS-27526 terlampir pada Lampiran 4.
3. Pengaruh Prebiotik terhadap PertumbuhanL. plantarumIS-10506 dan
L. caseistrain Shirota a. Persiapan Pengujian
Persiapan pengujian dilakukan seperti persiapan pengujian terhadap
larutan prebiotik inulin dan FOS masing-masing sebesar 1% (b/v) ke dalam total media dari larutan stok 10% (b/v) yang telah disterilisasi 100oC selama 30 menit.
b. Pengujian Aktivitas Prebiotik
Pengujian pembanding ini dilakukan dengan melihat pengaruh prebiotik terhadap pertumbuhan L. plantarum IS-10506 dan L. casei
strain Shirota. Pengujian dilakukan dalam dua kali ulangan tanpa penggunaan media m-MRSB + Glukosa.
Pengukuran yang dilakukan meliputi pengukuran pH dan TAT (% asam laktat) yang dilakukan dari jam ke-0 hingga jam ke-12 setiap 4 jam. Sedangkan pengukuran jumlah sel hidup dengan metode hitungan cawan dilakukan pada jam ke-0 untuk jumlah awal, jam ke-8 untuk jumlah pada awal fase eksponensial, dan jam ke-12 untuk mengetahui jumlah akhir. Diagram alir pengujian pengaruh prebiotik terhadap pertumbuhan probiotikL. plantarumIS-10506 danL. caseistrain Shirota terlampir pada Lampiran 5.
4. Analisis Statistik
IV. HASIL DAN PEMBAHASAN A. Kurva PertumbuhanE. faeciumIS-27526
Pertumbuhan E. faecium IS-27526 dilakukan dengan dua macam pengukuran, yaitu metode turbidimetri dengan spektrofotometer serta metode hitungan cawan yang mengukur jumlah sel hidup. Metode turbidimetri dilakukan dengan prinsip mengukur kenaikan massa sel. Cahaya yang dibiaskan sumber cahaya akan diserap oleh sel, sehingga semakin tinggi pertumbuhan sel akan memberikan nilai absorbansi yang lebih besar. Hasil pengukuran metode turbidimetri berbanding lurus dengan hitungan cawan pada satuan log cfu/ml dalam pengukuran pertumbuhanE. faecium IS-27526. Hasil pengukuran pertumbuhan ditampilkan pada Gambar 6.
Gambar 6 Kurva pertumbuhanE. faeciumIS-27526
(A) Fase Adaptasi/Lag; (B) Fase Eksponensial/Log; (C) Fase Stasioner
Penentuan fase pada kurva pertumbuhan didasarkan pada kurva nilai absorbansi. Kurva absorbansi menunjukkan pola garis mendatar hingga waktu
B C
inkubasi 8 jam, yang menunjukkan terjadinya fase adaptasi atau lag pada E. faeciumIS-27526.
Gambar 6 menunjukkan adanya pertumbuhan pada hasil hitungan cawan pada jam ke-0 hingga jam ke-8 pada pembuatan kurva pertumbuhan. Seharusnya kurva hitungan cawan menunjukkan pola mendatar seperti kurva absorbansi. Hal ini dimungkinkan karena adanya pertumbuhan sel ketika proses hitungan cawan. Dalam pelaksanaan teknis, sel dan sebagian nutrisi media yang terencerkan didiamkan dalam pengenceran 10-1, sehingga masih memungkinkan adanya pertumbuhan sel.
Kurva hitungan cawan menunjukkan awal fase log mulai jam ke-4, sedangkan dari kurva absorbansi awal fase log pada jam ke-8. Namun, hal ini tidak mempengaruhi tujuan pembuatan kurva pertumbuhan, yaitu untuk memperoleh waktu yang tepat untuk penambahan kultur. Kultur pada usia 4 hingga 18 jam masih berada pada fase eksponensial dengan kondisi pembelahan biner yang sama, sehingga diambil pada jam berapa pun, namun masih dalam rentang fase log, akan menunjukkan kondisi sel yang sama.
Peningkatan absorbansi mulai terjadi dari jam ke-8 hingga jam ke-18 yang merupakan fase eksponensial atau log dari pertumbuhanE. faecium IS-27526. Nilai log cfu/ml mencapai pertumbuhan tertinggi sebesar 10.8 log cfu/ml pada waktu inkubasi 16 dan 18 jam. Peningkatan ini terjadi akibat adanya pembelahan biner sel yang meningkatkan jumlah sel hidup, sehingga semakin banyak cahaya yang diserap yang membuat nilai absorbansi lebih besar (Pelczar dan Chan, 2008).
Fase stasioner E. faecium IS-27526 terlihat sejak jam ke-18. Nilai absorbansi dan jumlah sel hidup dengan satuan log cfu/ml pada kurva pertumbuhan di fase stasioner menunjukkan garis lurus. Pada fase ini terjadi pertumbuhan sel yang sebanding dengan kematian sel, sehingga jumlah sel yang hidup cenderung konstan pada proses pencawanan. Hal ini sesuai dengan pernyataan Fardiaz (1989b) yaitu populasi sel tetap karena jumlah sel yang tumbuh sama dengan jumlah sel yang mati.
konstan pada fase stasioner disebabkan karena sel hidup yang kehabisan nutrisi pada media akan mendegradasi sel yang telah mati sebagai sumber nutrisi dan energinya (Mandelstam dan McQuillen, 1989). Pengukuran massa sel pada fase stasioner, termasuk dengan turbidimetri, tidak mengalami perubahan nilai.
Kurva pertumbuhan E. faecium IS-27526 yang dihasilkan belum menunjukkan terjadinya fase kematian karena hingga pengujian di jam ke-24 kurva pertumbuhanE. faeciumIS-27526 masih menunjukkan garis lurus yang mengindikasikan fase stasioner. Fase kematian terlihat dari adanya penurunan garis pada kurva pertumbuhan. Pada fase ini terjadi laju kematian sel yang lebih tinggi dibanding dengan laju pertumbuhan sel, sehingga jumlah sel hidup akan berkurang (Pelczar dan Chan, 2008). Fase kematianE. faecium IS-27526 kemungkinan terjadi pada waktu lebih dari 24 jam.
Sel yang dipindahkan ke media baru akan mengalami fase lag dan lama fase lag ini ditentukan dari usia sel yang dipindahkan. Apabila sel berasal dari fase stasioner, maka banyak sel yang sudah mati akan terbawa yang akan mempengaruhi turbiditas. Selain itu, sel hidup di dalamnya membutuhkan waktu lama untuk pemulihan dari kondisi toksik lingkungan di media lama, seperti adanya kondisi asam, basa, atau alkohol (White, 1995). Apabila inokulum berasal dari fase lag, sel masih belum aktif membelah karena masih berada dalam proses pembesaran ukuran sel (Pelczar dan Chan, 2008).
Sel yang berada pada fase eksponensial atau log berada pada kondisi yang aktif membelah dan responsif, sehingga sel pada rentang usia di fase ini dapat dipilih untuk kultur pengujian pengaruh prebiotik. Sel probiotik E. faecium IS-27526 yang dipilih untuk pengujian prebiotik adalah sel yang berada pada kondisi awal fase eksponensial atau log.
Pengujian pengaruh prebiotik terhadap pertumbuhan probiotik menggunakanE. faecium IS-27526 berusia 8 jam untuk menjamin kecukupan jumlah dan kesiapan pertumbuhan. Kurva hitungan cawan menunjukkan awal fase log mulai jam ke-4, tidak sesuai dengan kurva absorbansi yang menjadi dasar penentuan kurva pertumbuhan. Namun hal ini tidak mempengaruhi kondisi kultur yang diambil, yaitu pada usia 8 jam, karena masih berada dalam fase log atau eksponensial dengan kondisi pembelahan biner yang sama.
B. Pengaruh Prebiotik terhadap PertumbuhanE. faeciumIS-27526
Manfaat minimum prebiotik adalah mempengaruhi fisiologi dan modulasi mikrobiota pada bagian tertentu, seperti saluran pencernaan (Marlis, 2008). Pengujian langsung terhadap probiotik dirasa penting untuk melihat efek prebiotik terhadap sifat fisiologi, khususnya pertumbuhan, probiotik secara spesifik. Penelitian terhadap prebiotik yang tepat untuk probiotik lokal seperti E. faecium IS-27526 dan L. plantarum IS-10506 belum pernah dilakukan.
Prebiotik yang sudah umum dikenal dan populer digunakan adalah inulin dan fruktooligosakarida (FOS). Prebiotik inulin dan FOS telah banyak diteliti efeknya hingga secara in vivo dan banyak digunakan secara komersial di produk pangan (Rouzaud, 2007).
Gambar 7 Pengaruh jenis prebiotik terhadap pertumbuhan (absorbansi)
E. faecium IS-27526
Gambar 7 menunjukkan hasil pengukuran absorbansi dengan spektrofotometer pada panjang gelombang 600 nm yang menggambarkan pengaruh prebiotik inulin dan FOS terhadap pertumbuhan probiotik E. faecium IS-27526. Nilai absorbansi tertinggi menunjukkan pertumbuhan tertinggiE. faecium IS-27526, yaitu pada media m-MRSB + Glukosa dengan nilai absorbansi 1.285 pada waktu inkubasi 12 jam. Glukosa adalah sumber karbon paling umum dalam lingkungan. Glukosa merupakan sumber energi yang segera dapat digunakan karena glukosa dapat dengan mudah dan lebih cepat masuk ke dalam sel (Piliang dan Djojosoebagio, 2006).
E. faecium IS-27526, yang tergolong dalam Bakteri Asam Laktat (BAL), tumbuh baik di media yang diperkaya glukosa tinggi karena glukosa merupakan sumber karbon utama dan juga merupakan sumber pembentukan asam laktat. White (1995) menyatakan bahwa umumnya hampir semua bakteri memiliki enzim metabolisme glukosa yang hadir di setiap kondisi dan siap tumbuh dalam media mengandung glukosa di setiap waktu. Glukosa merupakan substansi kaya energi yang penting karena umumnya dalam daur hidup mikroorganisme diawali dengan konversi senyawa menuju jalur katabolisme glukosa (Bertolani, 2007).
media m-MRSB hanya sebesar 0.349. Pertumbuhan dalam m-MRSB hanya mengandalkan sumber nitrogen dan vitamin yang berasal dari pepton, yeast extract, danlab lemco powder yang merupakan ekstrak daging.
Nilai absorbansi E. faecium IS-27526 pada jam ke-12 dalam media m-MRSB + Inulin dan m-m-MRSB + FOS masing-masing sebesar 0.407 dan 0.389. Kurva absorbansi menunjukkan adanya tren pertumbuhan namun setelah itu bersifat statis. Hal ini sesuai dengan kurva hasil hitungan cawan (Gambar 8) yang menunjukkan adanya fase log yang dilanjutkan dengan fase stasioner.
Gambar 8 Pengaruh jenis prebiotik terhadap pertumbuhan (log cfu/ml)
E. faeciumIS-27526
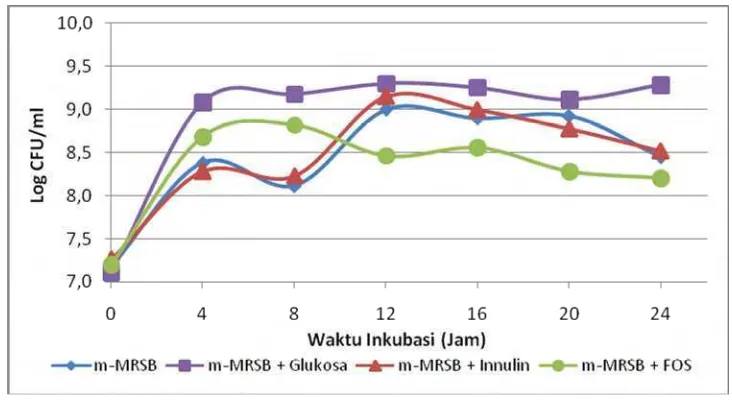
Jumlah E. faecium IS-27256 pada jam ke-0 berkisar pada 7 log cfu/ml. Hasil pengukuran absorbansi berkorelasi dengan hitungan cawan dalam satuan log cfu/ml. Pertumbuhan tertinggi diperoleh pada absorbansi tertinggi, yaitu 1.285 pada jam ke-12, dan jumlah sel tertinggi sebesar 9.3 log cfu/ml pada jam yang sama dalam media m-MRSB + Glukosa. Media dengan sumber karbon glukosa mendukung pertumbuhan sel sehingga jumlah sel hidup tinggi pada metode hitungan cawan. Banyaknya sel meningkatkan nilai penyerapan cahaya atau absorbansi pada metode turbidimetri.
jam ke-12 sebesar 9.1 log cfu/ml (absorbansi 0.407). Analisis statistik menunjukkan bahwa pertumbuhanE. faeciumIS-27526 pada jam ke-12 dalam kedua media tersebut tidak berbeda nyata pada taraf signifikansi 5% (Lampiran 17).
Kurva pertumbuhanE. faeciumIS-27526 juga menunjukkan bahwa pola pertumbuhan pada media m-MRSB + Inulin menyerupai kurva pertumbuhan pada media m-MRSB (Gambar 8). Hal ini menunjukkan bahwa kemungkinan pertumbuhan E. faecium IS-27526 memanfaatkan nutrisi dalam media m-MRSB dan tidak dengan memanfaatkan inulin.
E. faecium IS-27526 pada media m-MRSB masih dapat mengalami pertumbuhan, namun tidak secepat pertumbuhan pada media m-MRSB + Glukosa. Media m-MRSB merupakan media MRSB modifikasi yang terdiri dari mineral, vitamin, dan protein tanpa sumber karbon. Lingkungan yang kekurangan sumber karbon membuat E. faecium IS-27526 memanfaatkan sumber lain untuk menunjang pertumbuhannya.
Surono (2004) menyatakan BAL membutuhkan nutrisi kompleks untuk pertumbuhannya, yaitu asam amino dan vitamin. E. faecium IS-27526, yang tergolong sebagai BAL, dapat tumbuh mengandalkan asam amino sebagai sumber energi dalam kondisi lingkungan yang kritis sumber karbon. Kedua nutrisi ini dapat diperoleh dari kandungan m-MRSB yaituyeast extract, lab lemco powder yang merupakan ekstrak daging, serta pepton. Clifton (1958) menyatakan pepton dapat berperan sebagai sumber penyedia karbon dan nitrogen, serta meyuplai elemen anorganik untuk pertumbuhan bakteri.
Jumlah sel hidup E. faecium IS-27526 dalam media m-MRSB + FOS sebesar 8.7 log cfu/ml pada jam ke-4, kemudian menunjukkan pertumbuhan tertinggi 8.8 log cfu/ml pada waktu inkubasi 8 jam. Akan tetapi, terjadi penurunan menjadi 8.5 log cfu/ml ketika waktu inkubasi 12 jam dan 8,2 log cfu/ml pada waktu inkubasi 24 jam, namun penurunan jumlah tidak mencapai hingga 1 log cfu/ml.
Perubahan jumlah sel hidup E. faecium IS-27526 dari jam ke-4 hingga jam ke-24 dalam m-MRSB + FOS tidak berbeda signifikan dari analisis statistik. Namun, jumlah sel hidup pada jam ke-8 berbeda nyata dengan jumlah sel pada jam ke-24. Peningkatan jumlah sel hidup pada media m-MRSB + FOS mengindikasikan bahwa E. faecium IS-27526 dapat memanfaatkan FOS untuk pertumbuhannya, tetapi kemudian menurun.
Jumlah sel hidup atau kurva pertumbuhan dapat ditingkatkan dengan penambahan konsentrasi FOS. Konsentrasi FOS dalam media pengujian ini adalah 1% (b/v). Nutrisi yang paling penting dalam pertumbuhan sel adalah sumber karbon dan dalam hal ini dapat diperoleh dari prebiotik seperti FOS. Sehingga dimungkinkan bahwa jumlah sel hidup dapat ditingkatkan bila konsentrasi prebiotik ditingkatkan lebih banyak, yaitu melebihi 1% (b/v).
Fardiaz (1989b) menyatakan bahwa pada fase log pertambahan jumlah sel sensitif terhadap lingkungan dan dapat diperlambat oleh kurangnya zat nutrisi pada media hingga sel akan memasuki fase stasioner. Dinyatakan juga bahwa nutrisi penting untuk membentuk energi dan menyusun komponen sel. Penambahan jumlah nutrisi dapat meningkatkan jumlah sel yang ada karena terjadi sintesis RNA, DNA, dan protein baru secara cepat sehingga dapat meningkatkan kecepatan pembelahan sel (Mandelstam dan McQuillen, 1989).
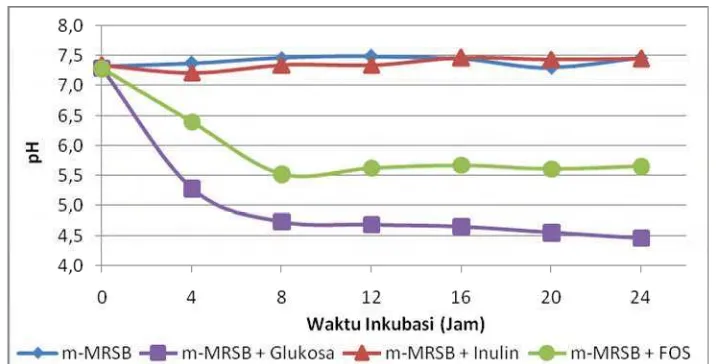
Gambar 9 menunjukkan nilai pH media m-MRSB serta m-MRSB + Inulin memiliki nilai pH yang saling berdekatan. Nilai pH media m-MRSB serta m-MRSB + Inulin tidak berbeda nyata dari jam ke-0 hingga jam ke-24 dari hasil analisis statistik. E. faeciumIS-27526 tidak membentuk asam laktat selama pertumbuhannya dalam kedua media ini, sehingga pH tidak mengalami perubahan nyata. Inulin tidak dapat difermentasi E. faecium IS-27526 menghasilkan asam laktat yang akan menurunkan pH media.
Gambar 9 Pengaruh jenis prebiotik terhadap nilai pH media selama pertumbuhanE. faecium IS-27526
E. faecium IS-27526 merupakan probiotik yang tergolong dalam BAL homofermentatif yang melakukan fermentasi asam laktat yang mengubah karbohidrat hampir seluruhnya menjadi produk tunggal, yaitu asam laktat (Madigan et al., 1997 dalam Surono, 2004b). BAL homofermentatif dapat mengubah 95% glukosa atau heksosa lainnya menjadi asam laktat dan sejumlah kecil CO2(Rahman et al., 1992).
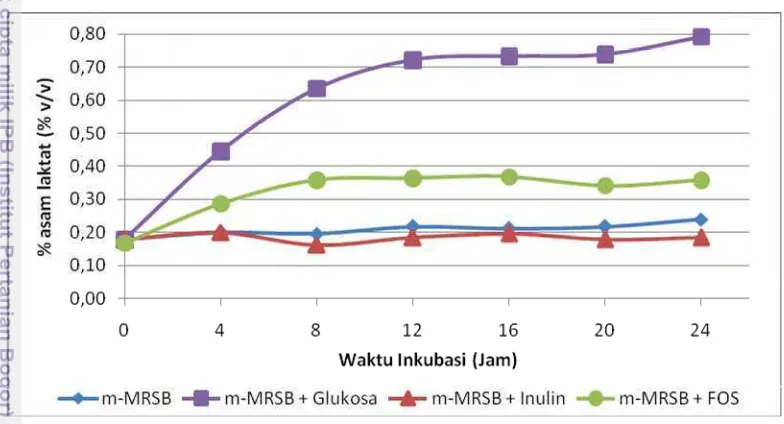
Hasil pengukuran pH sebanding dengan hasil pengukuran TAT (% asam laktat). Pengukuran TAT (% asam laktat) mengindikasikan banyaknya asam laktat yang terbentuk. Semakin tinggi total asam yang terbentuk pada media menandakan semakin tingginya asam laktat yang dihasilkan oleh E. faecium
IS-27526, karena sifatnya homofermentatif, sehingga hampir seluruh produk fermentasi yang dibentuk adalah asam laktat. Hasil pengukuran TAT (% asam laktat) dapat dilihat pada Gambar 10.
Gambar 10 Pengaruh jenis prebiotik terhadap nilai TAT (% asam laktat) media selama pertumbuhanE. faeciumIS-27526
Nilai TAT (% asam laktat) mendukung hasil absorbansi, hitungan cawan, dan pH media. Pertumbuhan optimum pada media m-MRSB + Glukosa di jam ke-12 menunjukkan absorbansi dan log cfu/ml tertinggi. Pada kondisi ini diperoleh nilai pH terendah (pH 4.7) dan nilai TAT (% asam laktat) tertinggi dibanding ketiga jenis media lainnya, yaitu sebesar 0.73% asam laktat. Nilai TAT (% asam laktat) media mengalami penurunan, namun cenderung statis hingga jam ke-24. Analisis statistik menunjukkan penurunan nilai TAT (% asam laktat) setelah jam ke-12 ini tidak berbeda nyata. Hasil analisis statistik nilai TAT (% asam laktat) media selama pengujian pengaruh prebiotik terhadapE. faeciumIS-27526 dapat dilihat pada Lampiran 19.
media dan TAT (% asam laktat) masing-masing sebesar 7.5 dan 0.22% asam laktat. Media m-MRSB + Inulin memiliki nilai pH 7.3 dan TAT (% asam laktat) sebesar 0.18% asam laktat.
Nilai TAT (% asam laktat) pada media m-MRSB berkorelasi dengan nilai pengukuran pH media. Analisis statistik menunjukkan nilai TAT (% asam laktat) media m-MRSB tidak berbeda nyata dari jam ke-0 hingga jam ke-24. Demikian halnya dengan nilai TAT (% asam laktat) pada media m-MRSB + Inulin. Nilai TAT (% asam laktat) kedua media ini tidak berbeda nyata dalam analisis statistik dengan taraf signifikansi 5%.
Hasil pengukuran pH dan TAT (% asam laktat) menunjukkan tidak terjadi pembentukan asam laktat yang dapat menurunkan pH media m-MRSB dan m-MRSB + Inulin. Nilai TAT (% asam laktat) tergolong rendah karena tidak ada sumber karbon yang dapat difermentasi oleh E. faecium IS-27526 menjadi asam laktat dan terlihat bahwa inulin tidak dapat difermentasi olehE. faeciumIS-27526.
Media m-MRSB + FOS memiliki nilai pH 5.5 dan TAT (% asam laktat) sebesar 0.36% asam laktat pada pertumbuhan tertingginya di jam ke-8. Nilai pH mengalami perubahan hingga jam ke-24, namun analisis statistik menunjukkan perubahan pH dari jam ke-8 hingga jam ke-24 tidak memiliki perbedaan nyata (Lampiran 18). Demikian halnya dengan nilai TAT (% asam laktat) media m-MRSB + FOS yang tidak berbeda nyata dari jam ke-4 hingga jam ke-24 (Lampiran 19).
Nilai pH dan TAT (% asam laktat) media m-MRSB + FOS berbeda nyata dengan media kontrol m-MRSB. Hasil pengukuran pH dan TAT (% asam laktat) menunjukkan E. faecium IS-27526 mampu memfermentasi FOS sehingga menghasilkan asam laktat yang dapat menurunkan pH media.
memiliki DP antara 2 – 8 (De Leenheer dan Hoebregs, 1994 dalam Franck dan De Leenheer, 2005).
FOS, yang dapat dipecah oleh enzimβ-fruktosidase, akan menghasilkan glukosa dan fruktosa. Molekul monosakarida ini akan masuk ke tahap glikolisis kemudian menghasilkan asam piruvat, 2 molekul adenosine triphosphate (ATP), dan 2 molekul NADH. Asam piruvat diubah oleh enzim laktat dehidrogenase menjadi asam laktat dengan mengubah 2 molekul NADH menjadi 2 molekul NAD+. Prinsip fermentasi asam laktat adalah transfer H+ dari NADH kepada gugus karbonil dari piruvat sehingga piruvat tereduksi menjadi laktat (Bertolani, 2007).
Fermentasi asam laktat dengan memanfaatkan FOS yang dilakukan oleh
E. faecium IS-27526 akan menghasilkan ATP. Peran ATP sangat penting dalam proses pertumbuhan karena merupakan sumber energi dalam aktivitas sel, salah satunya adalah pertumbuhan (Bertolani, 2007).
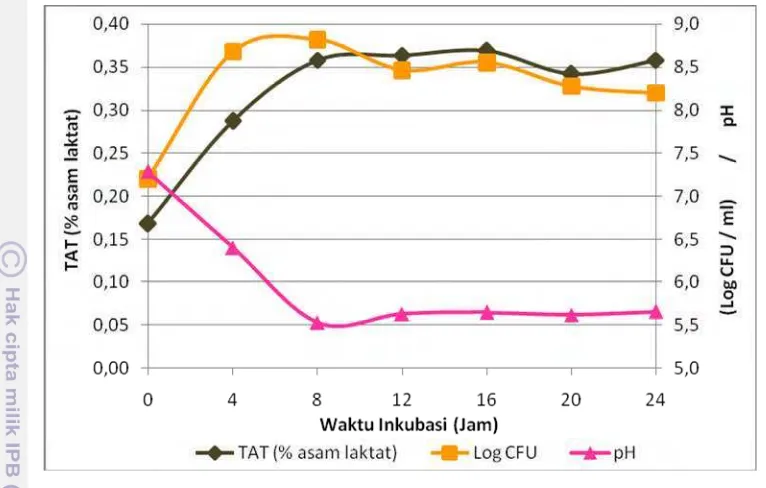
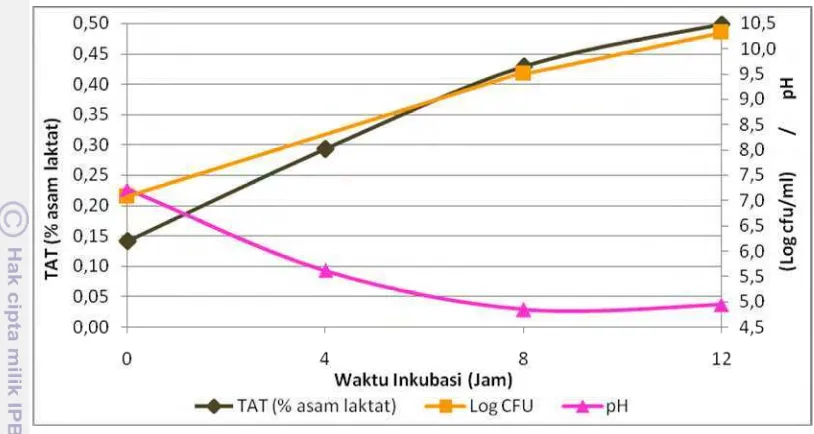
Gambar 11 Pengaruh prebiotik FOS terhadap pertumbuhan E. faecium IS-27526 (log cfu/ml), pH media, serta nilai TAT (% asam laktat)
E. faecium IS-27526 dapat memanfaatkan FOS untuk difermentasi membentuk asam laktat yang menurunkan pH media dan meningkatkan TAT (% asam laktat). Selain itu, ATP yang umum dihasilkan saat fermentasi dapat digunakan untuk mendukung aktivitas pertumbuhannya hingga mencapai jumlah sel tertinggi sebesar 8.8 log cfu/ml pada waktu inkubasi 8 jam.
Penelitian oleh Audisioet al. (2001) melihat efek prebiotik dari berbagai sumber gula terhadap E. faecium CRL1385. Hasil pertumbuhan E. faecium
CRL1385 tidak berbeda nyata pada taraf signifikansi 5% di antara kontrol tanpa sumber karbon, penambahan gula putih, penambahan gula merah, serta penambahan glukosa.
Penelitian Kaplan dan Hutkins (2003) dalam Saulnier et al. (2007) menyimpulkan bahwa L. paracasei dapat memanfaatkan FOS dengan implikasi sistem transpor yang bersifat dependen terhadap keberadaan ATP. Saulnier et al. (2007) meneliti lebih dalam dan menyatakan bahwa proses degradasi prebiotik FOS melibatkan tiga gen yaitu sistem transpor fosfoenolpiruvat (PTS) sukrosa,β-fruktofuranosidase, dan fruktokinase.
C. Pengaruh Prebiotik terhadap PertumbuhanL. plantarumIS-10506
Pengujian efek prebiotik terhadap strain E. faecium IS-27526 dibandingkan dengan kedua strain lainnya, yaituL. plantarum IS-10506 isolat dadih dan jugaL. caseistrain Shirota sebagai probiotik komersial. Pengukuran yang dilakukan adalah pH media dan TAT (% asam laktat) setiap 4 jam hingga waktu inkubasi 12 jam. Penghitungan sel hidup dengan metode hitungan cawan dilakukan pada jam ke-0, 8, dan 12.
Pengujian ini tidak menggunakan standar m-MRSB + Glukosa. Huebner
et al. (2007) dengan penelitian serupa menunjukkan jumlah log cfu/ml
Lactobacillus serta Bifidobacterium paling optimum pada media standar glukosa. Pembuktian teori bahwa BAL memerlukan glukosa untuk tumbuh optimum telah terlihat dari pengujian terhadap probiotikE. faeciumIS-27526. Pola pertumbuhan BAL pada media glukosa diperkirakan akan sama, yaitu menunjukkan hasil paling optimum, sehingga penggunaan standar glukosa tidak lagi digunakan padaL. plantarumIS-10506 danL. caseistrain Shirota.
Analisis statistik hasil hitungan cawan pada Lampiran 20 menunjukkan jumlah kultur awal yang ditambahkan dalam ketiga jenis media dalam pengujian tidak berbeda nyata pada taraf signifikansi 5%. Kultur awal (berkisar pada 7.0 log cfu/ml) yang digunakan sama jumlahnya dengan pengujian terhadap probiotik E. faeciumIS-27526. Jumlah kultur awal serupa digunakan dalam pengujian pengaruh prebiotik oleh Audisioet al.(2001).
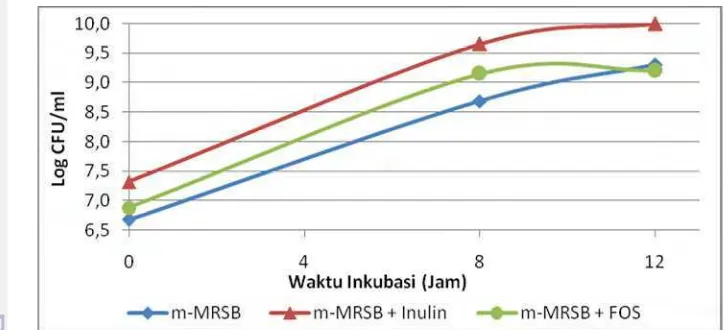
IS-10506 lebih tinggi secara signifikan (p<0.05) pada MRSB + Inulin dan m-MRSB + FOS dibanding kontrol m-m-MRSB pada waktu inkubasi 12 jam.
Pertumbuhan L. plantarum IS-10506 pada media kontrol m-MRSB sebesar 8.7 log cfu/ml di jam ke-12. Pertumbuhan tertinggi dalam m-MRSB terjadi di jam ke-8 sebesar 8.8 log cfu/ml, namun perubahan log cfu/ml ini tidak berbeda nyata. Pertumbuhan L. plantarum IS-10506 dalam m-MRSB tanpa sumber karbon sangat minim karena pertumbuhan BAL membutuhkan sumber karbohidrat yang dapat difermentasi (Pot et al., 1994). Hasil hitungan cawan dapat dilihat pada Gambar 12.
Gambar 12 Pengaruh jenis prebiotik terhadap pertumbuhan (log cfu/ml)
L. plantarumIS-10506
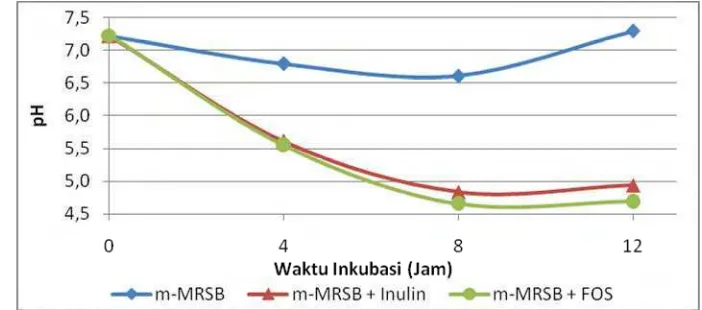
Gambar 13 Pengaruh jenis prebiotik terhadap nilai pH media selama pertumbuhanL. plantarum IS-10506
Hasil analisis statistik menunjukkan selama pertumbuhan L. plantarum
IS-10506 nilai pH terendah secara signifikan (p<0.05) diperoleh pada m-MRSB + FOS pada jam ke-8 dan 12. Nilai pH media yang mengandung prebiotik (m-MRSB + FOS serta m-MRSB + Inulin) berbeda nyata satu sama lain pada jam ke-8 dan 12 dan juga berbeda nyata dengan nilai pH media kontrol m-MRSB. Hasil analisis statistik pH media dapat dilhat pada Lampiran 21.
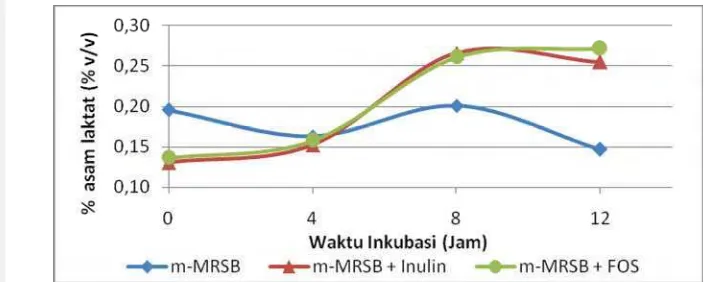
Gambar 14 Pengaruh jenis prebiotik terhadap nilai TAT (% asam laktat) media selama pertumbuhanL. plantarumIS-10506
Semakin tinggi konsentrasi asam laktat akan menghasilkan konsentrasi ion H+ yang semakin tinggi sehingga pH menjadi semakin asam (Helferich dan Westhoff, 1980).
Pertumbuhan tertinggi ditunjukkan dengan nilai TAT (% asam laktat) tertinggi. Pada jam ke-12 terjadi pertumbuhanL. plantarum IS-10506 dalam media m-MRSB + FOS memiliki pH terendah 4.7 dan nilai TAT (% asam laktat) tertinggi sebesar 0.61% dibanding jenis media lainnya. Hasil ini sesuai dengan analisis statistik nilai TAT (% asam laktat) selama pertumbuhan L. plantarumIS-10506 pada Lampiran 22.
Pada jam ke-12, nilai TAT (% asam laktat) media m-MRSB + Inulin sebesar 0.50% dan TAT (% asam laktat) terendah pada media m-MRSB sebesar 0.15%. Nilai TAT (% asam laktat) pada media yang mengandung prebiotik lebih tinggi secara signifikan (p<0.05) dibanding dengan kontrol m-MRSB dari hasil analisis statistik. L. plantarum IS-10506, yang merupakan BAL, dapat memfermentasi inulin dan FOS menjadi asam laktat sehingga terjadi penurunan pH dan kenaikan nilai TAT (% asam laktat) pada kedua media yang mengandung prebiotik dibanding dengan kontrol m-MRSB.
Lampiran 20 menunjukkan hasil analisis statistik pertumbuhan L. plantarum IS-10506. ANOVA dengan analisis lanjutan menggunakan uji Tukey menentukan jenis prebiotik yang signifikan menunjukkan pertumbuhan tertinggi dari analisis interaksi antara variabel jenis media dan waktu inkubasi.
Jumlah sel hidup pada media m-MRSB + Inulin pada jam ke-8, yaitu 9.5 log cfu/ml, tidak berbeda nyata dengan jumlah sel hidup pada media m-MRSB + FOS di jam ke-12. Jumlah sel hidup yang sama, yaitu 9.5 log cfu/ml, dapat dicapai oleh L. plantarum IS-10506 dengan lebih singkat pada m-MRSB + Inulin.L. plantarum IS-10506 dapat memanfaatkan prebiotik inulin dan FOS, namun tumbuh lebih cepat dengan prebiotik inulin dibanding FOS.
Gambar 15 Pengaruh prebiotik inulin terhadap pertumbuhanL.plantarum
IS-10506 (log cfu/ml), pH media, serta nilai TAT (% asam laktat)
L. plantarum IS-10506 menunjukkan adanya kemampuan untuk memecah ikatan pada rantai panjang inulin. Inulin umumnya dapat dipecah dengan enzim inulinase yang dapat dijumpai pada beberapa tanaman dan mikroorganisme (kapang, khamir, dan bakteri). Inulinase memotong unit fruktosa dari ujung yang tidak tereduksi atau dari posisi fruktosa tertentu (Molinaet al., 2005).
Fermentasi prebiotik sangat tergantung pada strain bakteri, bukan hanya berdasarkan spesies saja. Penelitian Huebner et al. (2007) menunjukkan bahwa strain berbeda dari spesies L. plantarummenunjukkan skor aktivitas prebiotik yang berbeda. Prebiotik inulin dan FOS mendukung pertumbuhanL. plantarum4008 dengan baik, namun tidak mendukungL. plantarum12006.
Pennachia et al.(2006) menyimpulkan adanya pertumbuhan dalam 2% FOS pada MRSB kontrol tanpa glukosa padaL. plantarum strain DL6, namun tidak demikian dengan L. plantarum strain GL2. Penelitian Saulnier et al.
(2007) menunjukkan L. plantarum WCFS1 tidak dapat tumbuh dengan baik menggunakan FOS selama 24 jam inkubasi.
(Huebner et al., 2007). Pemanfaatan prebiotik oleh BAL membutuhkan keberadaan sistem transportasi dan hidrolisis yang spesifik (Barrangou et al., 2003 dalam Huebneret al., 2007).
D. Pengaruh Prebiotik terhadap PertumbuhanL. caseistrain Shirota
Pengujian pengaruh prebiotik dilakukan pada L. casei strain Shirota mewakili probiotik komersial. Pengujian dilakukan dengan metode sama seperti L. plantarum IS-10506. Pengukuran yang dilakukan antara lain pengukuruan pH media dan TAT (% asam laktat) setiap 4 jam selama 12 jam, sedangkan jumlah sel hidup diukur dengan metode hitungan cawan pada jam ke-0, 8, dan 12.
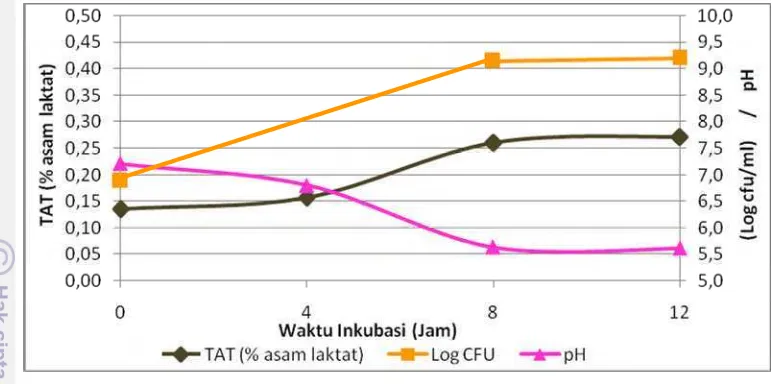
Pertumbuhan tertinggi L. casei strain Shirota diperoleh pada waktu inkubasi 12 jam pada media m-MRSB + Inulin sebesar 10.0 log cfu/ml. Pertumbuhan pada media m-MRSB + FOS dan m-MRSB masing-masing sebesar 9.2 dan 9.3 log cfu/ml. Gambar 16 menunjukkan hasil hitungan cawan
L. caseistrain Shirota dalam satuan log cfu/ml.
Gambar 16 Pengaruh jenis prebiotik terhadap pertumbuhan (log cfu/ml)
L. caseistrain Shirota
Dilihat dari segi waktu inkubasi, analisis statistik menunjukkan bahwa pertumbuhan dari jam ke-0, 8, dan 12 masing-masing memiliki perbedaan yang signifikan. Hal ini disebabkan karena selama jam ke-0 hingga jam ke-12 pertumbuhan L. casei strain Shirota berada pada fase log yang masih aktif membelah dan membetuk sel baru, sehingga jumlah sel setiap waktu penghitungan sel hidup akan berbeda. Peningkatan jumlah sel terjadi cukup tinggi akibat pembelahan biner sel selama fase log (Lay dan Hastowo, 1992).
Rata-rata pertumbuhan L. casei strain Shirota pada media m-MRSB + Inulin tidak berbeda nyata dengan m-MRSB + FOS, namun berbeda nyata dengan kontrol. Walaupun dikatakan berbeda nyata secara statistik, namun perbedaannya tidak mencapai 1 log cfu/ml. Rata-rata pertumbuhan L. casei
strain Shirota pada m-MRSB + FOS tidak berbeda nyata dibanding kontrol dan juga tidak berbeda nyata dengan m-MRSB + Inulin.
Media m-MRSB + Inulin dan m-MRSB + FOS memiliki nilai pH awal yang sama, yaitu 7.2 dan setelah inkubasi 12 jam turun menjadi 5.6. Nilai pH yang mendekati, yaitu 5.1, diperoleh dari fermentasi prebiotik FOS mikrobiota feses babi in vitroselama inkubasi 12 jam yang diteliti oleh Smiricky-Tjardes
et al. (2003). Analisis statistik pH media selama pertumbuhan L. caseistrain Shirota pada Lampiran 24 menunjukkan pH kedua media yang mengandung prebiotik tidak berbeda satu sama lain.
Analisis statistik menunjukkan nilai pH media MRSB + Inulin dan m-MRSB + FOS lebih rendah secara signifikan (p<0.05) dibanding media kontrol MRSB pada jam ke-8 dan 12. Pada jam ke-12, nilai pH media m-MRSB sebesar 7.7. Hasil pengukuran pH dapat dilihat pada Gambar 17.
pertumbuhanL. caseistrain Shirota
Hasil pengukuran pH sesuai dengan pengukuran TAT (% asam laktat) (Gambar 18). Setelah waktu inkubasi 12 jam, nilai TAT (% asam laktat) pada media m-MRSB, m-MRSB + Inulin, dan m-MRSB + FOS secara berturut-turut adalah 0.15%, 0.26%, dan 0.27%.
Gambar 18 Pengaruh jenis prebiotik terhadap nilai TAT (% asam laktat) media selama pertumbuhanL. caseistrain Shirota
Analisis statistik nilai TAT (% asam laktat) selama pertumbuhanL. casei
strain Shirota dapat dilihat pada Lampiran 25. Media yang mengandung prebiotik, yaitu m-MRSB + Inulin dan m-MRSB + FOS, tidak berbeda nyata satu sama lain. Pada jam ke-12, yaitu waktu inkubasi dengan pertumbuhanL. casei strain Shirota tertinggi, menunjukkan nilai TAT (% asam laktat) media prebiotik lebih tinggi dibanding kontrol m-MRSB. Media mengandung prebiotik dapat dimanfaatkan oleh L. casei strain Shirota untuk difermentasi membentuk asam laktat sehingga pH media turun.
L. casei strain Shirota menunjukkan kemampuan tumbuh di kedua jenis prebiotik, sehingga jenis prebiotik yang signifikan mendukung pertumbuhan
L. casei strain Shirota diketahui dengan bantuan analisis ANOVA dengan analisis lanjutan uji Tukey. Hasil analisis menunjukkanL. casei strain Shirota dapat tumbuh dengan baik pada kedua jenis prebiotik dan tidak berbeda signifikan satu sama lain (p<0.05). Walaupun demikian, pertumbuhanL. casei
strain Shirota cenderung memberikan hasil jumlah sel hidup yang lebih tinggi pada prebiotik inulin, yaitu sebesar 10.0 log cfu/ml.
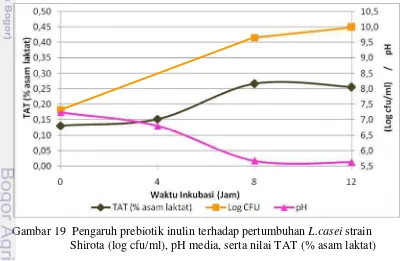
Pengaruh prebiotik inulin terhadap jumlah sel hidup, nilai pH media, dan nilai TAT (% asam laktat) selama pertumbuhan L. casei strain Shirota dapat dilihat pada Gambar 19, sedangkan pengaruh prebiotik FOS terhadap parameter yang sama dapat dilihat pada Gambar 20. Peningkatan pertumbuhan
L. casei strain Shirota dalam media mengandung prebiotik menunjukkan penurunan pH dan peningkatan nilai TAT (% asam laktat) karena fermentasi prebiotik menghasilkan asam laktat.
Gambar 20 Pengaruh prebiotik FOS terhadap pertumbuhan L.caseistrain Shirota (log cfu/ml), pH media, serta nilai TAT (% asam laktat)
Interaksi prebiotik dengan probiotik bersifat spesifik, sehingga studi ini penting dalam aplikasi sinbiotik, gabungan prebiotik-probiotik. Sinbiotik dapat meningkatkan manfaat kesehatan dibanding aplikasi prebiotik atau probiotik saja. Sistem sinbiotik efisien bila substrat mengandung prebiotik sesuai untuk mendukung pertumbuhan probiotik (Kneifel et al., 2000 dalam Pennachiaet al., 2006). Pemilihan lebih dari satu prebiotik diperlukan untuk meningkatkan pertumbuhan probiotik (Penacchiaet al., 2006).
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Prebiotik inulin 1% (b/v) dapat dimanfaatkan oleh L. plantarum IS-10506 dan L. casei strain Shirota untuk mendukung pertumbuhannya, tetapi tidak dapat dimanfaatkan E. faecium IS-27526. Prebiotik fruktooligosakarida (FOS) 1% (b/v) dapat dimanfaatkan oleh ketiga jenis probiotik.
E. faeciumIS-27526 dapat memfermentasi FOS sehingga TAT (% asam laktat) meningkat dan pH menurun. E. faecium IS-27526 tidak dapat memanfaatkan inulin karena kurva pertumbuhannya sama dengan m-MRSB, selain itu penurunan pH dan peningkatan TAT (% asam laktat) tidak terjadi.