PENGARUH PENYUNTIKAN SOMATOTROPIN TERHADAP
KADAR GLUKOSA DARAH DAN CAIRAN AMNION PADA
TIKUS BETINA BUNTING (Rattus norvegicus)
AGUS MULYADI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
RINGKASAN
AGUS MULYADI. Pengaruh Penyuntikan Somatotropin terhadap Kadar
Glukosa Darah dan Cairan Amnion pada Tikus Betina Bunting (Rattus
norvegicus). Dibawah bimbingan Dr. Nastiti Kusumorini dan Drs. Pudji Achmadi.
Penelitian ini dilakukan untuk melihat pengaruh pemberian bST terhadap
kadar glukosa darah induk dan cairan amnion selama kebuntingan yang
dihubungkan dengan tampilan anak. Sampel tikus (Rattus norvegicus) yang
digunakan sebanyak 36 ekor dan dibagi dalam 3 kelompok percobaan yaitu
kelompok yang disuntik dengan bST (kelompok H), kelompok yang disuntik
minyak jagung (kelompok M) dan kelompk kontrol (K) yang tidak diberi
perlakuan apapun. Tikus (Rattus norvegicus) disuntik pada hari ke-4 sampai hari
ke-12 kebuntingan. Perlakuan dilakukan dalam 4 kali pengulangan. Setelah umur
kebuntingan mencapai 13, 17, dan 21 hari, kadar glukosa darah, cairan amnion
dan bobot fetus diamati dan dibandingkan pada masing-masing umur kebuntingan
tersebut. Hasil penelitian menunjukkan bahwa bovine somatotropin (bST) tidak
mempengaruhi kadar glukosa darah maupun glukosa cairan amnion dan tidak
ABSTRACT
The aims of this research was to study influence of bST for blood and
amnion glucose rate during gestation period which related to foetus performance.
There are 36 rats (Rattus norvegicus) that devided into 3 treatment group that
are the groups treated by injected bST (group H), treated by corn oil (group M),
and the groups which has no any treatment (group K). The rats (Rattus
norvegicus) was injected with bST and corn oil on 4 until 12 days of gestation.
The experiment used 4 repetitions. When pregnant age reached days 13, 17 and
21, blood glucose rate, amnion glucose rate, and foetus wight mains perceived
and compared at each the pregnant age. The results showes that bST did not
influence blood and amnion glucose rate and did not induce any changes in
PENGARUH PENYUNTIKAN SOMATOTROPIN TERHADAP
KADAR GLUKOSA DARAH DAN CAIRAN AMNION PADA
TIKUS BETINA BUNTING (Rattus norvegicus)
AGUS MULYADI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul : Pengaruh Penyuntikan Somatotropin terhadap Kadar Glukosa
Darah dan Cairan Amnion pada Tikus Betina Bunting.
Nama penulis : Agus Mulyadi
NRP : B04103004
Menyetujui :
Dosen Pembimbing I Dosen Pembimbing II
Dr. Nastiti Kusumorini Drs. Pudji Achmadi NIP. 131 669 942 NIP. 131 956 684
Mengetahui :
Wakil Dekan Fakultas Kedokteran Hewan
Institut Pertanian Bogor
Dr. Drh. I Wayan Teguh Wibawan, MS. NIP. 131 129 090
RIWAYAT HIDUP
Penulis dilahirkan di Dompu, Nusa Tenggara Barat pada tanggal 13
Agustus 1984 sebagai anak kedua dari tiga orang bersaudara pasangan Bapak M.
Yakub Rais dan Ibu Maatu M. Yakub.
Pendidikan sekolah dasar penulis diselesaikan di SD Inpres Kandai I
Dompu pada tahun 1997. Selanjutnya penulis meneruskan pendidikan di SLTP 1
Dompu dan lulus pada tahun 2000. Pendidikan sekolah menengah atas penulis
diselesaikan di SMU 1 Dompu dan lulus pada tahun 2003.
Penulis diterima di Institut Pertanian Bogor (IPB) pada tahun 2003 melalui
jalur USMI (Undangan Seleksi Masuk IPB) sebagai mahasiswa Tingkat Persiapan
Bersama (TPB), kemudian pada tahun 2004 penulis mulai menduduki bangku
perkuliahan di Fakultas Kedokteran Hewan (FKH) IPB.
Selama menjadi mahasiswa FKH IPB penulis aktif di Badan Eksekutif
Mahasiswa (BEM) FKH-IPB sebagai pengurus pada tahun 2005-2006. Penulis
juga aktif di Himpunan Minat Profesi (Himpro) Ruminansia dan Himpro
Ornithologi dan Unggas 2005-2006. Disamping itu penulis juga terdaftar sebagai
pengurus Forum Ilmiah Mahasiswa (FIM) dan Dewan Keluarga Mushola (DKM)
AN-NAHL.
PRAKATA
Puji dan syukur penulis haturkan kehadirat ALLAH SWT, atas berkat
rahmat dan hidayah-Nya, penulisan skripsi dengan judul “Pengaruh Penyuntikan
Somatotropin terhadap Kadar Glukosa Darah dan Cairan Amnion pada Tikus
Betina Bunting”. Tugas akhir ini merupakan salah satu syarat untuk memperoleh
gelar kesarjanaan di Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Shalawat dan Salam senantiasa tercurahkan kepada suri tauladan kita Nabi
Muhammad SAW baserta keluarga, sahabat, dan umatnya.
Terima kasih penulis ucapkan sebesar-besarnya kepada :
1. Dr. Nastiti Kusumorini selaku dosen pembimbing skripsi yang telah
banyak memberikan banyak ilmu, kesempatan, motivasi, inspirasi,
pengarahan, koreksi, saran, serta pengorbanan dalam penelitian dan
penyusunan skripsi.
2. Drs. Pudji Achmadi selaku dosen pembimbing skripsi yang telah banyak
memberikan banyak ilmu, kesempatan, pengarahan, koreksi, saran, dan
pengorbanan dalam penelitian dan penyusunan skripsi.
3. Dr. drh. Aryani Sismin Satyaningtijas, MSc. Selaku dosen pembimbing
yang telah banyak memberikan banyak pengarahan, saran, dan
pengorbanan dalam penelitian.
4. Dr. drh. Syahrun Hamdani Nasution, selaku dosen penilai skripsi.
5. drh. Dudung Abdullah, selaku pembimbing akademik.
6. Program Hibah Kompetitif (PHK) A-3 FKH IPB yang telah membiayai
dan mendukung terlaksananya penelitian.
7. Mama, Dae, dan Dae lamu-koe tercinta, kakakku Adhim, adikku Ayu
Mutmainnah serta keluarga besar yang telah memberikan dukungan moril
dan materil.
8. Seluruh staf Laboratorium Fisiologi dan Farmakologi Fakultas Kedokteran
Hewan Institut Pertanian Bogor, terutama Pak Edi, Ibu Sri, Ibu Ida yang
telah banyak mencurahkan perhatian, waktu, dan tenaga selama penelitian.
9. Teman-teman sepenelitian, Widia, Ulil, Metha, Athien, dan Intan,
10.Teman-teman Wisma Hattori (Adhim, Daeng, Berri, Lando, Dedi,
Gunawan, dan Jemix).
11. Teman-teman terbaikku (Bheta, Bhonex, Zaldi, Daeng, Agung, Adam,
Ilham, Adji, dan Berri).
12.Gymnolaemata 40, terimakasih atas kebersamaan dan kekompakannya.
13.Semua pihak yang telah membantu dalam penulisan skripsi ini.
Penulis menyadari bahwa tulisan ini masih jauh dari kesempurnaan, tetapi
penulis berharap tulisan ini dapat memberikan warna baru dalam khasanah bidang
veteriner terutama penggunaan hormon. Di luar kekurangan yang ada, penulis
juga berharap tulisan ini dapat bermanfaat bagi semua pihak yang
membutuhkannya. Untuk itu penulis sangat berharap kritik dan saran yang
bersifat membangun demi kesempurnaan tulisan ini.
DAFTAR ISI
Manfaat Penelitian... 3
TINJAUAN PUSTAKA Hewan Coba... 4
Klasifikasi... 4
Biologi Reproduksi Tikus... 4
Fisiologi Kebuntingan... 5
Hormon reproduksi... 6
Fungsi estrogen pada masa kebuntingan... 6
Fungsi progesteron pada masa kebuntingan... 7
Plasenta... 7
Nutrisi embrio... 10
Nutrisi fetus... 12
Pertumbuhan embrio dan fetus... 13
Sirkulasi fetus... 16
Cairan amnion dan allantois... 16
Somatotropin Struktur dan biosintesis somatotropin... 18
Reseptor dan kerja somatotropin... 20
Efek somatotropin terhadap kadar glukosa... 22
Bovine Somatotropin (bST)... 24
MATERI DAN METODE Waktu dan Tempat Penelitian... 26
Bahan dan Alat... 26
Metode Penelitian... 26
Persiapan tikus percobaan... 26
Perlakuan... 27
Pengambilan darah... 27
Pengambilan cairan amnion... 27
Pengambilan dan penimbangan fetus... 27
Pengukuran kadar glukosa... 28
Analisis statistik……….. 28
Parameter yang diamati……….. 28
Diagram penelitian... 29
HASIL DAN PEMBAHASAN... 30
SARAN... . 34
DAFTAR PUSTAKA... 35
LAMPIRAN... 40
PENGARUH PENYUNTIKAN SOMATOTROPIN TERHADAP
KADAR GLUKOSA DARAH DAN CAIRAN AMNION PADA
TIKUS BETINA BUNTING (Rattus norvegicus)
AGUS MULYADI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
RINGKASAN
AGUS MULYADI. Pengaruh Penyuntikan Somatotropin terhadap Kadar
Glukosa Darah dan Cairan Amnion pada Tikus Betina Bunting (Rattus
norvegicus). Dibawah bimbingan Dr. Nastiti Kusumorini dan Drs. Pudji Achmadi.
Penelitian ini dilakukan untuk melihat pengaruh pemberian bST terhadap
kadar glukosa darah induk dan cairan amnion selama kebuntingan yang
dihubungkan dengan tampilan anak. Sampel tikus (Rattus norvegicus) yang
digunakan sebanyak 36 ekor dan dibagi dalam 3 kelompok percobaan yaitu
kelompok yang disuntik dengan bST (kelompok H), kelompok yang disuntik
minyak jagung (kelompok M) dan kelompk kontrol (K) yang tidak diberi
perlakuan apapun. Tikus (Rattus norvegicus) disuntik pada hari ke-4 sampai hari
ke-12 kebuntingan. Perlakuan dilakukan dalam 4 kali pengulangan. Setelah umur
kebuntingan mencapai 13, 17, dan 21 hari, kadar glukosa darah, cairan amnion
dan bobot fetus diamati dan dibandingkan pada masing-masing umur kebuntingan
tersebut. Hasil penelitian menunjukkan bahwa bovine somatotropin (bST) tidak
mempengaruhi kadar glukosa darah maupun glukosa cairan amnion dan tidak
ABSTRACT
The aims of this research was to study influence of bST for blood and
amnion glucose rate during gestation period which related to foetus performance.
There are 36 rats (Rattus norvegicus) that devided into 3 treatment group that
are the groups treated by injected bST (group H), treated by corn oil (group M),
and the groups which has no any treatment (group K). The rats (Rattus
norvegicus) was injected with bST and corn oil on 4 until 12 days of gestation.
The experiment used 4 repetitions. When pregnant age reached days 13, 17 and
21, blood glucose rate, amnion glucose rate, and foetus wight mains perceived
and compared at each the pregnant age. The results showes that bST did not
influence blood and amnion glucose rate and did not induce any changes in
PENGARUH PENYUNTIKAN SOMATOTROPIN TERHADAP
KADAR GLUKOSA DARAH DAN CAIRAN AMNION PADA
TIKUS BETINA BUNTING (Rattus norvegicus)
AGUS MULYADI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul : Pengaruh Penyuntikan Somatotropin terhadap Kadar Glukosa
Darah dan Cairan Amnion pada Tikus Betina Bunting.
Nama penulis : Agus Mulyadi
NRP : B04103004
Menyetujui :
Dosen Pembimbing I Dosen Pembimbing II
Dr. Nastiti Kusumorini Drs. Pudji Achmadi NIP. 131 669 942 NIP. 131 956 684
Mengetahui :
Wakil Dekan Fakultas Kedokteran Hewan
Institut Pertanian Bogor
Dr. Drh. I Wayan Teguh Wibawan, MS. NIP. 131 129 090
RIWAYAT HIDUP
Penulis dilahirkan di Dompu, Nusa Tenggara Barat pada tanggal 13
Agustus 1984 sebagai anak kedua dari tiga orang bersaudara pasangan Bapak M.
Yakub Rais dan Ibu Maatu M. Yakub.
Pendidikan sekolah dasar penulis diselesaikan di SD Inpres Kandai I
Dompu pada tahun 1997. Selanjutnya penulis meneruskan pendidikan di SLTP 1
Dompu dan lulus pada tahun 2000. Pendidikan sekolah menengah atas penulis
diselesaikan di SMU 1 Dompu dan lulus pada tahun 2003.
Penulis diterima di Institut Pertanian Bogor (IPB) pada tahun 2003 melalui
jalur USMI (Undangan Seleksi Masuk IPB) sebagai mahasiswa Tingkat Persiapan
Bersama (TPB), kemudian pada tahun 2004 penulis mulai menduduki bangku
perkuliahan di Fakultas Kedokteran Hewan (FKH) IPB.
Selama menjadi mahasiswa FKH IPB penulis aktif di Badan Eksekutif
Mahasiswa (BEM) FKH-IPB sebagai pengurus pada tahun 2005-2006. Penulis
juga aktif di Himpunan Minat Profesi (Himpro) Ruminansia dan Himpro
Ornithologi dan Unggas 2005-2006. Disamping itu penulis juga terdaftar sebagai
pengurus Forum Ilmiah Mahasiswa (FIM) dan Dewan Keluarga Mushola (DKM)
AN-NAHL.
PRAKATA
Puji dan syukur penulis haturkan kehadirat ALLAH SWT, atas berkat
rahmat dan hidayah-Nya, penulisan skripsi dengan judul “Pengaruh Penyuntikan
Somatotropin terhadap Kadar Glukosa Darah dan Cairan Amnion pada Tikus
Betina Bunting”. Tugas akhir ini merupakan salah satu syarat untuk memperoleh
gelar kesarjanaan di Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Shalawat dan Salam senantiasa tercurahkan kepada suri tauladan kita Nabi
Muhammad SAW baserta keluarga, sahabat, dan umatnya.
Terima kasih penulis ucapkan sebesar-besarnya kepada :
1. Dr. Nastiti Kusumorini selaku dosen pembimbing skripsi yang telah
banyak memberikan banyak ilmu, kesempatan, motivasi, inspirasi,
pengarahan, koreksi, saran, serta pengorbanan dalam penelitian dan
penyusunan skripsi.
2. Drs. Pudji Achmadi selaku dosen pembimbing skripsi yang telah banyak
memberikan banyak ilmu, kesempatan, pengarahan, koreksi, saran, dan
pengorbanan dalam penelitian dan penyusunan skripsi.
3. Dr. drh. Aryani Sismin Satyaningtijas, MSc. Selaku dosen pembimbing
yang telah banyak memberikan banyak pengarahan, saran, dan
pengorbanan dalam penelitian.
4. Dr. drh. Syahrun Hamdani Nasution, selaku dosen penilai skripsi.
5. drh. Dudung Abdullah, selaku pembimbing akademik.
6. Program Hibah Kompetitif (PHK) A-3 FKH IPB yang telah membiayai
dan mendukung terlaksananya penelitian.
7. Mama, Dae, dan Dae lamu-koe tercinta, kakakku Adhim, adikku Ayu
Mutmainnah serta keluarga besar yang telah memberikan dukungan moril
dan materil.
8. Seluruh staf Laboratorium Fisiologi dan Farmakologi Fakultas Kedokteran
Hewan Institut Pertanian Bogor, terutama Pak Edi, Ibu Sri, Ibu Ida yang
telah banyak mencurahkan perhatian, waktu, dan tenaga selama penelitian.
9. Teman-teman sepenelitian, Widia, Ulil, Metha, Athien, dan Intan,
10.Teman-teman Wisma Hattori (Adhim, Daeng, Berri, Lando, Dedi,
Gunawan, dan Jemix).
11. Teman-teman terbaikku (Bheta, Bhonex, Zaldi, Daeng, Agung, Adam,
Ilham, Adji, dan Berri).
12.Gymnolaemata 40, terimakasih atas kebersamaan dan kekompakannya.
13.Semua pihak yang telah membantu dalam penulisan skripsi ini.
Penulis menyadari bahwa tulisan ini masih jauh dari kesempurnaan, tetapi
penulis berharap tulisan ini dapat memberikan warna baru dalam khasanah bidang
veteriner terutama penggunaan hormon. Di luar kekurangan yang ada, penulis
juga berharap tulisan ini dapat bermanfaat bagi semua pihak yang
membutuhkannya. Untuk itu penulis sangat berharap kritik dan saran yang
bersifat membangun demi kesempurnaan tulisan ini.
DAFTAR ISI
Manfaat Penelitian... 3
TINJAUAN PUSTAKA Hewan Coba... 4
Klasifikasi... 4
Biologi Reproduksi Tikus... 4
Fisiologi Kebuntingan... 5
Hormon reproduksi... 6
Fungsi estrogen pada masa kebuntingan... 6
Fungsi progesteron pada masa kebuntingan... 7
Plasenta... 7
Nutrisi embrio... 10
Nutrisi fetus... 12
Pertumbuhan embrio dan fetus... 13
Sirkulasi fetus... 16
Cairan amnion dan allantois... 16
Somatotropin Struktur dan biosintesis somatotropin... 18
Reseptor dan kerja somatotropin... 20
Efek somatotropin terhadap kadar glukosa... 22
Bovine Somatotropin (bST)... 24
MATERI DAN METODE Waktu dan Tempat Penelitian... 26
Bahan dan Alat... 26
Metode Penelitian... 26
Persiapan tikus percobaan... 26
Perlakuan... 27
Pengambilan darah... 27
Pengambilan cairan amnion... 27
Pengambilan dan penimbangan fetus... 27
Pengukuran kadar glukosa... 28
Analisis statistik……….. 28
Parameter yang diamati……….. 28
Diagram penelitian... 29
HASIL DAN PEMBAHASAN... 30
SARAN... . 34
DAFTAR PUSTAKA... 35
LAMPIRAN... 40
Halaman
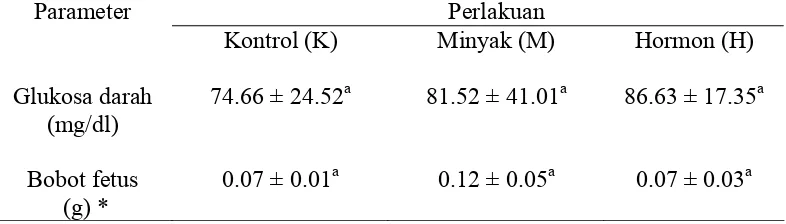
Tabel 1. Biologi reproduksi tikus putih... 5 Tabel 2. Sumber energi embrio tikus... 11 Tabel 3. Perkembangan dan pertumbuhan tikus pada masa embrional... 14 Tabel 4. Diferensiasi dan organogenesis tikus... 15 Tabel 5. Rataan kadar glukosa darah dan bobot fetus pada hari ke-13 30 Tabel 6. Rataan kadar glukosa darah, glukosa amnion, dan bobot
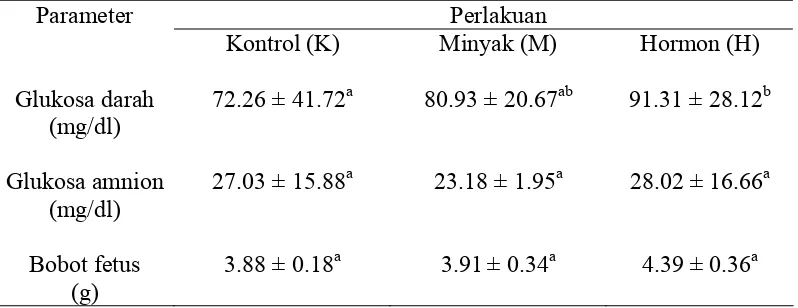
fetus pada hari ke-17... 31 Tabel 7. Rataan kadar glukosa darah, glukosa amnion, dan bobot
fetus pada hari ke-21... 31
Halaman
Gambar 1. Kontrol sekresi somatotropin... 19
Latar Belakang
Sektor peternakan merupakan sektor yang strategis, mengingat dalam
rangka mewujudkan ketahanan pangan dan mencerdaskan bangsa, sektor
peternakan berperan penting melalui penyediaan protein hewani, seperti daging,
susu, dan telur untuk makanan sehari-hari. Apabila bangsa Indonesia memenuhi
asupan kecukupan nilai gizi tinggi, maka akan memiliki sumberdaya manusia
sehat, cerdas, dan kuat.
Kenyataan yang terjadi saat ini, penyediaan protein hewani untuk
memenuhi kebutuhan masyarakat belum sepenuhnya terpenuhi karena
pertambahan penduduk yang lebih cepat dari peningkatan produksi pangan
terutama protein hewani. Meningkatnya kebutuhan konsumsi daging akibat
peningkatan taraf hidup, kenaikan tingkat pendidikan dan pengetahuan
menyebabkan perubahan pola konsumsi masyarakat ke arah yang lebih baik, tanpa
diimbangi oleh peningkatan populasi ternak.
Sebagai gambaran, kebutuhan konsumsi daging di Indonesia baru
terpenuhi 56% dari daging ayam, 23% terpenuhi dari daging sapi. Khusus untuk
memenuhi kebutuhan daging sapi, Indonesia masih mengimpor 50 ribu ton daging
dan 400 ribu ekor sapi setiap tahunnya dari negara lain dan yang diuntungkan
adalah peternak negara lain (Yudhoyono, 2006). Menurut Riady (2006) telah
terjadi peningkatan permintaan daging sapi, sejalan dengan peningkatan
pertumbuhan penduduk sebesar 1.45% yang tidak diiringi kelahiran ternak sapi
yang besarnya 20% per tahun, sehingga terdapat kekurangan pasokan dalam
negeri sebesar 28-29%. Selain itu populasi ternak khususnya ternak sapi menurun
rata-rata 0.98%, yaitu dari 11137 ribu ekor menjadi 10680 ekor, dalam kurun
waktu lima tahun (2001-2005).
Keberhasilan peningkatan populasi ternak sangat tergantung dari sistem
reproduksi ternak tersebut. Suatu usaha yang dapat meningkatkan kuantitas
hewan ternak dapat dilakukan melalui suatu penelitian dasar di bidang
fisiologi-reproduksi, terutama usaha pengembangan ternak politokus (ternak yang dapat
menghasilkan anak lebih dari satu dalam satu kali kebuntingan) sehingga usaha
Permasalahannya tidak hanya berhenti disini, jumlah anak yang banyak jelas
membutuhkan suplai nutrisi yang cukup dari induk. Nutrisi merupakan faktor
yang penting. Tanpa nutrisi yang baik dan dalam jumlah yang memadai, maka
pertumbuhan anak tidak akan optimal.
Selama kebuntingan, anak hewan harus mendapat nutrisi sebagai
penunjang pertumbuhan selanjutnya. Jika selama kebuntingan kurang mendapat
asupan nutrisi yang cukup, akan menjadi bakalan yang merugikan peternak,
sekalipun merupakan keturunan dari bibit unggul. Tingkat ketersediaan nutrisi
yang rendah dari induk dapat dikaitkan dengan kinerja tubuh yang tidak optimal
selama masa fetus. Apabila tubuh induk tidak mampu bekerja sebagaimana
mestinya maka anak yang banyak tidak akan bertahan hidup sehingga anak yang
lahir nanti jumlahnya sedikit.
Untuk mengatasi kecukupan nutrisi selama kebuntingan agar anak-anak
yang dilahirkan optimal, maka diperlukan suatu suplemen dari luar tubuh untuk
mengoptimalkan metabolisme induk sehingga kecukupan nutrisi untuk anak
terpenuhi. Salah satu suplemen yang mungkin bisa memperbaiki nutrisi induk
adalah hormon somatotropin. Kerja hormon somatotropin ini adalah
mempengaruhi metabolisme karbohidrat, lemak, dan protein dengan cara
memobilisasi pemecahan asam lemak dan menstimulus glukoneogenesis (Tortora
dan Anagnostakos, 1990). Adanya proses glukoneogenesis akan meningkatkan
glukosa yang beredar di dalam darah induk. Keadaan tersebut akan memperbaiki
asupan glukosa dari induk ke anak sehingga tampilan anak yang dilahirkan
menjadi lebih baik.
Melihat kondisi pertumbuhan ternak yang belum optimal, selanjutnya
mengamati pentingnya peranan somatotropin pada periode kebuntingan, dan
tersedianya hasil bioteknologi somatotropin, serta didukung oleh studi-studi
penelitian yang telah dilakukan pada berbagai objek dan metode penyuntikan
somatotropin selama ini, penelitian tentang pengaruh penyuntikan somatotropin
terhadap kadar glukosa darah dan cairan amnion menarik untuk dilakukan. Dari
berbagai hasil penelitian yang telah dipelajari, belum banyak data mengenai
pengaruh penggunaan somatotropin terhadap kadar glukosa darah dan cairan
Tujuan Penelitian
Penelitian ini dilakukan untuk melihat pengaruh pemberian somatotropin
terhadap kadar glukosa darah induk dan cairan amnion selama kebuntingan yang
dihubungkan dengan tampilan anak.
Manfaat Penelitian
Dari hasil penelitian ini tentu akan diperoleh tambahan informasi
mengenai aspek-aspek penggunaan soamtotropin pada hewan bunting serta
efeknya terhadap ketersediaan glukosa dalam darah dan cairan amnion yang
dihubungkan dengan tampilan anak.
Hewan Coba
Hewan model yang digunakan dalam penelitian ini adalah tikus putih yang
termasuk hewan bersifat politokus. Tikus putih sudah sejak lama digunakan
sebagai hewan laboratorium untuk kepentingan medis maupun penelitian karena
relatif lebih murah dan mudah dalam pemeliharaannya. Untuk penelitian dalam
bidang reproduksi, tikus adalah hewan yang tepat untuk digunakan karena
memiliki siklus reproduksi yang pendek, mudah berkembang biak dengan jumlah
keturunan yang cukup banyak (Harkness dan Wagner, 1983) dan daya adaptasi
yang sangat tinggi pada berbagai macam kondisi iklim dan lingkungan (Poole,
1989).
Klasifikasi
Klasifikasi tikus putih menurut Robinson (1979) :
Class : Mamalia
Reproduksi adalah proses perkembangbiakan suatu makhluk hidup yang
dimulai sejak bertemunya sel telur betina dengan sel sperma dari jantan, menjadi
makhluk hidup baru yang disebut zigot, yang disusul dengan kebuntingan dan
diakhiri dengan kelahiran anak (Hernawati, 2001). Tikus termasuk hewan yang
memperlihatkan gejala birahi lebih dari dua kali dalam setahun, dengan selang
birahi yang relatif pendek yaitu 4-5 hari. Data biologi reproduksi tikus disajikan
pada tabel 1.
Tabel 1. Data Biologi Reproduksi Tikus Putih
Lama bunting
Kawin sesudah beranak
Umur disapih
Umur dikawinkan / pubertas
Siklus kelamin
8-11 jam sesudah kawin
7-10 jam
2 kornua, bermuara sebelum serviks
3 betina 1 jantan
Sumber : (Smith dan Mangkoewidjaja, 1988)
Fisiologi Kebuntingan
Kebuntingan merupakan keadaan dimana fetus sedang berkembang di
dalam uterus seekor hewan betina (Frandson, 1992). Suatu interval waktu yang
disebut periode kebuntingan (gestasi), terentang dari saat proses fertilisasi
(pembuahan ovum) sampai lahirnya anak. Hal ini mencakup fertilisasi atau
persatuan antara ovum dan sperma, nidasi atau implantasi, perkembangan
membran fetus dan berlanjut ke pertumbuhan fetus (Mannan, 2002).
Periode kebuntingan sangat bervariasi dari satu spesies ke spesies lainnya,
begitu pula variasi antar individu dalam satu spesies tertentu. Saat terjadinya
fertilisasi, sperma harus berada di dalam saluran alat kelamin betina untuk jangka
waktu tertentu agar dapat membuahi ovum secara selektif. Ternak politokus
memiliki jarak-jarak yang jelas antara blastosis (embrio yang sedang berkembang)
refraktori di dalam endometrium yang menghambat terjadinya implantasi lain di
daerah yang sangat berdekatan (Mannan, 2002).
Pertumbuhan makhluk baru dari hasil pembuahan ovum oleh spermatozoa
setelah proses perkawinan berlalu mempunyai tiga periode, yaitu : periode ovum,
periode embrio, dan periode fetus. Roberts (1971) mengatakan bahwa periode
ovum dimulai pada saat terjadinya proses fertilisasi sampai saat terjadinya proses
implantasi, periode embrio dihitung mulai terjadinya proses implantasi sampai
saat terjadinya pembentukan alat-alat tubuh bagian dalam dan periode fetus
dihitung mulai dari setelah pembentukan alat-alat tubuh bagian dalam,
terbentuknya anggota gerak (extremitas) sampai fetus lahir.
Hormon reproduksi
Terjadinya kebuntingan pada hewan diawali dengan pembuahan sperma
terhadap sel telur dan diakhiri dengan kelahiran. Untuk menjaga kebuntingan,
tubuh melakukan persiapan-persiapan yaitu pembentukan plasenta, pertumbuhan
uterus, serta memproduksi hormon-hormon yang berperan dalam kebuntingan.
Diantara hormon yang berperan dalam kebuntingan adalah estrogen dan
progesteron. Pada saat hewan bunting estrogen dan progesteron diproduksi oleh
ovarium, plasenta (Guyton, 1994), dan korpus luteum (Garverick et al., 1992).
Fungsi estrogen pada masa kebuntingan
Pada hewan politokus seperti tikus estrogen akan menyebabkan
pertumbahan vaskularisasi pembuluh darah dan pertumbuhan endometrium yang
mengakibatkan adanya reaksi desidual di tempat terjadinya implantasi. Estrogen
menyebabkan peningkatan aliran darah secara tidak langsung, yaitu melalui
peningkatan prostaglandin yang dapat menyebabkan vasodilatasi pembuluh darah
pada miometrium maupun pada endometrium (Scharmm et al., 1984). Estrogen
mempengaruhi uterus untuk mempertahankan lingkungan yang cocok untuk
pertumbuhan dan perkembangan embrio dan fetus dengan meningkatkan
proliferasi sel-sel uterus.
Konsentrasi estrogen pada tikus bunting tidak berubah mulai hari ke-2
sampai akhir kebuntingan yaitu hari ke-22 (Taya dan Greenwald, 1981),
sementara itu Tuju (1996) melaporkan bahwa konsentrasi estrogen tidak berubah
dari hari ke-4 sampai dengan hari ke-12 kebuntingan dan selanjutnya akan
berangsur meningkat sampai akhir kebuntingan. Pada akhir kebuntingan estrogen
diperlukan dalam jumlah banyak untuk perkembangan kelenjar susu, pengendoran
ligament-ligament pelvis, memprakarsai tonus uterus, relaksasi serviks dan
mensensitifkan uterus terhadap oksitosin (Mannan, 2002).
Fungsi progesteron pada masa kebuntingan
Progesteron merupakan hormon steroid yang terdiri dari 21 atom karbon.
Konsentrasi progesteron meningkat setelah terjadinya ovulasi dan semakin
meningkat terutama setelah periode plasentasi (Manalu dan Sumaryadi, 1995).
Pada hewan bunting, progesteron meniadakan terjadinya ovulasi (Partodihardjo,
1992). Progesteron merangsang deferensiasi sel-sel endometrium dan
menyiapkan implantasi, bersamaan dengan ini terjadi penurunan proliferasi dan
penurunan reseptor estrogen (down regulation) (Okulicz dan Balsamo, 1993).
Selanjutnya progesteron berfungsi mencegah kontraksi uterus sehingga tidak
terjadi abortus (Putnam et al., 1975).
Tuju (1996) melaporkan konsentrasi progesteron pada tikus bunting tidak
mengalami perubahan dari umur kebuntingan ke-4 sampai dengan umur
kebuntingan ke-12 sedangkan Rodway dan Rothchild (1980) menyatakan bahwa
dalam serum tikus bunting konsentrasi progesteron mulai meningkat pada umur
kebuntingan ke-12. Peningkatan konsentrasi progesteron selama kebuntingan
dalam serum induk, terbukti meningkatkan pertumbuhan dan perkembangan
kelenjar susu selama kebuntingan (Tuju dan Manalu, 1995).
Plasenta
Plasenta merupakan suatu tenunan yang tumbuh dari embrio dan
induknya, dan terjalin saat proses pertumbuhan embrio yang memerlukan
kebutuhan penyaluran zat makanan dari induk ke anak dan sebaliknya, sisa
makanan anak dikeluarkan ke induk (Mannan, 2002). Menurut Guyton (1995)
darah fetus dan difusi hasil-hasil ekskresi dari fetus kembali masuk ke induk. Pada
awal kebuntingan, permeabilitas plasenta relatif kecil, karena tebal membran vili
belum berkurang ke ketebalan minimum. Akan tetapi ketika plasenta bertambah
tua, permeabilitasnya meningkat secara progresif sampai akhir kebuntingan.
Jaringan luar tropoblas mengalami perubahan morfologi menjadi amnion,
allantois, khorion, dan kantong kuning telur (Yolk sac). Mc. Donald (1980)
melaporkan bahwa dengan meningkatnya ukuran embrio, proses difusi zat
makanan menjadi tidak cukup untuk mempertahankan hidup dan meneruskan
pertumbuhannya. Membran ekstra embrional berkembang sebagai sarana untuk
mencukupi kebutuhan meningkatnya nutrisi yang lebih banyak. Proses ini disebut
plasentasi. Amnion adalah lapisan yang menyelubungi fetus pada bagian dalam.
Allantois adalah lapisan yang terdapat di antara amnion dan khorion. Khorion
adalah lapisan yang menyelubungi fetus di bagian luar. Menurut Frandson (1992)
plasenta terdiri dari susunan membran sedemikian rupa yang berisikan selaput
khorion, allantois, amnion, dan kuning-kuning telur vestigal.
Lapisan sel allantois pada bagian dalam menjadi satu atau berhimpitan
dengan sel – sel membran khorion. Arteri dan vena yang datang dari plasenta ke
tubuh embrio terdapat pada lapisan membran allantois dan khorion. Ruang yang
terbentuk karena pembentukan gelembung amnion berisi cairan yang
konsentrasinya amat kental dan disebut cairan amnion. Cairan amnion berfungsi
untuk mengatur tekanan dalam pertumbuhan embrio dan mengurangi goncangan
dari luar serta tempat menampung zat buangan embrio melalui urethra.
Sedangkan ruang yang terbentuk karena gelembung allantois berisi cairan
allantois. Kantong allantois mempunyai fungsi sebagai tempat pembuangan urin
melalui urachus. Urachus adalah suatu saluran urin yang menghubungkan
kantong urin dan kantong allantois melalui tali pusar (Mannan, 2002).
Kantong kuning telur (yolk sac) tumbuh pada awal pertumbuhan embrio,
dan terhenti saat setelah amnion dan allantois terbentuk sempurna. Lapis luar
tropoblas tumbuh menjalar menyelimuti seluruh permukaan endometrium.
Penjalaran tropoblas masing-masing hewan bervariasi sesuai dengan bentuk dan
berhubungan dengan epitel karankula segera melarutkan sel-sel epitel vili
tropoblas (Mannan, 2002).
Difusi oksigen melalui membran plasenta hampir mirip dengan difusi
oksigen melalui membran paru. Oksigen yang terlarut di dalam darah yang
terdapat dalam sinus-sinus plasenta yang lebar mudah melalui membran vili
masuk ke dalam darah fetus karena selisih tekanan oksigen dari darah induk
dengan darah fetus. Pada pO2 yang rendah, hemoglobin fetal dapat membawa 20
sampai 30 persen oksigen lebih banyak dari pada yang dapat dibawa oleh
hemoglobin induk. Selain itu konsentrasi hemoglobin fetus sekitar 50 persen
lebih besar daripada konsentrasi hemoglobin induk. Hal ini merupakan faktor
yang lebih penting dalam memperbesar jumlah oksigen yang ditranspor ke
jaringan fetus (Guyton, 1995).
Melalui membran plasenta, karbon dioksida secara terus menerus dibentuk
dalam jaringan-jaringan fetus dengan cara yang sama seperti pembentukan karbon
dioksida dalam jaringan-jaringan induk. Satu-satunya cara untuk
mengekskresikan CO2 adalah melalui plasenta. pCO2 yang terkumpul dalam
darah fetus sedikit lebih besar dibandingkan pCO2 darah induk. Selisih tekanan
yang rendah ini memungkinkan difusi CO2 yang cukup dari darah fetus ke dalam
darah induk, karena kelarutan CO2 yang ekstrem dalam air membran plasenta
sehingga memungkinkan CO2 berdifusi melalui membran itu dengan cepat, sekitar
20 kali kecepatan membran O2 (Guyton, 1995).
Zat-zat metabolik lain yang dibutuhkan oleh fetus berdifusi ke dalam
darah fetus dengan cara yang sama seperti oksigen. Zat makanan seperti glukosa
memiliki tingkat konsentrasi dalam darah fetus sekitar 20 sampai 30 persen lebih
rendah dibandingkan dengan kadar glukosa darah induk, karena glukosa
dimetabolisme dengan cepat oleh fetus. Hal ini selanjutnya menyebabkan difusi
glukosa lebih banyak dari darah induk ke darah fetus. Transport glukosa dari
induk ke fetus tidak diperlukan energi, transport ini disebut transport fasilitatif.
Transport fasilitatif memerlukan keberadaan zat pembawa (carrier) untuk
mengangkut zat-zat melalui plasenta (Stefani, 2007). Zat-zat seperti ion kalium,
natrium, dan klorida juga berdifusi dari darah induk ke dalam darah fetus
Sel-sel yang melapisi permukaan luar vili memungkinkan absorbsi secara
aktif zat-zat gizi tertentu dari darah induk selama kebuntingan. Misalnya,
kandungan asam amino, kalsium, dan fosfat inorganik memiliki konsentrasi lebih
besar di darah fetus dibandingkan dengan darah induk. Efek ini menunjukan
bahwa membran plasenta mempunyai kemampuan mengabsorbsi secara aktif
(Guyton, 1995).
Ekskresi melalui membran plasenta memiliki kemiripan dengan difusi
karbon dioksida dari darah fetus ke darah induk, hasil-hasil ekskresi lain yang
dibentuk dalam fetus berdifusi ke dalam darah induk dan kemudian diekskresikan
lagi bersama dengan produk sekresi dari induk. Produk-produk sampah dapat
berupa urea, asam urat, dan kreatinin. Kadar urea dalam darah fetus hanya
sedikit lebih tinggi dibandingkan dengan kadar urea dalam darah induk karena
urea berdifusi dengan sangat mudah melalui membran plasenta (Guyton, 1995).
Nutrisi embrio
Pembuahan sperma terhadap sel telur menghasilkan zigot. Dalam
perkembangannya zigot membutuhkan nutrisi sebagai sumber energi agar mampu
melakukan serangkaian pembelahan. Pada awal pembelahan, embrio bisa
memakai piruvat, tetapi tidak bisa memakai laktat (Takahashi et al., 1992).
Glukosa dibutuhkan oleh embrio setelah tahap 4-8 sel dan kebutuhan glukosa
tergantung stadium serta bervariasi pada spesies hewan (Tabel 2) (Austin and
Short, 1985 ; Gardner et al., 1993). Rendahnya pemakaian glukosa pada awal
perkembangan dimaksudkan untuk mengatasi hambatan perkembangan sehingga
tidak akan mengganggu proses glikolisis (Gardner et al., 1993). Pada embrio sapi
kebutuhan glukosa rendah dan tetap rendah selama stadium pembelahan,
kemudian pemakaian glukosa meningkat memasuki tahap 8 sel. Hal ini
berhubungan dengan waktu aktivitas dari genom embrio (Matsuyama et al.,
1993). Pola yang sama terjadi pada embrio domba serta spesies lain (Thompson
et al., 1992 ; Kim et al., 1993b).
Tingkat Pembelahan
Substrat Oosit 1-sel 2-sel 8-sel
Piruvat + + + +
Oxaloacetat + + + +
Fosfoenolpirufat - - + +
Laktat - - + +
Glukosa - - - +
Sumber : (Austin and Short, 1985)
Menurut Flood dan Wielbold (1988) pemakaian glukosa meningkat mulai
morula kompak. Hal ini berhubungan dengan pembentukan tropoblas pada saat
diferensiasi yaitu dibutuhkan energi tinggi sehingga metabolisme glukosa
meningkat (Hewitson et al., 1996). Selain itu meningkatnya metabolisme glukosa
pada tahap morula kompak disebabkan karena pada tahap ini kebutuhan energi
dan bahan-bahan lain hasil metabolisme glukosa lebih banyak dipergunakan untuk
proses kompaksi (Leese et al., 1993). Hal yang berbeda terjadi pada embrio
domba, glukosa bukan merupakan sumber energi utama pada saat diferensiasi sel
karena energi yang dihasilkan untuk metabolisme sel bisa berasal dari asam amino
(Thompson et al., 1992).
Glukosa berperan penting pada pertumbuhan blastosis dan proses hatcing
yang ditunjukan dengan peningkatan pemakaian glukosa dan metabolisme (Brison
dan Leese, 1994 ; Matsuyama et al., 1993). Adanya glukosa akan memperbaiki
tingkat perkembangan normal embrio dan merangsang proses blastulasi
berikutnya. Menurut Brison et al., (1994) peran glukosa pada tahap blastosis
sangat penting, karena glukosa sebagai energi substrat diperlukan untuk
pembentukan blastosul dan proses hacting. Peningkatan pemakaian glukosa
menyebabkan perubahan sistem metabolisme dari metabolisme dasar piruvat ke
metabolisme dasar glukosa. Selain itu perubahan metabolisme ini juga diketahui
akibat adanya kontrol instrinsik dan kontrol ekstrinsik. Kontrol instrinsik embrio
berhubungan dengan aktivitas enzim mediator intraselluler dan sistem transport
membran plasma. Sedangkan kontrol ekstrinsik berhubungan dengan diferensiasi
dan persiapan implantasi (Leese, 1995). Selain dibutuhkan sebagai sumber
energi, glukosa dapat menghambat proses perkembangan embrio terutama pada
yang menekan proses fosforilisasi oksidasi dan respirasi di mitokondria, akibatnya
akan menghambat petumbuhan embrionik (Seshagrirl et al., 1991).
Nutrisi fetus
Sebagian energi dibutuhkan untuk pertumbuhan dan metabolisme berasal
dari glukosa, seperempat bagian berasal dari laktat yang dibentuk dari glukosa di
dalam plasenta, dan seperempat sisanya berasal dari asam amino. Fetus tidak
mensintesis glukosa dari lemak atau protein (glukoneogenesis). Proses
glukoneogenesis akan terjadi dengan segera setelah kelahiran ketika pO2 naik
(Austin and Short, 1985). Sebagai tambahan untuk energi, fetus harus
mempunyai persediaan bahan-bahan yang dibutuhkan untuk membangun organ
tetapi tidak dapat disintesis. Bahan-bahan tersebut misalnya, asam amino
esensial, asam lemak esensial, vitamin, mineral, dan trace elemen. Banyak dari
zat-zat ini ditransfer secara selektif dari induk ke anak melalui mekanisme
pengangkutan aktif yang melindungi kebutuhan fetus (Austin and Short, 1985).
Nutrisi terutama glukosa disirkulasikan menuju fetus melalui aliran darah
induk. Dalam jumlah yang sedikit glukosa berasal dari makanan yang dikonsumsi
oleh induk, berasal dari glikogen hati, berasal dari depot lemak dan berasal dari
pemecahan protein. Jumlah glukosa yang tersedia untuk fetus tergantung dari
besarnya konsentrasi glukosa yang dibawa melalui aliran darah induk.
Konsentrasi glukosa ini dipertahankan dengan menyertakan banyak organ
endokrin. Selanjutnya tingkat glukosa induk ditentukan oleh absorbsi glukosa di
usus dan kerja hormon kortikosteroid, katekolamin, glukagon dan somatotropin
dengan meningkatkan proses glukoneogenesis. Selain itu peningkatan konsentrasi
glukosa di atas level normal dicegah oleh insulin dengan meningkatkan
penyimpanan glukosa di otot dalam bentuk glikogen atau lemak. Hormon
kebuntingan tertentu lebih lanjut mengontrol glukosa induk dalam meningkatkan
ketersediaan glukosa untuk fetus (Austin and Short, 1985).
Sebagian besar periode kebuntingan disertai dengan peningkatan bobot
badan karena terjadi peningkatan penyimpanan lemak di subkutan. Ini merupakan
efek dari hormon progesteron. Kemudian ketika kebutuhan metabolik dari fetus
digunakan untuk memelihara suplai glukosa ke fetus. Pada primata terdapat
hormon tambahan yang disekresikan dalam jumlah yang besar ke dalam sirkulasi
induk untuk membantu proses kebuntingan yang dikenal dengan nama plasenta
laktogen. Plasenta laktogen memiliki aktivitas biologis yang rendah, tetapi
bersama somatotropin ia mampu meningkatkan kadar glukosa darah. Kadar
glukosa yang mencapai plasenta ditentukan oleh konsentrasi dan volume darah
yang melewati plasenta. Jika konsentrasi glukosa atau volume darah yang
melewati plasenta kecil maka akan memperlambat pertumbuhan fetus (Austin and
Short, 1985).
Pertumbuhan embrio dan fetus
Fertilisasi adalah peristiwa bertemunya spermatozoa dan ovum di bagian
bawah ampula tuba Fallopii. Sebelum terjadi fertilisasi, spermatozoa mengalami
tahap seleksi dan komposisi dengan spermatozoa yang lain. Dari jutaan
spematozoa yang diejakulasikan, tidak lebih dari 1000 spermatozoa yang
mencapai ampula tuba Fallopii. Beberapa spermatozoa mencapai tempat
fertilisasi dalam waktu yang lebih singkat, kira-kia 15 menit setelah perkawinan.
Spermatozoa yang berhasil melalui vagina dan uterus dengan baik akan
mengalami reaksi akrosom pada membran plasmanya kemudian menembus massa
kumulus, zona pellusida, dan membran vitelin ovum (Toelihere, 1985). Proses
selanjutnya adalah fase cleavage, yaitu pembelahan sel tanpa pertumbuhan,
selanjutnya terjadi transport konseptus ke uterus, dan dilanjutkan dengan proses
implantasi. Pada tikus, implantasi terjadi pada hari ke-6 kebuntingan (Whimstatt,
1975).
Pembelahan zigot dari 1 sel menjadi 2 sel, 2 sel menjadi 4 sel, 8 sel,
hingga 16 sel berlangsung tanpa terjadi perubahan pada zigot. Selama fase
cleavage sampai munculnya blastoecele, sel-sel embrional disebut blastomer.
Pada tingkatan 16 sampai 32 sel, sel-sel berkumpul menjadi satu kelompok
membentuk blastomer yang kemudian disebut morula. Kemudian morula
berubah menjadi blastula (Tabel 3). Proses pembentukan blastula disebut
suatu rongga berisi cairan yang disbut blastocoele, sedangkan pada morula tidak
terdapat blastoecoele (Sukra et al., 1989).
Pada hewan politokus, blastosis tersebar di kedua tanduk rahim. Sebaran
blastosis bisa sedemikian rupa sehingga masing-masing tanduk rahim berisi
embrio sama banyak. Letak implantasi ditentukan oleh hubungan antara blastosis
terhadap rahim, bukan oleh faktor gaya berat. Blastosis yang masuk ke dalam
rahim tidak selalu langsung mengadakan implantasi. Dengan demikian blastosis
mengalami hidup bebas sebelum implantasi. Jangka hidup bebas pada tikus 2 hari
(Partodihardjo dan Manggung, 1978).
Tabel 3. Data perkembangan dan Pertumbuhan Tikus pada Masa Embrional
Fase sel Waktu kejadian setelah pembuahan (jam)
1 sel 0-29
2 sel 23-52
3-4 sel 42-59
5-8 sel 49-60
Morulla 68-77
Blastosis 74-82
Sumber : Whitten dan Dagg (1961)
Setelah mencapai tahap blastosis, proses selanjutnya adalah implantasi.
Implantasi merupakan proses bersarangnya blastosis di dalam selaput lendir rahim
sehingga terjadi hubungan erat antara selaput ekstra embrional dan selaput lendir
rahim. Ketika zigot berkembang dan menuju rahim, korona radiata dan zona
pelusida musnah, dengan demikian blastosis lebih leluasa berhubungan dengan
rahim. Sinkronisasi antara blastosis dan kesiapan endometrium merupakan faktor
penting kesempurnaan implantasi (Hafez, 1967). Proses selanjutnya adalah
Tabel 4. Data Diferensiasi dan Organogenesis Tikus
Hari
Kebuntingan
Ciri - ciri
6 Implantasi elastosis dengan tropoblas dan inner cell mass
delaminasi endoderm.
7 Vili khorionik sederhana dan tidak bercabang ;
pembentukan cakram benih embrional ; diferensiasi
bagian-bagian embrional dan extra embrional.
8 Diferensiasi tropoblas secara cepat ; terlihat garis, legokan
dan kancing primitif ; awal pembentukan mesoderm ;
pemanjangan sepalo kaudal embrio ; pembentukan sumbu
longitudinal embrio.
9 Pembentukan somit ossipital ; tampak dataran neural dari
ektodermal dan awal pembentukan lipatan neural.
10 – 10.5 Penutupan parsial saluran neural, otak, primer terbentuk
somit servikalis dan torasik bagian atas muncul dua arkus
visceralis jelas ; pembentukan jantung, mata, dan telinga
primordial ; diferensiasi endoderm menjadi saluran
pencernaan bagian depan, tengah, belakang. Bakal hati
terdapat di bawah jantung.
11 – 11.5 Pembentukan somit torakis bagian bawah dan lumbal,
empat arkus visceralis, pucuk ekor dan pucuk kaki depan ;
tubulus mesonefrik mulai berkembang ; pembentukan
fleksura sepalika dan kaudal embrio berbentuk C ;
lambung, saluran empedu, dan kantong empedu jelas.
12 – 12.5 Pembentukan otak sekunder, somit sakral, kaudal atas,
mandibular, maxilar, dan frontonasal ; diferensiasi kaki
depan dan kaki belakang ; pembentukan telinga bagian
dalam.
13 -13.5 Kaudal bersomit ; proses pembentukan kaki depan dan kaki
belakang, wajah, dan celah utama.
jelas ; pembentulan pinna ; prekartilago di mandibula, mata
berpindah ke anterior.
15 – 15.5 Kaudal bersomit ; celah di bagian wajah tertutup, diafragma
jelas, mata berada di anterior wajah.
16 Kaudal bersomit terakhir; bagian kepala terangkat dari dada
; ossifikasi dari skeleton mulai terbentuk.
Sumber : (Hafez, 1970)
Sirkulasi fetus
Aliran darah fetus melalui dua arteri umbilikalis akhirnya ke
kapiler-kapiler vili, dan kemudian kembali melalui vena umbilikalis ke fetus. Sebaliknya,
aliran darah induk dari arteri uterina masuk ke dalam sinus-sinus darah besar di
sekitar vili dan kemudian kembali masuk ke dalam vena uterina induk. Paru-paru
tidak berfungsi terutama selama kehidupan fetal, sehingga jantung fetus tidak
memompa banyak darah melalui paru. Sebaliknya, jantung fetus harus memompa
darah dalam jumlah besar melalui plasenta. Sebagian besar darah yang masuk ke
atrium kanan dari vena kava inferior langsung berjalan lurus melalui permukaan
posterior atrium kanan dan kemudian melalui foramen ovale langsung masuk ke
dalam atrium kiri. Jadi, darah yang dioksigenasi baik dari plasenta masuk ke sisi
kiri jantung bukan ke sisi kanan jantung dan dipompa oleh ventrikel kiri terutama
ke dalam pembuluh darah kepala dan anggota gerak bawah. Darah yang masuk
atrium kanan dari vena kava superior langsung berjalan turun melalui katub
trikuspidalis masuk ke dalam ventrikel kanan. Darah ini terutama darah
deoksigenasi dari daerah kepala fetus, dan dipompa oleh ventrikel kanan masuk
ke dalam arteri pulmonalis, kemudian melalui duktus arteriosus masuk ke dalam
aorta descenden dan melalui arteri umbilikalis masuk ke plasenta, tempat darah
deoksigenasi mengalami oksigenasi (Guyton, 1995).
Cairan amnion dan allantois
Selaput ekstra embrional atau selaput fetal berkembang dan berfungsi pada
beberapa saat sesudahnya. Selaput tersebut terdiri dari kantong kuning telur,
kantong amnion, allantois, dan khorion (Partodihardjo dan Manggung, 1978).
Perubahan volume uterus pada saat permulaan terjadinya kebuntingan,
sebagian besar disebabkan oleh pertambahan cairan amnion dan allantois. Pada
waktu pertengahan dari masa kebuntingan, pertambahan volume menjadi hampir
sama dengan pertambahan volume fetus. Cairan amnion pada periode
perkembangan fetus bersifat jernih, tidak berwarna dan mukoid. Pada sapi
volumenya dapat mencapai 2000-8000 ml dan rata-rata berkisar 5000-6000 ml.
Cairan amnion mengandung pepsin, protein, fruktosa, lemak, dan garam serta
bersifat bakterisidal dan adhesia. Sumber cairan amnion pada permulaan sampai
pertengahan kebuntingan adalah epitel amnion dan urin fetus. Pada kebuntingan
lebih lanjut sumber cairan amnion adalah air liur dan sekresi nasopharinks fetus
(Mannan, 2002).
Menurut Partodihardjo dan Manggung (1978) cairan amnion berfungsi
untuk : (1) mencegah embrio menjadi kering, embrio berkembang di dalam
lingkungan cairan (kolam renang pribadi embrio), (2) mencegah perlekatan
embrio dengan selaput ekstra embrional lainnya. Otot pada dinding amnion
berkontraksi sehingga secara tidak langsung menggoyang-goyang embrio, (3)
meniadakan goncangan. Pada sapi allantois timbul pada minggu kedua dan ketiga
kebuntingan sebagai suatu kantong luar usus belakang. Terdiri dari endoderm
yang ditutupi oleh suatu selaput vaskuler mesoderm splanchono-pleurik. Lapisan
luar allantois kaya pembuluh darah yang berhubungan dengan aorta fetus, melalui
arteri umbilikalis.
Kantong allantois menyimpan sisa-sisa bahan dari ginjal fetus yang
memasukinya dari vesika urinaria melalui korda umbilikalis dengan perantaraan
urethra. Cairan ini jernih seperti air dan berwarna kabur mengandung albumin,
fruktosa dan urea. Pada sapi menjelang akhir kebuntingan volume cairan allantois
berkisar antara 4000-15500 ml dan rata-rata 9500 ml, selanjutnya volume cairan
amnion dan allantois mempunyai volume sesuai dengan umur kebuntingan
(Mannan, 2002).
Chorioallantois, terbentuk karena fusi lapisan luar allantois vaskuler
menghubungkan fetus dengan endometrium uterus induk secara intim, diciptakan
untuk mengangkut pertukaran metabolik zat-zat makanan, gas, dan bahan sisa
antara sirkulasi fetal dan maternal. Chorioallantois adalah plasenta fetal.
Walaupun cairan, dan gas dapat menembus korion ke sirkulasi maternal dan fetal
benda-benda padat dan kebanyakan bakteri secara normal tidak dapat melewati
korion kecuali penyakit pada korion memudahkan penetrasinya. Beberapa
bakteri, virus, dan larva parasit tertentu dapat melewati plasenta yang utuh
(Mannan, 2002).
Somatotropin
Struktur dan biosintesis somatotropin
Somatotropin (growth hormon) adalah hormon polipeptida yang berantai
tunggal dan disekresikan oleh sel-sel somatotrof hipifise anterior (Coschigano et
al., 2003). Diketahui paling tidak ada tiga macam bentuk somatotropin yang
dikenal selama ini. Bentuk yang pertama mempunyai 191 asam amino dengan
bobot molekul 22 kDa dan bentuk ini yang paling banyak ditemukan dalam
kelenjar hipofise. Bentuk ini mengandung dua macam jembatan sulfida dalam
molekul somatotropin, molekul yang satu menghubungkan asam amino (asam
amino 53 dan 165 pada manusia) yang membentuk suatu lengkung besar dan yang
lain terletak di dekat terminal atau ujung karboksil dari peptida (asam amino 182
dan 189) membentuk suatu lengkungan yang kecil. Bentuk hormon yang kedua
mempunyai urutan asam amino yang sama seperti yang pertama, kecuali
hilangnya 15 asam amino (nomor 32-460 dari terminus asam molekul tersebut).
Bentuk ini mempunyai bobot molekul 20 kDa dan menempati sekitar 10-15% dari
hormon yang ada di hipofise. Bentuk yang ketiga dibentuk dari dimerisasi 2
bentuk peptida 22 kDa yang dihubungkan dengan ikatan disulfida antar rantai dan
mempunyai bobot molekul 45 kDa dan menempati 1% dari jumlah hormon
hipofise. Perbedaan struktur somatotropin ini menyebabkan perbedaan dalam
fungsi biologis. Somatotropin dengan berat molekul 20 kDa mempunyai ikatan
yang kurang efektif dibandingkan dengan bentuk 22 kDa terhadap reseptor hati,
Produksi dari somatotropin dipengaruhi oleh banyak faktor, termasuk di
dalamnya stress, olah raga, nutrisi, tidur, hipoglisemia, estradiol, arginin dan
somatotropin itu sendiri. Kontrol utama sekresi somatotropin adalah dua hormon
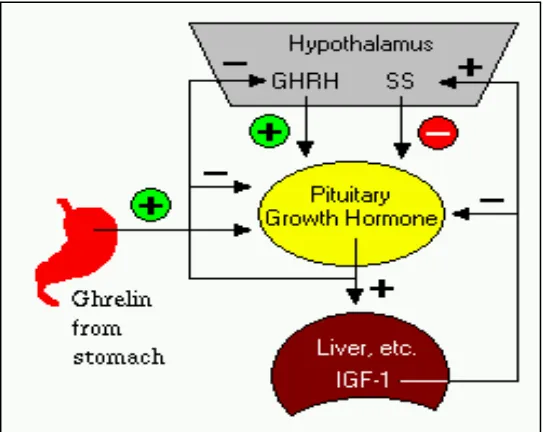
hipothalamus, yaitu growth hormone-releasing hormone (somatokrinin) dan
somatostatin. Selain itu hormon lambung (Ghrelin) juga ikut berperan dalam
pengaturan sekresi somatotropin (Gambar 1).
Gambar 1. Kontrol Sekresi Somatotropin
Sumber : (Cummings dan Merriam, 2003)
Growth hormone-releasing hormone (GHRH) berfungsi menstimulasi
sekresi dari somatotropin, sedangkan somatostatin menghambat pelepasan
somatotropin dari hipofise. Ghrelin merupakan hormon peptida yang disekresikan
dari lambung. Ghrelin mengikat reseptor somatotroph dan menstimulasi
pengeluaran somatotropin (Hartman, 2000). Sekresi somatotropin juga
dipengaruhi oleh umpan balik negatif yang menyertakan 1. Konsentrasi
IGF-1 yang tinggi dalam darah akan mengurangi produksi somatotropin dengan
merangsang produksi somatostatin. Somatotropin juga bersifat negatif feed back
terhadap GHRH dengan menghambat kerja dari sel-sel somatotroph dan sekresi
Reseptor dan kerja somatotropin
Reseptor somatotropin berada di permukaan sel. Pada prinsipnya, ikatan
antara somatotropin dengan reseptornya mengakibatkan aktivasi enzim seperti
fosforilasi yang dilakukan oleh enzim kinase dengan cara memindahkan atau
menambahkan gugus fosfat. Hal ini mengakibatkan reaksi intra sel sehingga
berpengaruh pada metabolisme dan fungsi sel (Granner, 2003).
Somatotropin beredar dalam aliran darah diikat oleh suatu growth hormon
binding protein (GHBP). Fungsi GHBP ini masih belum jelas tetapi ada yang
berpendapat bahwa GHBP ini meningkatkan waktu paruh somatotropin,
memodifikasi distribusinya, mengurangi efek biologis dari pulsatil sekresi
somatotropin dengan mengurangi somatotropin bebas selama pulsa sekretori.
Somatotropin bekerja di permukaan membran sel karena merupakan
molekul peptida dengan reseptornya yang disebut growth hormon reseptor
(GHR). Ada dua macam reseptor somatotropin yang berafinitas tinggi dan
rendah, namun yang berafinitas tinggi sangat penting karena dikaitkan dengan
pertumbuhan. Reseptor somatotropin berupa glikoprotein berantai tunggal yang
mempunyai 620 asam amino dengan domain ekstra seluler yang luas (246 residu)
asam amino, domain transmembran tunggal (24 residu) dan domain sitoplasmik
yang panjang (350 residu). Bagian ekstra seluler terdiri atas hormne binding side,
yaitu suatu daerah yang penting untuk dimerisasi reseptor (Sodhi dan Rajput,
2001).
Selain somatotropin, ada istilah somatomedin yang ditujukan untuk
mencerminkan kamampuan suatu unsur memperantarai pengaruh somatotropin.
Somatomedin terdiri atas beberapa subtipe, salah satunya adalah somatomedin C.
Istilah ini berganti dan didalilkan menjadi IGF-1 (insulin-like growth factor-1)
dan IGF-II (insulin-like growth factor-1I). Kedua unsur tersebut dimasukan ke
dalam golongan seperti insulin karena kemampuannya untuk merangsang
pengambilan glukosa ke dalam otot dan lemak. Di dalam serum sebagian besar
IGF adalah kompleks molekul berbobot 150 kDa yang mencakup IGFBP-3
(insulin-like growth factor binding protein-3) dan ALS (acid labile subunit)
(Yakar et al., 2002). Somatomedin C dan IGF-1 adalah dua penamaan untuk
somatomedin menjadi IGF menyusul purifikasi dua polipeptida yang sama untuk
somatomedin A dan C dengan non-suppressible insulin-like activity (NLISA) dan
aktivitasnya yang mempromosikan pertumbuhan dari serum manusia (Kamil et
al., 2001).
Aktivitas biologis IGF bergantung pada reseptor IGF yang spesifik yang
ada pada sel target. Reseptor tipe I merupakan suatu glikoprotein dengan bobot
molekul antara 300-350 kDa. Reseptor ini terdiri atas dua subunit ekstraselluler
dengan bobot molekul 130 kDa dan dua subunit B transmembran dengan bobot
molekul 95 kDa. Reseptor IGF ini baik dalam struktur atau fungsinya sejenis
dengan reseptor insulin. Kapasitas dan avinitas reseptor IGF-I berubah selama
perkembangan. Reseptor ini sudah tampak pada fetus dan tetap tinggi selama
pasca melahirkan dan kemudian menurun ketika menuju ke tingkat dewasa.
Reseptor tipe II berupa polipeptida berantai tunggal dengan bobot molekul 250
kDa, juga disebut reseptor manosa-6-fosfat. Tipe ini secara struktural tidak
berkaitan dengan reseptor IGF-I atau insulin (Hartman, 2000).
IGF-I berperan dalam pengaturan metabolisme, pertumbuhan, dan
diferensiasi sel mamalia. Sintesis dan konsentrasi IGF-I di dalam plasma sangat
dipengaruhi oleh somatotropin. IGF-I dalam darah sekitar 55 % diproduksi oleh
hati, sehingga hati dianggap sebagai tempat utama produksi IGF-I. Penyuntikan
somatotropin akan meningkatkan konsentrasi IGF-I di dalam darah (Vesteergaard
et al., 2003). Peningkatan level reseptor somatotropin berkaitan dengan
peningkatan konsentrasi IGF-I dalam plasma (Shen at al., 2002).
Somatotropin memiliki dua efek dasar, yang pertama adalah berkaitan
dengan proses produksi, dimana ia memiliki peranan sebagai penengah IGF-1
tetapi tidak bekerja sendiri, dan yang kedua adalah berperan pada ketersediaan
nutrisi dimana sebagai penengahnya adalah somatotropin itu sendiri. Sifat dan
kepentingan dari efeknya tergantung dari keadaan fisiologi dari hewan. Sebagai
contoh : penyuntikan somatotropin pada hewan yang sedang tumbuh dapat
meningkatkan jumlah protein otot sedangkan pada hewan yang sedang laktasi
menyebabkan kehilangan protein tubuh. Efek perlakuan somatotropin juga
berpengaruh pada status nutrisi dari hewan. Sebagai contoh : jika disuntikan pada
lipogenesis pada jaringan lemak (tidak meningkatkan lipolisis), tetapi jika
keseimbangan energinya negatif maka akan meningkatkan lipolisis (Boyd dan
Bauman, 1988).
Somatotropin memiliki fungsi yang penting terhadap metabolisme protein,
lipid, dan karbohidrat. Pada umumnya somatotropin menstimulasi anabolisme
protein di banyak jaringan. Efek ini mencerminkan bahwa terjadi peningkatan
pengikatan asam amino, peningkatan sintesis protein, pengurangan oksidasi
protein. Somatotropin meningkatkan pemanfaatan lemak dengan menstimulasi
penguraian trigliserida dan oksidasi dalam jaringan adiposa (Cummings dan
Merriam, 2003).
Pengaruh somatotropin terhadap kadar glukosa
Glukosa merupakan bentuk karbohidrat (monosakarida) yang terdapat
dalam makanan yang diserap dalam jumlah besar ke darah dan diubah menjadi
simpanan, yaitu glikogen di dalam hati dan otot rangka sebagai sumber energi
yang utama bagi jaringan tubuh hewan. Pada kondisi kelebihan glukosa, akan
dirombak menjadi glikogen, disimpan di otot rangka dan di hati. Pada kondisi
kekurangan glukosa, glikogen yang berada di hati akan dirombak menjadi glukosa
kembali.
Penguraian karbohidrat dalam proses pencernaan dimulai dari mulut
dengan enzim amilase yang menghidrolisis polisakarida menghasilkan
monosakarida dan disakarida (Tortora dan Anagnostakos, 1990). Bila proses
pencernaan dan penyerapan karbohidrat meningkat maka kadar glukosa dalam
darah akan meningkat, begitu juga dengan sintesis glikogen dari glukosa oleh hati.
Sebaliknya bila kadar glukosa turun, glikogen diuraikan menjadi glukosa untuk
dikatabolisme menjadi energi (Wirahadikusumah, 1985).
Makanan yang mengandung karbohidrat tinggi akan meningkatkan kadar
glukosa darah secara cepat. Menurut Champe dan Harvey (1994) bahwa salah
satu indikator klinis dari kurangnya asupan makanan sebagai sumber energi
adalah rendahnya kadar glukosa darah, dimana pada kondisi cukup asupan
digunakan untuk metabolisme. Guna menjaga keseimbangan metabolisme, maka
kadar glukosa normal harus dipertahankan (Williams, 1995).
Menurut Ganong (1995), faktor yang menentukan kadar glukosa darah
adalah keseimbangan antara jumlah glukosa yang masuk dan glukosa yang
meninggalkan aliran darah, ditentukan oleh masuknya diet, kecepatan masuk
dalam sel otot, jaringan lemak dan organ lain serta aktivitas sintesis glikogen dari
glukosa oleh hati. Masuknya glukosa ke dalam darah akan meningkatkan kadar
glukosa darah dan insulin disekresikan dari pankreas serta menurunnya sekresi
glukagon (Linder, 1992). Selanjutnya Guyton (1995) mengatakan somatotropin
yang diberikan pada hewan pertama kali akan meningkatkan ambilan glukosa oleh
sel dan konsentrasi glukosa darah sedikit menurun. Akan tetapi, bila sel menjadi
jenuh oleh glikogen dan penggunaan glukosa untuk energi berkurang, ambilan
glukosa menjadi sangat berkurang. Tanpa ambilan sel yang normal, konsentrasi
glukosa darah meningkat, kadang-kadang mencapai 50 % sampai 100 % di atas
normal.
Menurut Tortora dan Anagnostakos (1990) somatotropin mempengaruhi
metabolisme karbohidrat, lemak, dan protein dengan cara memobilisasi
pemecahan asam lemak dan menstimulus glukoneogenesis. Penyuntikan
somatotropin umumnya melawan efek insulin sehingga terjadi peningkatan
produksi glukosa di hati melalui proses glukoneogenesis. Akibatnya pemberian
somatotropin dalam waktu yang panjang akan mengakibatkan penyakit diabetes
militus serta efeknya di hati akan meningkatkan jumlah glikogen (Ganong, 2002).
Selanjutnya Turner (1961) mengatakan bahwa pemberian somatotropin dalam
jangka waktu yang lama menyebabkan diabetes militus yang permanen dan terjadi
kerusakan dari sel ß pankreas yang mensekresikan insulin. Belum pernah
dilaporkan apakah pemberian insulin, secara langsung akan menstimulasi sel ß
pankreas untuk memproduksi insulin (efek pankretrophik) atau bekerja secara
tidak langsung pada sel ß pankreas dengan meningkatkan konsentrasi glukosa
darah melalui beberapa mekanisme ekstrapankreatik. Kelebihan glukosa darah
akan memaksa kerja yang berlebihan dari sel ß pankreas, menyebabkan
atropi. Kejadian ini dilihat pada tikus yang mendapatkan asupan karbohidrat yang
terlalu banyak kemudian disuntik dengan somatotropin.
Bovine somatotropin (bST)
Bovine somatotropin merupakan hormon polipeptida yang dihasilkan oleh
hipofise anterior pada hewan sapi. Hormon ini berukuran besar karena disusun
dari 191 asam amino. Pada tahun 1930 sampai awal tahun 1980, pengetahuan
tentang struktur kimia, aktivitas dan fungsi bST mengalami kemajuan. Walaupun
demikian sangat susah untuk mendapatkan bST murni dari hewan sapi (Crooker,
2007).
Pada tahun 1921, Evans dan Long menyuntikan larutan yang diekstrak
dari hipofise anterior sapi pada tikus normal dan pertumbuhan dari hewan tersebut
mengalami percepatan. Percobaan berikutnya dilakukan oleh Smit pada tahun
1927, dia memberikan hasil ekstrak hipofise anterior yang sama pada tikus yang
hpofisektomi. Tahun 1944, Li dan Evans melaporkan bahwa berat molekul
protein dari ekstrak bovine hipofise sebesar 44.250 dalam larutan dengan pH
6.64-7.00 dan titik isoelektrik dengan pH 6.85 memiliki kemampuan untuk mendorong
pertumbuhan pada tikus yang mengalami hipofisektomi. Pada tahun 1947,
pertama kali dilakukan pemurnian terhadap bovine somatotropin dan disuntikan
pada seorang gadis yang menderita kekerdilan dengan dosis 5 mg/KgBB tetapi
tidak memiliki efek pada keseimbangan nitrogen. Ini memberikan gambaran
bahwa hormon ini bersifat spesies spesifik, bovine somatotropin (bST) memiliki
struktur kimia yang berbeda dengan human somatotropin (hST) sehingga bST
tidak dapat dijadikan sebagai pemacu tumbuh pada manusia (Li, 1988).
Perkembangan teknologi rekombinan DNA memungkinkan produksi
bovine somatotropin (bST) dalam skala besar. Pada tahun 1980an, teknik biologis
baru yang dikenal dengan ”rekayasa genetik” telah dikembangkan. Teknik ini
memungkinkan isolasi gen somatotropin yang bertanggung jawab atas
pemrograman sel-sel somatotrof pituitari untuk menghasilkan somatotropin, dan
penyisipannya ke dalam gen bakteri. Bakteri yang membawa gen somatotropin
kemudian akan menghasilkan somatotropin yang biasanya hanya dihasilkan oleh
dalam bejana fermentasi dan dimurnikan dengan biaya yang relatif murah
MATERI DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dimulai pada bulan Mei sampai dengan bulan Desember
2006 di Laboratorium Fisiologi dan Farmakologi Departemen Anatomi, Fisiologi,
dan Farmakologi Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Bahan dan Alat
Penelitian ini menggunakan tikus betina bunting (Rattus norvegicus) galur
Spraque-Dawley paritas kedua berumur ± 16 minggu. Bahan-bahan lain yang
digunakan adalah bST (bovine Somatotropin), corn oil (minyak jagung), eter, dan
NaCl fisiologis 0.9%.
Alat yang digunakan antara lain timbangan, timbangan analitik, syringe 1
ml, alat bedah, kalkulator, tabung reaksi, rak, sentrifuge, pipet, refrigerator,
spektrofotometer, dan alat-alat bantu lainnya yang digunakan sesuai kebutuhan.
Metode Penelitian
Persiapan tikus percobaan
Sebanyak 36 ekor tikus betina (Rattus norvegicus) dikawinkan dengan
tikus jantan. Untuk melihat terjadinya perkawinan dilakukan pemeriksaan ulas
vagina. Fertilisasi terjadi jika ditemukan spermatozoa di preparat ulas vagina.
Hari pertama kebuntingan dihitung sejak ditemukan spermatozoa di preparat ulas
vagina. Selanjutnya tikus-tikus tersebut dibagi dalam 3 kelompok percobaan
yaitu kelompok yang disuntik dengan bST (kelompok H), kelompok yang disuntik
minyak jagung (kelompok M), dan kelompok kontrol (K) yang tidak diberi
perlakuan. Selanjutnya tikus-tikus tersebut ditempatkan dalam kandang secara
individu. Tikus-tikus percobaan dipelihara dalam kandang tikus yang terbuat dari
bahan plastik dan disusun dalam rak-rak yang terbuat dari plat besi, setiap satu
kandang memiliki tempat pakan dan air minum. Pakan (pelet) dan minum
Perlakuan
Penyuntikan dilakukan pada hari ke-4 sampai hari ke-12 kebuntingan
dengan dosis bST 0 mg/KgBB/hari (kelompok M) dan bST 9 mg/KgBB/hari
(kelompok H) dan disuntik secara intramuskular (Azain et al., 1993) pada bagian
kaki belakang kiri dan kanan otot semitendinosus secara bergantian. Hari ke-13,
17 dan 21 kebuntingan, tikus dieutanasia dan dibedah untuk pengambilan darah,
cairam amnion, dan fetus.
Pengambilan darah
Darah diambil dari jantung dengan menggunakan syringe, kemudian
dimasukan ke dalam tabung reaksi. Untuk mendapatkan serum, darah dibiarkan
selama 2 jam pada suhu kamar, kemudian disentrifuge dengan kecepatan 2500
rpm selama 15 menit. Cairan bening yang berupa serum dikoleksi dan disimpan
dalam tabung eppendorf, dibekukan pada suhu -20oC untuk digunakan kemudian
dalam penentuan kadar glukosa darah.
Pengambilan cairan amnion
Setelah pengambilan darah melalui jantung, tikus dibedah dan diambil cairan
amnionnya dengan menggunakan syringe (alat suntik). Cairan ini dimasukan ke
dalam tabung eppendorf kemudian dibekukan pada suhu -20oC untuk digunakan
kemudian dalam penentuan kadar glukosa cairan amnion. Khusus untuk cairan
amnion pada umur kebuntingan 13 hari tidak diambil karena volumenya masih
terlalu sedikit.
Pengambilan dan penimbangan fetus
Setelah cairan amnion dipastikan optimal diambil, fetus diangkat dari
uterus dengan menggunakan gunting dan scalpel. Penimbangan bobot fetus
dilakukan pada umur 13, 17, dan 21 hari kebuntingan. Bobot fetus ditimbang
Pengukuran kadar glukosa darah dan cairan amnion
Analisis kadar glukosa dilakukan dengan menggunakan metode GOD-PAP,
sesuai petunjuk kerja KIT nomor katalog 112192 (Barham dan Trinder, 1972)
yang diukur dengan spektrofotometer. Sebanyak 10 μl serum darah atau cairan
amnion dimasukan ke dalam tabung reaksi, kemudian ditambahkan 1 ml (1000 μl)
reagen (pereaksi warna) dan dihomogenkan dengan menggunakan Vortex.
Campuran ini dibiarkan selama 10 menit dalam suhu kamar (20-25ºC), kemudian
absorbansinya dibaca dengan menggunakan spektrofotometer. Untuk pengukuran
ini, disiapkan juga larutan standar. Pembacaan absorbansi sampel dan standar
dilakukan pada panjang gelombang 500.5 nm.
Kadar glukosa darah diperoleh dengan membandingkan nilai absorbansi
sampel dengan absorbansi standar kemudian dikalikan 100 mg/dl :
As
Kg = x 100 mg/dl
Ast
Keterangan :
Kg : kadar glukosa darah/cairan amnion (mg/dl)
As : absorbansi sampel
Ast : absorbansi standar
Analisis statistik
Data yang diperoleh dianalisa dengan menggunakan metode statistik
ANOVA (analisa sidik ragam) dengan pola Rancangan Acak Lengkap (RAL) dan
dilanjutkan dengan uji perbandingan DUNCAN.
Parameter yang diamati
Kadar glukosa darah dan glukosa cairan amnion induk serta bobot fetus