PENGEMBANGAN METODE KULTUR
EMBRYONIC
STEM CELLS
DARI EMBRIO HASIL FERTILISASI
DAN PRODUKSINYA DARI EMBRIO
PARTENOGENETIK MENCIT
THOMAS MATA HINE
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi ‘Pengembangan Metode
Kultur Embryonic Stem Cells dari Embrio Hasil Fertilisasi dan Produksinya dari Embrio Partenogenetik Mencit’ adalah karya saya dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi
manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan
maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan
dicantumkan dalam Daftar Pustaka dibagian akhir disertasi ini.
Bogor, Agustus 2009
Thomas Mata Hine
THOMAS MATA HINE. Development Cultured Methods of Fertilized Embryo Derived-Stem Cells and their Production from Mouse Parthenogenetic Embryos. Under Direction of ARIEF BOEDIONO, IMAN SUPRIATNA, and DONDIN SAJUTHI.
The ability of embryonic stem cells (ESC) to contribute become all cell type of the body draw enthusiasm a lot of researcher to investigate and exploit ESC for various importance. One of the benefits of ESC is for treatment of various degenerative diseases resulted from cell damage or aging at certain tissues or organs of the body. In addition, ESC also applicable for pre-clinical trials new drugs before used for medical treatment for animal and human being. The efficiency of ESC deriving is influenced by some factors that are: stadia of the embryos, culture system, type of feeder layer, and passage method. In this research, we test the growth potential of ESC yielded by embryo at cleavage, morula, and blastocyst stage; culture of ESC from inner cell mass (ICM) of blastocyst isolated by enzymatic or immunosurgery methods at cumulus feeder layer (CFL) or cumulus conditioned medium in combination with leukemia inhibitory factor (LIF), passage of ESC with mechanical or enzymatic method, and furthermore induce of ESC to be differentiated. In addition, we produced parthenogenetic ESC in effort to minimize the ethical and immunogenicity problems resulted from fertilized embryos. Result of the research indicated that embryos at the morula stage can produce ESC, with attachment rate and number of primary ESC colony were lower than blastocyst, but doubling time and outgrowth were higher than the blastocyst, while embryos at the cleavage stage were unable to produce ESC. In the second experiment, isolation of ICM of blastocyst by enzymatic method were able to produce ESC wich was similar with immunosurgery, and was higher than produced by intact blastocyst. At the third experiment, effectiveness of CFL comparable with MEF feeder layer, and the LIF at concentration 10 ng/ml at CFL or 20 ng/ml at CCM were able to improve efficiency of ESC deriving, and the mechanical method for ESC colony passage showed the better results than enzymatic method. In addition, ESC colony culture in CFL or CCM was able to differentiate become cardiomyocyte-like cells and neuron-like cells. In the latest experiment, mouse parthenogenetic embryos could produced ESC with growth potential was lower than derive from fertilized embryos.
THOMAS MATA HINE. Pengembangan Metode Kultur Embryonic Stem Cells
dari Embrio Hasil Fertilisasi dan Produksinya dari Embrio Partenogenetik Mencit. Dimbimbing oleh ARIEF BOEDIONO, IMAN SUPRIATNA, dan DONDIN SAJUTHI.
Embryonic stem cells (ESC) adalah sel-sel yang dihasilkan dari kultur sel embrio pra-implantasi, yang memiliki kemampuan untuk berkembang menjadi semua tipe sel yang menyusun jaringan tubuh suatu organisme seperti sel syaraf, sel pankreas, sel ginjal, sel hati, sel darah, sel tulang, dan sebagainya. Dengan kemampuan seperti ini, ESC dapat digunakan untuk terapi berbagai penyakit degeneratif atau penyakit lainnya yang diakibatkan oleh adanya kerusakan atau penuaan sel pada suatu jaringan atau organ tubuh tertentu. Selain itu, ESC juga dapat digunakan untuk pengujian obat baru sebelum digunakan untuk pengobatan pada hewan dan manusia.
Ada beberapa masalah yang timbul dalam produksi ESC: 1) umumnya ESC diproduksi dari inner cell mass (ICM) blastosis yang memiliki potensi diferensiasi yang lebih terbatas dibandingkan dengan embrio pada stadium
cleavage dan morula. 2) ESC selama ini diproduksi dari kultur blastosis utuh atau kultur ICM hasil isolasi dengan metode immunosurgery. Kultur blastosis utuh menghasilkan tingkat pertumbuhan koloni ESC yang rendah sedangkan metode immunosurgery memiliki harga bahan yang mahal, 3) mouse embryonic fibroblast (MEF) feeder layer yang umumnya digunakan untuk kultur ESC sangat sensitif terhadap kontaminasi dengan bakteri atau jamur, dan metode produksinya relatif rumit, 4) ESC yang diproduksi dari embrio hasil fertilisasi memiliki tingkat imunogenitas yang tinggi dan berdampak pada tingginya resiko penolakan oleh jaringan pasien pada saat terapi, dan menimbulkan masalah etika karena diproduksi dari embrio yang berpotensi untuk menghasilkan individu baru. Untuk mengatasi masalah-masalah tersebut maka dalam penelitian ini, ESC diproduksi dari embrio yang berada pada stadium cleavage dan morula, isolasi ICM dengan metode enzimatik, kultur ESC pada feeder layer kumulus (CFL) atau conditioned medium
cumulus (CCM), dan produksi ESC dari embrio partenogenetik.
Tujuan penelitian ini adalah: 1) mengukur kemampuan tumbuh ESC yang dihasilkan oleh embrio pada stadium cleavage, morula dan blastosis, 2) mengembangkan metode isolasi ICM blastosis yang lebih murah dan sederhana untuk produksi ESC, 3) menemukan feeder layer dan conditioned medium alternatif untuk kultur ESC, 4) mengetahui profil pertumbuhan ESC partenogenetik.
Kegiatan penelitian diawali dengan produksi sel kumulus dari mencit DDY betina, pembuatan CFL, CCM, identifikasi protein pada CCM dengan
induksi diferensiasi ESC dengan melakukan perpanjangan masa kultur dalam ESC medium yang tidak disuplementasi dengan LIF.
Hasil penelitian menunjukkan bahwa embrio stadium morula dapat menghasilkan ESC, dengan attachment rate dan tingkat pembentukan koloni primer yang lebih rendah, tetapi doubling time dan outgrowth yang lebih tinggi daripada blastosis; sedangkan embrio stadium cleavage tidak mampu menghasilkan ESC. Pada tahap kedua, isolasi ICM blastosis dengan metode enzimatik mampu menghasilkan \produksi ESC yang setara dengan
immunosurgery, dan lebih tinggi dari yang dihasilkan kultur blastosis utuh. Tahap ketiga, efektivitas sel kumulus sebagai feeder layer pada kultur ESC mencit sebanding dengan mouse embryonic fibroblast (MEF) feeder layer, dan peningkatan konsentrasi LIF hingga 10 ng/ml pada CFL atau 20 ng/ml pada CCM mampu meningkatkan keberhasilan kultur ESC. Passage terhadap koloni ESC yang terbentuk paling baik dilakukan dengan metode mekanis. Selain itu, ESC hasil kultur pada CFL atau CCM berdiferensiasi menjadi
cardiomyocyte-like cells dan neuron-like cells. Tahap keempat, embrio partenogenetik mencit dapat menghasilkan ESC dengan kemampuan tumbuh yang lebih rendah dari yang dihasilkan embrio hasil fertilisasi.
Kata Kunci: metode kultur, fertilisasi, partenogenetik, embrio mencit,
© Hak cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
DAN PRODUKSINYA DARI EMBRIO
PARTENOGENETIK MENCIT
THOMAS MATA HINE
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Biologi Reproduksi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi pada Ujian Tertutup
: 1. Dr. drh. Ita Djuwita, M.Phil
2. drh. Bambang P. Priosoeryanto, MS, Ph.D
Penguji Luar Komisi pada Ujian Terbuka
: 1. dr. Triono Soendoro, Ph.D
Embrio Partenogenetik Mencit
Nama : Thomas Mata Hine
NIM : B061040021
Disetujui
Komisi Pembimbing
Prof. drh. Arief Boediono, Ph.D
Ketua
Prof. Dr. drh. Iman Supriatna
Anggota
Prof. drh. Dondin Sajuthi, MST, Ph.D
Anggota
Diketahui
Ketua Program Studi Biologi Reproduksi
Dekan Sekolah Pascasarjana
Prof. Dr. drh. Iman Supriatna Prof. Dr. Ir. Khairil A. Notodiputro, M.S
Limpahan syukur penulis panjatkan ke Hadirat Allah Yang Maha
Pengasih dan Penyayang, yang di dalam Kristus Yesus, Tuhan dan Juruselamat
umat manusia telah menyatakan kasihNya melalui penyertaan dan
pemeliharaanNya selama penulis menyelesaikan studi Doktoral di Institut
Pertanian Bogor. Tema penelitian ini adalah embryonic stem cells, yang dilaksanakan dalam kurun waktu lebih kurang 4 tahun, sejak Agustus 2005
hingga Juli 2009.
Pada kesempatan ini penulis menyampaikan terima kasih kepada Prof.
`drh. Arief Boediono, Ph.D selaku ketua komisi pembimbing, Prof. Dr. drh. Iman
Supriatna dan Prof. drh. Dondin Sajuthi, MST, Ph.D, selaku anggota komisi
pembimbing yang dengan penuh ketulusan memberi arahan dan masukan
selama pelaksanaan penelitian hingga penulisan disertasi. Penulis juga
menyampaikan terima kasih kepada Prof. Dr. drh. Mozes R. Toelihere, M.Sc
(Alm.) yang walaupun proses pembimbingan tidak berlanjut namun segala
arahan yang pernah disampaikan sangat berarti bagi penulis didalam berkarya di
masa mendatang. Ucapan terima kasih juga disampaikan kepada Dr. drh. Ita
Djuwita, M.Phil dan drh. Bambang Pontjo Priosoeryanto, MS, Ph.D selaku
penguji luar komisi pada Ujian Tertutup, dr. Triono Soendoro, Ph.D dan Dr. drh.
M. Agus Setiadi, selaku penguji luar komisi pada Ujian Terbuka, atas segala
masukan yang sangat bermanfaat untuk menyempurnakan tulisan ini.
Penulis juga mengucapkan terima kasih kepada Rektor, Dekan sekolah
Pascasarjana, Dekan Fakultas Kedokteran Hewan, Ketua Departemen KRP,
Ketua Program Studi, staf pengajar dan staf administrasi Biologi Reproduksi,
serta seluruh staf Pascasarjana IPB yang telah menerima penulis untuk
melanjutkan studi di IPB serta membantu kelancaran proses penyelesaian studi
penulis. Ucapan yang sama juga disampaikan kepada Rektor dan Dekan
Fakultas Perternakan Universitas Nusa Cendana yang telah memberikan ijin
studi, dan Pemda Propinsi NTT, Dirjen Dikti, dan PT Kalbe Farma, Tbk. atas
dukungan finansial dalam rangka penyelesaian studi penulis.
Ucapan terima kasih juga disampaikan kepada Drh. Ita Djuwita, M. Phil,
sebagai Kepala Laboratorium Embriologi dan Kepala Laboratorium PSSP yang
telah memberi ijin kepada penulis untuk melakukan penelitian dan menggunakan
Arifiantini, atas dukungan dan bantuan dalam bentuk informasi ilmiah yang
diterima penulis selama studi di Bogor. Kepada rekan-rekan senior, Dr. Ir.
Wilmientje Marlene Nalley, MS, Dr. Ir. Henny Belli, MS, dan Dr. Ir. Maritje
Hilakore, M.Si, atas segala dukungan dan bantuannya.
Kepada rekan-rekan saya, Bayu Rosadi, S.Pt, M.Si, Enny T. Setiatin,
Raden Harry Murti S.Si, Riris Lindiawati Puspitasari, S.Si, M.Si, Dini Budiharko,
S.Si, Dwi Agustina, S.Si, Nuril Farizah, S.Pi, M.Si, Sigit prastowo, S.Pt, M.Si, Ir.
Satya Gunawan, MP, Dra. Ekayanti, M.Si, Tatan Kastaman, S.Si, MP, Dr. drh. I
Wayan Batan, MS, dan Irma Andriani, S.Pi, M.Si, serta semua rekan-rekan
mahasiswa Biologi reproduksi atas hubungan baik dan kerjasamanya selama
studi.
Penulis juga menyampaikan terima kasih kepada semua rekan-rekan asal
NTT, Ir. Yohanes U.L. Sobang, M.Si, Ir. Maria Kondi, MP, Ir. Dodi Dharma
Kusuma dan Ibu, Ir. Kirenius Uly, MP, atas dukungan yang diberikan selama ini.
Kepada Wili Praira S.Si, Mas Wahyu dan Ibu Yani atas segala kebaikan dan
bantuannya selama penulis melakukan penelitian di Lab Embriologi dan
Laboratorium PSSP.
Akhirnya, karya ini dipersembahkan kepada isteri saya Erni Julita, dan
anak-anak saya Eirens Josua, Angel, Kerin Jeanita, dan Kezia Evangeline, yang
dengan penuh pengertian mendukung penulis melalui doa dan pengorbanan
yang begitu besar. Terima kasih juga disampaikan kepada kedua orangtua saya
(almarhum) yang telah membesarkan dan mendidik saya hingga berhasil,
kepada kedua mertua, kakak, adik, dan saudara-saudara atas dukungan moril
yang diberikan.
Bogor, Agustus 2009
Penulis dilahirkan di salah satu pulau kecil yang berada di bagian
terselatan Indonesia, Pulau Sawu, pada tanggal 5 Mei tahun 1966, dari kedua
orang tua Mira Kale dan Tamar Diana Lobo. Pendidikan Dasar dan Menengah
Pertama ditempuh di Pulau sawu, dan selanjutnya meneruskan pendidikan
Tingkat Menengah Atas di Kupang, Nusa Tenggara Timur. Pendidikan sarjana
diselesaikan pada tahun 1991, pada Fakultas Peternakan, Universitas Nusa
Cendana dan pada tahun 1992, penulis diterima sebagai staf pengajar pada
Fakultas yang sama. Tahun 1994 penulis melanjutkan pendidikan magister di
Program Studi Biologi Reproduksi Program Pascasarjana Institut Pertanian
Bogor, dan selesai pada awal tahun 1997. Pendidikan doktoral penulis jalani
sejak tahun 2004 hingga saat ini.
Beberapa karya yang dipublikasikan melalui jurnal atau seminar ilmiah
selama pendidikan di Bogor adalah:
1. Matahine T, Supriatna I, Sajuthi D, Boediono A.2008. Produksi embryonic stem cells dari inner cell mass blastosis yang diisolasi dengan metode enzimatik dan immunosurgery. Jurnal Veteriner 9:13-19
2. Matahine T, Boediono A, Supriatna I, Sajuthi D. 2008. Metode isolasi inner cells mass pada produksi embryonic stem cells. Seminar Nasional Persatuan Ahli Anatomi Indonesia (PAAI). Jakarta, 20-21 Juni 2008. pp 90 (abstr).
3. Matahine T, Supriatna I, Sajuthi D, Boediono A.2007. Produksi embryonic stem cells dari blastosis mencit pada stadium yang berbeda. Seminar Nasional XIII PERSADA, 9 Agustus 2007, Fakultas Kedokteran Hewan IPB, Bogor.
4. Matahine T, Boediono A. 2006. Peluang dan tantangan penggunaan stem cells untuk terapi regeneratif. Jurnal Medis Veteriner Indonesia 10(1):31-38. 5. Matahine T. 2005. Kemajuan kriopreservasi dan pendekatan seluler pada
embrio hewan domestik. Jurnal IMPASJA 1 :70-86.
xii
Halaman
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
DAFTAR SINGKATAN ... xvii
PENDAHULUAN ... 1
Latar Belakang ... 1
Kerangka Pemikiran ... 1
Tujuan Penelitian ... 4
Manfaat Penelitian ... 4
Hipotesis ... 4
Daftar Pustaka ... 4
TINJAUAN PUSTAKA ... 8
Perkembangan Embrionik Praimplantasi pada Mencit ... 8
Embrio Partenogenetik ... 9
Embryonic Stem Cells ... 12
Isolasi Inner Cell Mass ... 16
Feeder Layer ... 17
Sel Kumulus ... 18
Daftar Pustaka ... 19
KEMAMPUAN TUMBUH STEM CELLS MENCIT YANG DIPRODUKSI DARI EMBRIO STADIUM CLEAVAGE, MORULA, DAN BLASTOSIS... 26 Abstrak ... 26
Abstract ... 26
Pendahuluan ... 27
Metode Penelitian ... 27
Hasil dan Pembahasan 29 Kesimpulan ... 36
xiii
PRODUKSI EMBRYONIC STEM CELLS DARI INNER CELL MASS
BLASTOSIS YANG DIISOLASI DENGAN METODE ENZIMATIK ... 40
Abstrak ... 40
Abstract ... 40
Pendahuluan ... 41
Metode Penelitian ... 42
Hasil dan Pembahasan 43 Kesimpulan ... 48
Daftar Pusataka ... 48
EFEKTIVITAS FEEDER LAYER DAN CONDITIONED MEDIUM KUMULUS DALAM MENUNJANG PROLIFERASI DAN PLURIPOTENSI EMBRYONIC STEM CELLS ...... 51
Abstrak ... 51
Abstract ... 51
Pendahuluan ... 52
Metode Penelitian ... 53
Hasil dan Pembahasan 58 Kesimpulan ... 76
Daftar Pusataka ... 77
PRODUKSI EMBRYONIC STEM CELLS DARI EMBRIO PARTENOGENETIK ... 83
Abstrak ... 83
Abstract ... 83
Pendahuluan ... 84
Metode Penelitian ... 85
Hasil dan Pembahasan 86 Kesimpulan ... 98
Daftar Pusataka ... 98
PEMBAHASAN UMUM ... 103
KESIMPULAN DAN SARAN UMUM ... 110
DAFTAR PUSTAKA ... 111
xiv
Halaman
1. Profil perkembangan embryonic stem cells yang dihasilkan dari
embrio pada stadium berbeda ... 29
2. Profil perkembangan embryonic stem cell pasca isolasi ICM dengan
metode berbeda... 46
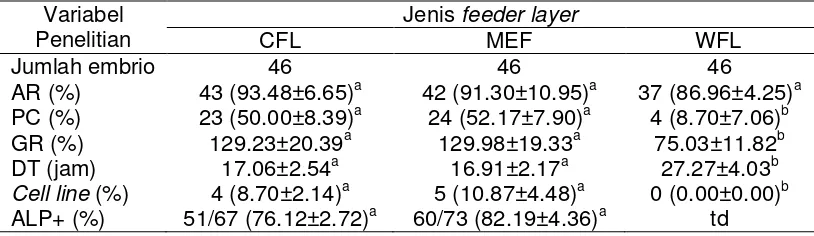
3. Proliferasi dan Pluripotensi ESC yang dikultur pada CFL dan MEF ... 60
4. Proliferasi dan pluripotensi ESC yang dikultur pada CFL dan CCM
dengan konsentrasi LIF berbeda... 65
5. Pengaruh metode passage terhadap proliferasi dan pluripotensi ESC.. 72 6. Induksi diferensiasi spontan pada ESC yang dikultur pada CFL dan
CCM ... 75
7. Tingkat aktivasi, diploidisasi, dan potensi perkembangan embrio
partenogenetik pasca aktivasi dengan strontium chloride dan etanol .. 88
8. Tingkat perkembangan embrio partenogenetik yang dikultur pada
KSOM dan CZB ... 92
xv
Halaman
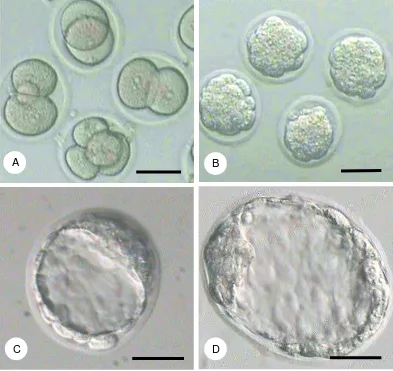
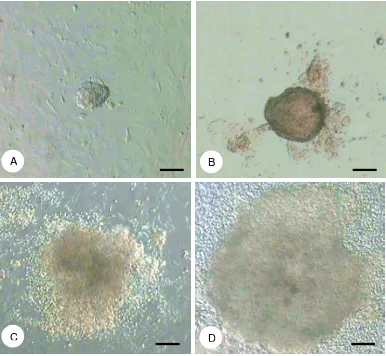
1. . Embrio stadium cleavage, morula, blastosis dan blastosis ekspan... 30
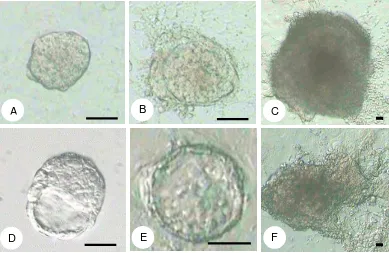
2. Perkembangan ESC yang dihasilkan oleh morula dan blastosis ... 32
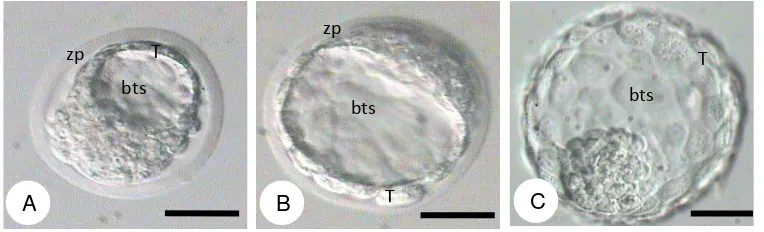
3. Blastosis pada berbagai stadium yang dikoleksi pada hari keempat kebuntingan ... 44 4. Proses isolasi ICM dengan metode immunosurgery dan enzimatik .... 45
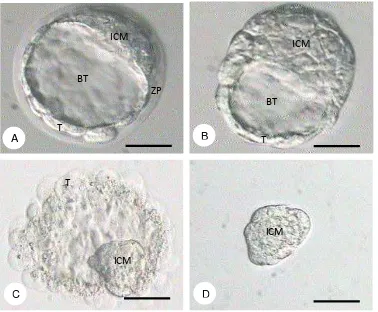
5. Proses isolasi ICM untuk kultur pada CFL dan CCM... 58
6. CFL dan MEF feeder layer yang digunakan untuk kultur ESC ... 59
7. Perkembangan ESC dalam kultur ... 59
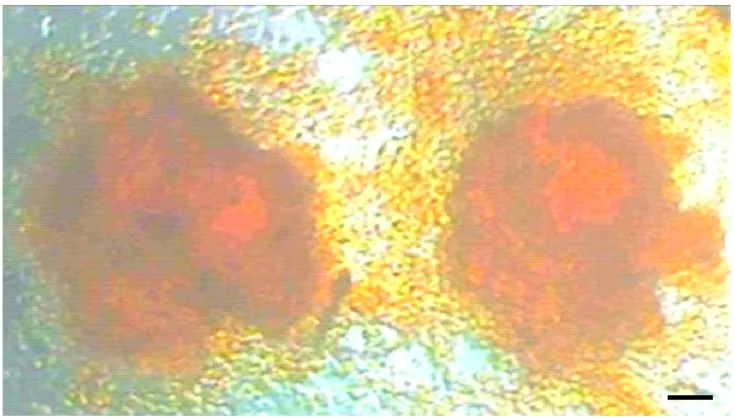
8. Koloni embryonic stem cells yang positif terhadap pewarnaan alkaline phosphatase ... 61 9. SDS-PAGE pada conditoned medium kumulus... 67
10. Pasase ESC dengan metode mekanis ... 70
11. ESC line yang terbentuk setelah pasasekelima ... 71
12. Embryoid body ... 74
13. Cardiomyocyte-like cells yang berasal dari ESC dan sel jantung dewasa ... 74 14. Neuron-like cell yang dihasilkan dari ESC ... 74
15. Perkembangan oosit sebelum dan setelah aktivasi partenogenesis ... 87
16. Perkembangan embrio partenogenetik dalam kultur in vitro ... 93 17. Pewarnaan Hoechst-Propidium Iodide pada embrio partenogenetik
sebelum dan setelah immunosurgery ...
94
18. Inner cell mass yang dihasilkan dari blastosis hasil fertilisasi dan partenogenetik ...
95
19. Koloni ESC partenogenetik dan ESC dari embrio fertilisasi sebelum dan setelah pewarnaan alkaline phosphatase ...
xvi
Halaman
1. . Medium Kultur Embryonic Stem Cells ... 114
2. Medium Kultur Feeder Layer ... 116
3. Medium Immunosurgery ... 117
4. Medium Inaktivasi Feeder Layer ... 118
5. Alkaline Phosphatase Staining ... 119
6. Chatot, Ziomex, Bavister Medium ... 121
7. Pembuatan Medium Kultur, Aktivasi, dan Diploidisasi Embrio Partenogenetik ... 122 8. Potassium Simplex Optimization Medium ... 123
xvii
6-DMAP : 6-dimethylaminopurine
ActRIB, ALK4 : reseptor activin tipe I
ActRII : reseptor activin tipe II
ALK : activin receptor-like kinase
ALP : alkaline phosphatase
ANOVA : analysis of variance
APC : adeomatosis polyposis coli
AR : tingkat perlekatan
BMP : bone morphogenic protein
CCM : conditioned medium kumulus
CFL : feeder layer kumulus
CKI : casein kinase I
CM conditioned medium
CSF cytostatic factor
CZB : chatot, Ziomex, and Bavister
DG diacylglycerol
DMEM : dulbecco’s modified eagle’s medium
Dsh : dishevelled
DT : doubling time
Ebs : embryoid bodies
EDTA : ethylene diamine tetraacetic acid
EGF epidermal growth factor
ERK : extracellular signal-regulated kinase
ESC : embryonic stem cells
FBS : fetal bovine serum
FGF fibroblast growth factor
GDF : growth differentiation factor
GR : tingkat pertumbuhan koloni
GSK3 glycogen synthase kinase-3
hCG : human chorionic gonadotropin
ICM : inner cell mass
IGF insulin-like growth factor
xviii
LEF : lymphoid enhancer factor
LIF leukemia inhibitoryfactor
MEF : mouse embryonic fibroblast
MHC : major histocompatibility complex
mPBS modified phosphate buffered saline
MPF M-phase promoting factor
NEAA : nonessential amino acid
Oct-4 : octamer-binding transcription factor-4
PC : tingkat pembentukan koloni primer
PDK-1 : phosphor-inositide-dependent kinase-1
PI3K : phospho-inositide 3-kinase
PIP2 : phosphatidylinositol 3,4,-bisphosphate
PIP3 : phosphatidylinositol 3,4,5-triphosphate
PKC protein kinase C
PLC phospholipase C
PMSG : pregnant mare’s serum gonadotropin
RAL : rancangan acak lengkap
REF : rat embryonic fibroblast
SDS-PAGE : sodium dedocyl sulfate-polyacrylamide gel
electrophoresis
SMAD : Sma and MAD (mothers agains decapentaplegic)
related protein
SSEA-1 : stage specific embryonic antigen 1
STAT : signal transducer dan activator of transcription
TCF : T cell factor
TGF- : transforming growth factor
Latar Belakang
Embryonic stem cells (ESC) adalah sel-sel yang dihasilkan dari kultur sel embrio pra-implantasi, yang memiliki kemampuan untuk berkembang menjadi
semua tipe sel yang menyusun jaringan tubuh suatu organisme (Lin 2008).
Beberapa penelitian sebelumnya telah membuktikan bahwa ESC dapat
diarahkan menjadi sel syaraf (Ban et al. 2007, Gossrau et al. 2007, Elkabetz et al. 2008, Erceg et al. 2009), sel pankreas (Roche et al. 2005), sel jantung (Guo
et al. 2006, Hong et al. 2007), sel ginjal (Kim & Dressler 2005), sel hati (Agarwal
et al. 2008, Snykers et al. 2009), sel darah (Rajesh et al. 2007, Ma et al. 2008), sel tulang (Karp et al. 2006, Duplomb et al. 2007) dan sebagainya.
Beberapa tahun terakhir banyak penelitian telah difokuskan pada
penggunaan ESC untuk terapi penyakit degeneratif (Dang et al. 2004). Kepentingan medis dan ilmiah dari ESC didasarkan pada keinginan untuk
menemukan sumber sel baru sebagai upaya memperbaharui jaringan atau organ
yang rusak (Doss et al. 2004). Beberapa penyakit yang telah terbukti dapat disembuhkan dengan terapi ESC pada mencit dan hewan laboratorium lainnya
diantaranya adalah penyakit Parkinson (Nishimura et al. 2003, Rodriguez-Gomez
et al. 2007, Yang et al. 2008), lever (Sukhikh & Shtil 2003, Brezillon et al. 2008), diabetes (Soria et al. 2000, Sameer et al. 2006), spinal cord injury (McDonald et al. 1999), jantung (Behfar et al. 2007), dan Alzheimer (Doss et al. 2004, Feng et al. 2009). Selain itu, ESC juga dapat digunakan untuk uji berbagai obat baru sebelum digunakan untuk menyembuhkan penyakit pada hewan dan manusia
(Yu & Thomson 2006).
Kerangka Pemikiran
Sejumlah faktor diperkirakan berpengaruh terhadap keberhasilan kultur
ESC. Faktor-faktor tersebut diantaranya adalah stadium perkembangan embrio
yang digunakan untuk menghasilkan ESC, sistem kultur, jenis feeder layer (Park
et al. 2004), dan metode perbanyakan ESC. Umumnya ESC diproduksi dari inner cell mass (ICM) blastosis (Rossant 2001, Cowan et al. 2004, Stojkovic et al.
stadium pra-blastosis dengan tingkat keberhasilan yang bervariasi (Delhaise et al. 1996, Tesar 2005). Bagaimanapun informasi tentang kemampuan tumbuh ESC yang dihasilkan embrio pra-blastosis khususnya yang berada pada stadium
cleavage dan morula masih sangat terbatas.
Faktor kedua adalah sistem kultur ESC yang digunakan. Hasil
eksperimen sebelumnya menunjukkan bahwa kultur blastosis utuh menghasilkan
ESC dengan tingkat pertumbuhan koloni dan doubling time yang lebih buruk daripada yang dihasilkan embrio stadium morula. Keberadaan sel trofoblas
dalam kultur ESC diduga sebagai penyebab utama hal tersebut (Li et al. 2003). Dalam rangka mengatasi masalah tersebut, beberapa peneliti sebelumnya
melakukan isolasi atau pemisahan ICM dari sel-sel trofoblas dengan metode
immunosurgery (Cowan et al. 2004). Walaupun demikian, antiserum dan
complement yang digunakan pada metode tersebut memiliki harga yang mahal dan proses isolasi lebih lama. Selain itu, penggunaan antiserum dalam proses
isolasi immunosurgery tidak selalu efektif untuk melisiskan trofoblas. Dalam penelitian ini, digunakan tripsin untuk isolasi ICM. Metode ini baru dilaporkan
penggunaannya untuk isolasi ICM babi (Li et al. 2003) dan belum pernah dilaporkan pada spesies lainnya termasuk pada mencit. Metode ini selain
memiliki harga bahan yang relatif murah, proses isolasi juga berlangsung dalam
jangka waktu yang relatif pendek.
Faktor ketiga adalah jenis sel yang digunakan sebagai feeder layer pada kultur ESC. Feeder layer yang umum digunakan adalah mouse embryonic fibroblast (MEF) (Thomson et al. 1998, Reubinoff et al. 2000). Penggunaan MEF untuk kultur ESC memiliki kelemahan yaitu metode produksinya relatif rumit dan
sangat sensitif terhadap kontaminasi dengan bakteri atau jamur terutama selama
proses awal pembuatan feeder layer. Selain itu, penggunaan MEF pada kultur ESC manusia menimbulkan masalah etika karena terjadinya pencampuran sel
hewan dengan manusia. Dalam penelitian ini, telah digunakan sel kumulus
sebagai feeder layer untuk kultur ESC mencit. Sel kumulus adalah sel yang menyertai oosit pada saat ovulasi dan berperan dalam menunjang
perkembangan dan pematangan oosit (Eppig et al. 2005). Feeder layer kumulus (cumulus feeder layer, CFL) telah terbukti dapat menunjang perkembangan embrio praimplantasi (Malekshah & Moghaddam 2005). Selain itu, sel kumulus
dayaguna sel kumulus maka dalam penelitian ini juga dilakukan produksi
conditioned medium kumulus (cumulus conditioned medium, CCM), yakni cairan (supernatan) yang dikoleksi dari kultur CFL setelah inkubasi selama periode
waktu tertentu. Kelebihan penggunaan CCM adalah tidak terjadi percampuran
antara ESC dengan feeder layer sehingga tingkat kemurnian ESC dapat dipertahankan.
Masalah lain yang timbul dalam produksi dan pemanfaatan ESC adalah
masalah etika, dan penolakan oleh jaringan pasien pada saat transplantasi.
Embryonic stem cells yang umumnya dihasilkan dari embrio hasil fertilisasi oosit dengan sperma, memiliki tingkat imunogenitas yang tinggi dan berdampak pada
tingginya resiko penolakan oleh jaringan atau organ pasien pada saat terapi.
Selain itu, penggunaan embrio hasil fertilisasi sebagai sumber ESC menimbulkan
masalah etika (khususnya pada manusia) karena dihasilkan dari embrio yang
berpotensi menjadi individu baru (de Wert & Mummery 2003).
Untuk mengatasi masalah-masalah tersebut, maka dalam penelitian ini,
ESC diproduksi dari embrio partenogenetik, yang merupakan hasil aktivasi oosit
dengan bahan kimia tertentu (Boediono et al. 1995, Ito et al. 2003), dan tidak melibatkan sperma dalam proses aktivasi. Dampak dari proses aktivasi tersebut
adalah embrio yang dihasilkan hanya memiliki kemampuan tumbuh hingga awal
atau pertengahan kebuntingan dan pada mamalia belum pernah terjadi kelahiran
secara alamiah. Dengan demikian, penggunaan embrio partenogenetik sebagai
sumber ESC akan meminimalisir atau menghilangkan masalah etika yang
ditimbulkan oleh embrio hasil fertilisasi. Selain itu, ESC yang dihasilkan oleh
embrio partenogenetik hanya mengandung satu set major histocompatibility complex (MHC) sehingga memiliki tingkat imunogenitas yang rendah (Lin et al.
2003). Penelitian tentang ESC partenogenetik masih relatif sedikit dan hasilnya
Tujuan Penelitian
1. Mengukur kemampuan tumbuh ESC yang dihasilkan oleh embrio pada
stadium cleavage, morula dan blastosis.
2. Mengembangkan metode isolasi ICM blastosis yang lebih murah dan
sederhana untuk produksi ESC.
3. Menemukan feeder layer dan conditioned medium alternatif untuk kultur ESC 4. Mengetahui profil pertumbuhan ESC partenogenetik
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat bermanfaat untuk pengembangan
metode kultur ESC yang lebih efisien dan sebagai alternatif produksi ESC dari
embrio partenogenetik.
Hipotesis
1. Kemampuan tumbuh ESC yang dihasilkan embrio stadium cleavage dan morula lebih baik dari blastosis.
2. Metode isolasi enzimatik dapat dijadikan sebagai metode untuk pemisahan
ICM untuk produksi ESC.
3. Sel kumulus dapat digunakan sebagai feeder layer dan penghasil
conditioned medium untuk kultur ESC.
4. Profil pertumbuhan ESC yang dihasilkan embrio partenogenetik tidak
berbeda dengan yang dihasilkan embrio hasil fertilisasi.
DAFTAR PUSTAKA
Agarwal S, Holton KL, Lanza R. 2008. Efficient differentiation of functional hepatocytes from human embryonic stem cells. Stem Cells 26:1117-1127. Ban J et al. 2007. Embryonic stem cell-derived neurons form functional networks
in vitro. Stem Cells 25:738 –749.
Behfar A et al. 2007. Cardiopoietic programming of embryonic stem cells for tumor-free heart repair. J Exp Med 204:405-420.
Brezillon N, Kremsdorf D, Weiss MC. 2008. Cell therapy for the diseased liver: from stem cell biology to novel models for hepatotropic human pathogens.
Boediono A, Saha S, Sumantri C, Suzuki T.1995. Development in vitro and in vivo of aggregated parthenogenetic bovine embryos. Reprod Fertil Dev
7:1073-1079.
Cowan A et al. 2004. Derivation of embryonic stem-cell lines from human blastocysts. N Engl J Med 350:1353-1356.
Dang SM, Gerecht-Nir S, Chen J, Itskovitz-Eldor J, Zandstra PW. 2004. Controlled, scalable embryonic stem cell differentiation culture. Stem Cells 22:275-282
Delhaise F, Bralion V, Schuurbiers N, Dessy F. 1996. Establishment of an embryonic stem cell line from 8-cell stage mouse embryos. Eur J Morph
34:237 (Abstr)
de Wert G, Mummery C. 2003. Human embryonic stem cells: research, ethics and policy. Hum Reprod 18:672-682.
Doss MX, Koehler CI, Gissel C, Hescheler J, Sachinidis A. 2004. Embryonic stem cells: a promising tool for cell replacement therapy. J Cell Mol Med 8: 465-473.
Duplomb L, Dagouassat M, Jourdon P, Heymann D. 2007. Concise review: embryonic stem cells: a new tool to study osteoblast and osteoclast differentiation. Stem Cells 25:544-552.
Elkabetz Y et al. 2008. Human ES cell-derived neural rosettes reveal a functionally distinct early neural stem cell stage. Genes & Development
22:152–165.
Eppig JJ, Pendola FL, Wigglesworth K, Pendola JK. 2005. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biol Reprod 73:351-357.
Erceg S, Ronaghi M, Stojkovi´c M. 2009. Human embryonic stem cell differentiation toward regional specific neural precursors. Stem Cells 27:78–87.
Feng Z, Zhao G, Yu L. 2009. Neural stem cells and Alzheimer’s disease: challenges and hope. American Journal of Alzheimer’s Disease & Other Dementias 24:52-57.
Gossrau G, Thiele J, Konang R, Schmandt T, Br¨Ustle U. 2007. Bone morphogenetic protein-mediated modulation of lineage diversification during neural differentiation of embryonic stem cells. Stem Cells 25:939-949.
Guo X-M et al. 2006. Creation of engineered cardiac tissue in vitro from mouse embryonic stem cells. Circulation 113:2229-2237.
Ito J, Shimada M, Terada T. 2003. Effect of protein kinase C activator on mitogen-activated protein kinase and p34cdc2 kinase activity during parthenogenetic activation of porcine oocyte by calcium ionophore. Biol Reprod 69:1675-1682.
Karp JM et al. 2006. Cultivation of human embryonic stem cells without the embryoid body step enhances osteogenesis in vitro. Stem Cells 24:835-843.
Kim D, Dressler GR. 2005. Nephrogenic factors promote differentiation of mouse embryonic stem cells into renal epithelia. J Am Soc Nephrol 16: 3527-3534.
Lee ST et al. 2007. Establishment of autologous embryonic stem cells derived from preantral follicle culture and oocyte parthenogenesis. Fertil Steril
88:1193 (Abstr).
Li M et al. 2003. Isolation and culture of embryonic stem cells from porcine blastocysts. Mol Reprod Dev 65:429-434.
Lin H. 2008. Cell biology of stem cells: an enigma of asymmetry and self-renewal.
The Journal of Cell Biology 180:257-260
Lin H et al. 2003. Multilineage potential of homozygous stem cells derived from metaphase II oocytes. Stem Cells 21:152-161.
Ma F et al. 2008. Generation of functional erythrocytes from human embryonic stem cell-derived definitive hematopoiesis. Proc Natl Acad Sci USA
105:13087-13092.
Malekshah AK, Moghaddam AE. 2005. Follicular fluid and cumulus cells synergistically improve mouse early embryo development in vitro. J Reprod Dev 51:195-199.
McDonald JW et al. 1999. Transplanted embryonic stem cells survive, differentiate and promote recovery in injured rat spinal cord. Nature Med 5:1410-1412.
Memili E et al. 2007. Bovine germinal vesicle oocyte and cumulus cell proteomics. Reproduction 133:1107-1120.
Nishimura F et al. 2003. Potential use of embryonic stem cells for the treatment of mouse parkinsonian models: improved behavior by transplantation of in vitro differentiated dopaminergic neurons from embryonic stem cells.
Stem Cells 21:171-180.
Park S-P et al. 2004. Establishment of human embryonic stem cell lines from frozen-thawed blastocysts using STO cell feeder layers. Hum Reprod 19: 676-684.
Reubinoff BE et al. 2000. Embryonic stem cell lines from human blastocysts: somatic differentiation in vitro. Nat Biotech 18:399-404.
Roche E, Sepulcre P, Reig JA, Santana A, Soria B. 2005. Ectodermal commitment of insulin-producing cells derived from mouse embryonic stem cells. The FASEB Journal 19:1341-1343.
Rodriguez-Gomez et al. 2007. Persistent dopamine functions of neurons derived from embryonic Stem cells in a rodent model of parkinson disease. Stem Cells 25:918-928.
Rossant J. 2001. Stem cells from the mammalian blastocyst. Stem Cells 19:477-482.
Sameer M, Balasubramanyam M, Mohan V. 2006. Stem cells and diabetes.
Current Science 91:1158-1165.
Snykers S, Kock JD, Rogiers V, Vanhaecke T. 2009. In vitro differentiation of embryonic and adult stem cells into hepatocytes: state of the art. Stem Cells 27:577–605
Soria B et al. 2000. Insulin-secreting cells derived from embryonic stem cells normalize glycemia in streptozotocin-induced diabetic mice. Diabetes
49:157-162.
Stojkovic M et al. 2004. Derivation of human embryonic stem cells from day-8 blastocysts recovered after three-step in vitro culture. Stem Cells 22:790– 797.
Sukhikh GT, Shtil AA. 2003. Stem cell transplantation for treatment of liver deseases: from biological foundation to clinical experience. International J molecular Medicine 11:395-400.
Tesar PJ. 2005. Derivation of germ-line-competent embryonic stem cell lines from preblastocyst mouse embryos. Proc Natl Acad Sci USA 102:8239-8244.
Thomson JA et al. 1998. Embryonic stem cell line from human blastocysts.
Science 282:1145-1147.
Tielens S et al. 2006. Generation of embryonic stem cell lines from mouse blastocysts developed in vivo and in vitro: relation to Oct-4 expression.
Reproduction 132: 59–66.
Yang D, Zhang Z-J, Oldenburg M, Ayala M, Zhang S-C. 2008. Human embryonic stem cell-derived dopaminergic neurons reverse functional deficit in parkinsonian rats. Stem Cells 26:55–63.
Perkembangan Embrionik Praimplantasi pada Mencit
Sebelum terjadi pembuahan, oosit akan membelah secara meiosis dan
mengalami pematangan dalam folikel ovarium hingga ia mencapai stadium
metafase II. Pada saat tersebut, folikel akan melepas oosit kedalam saluran telur.
Oosit matang merupakan sel haploid yang mengandung setengah jumlah
kromosom, yang dikelilingi oleh matriks ektraseluler dan glikoprotein yang
disebut zona pelusida. Jika terjadi perkawinan, oosit yang terdapat dalam saluran
telur akan dibuahi oleh sperma, dimana terjadi fusi antara pronukleus sperma
dengan pronukleus oosit, dan mengembalikan jumlah kromosom yang khas
untuk setiap spesies.
Pada kondisi alamiah, proses pembuahan terjadi di dalam ampula saluran
telur. Setelah mengalami beberapa proses pembelahan, genome zigot menjadi aktif dan mengontrol perkembangan embrionik selanjutnya (Jones & Thomson
2000). Selama proses pembelahan awal, sel-sel anak (blastomer) tidak
mengalami pertambahan ukuran. Seiring dengan kemajuan pembelahan sel
(cleavage), jumlah sitoplasma dari setiap sel anak berkurang setengahnya, dan total volume embrio tetap tidak berubah (Pelton et al. 1998).
Pada stadium delapan sel, embrio mencit mulai mengalami kompaksi,
dimana terdapat gap junction antar sel. Struktur membran yang spesial ini terdiri atas suatu susunan enam molekul protein yang disebut connexins, yang membentuk pori yang memungkinkan pertukaran ion dan molekul-molekul kecil
antar sel (Johnson et al. 1986). Proses pembelahan terus berlanjut dan menghasilkan morula. Selanjutnya diantara sel-sel morula akan terbentuk rongga
yang berisi cairan yang disebut blastosul, dan embrio pada stadium ini disebut
blastosis (Beddington & Robertson 1999). Blastosis tersusun oleh dua tipe sel
yaitu trofoblas yang terdapat pada bagian luar dan ICM pada bagian dalam.
Pada perkembangan selanjutnya, ICM akan berkembang menjadi semua tipe sel
yang menyusun jaringan tubuh embrio, dan juga jaringan nontrofoblas yang
menunjang perkembangan embrio (jaringan ekstraembrionik, termasuk kantung
kuning telur, allantois dan amnion), sedangkan trofoblas akan berkembang
menjadi plasenta (Jones & Thomson 2000, Johnson & McConnell 2004). Oleh
karena itu, trofoblas sangat penting untuk implantasi dan menunjang daya hidup
dan pertumbuhan embrio di dalam uterus. Gangguan perkembangan plasenta
Kejadian molekuler yang mendasari perbedaan galur sel belum diketahui
secara pasti. Namun, beberapa studi menunjukkan bahwa POU-domain transcription factor Oct4 (Pou5f1), esensial untuk perkembangan ICM. Pada mencit, Oct4 diekspresikan selama oogenesis dan perkembangan praimplantasi, dan pada perkembangan selanjutnya hanya terbatas diekspresikan oleh ICM,
epiblas, dan sel-sel germinal (Palmieri et al. 1994). Pada blastosis manusia, baik ICM maupun trofoblas mengekspresikan Oct4, tetapi dengan konsentrasi 31 kali
lebih tinggi pada ICM (Hansis et al. 2000). Embrio yang kekurangan Oct4 tidak dapat menghasilkan ICM, dan hanya dapat menghasilkan sel trofoblas (Nichols
et al. 1998), dengan demikian, Oct4 sangat diperlukan untuk perkembangan ICM. Ada beberapa transcription factor seperti Mash2 (Rossant et al. 1998), dan
Cdx2 (Beck et. al. 1995), yang pola ekspresinya bertentangan dengan Oct4; dimana mereka diekspresikan sepanjang perkembangan awal, tetapi pada
embrio stadium blastosis hanya diekspresikan oleh trofoblas. Cdx2 dan Eomes
diperlukan untuk perkembangan awal trophoblas, dan Mash2 dilibatkan dalam perkembangan plasenta selanjutnya (Guillemot et al. 1994).
Embrio Partenogenetik
Partenogenesis merupakan suatu fenomena biologis dimana
perkembangan embrionik diinisiasi tanpa melewati proses pembuahan oleh
sperma. Pola reproduksi ini umum terjadi pada beberapa ikan, burung dan reptil.
Mamalia tidak dapat bereproduksi secara partenogenesis yang disebabkan oleh
adanya kegagalan kebuntingan. Embrio partenogenetik mengalami
perkembangan tidak normal dan perkembangan terhenti setelah terjadi
organogenesis hari ke-10 pada mencit (Kono et al. 2004), hari ke-25 pada domba (Loi et al. 1998), dan hari ke-67 pada sapi (Boediono et al. 1995). Kegagalan kebuntingan tersebut ada kaitannya dengan genomic imprinting, dimana semua materi genetik berasal dari betina dan tidak ada kontribusi jantan.
Hal ini berakibat pada tidak berkembangnya trofoblas dan jaringan
ekstraembrionik-endoderm. Walaupun mamalia tidak dapat bereproduksi secara
partenogenesis, namun oositnya dapat diinduksi untuk menghasilkan embrio
partenogenetik menggunakan berbagai rangsangan fisik dan kimia.
Pada saat ovulasi, oosit mamalia tertahan pada stadium metafase dari
pembelahan meiosis II. Penahanan meiosis ini dipertahankan oleh aktivitas
melanjutkan meiosis dan perkembangan melewati meiosis ke metafase II. Pada
saat keluar dari M-phase, terjadi degradasi cyclin yang menyebabkan inaktivasi MPF. Pada oosit mencit, penahanan meiosis dapat dipertahankan selama
beberapa jam selama ada sintesis dan degradasi yang seimbang dari cyclin B, dan keseimbangan tersebut diregulasi oleh CSF yang merupakan produk dari
protoontogene c-mos, cdk2, dan MAP kinase (Zernicka-Goetz et al. 1995). Selama penahanan meiosis, status inti tidak berubah, tetapi sitoplasma
mengalami perubahan viabilitas, kemampuan fertilisasi dan kemampuan untuk
aktivasi partenogenesis seiring dengan pertambahan umur oosit (Kikuchi et al.
1995).
Aktivasi oosit oleh sperma atau secara partenogenesis akan
menyebabkan peningkatan kalsium intraseluler. Pola pelepasan kalsium pada
oosit hasil aktivasi partenogenesis berlangsung dalam waktu yang relatif pendek
dibandingkan dengan hasil aktivasi spermatozoa yang berlangsung tiga hingga
empat jam (sejak fertilisasi hingga pembentukan pronukleus) (Jones et al. 1995, Zernicka-Goetz et al. 1995).
Peningkatan kalsium intraseluler disebabkan oleh adanya aktivasi
produksi diacylglycerol (DG) dan inositol 3-phosphate (IP3) yang diinduksi G-protein melalui phospholipase C (PLC). Peningkatan kalsium intraseluler kemudian merangsang peningkatan aktivitas protein kinase C (PKC) pada oosit mencit, yang selanjutnya menginduksi eksositosis butiran korteks (Ito et al.
2003). Selain itu, peningkatan ion kalsium menyebabkan aktivasi calmodulin-dependent protein kinase II yang berfungsi menstimulasi destruksi cyclin B, dan inaktivasi p34cdc2 kinase. Dengan terjadinya degradasi cyclin B dan p34cdc2 kinase maka MPF akan mengalami destruksi sehingga oosit melanjutkan kembali siklus
sel-nya (Ito et al. 2003). Karakteristik oosit yang teraktivasi adalah adanya eksositosis butiran korteks, pengeluaran polar body II, pembentukan pronukleus dan pembelahan mitosis pertama (Gordo et al. 2002).
Oosit mamalia dapat mengalami partenogenesis in vitro dengan keberhasilan yang bervariasi. Oosit yang mengalami aktivasi akan menunjukkan
respon biokimiawi mirip dengan respon yang terjadi pada oosit yang mengalami
proses fertilisasi. Respon oosit yang diaktivasi ditunjukkan dengan terjadinya
peningkatan konsentrasi kalsium intraseluler yang dianggap sebagai sinyal untuk
terjadinya pembelahan meiosis. Namun demikian, embrio partenogenetik yang
dihasilkan tidak mengalami perkembangan normal dan perkembangan terhenti
Aktivasi partenogenetik dipengaruhi oleh umur oosit, dimana oosit yang
relatif lebih tua lebih sensitif terhadap perlakuan aktivasi in vitro (Otaegui et al.
1999, Meo et al. 2004). Hal ini ada kaitannya dengan penurunan secara gradual level MPF pada oosit tua (Tian et al. 2002). MPF menginduksi M-phase pada sel-sel eukaryotik, termasuk oosit. Aktivitas MPF yang tinggi dapat dideteksi pada
oosit mamalia metafase I dan II, dan semakin menurun dengan bertambahnya
umur oosit (Kikuchi et al. 2000). Studi pada tikus Wistar menunjukkan bahwa untuk aktivasi partenogenetik lebih efektif pada oosit tua (Krivokharchenko et al.
2003, Mizutani et al. 2004 ).
Aktivasi partenogenesis dapat dilakukan dengan memaparkan oosit
terhadap calcium ionophore A23187 (Kline & Kline 1992), strontium chloride
(Meo et al. 2004), etanol (Pinyopummin et al. 1993, Moos et al. 1995, Loi et al.
1998), ionomycin (Loi et al. 1998), atau stimulasi elektrik (Mizutani et al. 2004).
Strontium chloride merupakan bahan kimia yang sangat populer untuk aktivasi partenogenetik oosit mencit. Pemaparan oosit mencit kedalam medium yang
disuplementasi dengan 1.6 mM strontium chloride selama 2-10 menit menginduksi kejadian partenogenesis yang tinggi. Ketika oosit diinkubasi dalam
strontium selama 20-60 menit, terjadi penurunan tingkat aktivasi dan peningkatan
jumlah oosit yang berdegenerasi(O'Neill et al. 1991).
Bahan aktivasi partenogenesisi harus dikombinasikan dengan
cycloheximide (protein synthesis inhibitor), 6-dimethylaminopurine [6-DMAP,
protein phosphorylation inhibitor (Mizutani et al. 2004)], atau cytochalasin. Walaupun terjadi peningkatan pembentukan pronukleus, penghambatan sintesis
atau fosforilasi protein dapat memberikan efek yang merugikan bagi
perkembangan embrio yang disebabkan oleh adanya penghambatan sintesis
DNA pada oosit sapi (Ito et al. 2003).
Cytochalasin merupakan produk yang dihasilkan oleh jamur dengan berbagai metabolit seperti cytochalasin A, B, C, dan D, yang berfungsi untuk mencegah polimerisasi aktin dan menyebabkan perubahan yang dramatis pada
sitoskeleton, khususnya filamen aktin (Kim et al. 1997). Pemberian cytochalasin
selama pembelahan sel tidak akan mengganggu pergerakan kromosom
(kariokinesis), tetapi menghambat pemisahan sel-sel anak (sitokinesis).
Embryonic Stem Cells
Embryonic stem cells adalah sel-sel pluripoten yang mampu berdiferensiasi menjadi berbagai tipe sel tubuh. Embryonic stem cells umumnya dihasilkan dari ICM blastosis, yang dalam kultur in vitro tetap mempertahankan
self renewal (proliferasi untuk menghasilkan sejumlah sel anak yang sama persis dengan sel asalnya) dan dapat berdiferensiasi menjadi berbagai tipe sel tubuh.
Sifat pluripotensi tersebut telah menarik perhatian para peneliti untuk
menggunakan ESC dalam terapi sel pada jaringan atau organ yang mengalami
kerusakan (Darr & Benvenisty 2006, Biswas & Hutchins 2007).
Pluripotensi ESC diregulasi oleh kombinasi faktor eksogen dan endogen.
Yang termasuk faktor eksogen diantaranya adalah leukemia inhibitory factor
(LIF), transforming growth factor (TGF), fibroblast growth factor (FGF), dan Wnt (Wingsless-type MMTV integration site family members). Pluripotensi dan self renewal ESC mencit dapat dipertahankan ketika dikultur pada MEF yang mensekresikan suatu faktor penghambat diferensiasi, LIF. Leukemia inhibitory factor mempengaruhi tingkat proliferasi sel dengan mengaktivasi jalur sinyal yang dapat mengatur ekspresi gen pada sel pluripoten atau sel-sel yang telah
berdiferensiasi. Pengeluaran LIF dari medium kultur memicu hilangnya marker
pluripoten dan munculnya marker diferensiasi dalam 24 jam (Prockop 2006).
Leukemia inhibitory factor termasuk anggota interleukin-6 (IL6) family, yang setelah terikat pada reseptornya (LIFR), kompleks tersebut mengalami
heterodimerisasi dengan gp130 dan mengaktivasi janus associated tyrosine kinase (JAK), yang selanjutnya mengaktivasi jalur sinyal signal transducer and activator of transcription-3 (STAT3) untuk menginduksi transkripsi berbagai gen yang bertanggung jawab dalam self renewal (Niwa et al. 1998, Burdon et al.
1999). Signal transducer and activator of transcription-3 meregulasi pluripotensi dan self renewal ESC melalui empat mekanisme : 1) mempertahankan ekspresi beberapa gen spesifik yang dilibatkan dalam pluripotensi ESC, 2) meregulasi
siklus sel ESC, 3) menghambat transduksi sinyal yang menyebabkan diferensiasi
ESC seperti ERK (extracellular signal-regulated kinase), 4) mempertahankan level transkripsi Myc yang stabil, sebagai salah satu faktor utama yang dapat mempertahankan self-renewal ESC mencit. Tidak seperti pada ESC mencit, LIF tidak efektif untuk mempertahankan pluripotensi dan self renewal ESC manusia.
SMAD1/5 (Sma and MAD (mothers agains decapentaplegic) related protein-1/5), yang mentranduksi bone morphogenic protein (BMP) dan growth differentiation factor (GDF) melalui reseptor activin receptor-like kinase-1 (ALK1), ALK2, ALK3, dan ALK6. Transforming growth factor- /activin/nodal diregulasi melalui SMAD 2/3 yang selanjutnya mengaktivasi ALK4, ALK5, dan ALK7. Setelah mengalami
fosforilasi dan mengadakan kompleks dengan SMAD4, SMAD berpindah ke
dalam inti dan bergabung dengan faktor transkripsi yang lain untuk meregulasi
ekspresi gen yang bertanggung jawab dalam mempertahankan pluripotensi
(Besser 2004, James et al. 2005, Xiao et al. 2006).
Fibroblast growth factor 2 (FGF2) merupakan faktor lain yang menunjang
self renewal pada ESC. Fibroblast growth factor 2 eksogen mampu mempertahankan ESC manusia dalam ketidak-hadiran serum atau feeder layer. Pengikatan FGF ke reseptornya menyebabkan autofosforilasi reseptor dan
aktivasi berbagai jalur sinyal intraseluler seperti Ras/ERK (extracellular signal-regulated kinase), PLC- (phospholipase C- )/calcium, dan phospho-inositide 3-kinase (PI3K). Phospho-inositide 3-kinase mengkatalisis konversi phosphatidyl-inositol 3,4,-bisphosphate (PIP2) menjadi phosphatidylinositol 3,4,5-triphosphate (PIP3). Pengikatan PIP3 pada PH domain menyebabkan Akt berpindah ke membran plasma, yang selanjutnya difosforilasi dan diaktivasi oleh phosphor
-inositide-dependent kinase-1 (PDK-1). Akt yang teraktivasi merangsang proliferasi dan pluripotensi ESC. Selain itu Aktivasi PI3k/Akt diperlukan untuk
meningkatkan ekspresi protein matriks ekstraseluler (Xiao et al. 2006, Conley et al. 2007, Wang et al. 2005, Xu et al. 2005).
Wnt juga berperan penting dalam mempertahankan pluripotensi ESC.
Jalur sinyal Wnt melibatkan pengikatan Wnt pada frizzled receptor. Pengikatan Wnt pada reseptornya menyebabkan aktivasi Dishevelled (Dsh) dan mencegah degradasi -Catenin. Wnt juga dapat menyebabkan degradasi proteosomal yang
tersusun dari glycogen synthase kinase-3 (GSK3 ), adeomatosis polyposis coli
(APC) dan casein kinase I (CKI). Pada kondisi fisiologis, -catenin difosforilasi dan selanjutnya didegradasi oleh GSK3 . Oleh karena itu, degradasi GSK3
akan menyebabkan akumulasi -catenin dalam sitoplasma, dan selanjutnya
berpindah ke dalam inti sel (Barker et al. 2000, Bienz & Clever 2003, Reya & Clevers 2005). Di dalam inti, -catenin mengaktivasi T cell factor (TCF)/
lymphoid enhancer factor (LEF) protein yang selanjutnya menginduksi ekspresi berbagai gen yang berperan dalam mempertahankan pluripotensi ESC seperti
Selain faktor eksogen, terdapat beberapa faktor endogen yang
mempengaruhi pluripotensi ESC, diantaranya adalah Oct4 (octamer binding protein-4) dan Nanog. Octamer binding protein-4 memainkan peranan penting dalam perkembangan embrio, dan sekaligus sebagai marker pluripotensi.
Octamer binding protein-4 diekspresikan oleh oosit, ICM dan epiblas embrio pra-gastrulasi, dan juga pada primordial germ cells (Palmieri 1994). Dalam lingkungan in vitro, Oct4 hanya diekspresikan oleh sel-sel yang belum berdiferensiasi (Niwa 2001). Embryonic stem cells yang kekurangan Oct4 akan berdiferensiasi menjadi sel trofoblas, sedangkan ESC yang kelebihan Oct4 akan berdiferensiasi menjadi sel endoderm. Walaupun demikian, tanpa faktor
eksogen, Oct4 tidak dapat mempertahankan pluripotensi ESC (Hay et al. 2004). Studi pada mencit dan manusia menunjukkan bahwa Oct4 adalah komponen
faktor transkripsi yang mempertahankan pluripotensi pada ESC (Loh et al. 2006).
Octamer binding protein-4 dapat terikat secara langsung pada promoternya atau melakukan heterodimer dengan beberapa faktor seperti ELA, Sox2, dan Rox1,
untuk meregulasi ekspresi gen fgf-4, Utf-1, Opn, Zfp42/Rex1, dan Etn052.
Faktor endogen lainnya yang mempengaruhi pluripotensi adalah Nanog.
Selama perkembangan embrio, Nanog diekspresikan pada ICM, epiblas, dan
ectoderm. Dalam lingkungan in vitro, Nanog diekspresikan pada ESC, primordial germ cell dan embryo carcinoma cell. Nanog tidak ditemukan pada hematopoietic stem cells, fibroblas, jaringan dewasa, dan ESC yang telah berdiferensiasi (Hyslop et al. 2005). Sel yang tidak mengandung Nanog mengekspresikan level yang tinggi beberapa faktor transkripsi seperti GATA6, GATA4, dan Cdx2, yang merupakan indikasi diferensiasi trofoblas (Bhattacharya et al. 2004, Hyslop et al.
2005). Hal ini menunjukkan bahwa Nanog mempertahankan pluripotensi ESC dengan menekan ekspresi faktor-faktor transkripsi tersebut.
Embryonic stem cell umumnya dihasilkan dari ICM blastosis. Sel-sel ICM bersifat pluripoten dan mampu berkembang menjadi semua tipe sel yang
menyusun ketiga lapisan jaringan embrionik (ektoderm, mesoderm, endoderm)
(Czyz et al. 2003). Sel-sel ini dapat diisolasi dari blastosis dan mempertahankan mereka dalam status tidak berdiferensiasi selama kultur in vitro (NIH 2004).
Embryonic stem cell mencit dapat dipertahankan dalam kultur in vitro ketika dikultur dalam medium yang mengandung faktor-faktor penghambat diferensiasi
setelah transfer ke blastosis. Ketika dikeluarkan dari feeder layer dan dikultur dalam suspensi, ESC membentuk embryonic bodies, yang dapat berkembang menjadi berbagai tipe sel yang menyusun ketiga lapisan jaringan embrionik
(Reubinoff et al. 2000) termasuk sel-sel germinal (Marques-Mari et al. 2009). Status diferensiasi ESC dapat dibuktikan dengan adanya kehilangan produk gen
yang khas yang dihasilkan oleh ESC seperti c-myc (Cartwright et al. 2005),
nanog (Chambers et al. 2003, Darr et al. 2006), eed (Ura et al. 2008), jmjd1a (Ko
et al. 2006) dan GABP , atau terbentuknya karakteristik yang khas untuk berbagai tipe sel.
Embryonic stem cell dapat mempertahankan komplemen kromosom yang stabil dan normal (NIH 2004), mempertahankan morfologi dan ekspresi gen yang
konsisten dengan sel-sel embrionik asalnya (Rathjen et al. 1998, Fair et al.
2005), membentuk teratocarcinoma setelah transplantasi in vivo, dan mampu berkontribusi menjadi semua jaringan tubuh termasuk germline pada hewan kimera (Prelle et al. 2002). Selain itu, ESC memiliki rasio yang tinggi antara inti terhadap sitoplasma, tumbuh dalam koloni multilayer yang kompak, menunjukkan aktivitas alkaline phosphatase, membentuk embryoid bodies ketika ditumbuhkan dalam kultur suspensi atau hanging drop (Alex et al. 2005).
Embryonic stem cells dapat berdiferensiasi menjadi sel-sel yang memproduksi insulin yang berguna dalam perlakuan diabetes. Embryonic stem cells yang ditransplantasikan ke mencit yang menderita diabetes dapat memulihkan regulasi insulin secara parsial (Lumelsky et al. 2001). Studi yang lain telah mendemonstrasikan bahwa ESC mencit dapat ditransplantasikan ke mencit
yang menderita penyakit Parkinson dan secara parsial menghilangkan gejala
tersebut. Embryonic stem cells mencit juga dapat ditransplantasikan ke hewan yang menderita spinal-cord injury dan secara parsial memulihkan fungsi syaraf (McDonald et al. 1999).
Selain diproduksi oleh embrio hasil fertilisasi, ESC juga dapat dihasilkan
oleh embrio partenogenetik. Penelitian tentang ESC partenogenetik masih relatif
sedikit dan hasilnya masih sangat rendah dan tidak konsisten antara penelitian.
Lee et al. (2007) berhasil memproduksi ESC dari embrio partenogenetik. Dari 193 oosit yang teraktivasi, hanya 35 yang berhasil berkembang hingga stadium
blastosis, dan satu diantaranya berhasil membentuk cell line. Lin et al. (2003), gagal menghasilkan cell line dari embrio partenogenetik manusia. Dari 14 oosit yang mendapat perlakuan calcium ionophore and 6-DMAP, 4 diantaranya
berkembang membentuk cell line. Pada 5 oosit yang diaktivasi dengan calcium ionophore and puromycin, hanya 1 oosit yang mencapai stadium morula,
sementara dari 6 oosit yang diaktivasi dengan sham ICSI dan calcium ionophore,
satu diantaranya berkembang hingga blastosis ekspan, dan setelah dilakukan
assisted hatching dan kultur, ESC yang dihasilkan mampu berproliferasi lebih dari dua pasase. Revazona et al. (2007) berhasil memproduksi ESC partenogenetik manusia yang dikultur pada medium VitroHES yang
disuplementasi dengan 4 ng/ml hrbFGF, 5 ng/mL hrLIF, dan 10% serum darah
talipusat.
Isolasi Inner Cell Mass
Tahap pertama sebelum dilakukan isolasi ICM adalahpenghilangan zona
pelusida yang membungkus blastosis sehingga sel-sel yang terdapat di
dalamnya dapat dengan leluasa berproliferasi dan berkontak langsung dengan
substrat yang digunakan. Penghilangan zona pelusida dapat dilakukan dengan
memaparkan embrio pada larutan pronase 0.25% selama 3 hingga 5 menit (Paz
et al. 2003). Penghilangan zona pelusida juga dapat dilakukan dengan cara mengkultur blastosis selama satu atau dua hari hingga blastosis tersebut secara
spontan keluar dari zona pelusida.
Isolasi dimaksudkan untuk memisahkan ICM dari trofoblas. Inner cell mass merupakan sel-sel yang belum berdiferensiasi dan memiliki potensi untuk membentuk semua jenis sel tubuh, sedangkan sel-sel trofoblas sudah
berdiferensiasi dan hanya berpotensi untuk membentuk selaput ekstraembrionik.
Hasil penelitian sebelumnya menunjukkan bahwa kultur blastosis utuh (ICM
bersama trofoblas) menghasilkan produksi ESC yang rendah. Beberapa metode
isolasi ICM yang telah dikenal adalah immunosurgery (Chen & Melton 2007), dan pembedahan mikro (Li et al. 2003, Park et al. 2004).
Pada studi yang dilakukan oleh Li et al. (2003), telah dibuat suatu metode yang lebih sederhana untuk isolasi ICM blastosis babi, yakni dengan
menempatkan embrio dalam larutan tripsin/ethylene diamine tetraacetic acid
(EDTA). Kunci yang paling penting dalam metode ini adalah perlakuan waktu.
Manipulator harus mengobservasi embrio-embrio dibawah mikroskop selama
perlakuan. Pada saat trofoblas mulai terpisah, perlakuan sebaiknya dihentikan
Feeder Layer
Feeder layer adalah kultur sel yang membentuk suatu lapisan monolayer
pada dasar cawan kultur yang berfungsi sebagai penghasil growth factor yang berperan dalam proliferasi sel lain. Sifat pluripotensi ESC mencit dapat
dipertahankan ketika dikultur dalam medium yang mengandung feeder layer, dimana ESC menunjukkan kapasitas proliferasi in vitro yang tidak terbatas (Smith 2001), serta mempertahankan kemampuan untuk berkontribusi menjadi
semua tipe sel setelah transfer ke blastosis. Feeder layer untuk kultur ESC umumnya dibuat dari MEF, dan berfungsi mensekresikan berbagai faktor yang
berperan dalam menstimulasi pertumbuhan ESC dan menghambat
diferensiasinya (Kitiyanant et al 2000, CLS 2002, Yang & Pettite 2004). Feeder layer sebaiknya berada dalam bentuk tidak aktif sehingga tidak dapat berpoliferasi, tetapi tetap berpotensi untuk menghasilkan growth factor yang menunjang proliferasi ESC (CLS 2002). Menurut Zhang et al. (2003) tingkat proliferasi MEF sangat ditentukan oleh umur fetus. Salah satu senyawa yang
terdapat dalam MEF adalah LIF yang berperan dalam menghambat proses
diferensiasi ESC (Kitiyanant et al. 2000). Leukemia inhibitory factor juga dikenal dengan nama differentiation inhibiting factor, merupakan sitokin polipeptida yang menghambat diferensiasi spontan dari ESC. Kadar LIF yang ditambahkan ke
dalam medium kultur ESC berkisar antara 500 hingga 1000 unit/ml (Hogan et al.
1994). Jumlah LIF yang terdapat dalam medium kultur yang dikondisikan dengan
feeder layer mencit adalah 500 unit/ml (Kitiyanant et al. 2000). Selain itu, feeder layer juga mengandung beberapa protein yang berperan dalam proses pertumbuhan sel (Lim & Bodnar 2002, Zhang et al. 2003).
Kelemahan penggunaan MEF sebagai feeder layer adalah mudah terkontaminasi dengan bakteri dan jamur terutama pada proses awal pembuatan,
proses pembuatan relatif lebih rumit dan panjang yang diawali dari persiapan
betina bunting, panen fetus, pencacahan bagian karkas menjadi
potongan-potongan kecil, tripsinasi untuk menghasilkan sel tunggal, sentrifugasi, dan
kultur. Selain itu MEF tidak dapat digunakan pada pasase pertama karena masih
bercampur dengan berbagai jenis sel yang lain, dan dengan demikian diperlukan
minimal dua pasaage untuk perbanyakan MEF yang akan digunakan untuk kultur ESC. Pada kultur ESC manusia, pengunaan MEF terbentur dengan masalah
Sel Kumulus
Sel kumulus adalah subset dari sel-sel granulosa, yang mengelilingi oosit
mamalia yang sedang berkembang dalam folikel de Graaf yang matang. Pada
saat pembentukan antrum folikel, populasi sel granulosa menjadi lebih
heterogen. Satu populasi sel yang dikenal sebagai mural granulosa
dihubungkan dengan dinding folikel, populasi lainnya dikenal sebagai sel
kumulus dihubungkan dengan oosit. Ketika perkembangan folikel berlanjut, sel
granulosa dan sel kumulus berkembang dengan karakteristik yang berbeda.
Misalnya, sesaat sebelum ovulasi, gonadotropin menstimulasi sel kumulus untuk
memproduksi dan mensekresikan hyaluronic acid yang berfungsi melekatkan sel kumulus pada matrik yang menyerupai mucus; sedangkan sel granulosa tidak
mengalami ekspansi tetapi berkembang menjadi sel luteal (Latham et al. 1999). Sel kumulus menciptakan lingkungan yang kondusif untuk pertumbuhan
dan perkembangan oosit sebelum ovulasi dan pembuahan oleh sperma (Hess et al. 1999). Beberapa studi menunjukkan bahwa massa kumulus melindungi oosit sebelum dan setelah pembuahan. Misalnya, Sato et al. (1987) menunjukkan bahwa komponen yang diproduksi oleh sel kumulus (seperti glycosaminoglycan)
dapat memperlambat proses degenerasi oosit selama kultur in vitro. Selain itu, kriopreservasi oosit bersama dengan kumulus memiliki angka fertilisasi yang
lebih tinggi daripada oosit yang dibekukan tanpa sel kumulus (Hess et al. 1999). Sel kumulus juga dapat melindungi oosit terhadap pengaruh negatif heat shock
yang dapat menurunkan sintesis protein oosit ( Edwards et al. 1996).
Malekshah dan Moghaddam (2005) melakukan evaluasi untuk
mengetahui pengaruh monolayer kumulus dan cairan folikel manusia terhadap
perkembangan embrio mencit in vitro. Jumlah embrio satu sel yang dapat berkembang ke stadium blastosis adalah 33.7% ketika dikultur pada kombinasi
sel kumulus dan cairan folikel. Jumlah tersebut jauh lebih tinggi dibandingan
dengan yang dikultur pada medium Ham’s F-10 yaitu 1.9%.
Dalam penelitian ini, sel kumulus digunakan sebagai feeder layer atau penghasil conditioned medium untuk kultur ESC. Sel kumulus mengekspresikan berbagai faktor seperti transforming growth factor- (TGF- ; Mulheron et al.
1992), activin A (Lau et al. 1999), Wnt2 dan -catenin (Wang et al. 2009),
(Levenstein et al. 2006, Ogawa et al. 2007, James et al. 2005, Miyabayashi et al.
2007). Sel kumulus telah terbukti dapat menunjang perkembangan embrio in vitro, namun belum ada laporan tentang penggunaannya sebagai feeder layer
untuk kultur ESC. Selain dapat menghasilkan feeder layer, sel kumulus juga dapat memproduksi conditioned medium (CM) yang dapat menunjang pertumbuhan ESC. Penggunaan CM dimaksudkan untuk menghindari terjadinya
percampuran antara ESC dengan feeder layer, dan dengan demikian kemurnian ESC dapat dipertahankan.
DAFTAR PUSTAKA
Alex JL, Sarathi DP, Goel S, Kumar S. 2005. Isolation and characterization of a mouse embryonic stem cell line that contributes efficiently to the germ line. Current Science 88: 1167-1169.
Barker N, Clevers H. 2000. Catenins, Wnt signaling and cancer. Bioassays
22:961-965 (Abstr).
Beck F, Erler T, Russell A, James R. 1995. Expression of Cdx-2 in the mouse embryo and placenta: possible role in patterning of the extra-embryonic membranes. Dev Dyn 204:219–227.
Beddington RS, Robertson EJ. 1999. Axis development and early asymetry in mammals. Cell 96:195-209.
Besser D. 2004. Expression of nodal, lefty-a, and lefty-B in undifferentiated human embryonic stem cells requires activation of Smad2/3. J Biol Chem
279:45076-45084.
Bhattacharya B et al. 2004. Gene expression in human embryonic stem cell lines: Unique molecular signature. Blood 103:2956-2964.
Bienz M, Clevers H. 2003. Armadillo/beta-catenin signals in the nucleus-proof beyond a reasonable doubt? Nat Cell Biol 5: 179-182 (Abstr).
Biswas A, Hutchins R. 2007. Embryonic stem cells. Stem Cells Dev 16:213-222. Boediono A,