SKRIPSI
PRODUKSI DAN KARAKTERISASI XILANASE MIKROBA YANG DIISOLASI DARI TONGKOL JAGUNG
Oleh: Inda Setyawati
F24102008
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
PRODUKSI DAN KARAKTERISASI XILANASE MIKROBA YANG DIISOLASI DARI TONGKOL JAGUNG
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh: Inda Setyawati
F24102008
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PRODUKSI DAN KARAKTERISASI XILANASE MIKROBA YANG DIISOLASI DARI TONGKOL JAGUNG
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh: Inda Setyawati
F24102008
Dilahirkan pada tanggal 24 Mei 1984 Di Sabang, Nanggroe Aceh Darussalam
Tanggal lulus: 4 September 2006
Menyetujui, Bogor, September 2006
Prof. Dr. Ir. Maggy T Suhartono Pembimbing Skripsi
Mengetahui,
Inda Setyawati. F24102008. PRODUKSI DAN KARAKTERISASI XILANASE MIKROBA YANG DIISOLASI DARI TONGKOL JAGUNG. Di bawah bimbingan Prof. Dr. Ir. Maggy T Suhartono, M.Sc.
RINGKASAN
Enzim penghidrolisis xilan melibatkan dua tipe utama yaitu endo-β -1,4-xilanase (EC. 3.2.1.8) dan β-xilosidase (EC. 3.2.1.37). Enzim-enzim tersebut bekerjasama menghidrolisis xilan (hemiselulosa) menjadi rantai pendek xilooligosakarida dan xilosa. Xilanase (enzim penghidrolisis xilan) merupakan salah satu enzim yang banyak dimanfaatkan secara luas dalam bidang industri pangan maupun non pangan serta mempunyai dampak positif terhadap lingkungan (clean processing). Xilan (hemiselulosa) yang merupakan substrat xilanase banyak terdapat pada tongkol jagung yaitu sebesar 40 %. Dalam penelitian ini dilakukan isolasi mikroorganisme pendegradasi xilan (hemiselulosa) yang terdapat pada tongkol jagung busuk. Selain itu tongkol jagung itu sendiri dimanfaatkan sebagai substrat kasar (crude) dari mikroorganisme yang diisolasi. Penelitian yang dilakukan merupakan salah satu upaya diversifikasi pemanfaatan produk samping hasil pengolahan jagung.
Penelitian dimulai dengan mengisolasi mikroba penghasil xilanase dari tongkol jagung busuk. Dari hasil pemilahan diperoleh 12 isolat mampu menghasilkan clearing zone pada media yang mengandung oat spelt xylan 0.7 %, salah satu diantaranya adalah isolat yang diberi kode MBXiK4 yaitu memiliki indeks xilanolitik cukup tinggi (5.81) dan aktivitas enzim yang tertinggi (5.29 U/ml (pengukuran I), 1.78 U/ml (pengukuran II)). Isolat lokal yang terbaik tersebut digunakan untuk optimasi kondisi produksi enzim, karakterisasi enzim xilanase dan β-xilosidase. Hasil optimasi produksi oleh isolat MBXiK4 menunjukkan aktivitas enzim tertinggi (11.59 U/ml) terjadi pada hari ketiga, konsentrasi tongkol jagung 1%, dengan kondisi pH 7 dan suhu 37oC. Hasil ini tidak berbeda jauh jika dibandingkan dengan menggunakan substrat oat spelt xylan 0.7 % yang menghasilkan aktivitas enzim tertinggi sebesar 11.37 U/ml pada pH 7 dan suhu 37oC.
RIWAYAT HIDUP
Penulis dilahirkan di Sabang pada tanggal 24 Mei 1984. Penulis adalah anak kedua dari tiga bersaudara pasangan Parsilan, S.Ip dan Yunniar. Penulis menyelesaikan pendidikan dasar di SDN Angkasa V pada tahun 1996, kemudian melanjutkan pendidikan di SMPN I Kalijati dan lulus pada tahun 1999. Pada tahun yang sama penulis melanjutkan pendidikan ke SMAN I Subang dan lulus pada tahun 2002. Selepas SMA penulis diterima di Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB) sebagai mahasiswa departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian.
KATA PENGANTAR
Syukur Alhamdulillah penulis panjatkan kehadirat Allah SWT atas rahmat dan karuniaNya sehingga penulis dapat menyelesaikan skripsi ini yang berjudul “Produksi dan Karakterisasi Xilanase Mikroba dari Tongkol Jagung”. Penelitian ini merupakan salah satu upaya diversifikasi produk samping hasil pengolahan jagung yang didanai oleh Bogasari Nugraha VIII, PT. Indofood Sukses Makmur Tbk. Penulis juga mengucapkan terimakasih kepada:
1. Prof. Dr.Ir. Maggy T Suhartono atas bimbingan, perhatian dan dorongan yang kuat selama penulis menjalani studi di Institut Pertanian Bogor.
2. Prof. Dr. Ir. Fransiska Zakaria, MSc. atas kesediannya meluangkan waktu untuk menguji dan memberikan saran dalam penulisan skripsi ini.
3. Dr. Ir. Budiatman Satiawihardja, M.Sc. atas kesediannya meluangkan waktu untuk menguji dan memberikan saran dalam penulisa skripsi ini.
4. Pihak Bogasari Nugraha, PT. Indofood Sukses Makmur Tbk., yang telah memberikan dana penelitian.
5. Orang-orang yang tercinta Mama, Bapak, Kak Pina, dan Dini atas kasih sayang, do’a dan pengorbanannya.
6. Teman-teman seperjuangan: Fenni dan Prasna.
7. Warga Lab. MB: Bu Sri, Bu Ika, Bu Lukie, Bu Rika, Bu Ummu, Bu Eni, Mbak Agnes dan yang lainnya. Terimakasih atas segala bantuan, diskusi dan masa-masa indah yang penulis jalani selama penelitian.
8. Team kelompok A2: Nisvi, Christ, Tina dan Fajar.
9. Teman-teman ITP’39: Oga, Mumus, Dhenok, Eva, Manginar, Novi, Sari, Hana, Dora, Ajeng, Fafa, Karen, Shinta, Nanda, Ribka, Didin, Bekti, Dadik dan semuanya yang tidak bisa penulis sebutkan satu per satu. Terimakasih atas bantuannya selama penulis menempuh studi serta kenangan manis selama di ITP.
10. Sahabat-sahabatku di Asrama A2: Ulung, Oqi, Dewi, Erisya, Mel, Indri dan Erna. Terimakasih untuk kesan pertama yang menyenangkan di IPB.
Anna, Hamtoh dan Nucy. Terimaksih atas atas dorongan dan masa-masa indah di kos.
11. Teknisi laboran ITP untuk semua bantuannya selama penulis menjalankan studi di ITP, IPB.
12. Pegawai di tata usaha yang telah banyak membantu penulis.
Bogor, September 2006
Penulis
DAFTAR ISI
Halaman
Kata Pengatar ... i
Daftar Isi ... iii
Daftar Tabel ... v
Daftar Gambar ... vi
Daftar Lampiran ... vii
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 2
B. TUJUAN DAN SASARAN ... 3
II. TINJAUAN PUSTAKA ... 4
A. HEMISELULOSA DAN XILAN ... 4
B. TONGKOL JAGUNG ... 7
C. ENZIM XILANOLITIK ... 8
D. MANFAAT ENZIM XILANASE ... 11
E. PRODUKSI XILANASE DARI MIKROORGANISME ... 13
F. MEDIA PERTUMBUHAN MIKROBA PENGHASIL XILANASE ... 16
D. REGULASI SINTESIS XILANASE ... 18
III. BAHAN DAN METODE ... 20
A. BAHAN DAN ALAT ... 20
B. TEMPAT DAN WAKTU PELAKSANAAN PENELITIAN ... 20
C. METODOLOGI PENELITIAN ... 21
1. Isolasi Mikroba dari Tongkol Jagung Busuk ... 21
2. Seleksi Isolat ... 22
3. Analisis Aktivitas Enzim Xilanase ... 23
4. Analisis Aktivitas β-Xilosidase ... 24
5. Penentuan Kadar Protein ... 25
6. Penentuan Kadar Gula Pereduksi ... 25
7. Analisis Proksimat Bahan Baku Tongkol Jagung ... 25
9. Optimasi Produksi Enzim ... 27
10. Pengendapan Enzim Xilanase dengan Amonium Sulfat ((NH4)2SO4 ... 28
11. Karakterisasi Enzim Xilanolitik ... 28
12. Analisis SDS-PAGE ... 29
IV. HASIL DAN PEMBAHASAN ... 31
A. ISOLASI DAN SELEKSI BAKTERI PENGHASIL XILANASE ... 31
B. HASIL UJI PROKSIMAT TONGKOL JAGUNG ... 34
C. OPTIMASI PRODUKSI ENZIM ... 34
1. Optimasi Produksi pada Media Oat Spelt Xylan ... 35
2. Pengaruh Konsentrasi Substrat, pH dan Suhu pada Media Tongkol Jagung ... 38
D. PEMEKATAN ENZIM XILANASE ISOLAT MBXiK4 ... 41
E. KARAKTERISASI ENZIM XILANOLITIK ISOLAT MBXiK4 .... 42
1. Penentuan pH Optimum ... 43
2. Penentuan Suhu Optimum ... 45
3. Stabilitas Suhu ... 47
F. ANALISIS SDS-PAGE ... 48
V. KESIMPILAN DAN SARAN ... 52
A. KESIMPULAN ... 52
B. SARAN ... 52
DAFTAR PUSTAKA ... 54
DAFTAR TABEL
Halaman
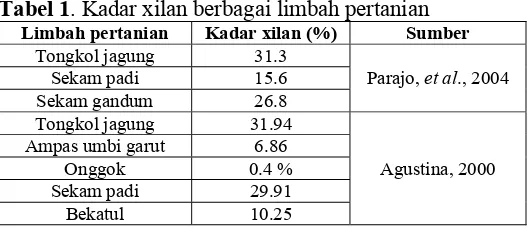
Tabel 1. Kadar xilan berbagai limbah pertanian ... 2
Tabel 2. Beberapa mikroorganisme penghasil xilanase ... 15
Tabel 3. Komposisi media pertumbuhan mikroorganisme penghasil xilanase ... 17
Tabel 4. Komposisi media pertumbuhan xilanase ... 21
Tabel 5. Aktivitas enzim xilanase berbagai isolat MBXiK4 ... 32
Tabel 6. Hasil uji proksimat tongkol jagung ... 34
Tabel 7. Hasil pengendapan amonium sulfat ... 42
Tabel 8. Marker untuk SDS-PAGE ... 49
Tabel 9. Penetapan berat molekul sampel ... 49
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur xilan dan enzim yang terlibat dalam hidrolisisnya ... 5
Gambar 2. Enzim xilanase dari Bacillus circulans (1XNB) ... 10
Gambar 3. Regulasi biosintesis xilanase ... 19
Gambar 4. Diagram alir pembuatan media ... 22
Gambar 5. Cacahan tongkol jagung ... 26
Gambar 6. Metode delignifikasi menggunakan NaOCl 1% ... 27
Gambar 7. (A) Berbagai isolat MBXi yang pada media oat spelt xylan, (B) Indeks xilanolitik berbagai isolat MBXi ... 31
Gambar 8. Koloni isolat MBXiK4 ... 33
Gambar 9. Kurva produksi xilanase harian oleh isolat MBXiK4 pada media oat spelt xylan ... 35
Gambar 10. Kadar gula pereduksi isolat MBXiK4 pada media oat spelt xylan ... 36
Gambar 11. Bobot biomassa isolat MBXiK4 pada media oat spelt xylan ... 37
Gambar 12. Kadar protein isolat MBXiK4 pada media oat spelt xylan ... 38
Gambar 13. Kurva produksi enzim harian isolat MBXiK4 pada berbagai konsentrsi tongkol jagung ... 39
Gambar 14. Pengaruh suhu dan pH terhadap produksi xilanase oleh isolat MBXiK4 pada media tongkol jagung 1% ... 41
Gambar 15. Pengendapan ekstrak kasar enzim xilanase dengan amonium sulfat ... 42
Gambar 16. Optimasi pH (A) aktivitas xilanase, (B) aktivitas β- xilosidase ... 44
Gambar 17. Optimasi pH (A) aktivitas relatif xilanase, (B) aktivitas relatif β-xilosidase ... 45
Gambar 18. Optimasi suhu (A) aktivitas xilanase, (B) aktivitas relatif β -xilosidase ... 46
Gambar 20. Hasil analisis SDS-PAGE. (A) Ekstrak hasil pengendapan amonium sulfat 50 % (b/v), (B) Ekstrak kasar enzim
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Metode Analisis Proksimat ... 59
Lampiran 2. Kurva Standar ... 64
Lampiran 3. Hasil Screening Isolat Penghasil Xilanase ... 66
Lampiran 4. Aktivitas Enzim Xilanase Berbagai Isolat MBXi ... 67
Lampiran 5. Kadar Protein dan Aktivitas Xilanase Spesifik Hasil pengukuran II ... 68
Lampiran 6. Hasil Uji Proksimat Tongkol Jagung ... 69
Lampiran 7. Aktivitas Xilanase pada Media Oat Spelt Xylan ... 71
Lampiran 8. Kadar Gula Pereduksi Supernatan Isolat MBXiK4 dan Bobot Biomassa pada Media Oat Spelt Xylan ... 72
Lampiran 9. Aktivitas Xilanase Isolat MBXiK4 pada Media Tongkol Jagung ... 73
Lampiran 10. Kadar Protein dan Aktivitas Spesifik Xilanase Isolat MBXiK4 pada Media Tongkol Jagung ... 74
Lampiran 11. Pengaruh pH dan Suhu Pertumbuhan Terhadap Aktivitas Xilanase Isolat MBXiK4 pada Media Tongkol Jagung 1%... 75
Lampiran 12. Karakterisasi Enzim Xilanase Isolat MBXiK4 ... 76
Lampiran 13. Karakterisasi Enzim β-Xilosidase Isolat MBXiK4 ... 78
I. PENDAHULUAN
A. LATAR BELAKANG
Xilan merupakan komponen hemiselulosa yang paling banyak ditemukan pada dinding sel tanaman. Sebagai biomassa yang dapat terbaharuhi (renewable) dan tersedia secara melimpah di alam, xilan mempunyai potensi yang sangat besar untuk dikembangkan menjadi produk akhir yang berguna. Oleh karena itu, selama dekade terakhir ini, potensi bioteknologi dari aplikasi xilan dan enzim penghidrolisis xilan (xilanase) telah menjadi perhatian utama dari para peneliti. Enzim penghidrolisis xilan melibatkan dua tipe utama yaitu endo-β-1,4-xilanase (EC. 3.2.1.8) dan β -xilosidase (EC. 3.2.1.37). Kedua enzim tersebut menghidrolisis xilan (hemiselulosa) menjadi rantai pendek xilooligosakarida dan xilosa.
Produksi enzim terutama xilanase belum ada di Indonesia. Xilanase belum banyak dikenal di kalangan pengusaha walaupun potensi pemanfaatannya sangat luas dan mempunyai dampak positif terhadap lingkungan (clean processing). Beberapa kendala produksi xilanase antara lain tidak tersedianya strain mikroorganisme unggul dan kurangnya pengetahuan tentang teknologi produksi enzim. Menurut pakar negara maju bahwa negara yang kaya akan keanekaragaman hayati, termasuk Indonesia merupakan sumber mikroorganisme maupun tanaman yang potensial untuk bioproses menghasilkan enzim (Richana, 2002).
Xilan yang merupakan substrat bagi enzim xilanase banyak dijumpai pada tanaman-tanaman tahunan dan khususnya limbah-limbah pertanian seperti tongkol jagung, bagas tebu, jerami padi, dedak gandum, dan biji kapas. Kandungan xilan dalam tongkol jagung adalah yang tertinggi diantara limbah-limbah pertanian lainnya, yaitu dapat mencapai 40g/100g (Yang, et al., 2005), 31.3 % (Parajo, et al., 2004), 31.94 % (Agustina, 2000). Kadar xilan dalam berbagai limbah industri pertanian dapat dilihat pada Tabel 1. Tingginya kadar xilan dalam tongkol jagung tersebut berpotensi untuk mendapatkan strain mikroorganisme penghasil enzim xilanase dari tongkol jagung busuk. Penelitian ini juga memanfaatkan tongkol jagung itu sendiri sebagai substrat kasar (crude) dari mikroorganisme yang diisolasi. Penggunaan tongkol jagung sebagai substrat kasar tersebut merupakan salah satu upaya yang efektif untuk menghasilkan enzim xilanase dalam skala industri besar, karena penggunaan substrat sintetik akan meningkatkan biaya produksi.
Tabel 1. Kadar xilan berbagai limbah pertanian
Limbah pertanian Kadar xilan (%) Sumber
Tongkol jagung 31.3
Parajo, et al., 2004 Sekam padi 15.6
Sekam gandum 26.8 Tongkol jagung 31.94
Agustina, 2000 Ampas umbi garut 6.86
Onggok 0.4 % Sekam padi 29.91
Potensi pemanfaatan tongkol jagung untuk bioproses industri enzim juga didukung oleh semakin banyaknya limbah tongkol jagung yang dihasilkan akibat penggunaan jagung sebagai bahan pangan dan pakan meningkat. Berdasarkan catatan pada tahun 2005, produksi jagung di Indonesia sangat tinggi yaitu sebanyak 12,52 juta ton pipilan kering, naik sebesar 1.30 juta ton (11.57 %) dibandingkan dari produksi jagung tahun 2004 (Anonim, 2006b). Dari total 12,52 juta ton jagung pipilan yang diproduksi di Indonesia pada tahun 2005, dapat diperkirakan banyak sekali limbah tongkol jagung yang dihasilkan. Oleh karena itu perlu adanya pemanfaatan tongkol jagung secara intensif untuk meningkatkan nilai ekonomisnya dan tidak terbuang begitu saja sebagai limbah.
B. TUJUAN DAN SASARAN
II. TINJAUAN PUSTAKA
A. HEMISELULOSA DAN XILAN
Hemiselulosa merupakan salah satu komponen lignoselulosa penyusun dinding sel tanaman, selain selulosa dan lignin. Perbedaan selulosa dan hemiselulosa adalah rantai molekulnya yang lebih pendek dan dari percabangan rantai molekul. Rantai utama hemiselulosa dapat terdiri dari satu jenis monomer (homopolimer), seperti xilan, namun ada juga yang terdiri dari dua unit atau lebih monomer (heteropolimer), seperti glukomanan. Beberapa unit monomer penyusun rantai utama sering tersubtitusi oleh gugus samping yang merupakan percabangan rantai molekul, seperti asam 4-0-metilglukuronat, galaktosa, dan sebagainya (Fengel & Wegener, 1989). Monomer-monomer penyusun hemiselulosa adalah gula-gula anhidro, yang terdiri dari heksosa (manosa, glukosa, galaktosa), pentosa (xilosa, arabinosa), asam heksuronat dan deoksi heksosa.
Menurut Wenzl (1990), komponen-komponen monomer hemiselulosa dapat dibagi dalam beberapa tipe sebagai berikut :
1. Glukomanan, yaitu hemiselulosa dimana monomer penyusunnya terdiri dari β-D-glukopiranosa dan β-D-manopiranosa.
2. Arabinogalaktan, yaitu hemiselulosa dimana monomer penyusunnya adalah β-D-galaktopiranosa dan α-L-arabinosa.
3. Xilan, yaitu hemiselulosa dimana monomer penyusunnya adalah β -D-xilopiranosa.
Secara umum, rantai utama xilan terdiri dari unit D-xilopiranosa yang dihubungkan oleh ikatan β-(1,4)-D-glikosidik. Struktur xilan semacam ini dapat ditemukan pada kayu keras, kayu lunak, dan rumput-rumputan. Namum ada juga xilan yang rantai utamanya dihubungkan oleh ikatan β -(1,3)-D-glikosidik, yaitu pada tanaman alga laut. Struktur xilan tersebut memiliki bentuk fibrillar yang lebih kristalin dan tidak terikat dengan molekul selulosa. Pada rumput laut tertentu, seperti Palmaria palmata, struktur rantai utama xilannya merupakan gabungan ikatan β-(1,3)-D-glikosidik dan β -(1,4)-D-glikosidik (Tuohy, et al., 1995).
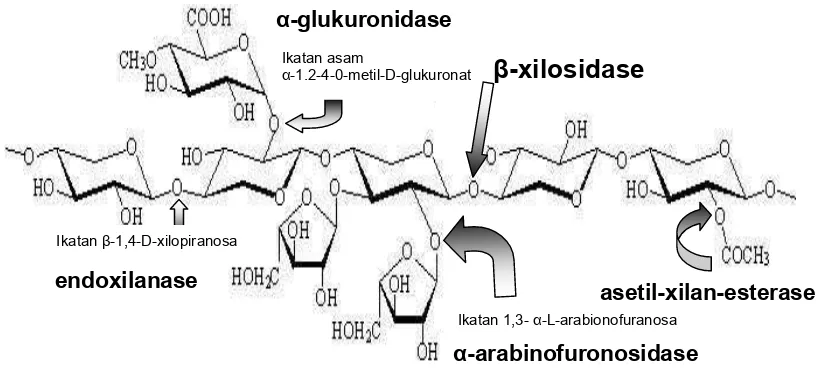
Rantai utama xilan sering tersubtitusi oleh α-L-arabinofuranosa yang terikat pada karbon nomor tiga dari gugus xilosa, D-glukuronat atau 0-2-metil-D-glukuronat yang terikat pada karbon nomor dua dari gugus xilosa. Beberapa dari gugus xilosanya kadang-kadang terasetilisasi. Interaksi xilan dengan lignin, selulosa dan polimer lainnya dihubungkan oleh ikatan kovalen dan non kovalen. Lignin yang merupakan senyawa yang melingkupi xilan terikat secara esterifikasi pada residu asam 4-0-metil-D-glukuronat (Subramaniyan dan Prema, 2002). Struktur xilan terlihat pada Gambar 1.
Gambar 1. Struktur xilan dan enzim yang terlibat dalam hidrolisisnya
Ikatan 1,3- α-L-arabionofuranosa
α-glukuronidase Ikatan asam
α-1.2-4-0-metil-D-glukuronat
β
-xilosidase
Ikatan β-1,4-D-xilopiranosa
endoxilanase
Selain karakteristik ikatan glikosidik yang menghubungkan unit D-xilopiranosa dalam rantai utamanya, gugus samping yang tersubtitusi pada rantai utama xilan juga berbeda-beda untuk setiap tanaman. Struktur xilan kayu keras disubtitusi oleh 10 % gugus asam 4-0-metilglukuronat dan 70 % dari unit-unit xilosanya disubtitusi oleh gugus 0-asetil. Oleh karena itu struktur xilan kayu keras membentuk molekul 0-asetil-4-0-metilglukuronoxilan (Tuohy, et al., 1995). Derajat polimerisasi rantai-rantai utama xilan kayu keras bervariasi antara sekitar 100 dan 200 tergantung pada spesies kayu dan cara isolasi. Di samping unit-unit utama, xilan kayu keras hanya mengandung sejumlah kecil rhamnosa dan asam galakturonat. Gugus rhamnosa dan asam galakturonat tersebut ada yang terikat pada ujung pereduksi xilan. Hal ini menyebabkan molekul xilan tahan terhadap alkali, karena asam galakturonat membuatnya stabil setelah unit pereduksi dari xilosa dihilangkan.
Berbeda dengan xilan kayu keras, xilan kayu lunak membentuk struktur arabino-4-0-metilglukuronoxilan. Derajat polimerisasi lebih dari 120 unit dan secara umum tidak terasetilisasi. Xilan kayu lunak memiliki gugus 4-0-metilglukuronosil lebih banyak dibandingkan xilan kayu keras. Perbandingan rata-rata unit gula yang menyusun xilan kayu lunak adalah 100 : 20 : 13 (xilosa : 4-0-metilglukuronat : arabinosa). Xilan dari tanaman rumput-rumputan dan sereal juga membentuk struktur arabino-4-0-metilglukuronoxilan, akan tetapi memiliki derajat polimerisasi yang lebih rendah yaitu sekitar 70. Struktur xilannya tersubtitusi oleh gugus asam 4-0-metilglukuronat yang lebih sedikit jika dibandingkan dengan xilan kayu keras, sedangkan gugus α-L-arabinosilnya lebih banyak. Xilan dari tanaman rumput-rumputan juga terasetilasi, yaitu sekitar 2-5% dari berat kering (Tuohy et al., 1995).
extended ribbon. Twofold extended ribbon β-(1,4)-D-xilan dilaporkan memiliki struktur yang lebih fleksibel dibandingkan dengan β-(1,4)-D-selulosa yang membentuk twofold helix. Hal ini dikarenakan hanya satu ikatan hidrogen yang mampu dibentuk oleh residu xilosil pada xilan dibandingkan dengan selulosa, yaitu dapat membentuk dua ikatan hidrogen pada residu glukosilnya (Subramaniyan dan Prema, 2002).
B. TONGKOL JAGUNG
Tongkol jagung adalah tempat pembentukan lembaga dan gudang penyimpanan makanan untuk pertumbuhan biji jagung. Tongkol jagung tersebut merupakan modifikasi dari cabang dan mulai berkembang pada ruas-ruas batang dengan diameter 3-5 cm. Umumnya jagung mengandung kurang lebih 30 % tongkol jagung sedangkan sisanya adalah kulit dan biji. Menurut Maynard dan Loosli (1993) komposisi kimia tongkol jagung terdiri dari 35,5 % serat kasar, 2.5 % protein, 0.12 % kalsium, 0.04 % fosfor dan zat-zat lainnya sebesar 38.16 %. Lebih lanjut Irawadi (1992) menyatakan bahwa tongkol jagung mengandung selulosa (40 %), hemiselulosa (36 %), lignin (16 %) serta zat-zat lainnya sebesar 6 %.
Komposisi kimia oat spelt xilan mengandung 15 % asam glukuronat, 10 % arabinosa dan 75 % xilosa, sedangkan komposisi kimia birch wood xylan mengandung 90 % xilosa dan mengandung sedikit gugus cabang (Kubata et al., 1994). Potensi pemanfaatan xilan dari tongkol jagung yang telah dilakukan adalah untuk produksi xilooligosakarida (Yang, et al., 2005) dan produksi enzim xilanase non selulase (Damaso, et al., 2002). Xilan dari tongkol jagung juga dilaporkan sebagai salah satu sumber biomassa yang sangat potensial untuk produksi xilooligosakarida (Yang, et al., 2005).
C. ENZIM XILANOLITIK
Struktur kompleks xilan membutuhkan beberapa enzim yang bekerjasama dalam menghidrolisis xilan secara total. Kelompok enzim tersebut disebut enzim-enzim xilanolitik. Enzim-enzim yang utama dalam menghidrolisis xilan adalah endo-β-1,4-xilanase (β-1,4-D-xylan xylanohydrolase; EC.3.2.1.8) dan β-1,4-xilosidase (β-1,4-D-xylosidase xylohydrolase; EC.3.2.1.37). Gugus samping yang menyusun xilan dibebaskan oleh enzim α-arabinofuronosidase (EC.3.2.1.55), α-glucuronidase (E.C.3.2.1.1), asetilxilanesterase (EC.3.1.1.6), serta esterase yang membebaskan gugus asetil, koumaril dan ferulil (Tuohy, et al., 1995).
a. β-xilosidase (1,4-β-D-xilan xilohidrolase, E.C.3.2.1.37)
transferase. Xilosa yang dihasilkan sebagai produk hidrolisis juga merupakan inhibitor. Hal ini menyebabkan enzim ini kurang dapat dimanfaatkan industri penghasil xilosa. Enzim β-xilosidase yang berhasil dimurnikan dari Bacillus thermoleoverans IT-08 oleh Puspaningsih (2004), memiliki massa molekul relatif 80 kDa dengan pH optimum 6 dan suhu optimum 70oC.
b. Endoxilanase (1,4-β-D-xilan xilohidrolase, E.C.3.2.1.8)
Hidrolisis xilan oleh endoxilanase menghasilkan xilooligosakarida dan xilosa. Endoxilanase mampu memutus ikatan β-1,4 pada bagian dalam rantai xilan secara acak. Ikatan yang diputus ditentukan berdasarkan panjang rantai substrat, derajat percabangan, ada atau tidaknya gugus subtitusi, dan pola pemutusan dari enzim hidrolase tersebut. Menurut Cleemput, et al. (1997), hampir semua endoxilanase menghidrolisis rantai utama xilan pada bagian yang tidak tersubtitusi oleh gugus arabinosa. Umumnya hampir semua endoxilanse merupakan protein yang terdiri dari subunit tunggal (Tuohy, et al., 1995). Enzim endoxilanase sangat potensial untuk dimanfaatkan bagi industri penghasil xilooligosakarida.
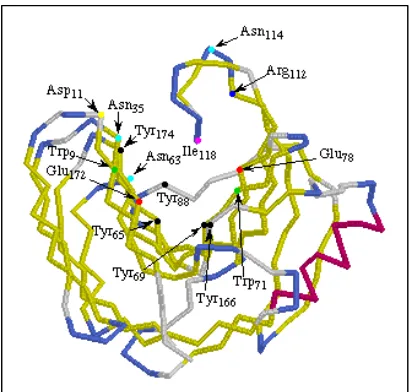
yang sama dengan β-xilosidase. Salah satu enzim xilanase dari Bacillus circulans dapat dilihat pada Gambar 2.
Gambar 2. Enzim xilanase dari Bacillus circulans (1XNB) (Jeffries, 1996) c. α-L-arabinofuranosidase (EC.3.2.1.55)
α-L-arabinofuranosidase berfungsi untuk menghidrolisis ujung non pereduksi dari gugus α-L-arabinofuronosil yang terikat dengan polisakarida yang mengandung arabinosa. Keberadaan enzim α -L-arabinofuranosidase sangat penting dalam degradasi xilan secara total. Adanya subtituen α-L-arabinofuranosida dalam struktur xilan dapat secara kuat menghambat aktivitas endoxilanase dan β-xilosidase yang berakibat menghalangi degradasi total polimer xilan. Hal ini dikarenakan struktur α -L-arabinofuranosida cukup besar, sehingga akan menjadi halangan ruang bagi aktivitas endoxilanase dan β-xilosidase (Shallom dan Shoham, 2003).
d . α-D-glukuronidase (E.C.3.2.1.1)
karena ikatan 4-0-metil membentuk barier dalam degradasi kayu yang hampir sama dengan ikatan antara lignin dan karbohidrat.
e. Asetil xilan esterase (EC.3.1.1.6)
Asetil xilan esterase diperlukan untuk memutuskan ikatan antara xilosa dan asam asetat. Selain asetil xilan esterase, kelompok enzim esterase lainnya juga diperlukan untuk melepaskan ikatan antara xilan dengan komponen lignin. Aktivitas ferulil esterase berfungsi untuk memutus ikatan antara gugus samping arabinosa dengan asam ferulat dan aktivitas ρ-kumoril esterase berfungsi untuk memutus ikatan antara gugus samping arabinosa dengan asam ρ-kumorat (Subramaniyan dan Prema, 2002).
E. MANFAAT ENZIM XILANASE
Enzim xilanase merupakan produk bioteknologi yang memiliki banyak kegunaan baik di bidang pangan maupun non pangan. Beberapa kegunaan enzim xilanase dalam bidang pangan antara lain:
1. Pembuatan Gula Xilosa.
Xilanase dalam pembuatan gula xilosa digunakan untuk menghidrolisis xilan (hemiselulosa) menjadi gula xilosa. Tongkol jagung merupakan sumber yang sangat berpotensi dalam pembuatan gula xilosa. Hal ini diperkenalkan pertama kali pada tahun 1959 oleh Stone dan Lotz. Lebih lanjut, Whistler (1950) menyatakan bahwa D-xilosa pada umumnya diperoleh dari tongkol jagung dan biji kapas. Oleh karena itu isolasi mikroba penghasil enzim xilanase secara langsung dari tongkol jagung, diharapkan mampu untuk menghasilkan enzim xilanase yang potensial dalam menghasilkan gula xilosa untuk skala industri besar.
dapat berfungsi memperkuat gigi. Xilosa dapat pula digunakan sebagai media fermentasi untuk menghasilkan bahan tambahan pangan menggunakan mikroorganisme dan dapat pula digunakan untuk memperoleh pigmen astaxanthin.
Kristal xilosa dapat diubah menjadi xilitol (C5H12O5) dengan cara hidrogenasi katalitik, yang merupakan proses komersial di Finlandia. Xilitol yang termasuk pemanis grup poliol ini digunakan secara luas pada berbagai produk pangan termasuk chewing gums, sweets, es krim, baked good, dan fruit spreads. Saat ini 80-90 % chewing gum yang dijual di Asia diformulasi menggunakan xilitol (Anonim, 2006c). Dengan beragamnya kegunaan gula xilosa maka perlu adanya inovasi ke arah produksi xilosa tersebut. Inovasi tersebut diantaranya dengan menggunakan enzim penghidrolisis xilan.
2. Produksi Xilooligosakarida
Xilooligosakarida merupakan oligosakarida fungsional yang saat ini baru mulai dikembangkan. Senyawa ini memiliki karakteristik yang bermanfaat, seperti low cariogenity, tidak dapat dicerna, dapat bertindak sebagai serat yang mempengaruhi pertumbuhan baik flora usus (menstimulasi bifidobacterial), mempunyai kemampuan menahan air, dan bersifat antifreezing. Xilooligosakarida juga dimanfaatkan sebagai pemanis buatan. Beberapa penelitian enzim yang potensial untuk menghasilkan xilooligosakarida adalah xilanse dari Trichoderma longibrachiatum. Xilooligosakarida yang dihasilkannya memiliki komponen utama xilobiosa, xilotetraosa, dan xilopentosa (Chen, et al., 1997). Enzim xilanase yang diperlukan untuk produksi xilooligosakarida adalah yang memiliki aktivitas endoxilanse tinggi dan β-xilosidase rendah (Vazquez, et al., 2000).
3. Proses Industri Makanan dan Minuman
digunakan untuk meningkatkan kualitas roti. Efisiensi xilanase dalam perbaikan kualitas roti yang telah dilakukan yaitu xilanase yang berasal dari Aspergillus niger var awamori yang ditambahkan ke dalam adonan roti menghasilkan kenaikan volume spesifik roti. Kualitas roti juga dapat ditingkatkan dengan melakukan kombinasi penambahan xilanase dan amilase (Maat et al., 1992).
Manfaat lain dari xilanase adalah pada bidang non pangan seperti untuk proses biokonversi limbah pertanian, untuk proses pembuatan kertas (bleaching), dan untuk makanan ternak. Enzim xilanase dalam proses biokonversi limbah digunakan untuk menghidrolisis limbah yang tinggi kadar lignoselulosa seperti jerami, tongkol jagung, onggok (ampas tapioka, garut), kulit jagung, bagas tebu, sabut, serta tandan kosong kelapa sawit. Hal ini berguna untuk mengurangi tingkat pencemaran lingkungan yang sering menimbulkan masalah. Xilanase untuk proses biobleaching pulp berguna untuk menghidrolisis xilan agar lignin dari pulp kertas dapat dengan mudah dihilangkan. Cara ini digunakan untuk mengurangi penggunaan klorin sebagai bleaching agent, sehingga pencemaran racun limbah kimia dapat dihindari. Pemanfaatan enzim xilanase untuk makanan ternak telah dilakukan oleh Bedford dan Classen (1992), yang melaporkan bahwa campuran pakan ayam boiler dengan xilanase dapat mengurangi viskositas pencernaan sehingga meningkatkan pencapaian berat karena efisiensi konversi makanan.
F. PRODUKSI XILANASE DARI MIKROORGANISME
alkalofilik, xilanase yang dihasilkannya memiliki pH optimum 9, suhu optimum 50oC dan berat molekul 36 kDa (Nakamura et al., 1993). Dung et al. (1993) melakukan penelitian β-1,4-xilanase 2 dan 3 dari Aeromonas Caviae W-61. pH optimum dari xilanase tersebut masing-masing adalah 5.5 (β -1,4-xilanase 2) dan 5.0 (β-1,4-xilanase 3), sedangkan suhu optimumnya adalah 45oC (β-1,4-xilanase 2) dan 50oC (β-1,4-xilanase 3). Ruiz-Arribas et al. (1995) telah mendapatkan Streptomyces halstedi JM8 penghasil xilanase (xys I) yang diisolasi dari jerami, xilanase yang dihasilkannya memiliki pH optimum sekitar 6 dan suhu optimum 60oC.
Tabel 2. Beberapa mikroorganisme penghasil xilanase
Mikroorganisme
Suhu pertumbuhan
(oC)
Aktivitas optimum Berat molekul
(kDa)
Suhu (oC) pH
Bakteri
Aeromonas sp. 30 30-55 5.0-7.0 22.0-58.0
Bacillus sp. 37-50 50-70 6.0-10.0 16.0-43.0
Clostridium sp. 37-65 50-75 5.5-7.0 29.0-72.0
Fibrobacter
succinogenes 37 39 7.0 53.7
Streptomyces sp. 36-50 50-72 4.5-8.0 21.0-50.0
Thermanobacterium 60 80 6.2 24.0-350.0
Thermonospora
curvata 55 75 6.8-7.8 15.0-36.0
Thermatoga sp. 77-80 80-105 5.4-6.2 40.0-120.0
Kapang
Aspergillus sp. 24-30 45-60 4.5-6.0 22.0-46.5
Aureobasidium sp. 28 45-54 4.5-4.8 20.0-25.0
Bipolaris sorokina 28 70 5.5 30.0
Criptococcus flavus 20 55 4.5 25.0
Fusarium oxysporium 26 50 5.0 80.0
Gloeophyllum trabeum 22 80 4.0 39.0
Humicola grisea 40 70 5.5 25.5
Myrothecium
verrucaria 30 45 5.5 15.9
Neurospora crassa 28 50 4.8 33.0
Penicillium sp. 25 40 6.0 35.0
Trichoderma sp. 25-30 50-60 3.5-6.5 18.0-32.0
G. MEDIA PERTUMBUHAN MIKROBA PENGHASIL XILANASE Menurut Richana (2002), komposisi medium fermentasi mikroba penghasil xilanase dapat sederhana atau kompleks tergantung jenis mikroba dan kondisi fermentasinya, dan dapat juga merupakan medium sintetik atau medium kasar (crude). Medium sintetik cocok digunakan untuk skala laboratorium dan industri kecil karena mempunyai beberapa keuntungan antara lain setiap komponen dapat dengan mudah dikurangi atau ditambahkan. Selain itu, pada medium sintetik biasanya tidak membentuk buih selama proses berlangsung dan kesalahan atau kelainan yang mungkin terjadi selama fermentasi akibat komposisi yang kurang tepat dapat dicegah. Untuk industri skala besar medium sintetik tidak sesuai digunakan, oleh karena itu perlu adanya inovasi baru penemuan medium kasar (crude) seperti pemanfaatan limbah berlignoselulosa untuk menghasilkan enzim xilanase dalam skala besar.
Sumber karbon utama bagi produksi enzim xilanase adalah xilan yang banyak terdapat pada limbah hasil pertanian. Xilan akan dihidrolisis oleh enzim xilanase menghasilkan xilosa (C5H10O5). Penggunaan xilan dalam produksi xilanase skala besar terlalu mahal. Sebagai sumber alternatif karbon selain xilan dapat digunakan jerami padi, tongkol jagung, bagas tebu, kulit pisang, limbah ekstrak minyak biji kapas dan limbah hasil pertanian lainnya. Penggunaan jerami padi sebagai substrat telah diteliti oleh Park et al. (1992). Hal ini dilakukan dengan memotong jerami padi sepanjang 10 mm, kemudian dipanaskan 121oC selama 1 jam. Sesudah penyaringan, xilan kasar diendapkan dengan etanol 99 % dan diinkubasi selama 24 jam. Sedangkan pemanfaatan ampas/limbah ekstrak minyak biji kapas sebagai pengganti xilan telah dilakukan oleh Yoshida et al. (1994).
mempengaruhi aktivitas dan produktivitas xilanase yang dihasilkan pada waktu proses fermentasi, yaitu seperti pH, suhu dan agitasi (Kulkarni, et al., 1999).
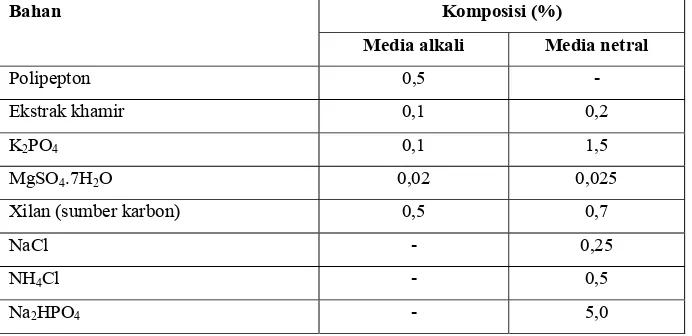
Tabel 3. Komposisi media pertumbuhan mikroorganisme penghasil xilanase
Bahan Komposisi (%)
Media alkali Media netral
Polipepton 0,5 -
Ekstrak khamir 0,1 0,2
K2PO4 0,1 1,5
MgSO4.7H2O 0,02 0,025
Xilan (sumber karbon) 0,5 0,7
NaCl - 0,25
NH4Cl - 0,5
Na2HPO4 - 5,0
Sumber : Nakamura et al. (1993); Dung et al. (1993)
Menurut Stanbury dan Whitaker (1984), formulasi media dalam pertumbuhan dan produksi hasil fermentasi merupakan suatu tahap penting untuk mendesain percobaan dalam skala kerja. Oleh karena itu perlu adanya pengaturan komposisi media dan pemilihan substrat yang tepat bagi pertumbuhan suatu mikroba agar dapat menghasilkan enzim xilanase dalam jumlah maksimal. Pemilihan substrat menjadi bagian penting dalam suatu proses produksi enzim, karena substrat dan produk hasil hidrolisis enzim biasanya merupakan induser utama bagi mikroorganisme dalam mensekresikan enzim. Karni et al. (1993), melaporkan bahwa produksi xilanase dengan menggunakan sumber karbon xilosa menghasilkan aktivitas yang lebih optimal dibandingkan dengan menggunakan sumber karbon xilan. Sedangkan Rawashdesh, et al. (2005), melaporkan bahwa aktivitas xilanase optimal didapatkan dari fermentasi menggunakan xilan murni (0.5%) sebagai sumber karbon dibandingkan dengan campuran xilosa 0.2 % dan xilan 0.3% sebagai sumber karbon.
D. REGULASI SINTESIS XILANASE
Sintesis xilanse dapat terjadi secara konstitutif maupun induktif. Xilanase yang disintesis secara konstitutif akan mendegradasi xilan yang merupakan heteropolisakarida berukuran besar dan tidak dapat masuk begitu saja ke dalam sel. Hidrolisis xilan tersebut menghasilkan fragmen yang mempunyai berat molekul rendah, seperti xilosa, xilobiosa, xilotriosa, dan oligosakarida lainnya. Xilosa dan xilooligomer yang berukuran kecil tersebut dapat dengan mudah masuk ke dalam sel bakteri dan menginduksi sintesis xilanase melalui beberapa mekanisme yang berbeda. Regulasi sintesis xilanase dapat dilihat pada (Gambar 2).
Wang, et al. (1992) dan Gomes, et al. (1994) di dalam Subramaniyan dan Prema (2002), menjelaskan dua mekanisme induksi xilanse oleh xilooligomer melalui dua mekanisme. Mekanisme pertama, xilooligomer ditransport langsung ke dalam sel dan kemudian dihidrolisis oleh β-xilosidase intraseluler menjadi xilosa. Mekanisme ini didukung oleh keberadaan β -xilosidase intraseluler yang secara umum terdapat di dalam mikroorganisme. Mekanisme kedua, xilooligomer dihidrolisis menjadi xilosa selama proses transportasi melalui membran ke dalam matriks sel. Hidrolisis dilakukan oleh transporter penghidrolisis (hydrolitic transporters) yang memiliki sisi aktif untuk memecah ikatan ekso-β-1,4 seperti yang dimiliki oleh β-xilosidase. Tahapan ini dapat dilakukan jika enzim β-xilosidase juga memiliki aktivitas transferase.
Gambar 3. Regulasi biosintesis xilanase (Kulkarni et al., 1999) EKSPRESI XILANASE
Glukosa/xilosa Membran sel
Alat sekresi Alat sekresi
Aktivitas xilanase konstitutif
Xilan
Xilooligosakarida
+
xilobiosa
+
xilosa Xilosidase
Induksi xilanase primer
Mono/hetero disakarida
Glukosa
Induksi xilanase tahap kedua
Xilobiase Sitoplasma
Permease(s)
Xilanase Xilosidase Transglikosidase
III. BAHAN DAN METODE
A. BAHAN DAN ALAT
Bahan-bahan yang digunakan adalah tongkol jagung hibrida CP 2 utuh dan busuk. Tongkol jagung diperoleh dari Desa Cikole, Kecamatan Lembang, Jawa Barat. Tongkol jagung hibrida CP2 busuk diperoleh dengan cara disimpan pada suhu lembab selama dua bulan di daerah Bogor, Jawa Barat. Bahan-bahan kimia yang digunakan adalah ekstrak khamir (Oxoid), K2HPO4, MgSO4.7H2O, NaCl, NH4Cl, Na2HPO4, CuSO4.5H2O, NaOH, Na-K tartrat, Na2CO3, NaOCl, oat spelt xylan (Sigma), bacto agar (Oxoid), tryptone, 3,5-Dinitro salycilic acid (Sigma), D-xilosa (Sigma), substrat paranitrophenyl-β -D-xylopiranoside (Sigma), paranitrophenol (Sigma), etanol 95 %, buffer tris-HCl, bufer fosfat sitrat, bufer fosfat, bufer glisin-NaOH, coomassie brilliant blue G-250 (Sigma), bovine serum albumine (Sigma), kertas saring dan bahan untuk SDS-PAGE (Lampiran 14). Alat-alat yang digunakan adalah cawan petri, gelas piala, labu erlenmeyer, gelas ukur, labu takar, tabung reaksi, jarum ose, botol semprot, inkubator, sheaker, spektrofotometer, alat sterilisasi, pH-meter, pipet mikro, oven, pengaduk stirer, sentrifuse, kertas saring, alat penyaring, dan mesin penggiling.
B. TEMPAT DAN WAKTU PELAKSANAAN PENELITIAN
C. METODOLOGI PENELITIAN
Langkah-langkah yang dilakukan dalam penelitian ini adalah sebagai berikut :
1. Isolasi Mikroba dari Tongkol Jagung Busuk
Isolasi mikroba dilakukan dari tongkol jagung hibrida CP 2 busuk. Tongkol jagung busuk tersebut dihancurkan dan dimasukkan ke dalam air aquades steril. Sebanyak 1.0 ml suspensi mikroba diinokulasi ke dalam 25 ml media cair oat spelt xylan 0.7 % dan diinkubasi menggunakan sheaker selama satu hari. Hasil kultivasi disebarkan ke media padat sebanyak 0.1 ml dengan menggunakan spreader dan diinkubasi selama dua hari. Seleksi koloni dilakukan secara bertahap sampai diperoleh isolat murni berdasarkan zona bening yang dihasilkan di sekeliling koloni. Galur-galur yang mempunyai kemampuan menghasilkan xilanase ditumbuhkan pada media agar miring, kemudian diawetkan dalam gliserol 50 % dan disimpan pada suhu -20oC. Komposisi media yang digunakan untuk mengisolasi mikroba penghasil xilanase dapat dilihat pada Tabel 4.
Tabel 4. Komposisi media pertumbuhan xilanase
Substrat Komposisi Media
(% b/V) Ekstrak khamir 0.2
K2HPO4 1.5 MgSO4.7H2O 0.025 Oat spelt xylan 0.7
Gambar 4. Diagram alir pembuatan media
2. Seleksi Isolat
Seleksi isolat penghasil xilanase terbaik dilakukan dengan mengukur indeks xilanolitik dan aktivitas enzim ekstrak kasar (supernatan). Pengujian indeks xilanolitik isolat dilakukan dengan mengukur area bening yang dihasilkan oleh masing-masing isolat pada media padat oat spelt xylan 0.7 %. Ekstrak kasar enzim untuk pengujian aktivitas xilanase diperoleh dari hasil sentrifuse inokulum masing-masing isolat. Metode inokulasi dilakukan dengan dua cara, yaitu dengan cara memasukkan sebanyak satu ose masing-masing isolat ke dalam 25 ml media cair oat spelt xylan 0.7 % dalam erlenmeyer 100 ml dan dengan cara memasukkan 10 % inokulum starter masing-masing isolat yang memiliki OD 0.600 ke dalam 10 ml media cair oat spelt xylan 0.7 % dalam tabung reaksi. Media inokulum starter yang digunakan adalah Luria Broth yang terdiri dari tryptone 1 %, ekstrak khamir 1 %, dan NaCl 1 %. Inkubasi dilakukan di dalam penangas air bergoyang selama 18 jam pada suhu 37oC. Isolat yang memiliki indeks xilanolitik dan aktivitas enzim yang cukup tinggi dipilih untuk dikarakterisasi lebih lanjut.
Disterilisasi dengan otoklaf selama 15 menit pada suhu 121oC
Komposisi Media % b/V
Aquades Na2CO3 1 %
Diatur pH sampai pH = 7.0
3. Analisis Aktivitas Enzim Xilanase
Analisis aktivitas xilanase dilakukan terhadap pengujian seleksi isolat, optimasi produksi enzim (pengaruh konsentrasi substrat, penentuan pH dan suhu optimum produksi), hasil endapan amonium sulfat, karakteristik xilanase (pH optimum, suhu optimum dan stabilitas suhu). Pengujian aktivitas enzim xilanase dilakukan dengan metode Miller (1959)* yang telah dimodifikasi. Aktivitas xilanase ditentukan dengan mengukur gula pereduksi yang dihasilkan dari hidrolisis 0.5 ml oat spelt xylan (0.5 % dalam 50 mM bufer Tris.HCl pH 7.5) oleh 0.05 ml enzim pada suhu 37oC selama 15 menit. Banyaknya gula pereduksi diukur dengan menggunakan metode DNS (3,5-dinitrosalysilic acid) secara spektrofotometri ( =550 nm). Satu unit aktivitas xilanase menunjukkan
mol xilosa yang dihasilkan per menit untuk setiap ml enzim atau mg protein.
Standar xilosa dibuat pada kisaran 200-2000 ppm xilosa/ml dari stok 2000 ppm xilosa. Sebanyak 0.5 ml masing-masing larutan standar dicampur dengan 0.5 ml akuades, kemudian ditambah 1 ml pereaksi DNS. Tabung dimasukkan dalam penangas air mendidih selama 15 menit, kemudian didinginkan dan diabsorbansi pada panjang gelombang 550 nm. *
)Modifikasi dilakukan pada perbandingan antara substrat, bufer dan enzim pada larutan reaksi, serta jumlah pereaksi.
(Cs – Ck) x 1000 Aktivitas enzim (U/ml) =
BM xilosa x T x VE Keterangan :
Cs : Konsentrasi xilosa sampel (mg/ml) Ck : Konsentrasi xilosa kontrol (mg/ml) BM xilosa : 150.3 mg/mmol
T : Waktu inkubasi reaksi enzim (menit) VE : Volume enzim yang ditambahkan (ml)
4. Analisis Aktivitas β-Xilosidase
Analisis aktivitas β-xilosidase dilakukan terhadap karakterisasi enzim β-xilosidase yang meliputi penentuan aktivitas pH optimum, aktivitas suhu optimum dan stabilitas suhu. Pengujian aktivitas β -xilosidase dilakukan dengan substrat ρ-nitrofenol-β-D-xilopyranosida berdasarkan metode Ratanakhanokchai et al. (1998)* yang telah dimodifikasi. Sebanyak 500 l substrat 0.9 mM PNP-β-D-xilopiranosida diinkubasi bersama-sama enzim (50 l) pada suhu 37oC selama 60 menit. Reaksi dihentikan dengan menambahkan 0.1 ml Na2CO3 0.4 M. Aktivitas enzim ditentukan dengan mengukur jumlah ρ-nitrofenol yang dilepaskan dan diukur nilai absorbansinya pada 405 nm. Satu unit aktivitas enzim didefinisikan sebagai satu mol ρ-nitrofenol yang dihasilkan dalam waktu satu menit per ml enzim pada kondisi percobaan.
Sebagai standar digunakan ρ-nitrofenol pada kisaran 0.1-0.5 mM dalam bufer fosfat 50 mM pH 7. Sebanyak 500 l masing-masing larutan standar diinkubasi dengan 50 l bufer fosfat 50 mM pH 7 pada suhu 37oC selama 60 menit. Setelah inkubasi ditambahkan 1 ml Na2CO3 0.4 M dan diabsorbansi pada 405 nm.
*
)Modifikasi dilakukan pada perbandingan antara substrat, bufer dan enzim pada larutan reaksi, serta jumlah pereaksi.
(Cs – Ck) x 1000 Aktivitas enzim (U/ml) =
T x VE Keterangan :
5. Penentuan Kadar Protein
Penentuan kadar protein dilakukan terhadap pengujian seleksi isolat (pengukuran I), optimasi produksi enzim (pengaruh konsentrasi substrat, pengaruh pH dan suhu pertumbuhan) dan hasil endapan amonium sulfat. Kadar protein diukur dengan metode Bradford (1976). Sebanyak 100 l enzim di dalam aquades 1 ml direaksikan dengan 1 ml pereaksi Coomasive Brilliant Blue G-250, kemudian divorteks dan didiamkan selama 5 menit. Absorbansi dibaca pada panjang gelombang 595 nm. Blanko menggunakan 1.1 ml aquades yang direaksikan dengan 1 ml pereaksi Coomasive Brilliant Blue G-250. Standar protein menggunakan Bovin Serum Albumin (BSA) pada kisaran 0.02-0.2 mg protein/ml dari stok BSA 1 mg/ml.
6. Penentuan Kadar Gula Pereduksi
Penentuan kadar gula pereduksi dilakukan dengan metode Apriyantono, et al. (1989)* yang telah dimodifikasi. Sebanyak 0.5 ml larutan ditambahkan 1.5 ml pereaksi DNS. Larutan tersebut diletakkan dalam air mendidih selama 5 menit, kemudian didinginkan pada suhu kamar. Setelah itu dilakukan pembacaan pada spektrofotometer dengan panjang gelombang 550 nm. Blanko dibuat seperti di atas hanya menggunakan aquades atau buffer. Sebagai standar digunakan larutan xilosa dengan konsentrasi 0, 0.2, 0.4, 0.6, 0.8, dan 1.0 mg/ml.
*
)Modifikasi dilakukan pada perbandingan antara sampel dan jumlah pereaksi yang sama.
7. Analisis Proksimat Bahan Baku Tongkol Jagung
8. Delignifikasi Tongkol Jagung
Sebelum digunakan sebagai substrat, tongkol jagung mengalami perlakuan pendahuluan berupa pengecilan ukuran dan delignifikasi. Delignifikasi dilakukan untuk memisahkan bagian lignin dari selulosa dan hemiselulosa. Tongkol jagung yang telah didelignifikasi memiliki warna yang lebih coklat dibandingkan tongkol jagung yang belum didelignifikasi. Perbandingan tongkol jagung yang belum didelignifikasi dan yang telah didelignifikasi dapat dilihat pada Gambar 5.
(A) (B)
Gambar 5. Cacahan tongkol jagung (A) sebelum delignifikasi, (B) setelah delignifikasi
Gambar 6. Metode delignifikasi menggunkan NaOCl 1 % (Agustina, 2000) 9. Optimasi Produksi Enzim
a. Penentuan Komposisi Tongkol Jagung Optimum
Optimasi produksi enzim dilakukan pada substrat tongkol jagung yang mengandung ekstrak khamir 0.2 %, K2HPO4 1.5 %, MgSO4.7H2O 0.025 %, NaCl 0.25 %, NH4Cl 0.5 %, dan Na2HPO4 0.5 %. Sebanyak 10 % kultur starter yang memiliki OD 0,600 diinokulasi ke dalam media 50 ml dalam erlenmeyer 125 ml, dengan komposisi tongkol jagung 1 %, 3 %, 5 %, dan 7 %. Penentuan komposisi tongkol jagung terbaik dilakukan dengan membuat kurva produksi enzim harian pada masing-masing komposisi tongkol jagung. Optimasi media juga dilakukan pada media oat spelt xylan, sebagai perbandingan penggunaan kualitas tongkol jagung sebagai substrat.
Cacahan tongkol jagung
Perendaman dalam NaOCl 1 % selama 5 jam pada suhu 28oC
Pencucian
Penyaringan
Lignin
Pengeringan
pada suhu 50oC selama 48 jam
b. Penentuan pH dan Suhu Optimum Produksi Enzim
Komposisi media tongkol jagung terbaik digunakan untuk menentukan pH dan suhu optimum produksi enzim. Penentuan pH optimum dilakukan pada kisaran pH 5, 6, 7, 8, dan 9, sedangkan optimasi suhu dilakukan pada kisaran suhu 37oC dan 45oC. Hasil kondisi optimum digunakan untuk produksi enzim pada tahap selanjutnya, yaitu pengendapan enzim xilanase dengan amonium sulfat dan karakterisasi enzim xilanase.
10. Pengendapan Enzim Xilanase dengan Amonium Sulfat ((NH4)2SO4) Pengendapan enzim ini dilakukan untuk memperoleh kondisi optimum fraksinasi dengan berbagai persentase kejenuhan amonium sulfat. Persentase amonium sulfat yang digunakan adalah pada kisaran (NH4)2SO4 20-60 % (b/v). Enzim diendapkan dalam keadaan dingin sambil diaduk perlahan menggunakan pengaduk megnetik. Enzim yang mengendap selanjutnya disentrifus pada kecepatan 10.000 rpm, suhu 4oC selama 30 menit. Endapan enzim dilarutkan dalam bufer Tris.HCl 100 mM pH 7.5. Aktivitas endapan enzim yang tertinggi menunjukkan persentase kejenuhan amonium sulfat optimum yang selanjutnya akan digunakan dalam pengendapan enzim xilanase skala satu liter.
11. Karakterisasi Enzim Xilanolitik
Hasil pengendapan amonium sulfat optimum dari satu liter supernatan digunakan untuk karakterisasi enzim xilanase dan enzim β -xilosidase. Karakterisasi meliputi penentuan pH optimum, suhu optimum, stabilitas pH, dan termostabilitas.
1. pH Optimum
enzim menggunakan bufer-bufer tersebut dan diinkubasi pada suhu 37oC.
2. Suhu Optimum
Penentuan suhu optimum dilakukan dengan pengujian aktivitas enzim yang diinkubasi pada bufer pH optimum pada suhu 27oC, 37oC, 50oC, 60oC, 70oC dan 80oC.
3. Stabilitas Suhu
Stabilitas suhu diuji dengan menginkubasi enzim dalam bufer pH optimum 100 mM pada suhu 70oC dengan waktu sampling 30 menit. Sampel kemudian direaksikan dengan 0.5 % oat spelt xylan dalam bufer optimum dan diinkubasi pada suhu optimum.
12.Analisis SDS-PAGE
Elektroforesis protein dengan SDS-PAGE dilakukan dengan menggunakan gel pemisah 10 % poliakrilamida dan gel penahan 4 % poliakrilamida (Laemli, 1970). Tahapan analisis SDS-PAGE adalah sebagai berikut.
1. Pembuatan Gel
Cetakan gel berupa dua lempeng kaca dihimpitkan dan diantaranya diletakkan pemisah (spacer) pada bagian tepi, lalu dijepit dengan klip dan diberdirikan di atas lempeng kaca. Larutan gel pemisah (separating gel) dibuat dengan komposisi seperti tercantum dalam Lampiran.14 dimasukkan ke dalam lempeng kaca. Setelah gel tersebut mengeras kemudian dimasukkan gel penahan ke atasnya. Sisir pencetak sumur segera dimasukkan ke bagian gel penahan sebelum gel mengeras.
2. Pelarian sampel
95oC selama 1 menit, dan diisikan ke dalam gel poliakrilamid sebanyak 12 l. Standar marker LMW (Low Molecular Weight) yang sebelumnya telah dilarutkan dalam bufer sampel juga diisikan ke dalam sumur sebanyak 12 l. Kemudian sampel dan standar marker dilarikan dalam gel elektroforesis selama 1.5 - 2 jam pada tegangan 100 V, 50 A. Setelah elektroforesis gel diwarnai dengan Coomasive Briliant Blue (CBB) untuk melihat protein yang terpisah dan diukur jarak migrasi pewarna dari batas atas gel pemisah.
4. Pewarnaan Coomasive Brilliant Blue (CBB)
IV. HASIL DAN PEMBAHASAN
A. ISOLASI DAN SELEKSI BAKTERI PENGHASIL XILANASE
Isolasi bakteri dilakukan langsung dari tongkol jagung hibrida yang dibusukkan selama kurang lebih dua bulan. Metode yang digunakan untuk isolasi adalah metode pengamatan visual berdasarkan difusi zona bening (halo) yang terbentuk di bawah dan di sekitar koloni yang ditumbuhkan pada medium padat yang disuplementasikan dengan xilan. Hasil pemilahan isolat bakteri didapatkan 12 koloni membentuk zona bening setelah 18 jam inkubasi dalam media yang mengandung oat splet xylan 0.7 % yang menunjukkan adanya degradasi senyawa xilan oleh enzim-enzim ekstraseluler (xilanolitik) yang dihasilkan bakteri. Isolat-isolat tersebut kemudian diberi kode MBXiK1-MBXiK9 (untuk isolat yang berwarna kuning) dan MBXiP1-MBXiP3 (untuk isolat yang berwarna putih). Setelah itu, masing-masing bakteri diukur indeks xilanolitiknya berdasarkan perbandingan diameter halo yang terbentuk terhadap diameter koloni. Ukuran indeks xilanolitik dari isolat-isolat yang mampu merombak xilan dapat dilihat pada Gambar 7.
Gambar 7. (A) Berbagai isolat MBXi yang pada media oat spelt xylan,
Pemilihan isolat yang menghasilkan enzim xilanase terbaik tidak hanya dilakukan berdasarkan indeks xilanolitik yang dihasilkan, tetapi juga ditentukan berdasarkan aktivitas enzim yang dihasilkan setelah bakteri ditumbuhkan pada media cair yang mengandung oat spelt xylan 0.7 %. Hasil pengukuran aktivitas enzim masing-masing isolat dapat dilihat pada Tabel 5. Pengukuran aktivitas enzim terhadap berbagai isolat MBXi dilakukan sebanyak dua kali. Pengukuran I merupakan hasil inokulasi sebanyak satu ose isolat ke dalam erlenmeyer 100 ml yang berisi 25 ml media oat spelt xylan. Pengukuran II merupakan hasil inokulasi 10 % inokulum yang memiliki OD (optical density) 0.6 ke dalam tabung reaksi yang berisi 10 ml media oat spelt xylan.
Tabel 5. Aktivitas enzim xilanase berbagai isolat MBXi
Berdasarkan Tabel 5 menunjukkan bahwa aktivitas enzim hasil pengukuran I mempunyai rata-rata aktivitas enzim yang lebih tinggi yaitu 1.53 U/ml dibandingkan aktivitas enzim hasil pengukuran II yaitu 0.81 U/ml. Namun terdapat pengecualian yaitu pada isolat MBXiK6 dan MBXiK7 yang memiliki aktivitas xilanase hasil pengukuran II lebih tinggi dibandingkan aktivitas xilanase hasil pengukuran I. Pengukuran I dilakukan dari produksi enzim yang dihasilkan secara aerob yaitu bakteri diinokulasi dalam erlenmeyer yang memiliki ruang udara lebih besar dan faktor agitasi yang
Kode isolat
Pengukuran I Pengukuran II
lebih tinggi, sedangkan pengukuran II dilakukan dalam tabung reaksi yang memiliki ruang udara lebih kecil dan faktor agitasi yang lebih kecil (anaerob). Berdasarkan hal tersebut menunjukkan bahwa bakteri-bakteri hasil pemilihan dari tongkol jagung busuk tersebut lebih cenderung bersifat aerobik (membutuhkan oksigen). Selanjutnya untuk optimasi produksi enzim dilakukan dalam kondisi aerob.
Hubungan indeks xilanolitik dan aktivitas enzim xilanase berdasarkan Gambar 7 dan Tabel 5 tidak berkorelasi nyata. Hal ini dapat dilihat pada Gambar 7 yang menunjukkan bahwa isolat yang memiliki indeks xilanolitik tertinggi adalah isolat MBXiK3 yaitu sebesar 6.77, namun berdasarkan Tabel 5 isolat yang memiliki aktivitas enzim xilanase tertinggi adalah isolat MBXiK4 yaitu sebesar 2.40 U/ml (pengukuran I) dan 1.58 U/ml atau 10.84 U/mg (pengukuran II). Sementara itu, MBXiP3 yang memiliki indeks xilanolitik cukup tinggi yaitu 5.08, hanya memiliki aktivitas xilanase 0.10 U/ml (pengukuran I) dan tidak memiliki aktivitas xilanase pada pengukuran II. Selanjutnya untuk penentuan optimasi produksi dan karakterisasi enzim xilanase digunakan isolat MBXiK4, karena memiliki indeks xilanolitik cukup tinggi yaitu 5.81 dan aktivitas enzim xilanase tertinggi yaitu 5.30 U/ml (pengukuran I) dan 1.78 U/ml atau 11.97 U/mg (pengukuran II). Isolat MBXiK4 terlihat pada Gambar 8.
Gambar 8. Koloni isolat MBXiK4
B. HASIL UJI PROKSIMAT TONGKOL JAGUNG
Kandungan proksimat tongkol jagung berdasarkan hasil penelitian dapat dilihat pada Tabel 6. Hasil penelitian menunjukkan bahwa serat kasar merupakan kandungan yang tertinggi dalam tongkol jagung hibrida, yaitu 34.92 %. Hal ini tidak terlalu berbeda dari hasil penelitian Maynard dan Loosli (1993) yang menyebutkan bahwa komposisi kimia tongkol jagung terdiri dari 35.5 % serat kasar, 2.5 % protein, 0.12 % kalsium, 0.04 % fosfor dan zat-zat lainnya sebesar 38.16 %. Kandungan serat kasar mengalami penurunan yang signifikan setelah mengalami proses delignifikasi, yaitu menjadi 22.71 %. Hal ini dikarenakan proses delignifikasi telah menyebabkan larutnya komponen-komponen hemiselulosa dan selulosa. Akan tetapi xilan yang merupakan salah satu komponen hemiselulosa, pada dasarnya tahan pada kondisi delignifikasi dengan NaOCl, yaitu karena adanya gugus asam galakturonat dan rhamnosa yang terikat pada ujung pereduksi xilan sehingga dapat membuat struktur xilan lebih stabil terhadap kondisi alkali.
Tabel 6. Hasil uji proksimat tongkol jagung
Perlakuan Komposisi Persentase (b.b)
(by different) 86.47 94.68 Serat kasar 31.89 34.92
Lignolosa 42.80 46.93
Setelah delignifikasi
Air 8.79 9.63
Serat kasar 20.72 22.71
C. OPTIMASI PRODUKSI ENZIM
9.82
mengalami proses delignifikasi. Sebagai perbandingan penggunaan kualitas tongkol jagung sebagai substrat, optimasi produksi enzim juga dilakukan pada media yang mengandung oat spelt xylan 0.7 %.
1. Optimasi Produksi Enzim pada Media Oat Spelt Xylan
Kurva produksi enzim xilanase pada media oat spelt xylan oleh isolat MBXiK4 dapat dilihat pada Gambar 9. Berdasarkan hasil tersebut menunjukkan bahwa aktivitas enzim xilanase optimum diproduksi pada hari kedua, yaitu 11.37 U/ml atau 27.26 U/mg dan semakin menurun pada hari-hari berikutnya. Ruiz Arribas et al. (1995), melaporkan bahwa produksi enzim xilanase dari Streptomyces JM 8 yang diisolasi dari jerami padi telah menghasilkan aktivitas enzim sebesar 4.12 U/ml atau 32.03 U/mg. Kultur tersebut ditumbuhkan pada media yang mengandung 1 % ekstrak khamir, 10.3 % sukrosa, 0.5 % oat spelt xylan dan 5 mM MgCl2 serta diinkubasi pada suhu 28oC.
Gambar 9. Kurva produksi xilanase harian oleh isolat MBXiK4 pada media oat spelt xylan
0.06
10.) terlihat bahwa kadar gula pereduksi tidak menunjukkan pengaruhnya terhadap penurunan aktivitas enzim xilanase.
Gambar 10. Kadar gula pereduksi isolat MBXiK4 pada media oat spelt xylan
6.07
Seperti halnya kadar gula pereduksi, bobot biomassa kultur isolat MBXiK4 dalam media aot spelt xylan juga tidak mengalami perubahan yang cukup nyata dari hari ke hari dan tidak menunjukkan korelasi nyata terhadap aktivitas enzim xilanase yang dihasilkan. Hal ini dapat dilihat bahwa bobot biomassa kering pada hari pertama adalah 6.07 mg/ml dan pada hari kelima adalah 6.56 mg/ml. Kurva bobot biomassa sel dapat dilihat pada Gambar 11. Pengukuran bobot biomassa kering tersebut merupakan bobot endapan sel dan substrat hasil sentrifus inokulum yang kemudian dikeringkan semalam pada suhu 50oC. Bobot biomassa substrat oat spelt xylan yang disuplementasikan ke dalam media yaitu 0.7 g/100 ml (7 mg/ml). Bobot ini sebenarnya mengalami penurunan setelah substrat disterilisasi karena terjadinya proses degradasi menghasilkan gula pereduksi terlarut sebesar 0.06 mg/ml. Seharusnya bobot substrat kering tersebut berkurang dengan meningkatnya kemampuan degradasi oat splet xylan oleh enzim xilanase yang dihasilkan oleh sel, akan tetapi bobot biomassa sel dapat mengalami peningkatan seiring dengan peningkatan konsentrasi sel.
0.40 0.42 0.43 0.73
0.82
0.0 0.2 0.4 0.6 0.8 1.0
0 1 2 3 4 5 6
Waktu (Hari)
K
a
da
r pr
ot
e
in (
m
g/
m
l)
selulase, protease dan sebagainya) yang dihasilkan oleh isolat MBXiK4 dan protein terlarut dari sel yang mati.
Gambar 12. Kadar protein isolat MBXiK4 pada media oat spelt xylan
2. Pengaruh Konsentrasi Substrat, pH dan Suhu Terhadap Produksi Xilanase pada Media Tongkol Jagung
7.16
Substrat tongkol jagung 1 % Substrat tongkol jagung 3 %
Substrat tongkol jagung 5 % Substrat tongkol jagung 7 %
Gambar 13. Kurva produksi enzim harian isolat MBXiK4 pada berbagai konsentrsi tongkol jagung
Thermomyces lanuginosus IOC-4145 yang diinkubasi selama empat hari telah menghasilkan aktivitas enzim sebesar 516 U/ ml dan aktivitas spesifik enzim sebesar 85 U/mg protein. Media yang digunakan untuk produksi enzim xilanase oleh Thermomyces lanuginosus IOC-4145 adalah tongkol jagung 3% (b/v), pepton 1 % (b/v), meat extract 1 % (b/v), NaCl 1 % (b/v), dan K2HPO4 0.1 % (b/v). Produksi xilanase dari limbah lignoselulosa lainnya juga telah dilakukan oleh Xu, et al. (2005), yang menemukan bahwa produksi xilanase dari dedak gandum oleh isolat Pseudomonas sp. WLU024 (strain hasil mutagenesis) dapat mencapai aktivitas optimum 1245 U/ml selama satu hari. Media yang digunakannya adalah 7 % (b/v) dedak gandum, 0.8 % (b/v) (NH4)2SO4, dan 0.4 % (b/v) K2HPO4. Xu, et al. (2005) juga menemukan bahwa produksi xilanase oleh Pseudomonas sp. WLU024 sangat dipengaruhi oleh komponen sumber nitrogen anorganik ((NH4)2SO4). Penambahan (NH4)2SO4 sampai batas optimalnya dapat meningkatkan aktivitas enzim sebesar 20 %. Oleh karena itu untuk meningkatkan aktivitas optimum xilanase oleh isolat MBXiK4 masih perlu dilakukan optimasi produksi lebih lanjut mengenai pengaruh komponen nitrogen dan mineral-mineral lain terhadap produksi xilanase. Perbandingan hasil penelitian xilanase isolat MBXiK4 terhadap xilanase dari bakteri lain dapat dilihat pada Tabel 10.
7.58
Suhu 37oC Suhu 45oC
Gambar 14. Pengaruh suhu dan pH terhadap produksi xilanase oleh isolat MBXiK4 pada media tongkol jagung 1%
D. PEMEKATAN ENZIM XILANASE ISOLAT MBXiK4
amonium sulfat 60 % (b/v), yaitu aktivitas meningkat sebesar 140.64 % dari ekstrak kasar enzim, tetapi kadar protein lebih kecil dari hasil penambahan amonium sulfat 50 % (b/v).
Gambar 15. Pengendapan ekstrak kasar enzim xilanase dengan amonium sulfat, C (kontrol, ekstrak kasar enzim xilanase)
Tabel 7. Hasil pengendapan amonium sulfat
[(NH4)2SO4]
C : Kontrol (ekstrak kasar enzim xilanase)
E. KARAKTERISASI ENZIM XILANOLITIK ISOLAT MBXiK4
Karakterisasi enzim bertujuan untuk mengetahui kondisi optimum aktivitas enzim sehingga penggunaan enzim dapat disesuaikan dengan kondisi optimumnya. Karakterisasi enzim xilanolitik pada penelitian ini meliputi penentuan pH optimum, suhu optimum, dan stabilitas suhu. Enzim xilanolitik
yang dikarakterisasi adalah xilanase total dan β-xilosidase yang merupakan hasil pemekatan dengan amonium sulfat 50 % (b/v).
1. Penentuan pH Optimum
Secara umum setiap enzim memiliki kisaran pH optimum, yaitu kisaran pH dimana enzim menunjukkan aktivitas maksimum dengan stabilitas tinggi. Menurut Lehninger (1995), karakteristik aktivitas pH enzim menggambarkan pH pada saat gugus pemberi atau penerima proton yang penting pada sisi katalitik enzim berada dalam tingkat ionisasi yang diinginkan. pH optimum aktivitas enzim xilanase total dan β-xilosidase dapat dilihat pada Gambar 16. Berdasarkan data tersebut menunjukkan bahwa enzim xilanase total mempunyai kisaran pH optimum yang luas, yaitu enzim masih stabil pada kisaran pH 4-10. Aktivitas enzim xilanase tertinggi terjadi pada pH 6 (bufer fosfat sitrat) yaitu aktivitas enzim mencapai 16.12 U/ml. Umumnya enzim hanya dapat aktif pada kisaran pH yanng sempit. Namun pada enzim xilanase ada yang ditemukan memiliki kisaran pH luas. Enzim xilanase yang diproduksi dari Bacillus sp. strain K-1 masih stabil pada kisaran pH 5-9 (Ratanakhanokchai, et al., 1998). Dilaporkan juga bahwa enzim xilanase yang diproduksi dari Pseudomonas sp. WLUN024 dengan menggunakan dedak gandum stabil pada kisaran pH 5.3-10.4 (Xu, et al., 2005). Kisaran pH luas yang dimiliki oleh enzim-enzim tersebut dapat dikarenakan tersebut terdiri dari beberapa enzim-enzim yang bekerjasama dalam menghidrolisis xilan secara total. Kisaran pH yang luas tersebut memungkinkan penggunaan enzim xilanase yang dihasilkan oleh isolat MBXiK4 untuk berbagai keperluan proses industri, seperti untuk proses bleaching pulp yang memerlukan pH alkali. Perbandingan karakteristik xilanase yang diproduksi oleh isolat MBXiK4 terhadap xilanase yang diproduksi oleh isolat bakteri lain dapat dilihat pada Tabel 10.
menurun drastis pada kondisi di luar pH optimal. Hal ini menunjukkan bahwa kondisi di luar pH optimal, enzim β-xilosidase tidak terlalu berperan banyak dalam aktivitas xilanolitik. Sebagai perbandingan enzim xilanolitik yang diproduksi oleh Bacillus thermoleovorans IT-08 memiliki aktivitas xilanase (β-xilanase) 1.56 U/ml dan aktivitas β-xilosidasenya mencapai 315.78 U/ml. Enzim β-xilosidase yang diproduksi dari Bacillus thermoleovorans IT-08 tersebut memiliki pH optimum 6 (Puspaningsih, 2004). Berdasarkan data tersebut menunjukkan juga bahwa ada kemungkinan enzim xilanolitik yang diproduksi oleh isolat MBXiK4 cenderung memiliki aktivitas endoxilanase yang tinggi. Aktivitas endoxilanase yang tinggi menunjukkan bahwa enzim tersebut cocok diaplikasikan pada industri penghasil xilooligosakarida dan tidak cocok diaplikasikan untuk industri penghasil xilosa.
Gambar 16. Optimasi pH (A) aktvitas xilanase, (B) aktivitas β-xilosidase 0
Fosfat sitrat Fosfat Glisin-NaOH
0
Fosfat sitrat Fosfat Glisin-NaOH
Gambar 17. Optimasi pH (A) aktivitas relatif xilanase, (B) aktivitas relatif β-xilosidase
2. Penentuan Suhu Optimum
Hampir sama dengan reaksi kimia yang lain, reaksi katalitik enzim juga dipengaruhi oleh suhu. Menurut Palmer (1991), peningkatan suhu akan menyebabkan peningkatan energi kinetik enzim yang mengakibatkan gerakan vibrasi, translasi, serta rotasi enzim dan substrat akan semakin besar, sehingga peluang keduanya untuk bertumbukkan akan semakin besar. Oleh karena itu aktivitas enzim akan semakin meningkat sampai pada suhu optimum enzim. Setelah suhu optimum terlewati, aktivitas enzim akan menurun drastis. Hal ini dikarenakan peningkatan suhu dalam batas tertentu akan menyebabkan peningkatan aktivitas katalitik enzim, namun sekaligus mengakibatkan terjadinya proses kerusakan enzim akibat panas. Penentuan suhu optimum enzim xilanase dan β-xilosidase dapat dilihat pada Gambar 18. Penentuan suhu optimum tersebut dilakukan pada pH 6 dan pH 10 untuk enzim xilanase serta pH 5.91 untuk enzim β-xilosidase.
0
Fosfat sitrat Fosfat Glisin-NaOH
0
Fosfat sitrat Fosfat Glisin-NaOH
0
Gambar 18. Optimasi suhu (A) aktivitas relatif xilanase, (B) aktivitas relatif β-xilosidase
memiliki suhu optimum yang lebih tinggi (70oC). Karakteristik beberapa xilanase yang dihasilkan oleh bakteri lainnya dapat dilihat pada Tabel 10. Untuk aktivitas β-xilosidase, aktivitas tertinggi yang dihasilkan oleh isolat MBXiK4 hanya terjadi pada suhu 37oC. Aktivitas optimum enzim ini dapat terjadi pada suhu yang lebih rendah dari 37oC. Hal ini berbeda dengan tingginya suhu optium enzim xilanase total, yang menunjukkan bahwa komponen enzim xilanolitik lainnya selain β-xilosidase memiliki struktur yang lebih kuat sehingga tahan suhu tinggi.
3. Stabilitas Suhu
0
Gambar 19. Stabilitas suhu (A) xilanase, (B) β-xilosidase
F. HASIL ANALISIS SDS-PAGE
dengan membandingkan pita yang muncul terhadap marker yang telah diketahui berat molekulnya (Tabel 8). Hasil perbandingan berat molekul sampel terhadap kurva standar berat molekul dapat dilihat pada Tabel 9. Berdasarkan data pada Tabel 9 menunjukkan dugaan berat protein sampel dalam ekstrak enzim hasil pengendapan amonium sulfat adalah 15.1 kDa, 25.4 kDa, 37.2 kDa, 54.5 kDa, 64.2 kDa, dan 113.7 kDa. Menurut Kulkarni, et al. (1999), xilanase dari mikroorganisme merupakan protein tunggal yang memiliki berat molekul 8-145 kDa. Oleh karena itu untuk mengetahui pita manakah yang mempunyai aktivitas xilanase, masih perlu dilakukan analisis zimogram. Hasil SDS-PAGE ekstrak enzim dapat dilihat pada Gambar 20.
Tabel 8. Marker untuk SDS-PAGE
Marker BM Diperoleh persamaan :
y = -1.137 x + 5.0796, r = 0,9935 Keterangan : y = log BM
x = Rf
Tabel 9. Penetapan berat molekul sampel
Gambar 20. Hasil analisis SDS-PAGE. (A) Ekstrak hasil pengendapan amonium sulfat 50 % (b/v), (B) Ekstrak kasar enzim (supernatan)
Marker Sampel
A B A
97.0 kDa 66.0 kDa 45.0 kDa
30.0 kDa 20.1 kDa 14.4 kDa 113.7 kDa
64.2 kDa 54.5 kDa
37.2 kDa
Tabel 10. Karakteristik beberapa xilanase yang dihasilkan bakteri
Mikroorganisme dan xilanase
Kondisi
pertumbuhan Sumber karbon
actuosus A-151 (xilanse FII-B) Bacillus sp. Strain
K-1 10.5 -
Bacillus sp. Strain
41M-1 10.5 37
*)Pengujian aktivitas xilanase berbeda untuk masing-masing peneliti dan pada dasarnya hal ini
V. KESIMPULAN
A. KESIMPULAN
Hasil pemilahan isolat didapatkan 12 isolat mampu menghasilkan zona bening pada media yang mengandung oat spelt xylan 0.7 %, salah satu diantaranya adalah isolat yang diberi kode MBXiK4 yaitu memiliki indeks xilanolitik cukup tinggi (5.81) dan aktivitas enzim yang tertinggi (5.29 U/ml (pengkuran I), 1.78 U/ml (pengukuran II)). Isolat lokal yang terbaik tersebut digunakan untuk optimasi kondisi produksi enzim dengan menggunakan substrat kasar tongkol jagung 32 mesh yang telah mengalami proses delignifikasi. Hasil optimasi produksi menunjukkan aktivitas enzim tertinggi (11.59 U/ml) terjadi pada hari kedua, konsentrasi tongkol jagung 1%, dengan kondisi pH awal 7 dan suhu 37oC. Hasil ini tidak berbeda jauh jika dibandingkan dengan menggunakan substrat oat spelt xylan 0.7 % yang menghasilkan aktivitas enzim tertinggi sebesar 11.37 U/ml pada pH awal 7 dan suhu 37oC.
Enzim xilanase yang dihasilkan dari isolat MBXiK4 tersebut mempunyai suhu optimum 70oC dan masih stabil pada kisaran pH yang luas yaitu 4-10 (tertinggi pada pH 6 dalam bufer fosfat sitrat). Selama lima jam, termostabilitas enzim xilanase tersebut pada suhu 70oC dan pH 6 masih memiliki aktivitas di atas 50 %, sedangkan pada suhu 70oC dan pH 10 enzim hanya mampu bertahan dengan aktivitas di atas 50 % selama satu jam. Berbeda dengan xilanase, β-xilosidase yang dihasilkan tidak memiliki aktivitas yang signifikan, enzim ini hanya memiliki aktivitas optimum pada suhu 37oC dan pH 5.91 sebesar 13.19 U/ml.
B. SARAN