EFEKTIVITAS EKSTRAK PELEPAH PISANG SEBAGAI ANTIBAKTERI
DAN IMUNOSTIMULAN PADA IKAN GURAME
YANG DIINFEKSI
Aeromonas hydrophila
IKE DEWI NUR FITRIANINGRUM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Efektivitas Ekstrak Pelepah Pisang sebagai Antibakteri dan Imunostimulan pada Ikan Gurame yang Diinfeksi Aeromonas hydrophila adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2015
Ike Dewi Nur Fitrianingrum
RINGKASAN
IKE DEWI NUR FITRIANINGRUM. Efektivitas Ekstrak Pelepah Pisang sebagai Antibakteri dan Imunostimulan pada Ikan Gurame yang Diinfeksi
Aeromonas hydrophila. Dibimbing oleh DINAMELLA WAHJUNINGRUM dan WIDANARNI.
Penyakit motile aeromonad septicaemia (MAS) merupakan penyakit bakterial yang disebabkan oleh bakteri A. hydrophila dan dapat menyebabkan permasalahan dalam kegiatan budidaya. Penyakit ini dapat ditanggulangi dengan pemberian sediaan obat dari tanaman atau dikenal dengan istilah fitofarmaka. Fitofarmaka yang digunakan salah satunya adalah pelepah pisang ambon, karena bahan ini mudah didapat, termasuk bahan limbah serta mengandung bahan fitokimia yang dapat menghambat aktivitas bakteri serta dapat berfungsi sebagai imunostimulan. Tujuan penelitian ini yaitu menguji efektivitas ekstrak pelepah pisang ambon dalam menghambat aktivitas bakteri A. hydrophila dan peranannya dalam meningkatkan respons imun ikan gurame Osphronemus goramy, serta untuk mengevaluasi metode yang efektif dalam menanggulangi infeksi A. hydrophila.
Ikan uji yang digunakan yaitu ikan gurame dengan bobot 15,7±0,31 g. Materi uji yang digunakan yaitu pelepah pisang ambon dan A. hydrophila. Perlakuan dalam penelitian ini terbagi menjadi tiga tahap yaitu persiapan uji, uji in vitro dan uji in vivo. Kegiatan persiapan uji meliputi penyediaan bakteri uji, persiapan wadah, persiapan ikan uji, ekstraksi pelepah pisang, uji jenis dan kandungan fitokimia pelepah pisang. Perlakuan uji in vitro meliputi uji zona hambat ekstrak pelepah pisang terhadap A. hydrophila dan Streptococcus sp. dengan dosis ekstrak yang digunakan yaitu 0,1, 2, 3 dan 4%. Perlakuan uji in vivo
terdapat 5 perlakuan dan 3 ulangan, masing-masing adalah kontrol negatif (K-), kontrol positif (K+), pencegahan (PC), pengobatan (PO) dan pengendalian (PG). Parameter yang diukur sebelum uji in vivo meliputi jenis fitokimia, kandungan fitokimia pelepah pisang dan zona hambat. Parameter gambaran darah (hemoglobin, hematokrit, total eritrosit, total leukosit dan diferensial leukosit),
respiratory burst activity dan aktivitas lisozim diukur pada hari ke 14 prauji tantang (H-14), hari ke 1 prauji tantang H-1, hari ke 2 pascauji tantang (H+2), hari ke 5 pascauji tantang (H+5) dan hari ke 7 pascauji tantang (H+7). Kelangsungan hidup ikan, gejala klinis ikan akibat infeksi A. hydrophila dan prevalensi diukur pada akhir perlakuan sedangkan untuk parameter jumlah konsumsi pakan dan jumlah kematian ikan gurame diukur setiap hari saat perlakuan uji. Kualitas air selama perlakuan berada pada kisaran optimum pemeliharaan ikan gurame yaitu nilai pH berkisar 6,26-7,80, suhu sekitar 28-32 °C, oksigen terlarut berkisar 7,0-8,2 ppm dan nilai amonia berkisar 0,009-0,05 ppm.
Pelepah pisang ambon mengandung bahan fitokimia dengan persentase terbesar adalah flavonoid sebesar 28,10%. Pelepah pisang lebih efektif menghambat bakteri A. hydrophila dibandingkan Streptococcus sp.. Hal ini dilihat dari diameter zona hambat A. hydrophila sebesar 1,15 cm sedangkan pada
dari 3x108 menjadi 8x106 CFU/g. Selain menghambat aktivitas bakteri, pelepah pisang mampu meningkatkan respons imun ikan gurame pascainfeksi A. hydrophila. Efek peningkatan respons imun tersebut dapat diketahui dari data total leukosit, diferensial leukosit, aktivitas lisozim dan respiratory burst activity pada perlakuan pencegahan, pengobatan dan pengendalian. Berdasarkan data yang didapat, nilai parameter tersebut secara signifikan (P<0,05) lebih tinggi dibandingkan kontrol positif. Skor infeksi A. hydrophila pada kontrol positif secara signifikan (P<0,05) paling tinggi yaitu 102 dengan tingkat prevalensi sebesar 100%. Skor infeksi A. hydrophila yakni 11 (PC), 18 (PO) dan 19 (PG) serta prevalensinya berturut-turut adalah 14,8% (PC), 20% (PO) dan 6.6% (PG). Kecilnya skor infeksi serta prevalensi pada tiga perlakuan tersebut karena terjadi penutupan luka pada akhir perlakuan.
Jumlah konsumsi pakan ikan gurame sebelum uji tantang sebanyak 6 g pada semua perlakuan, namun konsumsi pakan tersebut turun pascainfeksi dan naik kembali pada H+2. Konsumsi pakan pada H+3 sampai H+7 untuk semua perlakuan kecuali kontrol positif relatif sama yakni 6 g. Konsumsi pakan pada H+3 sampai H+7 untuk perlakuan K+ paling rendah yaitu 2,5 g. Kelangsungan hidup ikan gurame pada perlakuan PC, PO dan PG masing-masing 92,5%,100% dan 97,5% secara signifikan (P<0,05) lebih tinggi dibandingkan K+ yang hanya 60%. Kadar hemoglobin, hematokrit dan total eritrosit pada perlakuan K-, PC, PO dan PG pascainfeksi mengalami peningkatan yang masih berada pada kisaran normal namun hemoglobin dan hematokrit pada perlakuan kontrol positif mengalami penurunan dibawah kisaran normal. Kesimpulan dari penelitian ini yaitu ekstrak pelepah pisang 3% dapat menghambat aktivitas bakteri A. hydrophila dan dapat menginduksi imunitas ikan gurame sebagai upaya pencegahan, pengobatan dan pengendalian terhadap infeksi bakteri A. hydrophila
pada ikan gurame.
SUMMARY
IKE DEWI NUR FITRIANINGRUM. Effectivity of Banana Midrib Extract as Antibacterial and Immune-stimulant for Giant Gourami Infected with
Aeromonas hydrophila. Supervised by DINAMELLA WAHJUNINGRUM and WIDANARNI.
Motile aeromonad septicaemia (MAS) is an illness of fish caused by A. hydrophila bacteria which affected problems in aquaculture. This disease could be treated by herbal drugs. One selected material of herbal drugs is Ambon banana midrib. The material is chosen because of its abundance especially in tropical countries and considered as waste material. Banana midrib contains phytochemical material could inhibit A. hydrophila activity and stimulating immune response. The study aimed to evaluate efectivity of banana midrib extract to inhibit activity of A. hydrophila, stimulating immune response of giant gourami (Osphronemous goramy) by banana midrib and finding an effectively method for preventing A. hydrophila infection.
Fish maintaining was giant gourami with average weight 15.7 ± 0.31 g. Materials were Ambon banana midrib and A. hydrophila. Treatments in this research divided into three steps. First step was experiment preparation, in vitro
test and in vivo test. Preparation experiment involved preparation of bacteria, preparation of fish, extraction of banana midrib, confirming the composition of herbal drugs, and testing the percentage herbal drugs contents. In vitro test was inhibitation test of banana midrib 1%, 2%, 3%, 4% to A. hydrophila and
Streptococcus sp.. In vivo treatments at this study used 5 treatments and 3 replicates. The treatments were negative control, positive control, preventive, curative and controlling treatments. Parameters testing in this study were phytochemical composition, quantification of banana midrib phytochemical, clear zone test, feed consumption total, preparatory of fish blood (hemoglobin, hematocrit, erythrocyte total, leukocytes total and leukocytes differential), counting population of A. hydrophila bacteria in gurame fish, prevalence, respiratory burst activity, lysozyme activity. Water quality during rearing activity was in optimum condition for gourami: pH (6,26-7,80), temperature (28-32 °C), dissolved oxygen (7,0-8,2 ppm) and ammonia (0,009-0,05 ppm). Obtained data was processed using Microsoft Excel 2007, while statistic parameters ANOVA test. Significance was accepted at the P< 0.05 level, when a significant difference was identified, differences among means were compared by Tukey’s multiple range tests. Analyses were carried out on SPSS 18.0.
Ambon banana midrib contains several phytochemical. The high percentage of phytochemical compound in banana midrib is was flavonoid with 28.10%. Banana midrib 3% effectively detained A. hydrophila than Streptococcus
controlling treatment with total bacteria 4,0x106 and 8,0x106 CFU/g respectively. Banana midrib could had increased immune response of giant gourami after infected by A. hydrophila. Increasing immune response effects were showed by total data of leukocytes, leukocytes differential, lysozyme activity and respiratory burst activity at treatments. They were significantly higher (P<0.05) at preventive, curative and controlling treatments than positive control treatments.
Clinic effects causing by A. hydrophila infection in giant gourami were significantly (P<0.05) highest at positive control treatments. The score and prevalence percentage were 102 and 100% respectively. As infection effects of fish at this treatments were necrosis and fish mortality. At preventive, curative and controlling treatments, clinic effects of infection A. hydrophila got score disease with 11, 18,19 respectively and had prevalence percentage with 14.8%, 20% and 6.6% respectively. The low point of infection effect and prevalence percentage happened as there was smaller necrosis than before at last treatments period.
Feed consumption total of giant gourami before testing was 6 g for all treatments. It was lower at day infected and higher at 2nd day later. After infected, consumption feed total at all treatments were relatively same, excepted at positive control treatments. It was the lowest than all. Survival rate of giant gourami in preventive, curative and controlling treatments at last period treatment showed significantly higher percentage (P<0.05) with positive control treatments. Survival rate at negative, preventive, curative and controlling treatments were 100%, 92.5%, 97.5% and 60% respectively. The points of the study were banana midrib extract 3% can reduces bacterial activity of A. hydrophila, and also induces immunity of giant gourami.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
IKE DEWI NUR FITRIANINGRUM
EFEKTIVITAS EKSTRAK PELEPAH PISANG SEBAGAI ANTIBAKTERI
DAN IMUNOSTIMULAN PADA IKAN GURAME
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga karya tesis ini dapat terselesaikan dengan judul Efektivitas Ekstrak Pelepah Pisang sebagai Antibakteri dan Imunostimulan pada Ikan Gurame yang Diinfeksi Aeromonas hydrophila. Karya tesis ini bersumber dari data penelitian yang dilaksanakan pada bulan Desember 2014 - April 2015 bertempat di Laboratorium Kesehatan Ikan, Laboratorium Lingkungan Akuakultur, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, serta di Balai Penelitian Tanaman Rempah dan Obat, Bogor. Pada kesempatan ini penulis mengucapkan terimakasih kepada:
1. Ibunda Mastini dan Ayahanda Supardi serta Adik saya M. Ishadul Haque atas doa, kasih sayang dan dukungannya.
2. Ibu Dr. Dinamella Wahjuningrum dan Dr. Widanarni selaku dosen pembimbing yang telah banyak memberikan bimbingan dan masukan kepada penulis.
3. Bapak Dr. Odang Carman selaku dosen penguji tamu yang telah memberikan masukan dalam penulisan tesis.
4. Ibu Dr. Mia Setiawati selaku perwakilan dari Ketua Program Studi Ilmu Akukultur yang telah memberikan saran untuk kesempurnaan karya tesis ini.
5. Direktorat Jenderal Pendidikan Tinggi (DIKTI) yang telah memberikan bantuan beasiswa Fresh Graduate dalam menempuh pendidikan megister di Institut Pertanian Bogor.
6. Teman-teman yang selalu mendukung dalam menyelesaikan tugas akhir ini seperti Endang Saefudin, Septi Novia Alfiani, Zaki Abdullatif, Eius Rachmawati, Shema Mukti Anggraeni serta teman-teman seperjuangan
Fast Tract yaitu Amalia Putri Firdausi dan Kurdianto. Tak lupa penulis mengucapkan terimakasi kepada teman-teman Budidaya Perairan angkatan 47 dan teman-teman Ilmu Akuakultur 2013 khususnya Erni Susanti, Haezy dan Shavika Miranti.
7. Para tenaga kerja pembenihan ikan gurame di Kecamatan Ciomas khususnya kepada Bapak Harahap dan Bapak Ari.
8. Para laboran di Departemen Budidaya Perairan seperti Bapak Ranta, Ibu Lina, Bapak Abe dan Bapak Jajang. Serta para tenaga administrasi Departemen Budidaya Perairan seperti Ibu Yuli, Bapak Mar dan Ibu Suri. 9. Balai Penelitian Tanaman Rempah dan Obat (Balitro) yang telah membatu
peneliti untuk mendapatkan ekstrak pelepah pisang dan membantu dalam pengujian kandungan bahan fitokimia pelepah pisang.
Semoga karya tesis ini memberikan sumbangsih dalam kemajuan dunia perikanan.
Bogor, November 2015
DAFTAR ISI
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vi
1 PENDAHULUAN ... 1
Latar Belakang ... 1
Perumusan Masalah ... 2
Tujuan Penelitian ... 3
2 METODE ... 3
Materi Uji ... 3
Rancangan Penelitian ... 3
Prosedur Penelitian ... 4
Parameter Uji ... 7
Analisis Data ... 10
3 HASIL DAN PEMBAHASAN ... 10
Hasil ... 10
Pembahasan ... 21
4 SIMPULAN DAN SARAN ... 27
Simpulan ... 27
Saran ... 27
DAFTAR PUSTAKA ... 28
LAMPIRAN ... 32
DAFTAR TABEL
1 Skor infeksi A. hydrophila pada ikan teleostei ... 8 2 Data kualitas air selama perlakuan in vivo dan kisaran optimum
kualitas air pada pemeliharaan ikan gurame ... 9 3 Jenis dan kandungan fitokimia pelepah pisang ambon
Musa paradisiaca ... 10 4 Diameter zona hambat ekstrak pelepah pisang 1%, 2%, 3% dan 4%
terhadap bakteri A. hydrophila dan Streptococcus sp. ... 10 5 Skor gejala klinis ikan gurame pascainfeksi A. hydrophila pada
perlakuan kontrol positif (K+), pencegahan (PC), pengobatan
(PO) dan pengendalian (PG) ... 13 6 Total bakteri A. hydrophila pascauji tantang pada ikan gurame untuk
perlakuan kontrol negatif (K-), kontrol positif (K+), pencegahan (PC),
pengobatan (PO) dan pengendalian (PG) ... 20
DAFTAR GAMBAR
1 Skema waktu pengambilan sampel selama uji in vivo
(gambaran darah/GD meliputi hemoglobin, hematokrit, total eritrosit, total leukosit dan diferensial leukosit), (aktivitas lisozim/AL),
(respiratory bust activity/RBA), (total bakteri A. hydrophila),
(-)hari sebelum uji tantang, (+) hari setelah uji tantang ... 6 2 Skema perlakuan saat uji in vivo , (pakan tanpa ekstrak ),
(pakan ekstrak 3% ), (hari prauji tantang -),
(hari pascauji tantang +) ... 7 3 Kelangsungan hidup ikan gurame pascainfeksi A. hydrophila
pada akhir perlakuan (K- = kontrol negatif, K+ = kontrol positif,
PC = pencegahan, PO = pengobatan dan PG = pengendalian) ... 11 4 Kondisi klinis ikan gurame pascainjeksi PBS pada perlakuan
kontrol negatif dihari ke 2 (H+2), ke 5 (H+5)
dan ke 7 H+7 pascauji tantang ... 11 5 Kondisi klinis ikan gurame pascainfeksi A. hydrophila pada perlakuan
kontrol positif dihari ke 2 (H+2), ke 5 (H+5)
dan ke 7 H+7 pascauji tantang ... 12 6 Kondisi klinis ikan gurame pascainfeksi A. hydrophila pada perlakuan
pencegahan dihari ke 2 (H+2), ke 5 (H+5)
dan ke 7 H+7 pascauji tantang ... 12 7 Kondisi klinis ikan gurame pascainfeksi A. hydrophila pada perlakuan pengobatan dihari ke 2 (H+2), ke 5 (H+5)
dan ke 7 H+7 pascauji tantang ... 12 8 Kondisi klinis ikan gurame pascainfeksi A. hydrophila pada perlakuan
pengendalian dihari ke 2 (H+2), ke 5 (H+5)
dan ke 7 H+7 pascauji tantang ... 12 9 Persen prevalensi ikan gurame pascainfeksi A. hydrophila pada
perlakuan kontrol positif (K+), pencegahan (PC),
10 Jumlah konsumsi pakan (JKP) pada semua perlakuan selama uji in vivo 17 Diferensial leukosit pada hari ke 14 (H-14) prauji tantang pada
semua perlakuan, (K- = kontrol negatif, K+ = kontrol positif,
PC = pencegahan, PO = pengobatan dan PG = pengendalian)... 19 18 Diferensial leukosit pada hari ke 1 (H-1) prauji tantang pada
semua perlakuan, (K- = kontrol negatif, K+ = kontrol positif,
PC = pencegahan, PO = pengobatan dan PG = pengendalian)... 19 19 Diferensial leukosit pada hari ke 2 (H+2) pascauji tantang pada
semua perlakuan, (K- = kontrol negatif, K+ = kontrol positif,
PC = pencegahan, PO = pengobatan dan PG = pengendalian)... 19 20 Diferensial leukosit pada hari ke 5 (H+5) pascauji tantang pada
semua perlakuan, (K- = kontrol negatif, K+ = kontrol positif,
21 Diferensial leukosit pada hari ke 7 (H+7) pascauji tantang pada semua perlakuan, (K- = kontrol negatif, K+ = kontrol positif,
PC = pencegahan, PO = pengobatan dan PG = pengendalian) ... 20
22 Tingkat kematian harian ikan gurame sebelum uji tantang (H0) dan setelah uji tantang (H+), (K- = kontrol negatif, K+ = kontrol positif, PC = pencegahan, PO = pengobatan dan PG = pengendalian) ... 21
DAFTAR LAMPIRAN
1 Hasil karakterisasi sifat biokimia dan fisiologis bakteri A. hydrophila yang dibandingkan dengan hasil uji dari Austin & Austin (2007)... 322 Perhitungan lethal dosage 50 pada ikan gurame yang diinfeksi A. hydrophila ... 32
3 Sketsa posisi wadah saat penelitian... 33
4 Prosedur pengujian hematologi ... 33
4.1 Menghitung kadar hemoglobin ... 34
4.2 Menghitung hematokrit ... 33
4.3 Menghitung total sel darah merah ... 33
4.4 Menghitung total sel darah putih ... 34
4.5 Diferensiasi leukosit ... 34
5 Prosedur pengujian respiratory burst activity ... 34
6 Prosedur pengujian aktivitas lisozim ... 35
7 Analisis statistik zona hambat ekstrak pelepah pisang ambon dosis 1%, 2%, 3% dan 4% ... 35
8 Analisis statistik kelangsungan hidup ikan gurame pada akhir perlakuan .... 36
9 Analisis statistik aktivitas lisozim pada H-14,H-1, H+2, H+5 dan H+7 untuk semua perlakuan ... 36
10 Analisis statistik aktivitas respiratory burst pada H-14,H-1, H+2, H+5 dan H+7 untuk semua perlakuan ... 37
11 Analisis statistik profil darah ikan gurame pada H-14, H-1, H+2, H+5 dan H+7 untuk semua perlakuan ... 39
11.1 Analisis statistik hemoglobin darah ikan gurame pada H-14, H-1, H+2, H+5 dan H+7 ... 40
11.2 Analisis statistik hematokrit darah ikan gurame pada H-14, H-1, H+2, H+5 dan H+7 ... 41
11.3 Analisis statistik total eritrosit darah ikan gurame pada H-14, H-1, H+2, H+5 dan H+7 ... 42
11.4 Analisis statistik total leukosit darah ikan gurame pada H-14, H-1, H+2, H+5 dan H+7 ... 43
1
PENDAHULUAN
Ikan gurame merupakan jenis ikan air tawar yang mempunyai nilai ekonomis tinggi serta jumlah produksi yang selalu meningkat. Hal tersebut didukung dengan data statistik produksi ikan gurame pada tahun 2009 sebesar 46.254 ton dan tahun 2013 sebesar 94.602 ton yang menunjukkan adanya peningkatan produksi (DITJEN PB 2013). Salah satu cara untuk meningkatkan produksi yaitu dengan intensifikasi melalui peningkatan padat tebar. Namun peningkatan padat tebar akan berdampak negatif terhadap organisme budidaya. Menurut Ashley (2006) peningkatan padat tebar dalam budidaya akan berdampak pada perubahan fisiologis dari ikan. Respons fisiologis yang muncul dari peningkatan padat tebar yaitu meningkatnya hormon kortisol di dalam tubuh yang memicu ikan stres. Stres pada ikan akan berdampak pada tingkat imunitas yang rendah atau immunosuppresor sehingga ikan akan mudah terserang penyakit.
Penyakit dibedakan menjadi dua yaitu penyakit infeksi dan penyakit bukan infeksi. Penyakit infeksi disebabkan oleh agen penginfeksi seperti virus, bakteri, fungi dan parasit yang dapat menyebabkan permasalahan dalam kegiatan budidaya. Permasalahan yang disebabkan oleh agen penginfeksi seperti kematian ikan mencapai 80-90% dari populasi awal. Tingginya tingkat mortalitas tersebut disebabkan oleh tingginya tingkat virulensi dari agen penginfeksi. Salah satu agen penginfeksi yang sering menyerang ikan air tawar khususnya ikan gurame adalah bakteri dari golongan Aeromonas hydrophila (Minaka 2012).
Bakteri A. hydrophila bersifat oportunistik serta dapat bersifat toksik ketika kondisi lingkungan buruk. Tipe infeksi dari serangan A. hydrophila bersifat akut, kronis hingga laten dengan membentuk infeksi septisemia atau lebih dikenal dengan nama penyakit hemorrhagic septicaemia atau motile aeromonad septicaemia (MAS) (Ismail et al. 2010). Kondisi klinis pada tipe infeksi akut yaitu terjadi peradangan yang sistemik dan dapat mengakibatkan kematian ikan dalam jangka waktu 24 sampai 48 jam. Tipe infeksi kronis ditandai dengan kerusakan pada bagian sirip, lesi pada kulit dan gerakan renang lemah (Ibrahem et al. 2008).
Permasalahan penyakit bakterial dapat ditanggulangi dengan manajemen kesehatan ikan melalui pengendalian penyebaran infeksi. Pengendalian penyebaran infeksi dapat dilakukan melalui dua cara yaitu pencegahan dan pengobatan. Kegiatan pencegahan dilakukan dengan memberi tindakan untuk menghindari efek infeksi dari penyakit. Kegiatan pengobatan merupakan langkah responsif setelah terjadi infeksi untuk mengurangi ataupun menghilangkan efek infeksi dari agen infeksius (Direktorat Kesehatan Ikan dan Lingkungan 2009).
2
(Kahuripan et al. 2009). Selain itu antibiotik dapat mempengaruhi sensitivitas dan dapat menyebabkan bioakumulasi di dalam tubuh ikan (Citarusu 2010).
Alternatif penanggulangan infeksi A. hydrophila yang aman serta efektif dengan menggunakan imunostimulan. Imunostimulan merupakan komponen biologi yang dapat meningkatkan sistem imun non-spesifik seluler dan humoral inang saat terjadi paparan patogen. Contoh dari imunostimulan adalah levamisole, ß-glucan, peptidoglikan, kitin, kitosan, kapang, kombinasi vitamin dan yang sangat umum adalah produk turunan dari tumbuhan atau dikenal dengan istilah fitofarmaka, fitofarmaka secara efektif digunakan untuk mengendalikan infeksi penyakit (Gopalakannan et al. 2006). Fitofarmaka berdasarkan peraturan Menteri Kesehatan RI No. 760/Menkes/Per/IX/1992 adalah tumbuhan untuk obat yang bahan bakunya terdiri dari simplisia dan sediaan galenik yang telah terbukti keamanan dan khasiatnya. Perkembangan penggunaan fitofarmaka di masyarakat dunia semakin meningkat karena sifat fitofarmaka yang biodegradable (Maggon 2009). Peningkatan konsumsi fitofarmaka dari US $550 pada tahun 2004 menjadi US $900 pada tahun 2008 menunjukkan adanya efek positif dari fitofarmaka seperti antibakteri, antistres, antioksidan, imunostimulan, aman dan dapat meningkatkan pertumbuhan (Citarusu 2010).
Fitofarmaka yang dapat digunakan salah satunya adalah pelepah pisang karena ketersediaannya yang melimpah khususnya di negara tropis seperti Indonesia dan merupakan bahan limbah (Alawi et al. 2013). Pelepah pisang mengandung bahan fitokimia. Bahan fitokimia yang terdapat di dalam pelepah pisang meliputi asam askorbat, ß karoten, likopen, flavonoid, tanin, saponin dan alkaloid (Apriasari et al. 2013). Kandungan fitokimia pelepah pisang dapat menghambat aktivitas bakteri serta dapat meningkatkan imunitas (Citarusu 2010). Efektivitas pelepah pisang telah diujikan pada bakteri A. hydrophila yang diinjeksikan ke dalam tubuh ikan gurame dengan metode perendaman dan didapatkan hasil bahwa pelepah pisang efektif mengendalikan infeksi bakteri tersebut (Fitrianingrum 2014). Oleh karena itu perlu penelitian lebih lanjut mengenai efektivitas ekstrak pelepah pisang dalam menghambat aktivitas A. hydrophila dan kemampuan pelepah pisang dalam meningkatkan imunitas ikan gurame pascainfeksi A. hydrophila yang diberikan lewat pakan.
Perumusan Masalah
Wabah penyakit pada ikan dapat melibatkan berbagai faktor yaitu faktor lingkungan, patogen serta inang. Patogen infeksius seperti bakteri sering dianggap sebagai penyebab utama terjangkitnya penyakit ikan air tawar khusnya ikan gurame dengan agen penginfeksinya yaitu A. hydrophila. Bakteri A. hydrophila
dapat menyebabkan penyakit MAS yang akan berakibat pada kematian ikan. Penanggulangan infeksi bakteri A. hydrophila dilakukan melalui tindakan pencegahan, pengobatan dan pengendalian dengan menggunakan produk turunan dari tumbuhan atau yang disebut dengan istilah fitofarmaka.
3
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji efektivitas ekstrak pelepah pisang ambon Musa paradisiaca dalam menghambat aktivitas A. hydrophila dan menginduksi respons imunitas ikan gurame.
2
METODE
Materi Uji
Materi uji yang digunakan dalam penelitian ini adalah benih ikan gurame
Osphronemus goramy dengan bobot (15,7±0,31 g) yang diperoleh dari pembudidaya ikan gurame di Kecamatan Ciomas, Bogor. Bakteri penginfeksi benih ikan gurame adalah A.hydrophila yang merupakan koleksi bakteri dari Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Institut Pertanian Bogor. Fitofarmaka berupa pelepah pisang ambon Musa paradisiaca yang diperoleh di sekitar kampus Dramaga, Bogor.
Rancangan Penelitian
Rancangan penelitian terdiri atas dua bagian yaitu rancangan penelitian in in vitro dan in vivo. Rancangan penelitian in vitro untuk perlakuan zona hambat menggunakan rancangan acak lengkap (RAL) dengan lima perlakuan dan masing-masing tiga kali ulangan yaitu ekstrak pelepah pisang dosis 0%, 1%, 2%, 3% dan 4%. Sedangkan untuk rancangan penelitian in vivo menggunakan rancangan acak lengkap (RAL) dengan lima perlakuan dan tiga kali ulangan meliputi:
A. Kontrol negatif : Pemberian pakan tanpa ekstrak, selanjutnya diinjeksi dengan Phosphat Buffer Saline (PBS) dan setelah injeksi PBS pemberian pakan tanpa ekstrak kembali.
B. Kontrol positif : Pemberian pakan tanpa ekstrak, selanjutnya diuji tantang dengan A. hydrophila dan setelah uji tantang pemberian pakan tanpa ekstrak kembali.
C. Pencegahan : Pemberian pakan ekstrak 3%, selanjutnya uji tantang dengan A. hydrophila dan setelah uji tantang pemberian pakan tanpa ekstrak.
D. Pengobatan : Pemberian pakan tanpa ekstrak, selanjutnya uji tantang dengan A. hydrophila dan setelah uji tantang pemberian pakan dengan ekstrak 3%.
4
Prosedur Penelitian
Penyediaan Bakteri Uji
Bakteri uji yang digunakan adalah A. hydrophila. Bakteri selanjutnya digores pada media tripticase soy agar (TSA) cawan sampai mendapatkan koloni tunggal, kemudian koloni tersebut digores kembali di media TSA miring untuk memperluas bidang tumbuhnya.
Bakteri yang dikultur pada agar miring selanjutnya dikarakterisasi sifat gram, biokimia dan fisiologis untuk memastikan bakteri yang dikultur adalah A. hydrophila (Holt et al. 1994). Uji pewarnaan gram bakteri meliputi sifat gram dan bentuk sel bakteri, sedangkan uji biokimia dan fisiologis terdiri atas uji oksidatif/fermentatif, motilitas, oksidase dan katalase. Hasil identifikasi menunjukkan isolat bakteri adalah gram negatif, bentuk batang dengan warna koloni putih kekuningan, elevasi cembung (entire) dan tepian halus. Hasil uji biokimia juga menunjukkan karakteristik yang sama dengan hasil uji biokimia oleh Austin dan Austin (2007) sehingga dapat disimpulkan bahwa bakteri yang diuji adalah bakteri A. hydrophila. Hasil uji dapat dilihat pada Lampiran 1.
Sediaan bakteri yang telah teridentifikasi kemudian ditingkatkan virulensinya dengan menyuntikkan bakteri pada ikan yang sehat melalui intramuskular dengan dosis 0,1 mL/ekor. Ikan yang telah disuntik bakteri dan telah menunjukkan gejala klinis diisolasi untuk mendapatkan bakteri yang disuntikkan. Isolasi bakteri dari tubuh ikan dilakukan dengan cara menggoreskan jarum ose pada ginjal, kemudian ose yang mengandung bakteri dari ginjal tersebut di gores pada media TSA cawan. Bakteri hasil isolasi diuji kembali sifat gram, biokimia dan fisiologisnya untuk memastikan bahwa bakteri yang terisolasi dari ginjal tersebut adalah A. hydrophila.
Bakteri yang virulen digunakan untuk uji LD50 (lethal dosage 50) dengan tujuan menentukan kepadatan bakteri yang dapat mematikan setengah dari populasi ikan. Pengujian LD50 dilakukan dengan menyuntikkan sediaan bakteri kepadatan 106, 107 dan 108 CFU/mL pada ikan dengan dosis penyuntikan 0.1 mL/ekor secara intramuscular. Setiap konsentrasi bakteri yang berbeda terdiri atas 2 kali ulangan dengan setiap ulangan terdapat 5 ekor ikan. Setelah 7 hari pemeliharaan, jumlah ikan yang mati dihitung menggunakan metode Reed dan Muench (1938) (Lampiran 2). Kepadatan bakteri yang menyebabkan kematian ikan sebesar 50% digunakan untuk uji tantang saat perlakuan uji in vivo.
Uji Zona Hambat
5
Persiapan Wadah
Wadah yang digunakan yaitu akuarium dengan dimensi 60x30x30 cm sebanyak 15 akuarium. Akuarium diisi dengan air setinggi 20 cm, kemudian didesinfeksi dengan bahan kimia berupa klorin. Klorin dilarutkan ke dalam air hingga konsentrasi 30 ppm, selanjutnya ditambahkan aerasi selama 24 jam di dalam media yang telah diklorin, untuk menetralisir klorin digunakan thiosulfat dengan dosis 15 ppm. Di bagian luar dinding akuarium dilapisi plastik berwarna hitam untuk mengurangi tingkat stres pada ikan. Heater ditambahkan untuk mempertahankan nilai kisaran suhu. Skema wadah pemeliharaan disajikan pada (Lampiran 3).
Persiapan Ikan Uji
Masing-masing akuarium diisi ikan gurame sebanyak 10 ekor dan ikan gurame diadaptasi di dalam akuarium selama tujuh hari sampai ikan menunjukkan respons makan yang baik. Saat dilakukan proses adaptasi ikan diberi pakan pelet apung komersial (PF 1000), frekuensi pemberian pakan sebanyak 3 kali yang diberikan pada pagi, siang dan sore dengan Feeding Rate (FR) 3%. Selama proses adaptasi juga dilakukan pengontrolan kualitas air.
Ekstraksi Pelepah Pisang Ambon Musa paradisiaca
Ekstraksi pelepah pisang diawali dengan pembuatan tepung pelepah pisang. Cara yang digunakan untuk menepungkan pelepah pisang adalah dengan memotong pelepah pisang menjadi bagian yang lebih kecil dengan ukuran tiap potongan yaitu dua cm. Pelepah pisang yang telah dipotong selanjutnya dioven pada suhu 45°C untuk mengurangi kadar air bahan, kemudian bahan dihaluskan dengan menggunakan mesin penghalus untuk mendapatkan tepung pelepah pisang. Tepung pelepah pisang ditimbang sebanyak 25 g lalu dicampur dengan metanol 100 mL dan dihomogenkan dengan mesin pengaduk selama kurang lebih tiga jam untuk mendapatkan endapan. Endapan dikondensasi selama 24 jam dan akan didapatkan filtrat serta ampas. Ampas sebanyak 100 mg dicampur dengan metanol 20 mL dan diaduk selama satu jam untuk mendapatkan filtrat kembali. Filtrat pelepah pisang yang didapat diuapkan dengan rotavapor untuk mendapatkan ekstrak pelepah pisang yang kental (Sakunphueak dan Panichayupakarant 2010).
Pembuatan Pakan Uji
6
Uji in Vivo
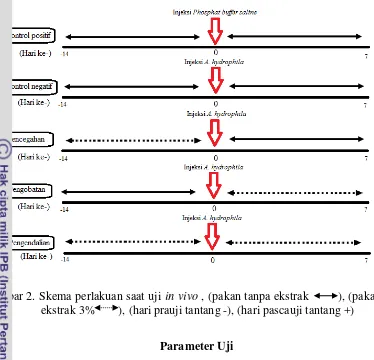
Uji in vivo digunakan untuk mengetahui pengaruh pelepah pisang terhadap kelangsungan hidup ikan gurame yang telah diinfeksi A. hydrophila. Pengujian dilakukan selama 21 hari dengan jumlah ikan 10 ekor setiap akuarium. Selama perlakuan, pakan diberikan tiga kali sehari yaitu pagi (07.00 WIB), siang (12.00 WIB) dan sore (17.00 WIB) secara restricted dengan FR 3% namun pascauji tantang metode pemberian pakan secara ad satiation. Pengontrolan kualitas air juga dilakukan dengan cara pergantian air setiap dua hari sekali sebanyak 30% serta dilakukan penyifonan setiap hari. Selama pemeliharaan, ikan yang mati dibedah untuk diamati kondisi organ dalam sebagai indikasi adanya pengaruh ekstrak pelepah pisang terhadap infeksi A. hydrophila. Pada saat uji in vivo juga dilakukan pengamatan kelimpahan bakteri A. hydrophila, kondisi klinis ikan gurame pascauji tantang, pola kematian harian ikan gurame dan pengamatan status imunitas ikan gurame. Berikut disajikan skema waktu pengambilan sampel selama pada uji in vivo (Gambar 1) dan juga disajikan skema perlakuan uji saat uji in vivo (Gambar 2).
7
Gambar 2. Skema perlakuan saat uji in vivo , (pakan tanpa ekstrak ), (pakan ekstrak 3% ), (hari prauji tantang -), (hari pascauji tantang +)
Parameter Uji
Jenis dan Kandungan Fitokimia Ekstrak Pelepah Pisang Ambon
Jenis fitokimia didalam pelepah pisang diuji dengan metode dari Mikail (2010) dan kuantifikasi fitokimia pelepah pisang diukur dengan menggunakan metode dari Venkatesh et al. (2014).
Zona Hambat
Pengukuran zona hambat dilakukan menggunakan penggaris dengan ketelitian 1 mm. Efektivitas ekstrak pelepah pisang dapat dilihat dari diameter zona bening yang dihasilkan di sekitar kertas cakram.
Jumlah Konsumsi Pakan
Jumlah konsumsi pakan dihitung dengan menggunakan rumus berikut: Jumlah konsumsi pakan (g) = jumlah pakan awal (g) - jumlah pakan sisa (g)
Gambaran Darah
8
Perhitungan Populasi Bakteri A. hydrophila
Penghitungan populasi bakteri A. hydrophila dilakukan pada H+5 (hari ke 5 pascauji tantang). Organ yang digunakan untuk menghitung jumlah bakteri A. hydrophila adalah ginjal. Ginjal ikan pada setiap perlakuan diambil sebanyak 1 g kemudian ginjal dihaluskan dan dilarutkan kedalam 9 mL Phosphat Buffer Saline. Filtrat yang didapat diencerkan secara berseri dari 10-1 sampai 10-9. Setiap pengenceran diambil sebanyak 0,05 mL untuk disebar pada media selektif A. hydrophila yaitu GSP (glutamat starch phenil). Populasi bakteri yang tumbuh ditentukan dalam colony forming unit (CFU) setelah diinkubasi selama 24 jam dan dapat dihitung dengan rumus sebagai berikut:
Kelangsungan Hidup
Pengamatan kelangsungan hidup ikan dilakukan setiap hari selama pemeliharaan dan tingkat kelangsungan hidup ikan gurame diakumulasi di akhir perlakuan dengan formulasi sebagai berikut:
Tingkat Kematian Harian pada Ikan gurame
Tingkat kematian harian ikan gurame dihitung dengan menjumlahkan ikan yang mati pada semua ulangan untuk masing-masing perlakuan.
Gejala Klinis Infeksi Bakteri A. hydrophila pada Ikan Gurame
Pengamatan gejala klinis dilakukan pascainjeksi A. hydrophila sampai dengan 7 hari pascainjeksi. Setiap ikan pada masing-masing perlakuan mempunyai skor gejala klinis. Skor gejala klinis tersebut diakumulasikan diakhir perlakuan dan pengambilan skor gejala klinis berdasarkan tingkat keparahan efek infeksi dari bakteri A. hydrophila, sehingga setiap ikan tidak mempunyai skor klinis ganda. Berikut disajikan skor infeksi A. hydrophila pada ikan teleostei menurut Angka (2005) (Tabel 1).
Tabel 1. Skor infeksi A. hydrophila pada ikan teleostei
Prevalensi
Perhitungan prevalensi tersebut dilakukan pada akhir perlakuan dengan formulasi sebagai berikut (Dogiel et al.1970).
Kondisi klinis Skor
Radang 1
Hemoragi 2
Tukak 3
9 Respiratory Burst (Metode NBT-Assay)
Produksi oksigen radikal dari proses fagositosis terhadap benda asing di dalam tubuh ikan dapat dilihat dengan pewarnaan nitroblue tetrazolium (NBT) seperti yang dilakukan Anderson dan Siwicki (1995). Analisis produksi oksigen radikal dengan menggunakan NBT dilakukan dengan menggunakan spektrofotometer pada panjang gelombang 630 nm (Lampiran 6).
Aktivitas Lisozim
Lisozim adalah enzim hidrolitik yang terdapat di dalam kelenjar mukus dan plasma yang dapat menghancurkan bakteri. Pengujian aktivitas lisozim ini dilakukan berdasarkan metode Ellis (2011) (Lampiran 7). Pengujian ini dilakukan untuk mengetahui konsentrasi lisozim yang terdapat didalam plasma. Satuan per unit dari aktivitas lisozim dihitung berdasarkan penurunan hasil pembacaan absorbansi untuk setiap 0,1/menit/mL plasma. Selanjutnya hasil tersebut dikonversi dengan menggunakan rumus berikut:
Konsentrasi lisozim (IU/mL/menit) = [(OD5m – OD20m)x 1000] x [1/(txs)] Keterangan:
1000 = Konversi hasil absorbansi (OD) menjadi IU t = Waktu (menit)
s = Jumlah sampel plasma (mL)
OD5m = Pembacaaan optikal densitas detik menit ke-5 OD20m = Pembacaaan optikal densitas menit ke-20
Parameter Kualitas Air
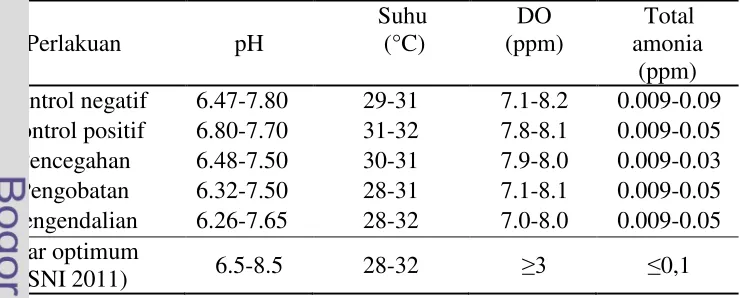
Parameter kualitas air yang diukur yaitu pH, suhu, Dissolve Oxygen (DO) dan total amonia. Pengukuran pH dan DO dengan menggunakan pH meter (pH-208) dan DO meter (DO-5510) sedangkan pengukuran total amonia menggunakan Spektrofotometer (SP-300). Pengukuran parameter kualitas air dilakukan saat awal, tengah dan akhir pemeliharaan, kecuali parameter suhu dilakukan harian yaitu saat pagi hari. Hasil pengukuran kualitas air selama perlakuan in vivo (Tabel 2).
Tabel 2. Data kualitas air selama perlakuan in vivo dan kisaran optimum kualitas air pada pemeliharaan ikan gurame Kontrol negatif 6.47-7.80 29-31 7.1-8.2 0.009-0.09
Kontrol positif 6.80-7.70 31-32 7.8-8.1 0.009-0.05 Pencegahan 6.48-7.50 30-31 7.9-8.0 0.009-0.03 Pengobatan 6.32-7.50 28-31 7.1-8.1 0.009-0.05 Pengendalian 6.26-7.65 28-32 7.0-8.0 0.009-0.05 Standar optimum
10
Analisis Data
Data yang diperoleh diuji statistik ANOVA dan uji jarak berganda Tukey dengan tingkat kesalahan 5% (α=5%) serta tingkat keyakinan uji sebesar 95%. Parameter yang dianalisis secara kuantitatif adalah kelangsungan hidup, zona hambat, skor gejala klinis, respiratory burst, gambaran darah dan aktivitas lisozim sedangkan parameter yang dianalisis secara deskriptif yaitu jumlah konsumsi pakan, tingkat kematian harian ikan gurame dan diferensial leukosit.
3
HASIL DAN PEMBAHASAN
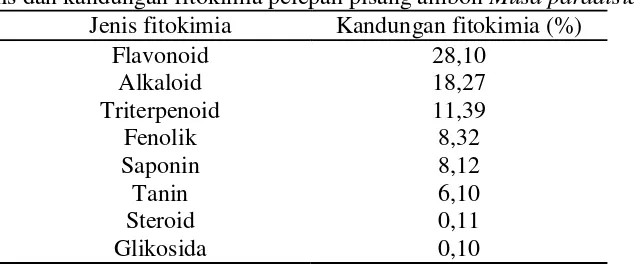
Hasil pengujian jenis fitokimia dan kandungan fitokimia pelepah pisang disajikan pada Tabel 3. Hasil uji menunjukkan bahwa pelepah pisang mengandung bahan aktif seperti alkaloid, flavonoid, triterpenoid, steroid, tanin, fenolik dan glikosida. Persentase fitokimia paling tinggi yaitu flavonoid sebesar 28,10% dan terendah adalah glikosida sebesar 0,10%.
Tabel 3. Jenis dan kandungan fitokimia pelepah pisang ambon Musa paradisiaca
Jenis fitokimia Kandungan fitokimia (%)
Flavonoid 28,10
Ekstrak pelepah pisang ambon 3% dan 4% dapat menghambat aktivitas A. hydrophila dan menghasilkan diameter zona hambat terbesar yaitu 1,15 cm. Perlakuan tersebut secara signifikan (P<0,05) lebih tinggi dibandingkan dengan perlakuan 1% dan 2% yang menghasilkan diameter zona hambat sebesar 0,8 cm dan 0,9 cm. Efek inhibitor ekstrak pelepah pisang terhadap Streptococcus sp. tertinggi pada perlakuan 4% dengan diameter zona hambat 0,69 cm dan terendah pada perlakuan 1% sebesar 0,55 cm (Tabel 4).
Tabel 4. Diameter zona hambat ekstrak pelepah pisang 1%, 2%, 3% dan 4% terhadap bakteri A. hydrophila dan Streptococcus sp.
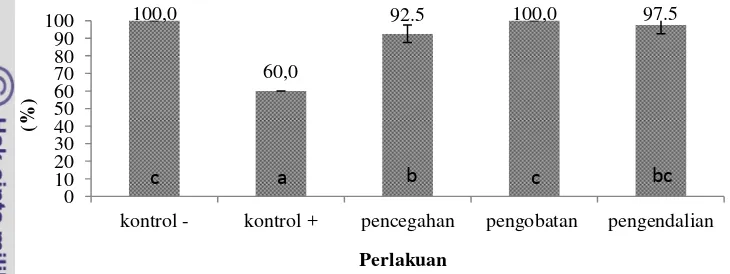
11 Persentase kelangsungan hidup ikan gurame perlakuan kontrol negatif, pengobatan dan pengendalian secara signifikan (P<0,05) paling tinggi dibandingkan dengan kontrol positif dan pencegahan, namun kelangsungan hidup ikan gurame pada perlakuan pencegahan secara signifikan (P<0,05) lebih tinggi dibandingkan dengan kontrol positif. Kelangsungan hidup ikan pada perlakuan kontrol negatif dan pengobatan adalah 100 %, kontrol positif 60%, pencegahan 92.5% dan pengobatan 97.5% (Gambar 3; Lampiran 9).
Keterangan: *Huruf yang berbeda pada setiap perlakuan menunjukkan hasil yang berbeda nyata (P<0,05)
Gambar 3. Kelangsungan hidup ikan gurame pascainfeksi A. hydrophila pada akhir perlakuan (K- = kontrol negatif, K+ = kontrol positif, PC = pencegahan, PO = pengobatan dan PG = pengendalian)
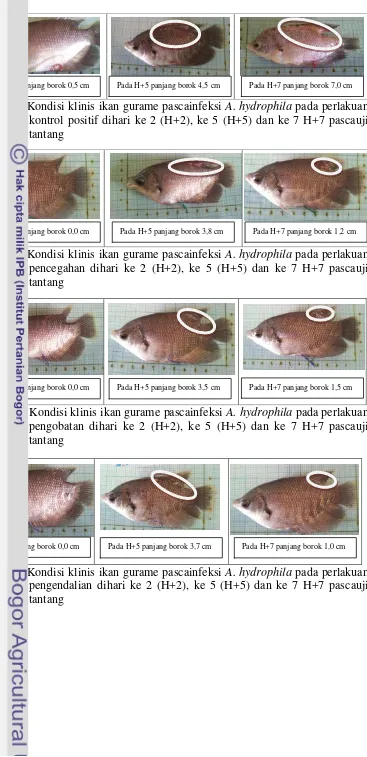
Gejala klinis ikan gurame pascainfeksi A. hydrophila pada perlakuan kontrol positif mengindikasikan efek infeksi paling parah dibandingkan dengan perlakuan yang lain. Efek klinis yang parah pada perlakuan kontrol positif ditunjukkan dengan terbentuknya borok pada permukaan tubuh ikan yang semakin memanjang sampai hari ke 7 pascauji tantang (panjang borok H+2 sebesar 0,5 cm dan pada H+7 menjadi 7 cm) (Gambar 5). Pada perlakuan pencegahan, pengobatan dan pengendalian borok mulai terbentuk pada H+5 dengan panjang borok masing-masing sebesar 3,8, 3,5 dan 3,7 cm, namun pada H+7 panjang borok mengalami penyempitan menjadi 1,2, 1,5 dan 1 cm (Gambar 6, 7 dan 8). Efek klinis pascainjeksi PBS pada perlakuan kontrol negatif tidak ditemukan (Gambar 4).
kontrol - kontrol + pencegahan pengobatan pengendalian
K
Pada H+2 panjang borok 0,0 cm cm
Pada H+5 panjang borok 0,0 cm cm
12
Gambar 5. Kondisi klinis ikan gurame pascainfeksi A. hydrophila pada perlakuan kontrol positif dihari ke 2 (H+2), ke 5 (H+5) dan ke 7 H+7 pascauji tantang
Gambar 6. Kondisi klinis ikan gurame pascainfeksi A. hydrophila pada perlakuan pencegahan dihari ke 2 (H+2), ke 5 (H+5) dan ke 7 H+7 pascauji tantang
Gambar 7. Kondisi klinis ikan gurame pascainfeksi A. hydrophila pada perlakuan pengobatan dihari ke 2 (H+2), ke 5 (H+5) dan ke 7 H+7 pascauji tantang
Gambar 8. Kondisi klinis ikan gurame pascainfeksi A. hydrophila pada perlakuan pengendalian dihari ke 2 (H+2), ke 5 (H+5) dan ke 7 H+7 pascauji tantang
Pada H+2 panjang borok 0,5 cm Pada H+5 panjang borok 4,5 cm Pada H+7 panjang borok 7,0 cm
Pada H+2 panjang borok 0,0 cm Pada H+5 panjang borok 3,8 cm Pada H+7 panjang borok 1,2 cm
Pada H+2 panjang borok 0,0 cm Pada H+5 panjang borok 3,5 cm Pada H+7 panjang borok 1,5 cm
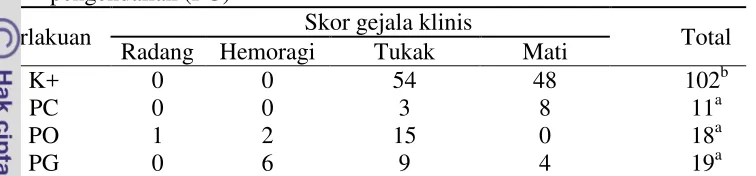
13 Skor gejala klinis pada perlakuan kontrol positif secara signifikan (P<0,05) paling tinggi dibandingkan perlakuan yang lain dengan nilai skor gejala klinis yaitu102. Sedangkan skor gejala klinis untuk perlakuan pencegahan, pengobatan dan pengendalian masing-masing adalah 11, 18 dan 19. Berikut disajikan skor gejala kinis ikan gurame pascainfeksi A. hydrophila pada perlakuan kontrol positif, pencegahan, pengobatan dan pengendalian (Tabel 5; Lampiran 14).
Tabel 5. Skor gejala klinis ikan gurame pascainfeksi A. hydrophila pada perlakuan kontrol positif (K+), pencegahan (PC), pengobatan (PO) dan pengendalian (PG)
Perlakuan Skor gejala klinis Total
Radang Hemoragi Tukak Mati (P<0,05); Nilai yang tertera merupakan nilai rata-rata.
Prevalensi merupakan metode yang digunakan untuk mengetahui persentase ikan yang sakit dari total ikan yang diperiksa. Persen prevalensi tertinggi yaitu pada perlakuan kontrol positif sebesar 100% dan terendah pada perlakuan pengendalian sebesar 6,7% (Gambar 9).
Gambar 9. Persen prevalensi ikan gurame pascainfeksi A. hydrophila pada perlakuan kontrol positif (K+), pencegahan (PC), pengobatan (PO) dan pengendalian (PG)
Jumlah konsumsi pakan sebelum dilakukan uji tantang mempunyai pola stagnan sebesar 6 g pada semua perlakuan. Setelah uji tantang (H+1) konsumsi pakan ikan mengalami penurunan secara drastis yakni 3 g pada perlakuan K-, PC, PO dan PG sedangkan pada K+ 0,5 g. Hari ke 2 pascauji tantang (H+2) terjadi peningkatan konsumsi pakan sebesar 4,5 g pada perlakuan K-, PC, PO dan PG sedangkan untuk K+ sebesar 1 g. Pada hari ke 3 pascauji tantang konsumsi pakan mulai stagnan kembali sampai akhir perlakuan. Pola konsumsi pakan pada perlakuan K-, PC, PO dan PG paling tinggi dibandingkan dengan perlakuan K+ yang konsumsi pakannya paling rendah di antara perlakuan yang lain (Gambar 10).
14
Gambar 10. Jumlah konsumsi pakan (JKP) pada semua perlakuan selama uji in vivo, (H0= JKP sebelum uji tantang, H1- H7= JKP setelah uji tantang, K- = kontrol negatif, K+ = kontrol positif, PC = pencegahan, PO = pengobatan dan PG = pengendalian)
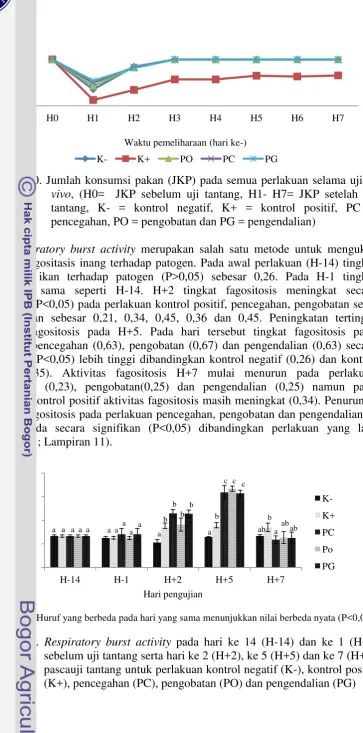
Respiratory burst activity merupakan salah satu metode untuk mengukur aktivitas fagositasis inang terhadap patogen. Pada awal perlakuan (H-14) tingkat fagositosis ikan terhadap patogen (P>0,05) sebesar 0,26. Pada H-1 tingkat fagositosis sama seperti H-14. H+2 tingkat fagositosis meningkat secara signifikan (P<0,05) pada perlakuan kontrol positif, pencegahan, pengobatan serta pengendalian sebesar 0,21, 0,34, 0,45, 0,36 dan 0,45. Peningkatan tertinggi aktivitas fagositosis pada H+5. Pada hari tersebut tingkat fagositosis pada perlakuan pencegahan (0,63), pengobatan (0,67) dan pengendalian (0,63) secara signifikan (P<0,05) lebih tinggi dibandingkan kontrol negatif (0,26) dan kontrol positif (0,35). Aktivitas fagositosis H+7 mulai menurun pada perlakuan pencegahan (0,23), pengobatan(0,25) dan pengendalian (0,25) namun pada perlakuan kontrol positif aktivitas fagositosis masih meningkat (0,34). Penurunan aktivitas fagositosis pada perlakuan pencegahan, pengobatan dan pengendalian di H+7 berbeda secara signifikan (P<0,05) dibandingkan perlakuan yang lain (Gambar 11; Lampiran 11).
Keterangan: *Huruf yang berbeda pada hari yang sama menunjukkan nilai berbeda nyata (P<0,05)
15
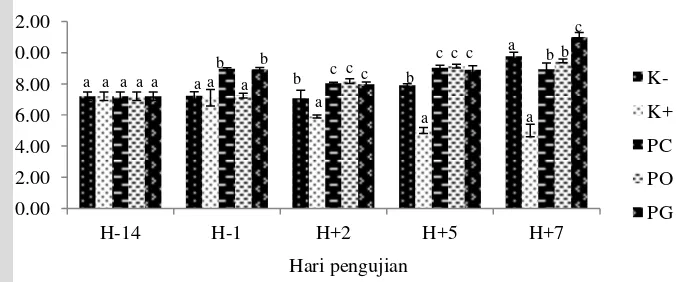
Aktivitas lisozim pada H-14 (P>0,05) pada semua perlakuan yaitu sebesar 259.33 IU/mL/menit. Aktivitas lisozim pada H-1 mengalami kenaikan menjadi 314.33 IU/mL/menit pada perlakuan pencegahan dan pengendalian serta secara signifikan (P<0,05) lebih tinggi dibandingkan dengan yang lain. Pada H+2 aktivitas lisozim pada perlakuan pengobatan dan pengendalian mengalami peningkatan menjadi 325 dan 355 IU/mL/menit serta signifikan(P<0,05) dengan perlakuan yang lain, sedangkan pada perlakuan pencegahan aktivitas lisozim mengalami penurunan menjadi 214 IU/mL/menit. Aktivitas lisozim H+5 mengalami peningkatan yang sangat signifikan (P<0,05) pada perlakuan pencegahan, pengobatan dan pengendalian yaitu 441, 330 dan 499IU/mL/menit namun pada perlakuan kontrol positif aktivitas lisozim masih mengalami penurunan 200 IU/mL/menit. Penurunan aktivitas lisozim secara signifikan (P<0,05) terjadi di H+7 pada perlakuan pencegahan (258 IU/mL/menit), pengobatan (250 IU/mL/menit) dan pengendalian (305 IU/mL/menit) sedangkan pada perlakuan kontrol negatif dan positif aktivitas lisozim relatif stagnan sebesar 180 IU/mL/menit (Gambar 12; Lampiran 10).
Keterangan: *Huruf yang berbeda pada hari yang sama menunjukkan nilai berbeda nyata (P<0,05)
Gambar 12. Aktivitas lisozim pada hari ke 14 (H-14) dan ke 1 (H-1) sebelum uji tantang serta hari ke 2 (H+2), ke 5 (H+5) dan ke 7 (H+7) pascauji tantang untuk perlakuan kontrol negatif (K-), kontrol positif (K+), pencegahan (PC), pengobatan (PO) dan pengendalian (PG)
16
Keterangan: *Huruf yang berbeda pada hari yang sama menunjukkan nilai berbeda nyata (P<0,05)
Gambar 13. Kadar hemoglobin pada hari ke 14 (H-14) dan ke 1 (H-1) sebelum uji tantang serta hari ke 2 (H+2), ke 5 (H+5) dan ke 7 (H+7) pascauji tantang untuk perlakuan kontrol negatif (K-), kontrol positif (K+), pencegahan (PC), pengobatan (PO) dan pengendalian (PG)
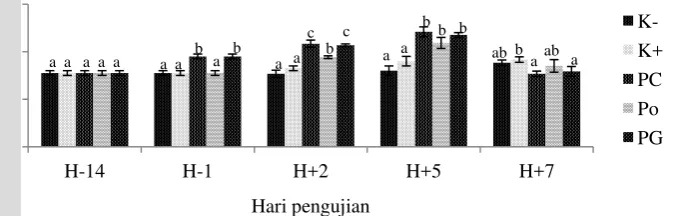
Persentase hemotokrit pada awal perlakuan yaitu 20,5%. Persentase hematokrit pada H-1 mengalami peningkatan. Pada perlakuan pencegahan dan pengendalian persentase hematokrit secara signifikan (P<0,05) lebih tinggi dibandingkan dengan perlakuan yang lain. Setelah H+2 pengujian, persentase hematokrit pada perlakuan pencegahan, pengobatan dan pengendalian secara signifikan (P<0,05) lebih tinggi dibandingkan yang lain. Pada H+5 nilai persentase hematokrit mulai naik kembali kecuali pada perlakuan kontrol positif yang masih mengalami penurunan. Pada H+7 persentase hematokit meningkat secara signifikan (P<0,05) menjadi 32, 32,4, 33,9 dan 36,5% pada perlakuan kontrol negatif, pencegahan, pengobatan serta pengendalian namun pada kontrol positif persentase hematokrit (18,16%) tidak menunjukkan kenaikan (Gamar 14; Lampiran 12.2).
Keterangan: *Huruf yang berbeda pada hari yang sama menunjukkan nilai berbeda nyata (P<0,05)
Gambar 14. Kadar hematokrit pada hari ke 14 (H-14) dan ke 1 (H-1) sebelum uji tantang serta hari ke 2 (H+2), ke 5 (H+5) dan ke 7 (H+7) pascauji tantang untuk perlakuan kontrol negatif (K-), kontrol positif (K+), pencegahan (PC), pengobatan (PO) dan pengendalian (PG)
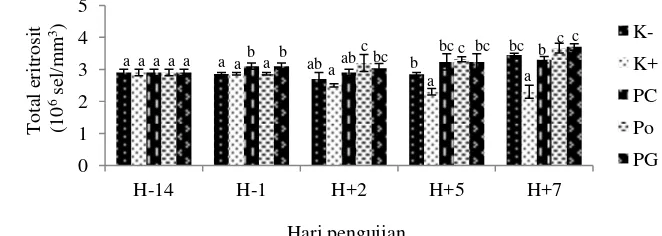
17 Total eritrosit pada H-14 sebesar 2,90x106 sel/mm3. Total eritrosit mengalami penurunan saat H-1 menjadi 2,86 x106 sel/mm3 pada perlakuan kontrol negatif, kontrol positif dan pengobatan namun pada perlakuan pencegahan dan pengendalian total eritrosit meningkat secara signifikan (P<0,05) menjadi 3,10 x106 sel/mm3. H+2 total eritrosit menurun pada semua perlakuan, kecuali pada perlakuan pengobatan meningkat menjadi 3,2 x106 sel/mm3. Total eritrosit pada H+5 dan H+7 mengalami peningkatan secara signifikan (P<0,05) pada semua perlakuan, namun total eritrosit pada perlakuan kontrol positif yang mengalami penurunan menjadi 2,30 x106 sel/mm3 (Gambar 15; Lampiran 12.3).
Keterangan: *Huruf yang berbeda pada hari yang sama menunjukkan nilai berbeda nyata (P<0,05)
Gambar 15. Total eritrosit pada hari ke 14 (H-14) dan ke 1 (H-1) sebelum uji tantang serta hari ke 2 (H+2), ke 5 (H+5) dan ke 7 (H+7) pascauji tantang untuk perlakuan kontrol negatif (K-), kontrol positif (K+), pencegahan (PC), pengobatan (PO) dan pengendalian (PG)
Total leukosit ikan gurame pada awal perlakuan sebesar 3,10x105 sel/mm3. Nilai total leukosit pada H-1 secara signifikan (P<0,05) meningkat untuk perlakuan pencegahan dan pengobatan. Nilai total leukosit terus meningkat sampai H+2 dan H+5. Pada (H+5) nilai total leukosit mencapai puncaknya pada perlakuan pencegahan, pengendalian dan pengobatan masing-masing dengan nilai leukositnya sebesar 4,75, 4,68 dan 4,3x105 sel/mm3. Ketiga perlakuan tersebut nilai total leukositnya secara signifikan (P<0,05) lebih tinggi dibandingkan dengan perlakuan kontrol negatif dan positif. Total leukosit mulai menurun secara signifikan (P<0,05) pada H+7 pada perlakuan pencegahan, pengobatan serta pengendalian. Total leukosit pada perlakuan kontrol positif masih meningkat sampai akhir perlakuan (H+7) sebesar 3,67 sel/mm3 (Gambar 16; Lampiran 12.4).
18
Keterangan: *Huruf yang berbeda pada hari yang sama menunjukkan nilai berbeda nyata (P<0,05)
Gambar 16. Total leukosit pada hari ke 14 (H-14) dan ke 1 (H-1) sebelum uji tantang serta hari ke 2 (H+2), ke 5 (H+5) dan ke 7 (H+7) pascauji tantang untuk perlakuan kontrol negatif (K-), kontrol positif (K+), pencegahan (PC), pengobatan (PO) dan pengendalian (PG)
19
Gambar 17. Diferensial leukosit pada hari ke 14 (H-14) prauji tantang pada semua perlakuan, (K- = kontrol negatif, K+ = kontrol positif, PC = pencegahan, PO = pengobatan dan PG = pengendalian)
Gambar 18. Diferensial leukosit pada hari ke 1 (H-1) prauji tantang pada semua perlakuan, (K- = kontrol negatif, K+ = kontrol positif, PC = pencegahan, PO = pengobatan dan PG = pengendalian)
Gambar 19. Diferensial leukosit pada hari ke 2 (H+2) pascauji tantang pada semua perlakuan, (K- = kontrol negatif, K+ = kontrol positif, PC = pencegahan, PO = pengobatan dan PG = pengendalian)
Gambar 20. Diferensial leukosit pada hari ke 5 (H+5) pascauji tantang pada semua perlakuan, (K- = kontrol negatif, K+ = kontrol positif, PC = pencegahan, PO = pengobatan dan PG = pengendalian)
20
Gambar 21. Diferensial leukosit pada hari ke 7 (H+7) pascauji tantang pada semua perlakuan, (K- = kontrol negatif, K+ = kontrol positif, PC = pencegahan, PO = pengobatan dan PG = pengendalian)
Jumlah bakteri A. hydrophila pada ikan gurame sebelum uji tantang yaitu 8,0x106 CFU/g. Jumlah bakteri tersebut meningkat setelah dilakukan uji tantang dengan A. hydrophila menjadi 3,1x108, 1,5x107, 1,1x107 dan 8,0x106 CFU/g pada perlakuan kontrol positif, pencegahan, pengobatan dan pengendalian. Sedangkan untuk kontrol negatif yang diinjeksi dengan Phosphate Buffer Saline jumlah total bakteri A. hydrophila yaitu 4,0 x106 CFU/g. Jumlah bakteri A. hydrophila secara signifikan (P<0,05) paling tinggi pada perlakuan kontrol positif dibandingkan dengan perlakuan yang lain. Berikut disajikan tabel total bakteri A. hydrophila
pada ikan gurame (Tabel 6; Lampiran 13).
Tabel 6. Total bakteri A. hydrophila pascauji tantang pada ikan gurame untuk perlakuan kontrol negatif (K-), kontrol positif (K+), pencegahan (PC), pengobatan (PO) dan pengendalian (PG)
Perlakuan Colony Forming Unit (CFU) /g
K- 4,0 x106 a (P<0,05); Nilai yang tertera merupakan nilai rata-rata.
21 mengetahui kemampuan suatu bahan dalam menghambat pertumbuhan bakteri. Hasil uji zona hambat ekstrak pelepah pisang terhadap bakteri A. hydrophila
menunjukkan bahwa ekstrak pelepah pisang mampu menghambat aktivitas bakteri tersebut. Zona hambat yang dihasilkan pada perlakuan dosis 3% dan 4% memberikan nilai yang tidak berbeda nyata sehingga untuk efisiensi bahan digunakan dosis terendah yaitu 3% (Lampiran 6). Zona hambat tersebut dihasilkan karena kandungan fitokimia pelepah pisang ambon seperti flavonoid, alkaloid, triterpenoid, fenolik, saponin dan tanin yang berfungsi sebagai antibakteri (Citarusu 2010). Mekanisme antibakteri dari flavonoid yaitu membentuk ikatan kompleks dengan protein melalui ikatan hidrogen dan efek hidrofobik dengan pembentukan ikatan kovalen, sehingga terjadi penghambatan sintesis DNA dan penghambatan sintesis makromolekuler pada bakteri (Agati et al.2012). Alkaloid bersifat antibakterial dengan mekanisme aksinya yaitu merusak ion-ion pada bakteri dan merusak protein bakteri (Queiroz et al.2013). Triterponoid terbagi menjadi 2 kelompok yaitu tetra siklik dan penta siklik. Kemampuan inhibitor bakteri lebih besar pada kelompok penta siklik karena pada penta siklik terdapat komponen α amyric, betulinic dan betulynaldehyde. Mekanisme inhibitor bakteri pada penta siklik triterpenoid yaitu dengan menghambat sintesis dinding sel bakteri, menghambat sintesis DNA dan sintesis makromolekul pada bakteri (Chung et al. 2011). Fenolik adalah bioaktif sederhana yang terdiri atas cincin fenolik tunggal. Mekanisme kerja fenolik dalam menghambat pertumbuhan bakteri yaitu dengan sekresi enzim inhibitor, oksidasi patogen dan sekresikan minyak esensial yang berfungsi sebagai bakteriostatik (Santangelo et al.2007). Efek saponin dalam menghambat aktivitas bakteri yaitu dengan melubangi dinding sel bakteri sehingga keseimbangan intraseluer pada bakteri terganggu. (Francic et al. 2002). Tanin adalah bagian dari kelompok polimerik fenol. Tanin terbagi menjadi dua kelompok yaitu hidrolisis tanin dan kondensasi tanin.
22
Mekanisme penghambatan mikroba pada hidrolisis tanin yaitu inaktivasi enzim pada bakteri (Makkar 2003).
Persentase fitokimia ekstrak pelepah pisang ambon terbesar adalah flavonoid yaitu 28,10%. Tingginya persentase flavonoid di dalam ekstrak pelepah pisang sesuai dengan pendapat dari Kumar dan Pandey (2013) yang menyatakan bahwa bahan obat dari tumbuhan yang kaya akan kandungan flavonoid salah satunya adalah pohon pisang Musa sp. Persentase flavonoid yang besar tersebut menyebabkan efek farmakologi yang ditimbulkan juga besar meskipun dalam kerjanya keterkaitan antara masing-masing komponen fitokimia sagat mempengaruhi. Efek farmakologi tersebut seperti antibakteri, anti-inflamasi dan antioksidan (Zhou et al. 2015).
Efek inhibitor ekstrak pelepah pisang ambon lebih tinggi pada bakteri gram negatif (A. hydrophila) dari pada gram positif (Streptococcus sp.). Hal tersebut diasumsikan bahwa jenis flavonoid yang ada pada ekstrak pelepah pisang dari kelas flavone. Flavone mempunyai tingkat kelarutan yang tinggi pada lemak (Kumar dan Pandey 2013). A. hydrophila mempunyai dinding yang sebagian besar tersusun atas lemak atau lipopolisakarida (LPS). Oleh karena itu flavone lebih mudah masuk ke dalam bakteri dan mempunyai efek destruksi yang lebih besar terhadap bakteri patogen gram negatif dibandingkan dengan bakteri gram positif, karena bakteri gram positif tersusun atas peptidoglikan sehingga flavone lebih susah masuk dan menyebabkan efek destruksi yang rendah.
Pemberian pakan yang dicampur dengan ekstrak pelepah pisang 3% dapat menurunkan jumlah bakteri A. hydrophila pada ikan gurame yang dapat dilihat pada (Gambar 22). Pemberian ekstrak pelepah pisang pada perlakuan pengobatan dan pencegahan mampu menghambat bakteri A. hydrophila sepersepuluh (1/10) dari kontrol positif sedangkan pada perlakuan pengendalian efek inhibitor pelepah pisang bisa sampai seperseratus (1/100) dari kontrol positif. Hal tersebut sesuai dengan penelitian yang dilakukan oleh Immanuel et al. (2004) bahwa artemia yang diperkaya dengan bahan herbal dapat menurunkan jumlah bakteri Vibro parahaemolyticus dari 3.86 x 105 CFU g-1 menjadi 1.36 x 105 CFU g-1 pada udang. Pemberian pakan pelepah pisang yang mengandung flavonoid 28,10% dapat inaktivasi penempelan mikroba pada inang dan menurunkan fluiditas membran inang bagian luar dan dalam sehingga bakteri patogen tidak bisa masuk, selain itu flavonoid dapat meningkatkan aktivitas ROS (reactive oxygen spesies) dari makrofag dan meningkatkan proliferasi sel leukosit dengan mengaktifkan gen PKC (protein kinase C) dan MAPK (mitogen activated protein kinase) (Mansuri
23 triterpenoid dalam meningkatkan imunitas yaitu dengan menghambat enzim 5-lipoxygenase, nitrit oksidase dan cyclooxygenase-2 (Zhang et al. 2013). Mekanisme alkaloid dalam meningkatkan sistem imun pada ikan yaitu dengan menghambat produksi nitrite oxide (NO) dan mengaktifkan makrofag (Ryu dan Chung 2010).
A. hydrophila merupakan bakteri fakultatif yang dapat menginfeksi ikan pada saat ikan mengalami stres. Mekanisme infeksi A. hydrophila terdiri atas tiga tahap yaitu menemukan inang, menempel dan menginfeksi inang. Saat menempel pada inang, A. hydrophila mempunyai faktor virulensi seperti mukus reseptor, bahan perekat aglutinasi dan adanya pili sehingga mempermudah bakteri A. hydrophila untuk menempel pada inang (Cipriano 2001). Proses infeksi terhadap inang oleh bakteri A. hydrophila dilakukan dengan memproduksi toksin ekstraseluler atau ECP (extracelluler product) dan endotoksin. Toksin ekstraseluler mempunyai tingkat patogenisitas yang lebih tinggi dibandingkan dengan endotoksin. Toksin ekstraseluler ini selanjutnya akan menghasilkan enzim seperti protease, gelatinase, kaseinase, elastase, lipase, hemolisin, sitotoksin, enterotoksin, asetilkolinesterase dan hemaglutin yang digunakan untuk masuk ke dalam tubuh inang. Enzim protease berfungsi untuk mendegradasi protein inang yang selanjutnya akan dikonsumsi oleh bakteri untuk berkembang biak. Selain protease terdapat enzim hemolisin yang dapat melisiskan sel darah merah sehingga ikan mengalami radang, hemoragi, tukak dan kematian pada ikan. Tingkat virulensi ECP yang paling tinggi adalah hemolisin. Endotoksin merupakan toksin yang diproduksi setelah bakteri mati. Toksin tesebut terdapat pada permukaan membran bakteri yaitu lipopolisakarida (LPS). LPS dari bakteri
A. hydrophila tersusun atas rantai polisakarida O dari panjang rantai homogenous. Antigen O ini tidak diaglutinasi dan resisten terhadap bakterisidal inang. Endotoksin menyebabkan peradangan pada inang (Angka 2005). Efek infeksi A. hydrophila pada ikan gurame dapat dilihat pada (Gambar 3) yang ditunjukkan dengan terbentuknya borok pada permukaan tubuh ikan gurame. Terbentuknya borok pada pada ikan gurame disebabkan adanya sekresi toksin dari A. hydrophila.
Proses penyembuhan luka pada ikan akibat infeksi A. hydrophila
24
2011). Ekstrak pelepah pisang mengandung flavonoid. Flavonoid pelepah pisang berfungsi sebagai faktor kemotaktik yang dapat menarik sel inflamasi dari sirkulasi darah menuju ke daerah infeksi sehingga dapat membantu mengendalikan infeksi, mengeliminasi bahan asing, membersihkan jaringan nekrotik dan mengurangi proses hipersensitivitas (Priosoeryanto 2008). Flavonoid juga dapat mengaktifkan gen MAPK pada kelas ERK yang berfungsi sebagai faktor tumbuh sehingga pemulihan luka pascainfeksi lebih cepat (Mansuri et al.
2014).
Flavonoid dapat memicu produksi protein adhesi, sehingga sel dan jaringan lebih permeabel terhadap sel neutrofil dan sel neutrofil lebih mudah masuk ke daerah luka (Sahu et al. 2007). Neutrofil merupakan sel yang berfungsi sebagai fagositosis antigen dan mikrosidal. Cara kerja neutrofil yaitu dengan mensekresikan enzim lisosom, proteolitik, ribonuklease dan fosfolipase untuk menghancurkan dinding bakteri (Waller et al. 2011). Pasca infeksi (H+2) presentase neutrofil meningkat pada perlakuan kontrol positif, pencegahan, pengobatan dan pengendalian. Hal tersebut sesuai dengan Katzenback dan Beloseviv (2009) yang menyatakan bahwa neutrofil merupakan sel fagosit pertama yang bersifat kemotaksis dan menginfiltrasi radang dengan cepat. Persentase neutrofil pada penelitian ini mulai meningkat setelah diberi ekstrak pelepah pisang (H-1) (Gambar 15.2). Peningkatan neutrofil tersebut disebabkan adanya flavonoid di dalam pelepah pisang yang berfungsi sebagai ligan melalui jalur PKC yang dapat menstimulasi proliferasi dari neutrofil. Persentase neutrofil mulai menurun pada hari ke 5 dan ke 7 pascauji tantang pada perlakuan pencegahan, pengobatan dan pengendalian. Penurunan persentase neutrofil karena patogen sudah tereliminasi dari inang dan adanya mediator peradangan yang dikeluarkan oleh neutrofil seperti histamin, enzim lisosom dan faktor pengaktivasi platelet (Fembram et al 2010). Namun pada perlakuan kontrol positif persentase neutrofil meningkat sampai akhir perlakuan. Hal ini disebabkan karena tidak adanya tambahan bahan aktif pelepah pisang pada campuran pakan sehingga masih dimungkinkan adanya antigen dan kerusakan jaringan yang harus difagosit oleh neutrofil (Fembram et al. 2010).
25 tinggi (Gambar 22), karena paparan patogen yang tinggi sehingga sel fagosit dalam yang berada di dalam darah jumlahnya masih banyak. Hal tersebut diakibatkan karena tidak adanya pelepah pisang yang ditambahkan untuk membantu proses eliminasi antigen sehingga tingkat inflamasi semakin parah dan akan terbentuk luka yang semakin memanjang yang berujung pada kematian ikan. Pada kontrol negatif pascainjeksi PBS juga ditemukan sel neutrofil sampai akhir perlakuan. Hal ini disebabkan karena sifat dari bakteri A. hydophila sebagai normal flora dan akan bersifat patogen jika ikan pada kondisi stres (Patil et al.
2011) sehingga adanya pola pertahanan tubuh ikan gurame yang menyebabkan ditemukannya sel neutrofil dan monosit. Namun kondisi tersebut masih ditoleransi oleh ikan gurame, karena pada perlakuan ini ikan gurame tidak ditemukan gejala klinis serta tidak ditemukan kematian.
Persentase limfosit mendominasi pada awal perlakuan yaitu 88% namun setelah uji tantang persentase limfosit semakin menurun. Perlakuan pencegahan, pengobatan dan pengendalian persentase limfosit mendominasi di akhir perlakuan yakni 86%, 81% dan 83%. Dominasi limsosit diakhir pemeliharaan pada perlakuan pencegahan, pengobatan dan pengendalian mengindikasikan bahwa respons imun spesifik yang terbentuk lebih besar dibandingkan kontrol positif sehingga jika terjadi paparan patogen yang sama akan lebih cepat dikenali dan proses destruksi antigen lebih cepat. Limfosit berfungsi sebagai sistem imun spesifik dan terdapat tiga tipe yaitu limfosit B yang terbentuk di sumsum tulang, limfosit T yang terbentuk di organ timus dan limfosit null. Limfosit B dengan persentase di dalam darah sebesar 10-12%. Limfosit B berfungsi untuk membentuk antibodi yang digunakan untuk kekebalan spesifik humoral. Limfosit T mempunyai persentase yang dominan di dalam darah yaitu 70-75%. Limfosit T berfungsi sebagai cell mediated immunity (CMI) dalam sistem imun spesifik seluler (Mariuzza et al. 2010). Limfosit mempunyai masa hidup yang lebih lama dibandingkan dengan neutrofil dan makrofag yaitu bisa mencapai tahunan (Litman et al. 2010).
Jumlah konsumsi pakan stagnan pada awal perlakuan sampai H-1. Penurunan konsumsi pakan secara drastis terjadi setelah uji tantang kemudian meningkat kembali pada H+3 sampai akhir perlakuan. Menurut Harper dan Wolf (2009) ikan yang stres setelah penyuntikan akan mengalami penurunan nafsu makan sehingga berdampak pada penurunan jumlah konsumsi pakan, kemudian nafsu makan akan kembali meningkat setelah respons stres hilang. Konsumsi pakan pada perlakuan kontrol negatif, pencegahan, pengobatan dan pengedalian paling tinggi dibandingkan kontrol positif. Hal tersebut disebabkan adanya tambahan ekstrak pelepah pisang yang dapat berfungsi sebagai antibakteri dan imunostimulan sehingga ketika terdapat stresor dari patogen, pemulihan akibat infeksi bisa berjalan dengan cepat sehingga konsumsi pakan menjadi normal seperti kontrol negatif yang tidak diuji tantang dengan patogen (Kumar dan Pandey 2013).