IDENTIFIKASI CENDAWAN TERBAWA BENIH PEPAYA
(
Carica papaya
L).
ANIK WIATI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Identifikasi Cendawan Terbawa Benih Pepaya (Carica papaya L) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
ANIK WIATI. Identifikasi Cendawan Terbawa Benih Pepaya (Carica papaya L). Dibimbing oleh SURYO WIYONO.
Pepaya merupakan salah satu buah yang sangat digemari oleh masyarakat Indonesia karena menduduki peringkat keenam setelah pisang, mangga, nanas, jeruk, dan salak. Kebutuhan pepaya dalam negeri belum dapat terpenuhi baik dari kualitas maupun kuantitasnya. Benih pepaya yang sehat penting untuk pertumbuhan tanaman yang sehat. Beberapa penyakit tanaman disebabkan oleh cendawan terbawa benih. Bagaimanapun, tidak ada informasi mengenai penyakit terbawa benih pepaya. Oleh karena itu, penelitian ini bertujuan untuk mengidentifikasi cendawan terbawa benih pepaya. Metode yang dilakukan meliputi penentuan asal benih contoh pepaya, uji blotter benih, penanaman benih pepaya, uji blotter batang dan akar, serta identifikasi secara langsung dan secara mikroskopis. Hasil dari penelitian ini menunjukkan bahwa cendawan Aspergillus sp., Rhizopus sp., Fusarium sp.,dan Chaetomium sp. dapat terbawa benih pepaya. Kata kunci: benih, Carica papaya L, patogen, uji blotter.
ABSTRACT
ANIK WIATI. Identification of Seed-borne Fungi of Papaya (Carica papaya L). Supervised by SURYO WIYONO.
Papaya is a very popular fruit in Indonesia, because the production ranked sixth after banana, mango, pineapple, orange, and zalacca. The demand of papaya is very high and continuously increase. Healthy seed is important for growing healthy plants. Some of plant diseases are caused by seed borne fungi. However, there is no information on papaya seed borne. The purpose of this research was to identify the fungi associated with papaya seed. The methods included papaya seed sampling, seed blotter test, papaya seed planting, root blotter test, and the identification of direct and microscopically. The results of this research showed that the fungi Aspergillus sp., Rhizopus sp., Fusarium sp., and Chaetomium sp., are seed borne on papaya.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
Pada
Departemen Proteksi Tanaman, Fakultas Pertanian ANIK WIATI
IDENTIFIKASI CENDAWAN TERBAWA BENIH PEPAYA
(
Carica papaya
L).
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
55(8 '1#/3#8 ,4% ' 3%8 ,6,8 168 ,#"8 /788
*8 8 ,$'8 #4#8
8 8 8
%345&5%8 .)"8
458024+-8
PRAKATA
Puji dan syukur penulis panjatkan atas kehadirat Allah SWT yang telah memberikan karunia dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul Identifikasi Cendawan Terbawa Benih Pepaya (Carica Papaya L) sebagai salah satu syarat untuk memeroleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini dilaksanakan pada bulan Maret 2015 hingga November 2015 bertempat di Laboratorium Pusat Kajian Hortikultura Tropika, Institut Pertanian Bogor.
Pada kesempatan ini penyusun mengucapkan terima kasih sebesar-besarnya kepada berbagai pihak dalam penyelesaian skripsi ini, di antaranya:
1 Dr. Ir. Suryo Wiyono, M.Sc.Agr selaku dosen pembimbing yang telah memberikan arahan dan bimbingan dalam penelitian dan penulisan.
2 Kedua orang tua tercinta dan saudara atas kasih sayang, doa, semangat, dan keteladanannya hingga saat ini.
3 Kepala Pusat Kajian Hortikultura Tropika (PKHT) yang telah memberikan izin untuk menggunakan laboratorium Hama dan Penyakit selama penelitian
4 Yeni Nurmaghfiroh yang bersedia membantu selama penelitian, dan Lutfi Nurcahyo Fambudi yang memberikan dorongan dan semangat selama penelitian.
5 Teman-teman seperjuangan di laboratorium PKHT, WISH, dan Mikologi. 6 Teman-teman Demfarm Optimasi Produksi Padi Varietas IPB 3S Karawang
yang membantu dan memberikan semangat selama penelitian.
7 Teman-teman dan sahabat seperjuangan Protector atas kebersamaan, cerita dan semua pelajaran selama masa perkuliahan.
8 Keluarga Koran Kampus IPB, Keluarga Hammina, Keluarga Ikatan Mahasiswa Ronggolawe Tuban, dan Keluarga Mahasiswa Nahdlatul Ulama IPB yang selalu menghibur dan menginspirasi.
9 Keluarga Besar Departemen Proteksi Tanaman, Dosen dan seluruh staf.
Semoga skripsi ini bermanfaat bagi penulis, ilmu pengetahuan, masyarakat dan berbagai pihak yang membutuhkan.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
BAHAN DAN METODE 5
Tempat dan Waktu Pelaksanaan 5
Alat dan Bahan 5
Metode Penelitian 5
Asal Benih Contoh 5
Blotter test benih 5
Identifikasi cendawan terbawa benih 6
Penghitungan Tingkat Infeksi 6
Growing on test benih 6
Identifikasi 6
Inokulasi Buatan Benih Pepaya dengan Colletotrichum sp. 6
Analisis Data 7
HASIL DAN PEMBAHASAN 8
Uji blotter pada benih pepaya 8
Growing on test di rumah kaca 12
Blotter test bibit pepaya 13
Growing on test benih yang diinokulasi Colletotrichum 14 Blotter test bibit pepaya dari benih yang diinokulasi Colletotrichum 15
SIMPULAN DAN SARAN 12
Simpulan 14
Saran 14
DAFTAR TABEL
1 Tingkat infeksi cendawan terhadap benih pepaya 7
2 Hasil blotter test pada bibit pepaya 11
DAFTAR GAMBAR
1 Uji blotter benih pepaya dari empat asal benih yang berbeda 3 2 Koloni cendawan yang menginfeksi benih saat diuji blotter 7
3 Bentuk mikroskopik spora cendawan 9
4 Hasil growing on test benih pepaya 10
5 Bibit pepaya yang mengalami damping-off 11
6 Koloni cendawan yang menginfeksi bibit saat diuji blotter 11
7 Bentuk mikroskopis cendawan 12
8 Growing on Test pada benih yang diinokulasi Colletotrichum 13 9 Koloni cendawan Fusarium sp. pada batang pepaya 13
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara peringkat ketiga sebagai penghasil pepaya terbesar di dunia setelah India dan Brazil (FAO 2012). Berdasarkan jumlah produksinya, pada tahun 2013 pepaya meduduki peringkat keenam setelah pisang, mangga, nanas, jeruk, dan salak yaitu sebesar 871 282 ton (BPS 2013). Pepaya termasuk dalam jajaran buah populer di Indonesia, sehingga permintaan pasar untuk buah pepaya segar sangat tinggi. Di pasar Jakarta saja dibutuhkan pasokan pepaya mencapai 100 ton per hari, namun permintaan tersebut belum dapat dipenuhi seluruhnya, baik dari segi kuantitas maupun kualitas (Sobir 2009). Belum terpenuhinya permintaan tersebut diantaranya disebabkan oleh serangan hama dan penyakit.
Pepaya umumnya diperbanyak dengan cara generatif menggunakan biji. Biji merupakan bentuk dorman tanaman yang sering digunakan sebagai benih. Selain untuk bahan perbanyakan tanaman, benih juga merupakan sarana penting bagi kelangsungan hidup patogen tanaman. Benih merupakan sarana eksklusif untuk bertahan hidup. Transmisi patogen palung benih dianggap lebih penting daripada kelangsungan hidupnya. Patogen bertahan hidup lebih lama pada biji daripada bagian vegetatif tanaman atau dalam tanah, karena patogen berada dalam kontak langsung dengan benih, kemungkinan infeksi bibit dapat lebih ditingkatkan. Infeksi patogen benih dapat menjadi sumber inokulum yang dapat menyebar pada kondisi yang menguntungkan dan menyebabkan epidemi penyakit (Agarwal dan Sinclair 1996).
Penyakit benih adalah hasil interaksi antara waktu, tanaman inang yang rentan, patogen, lingkungan, dan agen transmisi, sehingga dapat menimbulkan tanda-tanda atau gejala dari efek tersebut. Banyak patogen benih yang menjadi aktif ketika benih ditabur, sehingga dapat mengakibatkan kerusakan benih. Lebih lanjut, infeksi patogen dapat mengurangi kemampuan benih untuk berkecambah. Hilangnya kemampuan berkecambah suatu benih dipengaruhi beberapa faktor, antara lain yaitu kespesifikan kultivar tanaman yang meliputi jenis, jumlah dan lokasi inokulum, kondisi lingkungan, dan sebagainya (Agarwal dan Sinclair 1996). Penyebab utama kerusakan pada benih adalah jamur, bakteri, dan virus. Benih dapat diserang patogen sebelum biji (benih) berkecambah (pre emergence damping off), sedangkan apabila menyerang setelah muncul kecambah disebut post emergence damping off. Bentuk kerusakan karena serangan patogen sangat bervariasi, bergantung pada jenis patogen, benih, dan faktor lingkungan (Chailani dan Djauhari 2012). Patogen pada benih umumnya dari kelompok cendawan, yaitu dari spesies Fusarium sp, Pythium sp., dan Phomopsis sp.. Hingga kini, belum dilakukan penelitian tentang penyakit benih pada pepaya, sehingga identifikasi penyakit benih pada pepaya menjadi penting untuk menentukan langkah pencegahan maupun pengendalian yang tepat.
2
penyebab penyakit antraknosa, yang merupakan penyakit pascapanen pepaya yang paling umum. Antraknosa dapat menyebabkan kehilangan dari 1 hingga 93% (Paul et al. 1997).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengidentifikasi cendawan yang terbawa benih pepaya baik yang bersifat patogenik maupun non patogenik dan meneliti kemungkinan Colletotrichum sp. terbawa benih pepaya.
Manfaat Penelitian
3
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Hama dan Penyakit Pusat Kajian Hortikultura Tropika, Institut Pertanian Bogor pada bulan Maret 2015 hingga November 2015.
Alat dan Bahan
Bahan yang digunakan adalah benih pepaya Calina dari empat asal benih yang berbeda, bahan pembuatan media yang digunakan untuk menumbuhkan cendawan, kertas saring, air steril dan isolat Colletotrichum sp. dari Klinik Tanaman IPB. Alat yang digunakan adalah cawan petri, baki, mikroskop, dan buku identifikasi Pictorial Atlas of Soil and Seed Fungi (Watanabe 2002) dan Illustrated Genera of Imperfect Fungi (Barnett 1998).
Metode Penelitian Asal Benih Contoh
Contoh benih pepaya yang digunakan diambil dari varietas Calina produksi PKHT, California produksi Monagro, California produksi Sinar Laksmi dan benih pepaya lokal yang diperoleh dari petani pepaya di Kecamatan Senori, Kabupaten Tuban, Jawa Timur.
Blotter Test Benih
Blotter test dilakukan dengan meletakkan 400 butir benih pepaya dari empat jenis benih yang telah disampling ke dalam 20 cawan petri yang telah dialasi kertas blotter steril yang sebelumnya telah dilembabkan dengan air steril. Masing-masing cawan diisi benih pepaya sebanyak 20 butir. Benih pepaya kemudian diinkubasi pada suhu ruangan selama 8 hari.
4
Identifikasi Cendawan Terbawa Benih
Identifikasi cendawan terbawa benih dilakukan dengan menggunakan mikroskop binokuler. Pengamatannya meliputi bentuk dan ukuran spora serta hifa. Identifikasi genus cendawan menggunakan buku kunci identifikasi Pictorial Atlas of Soil and Seed Fungi (Watanabe 2002) dan Illustrated Genera of Imperfect Fungi (Barnett 1998).
Penghitungan Tingkat Infeksi
Tingkat infeksi (TI) dihitung dengan rumus:
TI % = ∑benih terinfeksi
∑benih yang diuji ×100%
Growing on Test Benih
Pengujian ini dilakukan dengan cara menanam sebanyak 100 butir benih pepaya dari empat produksi yang berbeda pada media pasir steril di dalam tray. Pasir yang digunakan telah disterilkan dan digunakan hanya untuk satu kali penanaman.
Identifikasi Cendawan Pasca berkecambah
Pengamatan Gejala Secara Visual. Pengamatan gejala dilakukan langsung pada daun dan batang tanaman yang terserang penyakit tiga minggu setelah benih disemai.
Blotter Test Bibit. Uji blotter dilakukan dengan cara kertas blotter
diletakkan ke dalam cawan petri. Kertas terlebih dahulu dilembabkan dengan air steril, setelah itu potongan sedotan dan kaca objek yang telah disterilkan dimasukkan ke dalam cawan. Bibit pepaya direndam terlebih dahulu ke dalam NaOCl dengan konsentrasi 1% selama dua menit dan dibilas dengan akuades mengalir sebanyak tiga kali, kemudian bibit pepaya dimasukkan ke dalam petri, lalu cawan petri ditutup dan diinkubasi sampai cendawan tumbuh.
Identifikasi Cendawan. Cendawan yang telah ditumbuhkan pada media PDA kemudian diamati dengan menggunakan mikroskop binokuler dan diidentifikasi dengan kunci identifikasi Pictorial Atlas of Soil and Seed Fungi (Watanabe 2002) dan Illustrated Genera of mperfect Fungi (Barnett 1998).
Inokulasi Buatan Benih Pepaya dengan Colletotrichum sp.
Persiapan Cendawan. Isolat cendawan Colletotrichum sp. didapatkan dari koleksi Klinik Tanaman IPB. Cendawan diperbanyak pada media PDA, dan ditunggu hingga jumlah konidia memenuhi cawan. Selanjutnya, spora dipanen dan dihitung kerapatannya dengan menggunakan hemasitometer.
Teknik Inokulasi. Uji ini dilakukan dengan cara benih pepaya sebanyak 25 butir dimasukkan ke dalam botol berisi 10 ml air steril yang mengandung konidia cendawan Colletotrichum sp. dengan kerapatan spora sebesar 105/ml.
Growing on Test Benih. Benih yang telah diinokulasi cendawan
5
Blotter Test Bibit. Bibit pepaya yang berumur 21 hari kemudian diuji
blotter dengan cara yang sama dengan uji blotter bibit tanpa inokulasi Colletotrichum sp..
Analisis Data
6
HASIL DAN PEMBAHASAN
Penggunaan benih bermutu mutlak adanya, yaitu bermutu fisik, fisiologi, serta genetika yang tinggi. Hal yang tak kalah penting adalah faktor kesehatan dari benih tersebut, sehingga benih dikatakan bermutu apabila mempunyai mutu fisik, fisiologi, serta genetika yang tinggi dan benih tersebut sehat, bebas dari hama dan penyakit. Identifikasi cendawan pada benih penting dilakukan, karena akan berkaitan dengan strategi pengelolaannya dalam rangka pengendalian penyakit benih. Selain itu dengan diketahuinya penyakit yang menyerang, maka dapat diduga sejauh mana pengaruh yang ditimbulkannya pada tingkat bibit hingga tanaman di lapangan serta untuk jangka waktu panjang adalah produktivitas dan tegaknya (Yulianti 2004).
Pengujian benih untuk patogen terbawa benih merupakan pekerjaan yang sulit. Tidak seperti jaringan tanaman vegetatif yang terinfeksi, karena benih yang terinfeksi dapat tidak memperlihatkan gejala, sehingga membuat deteksi visual tidak bisa dilakukan (Walcot 2003). Menurut Cram dan Fraedrich (2009), patogen terbawa benih didefinisikan sebagai setiap agen infeksi yang dibawa pada benih secara internal maupun eksternal, yang memiliki potensi untuk menyebabkan penyakit baik biji atau tanaman.
Tidak semua cendawan yang terbawa benih bersifat patogenik. Cendawan yang dapat dikategorikan sebagai patogen adalah cendawan yang dapat menyebabkan kemunduran mutu benih atau sampai mematikan. Dampak yang ditimbulkan oleh serangan patogen akan lebih besar apabila benih yang membawa suatu patogen baru atau strain patogen baru ke suatu tempat, sehingga akan menimbulkan ledakan suatu penyakit di tempat tersebut (Soekarno 2003).
Uji blotter pada benih pepaya
Hasil pengujian 400 butir benih pepaya dengan metode blotter test didapatkan empat genus cendawan yang terbawa benih yaitu Aspergillus, Rhizopus, Chaetomium, Fusarium, dan satu cendawan belum teridentifikasi (unidentified). Benih yang terinfeksi cendawan pada pengujian blotter terlihat tidak dapat berkecambah dan pada permukaan luar benih ditemukan koloni cendawan berupa hifa dan spora cendawan.
Benih yang terinfeksi cendawan Aspergillus sp., pada permukaan luar benihnya terdapat spora cendawan berwarna hijau keabu-abuan, dan jika dilihat di bawah mikroskop terlihat seperti sapu (Gambar 3a). Benih yang terinfeksi Rhizopus sp. pada permukaan luar benihnya terdapat spora hitam keabu-abuan yang apabila dilihat di bawah mikroskop terlihat sporanya berbentuk bulat dan bertangkai (Gambar 3b).
7 Benih yang terinfeksi unidentified fungus permukaan benihnya terdapat miselium berwarna putih kecokelatan yang membentuk jaring-jaring halus. Jika diamati di bawah mikroskop, dapat dilihat pada gambar 3e.
Gambar 2 Koloni cendawan yang menginfeksi benih saat diuji blotter a) Fusarium b) Aspergillus c) Rhizopus, dan d) Chaetomium
Pada pengamatan tingkat infeksi, infeksi cendawan Aspergillus sp. dan Rhizopus sp. tertinggi pada benih Monagro yaitu sebesar 85% dan 40%. Infeksi tertinggi oleh cendawan Fusarium sp. pada benih IPB 9, yaitu sebesar 25%, dan infeksi Chaetomium sp. tertinggi pada benih lokal, yaitu sebesar 20%, serta infeksi unidentified fungus tertinggi pada benih lokal, yaitu sebesar 100%.
Tabel 1 Tingkat infeksi cendawan terhadap benih pepaya Cendawan
Cendawan yang berhasil diidentifikasi merupakan cendawan yang umum ditemukan di lapangan dan di penyimpanan atau penggudangan. Cendawan dari genus Aspergillus dan Rhizopus merupakan cendawan yang umum dijumpai pada benih. Keduanya banyak mengganggu di penyimpanan. Cendawan Aspergillus sp. termasuk ke dalam kelas Deuteromycetes. Ciri penting cendawan Aspergillus sp. adalah bentuk sporanya yang menyerupai sapu. Menurut Watanabe (2002), Aspergillus sp. mempunyai ciri morfologi berupa konidiofornya hialin, simpel atau tidak bercabang, terkadang berdinding tebal, sedangkan cendawan Rhizopus sp. mempunyai ciri morfologi berupa sporangiofornya tegak, tunggal atau bercabang, berwarna kekuning-kuningan atau cokelat gelap, mempunyai rizoid
a b
8
yang terhubung dengan sporangiofor, dan juga mengandung spora. Sporanya berbentuk bulat, berwarna cokelat tua sampai hitam, berduri, bentuknya menjadi sub globose setelah matang, dan mempunyai kolumella yang berwarna cokelat.
Menurut Christensen dan Kauffman (1969), fungi di tempat penyimpanan (storage fungi), seperti Aspergillus sp. dan Rhizopus sp., merupakan contoh fungi yang menyerang benih sejak benih tersebut dipanen, diangkut hingga disimpan di tempat penyimpanan. Keberadaan Aspergillus dan Rhizopus pada benih dapat melalui kontaminasi atau infestasi. Kontaminasi atau infestasi mengacu pada hubungan pasif antara benih dan cendawan. Menurut Nome (2002), patogen itu sendiri atau bagian dari patogen dapat menempel atau tercampur dengan benih dalam setiap proses mendapatkan benih mulai dari panen, ekstraksi, seleksi, dan pengepakan. Keberadaannya dapat memperlemah benih ketika ditanam yang menyebabkan benih lebih rentan terhadap serangan beberapa patogen di dalam tanah, sehingga kematian semai atau bibit tidak disebabkan oleh patogen tersebut tetapi oleh hama dan penyakit yang lain (Purnawati 2015).
Menurut Soekarno (2003), patogen yang terdapat pada benih dapat terbawa melalui tiga cara. Pertama, patogen terbawa secara internal dan berada di dalam jaringan struktur perbanyakan tanaman seperti benih, dalam hal ini patogen biasa berada di embrio endosperma atau kulit benih. Kedua, patogen menempel pada permukaan benih. Ketiga, patogen secara terpisah terbawa benih, dalam hal ini patogen bisa berada dalam sisa tanaman, butiran tanah atau dalam bentuk struktur tertentu.
Cendawan Chaetomium sp. termasuk ke dalam kelas Ascomycetes. Cendawan ini mempunyai ciri morfologi yang khas yaitu terdapat peritesium yang pada permukaan luarnya terdapat rambut-rambut keriting. Selain peritesium, Chaetomium sp. juga memiliki askospora yang berbentuk elips (Watanabe 2002). Menurut Harman et al. (1978) dan Vannacci dan Harman (1987) salah satu spesies Chaetomium yaitu C. globosum dilaporkan menjadi agen biokontrol yang potensial. Cendawan C. globosum efektif dalam meminimalkan kerusakan seperti busuk benih dan rebah kecambah (damping off) yang disebabkan oleh Pythium ultimum, Alternaria raphani, Alternaria brassicola dan Fusarium sp.. Selain itu, hawar di pembibitan yang disebabkan oleh Rhizoctonia solani telah berhasil dikendalikan dengan perlakuan benih menggunakan Chaetomium sp. (Baker 1968). C. globosum juga memiliki efek antagonis terhadap blas yang disebabkan oleh Pyricularia oryzae (Soytong dan Quimio 1989).
Selanjutnya adalah cendawan dari genus Fusarium. Cendawan Fusarium sp. mempunyai ciri morfologi berupa konidiofor dan konidianya yang berwarna hialin. Konidianya terdiri atas dua jenis, yaitu makrokonidia dan mikrokonidia. Mikrokonidia terdiri atas satu sel ada yang berbentuk bulat, oval, hingga elips atau melebar bagian atasnya, tunggal atau dalam rantai dan ada yang berkesat atau tidak bersekat. Makrokonidia terdiri atas banyak sel, berbentuk bulan sabit dengan kedua ujung yang runcing, mempunyai sekat lebih dari satu dan mampu membentuk klamidospora (Barnett dan Hunter 1998). Makrokonidia Fusarium sp dapat dilihat pada gambar 3d.
9 menurunkan viabilitas benih. Menurut Alexopaulus dan Mims (1979), Fusarium menghasilkan toksin yang mendorong terjadinya kelayuan dengan memengaruhi permeabilitas dan metabolisme sel. Toksin yang dihasilkan tersebut adalah asam fusarik (fusaric acid). Menurut Erawati (1989), toksin yang dihasilkan tersebut dapat menyebabkan pertumbuhan kecambah menjadi abnormal atau mati.
Gambar 3 Bentuk mikroskopik spora cendawan: a) Aspergillus sp., b) Rhizopus sp., c) Chaetomium sp., d) Pythium sp., d) Fusarium sp., dan e) unidentified fungus pada perbesaran 400x.
Growing on Test (GOT) di Rumah Kaca
Hasil growing on test di rumah kaca menunjukkan bahwa benih pepaya lokal tidak tumbuh. Pada bibit Monagro ditemukan bibit yang mengalami rebah atau damping-off. Pada batang dan daun bibit pepaya baik dari Sinar Laksmi, Monagro, dan PKHT tidak ditemukan gejala seperti nekrotik atau pecah batang, sehingga dilanjutkan dengan uji blotter bibit.
Bibit pepaya tumbuhnya tidak serempak, sehingga tingginya berbeda-beda, hal ini dimungkinkan karena mutu benih yang kurang bagus, sehingga benih sulit berkecambah. Pada benih lokal benih tidak mampu berkecambah. Hal ini dimungkinkan karena benih telah terinfeksi unidentified fungus. Pada uji blotter benih, telah diketahui bahwa pada benih lokal, infeksi tertinggi oleh unidentified fungus.
a b c
10
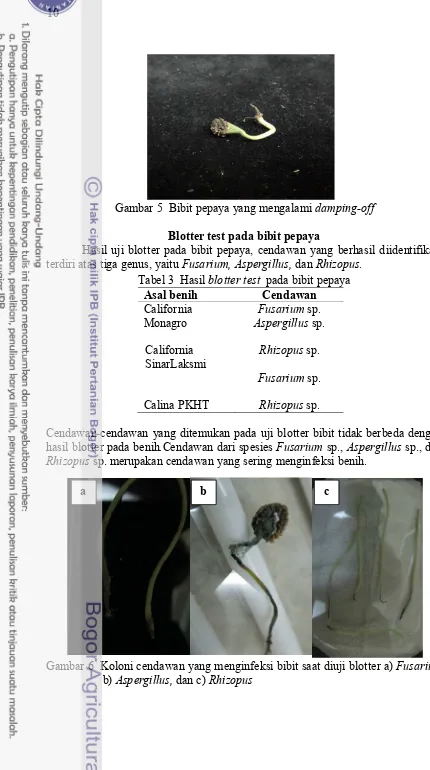
Gambar 5 Bibit pepaya yang mengalami damping-off
Blotter test pada bibit pepaya
Hasil uji blotter pada bibit pepaya, cendawan yang berhasil diidentifikasi terdiri atas tiga genus, yaitu Fusarium, Aspergillus, dan Rhizopus.
Tabel 3 Hasil blotter test pada bibit pepaya Asal benih Cendawan California
Monagro
Fusarium sp. Aspergillus sp. California
SinarLaksmi
Rhizopus sp. Fusarium sp. Calina PKHT Rhizopus sp.
Cendawan-cendawan yang ditemukan pada uji blotter bibit tidak berbeda dengan hasil blotter pada benih.Cendawan dari spesies Fusarium sp., Aspergillus sp., dan Rhizopus sp. merupakan cendawan yang sering menginfeksi benih.
Gambar 6 Koloni cendawan yang menginfeksi bibit saat diuji blotter a) Fusarium b) Aspergillus, dan c) Rhizopus
11 Cendawan terbawa benih dapat sangat memengaruhi kualitas benih dan menyebabkan penyakit yang berdampak terhadap produksi bibit di pembibitan. Kerugian untuk patogen terbawa benih termasuk mengurangi perkecambahan benih, damping-off, dan kematian bibit yang lebih tua. Pengaruh patogen terbawa benih pada benih dan produksi bibit diketahui dapat sampai ekstrim yaitu kegagalan perkecambahan di persemaian atau kerugian yang terjadi dalam kontainer (Cram dan Fraedrich 2009).
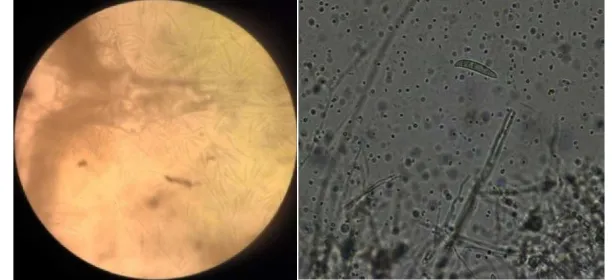
Gambar 7 Bentuk mikroskopik cendawan a) Fusarium, b) Rhizopus, dan c) Aspergillus pada perbesaran 400x
Penggunaan metode blotter test untuk pengujian cendawan pada benih pepaya disebabkan karena metode ini merupakan metode yang cukup sederhana, murah, efektif, dan akurat untuk mendeteksi cendawan terbawa benih. Metode ini juga telah diakui ISTA untuk pengujian beberapa cendawan terbawa benih seperti
seperti Alternaria padwickii dan Drechslera oryzae pada padi (ISTA 2011).
Penelitian Ora et al. (2003) juga membuktikan bahwa metode ini mampu mendeteksi 12 cendawan patogen terbawa benih padi secara akurat di Bangladesh, salah satunya
adalah Fusarium moniliforme dan cendawan ini merupakan salah satu cendawan
paling banyak ditemukan di berbagai varietas padi yang diuji. Metode ini juga
dilaporkan mampu mendeteksi 16 cendawan termasuk F. oxysporum pada benih
legum (Rathod et al. 2012).
Growing on Test pada Benih yang Diinokulasi Colletotrichum sp.
Bibit pepaya yang di growing on test beberapa ada yang mengalami kegagalan berkecambah dan gangguan pertumbuhan. Gejala yang ditunjukkan tersebut mirip dengan gejala infeksi Colletotrichum sp.. Gejala infeksi Colletotrichum pada benih dapat menimbulkan kegagalan berkecambah atau bila telah menjadi kecambah dapat menimbulkan rebah kecambah. Pada tanaman dewasa dapat menimbulkan mati pucuk, infeksi lanjut ke bagian lebih bawah yaitu daun dan batang yang menimbulkan busuk kering berwarna cokelat kehitaman.
Deteksi visual cendawan Colletotrichum sp. pada bibit tidak mudah dilakukan karena tidak ditemukan gejala khas pada bibit pepaya yang berumur tiga minggu, sehingga untuk melihat infeksi Colletotrichum sp. pada benih pepaya, dilakukan uji blotter bibit pepaya yang benihnya telah dinokulasi dengan konidia cendawan Colletotrichum sp.. Berdasarkan laporan Wiyono (2009), pada tahun 2008 terjadi ledakan penyakit antraknosa pada pertanaman pepaya di kabupaten Bogor, Sukabumi, dan Subang. Kerugian mencapai 100% karena buah gugur dan pada serangan yang berat pada varietas rentan menimbulkan gejala mati pucuk (die back).
12
Gambar 8 Growing on test pada benih yang diinokulasi Colletotrichum sp. a) sebelum dicabut dan b) setelah dicabut
Berdasarkan penelitian Uchida (1996), bibit pepaya sehat yang diinokulasi konidia Colletotrichum gloeosporioides dapat muncul gejala seperti nekrotik pada batang, bercak pada kotiledon atau daun defoliasi, busuk leher, dan juga damping-off pada bibit. Colletotrichum merupakan patogen yang bersifat laten. Infeksi mikroorganisme terhadap komoditi seperti bebuahan dapat terjadi ketika tumbuh di lapangan, namun mikroorganisme tersebut tidak tumbuh dan berkembang, hanya berada di dalam jaringan. Bila kondisinya memungkinkan terutama setelah produk tersebut dipanen dan mengalami penanganan dan penyimpanan lebih lanjut, maka mikroorganisme tersebut segera dapat tumbuh dan berkembang dan menyebabkan pembusukan yang serius. Infeksi seperti ini dinamakan infeksi laten. Menurut Sinaga (1992), serangan patogen antraknosa pada fase pembungaan menyebabkan persentase benih terinfeksi tinggi walaupun benih tampak sehat. Cendawan C. capsici dapat menyerang inang pada segala fase pertumbuhan.
Blotter test bibit pepaya dari benih yang diinokulasi Colletotrichum sp. Hasil uji blotter bibit menunjukkan bahwa semua bibit terinfeksi cendawan dari spesies Fusarium sp.. Batang dan akar yang diinfeksi Fusarium sp. terlihat koloni hifa yang berwarna putih. Pengamatan dibawah mikroskop, terlihat makrokonidianya berbentuk seperti bulan sabit (gambar 10).
Gambar 9 Koloni cendawan Fusarium sp. pada batang pepaya
13 Hasil uji blotter bibit menunjukkan bahwa Colletotrichum sp. yang diinokulasikan pada benih pepaya tidak terdeteksi pada batang atau akar bibit, sehingga teknik inokulasi dengan merendam benih menggunakan konidia Colletotrichum sp. tidak bisa membuktikan bahwa penyakit antraknosa pada pepaya yang disebabkan oleh Colletotrichum sp. dapat terbawa benih. Tidak munculnya Colletotrichum sp., baik dengan metode growing on test maupun blotter test belum diketahui kaitannya dengan keberadaan Fusarium sp.. Hal ini perlu dilakukan penelitian lebih lanjut. Tidak semua dari genus cendawan Fusarium menjadi patogen. Cendawan Fusarium non patogenik diduga berpengaruh terhadap perkembangan cendawan patogenik F. oxysporum yang disebabkan adanya kompetisi ruang dan waktu selama proses perkembangan cendawan (Bolwerk 2005).
14
SIMPULAN DAN SARAN
Simpulan
Cendawan yang terbawa benih pepaya pada uji blotter benih meliputi Fusarium sp., Rhizopus sp., Aspergillus sp., Pythium sp., dan Chaetomium sp., serta Unidentified fungus. Pada growing on test, cendawan yang berhasil diidentifikasi meliputi genus Fusarium, Rhizopus, dan Aspergillus. Inokulasi buatan benih dengan konidia Colletotrichum sp. tidak bisa menunjukkan bahwa Colletotrichum terbawa benih pepaya.
Saran
15
DAFTAR PUSTAKA
Agarwal VK, Sinclair JB. 1996. Principles of Seed Pathology. 2nd ed. Boca Raton (US): CRC Press.
Alexopaulus CJ, Mims CW, Blackwell M. 1979. Introductory Mycology. New York (US): John Wiley and Sons, Inc.
[BPS] Badan Pusat Statistik. 2013. Produksi buah-buahan menurut provinsi. [Internet]. Jakarta (ID): Badan Pusat Statistik Republik Indonesia; [diunduh
2014 Juni 3]. Tersedia pada: http://www.bps.go.id/tab_sub/view.php?kat=3&tabel=1&daftar=1&id_suby
ek=55¬ab=10.
Baker R. 1968. Mechanism of biological control of soil borne pathogens. Annu Rev Phytopath. 6:263-294.
Barnett HL, Hunter BB. 1998. Illustrated Genera of Imperfect Fungi. Fourth edition. Minessota (US): APS Press.
Bolwerk A, Anastasia L.L, Ben JJL, Guido VB. 2005. Visualization of interactions between a pathogenic and a beneficial Fusarium strain During biocontrol of tomato foot and root rot. Molecular Plant-Microbe Interactions. 18(7):710–721. doi: 10.1094/MPMI -18-0710.
Chailani SR, Djauhari S. 2012. Penyakit Benih. Malang (ID): UB Press.
Christensen CM, Kaufmann HH. 1969. Grain Storage. The Role of Fungi in Quality Loss. Minneapolis (US): University of Minnesota Press.
Christensen CM, Kaufmann HH. 1974. Storage of cereal grains and their products. American Association of Cereal Chemist. Minnessota (US): St Paul Inc. Cram MM, Fraedrich SW. 2009. Seed disease and seedborne pathogens of north
America. Tree Planters’ Notes. 53(2):35-44.
Erawati. 1989. Vigor kekuatan tumbuh terhadap Fusarium sp. pada benih kedelai (Glycine max. (L) Merrill). [skripsi]. Bogor (ID): Institut Pertanian Bogor. [FAO] Food and Agriculture Organization. 2012. Top production papayas 2012.
[Internet]. [diunduh 2014 Juni 3]. Tersedia pada: http://www. http://faostat.fao.org/site/339/default.asp.x.
Harman GE, Eckenrode CJ, Webb DR. 1978. Alteration of spermosphere ecosystems affecting oviposition by the bean seed fly and attack by soil borne fungi on germinating seeds. Ann Appl Biol. 90(1):1-6. doi: 10.1111/j.1744-7348.1978.tb02602.x.
[ISTA] International Seed Testing Association. 2011. ISTA Rules. Basserdorf (CH): International Seed Testing Association.
Nome FS, Barreto D, Docampo DM. 2002. Seed Borne Pathogens. Di dalam: McDonald M, Contreras, editor. Proceedings International Seed Seminar of Trade Production and Technology. [Internet]. [2002 Okt]. hlm 114-126. [diunduh 16 November 2015]. Tersedia pada: http//www.seedconsortium.org/PUC/eLibraryExtension.html.
Ora N, Faruq AN, Islam MT, Akhtar N, Rahman MM. 2011. Detection and identification of seed borne pathogens from some cultivated hybrid rice varieties in Bangladesh. Middle-East. J of Scientific Research. 10(4):482-488. Paul RE, Nishijima W, Cabaletto C. 1997. Postharvest handling and losses during
16
Purnawati F. 2015. Identifikasi tingkat serangan dan potensi terbawa benih Colletotrichum sp. pada tanaman mentimun (Cucumis sativus L). [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rathod LR, Jadhav MD, Mane SK, Deshmukh PS. 2012. Seed borne mycoflora of legume seed. International Journal of Advanced Biotechnology and Research 13(1):530-532.
Sinaga MS, Supramana, Widodo, Wahyu BP. 1992. Kemungkinan pengendalian hayati bagi Colletotrichum capsici (Syd) Bult.Et Bisby penyebab antraknosa pada cabai. Laporan Akhir Penelitian Pendukung PHT dalam Rangka Pelaksanaan Program Nasional Pengendalian Hama Terpadu. Buku VII. Bogor (ID): IPB.
Sobir. 2009. Sukes Bertanam Pepaya Unggul Kualitas Supermarket. Jakarta (ID): PT Agro Media pustaka.
Soekarno BPW. 2003. Pengujian Kesehatan Benih: Mutu Benih dan Pengelolaan Hutan Secara Berkelanjutan. Makalah pada Seed Sector Introduction, Indonesia Forest Seed Project.
Soytong K, Quimio TH. 1989. Antagonism of Chaetomium globosum to rice blast pathogen Pyricularia oryzae. Kasetsart. J Nat Sci. 23(1):198-203.
Uchida JY, Manshardt R. 1996. Papaya seedling blight and damping-off caused Colletotrichum gloeosporioides in Hawaii. Plant Disease.Department of Plant Pathology. 80:712. doi:10.1094/PD-80-0712A.
Vannacci G, Harman GF. 1987. Biocontrol of seed borne Alternaria raphani and A. brassicicola. Can J Microbiol. 33:850-856.
Walcot RR. 2003. Detection of seedborne pathogens. Hortscience. 13(1):40-47 Watanabe T. 2002. Pictorial Atlas of Soil and Seed Fungi: Morphologies of
Cultured Fungi and Key to Species. 2nd Edition. Boca Raton (US): CRC Press.
Wiyono S, Widodo, Giyanto. 2009. Pengendalian Terpadu Penyakit Antraknosa pada Pepaya di Lapangan. Bogor (ID): Institut Pertanian Bogor.
RIWAYAT HIDUP
Penulis dilahirkan di Tuban, Jawa Timur pada tanggal 4 September 1994 dari bapak Sudir dan ibu Djasmi. Penulis adalah puteri kelima dari lima bersaudara. Tahun 2011 penulis lulus dari SMA Negeri 1 Jatirogo Tuban dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur undangan dan diterima di Departemen Proteksi Tanaman, Fakultas Pertanian.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum Virologi Tumbuhan (2012/2013), dan Dasar Perlindungan Tanaman (2015/2016). Penulis pernah aktif di Lembaga Pers Mahasiswa Koran Kampus IPB dari tahun 2011 hingga 2015 dan menjadi Pimpinan Produksi tabloid Koran Kampus IPB (2014/2015). Penulis juga pernah aktif di Keluarga Mahasiswa Nahdlatul Ulama IPB dari tahun 2011 hingga 2015, Pimpinan Redaksi tabloid Nahdlatul Qolam pada (2013/2014).