ABSTRAK
DINI NURWAHYUNI. Uji Stabilitas IgG Anti Escherichia coli K99 Asal Kolostrum Sapi dalam Kemasan Mikrokapsul. Dibimbing oleh SRI MURTINI dan ANITA ESFANDIARI.
Teknik mikroenkapsulasi berfungsi untuk melindungi IgG anti Escherichia coli (E. coli) K99 asal kolostrum sapi terhadap pengaruh pH di saluran pencernaan sehingga IgG anti E. coli dapat bekerja secara efektif. Tujuan penelitian ini adalah untuk mengevaluasi stabilitas IgG anti E. coli K99 asal kolostrum sapi dalam mikrokapsul menggunakan teknik agar gel presipitation test (AGPT) dan enzyme linked immunosorbent assay (ELISA). Imunoglobulin G (IgG) murni asal kolostrum dikemas dalam mikrokapsul dengan waktu penyalutan selama 30 dan 60 menit. Keberadaan dan spesifisitas IgG anti E. coli diamati dalam mikrokapsul yang dilarutkan dengan larutan penyangga 0.2 M NaHCO3 dan 0.06 M Na3C6H5O7.2H2O pH 8. Pelarutan kemudian diatur dalam kondisi asam dan basa (8, 4, dan 9). Keberadaan IgG dideteksi dengan teknik ELISA tidak langsung, sedangkan spesifisitasnya dideteksi dengan teknik AGPT dan ELISA tidak langsung. Hasil pengamatan menunjukkan bahwa konsentrasi IgG total dari mikrokapsul dengan waktu penyalutan 30 dan 60 menit berkisar antara 0.971– 1.012 μg/ 100 μl. Hasil uji ELISA dan AGPT menunjukkan reaksi negatif antara IgG anti E . coli dari pelarutan mikrokapsul terhadap antigen E. coli K99, sedangkan reaksi positif ditunjukkan oleh IgG anti E. coli tanpa penyalutan. Hasil negatif diduga akibat rusaknya IgG anti E. coli selama proses pelarutan.
ABSTRACT
DINI NURWAHYUNI. Stability Test of IgG Anti Escherichia coli K99 from Bovine Colostrum in Microcapsule. Supervised by SRI MURTINI and ANITA ESFANDIARI.
The function of microencapsulation technique is to protect the IgG anti Escherichia coli (E. coli) K99 from bovine colostrum towards pH effect in the digestive tract so it can work effectively. The objective of this experiment is to evaluate the stability of IgG anti E. coli K99 from bovine colostrum in microcapsule using agar gel presipitation test (AGPT) and enzyme linked immunosorbent assay (ELISA) techniques. Purified IgG from colostrum were packaged in the form of coated-microcapsules 30 and 60 minutes. The occurrence and spesificity of IgG anti E. coli in was observed in microcapsules diluted with 0.2 M NaHCO3 and 0.06 M Na3C6H5O7.2H2O buffer pH 8. The dilution was subsequently subjected to acid and alkali condition (8, 4, and 9). The IgG anti E. coli occurrence was detected with indirect ELISA technique, while it specificity were detected by AGPT and indirect ELISA techniques. The result show that total IgG concentration from coated microcapsules of 30 and 60 minutes were 0.971– 1.012 μg/ 100 μl. ELISA and AGPT showed negative reaction between microcapsule diluted IgG anti E. coli againts E. coli K99 antigens, in contras with positive reaction in IgG anti E. coli uncoated. The negative result suspected due to the destruction of IgG anti E. coli during the dilution process.
UJI STABILITAS IgG ANTI
Escherichia coli
K99 ASAL
KOLOSTRUM SAPI DALAM KEMASAN
MIKROKAPSUL
DINI NURWAHYUNI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Uji Stabilitas IgG Anti Escherichia coli K99 Asal Kolostrum Sapi dalam Kemasan Mikrokapsul adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
DINI NURWAHYUNI. Uji Stabilitas IgG Anti Escherichia coli K99 Asal Kolostrum Sapi dalam Kemasan Mikrokapsul. Dibimbing oleh SRI MURTINI dan ANITA ESFANDIARI.
Teknik mikroenkapsulasi berfungsi untuk melindungi IgG anti Escherichia coli (E. coli) K99 asal kolostrum sapi terhadap pengaruh pH di saluran pencernaan sehingga IgG anti E. coli dapat bekerja secara efektif. Tujuan penelitian ini adalah untuk mengevaluasi stabilitas IgG anti E. coli K99 asal kolostrum sapi dalam mikrokapsul menggunakan teknik agar gel presipitation test (AGPT) dan enzyme linked immunosorbent assay (ELISA). Imunoglobulin G (IgG) murni asal kolostrum dikemas dalam mikrokapsul dengan waktu penyalutan selama 30 dan 60 menit. Keberadaan dan spesifisitas IgG anti E. coli diamati dalam mikrokapsul yang dilarutkan dengan larutan penyangga 0.2 M NaHCO3 dan 0.06 M Na3C6H5O7.2H2O pH 8. Pelarutan kemudian diatur dalam kondisi asam dan basa (8, 4, dan 9). Keberadaan IgG dideteksi dengan teknik ELISA tidak langsung, sedangkan spesifisitasnya dideteksi dengan teknik AGPT dan ELISA tidak langsung. Hasil pengamatan menunjukkan bahwa konsentrasi IgG total dari mikrokapsul dengan waktu penyalutan 30 dan 60 menit berkisar antara 0.971– 1.012 μg/ 100 μl. Hasil uji ELISA dan AGPT menunjukkan reaksi negatif antara IgG anti E . coli dari pelarutan mikrokapsul terhadap antigen E. coli K99, sedangkan reaksi positif ditunjukkan oleh IgG anti E. coli tanpa penyalutan. Hasil negatif diduga akibat rusaknya IgG anti E. coli selama proses pelarutan.
ABSTRACT
DINI NURWAHYUNI. Stability Test of IgG Anti Escherichia coli K99 from Bovine Colostrum in Microcapsule. Supervised by SRI MURTINI and ANITA ESFANDIARI.
The function of microencapsulation technique is to protect the IgG anti Escherichia coli (E. coli) K99 from bovine colostrum towards pH effect in the digestive tract so it can work effectively. The objective of this experiment is to evaluate the stability of IgG anti E. coli K99 from bovine colostrum in microcapsule using agar gel presipitation test (AGPT) and enzyme linked immunosorbent assay (ELISA) techniques. Purified IgG from colostrum were packaged in the form of coated-microcapsules 30 and 60 minutes. The occurrence and spesificity of IgG anti E. coli in was observed in microcapsules diluted with 0.2 M NaHCO3 and 0.06 M Na3C6H5O7.2H2O buffer pH 8. The dilution was subsequently subjected to acid and alkali condition (8, 4, and 9). The IgG anti E. coli occurrence was detected with indirect ELISA technique, while it specificity were detected by AGPT and indirect ELISA techniques. The result show that total IgG concentration from coated microcapsules of 30 and 60 minutes were 0.971– 1.012 μg/ 100 μl. ELISA and AGPT showed negative reaction between microcapsule diluted IgG anti E. coli againts E. coli K99 antigens, in contras with positive reaction in IgG anti E. coli uncoated. The negative result suspected due to the destruction of IgG anti E. coli during the dilution process.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
UJI STABILITAS IgG ANTI
Escherichia coli
K99 ASAL
KOLOSTRUM SAPI DALAM KEMASAN
MIKROKAPSUL
DINI NURWAHYUNI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberi kekuatan dan hidayah sehingga penulis dapat menyusun skripsi ini. Tema yang dipilih dalam penelitian adalah ”Uji Stabilitas IgG Anti Escherichia coli K99 Asal Kolostrum Sapi dalam Kemasan Mikrokapsul”. Penyusunan skripsi ini dilakukan sebagai salah satu syarat memeperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan.
Penulis menyampaikan terima kasih kepada Dr Drh Sri Murtini, MSi selaku pembimbing I dan Dr Drh Anita Esfandiari, MSi selaku pembimbing II yang telah memberikan bimbingan dan pengarahan selama penyusuna skripsi ini. Ucapan terima kasih juga disampaikan kepada Papa (Wahyudin, MSi), Mama (Tini Maryani), adik (Dina Nurwahyuni dan Arif Muhammad Nurdin) dan seluruh keluarga atas doa dan kasih sayangnya. Teman-tema Acromion 47 khususnya Shine, Shovia, Intan, Abid, Donny, Nafisatul, Riena, serta keluarga Ginastri atas dukungan dan semangat yang tak henti-hentinya sehingga penulis dapat menyelesaikan skripsi ini dengan baik. Penulis juga mengucapkan terima kasih kepada teman satu tim penelitian (Amanda), serta semua pihak di Laboratorium Reproduksi Balai Penelitian Ternak (Balitnak) Ciawi, Bogor atas bantuan dan kerja samanya.
Semoga penulis dapat menghasilkan laporan yang bermanfaat khususnya bagi penulis, umumnya bagi pembaca.
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR ix
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE PENELITIAN 2
Waktu dan Tempat 2
Bahan 3
Alat 3
Metode 3
Purifikasi IgG Anti E. coli K99 3
Pembuatan Mikrokapsul 4
Pengujian Keberadaan IgG Anti E. coli K99 dalam Mikrokapsul 4 Pengukuran konsentrasi IgG total dalam Mikrokapsul dengan ELISA 4 Deteksi IgG Anti E. coli K99 dalam Mikrokapsul dengan Teknik AGPT 5 Deteksi IgG Anti E. coli K99 dalam Mikrokapsul dengan Teknik ELISA 5
Analisis Data 6
HASIL DAN PEMBAHASAN 6
Pengukuran Konsentrasi IgG total dalam Mikrokapsul dengan ELISA 6 Deteksi IgG Anti E. coli K99 dalam Mikrokapsul dengan Teknik AGPT 8 Deteksi IgG Anti E. coli K99 dalam Mikrokapsul dengan Teknik ELISA 9
KESIMPULAN 10
SARAN 10
DAFTAR PUSTAKA 10
DAFTAR TABEL
1 Rataan absorbansi standar dan persamaan regresi linear 7 2 Rata-rata konsentrasi IgG total (μg/ 100 μl) dalam mikrokapsul 7
3 Nilai absorbansi IgG anti E. coli K99 9
DAFTAR GAMBAR
1 Hasil uji ELISA 7
2 Hasil AGPT kontrol 8
PENDAHULUAN
Latar Belakang
Diare merupakan gejala adanya gangguan pencernaan yang ditandai dengan pengeluaran feses dalam jumlah dan frekuensi melebihi normal dengan konsistensi cair. Feses dikeluarkan oleh penderita tanpa kesulitan karena terjadi peningkatan peristaltik usus (Ganong 2002). Diare dapat disebabkan oleh beberapa macam mikroorganisme, salah satunya Escherichia coli (E. coli). Escherichia coli tersebar di seluruh dunia dan dapat ditularkan melalui air atau pakan yang terkontaminasi oleh tinja. E. coli merupakan salah satu bakteri penyebab kolibasilosis pada anak sapi, terutama pada periode neonatal. E. coli juga merupakan suatu agen penyakit pada hewan peka yaitu hewan menyusui dan hewan muda terutama hewan yang berumur kurang dari satu minggu (Carter dan John 1990). Agen infeksius ini memiliki banyak serotipe dan serotipe yang banyak terdapat di lapangan adalah E. coli enterotoxigenic (ETEC) K99, F41 atau K99F41 (Supar 1996).
Escherichia coli K99 merupakan bakteri penting karena menyebabkan diare yang mematikan pada anak sapi (Supar et al. 1998). Prevalensi diare pada anak sapi perah akibat kolibasilosis berkisar antara 20–31% dengan tingkat mortalitas 65–85% (Supar 2001). Tingginya tingkat mortalitas pada anak sapi penderita kolibasilosis sangat merugikan peternak. Kerugian yang timbul tidak hanya berupa kematian, namun juga meningkatnya biaya pengobatan dan perawatan, penurunan berat badan, serta terganggunya pertumbuhan.
Pengobatan diare menggunakan antibiotik dinilai ampuh untuk membunuh bakteri. Penggunaan antibiotik secara berlebihan untuk pengobatan kolibasilosis menyebabkan terjadinya resistensi terhadap antibiotik. Penelitian Supar (2001) menunjukkan adanya resistensi bakteri E. coli K99 terhadap 9-15 macam antibiotika yang sering dipakai di lapangan. Hal ini mengindikasikan bahwa antibiotik tidak efektif untuk pengobatan dan pengendalian kolibasilosis. Pendekatan melalui imunisasi pasif melalui pemberian kolostrum dapat dijadikan alternatif untuk penanggulangan kasus diare akibat infeksi oleh ETEC K99 (Esfandiari et al. 2009).
Kolostrum merupakan sekresi yang dihasilkan oleh kelenjar ambing mamalia pada tahap akhir kebuntingan sampai tiga hari setelah melahirkan (Tizard 2004). Kolostrum mengandung dua komponen utama yaitu faktor pertumbuhan dan faktor imunitas (Thapa 2005). Salah satu faktor imun yang penting dalam kolostrum adalah antibodi (IgG) untuk kepentingan imunisasi pasif dari induk kepada anaknya yang baru lahir (Selk 2006). Hal ini penting karena anak sapi yang baru lahir tidak mendapatkan antibodi dari induk melalui plasenta sehingga antibodi mutlak didapatkan dari kolostrum sebagai pasokan IgG (Tizard 2000).
2
(keasaman lambung) dan digesti enzim pepsin (Esfandiari et al. 2008). Stabilitas IgG menjadi sangat penting apabila akan digunakan untuk terapi imunisasi pasif yang diberikan secara oral.
Teknik mikroenkapsulasi pada penelitian ini bertujuan melindungi IgG anti E. coli K99 asal kolostrum terhadap pengaruh pH di saluran pencernaan sehingga IgG dapat bekerja secara efektif. Efektifitas IgG anti E. coli yang telah disalut oleh kitosan-alginat menjadi mikrokapsul perlu diuji stabilitasnya. Uji stabilitas dapat dilakukan dengan uji serologis seperti agar gel precipitation test (AGPT) dan enzyme linked immunosorbant assay (ELISA). Agar gel presipitation test merupakan salah satu teknik untuk menganalisa atau mendeteksi keberadaan antibodi spesifik terhadap antigen tertentu pada media agar. Antigen dan antibodi yang diuji harus mampu terlarut dalam agar, sehingga dapat berdifusi dan membentuk garis presipitasi apabila antigen dengan antibodi tersebut homolog. Enzyme linked immunosorbant assay merupakan salah satu uji primer untuk mengukur interaksi antara antibodi dan antigen. Reaksi ikatan antigen dan atibodi dideteksi dengan antibodi yang dikonjugasikan dengan enzim. Uji ini lebih sensitif dan tidak berbahaya karena tidak menggunakan bahan radioaktif (Suwarno 2003).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi stabilitas IgG anti Escherichia coli K99 asal kolostrum sapi dalam kemasan mikrokapsul menggunakan teknik agar gel presipitation test (AGPT) dan enzyme linked immunosorbant assay (ELISA).
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang keberadaan dan stabilitas IgG anti Escherichia coli K99 asal kolostrum sapi dalam kemasan mikrokapsul tersalut kitosan-alginat.
METODE PENELITIAN
Waktu dan Tempat
3
Bahan
Bahan yang digunakan meliputi sampel kolostrum, amonium sulfat, akuabides steril, phosphate buffer saline (PBS), larutan Brad Fort, sodium alginat, kitosan, CaCl2, NaOH, akuades, 0.2 M NaHCO3, 0.06 M Na3C6H5O7.2H2O, Agarose (0.9%-1%), NaCl 0.85%, antigen E. coli K99, larutan buffer karbonat bikarbonat pH 9.6, larutan Phosphate Buffer Saline Tween-20 (PBST), larutan PBS skim 5%, konjugat anti bovine IgG peroxidase (Cat. No. A-5295, Sigma Chemical Co), substrat TMB.
Alat
Alat yang digunakan meliputi refrigerator, freezer, tabung mikrosentrifus, alat sentrifus, kantong dialisis membran nitroselulosa, benang nilon, vorteks, Encapsulator BUCHI B–390(R), pH meter, mikroskop cahaya, gelas obyek, beakerglass, stirrer, magnet pengaduk, batang pengaduk kaca, gelas ukur 100 mL, pipet ukur 10 mL, mikro pipet, timbangan, kertas perkamen, sudip, tabung erlenmeyer, alat penyaring, alumunium foil, gelas arloji, timer, kamera, gelas obyek, puncher, pipet pasteur, kertas saring, tabung mikro, cawan polysterene 96 sumuran (Nunc(R)), inkubator, dan alat pembaca mikro-ELISA.
Metode
Kolostrum yang mengandung IgG anti E. coli K99 diperoleh dari induk sapi yang divaksin dengan vaksin E. coli polivalen pada saat bunting trimester akhir.
Purifikasi IgG anti E. coli K99
Teknik purifikasi yang digunakan pada penelitian ini yaitu presipitasi garam (presipitasi dengan 40% amonium sulfat jenuh). Kolostrum kontrol (tidak mengandung anti E. coli) dan kolostrum yang mengandung anti E. coli masing-masing sebanyak 300 ml dihomogenkan dengan stirrer, kemudian ditambahkan amonium sulfat sebanyak 73 gram sedikit demi sedikit sampai mengental dan homogen. Kolostrum yang telah ditambah amonium sulfat disentrifus dengan kecepatan 5000 rpm pada suhu 4 ˚C selama 30 menit sampai terjadi pemisahan antara supernatan dan pelet. Supernatan dan pelet dimasukkan ke dalam tabung yang berbeda dan diberi label. Sebanyak 25 gram pelet dari kolostrum kontrol dan perlakuan dilarutkan dalam 50 ml larutan PBS dan dihomogenkan menggunakan vorteks. Setelah itu, supernatan dan pelet disimpan dalam refrigerator untuk selanjutnya dilakukan proses dialisis.
Proses dialisis dilakukan dengan memasukkan 25 ml pelet kolostrum hasil pengendapan amonium sulfat ke dalam kantong dialisis (berupa membran netroselulosa). Selanjutnya kantong dialisis di masukkan dalam 1 liter PBS dan diaduk menggunakan stirrer selama 24 jam pada suhu 40 ˚C dengan melakukan pergantian pelarut dialisis setiap 6 jam sekali. Hasil proses dialisis ini berupa IgG murni berasal dari kolostrum yang akan digunakan pada proses pembuatan mikrokapsul.
4
Pembuatan Mikrokapsul
Mikrokapsul kolostrum yang mengandung IgG anti E. coli dibuat berdasarkan modifikasi metode Li et al. (2007) dengan penyalut kitosan-alginat menggunakan mesin Microencapsulator BUCHI B–390(R). Pembuatan mikrokapsul dilakukan dengan metode ekstruksi yaitu mencampurkan larutan hidrokoloid seperti alginat dengan suspensi IgG kemudian diekstruksi melalui jarum (nozzle) dalam bentuk butiran ke dalam larutan pengeras seperti kalsium klorida (Krasaekoopt et al. 2003). Mikrokapsul dibuat melalui beberapa tahap, yaitu pembuatan mikrokapsul kitosan-alginat blanko dan dilanjutkan dengan pembuatan mikrokapsul kitosan-alginat yang berisi sampel IgG murni.
Pembuatan mikrokapsul kitosan-alginat blanko dan mikrokapsul berisi IgG anti E. coli murni dimulai dengan membuat larutan alginat 3% yang ditambahkan akuades dengan perbandingan 1:1 (10 ml : 10 ml) kemudian dihomogenkan menggunakan stirrer. Setelah larutan homogen, dilakukan proses pembuatan mikrokapsul menggunakan alat Microencapsulator BUCHI B–390(R), dengan ukuran nozzle 300, frekuensi 1000, elektroda 650, pressure 209–210 untuk mikrokapsul blanko dan pressure 432 untuk mikrokapsul berisi sampel. Butiran mikrokapsul yang dihasilkan kemudian ditampung dengan larutan CaCl2 yang diaduk menggunakan stirrer agar butiran mikrokapsul tidak saling menempel satu sama lain. Butiran mikrokapsul tersebut dicuci dengan akuades sebanyak tiga kali pengulangan kemudian direndam dalam larutan kitosan 1% pH 4.0 dengan lama perendaman 30 menit dan 60 menit. Mikrokapsul yang telah tersalut kitosan dicuci dengan akuades sebanyak lima kali, lalu disimpan di refrigerator dalam keadaan terendam akuades. Penyalutan dengan CaCl2 dan kitosan tersebut menggunakan metode Areekul et al. (2006) sebagai two step method.
Pengujian Keberadaan IgG Anti E. coli K99 dalam Mikrokapsul
Sebelum dilakukan pengujian IgG anti E. coli dalam mikrokapsul, sampel mikrokapsul blanko maupun mikrokapsul berisi IgG anti E. coli dilarutkan menurut metode Xue et al. (2004) ke dalam 5 ml larutan campuran 0.2 M NaHCO3 dan 0.06 M Na3C6H5O7.2H2O pada pH 8. Imunoglobulin G yang telah terlepas dari mikrokapsul kemudian diuji kandungan IgG anti E. coli dengan uji AGPT dan ELISA. Sampel yang digunakan untuk uji ELISA diatur pH dalam kondisi asam dan basa (normal, 4, dan 9). Sampel yang digunakan berupa IgG anti E. coli dari mikrokapsul dengan waktu penyalutan 30 dan 60 menit, IgG kontrol dan IgG anti E. coli non enkapsulasi hasil pemurnian dari kolostrum.
A. Pengukuran konsentrasi IgG total dalam mikrokapsul dengan ELISA
Anti-bovine IgG diencerkan dalam larutan buffer karbonat bikarbonat pH 9.6 dengan konsentrasi 3.5 µg/ml. Anti-bovine IgG kemudian dimasukkan ke dalam semua sumuran cawan ELISA sebanyak 100 μl/ sumur (coating). Cawan ditutup dan diinkubasi semalam pada suhu 4 ˚C. Setelah itu cawan ELISA dicuci dengan PBS Tween–20 sebanyak lima kali.
5
Sebanyak 100 μL konjugat anti-bovine IgG peroxidase yang diencerkan 1:10000 dimasukkan ke dalam semua sumur lalu diinkubasi pada suhu 37 ˚C selama satu jam. Cawan ELISA dicuci kembali lima kali dengan PBS Tween–20 dan sebanyak 100 μL substrat TMB dimasukkan ke dalam setiap sumur. Cawan ELISA kemudian diinkubasi pada suhu 37 ˚C selama 15 menit sampai ada perubahan warna. Hasil reaksi diukur dengan alat pembaca ELISA pada panjang gelombang 655 nm. Berdasarkan nilai absorbansi standar dihitung konsentrasi IgG total dalam mikrokapsul menggunakan persamaan regresi linear dengan nilai absorbansi sebagai Y dan X sebagai konsentrasi.
B. Deteksi IgG anti E. coli K99 dalam mikrokapsul dengan teknik AGPT
Sebanyak 0.1 gram agarose ditambahkan ke dalam 10 ml NaCl 8.5% kemudian dimasukkan ke dalam autoclave dengan tekanan 15 lb selama 15 menit. Agarose dipertahankan dengan menambahkan 0.1% sodium azide. Gelas objek dibersihkan kemudian pada permukaan yang datar dituangkan sebanyak 3.5 ml agarose hangat lalu dibiarkan sampai dingin dan mengeras. Sumur-sumur pada gel dibuat dengan menggunakan puncher. Pola yang digunakan yaitu satu sumur tengah yang dikelilingi oleh enam sumur perifer.
Antigen E. coli yang digunakan merupakan isolat bakteri E. coli yang dibiakkan pada media nutrient agar (NA) lalu dicuci dengan larutan PBS. Antigen E. coli kemudian disentrifus dengan kecepatan 1000 rpm selama 5 menit. Setelah itu, antigen E. coli dapat dipecah menggunakan sonikasi pada suhu 4 ˚C selama 20 menit.
Antigen E. coli dimasukkan pada sumur tengah, sedangkan sampel IgG anti E. coli yang akan diuji dimasukkan ke dalam masing-masing sumur perifer dengan menggunakan pipet pasteur. Gelas obyek diletakkan di atas kertas saring basah agar kelembaban dapat terjaga dan diinkubasi pada suhu ruang selama 24– 48 jam. Reaksi positif ditunjukkan dengan adanya garis presipitasi (garis buram putih) di antara sumur antigen dan sumur IgG anti E. coli. Hasil ini menandakan bahwa antigen dan antibodi tersebut homolog.
C. Deteksi IgG anti E. coli K99 dalam mikrokapsul dengan teknik ELISA
Antigen K99 diencerkan dalam larutan buffer karbonat bikarbonat pH 9.6 sehingga konsentrasinya 5 µg/ml. Antigen kemudian dimasukkan ke dalam semua sumuran cawan ELISA sebanyak 100 μL/ sumur (coating). Cawan ditutup dan diinkubasi semalam pada suhu 4 ˚C. Keesokan harinya cawan ELISA dicuci dengan PBS Tween–20 sebanyak lima kali.
6
Sampel yang akan diuji kemudian dimasukkan ke dalam sumuran-sumuran cawan ELISA sesuai dengan pola yang telah ditentukan. Setiap sumuran cawan berisi sebanyak 100 μL sampel. Cawan ELISA kemudian diinkubasi kembali pada suhu 37 ˚C selama 1 jam lalu dilakukan pencucian seperti prosedur di atas.
Sebanyak 100 μL konjugat anti-bovine IgG peroxidase yang diencerkan 1:10000 dimasukkan ke dalam setiap sumur lalu diinkubasi pada suhu 37 ˚C selama satu jam. Cawan ELISA dicuci kembali lima kali dengan PBS Tween–20 dan sebanyak 100 μL substrat TMB dimasukkan ke dalam setiap sumur. Cawan ELISA kemudian diinkubasi pada suhu 37 ˚C selama 15 menit sampai ada perubahan warna. Hasil reaksi diukur dengan alat pembaca ELISA pada panjang gelombang 655 nm. Hasil pengujian dianggap positif bila absorbansinya lebih besar sama dengan nilai rataan absorbansi IgG kontrol negatif ditambah standart deviasinya.
Analisis Data
Data yang diperoleh pada penelitian ini diolah dengan Microsoft excel 2007 dan dianalisis secara deskriptif.
HASIL DAN PEMBAHASAN
Penelitian ini menggunakan sampel pelet dan supernatan IgG anti E. coli hasil purifikasi. Purifikasi dilakukan untuk mendapatkan IgG anti E. coli murni dari kolostrum. Pelet dan supernatan IgG anti E. coli dimasukkan ke dalam mikrokapsul dengan lama penyalutan 30 dan 60 menit. Pengujian stabilitas IgG anti E. coli dalam mikrokapsul dilakukan dengan dua metode yaitu AGPT dan ELISA.
Pengukuran Konsentrasi IgG Total dalam Mikrokapsul dengan ELISA
7
Gambar 3 Hasil Uji ELISA
Hasil perhitungan kensentrasi IgG kontrol (standar IgG) pada Tabel 1 dengan menggunakan persamaan regresi linear (y=a+bx) diperoleh persamaan regresi liner y= 0.06+1.05x. Berdasarkan persamaan yang telah diperoleh maka dapat diketahui nilai konsentrasi IgG total pada masing-masing sampel (Tabel 2). Tabe l Rataan absorbasi standar dan persamaan regresi linear
Sampel uji Kontrol
Rataan absorbansi (y)
X
PBS* 0.095 0
1 1.071 0.5
2 1.268 1
3 1.486 2
4 1.163 4
5 1.565 8
Persamaan regresi linear → y = a+bx y = 0.06 + 1.05x
Keterangan :* Phosphate buffer saline (sebagai kontrol negatif) y = nilai absorbansi standar
x = konsentrasi standar IgG a = 0.06
b = 1.05
Tabel 2 Rata–rata konsentrasi IgG total (μg/ 100 μl) dalam mikrokapsul
Sampel Konsentrasi IgG total
8
Berdasarkan hasil rata-rata konsentrasi IgG total pada Tabel 1 menunjukkan bahwa teknik mikroenkapsulasi dapat mempertahankan kandungan IgG-nya. Hal ini tampak pada besarnya konsentrasi antara IgG yang disalut maupun yang tidak disalut. Konsentrasi IgG total sampel IgG anti E. coli pada pH 4 dari mikrokapsul dengan waktu penyalutan 30 dan 60 menit lebih tinggi dibandingkan dengan konsentrasi IgG total pada pH 8 dan pH 9. Konsentrasi IgG total pada pH 4 yang tidak disalut mengalami penurunan sehingga konsentrasinya lebih rendah dibandingkan dengan IgG yang tidak mengalami perubahan pH asam (IgG normal).
Suartini et al. (2007) menyatakan bahwa IgG lebih tahan terhadap pengaruh pH dibandingkan dengan IgY. Stabilitas IgG pada pH rendah (2–3) lebih tinggi dibandingkan IgY (Shimizu et al. 1993). Berbanding terbalik dengan IgG, IgY akan lebih cepat rusak pada pH asam dibandingkan dengan pH basa, hal ini berkaitan dengan struktur protein IgY yang lebih sensitif terhadap pH asam dibandingkan pH basa ( Shimizu et al. 1992).
Deteksi IgG anti E. coli K99 dalam Mikrokapsul dengan Teknik AGPT
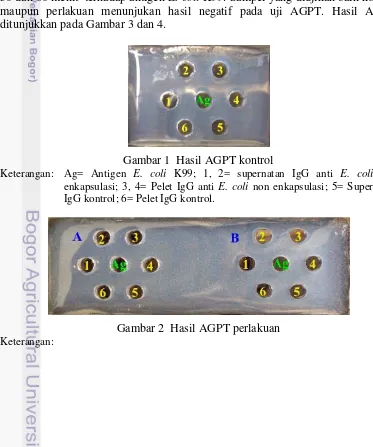
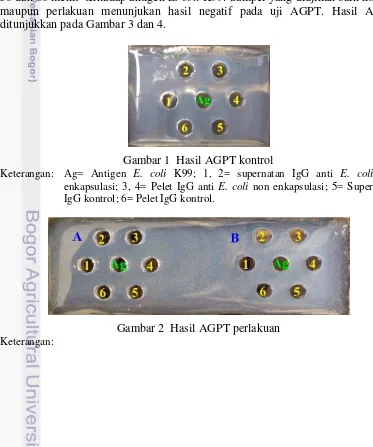
Agar gel presipitation test (AGPT) dilakukan untuk mengetahui keberadaan antibodi spesifik (IgG anti E. coli) dalam mikrokapsul dengan waktu penyalutan 30 dan 60 menit terhadap antigen E. coli K99. Sampel yang diujikan baik kontrol maupun perlakuan menunjukan hasil negatif pada uji AGPT. Hasil AGPT ditunjukkan pada Gambar 3 dan 4.
Gambar 1 Hasil AGPT kontrol
Keterangan: Ag= Antigen E. coli K99; 1, 2= supernatan IgG anti E. coli non enkapsulasi; 3, 4= Pelet IgG anti E. coli non enkapsulasi; 5= Supernatan IgG kontrol; 6= Pelet IgG kontrol.
Gambar 2 Hasil AGPT perlakuan
9
(A). Ag= Antigen Escherichia coli K99; 1, 2= supernatan IgG anti E. coli penyalutan 30 menit; 3, 4= Mikrokapsul berisi pelet IgG anti E. coli penyalutan 30 menit; 6, 7= Mikrokapsul blanko.
(B). Ag= Antigen; 1,2= Mikrokapsul berisi supernatan IgG anti E. coli penyalutan 60 menit; 3,4= Mikrokapsul berisi pelet IgG anti E. coli penyalutan 60 menit; 6,7= Mikrokapsul blanko.
Reaksi negatif dari uji AGPT menunjukkan bahwa antibodi terhadap E. coli K99 tidak terdeteksi dalam mikrokapsul. Reaksi negatif ini ditandai dengan tidak terbentuknya garis presipitasi di antara sumur antigen dan sumur antibodi. Hal ini disebabkan karena kurangnya konsentrasi IgG anti E. coli yang diperoleh dari hasil pelarutan mikrokapsul sehingga proporsi antara antigen dan IgG spesifik (IgG anti E. coli) tidak mencapai proporsi yang optimal. Pembentukan garis presipitasi terjadi apabila konsentrasi antigen dan antibodi seimbang (Kresno 1996). Menurut Tizard (1996), pada uji AGPT apabila konsentrasi antibodi lebih sedikit dibandingkan dengan antigen, maka akan terbentuk kompleks antigen-antibodi yang berukuran kecil sehingga larut dan tidak akan terbentuk garis presipitasi.
Deteksi IgG Anti E. coli K99 dalam Mikrokapsul dengan Teknik ELISA
Nilai cut off merupakan batas nilai positif dan negatif adanya antibodi anti E. coli K99 dalam sampel. Nilai cut off diperoleh dari rata-rata absorbansi sampel IgG kontrol non enkapsulasi pH 7 (1.097) ditambahkan dengan standar deviasinya (0.55). Berdasarkan nilai absorbansi IgG kontrol non enkapsulasi, sampel IgG anti E. coli dikatakan bernilai positif jika nilai absorbansi lebih besar atau sama dengan nilai cut off (≥ 1.647) dan bernilai negatif jika nilai absorbansi kurang dari atau sama dengan nilai cut off (≤ 1.647).
Nilai absorbansi yang menggambarkan pengaruh pH terhadap keberadaan IgG anti E. coli K99 pada IgG anti E. coli dalam mikrokapsul dengan waktu penyalutan 30 dan 60 menit serta IgG anti E. coli non enkapsulasi disajikan pada Tabel 3. Hasil pengujian memperlihatkan rataan nilai absorbansi dan interpretasi berdasarkan nilai cut off. Absorbansi bernilai positif tampak pada IgG anti E. coli non-enkapsulasi pH 7, sedangkan absorbansi IgG anti E. coli pH 8, 4 dan 9 dari mikrokapsul dengan waktu penyalutan 30 dan 60 menit bernilai negatif. Hasil ini menunjukkan bahwa IgG anti E. coli K99 yang disalut dan dilarutkan pada buffer 0.2 M NaHCO3 dan 0.06 M Na3C6H5O7.2H2O dengan pH 8, serta perlakuan asam dan basa pada pH 4 dan 9 tidak dapat terdeteksi.
Tabel 3 Nilai absorbansi IgG anti E.coli
Sampel uji ke- Rataan absorbasi Interpretasi
10
IgG non-enkapsulasi pH 9 1.527 -
IgG anti E. coli non enkapsulasi pH 7 1.887 +
IgG anti E. coli non enkapsulasi pH 4 0.037 -
IgG anti E. coli non enkapsulasi pH 9 1.178 -
Interpretasi : (+) jika rata-rata nilai absorbansi ≥ 1.647 (-) jika rata-rata nilai absorbansi ≤ 1.647
Tidak terdeteksinya IgG anti E. coli K99 dari mikrokapsul dengan waktu penyalutan 30 dan 60 menit diduga disebabkan karena rusaknya IgG anti E. coli pada saat pelarutan oleh larutan campuran natrium karbonat dan trisodium sitrat pada pH 8. Larutan campuran pH 8 ini akan mengganggu membran interphasic dan melarutkan semua fragmen dari mikrokapsul dalam waktu singkat (Xue et al. 2004) sehingga IgG anti E. coli dapat dikeluarkan. Menurut Davalos et al. (2000) stabilitas dan densitas permukaan IgG pada pH 8 lebih rendah dibandingkan dengan IgY. Stabilitas IgY yang lebih tinggi pada pH 8 akan menyebabkan densitas permukaan pada molekul antibodi IgY juga lebih tinggi, sehingga imunoreaktifitasnya kemungkinan lebih baik dibandingkan dengan IgG. Selain itu, IgY juga merupakan molekul yang lebihhidrofobik dibandingkan dengan IgG.
KESIMPULAN
Teknik mikroenkapsulasi IgG anti E. coli berhasil menyalut IgG dengan konsentrasi berkisar antara 0.971–1.012 μg/ 100 μl. Namun demikian keberadaan antibodi spesifik (IgG anti E. coli) dalam mikrokapsul tidak dapat terdeteksi (negatif) berdasarkan uji stabilitas IgG anti E. coli dari mikrokapsul yang terlarut menggunakan teknik ELISA dan AGPT. Hal ini diduga akibat dari kerusakan struktur IgG anti E. coli pada proses pelarutan mikrokapsul.
SARAN
Kajian lebih lanjut mengenai teknik pelarutan mikrokapsul yang mengandung IgG dan diperlukan teknik penyalutan mikrokapsul dengan variasi waktu yang berbeda-beda untuk melihat keberhasilan penyalutan mikrokapsul.
DAFTAR PUSTAKA
Areekul W, Kruenate J, Prahsarn C. 2006. Preparation and in vitro of mucoadhesive properties of alginate/ chitosan microparticles containing prednisolone. Int J Pharm. 312 (1–2): 113–118.
11 Davalos-Pantoja L, Ortega-Vinuesa JL, Bastos-Gonzalez D, Hidalgo-Alvarez R. 2000. A comparative study beetwen the adsorption of IgY and IgG on latex particles. J Biomater Sci Polym Ed. 11: 657–673.
Esfandiari A, Wibawan IWT, Murtini S, Widhyari SD, Febram B. 2008. Produksi kolostrum antivirus avian influenza dalam rangka pengendalian infeksi virus flu burung. JIPI. 13(2): 69–79.
Esfandiari A, Wibawan IWT, Wulansari R, Murtini S. 2009. Produksi kolostrum anti enteropatogen spesifik dalam rangka imunoterapi pasif guna mencegah Kematian Neonatal Akibat Diare. Laporan Penelitian Hibah Bersaing XIV/ 2. Lembaga Penelitian dan Pemberdayaan Masyarakat, Institut Pertanian Bogor.
Esfandiari A, Whidhyari SD, Hujarat A. 2011. Diare pada sapi neonatus yang ditantang Escherichia coli K-99. JIPI. 16(3): 191–197.
Ganong WF. 2002. Buku Ajar Fisiologi Kedokteran. Ed ke-20. Widjajakusumah D, editor. Jakarta (ID): EGC. Terjemahan dari: Review of Medical Physiology.
Indardi. 2005. Efek sistemik pemberian imunoglobulin y (IgY) anti enteripathogenic Escherichia coli (EPEC) peroral pada mencit. [skripsi]. Bogor (ID): Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Krasaekoopt W, Bhandari B, Deeth H. 2003. Evaluation of encapsulation techniques of probiotics for yoghurt. Int Dairy J. 13(1): 3–13.
Kresno SB. 1996. Imunologi: Diagnosa dan Prosedur Laboratorium. Edisi Keempat. Fakultas Kedokteran Universitas Indonesia. Jakarta (ID): Balai penerbit FKUI.
Li XY, Jin LJ, Mcallister, Stanford K, Xu JY, Lu YN, Zhen YH, Sun YX, Xu YP. 2007. Chitosan-alginate microcapsules for oral delivery of Yolk Immunoglobulun (IgY). J Agric food Chem. 55: 2911–2917.
Selk G. 2006. Passive Immunity in The Newborn Calf Affects Lifetime Performance. Cow/Calf Corner Oklahoma Cooperative Extension Service. Shimizu M, Nagashima H, Sano K, Hashimoto K, Ozeki M, Tsuda K, Hatta H.
1992. Molecular stability of chichken and rabbit immunoglobulin G. Biosci Biotech Biochem. 56(2): 270–274.
Shimizu M, Nagashima H, Hashimoto K. 1993. Comparative studies in molecular stability of immunology G from different spesies. Comp Biochem Physiol B. 106(2): 255–261.
Suartini IGT, Wibawan IWT, Suhartono MT, Supar, Suarta IN. 2007. Aktivitas IgY dab IgG antitetanus setelah perlakuan pada berbagai pH, suhu, dan enzim proteolitik. J Vet. 8(4): 160–166.
Supar. 1996. Kolibasilosis pada anak sapi perah di Indonesia. Wartazoa. 5(1): 26– 32.
Supar, Kusmiyati, Poerwadikarta MB. 1998. Aplikasi toksin enterotoksigenik escherichia coli (etec) k99, f41 polivalen pada induk sapi perah bunting dalam upaya pengendalian kolibasilosis dan kematian pedet neonatal. JITV 3(1): 27–33.
12
pengendalian kolibasilosis neonatal pada anak babi dan sapi. Wartazoa. 11(1): 36–43.
Suwarno. 2003. Prinsip Dasar, Optimalisasi dan Interpreasi Hasil Uji ELISA. Surabaya (ID): Lab Virologi dan Immunologi FKH Unair.
Thapa BR. 2005. Therapeutic potentials of bovine colostrums. Ind J Pediatr. 72(10): 849–852.
Tizard. 1996. Veterinary Immunology An introduction. Edisi ke-5. Texas (USA): WB Saunders Company.
Tizard IR. 2000. Veteriner Immunology an Introduction. Canada (CA): WB Saunders.
Tizard IR. 2004. Veterinary Immunology an Introduction. Ed ke-7. USA (USA): Saunders.
13
RIWAYAT HIDUP
Penulis lahir di Tasikmalaya pada tanggal 9 Juli 1991 dari Ayah yang bernama Wahyudin dan Ibu bernama Tini Maryani. Penulis merupakan putri pertama dari tiga bersaudara. Penulis pernah bersekolah di SDN 1 Cikatomas, SMPN 1 Cikatomas, lulus dari SMAN 1 Cikatomas tahun 2010 dan pada tahun yang sama lulus seleksi masuk IPB jalur Undangan Seleksi Masuk IPB (USMI) di Institut Pertanian Bogor.
PENDAHULUAN
Latar Belakang
Diare merupakan gejala adanya gangguan pencernaan yang ditandai dengan pengeluaran feses dalam jumlah dan frekuensi melebihi normal dengan konsistensi cair. Feses dikeluarkan oleh penderita tanpa kesulitan karena terjadi peningkatan peristaltik usus (Ganong 2002). Diare dapat disebabkan oleh beberapa macam mikroorganisme, salah satunya Escherichia coli (E. coli). Escherichia coli tersebar di seluruh dunia dan dapat ditularkan melalui air atau pakan yang terkontaminasi oleh tinja. E. coli merupakan salah satu bakteri penyebab kolibasilosis pada anak sapi, terutama pada periode neonatal. E. coli juga merupakan suatu agen penyakit pada hewan peka yaitu hewan menyusui dan hewan muda terutama hewan yang berumur kurang dari satu minggu (Carter dan John 1990). Agen infeksius ini memiliki banyak serotipe dan serotipe yang banyak terdapat di lapangan adalah E. coli enterotoxigenic (ETEC) K99, F41 atau K99F41 (Supar 1996).
Escherichia coli K99 merupakan bakteri penting karena menyebabkan diare yang mematikan pada anak sapi (Supar et al. 1998). Prevalensi diare pada anak sapi perah akibat kolibasilosis berkisar antara 20–31% dengan tingkat mortalitas 65–85% (Supar 2001). Tingginya tingkat mortalitas pada anak sapi penderita kolibasilosis sangat merugikan peternak. Kerugian yang timbul tidak hanya berupa kematian, namun juga meningkatnya biaya pengobatan dan perawatan, penurunan berat badan, serta terganggunya pertumbuhan.
Pengobatan diare menggunakan antibiotik dinilai ampuh untuk membunuh bakteri. Penggunaan antibiotik secara berlebihan untuk pengobatan kolibasilosis menyebabkan terjadinya resistensi terhadap antibiotik. Penelitian Supar (2001) menunjukkan adanya resistensi bakteri E. coli K99 terhadap 9-15 macam antibiotika yang sering dipakai di lapangan. Hal ini mengindikasikan bahwa antibiotik tidak efektif untuk pengobatan dan pengendalian kolibasilosis. Pendekatan melalui imunisasi pasif melalui pemberian kolostrum dapat dijadikan alternatif untuk penanggulangan kasus diare akibat infeksi oleh ETEC K99 (Esfandiari et al. 2009).
Kolostrum merupakan sekresi yang dihasilkan oleh kelenjar ambing mamalia pada tahap akhir kebuntingan sampai tiga hari setelah melahirkan (Tizard 2004). Kolostrum mengandung dua komponen utama yaitu faktor pertumbuhan dan faktor imunitas (Thapa 2005). Salah satu faktor imun yang penting dalam kolostrum adalah antibodi (IgG) untuk kepentingan imunisasi pasif dari induk kepada anaknya yang baru lahir (Selk 2006). Hal ini penting karena anak sapi yang baru lahir tidak mendapatkan antibodi dari induk melalui plasenta sehingga antibodi mutlak didapatkan dari kolostrum sebagai pasokan IgG (Tizard 2000).
2
(keasaman lambung) dan digesti enzim pepsin (Esfandiari et al. 2008). Stabilitas IgG menjadi sangat penting apabila akan digunakan untuk terapi imunisasi pasif yang diberikan secara oral.
Teknik mikroenkapsulasi pada penelitian ini bertujuan melindungi IgG anti E. coli K99 asal kolostrum terhadap pengaruh pH di saluran pencernaan sehingga IgG dapat bekerja secara efektif. Efektifitas IgG anti E. coli yang telah disalut oleh kitosan-alginat menjadi mikrokapsul perlu diuji stabilitasnya. Uji stabilitas dapat dilakukan dengan uji serologis seperti agar gel precipitation test (AGPT) dan enzyme linked immunosorbant assay (ELISA). Agar gel presipitation test merupakan salah satu teknik untuk menganalisa atau mendeteksi keberadaan antibodi spesifik terhadap antigen tertentu pada media agar. Antigen dan antibodi yang diuji harus mampu terlarut dalam agar, sehingga dapat berdifusi dan membentuk garis presipitasi apabila antigen dengan antibodi tersebut homolog. Enzyme linked immunosorbant assay merupakan salah satu uji primer untuk mengukur interaksi antara antibodi dan antigen. Reaksi ikatan antigen dan atibodi dideteksi dengan antibodi yang dikonjugasikan dengan enzim. Uji ini lebih sensitif dan tidak berbahaya karena tidak menggunakan bahan radioaktif (Suwarno 2003).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi stabilitas IgG anti Escherichia coli K99 asal kolostrum sapi dalam kemasan mikrokapsul menggunakan teknik agar gel presipitation test (AGPT) dan enzyme linked immunosorbant assay (ELISA).
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang keberadaan dan stabilitas IgG anti Escherichia coli K99 asal kolostrum sapi dalam kemasan mikrokapsul tersalut kitosan-alginat.
METODE PENELITIAN
Waktu dan Tempat
2
(keasaman lambung) dan digesti enzim pepsin (Esfandiari et al. 2008). Stabilitas IgG menjadi sangat penting apabila akan digunakan untuk terapi imunisasi pasif yang diberikan secara oral.
Teknik mikroenkapsulasi pada penelitian ini bertujuan melindungi IgG anti E. coli K99 asal kolostrum terhadap pengaruh pH di saluran pencernaan sehingga IgG dapat bekerja secara efektif. Efektifitas IgG anti E. coli yang telah disalut oleh kitosan-alginat menjadi mikrokapsul perlu diuji stabilitasnya. Uji stabilitas dapat dilakukan dengan uji serologis seperti agar gel precipitation test (AGPT) dan enzyme linked immunosorbant assay (ELISA). Agar gel presipitation test merupakan salah satu teknik untuk menganalisa atau mendeteksi keberadaan antibodi spesifik terhadap antigen tertentu pada media agar. Antigen dan antibodi yang diuji harus mampu terlarut dalam agar, sehingga dapat berdifusi dan membentuk garis presipitasi apabila antigen dengan antibodi tersebut homolog. Enzyme linked immunosorbant assay merupakan salah satu uji primer untuk mengukur interaksi antara antibodi dan antigen. Reaksi ikatan antigen dan atibodi dideteksi dengan antibodi yang dikonjugasikan dengan enzim. Uji ini lebih sensitif dan tidak berbahaya karena tidak menggunakan bahan radioaktif (Suwarno 2003).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi stabilitas IgG anti Escherichia coli K99 asal kolostrum sapi dalam kemasan mikrokapsul menggunakan teknik agar gel presipitation test (AGPT) dan enzyme linked immunosorbant assay (ELISA).
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang keberadaan dan stabilitas IgG anti Escherichia coli K99 asal kolostrum sapi dalam kemasan mikrokapsul tersalut kitosan-alginat.
METODE PENELITIAN
Waktu dan Tempat
3
Bahan
Bahan yang digunakan meliputi sampel kolostrum, amonium sulfat, akuabides steril, phosphate buffer saline (PBS), larutan Brad Fort, sodium alginat, kitosan, CaCl2, NaOH, akuades, 0.2 M NaHCO3, 0.06 M Na3C6H5O7.2H2O, Agarose (0.9%-1%), NaCl 0.85%, antigen E. coli K99, larutan buffer karbonat bikarbonat pH 9.6, larutan Phosphate Buffer Saline Tween-20 (PBST), larutan PBS skim 5%, konjugat anti bovine IgG peroxidase (Cat. No. A-5295, Sigma Chemical Co), substrat TMB.
Alat
Alat yang digunakan meliputi refrigerator, freezer, tabung mikrosentrifus, alat sentrifus, kantong dialisis membran nitroselulosa, benang nilon, vorteks, Encapsulator BUCHI B–390(R), pH meter, mikroskop cahaya, gelas obyek, beakerglass, stirrer, magnet pengaduk, batang pengaduk kaca, gelas ukur 100 mL, pipet ukur 10 mL, mikro pipet, timbangan, kertas perkamen, sudip, tabung erlenmeyer, alat penyaring, alumunium foil, gelas arloji, timer, kamera, gelas obyek, puncher, pipet pasteur, kertas saring, tabung mikro, cawan polysterene 96 sumuran (Nunc(R)), inkubator, dan alat pembaca mikro-ELISA.
Metode
Kolostrum yang mengandung IgG anti E. coli K99 diperoleh dari induk sapi yang divaksin dengan vaksin E. coli polivalen pada saat bunting trimester akhir.
Purifikasi IgG anti E. coli K99
Teknik purifikasi yang digunakan pada penelitian ini yaitu presipitasi garam (presipitasi dengan 40% amonium sulfat jenuh). Kolostrum kontrol (tidak mengandung anti E. coli) dan kolostrum yang mengandung anti E. coli masing-masing sebanyak 300 ml dihomogenkan dengan stirrer, kemudian ditambahkan amonium sulfat sebanyak 73 gram sedikit demi sedikit sampai mengental dan homogen. Kolostrum yang telah ditambah amonium sulfat disentrifus dengan kecepatan 5000 rpm pada suhu 4 ˚C selama 30 menit sampai terjadi pemisahan antara supernatan dan pelet. Supernatan dan pelet dimasukkan ke dalam tabung yang berbeda dan diberi label. Sebanyak 25 gram pelet dari kolostrum kontrol dan perlakuan dilarutkan dalam 50 ml larutan PBS dan dihomogenkan menggunakan vorteks. Setelah itu, supernatan dan pelet disimpan dalam refrigerator untuk selanjutnya dilakukan proses dialisis.
Proses dialisis dilakukan dengan memasukkan 25 ml pelet kolostrum hasil pengendapan amonium sulfat ke dalam kantong dialisis (berupa membran netroselulosa). Selanjutnya kantong dialisis di masukkan dalam 1 liter PBS dan diaduk menggunakan stirrer selama 24 jam pada suhu 40 ˚C dengan melakukan pergantian pelarut dialisis setiap 6 jam sekali. Hasil proses dialisis ini berupa IgG murni berasal dari kolostrum yang akan digunakan pada proses pembuatan mikrokapsul.
4
Pembuatan Mikrokapsul
Mikrokapsul kolostrum yang mengandung IgG anti E. coli dibuat berdasarkan modifikasi metode Li et al. (2007) dengan penyalut kitosan-alginat menggunakan mesin Microencapsulator BUCHI B–390(R). Pembuatan mikrokapsul dilakukan dengan metode ekstruksi yaitu mencampurkan larutan hidrokoloid seperti alginat dengan suspensi IgG kemudian diekstruksi melalui jarum (nozzle) dalam bentuk butiran ke dalam larutan pengeras seperti kalsium klorida (Krasaekoopt et al. 2003). Mikrokapsul dibuat melalui beberapa tahap, yaitu pembuatan mikrokapsul kitosan-alginat blanko dan dilanjutkan dengan pembuatan mikrokapsul kitosan-alginat yang berisi sampel IgG murni.
Pembuatan mikrokapsul kitosan-alginat blanko dan mikrokapsul berisi IgG anti E. coli murni dimulai dengan membuat larutan alginat 3% yang ditambahkan akuades dengan perbandingan 1:1 (10 ml : 10 ml) kemudian dihomogenkan menggunakan stirrer. Setelah larutan homogen, dilakukan proses pembuatan mikrokapsul menggunakan alat Microencapsulator BUCHI B–390(R), dengan ukuran nozzle 300, frekuensi 1000, elektroda 650, pressure 209–210 untuk mikrokapsul blanko dan pressure 432 untuk mikrokapsul berisi sampel. Butiran mikrokapsul yang dihasilkan kemudian ditampung dengan larutan CaCl2 yang diaduk menggunakan stirrer agar butiran mikrokapsul tidak saling menempel satu sama lain. Butiran mikrokapsul tersebut dicuci dengan akuades sebanyak tiga kali pengulangan kemudian direndam dalam larutan kitosan 1% pH 4.0 dengan lama perendaman 30 menit dan 60 menit. Mikrokapsul yang telah tersalut kitosan dicuci dengan akuades sebanyak lima kali, lalu disimpan di refrigerator dalam keadaan terendam akuades. Penyalutan dengan CaCl2 dan kitosan tersebut menggunakan metode Areekul et al. (2006) sebagai two step method.
Pengujian Keberadaan IgG Anti E. coli K99 dalam Mikrokapsul
Sebelum dilakukan pengujian IgG anti E. coli dalam mikrokapsul, sampel mikrokapsul blanko maupun mikrokapsul berisi IgG anti E. coli dilarutkan menurut metode Xue et al. (2004) ke dalam 5 ml larutan campuran 0.2 M NaHCO3 dan 0.06 M Na3C6H5O7.2H2O pada pH 8. Imunoglobulin G yang telah terlepas dari mikrokapsul kemudian diuji kandungan IgG anti E. coli dengan uji AGPT dan ELISA. Sampel yang digunakan untuk uji ELISA diatur pH dalam kondisi asam dan basa (normal, 4, dan 9). Sampel yang digunakan berupa IgG anti E. coli dari mikrokapsul dengan waktu penyalutan 30 dan 60 menit, IgG kontrol dan IgG anti E. coli non enkapsulasi hasil pemurnian dari kolostrum.
A. Pengukuran konsentrasi IgG total dalam mikrokapsul dengan ELISA
Anti-bovine IgG diencerkan dalam larutan buffer karbonat bikarbonat pH 9.6 dengan konsentrasi 3.5 µg/ml. Anti-bovine IgG kemudian dimasukkan ke dalam semua sumuran cawan ELISA sebanyak 100 μl/ sumur (coating). Cawan ditutup dan diinkubasi semalam pada suhu 4 ˚C. Setelah itu cawan ELISA dicuci dengan PBS Tween–20 sebanyak lima kali.
5
Sebanyak 100 μL konjugat anti-bovine IgG peroxidase yang diencerkan 1:10000 dimasukkan ke dalam semua sumur lalu diinkubasi pada suhu 37 ˚C selama satu jam. Cawan ELISA dicuci kembali lima kali dengan PBS Tween–20 dan sebanyak 100 μL substrat TMB dimasukkan ke dalam setiap sumur. Cawan ELISA kemudian diinkubasi pada suhu 37 ˚C selama 15 menit sampai ada perubahan warna. Hasil reaksi diukur dengan alat pembaca ELISA pada panjang gelombang 655 nm. Berdasarkan nilai absorbansi standar dihitung konsentrasi IgG total dalam mikrokapsul menggunakan persamaan regresi linear dengan nilai absorbansi sebagai Y dan X sebagai konsentrasi.
B. Deteksi IgG anti E. coli K99 dalam mikrokapsul dengan teknik AGPT
Sebanyak 0.1 gram agarose ditambahkan ke dalam 10 ml NaCl 8.5% kemudian dimasukkan ke dalam autoclave dengan tekanan 15 lb selama 15 menit. Agarose dipertahankan dengan menambahkan 0.1% sodium azide. Gelas objek dibersihkan kemudian pada permukaan yang datar dituangkan sebanyak 3.5 ml agarose hangat lalu dibiarkan sampai dingin dan mengeras. Sumur-sumur pada gel dibuat dengan menggunakan puncher. Pola yang digunakan yaitu satu sumur tengah yang dikelilingi oleh enam sumur perifer.
Antigen E. coli yang digunakan merupakan isolat bakteri E. coli yang dibiakkan pada media nutrient agar (NA) lalu dicuci dengan larutan PBS. Antigen E. coli kemudian disentrifus dengan kecepatan 1000 rpm selama 5 menit. Setelah itu, antigen E. coli dapat dipecah menggunakan sonikasi pada suhu 4 ˚C selama 20 menit.
Antigen E. coli dimasukkan pada sumur tengah, sedangkan sampel IgG anti E. coli yang akan diuji dimasukkan ke dalam masing-masing sumur perifer dengan menggunakan pipet pasteur. Gelas obyek diletakkan di atas kertas saring basah agar kelembaban dapat terjaga dan diinkubasi pada suhu ruang selama 24– 48 jam. Reaksi positif ditunjukkan dengan adanya garis presipitasi (garis buram putih) di antara sumur antigen dan sumur IgG anti E. coli. Hasil ini menandakan bahwa antigen dan antibodi tersebut homolog.
C. Deteksi IgG anti E. coli K99 dalam mikrokapsul dengan teknik ELISA
Antigen K99 diencerkan dalam larutan buffer karbonat bikarbonat pH 9.6 sehingga konsentrasinya 5 µg/ml. Antigen kemudian dimasukkan ke dalam semua sumuran cawan ELISA sebanyak 100 μL/ sumur (coating). Cawan ditutup dan diinkubasi semalam pada suhu 4 ˚C. Keesokan harinya cawan ELISA dicuci dengan PBS Tween–20 sebanyak lima kali.
6
Sampel yang akan diuji kemudian dimasukkan ke dalam sumuran-sumuran cawan ELISA sesuai dengan pola yang telah ditentukan. Setiap sumuran cawan berisi sebanyak 100 μL sampel. Cawan ELISA kemudian diinkubasi kembali pada suhu 37 ˚C selama 1 jam lalu dilakukan pencucian seperti prosedur di atas.
Sebanyak 100 μL konjugat anti-bovine IgG peroxidase yang diencerkan 1:10000 dimasukkan ke dalam setiap sumur lalu diinkubasi pada suhu 37 ˚C selama satu jam. Cawan ELISA dicuci kembali lima kali dengan PBS Tween–20 dan sebanyak 100 μL substrat TMB dimasukkan ke dalam setiap sumur. Cawan ELISA kemudian diinkubasi pada suhu 37 ˚C selama 15 menit sampai ada perubahan warna. Hasil reaksi diukur dengan alat pembaca ELISA pada panjang gelombang 655 nm. Hasil pengujian dianggap positif bila absorbansinya lebih besar sama dengan nilai rataan absorbansi IgG kontrol negatif ditambah standart deviasinya.
Analisis Data
Data yang diperoleh pada penelitian ini diolah dengan Microsoft excel 2007 dan dianalisis secara deskriptif.
HASIL DAN PEMBAHASAN
Penelitian ini menggunakan sampel pelet dan supernatan IgG anti E. coli hasil purifikasi. Purifikasi dilakukan untuk mendapatkan IgG anti E. coli murni dari kolostrum. Pelet dan supernatan IgG anti E. coli dimasukkan ke dalam mikrokapsul dengan lama penyalutan 30 dan 60 menit. Pengujian stabilitas IgG anti E. coli dalam mikrokapsul dilakukan dengan dua metode yaitu AGPT dan ELISA.
Pengukuran Konsentrasi IgG Total dalam Mikrokapsul dengan ELISA
6
Sampel yang akan diuji kemudian dimasukkan ke dalam sumuran-sumuran cawan ELISA sesuai dengan pola yang telah ditentukan. Setiap sumuran cawan berisi sebanyak 100 μL sampel. Cawan ELISA kemudian diinkubasi kembali pada suhu 37 ˚C selama 1 jam lalu dilakukan pencucian seperti prosedur di atas.
Sebanyak 100 μL konjugat anti-bovine IgG peroxidase yang diencerkan 1:10000 dimasukkan ke dalam setiap sumur lalu diinkubasi pada suhu 37 ˚C selama satu jam. Cawan ELISA dicuci kembali lima kali dengan PBS Tween–20 dan sebanyak 100 μL substrat TMB dimasukkan ke dalam setiap sumur. Cawan ELISA kemudian diinkubasi pada suhu 37 ˚C selama 15 menit sampai ada perubahan warna. Hasil reaksi diukur dengan alat pembaca ELISA pada panjang gelombang 655 nm. Hasil pengujian dianggap positif bila absorbansinya lebih besar sama dengan nilai rataan absorbansi IgG kontrol negatif ditambah standart deviasinya.
Analisis Data
Data yang diperoleh pada penelitian ini diolah dengan Microsoft excel 2007 dan dianalisis secara deskriptif.
HASIL DAN PEMBAHASAN
Penelitian ini menggunakan sampel pelet dan supernatan IgG anti E. coli hasil purifikasi. Purifikasi dilakukan untuk mendapatkan IgG anti E. coli murni dari kolostrum. Pelet dan supernatan IgG anti E. coli dimasukkan ke dalam mikrokapsul dengan lama penyalutan 30 dan 60 menit. Pengujian stabilitas IgG anti E. coli dalam mikrokapsul dilakukan dengan dua metode yaitu AGPT dan ELISA.
Pengukuran Konsentrasi IgG Total dalam Mikrokapsul dengan ELISA
7
Gambar 3 Hasil Uji ELISA
Hasil perhitungan kensentrasi IgG kontrol (standar IgG) pada Tabel 1 dengan menggunakan persamaan regresi linear (y=a+bx) diperoleh persamaan regresi liner y= 0.06+1.05x. Berdasarkan persamaan yang telah diperoleh maka dapat diketahui nilai konsentrasi IgG total pada masing-masing sampel (Tabel 2). Tabe l Rataan absorbasi standar dan persamaan regresi linear
Sampel uji Kontrol
Rataan absorbansi (y)
X
PBS* 0.095 0
1 1.071 0.5
2 1.268 1
3 1.486 2
4 1.163 4
5 1.565 8
Persamaan regresi linear → y = a+bx y = 0.06 + 1.05x
Keterangan :* Phosphate buffer saline (sebagai kontrol negatif) y = nilai absorbansi standar
x = konsentrasi standar IgG a = 0.06
b = 1.05
Tabel 2 Rata–rata konsentrasi IgG total (μg/ 100 μl) dalam mikrokapsul
Sampel Konsentrasi IgG total
8
Berdasarkan hasil rata-rata konsentrasi IgG total pada Tabel 1 menunjukkan bahwa teknik mikroenkapsulasi dapat mempertahankan kandungan IgG-nya. Hal ini tampak pada besarnya konsentrasi antara IgG yang disalut maupun yang tidak disalut. Konsentrasi IgG total sampel IgG anti E. coli pada pH 4 dari mikrokapsul dengan waktu penyalutan 30 dan 60 menit lebih tinggi dibandingkan dengan konsentrasi IgG total pada pH 8 dan pH 9. Konsentrasi IgG total pada pH 4 yang tidak disalut mengalami penurunan sehingga konsentrasinya lebih rendah dibandingkan dengan IgG yang tidak mengalami perubahan pH asam (IgG normal).
Suartini et al. (2007) menyatakan bahwa IgG lebih tahan terhadap pengaruh pH dibandingkan dengan IgY. Stabilitas IgG pada pH rendah (2–3) lebih tinggi dibandingkan IgY (Shimizu et al. 1993). Berbanding terbalik dengan IgG, IgY akan lebih cepat rusak pada pH asam dibandingkan dengan pH basa, hal ini berkaitan dengan struktur protein IgY yang lebih sensitif terhadap pH asam dibandingkan pH basa ( Shimizu et al. 1992).
Deteksi IgG anti E. coli K99 dalam Mikrokapsul dengan Teknik AGPT
Agar gel presipitation test (AGPT) dilakukan untuk mengetahui keberadaan antibodi spesifik (IgG anti E. coli) dalam mikrokapsul dengan waktu penyalutan 30 dan 60 menit terhadap antigen E. coli K99. Sampel yang diujikan baik kontrol maupun perlakuan menunjukan hasil negatif pada uji AGPT. Hasil AGPT ditunjukkan pada Gambar 3 dan 4.
Gambar 1 Hasil AGPT kontrol
Keterangan: Ag= Antigen E. coli K99; 1, 2= supernatan IgG anti E. coli non enkapsulasi; 3, 4= Pelet IgG anti E. coli non enkapsulasi; 5= Supernatan IgG kontrol; 6= Pelet IgG kontrol.
Gambar 2 Hasil AGPT perlakuan
9
(A). Ag= Antigen Escherichia coli K99; 1, 2= supernatan IgG anti E. coli penyalutan 30 menit; 3, 4= Mikrokapsul berisi pelet IgG anti E. coli penyalutan 30 menit; 6, 7= Mikrokapsul blanko.
(B). Ag= Antigen; 1,2= Mikrokapsul berisi supernatan IgG anti E. coli penyalutan 60 menit; 3,4= Mikrokapsul berisi pelet IgG anti E. coli penyalutan 60 menit; 6,7= Mikrokapsul blanko.
Reaksi negatif dari uji AGPT menunjukkan bahwa antibodi terhadap E. coli K99 tidak terdeteksi dalam mikrokapsul. Reaksi negatif ini ditandai dengan tidak terbentuknya garis presipitasi di antara sumur antigen dan sumur antibodi. Hal ini disebabkan karena kurangnya konsentrasi IgG anti E. coli yang diperoleh dari hasil pelarutan mikrokapsul sehingga proporsi antara antigen dan IgG spesifik (IgG anti E. coli) tidak mencapai proporsi yang optimal. Pembentukan garis presipitasi terjadi apabila konsentrasi antigen dan antibodi seimbang (Kresno 1996). Menurut Tizard (1996), pada uji AGPT apabila konsentrasi antibodi lebih sedikit dibandingkan dengan antigen, maka akan terbentuk kompleks antigen-antibodi yang berukuran kecil sehingga larut dan tidak akan terbentuk garis presipitasi.
Deteksi IgG Anti E. coli K99 dalam Mikrokapsul dengan Teknik ELISA
Nilai cut off merupakan batas nilai positif dan negatif adanya antibodi anti E. coli K99 dalam sampel. Nilai cut off diperoleh dari rata-rata absorbansi sampel IgG kontrol non enkapsulasi pH 7 (1.097) ditambahkan dengan standar deviasinya (0.55). Berdasarkan nilai absorbansi IgG kontrol non enkapsulasi, sampel IgG anti E. coli dikatakan bernilai positif jika nilai absorbansi lebih besar atau sama dengan nilai cut off (≥ 1.647) dan bernilai negatif jika nilai absorbansi kurang dari atau sama dengan nilai cut off (≤ 1.647).
Nilai absorbansi yang menggambarkan pengaruh pH terhadap keberadaan IgG anti E. coli K99 pada IgG anti E. coli dalam mikrokapsul dengan waktu penyalutan 30 dan 60 menit serta IgG anti E. coli non enkapsulasi disajikan pada Tabel 3. Hasil pengujian memperlihatkan rataan nilai absorbansi dan interpretasi berdasarkan nilai cut off. Absorbansi bernilai positif tampak pada IgG anti E. coli non-enkapsulasi pH 7, sedangkan absorbansi IgG anti E. coli pH 8, 4 dan 9 dari mikrokapsul dengan waktu penyalutan 30 dan 60 menit bernilai negatif. Hasil ini menunjukkan bahwa IgG anti E. coli K99 yang disalut dan dilarutkan pada buffer 0.2 M NaHCO3 dan 0.06 M Na3C6H5O7.2H2O dengan pH 8, serta perlakuan asam dan basa pada pH 4 dan 9 tidak dapat terdeteksi.
Tabel 3 Nilai absorbansi IgG anti E.coli
Sampel uji ke- Rataan absorbasi Interpretasi
10
IgG non-enkapsulasi pH 9 1.527 -
IgG anti E. coli non enkapsulasi pH 7 1.887 +
IgG anti E. coli non enkapsulasi pH 4 0.037 -
IgG anti E. coli non enkapsulasi pH 9 1.178 -
Interpretasi : (+) jika rata-rata nilai absorbansi ≥ 1.647 (-) jika rata-rata nilai absorbansi ≤ 1.647
Tidak terdeteksinya IgG anti E. coli K99 dari mikrokapsul dengan waktu penyalutan 30 dan 60 menit diduga disebabkan karena rusaknya IgG anti E. coli pada saat pelarutan oleh larutan campuran natrium karbonat dan trisodium sitrat pada pH 8. Larutan campuran pH 8 ini akan mengganggu membran interphasic dan melarutkan semua fragmen dari mikrokapsul dalam waktu singkat (Xue et al. 2004) sehingga IgG anti E. coli dapat dikeluarkan. Menurut Davalos et al. (2000) stabilitas dan densitas permukaan IgG pada pH 8 lebih rendah dibandingkan dengan IgY. Stabilitas IgY yang lebih tinggi pada pH 8 akan menyebabkan densitas permukaan pada molekul antibodi IgY juga lebih tinggi, sehingga imunoreaktifitasnya kemungkinan lebih baik dibandingkan dengan IgG. Selain itu, IgY juga merupakan molekul yang lebihhidrofobik dibandingkan dengan IgG.
KESIMPULAN
Teknik mikroenkapsulasi IgG anti E. coli berhasil menyalut IgG dengan konsentrasi berkisar antara 0.971–1.012 μg/ 100 μl. Namun demikian keberadaan antibodi spesifik (IgG anti E. coli) dalam mikrokapsul tidak dapat terdeteksi (negatif) berdasarkan uji stabilitas IgG anti E. coli dari mikrokapsul yang terlarut menggunakan teknik ELISA dan AGPT. Hal ini diduga akibat dari kerusakan struktur IgG anti E. coli pada proses pelarutan mikrokapsul.
SARAN
Kajian lebih lanjut mengenai teknik pelarutan mikrokapsul yang mengandung IgG dan diperlukan teknik penyalutan mikrokapsul dengan variasi waktu yang berbeda-beda untuk melihat keberhasilan penyalutan mikrokapsul.
DAFTAR PUSTAKA
Areekul W, Kruenate J, Prahsarn C. 2006. Preparation and in vitro of mucoadhesive properties of alginate/ chitosan microparticles containing prednisolone. Int J Pharm. 312 (1–2): 113–118.
10
IgG non-enkapsulasi pH 9 1.527 -
IgG anti E. coli non enkapsulasi pH 7 1.887 +
IgG anti E. coli non enkapsulasi pH 4 0.037 -
IgG anti E. coli non enkapsulasi pH 9 1.178 -
Interpretasi : (+) jika rata-rata nilai absorbansi ≥ 1.647 (-) jika rata-rata nilai absorbansi ≤ 1.647
Tidak terdeteksinya IgG anti E. coli K99 dari mikrokapsul dengan waktu penyalutan 30 dan 60 menit diduga disebabkan karena rusaknya IgG anti E. coli pada saat pelarutan oleh larutan campuran natrium karbonat dan trisodium sitrat pada pH 8. Larutan campuran pH 8 ini akan mengganggu membran interphasic dan melarutkan semua fragmen dari mikrokapsul dalam waktu singkat (Xue et al. 2004) sehingga IgG anti E. coli dapat dikeluarkan. Menurut Davalos et al. (2000) stabilitas dan densitas permukaan IgG pada pH 8 lebih rendah dibandingkan dengan IgY. Stabilitas IgY yang lebih tinggi pada pH 8 akan menyebabkan densitas permukaan pada molekul antibodi IgY juga lebih tinggi, sehingga imunoreaktifitasnya kemungkinan lebih baik dibandingkan dengan IgG. Selain itu, IgY juga merupakan molekul yang lebihhidrofobik dibandingkan dengan IgG.
KESIMPULAN
Teknik mikroenkapsulasi IgG anti E. coli berhasil menyalut IgG dengan konsentrasi berkisar antara 0.971–1.012 μg/ 100 μl. Namun demikian keberadaan antibodi spesifik (IgG anti E. coli) dalam mikrokapsul tidak dapat terdeteksi (negatif) berdasarkan uji stabilitas IgG anti E. coli dari mikrokapsul yang terlarut menggunakan teknik ELISA dan AGPT. Hal ini diduga akibat dari kerusakan struktur IgG anti E. coli pada proses pelarutan mikrokapsul.
SARAN
Kajian lebih lanjut mengenai teknik pelarutan mikrokapsul yang mengandung IgG dan diperlukan teknik penyalutan mikrokapsul dengan variasi waktu yang berbeda-beda untuk melihat keberhasilan penyalutan mikrokapsul.
DAFTAR PUSTAKA
Areekul W, Kruenate J, Prahsarn C. 2006. Preparation and in vitro of mucoadhesive properties of alginate/ chitosan microparticles containing prednisolone. Int J Pharm. 312 (1–2): 113–118.
10
IgG non-enkapsulasi pH 9 1.527 -
IgG anti E. coli non enkapsulasi pH 7 1.887 +
IgG anti E. coli non enkapsulasi pH 4 0.037 -
IgG anti E. coli non enkapsulasi pH 9 1.178 -
Interpretasi : (+) jika rata-rata nilai absorbansi ≥ 1.647 (-) jika rata-rata nilai absorbansi ≤ 1.647
Tidak terdeteksinya IgG anti E. coli K99 dari mikrokapsul dengan waktu penyalutan 30 dan 60 menit diduga disebabkan karena rusaknya IgG anti E. coli pada saat pelarutan oleh larutan campuran natrium karbonat dan trisodium sitrat pada pH 8. Larutan campuran pH 8 ini akan mengganggu membran interphasic dan melarutkan semua fragmen dari mikrokapsul dalam waktu singkat (Xue et al. 2004) sehingga IgG anti E. coli dapat dikeluarkan. Menurut Davalos et al. (2000) stabilitas dan densitas permukaan IgG pada pH 8 lebih rendah dibandingkan dengan IgY. Stabilitas IgY yang lebih tinggi pada pH 8 akan menyebabkan densitas permukaan pada molekul antibodi IgY juga lebih tinggi, sehingga imunoreaktifitasnya kemungkinan lebih baik dibandingkan dengan IgG. Selain itu, IgY juga merupakan molekul yang lebihhidrofobik dibandingkan dengan IgG.
KESIMPULAN
Teknik mikroenkapsulasi IgG anti E. coli berhasil menyalut IgG dengan konsentrasi berkisar antara 0.971–1.012 μg/ 100 μl. Namun demikian keberadaan antibodi spesifik (IgG anti E. coli) dalam mikrokapsul tidak dapat terdeteksi (negatif) berdasarkan uji stabilitas IgG anti E. coli dari mikrokapsul yang terlarut menggunakan teknik ELISA dan AGPT. Hal ini diduga akibat dari kerusakan struktur IgG anti E. coli pada proses pelarutan mikrokapsul.
SARAN
Kajian lebih lanjut mengenai teknik pelarutan mikrokapsul yang mengandung IgG dan diperlukan teknik penyalutan mikrokapsul dengan variasi waktu yang berbeda-beda untuk melihat keberhasilan penyalutan mikrokapsul.
DAFTAR PUSTAKA
Areekul W, Kruenate J, Prahsarn C. 2006. Preparation and in vitro of mucoadhesive properties of alginate/ chitosan microparticles containing prednisolone. Int J Pharm. 312 (1–2): 113–118.