PENGARUH KADAR FLAVONOID TOTAL DAN
WAKTU KONTAK FLAVONOID EKSTRAK
DAUN KATUK SEBAGAI ANTIOKSIDAN
PADA MINYAK KELAPA
SKRIPSI
Oleh
090405016
Indah Cikita
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA
PENGARUH KADAR FLAVONOID TOTAL DAN
WAKTU KONTAK FLAVONOID EKSTRAK
DAUN KATUK SEBAGAI ANTIOKSIDAN
PADA MINYAK KELAPA
SKRIPSI
Oleh
090405016
INDAH CIKITA
SKRIPSI INI DIAJUKAN UNTUK MELENGKAPI SEBAGIAN
PERSYARATAN MENJADI SARJANA TEKNIK
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA
i
PERNYATAAN KEASLIAN SKRIPSI
Saya menyatakan dengan sesungguhnya bahwa skripsi dengan judul :
PENGARUH KADAR FLAVONOID TOTAL DAN WAKTU KONTAK FLAVONOID EKSTRAK DAUN KATUK SEBAGAI ANTIOKSIDAN PADA
MINYAK KELAPA
dibuat untuk melengkapi sebagian persyaratan menjadi Sarjana Teknik pada Departemen Teknik Kimia Fakultas Teknik Universitas Sumatera Utara. Skripsi ini adalah hasil karya saya kecuali kutipan-kutipan yang telah saya sebutkan sumbernya. Demikian pernyataan ini diperbuat, apabila dikemudian hari terbukti bahwa karya ini bukan karya saya atau merupakan hasil jiplakan maka saya bersedia menerima sanksi sesuai dengan aturan yang berlaku.
Medan, 10 Juli 2015
iii
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas limpahan rahmat dan karunia-Nya sehingga skripsi ini dapat diselesaikan. Tulisan ini merupakan skripsi dengan judul “Pengaruh Kadar Flavonoid Total dan Waktu Kontak Flavonoid Ekstrak Daun Katuk sebagai Antioksidan pada Minyak Kelapa”, berdasarkan hasil penelitian yang penulis lakukan di Laboratorium Proses Industri Kimia Departemen Teknik Kimia Fakultas Teknik Universtas Sumatera Utara. Skripsi ini merupakan salah satu syarat untuk mendapatkan gelar sarjana teknik.
Hasil Penelitian ini diharapkan dapat memberikan gambaran kepada dunia industri tentang pemanfaatan daun katuk yang dapat digunakan sebagai antioksidan pada minyak kelapa.
Selama melakukan penelitian hingga penulisan skripsi ini, penulis banyak mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Ibu Prof. Dr. Ir. Rosdanelli. H, MT., selaku dosen pembimbing yang telah bersedia meluangkan waktu untuk memberi pengarahan, diskusi dan bimbingan serta persetujuan sehingga skripsi ini dapat selesai dengan baik.
2. Bapak Dr. Ir. Taslim, M.Si., dan Bapak Dr. Eng. Rondang Tambun, ST. MT., selaku dosen penguji yang telah memberikan saran dan masukan yang membangun dalam penulisan skripsi ini.
3. Bapak Dr. Eng. Ir. Irvan, MT., selaku ketua Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara.
4. Ibu Ir. Renita Manurung, MT., selaku koordinator penelitian.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, oleh karena itu penulis mengharapkan saran dan masukan demi kesempurnaan skripsi ini. Semoga skripsi ini memberikan manfaat bagi pengembangan ilmu pengetahuan.
Medan, Juli 2015 Penulis
iv
DEDIKASI
v
RIWAYAT HIDUP PENULIS
Nama : Indah Cikita NIM : 090405016
Tempat / Tanggal Lahir : Medan / 06 Juni 1991 Nama Orang Tua : Nursalimah Siregar
Alamat Orang Tua :
Perum Citra Raysa Indah, Jl. Padang Pasir,
Rantauprapat, Kec. Rantau Selatan, Kab. Labuhan Batu, Sumatera Utara
Asal Sekolah :
• Madrasah Ibtidaiyah Raudhatul Uluum, Aek Nabara 1997 – 2003 • Madrasah Tsanawiyah Negeri, Rantauprapat 2003 – 2006
• SMA Negeri 3 Rantau Utara, Rantauprapat 2006 – 2009 Beasiswa yang diperoleh :
• Beasiswa Bantuan Belajar Mahasiswa (BBM) tahun 2009
• Beasiswa Peningkatan Prestasi Akademik (PPA) tahun 2010 – 2011 • Beasiswa Peduli Pendidikan tahun 2011 – 2013
Pengalaman Organisasi / Kerja :
1. Himatek periode 2012 – 2013 sebagai Anggota Bidang Sosroh 2. CSG periode 2011 – 2012 sebagai Anggota Kebendaharaan
vi
ABSTRAK
Penelitian ini bertujuan untuk mengetahui pengaruh kadar flavonoid total dan waktu kontak flavonoid ekstrak daun katuk sebagai antioksidan pada minyak kelapa. Proses yang digunakan adalah ekstraksi daun katuk kemudian ekstrak dengan kadar flavonoid total sebesar 6,668%, 7,748% dan 27,909% digunakan sebagai sampel dan dikontakkan pada minyak kelapa dengan waktu kontak 2, 4 dan 6 hari. Selanjutnya dilakukan analisis pada minyak kelapa yaitu bilangan asam, bilangan iod dan bilangan peroksida. Hasil penelitian yang diperoleh adalah kadar flavonoid total yang semakin meningkat menyebabkan penurunan bilangan asam, peningkatan bilangan iod dan penurunan bilangan peroksida yang membuktikan bahwa ekstrak daun katuk dapat digunakan sebagai antioksidan pada minyak kelapa dengan hasil terbaik yaitu kadar flavonoid sebesar 27,909% dimana bilangan asam 0,962 mg KOH/g, bilangan iod 38,705 g I2/100 g dan bilangan peroksida 13,333 Meq/kg. Waktu kontak flavonoid pada minyak kelapa yang semakin meningkat menyebabkan sifat minyak semakin buruk tetapi perubahan tidak terlalu besar dibandingkan minyak tanpa penambahan ekstrak.
vii
ABSTRACT
This research aims to determine the effect of total flavonoid concentration and contact time the flavonoid of katuk leaves extract as antioxidants in coconut oil. The process used is extraction of katuk leaves then extract with the total flavonoid concentration 6,668%, 7,748% and 27,909% was used as a sample and contacted in the coconut oil with the contact time of 2, 4 and 6 days. Then, analysis which done of the coconut oil are the acid number, the iodine number and the peroxide number. The result obtained are the total flavonoid concentration increasing cause a decrease the acid number, the iodine number increase and decrease the peroxide number which proved that katuk leaves extract can be used as antioxidants in the coconut oil with the best result is the total flavonoid concentration in 27,909% where the acid number is 0,962 mg KOH/g, the iodine number is 38,705 g I2/100 g and the peroxide number is 13,333 Meq/kg. The contact time of flavonoid in the coconut oil which increasing cause oil properties is getting worse but the results are better than the oil without the addition of extract.
viii
DAFTAR ISI
Halaman
PERNYATAAN KEASLIAN SKRIPSI i
PENGESAHAN ii
PRAKATA iii
DEDIKASI iv
RIWAYAT HIDUP PENULIS v
ABSTRAK vi
ABSTRACT vii
DAFTAR ISI viii
DAFTAR GAMBAR xi
DAFTAR TABEL xii
DAFTAR LAMPIRAN xiii
DAFTAR SINGKATAN xiv
DAFTAR SIMBOL xv
BAB I PENDAHULUAN 1
1.1 LATAR BELAKANG 1
1.2 PERUMUSAN MASALAH 4
1.3 TUJUAN PENELITIAN 4
1.4 MANFAAT PENELITIAN 4
1.5 RUANG LINGKUP PENELITIAN 4
BAB II TINJAUAN PUSTAKA 5
2.1 TANAMAN KATUK (Sauropus androgynus (L) Merr) 5
2.2 ANTIOKSIDAN 7
2.2.1 Pengertian Antioksidan 7
2.2.2 Sumber Antioksidan 8
2.2.3 Mekanisme Kerja Antioksidan 10
2.2.4 Flavonoid 12
2.3 EKSTRAKSI 12
2.4 MINYAK KELAPA 13
ix
2.6 ANALISIS EKONOMI 17
BAB III METODOLOGI PENELITIAN 20
3.1LOKASI PENELITIAN 20
3.2BAHAN DAN PERALATAN 20
3.2.1 Bahan Penelitian 20
3.2.2 Peralatan 20
3.2.2.1 Peralatan Penelitian 20
3.2.2.2 Peralatan Analisis 21
3.3 RANCANGAN PENELITIAN 21
3.4 PROSEDUR PENELITIAN 22
3.4.1 Prosedur Percobaan Utama 22
3.4.2 Prosedur Analisis 22
3.4.2.1 Prosedur Penentuan Bilangan Asam 22 3.4.2.2 Prosedur Penentuan Bilangan Iod 22 3.4.2.3 Prosedur Penentuan Bilangan Peroksida 23
3.5 FLOWCHART PENELITIAN 24
3.5.1 Prosedur Percobaan Utama 24
3.5.2 Prosedur Analisis 25
3.5.2.1 Prosedur Penentuan Bilangan Asam 25 3.5.2.2 Prosedur Penentuan Bilangan Iod 26 3.5.2.3 Prosedur Penentuan Bilangan Peroksida 28
BAB IV HASIL DAN PEMBAHASAN 30
4.1 PENGARUH KADAR FLAVONOID TOTAL DAN
WAKTU KONTAK TERHADAP BILANGAN ASAM, IOD
DAN PEROKSIDA PADA MINYAK KELAPA 31
4.1.1 Pengaruh Kadar Flavonoid Total Dan Waktu Kontak
Terhadap Bilangan Asam Pada Minyak Kelapa 31 4.1.2 Pengaruh Kadar Flavonoid Total Dan Waktu Kontak
Terhadap Bilangan Iod Pada Minyak Kelapa 34 4.1.3 Pengaruh Kadar Flavonoid Total Dan Waktu Kontak
x
BAB V KESIMPULAN DAN SARAN 39
5.1 KESIMPULAN 39
5.2 SARAN 39
DAFTAR PUSTAKA 40
LAMPIRAN 1 DATA HASIL PENELITIAN 44
LAMPIRAN 2 CONTOH PERHITUNGN 46
xi
DAFTAR GAMBAR
Halaman Gambar 2.1 Tanaman Katuk (Sauropus androgynus (L) Merr) 6
Gambar 2.2 Reaksi Oksidasi Asam Lemak 16
Gambar 3.1 Flowchart Prosedur Percobaan Utama 24 Gambar 3.2 Flowchart Prosedur Penentuan Bilangan Asam 25 Gambar 3.3 Flowchart Prosedur Penentuan Bilangan Iod 26 Gambar 3.4 Flowchart Prosedur Penentuan Bilangan Peroksida 28 Gambar 4.1 Pengaruh Kadar Flavonoid Total Dan Waktu Kontak Terhadap
Bilangan Asam Pada Minyak Kelapa 31
Gambar 4.2 Pengaruh Kadar Flavonoid Total Dan Waktu Kontak Terhadap
Bilangan Iod Pada Minyak Kelapa 34
Gambar 4.3 Pengaruh Kadar Flavonoid Total Dan Waktu Kontak Terhadap Bilangan Peroksida Pada Minyak Kelapa 36 Gambar L3.1 Tahap Ekstraksi : (a) Proses Ekstraksi, (b) Ekstrak yang
Dihasilkan 52
Gambar L3.2 Minyak Kelapa yang Telah Ditambahkan Ekstrak 52 Gambar L3.3 Analisis Bilangan Asam : (a) Sebelum Titrasi, (b) Setelah
Titrasi 53
Gambar L3.4 Analisis Bilangan Iod : (a) Titrasi Awal, (b) Titrasi Akhir 53 Gambar L3.5 Analisis Bilangan Peroksida : (a) Titrasi Awal, (b) Titrasi
xii
DAFTAR TABEL
Halaman Tabel 1.1 Penelitian Pemanfaatan Bahan Alam sebagai Antioksidan 3 Tabel 2.1 Komposisi Kimia Daun Katuk per 100 Gram
Bagian yang Dapat Dimakan 7
Tabel 2.2 Komposisi Asam Lemak Minyak Kelapa 14
Tabel 3.1 Rancangan Penelitian 21
Tabel 4.1 Hasil Pengujian Minyak Kelapa tanpa Penambahan Ekstrak
Daun Katuk 30
Tabel 4.2 Hasil Analisis Percobaan dan Syarat Mutu Pada Minyak Kelapa 38
Tabel L1.1 Data Hasil Analisis Bilangan Asam 44
Tabel L1.2 Data Hasil Analisis Bilangan Iod 44
Tabel L1.3 Data Hasil Analisis Bilangan Peroksida 45
Tabel L2.1 Hasil Analisis Bilangan Asam 48
Tabel L2.2 Hasil Analisis Bilangan Iod 49
xiii
DAFTAR LAMPIRAN
Halaman
LAMPIRAN 1 DATA HASIL PENELTIAN 44
L1.1 DATA HASIL ANALISIS BILANGAN ASAM
MINYAK KELAPA 44
L1.2 DATA HASIL ANALISIS BILANGAN IOD
MINYAK KELAPA 44
L1.3 DATA HASIL ANALISIS BILANGAN PEROKSIDA
MINYAK KELAPA 45
LAMPIRAN 2 CONTOH PERHITUNGAN 46
L2. 1 PERHITUNGAN BAHAN KIMIA YANG
DIGUNAKAN 46
L2.1.1 Pembuatan Larutan KOH 0,1 N 46
L2.1.2 Pembuatan Indikator Phenolphthalein 1% 46
L2.1.3 Pembuatan Larutan Hanus 46
L2.1.4 Pembuatan Larutan Kalium Iodida 15% 46 L2.1.5 Pembuatan Larutan Natrium Tiosulfat
(Na2S2O3) 0,1 N 47
L2.1.6 Pembuatan Indikator Amilum 1% 47 L2.1.7 Pembuatan Larutan Asam Asetat Glasial dan
Kloroform 3:2 47
L2.2 PERHITUNGAN BILANGAN ASAM 47
L2.3 PERHITUNGAN BILANGAN IOD 48
L2.4 PERHITUNGAN BILANGAN PEROKSIDA 50
LAMPIRAN 3 DOKUMENTASI PENELITIAN 52
L3.1 TAHAP EKSTRAKSI 52
L3.2 SAMPEL UNTUK ANALISIS 52
L3.3 ANALISA BILANGAN ASAM 53
L3.4 ANALISA BILANGAN IOD 53
xiv
DAFTAR SINGKATAN
AOAC Association of Analytical Communities
BHA Butilated Hidroxy Anisol
BHT Butilated Hidroxy Toluena
PG Propyl Gallat
SFE Supercritical Fluid Extraction
SNI Standar Nasional Indonesia
SOD Superoksida Dismutase
TBHQ Tert-butil Hidroxy Quinon
xv
DAFTAR SIMBOL
Simbol C2H5OH KOH CH3COOH CHCl3 KI H2O Na2S2O3 (C6H10O5)n
Keterangan Etanol
Kalium Hidroksida Asam Asetat Kloroform Kalium Iodida Aquadest
Natrium Tiosulfat Indikator Amilum
Dimensi
A Volume larutan titrasi blanko ml
B Volume larutan titrasi sampel ml
N Normalitas N
vi
ABSTRAK
Penelitian ini bertujuan untuk mengetahui pengaruh kadar flavonoid total dan waktu kontak flavonoid ekstrak daun katuk sebagai antioksidan pada minyak kelapa. Proses yang digunakan adalah ekstraksi daun katuk kemudian ekstrak dengan kadar flavonoid total sebesar 6,668%, 7,748% dan 27,909% digunakan sebagai sampel dan dikontakkan pada minyak kelapa dengan waktu kontak 2, 4 dan 6 hari. Selanjutnya dilakukan analisis pada minyak kelapa yaitu bilangan asam, bilangan iod dan bilangan peroksida. Hasil penelitian yang diperoleh adalah kadar flavonoid total yang semakin meningkat menyebabkan penurunan bilangan asam, peningkatan bilangan iod dan penurunan bilangan peroksida yang membuktikan bahwa ekstrak daun katuk dapat digunakan sebagai antioksidan pada minyak kelapa dengan hasil terbaik yaitu kadar flavonoid sebesar 27,909% dimana bilangan asam 0,962 mg KOH/g, bilangan iod 38,705 g I2/100 g dan bilangan peroksida 13,333 Meq/kg. Waktu kontak flavonoid pada minyak kelapa yang semakin meningkat menyebabkan sifat minyak semakin buruk tetapi perubahan tidak terlalu besar dibandingkan minyak tanpa penambahan ekstrak.
vii
ABSTRACT
This research aims to determine the effect of total flavonoid concentration and contact time the flavonoid of katuk leaves extract as antioxidants in coconut oil. The process used is extraction of katuk leaves then extract with the total flavonoid concentration 6,668%, 7,748% and 27,909% was used as a sample and contacted in the coconut oil with the contact time of 2, 4 and 6 days. Then, analysis which done of the coconut oil are the acid number, the iodine number and the peroxide number. The result obtained are the total flavonoid concentration increasing cause a decrease the acid number, the iodine number increase and decrease the peroxide number which proved that katuk leaves extract can be used as antioxidants in the coconut oil with the best result is the total flavonoid concentration in 27,909% where the acid number is 0,962 mg KOH/g, the iodine number is 38,705 g I2/100 g and the peroxide number is 13,333 Meq/kg. The contact time of flavonoid in the coconut oil which increasing cause oil properties is getting worse but the results are better than the oil without the addition of extract.
1
BAB I
PENDAHULUAN
1.1 LATAR BELAKANG
Pengembangan produk minyak kelapa untuk memenuhi kebutuhan pangan di Indonesia memiliki prospek yang baik untuk jangka panjang. Hal tersebut karena Indonesia memiliki potensi area perkebunan kelapa yang luas bila dibandingkan dengan negara-negara penghasil kelapa yang lainnya. Menurut data Coconut Statistical Yearbook pada tahun 2006, luas area perkebunankelapa di Indonesia yaitu 3.701 Ha [1]. Minyak kelapa merupakan bagian yang paling berharga dari buah kelapa dan banyak digunakan sebagai bahan baku industri atau sebagai minyak goreng [2]. Minyak kelapa pada umumnya mengandung asam lemak jenuh yang tinggi yaitu kurang lebih 90% dan asam lemak tak jenuh sebesar 10% [3].
Kandungan asam lemak tak jenuh sangat mempengaruhi stabilitas minyak. Walaupun kandungan asam lemak tak jenuh pada minyak kelapa lebih rendah dibandingkan minyak kelapa sawit (±49%), namun minyak kelapa sawit mengandung senyawa karotenoida (antioksidan alami) yang mampu menghambat proses oksidasi, sedangkan kadar karotenoida yang terdapat pada minyak kelapa tergolong rendah sehingga lebih mudah teroksidasi. Oksidasi adalah faktor yang sangat penting sebab dapat menghasilkan senyawa-senyawa yang menyumbangkan terjadinya off flavour dan kondisi ini lazim disebut tengik (rancid). Hal ini menyebabkan produk olahan pangan akan menurun mutunya dan dapat membahayakan kesehatan manusia, sehingga perlu dilakukan upaya untuk mengatasinya. Salah satu cara mengatasinya adalah menambahkan senyawa antioksidan pada minyak kelapa agar tidak mudah teroksidasi [1].
2
Penggunaan antioksidan sintetik seperti BHA dan BHT sangat efektif untuk menghambat minyak atau lemak agar tidak terjadi oksidasi, namun penggunaan BHA dan BHT banyak menimbulkan kekhawatiran akan efek sampingnya. Berdasarkan penelitian diketahui bahwa penggunaan BHA pada level tinggi diketahui mempunyai sifat toksik dan efek penggunaan BHT dapat menyebabkan tumor paru-paru, tumor hati serta tumor kandung kemih pada mencit. Untuk menghindari efek antioksidan yang berbahaya maka cara yang paling aman adalah penggunaan antioksidan alami. Oleh karena itu, perlu dilakukan penelitian untuk menggali potensi senyawa bahan alam yang memiliki aktivitas antioksidan yang mudah diperoleh dalam jumlah besar dan tanpa efek samping [3].
Antioksidan alami yang saat ini banyak digunakan, bersumber dari bahan rempah - rempah. Rempah-rempah cukup berbau dan berasa, oleh sebab itu perlu dicari antioksidan alami yang aman tetapi tidak banyak berpengaruh terhadap aroma dan rasa makanan [4]. Salah satu bahan alami yang dapat digunakan sebagai antioksidan adalah daun katuk. Katuk merupakan jenis tanaman tahunan yang setiap saat dapat dipetik dan tidak tergantung pada musim. Tanaman ini mudah ditanam, tahan gulma dan menghasilkan daun yang banyak dalam waktu yang relatif singkat [5]. Tumbuhan ini dapat dijumpai hampir di semua tempat di Indonesia. Di dalam daun katuk banyak terdapat minyak atsiri, sterol, saponin, flavonoid, triterpin, asam-asam organik, asam-asam-asam-asam amino, alkaloid dan tanin [6].
3
Penelitian yang terkait dengan pemanfaatan bahan alam sebagai antioksidan pada minyak kelapa dapat dilihat pada tabel 1.1 berikut ini.
Tabel 1.1 Penelitian Pemanfaatan Bahan Alam sebagai Antioksidan Peneliti Judul Penelitian Hasil Penelitian Anie Komayaharti,
dan Dwi Paryanti.
Ekstrak Daun Sirih sebagai Antioksidan
Pada Minyak Kelapa.
Memanfaatkan ekstrak daun sirih sebagai antioksidan pada minyak kelapa dengan variasi volume pelarut etanol 96% (50 – 150 ml), waktu ekstraksi (30 – 90 menit) dan kecepatan pengadukan (200 – 1200 rpm), hasil yang paling
berpengaruh adalah volume pelarut dimana pada volume pelarut 130 ml diperoleh bilangan peroksida terkecil yaitu 10,626 Meq/kg [7]. Hermiati, Rusli,
Naomi Yemima, dan Mersi Suriani.
Ekstrak Daun Sirih Hijau dan Merah sebagai Antioksidan
Pada Minyak Kelapa.
Melakukan penelitian lanjutan yang memanfaatkan ekstrak daun sirih sebagai antioksidan pada
minyak kelapa dengan
memvariasikan jenis dan bentuk sirih yaitu jenis daun sirih hijau dan merah dalam bentuk daun dicacah dan serbuk, hasil yang diperoleh adalah serbuk daun sirih merah dengan volume pelarut etanol 150 ml, waktu ekstraksi 75 menit dan kecepatan pengadukan 300 rpm memberikan keadaan optimum terbaik yang dapat menurunkan bilangan peroksidan sebesar 55,13% [4].
Nana Dyah Siswati, Juni SU, dan Junaidi. Pemanfaatan Antioksidan Alami Flavonol untuk Mencegah Proses Ketengikan Minyak Kelapa.
Memanfaatkan antioksidan dari ekstraksi flavonol yang terkandung dalam kulit bawang merah menggunakan pelarut air dan hasil terbaik diperoleh pada konsentrasi ekstrak kulit bawang merah 11% yang diekstraksi pada waktu 1,5 jam untuk minyak kelapa yang disimpan selama 4 hari dengan angka peroksida 0,6144 mg O/100 g [8].
4 1.2 PERUMUSAN MASALAH
Perumusan masalah dalam penelitian ini adalah bagaimana keefektifan flavonoid ekstrak daun katuk sebagai antioksidan pada minyak kelapa berdasarkan pengaruh kadar flavonoid total dan waktu kontak flavonoid ekstrak daun katuk.
1.3 TUJUAN PENELITIAN
Penelitian ini bertujuan untuk mengetahui pengaruh kadar flavonoid total dan waktu kontak flavonoid ekstrak daun katuk sebagai antioksidan pada minyak kelapa.
1.4 MANFAAT PENELITIAN
Adapun manfaat dari penelitian ini adalah :
1. Sebagai informasi tentang pemanfaatan daun katuk sebagai antioksidan pada minyak kelapa.
2. Pemanfaatan daun katuk sebagai antioksidan pada minyak kelapa dapat dikembangkan dalam skala besar sehingga dapat dimanfaatkan secara maksimal pada industri-industri yang bersangkutan.
1.5 RUANG LINGKUP PENELITIAN
Penelitian ini dilakukan di Laboratorium Proses Industri Kimia, Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara, Medan.
Penelitian ini memiliki ruang lingkup dan batasan sebagai berikut :
1. Sampel yang digunakan adalah ekstrak daun katuk sebanyak 5% dari jumlah minyak kelapa.
2. Variabel penelitian adalah kadar flavonoid total dan waktu kontak flavonoid ekstrak daun katuk dengan perincian sebagai berikut:
− Kadar flavonoid total ekstrak yang digunakan yaitu 6,668%, 7,748% dan 27,909%.
− Waktu kontak flavonoid daun katuk pada minyak kelapa yaitu 2, 4 dan 6 hari.
5
BAB II
TINJAUAN PUSTAKA
2.1 TANAMAN KATUK (Sauropus androgynus (L) Merr)
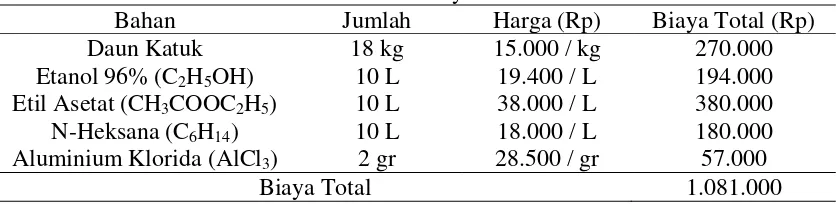
Sauropus androgynus (L) Merr yang disebut juga daun manis atau katuk adalah jenis semak yang termasuk ke dalam famili Euphorbiaceae, yang tumbuh di daerah tropis yang hangat dan lembab dan biasa digunakan sebagai sayuran. Tanaman ini dilaporkan memiliki batang tegak mencapai tinggi 2,5 cm. Sauropus androgynus (L) Merr dikenal di India dari Malaysia pada tahun 1950 karena nutrisinya dan berguna dalam kesehatan. Daun yang lembut dan lezat dari tanaman ini dimanfaatkan dalam dunia kuliner dan terkenal karena nilai gizinya yang tinggi. Oleh karena itu, tanaman ini dikenal sebagai sayuran multi mineral. Daun yang mentah memiliki rasa yang enak dan merupakan salah satu sayuran hijau yang penting. Daun Sauropus androgynus (L) Merr memiliki nilai gizi yang lebih unggul dibandingkan sayuran hijau yang biasa dikonsumsi lainnya. Sayuran ini biasanya diperbanyak dengan cara vegetatif namun tingkat perbanyakannya cukup rendah [9].
Batang tanaman katuk memiliki alur-alur dengan kulit yang agak licin berwarna hijau dan jumlah daun percabang berkisar antara 11 – 21 helai [6]. Katuk merupakan jenis tanaman tahunan yang setiap saat dapat dipetik, tidak tergantung pada musim dan dapat dipanen lebih dari sepuluh kali selama bertahun-tahun. Tanaman ini mudah ditanam, tahan gulma dan menghasilkan daun yang banyak dalam waktu yang relatif singkat [5].
6
Menurut [11], sistem taksonomi tanaman katuk adalah sebagai berikut : Divisi : Spermatophyta
Sub divisi : Angiospermae Kelas : Dicotiledoneae
Sub kelas : Monochlamydeae (Apetalae) Bangsa : Euphorbiales
Suku : Euphorbiaceae Marga : Sauropus
Jenis : Sauropus androgynus (L) Merr.
Gambar 2.1 Tanaman Katuk (Sauropus androgynus (L) Merr) [10]
7
Di dalam daun katuk banyak terdapat minyak atsiri, sterol, saponin, flavonoid, triterpin, asam-asam organik, asam-asam amino, alkaloid dan tanin. Selain itu daun katuk juga mengandung protein, kalsium, fosfor, besi, vitamin A, B, C dan senyawa steroid serta polifenol [6]. Hasil penelitian Kelompok Kerja Nasional Tumbuhan Obat Indonesia menunjukkan bahwa tanaman katuk mengandung beberapa senyawa kimia, antara lain alkaloid papaverin, protein, lemak, vitamin, mineral, saponin, flavonoid dan tanin [12].
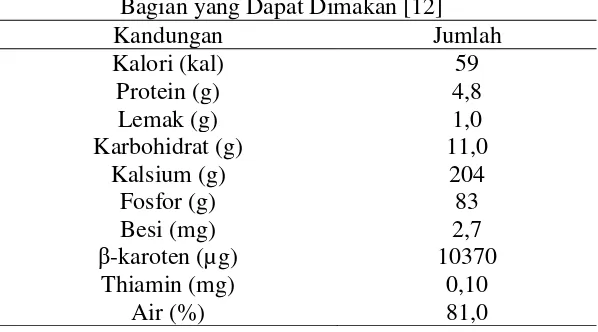
Tanaman katuk banyak dimanfaatkan sebagai sayuran atau lalapan dan dipercaya masyarakat mampu melancarkan air susu ibu (ASI) dan mempercepat pemulihan tenaga bagi orang sakit. Tanaman katuk juga bermanfaat sebagai tanaman obat keluarga (TOGA), bahan makanan dan sebagai tanaman hias. Rebusan daun katuk memberikan rasa yang agak asam dan manis, air perasan daun katuk digunakan juga untuk memberi warna pada makanan, disamping itu air rebusan daun dan akarnya digunakan sebagai obat demam, diuretika dan meningkatkan ASI [6]. Tabel 2.1 berikut menunjukkan komposisi kimia dari daun katuk.
Tabel 2.1 Komposisi Kimia Daun Katuk per 100 Gram Bagian yang Dapat Dimakan [12]
Kandungan Jumlah
Kalori (kal) 59
Protein (g) 4,8
Lemak (g) 1,0
Karbohidrat (g) Kalsium (g)
Fosfor (g) Besi (mg) β-karoten (µg)
Thiamin (mg)
Air (%)
11,0 204 83 2,7 10370
0,10 81,0
2.2 ANTIOKSIDAN
2.2.1 Pengertian Antioksidan
8
Antioksidan adalah senyawa kimia yang dapat menyumbangkan satu atau lebih elektron kepada radikal bebas, sehingga reaksi radikal bebas tersebut dapat terhambat. Antioksidan merupakan senyawa pemberi elektron (electron donor) atau reduktan. Senyawa ini memiliki berat molekul yang kecil, tetapi mampu menginaktivasi berkembangnya reaksi oksidasi dengan cara mencegah terbentuknya radikal. Antioksidan juga merupakan senyawa yang dapat menghambat reaksi oksidasi dengan mengikat radikal bebas dan molekul yang sangat reaktif [14].
Antioksidan adalah molekul yang mampu menghambat reaksi oksidasi pada molekul lain. Antioksidan berfungsi untuk mencegah kerusakan oksidatif yang disebabkan oleh radikal bebas, dapat mengganggu proses oksidasi dengan bereaksi dengan radikal bebas dan juga bertindak sebagai penangkap oksigen reaktif. Radikal bebas mempengaruhi sel-sel hidup yang dapat menyebabkan banyak penyakit kronis pada manusia seperti aterosklerosis, parkinson, arthritis, penyakit alzheimer, stroke, penyakit radang kronis, kanker, dan penyakit degeneratif lainnya [15].
2.2.2 Sumber Antioksidan
Antioksidan adalah zat yang jika dimasukkan ke dalam substrat pada konsentrasi rendah maka secara signifikan dapat menghambat oksidasi substrat tersebut. Antioksidan terdiri dari dua jenis yaitu antioksidan alami dan antioksidan sintetik [16].
1. Antioksidan Sintetik
Antioksidan sintetik ditambahkan ke dalam bahan pangan untuk mencegah terjadinya ketengikan. Penambahan antioksidan ini harus memenuhi beberapa persyaratan, misalnya tidak berbahaya bagi kesehatan, tidak menimbulkan warna yang tidak diinginkan, efektif pada konsentrasi rendah, larut dalam lemak, mudah diperoleh dan ekonomis. Beberapa contoh antioksidan sintetik yang diijinkan untuk makanan, ada lima antioksidan yang penggunaannya meluas dan menyebar di seluruh dunia, yaitu butil hidroksi anisol (BHA), butil hidroksi toluene (BHT), propil galat (PG), tert-butil hidroksi quinon (TBHQ) dan tokoferol [14].
9
BHA bersifat sangat larut dalam lemak dan tidak larut dalam air, berbentuk padat putih, dan dijual dalam bentuk tablet atau serpih.
2. BHT memiliki sifat serupa dengan BHA sehingga antioksidan ini dapat memberikan efek sinergis bila dimanfaatkan bersama dengan BHA, berbentuk kristal putih, dan digunakan secara luas karena harganya yang relatif murah.
3. TBHQ merupakan antioksidan paling efektif unuk lemak dan minyak khususnya minyak tanaman karena memiliki kemampuan antioksidan yang baik pada penggorengan dan kurang baik pada pembakaran. TBHQ yang dikombinasikan dengan BHA akan memiliki kemampuan antioksidan yang baik pada pemanggangan.
4. PG merupakan kristal putih yang mempunyai karakteristik sensitif terhadap panas dan terdekomposisi pada titik cair 148 oC, dapat membentuk kompleks warna dengan ion metal sehingga kemampuan antioksidannya rendah. Antioksidan ini memberikan efek sinergis dengan BHA dan BHT [17].
Saat ini, penggunaan antioksidan sintetik mulai dibatasi karena ternyata dari hasil penelitian yang telah dilakukan, antioksidan sintetik seperti BHT ternyata dapat meracuni binatang percobaan dan bersifat karsinogenik [12]. Selain itu, hasil uji yang telah dilakukan terhadap penggunaan BHT diperoleh bahwa BHT dapat menyebabkan pembengkakan organ hati dan mempengaruhi aktifitas enzim di dalam hati dan penggunaan BHA pada level tinggi diketahui mempunyai sifat toksik pada binatang percobaan [1].
2. Antioksidan Alami
Telah lama dikenal bahwa zat yang ada secara alami pada tumbuhan memiliki aktivitas antioksidan. Saat ini, kepentingan antioksidan alami telah jauh meningkat untuk digunakan dalam produk makanan, kosmetik dan farmasi untuk mengganti antioksidan sintetik yang dibatasi karena sifat karsinogeniknya. Antioksidan yang ada dalam minyak merupakan hal penting dalam stabilisasi asam lemak bebas. Dalam konteks ini, banyak tanaman sedang dievaluasi untuk aktivitas antioksidannya karena mereka dibutuhkan dalam penggunaan yang luas seperti dalam industri makanan dan minuman [18].
10
terbentuk dari reaksi-reaksi selama pengolahan dan senyawa antioksidan yang diisolasi dari sumber alami dan ditambahkan ke makanan sebagai bahan tambahan pangan. Kebanyakan senyawa antioksidan yang diisolasi dari sumber alami adalah berasal dari tumbuhan. Isolasi antioksidan alami telah dilakukan dari tumbuhan yang dapat dimakan, tetapi tidak selalu dari bagian yang dapat dimakan. Antioksidan alami tersebar di beberapa bagian tanaman seperti pada kayu, kulit kayu, akar, daun, buah, bunga, biji dan serbuk sari. Senyawa antioksidan alami tumbuhan umumnya adalah senyawa fenolik atau polifenolik yang dapat berupa golongan flavonoid, turunan asam sinamat, kumarin, tokoferol, dan asam-asam organik polifungsional [17].
Antioksidan bahan tanaman sangat tergantung pada sifat pelarut yang digunakan untuk ekstraksi zat aktif dan bagian tanaman yang digunakan. Selama ekstraksi bahan tanaman, pemilihan pelarut dan bagian tanaman adalah hal yang sangat penting untuk meminimalkan gangguan dari senyawa yang mungkin dapat mengganggu ekstrak dengan bahan kimia dan menghindari kontaminasi ekstrak. Pelarut seperti metanol, etanol, aseton, kloroform dan etil asetat telah banyak digunakan untuk ekstraksi senyawa antioksidan dari berbagai tanaman dan makanan berbasis tanaman dan obat-obatan [15].
2.2.3 Mekanisme Kerja Antioksidan
Mekanisme kerja antioksidan secara umun adalah dengan menghambat oksidasi lemak. Mekanisme kerja antioksidan pada umumnya dapat dipahami setelah mekanisme proses oksidasi lemak dalam bahan makanan atau pada sistem biologis dipahami dengan baik. Oksidasi lemak terdiri dari 3 tahapan utama, yaitu inisiasi, propagasi dan terminasi. Pada tahap inisiasi terjadi pembentukan radikal asam lemak, yaitu suatu senyawa turunan asam lemak yang bersifat tidak stabil dan sangat reaktif akibat dari hilangnya satu atom hidrogen. Pada tahap selanjutnya, yaitu propagasi, radikal asam lemak akan bereaksi dengan oksigen membentuk radikal peroksi. Radikal peroksi lebih lanjut akan menyerang asam lemak menghasilkan
11
Mekanisme antioksidan dalam menghambat oksidasi atau menghentikan reaksi berantai pada radikal bebas dari lemak yang teroksidasi, dapat disebabkan oleh 4 mekanisme reaksi yaitu :
1. pelepasan hidrogen dari antioksidan. 2. pelepasan elektron dari antioksidan.
3. adisi lemak ke dalam cincin aromatik pada antioksidan.
4. pembentukan senyawa kompleks antara lemak dan cincin aromatik dari antioksidan.
Antioksidan dapat dikelompokkan menjadi tiga kelompok berdasarkan mekanisme reaksinya, yaitu antioksidan primer, sekunder dan tersier.
Antioksidan primer disebut juga antioksidan endogenous atau enzimatis. Suatu senyawa dikatakan sebagai antioksidan primer apabila dapat memberikan atom hidrogen secara cepat kepada radikal, kemudian radikal antioksidan yang terbentuk segera menjadi senyawa yang lebih stabil. Antioksidan primer meliputi enzim superoksida dismutase (SOD), katalase dan glutation peroksidase. Enzim tersebut menghambat pembentukan radikal bebas dengan cara memutus reaksi berantai (polimerisasi), kemudian mengubahnya menjadi produk yang lebih stabil.
Antioksidan sekunder disebut juga sebagai antioksidan eksogeneus atau non-enzimatis. Antioksidan kelompok ini juga disebut sistem pertahanan preventif, yaitu terbentuknya senyawa oksigen reaktif dihambat dengan cara pengkelatan metal atau dirusak pembentukannya. Kerja antioksidan sekunder yaitu dengan cara memotong reaksi berantai dari radikal bebas atau dengan cara menangkapnya. Antioksidan
sekunder meliputi vitamin E, vitamin C, β-karoten, flavonoid, asam urat, bilirubin
dan albumin.
12
Dalam penelitian ini, antioksidan yang paling berperan dalam mencegah radikal bebas adalah flavonoid.
2.2.4 Flavonoid
Daun katuk dapat bekerja sebagai antioksidan yang ditunjukkan oleh adanya senyawa golongan fenol yaitu flavonoid. Flavonoid merupakan salah satu senyawa golongan fenol alam yang terbesar. Telah diketahui bahwa aktifitas antioksidan dari tumbuhan karena adanya senyawa fenol. Flavonoid adalah golongan senyawa polifenol yang diketahui memiliki sifat sebagai penangkap radikal bebas, penghambat enzim hidrolisis dan oksidatif, dan bekerja sebagai antiinflamasi. Jadi dapat disimpulkan bahwa flavonoid dapat bekerja sebagai antioksidan [19].
Flavonoid merupakan kelompok besar fitokimia yang bersifat melindungi dan banyak terdapat pada buah dan sayuran. Flavonoid sering dikenal sebagai bioflavonoid yang berperan sebagai antioksidan. Flavonoid terdapat beberapa jenis dan masing-masing berperan dalam menjaga kesehatan. Flavonoid adalah bagian dari senyawa fenolik yang terdapat pada pigmen tumbuh-tumbuhan. Kesehatan manusia sangat tergantung pada flavonoid sebagai antioksidan untuk mencegah kanker. Manfaat utama flavonoid adalah untuk melindungi struktur sel, membantu memaksimalkan manfaat vitamin C, mencegah keropos tulang, sebagai antibiotik dan anti-inflamasi [14].
2.3 EKSTRAKSI
Secara sederhana ekstraksi merupakan istilah yang digunakan untuk setiap proses dimana komponen-komponen pembentuk suatu bahan berpindah dari bahan ke cairan (pelarut). Metode sederhana ekstraksi adalah dengan mencampurkan seluruh bahan dengan pelarut, lalu memisahkan larutan dengan padatan tidak terlarut [20].
13
beberapa faktor, antara lain tujuan ekstraksi, skala ekstraksi, sifat komponen-komponen yang akan diekstrak dan sifat-sifat pelarut yang digunakan. Ekstraksi dapat dilakukan dengan berbagai metode, misalnya ekstraksi dengan pelarut,
supercritical fluid extraction (SFE), pengepresan dan sublimasi. Metode yang banyak digunakan adalah distilasi dan ekstraksi menggunakan pelarut [14].
Proses isolasi atau pemisahan komponen bioaktif yang terkandung dalam tumbuhan dapat dilakukan dengan metode ekstraksi dengan pelarut. Metode yang digunakan untuk melarutkan komponen yang dapat larut dari zat padat yang tidak dapat larut dengan menggunakan pelarut tertentu disebut dengan leaching atau ekstraksi padat-cair. Ekstraksi dengan pelarut dilakukan dengan melarutkan bahan ke dalam suatu pelarut organik sehingga komponen pembentuk bahan akan terlarut ke dalam pelarut.
Beberapa faktor yang mempengaruhi ekstraksi adalah perlakuan pendahuluan terhadap bahan yang meliputi pengecilan ukuran bahan dan pengeringan bahan, pemilihan jenis pelarut, perbandingan volume pelarut dan bahan serta pengaturan kondisi ekstraksi seperti lama ekatraksi dan suhu ekstraksi [21].
2.4 MINYAK KELAPA
Selama ribuan tahun minyak kelapa digunakan sebagai minyak pangan oleh masyarakat di daerah tropis. Minyak kelapa digunakan sebagai minyak goreng, bahan margarin dan mentega putih, komponen dalam pembuatan sabun serta formulasi kosmetika. Selain digunakan untuk menggoreng, pada masyarakat pedesaan minyak kelapa juga digunakan sebagai minyak pijat, kerik, dan untuk minyak cem-ceman. Dalam bidang farmasi, minyak kelapa dewasa ini mulai meningkat penggunaannya, terutama dengan semakin banyaknya produk minyak telon yang salah satu komponennya adalah minyak kelapa, juga dengan diketahuinya beberapa khasiat minyak kelapa terhadap kesehatan [22].
14
daging buah kelapa dan minyak kelapa sebagai minyak makan, ternyata kasus penyakit jantungnya sangat rendah [23].
[image:33.595.117.520.331.516.2]Minyak kelapa merupakan bagian yang paling berharga dari buah kelapa dan banyak digunakan sebagai bahan baku industri atau sebagai minyak goreng. Minyak kelapa dihasilkan dari daging buah kelapa atau daging buah kelapa yang dikeringkan (kopra). Kandungan minyak pada kopra umumnya 60 – 65%, sedangkan daging buah kelapa sekitar 43%. Berdasarkan kandungan asam lemaknya, asam lemak jenuh minyak kelapa kurang lebih 90% (dalam bentuk trigliserida) sebagian besar (sekitar 70%) adalah minyak dengan rantai lebih rendah yang dikenal sebagai alam lemak rantai menengah [24]. Tabel 2.2 berikut memperlihatkan komposisi asam lemak minyak kelapa.
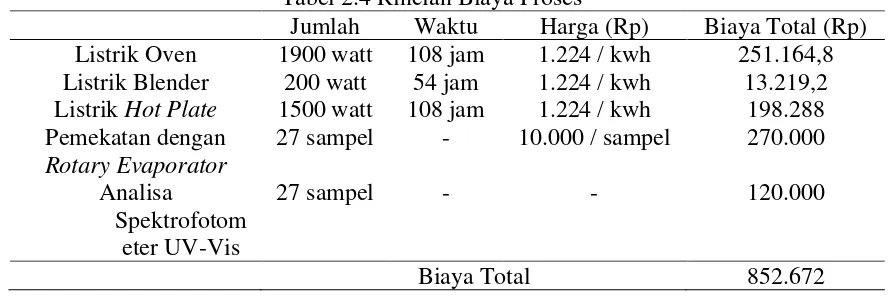
Tabel 2.2 Komposisi Asam Lemak Minyak Kelapa [2]
Asam Lemak Rumus Kimia Jumlah (%)
Asam lemak jenuh : Asam Kaproat Asam Kaprilat Asam Kaprat Asam Laurat Asam Palmitat Asam Stearat Asam Arachidat Asam lemak tak jenuh :
Asam Palmitoleat Asam Oleat Asam Linoleat
C5H11COOH C7H17COOH C9H19COOH C11H23COOH C13H27COOH C17H35COOH C19H39COOH C15H29COOH C17H33COOH C17H31COOH
0 – 0,8 5,5 – 9,5 4,5 – 9,5 44 – 52 7,5 – 10,5
1 – 3 0 – 0,4 0 – 1,3 5 – 8 1,5 – 2,5
Degradasi minyak dapat disebabkan oleh proses oksidasi, hidrolisis, polimerisasi dan pirolisis. Reaksi oksidatif dapat dipengaruhi oleh beberapa faktor seperti cahaya, panas, ionisasi dan logam, reaksi oksigen dengan lipid tak jenuh, reaksi kimia, dan mekanisme enzimatik seperti autoksidasi, foto oksidasi dan lipoksigenasi [25].
15
membahayakan kesehatan manusia, sehingga perlu dilakukan upaya untuk mengatasinya [1].
Bentuk minyak kelapa yang beredar di pasar ada tiga jenis yaitu RBD-Coconut Oil (minyak kelapa RBD), Traditional Coconut Oil (minyak kelapa tradisional) dan Virgin Coconut Oil (minyak kelapa murni). Minyak kelapa RBD merupakan minyak yang diproses dengan penambahan bahan kimia dalam pemurnian minyak (refined), pemutihan minyak (bleaching) dan penghilangan bau yang tidak sedap (deodorized). Traditional Coconut Oil (minyak kelapa tradisional) adalah minyak kelapa yang diolah secara tradisional yang mulai dari penghancuran buah kelapa segar hingga pemanasan yang menghasilkan minyak dan ampas atau blondo [1].
2.5 KETENGIKAN
Tipe penyebab ketengikan dalam lemak dibagi atas tiga golongan yaitu ketengikan oleh oksidasi (oxidative rancidity), ketengikan oleh enzim (enzymatic rancidity), dan ketengikan oleh proses hidrolisa (hidrolitic rancidity). Berbagai jenis minyak atau lemak akan mengalami perubahan flavour dan bau sebelum terjadi proses ketengikan. Minyak yang telah menjadi tengik akan menghasilkan flavour
yang sama untuk semua jenis minyak atau lemak. Bilangan peroksida yang sangat tinggi dapat menjadi indikasi ketengikan minyak atau lemak [26].
1. Ketengikan oleh oksidasi (oxidative rancidity)
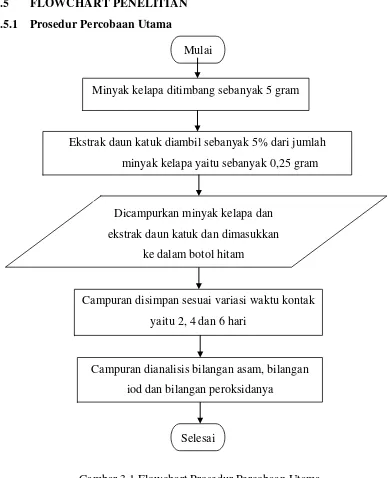
Kerusakan lemak yang utama adalah timbulnya bau dan rasa tengik yang disebut proses ketengikan. Hal ini disebabkan oleh otooksidasi radikal asam lemak tidak jenuh dalam lemak. Autooksidasi dimulai dengan pembentukan radikal-radikal bebas yang disebabkan oleh faktor-faktor yang dapat mempercepat reaksi seperti cahaya, panas, peroksida lemak atau hidroperoksida, logam-logam berat seperti Cu, Fe, Co, dan Mn, logam porfirin seperti hematin, hemoglobin, mioglobin, klorofil, dan enzim-enzim lipoksidase [26].
16
[image:35.595.118.516.202.581.2]akibat dari hilangnya satu atom hidrogen. Pada tahap selanjutnya, yaitu propagasi, radikal asam lemak akan bereaksi dengan oksigen membentuk radikal peroksi. Pada tahap terminasi, radikal peroksi lebih lanjut akan menyerang asam lemak menghasilkan hidroperoksidadan radikal asam lemak baru [1]. Reaksi oksidasi asam lemak dapat dilihat pada gambar 2.2 berikut.
Gambar 2.2 Reaksi Oksidasi Asam Lemak [1]
2. Ketengikan oleh enzim (enzymatic rancidity)
Bahan pangan berlemak dengan kadar air dan kelembaban udara tertentu, merupakan medium yang baik bagi pertumbuhan jamur. Jamur tersebut mengeluarkan enzim, misalnya enzim lipo clastic yang dapat menguraikan trigliserida menjadi asam lemak bebas dan gliserol. Enzim peroksida dapat mengoksidasi asam lemak tidak jenuh sehingga terbentuk peroksida. Disamping itu
energi panas + sinar
asam lemak tak jenuh
radikal
hidrogen yang labil + O2
peroksida akif
17
enzim peroksida dapat mengoksidasi asam lemak jenuh pada ikatan karbon atom β, sehingga membentuk asam keton dan akhirnya metil keton [26].
3. Ketengikan oleh proses hidrolisa (hidrolitic rancidity)
Dalam reaksi hidrolisa, minyak atau lemak akan diubah menjadi bermacam-macam asam lemak bebas dan gliserol. Reaksi hidrolisa yang dapat mengakibatkan kerusakan minyak atau lemak ini terjadi karena adanya kandungan air dalam minyak atau lemak, yang pada akhirnya menyebabkan ketengikan dengan perubahan rasa dan bau pada minyak tersebut.
Proses ketengikan sangat dipengaruhi oleh adanya prooksidan dan antioksidan. Prooksidan akan mempercepat terjadinya oksidasi, sedangkan antioksidan akan menghambatnya. Adanya antioksidan dalam lemak akan mengurangi kecepatan proses oksidasi. Antioksidan terdapat secara alamiah dalam minyak atau bahan pangan berlemak, atau kadang-kadang sengaja ditambahkan [26].
2.6 ANALISIS EKONOMI
Pada penelitian ini dilakukan suatu analisis ekonomi yang sederhana, sehingga dapat diketahui biaya operasional pembuatan ekstrak flavonoid sebagai antioksidan pada minyak kelapa dengan bahan baku daun katuk. Proses pembuatannya menggunakan proses ekstraksi. Berikut rincian biaya yang digunakan dengan menggunakan proses tersebut :
1. Biaya Bahan Baku
[image:36.595.109.529.655.757.2]Adapun bahan yang digunakan untuk pembuatan ekstrak flavonoid sebagai antioksidan pada minyak kelapa dengan bahan baku daun katuk antara lain, daun katuk, etanol 96% (C2H5OH), etil asetat (CH3COOC2H5), N-heksana (C6H14) dan aluminium klorida (AlCl3). Pada tabel 2.3 akan ditampilkan rincian biaya bahan baku.
Tabel 2.3 Rincian Biaya Bahan Baku
Bahan Jumlah Harga (Rp) Biaya Total (Rp)
Daun Katuk 18 kg 15.000 / kg 270.000
Etanol 96% (C2H5OH) 10 L 19.400 / L 194.000 Etil Asetat (CH3COOC2H5) 10 L 38.000 / L 380.000 N-Heksana (C6H14) 10 L 18.000 / L 180.000 Aluminium Klorida (AlCl3) 2 gr 28.500 / gr 57.000
18 2. Biaya Proses
[image:37.595.103.551.197.346.2]Proses pembuatan ekstrak flavonoid sebagai antioksidan pada minyak kelapa dengan bahan baku daun katuk terdiri dari proses ekstraksi. Pada tabel 2.4 akan ditampilkan rincian biaya proses.
Tabel 2.4 Rincian Biaya Proses
Jumlah Waktu Harga (Rp) Biaya Total (Rp) Listrik Oven 1900 watt 108 jam 1.224 / kwh 251.164,8 Listrik Blender 200 watt 54 jam 1.224 / kwh 13.219,2 Listrik Hot Plate 1500 watt 108 jam 1.224 / kwh 198.288 Pemekatan dengan
Rotary Evaporator
27 sampel - 10.000 / sampel 270.000 Analisa
Spektrofotom eter UV-Vis
27 sampel - - 120.000
Biaya Total 852.672
3. Total Biaya Operasional
Total biaya operasional merupakan biaya bahan baku ditambah dengan biaya proses pada pembuatan ekstrak flavonoid sebagai antioksidan pada minyak kelapa dengan bahan baku daun katuk.
Total biaya operasional = biaya bahan baku + biaya proses = Rp 1.081.000 + Rp 852.672
= Rp 1.933.672
Jadi total biaya yang diperlukan untuk operasional pembuatan ekstrak flavonoid sebagai antioksidan pada minyak kelapa dengan bahan baku daun katuk sebanyak 18 kg adalah Rp 1.933.672.
4. Total Penjualan
19 Total penjualan = total ekstrak x harga
= 0,33 kg x Rp 25.000 = Rp 8.250
Jika dibandingkan dengan total biaya operasional maka diperoleh : Keuntungan/kerugian = Total penjualan – Total biaya operasional = Rp 8.250 – Rp 1.933.672
20
BAB III
METODOLOGI PENELITIAN
3.1 LOKASI PENELITIAN
Penelitian ini dilakukan di Laboratorium Proses Industri Kimia, Jurusan Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara.
3.2 BAHAN DAN PERALATAN 3.2.1 Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah : 1. Ekstrak daun katuk
2. Minyak kelapa 3. Etanol (C2H5OH)
4. Kalium hidroksida (KOH) 5. Asam asetat glasial (CH3COOH) 6. Kloroform (CHCl3)
7. Kalium iodida (KI) 8. Aquadest (H2O)
9. Natrium tiosulfat (Na2S2O3) 10. Indikator amilum (C6H10O5)n
3.2.2 Peralatan
3.2.2.1 Peralatan Penelitian 1. Cutter
2. Timbangan 3. Blender
4. Ayakan mesh 5. Timbangan elektrik 6. Labu leher tiga 7. Beaker glass
21 9. Pipet tetes
10. Corong gelas 11. Batang pengaduk 12. Termometer 13. Magnetic stirrer
14. Penangas air 15. Refluks kondensor 16. Statif dan klem 17. Hot plate
18. Kertas saring 19. Gabus 20. Oven
3.2.2.2Peralatan Analisis 1. Erlenmeyer
2. Corong gelas 3. Gelas ukur 4. Pipet tetes 5. Buret
6. Statif dan klem
3.3 RANCANGAN PENELITIAN
[image:40.595.163.447.561.745.2]Rancangan dalam penelitian ini dapat dilihat pada tabel 3.1. Tabel 3.1 Rancangan Penelitian
adar Flavonoid Total (%) Waktu Kontak (Hari) 0
2 4 6 6,668
2 4 6 7,748
2 4 6 27,909
22 3.4 PROSEDUR PENELITIAN 3.4.1 Prosedur Percobaaan Utama
1. Minyak kelapa ditimbang sebanyak 5 gram.
2. Ekstrak daun katuk diambil sebanyak 5% dari jumlah minyak kelapa yaitu sebanyak 0,25 gram.
3. Dicampurkan minyak kelapa dan ekstrak daun katuk dan dimasukkan ke dalam botol hitam.
4. Campuran disimpan sesuai variasi waktu kontak yaitu 2, 4 dan 6 hari.
5. Campuran dianalisis bilangan asam, bilangan iod dan bilangan peroksidanya.
3.4.2 Prosedur Analisis
3.4.2.1 Prosedur Penentuan Bilangan Asam [27]
1. Campuran diambil dan dimasukkan ke dalam erlenmeyer.
2. Campuran ditambahkan 50 ml alkohol netral 95% kemudian dipanaskan selama 10 menit dalam penangas air sambil diaduk
3. Larutan ditambahkan indikator phenolpthalein.
4. Larutan dititrasi dengan KOH 0,1 N.
5. Titrasi blanko dilakukan tanpa menggunakan sampel.
W 56,1 x N A x Asam
Bilangan =
Dimana : A = volume KOH yang terpakai untuk titrasi sampel (ml) N = normalitas KOH (N)
W = massa sampel (gram)
3.4.2.2 Prosedur Penentuan Bilangan Iod [28]
1. Campuran diambil dan dimasukkan ke dalam erlenmeyer.
Campuran dilarutkan dalam 10 ml CCl4 dengan penambahan 25 ml pereaksi hanus.
2. Erlenmeyer ditutup dan dibiarkan ditempat gelap selama 1 jam sambil dikocok beberapa kali.
23
5. Larutan dititrasi dengan larutan Na2S2O3 0,1 N sampai larutan tersebut berwarna kuning pucat.
6. Larutan ditambahkan beberapa tetes indikator amilum 1%. 7. Larutan dititrasi hingga warna biru tepat hilang.
8. Titrasi blanko dilakukan tanpa mengggunakan sampel.
W 12,69 x N x B) -(A Iod Bilangan =
Dimana : A = volume larutan Na2S2O3 yang terpakai untuk blanko (ml) B = volume larutan Na2S2O3 yang terpakai untuk sampel (ml) N = normalitas larutan Na2S2O3
W = massa sampel (gram)
3.4.2.3 Prosedur Penentuan Bilangan Peroksida [27]
1. Campuran diambil dan dimasukkan ke dalam erlenmeyer.
2. Campuran ditambahkan 30 ml campuran asam asetat glasial dan kloroform dengan perbandingan 3:2.
3. Larutan KI jenuh sebanyak 0,5 ml ditambahkan ke dalam erlenmeyer lalu diaduk rata kemudian didiamkan selama 2 menit hingga larutan berwarna kuning.
4. Setelah 2 menit, aquadest sebanyak 30 ml ditambahakan ke dalam larutan. 5. Larutan dititrasi dengan menggunakan larutan natrium tiosulfat (Na2S2O3)
0,01 N hingga warna kuning hampir hilang (kuning muda).
6. Indikator amilum 1% sebanyak 0,5 ml ditambahkan sehingga larutan berubah menjadi warna biru gelap.
7. Larutan dititrasi menggunakan larutan natrium tiosulfat (Na2S2O3) 0,01 N sampai warna biru gelap tepat hilang.
8. Titrasi blanko dilakukan tanpa mengggunakan sampel. 100 x W 8 x N x B) -(A peroksida
Bilangan =
24 3.5 FLOWCHART PENELITIAN 3.5.1 Prosedur Percobaan Utama
Gambar 3.1 Flowchart Prosedur Percobaan Utama Mulai
Minyak kelapa ditimbang sebanyak 5 gram
Selesai
Campuran disimpan sesuai variasi waktu kontak yaitu 2, 4 dan 6 hari
Dicampurkan minyak kelapa dan ekstrak daun katuk dan dimasukkan
ke dalam botol hitam
Campuran dianalisis bilangan asam, bilangan iod dan bilangan peroksidanya
25 3.5.2 Prosedur Analisis
[image:44.595.130.509.95.716.2]3.5.2.1 Prosedur Penentuan Bilangan Asam
Gambar 3.2 Flowchart Prosedur Penentuan Bilangan Asam Mulai
Apakah larutan telah berwarna merah muda ?
Tidak
Selesai Ya Titrasi blanko dilakukan tanpa
menggunakan sampel
Campuran ditambahkan 50 ml alkohol netral 95% lalu dipanaskan selama 10
menit dalam penangas air sambil diaduk
Larutan ditambahkan indikator
phenolpthalein
Larutan dititrasi dengan KOH 0,1 N
Bilangan asam dihitung Campuran diambil dan dimasukkan
26 3.5.2.2 Prosedur Penentuan Bilangan Iod
Gambar 3.3 Flowchart Prosedur Penentuan Bilangan Iod Apakah larutan telah
berwarna kuning pucat?
Erlenmeyer ditutup dan dibiarkan di tempat gelap selama 1 jam sambil dikocok
Campuran dilarutkan dalam 10 ml CCl4 dan ditambah 25 ml pereaksi
hanus
Ya
Tidak Mulai
Campuran diambil dan dimasukkan ke dalam erlenmeyer
Larutan ditambahkan 10 ml KI 15% sambil terus dikocok
Larutan ditambahkan 100 ml aquadest yang telah dididihkan
Larutan dititrasi dengan larutan Na2S2O3
Larutan ditambahkan beberapa tetes indikator amilum 1%
27
Gambar 3.3 Flowchart Prosedur Penentuan Bilangan Iod (lanjutan) Selesai
A
Larutan dititrasi dengan larutan Na2S2O3 0,1 N
Apakah warna biru pada larutan telah
hilang?
Tidak
Ya Titrasi blanko dilakukan tanpa
menggunakan sampel
28 3.5.2.3 Prosedur Penentuan Bilangan Peroksida
Gambar 3.4 Flowchart Prosedur Penentuan Bilangan Peroksida Campuran diambil dan dimasukkan
ke dalam erlenmeyer Mulai
Ditambahkan 0,5 ml larutan KI jenuh ke dalam erlenmeyer lalu diaduk rata kemudian didiamkan selama 2 menit
hingga larutan berwarna kuning
Setelah 2 menit, aquadest sebanyak 30 ml ditambahkan ke dalam larutan
A
Tidak
Ya Campuran ditambahkan 30 ml campuran asam asetat glasial dan kloroform dengan perbandingan 3:2
Dititrasi larutan dengan menggunakan larutan Na2S2O3 0,01 N
29
Gambar 3.4 Flowchart Prosedur Penentuan Bilangan Peroksida (lanjutan) A
Selesai
Titrasi dilanjutkan menggunakan larutan Na2S2O3 0,01 N
Apakah warna biru gelap pada larutan
Tidak
Titrasi blanko dilakukan tanpa menggunakan sampel
30
BAB IV
HASIL DAN PEMBAHASAN
Penelitian kandungan flavonoid pada ekstrak daun katuk (Sauropus androgynus (L) Merr sebagai antioksidan pada minyak kelapa ini dilakukan dengan cara mengekstraksi daun katuk lalu mencampurkannya pada minyak kelapa. Variasi yang digunakan dalam penelitian ini adalah kadar flavonoid total dari ekstrak daun katuk dan waktu kontak flavonoid pada minyak kelapa.
Bahan baku utama yang digunakan dalam penelitian ini yaitu daun katuk (Sauropus androgynus (L) Merr. Kadar flavonoid yang ada pada daun katuk sebesar 143 mg/100 g atau sekitar 32% [29]. Penelitian pendahuluan yang dilakukan adalah ekstraksi daun katuk yang dipengaruhi oleh variabel volume pelarut, jenis pelarut dan waktu ekstraksi. Hasil ekstrak yang diperoleh kemudian dilakukan pengujian salah satunya yaitu pengujian kadar flavonoid total ekstrak. Ekstrak yang memiliki kadar flavonoid total 6,668%, 7,748% dan 27,909% kemudian akan digunakan sebagai bahan baku untuk pengujian keefektifan antioksidan terhadap minyak kelapa. Uji yang digunakan dalam penelitian ini adalah analisisi bilangan asam, bilangan iod dan bilangan peroksida. Perubahan yang terjadi dari setiap hasil analisis akan menunjukkan bahwa kandungan flavonoid dari ekstrak daun katuk dapat digunakan sebagai antioksidan pada minyak kelapa.
[image:49.595.114.526.645.732.2]Untuk menunjukkan bahwa kandungan flavonoid dari ekstrak daun katuk memberikan hasil dapat digunakan sebagai antioksidan pada minyak kelapa maka terlebih dahulu dilakukan pengujian terhadap minyak kelapa tanpa penambahan ekstrak daun katuk. Hasil yang diperoleh seperti pada tabel 4.1 berikut.
Tabel 4.1 Hasil Pengujian Minyak Kelapa tanpa Penambahan Ekstrak Daun Katuk
Kadar Flavonoid Total (%) Waktu Kontak (Hari) Bilangan Asam (mg KOH/g) Bilangan Iod (g I2/100 g)
Bilangan Peroksida
(Meq/kg) 0
2 2,030 24,190 24,762
4 2,351 14,514 32,381
31
4.1 PENGARUH KADAR FLAVONOID TOTAL DAN WAKTU KONTAK TERHADAP BILANGAN ASAM, IOD DAN PEROKSIDA PADA MINYAK KELAPA
4.1.1 Pengaruh Kadar Flavonoid Total Dan Waktu Kontak Terhadap Bilangan Asam Pada Minyak Kelapa
[image:50.595.132.508.260.450.2]Pengaruh kadar flavonoid total ekstrak daun katuk dan waktu kontak terhadap perubahan bilangan asam pada minyak kelapa dapat dilihat pada gambar 4.1.
Gambar 4.1 Pengaruh Kadar Flavonoid Total Dan Waktu Kontak Terhadap Bilangan Asam Pada Minyak Kelapa
Gambar 4.1 menunjukkan grafik pengaruh kadar flavonoid total dan waktu kontak terhadap bilangan asam pada minyak kelapa. Pada grafik pengaruh kadar flavonoid dapat dilihat semakin besar kadar flavonoid total yaitu 6,668%, 7,748% dan 27,909% maka bilangan asam minyak kelapa semakin menurun. Penurunan bilangan asam diperkirakan karena adanya keberadaan flavonoid pada ekstrak daun katuk sebagai antioksidan yaitu senyawa yang mampu mempertahankan kestabilan oksidasi untuk mencegah pembentukan peroksida. Sedangkan pada grafik pengaruh waktu kontak dapat dilihat semakin lama waktu kontak yaitu 2, 4 dan 6 hari maka bilangan asam minyak kelapa semakin meningkat.
Tujuan dari analisis bilangan asam adalah untuk mengukur jumlah asam lemak bebas yang terdapat dalam minyak atau lemak [30]. Bilangan asam merupakan
0 6,668
7,748 27,909
0,0 1,0 2,0 3,0 4,0 5,0
2
4
32
sebuah indikator penting kualitas minyak nabati [31]. Bilangan asam dinyatakan sebagai mg KOH yang dibutuhkan untuk menetralkan asam lemak bebas dalam 1 gram minyak. Asam lemak bebas merupakan hasil dari minyak yang terurai yang disebabkan oleh reaksi hidrolisis atau faktor fisik lainnya seperti cahaya dan panas [32]. Asam lemak bebas sebenarnya telah terdapat secara alami dalam minyak nabati tetapi dapat meningkat akibat reaksi hidrolisis yang disebabkan oleh kandungan air, enzim atau kontaminan mikroba [33]. Keberadaan asam lemak bebas biasanya dijadikan indikator awal terjadinya kerusakan minyak. Pembentukan asam lemak bebas akan mempercepat kerusakan oksidatif minyak karena asam lemak bebas mudah teroksidasi dibandingkan dengan bentuk esternya [34]. Selama proses oksidasi, peningkatan bilangan asam dalam minyak juga terjadi, hal ini disebabkan karena terbentuknya asam lemak bebas sebagai produk pecahan oksidasi ikatan rangkap dari asam lemak tidak jenuh [35].
Antioksidan efektif dalam menghambat reaksi oksidasi tetapi tidak berpengaruh terhadap reaksi hidrolisis. Penambahan antioksidan dapat menurunkan kadar asam lemak bebas secara signifikan [36]. Pengaruh penambahan antioksidan dalam menghambat kenaikan bilangan asam berawal dari penghambatan pembentukan peroksida melalui donor atom H sehingga radikal lipid yang terbentuk menjadi lebih stabil. Kadar atau konsentrasi antioksidan yang ditambahkan memiliki pengaruh terhadap kenaikan bilangan asam. Semakin tinggi kadar atau konsentrasi yang ditambahkan maka bilangan asam yang dihasilkan akan semakin menurun [35].
Hasil penelitian yang diperoleh telah sesuai dengan teori dimana semakin besar kadar flavonoid total maka bilangan asam semakin menurun. Bilangan asam terendah yang diperoleh adalah 0,962 mg KOH/g. Walaupun bilangan asam semakin menurun tetapi bilangan asam belum memenuhi standar menurut SNI 01-3741-2013 yaitu maksimal 0,6 mg KOH/g [34].
33
bilangan asam minyak juga semakin tinggi. Selama periode oksidasi, minyak mengalami degradasi yang menyebabkan terbentuknya asam lemak rantai pendek hasil penguraian senyawa peroksida dan asam lemak bebas [32]. Penambahan antioksidan dikatakan efektif jika mampu menahan oksidasi yang ditunjukkan dengan kenaikan bilangan asam yang tidak terlalu tinggi dibandingkan jika tanpa penambahan antioksidan [37].
34
4.1.2 Pengaruh Kadar Flavonoid Total Dan Waktu Kontak Terhadap Bilangan Iod Pada Minyak Kelapa
[image:53.595.125.509.199.389.2]Pengaruh kadar flavonoid total ekstrak daun katuk dan waktu kontak terhadap perubahan bilangan iod pada minyak kelapa dapat dilihat pada gambar 4.2.
Gambar 4.2 Pengaruh Kadar Flavonoid Total Dan Waktu Kontak Terhadap Bilangan Iod Pada Minyak Kelapa
Gambar 4.2 menunjukkan grafik pengaruh kadar flavonoid total dan aktu kontak terhadap bilangan iod pada minyak kelapa. Pada grafik pengaruh kadar flavonoid total dapat dilihat semakin besar kadar flavonoid total yaitu 6,668%, 7,748% dan 27,909% maka bilangan iod minyak kelapa semakin meningkat. Sedangkan pada grafik pengaruh waktu kontak dapat dilihat semakin lama waktu kontak yaitu 2, 4 dan 6 hari maka bilangan iod minyak kelapa semakin menurun.
Bilangan iod adalah ukuran dari jumlah asam lemak tidak jenuh dalam minyak. Ketidakjenuhan asam lemak penyusun minyak akan menyebabkan minyak kurang stabil dan lebih rentan terhadap reaksi oksidasi yang dapat menghasilkan radikal bebas [38]. Asam lemak tidak jenuh mampu mengikat iod dan membentuk senyawa yang jenuh. Banyaknya iod yang diikat menunjukkan banyaknya ikatan rangkap yang terdapat pada minyak. Hal ini menunjukkan bahwa semakin tinggi bilangan iod maka semakin baik kualitas minyak atau lemak [39]. Penurunan bilangan iod berhubungan dengan terbentuknya senyawa peroksida akibat oksidasi dan
0 6,668
7,748 27,909
0 10 20 30 40 50 60 70
2
4
35
polimerisasi oksidasi yang terjadi. Hal ini terjadi karena ikatan rangkap pada asam lemak tidak jenuh semakin berkurang karena teradisi oleh atom oksigen membentuk peroksida. Dengan demikian semakin tinggi bilangan peroksida minyak, maka bilangan iod semakin menurun. Penurunan bilangan iod ini juga disebabkan karena peristiwa polimerisasi asam lemak bebas dan asam lemak yang terikat pada trigliserida dimana ikatan rangkap terbuka untuk dapat bergabung dengan komponen asam lemak yang tidak jenuh lainnya [39].
Penambahan antioksidan dapat menghalangi oksigen berikatan dengan ikatan rangkap asam lemak. Banyaknya antioksidan yang diberikan menyebabkan proses oksidasi berjalan lambat karena oksigen yang berikatan dengan ikatan rangkap semakin sedikit sehingga bilangan iodin semakin tinggi. Semakin tinggi bilangan iodin, maka kualitas minyak semakin baik [26]. Dengan demikian dapat dikatakan bahwa semakin besar kadar antioksidan maka bilangan iod juga semakin meningkat.
Hasil penelitian yang diperoleh telah sesuai dengan teori dimana semakin besar kadar flavonoid total maka bilangan iod semakin meningkat. Bilangan iod tertinggi yang diperoleh adalah 38,705 g I2/100 g. Bilangan iod yang diperoleh telah memenuhi standar menurut AOAC Internasional yaitu minimal 50 g I2/100 g [34].
36
4.1.3 Pengaruh Kadar Flavonoid Total Dan Waktu Kontak Terhadap Bilangan Peroksida Pada Minyak Kelapa
[image:55.595.134.518.195.406.2]Pengaruh kadar flavonoid total ekstrak daun katuk dan waktu kontak terhadap perubahan bilangan peroksida pada minyak kelapa dapat dilihat pada gambar 4.3.
Gambar 4.3 Pengaruh Kadar Flavonoid Total Dan Waktu Kontak Terhadap Bilangan Peroksida Pada Minyak Kelapa
Gambar 4.3 menunjukkan grafik pengaruh kadar flavonoid total dan waktu kontak terhadap bilangan peroksida pada minyak kelapa. Pada grafik pengaruh kadar flavonoid total dapat dilihat yaitu pada waktu kontak 2 dan 4 hari menunjukkan hasil yang sama, semakin besar kadar flavonoid total yaitu 6,668%, 7,748% dan 27,909% maka bilangan peroksida minyak kelapa semakin menurun. Tetapi grafik pada waktu kontak 6 hari terjadi penyimpangan dimana pada kadar flavonoid total 7,748%, bilangan peroksida mengalami kenaikan kemudian mengalami penurunan kembali pada kadar flavonoid total 27,909%. Adanya penyimpangan ini kemungkinan disebabkan kadar flavonoid total 7,748% tidak terlalu jauh perbedaannya dari kadar flavonoid total sebelumnya yaitu 6,668% sehingga tidak mampu menghambat reaksi oksidasi yang terjadi tetapi pada kadar flavonoid total 27,909% terjadi penurunan bilangan peroksida kembali karena kadar flavonoid jauh meningkat lebih besar sehingga flavonoid dapat bertindak sebagai antioksidan yang lebih baik. Sedangkan pada grafik pengaruh waktu kontak dapat dilihat yaitu pada kadar flavonoid total 0%
0 6,668
7,748 27,909
0 5 10 15 20 25 30 35 40 45 50 55
2
4
37
(tanpa penambahan ekstrak), 7,748% dan 27,909% menunjukkan hasil yang sama yaitu dengan semakin lama waktu kontak maka bilangan peroksida minyak kelapa semakin meningkat. Akan tetapi grafik pada kadar 6,668% terjadi penyimpangan yaitu pada waktu kontak 6 hari, bilangan peroksida mengalami penurunan tetapi penurunan yang terjadi tidak begitu besar.
Bilangan peroksida didefinisikan sebagai berat oksigen aktif yang terkandung dalam 1 gram minyak atau lemak. Bilangan peroksida menentukan tingkat oksidasi minyak dan memberikan indikasi tingkat kerusakan minyak atau lemak [31]. Banyaknya peroksida yang ada dalam minyak mencerminkan tingkat oksidasi yang tinggi dan cenderung akan menjadi tengik [37]. Peroksida terbentuk pada tahap inisiasi oksidasi, pada tahap ini hidrogen akan menghasilkan radikal bebas. Radikal bebas yang terbentuk bereaksi dengan oksigen membentuk radikal peroksi, selanjutnya atom hidrogen dari molekul tak jenuh lain menghasilkan peroksida dan radikal bebas yang baru [34]. Penambahan antioksidan mampu menekan peningkatan bilangan peroksida. Antioksidan yang paling efektif merupakan antioksidan yang mampu menahan oksidasi yang ditunjukkan dengan kenaikan bilangan peroksida yang kecil [35]. Antioksidan yang sangat efektif untuk stabilitas lemak dan mencegah reaksi oksidasi yaitu dengan cara penetralan radikal bebas pada saat tahap inisiasi berlangsung. Antioksidan melindungi lemak dari reaksi oksidasi berantai dengan cara menyediakan atom hidrogen pada radikal bebas yang terbentuk, sehingga akan merubah radikal bebas yang tersebut menjadi senyawa yang stabil (non radikal) dan dapat mencegah terbentuknya peroksida [30]. Bilangan peroksida yang rendah adalah indikasi rendahnya tingkat ketengikan akibat oksidasi dan menyatakan bahwa adanya kehadiran antioksidan yang kuat, begitupun sebaliknya [31]. Semakin tinggi konsentrasi atau kadar antioksidan yang diberikan maka nilai bilangan peroksidanya semakin rendah. Konsentrasi atau kadar antioksidan yang kurang maksimal maka mengakibatkan kemampuan menghambat reaksi oksidasi juga semakin kecil [35].
38
Meq/kg. Walaupun bilangan peroksida semakin menurun tetapi bilangan peroksida belum memenuhi standar menurut SNI 01-3741-2013 yaitu maksimal 10 Meq/kg [34].
Bilangan peroksida dapat meningkat dengan bertambahnya waktu penyimpanan (waktu kontak), suhu dan udara [31]. Semakin lama waktu kontak antara ekstrak sebagai antioksidan dengan minyak kelapa maka menyebabkan waktu atau periode oksidasi juga semakin besar. Pada periode oksidasi yang semakin lama, bilangan peroksida minyak semakin bertambah. Kecenderungan peningkatan bilangan peroksida ini menunjukkan bahwa minyak mengalami kerusakan selama periode oksidasi akibat terbentuknya senyawa peroksida dalam minyak [39].
Dapat dikatakan bahwa penggunaan antioksidan menghambat proses oksidasi, sehingga walaupun tetap terjadi oksidasi dengan meningkatnya waktu penyimpanan tetapi banyaknya peroksida yang terbentuk lebih sedikit dibandingkan minyak tanpa penggunaan antioksidan [40].
[image:57.595.119.514.438.536.2]Hasil analisis terbaik pada minyak kelapa yang diperoleh dari percobaan dan syarat mutu (standar) minyak kelapa dapat dilihat pada tabel 4.2 berikut.
Tabel 4.2 Hasil Analisis Percobaan dan Syarat Mutu Pada Minyak Kelapa Analisis Hasil Percobaan Syarat Mutu (Standar) Bilangan Asam 0,962 mg KOH/g 0,6 mg KOH/g
(SNI 01-3741-2013) Bilangan Iod 38,705 g I2/100 g
50 g I2/100 g (AOAC Internasional) Bilangan Peroksida 13,333 Meq/kg 10 Meq/kg
39
BAB V
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
Kesimpulan yang dapat diambil dari penelitian yang telah dilakukan adalah : 1. Ekstrak daun katuk yang memiliki kadar flavonoid total sebesar 6,668%, 7,748%
dan 27,909% dimana semakin besar kadarnya dapat menghasilkan penurunan bilangan asam, peningkatan bilangan iod dan penurunan bilangan peroksida pada minyak kelapa. Hal ini membuktikan bahwa flavonoid ekstrak daun katuk dapat digunakan sebagai antioksidan pada minyak kelapa.
2. Peningkatan waktu kontak flavonoid membuat kualitas antioksidan semakin buruk. Waktu kontak flavonoid yang semakin meningkat yaitu selang waktu 2, 4 dan 6 hari akan meningkatkan bilangan asam, menurunkan bilangan iod dan meningkatkan bilangan peroksida pada minyak kelapa.
3. Ekstrak daun katuk dengan kadar flavonoid total tertinggi yaitu 27,909% memberikan hasil terbaik sebagai antioksidan pada minyak kelapa yaitu dengan hasil bilangan asam terkecil sebesar 0,962 mg KOH/g, bilangan iod terbesar sebesar 38,705 g I2/100 g dan bilangan peroksida terkecil sebesar 13,333 Meq/kg.
5.2 SARAN
Saran yang dapat diberikan adalah :
1. Penelitian berikutnya disarankan untuk mencoba menggunakan variasi jenis minyak seperti minyak bekas pakai.
2. Penelitian berikutnya diharapkan dapat meneliti kandungan bahan baku alami yang lain yang digunakan sebagai antioksidan pada minyak kelapa.
40
DAFTAR PUSTAKA
[1] Osy Yostia Utami. “Komponen Minyak Atsiri Daun Sirih (Piper betle L.) dan Potensinya dalam Mencegah Ketengikan Minyak Kelapa”. Skripsi, Departemen Biokimia Fakultas MIPA IPB, Bogor, 2011.
[2] Elfi Syafrini. “Studi Penggunaan Amida Asam Lemak Campuran Minyak Kelapa sebagai Bahan Pengemulsi Lateks Pekat”. Tesis, Program Magister Ilmu Kimia Fakultas MIPA USU, Medan, 2010.
[3] Ana Andari.“Uji Aktivitas Ekstrak Daun Katuk (Saoropus androgynus L.Merr) sebagai Antioksidan Pada Miyak Kelapa”. Skripsi, Program Studi Kimia Fakultas Sains dan Teknologi UIN Sunan Kalijaga, Yogyakarta, 2010.
[4] Hermiati, Rusli, Naomi Yemima, Mersi Suriani. “Ekstrak Daun Sirih Hijau dan Merah sebagai Antioksidan Pada Minyak Kelapa”. Jurnal Teknik Kimia USU, Article in Press, 2013.
[5] Mahareni Septyana. “Performa Itik Petelur Lokal dengan Pemberian Tepung Daun Katuk (Saoropus androgynus L.Merr) dalam Ransumnya”. Skripsi, Program Studi Ilmu Nutrisi dan Makanan Ternak Fakultas Peternakan IPB, Bogor, 2008. [6] Bernard David Sidauruk. “Produksi Air Susu Induk Babi dengan Penambahan Ekstrak Daun Katuk (Saoropus androgynus L.Merr) dalam Ransum Pada Taraf dan Waktu Pemberian yang Berbeda”. Skripsi, Program Studi Teknologi Produksi Ternak Fakultas Peternakan IPB, Bogor, 2008.
[7] Anie Komayaharti, Dwi Paryanti.“Ekstrak Daun Sirih sebagai Antioksidan Pada Minyak Kelapa”. Jurusan Teknik Kimia Fakultas Teknik UNDIP, Semarang, 2009. [8] Nana Dyah Siswati, Juni SU, Junaidi. “Pemanfaatan Antioksidan Alami Flavonol untuk Mencegah Proses Ketengikan Minyak Kelapa”. Jurusan Teknik Kimia FTI UPN, Surabaya, 2008.
[9] P Eganathan, Ajay Parida. “Micropropagation of Sauropus androgynus (L.) Merr An Important Green Leafy Vegetable”. Indian Journal of Biotechnology, Vol 11 (April), 2013 : hal. 235 – 237.
[10] Ratna Batari. “Identifikasi Senyawa Flavonoid Pada Sayuran Indigenous Jawa Barat”. Skripsi, Fakultas Teknologi Pertanian IPB, Bogor, 2007.
[11] C.A Backer, R.C.B van den Brink JR. Flora of Java Vol. 1. N.V.P. Noordhof, Groningen, The Netherlands, 1963.
[12] Cut Fatimah Zuhra, Juliati Br. Tarigan, Herlince Sihotang. “Aktivitas Antioksidan Senyawa Flavonoid dari Daun Katuk (Saoropus androgynus L.Merr)”.
41
[13] Ajit B. Patil, Asha S. Jadhav. “Flavonoid an Antioxidant : A Review”.
International Journal of Pharmaceutical and Biological Sciences Research and Devlopment, IJPBSRD 1 (2), Oktober 2013 : hal. 07 – 20.
[14] Sabri Sudirman. “Aktivitas Antioksidan dan Komponen Bioaktif Kangkung Air”. Skripsi, Departemen Teknologi Hasil Perairan fakultas Perikanan dan Ilmu Kelautan IPB, Bogor, 2011.
[15] Tapan Seal. “Antioxidant Activities of Some Wild Vegetables of North-Eastern Region in India and Effect of Solvent Extraction System”. International Journal of Pharmacy and Pharmaceutical Sciences, Vol. 6, Issue 5, April 2014 : hal. 315 – 319.
[16] Oladimedji T. Azeez, Kennedy O. Ejeta, Ehigiator O. Frank, Nwakamma E. Gerald. “Effects of Antioxidants on The Oxidative Stability of Vegetable Oil at Elevated Temperature”. International Journal of Applied Science and Technology, Vol. 3, No. 5, May 2013.
[17] Diny Agustini Sandrasari. “Kapasitas Antioksidan dan Hubungannya dengan Nilai Total Fenol Ekstrak Sayuran Indigenous”. Tesis, Sekolah Pascasarjana IPB, Bogor, 2008.
[18] Vishnupriya M, Nishaa S, Sasikumar J. M, Teepica Priya Darsini D, Hephzibah Christabel P, Gopalakrishnan V. K. “Chemical Composition and Antioxidant Activity of Essential Oil from Curcuma Amada Roxb”. International Research Journal of Pharmachy, IRJP 3 (6), 2012.
[19] Muhammad Haris.“Penentuan Kadar Flavonoid Total dan Aktifitas Antioksidan dari Daun Dewa (Gynura pseudochina [Lour] DC) dengan Spektrofotometer UV-Visibel”. Skripsi, Fakultas Farmasi Universitas Andalas

![Gambar 2.1 Tanaman Katuk (Sauropus androgynus (L) Merr) [10]](https://thumb-ap.123doks.com/thumbv2/123dok/530276.61273/25.595.218.421.272.497/gambar-tanaman-katuk-sauropus-androgynus-l-merr.webp)
![Tabel 2.2 Komposisi Asam Lemak Minyak Kelapa [2]](https://thumb-ap.123doks.com/thumbv2/123dok/530276.61273/33.595.117.520.331.516/tabel-komposisi-asam-lemak-minyak-kelapa.webp)
![Gambar 2.2 Reaksi Oksidasi Asam Lemak [1]](https://thumb-ap.123doks.com/thumbv2/123dok/530276.61273/35.595.118.516.202.581/gambar-reaksi-oksidasi-asam-lemak.webp)