FRAKSINASI SENYAWA FLAVOR ANALOG DAGING
PADA KACANG HIJAU (Phaseolus radiatus L.) HASIL
FERMENTASI MELALUI MEMBRAN MIKROFILTRASI
WARDATUL BAIDHOI
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
FRAKSINASI SENYAWA FLAVOR ANALOG DAGING
PADA KACANG HIJAU (Phaseolus radiatus L.) HASIL
FERMENTASI MELALUI MEMBRAN MIKROFILTRASI
WARDATUL BAIDHOI
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
FRAKSINASI SENYAWA FLAVOR ANALOG DAGING
PADA KACANG HIJAU (Phaseolus radiatus L.) HASIL FERMENTASI MELALUI MEMBRAN MIKROFILTRASI
Skripsi
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh :
WARDATUL BAIDHOI 105096003181
PROGRAM STUDI KIMIA FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
PENGESAHAN UJIAN
Skripsi berjudul ” Fraksinasi Senyawa Flavor Analog Daging pada Kacang Hijau (Phaseolus radiatus L.) Hasil Fermentasi Melalui Membran Mikrofiltrasi” yang ditulis oleh WARDATUL BAIDHOI, NIM 105096003181 telah diuji dan dinyatakan.”Lulus” dalam sidang Munaqosah Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta pada tanggal “14 JUNI 2010” Skripsi ini telah diterima sebagai salah satu syarat untuk memperoleh gelar Sarjana Strata Satu (S1) Program Studi Kimia.
Menyetujui,
Penguji I, Penguji II,
Anna Muawanah, M.Si Drs. Dede Sukandar, M.Si NIP. 19740508 199903 2002 NIP.19650104 199103 1001
Pembimbing I, Pembimbing II,
Ir. Agustine Susilowati, M.M Sri Yadial Chalid, M.Si NIP. 19580814 198402 2001 NIP. 19680313 200312 2001
Mengetahui,
Dekan Fakultas Sains dan Teknologi Ketua Program Studi Kimia
PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI ADALAH
HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI
SKRIPSI ATAU KARYA TULIS ILMIAH PADA PERGURUAN TINGGI
ATAU LEMBAGA MANAPUN
Jakarta, Juni 2010
LEMBAR PENGESAHAN
FRAKSINASI SENYAWA FLAVOR ANALOG DAGING
PADA KACANG HIJAU (Phaseolus radiatus L.) HASIL FERMENTASI
MELALUI MEMBRAN MIKROFILTRASI
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains
Pada Program Studi Kimia Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh :
Wardatul Baidhoi 105096003181
Menyetujui,
Pembimbing I, Pembimbing II,
Ir. Agustine Susilowati, M.M. Sri Yadial Chalid, M.Si. NIP.195808141984022001 NIP.196803132003122001
Mengetahui,
Ketua Program Studi Kimia
ABSTRAK
WARDATUL BAIDHOI, Fraksinasi Senyawa flavor Analog Daging Pada Kacang Hijau (Phaseolus radiatus L.) Hasil Fermentasi Melalui Membran Mikrofiltrasi. Di bawah bimbingan Ir. Agustine Susilowati, M.M. dan Sri Yadial Chalid M.Si.
Telah dilakukan penelitian tentang proses pemurnian fraksi analog daging yang diperoleh dari hasil proses flavoring melalui membran mikrofiltrasi pada kacang hijau (Phaseolus radiatus L.) terfermentasi (kaldu nabati). Jenis membran yang digunakan adalah membran mikrofiltrasi 0,2µm dengan selang waktu proses 0,5, 30, 60 dan 90 menit pada variasi tekanan 4 dan 6 bar. Tujuan dari penelitian ini adalah untuk mandapatkan fraksi analog daging serta senyawa pembentuk nya dan mengetahui pengaruh kondisi proses terhadap kandungan kimia hasil pemurnian. Pemurnian terbaik diperoleh pada waktu proses 90 menit dan tekanan 6 bar. Hasil analisa GCMS menunjukan bahwa fraksi analog (flavor analog daging) daging terdiri dari 8 jenis senyawa, yakni Senyawa yang mengandung sulfur/nitrogen-sulfur, nitrogen, furan, pyran, aldehid, alkohol, ester-asam organik dan hidrokarbon. Diperkirakan, senyawa penyusun utama serta yang berperan sebagai
flavor analog daging pada hasil pemurnian adalah 4-metil-5-hidroksietiltiazol dengan presentase hasil identifikasi mencapai 70,99%.
ABSTRACT
WARDATUL BAIDHOI, Fractination of Meat Analogue Flavor Component of Fermented Mung Bean ( Phaseolus radiatus L.) through Membrane Microfiltration. Under tuition of Ir. Agustine Susilowati, M.M. and Sri Yadial Chalid M.Si
Have been conducted the research towards meat analogue fraction purification of flavoring process result of fermented mung bean ( Phaseolus radiatus L.) through Membrane. The membrane type used is microfiltration membrane 0,2µm with an interval time process 0,5, 30, 60 and 90 minute at pressure variation 4 and 6 bar. The intention of this research is to get meat analogue flavor and the component which personating it, and to know the influence of process condition. The result of best purification obtained when purification process at 90 minute and the pressure is 6 bar. The result of GCMS analysis showed that meat analogue fraction (meat analogue flavor) consist of 8 compound type namely the compound containing sulfur/nitrogen-sulfur, nitrogen, furan, pyran, aldehyde, alcohol, organic ester-asam and the hydrocarbon. Estimated, the dominant compound and also which personating meat analogue flavor of purification result is 4-metil-5-hidroksietiltiazol by presentase result of purification reach 70,99 %.
BAB I PENDAHULUAN
1.1Latar Belakang
Kacang hijau terfermentasi atau kaldu nabati merupakan istilah untuk kaldu
yang dibuat dari proses fermentasi kacang–kacangan (Susilowati, 2006).
Pemanfaatan kacang hijau sebagai kaldu nabati merupakan salah satu usaha
diversifikasi produk olahan kacang hijau, pemanfaatan tanaman lokal untuk
dijadikan komoditas yang lebih bermanfaat, menaikkan nilai ekonomisnya, upaya
penerapan program pemerintah dalam usaha ketahanan pangan nasional bagi
produk–produk tanaman lokal serta sebagai upaya untuk mendapatkan bahan
penyedap rasa dan pengaroma bersumber protein nabati (Hanny, 2006).
Meningkatkan citarasa suatu makanan diperlukan bahan tambahan
makanan, salah satunya adalah penyedap rasa. Pada umumnya, masyarakat
menggunakan penyedap rasa dengan flavor yang menyerupai daging sapi atau
ayam untuk memperoleh makanan bercita rasa daging. Proses flavoring atau
pembentukan flavor analog daging dapat dilakukan melalui reaksi Maillard.
Reaksi ini terjadi antara asam amino dengan gula pentosa yang menghasilkan
senyawa- senyawa volatil pembentuk flavor analog daging (Heinze, 1978).
Pembuatan penyedap rasa berflavor daging biasa menggunakan bahan dasar
HVP (Hidrolized Vagetable Protein) sebagai sumber fraksi gurih dan pengganti
ekstrak daging. Kaldu nabati merupakan salah satu alternatif pengganti HVP yang
dapat digunakan sebagai media untuk mendapatkan penyedap rasa berflavor
analogdaging (Nagodawithana,1994).
Pemurnian dengan menggunakan teknologi berbasis membran dilakukan
untuk mendapatkan senyawa dominan pembentuk flavor analog daging dengan
tidak merusak senyawa penyusun tersebut. Ukuran partikel senyawa penyusun
citarasa yang kurang dari 0,2µm memungkinkan dilakukan pemurnian dengan
menggunakan teknologi membran. Keunggulan dari teknologi proses pemurnian
flavor ini adalah dapat beroperasi pada suhu kamar dan rendah, sehingga
mencegah kerusakan senyawa yang sensitif terhadap panas dan memperbaiki
kualitas produk seperti mencegah kerusakan flavor. Teknologi ini telah banyak
dikembangkan dan diaplikasikan ke dalam bidang pangan, seperti pemurnian
fraksi gurih, pemurnian gula, pengolahan minuman dan pengolahan susu
(Aspiyanto, 2002).
Pada penelitian ini, fraksinasi dengan membran mikrofiltrasi dilakukan
dalam beberapa kondisi, yakni tekanan dan waktu proses yang berbeda. Hal ini
dimaksudkan untuk mendapatkan hasil pemurnian yang optimal. Dari fraksi murni
analog daging ini bisa diketahui senyawa yang berperan penting pada
pembentukan flavor analog daging.
1.2. Perumusan Masalah
1. Bagaimana pengaruh tekanan dan waktu proses mikrofiltrasi dengan
membran mikrofiltrasi terhadap komposisi kimia hasil pemurnian?
2. Senyawa apa sajakah yang terdapat pada hasil pemurnian fraksi analog
daging?
1.3. Tujuan Penelitian
1. Mendapatkan fraksi analog daging melalui proses mikrofiltrasi.
2. Mengetahui pengaruh kondisi proses mikrofiltrasi terhadap komposisi
kimia hasil pemurnian
3 3. Mengetahui pengaruh kondisi proses mikrofiltrasi terhadap jenis senyawa
pembentuk flavor analog daging
1.4. Manfaat Penelitian
1. Mendapatkan teknik pemurnian flavor analog daging yang lebih efektif
dan efesien.
2. Hasil perolehan proses pemurnian flavor analog daging bisa dijadikan
BAB II
TINJAUAN PUSTAKA
2.1.Kaldu Nabati
Menurut Standar Nasional Indonesia (1996) kaldu merupakan produk yang
diperoleh dari daging atau daging unggas. Kaldu ini diperoleh dengan cara
memasak bahan kaya protein dengan air. Pembuatan kaldu ini disertai dengan
penambahan bumbu dan atau bahan penyedap, lemak yang dapat dimakan,
garam, rempah-rempah, dan bahan tambahan lain yang diizinkan penggunaannya
untuk meningkatkan citarasa. Sedangkan kaldu nabati adalah istilah yang
digunakan untuk produk kaldu hasil proses fermentasi garam pada
kacang-kacangan oleh Rhizopus sp. Kaldu nabati berfungsi sebagai penyedap rasa dan
pengaroma. Peranan kaldu nabati tidak jauh berbeda dengan rempah, bumbu atau
bahan sejenisnya (Susilowati dkk, 2006).
Produk serupa dengan kaldu nabati yang telah banyak dikenal orang adalah
miso dan tauco. Miso merupakan makanan hasil fermentasi yang berbentuk semi
padat berasal dari Jepang, yang terbuat hanya dari kacang kedelai ataupun dari
campuran kedelai-beras atau kedelai-gandum. Seperti miso, tauco adalah produk
fermentasi kedelai berbentuk pasta yang berwarna kekuning-kuningan dengan
rasa sedikit asin. Di China produk yang serupa kaldu nabati disebut Chiang, di
Korea disebut Doenjang dan di Thailand disebut Taochieo (Wood, 1982).
Perbedaan antara miso atau tauco dengan kaldu nabati adalah kapang yang
digunakan dalam fermentasi, miso atau tauco menggunakan kapang Aspergillus sp
sedangkan kaldu nabati menggunakan Rhizopus sp (Susilowati dkk, 2006).
Pemilihan kacang hijau (Phaseolus radiatus L) sebagai substrat untuk
memperoleh kaldu nabati kacang hijau ini didasarkan atas pemanfaatan kacang
hijau yang belum optimal. Selain itu juga sebagai salah satu usaha diversifikasi
olahan kacang-kacangan lokal, peningkatan nilai ekonomi serta potensinya untuk
dikembangkan sebagai bahan dasar seasoning agent (Susilowati dkk, 2006).
Tabel 1. Syarat Mutu Kaldu menurut SNI 01-4218-1996
No Kriteria Uji Satuan Persyaratan
1. Keadaan :
Min. 100 (kaldu daging, kaldu daging unggas)
Min. 160 (kaldu daging sapi) Min. 350 (kaldu daging lainnya) 3. Nitrogen Amino Mg/L Min. 210 (kadu daging lainnya) 4. Natrium Klorida g/L Maks. 12,5
5. Lemak g/L Min 3 (kaldu daging berlemak) 6. Bahan Tambahan Makanan SNI. 01-0222-1995
7. Cemaran logam
Timbal dalam produk kering Timbal dalam kemasan kaleng Timah
8. Cemaran mikroba Mikroba patogen/spora (clostridium botulinum untuk produk kaleng)
-
Negatif Negatif
Sumber: Direktorat Gizi Depkes RI (1996)
Adapun syarat mutu kaldu menurut SNI 01-4218-1996, seperti disajikan
pada Tabel 1. Kaldu nabati juga digunakan sebagai alternatif pengganti ekstrak
khamir dan HVP (Hidrolized Vagetable Protein) sebagai sumber fraksi gurih.
Ekstrak khamir merupakan konsentrat fraksi terlarut dari khamir, mengandung
asam-asam amino, peptida, nukleotida serta gula reduksi. HVP adalah hidrolisat
protein yang diperoleh dari hasil hidrolisis asam pada substrat yang berasal dari
kacang kedelai, gandum dan tanaman lainya. Pada umumnya, Ekstrak khamir dan
HVP banyak digunakan untuk mendapatkan produk berflavor daging karena
kemiripan kandungan asam amino dengan daging (Nagodawithana, 1994).
2.1.1. Fermentasi Kaldu Nabati
Proses pembuatan kaldu nabati secara fermentasi dilakukan melalui dua
tahap proses fermentasi. Tahap pertama meliputi pembuatan koji atau fermentasi
kapang. Fermentasi ini menggunakan media beras pada kondisi aerobik dengan
strain Rhizopus-C1. Tahap kedua dikenal dengan fermentasi garam pada kondisi
anaerob fakultatif. Hasil fermentasi tahap pertama sebagai sumber nutrisi dan
kapang sebagai sumber enzim. Dari dua tahap fermentasi ini, dihasilkan enzim
yang dapat memecah substrat menjadi senyawa pembentuk cita rasa dan aroma.
Semakin lama proses fermentasi berlangsung dalam larutan garam, semakin baik
pula rasa, aroma serta tekstur yang dihasilkan (Sabariman, 1987).
Pada proses fermentasi terjadi pemecahan substrat oleh enzim dari kapang
menjadi senyawa yang lebih sederhana, seperti asam amino, asam lemak, alkohol.
Reaksi antara asam amino dan gula menyebabkan pencoklatan yang
mempengaruhi warna produk. Reaksi kimia yang berlangsung selama fermentasi
ini diantaranya adalah pembentukan komponen flavor, baik yang volatil maupun
yang non volatil. Pada umumnya, senyawa yang terbentuk adalah ester, asam,
aldehid, hidrokarbon, furan. Terbentuk pula senyawa nitrogen, senyawa sulfur dan
senyawa hasil reaksi Mailard yang akan saling berikatan untuk membentuk flavor
spesifik hasil fermentasi (Nagodawithana, 1994).
Proses fermentasi kaldu nabati kacang hijau adalah sebagai berikut:
Kacang hijau yang bersih direndam selama semalam, dikupas kulitnya lalu
disterilisasi dengan cara direbus selama 30 menit pada suhu 100°C. Kacang hijau
yang telah steril dicampur dengan garam dapur dan inokulum Rhizopus-C1.
Komposisi masing-masing kacang hijau:garam dapur:Rhizopus-C1 adalah 51%,
23% dan 26% (b/b). Kemudian diaduk dan difermentasi pada suhu 30°C selama
24 minggu dalam inkubator. Selama fermentasi, enzim mengubah karbohidrat
menjadi dekstrin, maltosa, dan glukosa sebagai nutrisi untuk jamur. Sedangkan
protein menjadi peptida dan asam amino (Allan dan Sidney, 1980).
Gambar 1. Inokulum Rhizopus-C1 (Koji) (a) dan Crude kaldu nabati kacang hijau (b)
(a) (b)
2.1.2. Autolisis Kaldu Nabati
Autolisis adalah proses perusakan sel sendiri sesudah terjadi kematian sel,
disebabkan oleh kerja enzim yang terdapat di dalam sel itu sendiri (Joko dkk,
1992). Autolisis pada umumnya diartikan sebagai proses mencerna sendiri
(autodigesti). Autolisis pada kaldu nabati ini bertujuan untuk memperoleh
autolisat (hasil proses autolisis) yang mengandung peptida terlarut sebagai flavor
savory non volatil penghasil rasa gurih (Nagodawhitana, 1994).
Panas dan pH yang terkondisi pada proses autolisis menyebabkan
kematian sel. Pada saat sel mangalami lisis terjadi ketidakberaturan sistem sel
sehingga enzim protease dan glukanase terlepas ke matriks sel. Enzim ini
memecah substrat makromolekul yang akhirnya menyebabkan kandungan sel
menjadi terlarut. Komponen sel terlarut masuk dalam sistem substrat yang
ditandai dengan kenaikan kandungan fraksi gurih sebagai asam-asam amino,
peptida terlarut dan perubahan komposisi autolisat kaldu kacang hijau
(Nagodawithana, 1994).
Proses autolisis akan menyebabkan terjadinya hidrolisis protein kapang.
Kapang Rhizopus sp, diketahui memiliki aktivitas enzim protease, karbohidrase
dan lipase. Kapang ini juga memiliki enzim glutaminase dan gama glutamil
transferase yang berperan dalam meningkatkan kadar asam glutamat (Frazier W
dan D. Westhoff, 1988). Peningkatan kadar asam glutamat sebanding dengan
fraksi gurih yang semakin meningkat pula, hal ini dibuktikan dengan
meningkatnya kandungan asam amino dan peptida terlarut serta intensitas rasa
gurih pada autolisat setelah proses autolisis berlangsung (Susilowati dkk, 2007).
2.2.Flavor Analog Daging
Flavor atau citarasa merupakan sensasi yang dihasilkan oleh bahan
makanan ketika diletakkan dalam mulut terutama yang ditimbulkan oleh rasa dan
aroma. Penguat rasa (Flavor enhancer) adalah substansi yang ditambahkan pada
makanan sebagai suplemen untuk mempertinggi rasa aslinya. Substansi yang
biasa digunakan misalnya monosodium L-glutamat (MSG), disodium 5’-inosinate
(IMP), dan disodium 5’guanylate (GMP). Beberapa senyawa ini mampu
memperkuat atau memperbaiki citarasa makanan. Citarasa ini kadang dinyatakan
dengan kata gurih atau umami, kata umami berasal dari bahasa Jepang yang
berarti kesedapan. Citarasa glutamat kadang-kadang dikatakan menyerupai rasa
daging atau rasa ayam. Secara umum disepakati bahwa citarasa glutamat unik
dan tidak mempunyai kesamaan dengan daging (M deMan, 1989).
Savory flavor adalah istilah yang sering digunakan untuk rasa gurih. Savory
flavor dalam satu formulasinya terdapat berbagai macam komposisi, diantaranya
ekstrak daging, rempah-rempah dan asam amino. Savory flavor tersedia dalam
bentuk bubuk, pasta dan cair yang penggunaanya tergantung dari jenis produk.
Dalam bentuk bubuk biasanya terdiri dari filler berupa garam, gula, pati dan MSG
(Monosodium Glutamat). Bentuk cair, banyak terdapat pada minyak dalam mi
instan. Bentuk pasta terdiri dari campuran fraksi padatan dan cair, dapat terdiri
dari minyak dan pati.
Flavor analog daging merupakan flavor yang menyerupai flavor daging
sapi tetapi bahan dasarnya bukan dari daging sapi. Menurut Heinz (1978), analog
daging atau meat analog didefinisikan sebagai produk bernutrisi yang mirip
dengan daging tetapi tidak mengandung protein daging (protein hewani) atau
produk hasil samping daging. Analog daging dibuat menyerupai daging baik
dalam penampilan, textur dan rasa.
Flavor daging terdiri dari campuran senyawa yang diperoleh dengan cara
memanaskan non odorous prekusor (prekusor tidak berbau) yang bisa membentuk
senyawa volatil. Bila dibandingkan dengan tipe flavor buah- buahan dan flavor
lainnya, flavor daging tidak tersusun dari satu karakter senyawa volatil yang
dominan. Sejak ditemukannya teknik pembentukan flavor daging melalui proses
pemanasan, karakter senyawa volatilnya tergantung dari kondisi dan lama
pemanasan (Heinz 1978).
Beberapa senyawa volatil yang teridentifikasi pada daging terdiri dari 6
senyawa asam, 31 aldehid, 3 ester, 1 eter, 2 pirol, 25 alkohol, 23 keton, 19
hidrokarbon, 12 senyawa benzene, 11 lakton, 8 furan, 53 senyawa sulfur, 37
senyawa nitrogen (Heinz, 1978). Senyawa-senyawa yang mempunyai peranan
penting pada flavor daging adalah golongan furanoid, pirazin dan sulfur. Aroma
daging berhubungan dengan senyawa sulfur. 2-Metil-3-furanthiol (MFT) (1).
Senyawa ini merupakan senyawa volatil pemberi aroma daging yang banyak
ditemukan pada daging sapi (David, 1998). Berikut adalah beberapa senyawa
flavor daging rebus.
SH
Menurut Kerler (2000), senyawa yang terdapat pada daging yang direbus
adalah senyawa-senyawa sulfur seperti 2-metil-3-furantiol (1);
3-merkapto-2-butanon (2); 3-merkapto-2-pentanon (3); metanetiol (4); 2-merkapto-3-pentanon
(5); 2,5-dimetil-3-furantiol (6); hidrogen sulfida dan metional (7). Senyawa
tersebut dapat terbentuk dari prekusor. Prekusor adalah suatu senyawa yang
digunakan untuk mendapatkan senyawa flavor melalui suatu reaksi kimia.
Prekusor pembentuk substansi flavor daging adalah gula pentosa bebas atau
berikatan seperti ribosa, ribosa fosfat dan inosin fosfat. Prekusor lainya adalah
senyawa yang mengandung sulfur seperti thiamin, cystein, glutation dan metionin
(Erickson, 1991). Dalam Tabel 2 berikut terdapat beberapa komponen senyawa
volatil aroma daging sapi.
Tabel 2. Komponen senyawa volatil aroma daging sapi
Tipe senyawa Jumlah senyawa teridentifikasi
Alifatik hidrokarbon 73
Alisiklik hidrokarbon 4
Terpenoid 8
Alifatik alkohol 46
Alifatik aldehid 55
Alifatik keton 44
Alisiklik keton 8
Alifatik asam karboksilat 20
Lakton 32
Alifatik ester 27
Alifatik eter 5
Alifatik amin 20
Senyawa Klor 10
Senyawa benzena 86
Senyawa sulfur (bukan heterosiklik) 68
Furan dan derivatnya 43
Tiopen dan derivatnya 40
Pirol dan derivatnya 20
Piridin dan derivatnya 17
Pirazin dan derivatnya 54
Oksazole dan oksazoline 13
Tiazole dan tiazoline 29
S-heterosiklik 13
Lain - lain 12
Sumber : Lawrie (1995)
Kombinasi antara asam amino dengan gula dipakai pada reaksi
pembentukan flavor daging karena ditemukan adanya kesamaan komposisi asam
amino pada daging dan Hidrolised Vagetable Protein (HVP) (Ouweland, 1978).
Reaksi Maillard merupakan tipe reaksi yang dapat menghasilkan flavor daging.
Reaksi ini yang menjadi dasar proses flavoring untuk pembentukan flavor analog
daging pada kaldu nabati.
2.3. Reaksi Maillard (Proses Flavoring)
Proses flavoring untuk menghasilkan flavor analog daging merupakan
aplikasi dari reaksi Maillard. Reaksi Maillard adalah reaksi kimia antara asam
amino dan gula pereduksi pada suhu tinggi. Reaksi pencoklatan non enzimatik ini
menghasilkan warna coklat (browning). Pada reaksi Maillard gugus karbonil dari
glukosa bereaksi dengan gugus nukleofilik grup amino dari protein, menghasilkan
warna dan aroma yang khas. Proses yang terjadi pada reaksi Maillard adalah:
1. Gugus karbonil bereaksi dengan gugus amino dari asam amino menghasilkan
glukosilamin
.
Glukosilamin merupakan senyawa intermediet yang digunakan sebagai
prekusor pembentukan flavor. +
RNH
Glukosa Glukosilamin
2. Glukosilamin yang tidak stabil mengalami pengaturan kembali (Amadori
rearrangement) membentuk ketosamin.
Glukosilamin Ketosamin
3. Ketosamin dapat mengalami dehidrasi dengan kehilangan satu atau lebih
molekul air membentuk senyawa flavor, seperti hidroksi metil furfural. Selain
itu terbentuk pula asetol, diasetil, dan senyawa berwarna coklat yang disebut
dengan melanoidin.
-RNH2
Pembentukan aldehid yang merupakan hasil dari reaksi antara asam amino
dan senyawa dikarbonil disebut sebagai degradasi strecker. Jumlah atom karbon
pada aldehid yang terbentuk sebanyak jumlah atom karbon pada asam amino
dikurang satu. Merkaptoasetaldehid merupakan aldehid yang terbentuk dari
degradasi streker cystein, terbentuk juga enaminol pada proses ini, dua senyawa
ini bereaksi satu sama lain membentuk hidrogen sulfida dan asetaldehid (Acree,
1993).
Berikut adalah hasil dari degradasi streker Cystein:
-2H2O
Ketosamin 3-Deoxyoson
Cystein
Hidrogen Sulfida
Asetaldehid
Merkaptoasetaldehid
Reaksi Mailard banyak diaplikasikan pada industri pangan untuk rekayasa
rasa atau flavor. Kombinasi antara beberapa prekusor yaitu asam amino L-Cystein
dengan tiamin (vitamin B12) dan gula pentosa yakni Xylosa digunakan sebagai
pembentuk rasa daging. Beberapa prekusor yang biasa digunakan dalam proses
reaksi flavor seperti terlihat pada Tabel 3.
Tabel 3. Prekusor dasar dalam reaksi flavoring
No. Golongan Prekusor Jenis Prekusor
1 Asama Amino
Sistein, asam glutamat, valin, glisisn, Hidrolized Vagatable Protein (HVP), yeast extract, Hidrolized Animal Protein dan lain-lain.
2 Gula pereduksi Glukosa, Xylosa, Ribosa, Ribosa-5-fosfat
3 Vitamin Thiamin
4 Senyawa sulfur Furanon, Sulfida, Thiol (Cystein, Thiamin)
5 Nukleotida Inosin 5’-monofosfat, Guanosin 5’-monofosfat
6 Asam Asam laktat, asam α-karboksilat, asam asetat dan lain-lain.
Sumber : Nagodawithana (1994)
Pembentukan flavor dipengaruhi oleh jenis gula, asam amino, pH, suhu dan
lama proses. Pada umumnya, industri penghasil flavor analog daging
menggunakan rentang pH antara 4 sampai 5,5 dan rentang suhu antara 100-140°C
(Kerler, 2000).
2.3. Membran Mikrofiltrasi
Kata membran berasal dari bahasa latin membrane yang berarti kulit.
Sekarang membran bisa diartikan selaput tipis yang berfungsi sebagai lapisan
selektif untuk memisahkan dua fase karena sifatnya yang semipermeabel
(Wenten,1999). Membran merupakan lapisan permeabel atau semipermeabel,
berupa lapisan polimer yang tipis yang memiliki ukuran tertentu. Membran
digunakan sebagai pembatas antara bahan yang dimasukkan dengan produk yang
diinginkan (Scott dan Hugges, 1996).
Membran merupakan aplikasi dari proses filtrasi untuk memisahkan
padatan yang tidak terlarut pada suatu produk cair. Lapisan media menolak
padatan tersuspensi dan menghasilkan cairan yang jernih (Cheryan, 1992).
Pemisahan dengan membran merupakan pemisahan material dengan mengalirkan
umpan melalui suatu membran, dan merupakan pemisahan molekul ukuran besar
yang tertahan pada permukaan membran. Umpan (feed) adalah larutan yang berisi
satu atau lebih campuran molekul atau partikel yang akan dipisahkan.
Proses filtrasi dengan membran dihasilkan permeat dan retentat. Permeat
adalah bagian yang melewati membran, sedangkan retentat merupakan bagian
yang tertahan oleh membran (Paulson, 1995). Unit terkecil dimana membran
ditempatkan disebut modul.
Menurut Mulder (1996), kemampuan membran untuk memisahkan
komponen disebabkan karena perbedaan sifat fisik atau kimia antara membran
dengan komponen tersebut. Prinsip operasi pemisahannya adalah memisahkan
satu atau lebih komponen pada suatu aliran fluida. Secara umum, proses ini
digunakan untuk memisahkan makromolekul, substansi biologi serta komponen
yang tidak terlarut (suspensi dan koloid). Prinsip operasi membran secara
skematis ditunjukkan pada Gambar 2.
Membran
Retentat
Permeat Umpan (feed)
Modul
Gambar 2. Skema proses pemisahan dengan membran (Mulder,1996)
Berdasarkan ukuran partikel yang dipisahkan, membran dapat dibedakan
atas mikrofiltrasi, ultrafiltrasi dan reverse osmosis (Mulder, 1996). Membran
mikrofiltrasi berfungsi menyaring makromolekul (>500.000 g/mol) atau partikel
dengan ukuran 0,1-10 µm, membran ultrafiltrasi berfungsi untuk menyaring
makromolekul (>5000 g/mol) atau partikel dengan ukuran partikel 0,001-0,1 µm,
sedangkan reverse osmosis dapat menghalangi partikel yang berukuran lebih kecil
dari 0,001 µm.
Membran mikrofiltrasi dapat memisahkan partikel kecil seperti sel, bakteri,
dan virus. Membran mikrofiltrasi umumnya berupa cartridge yang berukuran
pori-pori 0,1 – 10 µm. Bahan cartridge bisa berasal dari katun, wool, rayon,
selulosa, fiberglass, polipropilen, akrilik, nilon, ester selulosa, dan polimer
hidrokarbon. Lemak serta partikel-partikel kecil seperti mikroorganisme tertahan
di membran, sementara senyawa makromolekul (protein, karbohidrat), gula,
garam mineral dan air lolos lewat membran. (Mulder, 1996). Peptida-peptida
terlarut yang berfungsi sebagai penyusun fraksi gurih serta beberapa senyawa
dengan berat molekul yang relatif kecil akan lolos lewat membran. Bagian yang
terpenting dari mikrofiltrasi adalah media penyaring yaitu membran. Membran
tersebut tipis dan mikroporus. Pori-porinya sangat kecil dan monodispersi,
pori-pori tersebut menahan partikel-partikel yang akan tersaring, tetapi dapat dilalui
dengan cepat oleh cairan dan zat terlarut yang kecil. Hal ini menunjukan bahwa
membran mikrofiltrasi berbeda dengan kebanyakan media penyaring
konvensional. Membran mikrofltrasi dan pemasangan membran mikrofiltrasi pada
modul ditunjukkan pada Gambar 3.
(a) (b)
Gambar 3. Membran mikrofiltrasi (a), pemasangan membran mikrofltrasi pada modul (b)
Menurut Wenten (1999), parameter utama yang digunakan dalam penilaian
kinerja membran adalah fluks dan selektifitas (rejeksi). Secara umum, fluks
didefinisikan sebagai volume aliran yang melalui membran per unit luas
permukaan membran dan satuan waktu. Fluks volume dapat dinyatakan sebagai
berikut:
V J =
A x t dimana:
J = Fluks volume (L/m2.Jam) A = Luas permukaan membran (m2) t = Waktu (Jam)
V = Volume permeat (L)
Fluks dipengaruhi beberapa faktor antara lain konsentrasi umpan, tekanan
membran, temperatur umpan dan waktu. Faktor tersebut memberikan pengaruh
yang berbeda-beda bagi fluks. Konsentarsi umpan yang tinggi menyebabkan
penurunan fluks sehingga suatu saat fluks akan bernilai nol. Pada tekanan rendah,
fluks akan meningkat, sedangkan pada tekanan tinggi fluks relatif konstan
(Mulder, 1996).
Rejeksi (selektivitas) menurut Wenten (1999) adalah kemampuan membran
untuk menahan suatu komponen agar tidak melewati membran. Nilai rejeksi
dinyatakan sebagai berikut :
R = 1 x100%
Cpermeat = Konsentrasi partikel dalam permeat Cretentat = Konsentrasi partikel dalam umpan (feed)
Nilai R tidak tergantung dari satuan konsentrasi. Nilai R bervariasi antara
0-100%. Nilai R 100% artinya pemisahan partikel sempurna, dalam hal ini
membran ideal dan nilai R sama dengan 0% artinya partikel larutan bebas
melewati membran.
Penurunan kinerja membran ditunjukkan dengan fluks yang semakin
menurun seiring dengan semakin lama waktu filtrasi. Penurunan fluks dapat
disebabkan oleh beberapa faktor antara lain polarosasi konsentrasi, adsorbsi,
pembentukan lapisan gel dan penyumbatan pada membran. Faktor–faktor tersebut
menyebabkan terjadinya fouling pada membran (Mulder, 1996).
Polarisasi konsentrasi merupakan tahap awal dari fouling berupa
peningkatan konsentrasi bahan terlarut pada permukaan membran yang dapat
menurunkan fluks. Efek dari polarisasi konsentrasi dapat dikurangi atau
dihilangkan dengan menurunkan tekanan operasi atau konsentrasi umpan
(Wenten,1999).
Menurut Wenten (1999), mekanisme penyumbatan atau penyempitan pori
membran pada perstiwa fouling dapat dibedakan menjadi empat macam:
1. Complete pore blocking
Jenis fouling seperti ini dapat terjadi jika ukuran partikel tepat menyumbat
lingkaran pori membran sehingga pori menutup total.
Gambar 4. Complete pore blocking
2. Intermediate pore blocking
Terakumulasinya partikel-partikel bahan terlarut di permukaan membran,
karena ukuran partikelnya yang lebih kecil dari pada pori membran sehingga
membran terlapisi oleh hamparan partkel-partikel tersebut.
Gambar 5. Intermediate pore blocking
3. Internal pore blocking
Penyempitan ukuran pori membran akibat teradsorpsinya partikel-partikel di
sekeliling bagian dalam pori membran. Penyempitan diameter pori ini akan
menyebabkan banyak partikel terlarut tertahan di membran.
Gambar 6. Internal pore blocking
4. Cake filtration
Terjadi jika ukuran partikel sangat kecil dan memiliki sifat-sifat gel jika
berada dalam keadaan terakumulasi.
Gambar 7. Cake filtration
Keunggulan penggunaan membran untuk operasi-operasi pengolahan
pangan adalah tidak membutuhkan energi yang terlalu besar karena tidak
menggunakan energi dalam bentuk panas sehingga komponen di dalamnya dapat
dipertahankan (Aspiyanto, 2002).
Menurut Cheryan (1992), teknologi membran telah digunakan pada
teknologi proses pengolahan susu dan pengolahan sari buah, namun sekarang
penggunaan membran di bidang pangan semakin meluas, misalnya pemekatan
makanan cair, penghilangan warna dan gula berantai panjang.
2.5. Gas Cromatograph-Mass Spectroscopy (GC-MS)
Menurut Sudjadi Kromatografi Gas – Spektroskopi Massa adalah teknik
analisis yang menggabungkan dua metode analisis yaitu (1) Kromatografi Gas;
dimana sampel yang diinjeksikan akan terpisahkan menjadi molekul-molekul
yang lebih kecil berdasarkan sifat fisiknya, dan (2) Spektroskopi Massa; dimana
molekul-molekul yang terpisah tersebut diubah menjadi ion-ion gas dan massanya
diukur melalui suatu detektor sehingga menghasilkan spektrum massa (m/Z)
(Sudjadi, 1985).
Instrumen GCMS didasarkan pada pemisahan sifat-sifat fisik zat organik
yang mudah menguap pada pemanasan termostabil dengan fase gerak berupa gas
inert, yang dikombinasikan menggunakan detektor berupa spektrum massa untuk
mengetahui berat molekul relatif dan jenis senyawa dari setiap puncak grafik yang
dihasilkan. Sampel yang dapat dianalisis dengan menggunakan GC-MS, harus
memenuhi beberapa syarat, diantaranya :
1. Dapat diuapkan sampai suhu ~ 4000C
2. Secara termal stabil (tidak terdekomposisi pada suhu ~ 4000C
3. Sampel lainnya dapat dianalisis setelah melalui tahap preparasi khusus.
2.5.1. Prinsip Dasar GC-MS
Transfer massa antara fase bergerak dan diam (cairan dengan titik didih
tinggi) terjadi bila molekul campuran terserap di dalam pori-pori partikel, laju
perpindahan suatu molekul zat terlarut tertentu di dalam kolom berhubungan
dengan bagian molekul tersebut diantara fase bergerak dan fase diam. Jika ada
perbedaan penahanan secara selektif, maka masing-masing komponen keluar dari
kolom pada interval yang berbeda (Khopkar, 1990).
Sampel dalam keadaan gas akan dibombardir dengan elektron yang
berenergi tinggi pada detektor. Tumbukan antara sebuah molekul organik dengan
salah satu elektron berenergi tinggi menyebabkan lepasnya sebuah elektron dari
molekul itu dan terbentuk suatu ion organik. Ion organik yang dihasilkan oleh
pemborbardir elektron berenergi tinggi ini tidak stabil dan pecah menjadi fragmen
kecil, baik berbentuk radikal maupun ion-ion lain. Spektrometer massa akan
mendeteksi fragmen bermuatan positif (Fessenden dan Fessenden, 1986).
2.5.2. Instrumentasi GCMS
Komponen pada instrumentasi GCMS meliputi (Khopkar, 1990; Sudjadi, 1985):
1. Pengaturan aliran gas (Gas Flow Controller)
Fase bergerak adalah gas pembawa, yang sering digunakan adalah He, N2,
H2, Ar. He lebih sering digunakan karena konduktivitasnya yang tinggi.
2. Tempat injeksi sampel (injector)
Berfungsi untuk mencampurkan sampel dengan gas pembawa sebelum
bisa disalurkan ke dalam kolom.
3. Kolom (Capillary column)
Berfungsi untuk memisahkan komponen-komponen molekul sampel.
Panjang kolom berkisar antara 30-60 meter dengan ketebalan 0,1-3
mikron. Salah satu kolom yang biasa digunakan adalah Wall coated open
tubular (WCOT) yaitu kolom yang dilapisi oleh polimer tipis berupa
Polysolixane atau Polyethileneglycol pada dinding kolom bagian dalam.
4. Interfase (Penghubung antara GC dengan MS)
5. Sumber ionisasi (Ion Source)
Berfungsi untuk mengionkan sampel ke bentuk gas sebelum masuk ke
dalam Mass-Analyzer.
6. Pompa vakum (Vacuum Pump)
Ada dua tipe vakum yaitu, pompa vakum tinggi, yang berfungsi untuk
mengurangi dan mempertahankan tekanan pada MS saat analisis. Tekanan
tinggi yang dipertahankan juga dapat menambah sensitivitas pada proses
analisis spektrum massa. Pompa vakum tipe kedua adalah pompa vakum
rendah, yang berfungsi untuk mengurangi tekanan udara luar. Sistem ini
diperlukan agar ion-ion tidak mengalami reaksi dengan partikel lain dan
mengurangi reaksi ion molekuler.
7. Penganalisis Massa (Mass Analyzer)
Mass Analyzer terdiri dari empat batang logam yang diberi muatan, baik
positif (+) maupun negatif (-) yang memiliki fungsi selektivitas untuk
molekul berion pada voltase yang diinginkan.
8. Detektor
9. Sistem pengolah data
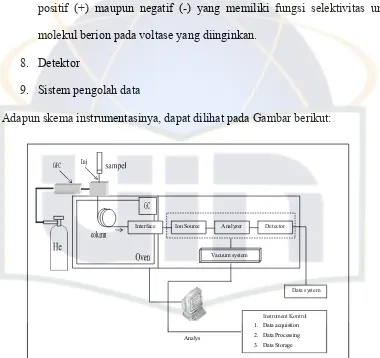
Adapun skema instrumentasinya, dapat dilihat pada Gambar berikut:
Gambar 8 . Skema Instrumentasi GC-MS
2.6. Spektrofotometri UV-VIS
Spektrofotometri digunakan untuk mengukur jumlah cahaya yang
diabsorbsi atu ditransmisikan oleh molekul-molekul di dalam larutan. Ketika
Vacuum system
Interface Ion Source Analyzer Detector
Data system
Instrument Kontrol
1. Data acquistion
2. Data Processing
3. Data Storage Analys
panjang gelombang cahaya ditransmisikan melalui larutan, sebagian nergi cahaya
tersebut akan diserap (diabsorbsi). Besarnya kemampuan moleul-molekul zat
terlarut untuk mengabsorbsi cahaya pada panjang gelomang tertentu dikenal
dengan istilah absorbansi (A), yang setara dengan nilai konsentrasi larutan
tersebut dan panjang berkas cahaya yang dilalui (biasanya 1 cm dalam
spektrofotometer) ke suatu poin dimana persentase jumlah cahaya yang
ditransmisikan atau diabsorbsi diukur dengan phototube (Hermanto, 2008).
Bagian-bagian spektrofotometer (Hermanto, 2008) :
1. Sumber cahaya
Sebagai sumber cahaya dapat dipakai lampu Wolfram yang menghasilkan sinar
di atas 375 nm atau lampu Deuterium (D2) yang memiliki sinar di bawah 375
nm. Sumber cahaya dalam spektrofotometer tersebut memancarakan berkas
cahaya yang melewati suatu monokromator berupa prisma yang mengubah
cahaya polikromatis menjadi cahaya monokromatis.
2. Pemilih panjang gelombang (monokromator)
Monokromator berfungsi untuk mendispersikan atau menguraikan cahaya
polikromatis menjadi monokromatis. Ada dua macam monokromator yang
dapat dipergunakan untuk memilih sinar yang dipakai yaitu prisma dan grating.
3. Kuvet (tempat sampel)
Kuvet untuk analisis secara spektrofotometri harus memenuhi syarat-syarat
sebagai berikut :
• Tidak berwarna sehingga dapat mentrasmisikan semua cahaya.
• Permukaan secara optis harus benar-benar sejajar.
• Harus tahan (tidak bereaksi) terhadap bahan-bahan kimia.s
25 • Tidak boleh rapuh.
• Mempunyai design yang sederhana.
4. Detektor
Detektor berfungsi untuk mengubah cahaya menjadi arus listrik (potosensitive
detector). Ketika cahaya dengan panjang gelombang tertentu melalui larutan
kimia yang diujikan, sebagian cahaya tersebut akan diabsorbsi oleh larutan.
Hukum Beer’s yang dikembangkan pada tahun 1852 oleh J.Beer’s menyatakan
secara kuantatif adsorbsi ini sebagai: s
Log I0/IT = ε.L.C……….*)
Keterangan :
I0 = intensitas cahaya sebelum melewati sampel
IT = intensitas cahaya setelah melewati sampel
ε = koefisien ekstingsi, yaitu konstanta yang tergantung pada sifat alami dari senyawa substansi dan panjang gelombang yang digunakan untuk analisis.
L = panjang atau jarak cahaya yang melewati sampel
BAB III
METODOLOGI PENELITIAN
3.1 Tempat dan Waktu penelitian
Penelitian dilaksanakan di Laboratorium Pangan Pusat Penelitian Kimia,
Lembaga Ilmu Pengetahuan Indonesia (LIPI) Puspitek, Serpong. Dimulai sejak
Mei sampai November 2009.
3.2 Alat dan Bahan
3.2.1 Alat
Alat–alat yang digunakan dalam penelitian ini meliputi; peralatan proses
flavoring yaitu beaker glass 5 L, fraksinator (close system) Bomex 10 L (TC-15),
homogenaizer (Ultra Turrax, Germany). Peralatan proses pemurnian meliputi
Vibosieve separator filter machine 200 mesh (62 µm) (AKIRA), membran
mikrofiltrasi FSM 0,2 PP (Fluoro Polimer, ukuran pori-pori 0,2 µm), modul
membran LabStak M20-0,72-Pso DSS Plate Frame Cross-Flow Membrane
Filtration. Peralatan analisa yang digunakan meliputi glassware, timbangan
analitik (Mettler Toledo AT 400), desikator, hotplate, vortex, oven (Memmert),
mikro pipet (eppendhorf), soxtech system HT 2 1045 extraction unit, destruksi
buchi 435 unit 21, salinometer (ATAGO, Japan), Destilator unit Sibata SI-315,
Spektrofotometer UV-Vis Hitachi U-2001, GCMS (Shimadzu QP-2010).
3.2.2 Bahan
Bahan baku yang digunakan dalam penelitian ini berupa Kaldu nabati
kacang hijau (crude kaldu) dari fermentasi garam selama 24 minggu pada suhu
30°C menggunakan inokulum Rhizopus-C1 yang diperoleh dari Pusat Penelitian
Kimia LIPI PUSPITEK Serpong. Bahan kimia yang digunakan adalah HCl,
NaOH, K2SO4 (Merk), H2SO4, Na2SO4 (Merk), NaCO3 (Merk), CuSO4 (Merk), Methyl blue, Na thiosulfat, Folin, Asam asetat, CuCl2, Buffer borat, KOH, L-Cystein (Biogen), Tiamin-HCl (Biogen), Xilosa (Biogen), Trisodium fosfat, Asam
borat, Thymolftalein, Sodium Thiosulfat, Reagen Nelson, NaKTartrat, KI, larutan
pati, methyl red, n-heksana, arsenomolibdat.
3.3. Prosedur Penelitian
3.3.1. Autolisis Kaldu Nabati Kacang Hijau
Proses autolisis dilakukan dengan cara melumatkan 1 kg crude kaldu
dalam 1,5 L air (rasio perbandingan crude kaldu dan air 2:3). NaOH atau HCl
ditambahkan untuk pengaturan pH 5,5. Campuran di masukkan ke dalam beaker
glass 3 L lalu dipanaskan pada suhu 55°C di dalam waterbath dengan pengadukan
4500 rpm selama 8 jam, kemudian dilakukan inaktivasi kapang pada suhu 70°C
selama 5 menit.
Gambar 9. Proses autolisis pada suhu 55°C, pH 5,5 selama ± 8 jam
Autolisat yang diperoleh dianalisa kandungan kimianya yang meliputi
analisa total padatan, kadar lemak, kadar garam, total protein, protein terlarut,
gula pereduksi, n-amino dan intensitas aroma daging (Lampiran 2). Autolisat ini
selanjutnya digunakan untuk proses flavoring.
3.3.2. Proses Flavoring
Proses flavoring dilakukan untuk memperoleh autolisat berflavor analog
daging. Reaksi ini dilakukan dengan cara menambahkan prekusor pembentuk rasa
daging pada autolisat. Prekusor yang digunakan adalah L-Cystein, Thiamin-HCl
dan Xylosa dengan formulasi masing-masing 7,67%; 12,40%; 2,55% (% berat
kering total protein (%b/b)) (presentase formulasi berdasarkan referensi,
Lampiran 5). Ketiga prekusor tersebut ditambahkan pada 2 L autolisat kaldu
nabati pada pH 5,5 di dalam beaker glass 5 L lalu dihomogenisasi kemudian di
pindahkan dalam fraksinator dan dipanaskan pada suhu 100ºC selama 3 jam.
Analisa kandungan kimia dan uji intensitas flavor analog daging juga
dilakukan pada hasil proses flavoring ini untuk mengetahui sejauh mana
peningkatan intensitas aroma analog daging. Autolisat berflavor analog daging ini
dimurnikan dengan menggunakan membran mikrofiltrasi untuk mendapatkan
fraksi analog daging (flavor analog daging).
3.3.3. Pemurnian Fraksi Analog Daging Melalui Membran Mikrofiltrasi
Sebelum dilakukan proses pemurnian dengan membran mikrofiltrasi,
terlebih dahulu 1,5 L autolisat berflavor analog daging ditambahkan dengan 4,5 L
air hasil penyaringan dengan membran Reverse Osmosis (air RO), perbandingan
autolisat dengan air RO adalah 1:3, campuran dihomogenisasi selama 20 menit
lalu disaring dengan saringan Vibosieve separator filter machine 200 mesh. Filtrat
yang dihasilkan disebut dengan feed (umpan). Feed selajutnya dimurnikan dengan
membran mikrofiltrasi. Analisa kandungan kimia dan intensitas flavor analog
dagingjuga dilakukan pada feed .
Mikrofiltrasi 0,2µm dicuci terlebih dahulu menggunakan aquades dengan 2
kali pengulangan. Tujuan pencucian adalah untuk memastikan bahwa membran
berada pada kondisi baik dan siap dipakai untuk sampel. Feed ditampung pada
tanki umpan berkapasitas 5 Liter. Tekanan operasi diatur dengan mengatur katup
pengatur retentat sampai pengukuran tekanan feed dan retentat masing-masing
menunjukan 4 bar serta pada frekuensi tetap yaitu 20 Hz dan temperatur diatur
tetap pada suhu kamar yaitu 29oC. permeat dan retentat ditampung dan masing-masing diambil sebanyak 150 mL pada waktu operasi 0,50 menit, 30 menit,
60menit dan 90 menit. Selanjutnya fluida yang lolos lewat membran sebagai
permeat ditampung. Setelah operasi filtrasi selesai, maka modul membran dicuci
berturut-turut menggunakan aquadest, larutan NaOH 0,4% dan aquadest pada
temperatur ruang sampai modul benar-benar bersih. Kemudian dilakukan proses
mikofiltrasi pada kondisi yang sama pada tekanan 6 bar.
Permeat dan retentat hasil perolehan proses pemurnian dianalisa intensitas
aroma analog daging dan komposisi kimianya (Total padatan, kadar lemak, kadar
garam, N-amino, total protein, protein terlarut dan gula pereduksi).
3.3.4. Identifikasi Senyawa Pembentuk Flavor Analog Daging
Kondisi optimum dari hasil analisa terbaik diambil untuk diuji lebih lanjut
dengan GCMS dengan tujuan menganalisis senyawa volatil sebagai komponen
senyawa pembentuk flavor analog daging.
Preparasi sampel dilakukan dengan menambahkan methanol pada permeat
dan feed, n-heksana pada retentat dengan perbandingan 1:1, kemudian dikocok
dan dibiarkan mengendap selama 1 malam. Selanjutnya filtrat diambil dan
diinjeksikan ke GCMS sebanyak 0,1µm. Karakteristik GC-MS yang digunakan
adalah:
Merk : Shimadzu QP2010
Suhu injektor : 280 oC Suhu kolom : 40oC Suhu detektor : 280 oC Gas pembawa : Helium
Tekanan : 86,9 Kpa
Total flow : 82,4 ml/m
Aliran kolom : 1,56 ml/m, percepatan linier
Split ratio : 50
Jenis kolom : Non polar C18 dimethyl polysiloxane (Rtx-1MS)
panjang kolom 30.00 m, ketebalan 0.25 µm, diameter
0,25 mm
Jenis pengion : EI (Electron Impact) 70 eV.
Diagram kerja proses keseluruhan penelitian ditunjukkkan pada Gambar 10.
Identifikasi dengan GCMS
Retentat Ampas
Pemurnian dengan membran mikrofiltrasi 0,2µm frekuansi 20 Hz, tekanan 4 dan 6 bar selama 0,50, 30, 60 dan 90 menit
Umpan (feed)
diencerkan (AFD:air RO = 1:3)
difiltrasi 200 mesh (62 µm)
Permeat sebagai
Flavor analog daging Autolisat berflavor
analog daging (AFD)
ditambahkan prekusor:
L-Cystein (7,67%); Thiamin-HCl (12,40%); Xylosa (2,55%) pH 5,5, suhu 100°C selama 3 jam
Autolisat
Dilumatkan (Kaldu kasar:air = 2:3)
pH 5,5 suhu 55°C selama 8 Jam
Kaldu kasar
Gambar 10. Diagram kerja proses pemurnian fraksi analog daging dari kacang hijau terfermentasi
BAB IV
HASIL DAN PEMBAHASAN
4.1. Kandungan Kimia Bahan Baku
Analisa kandungan kimia bahan baku berupa crude kaldu serta autolisat
yang diperoleh dari proses autolisis, dilakukan untuk mengetahui kandungan
kimia serta berapa besar fraksi gurih dan total protein dari autolisat. Total protein
pada autolisat menentukan jumlah prekusor pada tahap formulasi reaksi flavoring.
Formulasi ini dihitung berdasarkan berat kering dari total protein.
Crude kaldu merupakan produk fermentasi garam kacang hijau dengan
tampilan fisik semi solid (total padatan 51,81%), berwarna coklat, dengan rasa
yang asin (kadar garam 6,625%). Kadar N-amino sebesar 9,21 mg/mL
mengindikasikan adanya Flavor alami pada crude kaldu yang sangat berpotensi
sebagai sumber savory flavor.
Proses autolisis pada suhu 55ºC dan pH 5,5 selama 8 jam menghasilkan
autolisat kaldu nabati yang berupa suspensi coklat yang kental dengan kandungan
total padatan 20,39% dan rasa yang asin dengan kadar garam 3,61%. Kandungan
total protein sebesar 18,625% dan N-amino 4,37 mg/mL. Data kompenen kimia
crude kaldu dan autolisat ditunjukkan pada Lampiran 6. Proses pemanasan dan
pengadukan (55oC dan 4000 rpm selama 8 jam) menyebabkan sel kapang pecah. Dimana pada saat sel pecah terjadi suasana ketidakberaturan sistem sel dan
menyebabkan membran internal terdisintegrasi dan melepaskan enzim-enzim
degeneratif, terutama protease dan glukanase ke matriks sel yang selanjutnya
enzim tersebut bekerja terhadap substrat makromolekul. Komponen sel terlarut
akan masuk dalam sistem substrat yang ditandai dengan kenaikan kandungan
fraksi gurih sebagai asam-asam amino, peptida terlarut dan perubahan
keseluruhan komposisi substrat (Susilowati dkk, 2008).
Proses flavoring yang dilakukan pada suhu 100 ºC dan pH 5,5 selama 3
jam menghasilkan autolisat berflavor analog daging dengan kandungan kimia
yang berbeda dari autolisat sebelum flavoring. Penambahan padatan prekusor
menyebabkan total padatan berubah menjadi 23,14%. Kandungan lemak pada
hasil flavoring turun menjadi 0,59%, penurunan kadar lemak dimungkinkan
karena terurainya lemak menjadi asam-asam lemak yang disebabkan oleh adanya
proses pemanasan.
Pada autolisat hasil proses flavoring, kandungan total protein (33,743%),
protein terlarut (23,5 mg/mL) dan N-amino (5,5 mg/mL) serta intensitas aroma
daging yang sangat kuat (berdasarkan hasil uji intensitas dengan sulfur meaty
sebagai standar). Hal ini mengindikasikan bahwa telah terbentuk
senyawa-senyawa penyusun flavor daging karena adanya proses flavoring.
Reaksi Maillard antara prekusor yang terjadi pada proses Flavoring
membentuk senyawa flavor analog daging seperti senyawa furfural yang berasal
dari hasil reaksi antara xylosa dan cystein. Ketosamin yang terbentuk dari hasil
pengaturan kembali (amadori rearrangement) kehilangan 1 molekul air dan
membentuk 2- furfural, seperti terlihat pada reaksi berikut ini:
34
Hasil degradasi streker Cystein menghasilkan CH3CHO, H2S yang akan saling bereaksi membentuk senyawa flavor yang mengandung sulfur. Seperti pada
reaksi berikut :
Menurut Bailey (1998) reaksi Maillard ini membentuk senyawa yang
didominasi oleh senyawa heterosiklik yang mengandung Nitrogen, sulfur,
oksigen. Senyawa tersebut adalah thiazol, thiophen, pirazin, furan, pirol, imidazol,
piridin dan oksaazol. Pemanasan akan menyebabkan terdegradasinya thiamin
menjadi senyawa nitrogen-sulfur pembentuk flavor analog daging.
N
N NH2 N
S OH
[O]
Thiamin 4
N
S HO
4-metil-5-hidroksietilthiazo
Menurut Susilowati (2009) senyawa penyusun flavor analog daging pada
hasil proses flavoring terdiri dari 4 golongan senyawa, yaitu hidrokarbon,
nitrogen, nitrogen-sulfur dan sulfur. Presentase terbesar senyawa penyusun flavor
analog daging adalah senyawa nitrogen (53,3965%) yang terdiri dari piridin,
pirazin, pirazol, pirimidin, nitrifenil dan benzilamina. Sedangkan senyawa
nitrogen-sulfur (33,4258%) terdiri dari senyawa thiazol.
Kaldu nabati berflavor analog daging hasil dari reaksi flavoring ini
kemudian dimurnikan untuk mendapatkan fraksi analog daging melalui membran
mikrofiltrasi 0,2µm. Crude kaldu, autolisat, penambahan prekusor dan autolisat
berflavor analog daging ditunjukkan pada Gambar 11.
(a) (b)
(c) (d)
Gambar 11. Crude kaldu (A), Autolisat (B), Penambahan prekusor (C) dan Autolisat berflavor analog daging (D).
4.2. Pemurnian Fraksi Analog Daging melalui Membran Mikrofiltrasi
4.2.1. Kandungan Kimia Feed (umpan)
Proses pemurnian dilakukan menggunakan membran mikrofiltrasi 0,2 µm
untuk mendapatkan fraksi analog daging dari kaldu nabati berflavor analog
daging. Feed merupakan autolisat berflavor analog daging yang telah diencerkan
dengan air RO dan telah melalui filtrasi 200 mesh (62 µm). Kandungan total
padatan autolisat sebesar 23,14% akan menyulitkan proses mikrofiltrasi, sehingga
perlu dilakukan pengenceran dengan perbandingan autolisat berflavor analog
daging dan air RO masing-masing adalah 1:3.
Kandungan komponen kimia pada feed adalah sebagai berikut N-amino
6,35%, total protein 32,5%, gula pereduksi 456,25% dan protein terlarut 6,43%.
Setelah dilakukan pengenceran diperoleh kadar total padatan sebesar 6,8%,
dengan kadar total padatan yang lebih kecil, maka akan mempermudah proses
pemurnianan. Meskipun telah melalui tahap pengenceran, berdasarkan hasil uji
intensitas aroma analog daging, aroma daging yang tercium masih kuat.
Proses pemisahan dengan menggunakan membran mikrofiltarsi 0,2 µm
akan menghasilkan permeat dan retentat. Permeat merupakan bagian yang
melewati membran. Sedangkan retentat adalah bagian yang tertahan oleh
membran.
4.2.2. Pengaruh Waktu Proses dan Tekanan Terhadap Kandungan Kimia dan Intensitas Flavor Analog Daging Hasil Proses Pemurnian
4.2.2.1. Total Padatan
Berdasarkan hasil Analisis Variansi (Lampiran 7, Tabel 23) menunjukan
bahwa permeat dan retentat berbeda nyata pada taraf 5% terhadap kadar total
padatan kering. Tetapi tidak menunjukkan adanya pengaruh interaksi antara jenis
hasil perolehan, tekanan dan waktu proses membran terhadap kadar total padatan
kaldu nabati kacang hijau berflavor analog daging yang dihasilkan setelah
dilakukan pemurnian secara mikrofiltrasi.
Hasil analisis uji lanjut Duncan pada taraf 5 % (Lampiran 2, Tabel 24)
memperlihatkan bahwa terdapat perbedaan yang nyata pada nilai rata-rata total
padatan dengan jenis hasil pemurnian yaitu permeat dan retentat. Perbedaan ini
disebabkan oleh sistem mikrofiltrasi yang mampu memisahkan padatan dalam
permeat dan retentat.
Total padatan meliputi semua senyawa yang meliputi protein, lemak,
karbohidrat, vitamin, mineral. Pada tekanan 4 bar, sistem mikrofiltrasi mampu
menahan padatan dalam retentat lebih tinggi dari pada permeat di awal pemurnian
sampai 90 menit pemurnian. Pada 90 menit pemurnian, total padatan retentat
adalah 6,69% dan permeat adalah 5,21%. Begitu pula tekanan 6 bar, pada 90
menit pemurnian total padatan retentat adalah 6,07% dan 4,56% pada permeat.
Seperti ditunjukkan pada Tabel 4. Tingginya nilai total padatan retentat dikedua
tekanan dikarenakan kemampuan sistem mikrofiltrasi 0,2µm yang mampu
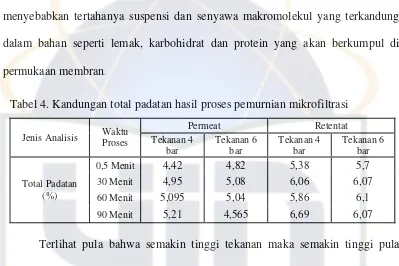
menyebabkan tertahanya suspensi dan senyawa makromolekul yang terkandung
dalam bahan seperti lemak, karbohidrat dan protein yang akan berkumpul di
permukaan membran.
Tabel 4. Kandungan total padatan hasil proses pemurnian mikrofiltrasi
Permeat Retentat Jenis Analisis Waktu
Proses Tekanan 4 bar
Tekanan 6 bar
Tekanan 4 bar
Tekanan 6 bar
0,5 Menit 4,42 4,82 5,38 5,7
30 Menit 4,95 5,08 6,06 6,07
60 Menit 5,095 5,04 5,86 6,1
Total Padatan (%)
90 Menit 5,21 4,565 6,69 6,07
Terlihat pula bahwa semakin tinggi tekanan maka semakin tinggi pula
nilai total padatan, baik pada permeat maupun retentat. Pada tekanan 6 bar lebih
banyak padatan tertahan dari pada 4 bar. Semakin lama waktu pemurnian, total
padatan cenderung semakin meningkat, hal ini sebanding dengan adanya nilai
fluks yang cenderung semakin turun. Penurunan nilai fluks ditunjukan pada
Gambar 12.
110.23
) Fluks (L/m.Jam) tekanan 4 bar Fluks (L/m.Jam) tekanan 6 bar
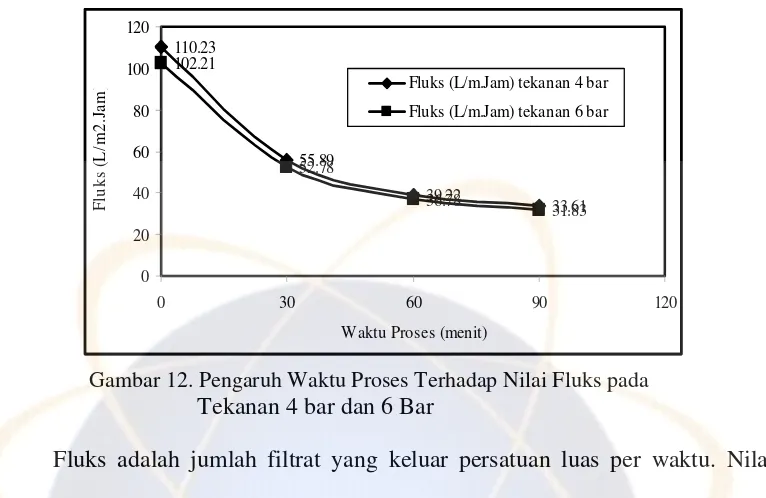
Gambar 12. Pengaruh Waktu Proses Terhadap Nilai Fluks pada Tekanan 4 bar dan 6 Bar
Fluks adalah jumlah filtrat yang keluar persatuan luas per waktu. Nilai
fluks yang semakin menurun disebabkan oleh adanya pemampatan. Pemampatan
dimungkinkan terjadi karena ukuran partikel yang lebih besar dari ukuran pori
membran sehingga membentuk cake dan fluks menjadi semakin menurun
nilainya. Permeat yang terdapat pada bahan akan keluar cepat pada awal proses
dan akan lambat setelah waktu yang lama kemudian menjadi konstan. Penurunan
permeat atau komponen yang lolos membran terlihat dengan menurunnya fluks
yang dihasilkan. Hal ini diduga, pada awal proses pemurnian belum terjadi
fouling, selanjutnya zat-zat yang terkandung pada bahan akan berkumpul
dipermukaan membran dan membentuk lapisan penghalang yang dapat
menghambat aliran bahan menuju membran, sehingga fluks berlangsung lebih
landai.
Penurunan nilai fluks terjadi karena peristiwa fouling pada permukaan dan
dan di dalam pori-pori membran, seperti pegendapan/deposisi partikel-partikel
solute, penyumbatan pori-pori membran oleh partikel-partikel solut dan absorpsi
partikel-partikel solute ke dalam pori-pori lapisan membran, polarisasi konsentrasi
(Moerniati, 2009).
4.2.2.2. Kadar Garam
Hasil perhitungan Analisis Variansi (Lampiran 7, Tabel 26) menunjukkan
bahwa permeat dan retentat berpengaruh nyata pada taraf 5% terhadap kadar
garam kaldu nabati berflavor analog daging. Tetapi tidak menunjukkan adanya
pengaruh nyata pada tekanan dan waktu proses membran serta interaksi antar
perlakuan terhadap kadar garam setelah dilakukan pemurnian secara mikrofiltrasi.
Berdasarkan analisis uji lanjut Duncan pada taraf 5%, diketahui bahwa
terdapat perbedaan yang nyata pada nilai rata-rata kadar garam dengan jenis hasil
proses pemurnian yaitu permeat dan retentat. Perbedaan ini disebabkan oleh
sistem mikrofiltrasi yang mampu memisahkan garam dengan ukuran partikel
0,01µm sehingga akan lolos dalam permeat.
Kadar garam merupakan senyawa yang larut dalam air, analisis kadar
garam dimaksudkan untuk mengetahui tingkat citarasa asin hasil pemurnian.
Fungsi garam itu sendiri adalah untuk mengawetkan dan memberi citarasa asin
pada permeat dan retentat kaldu nabati kacang hijau.
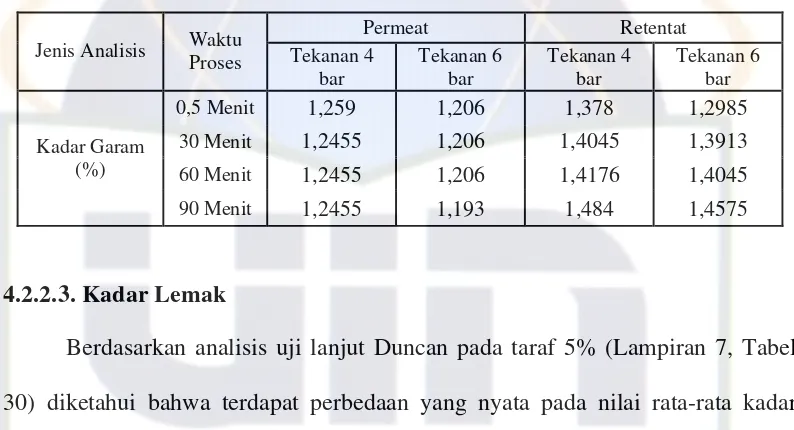
Kadar garam diperoleh lebih tinggi dalam retentat daripada permeat. Hal
ini sebanding dengan nilai total padatan, semakin lama waktu proses pemurnian,
semakin banyak total padatan yang tertahan pada retentat, sehingga menyulitkan
garam untuk lolos di permeat dan banyak tertahan di retentat. Seperti ditunjukkan
pada Tabel 5, bahwa semakin tinggi tekanan semakin banyak kadar garam yang
tertahan pada retentat dan permeat.
Nilai kadar garam pada retentat 6 bar 30 menit, 60 menit dan 90 menit
masing-masing adalah 1,3913%, 1,4045% dan 1,4575%. Sedangkan kandungan
kadar garam pada permeat dengan tekanan dan rentang waktu yang sama
masing-masing adalah 1,206%, 1,206% dan 1,193%. Sedangkan pada tekanan 4 bar,
kandungan garam retentat lebih rendah dari pada retentat di tekanan 6 bar di
rentang waktu yang sama, yaitu 1,4045%, 1,4178% dan 1,484%. Nilai kadar
garam permeat cenderung turun di waktu 90 menit pemurnian.
Tabel 5. Kandungan kadar garam hasil proses pemurnian mikrofiltrasi
Permeat Retentat Jenis Analisis Waktu
Proses Tekanan 4 bar
Tekanan 6 bar
Tekanan 4 bar
Tekanan 6 bar
0,5 Menit 1,259 1,206 1,378 1,2985
30 Menit 1,2455 1,206 1,4045 1,3913
60 Menit 1,2455 1,206 1,4176 1,4045
Kadar Garam (%)
90 Menit 1,2455 1,193 1,484 1,4575
4.2.2.3. Kadar Lemak
Berdasarkan analisis uji lanjut Duncan pada taraf 5% (Lampiran 7, Tabel
30) diketahui bahwa terdapat perbedaan yang nyata pada nilai rata-rata kadar
lemak dengan tekanan proses 4 bar dan 6 bar. Ukuran lemak berkisar antara
1-10µm sehingga sistem mikrofiltrasi dengan ukuran pori-pori 2µm memungkinkan
lemak lebih banyak tertahan di retentat dari pada lolos dalam permeat. Seperti
terlihat pada Tabel 6, lemak banyak tertahan di retentat dari pada di permeat di
kedua tekanan.
Tabel 6. Kandungan kadar lemak hasil proses pemurnian mikrofiltrasi
Permeat Retentat Jenis Analisis Waktu
Proses Tekanan 4
30 Menit 0,576 0,1874 0,8889 0,4514
60 Menit 0,5422 0,4739 0,9755 0,4857
Kadar Lemak (%)
90 Menit 0,615 0,4232 0,808 0,627
Pada tekanan 6 bar, lebih banyak lemak yang tertahan di retentat, begitu
pula di permeat. Kandungan lemak di retentat pada waktu proses 30, 60 dan 90
menit masing-masing adalah 0,4514%, 0,4857% dan 0,6270%, pada permeat di
masing-masing waktu proses adalah 0,1847%, 0,4739% dan 0,4231%. Sedangkan
kandungan lemak retentat 30, 60 dan 90 menit pada tekanan 4 bar masing-masing
adalah 0,8889%, 0,9755% dan 0,8080% dan pada permeat 30, 60 dan 90 menit
adalah 0,576%, 0,5422% dan 0,6150%.
Semakin lama waktu proses pemurnian, kandungan lemak pada permeat
cenderung meningkat di kedua tekanan. Hal ini diduga terdapat pertikel-partikel
lemak berukuran kurang dari 0,2µm yang diperoleh dari proses emulsifikasi
melalui homogenisasi, sehingga lolos dalam permeat dan hanya partikel lemak
berukuran lebih besar dari 0,2 µm yang dapat tertahan pada permukaan membran
(Moerniati, 2009).
4.2.2.4. N-amino
Hasil perhitungan Analisis Variansi (Lampiran 7, Tabel 32) menunjukkan
bahwa faktor tekanan proses dan waktu proses serta interaksi antara keduanya
tidak berpengaruh nyata pada taraf 5 % terhadap kadar n-amino, tetapi jenis hasil
proses pemurnian yakni permeat dan retentat serta interaksi antara jenis hasil
pemurnian dengan waktu proses berpengaruh nyata pada taraf 5% terhadap kadar
N-amino.
Berdasarkan analisis uji lanjut Duncan pada taraf 5% (Lampiran 7, Tabel
34) terdapat perbedaan yang nyata pada nilai rata-rata n-amino pada permeat dan
retentat. Perbedaan ini disebabkan oleh sistem mikrofiltrasi yang mampu
meloloskan n-amino (0,01-0,1µm) dalam permeat.
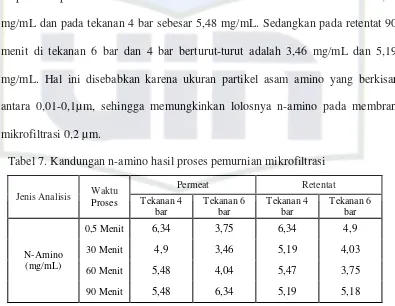
Seperti ditunjukkan pada Tabel 7, pemurnian fraksi analog daging kaldu
nabati kacang hijau berflavor analog daging dengan menggunakan mikrofiltrasi
0,2µm pada tekanan 4 dan 6 bar menghasilkan konsentrasi n-amino yang tertinggi
di permeat pada 90 menit. Konsentrasi n-amino di tekanan 6 bar adalah 6,34
mg/mL dan pada tekanan 4 bar sebesar 5,48 mg/mL. Sedangkan pada retentat 90
menit di tekanan 6 bar dan 4 bar berturut-turut adalah 3,46 mg/mL dan 5,19
mg/mL. Hal ini disebabkan karena ukuran partikel asam amino yang berkisar
antara 0,01-0,1µm, sehingga memungkinkan lolosnya n-amino pada membran
mikrofiltrasi 0,2 µm.
Tabel 7. Kandungan n-amino hasil proses pemurnian mikrofiltrasi
Permeat Retentat Jenis Analisis Waktu
Proses Tekanan 4
Pada tekanan 6 bar selama 90 menit pada permeat mengandung n-amino
sebagai fraksi analog daging tertinggi. Tingginya nilai n-amino sebanding dengan
semakin meningkatnya kandungan senyawa pembentuk flavor analog daging,
senyawa tersebut adalah senyawa-senyawa nitrogen seperti pirazin, pirimidin.
4.2.2.5. Gula Pereduksi
Berdasarkan hasil perhitungan Analisis Variansi (Lampiran 7, Tabel 36)
menunjukan tidak adanya pengaruh interaksi jenis hasil pemurnian, tekanan
membran dan waktu proses pemurnian terhadap kadar gula pereduksi. Demikian
pula dengan masing-masing faktor perlakuan tidak berpengaruh secara nyata pada
taraf 5%.
Gula pereduksi merupakan monosakarida yang mempunyai sifat reduksi
dengan ukuran partikel lebih kecil (0,001µm) dari pada membran (0,2µm)
sehingga akan lolos dalam permeat. Sedangkan gula pada umumnya (disakarida
dan monosakarida) dapat tertahan pada permukaan membran karena berukuran
lebih besar dari 0,2µm (8-20µm) (Anonim, 2005). Meskipun demikian, faktor
kondisi operasi yaitu tekanan dan waktu operasi, kecepatan waktu penggerak dan
suhu operasi serta kemungkinan terbentnya fouling oleh menumpuknya komponen
lain pada permukaan membran, sifat gula yaitu ukuran partikel, sifat kelarutan dan
interaksinya dengan komponen lain dapat berpengaruh terhadap perolehan gula
dalam permeat maupun retentat. Gula merupakan komponen dengan kelarutan
dalam air yang cukup tinggi sehingga kecenderungan untuk lebih mudah larut
sebagai permeat juga cukup besar.
Tabel 8. Kandungan Gula pereduksi hasil proses pemurnian mikrofiltrasi
Permeat Retentat Jenis Analisis Waktu
Proses Tekanan 4
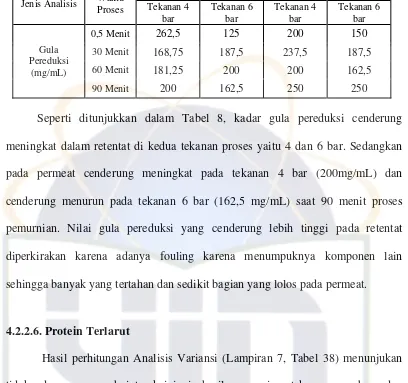
Seperti ditunjukkan dalam Tabel 8, kadar gula pereduksi cenderung
meningkat dalam retentat di kedua tekanan proses yaitu 4 dan 6 bar. Sedangkan
pada permeat cenderung meningkat pada tekanan 4 bar (200mg/mL) dan
cenderung menurun pada tekanan 6 bar (162,5 mg/mL) saat 90 menit proses
pemurnian. Nilai gula pereduksi yang cenderung lebih tinggi pada retentat
diperkirakan karena adanya fouling karena menumpuknya komponen lain
sehingga banyak yang tertahan dan sedikit bagian yang lolos pada permeat.
4.2.2.6. Protein Terlarut
Hasil perhitungan Analisis Variansi (Lampiran 7, Tabel 38) menunjukan
tidak adanya pengaruh interaksi jenis hasil pemurnian, tekanan membran dan
waktu proses pemurnian terhadap protein terlarut. Demikian pula dengan
masing-masing faktor perlakuan tidak berpengaruh secara nyata pada taraf 5%.
Protein terlarut adalah nitrogen dalam protein yang terpecah menjadi
peptida dan asam amino. Peptida terlarut mempunyai kisaran ukuran partikel
antara 0,01-0,1 µm (Beuchat, 1983), sehingga pada membran mikrofiltrasi 0,2µm
akan lolos sebagai permeat. Tabel 9 menunjukkan bahwa kandungan protein
terlarut pada permeat dan retentat terlihat fluktuatif. Pada tekanan 4 bar terlihat
bahwa protein terlarut lebih banyak lolos dalam permeat di 60 menit pemurnian
yaitu 6,63mg/mL dan turun di 90 menit pemurnian menjadi 5,9mg/mL. Pada
retentat, kandungan protein terlarut di 60 menit lebih rendah dari permeat yaitu
5,1 mg/mL dan meningkat di 90 menit menjadi 6,35mg/mL, hal ini disebabkan
telah terjadi fouling di 90 menit pemurnian.
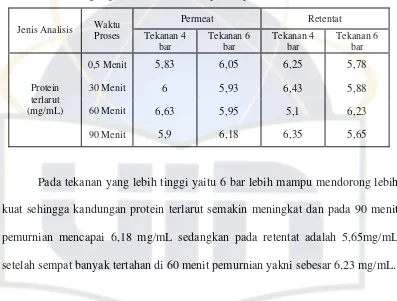
Tabel 9. Kandungan protein terlarut hasil proses pemurnian mikrofiltrasi
Permeat Retentat Jenis Analisis Waktu
Proses Tekanan 4
Pada tekanan yang lebih tinggi yaitu 6 bar lebih mampu mendorong lebih
kuat sehingga kandungan protein terlarut semakin meningkat dan pada 90 menit
pemurnian mencapai 6,18 mg/mL sedangkan pada retentat adalah 5,65mg/mL
setelah sempat banyak tertahan di 60 menit pemurnian yakni sebesar 6,23 mg/mL.
4.2.2.7. Total Protein
Hasil perhitungan Analisis Variansi (Lampiran 7, Tabel 40) menunjukkan
bahwa faktor jenis hasil proses pemurnian (permeat dan retentat) berpengaruh
nyata pada taraf 5% terhadap total protein. Tetapi tidak menunjukkan adanya
pengaruh nyata pada tekanan dan waktu proses membran serta interaksi antar
perlakuan terhadap total protein setelah dilakukan pemurnian secara mikrofiltrasi.