PENGEMBANGAN PLATFORM DIAGNOSTIK
MOLEKULER PENYAKIT MYELOPROLIFERATIVE
NEOPLASMS (MPN) DENGAN PENDEKATAN MULTI
BIOMARKER GENOTYPING
UMMU HABIBAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa Tesis yang berjudul “Pengembangan Platform Diagnostik Molekuler Penyakit Myeloproliferative Neoplasms (MPN) dengan Pendekatan Multi Biomarker Genotyping” adalah karya saya bersama komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
RINGKASAN
UMMU HABIBAH. Pengembangan Platform Diagnostik Penyakit
Myeloproliferative Neoplasms (MPN) dengan pendekatan Multi Biomarker Genotyping. Dibimbing oleh SUHARSONO dan AHMAD RUSDAN HANDOYO UTOMO.
Penyakit Myeloproliferative Neoplasms (MPN) terdiri atas beberapa kelainan darah, diantaranya Chronic Myeloid Leukemia (CML), Polyctyhemia Vera (PV), Essential Thrombocythemia (ET) dan Primary Myelofibrosis (PMF). Kelainan fungsi darah tersebut disebabkan oleh adanya translokasi gen BCR-ABL1 dan mutasi JAK2 V617F. Kelainan genetik tersebut mengakibatkan aktivasi terus-menerus enzim tirosin kinase. Metode deteksi RT-PCR based Reverse Dot Blot Hybridization menyediakan metode yang efektif dalam biaya, waktu dan resiko kerja. PCR konvensional dan direct DNA sequencing digunakan sebagai pembanding terhadap metode RDB.
Hasil uji sensitivitas metode RDB pada 19 sampel BCR-ABL1 yang telah diketahui kuantitasnya melalui PCR kuantitatif membuktikan bahwa RDB mampu memberikan sinyal yang kuat pada BCR-ABL1 dengan kuantitas BCR-ABL1 10%. Pengujian kepada kelompok BCR-ABL1 sebanyak 41 sampel memperoleh hasil yang sama antara metode RDB dan metode deteksi standar. Analisis terhadap JAK2 dengan 29 sampel menunjukkan 97% kesamaan data antara metode RDB dengan metode standar DNA sequencing. Sedangkan pengujian terhadap sampel BCR-ABL1+JAK2 yang berjumlah 8 sampel memperoleh hasil yang sama persis antara metode RDB dengan metode standar RT-PCR elektroforesis gel ( BCR-ABL1) dan DNA sequencing (JAK2).
SUMMARY
UMMU HABIBAH. The Development of Molecular Diagnostic Platform of
Myeloproliferative Neoplasms (MPN) with Multi Biomarker Genotyping. Supervised by SUHARSONO and AHMAD RUSDAN HANDOYO UTOMO.
Myeloproliferative neoplasms consist of various blood disorder, such as: chronic myeloid leukemia (CML), polycythemia vera (PV), essential thrombocythemia (ET) and primary myelofibrosis (PMF). Those kind of MPN are caused by BCR-ABL1 translocation and JAK2 V617F mutation. BCR-ABL1 translocation and JAK2 V617F mutation lead to consitutive activation of tyrosine kinase. RT-PCR based Reverse Dot Blot Hybridization method provided a cost-effective, less time consume and lower risk detection method. In this research RDB method was compared to common qualitative and quantitative PCR and direct DNA sequencing. Sensitivity test of RDB method with known quantity of nineteen BCR-ABL1 samples through standard quantitative PCR method proved that RDB could detect significant signal of BCR-ABL1 copies above 10%.
Fourty-one samples for BCR-ABL1 were proved to be 100% similarity between RDB and standard method. Similarity between RDB method and DNA direct sequencing for JAK2 V617F mutation were 28 of 29 samples, which one of 29 samples found to be Mutan with RDB method meanwhile resulted wild type with direct DNA sequencing. The analysis of eight samples for BCR-ABL1/JAK2 found highly similarity results between RDB method and standard PCR ( BCR-ABL1) and direct DNA sequencing (JAK2).
© Hak Cipta milik IPB, tahun 2016
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusuna laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PENGEMBANGAN PLATFORM DIAGNOSTIK
MOLEKUKER PENYAKIT MYELOPROLIFERATIVE
NEOPLASMS (MPN) DENGAN PENDEKATAN MULTI
BIOMARKER GENOTYPING
UMMU HABIBAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Penelitian : Pengembangan Platform Diagnostik Molekuler Penyakit ...Myeloproliferative Neoplasms (MPN) dengan
...Pendekatan Multi Biomarker Genotyping Nama ..: Ummu Habibah
NRP ..: P051130171
Disetujui oleh
Komisi Pembimbing
Prof Dr Ir Suharsono, DEA Ahmad R. H. Utomo, Ph.D
Ketua Anggota
Diketahui oleh
Ketua Progam Studi Dekan Sekolah Pascasarjana Bioteknologi
Prof Dr Ir Suharsono, DEA Dr Ir Dahrul Syah, MscAgr
PRAKATA
Puji berlimpah syukur penulis ucapkan kehadirat Allah SWT karena atas berkah rahmat dan karunia-Nya penulis dapat menyelesaikan karya ilmiah ini
dengan judul “Pengembangan Platform Diagnostik Molekuler Penyakit Myeloproliferative Neoplasms (MPN) dengan Pendekatan Multi Biomarker Genotyping”. Disertai dengan penulisan jurnal ilmiah dengan judul “Screening of BCR-ABL1 transcript variants and JAK2 V617F in suspected Myeloproliferative Neoplasms (MPN) patients using RT-PCR Reverse Dot-Blot Hybridization
(RDB) Method”.
Ucapan terima kasih penulis sampaikan kepada:
1. Bapak Prof Dr Ir Suharsono, DEA sebagai ketua komisi pembimbing dan Bapak Ahmad Rusdan Handoyo Utomo, Ph. D sebagai anggota komisi pembimbing.
2. Direktorat Jenderal Pendidikan Tinggi yang telah memberikan beasiswa pendidikan, hingga penulis bisa menyelesaikan pendidikan pada program Pascasarjana Bioteknologi IPB.
3. Keluarga besar laboratorium SCI dan Kalbe Genomic, PT Kalbe Farma, Tbk. Yang telah memberikan banyak bantuan demi kelancaran penelitian dan penyelesaian tesis ini.
4. Kedua orang tua dan adik atas doa dan perhatian tidak terbatas kepada penulis. 5. Keluarga besar Bioteknologi IPB angkatan 2013 dengan kebersamaan dan
motivasi ketika sama-sama menyelesaikan studi.
6. Segenap karyawan serta staf administrasi Program Studi Bioteknologi, Sekolah Pascasarjana IPB.
Serta semua pihak yang terlibat dalam dukungan, motivasi dan inspirasi bagi penulis dalam penyelesaian tesis ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 4
Manfaat Penelitian ... 4
Ruang Lingkup Penelitian ... 4
TINJAUAN PUSTAKA ... 5
METODE PENELITIAN ... 11
Waktu dan Tempat Penelitian ... 11
Bahan Penelitian ... 11
Prosedur Kerja ... 11
Immobilisasi Pelacak ... 11
Sintesis cDNA... 12
Amplifikasi cDNA ... 12
Hibridisasi Reverse Dot Blot (RDB) ... 13
Pengurutan DNA... 13
HASIL DAN PEMBAHASAN ... 14
Metode Reverse Dot Blot ... 14
Uji sensitifitas BCR-ABL1 ... 15
Kelompok sampel BCR-ABL1 ... 16
Kelompok sampel JAK2 ... 18
Kelompok Sampel BCR-ABL1+JAK2 ... 21
SIMPULAN DAN SARAN ... 23
KESIMPULAN ... 23
SARAN ... 24
DAFTAR PUSTAKA ... 24
DAFTAR TABEL
Tabel 1 Perbedaan klinis pasien ET ... 8
Tabel 2 Pelacak Oligonukleotida ... 11
Tabel 3 Primer dan pelacak yang digunakan dalam penelitian ini ... 12
Tabel 4 Hasil deteksi sampel JAK2 dengan metode RDB dan metode direct DNA .sequencing ... 19
Tabel 5 Hasil deteksi sampel ganda BCR-ABL1+JAK2 dengan metode RDB dan .metode standar ... 22
DAFTAR GAMBAR
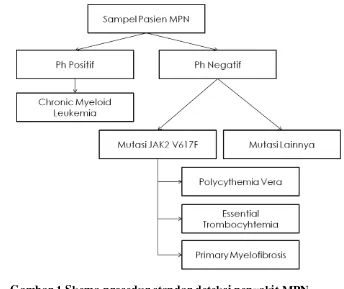
Gambar 1 Skema prosedur standar deteksi penyakit MPN ... 3Gambar 2 Varian transkrip tipe translokasi gen BCR-ABL1 (Burmeister dan Reindhart, 2007)... 6
Gambar 3 Skema jalur signaling BCR-ABL1 (Faderl et al., 1999)... 7
Gambar 4 Contoh skema deteksi penyakit MPN (Tefferi, 2010) ... 9
Gambar 5 Skema oligonukleotida (pelacak) pada membran nilon... 10
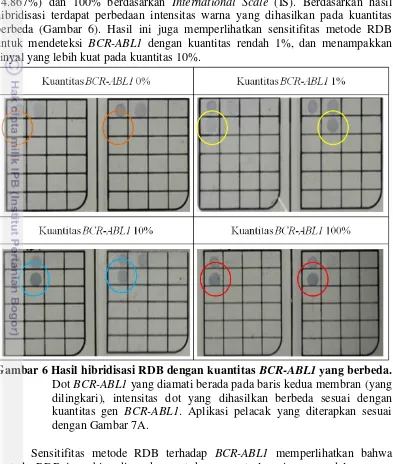
Gambar 6 Hasil hibridisasi RDB dengan kuantitas BCR-ABL1 yang berbeda... 15
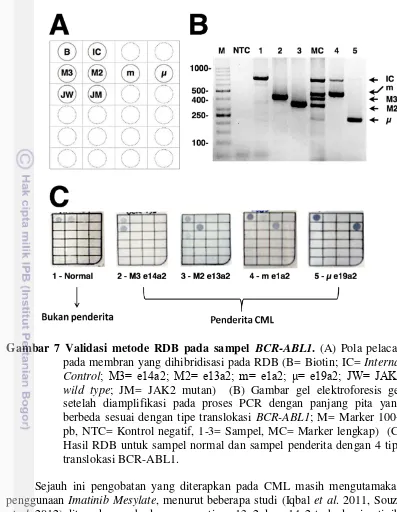
Gambar 7 Validasi metode RDB pada sampel BCR-ABL1 ... 17
Gambar 8 Gambar gel elektroforesis hasil amplifikasi JAK2 ... 19
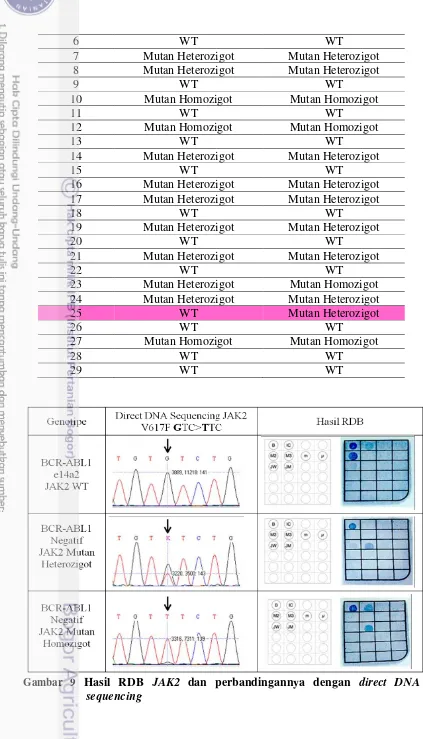
Gambar 9 Hasil RDB JAK2 dan perbandingannya dengan direct DNA sequencing ... 20
1
PENDAHULUAN
Latar BelakangMyeloproliferative Neoplasms atau Myeloproliferative Neoplasias (MPNs) merupakan suatu kelainan stem sel hematopoietik yang berkaitan dengan proliferasi satu atau lebih sel myeloid di sumsum tulang belakang dan meningkatkan jumlah sel dewasa pada sistem darah tepi (Jones et al. 2009). MPNs dikarakterisasi dengan produksi berlebihan sel darah dewasa dan fungsional dalam jangka waktu yang lama (Ma et al. 2009). Myeloproliferative Neoplasma (MPNs) dibagi menjadi delapan kelompok terpisah; chronic myelogeneous leukemia (CML), polycythemia vera (PV), essential thrombocythemia (ET), primary myelofibrosis (PMF), systemic mastocytosis, chronic eosinophilic leukemia, chronic neutrophilic leukemia dan MPN yang tidak diklasifikasi (Tefferi dan Vardiman 2008).
Chronic Myeloid Leukemia merupakan penyakit neoplasma berbahaya pada stem sel hematopoietik yang dikarakterisasi oleh pergantian difusi pada sumsum tulang belakang dan/atau darah tepi oleh sel neoplasma (Prasad et al. 2013). Chronic Myeloid Leukemia (CML) adalah kelainan neoplasma manusia pertama yang diketahui disebabkan oleh aberasi genetik, yaitu oleh kromosom philadelphia (Philadelphia (Ph) Chromosome). Kromosom Ph terbentuk melalui translokasi resiprokal antara gen ABL1 (Abelson 1) dari kromosom 9 dan gen BCR (Breakpoint Cluster Region) dari kromosom 22 yang meningkatkan aktivasi konstitutif tirosin kinase (Järås et al. 2010).
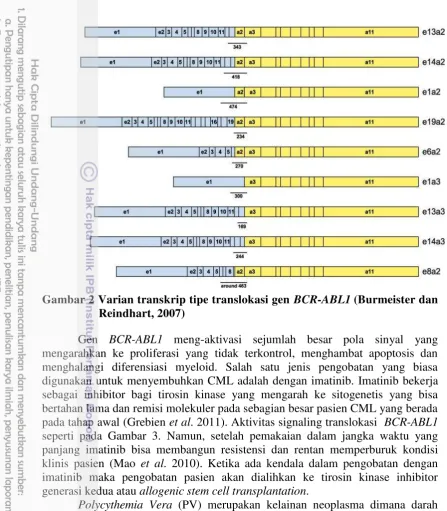
Tipe translokasi BCR-ABL1 terbagi menjadi 4 kelompok utama; Mayor (M-bcr), minor (m-bcr), mikro (μ-bcr) dan nano (n-bcr) (Burmeister dan Reindhart 2007). Fusi major (M-bcr) gen BCR-ABL1 menghasilkan transkrip dengan ukuran 210 kDa dari basa dengan panjang 8,5 kb yang akan mengaktifkan tirosin kinase secara konstitutif dan tidak menghambat diferensiasi tapi meningkatkan proliferasi dan viabilitas sel myeloid dan mengarah kepada perkembangan CML (Iqbal et al. 2011). Produk protein yang dihasilkan oleh gen yang mengalami translokasi relatif lebih tinggi dari protein normal abl tanpa translokasi (Eren 2000). Tirosin kinase terletak di sitoplasma pada membran plasma yang berinteraksi dengan aktin sitoskeletal (Constance et al. 2012). Protein abl normal berpindah antara sitoplasma dan nukleus pada sel yang berproliferasi (Preyer et al. 2011).
Pada penelitian ini 4 tipe translokasi BCR-ABL1 yang diteliti, adalah e13a2, e14a2, e1a2 dan e19a2. Tipe translokasi tersebut dipilih berdasarkan mayoritas tipe translokasi yang ditemukan di Indonesia berdasarkan data Kalbe Genomics Laboratory tahun 2013-2014. Tipe translokasi tersebut juga merupakan frekuensi dominan pada beberapa penelitian lainnya (Goh et al. 2006, Paz-y-Miño et al. 2013, Deb et al. 2014). Tipe e13a2 dan e14a2 merupakan tipe dengan prevalensi paling tinggi pada penderita CML. Selain e13a2 dan e14a2 tersebut tipe e1a2 dan e19a2 merupakan tipe yang banyak dimiliki oleh penderita dibanding tipe translokasi BCR-ABL1 lainnya.
bagi tirosin kinase yang mengarah ke sitogenetis yang bisa bertahan lama dan remisi molekuler pada sebagian besar pasien CML yang berada pada tahap awal (Grebien et al. 2011).
Penyakit lainnya yang termasuk dalam MPNs, yaitu: Polycythemia Vera (PV), Primary Myelofibrosis (PMV) dan Essential Trombocythemia (ET) disebabkan oleh mutasi pada gen Janus Kinase 2 (JAK2) yaitu mutasi V617F (D’Angelo et al. 2014). Polycythemia Vera merupakan kelainan klonal neoplasma stem sel sumsum tulang belakang yang menyebabkan proliferasi berlebihan pada eritroid, myeloid dan pembelahan megakaryosit dan membawa resiko komplikasi trombosit. Sedangkan Essential Thrombocythemia dikarakterisasi dengan trombosit yang bertahan di sistem darah (menjadi sekunder dari penyakit lain). Primary Myelofibrosis merupakan kelainan myeloproliferativ yang dikarakterisasi dengan fibrosis sumsum tulang belakang, splenomegaly, hematopoiesis ekstrameduler dan leucoerythroblastic sistem darah tepi (Provan et al. 2004).
Mutasi gen JAK2 terjadi pada asam amino ke 617 dengan substitusi basa G menjadi basa T. Substitusi tersebut berakibat terhadap perubahan asam amino valin mejadi fenilalanin (Hammond et al. 2007). Kedua asam amino tersebut merupakan asam amino non polar hidrofobik (Steensma 2006). Awal tahun 2005 ditemukan banyak pasien MPN yang disebabkan oleh mutasi gen JAK2 V617F (McLornan et al. 2006).
Optimasi deteksi dan monitoring telah dikembangkan dengan berbagai metode, diantaranya: metode Real Time PCR (Eder et al. 1999). Metode lainnya yang sering digunakan adalah quantitative reverse transcription PCR (RQ-PCR) (Jones et al. 2009). Stock et al. (2006) juga menggunakan quantitative real time PCR (RT-PCR) untuk monitoring pasien CML. Beberapa metode tersebut masih memiliki kekurangan seperti konsumsi waktu, tidak bisa membedakan tipe translokasi dengan perbedaan ukuran basa 10 pb, dan biaya yang relatif mahal (Stock et al. 2006). Metode lainnya yang bisa digunakan untuk deteksi MPN seperti Fluoresence In Situ Hybridization memiliki kekurangan karena memiliki rata-rata false positif mencapai 10% dan tidak berfungsi ketika sel yang membawa kromosom Ph kurang dari 10% (Faderl et al. 1999). Prosedur standar yang digunakan dalam deteksi molekuler penyakit MPN mempunyai alur seperti yang terlihat pada Gambar 1. Secara garis besar, pasien MPN dikelompokkan menjadi pasien positif Ph dan negatif Ph.
Alternatif lain yang bisa digunakan sebagai metode deteksi adalah dengan Reverse Dot Blot (RDB). Metode RDB merupakan metode deteksi untuk beberapa aberasi genetik secara bersamaan dalam satu kali proses dan spesifik, konsumsi waktu yang lebih sedikit, biaya yang lebih murah dan hasil yang akurat. Metode RDB merupakan metode yang telah digunakan dalam mendeteksi beberapa penyakit lain, seperti cystic fibrosis (Dooki et al. 2010) dan β-thalasemia (Lin et al. 2012). Metode RDB digunakan karena lebih murah dalam deteksi mutasi dibanding RT PCR atau sequencing. Metode RDB juga metode dengan resiko kerja lebih rendah karena dalam keadaan yang sudah dioptimasi proses elektroforesis tidak perlu dilakukan, karena tanpa elektroforesis zat berbahaya seperti Ethidium bromida tidak digunakan.
3
(2001) metode RDB sering digunakan dalam diagnosa genotip dengan spektrum mutasi tinggi, medium atau kelainan dengan frekuensi tinggi.
Hibridisasi RDB menerapkan prinsip formasi ikatan amida antara gugus karboksil yang ada pada membran dan amino-linker di ujung 5’ oligonukleotida
(Zhang et al. 1991). Pada prosedur RDB, ekson (atau daerah yang diinginkan lainnya) diamplifikasi dengan Polymerase Chain Reaction (PCR) menggunakan primer oligonukelotida yang dilabel dengan biotin. Amplikon kemudian didenaturasi dan dihibridisasi dengan pelacak DNA spesifik mutan yang kemudian akan saling berikatan. Posisi masing-masing pelacak “dot” sangat
penting untuk untuk validasi genotipe, bahkan kesalahan kecil dalam penilaian spot secara manual bisa menyebabkan identifikasi genotipe yang tidak akurat (Lappin et al. 2001). Pelacak dengan sekuens yang spesifik terhadap mutasi atau translokasi tertentu ditempelkan ke membran. Kemudian sampel produk PCR ditambahkan saat proses hibridisasi, utas DNA yang komplemen akan diikat pada membran.
Tujuan Penelitian
Penelitian ini bertujuan mengembangkan metode RDB sebagai prosedur standar untuk deteksi translokasi BCR-ABL1 dan mutasi JAK2 yang berperan dalam penyakit MPN (CML, PV, ET dan PMF).
Manfaat Penelitian
Hasil penelitian ini dapat digunakan untuk mendeteksi translokasi BCR-ABL1 dan mutasi JAK2 V617F penyebab penyakit MPN dengan cepat, akurat, spesifik dan murah.
Ruang Lingkup Penelitian
5
TINJAUAN PUSTAKA
Myeloproliferatife Neoplasms (MPN) sebelumnya disebut sebagai Myeloproliferative Disorders merupakan klasifikasi gabungan dari klasifikasi sebelumnya yaitu CMPDs (Chronic Myeloproliferative Diseases), MDS (Myelodysplastic syndromes), MDS/MDP dan MCD (Mast Cell Disease). Pada tahun 2008 tiga kelainan tersebut digabung dalam satu kelompok utama MPN yang mencakup 8 kelainan (Tefferi dan Vardiman 2008).
Penyakit Chronic Myeloid Leukemia (CML) secara fisiologis merupakan kelainan darah yang mengganggu fungsi normal sistem hematopoietik (MacLean et al. 2013). Secara umum leukemia diartikan sebagai neoplasma berbahaya pada stem sel hematopoietik yang dikarakterisasi oleh pergantian difusi pada sumsum tulang belakang dan/atau darah tepi oleh sel neoplasias (Prasad et al. 2013). Pengertian biologis pada penyakit CML adalah pengembangan sel progenitor myeloid di berbagai tahap pematangan yang dilepaskan lebih awal ke sistem darah tepi. Perubahan kelainan sel progenitor myeloid dipengaruhi oleh kapasitas proliferatif dan pergantian yang seimbang antara pembaruan diri sel dan diferensiasi (Faderl et al. 1999).
Pada tahun 2006 di Indonesia, penderita Leukemia berada di posisi kelima dari penderita kanker yang terdaftar di berbagai rumah sakit. Posisi pertama yaitu kanker payudara dan setelahnya kanker serviks, kanker hati dan saluran empedu intrahepatik serta limfoma non-Hodgkin (Rendra et al. 2013).
CML merupakan neoplasma manusia pertama yang diketahui berkaitan dengan aberasi genetik (Burmeister dan Reindhart 2007), yaitu kromosom philadelphia (Philadelphia (Ph) Chromosome). Kromosom Ph terbentuk melalui translokasi resiprokal antara gen ABL dari kromosom 9 dan gen BCR dari kromosom 22 yang meningkatkan aktivasi konstitutif tirosin kinase (Sessions 2007, Järås et al. 2010). Translokasi BCR-ABL1 merupakan terjadinya penambahan segmen ujung 3’ gen ABL dari kromosom 9q34 ke bagian ujung 5’
gen BCR 22q11 (Faderl et al. 1999).
Philadelphia chromosome pertama ditemukan oleh Nowell dan Hungerford pada tahun 1960. Translokasi tersebut berakibat pergantian ekson pertama ABL gen tirosin kinase non-reseptor dengan sekuens dari BCR menghasilkan oncoproteinBCR-ABL1chimeric (Jagani et al. 2008).
Gambar 2 Varian transkrip tipe translokasi gen BCR-ABL1 (Burmeister dan Reindhart, 2007)
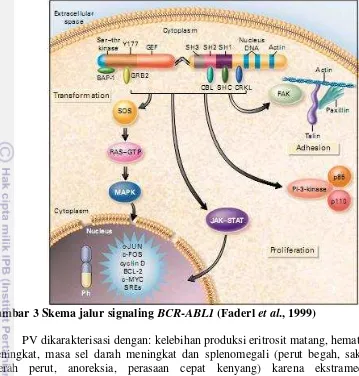
Gen BCR-ABL1 meng-aktivasi sejumlah besar pola sinyal yang mengarahkan ke proliferasi yang tidak terkontrol, menghambat apoptosis dan menghalangi diferensiasi myeloid. Salah satu jenis pengobatan yang biasa digunakan untuk menyembuhkan CML adalah dengan imatinib. Imatinib bekerja sebagai inhibitor bagi tirosin kinase yang mengarah ke sitogenetis yang bisa bertahan lama dan remisi molekuler pada sebagian besar pasien CML yang berada pada tahap awal (Grebien et al. 2011). Aktivitas signaling translokasi BCR-ABL1 seperti pada Gambar 3. Namun, setelah pemakaian dalam jangka waktu yang panjang imatinib bisa membangun resistensi dan rentan memperburuk kondisi klinis pasien (Mao et al. 2010). Ketika ada kendala dalam pengobatan dengan imatinib maka pengobatan pasien akan dialihkan ke tirosin kinase inhibitor generasi kedua atau allogenic stem cell transplantation.
7
Gambar 3 Skema jalur signaling BCR-ABL1 (Faderl et al., 1999)
PV dikarakterisasi dengan: kelebihan produksi eritrosit matang, hematokrit meningkat, masa sel darah meningkat dan splenomegali (perut begah, sakit di daerah perut, anoreksia, perasaan cepat kenyang) karena ekstramedular hematopoiesis. Banyak pasien PV juga memiliki sirkulasi granulosit dan trombosit meningkat. Pasien juga bisa komplikasi karean hemostasis abnormal, termasuk disfungsi trombosit (Zaleskas et al. 2006).
Pasien PV cenderung memiliki JAK2 V617F homozigot, sedangkan pasien ET cenderung memiliki JAK2 V617F heterozigot. Homozigositas V617F berhubungan dengan perubahan ekspresi yang ditandai di gen target downstream. Mutan JAK2 mempengaruhi penampilan dan stabilitas reseptor eritropoietin di permukaan sel dan mengurangi level reseptor trombopoietin di permukaan sel (Campbell dan Green 2006). Peningkatan level mutan JAK2 menyebabkan lebih banyak eritrositosis dan lebih sedikit trombositosis (Cross et al. 2008).
Mutasi gen JAK2 V617F mengenal Loss of Heterozigosity (LOH) yang dikarenakan keberadaan mutasi oleh duplikasi alel mutan melalui rekombinasi mitotik pada lengan pendek kromosom 9 yang menyebabkan homozigot. Homozigositas berakibat durasi penyakit yang lebih lama secara signifikan dan resiko komplikasi lebih tinggi. LOH berkaibat allele burden yaitu signifikansi perbandingan kuantitas mutan dan wild type. Menurut Gonzalez et al. (2009) homozigot JAK2 tidak bisa ditentukan ketika allele burden lebih rendah dari 50% (Gonzalez et al. 2014).
Tabel 1 Perbedaan klinis pasien ET
V617F positif ET V617F negatif ET
Hemoglobin lebih tinggi Trombosit lebih terisolasi Sel darah putih lebih tinggi Splenomegali
Sumsum tulang belakang lebih selular Abnormalitas sitogenetis Resiko lebih tinggi untuk trombosis vena Megakaryosit displasia Transformasi ke PV Hematopoiesis klona Lebih sensitif terhadap hydroxyurea
Gen JAK2 berlokasi di kromosom 9q24, memiliki 25 ekson dan 1132 asam amino (Tefferi 2010). Mutasi V617F dinyatakan oleh pada studi sebelumnya berlokasi di ekson 14 pada gen Janus Kinase 2 (Wu et al. 2014). Protein JAK2 merupakan tirosin kinase non-reseptor yang berkaitan dengan daerah sitoplasma pada beberapa reseptor membran sitokin (Gonzalez et al. 2014). Perubahan asam amino pada kodon 617 menyebabkan protein JAK2 mengaktivasi multiple sinyal downstream yang mempengaruhi transkripsi gen, yang menyebabkan proliferasi sel hematopoietik (Vytrva et al. 2014).
Protein JAK2 merupakan tirosin kinase non-reseptor yang berkaitan dengan daerah sitoplasma pada beberapa reseptor membran sitokin. JAK2 diaktivasi ketika reseptor berikatan ke faktor pertumbuhan hematopoietik, dan berperan sebagai molekul intermediet melewati aktivasi konstitutif jalur yang bergantung pada STAT5-, AKT- dan ERK- (Gonzalez et al. 2014). Perubahan asam amino pada kodon 617 menyebabkan protein JAK2 mengaktivasi multiple sinyal downstream yang mempengaruhi transkripsi gen, yang menyebabkan proliferasi sel hematopoietik (Vytrva et al. 2014).
Gen janus kinase 2 meregulasi tirosin kinase sitoplasma, diperlukan dalam memulai sinyal intraseluler oleh reseptor untuk pembentukan sel darah merah, pembentukan trombosit, interluekin 3, granulocyte stimulating factor (G-CSF) dan granulocyte macrophage colony stimulating factor (GM-CSF). JAK2 berikatan dengan reseptor eritropoitin di retikulum endoplasma dan dibutuhkan juga untuk ekspresi di permukaan sel (Campbell dan Green 2006).
Penyakit MPN digolongkan menjadi Ph positif dan Ph negatif, pada beberapa kasus gejala klinis yang ditimbulkan seringkali meragukan pengklasifikasian penyakit dnegan deteksi genetis akan lebih mudah untuk dibedakan. Metode yang digunakan dalam deteksi genetik penyakit MPNs sangat berperan dalam proses pengobatan. Perbedaan mutasi juga mempengaruhi obat terapi yang akan digunakan dalam pengobatan kanker. Berdasarkan prosedur standar yang biasa digunakan, deteksi MPN memakan waktu lama dan diurutakan berdasarkan aberasi genetik dengan prevalensi tinggi seperti yang diringkas pada Gambar 4.
9
positive serendah mungkin namun tidak bisa menggunakan sampel darah sistem darah tepi (Faderl et al. 1999).
Gambar 4 Contoh skema deteksi penyakit MPN (Tefferi 2010)
RDB merupakan metode berbasis PCR dengan kemampuan untuk screening beberapa mutasi dalam reaksi hibridisasi tunggal. Metode RDB biasanya digunakan untuk mendeteksi penyakit dengan spektrum mutasi tinggi. Pada RDB, ekson (atau daerah yang diteliti lainnya) diamplifikasi dengan Polymerase Chain Reaction (PCR) menggunakan primer oligonukleotida yang dilabel. Label yang sering digunakan adalah biotin, karena diketahui biotin tidak mempengaruhi integritas reaksi amplifikasi. Amplikon (produk yang telah diamplifikasi) kemudian didenaturasi dan dihibridisasi dengan oligonukleotida pelacak DNA spesifik. Setelah proses hibridisasi dan pencucian, asam nukleat diinkubasi dengan enzim yang dikonjugasikan ke streptavidin. Kompleks streptavidin-biotin-asam nukleat kemudian dicuci dan diinkubasi dengan substrat kromogenik atau luminogeni yang akan memvisualisasikan spot yang telah berhibridasasi (Lappin et al. 2001).
Metode RDB menggunakan prinsip formasi ikatan amida antara gugus karboksil pada membran dengan amino-linker dari ujung 5’ oligonukleotida
produk PCR. Membran biodyne C dipilih sebagai media hibridisasi karena mudah dan tahan lama, juga karena memiliki kelompok karboksil anionik tinggi. Komposisi anion berkontribusi dalam pengurangan ikatan non-spesifik dikarenakan interaksi elektrostatis antara asam nukleat di oligonukleotida dengan membran (Zhang et al. 1991).
RDB mempunyai kelebihan karena tidak menggunakan pelacak dengan label radioaktif seperti pada Allele Specific Oligonucleotide dan penggunaan kontrol positif untuk menunjukkan fungsional yang tepat dari reaksi PCR pada masing-masing tube seperti pada ARMS (Dooki et al. 2010).
Proses pelacakan sekuens DNA sasaran dengan metode RDB disajikan pada gambar 5. DNA pelacak yang sudah diikat dengan amino modifier C6 dan internal spacer 18 diimobilisasi ke membran. DNA yang dilacak didicampurkan ke membran sehingga terjadi proses hibridisasi antara DNA pelacak dan DNA yang dilacak dengan prinsip komplementasi.
Gambar 5 .Skema oligonukleotida (pelacak) pada membran nilon. (a) a-n
merupakan masing-masing sekuens pelacak spesifik dengan translokasi dan mutasi yang diteliti ditambahkan ke membran saat proses immobilisasi pelacak. (b) Hasil yang diperoleh setelah proses hibridisasi, dot berwarna berarti sampel yang mempunyai sekuens yang identik dengan pelacak, sedangkan pada kolom yang tidak terdapat dot berarti sampel tidak mempunyai sekuens yang spesifik dengan pelacak.
11
METODE PENELITIAN
Waktu dan Tempat PenelitianPenelitian ini dilaksanakan pada bulan September 2014 – September 2015 di Laboratorium Stem Cell and Cancer Institute, Jakarta.
Bahan Penelitian
RNA dari 78 pasien dengan kelainan darah yang terdapat di Laboratorium KalGen Service digunakan untuk validasi metode RDB. Pelacak untuk RDB berupa oligonukleotida yang diikat dengan amino modifier C6 dan internal spacer 18 (Tabel 2). Primer untuk amplifikasi cDNA disajikan pada Tabel 3.
Prosedur Kerja Immobilisasi Pelacak
Satu membran (2x2.5cm) untuk satu sampel dengan perlakuan yang sama. Membran dicuci dengan HCl 0.1 N, kemudian diinkubasi dengan EDC {1-Ethyl-3-(-Dimethylamino propyl) Carboiimide hydrochloride} 10% selama 15 menit sambil digoyang pada kecepatan 60 rpm. Membran dicuci dengan ddH2O sebanyak dua kali. Setelah membran dikeringkan di suhu ruangan, masing-masing pelacak dengan konsentrasi 2 µM (dilarutkan di NaHCO3 0.5 M) diteteskan dengan mikropipet pada masing-masing kotak di membran dan diinkubasi selama 15 menit. Membran dibiarkan pada larutan TBS (Tris Buffered Saline) 0.1% Tween selama 2 menit sambil digoyang pada kecepatan 60 rpm, kemudian membran dipindahkan ke larutan NaOH 0.1 N selama 10 menit sambil digoyang selama 10 menit pada kecepatan 60 rpm. Membran dicuci dengan ddH2O sebanyak dua kali dan kemudian dikeringkan pada suhu ruangan. Sekuens pelacak dirancang spesifik bagi masing-masing translokasi dan mutasi. Konsentrasi pelacak untuk setiap dot (Biotin, IC, translokasi BCR-ABL1 dan mutasi JAK2) adalah 2 μM.
Tabel 2 Pelacak Oligonukleotida
Name Location, 5'-3'
position (size, nt) Sequence Modification
e13a2 BCR-ABL1(21) , 287-307 5'- GAAGGGCTTCTTCCTTATTGA-3' 5'Amino Modifier C6,Int Spacer 18/Sequence
e1a2 BCR-ABL1(20) , 446-465 5'- TGAAGGGCTTCTGCGTCTCC-3' 5'Amino Modifier C6,Int Spacer 18/Sequence
e19a2 BCR-ABL1(21) , 827-847 5'- GCTGAAGGGCTTTGACGTCGA-3' 5'Amino Modifier C6,Int Spacer 18/Sequence
JAK2wt JAK2, 2336-2353 (18) 5'- TCTCCACAGACACATACT-3'
5'Amino Modifier C6,Int Spacer
18/Sequence
JAK2m JAK2, 2336-2355 (20) 5'- TCTCCACAGAAACATACTCC-3'
5'Amino Modifier C6,Int Spacer
Sintesis cDNA
RNA yang telah diisolasi dikonversi ke cDNA dengan enzim reverse trankriptase dan primer random hexamer. Proses konversi menggunakan Transcriptor First Strand cDNA Synthesize (Roche).
Amplifikasi cDNA
Amplifikasi BCR-ABL1 menggunakan metode PCR multiplex dengan 6 primer biotin (Tabel 1) dalam satu reaksi berdasarkan Burmeister dan Reindhart (2008). Reaksi PCR terdiri atas; 1 µL cDNA, 1x PCR buffer, 6 utas primer (Table 1), 0.2 mM dNTP, 1.25 U/mL HotStar Taq Polymerase (Qiagen). PCR dijalankan berdasarkan kondisi siklus; pre-denaturasi pada 950C selama 15 menit, 40 siklus 950C selama 10 detik, 630C selama 20 detik dan 720C selama 30 detik, untuk ekstensi akhir pada 720C selama 15 detik. Untuk masing-masing proses PCR digunakan cell line K562 sebagai kontrol positif, NTC (no template control) digunakan untuk kontrol kontaminasi. Amplifikasi JAK2 V617F menggunakan primer yang didesain oleh Gonzalez et al. (2014). Reaksi PCR terdiri atas: 1 µL cDNA, 1x PCR buffer, 0.25 μM primer, 0.2 mM dNTP, 3.5 mM MgCl2, dan 1.25 U/mL HotStar Taq Polymerase (Qiagen). PCR dijalankan berdasarkan Gonzalez et al. (2014) yaitu; pre-denaturasi pada 950C selama 15 menit, 50 siklus: 950C selama 5 detik, 580C selama 3 detik, 720C selama 20 detik, tahap akhir pada 750C selama 1 detik. Setiap primer dimodifikasi dengan pelabelan biotin. Biotin berperan dalam proses hibridisasi reverse dot blot.
Produk PCR sebanyak 5 µL ditambahkan dengan 1 µL loading dye diimigrasikan pada gel agarose dengan konsentrasi 2.5% selama 60 menit pada 95 volt. Gambar gel difoto dengan gel documentation.
Tabel 3 Primer dan pelacak yang digunakan dalam penelitian ini
Name
Location, 5'-3' position (size,
nt)
Sequence Modification
ABL-3AS ABL, 454-484 (29) 5'- CCATTGTGATTATAGCCTAAGACCCGGAG-3'
5' biotinylated, HPLC-purified
BCR-1S BCR, 1502-1524 (23) 5'- CTCCAGCGAGGAGGACTTCTCCT-3' HPLC-purified 5' biotinylated,
BCR-6S BCR, 2351-2378 (28) 5'- CCTGAGAGCCAGAAGCAACAAAGATGCC-3'
5' biotinylated, HPLC-purified
BCR-12S BCR, 3064-3088 (25) 5'- AGAACATCCGGGAGCAGCAGAAGAA-3' HPLC-purified 5' biotinylated,
BCR-19S BCR, 3788-3809 (22) 5'- ACTGAAGGCAGCCTTCGACGTC-3' HPLC-purified 5' biotinylated,
BCR-RAS BCR, 3766-3788 (23) 5'- ATGTCCGTGGCCACACCGGACAC-3' HPLC-purified 5' biotinylated,
JAK2(F)2 JAK2, 92281-92308 (28)
5'-
ATTTTTAAAGGCGTACGAAGAGAAGTAG-3' 5' biotinylated
13
Hibridisasi Reverse Dot Blot (RDB)
Proses hibridisasi dikembangkan oleh KalGen DNA beserta reagent-reagent yang dibutuhkan. Proses RDB terdiri atas dua proses utama: hibridisasi dan deteksi warna. Proses hibridisasi dimulai dengan denaturasi produk PCR pada suhu 950C selama 5 menit, kemudian didinginkan di es selama 2 menit. Pada masing-masing ruang (2x2 cm) di chamber hibridisasi dimasukkan 500 µL larutan hibridisasi dan didiamkan selama 2 menit. Produk PCR (cDNA pasien) yang telah didenaturasi dicampurkan dengan 500 µL larutan hibridisasi (Sodium Dodecyl Sulfat/SDS) kemudian dimasukkan ke masing-masing ruang hibridisasi dan diinkubasi selama 15 menit pada suhu 450C. Larutan sebelumnya dibuang kemudian diganti dengan larutan post-hibridisasi sebanyak 800 µL, proses yang sama diulang 2 kali. Proses selanjutnya merupakan deteksi warna yang dimulai dengan penurunan suhu sampai 250C. Membran dicuci dengan 500 µL blocking solution, larutan sebelumnya dikeluarkan kemudian ditambahkan lagi 500 µL dan diinkubasi selama 5 menit. Larutan kemudian diganti dengan larutan enzyme-conjugate (Streptavidin) sebanyak 500 µL dan diinkubasi selama 3 menit. Suhu dinaikkan menjadi 360C, wash solution I ditambahkan sebanyak 800 µL dan diulang sebanyak dua kali. Substrate solution ditambahkan 500 µL dan diinkubasi selama 3-6 menit sambil ditutup (mencegah cahaya masuk). Larutan diganti dengan wash solution II sebanyak 1000 µL dan diulang sebanyak 3 kali. Membran dikeringkan dan dianalisis.
Pengurutan DNA
Pengurutan DNA (Sequencing) dilakukan terhadap pasienn yang mengalami mutasi JAK2 untuk konfirmasi keakuratan proses RDB. Proses sekuensing menggunakan 3500 Sequence Analayzer (Applied Biosystems).
HASIL DAN PEMBAHASAN
Translokasi gen BCR dari kromosom 22 dan gen ABL dari kromosom 9 membentuk gen baru. Gen ini menghasilkan aktifitas tirosin kinase yang tinggi sehingga mengakibatkan proliferasi sel (Buyukasik et al. 2010). Gen BCR memiliki beberapa situs breakpoint, sehingga pembentukan translokasi bisa terjadi pada breakpoint yang berbeda dan mengakibatkan variasi translokasi gen (major, minor, mikro dan nano) (Sessions 2007). Translokasi BCR-ABL1 menghasil protein khimera p210 oleh translokasi major, sedangkan translokasi minor menghasilkan protein yang lebih pendek p190 dan translokasi nano menghasilkan protein p230 (Deininger et al. 2000).
Gen JAK2 V617F berperan dalam regulasi fungsi hematopoitik. Mutasi gen JAK2 V617F mengakibatkan proliferasi sel yang tidak terkontrol dan produksi karakteristik klinis MPN. Sedangkan translokasi gen BCR-ABL1 mengakibatkan ketidak-seimbangan pembagian sel, differensiasi dan apoptosis sehingga mengakibatkan CML (Carranza et al. 2014).
Metode Reverse Dot Blot
Prinsip kerja metode RDB merupakan hibridisasi antara dua utas DNA, satu utas ada pada pelacak yang ada pada membran dan satu utas ada pada produk PCR sampel. Utas yang komplemen akan mengikat utas sampel pada membran, sehingga ketika diberi substrat biotin yang sudah berikatan dengan enzim dan konjugat akan bereaksi dengan menghasilkan warna. Melalui penelitian ini metode RDB dikembangkan untuk menguji keberadaan gen BCR-ABL1 dan mutasi JAK2 V617F pada pasien yang diduga menderita MPN. Prinsip kerja reverse dot blot dikembangkan berdasarkan metode Zhang et al. (1991). Pelacak yang diimobilisasikan di membran dimodifikasi dengan penambahan ammino modifier C6 dan internal spacer 18. Primer yang digunakan untuk amplifikasi dilabel dengan bitotin yang akan berinteraksi dengan konjugat dan enzim alkalin fosfatase saat penambahan substrat pada proses deteksi warna dalam RDB. Membran yang digunakan harus memiliki densitas kelompok karboksil anionik yang tinggi untuk bereaksi dengan oligonukleotida dengan amino yang dimodifikasi. Membran biodyne C memiliki kemampuan gugus karboksil yang bisa bereaksi dengan amino-linker oligonukleotida melalui aktifasi EDC (Zhang et al. 1991).
Metode RT-PCR based hybridization Reverse Dot Blot dikembangakan dengan tujuan sebuah metode standar untuk deteksi BCR-ABL1 dan JAK2 yang lebih hemat dalam hal waktu, biaya dan resiko kerja. Dengan pengembangan metode RDB nantinya proses yang membahayakan seperti penggunakan Ethidium bromide yang bersifat karsinogenik bisa dihilangkan.
Pengujian spesifisitas dan sensitifitas metode PCR-based Reverse Dot Blot Hybridization menggunakan sampel yang dibagi menjadi 3 kelompok; kelompok BCR-ABL1, kelompok JAK2 dan kelompok BCR-ABL1+JAK2. Kelompok BCR-ABL1+JAK2 dimaksudkan agar memudahkan deteksi nantinya dengan dua gen sekaligus yang diperoleh dalam satu kali proses. Setelah melalui proses RDB kedua gen tersebut terbukti tidak saling komplementer.
15
Uji sensitifitas BCR-ABL1
Uji sensitifitas dilakukan dengan melakukan hibridisasi pada sampel dengan kuantitas BCR-ABL1 yang berbeda. Hal ini bertujuan untuk mengamati secara langsung mengenai perbedaan ketebalan warna dot yang dihasilkan pada kuantitas gen BCR-ABL1 berbeda. Percobaan dilakukan dengan kuantitas gen BCR-ABL1 0% (rentang 0-0.096%), 1% (rentang 1.125-1.751%), 10% (rentang 11.652-14.867%) dan 100% berdasarkan International Scale (IS). Berdasarkan hasil hibridisasi terdapat perbedaan intensitas warna yang dihasilkan pada kuantitas berbeda (Gambar 6). Hasil ini juga memperlihatkan sensitifitas metode RDB untuk mendeteksi BCR-ABL1 dengan kuantitas rendah 1%, dan menampakkan sinyal yang lebih kuat pada kuantitas 10%.
Gambar 6 Hasil hibridisasi RDB dengan kuantitas BCR-ABL1 yang berbeda.
Dot BCR-ABL1 yang diamati berada pada baris kedua membran (yang dilingkari), intensitas dot yang dihasilkan berbeda sesuai dengan kuantitas gen BCR-ABL1. Aplikasi pelacak yang diterapkan sesuai dengan Gambar 7A.
Hasil uji sensitifitas metode RDB menjadi salah satu bukti keunggulan metode RDB dibanding metode lainnya, dengan sensitif pada kuantitas 1%. Perubahan intensitas warna dot bisa dipengaruhi oleh konsentrasi pelacak pada membran, konsentrasi DNA sampel, konsentrasi reagent yang dipakai saat hibridisasi RDB terutama konsentrasi substrat dan enzim. Konstanitas konsentrasi setiap komponen perlu dipertahankan agar tidak terjadi kesalahan dalam penilaian hasil hibridisasi.
Kelompok sampel BCR-ABL1
Analisis terhadap empat puluh satu sampel BCR-ABL1 memperoleh hasil: lima sampel negatif BCR-ABL1, delapan belas sampel memiliki varian transkrip e13a2, tiga belas sampel merupakan tipe e14a2, tiga sampel merupakan tipe e19a2 dan dua sampel termasuk e1a2.
Pita hasil amplifikasi dengan ukuran berbeda mewakili tipe translokasi berbeda, merupakan hasil dari metode multiplex PCR (Gambar 7B). Setiap sampel yang positif memiliki translokasi BCR-ABL1 memiliki dua pita, satu pita untuk kontrol internal dan pita lainnya dengan ukuran lebih kecil untuk tipe translokasi. Pita kontrol internal berukuran 718 pb, untuk tipe e13a2 dengan ukuran 343 pb, e14a2 dengan ukuran 418 pb, e1a2 dengan ukuran 474 pb dan e19a2 dengan ukuran 234 pb. Internal kontrol berada pada gen BCR di kromosom 22. Sampel wild type hanya memiliki satu pita internal kontrol.
Kontrol untuk amplifikasi gen BCR-ABL1 adalah HL60 untuk kontrol negatif, dan cell line K562 untuk kontrol positif BCR-ABL1 dengan tipe translokasi major bcr.
Penelitian ini juga menggunakan PCR dan elektroforesis gel BCR-ABL1 sebagai konfirmasi hasil. Setelah diamplifikasi dengan multiplex PCR hasil elektroforesis gel akan memperlihatkan pita dengan ukuran yang berbeda sesuai dengan tipe translokasi berdasarkan pengembangan multiplex PCR oleh Burmeister dan Reindhart (2008). Namun, proses PCR dan elektroforesis gel tersebut meragukan ketika diperoleh pita yang ukurannya tidak jauh berbeda satu sama lain. Sehingga jarak antara pita sampel dan pita kontrol tidak terlalu jauh untuk bisa dibedakan secara mutlak. Karena itu, metode RDB merupakan metode yang lebih baik karena memiliki perbedaan pelacak pada setiap tipe translokasi BCR-ABL1.
Pelacak yang mewakili masing-masing translokasi BCR-ABL1 dan mutasi JAK2 V617F disusun seperti pada Gambar 7A. Secara umum pada masing-masing membran terdapat 3 dot (Gambar 7C); satu dot mewakili biotin sebagai pembuktian bahwa terjadi proses hibridisasi pada membran tersebut, satu dot mewakili tipe translokasi BCR-ABL1, dan satu dot mewakili mutasi JAK2 V617F (mutan atau wild type).
17
Gambar 7 Validasi metode RDB pada sampel BCR-ABL1. (A) Pola pelacak
pada membran yang dihibridisasi pada RDB (B= Biotin; IC= Internal Control; M3= e14a2; M2= e13a2; m= e1a2; μ= e19a2; JW= JAK2 wild type; JM= JAK2 mutan) (B) Gambar gel elektroforesis gel setelah diamplifikasi pada proses PCR dengan panjang pita yang berbeda sesuai dengan tipe translokasi BCR-ABL1; M= Marker 100+ pb, NTC= Kontrol negatif, 1-3= Sampel, MC= Marker lengkap) (C) Hasil RDB untuk sampel normal dan sampel penderita dengan 4 tipe translokasi BCR-ABL1.
beberapa penelitian ditemukan bahwa pasien yang memiliki varian e14a2 memiliki platelet yang lebih tinggi dibanding varian e13a2. Sedangkan pada parameter klinis lainnya belum ditemukan perbedaan berdasarkan varian translokasi yang signifikan.
Tipe selain e13a2, e14a2, e19a2 masih ditemukan dengan frekuensi yang rendah. Souza et al. (2012) menyatakan frekuensi e1a2 sebanyak 1% pada pasien CML di Brazil, sedangkan Goh et al. (2006) juga menemukan pasien dengan translokasi selain tipe major dengan frekuensi rendah. Beberapa varian translokasi yang ditemukan pada pasien CML di Korea diantaranya: b1a1, b2a3 dan e1a3 (Goh et al. 2006).
Tirosin kinase inhibitor yang digunakan dalam pengobatan pasien berbeda tergantung gejala klinis yang dimiliki oleh pasien tersebut. Imatinib mesylate memang menjadi pengobatan utama, tapi pada beberapa kasus pengobatan dialihkan ke tirosin kinase inhibitor generasi kedua, seperti: dasatinib, nilotinib, ponatinib dan lainnya. Dikarenakan tujuan penggunaan imatinib dan hasil pengobatan tidak sesuai dengan yang diharapkan.
Kasus lain yang juga ditemukan pada pasien CML adalah hadirnya dua tipe translokasi BCR-ABL1 pada satu pasien yang sama. Hal ini juga dikemukakan pada beberapa studi CML lainnya, Rosas-Cabral et al. (2003) menemukan 13 pasien (13%) dengan transkrip ganda e13a2+e14a2 sedangkan Lucas et al. (2009) menemukan 3 pasien (3.85%) yang memiliki e13a2+e14a2 dan 1 pasien (1.28%) dengan kehadiran e14a2+e1a2. Sejauh ini tidak ditemukan perbedaan dalam hal pengobatan maupun data klinis bagi pasien dengan transkrip ganda.
Kelompok sampel JAK2
19
Gambar 8 Gambar gel elektroforesis hasil amplifikasi gen JAK2.
Amplifikasi JAK2 menghasilkan basa dengan ukuran 371 pb, baik mutan maupun wild type. a dan b merupakan kontrol mutan dan wild type dari utas JAK2 sintetis.
Hasil amplifikasi gen JAK2 V617F 371 pb kemudian dilakukan uji lanjutan dengan metode RDB (Gambar 9) dengan posisi pelacak seperti pada Gambar 9. Dot yang mucul mewakili pelacak yang sesuai dengan posisi pelacak yang diperlakukan sebelumnya, untuk membuktikan validitas metode ini dilakukan proses sekuensing (Gambar 9). Mutasi JAK2 V617F hadir pada sebagian besar penderita penyakit PV, namun tidak ada obat spesifik yang biasa digunakan dalam pengobatan PV. Phlebotomy, chlorambucil, hydroxyurea, interferon alfa dan imatinib merupakan beberapa obat yang biasa digunakan bagi penderita PV (Goodyear 2011). Begitu juga dengan ET dan PMF tidak ada obat spesifik yang digunakan bagi pasien seperti halnya penyakit CML.
Tabel 4 Hasil deteksi sampel JAK2 dengan metode RDB dan metode direct
DNA sequencing
Pasien Hasil direct DNA
sequencing Hasil RDB
1 Mutan Heterozigot Mutan Heterozigot 2 Mutan Heterozigot Mutan Heterozigot
3 WT WT
4 Mutan Heterozigot Mutan Heterozigot
5 Mutan Heterozigot Mutan Homozigot
M NTC a b c d e f g
1000 bp
500 bp
300 bp
6 WT WT
7 Mutan Heterozigot Mutan Heterozigot 8 Mutan Heterozigot Mutan Heterozigot
9 WT WT
10 Mutan Homozigot Mutan Homozigot
11 WT WT
12 Mutan Homozigot Mutan Homozigot
13 WT WT
14 Mutan Heterozigot Mutan Heterozigot
15 WT WT
16 Mutan Heterozigot Mutan Heterozigot 17 Mutan Heterozigot Mutan Heterozigot
18 WT WT
19 Mutan Heterozigot Mutan Heterozigot
20 WT WT
21 Mutan Heterozigot Mutan Heterozigot
22 WT WT
23 Mutan Heterozigot Mutan Homozigot 24 Mutan Heterozigot Mutan Heterozigot
25 WT Mutan Heterozigot
26 WT WT
27 Mutan Homozigot Mutan Homozigot
28 WT WT
29 WT WT
Gambar 9 Hasil RDB JAK2 dan perbandingannya dengan direct DNA
21
Hasil RDB JAK2 dikonfirmasi dengan metode sekuensing. Berdasarkan perbandingan hasil kedua metode diperoleh hasil yang sama untuk hampir semua sampel yang diujikan. Kecuali pada salah satu sampel dimana berdasarkan hasil direct DNA sequencing diperoleh hasil wild type sedangkan berdasarkan proses RDB diperoleh hasil mutan heterozigot. Hal ini bisa disebabkan oleh kesalahan dalam pembacaan sequencing karena noise level atau sinyal berlebihan pada proses hibridisasi reverse dot blot.
Metode direct DNA sequencing diketahui bisa mendeteksi mutan dalam kuantitas 25% (Jancik et al. 2012). Namun, sensitifitas metode RDB untuk deteksi gen JAK2 juga belum diketahui. Satu sampel dengan hasil yang berbeda antara kedua metode mempunyai kelemahan karena tidak ada akses ke data klinis pasien. Jadi tidak bisa ditentukan hipotesis yang lebih tepat untuk pasien tersebut yang mengacu pada data klinis pasien. Sehingga, untuk pasien #25 tersebut diputuskan memiliki mutasi gen JAK2 V617F. Karena RDB diketahui lebih sensitif dibanding sequencing.
Kelompok Sampel BCR-ABL1+JAK2
Kejadian tidak biasa dalam proses pengobatan pasien kadang terjadi seperti tidak ada pengaruh pengobatan terhadap pasien, hal ini bisa disebabkan oleh juga hadirnya mutasi lain pada pasien salah satunya mutasi JAK2 V617F. Beberapa kasus telah dikemukakan hal serupa (Tabassum et al. 2013, Carranza et al. 2014, Hassan et al. 2015) namun memiliki frekuensi yang rendah. Pada beberapa kasus tersebut ditemukan resistensi terhadap imatinib pada pasien. Kehadiran mutasi ini bisa terjadi sebelum pengobatan (Hassan et al. 2015) atau setelah pengobatan dengan hydroxyurea (Ursuleac et al. 2013). Menurut Cambier et al. (2008) BCR-ABL1 dan JAK2 V617F bisa hadir secara bersamaan pada sel hematopoetik pada pasien yang sama dari awal. Setelah diterapi dengan imatinib BCR-ABL1 mampu dikurangi namun mutasi JAK2 V617F tetap bertahan (Cambier et al. 2008).
Gambar 10 Gambar membran hasil RDB dengan deteksi BCR-ABL1+JAK2 sekaligus
Co-existence antara kedua gen masih memiliki persentase yang rendah pada penelitian sebelumnya (Tabassum et al. 2013, Carranza et al. 2014, Hassan et al. 2015). Tetapi kehadiran gen BCR-ABL1 dan mutasi JAK2 V617F memiliki pengaruh terhadap pengobatan pasien. Pada beberapa kasus menyebabkan resistensi terhadap tirosin kinase inhibitor yang digunakan sebagai terapi target pasien, sehingga pengobatan harus dialihkan ke inhibitor lainnya ketika gejala klinis tidak menunjukkan penyembuhan.
Penelitian mengenai kehadiran dua aberasi gen pada pasien yang sama memperlihatkan berbagai data yang berbeda yang tidak persis sama hasilnya. Namun bisa berpengaruh pada pengobatan, sehingga mengharuskan pengalihan pengobatan ke alternatif lainnya. Pengaruh keberadaan mutasi lain seperti JAK2 dan mutasi lainnya juga tidak memperlihatkan hasil yang signifikan dan konstan pada kondisi klinis pasien.
Tabel 5 Hasil deteksi sampel ganda BCR-ABL1+JAK2 dengan metode RDB
dan metode standar
Pasien BCR-ABL1elektroforesis gel dengan
JAK2 V617F dengan direct DNA sequencing
BCR-ABL1+JAK2 dengan RDB
1 Tidak Terdeteksi Mutan Homozigot
BCR-ABL1 Tidak Terdeteksi, JAK2 Mutan Homozigot
2 Tidak Terdeteksi Wild Type BCR-ABL1Terdeteksi, Tidak JAK2 Wild Type
23
JAK2 Wild Type
4 Tidak Terdeteksi Mutan Heterozigot BCR-ABL1Terdeteksi, Tidak JAK2 Mutan Heterozigot
5 e14a2 Wild Type BCR-ABL1 e14a2,
JAK2 Wild Type
6 e13a2 Mutan Homozigot
BCR-ABL1 e13a2,
JAK2 Mutan
Homozigot
7 e13a2 Wild Type BCR-ABL1 e13a2,
JAK2 Wild Type
8 Tidak Terdeteksi Mutan Heterozigot BCR-ABL1Terdeteksi, Tidak JAK2 Mutan Heterozigot
SIMPULAN DAN SARAN
KESIMPULAN
1. Metode PCR-based Reverse Dot Blot berhasil dikembangkan sebagai metode yang lebih tepat untuk mendeteksi translokasi BCR-ABL1 dan mutasi JAK2 V617F pada pasien penderita MPN
2. Empat tipe translokasi BCR-ABL1; e13a2, e14a2, e1a2 dan e19a2 dideteksi berdasarkan data pasien CML dari Kalbe Genomics Laboratory Tahun 2013-2014.
4. Dari sampel BCR-ABL1 dengan total 41 sampel diperoleh hasil yang sama dengan perbandingan metode RDB dan metode standar deteksi yang biasa digunakan (RT-PCR).
5. Dari sampel JAK2 dengan total 29 sampel terdapat pengecualian 1 sampel yang berbeda antar metode RDB (mutan) dengan metode standar direct DNA sequencing (WT), dua puluh delapan sampel lainnya sama hasilnya antara kedua metode tersebut.
6. Dari sampel ganda BCR-ABL1+JAK2 diperoleh hasil yang sama persis antara metode standar untuk kedua gen dengan metode RDB.
7. Metode RDB bisa digunakan sebagai metode standar deteksi BCR-ABL1 dan JAK2 pada pasien MPN dengan kelebihan; hemat biaya, hemat waktu, resiko kerja lebih rendah.
SARAN
1. Penelitian lebih lanjut dengan tipe translokasi BCR-ABL1 lainnya selain yang dikembangkan dalam penelitian ini.
2. Penelitian lebih lanjut untuk uji sensitifitas metode RDB untuk gen JAK2. 3. Penelitian lebih lanjut terhadap penyakit selain yang dikembangkan dalam
penelitian ini.
4. Penelitian yang mengembangkan platform diagnostik di bidang lain seperti bidang pangan.
DAFTAR PUSTAKA
Burmeister T, Reindhart R (2007) A multiplex PCR for improved detection of typical and atypical BCR-ABL fusion transcripts. In: Leukres, vol. 32, pp 579-585.
Buyukasik Y, Haznedaroglu IC, Ilhan O (2010) Chronic myeloid leukemia: practical issues in diagnosis, treatment and follow-up. Int J Hematology and Oncology 20.
25
Campbell PJ, Green A (2006) The myeloproliferative disorders. The New Englanf J of Med 355:2452-2466.
Carranza C, Tinti D, Herrera M, Rosales L, Villegas M, Silva G (2014) Detection of Jak2 V617f mutation, secondary to the presence of Bcr-Abl Translocation in a patient with Chronic Myeloid Leukemia: report of a case and review of the literature. Int J Genomic Med 2.
Constance JE, Woessner DW, Matissek KJ, Mossalam M, Lim CS (2012) Enhanced and selective kliing of chronic myelogenous leukemia cells with an engineered BCR-ABL binding protein and imatinib. Mol Pharm 9:3318-3329.
Cross N, Daley G, Green A, Hughes T, Jamieson C, Manley P, Mughal T, Perrootti D, Radich J, Skoda R, Soverini S, Vainchenker W, Verstovsek S, Villeval J-L, Goldman J (2008) Spotlight Editorial: BCR-ABL1 positive CML and BCR-ABL1 negative chronic myeloproliferative disorders: some common and contrasting features. Leukemia 22:1975-1989.
Deb P, Chakrabarti P, Chakrabarty S, Aich R, Nath U, Ray SS, Chaudhuri U (2014) Incidence of BCR-ABL transcript variants in patients with chronic myeloid leukemia: their correlation with presenting features, risk scores and response to treatment with imatinib mesylate. Indian Journal of Medical and Paediatric Oncology 35:26-30.
Deininger MWN, Goldman JM, Melo JV (2000) The molecular biology of chronic myeloid leukemia. Blood 96:3343-3356.
Dooki M-RE, Akhavan-Niaki H, Juibary AG (2010) Detecting common CFTR mutations by Reverse Dot Blot hybridization method in Cystic Fibrosis. Iran J Pediatr 21:51-57.
Eder M, Battmer K, Kafert S, Stucki A, Ganser A, Hertenstein B (1999) Monitoring of BCR-ABL espression using real time RT-PCR in CML after bone marrow of peripheral blood stem cell transplantation. Leukemia 13:1382-1389.
Eren E AU, Tetik E, Akman O, Kansu E and Gunduz U (2000) Detection of BCR/ABL gene rearrangement and the elimination of rearranged clone in chronic myelocytic leukemia patients. American J Hematology 63:85-89. Faderl S, Talpaz M, Estrov Z, O'Brien S, Kurzrock R, Kantarjian HM (1999) The
biology of chronic myeloid leukemia. The New Englanf J of Med 342:164-172.
Goh H-G, Hwang J-Y, Kim S-H, Lee Y-H, Kim Y-L, Kim D-W (2006) Comprehensive analysis of BCR-ABL transcript types in Korean CMl patients using a newly developed multiplex PCR. Translational Res 148:249-256.
Gonzalez MS, Brasi CDD, Bianchini M, Gargallo P, Stanganelli C, Zalcberg I, Larripa IB (2014) Improved diagnosis of the transition to JAK2 V617F homozygosity: the key feature for predicting the evolution of myeloprilferative neoplasms. PLoS 9.
Grebien F, Hantschel O, Wojcik J, Kaupe I, Kovacic B, Wyrzucki AM, Sigh GD, Cerny-Reiterer S, Koide A, Beug H, Pawson T, Valent P, Koide S, Superti-Furga G (2011) Targeting the SH2-kinase interface in Bcr-Abl inhibits leukemogenesis. Cell 147:306-319.
Hammond E, Shaw K, Carnley B, P'ng S, James I, Herrmann R (2007) Quantitative determination of JAK2 V617F by TaqMan: an absolute measure of averaged copies per cell that may be associated with the different types of Myeloproliferative Disorders. Journal of Molecular Diagnostics 9:242-248.
Hassan A, Dogara LG, Badoko AA, Awwalu S, Mamman AI (2015) Coexistence of JAK2 and BCR-ABL mutation in patient with myeloproliferative neoplasm. Nigerian Med J 56:74-76.
Iqbal Z, Manzoor F, Iqbal M, Ali S, Sheikh N, Khan M, Aleen A, Akhtar T (2011) Frequency of Bcr-Abl fusion oncogene splice variants associated with chronic myeloid leukemia (CML). J Canc Therapy 2:176-180.
Jagani Z, Singh A, Khosravi-Far R (2008) FoxO tumor suppressors and BCR-ABL-induced leukemia: a matter of evasion of apoptosis. Biochim Biophys Acta 1785:63-84.
Jancik S, Drabek J, Berkocova J, Xu YZ, Stankova M, Klein J, Kolek V, Skarda J, Tichy T, Grygarkova I, Radzioch D, Hajduch M (2012) A comparison of direct sequencing, pyrosequencing, high resolution melting analysis, TheraScreen DxS, and the K-ras StripAssay for detecting KRAS mutations in non small cell lung carcinomas. J Experimental & Clin Canc Research 31:1-13.
Järås M, Johnels P, Hansen N, Ågerstam H, Tsapogas P, Rissler M, Lassen C, Olofsonn T, Bjerrum OW, Richter J, Fioretos T (2010) Isolation and killing of candidate chronic myeloid leukemia stem cells by antibody targetting of IL-1 receptor accessory protein. PNAS 107:16280-16285. Jones D, Kamel-Reid S, Bahler D, Dong H, Elenitoba-Johnson K, Press R,
Quigley N, Rothberg P, Sabath D, Viswanatha D, Weck K, Zehnder J (2009) Laboratory practice guidelines for detecting and reporting BCR-ABL drug resistance mutations in chronic myelogenous leukemia and acute lymphoblastic leukemia. Journal of Molecular Diagnostics 11:4-11. Kim H-R, Choi H-J, Kim Y-K, Kim H-J, Shin J-H, Suh S-P, Ryang D-W, Shin
M-G (2013) Allelic expression imbalance of JAK2 V617F mutation in BCR-ABL negative myeloproliferative neoplasms. PLoS One J 8.
Lappin S, Chalik J, Gold B (2001) Robot printing of reverse dot blot arrays for human mutation detection. Journal of Molecular Diagnostics 3:178-188. Lin M, Zhu J-J, Wang Q, Xie L-X, Lu M, Wang J-L, Wang C-F, Zhong T-Y,
Zheng L, Pan M-C, Wu J-R, Wen Y-F, Liu G-R, Zhan X-F, Lin F, Yang L-Y (2012) Development and evaluation of a reverse dot blot assay for the simultaneous detection of common alpha and beta thalassemia in Chinese. Blood Cells, Molecules, Diseases 48:86-90.
27
Ma W, Kantarjian H, Zhang X, Yeh C-H, Zhang ZJ, Verstovsek S, Albitar M (2009) Mutation profile of JAK2 transcripts in patients with chronic myeloproliferative neoplasias. J Mol Diagnost 11:49-53.
MacLean AL, Filippi S, Stumpf MPH (2013) The ecology in the hematopoietic stem cell niche determines the clinical outcome in chronic myeloid leukemia. PNAS 111:3883-3888.
Mao J-H, Sun X-Y, Liu J-X, Zhang Q-Y, Liu P, Huang Q-H, Li LK, Chen Q, Chen Z, Chen SJ (2010) As4S4 targets ring type E3 ligase c-CBL to induce degradatiion of BCR-ABL in chronic myelogenous leukemia. PNAS 107:21683-21688.
McLornan D, Percy M, McMullin MF (2006) JAK2 V617F: a single mutation in the myeloproliferative group of disorders. Ulster Med J 75:112-119. Paz-y-Miño C, Sánchez ME, Araujo S, Ocampo L, Espín VH, Leone PE (2013)
Cytogenetic and molecular characterization of haemtological neoplasm in an Ecuadorian population. J Blood Diseases 3:108-115.
Posfai E, Marton I, Kiss-Laszlo Z, Kotosz B, Szell M, Borbenyi Z (2014) Thrombosis and risk factors in female patients with a rare acquired thrombophilia: chronic myeloproliferative disorder - polycythaemia vera and essential thrombocythaemia. Eur Rev Med Pharmacol Sci 18:3810-3818.
Prasad C, Singh SB, Chandra S, Prakash S, Prakash A (2013) Screening for different type of leukemia by observing peripheral blood smear in patients of Rajendra Institute of Medical Sciences, Ranchi, Jharkhand. Research J Pharm Bio Chem Sci 4:1256-1261.
Preyer M, Vigneri P, Wang JYJ (2011) Interplay between kinase domain autophophorylation and F-Action binding domain in regulating imatinib sensitivity and nuclear import of BCR-ABL. PLoS One J 6.
Provan D, Singer CRJ, Baglin T, Lilleyman J (2004) Oxford Handbook of Clinical Haematology, Second Edition. p 732 Oxford: Oxford University Press.
Rendra M, Yaswir R, Hanif AM (2013) Gambaran laboratorium leukemia kronik di bagian penyakit dalam RSUP Dr. M. Djamil Padang. J Kesehatan Andalas 2:141-145.
Rosas-Cabral A, Matinez-Mancilla M, Ayala-Sanchez M, Vela-Ojeda J, Bahena-Resendiz P (2003) Analysis of Bcr-abl type transcript and its relationship with platelet count in Mexican patients with chronic myeloid leukemia. Gac Med Mex 139:553-559.
Savona MR (2014) Are we altering the natural history of primary myelofibrosis? Leukemia Res 38:1004-1012.
Sessions J (2007) Chronic myeloid leukemia in 2007. J Managed Care Pharmacy 13:4-7.
Souza CAd, Pagnano KBB, Bendit I, Conchon M, Freitas CMBdM, Coelho AM, Funke VAM, Bernardo WM (2012) Chronic myeloid leukemia treatment guidelines: Brazilian Association of Hematology, Hemaotherapy and Cell Therapy. Brazilian Medical Association Guidelines Project - 2012. Rev Bras Hematol Hemoter 34:367-382.
Stock W, Yu D, Karrison T, Sher D, Stone RM, Larson RA, Bloomfield CD (2006) Quantitative real-time RT-PCR monitoring of BCR-ABL in chronic myelogenous leukemia shows lack of agreement in blood and bone marrow samples. Int J Oncology 28:1099-1103.
Tabassum N, Saboor M, Ghani R, Moinuddin M (2013) Frequency of JAK2 V617F mutation in patients with Philadelphia positive Chronic Myeloid Leukemia in Pakistan. Pak J Med Sci 30:185-188.
Tefferi A (2010) Novel mutations and their functional and clinical relevance in myeloproliferative neoplasms: JAK2, MPL, TET2, ASXL1, CBL, IDH and IKZF1. Leukemia 24.
Tefferi A, Vardiman J (2008) Classification and diagnosis of myeloproliferative neoplasms: the 2008 World Health Organization criteria and point-of-care diagnostic algorithms. Leukemia 22:14-22.
Ursuleac I, AC C, T A, C J, A I, D C (2013) The concomitant occurence of JAK2V617F mutation and BCR/ABL transcript with phenotypic expression - an overlapping myeloproliferative disorder or two distinct diseases? - case report. J Med Life 6:34-37.
Vytrva N, Stacher E, Regitnig P, Zinke-Cerwenka W, Hojas S, Hubmann E, Porwit A, Bjorkholm M, Hoefler G, Beham-Schmid C (2014) Megakaryocytic morphology and clinical paramteres in essential thrombocythemia, polycthemia vera, and primary myelofibrosis with and without JAK2 V617F. Arch Pathol Lab Med 138:1203-1209.
Wu Z, Zhang X, Xu X, Chen Y, Hu T, Kang Z, Li S, Wang H, Lio W, Ma X, Guan M (2014) The mutation profile of JAK2 and CALR in Chinese Han patients with philadelphia chromosome-negative myeloproliferative neoplasms. J Hem Onc 7.
Zaleskas VM, Krause DS, Lazarides K, Patel N, Hu Y, Li S, Etten RAV (2006) Molecular pathogenesis and therapy of Polyctyhemia Vera indiced in mice by JAK2 V617F. Plos One J 1:1-11.
Zhang Y, Coyne MY, Will SG, Levenson CH, Kawasaki ES (1991) Single-base mutational analysis of cancer and genetic diseases using membrane bound modified oligonucleotides. Nucleic Acids Research 19:3929-3933.
RIWAYAT HIDUP
29
Adrenergic β-3 (ADRB3) pada Pasien Diabetes Mellitus Tipe 2 Etnis Minangkabau.