TOLERANSI KEDELAI (
Glycine max
(L.) Merrill)
TERHADAP INTENSITAS CAHAYA RENDAH
LA MUHURIA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi “Mekanisme Fisiologi dan Pewarisan Sifat Toleransi Kedelai (Glycine Max (L) Merrill) Terhadap Intensitas Cahaya Rendah” adalah karya saya sendiri dengan arahan Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Februari 2007
LA MUHURIA. Mechanism of Physiology and Tolerance Characters Inheritance of Soybean (Glycine max (L) Merrill) to Low Light Intensity. Under the direction of Didy Sopandie, Nurul Khumaida, Trikoesoemaningtyas, Latifah K. Darusman, and Tania June.
Plants have avoidance and tolerance mechanism to enable to grow in low light intensity. Avoidance mechanism was achieved by efficiency of light capture obtained through adaptation of morpho-anatomy. Tolerance mechanism light use efficiency which can be reached through pigment content, efficient photosynthetic activity, and low respiration. Pattern of characters inheritance that responsible for light capture and light utilizing efficiencies must be studied to produce a new variety. Study on light capture and light utilizing efficiencies were done in four step : (1) light capture efficiencies mechanism, (2) photosynt hetic and respiration enzyme activity, (3) photosynt hesis and respiration under low light intensity, (4) the inheritance of tolerant characters to low light intensity. Experiment 1-3 used long term and short term exposure of 50% and 100% light intensity, while experiment 4 only used 50% light intensity. Two tolerant genotype (Ceneng and Pangrango) and two sensitive genotype (Godek and Slamet) were used. Diallel population were used especially on experiment 4. In 50% light intensity, Ceneng tolerant genotype, have higher ability to develop an ideal light capture efficiencies characters (wider and thicker leaves, fewer trichome, higher chlorophyll a, b, and lower chlorophyll a/b ratio) compare to sensitive genotypes, especially Godek. Ceneng also have higher light utilizing efficiencies because of its higher photosynt hetic and electron transport rate as well as their photosynthetic enzymes activity (rubisco and SPS), while respiration activity (MDH and IA) is lower. Therefore it has higher sucrose, starch, more filling pod number and higher seed weight per plant. Efficiency characters of Ceneng is more responsive following the recent light condition in short term exposure. Characters that have significant role in light capture efficiency are leaves area, palisade length, leaves thickness, filling pod number, chlorophyll a and trichome density. Inheritance study on light capture efficiencies showed that no maternal effect on trichome density, chlorophyll contents and seed weight per plant. Gen action that regulate the expression on trichome density and seed weight per plant is additive, chlorophylls a content is additive and dominant, where as chlorophyll b is dominant. Trichome density, chlorophyll a and b content are inheritance with high heritability. Trichome density have high the genetic gain following chlorophyll a and chlorophyll b, but cannot be used as selection character in the effort of seed weight per plant improvement because have ratio of CRY/RY less than one.
ABSTRAK
LA MUHURIA. Mekanisme Fisiologi dan Pewarisan Sifat Toleransi Kedelai (Glycine Max (L) Merrill) Terhadap Intensitas Cahaya Rendah. Dibimbing oleh Didy Sopandie, Nurul Khumaida, Trikoesoemaningtyas, Latifah K. Darusman, dan Tania June.
Tanaman membangun mekanisme penghindaran (avoidance) dan toleran (tolerance) untuk mengatasi cekaman intensitas cahaya rendah. Mekanisme penghindaran diperoleh melalui adaptasi morfo-anatomi sehingga memungkinkan efisiensi penangkapan cahaya. Mekanisme toleran mengarah pada efisiensi penggunaan cahaya yang dapat dicapai melalui peningkatan kandungan pigmen pemanen cahaya, aktivitas fotosintesis yang efisien, dan laju respirasi yang rendah. Pola pewarisan karakter efisiensi penangkapan cahaya perlu dipelajari agar upaya pencapaian perbaikan tanaman mudah diperoleh.
Percobaan dilakukan dalam empat tahap, masing- masing untuk mempelajari: (1) efisiensi penangkapan cahaya, (2) aktivitas enzim fotosintetik dan respirasi, (3) respon fotosintesis dan respirasi, dan (4) pola pewarisan sifat toleransi terhadap intensitas cahaya rendah. Percobaan 1, 2, dan 3 dilakukan pada intensitas cahaya 100% dan 50% dalam periode yang lama (long-term expossure) serta pada berbagai kondisi cahaya dalam periode singkat (short-term expossure). Percobaan 4 hanya dilakukan pada intensitas cahaya 50% dalam waktu periode yang lama.
Pada intensitas cahaya 50%, genotipe toleran Ceneng memiliki kemampuan penangkapan cahaya yang lebih tinggi (daun lebih luas dan lebih tipis, trikoma lebih sedikit, klorofil a dan b yang lebih tinggi, serta nisbah klorofil a/b yang lebih rendah). Kemampuan penggunaan cahaya pada Cene ng juga lebih tinggi (laju fotosintesis, laju transpor elektron, aktivitas enzim fotosintetik rubisco dan SPS yang lebih tinggi), sedangkan aktivitas respirasi lebih rendah sehingga memiliki sukrosa, pati, jumlah polong berisi, dan bobot biji/tanaman yang lebih tinggi. Genotipe toleran Ceneng lebih responsif terhadap perubahan intensitas cahaya periode singkat mengikuti kondisi intensitas cahaya yang terakhir kali diterima.
Karakter yang memiliki peranan besar dalam mendukung efisiensi penangkapan cahaya adalah: luas daun trifoliat, tebal daun, jumlah polong berisi, klorofil a dan b, serta kerapatan trikoma. Pewarisan kerapatan trikoma, kandungan klorofil, dan bobot biji/tanaman tidak dipengaruhi tetua betina. Aksi gen yang mengendalikan ekspresi kerapatan trikoma dan bobot biji/tanaman bersifat aditif, kandungan klorofil a bersifat aditif dan dominan sedangkan kandungan klorofil b, aksi gen pengendalinya bersifat dominan.
Kerapatan trikoma, kandungan klorofil a, dan kandungan klorofil b diwariskan dengan heritabilitas yang tinggi. Kemajuan genetik tertinggi diperoleh dengan menggunakan kerapatan trikoma sebagai karakter seleksi, disusul klorofil b dan klorofil b. Namun demikian, karakter-karakter tersebut tidak memenuhi syarat sebagai karakter seleksi karena memiliki nisbah CRy/Ry yang kurang dari satu.
©
Hak cipta milik
Institut Pertanian Bogor
, tahun 2007
Hak cipta dilindungi
MEKANISME FISIOLOGI DAN PEWARISAN SIFAT
TOLERANSI KEDELAI (
Glycine max
(L.) Merrill)
TERHADAP INTENSITAS CAHAYA RENDAH
LA MUHURIA
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Departemen Agronomi dan Hortikultura
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Cahaya Rendah Nama Mahasiswa : La Muhuria Nomor Pokok : A 361030121
Disetujui Komisi Pembimbing,
Prof. Dr. Ir. Didy Sopandie, M.Agr. Dr. Ir. Nurul Khumaida, M.Si. Ketua Anggota
Dr. Ir. Trikoesoemaningtyas, M.Sc . Anggota
Prof. Dr. Ir. Latifah K. Darusman, M.S. Dr. Ir. Tania June, M.Sc.
Anggota Anggota
Diketahui,
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Satriyas Ilyas, M.S. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
RIWAYAT HIDUP
Penulis lahir di Tomia Sulawesi Tenggara pada 2 Mei 1964, merupakan putra pertama dari tujuh bersaudara dari ayah La Olu Mony (almarhum) dan Ibu Wa Asi. Penulis menikah dengan Murni dan telah dikaruniai empat orang anak.
Pada Juli 1984, diterima di Fakultas Pertanian Universitas Haluoleo Kendari jurusan Budidaya Pertanian program studi Agronomi dan selesai pada Mei 1989. Jenjang Strata dua (S-2) diikuti pada Program Pascasarjana Universitas Gadjah Mada Program Studi Agronomi sejak Juli 1994 dan selesai pada Februari 1997. Selanjutnya, sejak Agustus 2003 mengikuti pendidikan jenjang Strata tiga (S-3) di Program Studi Agronomi Sekolah Pascasarjana Institut Pertanian Bogor.
Pada Mei – Desember 1989 menjadi staf peneliti pada Balai Penelitian Kelapa UPT Makariki Maluku Tengah. Selanjutnya, pada Agustus 1989 hingga Oktober 1994 menjadi staf pengajar pada Universitas Darussalam Ambon. Sejak Oktober 1994 hingga sekarang menjadi staf pengajar pada Kopertis Wilayah XII yang dipekerjakan pada Universitas Darussalam Ambon.
Alhamdulillah, puji dan syukur penulis panjatkan kepada Allah SWT atas rahmat dan hidayahNya sehingga penulis dapat menyelesaikan penelitian dan penulisan disertasi yang berjudul “Mekanisme Fisiologi dan Pewarisan Sifat Toleransi Kedelai (Glycine Max (L) Merrill) terhadap Intensitas Cahaya Rendah”.
Penelitian dan penulisan disertasi ini berlangsung di bawah bimbingan Prof. Dr. Ir. Didy Sopandie, M.Agr. selaku Ketua Komisi Pembimbing dan empat orang Anggota Komisi Pembimbing yakni Dr. Ir. Nurul Khumaida, M.Si., Dr. Ir. Trikoesoemaningtyas, M.Sc., Prof. Dr. Ir. Latifah K. Darusman, M.S., dan Dr. Ir. Tania June, M.Sc. Pada kesempatan ini penulis menyampaikan terima kasih dan penghargaan yang tulus atas waktu dan kesempatan yang telah diluangkan dalam mengarahkan dan membimbing penulis.
Penelitian dan penyelesaian disertasi ini sebagian besar didanai oleh Hibah Penelitian Tim Pascasarjana (HPTP), karena itu penulis menyampaikan banyak terima kasih kepada Dirjen DIKTI selaku pemberi dana bagi HPTP, Prof. Dr. Ir. Didy Sopandie, M.Agr. selaku Ketua Peneliti HPTP serta Dr. Ir. Nurul Khumaida, M.Si. dan Dr. Ir. Trikoesoemaningtyas, M.Sc., masing- masing sebagai Anggota Peneliti HPTP. Ucapan terima kasih penulis sampaikan juga kepada Ir. Kisman M.Sc., Ir. Imam Widodo M.S., Ir. Kartika Ning Tyas, M.Si., Desta Winas S.P., M.Si., dan Tri Lestari S.P., M.Si. atas kebersamaannya di Tim HPTP.
Penghargaan yang setinggi- tingginya serta rasa terima kasih yang tulus, penulis sampaikan juga kepada :
1. Dirjen DIKTI yang telah memberikan Beasiswa BPPS .
2. Koordinator Kopertis Wilayah XII Maluku, Maluku Utara, Papua, dan Irian
Jaya Barat, serta Rektor Universitas Darussalam Ambon yang telah memberikan izin tugas belajar.
3. Rektor Institut Pertanian Bogor serta Dekan dan Ketua Program Studi Agronomi Sekolah Pascasarjana Institut Pertanian Bogor yang telah menerima penulis untuk melanjutkan studi di Institut Pertanian Bogor.
sidang terbuka yang telah memberikan saran-saran dan koreksi konstruktif untuk menyempurnakan tulisan ini.
5. Yayasan Pendidikan Putra Mama, Pemerintah Daerah Propinsi Maluku, Yayasan Darussalam Maluku, dan Kupek yang telah memberikan bantuan dana pendidikan dan penelitian.
6. Ir. La Ode Safuan, M.P., Ir. Gunawan Setyono, Dr. Ir. Ahmad Jufri, M.Sc., Dr. Ir. Bregas Budihardjo, MS., Dra. Surtini Suganda, Ir. Irawan, dan La Sainudin ST. atas kebersamaan dan bantuannya yang tanpa pamrih.
7. Kepala dan Staf Kebun Percobaan Balai Besar Bioteknologi dan Sumberdaya Genetik (BB. Biogen) Cikeumeuh dan Laboratorium Pascapanen BB. Biogen Cimanggu Bogor atas kerjasama dan bantuannya.
8. Kepala beserta Staf Laboratorium Ekofisiologi Tanaman dan Research Group on Crop Improvement Faperta IPB., serta Laboratorium Biokimia FMIPA IPB atas kerjasama, kebersamaan, dan bantuannya.
9. Kepala dan Staf Laboratorium Histologi Biotrop Bogor dan Laboratorium Pusat Aplikasi Teknologi Isotop dan Radiasi BATAN Jakarta atas bantuannya. 10. Dr. Ir. L. Ega, MS., Drs. H. Halim Daties, H. La Ode Buraku, dr. Makmur
Tamani, dan Qaimuddin Thamsy SH., atas bantuan dan dorongan morilnya. 11. Ayahanda La Olu Mony (alm) dan ibunda Wa Asi yang telah membesarkan,
mendidik, serta selalu menyertai penulis hingga detik ini dengan kasih sayang dan do’anya.
12. Adik-adik sekeluarga: Wa Nursida, La Dahamarudin SP., Wa Dahria, Wa Ade Harti, Wa Sulastri SAg., Wa Muriani SP., atas iringan do’a dan motivasinya. 13. Istri tercinta Murni dan anak-anak yang tersayang : Abdul Wahid Kamarullah,
Milatul Hijrah, Mauludia Khamsin, dan Nur Cessy Zulma atas do’a, dorongan, pengertian, dan pengorbanannya.
14. Rekan-rekan di Kopertis Wilayah XII, Universitas Darussalam Ambon, Sekolah Pascasarjana IPB, serta semua pihak yang telah memberikan dukungan dan bantuan.
Semoga karya ini bermanfaat bagi pengembangan ilmu pengetahuan, khususnya di bidang pertanian. Amin.
Bogor, Februari 2007
xi
DAFTAR ISI
Halaman
PRAKATA ……… ix
DAFTAR ISI ……… xi
DAFTAR TABEL ………... xiv
DAFTAR GAMBAR ………... xvi
DAFTAR LAMPIRAN ……… xix
PENDAHULUAN ……… 1
Latar Belakang ……….. 1
Rumusan Masalah ……… 3
Tujuan Penelitian ………. 3
Kerangka Pemikiran ……… 4
Hipotesis ………. 5
Ruang Lingkup Penelitian ……… 5
TINJAUAN PUSTAKA ………. 7
Anatomi Daun Kedelai ……… 7
Fotosintesis ……….. 9
Penangkapan Cahaya oleh Kanopi Tanaman ……….... 10
Mekanisme Penangkapan dan Penggunaan Cahaya ………….. 13
Fotosintesis pada Kondisi Intensitas Cahaya Rendah ………… 17
Pembentukan Klorofil ……… 17
Pembentukan Antosianin ……… 21
Respirasi ………... 23
Respirasi pada Intensitas Cahaya Rendah ……….. 25
Respon Tanaman terhadap Intensitas Cahaya Rendah ………. 26
Perubahan Anatomi dan Morfologi ……… 26
Perubahan Kloroplas ……….. 26
Perubahan Kandungan Klorofil Daun ……… 27
Perubahan Fisiologi dan Biokimia ………. 27
Pewarisan Sifat Toleransi terhadap Intensitas Cahaya Rendah ... 30
Pewarisan Sifat ………... 32
Pewarisan Kloroplas dan Klorofil ……….. 36
MEKANISME EFISIENSI PENANGKAPAN CAHAYA PADA KEDELAI TOLERAN DAN PEKA INTENSITAS CAHAYA RENDAH 38 ABSTRAK ………... 38
ABSTRACT ………... 38
PENDAHULUAN ………... 39
Latar Belakang ………... 39
Tujuan ………... 41
BAHAN DAN METODE ………... 41
Waktu dan Tempat ………... 41
xii
dalam Periode Singkat "………... 44
HASIL DAN PEMBAHASAN ………... 46
Luas Daun ………... 46
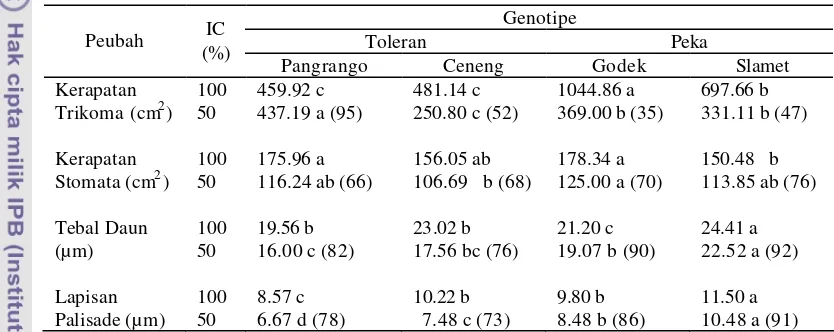
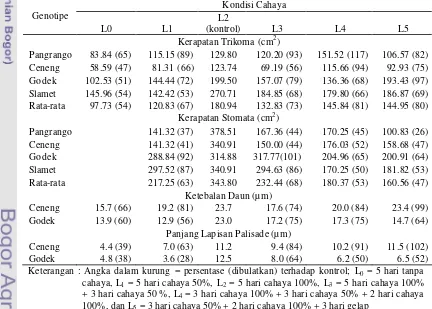
Kerapatan Trikoma ………... 47
Kerapatan Stomata ………... 51
Ketebalan Daun dan Panjang Lapisan Palisade ……….. 53
Kandungan Klorofil ……… 57
Intensitas Kehijauan Daun ……….. 60
Antosianin ………... 62
Komponen Hasil dan Hasil ………... 64
SIMPULAN ………... 66
AKTIVITAS ENZIM-ENZIM FOTOSINTETIK DAN RESPIRASI PADA KEDELAI TOLERAN DAN PEKA INTENSITAS CAHAYA RENDAH ………... 67
ABSTRAK ………... 67
ABSTRACT ………... 67
PENDAHULUAN ………... 68
Latar Belakang ………... 68
Tujuan ………... 70
BAHAN DAN METODE ………... 71
Waktu dan Tempat ………... 71
Percobaan Pertama "Aktivitas Enzim-Enzim Fotosintesis dan Enzim- Enzim Respirasi pada Intensitas Cahaya 100% dan 50% dalam Periode yang Lama" ... 71
Percobaan Kedua "Aktivitas Enzim- Enzim Fotosintesis dan Enzim- Enzim Respirasi dalam Berbagai Intensitas Cahaya Periode Singkat" ………. 73
HASIL DAN PEMBAHASAN ………... 74
Aktivitas Enzim Ribulose Biphosphate Carboxylase/Oxy-genase (Rubisco) ……... 74
Aktivitas Enzim Sucrose Phosphate Synthase (SPS) ……... 78
Aktivitas Enzim Malatedehydrogenase (MDH) ……... 79
Aktivitas Enzim Asam Invertase (AI) ……... 82
SIMPULAN ………... 85
RESPON FOTOSINTESIS DAN RESPIRASI PADA KEDELAI TOLERAN DAN PEKA INTENSITAS CAHAYA RENDAH ………... 86
ABSTRAK ………... 86
ABSTRACT ………... 86
PENDAHULUAN ………... 87
Latar Belakang ………... 87
Tujuan ………... 90
BAHAN DAN METODE ………... 90
Waktu dan Tempat ………... 90
xiii Percobaan Kedua "Respon Fotosintetik dan Respirasi pada
Kedelai Toleran dan Peka terhadap Berbagai Kondisi
Intensitas Cahaya Periode Singkat" ……….... 93
HASIL DAN PEMBAHASAN ………... 94
Laju Fotosintesis ……... 94
Laju Transpor Elektron ……... 96
Respirasi Gelap ……... 98
Titik Kompensasi Cahaya ……... 99
Kandungan Sukrosa ……... 104
Kandungan Pati ……... 104
SIMPULAN ………... 107
PEWARISAN SIFAT EFISIENSI PENANGKAPAN CAHAYA PADA KEDELAI ………....………... 108
ABSTRAK ………... 108
ABSTRACT ………... 108
PENDAHULUAN ………... 109
Latar Belakang ………... 109
Tujuan ……….... 112
BAHAN DAN METODE ………... 112
Waktu dan Tempat ………... 112
Percobaan Pertama: “Analisis Hubungan antar Karakter Efisiensi Penangkapan Cahaya dan Kontribusinya terhadap Hasil Serta Analisis Ragam” ... 112
Percobaan Kedua : “Pewarisan Sifat Toleransi Kedelai terhadap Intensitas Cahaya Rendah” ... 115
HASIL DAN PEMBAHASAN ………... 117
Analisis Korelasi dan Analisis Lintasan Sifat yang Diamati pada Tetua ... 117
Korelasi antar Karakter pada Tetua ... 117
Sidik Lintas ……... 119
Keragamaman Karakter ……... 121
Analisis Dialel ... 123
Pengaruh Tetua Betina ……... 123
Daya Gabung ……... 126
Aksi Gen Pengendali ……... 127
Heritabilitas ... 129
Kemajuan Genetik ……... 130
SIMPULAN ………... 132
PEMBAHASAN UMUM ……….. 133
SIMPULAN DAN SARAN ……..……… 140
Simpulan ……… 140
Saran ………...….………... 141
DAFTAR PUSTAKA ………..…………. 142
xiv
DAFTAR TABEL
Halaman
1. Luas daun beberapa genotipe kedelai pada intensitas cahaya 100%
(kontrol) dan 50% ………... 47
2. Kerapatann trikoma dan stomata serta ketebalan daun dan panjang lapisan palisade beberapa genotipe kedelai pada intensitas cahaya
100% (kontrol) dan 50% ……… 48
3. Kerapatann trikoma dan stomata (cm2) serta ketebalan daun dan panjang lapisan palisade (µm) beberapa genotipe kedelai pada
berbagai kondisi cahaya jangka pendek ………. 52
4. Kandungan klorofil beberapa genotipe kedelai dalam intensitas cahaya
(IC) 100% (kontrol) dan 50% ………. 58
5. Kandungan klorofil beberapa genotipe kedelai pada berbagai kondisi
cahaya periode singkat ……… 59
6. Intensitas kehijauan daun dan kandungan antosianin beberapa genotipe kedelai pada intensitas cahaya (IC) 100% (kontrol) dan 50% ………… 61
7. Intensitas kehijauan dan kandungan antosianin beberapa genotipe kedelai pada berbagai kondisi cahaya periode singkat ... 63
8. Jumlah polong dan bobot biji/tanaman beberapa genotipe kedelai pada
intensitas cahaya (IC) 100% (kontrol) dan 50% ………. 64
9. Laju fotosintesis maksimum (Amax), transpor elektron maksimum
(Jmax), respirasi gelap (Rd), dan titik kompensasi cahaya (LCP)
genotipe toleran Ceneng dan genotype peka Godek pada intensitas
cahaya 100% (kontrol) dan 50% ………. 95
10. Laju fotosintesis maksimum (Amax), laju transpor elektron maksimum
(Jmax), respirasi gelap (Rd), dan titik kompensasi cahaya (LCP) pada
kedelai genotipe toleran Ceneng dan genotipe peka Godek dalam berbagai kondisi intensitas cahaya periode singkat …………... 103
11. Kandungan sukrosa dan pati genotipe toleran Ceneng dan genotype peka Godek dalam intensitas cahaya 100% (kontrol) dan 50% ………. 104
12. Anova pengujian karakter efisiensi penangkapan cahaya pada kedelai
dalam keadaan tercekam intensitas cahaya rendah ………. 114
xv 14. Koefisien korelasi parsial antar karakter ………. 118
15. Ragam genetik, ragam lingkungan, ragam fenotip, dan heritabilitas arti luas beberapa karakter agronomi, morfo-anatomi, dan pigmen pada kedelai dalam keadaan tercekam intensitas cahaya rendah ……… 122
16. Anova kerapatan trikoma, kandungan klorofil, dan bobot biji/tanaman dalam intensitas cahaya rendah ...
124
17. Anova daya gabung untuk kerapatan trikoma, kandungan klorofil, dan bobot biji/tanaman dalam intensitas cahaya rendah ... 125
18. Hasil uji t pengaruh tetua betina untuk karakter kerapatan trikoma, kandungan klorofil, dan bobot biji/tanaman ... 125
19. Daya gabung umum dan daya gabung khusus untuk karakter kerapatan trikoma, kandungan klorofil, dan bobot biji/tanaman ... 127
20. Ragam genetik aditif (s2gA) dan ragam genetik dominan (s2gD), kerapatan trikoma, kandungan klorofil, dan bobot biji/tanaman kedelai pada keadaan ternaungi ... 128
21. Heritabilitas arti luas (h2bs) dan heritabilitas arti sempit (h2ns) dari kerapatan trikoma, kandungan klorofil, dan bobot biji/tanaman kedelai pada keadaan ternaungi ... 130
xvi
DAFTAR GAMBAR
Halaman 1. Alur Kegiatan Penelitian ... 6
2. Struktur anatomi daun tanaman C3 (Becker et al. 2000) ……… 7
3. Serapan pigmen pemanen cahaya (klorofil a dan b) pada panjang
gelombang 400 – 700 nm ……… 9
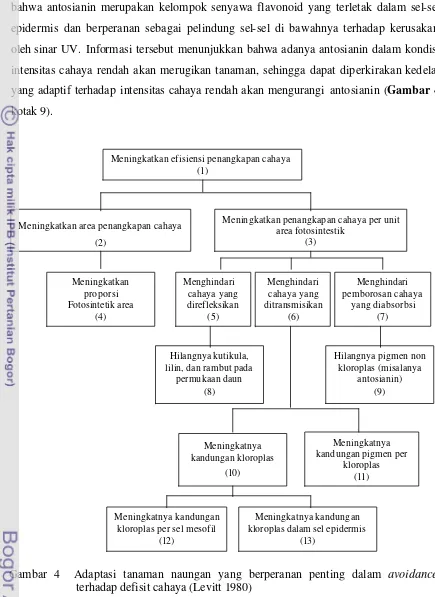
4. Adaptasi tanaman naungan yang berperanan penting dalam avoidance
terhadap defisit cahaya (Levitt 1980) ……… 15
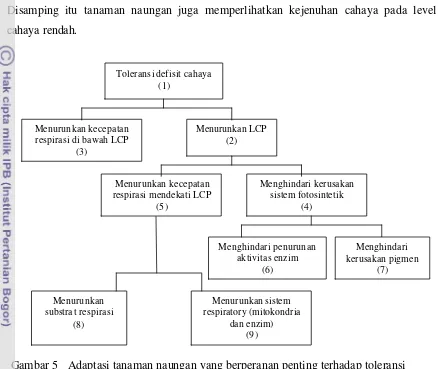
5. Adaptasi tanaman naungan yang berperanan penting terhadap toleransi defisit cahaya (LCP = light compesation point) (Levitt, 1980) ……….. 16
6. Kendali inti terhadap pembentukan klorofil ……….. 19
7. Reaksi lengkap sintesis klorofil a dan b (Malkin dan Niyogi 2000)…... 20
8. Struktur kimia klorofil a dan b (Becker et al. 2000)………... 21
9. Lintasan pembentukan antosianin. Enzim yang terlibat adalah PAL (Phenylalanine Ammonia Lyase); CHS (Chalcone synthase); CHI (Chalcone Isomerase); F3H (Flavanone-3-hydroxylase); dan DR (Dihydroflavonol 4-reductase) (Buchanan et al. 2000) ... 22
10. Hubungan antara cahaya, fotosintesis, dan enzim (diberi lingkaran) yang berperanan dalam mengkatalisis proses pembentukan pati di
kloroplas dan sukrosa di sitosol; ADPG-PPi = adenosine
difosfoglukosa pirofosforilase (dirangkum dari Salisbury dan Ross 1992, Dennis dan Blakeley 2000, Hopkins dan Huner 2004) ………… 29
11. Alur informasi genetik dari satu organel ke organel lain dalam sel
tanaman ………... 36
12. Kerapatan trikoma pada genotipe toleran Ceneng (a) dan genotipe peka Godek (b) yang memperoleh intensitas cahaya 100% dan 50% ………. 49
13. Kerapatan trikoma pada genotipe Pangrango, Ceneng, Godek, dan Slamet dalam berbagai kondisi intensitas cahaya periode singkat ……. 50
14. Kerapatan stomata pada genotipe toleran Ceneng (a) dan genotipe peka
Godek (b) dalam intensitas cahaya 100% dan 50% ……… 51
xvii 16. Ketebalan daun dan lapisan palisade pada genotipe toleran Pangrango
dan Ceneng serta genotipe peka Godek dan Slamet dalam intensitas
cahaya 100% dan 50% ……… 55
17. Ketebalan daun (a) dan panjang lapisan palisade (b) pada genotipe toleran Ceneng dan genotipe peka Godek dalam berbagai kondisi
intensitas cahaya periode singkat ……… 56
18. Hubungan antara kandungan klorofil a (a) dan kandungan klorofil b
(b) dengan intensitas kehijauan daun relatif ………... 62
19. Aktivitas rubisco pada genotipe toleran Ceneng dan genotipe peka
Godek dalam intensitas cahaya 100% dan 50% ……….. 75
20. Aktivitas rubisco pada genotipe toleran Ceneng dan genotipe peka Godek dalam berbagai intensitas cahaya periode singkat ………... 77
21. Aktivitas SPS pada genotipe toleran Ceneng dan genotipe peka Godek
dalam intensitas cahaya 100% dan 50% ………. 78
22. Aktivitas SPS pada genotipe toleran Ceneng dan genotipe peka Godek
dalam berbagai intensitas cahaya periode singkat ……….. 79
23. Aktivitas MDH pada genotipe toleran Ceneng dan genotipe peka
Godek dalam intensitas cahaya 100% dan 50% ……….. 80
24. Aktivitas MDH pada genotipe toleran Ceneng dan genotipe peka Godek dalam berbagai intensitas cahaya periode singkat ………... 81
25. Aktivitas AI pada genotipe toleran Ceneng dan genotipe peka Godek
dalam intensitas cahaya 100% dan 50% ………. 83
26. Aktivitas AI pada genotipe toleran Ceneng dan genotipe peka Godek dalam berbagai intensitas cahaya periode singkat ………... 84
27. Laju fotosintesis pada genotipe toleran Ceneng (a) dan genotipe peka
Godek (b) dalam intensitas cahaya 100% 50% ……… 95
28. Laju laju transpor elektron pada genotipe toleran Ceneng (a) dan genotipe peka Godek (b) dalam intensitas cahaya 100% dan 50% ……. 97
29. Respirasi gelap (Rd) dan tititk kompensasi cahaya (LCP) pada genotipe toleran Ceneng (a) dan genotipe peka Godek (b) dalam
intensitas cahaya 100% dan 50% ……… 99
30. Laju fotosintesis (A) dan laju transpor elektron (J) pada genotipe toleran Ceneng dan genotipe peka Godek dalam kondisi cahaya L1 dan
L2 ………. 101
xviii 31. Laju fotosintesis (A) dan laju transpor elektron (J) pada genotipe
toleran Ceneng dan genotipe peka Godek dalam kondisi cahaya L3 dan
L4 ………. 102
32. Kandungan sukrosa (a) dan pati (b) pada genotipe toleran Ceneng dan genotipe peka Godek dalam berbagai kondisi cahaya periode singkat.... 106
xix
DAFTAR LAMPIRAN
Halaman
1 Denah percobaan mekanisme efisiensi penangkapan dan penggunaan
cahayadalam periode yang lama ………...…………... 157
2 Pengaturan waktu tanam dan pemberian perlakuan pada percobaan
periode singkat menggunakan media tanam polybag ……….. 158
3 Denah percobaan pewarisan sifat ………...………. 159
4 Prosedur kerja penentuan kandungan klorofil daun ……… 160
5 Prosedur kerja penentuan kandungan antosianin ……… 160
6 Prosedur kerja penentuan sukrosa dan pati jaringan tanaman ... 161
7 Prosedur kerja penentuan aktivitas enzim AI …... 162
8 Prosedur kerja penentuan aktivitas enzim MDH …... 162
9 Prosedur kerja penentuan aktivitas enzim rubisco ………... 162
PENDAHULUAN
Latar Belakang
Kedelai (Glycine max (L) Merrill) merupakan sumber protein terpenting di Indonesia. Kandungan protein kedelai sangat tinggi, sekitar 35%-40%, persentase tertinggi dari seluruh tumbuhan yang dikenal (Salisbury dan Ross 1992; Adisarwanto 2005). Kedelai juga memiliki kandungan asam amino (metionin, isoleusin, leusine, fenilalanin, treonin, triptofan, valin, dan lisin) yang lebih tinggi dibanding bahan pangan serealia lainnya (Suprapto 2001). Karena itu, keberadaan kedelai diharapkan dapat memperbaiki dan meningkatkan gizi masyarakat.
Sejalan dengan peran penting kedelai dalam pangan masyarakat serta pertambahan penduduk, Indonesia harus mengimpor kedelai. Sebelum tahun 1975, Indonesia pernah berswasembada kedelai. Setelah itu impor kedelai meningkat sangat pesat, puncaknya terjadi pada tahun 1993 dan 1996, masing-masing sebesar 700 ribu dan 744 ribu ton (Swastika et al. 2002). Dalam periode 2000-2004 impor kedelai telah mencapai rata-rata 1.20 juta ton/tahun (BPS 2005). Di sisi lain produksi kedelai pada tahun 1999 mencapai 1.38 juta ton sedangkan pada tahun 2000, 2001, 2002, 2003, 2004 masing- masing hanya mencapai 1.02, 0.83, 0.67, 0.67, dan 0.72 juta ton (BPS 2005). Uraian di atas menunjukkan bahwa kebutuhan kedelai meningkat dari tahun ke tahun, sebaliknya produksi kedelai cenderung menurun. Untuk mengurangi impor tersebut, upaya- upaya ke arah peningkatan produktivitas dan luas tanam kedelai perlu mendapat perhatian.
Potensi produksi kedelai di Indonesia mencapai lebih dari 2.0 ton/ha, namun sejauh ini produksi aktual di tingkat petani hanya mencapai rata-rata 1.2 ton/ha (Badan Litbang Deptan 2004). Rendahnya produksi kedelai disebabkan oleh berbagai faktor antara lain kondisi lingkungan biotik maupun abiotik yang kurang optimal seperti kekeringan, intensitas cahaya rendah, serangan hama pengisap polong dan penyakit karat, serta rendahnya penguasaan dan penerapan teknologi budidaya. Informasi ini mengindikasikan bahwa diperlukan upaya perbaikan produktivitas tanaman untuk kondisi spesifik melalui perakitan varietas toleran.
(HTI) menjadi salah satu pilihan. Potensi lahan tidur di bawah tegakan tanaman perkebunan maupun HTI cukup besar. Luas areal perkebunan mencapai 16.86 juta ha dengan luas areal tanaman baru sekitar 3.23 juta ha sedangkan luas areal HTI mencapai 8.82 juta ha (BPS 2004). Areal tanaman baru dapat ditumpangsarikan dengan kedelai sampai tanaman pokok berumur 2–3 tahun (Sopandie el al 2002).
Peningkatan produksi kedelai dengan memanfaatkan lahan tidur di bawah tegakan tanaman perkebunan atau HTI telah menjadi salah satu strategi (Pinem 2000). Dalam Rencana Aksi Pemantapan Ketahanan Pangan 2005-2010 disebutkan bahwa lebih dari 2 juta ha lahan di bawah tegakan tanaman perkebunan dan HTI telah menjadi salah satu program peningkatan luas areal panen kedelai (Badan Litbang Deptan 2005). Apabila 10% luas areal tersebut atau sekitar 200 ribu ha diasumsikan cocok bagi budidaya kedelai dan hasil kedelai dapat mencapai 80% kondisi optimum (Sopandie el al. 2002) atau sekitar 0.96 ton/ha, maka budidaya kedelai di bawah tegakan dapat menyumbangkan sekitar 192 ribu ton atau sekitar 16% dari rata-rata impor tahun 2000-2004.
Lahan di bawah tegakan memiliki berbagai faktor pembatas, antara lain intensitas cahaya rendah. Asadi et al. (1997) menyebutkan bahwa TBM berumur 2-3 tahun memberikan naungan sebesar 33-50%. Menurut Adisarwanto et al. (2000) naungan 50% tidak sesuai bagi pertanaman kedelai, sehingga kedelai yang akan dikembangkan sebagai tanaman sela harus toleran terhadap intensitas cahaya rendah. Menurut Levitt (1980), toleransi tanaman terhadap intensitas cahaya rendah dapat diperoleh melalui mekanisme penghindaran (avoidance) untuk efisiensi penangkapan cahaya dan mekanisme toleran (tolerance) untuk efisiensi penggunaan cahaya.
3
cahaya untuk fotosintesis dan respirasi yang efisien pada kedelai belum dilaporkan.
Dalam studi morfo-anatomi dan fisiologis terkait efisiensi penangkapan dan penggunaan cahaya pada sejumlah genotipe kedelai disimpulkan bahwa terdapat perbedaan yang nyata antara kedelai toleran dan peka intensitas cahaya rendah (Khumaida 2002, Sopandie et al. 2003a, Lestari 2005, Tyas 2006, Jurfri 2006). Informasi tersebut menunjukkan bahwa, tersedia peluang yang besar untuk merakit varietas kedelai toleran intensitas cahaya rendah. Keberhasilan perakitan varietas sangat tergantung pada pengetahuan tentang kendali genetik karakter toleransi intensitas cahaya rendah sehingga pola pewarisan karakter-karakter tersebut perlu dipelajari untuk dimanfaatkan dalam program perbaikan tanaman.
Rumusan Masalah
Pemanfaatan lahan tidur di bawah tegakan merupakan salah satu pilihan dalam upaya peningkatan luas tana m dan produksi kedelai, namun terdapat beberapa faktor pembatas pertumbuhan dan perkembangan tanaman antara lain intensitas cahaya rendah. Tanaman kedelai yang akan dibudidayakan dalam kondisi demikian harus toleran terhadap intensitas cahaya rendah agar dapat tumbuh dan berkembang serta berproduksi tinggi. Kedelai toleran intensitas cahaya rendah memiliki ciri-ciri : (1) morfo-anatomi yang mendukung efisiensi penangkapan cahaya, dan (2) karakter fisiologis yang dapat mempertahankan laju fotosintesis dan laju respirasi rendah.
Informasi respon morfo-anatomi dan fisiologi terhadap intensitas cahaya rendah sangat penting bagi program pemuliaan perbaikan sifat tanaman. Sejauh ini, informasi tentang kendali genetik terhadap karakter toleransi intensitas cahaya rendah pada kedelai masih sangat terbatas, karena itu perlu dilakukan studi pola pewarisan.
Tujuan Penelitian
Penelitian bertujuan untuk :
a) Mengidentifikasi mekanisme adaptasi kedelai terhadap intensitas cahaya rendah melalui karakter morfo logi, anatomi, dan fisiologi,
Kerangka Pemikiran
Intensitas cahaya di bawah tegakan tanaman perkebunan atau HTI lebih rendah dari areal terbuka karena terjadi penutupan oleh kanopi tanaman utama. Pada perkebunan karet umur 2, 3, dan 4 tahun, intensitas cahaya di bawah tegakan berturut-turut setara dengan naungan paranet 25%, 50%, dan 75% (Chozin et al. 1999). Pada perkebunan kelapa umur lima tahun, intensitas cahaya di bawah tegakan hanya sekitar 50% (Magat 1989). Intensitas cahaya 50% tidak sesuai lagi bagi pertanaman kedelai (Adisarwanto et al. 2000) sehingga diperlukan upaya untuk memperoleh varietas kedelai yang adaptif.
Hasil penelitian menggunakan naungan ringan (33%) dimana kedelai ditumpangsarikan dengan jagung telah dilepas varietas Pangrango sebagai kedelai yang adaptif (Asadi dan Arsyad 1995) sedangkan upaya pemuliaan kedelai untuk pola tumpangsari dengan kondisi naungan yang lebih berat (± 50%) masih sangat terbatas. Upaya pemuliaan kedelai toleran naungan berat dapat dilakukan melalui tahapan-tahapan sebagai berikut : (1) identifikasi mekanisme efisiensi penangkapan dan penggunaan cahaya pada kedelai yang mendapat naungan berat, (2) mempelajari pola pewarisan karakter toleransi terhadap naungan berat, (3) menyeleksi galur- galur toleran terhadap naungan berat, dan (4) uji daya hasil dalam kondisi naungan berat pada waktu yang berbeda.
5
Hipotesis
a) Adaptasi morfo-anatomi pada kedelai genotipe toleran intensitas cahaya rendah lebih baik sehingga lebih efisien menangkap cahaya.
b) Penggunaan cahaya pada genotipe toleran yang lebih efisien diperoleh dengan meningkatkan kandungan klorofil, mengurangi kandungan antosianin, mempertahankan aktivitas fotosintesis, serta respirasi yang lebih rendah.
c) Kandungan klorofil dan kerapatan trikoma diwariskan dengan heritabilitas yang tinggi.
d) Aksi gen- gen yang mengendalikan ekspresi kerapatan trikoma dan kandungan klorofil bersifat aditif.
Ruang Lingkup Penelitian
Berdasarkan uraian di atas, maka penelitian ini dirumuskan ke dalam tiga aspek : (1) mekanisme efisiensi penangkapan cahaya, (2) mekanisme efisiensi penggunaan cahaya, dan (3) pola pewarisan sifat toleransi terhadap intensitas cahaya rendah. Ketiga aspek tersebut dikelompokkan menjadi empat subjudul penelitian : (1) mekanisme efisiensi penangkapan cahaya pada kedelai toleran dan peka intensitas cahaya rendah, (2) aktivitas enzim-enzim fotosintetik dan respirasi pada kedelai toleran dan peka intensitas cahaya rendah, (3) respon fotosintesis dan respirasi pada kedelai toleran dan peka intensitas cahaya rendah, dan (4) pewarisan sifat efisiensi penangkapan cahaya pada kedelai.
Perubahan morfologi, anatomi, dan kandungan pigmen yang merupakan adaptasi tanaman untuk efisiensi penangkapan cahaya dipelajari dalam subjudul penelitian pertama. Efisiensi penggunaan cahaya tersebut dipelajari berdasarkan aktivitas enzim fotosintesis dan respirasi (subjudul penelitian kedua) dan respon fotosintesis dan respirasi (subjudul penelitian kedua). Karakter atau peubah terkait penangkapan cahaya yang berkorelasi dan memberikan kontribusi besar terhadap hasil dipelajari kendali genetiknya dalam subjudul penelitian keempat.
(50%) menggunakan tetua dan populasi dialel. Garis besar seluruh kegiatan penelitian disajikan dalam Gambar 1.
KEDELAI (TETUA)
POPULASI DIALEL
Mekanisme Efisiensi Penangkapan cahaya
Aktivitas Enzim Fotosintesis dan
Respirasi
Respon Fotosintesis dan Respirasi
4 1
2
3 Intensitas
Cahaya 100% (Long-term
exposure)
Intensitas Cahaya 50%
(Short-term exposure)
Pewarisan Sifat Toleransi Kedelai terhadap Intensitas
Cahaya Rendah Penangkapan
dan Penggunaan Cahaya secara
Efisien
Responsivitas Perubahan
Karakter
Aksi Gen, Heritabilitas, Karakter Seleksi
Gambar 1. Alur Kegiatan Penelitian
TINJAUAN PUSTAKA
Anatomi Daun Kedelai
Daun mempunyai dua permukaan, permukaan yang menghadap ke atas (adaksial) dan permukaan yang menghadap ke bawah (abaksial). Susunan anatomi daun tanaman C3 disajikan pada Gambar 2. Epidermis daun berbagai tumbuhan berbeda-beda dalam jumlah lapisan jaringan, bentuk, struktur, susunan stomata, dan ada-tidaknya trikoma (Fahn 1995).
Gambar 2 Struktur anatomi daun tanaman C3 (Beecker et al. 2000)
Percobaan dengan intensitas cahaya yang berbeda pada daun Iris sp. memperlihatkan bahwa jumlah stomata berkurang dengan menurunnya intensitas cahaya (Fahn 1995). Allard et al. (1991) dalam penelitiannya menggunakan tall fescue menemukan bahwa perlakuan radiasi rendah menyebabkan penurunan kerapatan stomata pada kedua permukaan daun dan pengaruh paling kuat adalah terhadap kerapatan stomata pada epidermis abaksial.
Selain stomata, pada lapisan epidermis daun kedelai juga ditemukan bulu daun atau trikoma. Trikoma memiliki peranan ekologis yang cukup penting antara lain : mengurangi evaporasi dengan cara melindungi stomata dari suhu yang terlalu tinggi, menurunkan suhu daun dengan cara merefleksikan radiasi surya, serta meningkatkan ketebalan daun dan menurunkan transpirasi (Velasco et al. 2001). Bentuk, ukuran, struktur dan tempat trikoma, dan komposisi eksudat yang dihasilkannya sangat beragam di antara spesis dan karena itu digunakan dalam taxonomi untuk membedakan spesies atau hibrida yang hubungan kekerabatannya sangat dekat (Valkama et al. 2003). Pada kedelai cultivar Clark, kepadatan trikoma telah menjadi penciri untuk membedakan galur-galur isogenik dan Clark tetraploid (Rosaria et al.2004).
Lapisan kedua setelah sel-sel epidermis adalah sel-sel palisade, terdiri dari satu atau dua baris, panjang sel-sel dalam barisan yang berbeda dapat sama, semakin ke tengah ukuran sel-sel menjadi lebih pendek. Jaringan palisade biasanya terdapat di bawah lapisan epidermis adaksial daun. Genotipe kedelai yang ditumbuhkan pada kondisi cahaya penuh memiliki palisade lebih dari satu lapisan sehingga daun menjadi lebih tebal sedangkan genotipe yang ditumbuhkan pada kondisi cahaya 50% hanya memiliki satu lapisan palisade sehingga daun menjadi lebih tipis (Khumaida 2002).
Lapisan ketiga adalah mesofil palisade, terdiri dari sel- sel berbentuk tiang yang mengandung 15 – 30 kloroplas. Mesofil daun kedelai terdiri dari 5 – 6 lapisan interior (Lersten dan Calson 1987). Pada daun yang ternaungi, terjadi pengurangan jumlah sel-sel mesofil sehingga helaian daun menjadi lebih tipis (Allard at al. 1991).
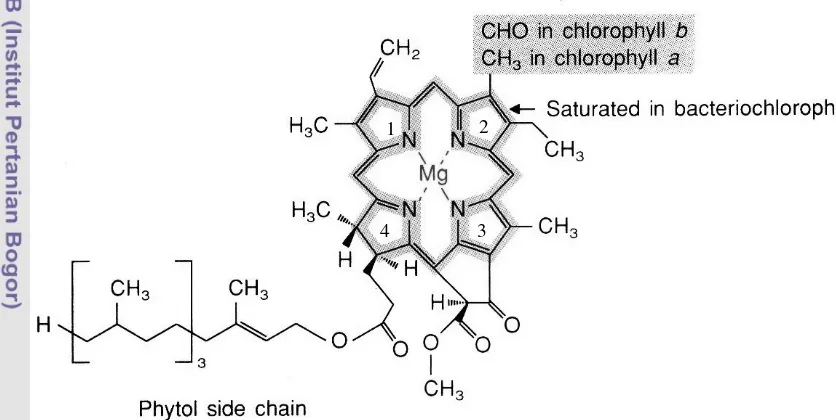
Kloroplas terdapat dalam sitoplasma dan mengandung DNA, RNA, ribosom, serta enzim. Kloroplas pada tumbuhan tingkat tinggi selalu mengandung dua jenis klorofil, klorofil a (C55H72O5N4Mg) dan klorofil b (C55H70O6N4Mg), keduanya dibedakan oleh adanya gugus methyl (CH3) pada klorofil a dan gugus aldehid (CHO) pada klorofil b (Malkin dan Niyogi 2000).
9
mengandung 200 – 300 molekul klorofil dan 40 molekul karotenoid. Pigmen fotosintetik menyerap cahaya pada panjang gelombang 400 – 700 nm dan biasa disebut pigmen pemanen caha ya atau antena (Taiz dan Zeiger 2002) (Gambar 3). Kandungan klorofil berkorelasi dengan laju fotosintesis total sehingga evaluasi potensi hasil dapat dilakukan melalui analisis kandunga n klorofil (Lersten dan Carlson 1987).
Fotosintesis
Proses fotosintesis memegang peranan kunci dalam siklus hidup tanaman. Proses ini terdiri dari tiga bagian yang terpisah : (i) reaksi terang, dimana energi radiasi diabsorbsi dan digunakan untuk menghasilkan senyawa berenergi tinggi ATP dan NADPH, (ii) reaksi gelap, meliputi reduksi biokimia CO2 menjadi gula menggunakan senyawa berenergi tinggi yang dihasilkan pada reaksi terang, dan (iii) suplai CO2 dari udara ke tempat reduksi di kloroplas (Malkin dan Niyogi 2000).
Secara umum, fotosintesis dipengaruhi oleh umur daun, genotipe tanaman, besarnya kebutuhan hasil asimilat oleh sink, dan pengaruh lingkungan seperti kesuburan tanah, kandungan CO2 di atmosfir, kelembaban, suhu, dan cahaya. Dalam kondisi tanpa cekaman, intensitas cahaya merupakan faktor lingkungan terpenting yang menyebabkan perbedaan laju fotosintesis (Sinclair dan Torrie 1989).
Efisiensi konversi energi dalam tanaman yang didefinisikan sebagai kandungan energi dalam bobot kering tanaman dibagi dengan total energi surya yang tersedia sangat rendah (Frageria 1991). Pada intensitas cahaya rendah, tanaman yang dapat berfotosintesis secara efisien akan mempunyai kecepatan pertumbuhan yang lebih besar dan akan sukses dalam berkompetisi, seperti yang terjadi pada vegetasi yang rapat atau pada habitat yang ternaungi (Lawlor 1987).
Penangkapan Cahaya oleh Kanopi Tanaman
Cahaya tampak (visible light) sebagai sumber energi yang digunakan tumbuhan untuk fotosintesis merupakan bagian spektrum energi radiasi. Energi radiasi memiliki karakteristik yang khas, yang dapat dijelaskan dengan dua macam teori; teori gelombang elektromagnet dan teori kuantum (Malkin dan Niyogi 2000). Teori gelombang elektromagnet menyatakan bahwa cahaya merambat melalui ruangan sebagai suatu gelombang, jumlah gelombang yang merambat melewati titik tertentu dalam interval tertentu dinyatakan sebagai frekuensi. Teori kuantum menyatakan bahwa cahaya merambat dalam bentuk aliran partikel yang disebut foton; energi yang terkandung dalam satu foton disebut satu kuantum dan berbanding lurus dengan frekuensi tetapi berbanding terbalik dengan panjang gelombang. Jadi cahaya memiliki sifat gelombang dan sifat partikel (Salisbury dan Ross 1992).
Reaksi cahaya dalam fotosintesis merupakan akibat langsung penyerapan foton oleh molekul- molekul pigmen pemanen cahaya. Tingkat energi yang cocok untuk mengaktifkan pigmen pemanen cahaya berada pada kisaran 390 – 760 nm. Foton di atas 760 nm tidak memiliki cukup energi untuk aktivitas fotosintesis, sedangkan foton di bawah 390 nm memiliki energi yang terlalu banyak sehingga dapat merusak pigmen.
11
densitas aliran foton fotosintesis atau photosynthetic photon flux density (PPFD) dengan satuan µmol.m-2.det-1.
Untuk memahami bagaimana cahaya mempengaruhi fotosintesis secara kuanti-tatif, harus ditelaah berapa banyak energi cahaya yang disediakan oleh matahari. Pada puncak atmosfer, pada jarak bumi- matahari rata-rata, total radiasi matahari (termasuk cahaya infra merah dan ultraviolet) adalah sebesar 1360 J.m-2.det-1, nilai ini disebut konstanta matahari. Pada saat cahaya matahari menuju permukaan bumi, banyak energi yang hilang karena diserap atau dipantulkan oleh uap air, debu, dan gas-gas lainnya yang terkandung dalam atmosfer. Hanya sekitar 900 J.m-2.det-1 yang diterima oleh permukaan bumi; terdiri dari 50% cahaya infra merah, 5% cahaya ultraviolet, dan sisanya adalah cahaya dengan panjang gelombang 400 – 700 nm (PAR) dengan kandungan energi sebanyak kira-kira 400 J.m-2.det-1. Sekitar 80% dari PAR tersebut akan diserap oleh daun sedangkan sisanya (20%, yakni cahaya hijau) diteruskan atau dipantulkan. Dari jumlah yang diserap daun, lebih dari 95% hilang dalam bentuk panas dan hanya kurang dari 5% yang berhasil dimanfaatkan untuk fotosintesis (Salisbury dan Ross 1992).
Cahaya yang tiba pada permukaan sehelai daun terdiri dari empat komponen : (1) cahaya langsung, (2) cahaya difus, (3) cahaya refleksi, dan (4) cahaya transmisi (Valladares 2003). Daun-daun pada lapisan kanopi atas (yang tidak ternaungi) lebih banyak memperoleh cahaya langsung dan cahaya difusi untuk proses fotosintesisnya, sedangkan daun-daun sebelah bawah atau bagian dalam kanopi memperoleh cahaya fotosintesis dalam bentuk cahaya difusi, cahaya yang direfleksikan dan ditransmisikan oleh daun lain, serta yang direfleksikan oleh permukaan lain seperti dari tanah.
Sumbangan keempat komponen cahaya di atas terhadap proses fotosintesis pada suatu tanaman tergantung jumlah ketebalan dan tipe daun dalam kanopi. Ketebalan kanopi dapat dinilai dari indeks luas daun (LAI) yang menunjukkan luas permukaan daun yang menutupi satu satuan luas tanah. Hubungan antara kecepatan pengurangan cahaya yang melewati suatu kanopi dengan LAI dapat disederhanakan dengan rumus :
IL = Io.e-kLAI; ………...………..(1)
dimana Io dan IL masing- masing adalah cahaya yang mengalir di atas kanopi pada titik yang bersesuaian dengan LAI lapisan-lapisan daun dan k adalah koefisien peredaman (Atwell et al. 1999). Sitompul dan Guritno (1995) juga menyebutkan bahwa pendekatan sederhana untuk menghitung kuanta cahaya yang diintersepsi adalah menghitung selisih antara kuanta cahaya datang dengan cahaya yang direfleksikan dan yang ditransmisikan.
June (2003) menjelaskan bahwa fotosintesis bersih kanopi yang merupakan integrasi dari laju fotosintesis dan respirasi seluruh daun yang ada di dalam kanopi dipengaruhi oleh kapasitas fotosintesis di tingkat daun, intersepsi cahaya oleh kanopi, status nitrogen kanopi, dan faktor fisik lingkungan lainnya. Lebih lanjut disebutkan bahwa laju fotosintesis di dalam daun dapat dijelaskan oleh persamaan mekanistik dengan asumsi bahwa laju fotosintesis dikendalikan oleh jumlah enzim Rubisco yang aktif, laju regenerasi RuBP (yang ditentukan oleh transpor elektron dari cahaya yang ditangkap oleh daun), serta tekanan parsial CO2 (ci) dan O2 di lokasi dimana CO2 difiksasi. Pada kondisi lingkungan tertentu, laju fotosintesis A (µmol.m-2.s-1) dapat dinyatakan sebagai laju yang dikendalikan ole h Rubisco Av atau dikendalikan oleh laju
transpor elektron Aj (untuk regenerasi RuBP) yang mempunyai nilai terkecil pada ci tertentu. Pernyataan tersebut dapat disederhanakan dalam bentuk persamaan-persamaan sebagai berikut (June 2003) :
Ai = R
c c J i i − Γ + Γ − * * 2 4 ………..(2)
Av = R
c K O K c V i c i c − + + Γ − 0 * max 1 ………...(3)
A = min (Aj, Av) ………...(4)
13
Michaelis-Menten untuk carboxylation dan oxygenation oleh Rubisco (Pa); Vc max = laju maksimum aktivitas Rubisco di dalam daun; dan J = laju transpor elektron (µ mol.m-2.s-1). Selanjutnya, hubungan antara fotosintesis daun (A, µmol.m-2.s-1) dengan cahaya yang diterima tanaman (I, µmol.m-2.s-1) dapat dirumuskan sebagai berikut :
A = Ia A Ia A Ia A −R
Θ Θ − + − + 2 4 )
( 2 max 2 2 max
max 2
…………..……..(5)
Amax = laju fotosintesis pada kondisi jenuh cahaya (µmol.m-2.s-1), T = pembengkokan kurva respon A terhadap I (curvature factor) yang nilainya bervariasi dari 0 (rectangular hyperbola) sampai 1 (two straight lines quasi Blackman), a2 = quantum yield dari fotosintesis pada cahaya rendah (efisiensi fotosintesis). Pada level cahaya rendah, A ≈ a2I
sehingga a2 dapat diduga dari slope kurva hubungan A dan I (Thornley & Johnson 1990 dalam June 2003).
Dari persamaan 2, A dapat diubah menjadi J sehingga hubungan antara laju transpor elektron dengan cahaya yang diterima (I, µmol.m-2.s-1), dapat dirumuskan sebagai berikut (June 2003) :
J =
(
)
Θ Θ − + − + 2
4 2 max
2 max 2 max
2 J Ia J Ia J
Ia
………(6)
Jmax = laju transpor elektron maksimum (pada kondisi jenuh cahaya) pada daun (µmol.m
-2
.s-1), dan J = laju transpor elektron aktual. Hasil- hasil penelitian terdahulu menyebutkan bahwa T tidak dipengaruhi oleh suhu, tetapi nilainya lebih dipengaruhi oleh distribusi cahaya dalam daun (June 2002 dalam June 2005a).
Efisiensi penggunaan cahaya (e), disebut juga efisiensi kanopi didefenisikan sebagai jumlah mol CO2 yang diasimilasikan (Ac) per satuan mol cahaya yang diserap
(Ic); jadi e = Ac/Ic. ……….………..(7)
Nilai e menunjukkan seberapa efisien kanopi menggunakan PAR untuk asimilasi CO2 (June 2003).
Mekanisme Penangkapan dan Penggunaan Cahaya
direfleksikan (Hale dan Orchut 1987). Sebelumnya, Levitt (1980) telah membuat hipotesis bahwa adaptasi terhadap intensitas cahaya rendah dicapai melalui mekanisme penghindaran (avoidance) (Gambar 3) dan mekanisme toleransi (tolerance) (Gambar 4).
Mekanisme penghindaran. Dalam mekanisme penghindaran, tersedia dua cara yaitu : (i) meningkatkan total intersepsi caha ya melalui peningkatan luas daun, dan (ii) meningkatkan persentase cahaya yang digunakan dalam fotosintesis melalui penurunan jumlah cahaya yang direfleksikan dan yang ditransmisikan (Levitt 1980, Lawlor 1987). Penghindaran intensitas cahaya rendah dilakukan dengan cara tidak mengembangkan kutikula, lilin, dan bulu-bulu rambut pada permukaan daun serta meniadakan pigmen antosianin (Levitt 1980).
Beberapa mekanisme penghindaran intensitas cahaya rendah yang dihipotesiskan Levitt (1980) telah terbukti pada kedelai, seperti : (1) meningkatnya luas daun (Khumaida 2002, Sopandie et al. 2003a dan 2003b), dan (2) meningkanya pigmen fotosintesis (Khumaida 2002, Sopandie et al. 2003a dan 2003b, Handayani 2003). Meskipun demikian terdapat beberapa mekanisme penghindaran intensitas cahaya rendah yang belum diteliti terutama yang terkait dengan penurunan jumlah cahaya yang direfleksikan (Gambar 3 kotak 5) dan pemborosan penangkapan cahaya (Gambar 3 kotak 7) serta perubahan efisiensi fotosintesis.
Pada daun kedelai terdapat bulu-bulu rambut (trikoma) yang kepadatannya tergantung genotipe (Rosario et al. 2004). Trikoma memiliki peranan penting antara lain menurunkan suhu daun dengan cara merefleksikan kelebihan cahaya (Velasco et al. 2001). Gardner et al. (1991) juga menyebutkan bahwa daun kedelai cenderung menggulung daunnya ke atas sehingga trikoma pada permukaan bawah daun dapat merefleksikan kelebihan cahaya. Berdasarkan informasi tersebut, dapat dihipotesiskan bahwa kedelai tertentu akan memiliki mekanisme pengindaran intensitas cahaya rendah dengan cara mengurangi atau menghilangkan trikomanya (Gambar 3 kotak 8).
15
bahwa antosianin merupakan kelompok senyawa flavonoid yang terletak dalam sel-sel epidermis dan berperanan sebagai pelindung sel-sel di bawahnya terhadap kerusakan oleh sinar UV. Informasi tersebut menunjukkan bahwa adanya antosianin dalam kondisi intensitas cahaya rendah akan merugikan tanaman, sehingga dapat diperkirakan kedelai yang adaptif terhadap intensitas cahaya rendah akan mengurangi antosianin (Gambar 4 kotak 9).
Mekanisme toleran. Toleransi terhadap intensitas cahaya rendah dilakukan dengan menurunkan titik kompensasi cahaya dan respirasi (Gambar 5). Pada titik kompensasi cahaya (LCP) yaitu cahaya pada permukaan daun yang menginduksi kecepatan asimilasi CO2 aktua l sama dengan kecepatan evolusi O2 respirasi, dalam
Meningkatkan efisiensi penangkapan cahaya (1)
Meningkatkan area penangkapan cahaya (2)
Meningkatkan penangkapan cahaya per unit area fotosintestik
(3)
Meningkatkan proporsi Fotosintetik area
(4)
Menghindari cahaya yang direfleksikan
(5)
Menghindari cahaya yang ditransmisikan
(6)
Menghindari pemborosan cahaya
yang diabsorbsi (7)
Hilangnya kutikula, lilin, dan rambut pada
permukaan daun (8)
Hilangnya pigmen non kloroplas (misalanya
antosianin) (9)
Meningkatnya kandungan kloroplas
(10)
Meningkatnya kandungan pigmen per
kloroplas (11)
Meningkatnya kandungan kloroplas per sel mesofil
(12)
Meningkatnya kandungan kloroplas dalam sel epidermis
(13)
Gambar 4 Adaptasi tanaman naungan yang berperanan penting dalam avoidance terhadap defisit cahaya (Levitt 1980)
[image:34.596.83.518.71.668.2]kond isi demikian asimilasi CO2 bersih sama dengan nol (zero). Tanaman naungan ditandai oleh rendahnya titik kompensasi cahaya sehingga dapat mengakumulasi produk fotosintetik pada tingkat cahaya yang rendah dibandingkan tanaman cahaya penuh. Disamping itu tanaman naungan juga memperlihatkan kejenuhan cahaya pada level cahaya rendah.
Titik kompensasi cahaya pada tanaman gandum yang adaptif terhadap intensitas cahaya rendah adalah sekitar 10 W/m2 sedangkan yang peka sekitar 18 W/m2. Penurunan cahaya dari 90 ke 45 W/m2 menurunkan titik kompensasi cahaya dari 11.1 menjadi 1.9 W/m2. Adaptasi ini membutuhkan waktu sekitar 8 hari (Levitt 1980). Titik kompensasi cahaya pada daun gandum dewasa juga meningkat selama siang hari; berkorelasi dengan kecepatan respirasi. Hubungan ini mengisyaratkan bahwa respirasi merupakan komponen utama titik kompensasi cahaya (Azcon-bieto dan Osmond, 1983). Namun demikian, informasi yang spesifik tentang fisiologi daya adaptasi tanaman yang toleran dan peka terhadap intensitas cahaya rendah masih sangat sedikit.
[image:35.596.87.525.131.500.2]Pada kedelai, mekanisme toleransi intensitas cahaya rendah yang telah dipelajari baru sebatas “menghindari penurunan aktivitas enzim fotosintesis” (Gambar 4 kotak 6)
Gambar 5 Adaptasi tanaman naungan yang berperanan penting terhadap toleransi defisit cahaya ; LCP = light compensation point (Levitt 1980)
Toleransi defisit cahaya (1)
Menurunkan LCP (2) Menurunkan kecepatan
respirasi di bawah LCP (3)
Menghindari kerusakan sistem fotosintetik
(4) Menurunkan kecepatan
respirasi mendekati LCP (5)
Menghindari penurunan aktivitas enzim
(6)
Menurunkan sistem respiratory (mitokondria
dan enzim) (9) Menurunkan
substrat respirasi (8)
Menghindari kerusakan pigmen
17
(Khumaida 2002, Sopandie et al. 2003a dan 2003b). Masih banyak kotak-kotak hipotesis yang belum dipelajari. Dalam penelitian ini, selain ingin memperkuat hasil- hasil penelitian terdahulu seperti aktivitas enzim rubisco (kotak 6), juga akan dilengkapi dengan pengamatan aktivitas enzim SPS (kotak 6), laju respirasi dan aktivitas enzim respirasi MDH dan AI (kotak 3), serta kandungan sukrosa dan pati (kotak 8).
Fotosintesis pada Kondisi Intensitas Cahaya Rendah
Aklimasi fotosintetik pada kondisi cahaya rendah memiliki karakteristik tertentu. Daun yang dikembangkan pada kondisi cahaya rendah menunjukkan peningkatan jumlah klorofil (Evans 1987) dan rendahnya akumulasi karbohidrat (Makino et al. 1997). Tanaman yang memperoleh naungan mengandung klorofil a dan b per unit volume kloroplas 4 hingga 5 kali lebih banyak dan mempunyai nisbah klorofil a/b lebih rendah daripada tanaman cahaya penuh sebab memiliki kompleks pemanen cahaya yang meningkat (Lawlor 1987). Daun yang ternaungi memperlihatkan perkembangan grana yang lebih intensif tetapi kapasitas transpor elektron cenderung berkurang. Sebagai contoh, transpor elektron melalui ke dua fotosistem 14 kali lebih tinggi pada kloroplas yang diekstrak dari daun cahaya penuh dibandingkan tanaman naungan. Sitokrom f dan b yang merupakan bagian transpor elektron juga berkurang pada tanaman ternaungi (Jones 1992).
Tanaman yang memperoleh cahaya penuh yang terdiri dari berbagai tanaman di daerah tropis, mencapai kecepatan fotosintesis maksimum lebih besar dari 30 µmol CO2.m-2.det-1 dan kecepatan respirasi gelap 2 µmol CO2.m-2.det-1. Tanaman naungan mempunyai kecepatan fotosintesis lebih kecil dari 10 µmol CO2.m-2.det-1 pada intensitas cahaya sekitar 1/10 dari spesies cahaya penuh dan mungkin mengalami kerusakan oleh intensitas cahaya di atas ½ dari cahaya penuh (Lawlor 1987).
Hubungan antara kecepatan fotosintesis dan konduktans stomata memperlihatkan bahwa kecepatan fotosintesis pada 20oC lebih tinggi 20-25% pada tanaman yang ditumbuhkan pada intensitas cahaya rendah dibandingkan tanaman yang ditumbuhkan pada intensitas cahaya tinggi. Konduktans stomata yang diukur pada 25oC dan 20oC lebih rendah pada tanaman yang ditumbuhkan dalam intensitas cahaya rendah (Ohashi et al. 1998).
intensitas cahaya rendah mungkin disebabkan oleh modifikasi atau perubahan enzim atau komponen yang berhubungan dengan regenerasi RuBP dan perubahan dalam level metabolit fotosintetik.
Pada spesies tanaman yang beradaptasi terhadap naungan atau daun yang tumbuh dalam naungan, fotosintesis neto mencapai kejenuhan pada PAR kurang dari 100 µmol.m-2.det-1 atau mendekati 5% cahaya penuh. Titik kompensasi cahaya juga bervariasi dari 0.5–2.0 µmol.m-2.det-1 pada spesies yang ternaungi seperti Allocasia macrorhiza hingga lebih dari 40 µmol.m-2.det-1 pada tanaman yang beradaptasi pada cahaya penuh (Jones 1996). Salisbury dan Ross (1992) menyimpulkan bahwa spesies toleran naungan memiliki ciri khas : (1) mempunyai laju fotosintesis yang jauh lebih rendah pada cahaya penuh, (2) laju fotosintesis mencapai jenuh pada tingkat radiasi yang jauh lebih rendah, (3) pada tingkat cahaya yang sangat rendah mampu berfotosintesis dengan laju yang lebih tinggi, dan (4) memiliki titik kompensasi cahaya sangat rendah.
Pembentukan Klorofil
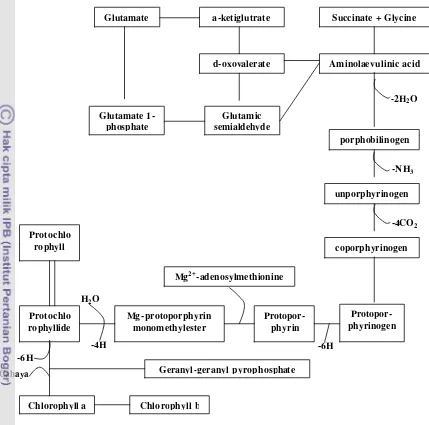
Prekursor dalam pembentukan klorofil adalah senyawa organik yang merupakan senyawa intermediet. Prekursor tersebut adalah glutamat yang mengalami deaminasi menghasilkan a-ketoglutarat, kemudian direduksi menjadi ?,d-dioxovalerate dan mengalami transaminasi menjadi d-amino- laevulinic; sintesis ini memerlukan ATP dan NADPH (Malkin dan Niyogi 2000).
Pelepasan air dari 2 molekul asam amino- laevulinic menghasilkan prophobili-nogen yang mengandung struktur cincin pyrrole. Reaksi selanjutnya adalah pelepasan NH3 dan CO2 yang kemudian membentuk protoporphyrinogen. Penambahan Mg2+ dan adenosylmethionine pada protoporphyrin menghasilkan Mg-protoporphyrin mono-methylester. Mg pada klorofil berfungsi sebagai pengatur absorbsi spektrum. Mg-porphyrin monomethylester mengalami dehidrasi dan reduksi menghasilkan proto-chlorophylide. Penambahan proton H+ akan menghasilkan chlorophylide a. Cahaya yang diabsorbsi oleh protochlorophylide akan mereduksi chlorophylide a menjadi klorofil a. Jadi, pembentukan klorofil a sangat dipengaruhi cahaya (Lawlor 1987). Klorofil b merupakan bentuk spesial dari klorofil a yang dalam reaksinya membutuhkan O2 dan NADPH2. Klorofil menyusun sekitar 4% bobot kering kloroplas, dan klorofil b berjumlah 1/3 dari klorofil a (Hall dan Rao 1999).
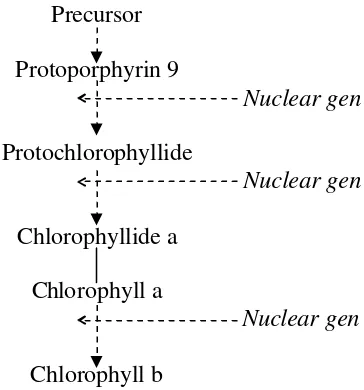
19
yaitu : (1) lintasan reaksi antara protoporphyrin 9 dan protochlorophyllide (Rissler et al. 2002, Nagata et al. 2005), (2) konversi protochlorophyllide menjadi chlorophyllide (Heyes et al. 2006), dan (3) lintasan sintesis chlorophyll b (Tanaka et al. 1998, Espineda et al. 1999, Malkin dan Niyogi 2000). Kendali gen-gen nukleus terhadap sintesis klorofil tersebut dapat diringkas seperti dalam Gambar 6. Reaksi-reaksi yang terlibat dalam sintesis klorofil secara lengkap disajikan pada Gambar 7 sedangkan struktur kimia klorofil a dan b disajikan pada Gambar 8.
Prekursor klorofil Mg-protoporhyrin 9 dan monomethylesternya (Gambar 7) merupakan kandidat untuk molekul plastid-derived dalam memberi isyarat cahaya dari kloroplas ke nukleus; ukuran pool porphyrin yang mengandung Mg dan protoporphyrin 9 meningkat jika kultur Chlamydomonas dipindahkan dari gelap ke cahaya; peningkatan ini bersamaan dengan akumulasi mRNA yang dikode oleh gen-gen nukleus HSP70A dan HSP70B (Kropat et al. 2000).
Precursor
Protoporphyrin 9
Nuclear gen
Protochlorophyllide
Nuclear gen
Chlorophyllide a
Chlorophyll a
Nuclear gen
[image:38.596.260.442.361.556.2]Chlorophyll b
Gambar 6 Kendali inti terhadap pembentukan klorofil
Gambar 7 Reaksi lengkap sintesis klorofil a dan b (Malkin dan Niyogi 2000)
Perbedaan utama antara tanaman yang tidak ternaungi dengan tanaman ternaungi terletak pada kloroplasnya. Daun tanaman ternaungi memiliki tumpukan grana yang lebih besar, sekitar 100 tilakoid per granum yang terletak tidak teratur dalam kloroplas. Proporsi lamella pembentuk grana lebih besar dan nisbah tilakoid /stroma lebih tinggi sehingga kandungan klorofil per unit luas daun lebih tinggi serta nisbah kloroplas per unit luas daun lebih rendah (Halle dan Orcutt 1987). Khumaida (2002) menyatakan bahwa kedelai toleran (Pangrango dan B613) yang ditumbuhkan pada naungan 50% memperlihatkan grana yang lebih berkembang dengan tilakoid yang lebih banyak dalam masing- maisng grana, jumlah stroma lebih sedikit dan ukuran kloroplas lebih besar.
Glutamate a-ketiglutrate Succinate + Glycine
d-oxovalerate Aminolaevulinic acid
Glutamate 1-phosphate
Glutamic semialdehyde
porphobilinogen
unporphyrinogen
coporphyrinogen
Protopor-phyrinogen
Protopor-phyrin Mg -protoporphyrin
monomethylester Protochlo
rophyllide Protochlo rophyll
Chlorophyll a Chlorophyll b
Geranyl-geranyl pyrophosphate -4H
H2O
Mg2+-adenosylmethionine
-6H
-4CO2
-NH3
-2H2O
-6H
21
[image:40.596.87.505.303.513.2]Klorofil merupakan suatu komponen integral kompleks protein pemanen cahaya, klorofil a/b (LHC) dan klorofil a/b-binding protein pada kompleks pusat reaksi PS I dan PS II yang ada pada membran tilakoid. Jadi pengurangan klorofil menunjukkan pemecahan (breakdown) kompleks protein atau degradasi membran tilakoid (Okada et al. 1992). Pemecahan klorofil pada daun padi dapat ditekan secara komplit dengan 1 µM Cyclohexamide. Degradasi dari protein membran tilakoid juga sangat kuat dihambat oleh cyclohexamide pada konsentrasi tersebut. Okada et al. (1992) menjelaskan bahwa selain pengaruh temperatur rendah yang memperlambat penurunan klorofil, kehilangan klorofil pada kondisi ternaungi dihambat oleh adanya Cyclohexamide. Kehilangan klorofil sedikit dirangsang oleh adanya chloramphe nicol.
Gambar 8 Struktur kimia klorofil a dan b (Beecker et al. 2000)
Pembentukan Antosianin
Selain pigmen fotosintetik seperti klorofil dan karotenoid, tanaman juga memiliki pigmen non fotosintetik yaitu antosianin. Antosianin merupakan produk metabolisme sekunder, termasuk golongan flavonoid dan dikenal sebagai pigmen yang menyebabkan warna merah jambu, ungu dan biru. Menurut Buchanan et al. (2000), antosianin dibentuk dari asam amino phenylalanine melalui lintasan sikimat di sitoplasma dan ditimbun dalam vakuola sel parenkim dewasa (Gambar 9). Antosianin merupakan bentuk glikosida dari berbagai jenis antosianidin yang dibentuk dari dihidroflavonol (Salisbury dan Roos 1992). Phenylalanine ammonia lyase (PAL) merupakan enzim
1 2
kunci dalam metabolisme antosianin. Aktivitas enzim tersebut meningkat bersamaan dengan bertambahnya umur daun (Buchanan et al. 2000), adanya cahaya ultra violet dan cahaya tampak, cekaman hara terutama nitrogen dan fosfor, cekaman kekeringan, serta cekaman suhu rendah (Hoch et al. 2003).
Gambar 9 Lintasan pembentukan antosianin. Enzim yang terlibat adalah PAL (Phenylalanine Ammonia Lyase); CHS (Chalcone synthase); CHI (Chalcone Isomerase); F3H (Flavanone-3-hydroxylase); dan DR (Dihydroflavonol 4-reductase) (Buchanan et al. 2000)
Berdasarkan sejumlah penelitian diketahui bahwa antosianin mempunyai distribusi yang luas pada daun, dapat ditemukan pada sel epidermis bagian atas atau bawah, atau sel-sel mesofil dan biasanya mempunyai absorbsi pada panjang gelombang 270-290 nm (UV) dan 500-550 nm (visible spectrum) (Woodall dan Stewart 1998). Acylasi antosianin dengan asam organik aromatik meningkatkan penyerapan pada daerah UV di panjang gelombang 310-320 nm. Hal ini memperlihatkan fungsi antosianin untuk mencegah kerusakan asam nukleat, protein, dan apparatus fotosintesis akibat radiasi UV.
Shikimat Siklus Calvin
Phenylalanine
Cinnamate
Naringenin chalcone
Flavan-3,4-diols
Anthocyanin 4-Coumarate Metabolisme Primer
Metabolisme Sekunder
4-Coumaryl-CoA
3 malonyl-CoA
Naringenin
3-hydroxyflavones
PAL1 PAL2 PAL3
CHS
CHI
F3 H
23
Hopkins dan Huner (2004) juga menjelaskan bahwa antosianin menyerap cahaya antara 475 nm dan 560 nm dan mentransmisikan cahaya biru dan merah.
Respirasi
Semua sel hidup aktif melakukan respirasi. Secara umum reaksi respirasi dapat dirangkum sebagai : C6H12O6 + 6O2 → 6CO2 + 6H2O + energi, tetapi biasanya hanya beberapa substrat respirasi yang dioksidasi secara lengkap menjadi CO2 dan H2O, sisanya digunakan dalam proses sintesis, terutama dalam sel yang sedang tumbuh. Energi yang ditangkap dari proses oksidasi sempurna beberapa senyawa digunakan untuk sintesis molekul lain yang dibutuhkan untuk pertumbuhan. Bila tumbuhan sedang tumbuh aktif, laju respirasi meningkat sebaga i akibat permintaan pertumbuhan. Beberapa senyawa yang hilang dialihkan ke dalam reaksi sintesis dan tidak pernah muncul sebagai CO2. Atom karbon dalam senyawa yang sedang terespirasi dapat diubah menjadi CO2 atau menjadi molekul besar lainnya [seperti asam amino untuk protein, nukleotida untuk asam nukleat, prazat karbon untuk pigmen porfirin (seperti klorofil dan sitokrom), lemak, sterol, karotenoid, flavonoid (seperti antosianin), dan senyawa aromatik tertentu lainnya (seperti lignin)], tergantung pada sel yang terlibat, lokasinya dalam tumbuhan, dan apakah tumbuhan sedang tumbuh cepat atau tidak. Jadi, total respirasi = pertumbuhan + pemeliharaan. Pertumbuhan tergantung pada tipe biomassa dan pertumbuhan baru sedangkan pemeliharaan tergantung pada faktor lingkungan yang mempengaruhi respirasi dan eksistensi biomassa (Taiz dan Zeiger 2002).
Glikolisis. Glikolisis merupakan urutan reaksi yang mengubah glukosa, glukosa-1-P, atau fruktosa menjadi asam piruvat di sitosol dan merupakan tahap pertama dari tiga fase respirasi yang sangat berkaitan; diikuti oleh siklus Krebs dan pengangkutan elektron yang berlangsung di mitokondria. Sukrosa, pati, dan fruktan merupakan sumber utama substrat untuk glikolisis. Umumnya, jika heksosa melimpah, glikolisis dan tahap lain respirasi berlangsung lebih cepat dibandingkan dengan bila heksosa sedikit (Salisbury dan Ross 1992).
substrat ini dapat pula diamati melalui jumlah daun bagian bawah yang mati lebih cepat (Salisbury dan Ross 1992).
ATP- fosfofruktokinase (ATP-PFK) dapat bertindak sebagai enzim pertama glikolisis yang mengkatalisis pembentukan fruktosa-1,6-bisfosfat. Heksosa fosfat yang terbentuk dalam reaksi ini tidak dapat digunakan untuk membentuk sukrosa atau pati, sehingga titik ini menjadi titik pengendalian keseluruhan lintasan glikolisis. Aktivitas ATP-PFK dihambat oleh ATP, PEP, dan asam sitrat, tetapi ditingkatkan oleh Pi (Salisbury dan Ross 1992). Dengan demikian, kandungan ATP, asam sitrat, dan Pi dapat dijadikan indikator tinggi- rendahnya respirasi yang berlangsung pada suatu tanaman. Kandungan ATP dan asam sitrat yang tinggi akan menyebabkan kecepatan respirasi berkurang, demikian pula kandungan Pi yang rendah. Pada padi, terdapat kecenderungan peningkatan kandungan ATP akibat naungan, dan peningkatan yang relatif tinggi terjadi pada genotipe toleran naungan (Lautt 2000).
Siklus Kre bs. Salah satu enzim pengatur pada tahap pertama daur Krebs adalah kinase yang menggunakan ATP untuk memfosforilasi gugus hidroksil dari berbagai gugus residu asam amino treonin pada bagian tertentu dan enzim pyruvat dehydrogenase. Fosforilasi ini segera menon-aktifkan enzim sehingga daur Krebs terhenti. Enzim pengatur kedua adalah fosfatase, menghidrolisis fosfat agar lepas dari treonin dan mengaktifkan kembali enzim tersebut sehingga daur Krebs dapat mengoksidasi lagi pyruvat. Karena itu jika tingkat ATP di mitokondria tinggi dan jika kinase aktif maka daur Krebs terhenti atau lambat sehingga melambatkan semua proses respirasi berikut-nya di mitokondria (Salisbury dan Ross 1992). Dengan demikian, kandungan ATP yang tinggi, dapat dijadikan indikator tinggi-rendahnya respirasi dalam tanaman.
25
Tanaman memperoleh energi dari oksidasi gula menjadi CO2 dan H2O selain melalui glikolisis dan siklus Krebs, juga melalui lintasan pentosa fosfat. Lintasan pentosa fosfat menghasilkan : (1) NADPH yang kemudian dioksidasi oleh mitokondria untuk menghasilkan ATP, (2) eritrosa-4-fosfat yang sangat penting sebagai prazat dalam pembentukan berbagai senyawa fenol seperti antosianin dan lignin, dan (3) ribulosa-5-fosfat yang merupakan prazat dalam pembentukan unit ribosa dan deoksiribosa di nukleotida, termasuk yang ada di RNA dan DNA (Salisbury dan Ross 1992). Berdasar-kan penjelasan tersebut, dapat diduga bahwa rendahnya produksi antosianin pada suatu tanaman dapat menjadi indikator terhadap rendahnya aktivitas pemecahan gula melalui lintasan pentosa fosfat. Hal tersebut akan menguntungkan bagi tanaman yang beradaptasi pada kondisi cahaya rendah karena selain memungkinkan penimbunan cadangan makanan yang lebih tinggi, juga dapat menghindari pemborosan penyerapan cahaya oleh antosianin karena intensitas cahaya yang diserapnya tidak dimanfaatkan dalam proses fotosintesis (Levitt 1980).
Respirasi pada Intensitas Cahaya Rendah
Cahaya mempengaruhi kecepatan respirasi tanaman dan spesies toleran cahaya rendah memiliki kecepatan respirasi yang lebih rendah daripada tanaman cahaya penuh (Levitt 1980). Lebih lanjut disebutkan bahwa salah satu strategi tanaman agar toleran terhadap cahaya rendah adalah mengurangi kecepatan respirasinya untuk menurunkan titik kompensasi. Taiz dan Zeiger (2002) juga mengemukakan bahwa laju respirasi yang re