1
PENDAHULUAN
Latar Belakang
Kedelai (Glycine max (L) Merrill) adalah salah satu tanaman sumber pangan penting di Indonesia. Beberapa makanan populer di Indonesia seperti tahu, tempe, tauco, dan kecap menggunakan biji kedelai sebagai bahan bakunya. Kandungan protein kedelai cukup tinggi, yaitu 40 persen, sedangkan beras hanya 9 persen. Keunggulan lainnya bisa dilihat pada kandungan asam amino esensialnya. Jumlah asam amino lisin yang rendah pada beras ternyata sangat tinggi pada kedelai. Kandungan lisin pada beras 253 mg/100 g, sedangkan pada kedelai 2300 mg/100 g (Pusat Penelitian dan Pengembangan Gizi, 1995). Karena itu kedelai diharapkan dapat memperbaiki level gizi sebagian besar penduduk Indonesia dan beberapa negara Asia (Chomchalow dan Laosuwan, 1993). Penduduk miskin yng sulit memperoleh protein hewani bisa memenuhi kebutuhan gizi dari protein nabati kedelai.
Sekitar 80% kebutuhan kedelai dipergunakan untuk bahan baku industri, terutama tahu dan tempe, sedangkan 20% sisanya untuk pakan ternak dan konsumsi rumah tangga (Amang dan Sawit, 1996). Karena kebutuhan dalam negeri tidak tercukupi oleh produksi dalam negeri Indonesia mengimpor kedelai. Pada tahun 1994 impor kedelai Indonesia sekitar 628 ribu ton dan pada tahun 1999 impor itu mencapai 1301 ribu ton (BPS, 2000). Impor kedelai itu telah diupayakan dikurangi melalui strategi peningkatan produksi dalam negeri (Manwan dan Sumarno, 1996). Namun, upaya itu sulit dilaksanakan karena kenyataannya impor kedelai tetap tinggi. Pada tahun 2004 impor kedelai Indonesia sebesar 1116 ribu ton (BPS, 2005).
Strategi peningkatan produksi kedelai nasional itu dirumuskan dalam Sumber Pertumbuhan Produksi yang terdiri atas lima peluang yaitu: (a) perluasan areal panen, (b) peningkatan produktivitas, (c) peningkatan keseragaman dan stabilitas hasil, (d) penekanan senjang hasil, dan (e) penekanan kehilangan hasil panen. Dalam sumber pertumbuhan produksi tersebut peningkatkan luas areal panen dilakukan dengan pembukaan areal baru, peningkatan indeks pertanaman (IP), dan pelaksanaan tumpang sari kedelai dengan tanaman perkebunan dan kehutanan (Adisarwanto et al, 1997).
luas panen kedelai. Luas panen pada tahun 2003 sekitar 50% luas panen pada tahun 1998. Karena itu peningkatan produktivitas (yield) sekitar 10% tidak bisa mengkompensasi pengurangan luas panen dalam mempertahankan produksi nasional. Tahun 2004 produksi kedelai nasional meningkat dibanding tahun 2003 karena adanya peningkatan luas panen. Dengan produktivitas yang sama kebutuhan kedelai nasional bisa dipenuhi tanpa impor (swasembada) bila luas panen kedelai ditambah 871 ribu ha menjadi 1435 ribu ha.
Tabel 1. Produksi kedelai nasional tahun 1998 – 2004
1998 1999 2000 2001 2002 2003 2004 Luas Panen
(1000 ha)
1095 1151 825 679 545 527 563
Produksi (1000 ton)
1306 1383 1018 827 673 672 721
Produktivitas (kw/ha)
11.2 12.0 12.3 12.2 12.4 12.8 12.8
Sumber: BPS (1999-2005)
Peluang untuk meningkatkan luas panen kedelai nasional melalui aplikasi tumpang sari kedelai dengan tanaman perkebunan dan kehutanan cukup besar. Luas perkebunan di Indonesia tidak kurang dari 15 juta hektar. Luas perkebunan pada tahun 2002 bahkan melebihi 19 juta ha (BPS, 2003). Dengan siklus peremajaan 25 - 30 tahun, maka sekitar 3 - 4% dari luas perkebunan tersebut merupakan areal tanaman baru yang masih memungkinkan untuk ditumpangsarikan dengan kedelai sampai tanaman pokoknya (TBM) mencapai umur 2 - 3 tahun. TBM berumur 2 - 3 tahun memberi naungan sebesar 33-50 % (Asadi et al., 1997).
3
sekitar perkebunan. Hal ini berarti pengembangan kedelai di lahan perkebunan dapat meningkatkan ketahanan pangan nasional, sekaligus mempertahankan kualitas lingkungan.
Depertemen Pertanian RI melalui Program Aksi Masyarakat Agribisnis Tanaman Pangan memproyeksikan lahan tanaman kedelai pada tahun 2004 seluas 680 ribu ha atau meningkat 28% dari luas panen pada 2003. Salah satu sumber lahan yang digarap adalah lahan perkebunan rakyat seluas 11 juta ha dan kehutanan seluas 14.2 juta ha (Direktorat Jenderal Bina Produksi Tanaman Pangan, 2003).
Salah satu kendala utama dalam pengembangan kedelai pada lahan tersebut di atas adalah intensitas cahaya rendah karena tajuk pohon-pohon tersebut menaungi ruang di bawahnya. Berdasarkan penelitian pada perkebunan karet diperoleh informasi bahwa rata-rata intensitas cahaya pada areal terbuka adalah 0.773 kal cm-2 mnt-2. Intensitas cahaya di bawah tegakan karet umur 1, 2, dan 4 tahun berturut- turut sebesar 0.571 kal cm-2 mnt-1, 0.253 kal cm-2 mnt-1, dan 0.216 kal cm-2 mnt-1 atau berarti memberi naungan 26%, 67%, dan 72% terhadap areal terbuka.(Sukaesih, 2002). Sementara itu, naungan 20% sudah digolongkan ke dalam agroklimat yang tidak sesuai bagi pertanaman kedelai (Adisarwanto et al, 2000)
Reduksi cahaya oleh naungan merupakan cekaman (stres) terhadap cahaya. Levitt (1980) mendefinisikan cekaman sebagai faktor lingkungan apapun yang secara potensial tidak sesuai bagi makhluk hidup. Cekaman itu bisa menimbulkan strain. Strain adalah suatu keadaan perubahan fisik atau kimia pada makhluk hidup akibat dikenai cekaman. Strain itu bisa bersifat elastis (dapat balik) artinya keadaan akan kembali seperti semula bila cekamannya dihilangkan. Cekaman yang besar bisa menyebabkan strain permanen (plastis) yang berarti kerusakan atau bahkan kematian pada organisme.
tanaman ditentukan oleh faktor pembatas tersebut walaupun faktor lain dalam kondisi optimum.
Tanaman membutuhkan radiasi cahaya matahari sebagai sumber energi untuk menggerakkan proses-proses biokimia dalam fotosintesis. Naungan membuat ketersediaan cahaya, terutama intensitas berkurang. Dalam keadaan ternaungi cahaya menjadi faktor pembatas. Perbedaan karakteristik tanaman sebagaimana diatur oleh gennya menyebabkan kemampuan tanaman untuk beradaptasi terhadap kondisi ternaungi berbeda pula.
Walaupun sumber cahaya adalah sama yaitu matahari, namun banyaknya penyerapan energi matahari oleh sehelai daun bisa berbeda-beda. Perbedaan tersebut disebabkan antara lain oleh halangan awan di atmosfer, naungan di atas tanaman, atau bahkan oleh bagian tanaman (daun) yang lain.
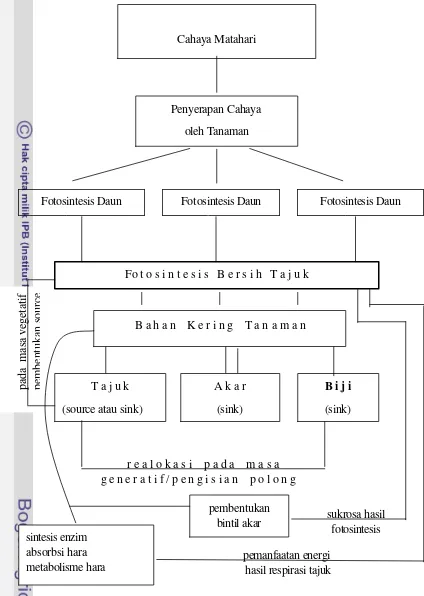
Fotosintesis bersih tajuk adalah jumlah fotosintesis daun total. Fotosintesis ini menghasilkan sukrosa dan pati yang selanjutnya dengan hara mineral yang diabsorbsi disintesis menjadi bahan kering tanaman. Energi yang digunakan untuk menyusun bahan kering juga berasal dari hasil fotosintesis. Bahan kering tanaman ini bisa berupa tajuk, akar, dan biji (Gardner et al, 1990).
Energi yang tersimpan dalam karbohidrat kemudian bisa dipakai untuk sintesis protein, enzim serta absorbsi hara. Baik enzim maupun hara penting bagi proses produksi kedelai. Pada kedelai bintil akar juga mensuplai hara N. Pembentukan bintil memerlukan sukrosa hasil fotosintesis. Pengurangan energi yang diterima tanaman menyebabkan penurunan hasil fotosintesis yang pada giliran berikutnya menurunkan cadangan energi, bahan kering tanaman (termasuk daun), dan pertumbuhan bintil. Akhirnya, berkurangnya penyerapan energi matahari menyebabkan penurunan produksi tanaman (Gambar 1).
Radiasi matahari optimum untuk fotosintesis kedelai adalah berkisar antara 0.3 – 0.8 kal cm-2 mnt-1. Pada radiasi 0.430 kal cm-2 mnt-1 fotosintesis mencapai maksimum (White dan Izquierdo, 1993). Pengurangan intensitas radiasi matahari yang ditimbulkan oleh naungan bisa menyebabkan cekaman yang selanjutnya menyebabkan strain yang kemudian menyebabkan penurunan hasil biji per tanaman.
5
batang, jumlah polong dan hasil biji kedelai. Perlakuan tersebut pada awal pengisian polong menurunkan jumlah polong, hasil biji, dan kandungan protein biji (Baharsjah et al, 1985).
Penelitian tentang naungan juga dilaporkan oleh Sunarlim (1985). Naungan pada penelitian tersebut menyebabkan antara lain kenaikan kandungan klorofil daun dan bobot 100 biji, penurunan jumlah polong dan produksi biji per tanaman. Penelitian ini menunjukkan bahwa naungan tidak mempengaruhi kadar N daun, bobot spesifik daun secara nyata. Namun, penelitian ini belum membedakan respon yang berbeda antar genotipe yang berbeda ketenggangannya.
Naungan 50% menyebabkan penurunan produksi biji antara 0 – 46% terhadap kontrol. Ceneng dan B613 menunjukkan paling toleran, sedangkan Godek paling peka (Sopandie et al, 2002). Selanjutnya, Ceneng dan Godek bisa menjadi model dan bahan tanaman yang utama untuk penelitian dan pengembangan, yang masing-masing mewakili genotipe toleran dan peka.
Pemuliaan tanaman kedelai telah dilakukan pada kondisi naungan ringan (33 %) yaitu pada tumpang sari dengan jagung, sedangkan pada kondisi naungan berat (50 %) yaitu pada tumpang sari dengan tanaman perkebunan belum pernah dilakukan. Penurunan hasil kedelai dengan naungan ringan seperti tumpang sari jagung - kedelai mencapai 2 - 56%. (Asadi et al, 1997). Peningkatan cekaman (stres) cahaya dalam bentuk naumgan 50% akan menyebabkan strain dan pengurangan hasil lebih besar.
Program pemuliaan untuk memperoleh varietas kedelai unggul toleran naungan dilakukan dengan lima tahap yaitu: (a) pencarian sumber gen toleran, (b) hibridisasi, (c) seleksi tanaman F2 - F5, (d) uji daya hasil, dan (e) uji adaptasi dan pelepasan varietas unggul. Strategi yang ditempuh adalah menambah sumber gen toleran naungan dan meningkatkan pengetahuan tentang mekanisme toleransi (Asadi et al., 1997). Untuk itu penelitian dan pengetahuan tentang fisiologi tanaman perlu ditingkatkan.
tertentu menentukan hasil (yield) tanaman. Pengetahuan tentang proses fisiologi yang menentukan hasil inilah yang dipakai untuk menduga potensi hasil dan toleransi cekaman. Dengan pengetahuan yang meningkat, maka keuntungan praktispun akan segera dapat diperoleh (White dan Izquierdo, 1993).
Studi fisiologi terhadap tanaman toleran naungan akan memberi banyak manfaat mengingat keterkaitan naungan dengan proses fisiologi dalam tanaman. Sebuah studi (Kerstiens, 1998) menunjukkan adanya dugaan bahwa tanaman toleran naungan dapat menghasilkan bahan kering lebih tinggi dengan perlakuan penambahan CO2 dibanding tanaman yang peka naungan.
Informasi tentang pengaruh naungan terhadap pertumbuhan dan fisisologi kedelai seyogyanya bisa dirunut dari hasil penelitian tanaman padi yang dinaungi. Pada kondisi ternaungi, genotipe padi gogo toleran naungan mempunyai kemampuan intersepsi cahaya dan kandungan klorofil a dan b yang lebih tinggi. Kelompok ini juga mampu mempertahankan sintesis pati dan sukrosa serta aktivitas sukrosa fosfat sintase (Lautt et al, 2000) dan enzim rubisco (Sopandie et al, 2003a) lebih tinggi dibanding kelompok peka naungan pada saat dinaungi. Informasi ini menunjukkan bahwa padi gogo toleran naungan memiliki kemampuan penghindaran dan toleransi yang lebih baik daripada yang peka pada kondisi naungan berat.
Pada kedelai informasi tersebut belum terungkap sehingga perlu dilakukan penelitian. Hasil penelitian yang mengungkapkan perbedaan perubahan karakter bisa mengungkapkan mekanisme adaptasi tanaman kedelai terhadap naungan apakah melalui mekanisme penghindaran atau mekanisme toleransi atau keduanya.
Manfaat Penelitian
7
Penerapan hasil penelitian ini berupa peningkatan produksi produksi pertanian khususnya kedelai melalui peningkatan indeks pertanaman dan pemanfaatan lahan tidur. Selanjutnya, hasil penelitian ini akan memberi dampak dalam:
a. peningkatkan kualitas lingkungan, khususnya kesuburan tanah dan perlindungan tanah terhadap erosi,
b. perlindungan hutan dan perkebunan dari kerusakan akibat penebangan dan penga-lihan fungsi atau penyerobotan,
c. peningkatan ketahanan pangan dan keamanan sosial melalui penyediaan sumber pangan berkualitas gizi baik.
Kerangka Pemikiran
Sekitar 75 persen (600 000 ha) kedelai dibudidayakan secara tumpang sari. Kebanyakan berupa tumpang sari jagung - kedelai dan kedelai-ubi kayu. Tajuk pada jagung dan ubi kayu memberi naungan maksimal 33%. Karena itu penelitian naungan pada kedelai selama ini dilakukan pada naungan 33% (Asadi, et al, 1997).
Pemanfaatan lahan-lahan di bawah tegakan pohon perlu ditingkatkan mengingat kecenderungan penurunan luas panen kedelai secara nasional. Lahan tidur dan tak termanfaatkan di bawah tegakan tanaman perkebunan dan kehutanan berpotensi cukup besar untuk pengembangan kedelai. Namun, upaya pengembangan kedelai tersebut menghadapi kendala, terutama pada ketersediaan galur-galur yang toleran naungan. Tajuk pohon karet memberi naungan yang lebih besar dari 33% apabila karet telah berumur 2 tahun (Lampiran 1). Karena itu perlu penelitian untuk naungan berat (50%) bila kita hendak mengembangkan kedelai di bawah tegakan pohon karet umur 2 tahun.
Menurut Levitt (1980) tanaman mampu beradaptasi terhadap intensitas cahaya rendah melalui mekanisme penghindaran dan toleransi. Mekanisme penghindaran defisit cahaya dilakukan dengan meningkatkan efisiensi penangkapan cahaya. Mekanisme toleransi terhadap defisit cahaya diperoleh melalui kemampuan tanaman mengurangi respirasi, mengurangi derajat penurunan aktivitas enzim dan kerusakan pigmen.
Merunut dan membandingkan penelitian naungan yang telah dilakukan pada kedelai dan padi gogo, maka terdapat beberapa informasi yang belum terungkap pada kedelai tentang mekanisme penghindaran dan toleransi. Gambar 2 menunjukkan skema pengaruh cahaya terhadap tanaman serta mekanime penghindaran dan toleransi berdasarkan hasil penelitian yang telah diperoleh.
Perubahan anatomi dan morfologi sebagai mekanisme penghindaran telah dilakukan untuk beberapa genotipe (Sopandie et al, 2002; Sopandie et al, 2005). Namun, mekanisme penghindaran untuk genotipe lain juga perlu diteliti. Perubahan karakter daun akibat perlakukan cahaya ekstrim (gelap total) juga belum pernah dilakukan. Selain itu, pembahasan tentang persentase perubahan karakter daun yang berhubungan dengan mekanisme penghindaran perlu dipertajam.
Penelitian pada padi gogo menunjukkan bahwa padi toleran mampu mempertahankan kandungan rubisco dan aktivitasnya tetap tinggi (Sopandie et al, 2003a). Genotipe padi gogo yang toleran naungan juga memiliki rasio sukrosa/pati dan aktivitas enzim sukrosa fosfat sintase (SPS) lebih tinggi dibanding padi peka naungan saat dinaungi 50% (Lautt et al, 2003). Selanjutnya, genotipe padi gogo yang toleran naungan memiliki tingkat respirasi gelap lebih rendah dibanding yang peka Semua peubah tersebut menunjukkan mekanisme adaptasi melalui toleransi yang belum diungkap pada kedelai.
9
Tujuan Penelitian
Tujuan penelitian ini adalah mengkaji mekanisme adaptasi tanaman kedelai terhadap intensitas cahaya rendah melalui mekanisme penghindaran (avoidance) maupun toleransi (tolerance). Mekanisme tersebut dikaji berdasarkan respon berbagai genotipe kedelai terhadap intensitas cahaya rendah melalui perubahan karakter produksi, karakteristik daun, dan fisiologi yang berhubungan dengan fotosintesis dan respirasi.
Hipotesis
Hipotesis dalam penelitian ini adalah:
a. Intensitas cahaya rendah menyebabkan penurunan produksi lebih besar pada genotipe peka daripada genotipe toleran
b. Genotipe toleran menunjukkan perubahan karakter daun yang lebih besar daripada genotipe peka sehingga mempunyai mekanisme penghindaran lebih baik.
Fotosintesis Daun Fotosintesis Daun Fotosintesis Daun
Fo t o s i n t e s i s B e r s i h T a j u k
r e a l o k a s i p a d a m a s a
g e n e r a t i f / p e n g i s i a n p o l o n g
Gambar 1. Hubungan ketersediaan energi cahaya dengan proses metabolisme untuk produksi biji kedelai (Gardner et al, 1990)
pemanfaatan energi hasil respirasi tajuk
sukrosa hasil fotosintesis pada masa vegetatif pembentukan source
Cahaya Matahari
Penyerapan Cahaya oleh Tanaman
T a j u k (source atau sink)
A k a r (sink)
B i j i
(sink)
pembentukan bintil akar sintesis enzim
absorbsi hara metabolisme hara
11
Kekurangan Cahaya
Kerkurangan cahaya karena naungan
Kerkurangan cahaya karena kondisi gelap
Mengakibatkan (pada kedelai): - Penurunan hasil biji
- Penurunan laju fotosintesia aktual dan maksimum - Tetap menghasilkan butir pati
- Perkembangan membran tilakoid tetap baik - Perubahan jumlah cabang utama
- Menambah panjang (tinggi) tanaman (etiolasi)
Mengakibatkan (pada kedelai): - Penurunan bobot kering kedelai - Fotosintesis bersih negatif - Tidak menghasilkan butir pati - Tilakoid tidak berkembang
Respon untuk menghindari defisit cahaya dengan meningkatkan efisiensi penangkapan cahaya (pada padi dan kedelai):
- Peningkatan kandungan klorofil a - Peningkatan kandungan klorofil b
- Penurunan rasio kandungan klorofil a terhadap klorofil b - Peningkatan rasio luas/ bobot daun
- Penipisan daun, pengurangan bulu daun
Respon untuk toleran terhadap kondisi defisit cahaya (pada padi):
- Mempertahankan perimbangan kandungan sukrosa/pati dan aktivitas enzim SPS dan rubisco tetap tinggi
- Kandungan N terlarut daun meningkat
1. Perlakuan singkat on/off
2. Perlakuan variasi pergiliran gelap- naungan/ terang
Mengakibatkan:
- Perubahan kandungan karbohidrat daun?
- Adaptasi dan penyembuhan? -
Respon untuk toleran
dengan menurunkan tingkat respirasi gelap (pada padi)
13
Studi Pendahuluan
Evaluasi 75 genotipe (Elfarisna, 2000)
Perbanyakan Benih
Evaluasi Ulang terhadap Daya Adaptasi in situ (Percobaan di Bawah Tegakan Pohon Karet di Sukabumi)
(Sukaesih, 2002; Sopandie et al, 2001)
Penelitian Disertasi
Produktivitas dan Mekanisme Adaptasi Kedelai pada Naungan Sejak Tanam sampai Panen
(Percobaan di Kebun Cikabayan IPB) 1. Respon delapan genotipe terhadap naungan - Produksi (penelitian 1)
2. Identifikasi karakter struktur daun (penelitian 2) - morfologi dan anatomi daun
- klorofil
3. Identifikasi karakter fisiologi (penelitian 3) - aktivitas enzim rubisco
- perimbangan sukrosa/pati - N daun
- aktivitas enzim SPS
Penelitian Disertasi
Studi Mekanisme Adaptasi pada Cekaman Ekstrim (on/off) melalui Variasi Pergiliran Gelap - Terang
(Percobaan di Kebun Cikabayan IPB) 1. Perubahan struktur daun (penelitian 2) 2. Perubahan fisiologi (penelitian 3)
Penelitian Disertasi
Percobaan 1-A Percobaan di
Sukabumi
Penelitian Disertasi
Percobaan II
Penelitian Disertasi
15
TINJAUAN PUSTAKA
Kedelai
Kedelai (Glycine max (L) Merrill) merupakan anggota keluarga Papilonaceae. Kedelai adalah tanaman semusim berbentuk semak-semak rendah, tumbuh tegak dengan panjang batang antara 100 – 200 cm. Akar kedelai bisa membentuk bintil akar yang berbentuk bulat atau tidak beraturan yang merupakan koloni bakteri Rhizobium japonicum. Hubungan saling menguntungkan (mutualisme) antara bakteri dengan kedelai ini terjadi karena bakteri memperoleh karbohidrat dari hasil fotosintesis kedelai, sedangkan kedelai memperoleh suplai nitrogen yang ditambat dari udara (Hidayat, 1985).
Jumlah buku dan panjang ruas kedelai tergantung genotipe, panjang hari, dan tipe tumbuh. Pembentukan buku pada tanaman selesai pada umur 35 hari. Jumlah buku, cabang dan diameter batang bisa turun bila lingkungan tumbuhnya kekurangan cahaya (Lersten dan Carlson, 1987).
Agronomi dan Produksi Tanaman
Kemampuan kedelai untuk berproduksi tergantung kepada potensi genetik yang tersimpan dalam benihnya serta lingkungan tumbuhnya yang mensuplai cahaya, air, dan hara mineral (Iowa State University, 1994). Bahan kering total kedelai merupakan hasil tajuk tanaman dalam memanfaatkan radiasi matahari yang tersedia selama masa pertumbuhan. Proses yang menentukan produksi tanaman adalah akumulasi dan partisipasi bahan kering. Akumulasi bahan kering merupakan pertumbuhan tanaman dan hasil langsung dari keseimbangan fotosintesis dan respirasi serta kehilangan karena senesens dan absisi. Partisipasi adalah keseimbangan antara pertumbuhan vegetatif dan generatif (Gardner et al, 1990).
Pertumbuhan tanaman pada dasarnya disebabkan pertambahan atau pembesaran sel. Proses pembesaran sel dimulai dari air yang berdifusi ke dalam sel sehingga menimbulkan tekanan hidrostatis. Tekanan hidrostatis ini menekan dinding sel ke arah luar sehingga sel mengembang dan membesar (Taiz dan Zeiger, 1991; Salisburry dan Ross, 1992).
al, 1990). Respirasi gelap ini bisa untuk pertumbuhan atau pemeliharaan (Smith, 1997). Akhirnya, produksi biji kedelai tergantung kepada kekuatan biji sebagai sink untuk menarik biomasa menjadi biomasa biji ( Shibels et al, 1987).
Produksi tanaman ditentukan oleh pertumbuhan dan perkembangan. Pertumbuhan ialah penambahan pada ukuran tanaman, berupa jumlah daun, jumlah buku, tinggi dan bobot kering tanaman. Perkembangan menyangkut perubahan fase siklus hidup, yaitu perkecambahan, inisiasi cabang bunga, pembungaan, dan pengisian biji (White dan Izquierdo, 1993).
Kapasitas dan laju fotosintesis daun kedelai sangat dipengaruhi oleh usia daun dan kondisi lingkungan (Shibels et al, 1987). Laju fotosintesis daun meningkat sejalan dengan pertambahan luasnya, lalu mencapai maksimum untuk beberapa lama yang tergantung pada genotipe dan posisi daun, kemudian menurun. Penurunan ini disebabkan terutama oleh kehilangan kapasitas fotosintesis, disamping penurunan konduktansi stomata terhadap air dan udara. Penurunan kapasitas fotosintesis ini berkorelasi positif dengan pengurangan N dan aktifitas mobilisasi.
Saat intensitas cahaya rendah kecepatan fotosintesis berbanding lurus (linear) dengan PPFD (photosynthetic photon flux density). Semakin bertambah intensitas cahaya, perbandingan tersebut semakin mengecil sampai mencapai laju fotosintesis maksimum. Laju fotosintesis daun kedelai maksimum dicapai pada saat radiasi 300 W m-2 atau 0.430 kal cm-2 mnt-1 (White dan Izquierdo, 1993).
Penelitian Khumaida (2002) menunjukkan bahwa genotipe Ceneng (toleran), Pangrango (toleran), Orba (moderat), dan Godek (peka) mencapai fotosintesis maksimum pada intensitas cahaya yang sama yaitu sekitar 1500 µmol cm-2 dtk-1. Baik pada kedelai yang beradaptasi terhadap cahaya penuh maupun yang ternaungi fotosintesis maksimum dicapai pada intensitas cahaya yang sama. Namun, laju fotosintesis dan fotosintesis maksimum lebih rendah pada kedelai yang ternaungi.
17
Fotosintesis
Cahaya berperan sangat penting dalam kehidupan tanaman. Cahaya mempengaruhi pertumbuhan produksi biomasa tanaman melalui fotomorfogenesis dan fotosintesis. Total energi yang masuk dan tersimpan dalam sistem tanaman tergantung kepada laju fotosintesis per unit area dan luas bagian tanaman yang menerima cahaya. Kecepatan fotosintesis tergantung kepada cahaya, umur daun, tahap perkembangan tanaman, kandungan N daun, status air, temperatur, konsentrasi CO2, dan distribusi (penyebaran) daun (Raper dan Kramer, 1987). Di bawah kondisi suhu 20 - 30o C dan kelembaban optimum, serta jenuh cahaya bisa diketahui AP (apparent photosynthesis) potensial kedelai yang juga mencerminkan aparatus fotosintesis (Shibels et al, 1987).
Hasil fotosintesis tajuk ditentukan oleh efisiensi fotosintesis daun dan penerimaan cahaya. Kapasistas penerimaan cahaya tergantung antara lain oleh banyaknya radiasi dan efisiensi penerimaannya (Gardner et al, 1990). Dengan kata lain, akumulasi bahan kering tergantung kepada banyaknya radiasi cahaya tersedia dan kemampuan tanaman menangkap, menyerap, dan memanfaatkan cahaya. Jadi naungan akan menyebabkan produksi biji kedelai turun karena radiasi tersedia yang sampai ke badan tanaman berkurang. Dalam hal kapasitas, naungan tidak menyebabkan penurunan yang signifikan.
Proses Fotosintesis
Peranan fotosintesis sangat penting dalam manajemen produksi tanaman karena hampir semua produksi tanaman didominasi oleh komponen karbohidrat yang merupakan hasil akhir fotosintesis. Sementara itu, metabolisme lipid dan protein yang juga merupakan komponen hasil utama memerlukan unsur karbon hasil fotosintesis.
Dalam fotosintesis energi cahaya diserap oleh klorofil dan berbagai pigmen. Pada fotosintesis energi matahari digunakan untuk mereduksi CO2 menjadi gula. Klorofil adalah pigmen hijau penyerap cahaya: Chl + hν → Chl*. Energi cahaya yang ditangkap digunakan
Pada dasarnya fotosintesis adalah suatu reaksi redoks yang digerakkan oleh cahaya. Reaksi fotosintesis terdiri atas 3 tahapan yaitu: (1) tahap antena menangkap cahaya dan mentransfernya ke pusat reaksi, (b) tahap rangkaian reaksi transfer elektron dan fotofosforilasi, serta (c) metabolisme karbon. Metabolisme karbon adalah suatu rangkaian proses reaksi yang disebut siklus PCR (photosinthetic carbon reduction). Siklus PCR terdiri atas karboksilasi, reduksi, dan regenerasi. Dalam karboksilasi CO2 masuk siklus PCR melalui reaksinya dengan ribulose 1, 5 bisphosphate (RuBP) yang menghasilkan 3-phosphoglycerate (3-PGA). Reaksi ini dikatalisis oleh enzim ribulose bisphosphate carboxylase/ oxygenase (rubisco). Kelompok tanaman yang menangkap CO2 atmosfir dengan RuBP disebut tanaman C3. Salah satunya ialah kedelai.
Tanaman C3 dan Fiksasi Karbon
Produksi tanaman sangat ditentukan oleh produksi bahan kering yang dalam fisiologi ditentukan oleh selisih CO2 udara yang diserap melalui fotosintesis dan CO2 yang dilepas tanaman melalui respirasi. Selama pertumbuhan umumnya respirasi tanaman menggunakan 25 - 30 % total fotosintesis sehingga ada selisih positif yang digunakan untuk pertumbuhan (akumulasi) bobot kering. Bila respirasi lebih tinggi daripada fotosintesis (tanaman diletakkan dalam gelap sehingga tidak ada fotosintesis) maka bobot tanaman akan berkurang (Gardner et al., 1990).
Berdasarkan perbedaan proses fiksasi karbondioksida tanaman bisa digolongkan menjadi tanaman C3, C4, dan CAM. Kedelai dimasukkan ke dalam tanaman C3 yang efisien memanfaatkan cahaya (Gardner et al, 1990 dan Specht, 1999). Pada tanaman C3 karbondioksida atmosfer diikat oleh RuBP menjadi 3-PGA yaitu suatu molekul 3-karbon. Tanaman C4 menangkap CO2 udara dengan fosfoenol piruvat (PEP) untuk menghasilkan molekul 4-karbon. Fiksasi CO2 pada tanaman CAM juga menghasilkan molekul 4-karbon. Perbedaannya, pada CAM karbondioksida diikat pada malam hari (yaitu saat stomata terbuka maksimum) dengan menggunakan energi glikolisis. Pada siang terik dan stomata tertutup tanaman CAM hanya menjalankan reaksi terang. Jika kondisi air mencukupi beberapa tanaman CAM juga bisa bertindak seperti tanaman C3 (Gardner et al., 1990; Taiz dan Zeiger, 1991)
19
mengubah riboluse-5-phosphat menjadi RuBP. ATP dan NADPH hasil reaksi terang juga digunakan untuk mengubah 3-PGA menjadi 3-PGAld. Keseluruhan proses ini disebut siklus Calvin. Pada tanaman C3 siklus Calvin berlangsung di sel mesofil.
Pada tanaman C4 fiksasi CO2 udara oleh PEP dikatalisis oleh enzim phosphoenol pyruvate (PEP) carboxylase. ATP hasil fotofosforilasi digunakan untuk mengubah piruvat menjadi PEP. Penangkapan CO2 udara oleh PEP berlangsung di sel mesofil, tetapi siklus Calvinnya berlangsung di sel seludang pembuluh (Gardner et al., 1990; Taiz dan Zeiger, 1991)
Selain perbedaan dalam proses penangkapan CO2 tanaman C3 dan C4 juga berbeda dalam hal berikut, yaitu: (a) anatomi, (b) efisiensi penangkapan CO2 dan kecepatan fotosintesis, dan (c) kandungan rubisco dan adaptasi. Tanaman C4 memiliki kloroplas di sel seludang pembuluh, sedangkan tanaman C3 tidak punya. Untuk tanaman C3, kloroplas di mesofil menjadi tempat bagi pengikatan CO2, proses siklus Calvin, dan akumulasi pati. Untuk tanaman C4, pati tidak terbentuk di sel mesofil karena siklus Calvin berlangsung di sel seludang (Gardner et al., 1990).
Tanaman C4 mempunyai tingkat efisiensi pengikatan CO2 dan kecepatan fotosintesis lebih tinggi, tetapi efisiensi pemakaian energi lebih rendah. Enzim PEP karboksilase mempunyai afinitas terhadap CO2 lebih tinggi dibanding rubisco sehingga pada level CO2 rendah fotosintesis tanaman C4 lebih efisien. Karena itu, pada intensitas cahaya tinggi tanaman C4 mempunyai efisiensi fotosintesis lebih tinggi. Namun, efisiensi energi pada tanaman C4 lebih rendah karena sebagian ATP digunakan untuk membentuk PEP. Jadi pada kondisi intensitas cahaya rendah, hasil fotosintesis berupa karbohidrat bisa lebih rendah (Gardner et al., 1990)
Tanaman C3 mempunyai kandungan rubisco per bobot kering daun lebih tinggi dibanding tanaman C4. Tetapi, tanaman C3 tidak memiliki enzim PEP karboksilase. Karena stomata menutup pada kondisi kering dan panas, maka tanaman C4 yang efisien dalam menangkap CO2 akan lebih adaptif untuk ditanam pada daerah kering dan panas dibanding tanaman C3 (Gardner et al, 1990). Dengan demikian tanaman C4 lebih responsif terhadap perubahan radiasi cahaya daripada tanaman C3.
dibanding tanaman C4. Pada tanaman C4 fotorespirasi sangat rendah karena CO2 dikonsentrasikan terlebih dulu di sel-sel seludang pembuluh. Pengkonsentrasian CO2 ini menyebabkan rasio CO2 terhadap O2 meningkat sehingga lebih cocok untuk RuBP karboksilase daripada RuBP oksigenase. Fotorespirasi memungkinkan aminasi untuk sintesa asam amino dan mempertahankan fosfat inorganik bersiklus sehingga lebih cocok dan menguntungkan pada kondisi intensitas cahaya rendah dan temperatur sejuk (Gardner et al., 1990; Taiz dan Zeiger, 1991). Hampir semua tanaman lantai hutan tergolong tanaman C3 (Smith, 1997). Tanaman C3 teraklimisasi pada cahaya rendah karena memiliki laju respirasi gelap rendah dan titik jenuh cahaya yang rendah (Salisburry dan Ross, 1992).
Daun dan Produksi Tanaman
Daun tanaman budidaya kebanyakan mempunyai (a) permukaan luar rata dan luas, (b) lapisan pelindung atas dan bawah, (c) beberapa stomata per satuan luas, (d) ruang udara yang saling berhubungan di dalamnya, (e) sejumlah banyak kloroplas, dan (f) saluran pembuluh. Yang ideal untuk fotosintesis ialah daun yang bertebal satu sel untuk memaksimumkan intersepsi cahaya per unit volume dan meminimumkan jarak yang harus dilalui untuk pertukaran gas (Gardner et al., 1990).
Daun juga perlu perlindungan terhadap lingkungan, maka daun juga perlu beberapa lapis sel dan lapisan permukaan pelindung. Lapisan kutikula dan lilin bersifat transparan dan dapat dilalui cahaya, tetapi tidak dapat dilalui CO2. Karena itu daun mempunyai jendela pada permukaannya berupa stomata (Gardner et al., 1990).
Anatomi Daun dan Stomata
Sel-sel palisade biasanya dijumpai pada bagian adaxial (atas) daun, berbentuk tiang, dan mengandung klorofil. Sel parenkima palisade bisa berbentuk barisan dengan satu lapisan atau dua lapisan. Panjang selnya bisa sama atau semakin mengecil bila menuju ke bagian tengah mesofilnya (Lersten dan Carlson, 1987).
Stomata terletak di bagian epidermis. Stomata merupakan pintu untuk pertukaran gas antara jaringan dalam tumbuhan dan lingkungannya. Pada tumbuhan darat, umumnya stomata tersebar pada epidermis bawah. Beberapa tanaman mempunyai stomata pada kedua permukaan daunnya.
21
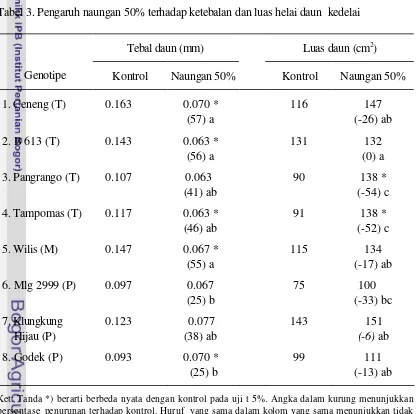
di tempat yang cahayanya kurang (Lersten dan Carlson, 1987). Penurunan stomata karena naungan juga terjadi pada manggis (Garcinia mangostana) (Wiebel et al, 1999) dan Amborella trichopoda (Field et al, 2001). Penelitian Sopandie et al (2002) menunjukkan bahwa naungan 50% menyebabkan penurunan kerapatan stomata. Dalam hal ini kelompok genotipe toleran mengalami persentase penurunan lebih sedikit dibanding genotipe peka, yaitu masing-masing 12% dan 32%.
Ketersediaan cahaya dan konsentrasi CO2 menjadi faktor pembatas bagi kecepatan fotosintesis tumbuhan. Untuk mengefektifkan penerimaan dan penangkapan cahaya susunan sel-sel palisade dan bunga karang dibuat sedemikian sehingga cahaya bisa terdistribusi dalam sel mesofil dan penangkapan cahaya secara total optimum. Tumbuhan juga bisa mengatur letak kloroplas dan mengorientasikan daun sesuai dengan arah dan intensitas cahaya. Dalam situasi ternaungi kloroplas mengumpul ke dekat lapisan epidermis sehingga daun tampak lebih hijau (Taiz dan Zeiger, 1991).
Daun bisa beradaptasi dengan lingkungan untuk meningkatkan fotosintesis melalui pengaturan laju pertukaran gas. Kecepatan pertukaran gas pada daun tergantung kepada banyaknya stomata per luas daun dan lebar pembukaan stomata. Di sini stomata adalah jendela yang bisa dilalui gas dan air. Konduktansi stomata mencerminkan kondisi kemudahan stomata untuk pertukaran gas CO2 dan air. Semakin banyak dan lebar pembukaan stomata maka semakin tinggi konduktansi stamota dan semakin tinggi pertukaran CO2 per satuan luas daun. Karena itu konduktansi stomata juga mencerminkan level fotosintesis (Taiz dan Zeiger, 1991).
Kloroplas
Stroma mengandung banyak ribosom, bahan protein, dan protein. Rubisco menempati lebih 50 persen bagian dari protein stroma. Proses reduksi karbondioksida (reaksi gelap) terjadi di stroma, sedangkan transformasi energi cahaya menjadi energi kimiawi (reaksi terang) terjadi di lamela. Pembentukan potensi kimia terjadi karena transformasi energi cahaya membentuk gradien proton antara sisi membran. Dengan bantuan enzim ATP sintase perbedaan gradien digunakan untuk mengubah ADP menjadi ATP dan NADP menjadi NADPH. Selanjutnya, ATP dan NADPH dipergunakan dalam proses perubahan karbondioksida (CO2 ) menjadi karbohidrat, molekul -molekul organik serta proses biologi lain (Gardner et al, 1990; Newcomb, 1990; Mullet, 1990).
Pigmen dalam kloroplas sebagian besar berupa klorofil (a dan b) serta karotenoid (karotin dan xantofil). Klorofil merupakan pigmen fotosintesis yang terdapat pada membran tilakoid dalam kloroplas. Pada tumbuhan tingkat tinggi, termasuk kedelai selalu terdapat dua jenis klorofil a (C55H72O5N4Mg) dan klorofil b (C55H70O6N4Mg). Klorofil bergabung dalam suatu kompleks yang disebut fotosistem.
Klorofil adalah pigmen penyerap cahaya utama. Karotenoid bisa tidak aktif, bisa menyerap cahaya dan mentranfer elektron ke klorofil, atau mentrafer elektron antar fotosistem. Cahaya yang diserap daun berbeda dengan yang diserap oleh kloroplas. Yang paling banyak diserap oleh klorofil adalah cahaya merah, kemudian biru dan yang paling sedikit adalah cahaya hijau (Gardner et al, 1990; Hall dan Rao, 1999). Cahaya yang diserap daun tetapi tidak diserap klorofil, tidak dapat dimanfaatkan untuk fotosintesis.
Sel meristematik akar, tajuk, embrio, endosperma, dan daun muda yang sedang berkembang berisi proplastid. Proplastid tidak berwarna. Proplastid tidak atau sedikit memiliki membran dalam, tidak punya klorofil, serta perangkat fotosintesisnya tidak lengkap untuk kerja fotosintesis. Perkembangan kloroplas dari proplastid di batang dan daun dipicu oleh cahaya. Setelah terkena penyinaran proplastid membesar dan terjadi perubahan: (a) enzym terbentuk dalam proplastid atau diimpor dari sitosol, (b) pigmen penyerap cahaya terbentuk, (c) membran dalam berkembang cepat membentuk lamela stroma dan grana (lamela yang bertumpuk) yang jelas (Taiz dan Zeiger, 1991; Newcomb, 1990)
23
berdiferensiasi: (a) prolamela menjadi tilakoid dan lamela stroma (b) protoklorofil menjadi klorofil. Kloroplas juga bisa kembali jadi etioplas bila dikenai gelap panjang (Gardner et al, 1990; Taiz dan Zeiger, 1991). Kloroplas yang usang dan tidak berfungsi berubah menjadi kromoplas. Di sini lamela stroma dan grana teracak dan klorofilnya hancur. Namun, kromoplas juga bisa balik menjadi kloroplas (Newcomb, 1990).
Pada tanaman yang mengalami etiolasi, yaitu tanaman yang ditumbuhkan pada tempat gelap secara terus menerus kloroplas tidak berkembang normal, tetapi menjadi etioplas. Etioplas berwarna kuning karena adanya protoklorofil, dan bukan klorofil. Membran dalamnya disebut badan prolamelar. Bila menerima cahaya etioplas menjadi kloroplas ditandai dengan: protoklorofil menjadi klorofil dan badan prolamelar menjadi grana dan lamela stroma (Newcomb, 1990; Taiz dan Zeiger, 1991).
Peranan cahaya dalam pembentukan klorofil terdapat pada dua proses (Gambar 4), yaitu pada regulasi ekspresi gen untuk komplek pemanen cahaya (gen cab) dan pada perubahan protoklorofilida (Pchl) menjadi klorofil ( Mohr dan Schopfer, 1995). Selanjutnya, seperti diperlihatkan pada Gambar 5 klorofil b bisa terbentuk dari bahan klorofil a (Schoefs dan Bertrand, 1997). Hambatan pembentukan gen cab bisa disebabkan oleh tingkat kandungan karbohidrat yang tinggi pada daun (Madore, 1997).
Klorofil dan Adaptasi terhadap naungan
Tanaman merespon kondisi lingkungan berintensitas cahaya rendah dengan meningkatkan kandungan klorofil, mengurangi ketebalan daun, dan mengurangi rasio klorofil a terhadap klorofil b (Taiz dan Zeiger, 1991; Zhao dan Oosterhuis, 1998; Johnston dan Onwueme, 1998).
gen cab
hv
Pr Pfr
hv
apoprotein Light Harvesting Complex II
ALA PChl Chl (klorofil dalam LHC II) Gambar 4. Peranan cahaya dalam pembentukan klorofil daun ( Mohr dan Schopfer, 1995)
cahaya
PChl a
Chlide a
Chl a
Pchl b
Chlide b
Chl b
Gambar 5. Peranan cahaya pada proses pembentukan klorofil a dan b (Schoefs dan Bertrand, 1997).
25
Cahaya dan Tanaman
Matahari adalah sumber energi bagi kehidupan. Besarnya radiasi surya yang diterima oleh suatu area di bumi pada satu hari dipengaruhi oleh: (a) sudut sinar terhadap titik tersebut, (b) panjang hari, (c) besarnya atmosfir yang dilalui sinar, dan (4) partikel di atmosfir. Pada daerah tropik sudut sinar dan panjang hari hampir tetap. Besarnya atmosfir yang dilalui tergantung kepada waktu harian. Pada sekitar jam 12 siang matahari tepat tegak lurus di atas, sehingga jarak atmosfer yang dilalui paling pendek. Pada pagi hari atau sore hari matahari membentuk sudut lancip dengan permukaan bumi dan jarak atmosfir yang dilalui sinar matahri lebih panjang. Pada daerah tropis basah partikel air (awan) dan asap bisa menyebabkan cahaya yang sampai ke permukaan bumi berkurang (Gardner et al., 1990).
Karakteristik Cahaya
Cahaya yang bisa dimanfaatkan untuk fotosintesis adalah cahaya tampak, yaitu cahaya dengan panjang gelombang 400 - 700 nm. Spektrum cahaya pada gelombang tersebut meliputi cahaya ungu, biru, hijau, kuning, oranye, merah. Cahaya infra merah (tidak termasuk cahaya tampak) mempunyai panjang gelombang 700 - 1000 nm. Energi matahari berada dalam foton yang bisa bergerak secara bergelombang. Reaksi cahaya pada proses fotosintesis diawali saat absorpsi foton oleh pigmen klorofil.
PFD (photon flux density) adalah banyaknya foton yang mengenai suatu luasan permukaan per satuan waktu. PPFD (photosyntetic photon flux density) atau PAR (photosynthetically active radiation) adalah PFD yang terbatas pada panjang gelombang paling efisien bagi fotosintesis yaitu 400 - 700 nm.
Intensitas cahaya rendah berarti cahaya ber-PFD rendah sehingga PPFD-nya juga rendah. Pada situasi ternaungi oleh tanaman perkebunan atau paranet PPFD yang diterima permukaan daun tidak konstan. Maka, besarnya foton yang diterima daun bukanlah hasil perkalian PPFD (X) kali waktu (T) atau X.T, tetapi merupakan kumpulan hasil Xi.Ti setiap saat atau ∑(Xi.Ti).
Berdasarkan perbedaan responnya terhadap panjang hari tanaman digolongkan pada tanaman hari netral, hari pendek dan hari panjang. Kedelai termasuk tanaman hari pendek (Dennis, 1988; Tomkins dan Shipe, 1996). Pada panjang hari melebihi 15 jam kedelai tidak atau terlambat berbunga. Dari berbagai percobaan diketahui bahwa yang menginduksi pembungaan adalah panjang masa gelapnya. Perlakuan fotoperiodisme pada tahap R5 (awal pembentukan biji) menunjukkan kandungan total karbohidrat nonstruktural (TNC) di daun lebih besar pada perlakuan hari panjang daripada perlakuan hari pendek (Cure et al, 1985). Efek paling nyata dari fotoperiodisme adalah: (a) jumlah buku dari batang utama, (b) tinggi tanaman, (c) permulaan berbunga. (d) umur kematangan biji.
Energi cahaya rendah hanya untuk menginduksi inisiasi pembungaan, sementara untuk perkembangan bunga selanjutnya diperlukan energi cahaya yang lebih tinggi. Buktinya, produksi bunga turun drastis karena naungan. Pada apel penurunan menjadi 37%, 25% dan 11% cahaya penuh menurunkan pembungaan berturut-turut sebesar 40%, 56%, dan 76% (Masaya dan White, 1993).
Cahaya dan Fitokrom
Durasi periode malam (gelap) diterjemahkan dalam sel tanaman oleh fitokrom ( Masaya dan White, 1993). Penghitungan malam dimulai dari suatu tingkat Pr dalam tanaman. Semakin tinggi Pr berarti semakin banyak Pfr menyerap gelombang infra merah, yaitu situasi gelap. Respon fotoperiodisme hanya perlu flux cahaya 15 lux. Ini sangat rendah mengingat cahaya matahari normal sekitar 50 - 100 klux. Jadi pengaruh fotoperiodisme tidak berhubungan dengan fotosintesis (Dennis, 1988).
Fitokrom seringkali dihubungkan dengan kondisi aktif suatu enzim karena perlakuan cahaya. Fitokrom juga menyebabkan rangsangan terhadap pembentukan rubisco subunit kecil, klorofil a dan b. Gen-gen yang mengatur pembentukan rubisco subunit kecil dan protein klorofil a/b pada komplek penangkapan cahaya diaktifkan oleh cahaya melalui mekanisme perubahan fitokrom (Taiz dan Zeiger, 1991).
Faktor Pembatas pada Fotosintesis
27
rubisco, regenerasi RuBP, dan metabolisme triosfosfat. Kenyataan di alam menunjukkan bahwa dua langkah pertama yaitu aktivitas rubisco dan regenarasi RuBP yang sering menjadi faktor pembatas utama. Fakta bahwa daun yang dinaungi daun lain memiliki kecepatan fotosintesis yang lebih rendah bisa disebabkan oleh faktor pembatas di atas (Taiz dan Zeiger, 1991).
Naungan pada padi menurunkan produktivitas karena perkembangan biji terganggu dan indeks panen rendah. Naungan juga menyebabkan karbohidrat rendah dan nitrogen terlarut meningkat sehingga banyak bakal biji menjadi seteril. Selanjutnya, naungan menyebabkan gula dan pati turun (Chaturvedi, 1994).
Hang et al (1984) menunjukkan bahwa naungan pada kedelai menurunkan bobot spesifik daun dan kecepatan fotosintesis. Sebaliknya, penambahan cahaya pada akhir pembungaan menambah biji, buku, cabang berpolong, polong per buku, biji per polong, dan kandungan minyak kedelai. Naungan pada beberapa periode menurunkan bagian tanaman sepert akar, tajuk, dan polong. Reed et al (1988) menyampaikan bahwa naungan selama masa vegetatif maupun generatif menurunkan bobot kering tanaman kedelai. Sedikit berbeda, pengurangan penyinaran ternyata meningkatkan panjang tajuk pada rumput lapang (Poa pratensis L). Penambahan tajuk ini dikompensasi dengan pertumbuhan akar yang menurun (Stier et al, 1999).
Naungan dan Produksi Tanaman
Pengaruh naungan terhadap produksi tanaman bisa diketahui dari hubungan cahaya dan ATP untuk menghasilkan produk fotosintesis. Cahaya berperan sebagai sumber penggerak dalam mesin-mesin fotosistem yang dapat menghasilkan ATP. Intensitas cahaya rendah yang disebabkan oleh naungan akan mengurangi ATP yang dihasilkan dalam reaksi terang fotosintesis. Selanjutnya, ATP yang terbentuk merupakan sumber energi dalam reaksi gelap fotosintesis (Lawlor, 1987). Percobaan yang dilakukan Khumaida (2002) menunjukkan bahwa naungan menyebabkan penurunan laju fotosintesis pada semua genotipe kedelai yang diuji.
simpanan terpenting, sedangkan sukrosa adalah karbohidrat dapat ditranspor yang terpenting (Chaturvedi et al, 1994).
Naungan dapat menyebabkan penurunan produksi kedelai dan komponen produksinya. Komponen produksi yang menurun antara lain: jumlah polong, biji/polong, dan bobot biji. Sementara itu, kandungan N daun tidak dipengaruhi oleh naungan (Sakamoto dan Shaw, 1967). Terakhir, Khumaida (2002) melaporkan bahwa naungan sebesar 50 % menurunkan produksi biji per tanaman, mengurangi jumlah cabang, dan meningkatkan tinggi tanaman pada semua genotipe kedelai yang diuji. Namun pengaruh naungan terhadap bobot 100 biji bervariasi antar genotipe yang diuji.
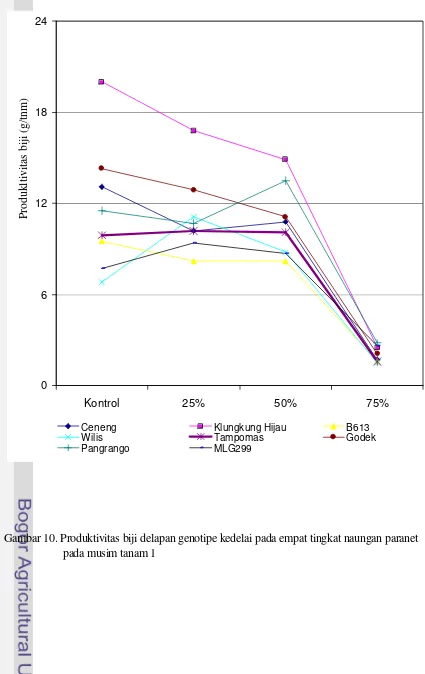
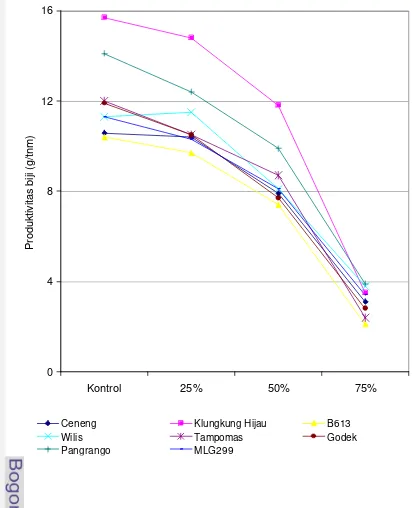
Penurunan produksi akibat naungan 50% pada genotipe kedelai antara 0 – 3%, sedangkan pada genotipe tahan antara 33 – 45%. Ceneng adalah genotipe paling toleran dengan penurunan produksi 0%, sedangkan Godek adalah genotipe paling peka dengan penurunan 45% (Sopandie et al, 2002). Khumaida (2002) menunjukkan penurunan yang berbeda pada Ceneng (toleran), yaitu sebesar 65% sehingga produksinya menjadi 35% kontrol. Namun, penurunan produksi tersebut tergolong paling kecil. Penurunan produksi Godek (peka) mencapai 80% sehingga produksinya menjadi 20% terhadap kontrol.
Naungan menyebabkan penurunan produktivitas (yield) padi IR 46, IR 64 dan Mashuri dengan persentase berbeda-beda. (Chaturvedi et al, 1994). Zhao dan Oosterhuis (1998) melaporkan bahwa naungan menyebabkan laju pertukaran CO2 (laju fotosintesis netto daun) kapas turun. Selain itu, penelitian menunjukkan bahwa naungan dapat menurunkan bobot kering dan penyerapan N yam (Dioscorea sp ) (Pushpakumari dan Sasidhar, 1996).
Naungan dan Karbohidrat
29
(Judel dan Mengel, 1982). Penurunan kandungan pati, sukrosa, glukosa, dan fruktosa juga terjadi pada padi yang diberi perlakuan gelap selama 3 hari (Sopandie et al, 2003b).
Lautt et al. (2000) melaporkan bahwa naungan menyebabkan kandungan sukrosa naik pada padi toleran naungan dan turun pada padi peka. Rasio sukrosa yang tinggi pada genotipe toleran saat dinaungi menguntungkan tanaman karena transpor fotosintat lebih lancar. Transpor fotosintat yang lancar akan dapat mengurangi hambatan fotosintesis yang disebabkan oleh penumpukan karbohidrat (pati) di daun (Shibels et al,1987).
Hasil sukrosa yang tinggi tentunya didukung oleh aktifitas enzim SPS yang tinggi saat dinaungi. Enzim ini berperan dalam mengkatalisis reaksi UDP-glukosa + Fruktosa-6-fosfat menjadi UDP + sukrosa-6 Fosfat. Sukrosa-6 Fosfat selanjutnya menjadi sukrosa dan Pi (Taiz dan Zeiger, 1991).
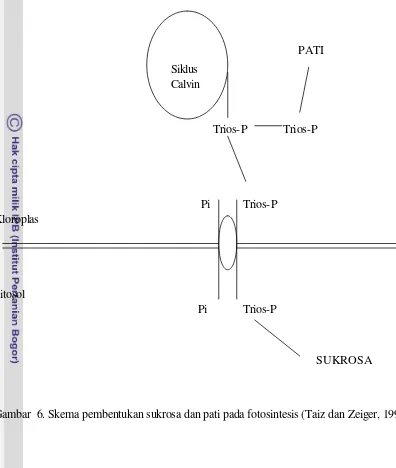
Gardner et al (1990) menyatakan bahwa pati bisa terbentuk bila laju penangkapan CO2 sangat tinggi atau adanya hambatan transfer triosfosfat dari kloroplas ke sitosol. Menurut Taiz dan Zeiger (1991) tranpor triosfosfat bisa tinggi bila proses pertukaran (dalam mekanisme antiport) antara Pi dan triosfosfat berjalan baik. Secara ringkas proses pembentukan pati dan sukrosa yang saling bersaing dipaparkan pada Gambar 6.
Hasil penelitian yang berbeda (Bell dan Danneberger, 1999) terjadi pada naungan yang diperlakukan pada creeping bentgrass turf (Agrostis palustris Huds). Hasilnya menunjukkan bahwa semakin lama naungan TNC tajuk cenderung naik. Fenomena ganjil ini dijelaskan bahwa respon tersebut berkebalikan dengan massa akar yaitu naungan mengurangi bobot akar. Jadi rumput ini mempertahankan level TNC tinggi dengan mengurangi perpanjangan akar. Levitt (1980) menjelaskan bahwa naungan bisa menurunkan kadar karbohidrat, aktivitas enzim, dan kandungan protein.
Siklus
Calvin
Trios-P Trios-P
Pi Trios-P Kloroplas
Sitosol
[image:30.596.103.499.90.558.2]Pi Trios-P
Gambar 6. Skema pembentukan sukrosa dan pati pada fotosintesis (Taiz dan Zeiger, 1991)
Cahaya dan Asimilasi Nitrogen
Tingginya kadar protein pada biji menunjukkan pentingnya metabolisme N dalam fisiologi kedelai. Protein tersusun dari atom-atom C, H, O, N dan unsur lain. Atom-atom C, H, O, dan N merupkan bagian terpenting dari asam amino. Perbedaan jumlah dan susunan atom C, H, O, N dan unsur lain serta ikatan molekulnya merupakan ciri asam amino yang satu berbeda dengan yang lainnya.
Cahaya berperan dalam pembentukan protein melalui dua faktor yaitu unsur pembentuk dan energi untuk pembentukan protein. Unsur pembentuk protein C, H, dan O berasal dari karbohidrat hasil fotosintesis. Karbohidrat hasil fotosintesis ini melalui proses
PATI
31
respirasi menghasilkan energi yang dipakai untuk proses pembentukan protein (Gardner et al, 1990).
Murty dan Sahu (1987) melaporkan bahwa naungan menyebabkan kandungan N terlarut daun meningkat. N terlarut yang tinggi menunjukkan kegagalan pembentukan protein. N terlarut yang tinggi diduga menyebabkan kehampaan pada padi. Padi peka naungan mengalami peningkatan N terlarut lebih tinggi dibanding padi toleran saat keduanya dinaungi.
Metabolisme Nitrogen
Bangun tanaman yang terdiri atas kumpulan materi sudah membuktikan bahwa tanaman memerlukan unsur hara dalam pertumbuhannya. Suatu unsur hara disebut esensial hanya bila unsur tersebut menjadi kebutuhan yang tak bisa digantikan unsur lain dalam pertumbuhan dan perkembangannya. Tanpa unsur tersebut tanaman tidak mampu menyelesaikan siklus hidupnya secara sempurna. Unsur tersebut bisa juga merupakan bagian dari metabolit esensial.
Proses absorpsi hara bisa aktif maupun pasif. Absorpsi aktif memerlukan energi berupa ATP yang diproduksi oleh proses respirasi. Radiasi dan kecepatan fotosintesis berpengaruh terhadap absorbsi hara. Perjalanan hara tidak memerlukan energi selama berada dalam wilayah apoplastik, seperti ruang antar sel. Lapisan Caspary yang tidak tembus air pada endodermis mengharuskan hara memasuki wilayah simplastik, yaitu wilayah yang terdiri atas sel-sel hidup yang isinya saling berhubungan karena plasmodesmata. Perjalanan hara dalam wilayah simplastik memerlukan ATP (Gardner et al, 1990; Marchner,1994).
.Salah satu unsur hara esensial tanaman yang terpenting adalah nitrogen. Nitrogen adalah unsur hara yang paling menjadi faktor pembatas. Selain karbon, hidrogen, dan oksigen, nitrogen adalah komponen utama bahan kering tanaman. Nitrogen adalah unsur pembentuk asam amino, basa N seperti purin, protein dan nukleoprotein seperti DNA dan RNA (Gardner et al, 1990;Taiz dan Zeiger, 1991).
Peranan cahaya dalam proses reduksi nitrat menjadi nitrit bisa dilihat pada Gambar 7. Pembentukan gen NR dipicu oleh glukosa yang merupakan hasil fotosintesis. Enzim NR yang tidak aktif diaktifkan oleh NADH yang merupakan hasil fotosintesis (Vivekanandan, 1997).
Cahaya (hv)
klorofil
siklus Calvin
Glukosa
Cahaya (hv)
klorofil
siklus Calvin
NADH
gen NR NR mRNA enzim NR (tidak aktif)
[image:32.596.96.517.139.751.2]enzim NR (aktif)
Gambar 7. Cahaya menstimulasi enzim nitrat reduktase (Vivekanandan, 1997)
Nitrogen dari udara bebas (atmosfir) bisa menjadi sumber N bagi kedelai apabila kedelai bersimbiosis dengan rhizobium yang membentuk bintil di akar kedelai. Simbiosis ini menguntungkan kedua belah pihak. Pada akar yang ternodulasi terjadi pertukaran zat-zat antara tanaman dan bakteri dalam bintil akar. Kedelai memberi karbohidrat (gula) dari fotosintesis, tetapi memperoleh NH4+. dari bintil akar. Karbohidrat yang diberikan kedelai kepada bintil akar tersebut berupa malat yang berasal dari sukrosa. Sementara itu NH4+ segera diubah menjadi glutamin dan asparagin (Gardner et al, 1990; Hall dan Rao, 1999, Purcell et al, 2000).
Kekurangan unsur N menyebabkan penurunan pada: (a) pembelahan dan ekspansi sel, (b) perkembangan kloroplas, (c) konsentrasi klorofil dan aktifitas enzim. Tanaman yang kekurangan N biasanya kerdil (Gardner et al, 1990; Taiz dan Zeiger, 1991). Pada kedelai
NO3
-33
non-nodulasi pemupukan N meningkatkan fotosintesis daun. Ini berkorelasi positif dengan persentase N daun (Shibels et al, 1987).
Meskipun N bisa masuk tanaman melalui daun berupa pupuk daun, namun secara alami N diserap tanaman sebagai nitrat atau N2 yang segera diubah menjadi amonium. Ion amonium dari fiksasi N2 segera diubah menjadi asam amino. Nitrat yang diambil tanaman diubah menjadi nitrit oleh nitrat reduktase dan nitrit diubah menjadi amonium oleh nitrit reduktase (Gardner et al, 1990; Harper, 1987).
Adaptasi terhadap Naungan
Adaptasi Tanaman
Kondisi lingkungan yang sesuai dan optimum untuk pertumbuhan dan perkembangan tanaman sangat jarang terdapat di alam. Ketidaksesuaian lingkungan tumbuh menyebabkan cekaman pada tanaman. Cekaman ialah faktor biotik dan abiotik yang menyebabkan gangguan fungsional sehingga pertumbuhan dan produksi turun. Level cekaman tergantung kepada faktor penyebab cekaman dan tanamannya sendiri (Biswal dan Biswal, 1999).
Menurut Levitt (1980) cekaman (stres) adalah faktor lingkungan apapun di luar organisme yang secara potensial tidak cocok (mengganggu) organisme tersebut. Cekaman bisa menyebabkan perubahan (strain) pada organisme. Perubahan tersebut bisa dapat balik (reversible strain) atau tidak dapat balik (irreversible strain). Strain elastis bisa hilang bila cekaman dihilangkan atau tanaman dikembalikan pada lingkungan yang sesuai. Penambahan level cekaman pada strain elastis bisa menyebabkan strain plastis. Strain plastik yang besar dan melebihi atau melewati ambang tertentu bisa menyebabkan kerusakan, bahkan kematian bagi organisme.
Pada benda mati strain plastis benar-benar tidak dapat kembali. Pada organisme hidup strain plastis (kerusakan) bisa diperbaiki untuk waktu yang cukup lama. Kemampuan tanaman untuk menyembuhkan dari kerusakan akibat strain yang besar juga mengarah kepada adaptasi (Levitt, 1980).
Resistensi elastis adalah kemampuan tanaman bertahan dalam kondisi strain elastis. Dalam waktu lama strain elastis dapat menyebabkan akumulasi racun yang juga dapat menyebabkan kerusakan dan kematian. Tanaman yang mampu tumbuh dan beregenerasi dalam strain elastis yang lama disebut mempunyai resistensi elastis (adaptasi kapasitas).
Adaptasi ialah sifat yang dikontrol secara genetik yang memungkinkan tanaman berproduksi relatif baik pada suatu lingkungan tertentu. Suatu genotipe disebut beradaptasi luas bila genotipe tersebut bisa menampilan pertumbuhan dan produksi baik untuk selang yang besar dari nilai fator lingkungan tertentu, misalnya pH, kadar air, dan radiasi cahaya. Adaptasi sempit mengacu kepada persyaratan faktor lingkungan yang khusus untuk tumbuh dan berkembang baik. Genotipe yang beradaptasi sempit berarti tidak toleran terhadap situasi lingkungan yang berbeda dengan persyaratan tumbuhnya (White dan Izquierdo, 1993). Kemampuan beradaptasi terhadap lingkungan ditentukan oleh gen-gen dalam tanaman.
Adaptasi terhadap cekaman bisa bersifat jangka pendek maupun jangka panjang. Adaptasi jangka pendek merupakan respon cepat. Di sini tidak terdapat pembentukan protein baru. Sinyal transduksi hanya ditandai perubahan konsentrasi metabolit. Pada cekaman cahaya adaptasi jangka pendek tanaman menciptakan interaksi yang terkoordinasi antara antena pemanen cahaya dan konversi energi dengan aktivitas transpor elektron pada komplek tilakoid dan operasi siklus Calvin untuk mengoptimalkan kecepatan fotosintesis. Dalam adaptasi jangka panjang sinyal cekaman mengarah kepada sintesis protein, lipid, dan pigmen. Produksi berlebihan atau kurang dari protein chl a/b (LHC II), protein DI pada PS II menyebabkan perubahan stoikiometri dari fotosistem tilakoid dan kuantitas rubisco dan protein (Biswal dan Biswal, 1999)
35
paling tinggi, dan luas spesifik (luas permukan daun per bobot daun) paling tinggi (Callan dan Kennedy, 1995).
Tanaman yang toleran cahaya rendah mampu memanfaatkan cahaya secara efisien melalui kemampuannya beradaptasi baik secara anatomi, morfologi, fisiologi dan biokimia yang berkaitan dengan kegiatan fotosintesis.
Daya adaptasi tanaman terhadap naungan tergantung kepada kemampuan tanaman dalam melanjutkan proses fotosintesis dan mempertahankan lajunya dalam kondisi kekurangan cahaya. Menurut Bruick dan Mayfield ( 1999) pohon yang toleran kekurangan cahaya mempunyai ciri yaitu di bawah kondisi cahaya optimum bagi kebanyakan tanaman, pohon-pohon tersebut dibanding yang lain mempunyai (a) kecepatan pertumbuhan relatif (RGR) lebih rendah, (b) rasio luas daun/bahan kering lebih rendah (daun lebih tebal dan padat), (c) kandungan nitogen daun lebih rendah, dan (d) rasio tajuk dan akar lebih rendah.
Mekanisme Penghindaran
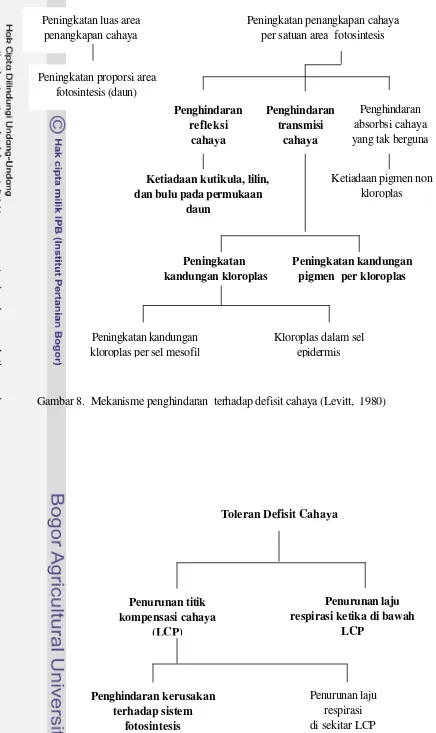
Menurut Levitt (1980) tanaman mampu beradaptasi terhadap naungan melalui mekanisme penghindaran dan toleransi. Penghindaran kekurangan cahaya dilakukan dengan meningkatkan efisiensi penangkapan cahaya. Peningkatan efisiensi penangkapan diperoleh melalui perluasan daun sebagai bagian tanaman yang bisa menangkap cahaya dan kemampuan menangkap cahaya per satuan luas daun. Penangkapan cahaya diperoleh melalui peningkatan kandungan kloroplas dan kandungan kloropil per kloroplas daun Gambar 8).
Penelitian pada padi gogo menunjukkan naungan menyebabkan daun lebih luas dan tipis karena pengurangan lapisan palisade dan sel-sel mesofil. Padi gogo yang diberi cekaman cahaya rendah meningkatkan klorofil a maupun klorofil b (Lautt, 2000). Givnish et al (1988) menyimpulkan bahwa intensitas cahaya rendah menyebabkan penurunan ketebalan bobot spesifik daun (BSD) dan peningkatan klorofil a dan b. Penelitian naungan pada manggis (Wiebel et al, 1994), Amborella trichopoda ( Feild, 2001) dan Baringtonia (Feng et al, 2004) menunjukkan bahwa perubahan karakter pada daun antara lain pada penipisan daun, pengurangan ketebalan lapisan palisade, peningkatan kandungan klorofil a dan b, peningkatan luas helai daun, dan penurunan BSD.
dan b, bisa terjadi pada perlakuan naungan selama 6 hari setelah pada umur 0 - 20 HST tumbuh pada cahaya normal.
Mekanisme penghindaran defisit cahaya melalui peningkatan kandungan klorofil terjadi pada semua genotipe kedelai yang diberi perlakuan naungan (Khumaida, 2002). Peningkatan efisiensi peningkatan cahaya ini bisa dilihat pada ekspresi gen untuk pembentukan komplek pemanen cahaya (lhc) dimana klorofil berada. Ekspresi gen ini mulai ada bahkan bila kedelai diberi perlakuan naungan 50 % selama sehari. Tetapi pemberian perlakuan gelap tidak memunculkan gen untuk protein pemanen cahaya.
Tanaman yang toleran naungan bila diberi perlakuan naungan mampu mempertahankan laju fotosintesis tinggi dengan dua cara yaitu (a) meningkatkan luas daun untuk meningkatkan luas areal penangkapan cahaya dan (b) pengurangan jumlah cahaya yang ditransmisikan dan direfleksikan. Tanaman tersebut mengurangi kutikula dan menghilangkan lapisan lilin dan bulu. Daun tanaman toleran lebih tipis dan kandungan bahan keringnya rendah. Ini untuk meningkatkan tingkat fotosintesis per bobot kering (Hale dan Orcutt, 1987; Levitt, 1980).
Sopandie et al (2005) menunjukkan bahwa bulu daun menurun pada kedelai yang dinaungi 50%. Penurunan itu terjadi pada pengamatan 8 - 10 MST, sedangkan pada pengamatan saat 4 – 6 MST kerapatan bulu lebih besar pada kondisi kontrol dibanding naungan 50%. Kerapatan bulu terendah terdapat pada Ceneng (toleran), tetapi persen penurunan tertinggi terdapat pada genotipe Godek (peka) dan Slamet. Informasi penurunan kerapatan bulu pada Klungkung Hijau, B613, Wilis, Tampomas, MLG2999 belum ada.
37
Kedelai yang diberi naungan 50% mengalami penurunan ketebalan daun dan lapisan palisade. Persen penurunan lebih besar pada kelompok genotipe toleran daripada peka (Sopandie et al, 2002). Luas helai daun trifoliat juga meningkat akibat naungan 50%. Persentase peningkatan luas helai daun lebih besar pada Pangrango (T) dan Ceneng (T) daripada Godek (Sopandie et al, 2004). Namun belum ada keterangan tegas apakah perbedaan tersebut nyata. Penelitian di atas juga mengungkapkan bahwa rasio luas per bobot daun meningkat atau berarti bobot spesifik daun (BSD) menurun dengan persentase penurunan hampir sama. Belum ada uji beda nyata tentang persentase penurunan BSD akibat naungan 50%.
Pembentukan kloropas dipengaruhi oleh ketersediaan cahaya. Tanaman yang toleran cahaya mampu mempertahankan jumlah kloroplas yang tinggi per luas daun (Hale dan Orchut, 1987) dan jumlah klorofil per kloroplas (Okada et al, 1992). Dalam kondisi ternaungi jumlah klorofil a dan klorofil b genotipe padi yang toleran lebih tinggi dibanding yang peka (Lautt et al, 2000). Peningkatan klorofil b yang lebih tinggi daripada klorofil a menyebabkan rasio klorofil a/b menurun. Fenomena ini juga terjadi pada kedelai (Khumaida, 2002). Ini berkaitan dengan peningkatan klorofil b yang lebih tinggi pada LHC-II. Pembesaran antena pada fotosistem II ini akan mempertinggi efisiensi pemanenan cahaya (Hidema et al, 1992; Kennedy dan Allan, 1995). Sopandie et al (2002) mengungkapkan bahwa peningkatan kandungan klorofil a maupun klorofil b lebih tinggi pada kelompok genotipe toleran dibanding genotipe peka. Namun penurunan rasio klorofil a/b tidak berbeda nyata antar dua kelompok genotipe tersebut.
Mekanisme Toleransi
Peranan rubisco sangat vital karena dalam siklus Calvin enzim ini bisa mengikat CO2 dan RuBP menghasilkan 3-PGA. Cahaya menginduksi aktifitas rubisco saat ternaungi (Hall dan Rao, 1999). Intensitas cahaya mempengaruhi aktifitas rubisco (Portis, 1992). Enzim rubisco memainkan peran kunci pada asimilasi karbon dalam fotosintesis. Karena peran pentingnya tersebut rubisco menjadi salah satu faktor pembatas fotosintesis (Vu et al, 1983) dan aktivitas rubisco bisa menjadi faktor penduga besarnya level fotosintesis.
Tanaman yang toleran naungan mampu mempertahankan aktivitas rubisco tetap tinggi bila diberi perlakuan naungan, seperti pada padi. Pada padi naungan menyebabkan kandungan protein dan aktivitas total rubisco menurun. Namun, padi varietas jatiluhur (toleran naungan) mampu mempertahankan kandungan protein dan aktivitas rubisco tetap tinggi (Sopandie et al, 2003a).
Naungan menyebabkan penurunan produksi padi gogo. Naungan juga menurunkan kandungan pati di daun. Meskipun kandungan patinya turun, besarnya penurunan tersebut lebih kecil pada padi yang toleran dibanding yang peka. Hal menarik terjadi pada parameter kandungan sukrosa daun. Pada masa pertumbuhan vegetatif aktif kandungan sukrosa (mg/g) daun justru mengalami peningkatan pada genotipe padi gogo toleran yang diberi perlakuan 50 %. Sebaliknya pada genotipe peka naungan 50 % menurunkan sukrosa daun (Lautt et al, 2000). Dalam kondisi ternaungi aktivitas enzim SPS dan rubisco juga tetap lebih tinggi pada genotipe toleran daripada genotipe peka naungan (Lautt et al, 2000; Sopandie et al, 2003a).
Lautt (2003) menggunakan kandungan gula dan pati sebagai indikator besarnya rerspirasi gelap pada padi gogo. Setelah diletakkan di ruang gelap kandungan gula dan pati daun padi menurun. Namun, padi toleran naungan tetap bisa mempertahankan kandungan gula dan pati tinggi, yang menunjukkan respirasi gelap lebih rendah pada genotipe toleran naungan.
Penghindaran Kekurangan Cahaya
39
Gambar 8. Mekanisme penghindaran terhadap defisit cahaya (Levitt, 1980) Peningkatan penangkapan cahaya
per satuan area fotosintesis Peningkatan luas area
penangkapan cahaya
Peningkatan proporsi area fotosintesis (daun)
Penghindaran refleksi
cahaya
Penghindaran transmisi
cahaya
Penghindaran absorbsi cahaya yang tak berguna
Ketiadaan kutikula, lilin, dan bulu pada permukaan
daun
Ketiadaan pigmen non kloroplas
Peningkatan kandungan kloroplas
Peningkatan kandungan pigmen per kloroplas
Peningkatan kandungan kloroplas per sel mesofil
Kloroplas dalam sel epidermis
Toleran Defisit Cahaya
Penurunan titik kompensasi cahaya
(LCP)
Penurunan laju respirasi ketika di bawah
LCP
Gambar 9. Mekanisme toleransi terhadap defisit cahaya (Levitt, 1980)
Penghindaran penurunan aktifitas enzim
Penghindaran kerusakan pigmen-pigmen
Penurunan zat yang dapat direspirasikan
Penurunan dalam sistem respirasi
41
BAHAN DAN METODE
Penelitian ini terdiri atas tiga bagian. Penelitian pertama adalah penelitian tentang pengaruh cekaman intensitas cahaya rendah terhadap produktivitas delapan genotipe kedelai. Penelitian kedua adalah penelitian tentang perubahan karakter daun yang berkaitan dengan adaptasi kedelai terhadap intensitas cahaya rendah melalui mekanisme penghindaran, sedangkan penelitian ketiga tentang perubahan fisiologi yang berhubungan dengan mekanisme toleransi sebagai respon terhadap cekaman intensitas cahaya rendah.
Penelitian 1. Respon Delapan Genotipe Kedelai terhadap
Cekaman Intensitas Cahaya Rendah
Penelitian ini bertujuan untuk membandingkan persentase penurunan produksi akibat cekaman naungan pada delapan genotipe yang antara lain meliputi geneotipe toleran, moderat, serta peka naungan. Perlakuan naungan diberikan sejak tanam sampai panen.
Waktu dan Tempat
Percobaan lapang dilaksanakan dalam dua musim tanam (MT). Percobaan I-A atau MT-1 berlangsung pada Mei – Agustus 2002, sedangkan percobaan I-B atau MT-2 pada Nopember 2002 – Pebruari 2003. Percobaan lapang dilaksanakan di kebun percobaan IPB Cikabayan, Bogor. Pekerjaan laboratorium dilaksanakan di laboratorium Pusat Studi Pemuliaan Tanaman (PSPT) Departemen Agronomi dan Hortikultura IPB.
Bahan dan Alat
Sebanyak delapan genotipe kedelai hasil penyaringan penelitian sebelumnya (Gambar 3) digunakan sebagai bahan tanaman. Dari 8 genotipe kedelai tersebut, menurut Sopandie et al (2002), 4 genotipe dimasukkan sebagai toleran, yaitu Ceneng, B613, Pangrango, dan Tampomas; 1 genotipe termasuk moderat, yaitu Wilis; dan 3 genotipe termasuk peka naungan, yaitu Klungkung Hijau, MLG2999 dan Godek.
Bahan kimia dan peralatan laboratorium dijelaskan pada Lampiran 5. Alat dan bahan lain yang digunakan adalah peralatan standar untuk budidaya kedelai secara konvensional
Metode
Penelitian ini merupakan percobaan lapang. Kedelai ditanam dalam polibag di lapang dan diberi empat perlakuan naungan paranet, yaitu tanpa naungan sebagai kontrol, naungan paranet 25%, 50%, dan 75%. Perlakuan naungan diberikan sejak tanam sampai panen.
Rancangan Percobaan
Pada percobaan lapang ini rancangan lingkungan yang digunakan adalah rancangan acak kelompok dan rancangan perlakuannya berupa petak terpisah (split plot). Pada percobaan ini digunakan tiga ulangan yang tersarang pada perlakuan naungan. Tata letak percobaan di lapang terlihat pada Lampiran 2.
Petak utama terdiri atas empat taraf perlakuan naungan yaitu
:
N0 : tanpa naungan atau kontrolN1 : naungan 25 % N2 : naungan 50 % N3 : naungan 75 %.
Anak petaknya meliputi delapan genotipe kedelai, yaitu G1 = Ceneng, G2 = Klungkung Hijau, G3 = B613, G4 = Wilis, G5 = Tampomas, G6 = Godek, G7 = Pangrango, dan G8 = MLG2999. Percobaan ini menggunakan tiga ulangan sehingga terdapat 96 satuan percobaan. Tiap satuan percobaan terdiri atas dua polibag. Masing-masing polibag berisi satu tanaman
Model statistik untuk rancangan percobaan ini adalah: Yijk = µ + N j + Ki + γ i(j) + G k + NG jk + ε ijk
Yijk = nilai pengamatan akibat kelompok ke-i, naungan ke-j dan genotipe ke-k
µ = nilai rata-rata umum
N j = nilai pengamatan akibat pengaruh naungan ke-j Ki = nilai pengamatan akibat pengaruh kelompok ke-i
γ ij = galat akibat kelompok ke-i dan naungan ke-j G k = nilai pengamatan akibat pengaruh genotipe ke-k
NG jk = nilai interaksi antara faktor perlakuan naungan ke-j dan genotipe ke-k
43
Pelaksanaan
Perlakuan naungan (N) dilaksanakan dengan cara meletakkan paranet hitam di sisi atas dan keempat sisi samping areal pertanaman (Lampiran 2). Dengan demikian pertanaman kedelai terkurung (terselubungi) oleh paranet. Tinggi paranet sekitar 2 m di atas permukaan tanah. Paranet disangga oleh rangka bambu. Perlakuan naungan diberikan sejak tanam sampai panen.
Media tanam terdiri atas campuran tanah dan pupuk kandang (9:1) dimasukkan ke dalam polibag, sehingga tiap polibag berisi sekitar 8 kg campuran tanah. Pupuk kandangnya berasal dari kotoran kambing. Polibag kemudian diatur berbaris di dalam selubung paranet dengan jarak 50 x 50 cm pusat ke pusat dan dibiarkan selama seminggu agar media tanah dalam polibag stabil.
Benih kedelai yang telah dilumuri dengan inokulan rhizobium ditanam pada polibag tersebut dengan lubang tanam sedalam 2 – 3 cm. Tiap lubang tanam berisi tiga butir benih. Setelah seputar benih ditaburi Furadan lubang tanam ditutup tanah. Pada umur 1 - 2 minggu tanaman dijarangkan sehingga tinggal 1 tanaman tiap polibag.
Pada umur 1 minggu setelah tanam (MST) media tanam diberi pupuk urea dengan dosis pemupukan 0.3 g urea, 1.25 g TSP, dan 1 g KCl per polibag, yang setara dengan 34 kg N, 144 kg P2O5 dan 150 kg K2O per ha. Pada waktu tersebut juga dilakukan penyulaman dan penjarangan tanaman sehingga tiap polibag berisi dua tanaman. Pada umur 2 MST dilakukan penjarangan lagi sehingga tiap polibag hanya berisi satu tanaman. Penyiraman dilakukan tiap hari pagi dan sore sampai umur 3 MST, setelah itu penyiraman dilakukan hanya pada pagi hari. Pengendalian gulma dilaksanakan secara manual dengan mencabut gulma yang ada di polibag dan mencangkul lahan di sekeliling polibag. Hama dikendalikan dengan Decis sedangkan penyakit dengan Dithane M-45.
Waktu panen ditentukan apabila polong telah kehilangan warna hijaunya. Panen dilakukan dengan cara menggunting tangkai polong dan tetap membiarkan tanaman kedelai hidup dengan polong lain yang belum bisa dipanen, sampai semua polong habis dipanen.
Analisis Data
ditransformasi (Steel dan Torrie, 1993). Perbandingan dilakukan untuk (1) perlakuan kontrol dan naungan 50% pada setiap genotipe dengan uji t, serta (2) persentase penurunan produktivitas biji akibat naungan 50% antar genotipe dengan DMRT bila ada beda nyata.
Penelitian 2. Perubahan Struktur Daun Beberapa Genotipe Kedelai sebagai
Adaptasi melalui Mekanisme Penghindaran terhadap Intensitas Cahaya Rendah
Penelitian ini bertujuan untuk membandingkan perubahan struktur daun antara genotipe toleran dan peka. Pada percobaan I perlakuan naungan diberikan sejak tanam sampai panen untuk menggambarkan adaptasi. Pada percobaan II perlakuan gelap diberikan dalam variasi pergiliran dengan cahaya normal pada umur 23 - 32 HST. Variasi tersebut menyebabkan terjadinya perbedaan umur tanaman saat perlakuan gelap diberikan (Lampiran 4). Pada percobaan II perlakuan gelap selama tiga hari (TTG= terang-terang-gelap) menggambarkan perlakuan cekaman defisit cahaya ekstrim yang diberikan pada umur 29 - 32 HST. Perlakuan gelap 3 hari dilanjutkan terang 3 hari (TGT=terang-gelap-terang) mencerminkan penyembuhan setelah cekaman akibat perlakuan gelap selama 3 hari pada umur 26 -29 HST. Perlakuan GTG (gelap-terang-gelap) bisa menunjukkan adaptasi (on/off) terhadap gelap, yaitu menunjukkan kondisi tanaman pada saat gelap, yang sebelumnya diberi perlakuan gelap 3 hari dilanjutkan dengan cahaya normal 3 hari. Perlakuan TGN (terang-gelap-naungan 50%) mengambarkan adanya penyembuhan dan adaptasi.
Waktu dan Tempat
Penelitian ini terdiri atas dua percobaan. Percobaan pertama dilaksanakan pada Mei sampai Agustus 2002, sedangkan percobaan kedua pada Maret sampai Mei 2004. Seluruh percobaan dilaksanakan di Kebun Percobaan Cikabayan IPB, di Darmaga Bogor. Perlakuan gelap total pada percobaan II menggunakan suatu ruangan gelap di Cikabayan.
Pengeringan dan penimbangan dilakukan di laboratorium PSPT - IPB Bogor Pembuatan penampang melintang daun dilakukan di Biotrop Bogor. Pengukuran luas daun dilakukan di Balai Penelitian Tanaman Rempah dan Obat Bogor..
Bahan dan Alat
45
empat genotipe yang dipilih dari delapan genotipe pada percobaam I, yaitu Ceneng (T), B613 (T), Pangrango (T), dan Godek (P). Ceneng adalah genotipe yang konsisten toleran, sedangkan Godek konsisten peka (Sopandie et al, 2002)
Alat yang digunakan antara lain mikroskup elektrik binokuler, pisau silet, penggaris, oven pengering, timbangan, dan areameter. Alat dan bahan untuk membuat preparat penampang melintang daun dikemukakan pada Lampiran 5.
Metode
Penelitian ini bertujuan untuk mengkaji adaptasi kedelai melalui mekanisme penghindaran, yaitu berupa perubahan struktur daun. Struktur daun yang bisa menggambarkan mekanisme penghindaran antara lain tebal daun, bobot spesifik daun, luas helai daun, kerapatan bulu dan stomata daun, serta kandungan klorofil daun.
Penelitian ini merupakan percobaan lapang, yang terdiri atas dua percobaan. Pada percobaan I tanaman diberi cekaman intensitas cahaya rendah berupa naungan paranet 25%, 50%, dan 75% sejak tanam sampai panen seperti pada penelitian 1. Pada pe