MEKANISME ADAPTASI
KEDELAI [Glycine max (L) Merrill]
TERHADAP
CEKAMAN INTENSITAS CAHAYA RENDAH
AKHMAD JUFRI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
AKHMAD JUFRI. Mekanisme Adaptasi Kedelai [Glycine Max (L) Merrill] terhadap Cekaman Intensitas Cahaya Rendah. Dibimbing oleh Sri Setyati Harjadi, Didy Sopandie, Muhammad Jusuf, dan Novianti Sunarlim.
Tanaman beradaptasi terhadap cekaman intensitas cahaya rendah melalui mekanisme penghindaran dan mekanisme toleransi. Evaluasi mekanisme adaptasi dilakukan terhadap 8 genotipe, terdiri atas 4 genotipe toleran yaitu Ceneng, B613, Pangrango, dan Tampomas, 1 moderat yaitu Wilis, dan 3 peka yaitu MLG2999, Klungkung hijau, dan Godek. Evaluasi meliputi respon masing-masing genotipe terhadap cekaman intensitas cahaya rendah yang berupa persentase: (1) penurunan produktivitas, (2) perubahan struktur daun yang berhubungan dengan mekanisme penghindaran, dan (3) perubahan fisiologi yang berkaitan dengan mekanisme toleransi.
Cekaman pada penelitian ini diberikan dalam dua tipe perlakuan, yaitu (1) berupa naungan paranet 25%, 50%, dan 75% yang diberikan sejak tanam sampai panen dan (2) berupa cekaman ekstrim yang diwujudkan dalam 5 variasi pergiliran 3 hari gelap - terang pada umur 23 - 32 HST (hari setelah tanam). Kelima perlakuan variasi gelap-terang tersebut adalah terang-terang-gelap (TTG), terang-gelap-terang (TGT), terang-gelap-naungan 50% (TGN), gelap-terang-gelap (GTG) dan kontrol untuk menduga respirasi gelap, penyembuhan, dan adaptasi. Sampel diambil pada 30 HST untuk percobaan dengan cekaman tipe 1 dan 32 HST untuk tipe 2.
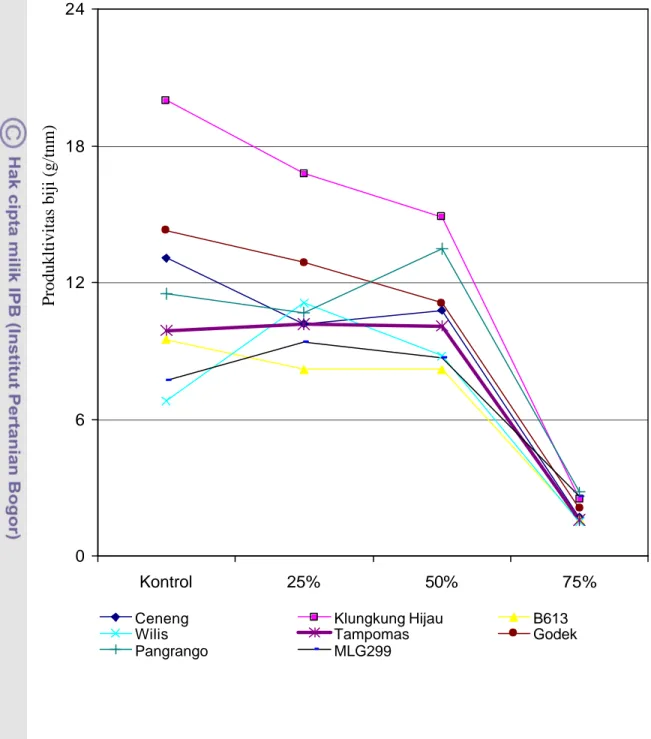
Klungkung Hijau menunjukkan produksi biji per tanaman tertinggi dibanding genotipe lain. Produksi tertinggi tersebut konsisten pada ketiga level naungan, yaitu kontrol, naungan 25%, dan 50%. Pangrango juga memberi hasil tinggi pada kondisi kontrol, naungan 25%, dan 50%.
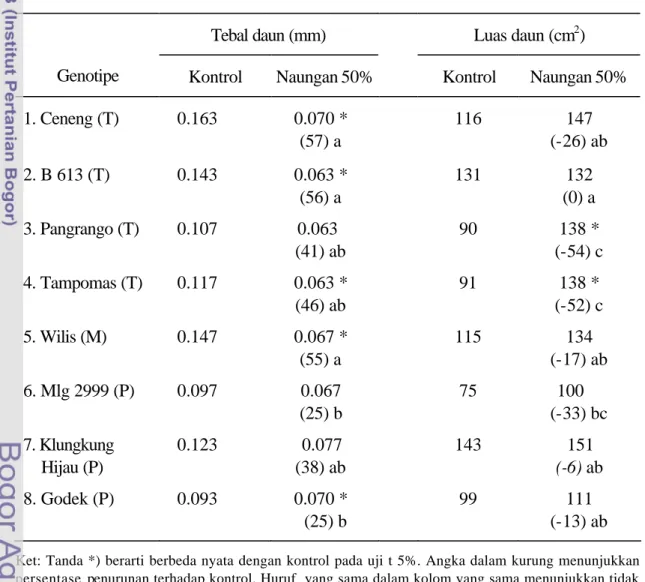
Naungan 50% terbukti efektif untuk menyaring ketenggangan terhadap cekaman intensitas cahaya rendah karena menyebabkan perubahan yang signifikan terhadap anatomi, morfologi, dan produktivitas tanaman, serta keragaman antar genotipe. Ceneng (T) konsisten sebagai genotipe toleran naungan karena mengalami persentase penurunan produksi terendah dan penurunannya tidak nyata, sedangkan Godek (P) konsisten peka naungan karena menunjukkan persentase penurunan hasil biji terbesar dan penurunannya nyata. Besarnya persentase penurunan produksi ini tidak berbeda nyata antar genotipe.
Dalam mekanisme penghindaran kelompok genotipe toleran memperlihatkan persentase penurunan ketebalan daun lebih besar daripada kelompok peka. Ceneng (T) mengalami persentase penurunan berat spesifik daun dan bulu lebih besar daripada Godek (P). B613 (T) menghindari cekaman cahaya rendah terutama melalui peningkatan klorofil , sedangkan Tampomas terutama melalui pengurangan kerapatan bulu daun. Kandungan Klorofil mengalami peningkatan bila tanaman diberi naungan 25%, 50%, atau 75%. Perlakuan gelap selama 3 hari bisa menyebabkan kandungan klorofil daun turun, kecuali pada B613 (T). Kandungan klorofil yang turun akibat gelap bisa pulih kembali setelah tanaman dikembalikan pada cahaya normal selama 3 hari yang menunjukkan penyembuhan.
Perlakuan gelap 3 hari menyebabkan kandungan gula dan pati daun serta karbohidrat batang menurun. Kandungan gula dan pati daun serta karbohidrat batang naik kembali setelah tanaman dikembalikan pada cahaya normal selama 3 hari yang juga menunjukkan
penyembuhan. Bila dikembalikan kepada naungan 50% (variasi TGN) kelompok tahan menunjukkan kandungan gula dan pati lebih tinggi yang menunjukkan fotosintesis lebih baik
.
Godek (P) menunjukkan penurunan kandungan karbohidrat batang, gula dan pati daun yang lebih besar saat diberi perlakuan gelap 3 hari, yang menunjukkan respirasi gelap lebih tinggi dibanding Ceneng (toleran) dan Pangrango (toleran).
Pada kondisi ternaungi paranet 50% sejak tanam sampai panen Ceneng (T) menunjukkan mekanisme toleransi lebih baik dibanding Godek (P) karena lebih mampu mempertahankan perubahan fisiologi yang lebih kecil antara lain pada variabel kandungan sukrosa serta aktivitas enzim SPS dan rubisco. Ceneng bisa mengefektifkan metabolisme N melalui pengurangan kandungan N daun sekaligus pemanfaataannya yang tepat untuk mempertahankan kandungan protein N terlarut tetap tinggi.
Klungkung Hijau bisa dianjurkan menjadi genotipe yang dikembangkan untuk
pertanaman kedelai di bawah tegakan pohon perkebunan maupun kehutanan yang memberi naungan 0 – 50%. Ceneng bisa menjadi sumber gen toleran untuk program pemuliaan. Ceneng dan Godek bisa menjadi tanaman model untuk studi mekanisme adaptasi terhadap cekaman intensitas cahaya rendah.
ABSTRACT
AKHMAD JUFRI. Adaptation Mechanism of Soybean [Glycine Max (L) Merrill] to Low Light Intensity Stress. Under the direction of Sri Setyati Harjadi, Didy Sopandie, Muhammad Jusuf, and Novianti Sunarlim.
Plants adapt to stress of low light intensity by mechanism of avoidance and/ or tolerance. The evaluation of this adaptation mechanism was conducted on 8 genotypes of soybean [Glycine max (L) Merrill], consisted of 4 tolerant genotypes (Ceneng, B613, Pangrango, and Tampomas), 1 moderate (Wilis), and 3 susceptible genotypes (Klungkung Hijau, MLG2999, and Godek). The evaluation was studied by the responses of the genotypes in the changes of (1) productivity, (2) leaf characters correlated for the avoidance mechanism, and (3) physiological characters correlated for the tolerance mechanism.
Two types of light stress were applied in this research. The first one was shading by 25%, 50%, 75% plastic paranet, and control. The second was 5 various alternating 3-days light-dark or 50% shading treatments at 23 – 32 DAP (days after planting). Treatments were light-light-dark (TTG), light-dark-light (TGT), light-dark-50% shading (TGN), and dark-light-dark (GTG), and continuously normal light as control (TTT); an assessment of dark respiration, recovery, and adaptation of the plant were measured. Sampling was conducted at 30 DAP for the first stress-type experiment and at 32 DAP for the second type experiment.
Klungkung Hijau and Pangrango showed the highest productivity among the genotypes. The highest productivity was consistent at three light intensity levels, such as control, 25% shading, and 50% shading. Klungkung Hijau and Pangrango can be recommended as genotypes to be cultivated under plantation tree stands. Ceneng can be used as source of tolerant gene for breeding program.
Treatment of 50% shading was effective for screening tolerance to low light intensity by significantly differed in plant anatomy, morphology, and productivity, and causing diverse responses among genotypes. Ceneng was considered as the most tolerant genotypes and Godek was the most susceptible.
The tolerant genotypes decreased significantly than the susceptible genotypes for leaf thickness. Ceneng (T) had bigger changes in leaf specific weight and leaf thickness than Godek (S). B613 (T) avoided the stress mainly through increasing chlorophyll content and Tampomas (T) through decreasing leaf hair density. Chlorophyll content increased in the plant treated by 25%, 50%, and 75% shading.
Three-day dark treatment caused the leaf chlorophyll content decreased in all genotypes except B613. The chlorophyll content was reversed to normal after normal light, indicated the recovery process.
The recovery symptom was also seen on sugar, starch, and carbohydrate characters. Godek was predicted to have the highest dark respiration among the four genotypes. The three tolerant genotypes (Ceneng, B613, and Pangrango) had the higher carbohydrate content compared to Godek at treatment of 3 days shading following 3 days-dark (TGN).
Ceneng (T) showed better mechanism of tolerance compared to Godek by smaller changes in physiological character such as sucrose and starch contents and enzyme activities of rubisco and SPS of leaf. Ceneng was also effective in utilizing N to produce protein in the leaf.
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan dalam disertasi yang berjudul:
MEKANISME ADAPTASI KEDELAI [Glycine max (L) Merrill]
TERHADAP CEKAMAN INTENSITAS CAHAYA RENDAH
adalah gagasan dan hasil penelitian saya sendiri dengan bimbingan komisi pembimbing, kecuali yang dengan jelas ditunjukkan rujukannya. Disertasi ini belum pernah dipublikasikan atau diajukan untuk memperoleh gelar akademik di perguruan tinggi lain.
Semua data dan informasi yang digunakan telah dinyatakan dengan jelas dan dapat diperiksa kebenarannya.
Bogor, Maret 2006
5
MEKANISME ADAPTASI
KEDELAI [Glycine max (L) Merrill]
TERHADAP
CEKAMAN INTENSITAS CAHAYA RENDAH
AKHMAD JUFRI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Departemen Agronomi dan Hortikultura
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2006
Judul Penelitian : Mekanisme Adaptasi Kedelai [Glycine Max (L) Merrill] terhadap Cekaman Intensitas Cahaya Rendah
N a m a : Akhmad Jufri
NIM : 995045
Disetujui: Komisi Pembimbing
Prof. Dr. Ir. Sri Setyati Harjadi Ketua
Prof. Dr. Ir. Didy Sopandie Anggota
Dr. Ir. Muhammad Jusuf Anggota
Dr. Ir. Novianti Sunarlim
Anggota
Diketahui:
Ketua Program Studi Agronomi
Dr. Ir. Satriyas Ilyas
Dekan Sekolah Pascasarjana
Tanggal ujian : 7 Pebruari 2006 Tanggal lulus:
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah Yang Maha Pengasih dan Penyayang atas rahmat yang dianugerahkan sehingga penulis dapat menyelesaikan disertasi ini. Disertasi ini merupakan hasil penelitian tentang respon kedelai terhadap cekaman intensitas cahaya rendah yang dilakukan di Bogor sejak tahun Mei 2002 sampai Agustus 2003 serta Maret 2004 sampai Oktober 2004.
Penghargaan dan terima kasih yang sebesar-besarnya penulis sampaikan kepada Ibu Prof. Dr. Ir. Sri Setyati Harjadi selaku ketua komisi pembimbing, serta Bapak Prof. Dr. Ir. Didy Sopandie, Bapak Dr. Ir. Muhammad Jusuf, dan Ibu Dr. Ir. Novianti Sunarlim selaku anggota komisi pembimbing yang telah memberi bimbingan, petunjuk serta pengarahannya selama penelitian dan penyusunan disertasi ini. Penghargaan dan terima kasih kepada Bapak Prof. Dr. Ir. Didy Sopandie juga selaku ketua Tim Hibah Bersaing IPB yang telah membantu sebagian dana untuk penelitian dalam disertasi ini
Penulis juga menyampaikan penghargaan dan terima kasih kepada para dosen pengajar pada Sekolah PascaSarjana IPB yang telah memberikan ilmu dan pengetahuan. Penghargaan dan terima kasih juga disampaikan kepada Ibu Dr. Ir. Satriyas Ilyas selaku Ketua Program Studi Agronomi yang telah memberi saran dan pengarahannya dalam penulisan disertasi ini. Penghargaan dan terima kasih penulis ucapkan kepada Bapak Dr. Suyamto dan Ibu Dr. Ir. Nurul Khumaida yang telah berkenan menjadi penguji luar komisi pada sidang terbuka dan atas saran-sarannya untuk perbaikan disertasi ini. Kepada Bapak Dr. Ir. Munif Gulamahdi penulis sampaikan penghargaan dan terima kasih atas perkenannya menjadi penguji luar komisi pada sidang tertutup dan koreksi serta sarannya untuk perbaikan disertasi ini.
.Penghargaan dan terima kasih yang sebesar-besarnya penulis sampaikan kepada Bapak Dr. Tisno Suwarno, Bapak Dr. Ir. Tatang A. Taufik, Bapak Dr. Ir. Hasan Mustafa, serta Bapak Dr. Ir. Ugay Sugarmansyah selaku pimpinan Badan Pengkajian dan Penerapan Teknologi yang telah memberi kesempatan, dorongan dan bantuan kepada penulis untuk melanjutkan dan menyelesaikan studi di Sekolah Pascasarjana IPB.
Penulis mengucapkan terima kasih kepada teman-teman di laboratorium dan di lapang: Ibu Dra. Surtini Gondonegoro dan Bapak Drs. Irawan, Msi di BATAN Jakarta, Bapak Yosef di Balitnak Bogor, Ibu Iis dan Ibu Merry di Biokimia IPB, Mas Yudi, Mas Bambang dan Mas Joko di Departemen Agronomi dan Hortikultura IPB, serta Mas Haryanto dan Mas Moko di Kebun Cikabayan IPB.
Terima kasih yang tulus penulis sampaikan kepada teman-teman: Dr. Ir. Lilik B. Prasetyo, Dr. Titin Handayani, Dr. Ir. Dwi Hapsoro, Dr. Ir. Shahidin, Dr. Churiyah, Dr. Ir. Winarso D. Widodo, Dr. Ir. Yusnita dan Dr. Ir. Endah Palupi atas segala bantuan, dorongan, dan saran selama penelitian dan penyusunan disertasi ini..
Terima kasih yang sedalam-dalamnya kepada seluruh keluarga: istri dan anak-anak, Bapak (almarhum), ibu, kakak dan adik tercinta atas segala dorongan dan doa yang tak pernah putus. Penulis berterima kasih kepada semua pihak yang telah membantu dalam penyelesaian disertasi.
Akhirnya penulis berharap agar disertasi ini bermanfaat bagi yang membutuhkan.
Bogor, Maret 2006
RIWAYAT HIDUP
Penulis lahir di Lumajang, Jawa Timur pada tanggal 31 Juli 1962. Ia adalah anak kelima dari sepuluh bersaudara dari ayah Muhammad Toyib (almarhum) dan ibu Maimunah. Ia menikah dengan Dwi Rahayu dan dianugerahi dua orang anak.
Pada tahun 1981 penulis menempuh pendidikan di Institut Pertanian Bogor dan lulus sebagai sarjana pertanian dengan keahlian agronomi pada tahun 1985. Ia melanjutkan studi S-2 di Department of Agronomy Iowa State University, USA pada tahun 1993 hingga 1995. Sejak tahun 1999 ia kembali ke Institut Pertanian Bogor untuk belajar pada jenjang S-3 pada program studi Agronomi dengan beasiswa dari Proyek Peningkatan Kemampuan Personil (PPKP) Badan Pengkajian dan Penerapan Teknologi.
Penulis bekerja sebagai peneliti di Badan Pengkajian dan Penerapan Teknologi (BPPT), Jakarta. Penulis pernah menjadi ketua kelompok Pengkajian Lingkungan pada Direktorat Pengkajian dan Penerapan Ilmu-ilmu Kehidupan, Deputi Bidang Pengkajian Ilmu Dasar dan Terapan. Sekarang penulis bekerja sebagai peneliti pada Deputi Bidang Pengkajian Kebijakan Teknologi BPPT.
DAFTAR TABEL ……….…...……… DAFTAR GAMBAR ……….……… DAFTAR LAMPIRAN ………..……….……….………….. PENDAHULUAN ………….…………..………. Latar Belakang ………...………..…….…...……….... Manfaat Penelitian ………..……….….………...……... Kerangka Pemikiran ………...…...………. Tujuan Penelitian ………...………. Hipotesis ………..………...……… TINJAUAN PUSTAKA …...………..….………….. Kedelai ………. ..….………. Agronomi dan Produksi Tanaman …..……….
Fotosintesis ……….……….……… Proses Fotosintesis ………. Tanaman C3 dan Fiksasi Karbon ……….….………
Daun dan Produksi Tanaman ……….…..………… Anatomi Daun dan Stomata ………...……… Kloroplas ………...…...……….… Klorofil dan Adaptasi Naungan ………. ………...………. Cahaya dan Tanaman ……….…...….…...………..
Karakteristik Cahaya ………..………..………. Cahaya dan Fitokrom ……….……...……..………..… Faktor Pembatas pada Fotosintesis ……….………..…….……... Naungan dan Produksi Tanaman ……….…...………….………. Naungan dan Karbohidrat ……….………..……...………… Cahaya dan Asimilasi Nitrogen ……….…………. Metabolisme Nitrogen …….……….…..……..……... Adaptasi terhadap Naungan ……….…...………...………….
Adaptasi Tanaman ………….………..……...………. Mekanisme Penghindaran ……….………..……. Mekanisme Toleransi ……… Halaman xiii xv xvi 1 1 6 7 9 9 13 13 13 15 15 16 18 18 19 21 23 23 24 25 25 27 29 29 31 31 33 36
BAHAN DAN METODE …..……….………...…………..…….…… Penelitian 1. Respon Delapan Genotipe Kedelai terhadap Cekaman Intensitas Cahaya Rendah ………...…...….……..
Waktu dan Tempat ……….………....…..……… Bahan dan Alat ………...…………...……..………. Metode ………....………... Rancangan Percobaan ……….………..……….….….. Pelaksanaan ………...…….………..….……… Analisis Data ……….………... Penelitian 2. Perubahan Struktur Daun Beberapa Genotipe Kedelai sebagai Adaptasi melalui Mekanisme Penghindaran terhadap Intensitas Cahaya Rendah ………..……..
Waktu dan Tempat ……….…….………...……… Bahan dan Alat ………..….…..………. Metode ………..……… Rancangan Percobaan ……….………….……… Pelaksanaan ………...……..………. Analisis Data ………..…………..………. Penelitian 3. Perubahan Fisiologi yang terkait dengan Adaptasi melalui Mekanisme Toleransi terhadap Cekaman Intensitas Cahaya Rendah.…
Waktu dan Tempat ……….………...…….……...… Bahan dan Alat ………...……….…..……...…. Metode ………...………..………...…… Rancangan Percobaan ……….………...…… Pelaksanaan ……….….………. Analisis Data ………..………….……..…… HASIL DAN PEMBAHASAN ………..………….……...………
Kondisi Umum ………...……..…... Penelitian 1. Respon Delapan Genotipe Kedelai terhadap Cekaman Intensitas Cahaya Rendah ………...………...……...….. Penelitian 2. Perubahan Karakteristik Daun untuk Mekanisme
Penghindaran……….………...……..…. Respon terhadap Cekaman Naungan sejak Tanam sampai Panen.. Respon terhadap Perlakuan Variasi Pergiliran Gelap-Terang ...…...
39 39 39 40 40 41 42 42 42 42 43 43 44 44 46 46 46 47 47 48 48 49 50 50 51 57 57 66
Penelitian 3. Perubahan Fisologi sebagai Mekanisme Toleransi ……... Pembahasan Umum ………...
KESIMPULAN DAN SARAN ………...……….. Kesimpulan ……….………..…………. Saran ………...………….………..……. DAFTAR PUSTAKA ………...………... LAMPIRAN ………...……….. GLOSARI ……….……… 74 86 94 94 95 97 104 129
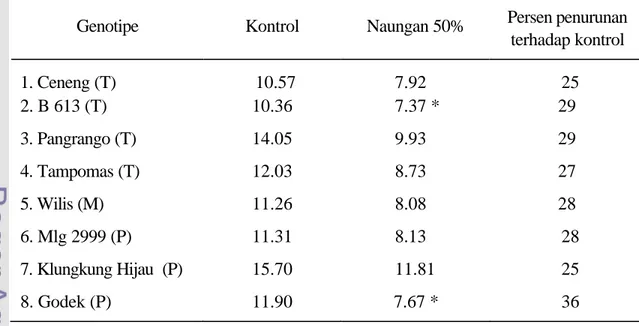
1. Produksi kedelai nasional tahun 1998 – 2004 ………...………. 2. Produktivitas biji delapan genotipe kedelai akibat naungan 50% pada musim
tanam kedua .……….………..…. 3. Pengaruh naungan 50% terhadap ketebalan dan luas helai daun kedelai
Pengaruh naungan terhadap kerapatan bulu ………....…. 4. Pengaruh naungan terhadap berat spesifik daun, kerapatan bulu, dan
kerapatan stomata ……….……...………. 5. Pengaruh naungan terhadap kandungan klorofil daun delapan genotipe kedelai
……….…..………. 6. Ketebalan daun kedelai pada lima perlakuan variasi pergiliran tiga hari
gelap-terang saat 32 HST …….. …..………..………….…………..…… 7. Luas helai daun trifoliat pada lima perlakuan variasi pergiliran tiga hari
gelap-terang saat 32 HST ….……….….……… 8. Berat spesifik daun kedelai pada lima perlakuan variasi pergiliran tiga hari
gelap-terang saat 32 HST ………...………....……...… 9. Kerapatan bulu daun kedelai pada lima perlakuan variasi pergiliran tiga hari
gelap-terang saat 32 HST ……….….………....… 10. Kerapatan stomata daun kedelai pada lima perlakuan variasi pergiliran tiga
hari gelap-terang saat 32 HST ……..………...….… 11. Kandungan klorofil a daun kedelai pada lima perlakuan variasi pergiliran
tiga hari gelap-terang saat 32 HST ………...………...……
12. Kandungan klorofil b daun kedelai pada lima perlakuan variasi pergiliran tiga hari gelap-terang saat 32 HST ……….…………
13. Rasio kandungan klorofil a/b daun kedelai pada lima perlakuan variasi pergiliran tiga hari gelap-terang saat 32 HST ……….…….…
14. Pengaruh naungan terhadap aktivitas rubisco, sukrosa, pati, dan aktivitas SPS ……… 15. Pengaruh naungan terhadap kandungan N daun ……..………….…….. 16. Kandungan gula total daun kedelai pada lima perlakuan variasi pergiliran tiga
Halaman 2 56 58 60 64 67 68 69 70 71 72 73 74 76 78
17. Kandungan pati daun kedelai pada lima perlakuan variasi pergiliran tiga hari gelap-terang saat 32 HST …………..……….…
18. Kandungan karbohidrat batang kedelai pada lima perlakuan variasi pergiliran tiga hari gelap-terang saat 32 HST ...………… …….…… 19. Aktivitas rubisco pada lima perlakuan variasi pergiliran tiga hari gelap-terang
saat 32 HST ……….……..
20. Intensitas cahaya di luar dan di dalam paranet ………..…..…………
82
83
84 87
DAFTAR GAMBAR
1. Hubungan ketersediaan energi cahaya dengan proses metabolisme untuk produksi biji kedelai …….………..………..………. 2. Respon tanaman terhadap kekurangan cahaya ……..………...……… 3. Alur penelitian dan sumber benih …..………..…...………...……… 4. Peranan cahaya dalam pembentukan klorofil daun ….…………..…..…… 5. Peranan cahaya pada proses pembentukan klorofil a dan b (Schoefs dan
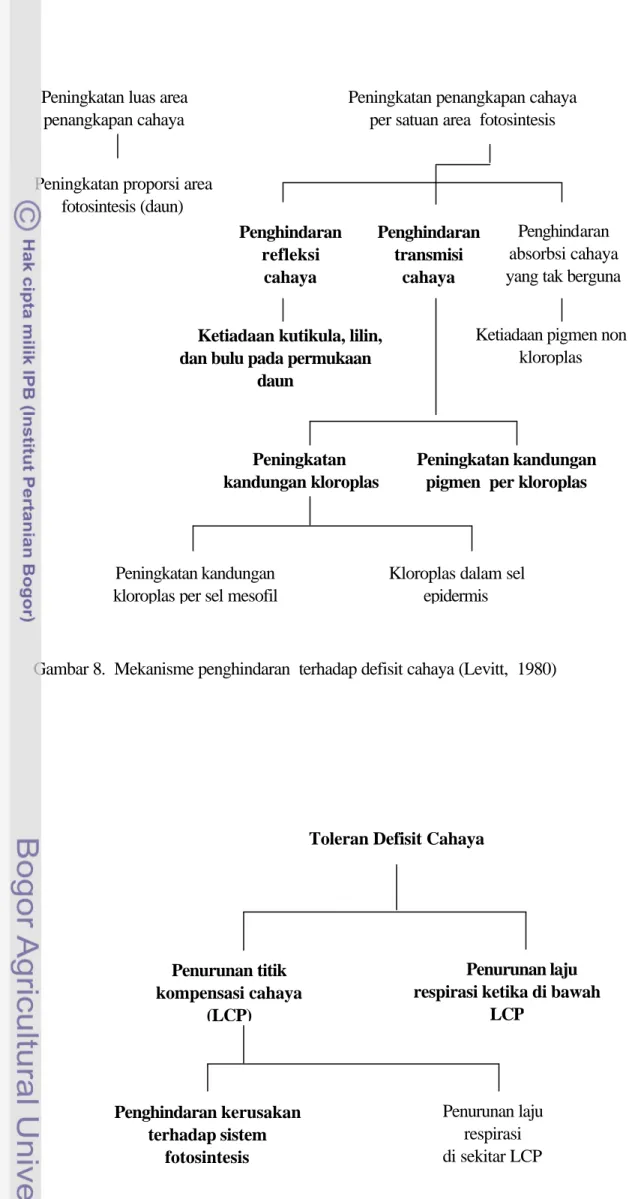
Bertrand, 1997). ………..………..…… 6. Skema pembentukan sukrosa dan pati pada fotosintesis ……...………..… 7. Cahaya menstimulasi enzim Nitrat reduktase ………..………. 8. Mekanisme penghindaran terhadap defisit cahaya (Levitt, 1980) ….…….
9. Mekanisme toleransi terhadap defisit cahaya (Levitt, 1980) ………..…… 10. Produktivitas Biji Delapan Genotipe Kedelai pada Empat Tingkat
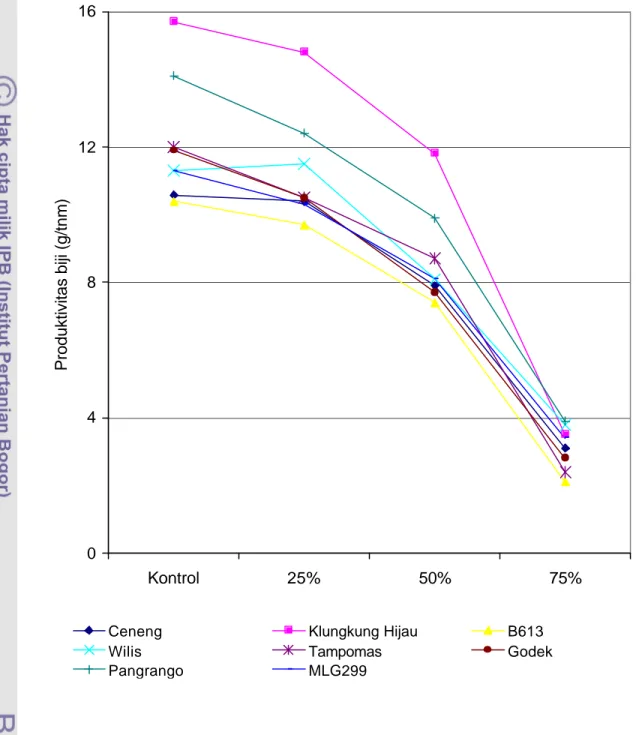
Naungan Paranet pada Musim Tanam I….……….………… 11. Produktivitas Biji Delapan Genotipe Kedelai pada Empat Tingkat
Naungan Paranet pada Musim Tanam II………..………... 12. Penampang melintang daun Ceneng (tahan) dan Godek (peka) pada
kontrol dan naungan paranet 50% (400 X) ………...
Halaman 10 11 12 22 22 28 30 37 38 53 54 61
DAFTAR LAMPIRAN
1. Tabel produksi biji beberapa kultivar kedelai pada lahan di bawah pohon karet di Sukabumi ……….………...………. 2. Denah percobaan 1 di kebun Cikabayan – Bogor dan naungan paranet di lapang
……….………..…...….. 3. Denah percobaan 2 di kebun Cikabayan – Bogor...………….……..………. 4. Jadwal perlakuan cahaya pada percobaan 2 ………...…...…………. 5. Prosedur Analisis Laboratorium dan Biokimia ……….. 6. Kelembaban udara pada empat tingkat naungan pada Juni 2002 ……..…… 7. Rata-rata Suhu dan kelembaban udara di lokasi percobaan pada April – Mei
2004 ……….……….……….……….………… 8. Rekapitulasi hasil analisis ragam untuk beberapa variabel pada percobaan split
plot (percobaan I-A dan I-B) ………..………... ……… 9. Rangkuman analisis ragam beberapa variabel pada percobaan variasi pergiliran
gelap-terang ……….………....…….……….………
10. Intensitas radiasi matahari di Darmaga menurut Stasiun Badan Meteorologi dan Geofisika Darmaga ………..……….…….
11. Intensitas radiasi matahari pada bulan Jumi 2002 jam 12.00 ………...…. 12. Data intensitas cahaya pada Januari 2003 ……….………...……...…. 13. Pengaruh naungan terhadap produktivitas biji, tebal daun, luas daun, kerapatan
bulu, kerapatan stomata, dan klorofil daun………..……….
14. Produktivitas biji, tebal daun, dan luas daun 8 genotipe kedelai …..….…. 15. Bobot spesifik daun, kerapatan bulu, kandungan klorofil daun 8 genotipe
kedelai ………..………...………...………...… 16. Pengaruh variasi pergiliran gelap – terang terhadap tebal daun, berat spesifik
daun, kandungan klorofil, gula daun, pati daun, karbohidrat batang, dan aktivitas rubisco ……….………...……..….……….… Halaman 115 106 107 108 109 114 114 115 116 117 118 119 120 121 121 122
17. Pengaruh genotipe terhadap berat spesifik daun, kerapatan bulu dan rasio
klorofil a/b ……….………...……….………...… 122
18. Pengaruh tingkat naungan paranet terhadap berat spesifik daun daun ....…. 19. Pengaruh tingkat naungan paranet terhadap kerapatan bulu daun ……..…. 20..Tinggi tanaman delapan genotipe kedelai pada 7 MST ………..……. 21. Jumlah buku delapan genotipe kedelai pada 7 MST ……….………..……. 22. Jumlah daun delapan genotipe kedelai pada 7 MST ……...…………...….
23. Berat akar delapan genotipe kedelai pada saat panen .. ………..…...……. 24. Berat bintil akar delapan genotipe kedelai saat panen……….….…...……. 123 123 124 125 126 127 128
PENDAHULUAN
Latar Belakang
Kedelai (Glycine max (L) Merrill) adalah salah satu tanaman sumber pangan penting di Indonesia. Beberapa makanan populer di Indonesia seperti tahu, tempe, tauco, dan kecap menggunakan biji kedelai sebagai bahan bakunya. Kandungan protein kedelai cukup tinggi, yaitu 40 persen, sedangkan beras hanya 9 persen. Keunggulan lainnya bisa dilihat pada kandungan asam amino esensialnya. Jumlah asam amino lisin yang rendah pada beras ternyata sangat tinggi pada kedelai. Kandungan lisin pada beras 253 mg/100 g, sedangkan pada kedelai 2300 mg/100 g (Pusat Penelitian dan Pengembangan Gizi, 1995). Karena itu kedelai diharapkan dapat memperbaiki level gizi sebagian besar penduduk Indonesia dan beberapa negara Asia (Chomchalow dan Laosuwan, 1993). Penduduk miskin yng sulit memperoleh protein hewani bisa memenuhi kebutuhan gizi dari protein nabati kedelai.
Sekitar 80% kebutuhan kedelai dipergunakan untuk bahan baku industri, terutama tahu dan tempe, sedangkan 20% sisanya untuk pakan ternak dan konsumsi rumah tangga (Amang dan Sawit, 1996). Karena kebutuhan dalam negeri tidak tercukupi oleh produksi dalam negeri Indonesia mengimpor kedelai. Pada tahun 1994 impor kedelai Indonesia sekitar 628 ribu ton dan pada tahun 1999 impor itu mencapai 1301 ribu ton (BPS, 2000). Impor kedelai itu telah diupayakan dikurangi melalui strategi peningkatan produksi dalam negeri (Manwan dan Sumarno, 1996). Namun, upaya itu sulit dilaksanakan karena kenyataannya impor kedelai tetap tinggi. Pada tahun 2004 impor kedelai Indonesia sebesar 1116 ribu ton (BPS, 2005).
Strategi peningkatan produksi kedelai nasional itu dirumuskan dalam Sumber Pertumbuhan Produksi yang terdiri atas lima peluang yaitu: (a) perluasan areal panen, (b) peningkatan produktivitas, (c) peningkatan keseragaman dan stabilitas hasil, (d) penekanan senjang hasil, dan (e) penekanan kehilangan hasil panen. Dalam sumber pertumbuhan produksi tersebut peningkatkan luas areal panen dilakukan dengan pembukaan areal baru, peningkatan indeks pertanaman (IP), dan pelaksanaan tumpang sari kedelai dengan tanaman perkebunan dan kehutanan (Adisarwanto et al, 1997).
Upaya peningkatan produksi kedelai tampaknya mengalami hambatan dalam pelaksanaan karena kenyataannya produksi kedelai cenderung menurun (Tabel 1). Data pada Tabel 1 menunjukkan bahwa penurunan produksi nasional disebabkan oleh penurunan
luas panen kedelai. Luas panen pada tahun 2003 sekitar 50% luas panen pada tahun 1998. Karena itu peningkatan produktivitas (yield) sekitar 10% tidak bisa mengkompensasi pengurangan luas panen dalam mempertahankan produksi nasional. Tahun 2004 produksi kedelai nasional meningkat dibanding tahun 2003 karena adanya peningkatan luas panen. Dengan produktivitas yang sama kebutuhan kedelai nasional bisa dipenuhi tanpa impor (swasembada) bila luas panen kedelai ditambah 871 ribu ha menjadi 1435 ribu ha.
Tabel 1. Produksi kedelai nasional tahun 1998 – 2004
1998 1999 2000 2001 2002 2003 2004 Luas Panen (1000 ha) 1095 1151 825 679 545 527 563 Produksi (1000 ton) 1306 1383 1018 827 673 672 721 Produktivitas (kw/ha) 11.2 12.0 12.3 12.2 12.4 12.8 12.8 Sumber: BPS (1999-2005)
Peluang untuk meningkatkan luas panen kedelai nasional melalui aplikasi tumpang sari kedelai dengan tanaman perkebunan dan kehutanan cukup besar. Luas perkebunan di Indonesia tidak kurang dari 15 juta hektar. Luas perkebunan pada tahun 2002 bahkan melebihi 19 juta ha (BPS, 2003). Dengan siklus peremajaan 25 - 30 tahun, maka sekitar 3 - 4% dari luas perkebunan tersebut merupakan areal tanaman baru yang masih memungkinkan untuk ditumpangsarikan dengan kedelai sampai tanaman pokoknya (TBM) mencapai umur 2 - 3 tahun. TBM berumur 2 - 3 tahun memberi naungan sebesar 33-50 % (Asadi et al., 1997).
Selama ini ruang di antara tegakan tanaman pokok perkebunan ditanami dengan tanaman legum penutup tanah (LCC). Tujuan penanaman LCC di sini antara lain untuk: (a) perlindungan terhadap erosi tanah, (b) penambahan nitrogen tanah melalui penangkapan nitrogen udara, dan (c) pengendalian gulma (Gardner et al., 1990). Dengan manajemen yang baik pengalihan pemanfaatan lahan dari LCC kepada kedelai tidak akan mengurangi keuntungan seperti dikemukakan di atas. Bahkan pemanfaatan kedelai menambah keuntungan yang berupa peningkatan ketersedian pangan dan perbaikan gizi penduduk di
sekitar perkebunan. Hal ini berarti pengembangan kedelai di lahan perkebunan dapat meningkatkan ketahanan pangan nasional, sekaligus mempertahankan kualitas lingkungan.
Depertemen Pertanian RI melalui Program Aksi Masyarakat Agribisnis Tanaman Pangan memproyeksikan lahan tanaman kedelai pada tahun 2004 seluas 680 ribu ha atau meningkat 28% dari luas panen pada 2003. Salah satu sumber lahan yang digarap adalah lahan perkebunan rakyat seluas 11 juta ha dan kehutanan seluas 14.2 juta ha (Direktorat Jenderal Bina Produksi Tanaman Pangan, 2003).
Salah satu kendala utama dalam pengembangan kedelai pada lahan tersebut di atas adalah intensitas cahaya rendah karena tajuk pohon-pohon tersebut menaungi ruang di bawahnya. Berdasarkan penelitian pada perkebunan karet diperoleh informasi bahwa rata-rata intensitas cahaya pada areal terbuka adalah 0.773 kal cm-2 mnt-2. Intensitas cahaya di bawah tegakan karet umur 1, 2, dan 4 tahun berturut- turut sebesar 0.571 kal cm-2 mnt-1, 0.253 kal cm-2 mnt-1, dan 0.216 kal cm-2 mnt-1 atau berarti memberi naungan 26%, 67%, dan 72% terhadap areal terbuka.(Sukaesih, 2002). Sementara itu, naungan 20% sudah digolongkan ke dalam agroklimat yang tidak sesuai bagi pertanaman kedelai (Adisarwanto et al, 2000)
Reduksi cahaya oleh naungan merupakan cekaman (stres) terhadap cahaya. Levitt (1980) mendefinisikan cekaman sebagai faktor lingkungan apapun yang secara potensial tidak sesuai bagi makhluk hidup. Cekaman itu bisa menimbulkan strain. Strain adalah suatu keadaan perubahan fisik atau kimia pada makhluk hidup akibat dikenai cekaman. Strain itu bisa bersifat elastis (dapat balik) artinya keadaan akan kembali seperti semula bila cekamannya dihilangkan. Cekaman yang besar bisa menyebabkan strain permanen (plastis) yang berarti kerusakan atau bahkan kematian pada organisme.
Dalam pandangan agronomi varietas unggul ialah varietas bergenotipe tertentu yang bisa berproduksi tinggi atau sesuai yang dikehendaki dengan memanipulasi lingkungan tumbuhnya. Varietas unggul berproduksi tinggi (high-yielding variety) memberi hasil tinggi bila ditumbuhkan di lingkungan yang cocok serta mendapat perlakuan yang sesuai berupa pengairan, pemupukan, perlindungan terhadap hama penyakit dan sebagainya. Namun lingkungan yang cocok tidak selalu bisa diperoleh. Bila faktor lingkungan tersebut tidak dapat dimanipulasi, maka faktor lingkungan tersebut menjadi faktor pembatas (limiting factor). Berdasarkan hukum ekologi faktor pembatas Liebig maka pertumbuhan dan hasil
tanaman ditentukan oleh faktor pembatas tersebut walaupun faktor lain dalam kondisi optimum.
Tanaman membutuhkan radiasi cahaya matahari sebagai sumber energi untuk menggerakkan proses-proses biokimia dalam fotosintesis. Naungan membuat ketersediaan cahaya, terutama intensitas berkurang. Dalam keadaan ternaungi cahaya menjadi faktor pembatas. Perbedaan karakteristik tanaman sebagaimana diatur oleh gennya menyebabkan kemampuan tanaman untuk beradaptasi terhadap kondisi ternaungi berbeda pula.
Walaupun sumber cahaya adalah sama yaitu matahari, namun banyaknya penyerapan energi matahari oleh sehelai daun bisa berbeda-beda. Perbedaan tersebut disebabkan antara lain oleh halangan awan di atmosfer, naungan di atas tanaman, atau bahkan oleh bagian tanaman (daun) yang lain.
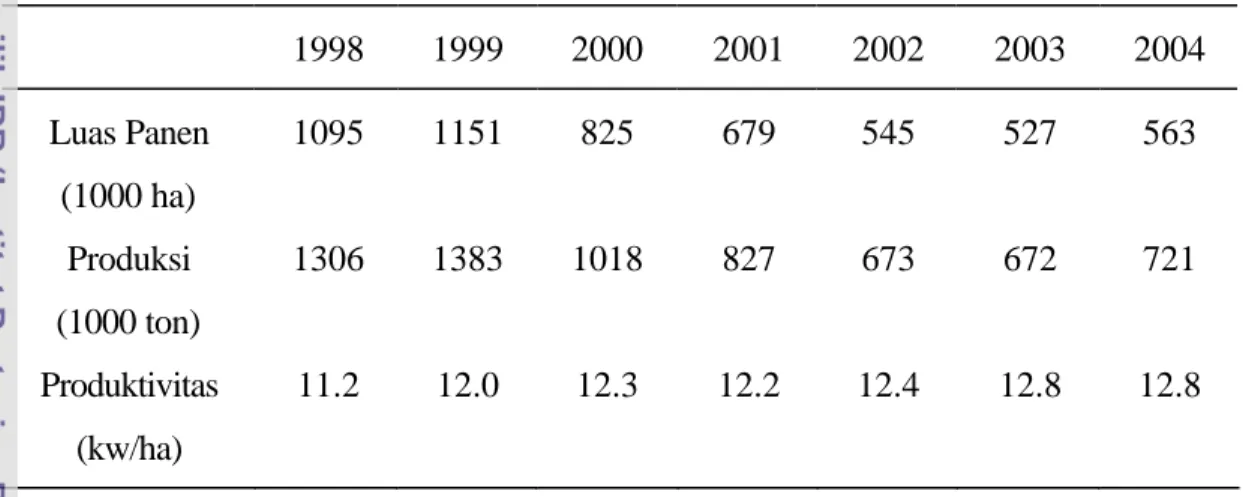
Fotosintesis bersih tajuk adalah jumlah fotosintesis daun total. Fotosintesis ini menghasilkan sukrosa dan pati yang selanjutnya dengan hara mineral yang diabsorbsi disintesis menjadi bahan kering tanaman. Energi yang digunakan untuk menyusun bahan kering juga berasal dari hasil fotosintesis. Bahan kering tanaman ini bisa berupa tajuk, akar, dan biji (Gardner et al, 1990).
Energi yang tersimpan dalam karbohidrat kemudian bisa dipakai untuk sintesis protein, enzim serta absorbsi hara. Baik enzim maupun hara penting bagi proses produksi kedelai. Pada kedelai bintil akar juga mensuplai hara N. Pembentukan bintil memerlukan sukrosa hasil fotosintesis. Pengurangan energi yang diterima tanaman menyebabkan penurunan hasil fotosintesis yang pada giliran berikutnya menurunkan cadangan energi, bahan kering tanaman (termasuk daun), dan pertumbuhan bintil. Akhirnya, berkurangnya penyerapan energi matahari menyebabkan penurunan produksi tanaman (Gambar 1).
Radiasi matahari optimum untuk fotosintesis kedelai adalah berkisar antara 0.3 – 0.8 kal cm-2 mnt-1. Pada radiasi 0.430 kal cm-2 mnt-1 fotosintesis mencapai maksimum (White dan Izquierdo, 1993). Pengurangan intensitas radiasi matahari yang ditimbulkan oleh naungan bisa menyebabkan cekaman yang selanjutnya menyebabkan strain yang kemudian menyebabkan penurunan hasil biji per tanaman.
Penelitian tentang naungan pada kedelai menunjukkan bahwa reduksi cahaya menjadi 40 % sejak perkecambahan sampai panen menurunkan jumlah buku, cabang, diameter
batang, jumlah polong dan hasil biji kedelai. Perlakuan tersebut pada awal pengisian polong menurunkan jumlah polong, hasil biji, dan kandungan protein biji (Baharsjah et al, 1985).
Penelitian tentang naungan juga dilaporkan oleh Sunarlim (1985). Naungan pada penelitian tersebut menyebabkan antara lain kenaikan kandungan klorofil daun dan bobot 100 biji, penurunan jumlah polong dan produksi biji per tanaman. Penelitian ini menunjukkan bahwa naungan tidak mempengaruhi kadar N daun, bobot spesifik daun secara nyata. Namun, penelitian ini belum membedakan respon yang berbeda antar genotipe yang berbeda ketenggangannya.
Naungan 50% menyebabkan penurunan produksi biji antara 0 – 46% terhadap kontrol. Ceneng dan B613 menunjukkan paling toleran, sedangkan Godek paling peka (Sopandie et al, 2002). Selanjutnya, Ceneng dan Godek bisa menjadi model dan bahan tanaman yang utama untuk penelitian dan pengembangan, yang masing-masing mewakili genotipe toleran dan peka.
Pemuliaan tanaman kedelai telah dilakukan pada kondisi naungan ringan (33 %) yaitu pada tumpang sari dengan jagung, sedangkan pada kondisi naungan berat (50 %) yaitu pada tumpang sari dengan tanaman perkebunan belum pernah dilakukan. Penurunan hasil kedelai dengan naungan ringan seperti tumpang sari jagung - kedelai mencapai 2 - 56%. (Asadi et al, 1997). Peningkatan cekaman (stres) cahaya dalam bentuk naumgan 50% akan menyebabkan strain dan pengurangan hasil lebih besar.
Program pemuliaan untuk memperoleh varietas kedelai unggul toleran naungan dilakukan dengan lima tahap yaitu: (a) pencarian sumber gen toleran, (b) hibridisasi, (c) seleksi tanaman F2 - F5, (d) uji daya hasil, dan (e) uji adaptasi dan pelepasan varietas unggul. Strategi yang ditempuh adalah menambah sumber gen toleran naungan dan meningkatkan pengetahuan tentang mekanisme toleransi (Asadi et al., 1997). Untuk itu penelitian dan pengetahuan tentang fisiologi tanaman perlu ditingkatkan.
Penelitian tentang mekanisme adaptasi sangat penting bagi pengembangan IPTEK dan pembangunan pertanian. Evaluasi adaptasi di lapangan terhadap galur toleran naungan yang berproduksi tinggi memerlukan informasi pendukung antara lain karakter anatomi, morfologi, dan fisiologi yang berkaitan dengan mekamisme adaptasi terhadap naungan. Studi fisiologi memberi informasi berharga untuk menuntun atau menentukan pilihan-pilihan dalam manajemen budidaya dan saran strategis untuk pemuliaan tanaman. Proses-proses fisiologi
tertentu menentukan hasil (yield) tanaman. Pengetahuan tentang proses fisiologi yang menentukan hasil inilah yang dipakai untuk menduga potensi hasil dan toleransi cekaman. Dengan pengetahuan yang meningkat, maka keuntungan praktispun akan segera dapat diperoleh (White dan Izquierdo, 1993).
Studi fisiologi terhadap tanaman toleran naungan akan memberi banyak manfaat mengingat keterkaitan naungan dengan proses fisiologi dalam tanaman. Sebuah studi (Kerstiens, 1998) menunjukkan adanya dugaan bahwa tanaman toleran naungan dapat menghasilkan bahan kering lebih tinggi dengan perlakuan penambahan CO2 dibanding
tanaman yang peka naungan.
Informasi tentang pengaruh naungan terhadap pertumbuhan dan fisisologi kedelai seyogyanya bisa dirunut dari hasil penelitian tanaman padi yang dinaungi. Pada kondisi ternaungi, genotipe padi gogo toleran naungan mempunyai kemampuan intersepsi cahaya dan kandungan klorofil a dan b yang lebih tinggi. Kelompok ini juga mampu mempertahankan sintesis pati dan sukrosa serta aktivitas sukrosa fosfat sintase (Lautt et al, 2000) dan enzim rubisco (Sopandie et al, 2003a) lebih tinggi dibanding kelompok peka naungan pada saat dinaungi. Informasi ini menunjukkan bahwa padi gogo toleran naungan memiliki kemampuan penghindaran dan toleransi yang lebih baik daripada yang peka pada kondisi naungan berat.
Pada kedelai informasi tersebut belum terungkap sehingga perlu dilakukan penelitian. Hasil penelitian yang mengungkapkan perbedaan perubahan karakter bisa mengungkapkan mekanisme adaptasi tanaman kedelai terhadap naungan apakah melalui mekanisme penghindaran atau mekanisme toleransi atau keduanya.
Manfaat Penelitian
Hasil penelitian ini diharapkan memberi informasi tentang (1) produktivitas delapan genotipe kedelai pada empat tingkat intensitas cahaya yang berbeda serta (2) karakter tanaman mana yang berhubungan dengan adaptasi tanaman terhadap kondisi naungan di bawah tegakan pohon. Informasi pertama (produktivitas) akan menjadi dasar bagi penentuan pilihan genotipe kedelai yang sesuai bagi lahan-lahan berintensitas cahaya rendah. Informasi kedua akan menjadi dasar bagi penentuan sumber gen untuk pemuliaan tanaman yang mampu beradaptasi dengan kondisi naungan di bawah tegakan tanaman perkebunan atau kehutanan.
Penerapan hasil penelitian ini berupa peningkatan produksi produksi pertanian khususnya kedelai melalui peningkatan indeks pertanaman dan pemanfaatan lahan tidur. Selanjutnya, hasil penelitian ini akan memberi dampak dalam:
a. peningkatkan kualitas lingkungan, khususnya kesuburan tanah dan perlindungan tanah terhadap erosi,
b. perlindungan hutan dan perkebunan dari kerusakan akibat penebangan dan penga-lihan fungsi atau penyerobotan,
c. peningkatan ketahanan pangan dan keamanan sosial melalui penyediaan sumber pangan berkualitas gizi baik.
Kerangka Pemikiran
Sekitar 75 persen (600 000 ha) kedelai dibudidayakan secara tumpang sari. Kebanyakan berupa tumpang sari jagung - kedelai dan kedelai-ubi kayu. Tajuk pada jagung dan ubi kayu memberi naungan maksimal 33%. Karena itu penelitian naungan pada kedelai selama ini dilakukan pada naungan 33% (Asadi, et al, 1997).
Pemanfaatan lahan-lahan di bawah tegakan pohon perlu ditingkatkan mengingat kecenderungan penurunan luas panen kedelai secara nasional. Lahan tidur dan tak termanfaatkan di bawah tegakan tanaman perkebunan dan kehutanan berpotensi cukup besar untuk pengembangan kedelai. Namun, upaya pengembangan kedelai tersebut menghadapi kendala, terutama pada ketersediaan galur-galur yang toleran naungan. Tajuk pohon karet memberi naungan yang lebih besar dari 33% apabila karet telah berumur 2 tahun (Lampiran 1). Karena itu perlu penelitian untuk naungan berat (50%) bila kita hendak mengembangkan kedelai di bawah tegakan pohon karet umur 2 tahun.
Penelitian kedelai pada naungan berat dimulai dengan mengevaluasi 75 genotipe kedelai yang selama pertumbuhannya diberi naungan 50% dan kemudian disaring menjadi 20 genotipe (Elfarisna, 2000). Setelah itu dilakukan pengkajian ulang terhadap 20 genotipe hasil penyaringan tersebut secara in situ pada lahan di bawah pohon karet pada areal perkebunan di Sukabumi (Sukaesih, 2002; Sopandie et al, 2001). Kemudian dilakukan penelitian tentang karakter agronomi. anatomi dan morfologi pada beberapa genotipe yang dipilih. Dari penelitian-penelitian di atas diperoleh antara lain 4 genotipe toleran, yaitu Ceneng, B613, Pangrango, dan Tampomas; 1 genotipe moderat, yaitu Wilis; 3 genotipe peka, yaitu Klungkung Hijau, MLG2999, dan Godek (Sopandie et al, 2002).
Menurut Levitt (1980) tanaman mampu beradaptasi terhadap intensitas cahaya rendah melalui mekanisme penghindaran dan toleransi. Mekanisme penghindaran defisit cahaya dilakukan dengan meningkatkan efisiensi penangkapan cahaya. Mekanisme toleransi terhadap defisit cahaya diperoleh melalui kemampuan tanaman mengurangi respirasi, mengurangi derajat penurunan aktivitas enzim dan kerusakan pigmen.
Merunut dan membandingkan penelitian naungan yang telah dilakukan pada kedelai dan padi gogo, maka terdapat beberapa informasi yang belum terungkap pada kedelai tentang mekanisme penghindaran dan toleransi. Gambar 2 menunjukkan skema pengaruh cahaya terhadap tanaman serta mekanime penghindaran dan toleransi berdasarkan hasil penelitian yang telah diperoleh.
Perubahan anatomi dan morfologi sebagai mekanisme penghindaran telah dilakukan untuk beberapa genotipe (Sopandie et al, 2002; Sopandie et al, 2005). Namun, mekanisme penghindaran untuk genotipe lain juga perlu diteliti. Perubahan karakter daun akibat perlakukan cahaya ekstrim (gelap total) juga belum pernah dilakukan. Selain itu, pembahasan tentang persentase perubahan karakter daun yang berhubungan dengan mekanisme penghindaran perlu dipertajam.
Penelitian pada padi gogo menunjukkan bahwa padi toleran mampu mempertahankan kandungan rubisco dan aktivitasnya tetap tinggi (Sopandie et al, 2003a). Genotipe padi gogo yang toleran naungan juga memiliki rasio sukrosa/pati dan aktivitas enzim sukrosa fosfat sintase (SPS) lebih tinggi dibanding padi peka naungan saat dinaungi 50% (Lautt et al, 2003). Selanjutnya, genotipe padi gogo yang toleran naungan memiliki tingkat respirasi gelap lebih rendah dibanding yang peka Semua peubah tersebut menunjukkan mekanisme adaptasi melalui toleransi yang belum diungkap pada kedelai.
Penelitian dalam disertasi ini mengkaji perubahan karakter fisiologi akibat naungan yang pernah dilakukan pada padi tetapi belum dilakukan pada kedelai, yaitu komponen nitrogen (N) daun, aktivitas enzim rubisco, aktivitas enzim SPS, kandungan sukrosa dan pati daun. Selain itu juga dilakukan penelitian perlakuan cahaya dalam waktu singkat secara on/off yang bisa menggambarkan penyembuhan setelah cekaman naungan, adaptasi terhadap naungan, dan pendugaan respirasi gelap. Alur penelitian disertasi ini dipaparkan pada Gambar 3.
Tujuan Penelitian
Tujuan penelitian ini adalah mengkaji mekanisme adaptasi tanaman kedelai terhadap intensitas cahaya rendah melalui mekanisme penghindaran (avoidance) maupun toleransi (tolerance). Mekanisme tersebut dikaji berdasarkan respon berbagai genotipe kedelai terhadap intensitas cahaya rendah melalui perubahan karakter produksi, karakteristik daun, dan fisiologi yang berhubungan dengan fotosintesis dan respirasi.
Hipotesis Hipotesis dalam penelitian ini adalah:
a. Intensitas cahaya rendah menyebabkan penurunan produksi lebih besar pada genotipe peka daripada genotipe toleran
b. Genotipe toleran menunjukkan perubahan karakter daun yang lebih besar daripada genotipe peka sehingga mempunyai mekanisme penghindaran lebih baik.
c. Genotipe toleran naungan mengalami perubahan karakter fisiologi lebih kecil daripada genotipe peka sehingga mempunyai mekanisme toleransi lebih baik
Fotosintesis Daun Fotosintesis Daun Fotosintesis Daun Fo t o s i n t e s i s B e r s i h T a j u k
r e a l o k a s i p a d a m a s a
g e n e r a t i f / p e n g i s i a n p o l o n g
Gambar 1. Hubungan ketersediaan energi cahaya dengan proses metabolisme untuk produksi biji kedelai (Gardner et al, 1990)
pemanfaatan energi hasil respirasi tajuk
sukrosa hasil fotosintesis pada masa vegetatif pembentukan source
Cahaya Matahari
Penyerapan Cahaya oleh Tanaman
T a j u k (source atau sink)
A k a r (sink) B i j i (sink) pembentukan bintil akar sintesis enzim absorbsi hara metabolisme hara B a h a n K e r i n g T a n a m a n
Kekurangan Cahaya
Kerkurangan cahaya karena naungan Kerkurangan cahaya karena kondisi gelapMengakibatkan (pada kedelai): - Penurunan hasil biji
- Penurunan laju fotosintesia aktual dan maksimum - Tetap menghasilkan butir pati
- Perkembangan membran tilakoid tetap baik - Perubahan jumlah cabang utama
- Menambah panjang (tinggi) tanaman (etiolasi)
Mengakibatkan (pada kedelai): - Penurunan bobot kering kedelai - Fotosintesis bersih negatif - Tidak menghasilkan butir pati - Tilakoid tidak berkembang
Respon untuk menghindari defisit cahaya dengan meningkatkan efisiensi penangkapan cahaya (pada padi dan kedelai):
- Peningkatan kandungan klorofil a - Peningkatan kandungan klorofil b
- Penurunan rasio kandungan klorofil a terhadap klorofil b - Peningkatan rasio luas/ bobot daun
- Penipisan daun, pengurangan bulu daun
Respon untuk toleran terhadap kondisi defisit cahaya (pada padi):
- Mempertahankan perimbangan kandungan sukrosa/pati dan aktivitas enzim SPS dan rubisco tetap tinggi
- Kandungan N terlarut daun meningkat
1. Perlakuan singkat on/off
2. Perlakuan variasi pergiliran gelap- naungan/ terang
Mengakibatkan:
- Perubahan kandungan karbohidrat daun?
- Adaptasi dan penyembuhan? -
Respon untuk toleran dengan menurunkan tingkat respirasi gelap (pada padi)
Studi Pendahuluan Evaluasi 75 genotipe
(Elfarisna, 2000)
Perbanyakan Benih
Evaluasi Ulang terhadap Daya Adaptasi in situ (Percobaan di Bawah Tegakan Pohon Karet di Sukabumi)
(Sukaesih, 2002; Sopandie et al, 2001)
Penelitian Disertasi
Produktivitas dan Mekanisme Adaptasi Kedelai pada Naungan Sejak Tanam sampai Panen
(Percobaan di Kebun Cikabayan IPB) 1. Respon delapan genotipe terhadap naungan - Produksi (penelitian 1)
2. Identifikasi karakter struktur daun (penelitian 2) - morfologi dan anatomi daun
- klorofil
3. Identifikasi karakter fisiologi (penelitian 3) - aktivitas enzim rubisco
- perimbangan sukrosa/pati - N daun
- aktivitas enzim SPS
Penelitian Disertasi
Studi Mekanisme Adaptasi pada Cekaman Ekstrim (on/off) melalui Variasi Pergiliran Gelap - Terang
(Percobaan di Kebun Cikabayan IPB) 1. Perubahan struktur daun (penelitian 2) 2. Perubahan fisiologi (penelitian 3) Penelitian Disertasi Percobaan 1-A Percobaan di Sukabumi Penelitian Disertasi Percobaan II Penelitian Disertasi Percobaan I-B
TINJAUAN PUSTAKA
Kedelai
Kedelai (Glycine max (L) Merrill) merupakan anggota keluarga Papilonaceae. Kedelai adalah tanaman semusim berbentuk semak-semak rendah, tumbuh tegak dengan panjang batang antara 100 – 200 cm. Akar kedelai bisa membentuk bintil akar yang berbentuk bulat atau tidak beraturan yang merupakan koloni bakteri Rhizobium japonicum. Hubungan saling menguntungkan (mutualisme) antara bakteri dengan kedelai ini terjadi karena bakteri memperoleh karbohidrat dari hasil fotosintesis kedelai, sedangkan kedelai memperoleh suplai nitrogen yang ditambat dari udara (Hidayat, 1985).
Jumlah buku dan panjang ruas kedelai tergantung genotipe, panjang hari, dan tipe tumbuh. Pembentukan buku pada tanaman selesai pada umur 35 hari. Jumlah buku, cabang dan diameter batang bisa turun bila lingkungan tumbuhnya kekurangan cahaya (Lersten dan Carlson, 1987).
Agronomi dan Produksi Tanaman
Kemampuan kedelai untuk berproduksi tergantung kepada potensi genetik yang tersimpan dalam benihnya serta lingkungan tumbuhnya yang mensuplai cahaya, air, dan hara mineral (Iowa State University, 1994). Bahan kering total kedelai merupakan hasil tajuk tanaman dalam memanfaatkan radiasi matahari yang tersedia selama masa pertumbuhan. Proses yang menentukan produksi tanaman adalah akumulasi dan partisipasi bahan kering. Akumulasi bahan kering merupakan pertumbuhan tanaman dan hasil langsung dari keseimbangan fotosintesis dan respirasi serta kehilangan karena senesens dan absisi. Partisipasi adalah keseimbangan antara pertumbuhan vegetatif dan generatif (Gardner et al, 1990).
Pertumbuhan tanaman pada dasarnya disebabkan pertambahan atau pembesaran sel. Proses pembesaran sel dimulai dari air yang berdifusi ke dalam sel sehingga menimbulkan tekanan hidrostatis. Tekanan hidrostatis ini menekan dinding sel ke arah luar sehingga sel mengembang dan membesar (Taiz dan Zeiger, 1991; Salisburry dan Ross, 1992).
Akumulasi bahan kering tanaman sangat ditentukan oleh kapasitas fotosintesis tajuk dan respirasi tajuk. Produksi tanaman akan lebih tinggi pada tanaman yang mempunyai respirasi tajuk lebih rendah. Respirasi tajuk terdiri atas respirasi gelap dan fotorespirasi (Gardner et
al, 1990). Respirasi gelap ini bisa untuk pertumbuhan atau pemeliharaan (Smith, 1997). Akhirnya, produksi biji kedelai tergantung kepada kekuatan biji sebagai sink untuk menarik biomasa menjadi biomasa biji ( Shibels et al, 1987).
Produksi tanaman ditentukan oleh pertumbuhan dan perkembangan. Pertumbuhan ialah penambahan pada ukuran tanaman, berupa jumlah daun, jumlah buku, tinggi dan bobot kering tanaman. Perkembangan menyangkut perubahan fase siklus hidup, yaitu perkecambahan, inisiasi cabang bunga, pembungaan, dan pengisian biji (White dan Izquierdo, 1993).
Kapasitas dan laju fotosintesis daun kedelai sangat dipengaruhi oleh usia daun dan kondisi lingkungan (Shibels et al, 1987). Laju fotosintesis daun meningkat sejalan dengan pertambahan luasnya, lalu mencapai maksimum untuk beberapa lama yang tergantung pada genotipe dan posisi daun, kemudian menurun. Penurunan ini disebabkan terutama oleh kehilangan kapasitas fotosintesis, disamping penurunan konduktansi stomata terhadap air dan udara. Penurunan kapasitas fotosintesis ini berkorelasi positif dengan pengurangan N dan aktifitas mobilisasi.
Saat intensitas cahaya rendah kecepatan fotosintesis berbanding lurus (linear) dengan PPFD (photosynthetic photon flux density). Semakin bertambah intensitas cahaya, perbandingan tersebut semakin mengecil sampai mencapai laju fotosintesis maksimum. Laju fotosintesis daun kedelai maksimum dicapai pada saat radiasi 300 W m-2 atau 0.430 kal cm-2 mnt-1 (White dan Izquierdo, 1993).
Penelitian Khumaida (2002) menunjukkan bahwa genotipe Ceneng (toleran), Pangrango (toleran), Orba (moderat), dan Godek (peka) mencapai fotosintesis maksimum pada intensitas cahaya yang sama yaitu sekitar 1500 µmol cm-2 dtk-1. Baik pada kedelai yang beradaptasi terhadap cahaya penuh maupun yang ternaungi fotosintesis maksimum dicapai pada intensitas cahaya yang sama. Namun, laju fotosintesis dan fotosintesis maksimum lebih rendah pada kedelai yang ternaungi.
Fotosintesis bisa turun bila permintaan (kebutuhan) di jaringan yang sedang tumbuh kecil. Ini terjadi karena permintaan (demand) yang rendah menyebabkan laju transpor hasil fotosintes keluar dari jaringan daun juga kurang. Akibatnya, akumulasi pati di daun meningkat. Akumulasi pati di daun menghambat fotosintesis (White dan Izquierdo, 1993; Shibels et al, 1987)
Fotosintesis
Cahaya berperan sangat penting dalam kehidupan tanaman. Cahaya mempengaruhi pertumbuhan produksi biomasa tanaman melalui fotomorfogenesis dan fotosintesis. Total energi yang masuk dan tersimpan dalam sistem tanaman tergantung kepada laju fotosintesis per unit area dan luas bagian tanaman yang menerima cahaya. Kecepatan fotosintesis tergantung kepada cahaya, umur daun, tahap perkembangan tanaman, kandungan N daun, status air, temperatur, konsentrasi CO2, dan distribusi (penyebaran) daun (Raper dan
Kramer, 1987). Di bawah kondisi suhu 20 - 30o C dan kelembaban optimum, serta jenuh cahaya bisa diketahui AP (apparent photosynthesis) potensial kedelai yang juga mencerminkan aparatus fotosintesis (Shibels et al, 1987).
Hasil fotosintesis tajuk ditentukan oleh efisiensi fotosintesis daun dan penerimaan cahaya. Kapasistas penerimaan cahaya tergantung antara lain oleh banyaknya radiasi dan efisiensi penerimaannya (Gardner et al, 1990). Dengan kata lain, akumulasi bahan kering tergantung kepada banyaknya radiasi cahaya tersedia dan kemampuan tanaman menangkap, menyerap, dan memanfaatkan cahaya. Jadi naungan akan menyebabkan produksi biji kedelai turun karena radiasi tersedia yang sampai ke badan tanaman berkurang. Dalam hal kapasitas, naungan tidak menyebabkan penurunan yang signifikan.
Proses Fotosintesis
Peranan fotosintesis sangat penting dalam manajemen produksi tanaman karena hampir semua produksi tanaman didominasi oleh komponen karbohidrat yang merupakan hasil akhir fotosintesis. Sementara itu, metabolisme lipid dan protein yang juga merupakan komponen hasil utama memerlukan unsur karbon hasil fotosintesis.
Dalam fotosintesis energi cahaya diserap oleh klorofil dan berbagai pigmen. Pada fotosintesis energi matahari digunakan untuk mereduksi CO2 menjadi gula. Klorofil adalah
pigmen hijau penyerap cahaya: Chl + hν → Chl*. Energi cahaya yang ditangkap digunakan
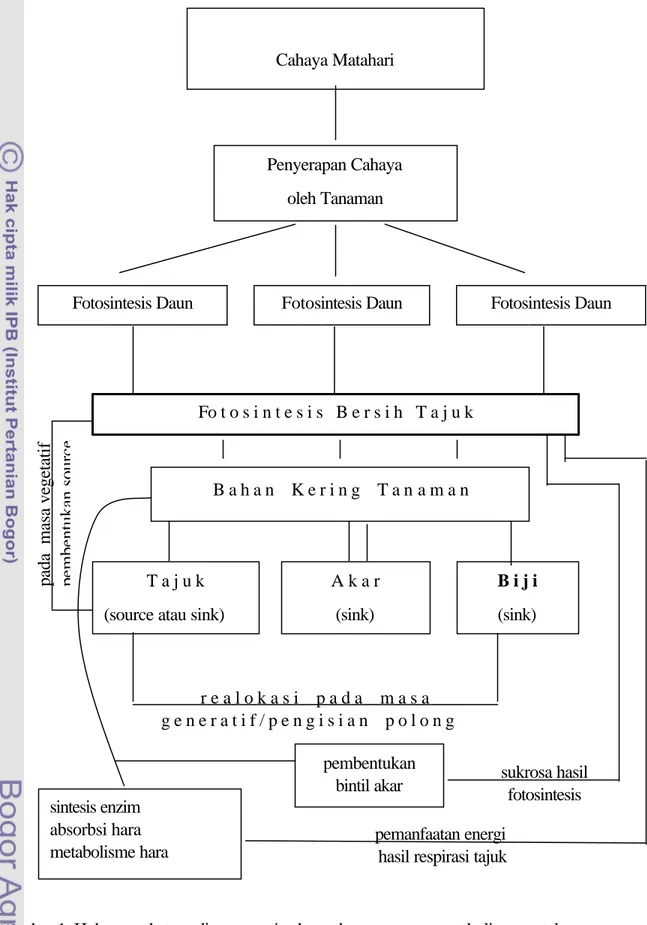
untuk penggerak tranfer elektron dalam rangkaian energi sehingga terbentuk senyawa berenergi tinggi yaitu NADPH dan ATP. Terbentuknya senyawa ATP dan NADPH ini menandai berakhirnya reaksi cahaya dalam fotosintesis, untuk berlanjut kepada reaksi gelap. Dalam reaksi gelap energi yang tersimpan dalam ATP dan NADPH digunakan untuk menambat dan mengubah CO2 menjadi karbohidrat (Taiz dan Zeiger, 1991).
Pada dasarnya fotosintesis adalah suatu reaksi redoks yang digerakkan oleh cahaya. Reaksi fotosintesis terdiri atas 3 tahapan yaitu: (1) tahap antena menangkap cahaya dan mentransfernya ke pusat reaksi, (b) tahap rangkaian reaksi transfer elektron dan fotofosforilasi, serta (c) metabolisme karbon. Metabolisme karbon adalah suatu rangkaian proses reaksi yang disebut siklus PCR (photosinthetic carbon reduction). Siklus PCR terdiri atas karboksilasi, reduksi, dan regenerasi. Dalam karboksilasi CO2 masuk siklus
PCR melalui reaksinya dengan ribulose 1, 5 bisphosphate (RuBP) yang menghasilkan 3-phosphoglycerate (3-PGA). Reaksi ini dikatalisis oleh enzim ribulose bisphosphate carboxylase/ oxygenase (rubisco). Kelompok tanaman yang menangkap CO2 atmosfir
dengan RuBP disebut tanaman C3. Salah satunya ialah kedelai. Tanaman C3 dan Fiksasi Karbon
Produksi tanaman sangat ditentukan oleh produksi bahan kering yang dalam fisiologi ditentukan oleh selisih CO2 udara yang diserap melalui fotosintesis dan CO2 yang dilepas
tanaman melalui respirasi. Selama pertumbuhan umumnya respirasi tanaman menggunakan 25 - 30 % total fotosintesis sehingga ada selisih positif yang digunakan untuk pertumbuhan (akumulasi) bobot kering. Bila respirasi lebih tinggi daripada fotosintesis (tanaman diletakkan dalam gelap sehingga tidak ada fotosintesis) maka bobot tanaman akan berkurang (Gardner et al., 1990).
Berdasarkan perbedaan proses fiksasi karbondioksida tanaman bisa digolongkan menjadi tanaman C3, C4, dan CAM. Kedelai dimasukkan ke dalam tanaman C3 yang efisien memanfaatkan cahaya (Gardner et al, 1990 dan Specht, 1999). Pada tanaman C3 karbondioksida atmosfer diikat oleh RuBP menjadi 3-PGA yaitu suatu molekul 3-karbon. Tanaman C4 menangkap CO2 udara dengan fosfoenol piruvat (PEP) untuk menghasilkan
molekul 4-karbon. Fiksasi CO2 pada tanaman CAM juga menghasilkan molekul 4-karbon.
Perbedaannya, pada CAM karbondioksida diikat pada malam hari (yaitu saat stomata terbuka maksimum) dengan menggunakan energi glikolisis. Pada siang terik dan stomata tertutup tanaman CAM hanya menjalankan reaksi terang. Jika kondisi air mencukupi beberapa tanaman CAM juga bisa bertindak seperti tanaman C3 (Gardner et al., 1990; Taiz dan Zeiger, 1991)
Fiksasi CO2 menjadi 3-PGA dikatalisis oleh enzim ribulose bis-phosphate (RuBP) carboxylase/oxygenase atau rubisco. ATP dari hasil fotofosforilasi digunakan untuk
mengubah riboluse-5-phosphat menjadi RuBP. ATP dan NADPH hasil reaksi terang juga digunakan untuk mengubah 3-PGA menjadi 3-PGAld. Keseluruhan proses ini disebut siklus Calvin. Pada tanaman C3 siklus Calvin berlangsung di sel mesofil.
Pada tanaman C4 fiksasi CO2 udara oleh PEP dikatalisis oleh enzim phosphoenol
pyruvate (PEP) carboxylase. ATP hasil fotofosforilasi digunakan untuk mengubah piruvat menjadi PEP. Penangkapan CO2 udara oleh PEP berlangsung di sel mesofil, tetapi siklus
Calvinnya berlangsung di sel seludang pembuluh (Gardner et al., 1990; Taiz dan Zeiger, 1991)
Selain perbedaan dalam proses penangkapan CO2 tanaman C3 dan C4 juga berbeda
dalam hal berikut, yaitu: (a) anatomi, (b) efisiensi penangkapan CO2 dan kecepatan
fotosintesis, dan (c) kandungan rubisco dan adaptasi. Tanaman C4 memiliki kloroplas di sel seludang pembuluh, sedangkan tanaman C3 tidak punya. Untuk tanaman C3, kloroplas di mesofil menjadi tempat bagi pengikatan CO2, proses siklus Calvin, dan akumulasi pati.
Untuk tanaman C4, pati tidak terbentuk di sel mesofil karena siklus Calvin berlangsung di sel seludang (Gardner et al., 1990).
Tanaman C4 mempunyai tingkat efisiensi pengikatan CO2 dan kecepatan fotosintesis
lebih tinggi, tetapi efisiensi pemakaian energi lebih rendah. Enzim PEP karboksilase mempunyai afinitas terhadap CO2 lebih tinggi dibanding rubisco sehingga pada level CO2
rendah fotosintesis tanaman C4 lebih efisien. Karena itu, pada intensitas cahaya tinggi tanaman C4 mempunyai efisiensi fotosintesis lebih tinggi. Namun, efisiensi energi pada tanaman C4 lebih rendah karena sebagian ATP digunakan untuk membentuk PEP. Jadi pada kondisi intensitas cahaya rendah, hasil fotosintesis berupa karbohidrat bisa lebih rendah (Gardner et al., 1990)
Tanaman C3 mempunyai kandungan rubisco per bobot kering daun lebih tinggi dibanding tanaman C4. Tetapi, tanaman C3 tidak memiliki enzim PEP karboksilase. Karena stomata menutup pada kondisi kering dan panas, maka tanaman C4 yang efisien dalam menangkap CO2 akan lebih adaptif untuk ditanam pada daerah kering dan panas dibanding
tanaman C3 (Gardner et al, 1990). Dengan demikian tanaman C4 lebih responsif terhadap perubahan radiasi cahaya daripada tanaman C3.
Rubisco juga mengikat O2 selain CO2. Pengikatan O2 menyebabkan terjadinya proses
dibanding tanaman C4. Pada tanaman C4 fotorespirasi sangat rendah karena CO2
dikonsentrasikan terlebih dulu di sel-sel seludang pembuluh. Pengkonsentrasian CO2 ini
menyebabkan rasio CO2 terhadap O2 meningkat sehingga lebih cocok untuk RuBP
karboksilase daripada RuBP oksigenase. Fotorespirasi memungkinkan aminasi untuk sintesa asam amino dan mempertahankan fosfat inorganik bersiklus sehingga lebih cocok dan menguntungkan pada kondisi intensitas cahaya rendah dan temperatur sejuk (Gardner et al., 1990; Taiz dan Zeiger, 1991). Hampir semua tanaman lantai hutan tergolong tanaman C3 (Smith, 1997). Tanaman C3 teraklimisasi pada cahaya rendah karena memiliki laju respirasi gelap rendah dan titik jenuh cahaya yang rendah (Salisburry dan Ross, 1992).
Daun dan Produksi Tanaman
Daun tanaman budidaya kebanyakan mempunyai (a) permukaan luar rata dan luas, (b) lapisan pelindung atas dan bawah, (c) beberapa stomata per satuan luas, (d) ruang udara yang saling berhubungan di dalamnya, (e) sejumlah banyak kloroplas, dan (f) saluran pembuluh. Yang ideal untuk fotosintesis ialah daun yang bertebal satu sel untuk memaksimumkan intersepsi cahaya per unit volume dan meminimumkan jarak yang harus dilalui untuk pertukaran gas (Gardner et al., 1990).
Daun juga perlu perlindungan terhadap lingkungan, maka daun juga perlu beberapa lapis sel dan lapisan permukaan pelindung. Lapisan kutikula dan lilin bersifat transparan dan dapat dilalui cahaya, tetapi tidak dapat dilalui CO2. Karena itu daun mempunyai jendela
pada permukaannya berupa stomata (Gardner et al., 1990). Anatomi Daun dan Stomata
Sel-sel palisade biasanya dijumpai pada bagian adaxial (atas) daun, berbentuk tiang, dan mengandung klorofil. Sel parenkima palisade bisa berbentuk barisan dengan satu lapisan atau dua lapisan. Panjang selnya bisa sama atau semakin mengecil bila menuju ke bagian tengah mesofilnya (Lersten dan Carlson, 1987).
Stomata terletak di bagian epidermis. Stomata merupakan pintu untuk pertukaran gas antara jaringan dalam tumbuhan dan lingkungannya. Pada tumbuhan darat, umumnya stomata tersebar pada epidermis bawah. Beberapa tanaman mempunyai stomata pada kedua permukaan daunnya.
Kerapatan stomata daun berbeda-beda. Pada kedelai yang pernah diteliti kerapatan stomata antara 130 – 316 per mm2. Banyaknya stomata bisa berkurang bila kedelai ditanam
di tempat yang cahayanya kurang (Lersten dan Carlson, 1987). Penurunan stomata karena naungan juga terjadi pada manggis (Garcinia mangostana) (Wiebel et al, 1999) dan Amborella trichopoda (Field et al, 2001). Penelitian Sopandie et al (2002) menunjukkan bahwa naungan 50% menyebabkan penurunan kerapatan stomata. Dalam hal ini kelompok genotipe toleran mengalami persentase penurunan lebih sedikit dibanding genotipe peka, yaitu masing-masing 12% dan 32%.
Ketersediaan cahaya dan konsentrasi CO2 menjadi faktor pembatas bagi kecepatan
fotosintesis tumbuhan. Untuk mengefektifkan penerimaan dan penangkapan cahaya susunan sel-sel palisade dan bunga karang dibuat sedemikian sehingga cahaya bisa terdistribusi dalam sel mesofil dan penangkapan cahaya secara total optimum. Tumbuhan juga bisa mengatur letak kloroplas dan mengorientasikan daun sesuai dengan arah dan intensitas cahaya. Dalam situasi ternaungi kloroplas mengumpul ke dekat lapisan epidermis sehingga daun tampak lebih hijau (Taiz dan Zeiger, 1991).
Daun bisa beradaptasi dengan lingkungan untuk meningkatkan fotosintesis melalui pengaturan laju pertukaran gas. Kecepatan pertukaran gas pada daun tergantung kepada banyaknya stomata per luas daun dan lebar pembukaan stomata. Di sini stomata adalah jendela yang bisa dilalui gas dan air. Konduktansi stomata mencerminkan kondisi kemudahan stomata untuk pertukaran gas CO2 dan air. Semakin banyak dan lebar
pembukaan stomata maka semakin tinggi konduktansi stamota dan semakin tinggi pertukaran CO2 per satuan luas daun. Karena itu konduktansi stomata juga mencerminkan
level fotosintesis (Taiz dan Zeiger, 1991). Kloroplas
Kloroplas adalah tempat konversi energi yang bisa ditemukan hanya pada sel fotosintesis. Ukurannya sekitar 5 x 2 x (1-2) µm. Organel ini dipisahkan oleh sitosol dengan membran ganda (membran luar dan dalam). Kloroplas tergolong plastid yang memiliki pigmen klorofil dan protein yang berhubungan dengan fotosintesis. Karena mengandung klorofil maka kloroplas berwarna hijau. Kloroplas punya membran ketiga, yaitu tilakoid. Di tilakoid inilah terdapat klorofil dan protein yang berfungsi dalam fotokimia di fotosintesis. Stroma ialah bagian cairan yang mengelilingi tilakoid, sedangkan lamella ialah tilakoid yang tidak bertumpuk (Taiz dan Zeiger, 1991; Gardner et al, 1990).
Stroma mengandung banyak ribosom, bahan protein, dan protein. Rubisco menempati lebih 50 persen bagian dari protein stroma. Proses reduksi karbondioksida (reaksi gelap) terjadi di stroma, sedangkan transformasi energi cahaya menjadi energi kimiawi (reaksi terang) terjadi di lamela. Pembentukan potensi kimia terjadi karena transformasi energi cahaya membentuk gradien proton antara sisi membran. Dengan bantuan enzim ATP sintase perbedaan gradien digunakan untuk mengubah ADP menjadi ATP dan NADP menjadi NADPH. Selanjutnya, ATP dan NADPH dipergunakan dalam proses perubahan karbondioksida (CO2 ) menjadi karbohidrat, molekul -molekul organik serta proses biologi
lain (Gardner et al, 1990; Newcomb, 1990; Mullet, 1990).
Pigmen dalam kloroplas sebagian besar berupa klorofil (a dan b) serta karotenoid (karotin dan xantofil). Klorofil merupakan pigmen fotosintesis yang terdapat pada membran tilakoid dalam kloroplas. Pada tumbuhan tingkat tinggi, termasuk kedelai selalu terdapat dua jenis klorofil a (C55H72O5N4Mg) dan klorofil b (C55H70O6N4Mg). Klorofil bergabung dalam
suatu kompleks yang disebut fotosistem.
Klorofil adalah pigmen penyerap cahaya utama. Karotenoid bisa tidak aktif, bisa menyerap cahaya dan mentranfer elektron ke klorofil, atau mentrafer elektron antar fotosistem. Cahaya yang diserap daun berbeda dengan yang diserap oleh kloroplas. Yang paling banyak diserap oleh klorofil adalah cahaya merah, kemudian biru dan yang paling sedikit adalah cahaya hijau (Gardner et al, 1990; Hall dan Rao, 1999). Cahaya yang diserap daun tetapi tidak diserap klorofil, tidak dapat dimanfaatkan untuk fotosintesis.
Sel meristematik akar, tajuk, embrio, endosperma, dan daun muda yang sedang berkembang berisi proplastid. Proplastid tidak berwarna. Proplastid tidak atau sedikit memiliki membran dalam, tidak punya klorofil, serta perangkat fotosintesisnya tidak lengkap untuk kerja fotosintesis. Perkembangan kloroplas dari proplastid di batang dan daun dipicu oleh cahaya. Setelah terkena penyinaran proplastid membesar dan terjadi perubahan: (a) enzym terbentuk dalam proplastid atau diimpor dari sitosol, (b) pigmen penyerap cahaya terbentuk, (c) membran dalam berkembang cepat membentuk lamela stroma dan grana (lamela yang bertumpuk) yang jelas (Taiz dan Zeiger, 1991; Newcomb, 1990)
Pada kecambah, kloroplas terbentuk hanya jika tajuk terkena cahaya. Jika tidak ada cahaya proplastid berubah jadi etioplas. Proplastid berisi protoklorofil (perkusor pigmen berwarna hijau kuning pucat). Beberapa menit setelah terkena cahaya proplastid
berdiferensiasi: (a) prolamela menjadi tilakoid dan lamela stroma (b) protoklorofil menjadi klorofil. Kloroplas juga bisa kembali jadi etioplas bila dikenai gelap panjang (Gardner et al, 1990; Taiz dan Zeiger, 1991). Kloroplas yang usang dan tidak berfungsi berubah menjadi kromoplas. Di sini lamela stroma dan grana teracak dan klorofilnya hancur. Namun, kromoplas juga bisa balik menjadi kloroplas (Newcomb, 1990).
Pada tanaman yang mengalami etiolasi, yaitu tanaman yang ditumbuhkan pada tempat gelap secara terus menerus kloroplas tidak berkembang normal, tetapi menjadi etioplas. Etioplas berwarna kuning karena adanya protoklorofil, dan bukan klorofil. Membran dalamnya disebut badan prolamelar. Bila menerima cahaya etioplas menjadi kloroplas ditandai dengan: protoklorofil menjadi klorofil dan badan prolamelar menjadi grana dan lamela stroma (Newcomb, 1990; Taiz dan Zeiger, 1991).
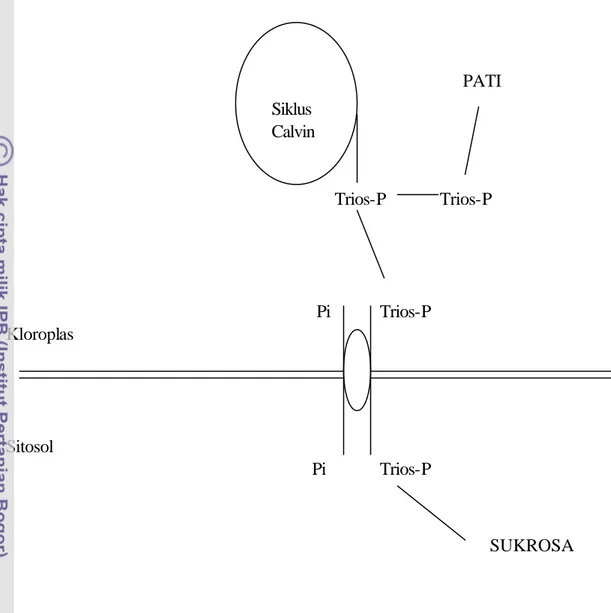
Peranan cahaya dalam pembentukan klorofil terdapat pada dua proses (Gambar 4), yaitu pada regulasi ekspresi gen untuk komplek pemanen cahaya (gen cab) dan pada perubahan protoklorofilida (Pchl) menjadi klorofil ( Mohr dan Schopfer, 1995). Selanjutnya, seperti diperlihatkan pada Gambar 5 klorofil b bisa terbentuk dari bahan klorofil a (Schoefs dan Bertrand, 1997). Hambatan pembentukan gen cab bisa disebabkan oleh tingkat kandungan karbohidrat yang tinggi pada daun (Madore, 1997).
Klorofil dan Adaptasi terhadap naungan
Tanaman merespon kondisi lingkungan berintensitas cahaya rendah dengan meningkatkan kandungan klorofil, mengurangi ketebalan daun, dan mengurangi rasio klorofil a terhadap klorofil b (Taiz dan Zeiger, 1991; Zhao dan Oosterhuis, 1998; Johnston dan Onwueme, 1998).
Tumbuhan Atriplex triangularis memiliki adaptasi plastik terhadap ketersediaan cahaya. Atriplex yang beradaptasi dan toleran naungan memiliki klorofil total per pusat reaksi fotosintesis lebih tinggi. Selain itu, Atriplex yang toleran memiliki daun lebih tipis dan rasio klorofil a/b lebih kecil dibanding yang kurang toleran. Daun yang beradaptasi terhadap cahaya berlebih mempunyai protein terlarut tinggi, aktivitas rubisco tinggi, tingkat respirasi tinggi dibanding yang yang beradaptasi terhadap lingkungan berintensitas cahaya rendah (Taiz dan Zeiger, 1991). Pembentukan klorofil dipengaruhi oleh cahaya, sehingga tanaman toleran mungkin memerlukan intensitas cahaya minimal lebih rendah bagi pemicuan pembentukan klorofil.
gen cab
hv
Pr Pfr
hv
apoprotein Light Harvesting Complex II
ALA PChl Chl (klorofil dalam LHC II) Gambar 4. Peranan cahaya dalam pembentukan klorofil daun ( Mohr dan Schopfer, 1995)
cahaya PChl a Chlide a Chl a Pchl b Chlide b Chl b
Gambar 5. Peranan cahaya pada proses pembentukan klorofil a dan b (Schoefs dan Bertrand, 1997).
Johnston dan Onwueme (1998) menunjukkan daun talas yang dinaungi memiki kandungan klorofil lebih tinggi dan rasio klorofil a/b lebih rendah. Fenomena yang sama diungkapkan oleh Zhao dan Oosterhuis (1998) terjadi pada kapas (Gossypium hirsutum). Selanjutnya, Sopandie et al (2003) menunjukkan bahwa genotipe padi yang toleran naungan meningkatkan jumlah klorofil lebih banyak, baik secara kuantitas maupun persentase bila diberi perlakuan naungan. Rasio klorofil a/b (klorofil a terhadap klorofil b) pada kedua jenis padi yang dinaungi menurun, tetapi penurunan pada genotipe yang toleran naungan lebih besar.