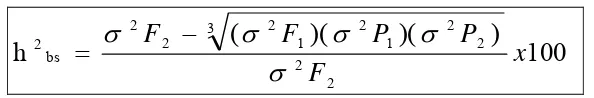ANALISIS GENETIK DAN MOLEKULER ADAPTASI
KEDELAI TERHADAP INTENSITAS CAHAYA
RENDAH BERDASARKAN KARAKTER
MORFO-FISIOLOGI DAUN
KISMAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi “Analisis Genetik dan Molekuler Adaptasi Kedelai terhadap Intensitas Cahaya Rendah berdasarkan Karakter Morfo-fisiologi Daun” adalah karya saya sendiri dengan arahan Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Juli 2007
Kisman
ABSTRACT
KISMAN. Genetic and Molecular Analyses of Soybean Adaptation to Low Light Intensity based on Leaf Morpho-physiological Characters. Supervised by DIDY SOPANDIE, SOBIR, TRIKOESOEMANINGTYAS, and NURUL KHUMAIDA
In order to increase soybean production in Indonesia, developing soybean as intercrop under estate crops or agroforestry systems are required. The main problem, however, is low light intensity due to neighbour shade. Therefore, low light intensity tolerance genotypes or varieties of soybean are needed. Development of new low light intensity tolerance varieties of soybean, however, is still very slow. The reason is that very little understanding on the comprehensive mechanism of soybean tolerance to low light intensity condition in such of the aspect of morpho-physiology, genetics, and molecular. The main objective of this study was to obtain the comprehensive knowledge on the mechanism of adaptation through morpho-physiological, genetic and molecular approaches to strengthen the breeding efforts in developing new low light intensity tolerance variety of soybean.
This study was comprised in four topics of research. (1) Response of leaf morpho-physiological characters, conducted using two tolerant genotypes (Ceneng, Pangrango) and two sensitive genotypes (Godek, Slamet) under various treatments of light intensity. (2) Genetic analysis of adaptation of soybean to low light intensity based on leaf morpho-physiological characters, conducted using tolerant genotype of Ceneng and sensitive genotype of Godek under 50% shade. (3) Analysis of full length sequence of low light intensity adaptation related genes (JJ3), conducted using bioinformatics tools. (4) Analysis of gene expression of the low light intensity adaptation related genes, carried out using the method of RT-PCR to the tolerant genotype of Ceneng and sensitive genotype of Godek under various treatments of light intensity.
The results of this study revealed that: leaf morpho-physiological characters (leaf area, specific leaf weight, chlorophyll content) were highly correlated to adaptation of soybean to low light intensity. The character of leaf area might be used as selection criterion for improvement of adaptation of soybean to low light intensity since additively heritable, high broad sense heritability, and highly positive correlated to yield. Full length sequence of JJ3 with the size of 841 bp on nucleotides homologue to gene psaD photosystem I (PSI) subunit. The genes of JJ3, CAB, phyB, and ATHB-2 could not be used for DNA genome marker because they were expressed in both shade tolerance and sensitive genotypes of soybean. Increase of leaf area to efficiently light capture was assumed to be controlled and related to the genes corresponding with phyB. The character of chlorophyll content is not appropriate marker for selection of soybean lines since the genes controlling the character were isoepistatic mode of action. The character, however, could be used to screen the tolerant or sensitive genotypes for parental candidates.
RINGKASAN
KISMAN. Analisis Genetik dan Molekuler Adaptasi Kedelai terhadap Intensitas Cahaya Rendah berdasarkan Karakter Morfo-fisiologi Daun. Dibimbing oleh DIDY SOPANDIE, SOBIR, TRIKOESOEMANINGTYAS, dan NURUL KHUMAIDA
Pengembangan kedelai sebagai tanaman sela di bawah tegakan tanaman perkebunan, lingkungan agroforestri, atau tumpang sari dengan tanaman pangan lain merupakan alternatif andalan untuk meningkatkan produksi kedelai nasional yang masih sangat rendah. Kendala utama pengembangan kedelai sebagai tanaman sela adalah intensitas cahaya rendah akibat naungan. Untuk itu diperlukan genotipe atau varietas baru kedelai yang toleran terhadap intensitas cahaya rendah. Sejauh ini upaya pemuliaan untuk mendapatkan genotipe atau varietas baru toleran intensitas cahaya rendah masih belum berkembang dengan baik karena belum tersedianya informasi lengkap mekanisme adaptasi di bidang morfo-fisiologi, genetik, dan molekuler bagi perakitan varietas toleran naungan. Untuk mendukung upaya perakitan varietas kedelai toleran intensitas cahaya rendah, diperlukan pengetahuan komprehensif tentang mekanisme adaptasi kedelai terhadap intensitas cahaya rendah baik dari aspek morfo-fisiologi, genetika dan molekuler.
Penelitian ini secara umum bertujuan untuk memperoleh pengetahuan dan pemahaman komprehensif tentang mekanisme adaptasi kedelai terhadap cekaman intensitas cahaya rendah melalui pendekatan morfo-fisiologi, genetik dan molekuler yang dibutuhkan bagi perakitan varietas untuk adaptasi kedelai terhadap intensitas cahaya rendah. Secara khusus, penelitian ini bertujuan untuk: (i) memperoleh karakter morfo-fisiologi daun sebagai penciri adaptasi kedelai terhadap intensitas cahaya rendah, (ii) melakukan pendugaan parameter genetik adaptasi kedelai terhadap intensitas cahaya rendah berdasarkan morfo-fisiologi daun, (iii) melakukan karakterisasi sekuen lengkap, gen yang terkait dengan adaptasi kedelai terhadap intensitas cahaya rendah (JJ3), dan (iv) memperoleh informasi pola ekspresi gen-gen yang terkait adaptasi kedelai terhadap intensitas cahaya rendah (JJ3, CAB, phyB, dan ATHB)
Penelitian dilakukan dalam empat percobaan: (1) respon karakter morfo-fisiologi daun, penciri adaptasi kedelai terhadap intensitas cahaya rendah, (2) analisis genetik adaptasi kedelai terhadap intensitas cahaya rendah berdasarkan morfo-fisiologi daun, (3) analisis sekuen lengkap gen-gen yang terkait adaptasi kedelai terhadap intensitas cahaya rendah (JJ3), dan (4)analisis ekspresi gen-gen yang terkait adaptasi kedelai terhadap intensitas cahaya rendah.
kedelai terhadap intensitas cahaya rendah dilanjutkan dengan analisis genetik menggunakan tetua toleran Ceneng, tetua peka Godek, populasi F1 persilangan
Ceneng x Godek, dan populasi F2 hasil selfing F1. Populasi tersebut ditanam di
bawah paranet 50% dan disusun dengan rancangan acak kelompok dengan 2 ulangan. Analisis genetik karakter morfo-fisiologi daun, penciri adaptasi kedelai terhadap intensitas cahaya rendah meliputi: pendugaan koefisien korelasi, heritabilitas arti luas, jumlah gen (effective factor), dan aksi gen. Analisis molekuler untuk analisis sekuen lengkap gen terkait adaptasi kedelai terhadap intensitas cahaya rendah dilakukan menggunakan jasa bioinformatika, sedangkan analisis ekspresi JJ3, CAB, phyB, dan ATHB yang terkait adaptasi kedelai terhadap intensitas cahaya rendah dilakukan menggunakan metode RT-PCR terhadap genotipe toleran Ceneng dan genotipe peka Godek yang diberikan beberapa perlakuan intensitas cahaya: cahaya penuh (kontrol), lima hari naungan menggunakan paranet 50%, dan lima hari gelap total.
Analisis respon morfo-fisiologi daun menunjukkan bahwa kedelai toleran naungan memiliki daun lebih luas dan lebih tipis dibanding kedelai peka naungan pada kondisi intensitas cahaya rendah. Pada kondisi intensitas cahaya rendah, kedelai toleran naungan memiliki kandungan klorofil lebih tinggi dan rasio klorofil a/b lebih rendah dibanding genotipe peka. Karakter morfo-fisiologi daun (luas daun, bobot daun spesifik, kandungan klorofil, rasio klorofil a/b) dapat dijadikan sebagai penciri adaptasi kedelai terhadap intensitas cahaya rendah.
Analisis genetik adaptasi kedelai terhadap intensitas cahaya rendah berdasarkan morfo-fisiologi daun menunjukkan bahwa: adaptasi kedelai terhadap intensitas cahaya rendah terkait erat dengan karakter morfo-fisiologi daun seperti luas daun, bobot daun spesifik, dan kandungan klorofil. Karakter hasil dikendalikan sekurang-kurangnya 6 gen minor, aksi gen dominan parsial, dan nilai heritabilitas arti luas (h2bs) tinggi (68%). Karakter luas daun dan bobot daun
spesifik masing-masing dikendalikan sekurang-kurangnya 4 dan 5 gen minor, aksi gen aditif, dan nilai heritabilitas arti luas (h2bs) tinggi dan sedang (63%, 48%).
Adaptasi berdasarkan karakter klorofil a, klorofil b, dan klorofil total masing-masing dikendalikan 2 gen mayor, aksi gen isoepistasis, dan nilai heritabilitas arti luas (h2bs) tinggi (78%, 84%, 86%). Adaptasi berdasarkan karakter rasio klorofil
a/b dikendalikan 2 gen mayor, aksi gen dominan dan resesif epistasis, dan nilai heritabilitas arti luas (h2bs) tinggi (70%).
Analisis ekspresi gen-gen yang terkait adaptasi kedelai terhadap intensitas cahaya rendah menunjukkan bahwa: pada kedelai toleran naungan, ekspresi JJ3, phyB, dan ATHB-2 dapat dideteksi pada kondisi intensitas cahaya rendah, akan tetapi pada genotipe peka naungan kurang terdeteksi bahkan ada yang tidak terdeteksi. Pada kedelai toleran naungan, gen CAB-3 terekspresi cukup kuat pada kondisi naungan 50%, akan tetapi pada kedelai peka naungan terekspresi lemah. Pola ekspresi JJ3, CAB-3, phyB, dan ATHB-2 terutama pada kedelai toleran dapat menjelaskan secara molekuler mekanisme penghindaran (avoidance) dan toleransi (tolerance) adaptasi kedelai terhadap intensitas cahaya rendah. Pada kondisi naungan 50%, ekspresi gen CAB-3 dan phyB berpotensi dijadikan sebagai marka untuk skrining kedelai toleran naungan.
Secara umum hasil penelitian ini menunjukkan bahwa karakter morfo-fisiologi daun (luas daun, bobot daun spesifik, kandungan klorofil) terkait erat dengan adaptasi kedelai terhadap intensitas cahaya rendah. Karakter luas daun dapat dijadikan sebagai kriteria seleksi dalam pengembangan kedelai toleran naungan karena secara genetik karakter tersebut dikendalikan oleh gen dengan aksi aditif, mempunyai nilai heritabilitas arti luas yang tinggi, dan berkorelasi tinggi dengan hasil. Sekuen lengkap cDNA JJ3 yang memiliki panjang 841 basa nukleotida homolog dengan gen psaD fotosistem I (PSI) subunit. JJ3, CAB-3, phyB, dan ATHB-2 terekspresi pada genotipe toleran maupun genotipe peka naungan, sehingga gen-gen tersebut pada tingkat DNA genom tidak dapat dijadikan sebagai marka untuk membedakan genotipe toleran dan genotipe peka. Peningkatan luas daun untuk penangkapan cahaya yang efisien merupakan bentuk mekanisme avoidance yang diduga terkait dengan peningkatan ekspresi gen-gen yang berhubungan dengan fitokrom-B (phyB). Karakter kandungan klorofil tidak efektif dijadikan sebagai marka untuk seleksi galur karena gen-gen yang mengendalikannya bersifat isoepistasis, akan tetapi karakter tersebut dapat digunakan untuk skrining genotipe toleran atau peka untuk calon tetua.
Dari hasil penelitian ini dapat disarankan bahwa kedelai Ceneng dapat dianjurkan dalam pengembangan kedelai sebagai tanaman sela di bawah tegakan perkebunan atau hutan tanaman industri (HTI) yang masih berumur 2-3 tahun, atau tumpangsari dengan tanaman pangan semusim yang berpotensi menaungi. Dalam perbaikan adaptasi kedelai terhadap intensitas cahaya rendah, karakter luas daun dapat dijadikan sebagai salah satu kriteria seleksi. Seleksi menggunakan marka molekuler atau MAS sebaiknya dikembangkan dari gen-gen yang terkait dengan penangkapan cahaya melalui teknik CAPS (cleavage amplified polymorphic sequence) atau SCAR (sequence characterized amplified region). Diperlukan analisis kandungan gibberellin dan aspek molekulernya untuk dapat lebih memahami mekanisme adaptasi kedelai terhadap intensitas cahaya rendah. Selain itu diperlukan analisis molekuler gen-gen penting lain seperti CAO yang mengubah klorofil a menjadi klorofil b yang berperan dalam mekanisme adaptasi kedelai terhadap intensitas cahaya rendah. Diperlukan juga pengamatan terhadap kemungkinan perubahan kualitas cahaya di bawah paranet maupun di sekitar kanopi tanaman kedelai.
© Hak cipta milik
Institut Pertanian Bogor
, tahun 2007
Hak cipta dilindungi
ANALISIS GENETIK DAN MOLEKULER ADAPTASI
KEDELAI TERHADAP INTENSITAS CAHAYA
RENDAH BERDASARKAN KARAKTER
MORFO-FISIOLOGI DAUN
KISMAN
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup: Dr. Ir. Utut Widyastuti S, M.Si
Judul Disertasi : Analisis Genetik dan Molekuler Adaptasi Kedelai terhadap Intensitas Cahaya Rendah Berdasarkan Karakter Morfo-fisiologi Daun
Nama : Kisman
NIM : A361030061
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Didy Sopandie, M.Agr. Dr. Ir. Sobir, M.Si.
Ketua Anggota
Dr. Ir. Trikoesoemaningtyas, M.Sc. Dr. Ir. Nurul Khumaida, M.Si.
Anggota Anggota
Diketahui,
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Satriyas Ilyas, M.S. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
Makin memperkuat keimanan dan keyakinan saya bahwa Allah menciptakan segala sesuatu di muka bumi ini, dari hal yang paling kecil hingga yang paling dahsyat, semua dalam segala keberaturan, keseimbangan, dan saling bermakna satu sama lain.
AL-QUR’AN:
Surat FUSHSHILAT ayat 53 ”Kami akan memperlihatkan kepada mereka tanda-tanda (kekuasaan) Kami di segenap ufuk dan pada diri mereka sendiri, sehingga jelaslah bagi mereka bahwa AlQur’an itu adalah benar. Dan apakah Tuhanmu tidak cukup (bagi kamu) bahwa sesungguhnya Dia menyaksikan segala sesuatu?”.
Surat AL AN’AAM ayat 99 ”Dan Dialah yang menurunkan air hujan dari langit, lalu Kami tumbuhkan dengan air itu segala macam tumbuh-tumbuhan, maka Kami keluarkan dari tumbuh-tumbuhan itu tanaman yang menghijau, Kami keluarkan dari tanaman yang menghijau itu butir yang banyak; dan dari mayang korma mengurai tangkai-tangkai yang menjulai, dan kebun-kebun anggur, dan (Kami keluarkan pula) zaitun dan delima yang serupa dan yang tidak serupa. Perhatikanlah buahnya di waktu pohonnya berbuah, dan (perhatikan pulalah) kematangannya. Sesungguhnya pada yang demikian itu ada tanda-tanda (kekuasaan Allah) bagi orang-orang yang beriman”.
Surat AR RAHMAN ayat 33-34 ”Hai jama’ah jin dan manusia, jika kamu sanggup menembus (melintasi) penjuru langit dan bumi, maka lintasilah, kamu tidak dapat menembusnya melainkan dengan kekuatan”. Maka nikmat Tuhan kamu yang manakah yang kamu dustakan?”.
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat, karunia dan ridhoNya sehingga penulis dapat menyelesaikan pendidikan dan penelitian serta penulisan disertasi yang berjudul “Analisis Genetik dan Molekuler Adaptasi Kedelai terhadap Intensitas Cahaya Rendah berdasarkan Karakter Morfo-fisiologi Daun”.
Dalam penyelesaian disertasi ini penulis banyak mendapat bimbingan, arahan, dan koreksi kostruktif terutama dari komisi pembimbing. Oleh karena itu, ucapan terima kasih dan perhargaan yang sebesarnya dan setulusnya penulis sampaikan kepada komisi pembimbing: Prof. Dr. Ir. Didy Sopandie, MAgr (Ketua), Dr. Ir. Sobir, MSi, Dr. Ir. Trikoesoemaningtyas, MSc, dan Dr. Ir. Nurul Khumaida, MSi (masing-masing Anggota).
Penelitian disertasi ini sebagian besar didanai oleh Hibah Penelitian Tim Pascasarjana (HPTP) 2004-2006, karenanya penulis menyampaikan banyak terima kasih kepada Prof. Dr. Ir. Didy Sopandie, MAgr selaku Ketua Peneliti HPTP dan Dr. Ir. Trikoesoemaningtyas, MSc dan Dr. Ir. Nurul Khumaida, MSi (masing-masing sebagai Anggota Peneliti) yang telah bersedia menerima penulis bergabung dalam penelitian HPTP. Secara khusus penulis juga ingin sampaikan terima kasih kepada Prof. Dr. Tetsuo Takano yang telah mengijinkan dan memberikan fasilitas kepada penulis untuk melakukan sebagian penelitian molekuler di lab Tolerance Mechanism, ANESC, Universitas Tokyo. Terima kasih juga kepada rekan-rekan selama bersama-sama di HPTP: Dr. Ir. La Muhuria, MS; Ir. Imam Widodo, MS; Desta Wirnas, SP, MSi; Ir. Kartika Ning Tyas, MSi; dan Tri Lestari, SP, MSi atas kebersamaan dan kerjasama yang baik.
Penghargaan yang setinggi-tingginya juga penulis sampaikan kepada: 1. Dirjen Dikti yang telah memberikan beasiswa melalui program Technological
and Professional Skills Development Sector Project (TPSDP) ADB Loan No 1792-INO.
2. Rektor Universitas Mataram yang telah memberikan izin tugas belajar.
3. Dekan Fakultas Pertanian Universitas Mataram yang telah memberikan kesempatan dan dorongan untuk melanjutkan pendidikan S3 di IPB.
4. Staf pengajar di Program Studi Pemuliaan Tanaman Fakultas Pertanian Universitas Mataram yang telah bersama-sama bekerja keras menyusun proposal untuk mendapatkan dana TPSDP Loan No 1792-INO.
5. Rektor Institut Pertanian Bogor, Dekan dan Ketua Program Studi Agronomi Sekolah Pascasarjana IPB yang telah menerima penulis untuk melanjutkan studi di IPB, begitu juga saran dan masukan konstruktif yang diberikan kepada penulis sehingga disertasi ini menjadi lebih baik.
6. Prof. Dr. Ir. Sudirman Yahya MSc (selaku penguji luar komisi pada ujian komprehensif), Ibu Dr. Ir. Utut Widiastuti S. MSi (selaku penguji luar komisi pada ujian tertutup), Ibu Dr. Ir. Sriani Sujiprihati, M.S. dan Dr. Ir. Novianti Sunarlim (selaku penguji luar komisi pada ujian terbuka) yang dengan sangat cermat telah memberikan saran dan masukan konstruktif sehingga disertasi ini menjadi lebih baik.
(Mulya, Pepy, Firdaus, dan rekan-rekan) atas kerjasama dan kebersamaan serta bantuan yang diberikan.
8. Kepala dan staf Kebun Percobaan Balai Besar Bioteksnologi dan Sumberdaya Genetik Cikemeuh Cimanggu (Drajat, Pur, dan rekan-rekan) atas kerjasama dan bantuan yang diberikan.
9. Ayahanda H. Makbul (alm) dan Ibunda Inaq Gadung dan Inaq Siun(alm), ayah dan ibu mertua H. Mohammad Ali (alm) dan Hj. Halimah (alm) atas kasih sayang dan doanya.
10.Saudara-saudara tercinta di Kawo, di Kelayu dan di Mataram atas segala dorongan dan doa.
11.Istri tercinta Ir. Hj. Ulayati Ali dan anak-anak tersayang Febrian Humaidi Sukmana, Suprayanti Martia Dewi, dan Muhammad Halim Suhartawan atas segala doa, dorongan, dan kesabaran serta kebersamaan dalam penantian. 12. Semua pihak yang telah membantu kelancaran penulisan disertasi ini yang
tidak bisa disebutkan satu per satu.
Semoga disertasi ini dapat bermanfaat. Amin Amin Ya Rabbal Alamin.
Bogor, Juli 2007
RIWAYAT HIDUP
Penulis dilahirkan di Desa Kawo, Pujut, Lombok Tengah, Nusa Tenggara Barat pada 31 Desember 1961, merupakan putra ketiga dengan enam bersaudara dari ayahanda Tarap alias Amaq Siun alias H. Makbul (alm) dan ibunda Tiasih alias Inaq Gadung. Pada 1 Mei 1985 penulis menikah dengan Ir. Hj. Ulayati Ali dan dikaruniai tiga anak yaitu Febrian Humaidi Sukmana, Suprayanti Martia Dewi, dan Muhammad Halim Suhartawan.
Pada 1981 penulis sebagai mahasiswa S1 di Jurusan Agronomi Fakultas Pertanian Universitas Mataram dan menyelesaikan studi pada Oktober 1986. Mulai Juli 1996 penulis mengikuti pendidikan S2 pada Departemen Plant Sciences Fakultas Pertanian Universitas Saskatchewan Kanada dan selesai pada Oktober 1998. Selanjutnya, sejak Agustus 2003 penulis diterima sebagai mahasiswa S3 di Program Studi Agronomi Sekolah Pascasarjana Institut Pertanian Bogor dan mendapatkan gelar Doktor pada Juni 2007. Beasiswa pendidikan pascasarjana diperoleh dari Departemen Pendidikan Nasional Republik Indonesia dalam bentuk bantuan proyek TPSDP ADB Loan No. 1792-INO.
Penulis adalah staf pengajar pada Program Studi Pemuliaan Tanaman Jurusan Budidaya Pertanian Fakultas Pertanian Universitas Mataram di provinsi Nusa Tenggara Barat mulai tahun 1988 sampai sekarang.
DAFTAR SINGKATAN YANG DIGUNAKAN DALAM DISERTASI
A2 : uji normalitas Anderson-Darling ATHB : gen Arabidopsis thaliana homeobox
bb : berat basah daun
BDS : berat daun spesifik
BLAST : Basic Local Aligment Search Tool BNT : beda nyata terkecil
bp : base pair
CAB : gen chlorophyll a/b binding protein
cDNA : complementary deoxyribonucleic acid
CDS coding sequence
cm : centi meter
DAP : days after planting
DNA : deoxyribonucleic acid
dNTP : deoxynucleotide-5’-triphosphate
EDTA : ethylen diamine tetra acetic acid F1 : generasi pertama hasil persilangan
F2 : generasi kedua selfing
g : gram
GSP : gene specific primer
h2 : heritabilitas
h2bs : heritabilitas arti luas
ha : hektar
hp : nisbah potensi
HST : hari setelah tanam
kb : kilo base
kg : kilo gram
LI : low irradiance, intesitas cahaya rendah
LiCl : lithium chloride
M : molar
mg : mili gram
ml : mili liter
mM : mili molar
mRNA : messenger RNA
MST : minggu setelah tanam
N2 : nitrogen
NCBI : National Center for Biotechnology Information
oC : degree celcius
ORF : open reading frame
p : probabilitas
P1 : tetua 1
P2 : tetua 2
phyB : gen phytochrome B
poly-A : poly-adenine
r : koefesien korelasi R : FR : red : far red
RACE : Rapid Amplification of cDNA Ends RACE-PCR : Rapid Amplification of cDNA Ends-PCR
RNA : ribonucleic acid
RNase H : ribonuclease inhibitor rpm : rotation per minute
RT-M-MLV : Reverse Transcriptase - Moloney-Murine Leukimia Virus RT-PCR : Reverse Transcription Polymerase Chain Reaction SDS : sodium dodecyl sulphate
TAE : tris acetate EDTA
TE : tris EDTA
U : unit
μg : mikro gram
μl : mikro liter
μM : mikro molar
σ2
: varians
σF1 : standar deviasi generasi F1
σF2 : standar deviasi generasi F2
χ2
DAFTAR ISI
Halaman
DAFTAR TABEL ………...
DAFTAR GAMBAR ………
DAFTAR LAMPIRAN ………...
1. PENDAHULUAN………...
xvii
xix
xxi
1
Latar Belakang ………... Rumusan Masalah ... Tujuan Penelitian ………... Manfaat Penelitian ... Hipotesis... Ruang Lingkup Penelitian ...
1 4 5 5 5 6
2. TINJAUAN PUSTAKA ………... 8
Fotosintesis pada Kondisi Intensitas Cahaya Rendah …………... 8 PAR dan Fotosintesis ………... Pembentukan Klorofil..………... Pengaruh Intensitas Cahaya Rendah terhadap Pertumbuhan dan Hasil Tanaman ………
8 10
13 Mekanisme Adaptasi Tanaman terhadap Intensitas Cahaya Rendah .. 14
Perubahan Anatomi dan Morfologi ………..….………... Perubahan Kandungan Klorofil Daun ……...………... Perubahan Fisiologi dan Biokimia ……….………... Perubahan Struktur Kloroplas ...
16 16 17 18
Struktur Kloroplas dan Mekanisme Transport Elektron…..………… 19
Struktur Kloroplas………. Mekanisme Transport Elektron………. Fotosistem II (PSII)………... Fotosistem I (PSI) ……….
19 21 22 25 Gen-gen Fotosintesis yang Terkait Adaptasi Tanaman terhadap
Intensitas Cahaya Rendah ………... 29
Gen-gen Fotosintetik Inti …..………... Gen-gen Fotosintetik Kloroplas ………... Prinsip Kontrol Redoks pada Ekspresi Gen Fotosintetik …….. Ekspresi Gen-gen Terkait Adaptasi Tanaman terhadap Intensitas Cahaya Rendah ……….
29 30 30
35 Analisis Genetik Adaptasi Tanaman………....
Pendugaan Jumlah Gen Pengendali………... Aksi Gen………. Pendugaan Nilai Heritabilitas……….
37 37 39 42 3. RESPON KARAKTER MORFO-FISIOLOGI DAUN, PENCIRI
Abstrak ...
Abstract ... PENDAHULUAN... Latar Belakang... Tujuan ... ... BAHAN DAN METODE ... Bahan Tanaman ... Persiapan Tanaman ... Pengamatan ... Analisis Data ... HASIL DAN PEMBAHASAN... Luas Daun dan Bobot Daun Spesifik ... Kandungan Klorofil Daun ... KESIMPULAN ... 44 45 46 46 48 48 48 48 49 50 50 50 55 64
4. ANALISIS GENETIK ADAPTASI KEDELAI TERHADAP INTENSITAS CAHAYA RENDAH BERDASARKAN KARAKTER MORFO-FISIOLOGI DAUN... 65 Abstrak ...
Abstract ... PENDAHULUAN ... Latar Belakang... Tujuan ... BAHAN DAN METODE ... Bahan Tanaman ... Pengamatan ... Analisis Data ... HASIL DAN PEMBAHASAN... Hasil dan Morfo-fisiologi Daun pada Tetua Toleran dan Peka Naungan... Korelasi Karakter Morfo-fisiologi Daun dengan Hasil pada Populasi F2...
Pola Pewarisan Sifat Adaptasi Kedelai berdasarkan Morfo- fisiologi Daun... Pendugaan Jumlah Gen dan Tipe Aksi Gen Pengendali Adaptasi.. Pendugaan Nilai Heritabilitas Arti Luas... KESIMPULAN... 65 66 67 67 68 69 69 69 70 75 75 76 78 83 86 89
5. ANALISIS SEKUEN LENGKAP GEN YANG TERKAIT ADAPTASI KEDELAI TERHADAP INTENSITAS CAHAYA RENDAH……… 90 Abstrak ...
Analisis Sekuen Lengkap cDNA JJ3... HASIL DAN PEMBAHASAN... Sekuen Lengkap (full length) JJ3...
Analisis struktur sekuen lengkap JJ3……….
Analisis Homologi Sekuen Lengkap JJ3... KESIMPULAN ...
95 95 95 96 100 106
6. ANALISIS EKSPRESI GEN-GEN YANG TERKAIT ADAPTASI
KEDELAI TERHADAP INTENSITAS CAHAYA RENDAH... 107
Abstrak ... Abstract ... PENDAHULUAN ... Latar Belakang ... Tujuan ... BAHAN DAN METODE ... Bahan Tanaman... Analisis Ekspresi Gen... HASIL DAN PEMBAHASAN... Analisis Ekspresi JJ3 dan CAB-3... Analisis Ekspresi Gen phyB dan ATHB-2………... KESIMPULAN... 107 108 109 109 110 111 111 111 114 115 119 121 7. PEMBAHASAN UMUM ………... 122
8. KESIMPULAN DAN SARAN.………...………... 129
DAFTAR PUSTAKA ………... 131
DAFTAR TABEL
No. Halaman
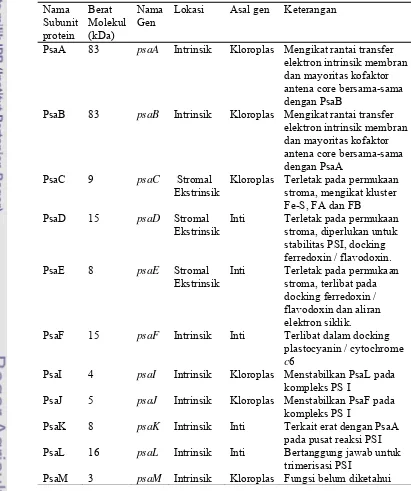
1. Diskripsi subunit protein pada fotosistem 1 (PSI) ……..………….... 27
2. Klasifikasi derajat dominansi berdasarkan nilai potensi rasio... 40
3. Rata-rata luas daun (cm2) dari berbagai intensitas cahaya rendah pada masing-masing genotipe kedelai…………... 52
4. Respon bobot daun spesifik (mg/cm2) masing-masing genotipe kedelai pada berbagai perlakuan intensitas cahaya ... 54
5. Repon kandungan klorofil a genotipe kedelai terhadap berbagai perlakuan intensitas cahaya... 56
6. Repon kandungan klorofil b genotipe kedelai terhadap berbagai perlakuan intensitas cahaya ..………..
58
7. Repon kandungan klorofil total dan rasio klorofil a/b genotipe kedelai terhadap berbagai perlakuan intensitas cahaya ..………
59
8. Repon kandungan rasio klorofil a/b genotipe kedelai terhadap
berbagai perlakuan intensitas cahaya …..………... 61
9. Nisbah fenotipe karakter yang terkait adaptasi terhadap suatu cekaman yang dikendalikan oleh gen mayor pada populasi bersegregasi F2 ………... 74
10. Keragaan karakter hasil dan morfo-fisiologi daun tetua toleran (Ceneng) dan peka (Godek) pada kondisi naungan 50%... 75
11. Koefesien korelasi fenotipik karakter morfo-fisiologi daun dan hasil pada populasi F2 hasil persilangan tetua toleran Ceneng dengan
tetua peka (Godek) ………. 76
12. Nilai rata-rata fenotipe, kemenjuluran (skewness), nilai normalitas, dan probabilitas karakter morfo-fisiologi pada populasi F2………… 79
13. Pendugaan jumlah gen minor (effective factor) dan tipe aksi gen yang mengendalikan karakter-karakter dengan pola sebaran kontinu
dan mengikuti kurva normal pada populasi F2……….... 83
14. Pendugaan jumlah gen mayor dan tipe aksi gen yang mengendalikan karakter-karakter klorofil pada populasi F2 ……….. 85
15. Nilai duga heritabilitas arti luas karakter-karakter yang terkait dengan adaptasi kedelai terhadap intensitas cahaya rendah….……... 87
16. Matriks tingkat homologi (%) sekuen lengkap basa nukleotida dan
asam amino JJ3 dengan tanaman lain………. 101
17. Tingkat homologi cDNA JJ3 dengan gen psaD beberapa spesies tanaman lain menggunakan domain terkonservasi sekuen basa
nukleotida dan asam amino………. 102
18. Diskripsi GSP (gene specific primer) yang digunakan untuk analisis ekspresi gen-gen yang terkait adaptasi kedelai terhadap cekaman
DAFTAR GAMBAR
No. Halaman
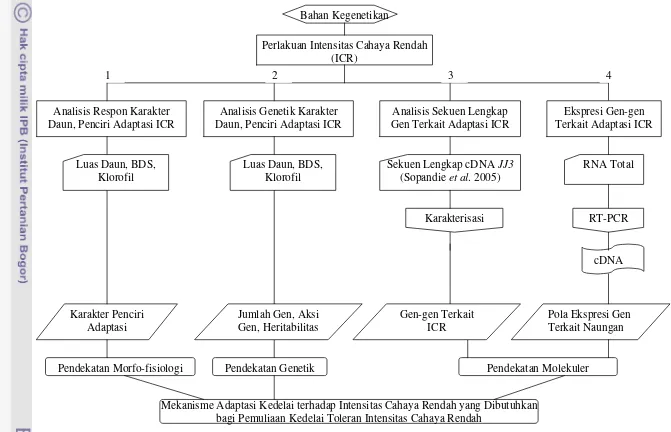
1. Bagan alir penelitian ……….. 7
2. Spektrum cahaya yang dapat diserap oleh pigmen tanaman, biasa
disebut photosynthetically active radiation (PAR) ……… 9
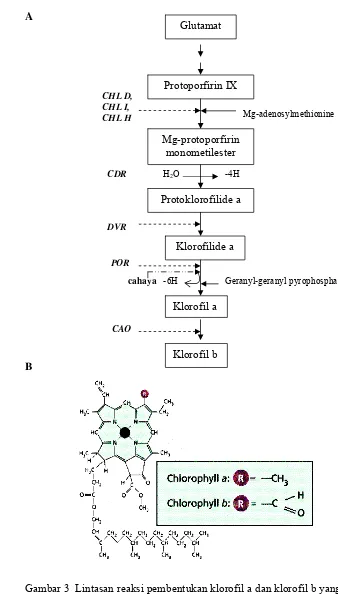
3. Lintasan reaksi pembentukan klorofil a dan klorofil b yang
melibatkan gen-gen fotosintesis (A) dan struktur kimia klorofil a
dan klorofil b (B)……… 11
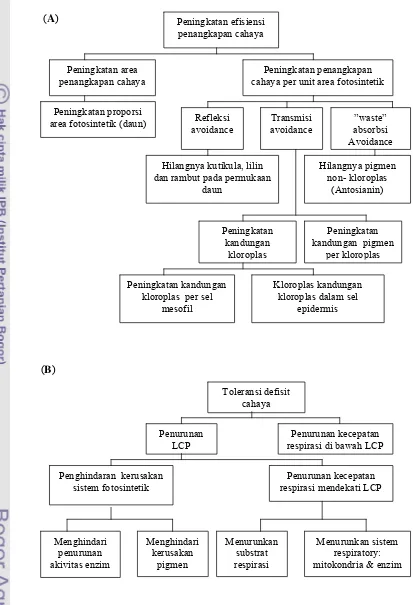
4. Model mekanisme penghindaran (avoidance) (A) dan mekanisme toleransi (tolerance) (B) untuk adaptasi tanaman terhadap intensitas
cahaya rendah………. 15
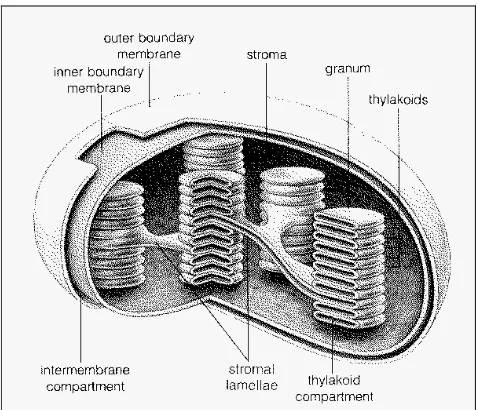
5. Skema bangun kloroplas. Kloroplas merupakan organel
semi-otonom pada sel tanaman. ……….. 20
6. Skema rantai transport elektron fotosintetik pada PS II dan PS I…... 21
7. Diagram skematik pusat reaksi PSII ... 24
8. Struktur keseluruhan PSI……… 28
9. Model redox control pada ekspresi gen fotosintesis pada bakteri, alga dan tanaman tingkat tinggi………... 33
10. Model sintesis, prosesing, transport, dan protein PSII intrinsik dan
ekstrinsik ……… 36
11. Histogram rata-rata luas daun genotipe kedelai pada masing-masing
intensitas cahaya rendah………. 51
12. Histogram rata-rata bobot daun spesifik (BDS) genotipe kedelai
pada masing-masing perlakuan intensitas cahaya. ……… 53
13. Histogram rata-rata klorofil a genotipe kedelai pada masing-masing
perlakuan intensitas cahaya ..………. 56
14. Histogram rata-rata klorofil b genotipe kedelai pada masing-masing
perlakuan intensitas cahaya..……….. 58
15. Histogram rata-rata klorofil total genotipe kedelai pada
masing-masing perlakuan intensitas cahaya.………...…. 59
masing-masing perlakuan intensitas cahaya……… 60
17. Histogram fenotipe karakter hasil per tanaman pada populasi F2
dengan kurva normal sebagai pembanding………. 79
18. Histogram fenotipe karakter luas daun pada populasi F2 dengan
kurva normal sebagai pembanding………. 80
19. Histogram fenotipe karakter bobot daun spesifik pada populasi F2
dengan kurva normal sebagai pembanding………. 80
20. Histogram fenotipe karakter klorofil a pada populasi F2 dengan
kurva normal sebagai pembanding………. 81
21. Histogram fenotipe karakter klorofil b pada populasi F2 dengan
kurva normal sebagai pembanding………. 81
22. Histogram fenotipe karakter klorofil total pada populasi F2 dengan
kurva normal sebagai pembanding………. 82
23. Histogram fenotipe karakter rasio klorofil a/b pada populasi F2
dengan kurva normal sebagai pembanding……… 82
24. (A). Sekuen lengkap basa nukleotida JJ3 hasil pemanjangan
menggunakan metode PCR-RACE. (B). Asam amino hasil translasi dari sekuen lengkap basa nukleotida JJ3... 96
25. (A) Estimasi struktur sekuen lengkap JJ3, (B) Prediksi sekuen pengkodean, CDS lengkap, dan (C) prediksi sekuen peptida, (D) domain terkonservasi (conserved domain) berwarna merah dan
yang tidak terkonservasi (domain beragam) berwarna hitam………. 97
26. Open reading frame (ORF) atau coding sequence dari sekuen lengkap JJ3. Sekuen yang ditulis dengan huruf kecil merupakan CDS JJ3 dan huruf kapital merupakan deduksi asam amino... 98
27. Sebagian hasil pensejajaran (multi-alignment) sekuen basa
nukleotida cDNA JJ3 dengan spesies tanaman lain menggunakan
progran clustalW. ………... 103
28. Hasil pensejajaran sekuen lengkap asam amino cDNA JJ3 dengan
tanaman tingkat tinggi lain. ………... 104
29. Filogenetik cDNA JJ3 dengan gen psaD pada beberapa tanaman
berdasarkan urutan asam amino……….. 105
masing-masing gen (B). Hasil elektroforesis 1% agarose. Gen
ß-actin sebagai internal standar (house keeping gene)………... 115
31. Pola ekspresi gen PhyB dan ATHB-2 pada kedelai toleran naungan (Ceneng) dan peka naungan (Godek) (A) serta kuantifikasi ekspresi masing-masing gen (B). Hasil elektroforesis 1% agarose. Gen
DAFTAR LAMPIRAN
No. Halaman
1. Kandungan klorofil (mg/g berat basah sampel) ...………... 144
2. Penampilan warna daun beberapa genotipe kedelai pada berbagai
intensitas cahaya rendah……….. 145
3. Diskripsi varietas Pangrango……….. 146
4. Diskripsi varietas Pangrango..………... 147
BAB I
PENDAHULUAN
Latar Belakang
Kedelai merupakan salah satu tanaman pangan penting di Indonesia
karena memiliki kandungan gizi yang cukup tinggi. Kebutuhan kedelai di dalam
negeri terus meningkat setiap tahun (sekitar 2 juta ton) seiring dengan kesadaran
masyarakat yang semakin tinggi akan pentingnya produk berbahan baku kedelai.
Di lain pihak, produksi kedelai nasional cenderung stagnan, sekitar 730 ribu ton
per tahun. Oleh karena itu, untuk memenuhi kebutuhan kedelai nasional,
pemerintah mengimpor sekitar 60 persen atau sekitar 700 ribu ton per tahun pada
tahun 1998 bahkan meningkat mencapai rata-rata 1,2 juta ton per tahun sejak 2000
– 2004 (Badan Litbang Deptan 2005). Berbagai upaya pemerintah seperti program
kedelai mandiri (prokema), gema palagung, dan program lainnya ternyata belum
mampu meningkatkan produksi kedelai nasional. Untuk mengatasi kesenjangan
tersebut maka pemerintah mencanangkan Program Swasembada Kedelai 2008
melalui peningkatan produktivitas dengan penerapan teknologi produksi dan juga
melalui perluasan areal tanam.
Peningkatan produksi kedelai nasional melalui perluasan areal tanam
memiliki potensi yang cukup besar, antara lain melalui penggunaan lahan di
bawah tegakan tanaman perkebunan, hutan tanaman industri (HTI) melalui
program agroforestri, atau tumpangsari dengan tanaman pangan semusim lainnya.
Kendala utama pengembangan kedelai di bawah tegakan atau sistem tumpangsari
tersebut adalah rendahnya intensitas cahaya akibat faktor naungan. Menurut Asadi
dan Arsyad (1995); Asadi et al. (1997), intensitas cahaya berkurang hingga mencapai 75% di bawah tegakan tanaman perkebunan dan 33% di bawah
tumpangsari dengan jagung atau sorgum. Tanaman kedelai memerlukan radiasi
matahari yang optimum (sekitar 0.3 - 0.8 kal/cm2/menit setara 431-1152
kal/cm2/hari) dengan spektrum atau panjang gelombang berkisar 400-700 nm (disebut photosynthetically active radiation, PAR) untuk mendapatkan hasil bersih fotosintat yang tinggi (Kassam 1978; Salisbury dan Ross 1992). Selain
pengendali, pemicu, dan modulator respon morfogenesis khususnya pada tahap
awal pertumbuhan tanaman (McNellis dan Deng 1995). Anderson (2000) juga
menjelaskan bahwa tanaman yang tumbuh di lingkungan bercekaman tersebut
sulit mengekspresikan potensial genetiknya secara utuh untuk tumbuh,
berkembang dan berproduksi secara maksimum. Dilaporkan bahwa hasil kedelai
menurun rata-rata 30-60% pada kondisi cekaman naungan. Handayani (2003) juga
melaporkan bahwa akibat cekaman naungan 50%, hasil per hektar tanaman
kedelai menurun 10 - 40%. Oleh karena itu diperlukan upaya pemuliaan untuk
memperoleh genotipe atau varietas unggul baru kedelai yang mampu beradaptasi
pada lingkungan bercekaman intensitas cahaya rendah.
Berbagai upaya pendekatan ke arah perbaikan adaptasi kedelai terhadap
intensitas cahaya rendah sudah mulai dirintis sejak tahun 2001 oleh Kelompok
Penelitian untuk Perbaikan Tanaman (Research Group for Crop Improvement,
RGCI) IPB melalui kajian aspek fisiologi, pemuliaan, dan molekuler (Sopandie et al. 2002, 2003a; Khumaida 2002; Trikoesoemaningtyas et al. 2003).
Kegiatan pemuliaan kedelai toleran naungan dimulai dengan pembentukan
12 populasi bersegregasi dengan metode restricted bulk hasil persilangan dialel lengkap dari empat tetua terpilih (Ceneng, Pangrango, Godek, Slamet). Analisis
genetik karakter agronomi yang terkait adaptasi kedelai terhadap naungan sudah
dilaporkan (Trikoesoemaningtyas et al. 2003). Seleksi terhadap karakter-karakter yang berkontribusi terhadap sifat adaptasi akan lebih efektif apabila didasari oleh
hasil analisis genetik seperti pendugaan jumlah dan aksi gen serta daya waris
gen-gen yang mengen-gendalikan karakter-karakter tersebut (Poehlman dan Sleper 1995;
Roy 2000). Karakter daun merupakan karakter yang terlibat langsung dalam
proses penerimaan, pengiriman signal cahaya sampai proses fotosintesis. Namun
informasi genetik untuk aspek fisiologi dan morfologi daun yang terkait dengan
adaptasi kedelai terhadap intensitas cahaya rendah masih sangat terbatas.
Aspek fisiologi adaptasi kedelai terhadap intensitas cahaya rendah sudah
mulai dipelajari melalui respon spesifik pada berbagai tingkatan seperti adanya
perubahan anatomi, morfologi, fisiologi, biokimia sampai tingkat molekuler dan
dilaporkan bahwa beberapa karakter anatomi, morfologi, fisiologi dan biokimia
(klorofil, karoten, karbohidrat, enzim rubisko) terkait erat dengan efisiensi
fotosintesis. Selain itu terdapat perbedaan yang jelas antara genotipe toleran dan
peka dalam mekanisme adaptasinya terhadap naungan (Sopandie et al. 2001, 2003a, 2003b; Khumaida 2002; Soverda 2002). Pada tanaman kedelai, karakter
fotosintetik daun seperti kandungan klorofil a, b dan rasio klorofil a/b serta luas
daun merupakan karakter penting bagi adaptasi kedelai terhadap naungan
(Sopandie et al. 2002 dan 2006; Khumaida 2002; Handayani 2003; Jufri 2006). Penurunan rasio klorofil a/b sebagai bentuk aklimatisasi fotosintesis terhadap
intensitas cahaya rendah juga telah dilaporkan pada kacang kapri (Leong dan
Anderson 1984), bayam (Lindahl et al. 1995), barley (de la Torre dan Burkey 1999), gandum (Behera dan Choudhury 2001), dan Arabidopsis (Bailey et al. 2001).
Dari aspek molekuler, gen-gen yang terkait adaptasi kedelai terhadap
intensitas cahaya masih belum banyak dilaporkan namun sudah mulai dirintis oleh
Dr Nurul Khumaida. Khumaida (2002) berhasil mengidentifikasi sembilan
kandidat gen yang terkait erat dengan karakter adaptasi kedelai terhadap naungan
dan tiga fragment cDNA diantaranya (E3, JJ3, dan EE2) terindikasi merupakan kandidat gen fotosintetik yang terkait erat dengan gen yang mengkode protein
kompleks membran tilakoid yaitu berturut-turut fotosistem II (PSII), fotosistem I
(PSI), dan sitokrom. Fragmen cDNA JJ3 yang terkait protein kompleks PSI telah
berhasil diperoleh sekuen lengkapnya (Sopandie et al. 2005) dengan
menggunakan metode RACE (Rapid Amplification of cDNA Ends). Dengan
demikian tahap berikutnya adalah karakterisasi, konfirmasi fungsi dan analisis
pola ekspresinya bagi keperluan mempelajari mekanisme adaptasi dan pemuliaan
adaptasi kedelai terhadap intensitas cahaya rendah.
Pola ekspresi gen bermanfaat untuk dapat mengetahui apakah gen tersebut
termasuk gen dengan respon umum (regulated genes atau functional genes) ataukah gen pengendali stres spesifik (regulatory genes). Pada kondisi stres cahaya rendah, ekspresi gen dengan respon umum (regulated genes) meningkat pada genotipe toleran maupun genotipe peka. Gen tersebut tidak dapat digunakan
spesifik (regulatory genes) ekspresinya lebih tinggi pada genotipe toleran dari pada genotipe peka. Gen-gen regulator ini sangat penting karena dapat berfungsi
sebagai ‘master switches’ yang mengaktifkan program pengiriman signal stres (signal transduction) sehingga dapat meningkatkan kemampuan adaptasi tanaman kedelai terhadap cekaman naungan.
Pola ekspresi beberapa gen fotosintetik pada berbagai kondisi cahaya telah
banyak dilaporkan antara lain gen chlorophyll a/b binding protein (CAB),
chalcone synthase (CHS) dan ribulose-1,5-bisphosphate carboxylase/oxygenase small subunit (rbcS) ketiganya merupakan light-regulated genes yang bersifat up-regulated pada tanaman tomat (Peters et al. 1998), gen chlorophyll a oxygenase (CAO) yang mengkatalisis konversi klorofil a menjadi klorofil b, gen CHLD yang mengkode enzim biosintesis klorofil pada ganggang hijau Dunaliella salina
(Masuda et al. 2002), gen phytochrome B (phyB) dan gen Arabidopsis thaliana homeobox (ATHB) yang terlibat dalam mekanisme avoidance (Ziemienowicz dan Gabrys 2003; Vandenbussche 2005). Pola ekspresi gen-gen fotosintetik tersebut
pada tanaman kedelai dalam kondisi cekaman intensitas cahaya rendah belum
banyak dilaporkan. Informasi genomik yang berbasis RNA ini bermanfaat untuk
mempelajari mekanisme fisiologi dan molekuler adaptasi kedelai terhadap
intensitas cahaya rendah.
Rumusan Masalah
Pengembangan tanaman kedelai sebagai tanaman sela di bawah tanaman
perkebunan, hutan tanaman industri, atau tumpangsari dengan tanaman pangan
lain, merupakan salah satu bentuk terobosan untuk meningkatkan produksi kedelai
nasional dan mengurangi ketergantungan impor yang terus meningkat setiap
tahun. Akan tetapi kendala utama pengembangan kedelai di lingkungan tersebut
adalah faktor intensitas cahaya rendah akibat naungan. Untuk itu diperlukan
genotipe atau varietas baru kedelai yang toleran terhadap intensitas cahaya rendah.
Sejauh ini upaya pemuliaan untuk mendapatkan genotipe atau varietas baru
toleran intensitas cahaya rendah masih belum berkembang dengan baik karena
belum tersedianya informasi lengkap di bidang fisiologi, genetika, dan molekuler
pencarian karakter terutama karakter morfologi dan fisiologi daun, genetika
adaptasi kedelai terhadap intensitas cahaya rendah berdasarkan karakter
morfo-fisiologi daun, dan molekuler gen-gen yang terkait adaptasi kedelai terhadap
intensitas cahaya rendah mutlak diperlukan.
Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk memperoleh pengetahuan dan
pemahaman komprehensif tentang mekanisme adaptasi kedelai terhadap cekaman
intensitas cahaya rendah melalui pendekatan morfo-fisiologi, genetik dan
molekuler yang dibutuhkan bagi perakitan varietas untuk adaptasi kedelai
terhadap intensitas cahaya rendah. Secara khusus, penelitian ini bertujuan untuk:
1. Memperoleh karakter morfo-fisiologi daun sebagai penciri adaptasi kedelai
terhadap intensitas cahaya rendah.
2. Melakukan pendugaan parameter genetik adaptasi kedelai terhadap intensitas
cahaya rendah berdasarkan morfo-fisiologi daun.
3. Melakukan karakterisasi sekuen lengkap, gen yang terkait dengan adaptasi
kedelai terhadap intensitas cahaya rendah (JJ3).
4. Memperoleh informasi pola ekspresi gen-gen yang terkait adaptasi kedelai
terhadap intensitas cahaya rendah (JJ3, CAB, phyB, dan ATHB).
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat dimanfaatkan sebagai pedoman dasar
dalam program pemuliaan atau perbaikan tanaman kedelai toleran intensitas
cahaya rendah. Selain itu diharapkan juga sebagai pedoman dalam pengembangan
teknik budidaya untuk memperbaiki karakter kedelai sehingga mampu beradaptasi
pada kondisi intensitas cahaya rendah seperti di bawah tegakan tanaman
perkebunan, hutan industri, atau tumpangsari dengan tanaman semusim lain.
Hipotesis
Agar penelitian ini dapat dilaksanakan lebih terarah, maka diajukan
1. Kedelai genotipe toleran dan genotipe peka naungan memiliki karakter
morfologi dan fisiologi daun sebagai penciri adaptasi yang berbeda terhadap
cekaman intensitas cahaya rendah.
2. Karakter morfo-fisiofologi daun, karakter penciri kedelai toleran dan peka
cahaya rendah, dikendalikan oleh gen minor dan gen major.
3. Gen-gen yang terkait adaptasi kedelai terhadap cekaman intensitas cahaya
rendah memiliki tingkat homologi yang tinggi dengan gen-gen yang terkait
adaptasi terhadap cekaman intensitas cahaya rendah pada tanaman lain.
4. Terdapat perbedaan pola ekspresi gen-gen yang terkait adaptasi kedelai
terhadap intensitas cahaya rendah.
Ruang Lingkup Penelitian
Untuk mencapai tujuan penelitian tersebut, maka telah dilakukan empat
rangkaian percobaan. Percobaan 1, Respon Morfo-fisiologi Daun, Penciri
Adaptasi Kedelai terhadap Intensitas Cahaya Rendah. Percobaan 2, Analisis
Genetik Adaptasi Kedelai terhadap Intensitas Cahaya Rendah berdasarkan
Karakter Morfo-fisiologi Daun. Percobaan 3, Analisis Sekuen Lengkap Gen yang
Terkait Adaptasi Kedelai terhadap Intensitas Cahaya Rendah. Percobaan 4,
Analisis Pola Ekspresi Gen-gen yang Terkait Adaptasi Kedelai terhadap Intensitas
Cahaya Rendah.
Secara skematis, bagan alir atau tahapan penelitian secara keseluruhan
Karakter Penciri Adaptasi
Mekanisme Adaptasi Kedelai terhadap Intensitas Cahaya Rendah yang Dibutuhkan bagi Pemuliaan Kedelai Toleran Intensitas Cahaya Rendah
Bahan Kegenetikan
Analisis Genetik Karakter Daun, Penciri Adaptasi ICR Analisis Respon Karakter
Daun, Penciri Adaptasi ICR
Perlakuan Intensitas Cahaya Rendah (ICR)
Analisis Sekuen Lengkap Gen Terkait Adaptasi ICR
Ekspresi Gen-gen Terkait Adaptasi ICR
RT-PCR RNA Total
Pola Ekspresi Gen Terkait Naungan Jumlah Gen, Aksi
Gen, Heritabilitas
Karakterisasi
Gen-gen Terkait ICR
Pendekatan Molekuler Pendekatan Morfo-fisiologi
Sekuen Lengkap cDNA JJ3
(Sopandie et al. 2005)
cDNA Luas Daun, BDS,
Klorofil
Luas Daun, BDS, Klorofil
[image:32.792.70.741.59.491.2]Pendekatan Genetik
Gambar 1 Bagan alir penelitian
BAB II
TINJAUAN PUSTAKA
Fotosintesis pada Kondisi Intensitas Cahaya Rendah
Photosynthetically Active Radiation (PAR) dan Fotosintesis
Cahaya matahari merupakan sumber energi bagi kehidupan di atas bumi ini, karena semua mahluk hidup seperti tumbuhan, hewan, bakteri, ganggang, langsung atau tidak langsung tergantung dari fotosintesis. Organisme fotosintetik menggunakan energi cahaya untuk mensintesis makromolekul (karbohidrat, asam amino, dan asam lemak) yang pada gilirannya digunakan oleh organisme lain sebagai material dasar untuk proses metabolisme.
Spektrum cahaya yang dibutuhkan tanaman berkisar antara panjang gelombang 400-700 nm, yang biasa disebut photosynthetically active radiation (PAR). Energi cahaya dikonversi ke molekul berenergi tinggi (ATP) dan NADPH, terjadi di dalam pigmen atau kompleks protein yang menempel pada membran tilakoid yang terletak pada kloroplas. Pigmen tanaman yang meliputi klorofil a, klorofil b, dan karotenoid termasuk xantofil menyerap PAR terbaik pada panjang gelombang tertentu (Gambar 2). Klorofil a menyerap cahaya tertinggi pada kisaran panjang gelombang 420 nm dan 660 nm. Klorofil b menyerap cahaya paling efektif pada panjang gelombang 440 nm dan 640 nm, sedangkan karotenoid termasuk xantofil mengabsorpsi cahaya pada panjang gelombang 425 dan 470 nm. Menurut Salisbury dan Ross (1992); Grant (1997), cahaya dengan panjang gelombang lebih pendek akan menghasilkan energi foton yang lebih besar dari pada cahaya dengan panjang gelombang lebih panjang. Dengan demikian klorofil a menyerap energi foton lebih besar dari pada klorofil b.
aktif untuk induksi fotoperiodisitas pembungaan, perkembangan kloroplas (tidak termasuk sintesis klorofil), penuaan (senescence) daun dan absisi daun. Kelompok cahaya hijau dengan panjang gelombang 500-600 nm tergolong tidak aktif untuk fotosintesis. Cahaya merah jauh (far-red) dengan panjang gelombang 700-800 nm juga tidak aktif untuk fotosintesis akan tetapi banyak mempengaruhi fotomorfogenesis (Grant 1997).
Gambar 2 Spektrum cahaya yang dapat diserap oleh pigmen tanaman, biasa disebut photosynthetically active radiation (PAR) (Salisbury dan Ross 1992)
Fotosintesis dapat dibagi ke dalam tiga kelompok yang terpisah: (i) reaksi terang, dimana energi radiasi (hv) diserap dan digunakan untuk menghasilkan senyawa berenergi tinggi ATP dan NADPH; (ii) reaksi gelap, meliputi reduksi biokimia CO2 menjadi gula menggunakan senyawa berenergi tinggi yang
dihasilkan pada reaksi terang; dan (iii) suplai CO2 dari udara ke tempat reduksi di
kloroplas (Jones 1992).
Secara umum proses fotosintesis dipengaruhi oleh umur daun, genotipe tanaman, besarnya kebutuhan hasil asimilat oleh sink, dan pengaruh lingkungan seperti kandungan hara, kelembaban, suhu, dan cahaya. Dalam kondisi tanpa stres, intensitas radiasi merupakan faktor lingkungan terpenting yang menyebabkan perbedaan laju fotosintesis (Sinclair dan Torie 1989).
Klorofil a
Klorofil b
Karotenoid
Ungu Biru Hijau Kuning Jingga Merah
400 450 500 550 600 650 700 Panjang gelombang (nm)
Se
rap
Tanaman yang memiliki efisiensi fotokimia yang lebih besar pada cahaya rendah akan mempunyai kecepatan pertumbuhan yang lebih besar dan akan berhasil dalam berkompetisi pada vegetasi yang rapat atau pada kondisi yang ternaungi (Lawlor 1987).
Aklimatisasi fotosintetik pada kondisi cahaya rendah memiliki karakteristik tertentu. Sebagai contoh daun yang terbentuk pada kondisi intensitas cahaya rendah menunjukkan peningkatan jumlah klorofil (Evans 1987) dan akumulasi karbohidrat yang rendah (Makino et al. 1985). Tanaman naungan mengandung klorofil a dan b per unit volume kloroplas 4 sampai lima kali lebih banyak dan mempunyai nisbah a/b lebih rendah pada tanaman cahaya penuh karena mempunyai kompleks pemanen cahaya yang meningkat (Lawlor 1987). Daun yang ternaungi memperlihatkan perkembangan grana yang lebih intensif tetapi kapasitas transpor eletron cenderung berkurang. Sebagai contoh, transpor elektron melalui kedua fotosistem 14 kali lebih tinggi pada kloroplas yang diekstrak dari daun cahaya penuh dibandingkan tanaman naungan. Cyt b6f yang merupakan bagian transpor elektron juga berkurang pada tanaman ternaungi (Jones 1992).
Pembentukan Klorofil
Klorofil dihasilkan di dalam kloroplas pada jaringan fotosintesis daun. Prekursor dalam pembentukan senyawa pigmen klorofil adalah senyawa intermidiate, glutamat, yang mengalami deaminasi menghasilkan α-ketoglutarat, kemudian direduksi menjadi γ,δ-dioxovalerate dan mengalami transaminasi menjadi asam δ–amino-laevulinat (ALA); sintesis ini memerlukan ATP dan NADPH (Malkin dan Niyogi 2000).
Pelepasan air dari asam amino-laevulinat menghasilkan porphobilinogen yang mengandung struktur cincin pyrrole. Selanjutnya terjadi reaksi pelepasan NH3 dan CO2 kemudian membentuk protoporphyrinogen. Penambahan Mg2+ dan
A
[image:36.612.108.446.71.665.2]B
Gambar 3 Lintasan reaksi pembentukan klorofil a dan klorofil b yang melibatkan gen-gen fotosintesis (A) dan struktur kimia klorofil a dan klorofil b (B) (Malkin dan Niyogi 2000; Nagata et al. 2005)
Protoporfirin IX
Mg-protoporfirin monometilester
Protoklorofilide a
Klorofilide a
Mg-adenosylmethionine
H2O -4H CHL D,
CHL I, CHL H
-6H
Klorofil a
Klorofil b
Geranyl-geranyl pyrophosphate
CAO DVR
POR CDR
Glutamat
Klorofil b merupakan bentuk khusus dari klorofil a. Pembentukan klorofil b membutuhkan O2 dan NADPH2 dengan bantuan enzim chlorophyll a oxygenase
(CAO). Pigmen klorofil menyusun sekitar 4% bobot kering kloroplas, dan klorofil b berjumlah sekitar 1/3 dari klorofil a (Hall dan Rao 1999). Klorofil a berperan sentral untuk menyerap dan menyalurkan energi cahaya ke pusat reaksi untuk mengeksitasi elektron.
Klorofil b berfungsi sebagai pigmen antena. Cahaya ditangkap oleh klorofil b yang tergabung dalam kompleks pemanen cahaya (LHC) kemudian segera ditransfer ke klorofil a dan pigmen antena lain yang berdekatan dengan pusat reaksi.
Dalam pembentukan klorofil terdapat paling kurang 3 lintasan reaksi yang dikendalikan oleh gen-gen inti yaitu: lintasan reaksi antara protoporfirin 9 dan protoklorofilide yang melibatkan gen-gen CHLD, CHLI, CHLH, CDR, perubahan protoklorofilide menjadi klorofilide yang melibatkan gen-gen seperti VDR, POR, dan lintasan sintesis klorofil b yang melibatkan gen CAO (Malkin dan Niyogi 2000; Masuda et al. 2002; Nagata et al. 2005; Heyes et al. 2006). Reaksi-reaksi yang terlibat dalam lintasan pembentukan klorofil dan kendali gen-gen inti serta struktur kimia klorofil a dan b disajikan pada Gambar 3.
Klorofil a (C55H72O5N4Mg) dan klorofil b (C55H72O6N4Mg) dapat dibedakan
dengan adanya gugus metil (CH3) pada klorofil a dan gugus aldehid (CHO) pada
klorofil b. Klorofil biasanya mengalami degradasi atau terurai seiring dengan penuaan daun, dan sebagian besar nitrogennya diabsorpsi kembali oleh tanaman.
Klorofil a berfungsi meneruskan cahaya ke pusat reaksi yang merubah energi cahaya menjadi energi kimia. Sedangkan klorofil b berfungsi sebagai pemanen cahaya dan meneruskan energi dari karotenoid ke klorofil a (Salisbury dan Ross 1992).
Pengaruh Intensitas Cahaya Rendah terhadap Pertumbuhan dan Hasil Tanaman
Bagi tanaman, cahaya sangat besar peranannya dalam proses fisiologi, seperti fotosintesis, respirasi, pertumbuhan dan perkembangan, penutupan dan pembukaan stomata, berbagai pergerakan tanaman dan perkecambahan (Taiz dan Zeiger 2002; Salisbury dan Ross 1992). Kedelai termasuk tanaman C3, yang mempunyai tingkat fotorespirasi yang lebih tinggi yang mengakibatkan hasil bersih fotosintesisnya jauh lebih rendah bila dibandingkan dengan tanaman C4. Baharsyah et al. (1993) menyatakan bahwa radiasi matahari akan mencapai titik jenuh antara 0.1-0,6 kal/cm2/menit. Hasil bersih dari proses fotosintesis pada radiasi penuh (1,4-1,7 kal/cm2/menit) adalah sebesar 15-35 mg CO2/dm2 luas
daun/jam. Pada kedelai, radiasi matahari optimum untuk fotosistesis maksimal pada kondisi laboratorium berkisar 0,3-0,8 kal/cm2/menit (432-1152 kal/cm2/hari) (Kassam 1978; Salisbury dan Ross 1992). Nilai tersebut jauh lebih besar dibandingkan intensitas cahaya di bawah tegakan karet (Chozin et al. 1999).
Studi yang telah dilakukan untuk tanaman padi gogo sebagai tanaman sela pada perkebunan karet menunjukkan, rata-rata nilai intensitas cahaya pada areal terbuka sebesar 398,4 kal/cm2/hari. Nilai rata-rata intensitas cahaya dibawah tegakan karet umur 1, 2, 3 dan 4 tahun berturut-turut sebesar 326.7; 237.6; 109.2 dan 38.2 kal/cm2/hari. Nilai intensitas cahaya di bawah tegakan karet umur 2 tahun setara dengan naungan paranet 25%, nilai di bawah tegakan karet umur 3 tahun setara dengan naungan paranet 50 %, dan untuk umur 4 tahun sudah melebihi naungan paranet 75 % (Chozin et al. 1999; Haris 1999). Penurunan intensitas cahaya akan mempengaruhi pertumbuhan dan hasil kedelai.
padi gogo (Watanabe et al. 1993; Jiao et al. 1993; Chozin et al. 1999; Sulistyono et al. 1999; Lautt et al. 2000; Sopandie at al. 2003b dan 2003c). Akan tetapi informasi serupa pada tanaman kedelai belum banyak diperoleh. Penelitian Baharsyah (1980) pada kedelai menunjukkan bahwa penurunan cahaya menjadi 40 % sejak perkecambahan mengakibatkan penurunan jumlah buku, cabang, diameter batang, jumlah polong dan hasil biji. Naungan 60 % pada saat awal pengisian polong menyebabkan penurunan jumlah polong, hasil biji dan kadar protein biji. Asadi et al. (1997) menunjukkan bahwa penurunan hasil biji kedelai (28 galur) yang diuji di bawah naungan 33 % berkisar 2-45 % dibandingkan dengan tanpa naungan
Mekanisme Adaptasi Tanaman terhadap Intensitas Cahaya Rendah
Pada kebanyakan tanaman, kemampuan tanaman dalam mengatasi cekaman intensitas cahaya rendah tergantung kepada kemampuannya melanjutkan fotosintesis dalam kondisi defisit cahaya. Hale dan Orchut (1987) menjelaskan bahwa adaptasi terhadap naungan pada dasarnya dapat melalui dua cara, yaitu melalui: (a) peningkatan luas daun sebagai cara mengurangi penggunaan metabolit, dan (b) pengurangan jumlah cahaya yang ditransmisikan dan yang direfleksikan. Levitt (1980) membuat hipotesis bahwa adaptasi terhadap naungan dicapai melalui: (a) mekanisme penghindaran (avoidance) yang berkaitan dengan respon perubahan anatomi dan morfologi daun untuk peningkatan penangkapan cahaya dan fotosintesis yang efisien (Gambar 4A), serta (b) mekanisme toleransi (tolerance) yang berkaitan penurunan titik konpensasi cahaya serta respirasi yang efisien (Gambar 4B). Penghindaran defisit cahaya dilakukan dengan mengurangi kutikula, lilin, dan bulu daun serta meniadakan pigmen antosianin (Levitt 1980).
Pada mekanisme toleransi, asimilasi bersih CO2 nol terjadi pada titik
kompensasi cahaya (LCP) yaitu cahaya pada permukaan daun yang menginduksi kecepatan asimilasi CO2 aktual sama dengan kecepatan evolusi O2 respirasi.
(A)
[image:40.612.92.505.68.673.2](B)
Gambar 4 Model mekanisme penghindaran (avoidance) (A) dan mekanisme toleransi (tolerance) (B) untuk adaptasi tanaman terhadap intensitas
Peningkatan efisiensi penangkapan cahaya
Peningkatan area penangkapan cahaya
Peningkatan proporsi area fotosintetik (daun)
Peningkatan penangkapan cahaya per unit area fotosintetik
Refleksi avoidance Transmisi avoidance ”waste” absorbsi Avoidance
Hilangnya kutikula, lilin dan rambut pada permukaan
daun Hilangnya pigmen non- kloroplas (Antosianin) Peningkatan kandungan kloroplas Peningkatan kandungan pigmen
per kloroplas
Peningkatan kandungan kloroplas per sel
mesofil
Kloroplas kandungan kloroplas dalam sel
epidermis Toleransi defisit cahaya Penurunan LCP Penurunan kecepatan respirasi di bawah LCP
Penghindaran kerusakan sistem fotosintetik
Penurunan kecepatan respirasi mendekati LCP
Perubahan anatomi dan morfologi. Dari sudut anatomi dan morfologi, karakter yang mengalami perubahan terhadap intensitas cahaya rendah telah dijelaskan oleh Bjorkman (1981), Anderson (1986), Evans (1988) dan Anderson et al. (1995). Intensitas cahaya akan mempengaruhi bentuk dan anatomi daun termasuk sel epidermis dan tipe sel mesofil (Vogelmann dan Martin 1993). Perubahan tersebut sebagai mekanisme untuk pengendalian kualitas dan jumlah cahaya yang dapat dimanfaatkan oleh kloroplas daun. Daun tanaman yang ternaungi akan lebih tipis dan lebar dari pada daun yang ditanam pada areal terbuka, yang disebabkan oleh pengurangan lapisan palisade dan sel-sel mesofil (Taiz dan Zeiger 2002). Pada genotipe padi gogo dan kedelai toleran naungan, terjadi pengurangan lapisan palisade yang lebih besar akibat cekaman naungan dibanding genotipe peka, menyebabkan daun menjadi lebih tipis (Khumaida 2002; Sopandie et al. 2003a, 2003b). Lapisan palisade dapat berubah sesuai kondisi cahaya, yang menyebabkan tanaman menjadi efisien dalam menyimpan energi cahaya (Taiz dan Zeiger 2002). Tanaman dikotil termasuk kedelai mempunyai kapasitas yang lebih besar untuk menggunakan cara menghindari naungan (shade avoidance) (Morelli dan Ruberti 2002).
kandungan klorofil tinggi, rendahnya laju fotosintesis sering dihubungkan dengan tingginya resistensi stomata dan rendahnya aktivitas Ribulose bifosfat (RuBP) (Murty dan Sahu 1987). Selain itu, walaupun kandungan klorofil meningkat namun terjadi penurunan klorofil per luas area karena daun menjadi lebih tipis (Nilsen dan Orcutt 1996).
Perubahan fisiologi dan biokimia. Hubungan antara enzim rubisco dan fotosintesis telah diketahui dengan sangat baik (Makino et al. 1984; Evans 1987); jumlahnya pada daun secara relatif merefleksikan 20-30 % dari total N daun. Naungan menyebabkan perubahan fisiologi dan biokimia, salah satu di antaranya adalah perubahan kandungan N daun, kandungan rubisco dan aktivitasnya. Rubisco adalah enzim yang memegang peranan penting dalam fotosintesis, yaitu yang mengikat CO2 dan RuBP dalam siklus Calvin yang menghasilkan 3-PGA.
Intensitas cahaya rendah (naungan) menyebabkan rendahnya aktivitas rubisco (Portis 1992, Bruggeman dan Danborn 1993). Diperkirakan genotipe kedelai toleran naungan akan memiliki aktivitas rubisco yang lebih tinggi dan kandungan N terlarut yang lebih rendah dibandingkan dengan yang peka pada kondisi naungan, seperti dilaporkan pada padi gogo (Sopandie et al. 2003b).
Hubungan antara cekaman intensitas cahaya rendah dengan penurunan karbohidrat dapat dijelaskan dalam beberapa hal. Pengurangan fotosintat pada intensitas cahaya rendah dapat dihubungkan dengan tingginya resistensi stomata dan sel-sel mesofil terhadap pertukaran CO2. Pada kondisi cahaya rendah aktivitas
karboksilase dan RuBP menurun (Thorne dan Koller 1974). Reaksi pembentukan pati dikatalisis oleh enzim ADP-glukosa pyrofosforilase yang mengatur aliran karbon, dimana enzim ini diatur secara alosterik oleh produk dari siklus PCR. Intensitas cahaya yang rendah menyebabkan rendahnya pembentukan 3-PGA, yang menyebabkan hambatan kerja enzim ADP-glukosa pyrofosfatase karena adanya Pi yang berinteraksi dengan 3-PGA. Soverda (2002) menunjukkan bahwa cekaman intensitas cahaya rendah menurunkan aktivitas PGA kinase, penurunan yang lebih kecil dijumpai pada genotipe padi gogo yang toleran naungan dibandingkan genotipe yang peka.
mengalami kenaikan, selanjutnya perimbangan antara pati dan sukrosa tersebut berubah kembali seperti semula setelah perlakuan naungan dihentikan. Pada intensitas cahaya rendah terjadi gangguan translokasi karbohidrat. Pada kondisi ini gula total (sebagian besar gula non reduksi dan pati) secara nyata menurun pada seluruh bagian tanaman. Murty dan Sahu (1987) melaporkan peningkatan kandungan total amino-N dan N terlarut pada varietas padi yang peka, yang menyebabkan sintesis protein terganggu dan ketersediaan karbohidrat menjadi rendah dan tingkat kehampaan menjadi tinggi. Penelitian Lautt et al. (2000) pada padi gogo menunjukkan bahwa galur toleran padi gogo memperlihatkan kandungan pati pada daun dan batang yang lebih tinggi daripada yang peka saat dinaungi 50 % saat vegetatif aktif. Kenaikan sukrosa pada saat vegetatif aktif hanya terjadi pada galur yang toleran, sejalan dengan peningkatan aktivitas enzim SPS (sukrosa fosfat sintase).
Perubahan struktur kloroplas. Intensitas cahaya tinggi maupun intensitas cahaya rendah merupakan faktor stres yang dapat merusak dan mempengaruhi struktur dan fungsi kloroplas (Mostowska 1997). Menurut Biswal (1997b) dan Mostowska (1997), perubahan struktur dan fungsi kloroplas akibat stres cahaya terjadi pada level komposisi pigmen, struktur organisasi tilakoid, reaksi fotokimia, dan efisiensi fiksasi CO2. Selain itu juga penurunan bahkan kehilangan pigmen
fotosintesis, perbedaan respon Chla dan Chlb, dan perubahan dalam komposisi karotinoid, terutama perubahan komposisi komponen siklus xanthophyll. Stress tersebut menyebabkan perubahan struktur kloroplas (secara umum) dan kompleks transport elektron (secara khusus). Perubahan pigmen dan struktur membran tilakoid diikuti oleh perubahan laju reaksi fotokimia yang terkait dengan PSI dan PSII dan juga aktivitas enzim dalam siklus Calvin (Biswal 1997b).
dilaporkan sebagai suatu komponen kunci selama pengiriman signal stres untuk adaptasi kloroplas (Biswal 1997b; Mostowska 1997).
Pengaruh stres cahaya rendah terhadap perubahan kloroplas juga sudah dilaporkan. Intensitas cahaya rendah terbukti mempengaruhi orientasi kloroplas tanaman. Pada intensitas cahaya rendah kloroplas akan mengumpul pada dua bagian, yaitu pada kedua sisi dinding sel terdekat dan terjauh dari cahaya (Salisbury dan Ross, 1992). Hal ini sering menyebabkan warna daun lebih hijau, karena posisi kloroplas yang terkonsentrasi pada permukaan daun. Intensitas cahaya rendah menyebabkan terjadi peningkatan jumlah kloroplas per sel, volume kloroplas dan membran tilakoid serta grana (stack granum), seperti pada Gusmania monostachia (Maxwell et al. 1999).
Respon kloroplas terhadap perubahan intensitas cahaya matahari tergantung pada skala waktu perubahan tersebut. Respon jangka pendek terjadi dalam beberapa detik sampai menit yang melibatkan penyusunan kembali struktur dan fungsi komponen kloroplas. Regulasi jangka pendek ini termasuk pada saat transisi dan penyesuaian fotosistem stoikiometrik pada fosforilasi protein tilakoid (Allen 1995), regulasi untuk efisiensi PS II (Horton et al. 1996), serta perubahan aktivitas rubisco (Salvucci dan Ogren 1996). Perubahan jangka panjang terhadap cahaya melibatkan sintesis yang selektif dan degradasi komponen kloroplas untuk menyusun komposisi dan fungsi organ fotosintesis. Sangat menarik untuk dipelajari perubahan struktur kloroplas pada genotipe kedelai toleran dan peka dalam kondisi intensitas cahaya rendah dalam periode pendek dan panjang. Hipotesis yang dapat diajukan adalah genotipe toleran akan memiliki struktur kloroplas dan komponen (grana, jumlah tilakoid pada grana, stroma, stack membrane, ukuran kloroplas) yang normal dibandingkan dengan yang peka.
Struktur Kloroplas dan Mekanisme Transport Elektron
Struktur Kloroplas
komponen transkripsi dan translasi, dan enzim-enzim untuk sintesis lipid, porphyrin, terpenoid, quinoid dan senyawa aromatik lain. Struktur membran tilakoid beragam dari yang sederhana pada bakteri sampai yang paling kompleks pada kloroplas tanaman tingkat tinggi. Membran tilakoid, yang diklasifikasikan ke dalam grana dan lamella stroma, terdiri atas pigmen-pigmen fotosintesis seperti klorofil a, klorofil b, karoten, dan xantofil. Pigmen-pigmen tersebut berasosiasi dengan protein spesifik yang terikat membran (specific membrane-bound protein) dan membentuk gabungan pigmen guna mengoptimalkan penyerapan energi cahaya (foton) (Biswal dan Biswal 1999).
Gambar 5 Skema bangun kloroplas. Kloroplas merupakan organel semi-otonom pada sel tanaman. Energi cahaya dirubah menjadi energi kimia di membran tilakoid. Fiksasi CO2 berlangsung di stroma. Tumpukan
grana lebih besar pada daun yang ternaungi dari pada daun penuh cahaya (Biswal dan Biswal 1999).
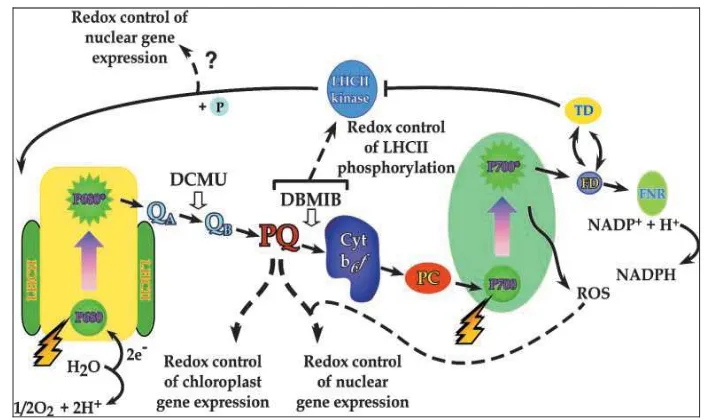
Mekanisme Transport Elektron
Menurut Critchley (1997) dan Biswal dan Biswal (1999), reaksi cahaya yang terjadi pada membran tilakoid dikendalikan oleh dua fotosistem (PSII dan PSI) yang dihubungkan oleh suatu intersistem rantai transport elektron (Gambar 6). Reaksi cahaya merupakan reaksi fotokimia yang menghasilkan NADPH dan ATP serta membebaskan O2 dari molekul air. Produk reaksi cahaya selanjutnya
[image:46.612.144.496.232.442.2]digunakan reaksi gelap melalui siklus Calvin untuk pembentukan gula.
Gambar 6 Skema rantai transport elektron fotosintetik pada PS II dan PS I (Surpin et al. 2002; Andersson et al. 2003).
ATP sintase memproduksi ATP dengan memanfaatkan energi yang diperoleh dari proton (H+) yang kembali berdifusi dari lumen ke stroma (Critchley 1997).
Secara detail, rangkaian transport elektron dapat dijelaskan sebagai berikut: Cahaya (hv) yang diterima fotosistem II (PSII) menyebabkan terjadinya pemisahan muatan pada pusat reaksi sehingga terbentuk pasangan radikal (P680+Pheo-). P680+ melepas satu elektron dari residu tyrosin di dalam protein D1 kemudian direduksi kembali oleh elektron dari kelompok manganese yang mengoksidasi air dan melepaskan proton (H+) dan O2 ke lumen. Pheo- mereduksi
quinone yang masih terikat (QA) dan menggerakkan elektron ke quinone kedua
(QB) untuk membentuk semi quinone (QB-). Selanjutnya, QB direduksi menjadi
quinol dan membutuhkan dua H+ dari stroma dan mendifusikan ke tempat ikatannya menjadi plastoquinol (PQH2). PQH2 dioksidasi di dalam siklus Q oleh
sitokrom kompleks b6f yang mereduksi plastosianin (PC) dan melepaskan proton
ke lumen (Biswal dan Biswal 1999; Surpin et al. 2002; Andersson et al. 2003). Pada fotosistem I (PSI) penyerapan cahaya menyebabkan pemisahan muatan antara P700 dan penerima elektron A0 (klorofil). Elektron tersebut bergerak
melalui filoquinon (A1) dan sejumlah pusat Fe-S (Fx, FA dan FB) ke Fe-S protein
ferredoksin terlarut (Fdx). Fdx-NADP+ reduktase (FNR) NADP+ mereduksi menjadi NADPH dengan elektron dari Fdx dan dari H+ stroma. P700+ direduksi kembali dengan elektron yang berasal dari plastosianin (PC). Translokasi H+ dari lumen ke stroma menghasilkan proton motif force yang menyebabkan fosforilasi ADP menjadi ATP oleh ATP sintase (CF0 CF1) (Surpin et al. 2002; Andersson et
al. 2003).
Secara ringkas, energi matahari digunakan untuk mengoksidasi air untuk menghasilkan proton, elektron dan oksigen. Elektron dikonversi ke NADPH. H+ dari oksidasi air dan siklus Q digunakan untuk mensintesis ATP. Selanjutnya NADPH dan ATP yang terbentuk digunakan untuk asimilasi CO2 menjadi
karbohidrat pada siklus Calvin-Benson (Surpin et al. 2002; Andersson et al. 2003).
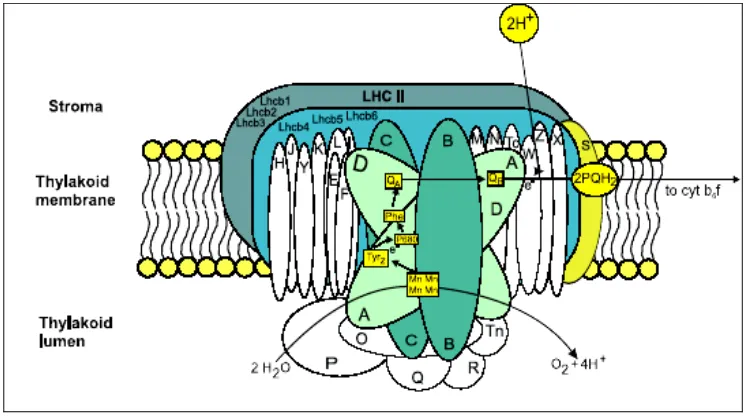
plastoquinon (PQ) dimediasi oleh PSII (Trebst 1995; Kulandaivelu dan Lingakumar 2000). Biswal dan Biswal (1999) menyebut PSII sebagai kompleks multi-subunit yang terdiri atas lebih dari 25 jenis protein berbeda. Beberapa di antara protein tersebut terletak intrinsik dan protein yang lainnya ekstrinsik serta dikode oleh genom plastida dan genom inti. Protein intrinsik seperti D1 dan D2 serta komponen nonprotein seperti Chl a dimer (P680), 2 Chl a monomer, 2 pheophytin (pheo), quinon A (QA), dan quinon B (QB), dan Fe nonheme, menyusun kompleks inti (core complex) PSII. Kompleks inti tersebut berhubungan dengan kluster Mn (4 Mn) dan antena pemanen cahaya (light-harvesting antenna) seperti CP47 dan CP43 (Whitelegge 1997; Biswal dan Biswal 1999). Beberapa protein ekstrinsik, seperti protein 33-kDa penstabil Mn (Mn-stabilizing protein) bergabung dengan fotosistem pada sisi lumen. P680 bertindak sebagai donor elektron dan pheo sebagai akseptor elektron.
Fotokimia atau reaksi cahaya PSII dimulai dengan pemisahan muatan yang menghasilkan pasangan radikal P680+ Pheo-. Menurut Whitelegge (1997), aktifitas PSII dapat dibagi menjadi 3 domain fungsional. Fungsi pemanen cahaya dengan sejumlah protein intrinsik (C