Magnetospirillum magneticum
AMB-1 DI
Escherichia coli
YONATAN BANOET
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Magnetosom pada Magnetospirillum magneticum AMB-1 di Esherichia coli. Dibimbing oleh ARIS TRI WAHYUDI dan UTUT WIDYASTUTI.
Magnetospirillum magneticum AMB-1 adalah salah satu strain bakteri magnet yang mampu mensintesis magnetosom. Magnetosom pada M. magneticum AMB-1 merupakan partikel magnetit berukuran nano yang diselimuti membran, dan mampu memberikan kemampuan magneto-aerotaksis pada bakteri magnet. Pembentukan magnetosom pada sel bakteri magnet dikontrol secara genetik. Sampai saat ini telah diketahui setidaknya ada 36 gen yang terlibat dalam biosintesis magnetosom, dua open reading frame (ORF) diantaranya adalah ORF 14 dan ORF 38.0. Kedua ORF tersebut dalam penelitian ini dianalisis secara bioinformatika dan diintroduksikan kedalam sel E. coli DH5α menggunakan vektor kloning pGEMT-Easy.
Hasil analisis bioinformatika untuk ORF 14 menunjukkan bahwa gen tersebut mengkode protein yang memiliki homologi sebesar 90% dengan domain GGDEF pada
Magnetospirillum magnetotacticum MS-1. Sedangkan hasil analisis bioinformatika untuk ORF 38 menunjukkan bahwa gen tersebut memiliki homologi sebesar 70% dengan
6-hydroxynicotinate reductase pada Bradyrhizobium sp. BTAi1. Verifikasi hasil kloning kedua ORF dilakukan melalui pemotongan plasmid rekombinan menggunakan enzim restriksi EcoRI, NdeI, dan BamHI; serta PCR koloni. Verifikasi hasil kloning membuktikan bahwa kedua ORF telah berhasil diintroduksi ke dalam sel E. coli DH5α.
ABSTRACT
YONATAN BANOET. The Cloning of Two Candidate Genes that Involved in Magnetosomes Biosynthesizes of Magnetospirillum magneticum AMB-1 to Escherichia coli. Supervised by ARIS TRI WAHYUDI and UTUT WIDYASTUTI.
Magnetospirillum magneticum AMB-1 is a magnetotactic bacterium that synthesizes nanoscale magnetites particles enveloped by membrane, called as magnetosomes. Magnetosomes are membranous bacterial organelles that allow magneto-aerotaxis in magnetotactic bacteria. The formation of magnetosomes in magnetotactic bacteria was genetically controlled. There are 36 genes from the genome of M. magneticum
AMB-1 that involved in magnetosomes formation, two open reading frames from those genes referred to ORF 14 and ORF 38.0. Here in, bioinformatics analysis was done to analyze ORF 14 and ORF 38.0. These genes were amplified by polymerase chain reaction and cloned in Escherichia coli DH5α using pGEMT-Easy as a Cloning Vector System.
Magnetospirillum magneticum
AMB-1 DI
Escherichia coli
YONATAN BANOET
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains
Pada Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Nama : Yonatan Banoet
NIM :
G34104069
Menyetujui:
Pembimbing I, Pembimbing II,
Dr. Aris Tri Wahyudi, M.Si. Dr. Utut Widyastuti,
M.Si
NIP 131957319 NIP 131851279
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. drh. Hasim, DEA
NIP 131578806
dan karuniaNya, sehingga penulis dapat menyelesaikan karya ilmiah ini. Penelitian yang dilaporkan dalam karya ilmiah ini dilakukan mulai Februari 2008 sampai dengan Juli 2008, di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Dr. Aris Tri Wahyudi, M. Si dan Dr. Utut Widyastuti atas bimbingan dan pengarahan yang diberikan. Demikian pula kepada Dr. Dedy Duryadi S., DEA sebagai wakil komisi pendidikan atas saran dan masukan yang diberikan. Terima kasih kepada Rika Indri Astuti, M. Si dan Ari Sulistiowati, M. Si di Laboratorium Mikrobiologi, juga kepada Muzuni, M. Si di Laboratorium BIORIN PAU atas bantuan, saran, dan budi baiknya selama penulis menjalankan penelitian ini. Terima kasih kepada keluarga untuk dukungan dan semangat yang telah diberikan sampai saat ini. Terima kasih juga kepada teman-teman di Asrama Mahasiswa IPB Ekasari atas tawa dan hiburan yang selalu ada, dan kepada teman-teman Biologi 41 tercinta atas bantuan, senyum, dan perhatiannya. Semoga skripsi ini bermanfaat.
Bogor, Januari 2009
Yonatan Banoet
dan Ibu Wiwi Kartiwi. Penulis adalah anak kedua dari dua bersaudara. Penulis lulus SD tahun 1998 dan lulus dari SLTP tahun 2001. Tahun 2004 penulis lulus dari SMAN 1 Bekasi dan pada tahun yang sama diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor, melalui jalur SPMB.
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vi
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 1
BAHAN DAN METODE Waktu dan Tempat ... 1
Bahan ... 1
Metode Analisis Bioinformatika Sekuen ORF 14 dan 38.0 ... 2
Amplifikasi ORF 14 dan 38.0 ... 2
Kloning ORF 14 dan 38.0 ke dalam Sel E. coli DH5α ... 2
Verifikasi Hasil Kloning ORF 14 dan 38.0 ... 3
HASIL Analisis Bioinformatika Sekuen ORF 14 dan 38.0 ... 5
Amplifikasi ORF 14 dan 38.0 ... 5
Kloning ORF 14 dan 38.0 ke dalam Sel E. coli DH5α ... 5
Verifikasi Hasil Kloning ORF 14 dan 38.0 ... 6
PEMBAHASAN ... 7
SIMPULAN ... 9
SARAN ... 9
DAFTAR PUSTAKA ... 9
1 Hasil analisis bioinformatika sekuen ORF 14 dan ORF 38.0 ... 5
DAFTAR GAMBAR
Halaman 1 Skema proses konstruksi plasmid rekombinan pGEMT-14 dan pGEMT-38.0, dan kloning kedua ORF ke dalam sel E. coli DH5α ... 42 Hasil analisis bioinformatika menggunakan program ScanProsite ... 6
3 Elektroforesis gel agarosa DNA hasil amplifikasi ORF 14 dan ORF 38.0 ... 6
4 Koloni putih E. coli DH5α yang membawa plasmid rekombinan ... 6
5 Elektroforesis gel agarosa DNA hasil verifikasi kloning ORF 14 dan 38.0 ke dalam E. coli DH5α ... 7
DAFTAR LAMPIRAN
Halaman 1 Peta keseluruhan genom M. magneticum AMB-1 ... 112 Peta plasmid pGEMT-Easy (Promega) ... 12
Kelompok bakteri magnet merupakan bakteri gram negatif dan termasuk ke dalam grup α-proteobakteria (Burgess et al. 2007). Bakteri magnet memiliki habitat di perairan tawar dan laut. Kelompok bakteri magnet memilih lingkungan mikroaerofilik atau anaerob seperti sedimen dan memiliki ketergantungan terhadap unsur-unsur mineral dalam perairan, terutama terhadap besi (Schuler & Baeurlein 1998).
Bakteri magnet memiliki kemampuan untuk merespon medan magnet dan cenderung bermigrasi sepanjang garis bidang magnet bumi (Blakemore 1975). Hal ini dikarenakan kemampuan kelompok bakteri tersebut mensintesis magnetosom. Magnetosom merupakan partikel magnetit (Fe3O4) atau greigit (Fe3S4), dan dilapisi membran fesikel yang berasal dari invaginasi membran sitoplasma (Gorby et al. 1998, Komeili et al. 2006). Umumnya magnetosom tersusun berantai dalam sel, terdiri dari 15 sampai 20 partikel magnet berukuran antara 20 hingga 50 nm. Magnetosom berperan seperti jarum kompas yang mengorientasikan bakteri magnet pada medan magnet bumi, sehingga bakteri magnet dapat memilih lingkungan mikroaerofilik yang menjadi habitatnya (Bazylinski & Frankel 2004, Smith et al. 2006).
Salah satu strain bakteri magnet yang sering dijadikan model dalam biosintesis magnetosom adalah Magnetospirillum magneticum AMB-1. Strain tersebut bersifat anaerob fakultatif, mampu tumbuh dalam kondisi aerob, namun tidak dapat mensintesis magnetosom. Strain tersebut juga mudah dikulturkan di laboratorium (Matsunaga et al. 1991). Partikel magnetosom dalam sel M. magneticum
AMB-1 berupa magnet magnetit (Fe3O4) dan tersusun berbentuk rantai memanjang searah panjang sel (Wahyudi et al. 2003).
Matsunaga et al. (2005) telah mensekuen keseluruhan DNA genom M. magneticum AMB-1. Ukuran genom total
M. Magneticum AMB-1 adalah 4. 9 Mb. Berdasarkan studi genetik terhadap pembentukan magnetosom pada M. magneticum AMB-1 melalui mutagenesis menggunakan transposon, setidaknya ada 36 gen yang terlibat dalam biosintesis magnetosom dan tersebar pada genom
magnetosom melalui mutagenesis menggunakan transposon adalah ORF 14 dan ORF 38.0 (Wahyudi 2004a).
Penelitian ini menggunakan sekuen ORF 14 dan 38.0 yang terdapat pada Gen Bank untuk dianalisis secara bioinformatika. Kedua ORF akan diintroduksikan ke dalam sel Esherichia coli DH5α menggunakan vektor kloning pGEMT-Easy. Kloning molekuler yang dilakukan dalam penelitian ini akan berguna dalam telaah lanjutan mengenai peranan kedua ORF dalam biosintesis magnetosom pada M. magneticum AMB-1.
Biosintesis magnetosom pada bakteri merupakan proses kompleks yang diregulasi secara genetik. Sampai saat ini mekanisme dalam pembentukan magnetosom belum dapat dipahami sepenuhnya (Grünberg 2001, Wahyudi 2004b). Sehingga diperlukan telaah molekuler seperti isolasi, kloning molekuler, dan karakterisasi tiap gen yang terlibat biosintesis magnetosom.
Tujuan
Melakukan analisis bioinformatika dan melakukan kloning molekuler terhadap dua ORF yang terlibat dalam biosintesis magnetosom.
BAHAN DAN METODE Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Febuari hingga Juli 2008 di Laboratorium Bagian Mikrobiologi Departemen Biologi, FMIPA, IPB.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah genom M. magneticum AMB-1, sekuen ORF 14 (gene id: amb0759) dan ORF 38.0 (gene id: amb1482), galur Escherichia coli
DH5α, media Luria Agar (LA) (NaCl 10 g/L, Bacto Trypton 10 g/L, Yeast extract 5 g/L dan Bacto Agar 15 g/L) dan Luria Broth (LB), ampisilin (5 mg/ml), pGEMT-Easy (Promega) (Lampiran 2), gel agarosa,
KIT-Polymerase Chain Reaction (PCR) (TAKARA La Taq), primer spesifik (forward dan reverse) yang didesain berdasarkan sekuen ORF 14 dan 38.0, Geneaid Gel/PCR Fragments Extraction Kit, bufer transformasi (0.1 M CaCl2, 5 mM MgCl2, 5mM Tris-Cl pada pH 7), enzim restriksi EcoRI, NdeI dan BamHI (Promega). Alat-alat yang digunakan dalam penelitian ini adalah mesin sentrifuse (Jouan A14), mesin PCR 2400 (Perkin-Elmer), piranti elektroforesis (BioRad), dan peralatan yang umum digunakan di laboratorium mikrobiologi.
Metode
Analisis Bioinformatika Sekuen ORF 14 dan ORF 38.0. Analisis bioinformatika sekuen ORF 14 (gene id: amb0759) dan ORF 38.0 (gene id: amb1482) menggunakan program Bioedit, ScanProsite yang tersedia di situs www.expasy.org, dan BLASTX yang tersedia di situs www.ncbi.nlm.nih.gov.
Amplifikasi ORF 14 dan ORF 38.0 dengan Polymerase chain reaction. Amplifikasi ORF 14 (1059 bp) dan ORF 38.0 (1482 bp) dilakukan dengan mencampurkan berturut-turut 1.25 µl ddH2O, 12.5 µl bufer PCR GC II, 4 µl (2.5 mM) dNTPs, 0.25 µl (5 unit/µl) enzim LA Taq DNA Polymerase, 1 µl (10 pmol) primer spesifik (forward dan reverse) masing-masing ORF, dan 5 µl (0.5 µg) DNA template. Sekuen primer spesifik ORF 14 yaitu forward: GGG GGA CAT ATG AAG AGT CCG GAT ACC;
reverse: GGG GGA TCC AAA CTA TTT CGC CGC TTC GCC. Sedangkan sekuen primer spesifik ORF 38.0 yaitu forward: GGG GGA CAT ATG AGC GAC GTC GTC GAA; reverse: GGG GGA TCC AAA TCA CGT GTC GTC CCC CCA. Sekuen kedua primer yang digunakan dalam penelitian ini memiliki situs restriksi enzim NdeI (forward, terlihat pada basa yang digarisbawahi) dan BamHI (reverse, terlihat pada basa yang digaris bawahi) (Lampiran 3).
Tahap awal dalam reaksi PCR adalah pradenaturasi pada suhu 95 0C selama 2 menit. Selanjutnya reaksi PCR dilakukan sebanyak 30 siklus, tiap siklus terdiri dari tahap denaturasi, annealing, dan elongasi. Denaturasi kedua DNA dilakukan pada suhu 950C selama 2 menit, annealing pada
suhu 580C selama 1 menit, dan elongasi pada suhu 720C selama 1 menit. Tahap terakhir dilakukan pada suhu 720C selama 10 menit.
Produk PCR dielektroforesis pada gel agarosa 1% (b/v). Proses selanjutnya adalah purifikasi produk PCR dari gel agarosa menggunakan PCR Fragments Extraction Kit (Geneaid). Setelah dielektroforesis, gel berisi pita DNA hasil PCR dipotong dan dimasukkan ke dalam tabung mikro 1.5 ml. Kemudian, ke dalam tabung tersebut ditambahkan 500 µl DF Buffer, lalu diinkubasi pada suhu 600C selama 10 menit. Setelah gel larut, tabung mikro diinkubasikan hingga suhunya sama dengan suhu ruang. Pengikatan DNA dilakukan dengan memasukkan campuran gel ke dalam tabung penampung yang dilengkapi DFkolom. Selanjutnya tabung penampung disentrifugasi pada kecepatan 13000 rpm selama 30 detik. Cairan yang tertampung dibuang, kemudian DFkolom dimasukkan kembali ke dalam tabung penampung. Proses pencucian dilakukan dengan menambahkan 600 µl Wash Buffer
pada DFkolom dan disentrifugasi pada kecepatan 13000 rpm selama 30 detik. Cairan yang tertampung dibuang, kemudian Dfkolom dikembalikan ke tabung penampung dan disentrifugasi selama 3 menit untuk mengeringkan membran pada DFkolom. DFkolom dipindahkan ke tabung mikro steril, lalu 30 µl Elution Buffer ditambahkan di tengah-tengah membran Dfkolom, untuk proses elusi. Kemudian diinkubasi pada suhu ruang selama 2 menit dan disentrifugasi selama 1 menit pada kecepatan 13000 rpm. DFkolom dibuang dan DNA yang tertampung disimpan pada suhu -200C.
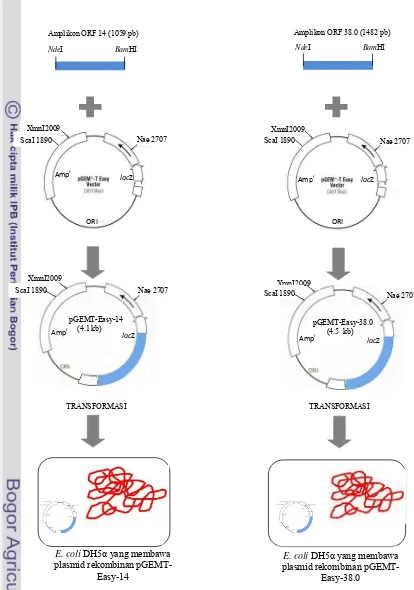
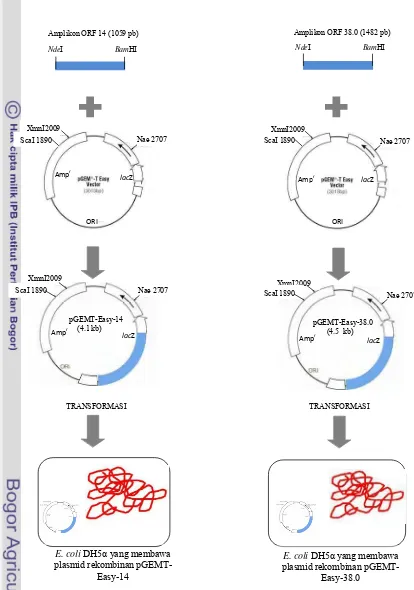
Kloning ORF 14 dan ORF 38.0 ke dalam sel E. coli DH5α. Amplikon hasil purifikasi diligasi ke dalam vektor kloning pGEMT-Easy. Ligasi ORF 14 ke plasmid pGEMT-Easy dilakukan dengan mencampurkan berturut-turut 5 µl 2x
Rapid Ligation Buffer (Promega), 0.53 µl (53 ng) DNA sisipan, 1 µl (3 Weiss Unit/µl) enzim T4 DNA ligase (Promega), 1 µl (50 ng) vektor kloning pGEMT-Easy (Promega). Campuran kemudian dilarutkan dengan ddH2O hingga volume reaksi 10 µl. Ligasi ORF 38.0 ke plasmid pGEMT- Easy dilakukan dengan mencampurkan berturut-turut 5 µl 2x
DNA sisipan, 1 µl (3 Weiss Unit/µl) enzim T4 DNA ligase, dan 1 µl (50 ng) vektor kloning pGEMT-Easy. Campuran kemudian dilarutkan dengan ddH2O hingga volume reaksi 10 µl. Inkubasi dilakukan pada suhu 15 0C selama 12 jam. Ligasi ORF 14 dan ORF 38.0 ke dalam pGEMT-Easy akan menghasilkan plasmid rekombinan pGEMT-Easy-14 dan pGEMT-Easy-38.0 (Gambar1). Plasmid rekombinan kemudian diintroduksikan kedalam sel E. coli DH5α (Gambar 1) menggunakan metode kejutan panas (Sambrook & Russel 1989).
Tahap awal dalam introduksi kedua plasmid rekombinan ke dalam sel E. coli
DH5α adalah pembuatan sel kompeten (Sambrook & Russel 1989). Satu koloni E. coli DH5α dikulturkan kedalam 2 ml media LB, lalu diinkubasi pada suhu 37 0C dan kecepatan 100 rpm selama 16 jam. Setelah 16 jam, 0.5 ml kultur dipindahkan ke dalam 50 ml media LB, dan diinkubasi selama 3 jam pada suhu 37 0C dan kecepatan 100 rpm. Sebanyak 1.5 ml kultur dipindahkan kedalam tabung mikro steril dan disentrifugasi pada kecepatan 3000 rpm selama 10 menit. Pelet yang didapat kemudian diresuspensi dengan 1 ml bufer transformasi (0.1 M CaCl2, 5 mM MgCl2, 5mM Tris-Cl pada pH 7) dingin lalu diinkubasi dalam es selama 20 menit, dan disentrifugasi kembali pada kecepatan 3000 rpm selama 10 menit. Pelet yang didapatkan kemudian diresuspensi dengan 250 µl bufer transformasi dingin selama 10 menit. Setelah diinkubasi dalam es, sel
E. coli DH5α telah kompeten dan siap diintroduksi dengan plasmid rekombinan. Sebanyak 250 µl sel E. coli yang telah dibuat kompeten dicampurkan dengan 10 µl plasmid rekombinan dan diinkubasi pada suhu 420C selama 45 detik, kemudian diinkubasikan kembali dalam es selama 2 menit. 100 µl media LB ditambahkan kedalam suspensi dan diinkubasi pada inkubator bergoyang selama 24 jam pada suhu 370C. Suspensi selanjutnya disentrifugasi pada 8000 rpm selama 2 menit, pelet diresuspensi dengan 100 µl media LB, kemudian sebanyak 100 µl suspensi disebarkan pada media LA + Amp 50 µg/ml + X-gal 40 µg/ml.
Verifikasi Hasil Kloning ORF 14 dan ORF 38.0. Verifikasi dilakukan untuk memastikan bahwa koloni putih E. coli
DH5α yang tumbuh pada media LA
diduga membawa plasmid rekombinan pGEMT-Easy-14 dan pGEMT-Easy-38.0. Verifikasi dilakukan dengan pemotongan plasmid rekombinan menggunakan enzim restriksi EcoRI (5‘ G–A–A–T–T–C 3‘),
BamHI (5; G–G–A–T–C–C 3‘), dan NdeI (5‘ C–A–T–A–T–G 3‘) (Promega), dan PCR koloni menggunakan primer spesifik untuk mengamplifikasi kedua ORF.
Isolasi plasmid rekombinan menggunakan metode Sambrook & Russel (1989) dilakukan dengan mengkulturkan koloni putih yang tumbuh ke dalam 10 ml media LB, lalu diinkubasi pada suhu 37 0C dan kecepatan 100 rpm selama 16 jam. 1,5 ml kultur sel E. coli DH5α disentrifugasi pada kecepatan 5000 rpm selama 2 menit, pelet diresuspensi dengan 100 µl larutan A (glukosa 50 mM, Tris-Cl 25 mM pH 8 dan ethylenediamintetra-acetic acid [EDTA] 10 mM pH 8), lalu ditambahkan 150 µl larutan B (sodium dodecyl sulfat [SDS] 1% dan NaOH 0.2 N) untuk melisis sel, dan 200 µl larutan C (kalium asetat 5M dan asam asetat glasial pada pH 6), kemudian disentrifugasi pada kecepatan 12000 rpm selama 10 menit. Presipitasi plasmid dilakukan menggunakan etanol absolut (2 kali volume) dan sodium asetat 3 M (10% volume total), dan diinkubasi selama 12 jam pada suhu -20 0C, kemudian disentrifugasi pada kecepatan 12000 rpm selama 10 menit. Pelet dibilas dengan 1 ml etanol 70 %, kemudian dikeringudarakan selama 3 jam. Plasmid rekombinan diresuspensi dalam 20 µl ddH2O, lalu ditambahkan 0.2 µl RNase 1% (b/v). Verifikasi pertama kali dilakukan dengan pemotongan plasmid rekombinan menggunakan enzim restriksi EcoRI. Sebanyak 3 µl (± 120 ng) plasmid rekombinan hasil isolasi ditambahkan 2 µl bufer H (Promega), 0.2 µl Bouvine serum albumin (BSA) (Promega), 0.5 µl (6 unit)
Gambar 1. Skema konstruksi plasmid rekombinan pGEMT-Easy-14 dan pGEMT-Easy-38.0, dan kloning kedua ORF ke dalam sel E. coli DH5α.
Amplikon ORF 14 (1059 pb)
NdeI BamHI
Amplikon ORF 38.0 (1482 pb)
NdeI BamHI
E. coli DH5α yang membawa plasmid rekombinan
pGEMT-Easy-14
E. coli DH5α yang membawa plasmid rekombinan
pGEMT-Easy-38.0
TRANSFORMASI TRANSFORMASI
Nae 2707 XmnI2009
ScaI 1890
Nae 2707 XmnI2009
ScaI 1890
Nae 2707 XmnI2009
ScaI 1890
Nae 2707 XmnI2009
ScaI 1890
Ampr lacZ
Ampr lacZ
pGEMT-Easy-14 (4.1 kb)
lacZ Ampr
lacZ lacZ
Ampr ORI ORI
Plasmid rekombinan (pGEMT-Easy-14 dan pGEMT-Easy-38.0) yang telah diverifikasi menggunakan enzim restriksi
EcoRI, kemudian dipilh untuk pemotongan menggunakan enzim restriksi
BamHI dan NdeI (Promega) yang situs restriksinya terdapat pada primer spesifik kedua ORF. Sebanyak 3 µl (± 160 ng) plasmid rekombinan ditambahkan 2 µl bufer D (Promega), 0.2 µl BSA (Promega), 0.5 (5 unit) µl BamHI, 0.5 µl (5 unit) NdeI dan ddH2O hingga volume reaksi 20 µl. Campuran reaksi kemudian diinkubasi pada suhu 37 0C selama 12 jam.
PCR koloni menggunakan primer spesifik ORF 14 dan ORF 38.0 dilakukan untuk memastikan bahwa DNA sisipan adalah benar-benar ORF 14 dan ORF 38.0. Koloni putih E. coli DH5α yang telah diverifikasi menggunakan enzim restriksi
EcoRI, BamHI, dan NdeI kemudian disuspensikan kedalam 25 µl ddH2O dan dipanaskan pada suhu 95 0C selama 2 menit, 2.5 µl suspensi ditambahkan kedalam 22.5 µl reaksi PCR. Komposisi reaksi dan kondisi PCR dalam verifikasi sama dengan kondisi PCR yang digunakan untuk mengamplifikasi kedua ORF tersebut diatas. Visualisasi hasil restriksi dan PCR koloni dengan elektroforesis menggunakan gel agarosa 0.7% (b/v).
HASIL
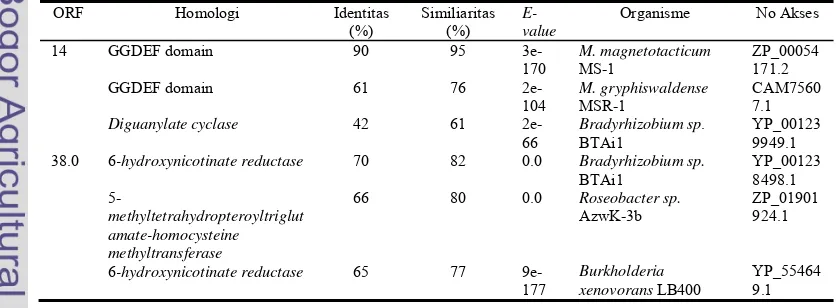
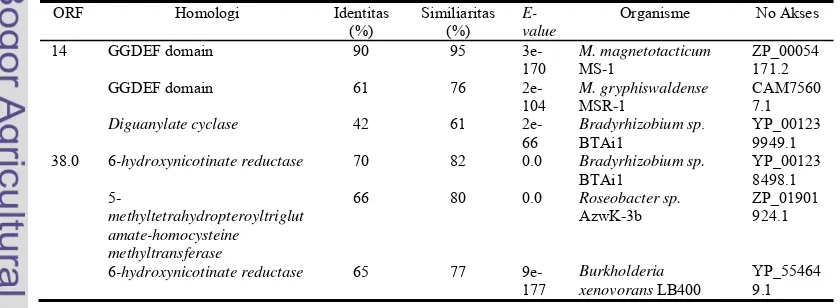
Hasil Analisis Bioinformatika Sekuen ORF 14 dan ORF 38.0. Hasil analisis bioinformatika menggunakan program BLASTX NCBI untuk ORF 14 menunjukkan sekuen tersebut mengkodekan protein yang memiliki homologi sebesar 90% dengan protein
berdomain GGDEF pada M. magnetotacticum MS-1, sedangkan ORF 38.0 mengkodekan protein yang memiliki homologi sebesar 70% dengan
6-hydroxynicotinate reductase pada
Bradyrhizobium sp. BTAi1 (Tabel 1). Sekuen asam amino yang dikode ORF 14 berdasarkan analisis program ScanProsite memiliki ukuran 352 asam amino dan memiliki satu domain GGDEF (Gambar 2 a). Sekuen asam amino yang dikode ORF 38.0 memiliki ukuran 493 asam amino. Berdasarkan analisis menggunakan program ScanProsite, protein yang dikode ORF tersebut adalah protein feredoksin (2Fe2S) (Gambar 2b).
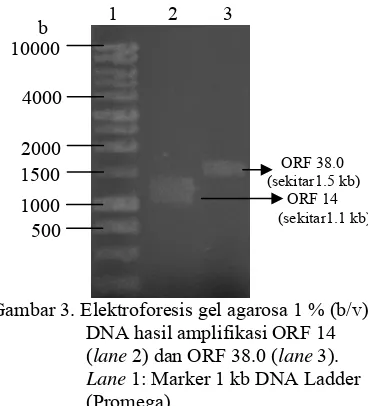
Amplifikasi ORF 14 dan ORF 38.0.
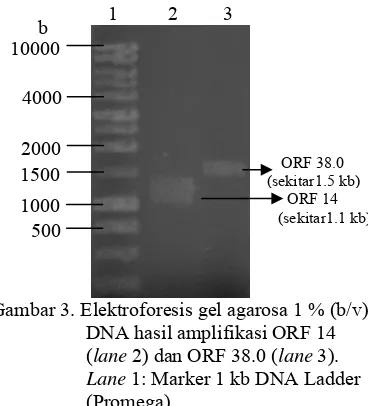
Visualisasi hasilamplifikasi ORF 14 dan ORF 38.0 pada gel agarosa 1% (b/v) menunjukkan pita berukuran sekitar 1.1 kb untuk ORF 14 dan sekitar 1.5 kb untuk ORF 38.0 (Gambar 3). Hal ini sesuai dengan ukuran sebenarnya kedua sekuen tersebut pada GenBank.
Kloning ORF 14 dan ORF 38.0 ke dalam sel E. coli DH5α. DNA hasil amplifikasi telah diligasikan kedalam vektor kloning pGEMT-Easy (3 kb), proses ligasi menghasilkan plasmid rekombinan pGEMT-Easy-14 dan pGEMT-Easy-38.0. Plasmid rekombinan yang dikonstruksi telah berhasil diintroduksikan ke dalam sel E. coli DH5α melalui metode kejutan panas (heat shock). Koloni E. coli DH5α yang membawa plasmid rekombinan terlihat berwarna putih pada media LA yang mengandung ampisilin (50 µg/ml) dan X-gal (40 µg/ml) (Gambar 4).
Tabel 1. Hasil Analisis Bioinformatika Sekuen ORF 14 dan ORF 38.0, diambil tiga hasil yang terbaik dari analisis menggunakan program BLASTX-NCBI.
ORF Homologi Identitas (%)
Similiaritas (%)
E-value
Organisme No Akses
14 GGDEF domain
GGDEF domain Diguanylate cyclase 90 61 42 95 76 61 3e-170 2e-104 2e-66 M. magnetotacticum MS-1 M. gryphiswaldense MSR-1
Bradyrhizobium sp. BTAi1 ZP_00054 171.2 CAM7560 7.1 YP_00123 9949.1 38.0 6-hydroxynicotinate reductase
5-methyltetrahydropteroyltriglut amate-homocysteine methyltransferase
6-hydroxynicotinate reductase
70 66 65 82 80 77 0.0 0.0 9e-177 Bradyrhizobium sp. BTAi1 Roseobacter sp. AzwK-3b Burkholderia xenovorans LB400
a)
(352 aa)GGDEF: (207-342) APLSLLMIDIDHFKQFNDTYGHQLGDQVLKLVARSLSEVAQAKDTAARYGGEEFAVILPA TPLEKSMEVAETIRNQVSTKRLTNrrtgqvLGQVTLSIGAALLREAEAPDSLVHRADEAM
YLAKRDGRNRVKSEID
b)
(493aa) Keterangan:
1.HDG (103-105) 2Fe2S 2.RGG (358-361) 2Fe2S 3.LGG (450-452) 2Fe2S 4.QVI (462-464) 2Fe2S 5.RNY (485-487) 2Fe2S
Gambar 2. Hasil analisis bioinformatika menggunakan program ScanProsite. a. Domain GGDEF yang dikode ORF 14, b. Feredoksin (2Fe2S) yang dikode ORF 38.0.
1 2 3
Gambar 3. Elektroforesis gel agarosa 1 % (b/v)
DNA hasil amplifikasi ORF 14 (lane 2) dan ORF 38.0 (lane 3). Lane 1: Marker 1 kb DNA Ladder (Promega).
Verifikasi Hasil Kloning ORF 14 dan ORF 38.0. Pemotongan plasmid rekombinan hasil isolasi dari beberapa koloni putih E. coli
DH5α yang diduga adalah pGEMT-Easy-14 menggunakan enzim restriksi EcoRI telah menghasilkan pita berukuran 3 kb yang menunjukkan ukuran pGEMT-Easy, pita berukuran sekitar 0.8 kb dan 0.3 kb yang menunjukkan bahwa ORF 14 (sekitar 1.1 kb) telah terpotong EcoRI (Gambar 5a). Visualisasi hasil restriksi plasmid rekombinan pada lane 2 gel agarosa (Gambar 5a) hanya memperlihatkan dua pita yaitu pGEMT-Easy dan fragmen DNA yang tidak sesuai dengan ukuran ORF 14 jika terpotong EcoRI, sehingga plasmid rekombinan pada lane 2 bukan pGEMT-Easy-14. Pemotongan plasmid rekombinan yang diduga adalah pGEMT-Easy-38.0 menggunakan enzim restriksi
EcoRI telah menghasilkan pita berukuran 3 kb yang menunjukkan pGEMT-Easy dan pita
berukuran sekitar 1.5 kb yang menunjukkan ukuran ORF 38.0 (Gambar 5b). Verifikasi kedua plasmid rekombinan menggunakan enzim restriksi NdeI dan BamHI masing-masing menghasilkan dua pita pada gel agarosa (Gambar 5c). Pita 3 kb (lane 2 &3) menunjukkan ukuran plasmid pGEMT-Easy, sedangkan pita berukuran sekitar 1.5 kb (lane
2) menunjukkan ukuran ORF 38.0 dan pita berukuran sekitar 1.1 kb (lane 3) menunjukkan ukuran ORF 14. PCR koloni menggunakan primer spesifik ORF 14 dan ORF 38.0 menghasilkan pita berukuran sekitar 1.1 kb untuk ORF 14 dan sekitar 1.5 kb untuk ORF 38.0 (Gambar 5d). Pemotongan plasmid rekombinan dan PCR koloni yang dilakukan dalam penelitian ini telah membuktikan bahwa ORF 14 dan ORF 38.0 dari M. magneticum AMB-1 telah berhasil diintroduksi ke dalam sel E. coli DH5α. 10000
4000
2000 1500
1000 500 b
ORF 38.0 (sekitar1.5 kb)
ORF 14 (sekitar1.1 kb)
Gambar 4. Koloni putih E. coli DH5α yang diduga membawa plasmid rekombinan (ditunjukan oleh panah merah).
100 aa
100 aa
1 2 3 4 5
PEMBAHASAN
Berdasarkan sekuen yang terdapat pada
GenBank, ORF 14 memiliki ukuran sebesar 1059 pasang basa (pb), sedangkan ORF 38.0 berukuran 1482 pb. Kedua ORF telah berhasil diamplifikasi dalam penelitian ini, elektroforesis gel agarosa menunjukkan pita DNA berukuran sekitar 1.1 kb untuk amplikon ORF 14 dan pita DNA berukuran sekitar 1.5 kb untuk amplikon ORF 38.0. Penentuan ukuran amplikon kedua ORF didasarkan pada pengamatan visual letak pita DNA terhadap marker (1 kb DNA Ladder Promega), terdapat kemungkinan perbedaan ukuran amplikon kedua ORF dengan ukuran kedua ORF pada
GenBank karena ada penambahan dari primer yang digunakan.
Analisis menggunakan program BLASTX NCBI dalam penelitian ini memperlihatkan sekuen tersebut mengkode protein yang memiliki homologi dengan protein berdomain GGDEF pada M. magnetotacticum MS-1. Hal ini ditunjukkan oleh nilai identitas (90 %) yang menunjukkan kesamaan sekuen asam amino dan nilai similiaritas (95 %) yang menunjukkan kesamaan struktur dan fungsi protein yang dikode ORF 14 dengan domain GGDEF. Nilai expectation value (e-value) menunjukkan jumlah pemasangan yang kemungkinan terjadi dengan sekuen yang ada di GenBank. Nilai e-value 0.0 menunjukkan kesamaan panjang kedua sekuen yang
1 2 3 4 5 1 2 3 4
a) Restriksi pGEMT-Easy-14 menggunakan EcoRI. b) Restriksi pGEMT-Easy-38 menggunakan EcoRI.
Lane 1: 1 kb DNA Ladder RealBiotech Lane 1: 1 kb DNA Ladder RealBiotech
Lane 3, 4, 5: Hasil Restriksi pGEMT-14 Lane 2, 3, 4: Hasil Restriksi pGEMT-38
1 2 3 1 2 3
c) Restriksi pGEMT-Easy-14 dan pGEMT-Easy-38.0 d) PCR koloni dari koloni putih E. coli DH5α menggunakan NdeI dan BamHI. Lane 1: 1 kb DNA Ladder RealBiotech
Lane 1: 1 kb DNA Ladder RealBiotech Lane 2: Amplikon ORF 14
Lane 2: Restriksi pGEMT-38.0 Lane 3: Amplikon ORF 38.0
Lane 3: Restriksi pGEMT-14
Gambar 5. Elektroforesis gel agarosa 0.7 % (b/v) DNA hasil verifikasi kloning ORF 14 dan 38.0 ke dalam E. coli DH5α.
pGEMT-Easy (3 kb)
Pita 0.8 kb ORF 14
Pita 0.3 kb ORF 14 3000
2000
1000
500
b b
pGEMT-Easy (3 kb)
ORF 38.0 (sekitar1.5 kb) 3000
2000
1000
500
pGEMT-Easy (3 kb)
ORF 38.0 (sekitar 1.5 kb) ORF 14 (sekitar1.1 kb) 3000
2000
1000
500 b
3000 2000
1000
500
dibandingkan pada analisis BLAST, dan merupakan nilai terbaik dalam menentukan homologi suatu sekuen DNA. Analisis menggunakan program ScanProsite juga memperlihatkan bahwa sekuen asam amino yang dikode ORF 14 mengkonservasi domain GGDEF pada asam amino ke-207 hingga asam amino ke-342, dan memiliki motif GGD/EF pada sekuen asam aminonya. Domain GGDEF berperan dalam sistem transduksi sinyal bakteri. Secara fungsional, domain GGDEF dalam sistem transduksi sinyal sama seperti situs katalisis pada adenilat siklase dan DNA polimerase, yaitu mengkatalisis pembentukan ikatan 3’-5’ fosfodiester. Domain GGDEF pada sel prokariot mengkatalisis pembentukan molekul c-diGMP dari dua molekul GTP (Chan et al
2004). c-diGMP merupakan molekul yang berfungsi sebagai second messenger pada sel prokariot (D’Argenio & Miller 2004). Biosintesis magnetosom memerlukan kespesifikan lingkungan seperti kondisi mikroaerofilik dan ketersediaan besi (Fe3+/Fe2+) (Wahyudi 2004b). Domain GGDEF pada bakteri magnet kemungkinan terlibat dalam merespon kondisi lingkungan seperti konsentrasi oksigen. Domain-domain yang terlibat dalam regulasi dan transduksi sinyal seperti GGDEF, EAL, HD-GYP, dan CheY pada M. magneticum AMB-1 berada dalam jumlah berlebihan dibandingkan dengan kelompok bakteri yang hidup bebas lainnya. Domain-domain tersebut terlibat dalam regulasi biosintesis magnetosom dan kemotaksis seperti merespon konsentrasi oksigen dan besi di lingkungan, juga berperan dalam magnetotaksis (Matsunaga et al. 2005). ORF 14 sebelumnya telah diidentifikasi Wahyudi (2004a) melalui mutagenesis menggunakan transposon. Penyisipan transposon pada ORF 14 menyebabkan ekspresi gen tersebut menghasilkan domain GGDEF tidak berlangsung, sehingga pembentukan c-diGMP yang merupakan
second messenger pada sistem transduksi sinyal tidak terjadi. Hal tersebut menyebabkan sel M. magneticum AMB-1 tidak dapat mensintesis magnetosom.
Analisis menggunakan program BLASTX NCBI memperlihatkan sekuen ORF 38.0 mengkode protein yang memiliki homologi dengan 6-hidroxynicotinate reductase pada
Bradyrhizobium sp BTAi1 dengan nilai e-value mencapai 0.0. 6-hydroxynicotinate reductase merupakan protein yang memiliki feredoksin dan berperan pada sistem transfer elektron (Alhapel 2006). Berdasarkan analisis
menggunakan program ScanProsite, sekuen asam amino yang dikode ORF 38.0 memiliki 2Fe2S feredoksin.
Enzim ini berperan dalam proses katabolisme nicotinate adenin dinucleotide
(NAD+) pada kondisi mikroaerofilik dengan mereduksi 6-hydroxynicotinate menjadi 1,4,5,6-tetrahydroxy-6-oxonicotinate.
Metabolisme NAD+ dilakukan untuk mensuplai kebutuhan sel akan nitrogen, karbon, dan energi (Alhapel 2006).
Kemampuan magneto-aerotaksis pada bakteri magnet membutuhkan regulasi yang kompleks dan kebutuhan energi yang besar. Sel bakteri magnet harus mensintesis magnetosom, mampu merespon medan magnet bumi menggunakan magnetosom, mendeteksi perubahan konsentrasi oksigen, mengirimkan seluruh informasi tesebut ke flagela dan menggerakkan flagela sehingga bakteri magnet dapat memilih lingkungan mikroaerofilik untuk pertumbuhan yang optimal (Matsunaga et al 2005).
ORF 14 dan ORF 38.0 dalam penelitian ini berhasil diamplifikasi dan diintroduksi ke dalam sel E. coli DH5α menggunakan vektor kloning pGEMT-Easy. Kloning molekuler kedalam sel E. coli DH5α dilakukan dengan tujuan membentuk klon, sehingga DNA rekombinan (Easy-14 & pGEMT-Easy-38.0) yang membawa kedua ORF dapat diperbanyak dan disimpan dalam keadaan stabil untuk jangka waktu yang panjang (Dawson et al. 1996).
Seleksi sel E. coli DH5α yang membawa plasmid rekombinan dapat dilakukan karena vektor pGEMT-Easy memiliki gen resisten ampisilin, sehingga koloni yang tumbuh pada media LA mengandung ampisilin adalah koloni yang membawa vektor pGEMT-Easy.
Multicloning site (MCS) pada pGEMT-Easy berada pada gen lacZ. Penyisipan ORF 14 atau ORF 38.0 pada gen lacZ menyebabkan tidak adanya α-komplementasi antara plasmid rekombinan dan sel inang dalam pembentukan enzim β-galactosidase. Hal ini menyebabkan senyawa X-gal yang terdapat pada media LA tidak dapat dipecah. Pemecahan senyawa X-gal akan mengubah koloni E. coli DH5α yang membawa plasmid nonrekombinan menjadi biru (Turner et al. 1997), sedangkan koloni putih adalah E. coli DH5α yang diduga membawa plasmid rekombinan (pGEMT-Easy-14 atau pGEMT-Easy-38.0).
mendalam terhadap peranan kedua ORF terebut dalam biosintesis magnetosom pada
M. magneticum AMB-1.
SIMPULAN
Analisis bioinformatika menunjukkan ORF 14 mengkode protein yang memiliki homologi sebesar 90% dengan domain GGDEF pada M. magnetotacticum MS-1. Sedangkan ORF 38.0 mengkode protein yang memiliki homologi sebesar 70% dengan
6-hidroxynicotinate reductase pada
Bradyrhizobium sp. BTAi1. Kedua ORF telah berhasil diamplifikasi menggunakan primer spesifik berdasarkan sekuen dua ORF yang digunakan dalam penelitian ini, dan berhasil diintroduksi ke dalam sel E. coli DH5α menggunakan vektor kloning pGEMT-Easy.
SARAN
Ekspresi ORF 14 dan ORF 38.0 perlu dilakukan untuk mengkarakterisasi protein yang dikodekan kedua ORF tersebut. Hal ini akan berguna dalam mempelajari peranan ORF 14 dan ORF 38.0 dalam biosintesis magnetosom pada M. magneticum AMB-1.
DAFTAR PUSTAKA
Alhapel A et al. 2006. Molecular and functional analysis of nicotinate catabolism in Eubacterium barkeri. Proc Natl Acad Sci 103: 12341-12346.
Bazylinski DA, Frankel RB. 2004. Magnetosom formation in prokaryotes.
Nat Rev Microbiol 2: 217-230.
Blakemore RP. 1975. Magnetotactic bacteria.
Science 190:377-379.
Burgess JG, Kawaguchi R, Sakaguchi T, Thornhill RH, Matsunaga T. 2007. Evolutionary Relationships among Magnetospirillum Strains Inferred from Phylogenetic Analysis of 16S rDNASequences. J Bacteriol 175: 6689-6694.
Chan et al. 2004. Structural basis of activity and allosteric control of diguanylate cyclase. Proc Natl Acad Sci 101:17084-17089.
D’Argenio DA, Miller SI. 2004. Cyclic di-GMP as a bacterial second messenger.
Microbiology 150: 2497-2502.
Dawson MT, Powell R, Gannon F. 1996.
Gene Technology. Graham JM, Bilington D, Gilmartin PM, editor. Oxford: BIOS Scientific Publ. Ltd. hlm 91-95.
Gorby YA, Beveridge TJ, Blakemore RP. 1998. Characterization of bacterial magnetosome membrane. J Bacteriol
170:834-841.
Grünberg K, Wawer C, Tebo M B, Schuler D. 2001. A large gene cluster encoding several magnetosome proteins is conserved in different species of magnetotactic bacteria. Appl Environ Microbiol 67: 4573-4582.
Komeili A, Li Z, Newman DK, Jensen GJ. 2006. Magnetosome are cell membrane invaginations organized by the actin-like protein Mam. Nature 311:342-343.
Matsunaga T, Sakaguchi T, Todokoro F. 1991. Magnetite formation by a magnetic bacterium capable of growing aerobically.
Appl Microbiol Biotechnol 35:651-655. Matsunaga et al. 2005. Complete genome
sequence of the falcutative anaerobic magnetotactic bacterium Magnetispirillum
sp. strain AMB-1. DNA Res 12:157-166. Sambrook W, Russel DW. 1989. Molecular
Cloning: A Laboratory Manual. Vol 1. Ed e-3. New York: Cold Spring Harbor Laboratory.
Schuler D, Baeurlein E. 1998. Iron-limited growth and kinetics of iron uptake in
Magnetospirillum gryphiswaldense. Arhc Microbiol 166:301-307.
Smith et al. 2006. Quantifying the Magnetic Advantage in Magnetotaxis. Biophys J 91: 1098–1107.
Turner PC, Mc Lennan, Bates AD. White MRH. 1997. Instant Notes in Molecular Biology. Washington: BIOS Scientific. Wahyudi AT, Takeyama H, Okamura Y,
Fukuda Y, Matsunaga T. 2003. Characterization of aldehyde ferredoxin oxidoreductase gene defective mutant in
Magnetospirillum magneticum AMB-1.
Biochem Biophys Res Commun 303:223-229.
Wahyudi AT. 2004a. Genome-wide screening of genes involved in magnetite synthesis in
Magnetispirillum magneticum AMB-1 [disertasi]. Tokyo University of Agriculture and Technology. Japan.
Lampiran 1. Peta keseluruhan genom M. magneticum AMB-1 (Matsunaga et al 2005).
Keterangan:
1. Ukuran genom: 4967148 pb; tidak memiliki plasmid. 2. % GC DNA genom: 65.09 %
% GC ORFs: 65.55 %
3. Jumlah ORF: 4472 (lingkaran 1 dan 2).
4. Sebanyak 36 ORF terlibat dalam biosintesis magnetosom, dan tersebar pada genom M. magneticum AMB-1 (lingkaran 6 dan 7).
Lampiran 3. Penempelan primer spesifik ORF 14 dan 38.0.
ORF 14 (1059 pb)
ATGAAGAGTCCGGATACCCTTGATGTCGCCGCCCATTGCGCCCGGGCGGCGCTGG CCATGATGGAGCGGCACAAGGTGCCGCCCCATCCCGAGAATTACGCCATCTGGTACGCCTATGTGGCCG GGCGCAATCCGGACCTGACCGCCGCCATCGACGCCATCTTGCAATCGGGCAAGAAGTTCACAGCCAAG GTCAATGACGAACTCTACGAGCGCTTTGCCGTCTTCCCCCAGGACACTGCCGAACTGCGCGAAGTGGGC CAGCGGGTCGAGGAGGCGGTGGGGCGCGTGCTGGAATACCTGAGCAACGCCAACCAGGGCACCAGCAA TTACGGCGCAGCCCTGGAGGATTTCAGCGGCAAGCTGGCCGACGGGCCGTCCGCCGCCGGGTTGTCCGA ACTGATCTCGGGCATCCTGGCCGAGACCAAGGTGATGGCCGATCTGAACCGGCAACTGGAACAGCGCC TGGAAAACTCGTCCAACGAGGTGGCGCGGCTGCGCAACCACCTGGACGACCTGAAGCGCGAGGCCTCC ACCGACGCCCTGACCCAGTTGGCCAACCGCAAGCTGTTCGATCACTCGCTCAATCTGGCGGTGCTCGAC GCCAGGGCGGCGGATGCGCCGCTGTCGCTGCTGATGATCGACATCGATCACTTCAAGCAGTTCAACGAC ACCTACGGCCACCAGCTGGGCGATCAGGTGCTGAAGCTGGTGGCGCGCTCGCTCTCCGAGGTGGCCCAG GCCAAGGATACCGCCGCCCGCTATGGTGGCGAGGAATTCGCGGTGATCCTGCCCGCCACGCCCCTGGAG AAGTCCATGGAGGTGGCGGAAACCATCCGCAATCAGGTCTCCACCAAGCGGCTGACCAACCGTCGCAC TGGTCAGGTCCTGGGCCAGGTGACCCTGTCCATCGGCGCCGCCCTGCTTCGGGAGGCCGAGGCCCCCGA TTCCCTGGTCCACCGCGCCGACGAGGCCATGTATCTCGCCAAGCGCGACGGCCGCAACCGGGTGAAGA GCGAGATCGACCTGGAAAAGCCAACGGGCGAAGCGGCGAAATAG
5’-GGG-GGA-CATATGAAG AGT CCGGAT ACC
CCG CTT CG C CGCTTT ATCAAACCTAGG-GGG-5’
ORF 38.0 (1482 pb)
ATGAGCGACGTCGTCGAAGCCGGCATCATCAATTGCGACGCCTGCCCGGTGCTGTGCCGCAT CCGCGAGGGGCGTTCGGGGGCCTGCGACCGCTATGCCAATACCGGCGGCACGCTCACCCGCGT CGACCCGCTGGTGGTGGTCCAGGCCATCAAGGAGAAGGACGGCAAGCTGATCCCCTTCCTGTCCACCGA CCGGGAATGGGACGGCGCCGTGGTCTCCAACTCGCCCACCTTCATCACCGGCATCGGCGCGTCGACCACT TATCCCGATTACAAGCCCGCCCCCTTCATCGTCGCGGCCGAGCATGACGGCGTCGACATGGTCACCGTGG TGACCGAAGGCATCTTCAGCTATTGCGCCGTCAAGGTGAAGATCGACACCGACCGCTTCTTAGGCCCGGA ACAGTCCACGGTGAGGGCGGGCGGCGAGGCGGTGGGCCATGTGACCACCAGCGAGTACGGCTCGCAAAT GCTGTCCATCGGCGGCGTCCACCATCTGACCGGCGGCTCCAAGAAGGAGGGCAAGCTCACCTGCGACAC CATGCTGGCGCTGTGCAACAAGCAGGCGGTGGAGCTGACCATCGATAACGGCGCCACCGTGGTGGTCCA GGCGGGTCAGGCCCCCATCGTCAACGGCACCGTCGAGGAACGCATGCGGGTGGGCTGCGGCTCGGCCAC CATCGGCATGTTCGCCAAGCAATGGTTCGGGCTGGTGGAAGAGGTGGTGGTGGTCGACGACCACATCAC CGGCCTGCTGTCCGAGCACAAGGCCGGACGCTATCTCGGCATCGAGGACAGCGGCGCGGTGATCCGCGG CCGCCGCTCGACGCTGGGGCGCTATTTCCAGGTGGCAGAGCCGGGGACCGGCTGGGGCGGCACCAACAT CACCGACCCGCTGTCCATCCTCGACCCATTCAATCCCAAGGTGGCCAAGCCCGGCCATCGCCTGCTGATG GTCAGCACCACCGGCGAACATGCCGGCTATTACGTCCTGGATCAGGACCTGAAGCCGGTGGAGGCCGAG ATGCCCGCCGCCGTGGCCGCCACGGTGGAGCGCATGCGCGAGAATTGCGAGGCGGCGCTCTGCTCGGTG GTGTTCATCGCCGGAGCGGGCGGCTCGCTGCGGGCCGGGGTCACCGAGAACCCGGTCAAGCTGACCCGC TCGGTCAAGGACTCACTGACCCTGGTCACCAGCGGCGGCGCCCCGGTCTATGTCTGGCCGGGCGGCGGCA TCACCTACATGGTCGACGTGCTGCGCATGCCCGACCACTCGTTCGGCGCCGTGCCCACCCCCGCTTTGGT GGCGCCCATCGAGTTCACCATGCGCCTCGACGACTATCGCGCCCTGGGCGGCCACATGGATGCCGTGGTG CGGCTGGAGCAGGTCATCAATCAGGATCGGCGCAAATCGGTGCAATGGGACCCGGACAATCCCTGGCCC ATGCTGAAGCGGAACTACAAGTGGGGGGACGACACGTGA
5’-GGG-GGA-CATATG AGC GACGTC GTCGAA
Magnetospirillum magneticum
AMB-1 DI
Escherichia coli
YONATAN BANOET
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Magnetosom pada Magnetospirillum magneticum AMB-1 di Esherichia coli. Dibimbing oleh ARIS TRI WAHYUDI dan UTUT WIDYASTUTI.
Magnetospirillum magneticum AMB-1 adalah salah satu strain bakteri magnet yang mampu mensintesis magnetosom. Magnetosom pada M. magneticum AMB-1 merupakan partikel magnetit berukuran nano yang diselimuti membran, dan mampu memberikan kemampuan magneto-aerotaksis pada bakteri magnet. Pembentukan magnetosom pada sel bakteri magnet dikontrol secara genetik. Sampai saat ini telah diketahui setidaknya ada 36 gen yang terlibat dalam biosintesis magnetosom, dua open reading frame (ORF) diantaranya adalah ORF 14 dan ORF 38.0. Kedua ORF tersebut dalam penelitian ini dianalisis secara bioinformatika dan diintroduksikan kedalam sel E. coli DH5Į menggunakan vektor kloning pGEMT-Easy.
Hasil analisis bioinformatika untuk ORF 14 menunjukkan bahwa gen tersebut mengkode protein yang memiliki homologi sebesar 90% dengan domain GGDEF pada
Magnetospirillum magnetotacticum MS-1. Sedangkan hasil analisis bioinformatika untuk ORF 38 menunjukkan bahwa gen tersebut memiliki homologi sebesar 70% dengan
6-hydroxynicotinate reductase pada Bradyrhizobium sp. BTAi1. Verifikasi hasil kloning kedua ORF dilakukan melalui pemotongan plasmid rekombinan menggunakan enzim restriksiEcoRI,NdeI, dan BamHI; serta PCR koloni. Verifikasi hasil kloning membuktikan bahwa kedua ORF telah berhasil diintroduksi ke dalam sel E. coli DH5Į.
ABSTRACT
YONATAN BANOET. The Cloning of Two Candidate Genes that Involved in Magnetosomes Biosynthesizes of Magnetospirillum magneticum AMB-1 to Escherichia coli. Supervised by ARIS TRI WAHYUDI and UTUT WIDYASTUTI.
Magnetospirillum magneticum AMB-1 is a magnetotactic bacterium that synthesizes nanoscale magnetites particles enveloped by membrane, called as magnetosomes. Magnetosomes are membranous bacterial organelles that allow magneto-aerotaxis in magnetotactic bacteria. The formation of magnetosomes in magnetotactic bacteria was genetically controlled. There are 36 genes from the genome of M. magneticum
AMB-1 that involved in magnetosomes formation, two open reading frames from those genes referred to ORF 14 and ORF 38.0. Here in, bioinformatics analysis was done to analyze ORF 14 and ORF 38.0. These genes were amplified by polymerase chain reaction and cloned in Escherichia coli DH5Į using pGEMT-Easy as a Cloning Vector System.
Kelompok bakteri magnet merupakan bakteri gram negatif dan termasuk ke dalam grup α-proteobakteria (Burgess et al. 2007). Bakteri magnet memiliki habitat di perairan tawar dan laut. Kelompok bakteri magnet memilih lingkungan mikroaerofilik atau anaerob seperti sedimen dan memiliki ketergantungan terhadap unsur-unsur mineral dalam perairan, terutama terhadap besi (Schuler & Baeurlein 1998).
Bakteri magnet memiliki kemampuan untuk merespon medan magnet dan cenderung bermigrasi sepanjang garis bidang magnet bumi (Blakemore 1975). Hal ini dikarenakan kemampuan kelompok bakteri tersebut mensintesis magnetosom. Magnetosom merupakan partikel magnetit (Fe3O4) atau greigit (Fe3S4), dan dilapisi membran fesikel yang berasal dari invaginasi membran sitoplasma (Gorby et al. 1998, Komeili et al. 2006). Umumnya magnetosom tersusun berantai dalam sel, terdiri dari 15 sampai 20 partikel magnet berukuran antara 20 hingga 50 nm. Magnetosom berperan seperti jarum kompas yang mengorientasikan bakteri magnet pada medan magnet bumi, sehingga bakteri magnet dapat memilih lingkungan mikroaerofilik yang menjadi habitatnya (Bazylinski & Frankel 2004, Smith et al. 2006).
Salah satu strain bakteri magnet yang sering dijadikan model dalam biosintesis magnetosom adalah Magnetospirillum magneticum AMB-1. Strain tersebut bersifat anaerob fakultatif, mampu tumbuh dalam kondisi aerob, namun tidak dapat mensintesis magnetosom. Strain tersebut juga mudah dikulturkan di laboratorium (Matsunaga et al. 1991). Partikel magnetosom dalam sel M. magneticum
AMB-1 berupa magnet magnetit (Fe3O4) dan tersusun berbentuk rantai memanjang searah panjang sel (Wahyudi et al. 2003).
Matsunaga et al. (2005) telah mensekuen keseluruhan DNA genom M. magneticum AMB-1. Ukuran genom total
M. Magneticum AMB-1 adalah 4. 9 Mb. Berdasarkan studi genetik terhadap pembentukan magnetosom pada M. magneticum AMB-1 melalui mutagenesis menggunakan transposon, setidaknya ada 36 gen yang terlibat dalam biosintesis magnetosom dan tersebar pada genom
magnetosom melalui mutagenesis menggunakan transposon adalah ORF 14 dan ORF 38.0 (Wahyudi 2004a).
Penelitian ini menggunakan sekuen ORF 14 dan 38.0 yang terdapat pada Gen Bank untuk dianalisis secara bioinformatika. Kedua ORF akan diintroduksikan ke dalam sel Esherichia coli DH5α menggunakan vektor kloning pGEMT-Easy. Kloning molekuler yang dilakukan dalam penelitian ini akan berguna dalam telaah lanjutan mengenai peranan kedua ORF dalam biosintesis magnetosom pada M. magneticum AMB-1.
Biosintesis magnetosom pada bakteri merupakan proses kompleks yang diregulasi secara genetik. Sampai saat ini mekanisme dalam pembentukan magnetosom belum dapat dipahami sepenuhnya (Grünberg 2001, Wahyudi 2004b). Sehingga diperlukan telaah molekuler seperti isolasi, kloning molekuler, dan karakterisasi tiap gen yang terlibat biosintesis magnetosom.
Tujuan
Melakukan analisis bioinformatika dan melakukan kloning molekuler terhadap dua ORF yang terlibat dalam biosintesis magnetosom.
BAHAN DAN METODE Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Febuari hingga Juli 2008 di Laboratorium Bagian Mikrobiologi Departemen Biologi, FMIPA, IPB.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah genom M. magneticum AMB-1, sekuen ORF 14 (gene id: amb0759) dan ORF 38.0 (gene id: amb1482), galur Escherichia coli
DH5α, media Luria Agar (LA) (NaCl 10 g/L, Bacto Trypton 10 g/L, Yeast extract 5 g/L dan Bacto Agar 15 g/L) dan Luria Broth (LB), ampisilin (5 mg/ml), pGEMT-Easy (Promega) (Lampiran 2), gel agarosa,
KIT-Kelompok bakteri magnet merupakan bakteri gram negatif dan termasuk ke dalam grup α-proteobakteria (Burgess et al. 2007). Bakteri magnet memiliki habitat di perairan tawar dan laut. Kelompok bakteri magnet memilih lingkungan mikroaerofilik atau anaerob seperti sedimen dan memiliki ketergantungan terhadap unsur-unsur mineral dalam perairan, terutama terhadap besi (Schuler & Baeurlein 1998).
Bakteri magnet memiliki kemampuan untuk merespon medan magnet dan cenderung bermigrasi sepanjang garis bidang magnet bumi (Blakemore 1975). Hal ini dikarenakan kemampuan kelompok bakteri tersebut mensintesis magnetosom. Magnetosom merupakan partikel magnetit (Fe3O4) atau greigit (Fe3S4), dan dilapisi membran fesikel yang berasal dari invaginasi membran sitoplasma (Gorby et al. 1998, Komeili et al. 2006). Umumnya magnetosom tersusun berantai dalam sel, terdiri dari 15 sampai 20 partikel magnet berukuran antara 20 hingga 50 nm. Magnetosom berperan seperti jarum kompas yang mengorientasikan bakteri magnet pada medan magnet bumi, sehingga bakteri magnet dapat memilih lingkungan mikroaerofilik yang menjadi habitatnya (Bazylinski & Frankel 2004, Smith et al. 2006).
Salah satu strain bakteri magnet yang sering dijadikan model dalam biosintesis magnetosom adalah Magnetospirillum magneticum AMB-1. Strain tersebut bersifat anaerob fakultatif, mampu tumbuh dalam kondisi aerob, namun tidak dapat mensintesis magnetosom. Strain tersebut juga mudah dikulturkan di laboratorium (Matsunaga et al. 1991). Partikel magnetosom dalam sel M. magneticum
AMB-1 berupa magnet magnetit (Fe3O4) dan tersusun berbentuk rantai memanjang searah panjang sel (Wahyudi et al. 2003).
Matsunaga et al. (2005) telah mensekuen keseluruhan DNA genom M. magneticum AMB-1. Ukuran genom total
M. Magneticum AMB-1 adalah 4. 9 Mb. Berdasarkan studi genetik terhadap pembentukan magnetosom pada M. magneticum AMB-1 melalui mutagenesis menggunakan transposon, setidaknya ada 36 gen yang terlibat dalam biosintesis magnetosom dan tersebar pada genom
magnetosom melalui mutagenesis menggunakan transposon adalah ORF 14 dan ORF 38.0 (Wahyudi 2004a).
Penelitian ini menggunakan sekuen ORF 14 dan 38.0 yang terdapat pada Gen Bank untuk dianalisis secara bioinformatika. Kedua ORF akan diintroduksikan ke dalam sel Esherichia coli DH5α menggunakan vektor kloning pGEMT-Easy. Kloning molekuler yang dilakukan dalam penelitian ini akan berguna dalam telaah lanjutan mengenai peranan kedua ORF dalam biosintesis magnetosom pada M. magneticum AMB-1.
Biosintesis magnetosom pada bakteri merupakan proses kompleks yang diregulasi secara genetik. Sampai saat ini mekanisme dalam pembentukan magnetosom belum dapat dipahami sepenuhnya (Grünberg 2001, Wahyudi 2004b). Sehingga diperlukan telaah molekuler seperti isolasi, kloning molekuler, dan karakterisasi tiap gen yang terlibat biosintesis magnetosom.
Tujuan
Melakukan analisis bioinformatika dan melakukan kloning molekuler terhadap dua ORF yang terlibat dalam biosintesis magnetosom.
BAHAN DAN METODE Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Febuari hingga Juli 2008 di Laboratorium Bagian Mikrobiologi Departemen Biologi, FMIPA, IPB.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah genom M. magneticum AMB-1, sekuen ORF 14 (gene id: amb0759) dan ORF 38.0 (gene id: amb1482), galur Escherichia coli
DH5α, media Luria Agar (LA) (NaCl 10 g/L, Bacto Trypton 10 g/L, Yeast extract 5 g/L dan Bacto Agar 15 g/L) dan Luria Broth (LB), ampisilin (5 mg/ml), pGEMT-Easy (Promega) (Lampiran 2), gel agarosa,
KIT-Polymerase Chain Reaction (PCR) (TAKARA La Taq), primer spesifik (forward dan reverse) yang didesain berdasarkan sekuen ORF 14 dan 38.0, Geneaid Gel/PCR Fragments Extraction Kit, bufer transformasi (0.1 M CaCl2, 5 mM MgCl2, 5mM Tris-Cl pada pH 7), enzim restriksi EcoRI, NdeI dan BamHI (Promega). Alat-alat yang digunakan dalam penelitian ini adalah mesin sentrifuse (Jouan A14), mesin PCR 2400 (Perkin-Elmer), piranti elektroforesis (BioRad), dan peralatan yang umum digunakan di laboratorium mikrobiologi.
Metode
Analisis Bioinformatika Sekuen ORF 14 dan ORF 38.0. Analisis bioinformatika sekuen ORF 14 (gene id: amb0759) dan ORF 38.0 (gene id: amb1482) menggunakan program Bioedit, ScanProsite yang tersedia di situs www.expasy.org, dan BLASTX yang tersedia di situs www.ncbi.nlm.nih.gov.
Amplifikasi ORF 14 dan ORF 38.0 dengan Polymerase chain reaction. Amplifikasi ORF 14 (1059 bp) dan ORF 38.0 (1482 bp) dilakukan dengan mencampurkan berturut-turut 1.25 µl ddH2O, 12.5 µl bufer PCR GC II, 4 µl (2.5 mM) dNTPs, 0.25 µl (5 unit/µl) enzim LA Taq DNA Polymerase, 1 µl (10 pmol) primer spesifik (forward dan reverse) masing-masing ORF, dan 5 µl (0.5 µg) DNA template. Sekuen primer spesifik ORF 14 yaitu forward: GGG GGA CAT ATG AAG AGT CCG GAT ACC;
reverse: GGG GGA TCC AAA CTA TTT CGC CGC TTC GCC. Sedangkan sekuen primer spesifik ORF 38.0 yaitu forward: GGG GGA CAT ATG AGC GAC GTC GTC GAA; reverse: GGG GGA TCC AAA TCA CGT GTC GTC CCC CCA. Sekuen kedua primer yang digunakan dalam penelitian ini memiliki situs restriksi enzim NdeI (forward, terlihat pada basa yang digarisbawahi) dan BamHI (reverse, terlihat pada basa yang digaris bawahi) (Lampiran 3).
Tahap awal dalam reaksi PCR adalah pradenaturasi pada suhu 95 0C selama 2 menit. Selanjutnya reaksi PCR dilakukan sebanyak 30 siklus, tiap siklus terdiri dari tahap denaturasi, annealing, dan elongasi. Denaturasi kedua DNA dilakukan pada suhu 950C selama 2 menit, annealing pada
suhu 580C selama 1 menit, dan elongasi pada suhu 720C selama 1 menit. Tahap terakhir dilakukan pada suhu 720C selama 10 menit.
Produk PCR dielektroforesis pada gel agarosa 1% (b/v). Proses selanjutnya adalah purifikasi produk PCR dari gel agarosa menggunakan PCR Fragments Extraction Kit (Geneaid). Setelah dielektroforesis, gel berisi pita DNA hasil PCR dipotong dan dimasukkan ke dalam tabung mikro 1.5 ml. Kemudian, ke dalam tabung tersebut ditambahkan 500 µl DF Buffer, lalu diinkubasi pada suhu 600C selama 10 menit. Setelah gel larut, tabung mikro diinkubasikan hingga suhunya sama dengan suhu ruang. Pengikatan DNA dilakukan dengan memasukkan campuran gel ke dalam tabung penampung yang dilengkapi DFkolom. Selanjutnya tabung penampung disentrifugasi pada kecepatan 13000 rpm selama 30 detik. Cairan yang tertampung dibuang, kemudian DFkolom dimasukkan kembali ke dalam tabung penampung. Proses pencucian dilakukan dengan menambahkan 600 µl Wash Buffer
pada DFkolom dan disentrifugasi pada kecepatan 13000 rpm selama 30 detik. Cairan yang tertampung dibuang, kemudian Dfkolom dikembalikan ke tabung penampung dan disentrifugasi selama 3 menit untuk mengeringkan membran pada DFkolom. DFkolom dipindahkan ke tabung mikro steril, lalu 30 µl Elution Buffer ditambahkan di tengah-tengah membran Dfkolom, untuk proses elusi. Kemudian diinkubasi pada suhu ruang selama 2 menit dan disentrifugasi selama 1 menit pada kecepatan 13000 rpm. DFkolom dibuang dan DNA yang tertampung disimpan pada suhu -200C.
Kloning ORF 14 dan ORF 38.0 ke dalam sel E. coli DH5α. Amplikon hasil purifikasi diligasi ke dalam vektor kloning pGEMT-Easy. Ligasi ORF 14 ke plasmid pGEMT-Easy dilakukan dengan mencampurkan berturut-turut 5 µl 2x
Rapid Ligation Buffer (Promega), 0.53 µl (53 ng) DNA sisipan, 1 µl (3 Weiss Unit/µl) enzim T4 DNA ligase (Promega), 1 µl (50 ng) vektor kloning pGEMT-Easy (Promega). Campuran kemudian dilarutkan dengan ddH2O hingga volume reaksi 10 µl. Ligasi ORF 38.0 ke plasmid pGEMT- Easy dilakukan dengan mencampurkan berturut-turut 5 µl 2x
DNA sisipan, 1 µl (3 Weiss Unit/µl) enzim T4 DNA ligase, dan 1 µl (50 ng) vektor kloning pGEMT-Easy. Campuran kemudian dilarutkan dengan ddH2O hingga volume reaksi 10 µl. Inkubasi dilakukan pada suhu 15 0C selama 12 jam. Ligasi ORF 14 dan ORF 38.0 ke dalam pGEMT-Easy akan menghasilkan plasmid rekombinan pGEMT-Easy-14 dan pGEMT-Easy-38.0 (Gambar1). Plasmid rekombinan kemudian diintroduksikan kedalam sel E. coli DH5α (Gambar 1) menggunakan metode kejutan panas (Sambrook & Russel 1989).
Tahap awal dalam introduksi kedua plasmid rekombinan ke dalam sel E. coli
DH5α adalah pembuatan sel kompeten (Sambrook & Russel 1989). Satu koloni E. coli DH5α dikulturkan kedalam 2 ml media LB, lalu diinkubasi pada suhu 37 0C dan kecepatan 100 rpm selama 16 jam. Setelah 16 jam, 0.5 ml kultur dipindahkan ke dalam 50 ml media LB, dan diinkubasi selama 3 jam pada suhu 37 0C dan kecepatan 100 rpm. Sebanyak 1.5 ml kultur dipindahkan kedalam tabung mikro steril dan disentrifugasi pada kecepatan 3000 rpm selama 10 menit. Pelet yang didapat kemudian diresuspensi dengan 1 ml bufer transformasi (0.1 M CaCl2, 5 mM MgCl2, 5mM Tris-Cl pada pH 7) dingin lalu diinkubasi dalam es selama 20 menit, dan disentrifugasi kembali pada kecepatan 3000 rpm selama 10 menit. Pelet yang didapatkan kemudian diresuspensi dengan 250 µl bufer transformasi dingin selama 10 menit. Setelah diinkubasi dalam es, sel
E. coli DH5α telah kompeten dan siap diintroduksi dengan plasmid rekombinan. Sebanyak 250 µl sel E. coli yang telah dibuat kompeten dicampurkan dengan 10 µl plasmid rekombinan dan diinkubasi pada suhu 420C selama 45 detik, kemudian diinkubasikan kembali dalam es selama 2 menit. 100 µl media LB ditambahkan kedalam suspensi dan diinkubasi pada inkubator bergoyang selama 24 jam pada suhu 370C. Suspensi selanjutnya disentrifugasi pada 8000 rpm selama 2 menit, pelet diresuspensi dengan 100 µl media LB, kemudian sebanyak 100 µl suspensi disebarkan pada media LA + Amp 50 µg/ml + X-gal 40 µg/ml.
Verifikasi Hasil Kloning ORF 14 dan ORF 38.0. Verifikasi dilakukan untuk memastikan bahwa koloni putih E. coli
DH5α yang tumbuh pada media LA
diduga membawa plasmid rekombinan pGEMT-Easy-14 dan pGEMT-Easy-38.0. Verifikasi dilakukan dengan pemotongan plasmid rekombinan menggunakan enzim restriksi EcoRI (5‘ G–A–A–T–T–C 3‘),
BamHI (5; G–G–A–T–C–C 3‘), dan NdeI (5‘ C–A–T–A–T–G 3‘) (Promega), dan PCR koloni menggunakan primer spesifik untuk mengamplifikasi kedua ORF.
Isolasi plasmid rekombinan menggunakan metode Sambrook & Russel (1989) dilakukan dengan mengkulturkan koloni putih yang tumbuh ke dalam 10 ml media LB, lalu diinkubasi pada suhu 37 0C dan kecepatan 100 rpm selama 16 jam. 1,5 ml kultur sel E. coli DH5α disentrifugasi pada kecepatan 5000 rpm selama 2 menit, pelet diresuspensi dengan 100 µl larutan A (glukosa 50 mM, Tris-Cl 25 mM pH 8 dan ethylenediamintetra-acetic acid [EDTA] 10 mM pH 8), lalu ditambahkan 150 µl larutan B (sodium dodecyl sulfat [SDS] 1% dan NaOH 0.2 N) untuk melisis sel, dan 200 µl larutan C (kalium asetat 5M dan asam asetat glasial pada pH 6), kemudian disentrifugasi pada kecepatan 12000 rpm selama 10 menit. Presipitasi plasmid dilakukan menggunakan etanol absolut (2 kali volume) dan sodium asetat 3 M (10% volume total), dan diinkubasi selama 12 jam pada suhu -20 0C, kemudian disentrifugasi pada kecepatan 12000 rpm selama 10 menit. Pelet dibilas dengan 1 ml etanol 70 %, kemudian dikeringudarakan selama 3 jam. Plasmid rekombinan diresuspensi dalam 20 µl ddH2O, lalu ditambahkan 0.2 µl RNase 1% (b/v). Verifikasi pertama kali dilakukan dengan pemotongan plasmid rekombinan menggunakan enzim restriksi EcoRI. Sebanyak 3 µl (± 120 ng) plasmid rekombinan hasil isolasi ditambahkan 2 µl bufer H (Promega), 0.2 µl Bouvine serum albumin (BSA) (Promega), 0.5 µl (6 unit)
Gambar 1. Skema konstruksi plasmid rekombinan pGEMT-Easy-14 dan pGEMT-Easy-38.0, dan kloning kedua ORF ke dalam sel E. coli DH5α.
Amplikon ORF 14 (1059 pb)
NdeI BamHI
Amplikon ORF 38.0 (1482 pb)
NdeI BamHI
E. coli DH5α yang membawa plasmid rekombinan
pGEMT-Easy-14
E. coli DH5α yang membawa plasmid rekombinan
pGEMT-Easy-38.0
TRANSFORMASI TRANSFORMASI
Nae 2707 XmnI2009
ScaI 1890
Nae 2707 XmnI2009
ScaI 1890
Nae 2707 XmnI2009
ScaI 1890
Nae 2707 XmnI2009
ScaI 1890
Ampr lacZ
Ampr lacZ
pGEMT-Easy-14 (4.1 kb)
lacZ Ampr
lacZ lacZ
Ampr ORI ORI
Plasmid rekombinan (pGEMT-Easy-14 dan pGEMT-Easy-38.0) yang telah diverifikasi menggunakan enzim restriksi
EcoRI, kemudian dipilh untuk pemotongan menggunakan enzim restriksi
BamHI dan NdeI (Promega) yang situs restriksinya terdapat pada primer spesifik kedua ORF. Sebanyak 3 µl (± 160 ng) plasmid rekombinan ditambahkan 2 µl bufer D (Promega), 0.2 µl BSA (Promega), 0.5 (5 unit) µl BamHI, 0.5 µl (5 unit) NdeI dan ddH2O hingga volume reaksi 20 µl. Campuran reaksi kemudian diinkubasi pada suhu 37 0C selama 12 jam.
PCR koloni menggunakan primer spesifik ORF 14 dan ORF 38.0 dilakukan untuk memastikan bahwa DNA sisipan adalah benar-benar ORF 14 dan ORF 38.0. Koloni putih E. coli DH5α yang telah diverifikasi menggunakan enzim restriksi
EcoRI, BamHI, dan NdeI kemudian disuspensikan kedalam 25 µl ddH2O dan dipanaskan pada suhu 95 0C selama 2 menit, 2.5 µl suspensi ditambahkan kedalam 22.5 µl reaksi PCR. Komposisi reaksi dan kondisi PCR dalam verifikasi sama dengan kondisi PCR yang digunakan untuk mengamplifikasi kedua ORF tersebut diatas. Visualisasi hasil restriksi dan PCR koloni dengan elektroforesis menggunakan gel agarosa 0.7% (b/v).
HASIL
Hasil Analisis Bioinformatika Sekuen ORF 14 dan ORF 38.0. Hasil analisis bioinformatika menggunakan program BLASTX NCBI untuk ORF 14 menunjukkan sekuen tersebut mengkodekan protein yang memiliki homologi sebesar 90% dengan protein
berdomain GGDEF pada M. magnetotacticum MS-1, sedangkan ORF 38.0 mengkodekan protein yang memiliki homologi sebesar 70% dengan
6-hydroxynicotinate reductase pada
Bradyrhizobium sp. BTAi1 (Tabel 1). Sekuen asam amino yang dikode ORF 14 berdasarkan analisis program ScanProsite memiliki ukuran 352 asam amino dan memiliki satu domain GGDEF (Gambar 2 a). Sekuen asam amino yang dikode ORF 38.0 memiliki ukuran 493 asam amino. Berdasarkan analisis menggunakan program ScanProsite, protein yang dikode ORF tersebut adalah protein feredoksin (2Fe2S) (Gambar 2b).
Amplifikasi ORF 14 dan ORF 38.0.
Visualisasi hasilamplifikasi ORF 14 dan ORF 38.0 pada gel agarosa 1% (b/v) menunjukkan pita berukuran sekitar 1.1 kb untuk ORF 14 dan sekitar 1.5 kb untuk ORF 38.0 (Gambar 3). Hal ini sesuai dengan ukuran sebenarnya kedua sekuen tersebut pada GenBank.
Kloning ORF 14 dan ORF 38.0 ke dalam sel E. coli DH5α. DNA hasil amplifikasi telah diligasikan kedalam vektor kloning pGEMT-Easy (3 kb), proses ligasi menghasilkan plasmid rekombinan pGEMT-Easy-14 dan pGEMT-Easy-38.0. Plasmid rekombinan yang dikonstruksi telah berhasil diintroduksikan ke dalam sel E. coli DH5α melalui metode kejutan panas (heat shock). Koloni E. coli DH5α yang membawa plasmid rekombinan terlihat berwarna putih pada media LA yang mengandung ampisilin (50 µg/ml) dan X-gal (40 µg/ml) (Gambar 4).
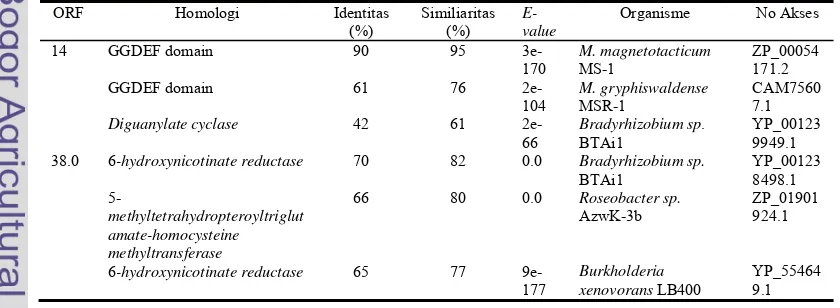
Tabel 1. Hasil Analisis Bioinformatika Sekuen ORF 14 dan ORF 38.0, diambil tiga hasil yang terbaik dari analisis menggunakan program BLASTX-NCBI.
ORF Homologi Identitas (%)
Similiaritas (%)
E-value
Organisme No Akses
14 GGDEF domain
GGDEF domain Diguanylate cyclase 90 61 42 95 76 61 3e-170 2e-104 2e-66 M. magnetotacticum MS-1 M. gryphiswaldense MSR-1
Bradyrhizobium sp. BTAi1 ZP_00054 171.2 CAM7560 7.1 YP_00123 9949.1 38.0 6-hydroxynicotinate reductase
5-methyltetrahydropteroyltriglut amate-homocysteine methyltransferase
6-hydroxynicotinate reductase
70 66 65 82 80 77 0.0 0.0 9e-177 Bradyrhizobium sp. BTAi1 Roseobacter sp. AzwK-3b Burkholderia xenovorans LB400
Plasmid rekombinan (pGEMT-Easy-14 dan pGEMT-Easy-38.0) yang telah diverifikasi menggunakan enzim restriksi
EcoRI, kemudian dipilh untuk pemotongan menggunakan enzim restriksi
BamHI dan NdeI (Promega) yang situs restriksinya terdapat pada primer spesifik kedua ORF. Sebanyak 3 µl (± 160 ng) plasmid rekombinan ditambahkan 2 µl bufer D (Promega), 0.2 µl BSA (Promega), 0.5 (5 unit) µl BamHI, 0.5 µl (5 unit) NdeI dan ddH2O hingga volume reaksi 20 µl. Campuran reaksi kemudian diinkubasi pada suhu 37 0C selama 12 jam.
PCR koloni menggunakan primer spesifik ORF 14 dan ORF 38.0 dilakukan untuk memastikan bahwa DNA sisipan adalah benar-benar ORF 14 dan ORF 38.0. Koloni putih E. coli DH5α yang telah diverifikasi menggunakan enzim restriksi
EcoRI, BamHI, dan NdeI kemudian disuspensikan kedalam 25 µl ddH2O dan dipanaskan pada suhu 95 0C selama 2 menit, 2.5 µl suspensi ditambahkan kedalam 22.5 µl reaksi PCR. Komposisi reaksi dan kondisi PCR dalam verifikasi sama dengan kondisi PCR yang digunakan untuk mengamplifikasi kedua ORF tersebut diatas. Visualisasi hasil restriksi dan PCR koloni dengan elektroforesis menggunakan gel agarosa 0.7% (b/v).
HASIL
Hasil Analisis Bioinformatika Sekuen ORF 14 dan ORF 38.0. Hasil analisis bioinformatika menggunakan program BLASTX NCBI untuk ORF 14 menunjukkan sekuen tersebut mengkodekan protein yang memiliki homologi sebesar 90% dengan protein
berdomain GGDEF pada M. magnetotacticum MS-1, sedangkan ORF 38.0 mengkodekan protein yang memiliki homologi sebesar 70% dengan
6-hydroxynicotinate reductase pada
Bradyrhizobium sp. BTAi1 (Tabel 1). Sekuen asam amino yang dikode ORF 14 berdasarkan analisis program ScanProsite memiliki ukuran 352 asam amino dan memiliki satu domain GGDEF (Gambar 2 a). Sekuen asam amino yang dikode ORF 38.0 memiliki ukuran 493 asam amino. Berdasarkan analisis menggunakan program ScanProsite, protein yang dikode ORF tersebut adalah protein feredoksin (2Fe2S) (Gambar 2b).
Amplifikasi ORF 14 dan ORF 38.0.
Visualisasi hasilamplifikasi ORF 14 dan ORF 38.0 pada gel agarosa 1% (b/v) menunjukkan pita berukuran sekitar 1.1 kb untuk ORF 14 dan sekitar 1.5 kb untuk ORF 38.0 (Gambar 3). Hal ini sesuai dengan ukuran sebenarnya kedua sekuen tersebut pada GenBank.
[image:30.595.88.508.591.745.2]Kloning ORF 14 dan ORF 38.0 ke dalam sel E. coli DH5α. DNA hasil amplifikasi telah diligasikan kedalam vektor kloning pGEMT-Easy (3 kb), proses ligasi menghasilkan plasmid rekombinan pGEMT-Easy-14 dan pGEMT-Easy-38.0. Plasmid rekombinan yang dikonstruksi telah berhasil diintroduksikan ke dalam sel E. coli DH5α melalui metode kejutan panas (heat shock). Koloni E. coli DH5α yang membawa plasmid rekombinan terlihat berwarna putih pada media LA yang mengandung ampisilin (50 µg/ml) dan X-gal (40 µg/ml) (Gambar 4).
Tabel 1. Hasil Analisis Bioinformatika Sekuen ORF 14 dan ORF 38.0, diambil tiga hasil yang terbaik dari analisis menggunakan program BLASTX-NCBI.
ORF Homologi Identitas (%)
Similiaritas (%)
E-value
Organisme No Akses
14 GGDEF domain
GGDEF domain Diguanylate cyclase 90 61 42 95 76 61 3e-170 2e-104 2e-66 M. magnetotacticum MS-1 M. gryphiswaldense MSR-1
Bradyrhizobium sp. BTAi1 ZP_00054 171.2 CAM7560 7.1 YP_00123 9949.1 38.0 6-hydroxynicotinate reductase
5-methyltetrahydropteroyltriglut amate-homocysteine methyltransferase
6-hydroxynicotinate reductase
70 66 65 82 80 77 0.0 0.0 9e-177 Bradyrhizobium sp. BTAi1 Roseobacter sp. AzwK-3b Burkholderia xenovorans LB400
a)
(352 aa)GGDEF: (207-342) APLSLLMIDIDHFKQFNDTYGHQLGDQVLKLVARSLSEVAQAKDTAARYGGEEFAVILPA TPLEKSMEVAETIRNQVSTKRLTNrrtgqvLGQVTLSIGAALLREAEAPDSLVHRADEAM
YLAKRDGRNRVKSEID
b)
(493aa) Keterangan:
[image:31.595.100.500.78.252.2]1.HDG (103-105) 2Fe2S 2.RGG (358-361) 2Fe2S 3.LGG (450-452) 2Fe2S 4.QVI (462-464) 2Fe2S 5.RNY (485-487) 2Fe2S
Gambar 2. Hasil analisis bioinformatika menggunakan program ScanProsite. a. Domain GGDEF yang dikode ORF 14, b. Feredoksin (2Fe2S) yang dikode ORF 38.0.
1 2 3 [image:31.595.118.302.292.495.2]
Gambar 3. Elektroforesis gel agarosa 1 % (b/v)
DNA hasil amplifikasi ORF 14 (lane 2) dan ORF 38.0 (lane 3). Lane 1: Marker 1 kb DNA Ladder (Promega).
Verifikasi Hasil Kloning ORF 14 dan ORF 38.0. Pemotongan plasmid rekombinan hasil isolasi dari beberapa koloni putih E. coli
DH5α yang diduga adalah pGEMT-Easy-14 menggunakan enzim restriksi EcoRI telah menghasilkan pita berukuran 3 kb yang menunjukkan ukuran pGEMT-Easy, pita berukuran sekitar 0.8 kb dan 0.3 kb yang menunjukkan bahwa ORF 14 (sekitar 1.1 kb) telah terpotong EcoRI (Gambar 5a). Visualisasi hasil restriksi plasmid rekombinan pada lane 2 gel agarosa (Gambar 5a) hanya memperlihatkan dua pita yaitu pGEMT-Easy dan fragmen DNA yang tidak sesuai dengan ukuran ORF 14 jika terpotong EcoRI, sehingga plasmid rekombinan pada lane 2 bukan pGEMT-Easy-14. Pemotongan plasmid rekombinan yang diduga adalah pGEMT-Easy-38.0 menggunakan enzim restriksi
EcoRI telah menghasilkan pita berukuran 3 kb yang menunjukkan pGEMT-Easy dan pita
berukuran sekitar 1.5 kb yang menunjukkan ukuran ORF 38.0 (Gambar 5b). Verifikasi kedua plasmid rekombinan menggunakan enzim restriksi NdeI dan BamHI masing-masing menghasilkan dua pita pada gel agarosa (Gambar 5c). Pita 3 kb (lane 2 &3) menunjukkan ukuran plasmid pGEMT-Easy, sedangkan pita berukuran sekitar 1.5 kb (lane
2) menunjukkan ukuran ORF 38.0 dan pita berukuran sekitar 1.1 kb (lane 3) menunjukkan ukuran ORF 14. PCR koloni menggunakan primer spesifik ORF 14 dan ORF 38.0 menghasilkan pita berukuran sekitar 1.1 kb untuk ORF 14 dan sekitar 1.5 kb untuk ORF 38.0 (Gambar 5d). Pemotongan plasmid rekombinan dan PCR koloni yang dilakukan dalam penelitian ini telah membuktikan bahwa ORF 14 dan ORF 38.0 dari M. magneticum AMB-1 telah berhasil diintroduksi ke dalam sel E. coli DH5α. 10000
4000
2000 1500
1000 500 b
ORF 38.0 (sekitar1.5 kb)
ORF 14 (sekitar1.1 kb)
Gambar 4. Koloni putih E. coli DH5α yang diduga membawa plasmid rekombinan (ditunjukan oleh panah merah).
100 aa
100 aa
1 2 3 4 5
PEMBAHASAN
Berdasarkan sekuen yang terdapat pada
GenBank, ORF 14 memiliki ukuran sebesar 1059 pasang basa (pb), sedangkan ORF 38.0 berukuran 1482 pb. Kedua ORF telah berhasil diamplifikasi dalam penelitian ini, elektroforesis gel agarosa menunjukkan pita DNA berukuran sekitar 1.1 kb untuk amplikon ORF 14 dan pita DNA berukuran sekitar 1.5 kb untuk amplikon ORF 38.0. Penentuan ukuran amplikon kedua ORF didasarkan pada pengamatan visual letak pita DNA terhadap marker (1 kb DNA Ladder Promega), terdapat kemungkinan perbedaan ukuran amplikon kedua ORF dengan ukuran kedua ORF pada
GenBank karena ada penambahan dari primer yang digunakan.
Analisis menggunakan program BLASTX NCBI dalam penelitian ini memperlihatkan sekuen tersebut mengkode protein yang memiliki homologi dengan protein berdomain GGDEF pada M. magnetotacticum MS-1. Hal ini ditunjukkan oleh nilai identitas (90 %) yang menunjukkan kesamaan sekuen asam amino dan nilai similiaritas (95 %) yang menunjukkan kesamaan struktur dan fungsi protein yang dikode ORF 14 dengan domain GGDEF. Nilai expectation value (e-value) menunjukkan jumlah pemasangan yang kemungkinan terjadi dengan sekuen yang ada di GenBank. Nilai e-value 0.0 menunjukkan kesamaan panjang kedua sekuen yang
1 2 3 4 5 1 2 3 4
a) Restriksi pGEMT-Easy-14 menggunakan EcoRI. b) Restriksi pGEMT-Easy-38 menggunakan EcoRI.
Lane 1: 1 kb DNA Ladder RealBiotech Lane 1: 1 kb DNA Ladder RealBiotech
Lane 3, 4, 5: Hasil Restriksi pGEMT-14 Lane 2, 3, 4: Hasil Restriksi pGEMT-38
1 2 3 1 2 3
c) Restriksi pGEMT-Easy-14 dan pGEMT-Easy-38.0 d) PCR koloni dari koloni putih E. coli DH5α menggunakan NdeI dan BamHI. Lane 1: 1 kb DNA Ladder RealBiotech
Lane 1: 1 kb DNA Ladder RealBiotech Lane 2: Amplikon ORF 14
Lane 2: