AKTIVITAS PROTEIN UMBI SEBAGAI ANTIPROLIFERASI
SEL KANKER MCF-7 DAN KARAKTERISASI LEKTIN UMBI
DARI KELADI TIKUS (Typhonium flagelliforme
(Lodd.) Blume)
MUHAMMAD ALFARABI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
*Dengan ini saya menyatakan bahwa disertasi berjudul "Aktivitas Protein Umbi sebagai Antiproliferasi Sel Kanker MCF-7 dan Karakterisasi Lektin Umbi dari Keladi Tikus (Typhonium flagelliforme (Lodd.) Blume)" adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Muhammad Alfarabi
NIM G363100081
*Pelimpahan hak cipta atas karya tulis dari penelitian kerja sama dengan pihak
MUHAMMAD ALFARABI. Aktivitas Protein Umbi sebagai Antiproliferasi Sel Kanker MCF-7 dan Karakterisasi Lektin Umbi dari Keladi Tikus (Typhonium flagelliforme(Lodd.) Blume). Dibimbing oleh MIFTAHUDIN, CHAIDIR, dan MARIA BINTANG.
Kanker termasuk dari sepuluh besar penyakit yang banyak menyebabkan kematian di Indonesia. Sel kanker memiliki sifat utama, yaitu pertumbuhan sel tidak terhambat secara normal dan dapat menginvasi sel-sel normal lainnya. Masyarakat di Indonesia secara tradisional telah banyak menggunakan tumbuhan keladi tikus (Typhonium sp.) untuk pengobatan kanker. Berdasarkan penelitian sebelumnya, tanaman keladi tikus dari jenis Typhonium divaricatum (L.) Decne yang tumbuh di daerah Chengdu (Cina) memiliki aktivitas sebagai antikanker. Hal ini dikarenakan pada bagian umbi tanaman tersebut mengandung lektin yang dapat menghambat proliferasi sel kanker. Keladi tikus yang tumbuh di Indonesia tidak memiliki informasi ilmiah mengenai hal tersebut hingga saat kini, sehingga tidak ada data fitofarmaka yang mendukung lektin umbi keladi tikus memiliki aktivitas antikanker. Oleh karenanya penelitian ini bertujuan mengidentifikasi protein dan lektin dari umbi keladi tikus (T. flagelliforme) yang tumbuh di beberapa wilayah Indonesia. Manfaat dari penelitian ini adalah memberikan informasi ilmiah mengenai profil protein dan lektin umbi dari keladi tikus (T. flagelliforme) yang tumbuh di wilayah Indonesia. Informasi ini dapat dijadikan dasar pengembangan produk fitofarmaka berbasis lektin sebagai obat antikanker.
Penelitian ini menggunakan umbi segar dari 7 aksesi T. flagelliforme
(Lodd.) Blume yang didapatkan dari beberapa wilayah di Indonesia, yaitu Bogor (Jawa Barat), Yogyakarta (Merapi Farm dan Indmira), Matesih (Jawa Tengah), Singaraja (Bali), Ogan Ilir (Sumatera Selatan), dan Solok (Sumatera Barat). Tanaman tersebut ditumbuhkan di rumah kaca pada Pusat Bioteknologi, Badan Pengkajian dan Penerapan Teknologi, Indonesia. Umbi yang digunakan adalah umbi yang dipanen pada umur 1, 3, 5, dan 6 bulan setelah tanam. Umbi tersebut diekstrak proteinnya untuk diukur kadar total protein umbi, nilai toksisitas, dan aktivitas hemaglutinasi dari lektin yang terkandung pada total protein umbi. Aksesi umur 6 bulan setelah tanam yang terpilih berdasar aktivitas hemaglutinasi tertinggi hasil dari proses ekstraksi menggunakan NaCl dilakukan fraksinasi protein terhadap ekstrak protein umbinya untuk mendapatkan lektin terpurifikasi. Tahap selanjutnya adalah identifikasi gen pengkode lektin dilakukan dari setiap aksesi tanaman sehingga didapatkan sekuens basa dari gen tersebut. Selanjutnya, umbi dari tanaman berumur 6 bulan setelah tanam juga dilakukan ekstraksi dengan akuades untuk pengujian terhadap kultur sel mamalia (sel MCF-7 dan fibroblas). Ekstrak protein menggunakan ekstraksi akuades yang sudah diseleksi berdasarkan aktivitas hemaglutinasi dan efek toksik dengan metode BSLT (Brine Shrimp Lethality Test) dilanjutkan dengan uji antiproliferasi terhadap sel kanker (MCF-7) dan sitotoksisitas terhadap sel normal (fibroblas).
umbi pada setiap bulannya, dari umur 1 hingga 6 bulan setelah tanam. Hasil pengamatan kadar total protein selama masa tanam menunjukkan bahwa hanya aksesi Ogan Ilir yang kadar total protein umbinya meningkat dari umur tanam 1 bulan hingga 6 bulan, sedangkan 5 aksesi yang lain mengalami fluktuasi kadar total protein umbi selama masa tanam. Kandungan protein umbi pada aksesi Bogor umur 1 bulan tidak terdeteksi. Hasil pengamatan deteksi lektin umbi menunjukkan bahwa lektin umbi telah diproduksi dari umur tanaman 1 bulan setelah tanam, yaitu aksesi Singaraja, Merapi Farm, dan Indmira. Lektin pada aksesi lainnya terdeteksi pada umur tanaman 3 bulan setelah tanam. Tidak terdapat aksesi yang menunjukkan peningkatan kadar lektin secara linier pada umur tanam 1 bulan hingga 6 bulan, kecuali aksesi Bogor. Pengamatan profil protein umbi setiap aksesi menunjukkan protein umbi memiliki banyak kandungan protein yang berbobot molekul di bawah 30 kDa. Protein-protein umbi yang berbobot molekul di atas 30 kDa terdeteksi ketika umur tanaman 5 dan 6 bulan setelah tanam.
Fraksinasi ekstrak protein umbi aksesi Solok dilakukan karena ekstrak protein umbi tersebut memiliki aktivitas hemaglutinasi tertinggi. Hasilnya didapatkan lektin terpurifikasi yang terkandung pada umbi aksesi Solok dengan bobot molekul 12.67 kDa, dengan kadar lektin sekitar 0.35 % dari kadar total protein umbi, stabil pada suhu 20-40 °C, dan stabil pada pH 5-7.2.
Hasil analisis sekuens basa parsial gen pengkode lektin yang terdeteksi dari setiap aksesi berukuran 600 pb. Sekuens tersebut memiliki kesamaan tertinggi dengan sekuens CDS (Coding DNA Sequence) lektin dari tumbuhan lain famili Araceae, yaituT. divaricatum,Pinellia ternata, danPinellia pedatisecta.
Hasil ekstraksi protein umbi menggunakan akuades dari umbi berumur 6 bulan menunjukkan aksesi Bogor memiliki aktivitas hemaglutinasi tertinggi, sedangkan aksesi Solok memiliki efek toksisitas terhadap larva udang tertinggi. Oleh karenanya aksesi Bogor dan Solok diuji lanjut ekstrak protein umbinya pada uji antiproliferasi dan sitotoksik. Hasil uji antiproliferasi dengan metode MTT menunjukan bahwa ekstrak protein umbi aksesi Solok memiliki nilai LC50, yaitu
95.36 ppm yang lebih rendah dibandingkan dengan aksesi Bogor, yaitu 102.86 ppm sehingga ekstrak dari aksesi Solok lebih mampu menghambat proliferasi sel MCF-7. Ekstrak aksesi Bogor dan Solok diuji kembali dengan sel fibroblas manusia (sel normal) untuk melihat efek toksik ekstrak terhadap sel non kanker. Proliferasi sel fibroblas meningkat dengan pemberian ekstrak dibandingkan sel fibroblas tanpa perlakuan. Namun, pada konsentrasi ekstrak 100 ppm untuk aksesi Solok pertumbuhan sel fibroblas terhambat 8.33 % dan pada konsentrasi ekstrak 200 ppm untuk aksesi Bogor, pertumbuhan sel fibroblas terhambat 29.90 %.
Simpulan penelitian adalah biosintesis lektin pada umbi setiap aksesi T. flagelliforme berlangsung sampai 6 bulan setelah tanam. Ekstrak protein umbi memiliki aktivitas antiproliferasi terhadap sel kanker MCF-7 dan tidak toksik terhadap sel normal fibroblas pada konsentrasi kurang dari 100 ppm untuk aksesi Solok dan konsentrasi kurang dari 200 ppm untuk aksesi Bogor. Lektin yang terdeteksi berbobot molekul 12.67 kDa. Gen parsial penyandi lektin dari setiap aksesi terdeteksi berukuran 600 pb.
MUHAMMAD ALFARABI. Antiproliferative Activity of Tuber Protein on Cancer Cell MCF-7 and Tuber Lectin Characterization from Typhonium flagelliforme (Lodd.) Blume. Under the direction of MIFTAHUDIN, CHAIDIR, and MARIA BINTANG.
Many people in Indonesia are suffering breast and cervical cancer. Cancer cell is a cell that continuesly grow without inhibition and it can invade other normal cells. Traditionally, Typhonium flagelliforme was used for anticancer treatment in Indonesia. Previous study showed that theT. divaricatum(L.) Decne from Chengdu (Cina) has anticancer activity because it has antiproliferative effect of tuber lectin on cancer cell line. However, there is no phytopharmaca information about tuber lectin of T. flagelliforme in Indonesia. Therefore, the objective of this research to identify tuber protein and lectin content of T. flagelliforme from Indonesia. The results of this research provided scientific information of T. flagelliforme lectin tuber in Indonesia that can be used for anticancer lectin based drug development.
Seven accessions of T. flagelliforme from Bogor (West Java), Yogyakarta (Merapi Farm dan Indmira), Matesih (Central Java), Singaraja (Bali), Ogan Ilir (South Sumatera), and Solok (West Sumatera) were used in this research. Those accessions have been cultivated in greenhouse at Biotech Centre, Agency for The Assessment and Application of Technology, Indonesia. The tubers were harvested from 1, 3, 5, and 6 months old plant and used as plant materials. The tuber total protein content, toxicity effect, and hemagglutination activity was determined from the crude tuber protein extract. The selected of tuber protein extract from 6 months old plant (NaCl extraction) used for protein fractination. The next stage was to identify of lectin gene from all accession. After that, the selected of tuber protein extract from 6 months old plant (water extraction) used for mammalian cell culture test (MCF-7 and fibroblast cells). Those extracts was selected by hemagglutination activity and toxicity effect on BSLT (Brine Shrimp Lethality Test) before mammalian cell culture test performed.
The results showed some accessions have fluctuations of the tuber weight like Singaraja, Merapi Farm, Indmira, and Solok accession. Bogor, Ogan Ilir, and Matesih accession showed tuber weight increasing in each month, from 1 to 6 months planting. The observation of the total protein level during growing period showed that Ogan Ilir protein increased linearly from 1 to 6 months, while other accessions showed fluctuation in total protein level during growing period. Three accessions, Singaraja, Merapi Farm, and Indmira have been produced lectin since 1 month planting. The other accessions, Bogor, Ogan Ilir, Matesih, and Solok were detected of lectin in 3 months planting. There is no accession showed linearly elevated levels of lectin from 1 month to 6 months planting, except Bogor accession. The tuber protein content has many proteins under 30 kDa. The above 30 kDa proteins in tuber were detected in 5 and 6 months old plant.
The lectin content in the total tuber protein is 0.35 %. This lectin was stable in 20-40 °C and pH 5-7.2.
The partial coding DNA sequence of each accessions were isolated with the size of 600 bp for each accessions. These sequences have high similarity with the lectin coding DNA sequence of another plants in Araceae, such asT. divaricatum,
Pinellia ternata, andPinellia pedatisecta.
The tuber protein extract using water from 6 months old plant showed extract of Bogor accession has the highest hemagglutination activity, while Solok accession has the highest toxicity on shrimp larvae. Therefore, Bogor and Solok accession tested for antiproliferative and cytotoxic effect. Antiproliferasi test results with MTT method showed that the LC50values of tuber protein extracts of
Solok accession lower than Bogor accession. That means Solok accession was be able to inhibited the proliferation of MCF-7 cells. In cytotoxic test, the proliferation of fibroblast cell was increased in lower concentrations of tuber protein extracts. However, in 100 ppm of Solok accesion extract, the proliferation of fibroblast cell was inhibited for 8.33 % and in 200 ppm of Bogor accession extract, the proliferation of fibroblast cell was inhibited for 29.90 %.
The conclusion of this research were the lectin biosynthesis occured during growing period. The tuber protein extract has antiproliferative activity on MCF-7 cell and no toxic effect to fibroblast cell under 100 ppm of the tuber protein extract Solok accession and under 200 ppm of the tuber protein extract Bogor accession. The molecular weight of Lectin was detected at 12.67 kDa and the size of isolated partial gene of lectin was 600 bp.
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Biologi Tumbuhan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
MUHAMMAD ALFARABI
AKTIVITAS PROTEIN UMBI SEBAGAI ANTIPROLIFERASI
SEL KANKER MCF-7 DAN KARAKTERISASI LEKTIN UMBI
Dr. Hamim, M.Si
(Staf pengajar pada Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor)
Dr. Mega Safithri, M.Si
(Staf pengajar pada Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor)
Penguji pada Ujian Terbuka:
Dr. Hamim, M.Si
(Staf pengajar pada Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor)
Dr. Siswa Setyahadi
Judul Disertasi: Aktivitas Protein Umbi sebagai Antiproliferasi Sel Kanker MCF-7 dan Karakterisasi Lektin Umbi dari Keladi Tikus (Typhonium flagelliforme(Lodd.) Blume)
Nama : Muhammad Alfarabi NIM : G363100081
Disetujui
Komisi Pembimbing
Dr. Ir. Miftahudin, M.Si Ketua
Dr.rer.nat. Chaidir, Apt Prof. Dr. drh. Maria Bintang, M.S
Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Biologi Tumbuhan
Dr. Ir. Miftahudin, M.Si Dr. Ir. Dahrul Syah, M.Sc.Agr
Tanggal Ujian Tertutup: 3 Agustus 2015
Puji syukur penulis panjatkan kehadirat Allah SWT Yang Maha Pengasih dan Maha Penyayang karena atas rahmat izin dan hidayah-Nya disertasi yang
berjudul “Aktivitas Protein Umbi sebagai Antiproliferasi Sel Kanker MCF-7 dan Karakterisasi Lektin Umbi dari Keladi Tikus (Typhonium flagelliforme (Lodd.) Blume)” dapat diselesaikan dengan baik. Disertasi ini merupakan salah satu syarat untuk memperoleh gelar Doktor pada Mayor Biologi Tumbuhan, Sekolah Pascasarjana, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada para pembimbing, yaitu Dr. Ir. Miftahudin, M.Si, Dr.rer.nat Chaidir, Apt., dan Prof. Dr. drh. Maria Bintang, MS yang sudah memberikan arahan dan bimbingan selama penelitian dan penulisan disertasi ini. Terima kasih penulis ucapkan kepada Dr. Hamim, M.Si, Dr. Mega Safithri, M.Si, dan Dr. Siswa Setyahadi selaku penguji pada ujian tertutup dan ujian terbuka yang telah memberikan saran demi kesempurnaan penulisan disertasi ini.
Terima kasih pula penulis ucapkan kepada Dr. Prasetyawan Yunianto sebagai Kepala Laboratorium Teknologi Farmasi Medika yang telah mengizinkan penulis melakukan penelitian di lab tersebut. Selain itu, ucapan terima kasih penulis kepada Syofi Rosmalawati, M.AgrSc. beserta staf Laboratorium Bioteknologi Pertanian, Dr. Churiyah beserta staf peneliti Laboratorium Kultur Sel Hewan, Dr. Kurnia Agustini beserta staf peneliti Laboratorium Farmakologi, Dr. Siswa Setyahadi beserta staf peneliti Laboratorium Bioseparasi, Fifit Juniarti, BSc (HONS) beserta staf peneliti Laboratorium Biologi Molekuler, dan Dr.rer.nat Anis Mahsunah yang telah membantu berjalannya proses kegiatan penelitian di Laboratorium BPPT, Puspiptek, Serpong. Ungkapan terima kasih juga penulis ucapkan kepada seluruh dosen dan staf Mayor Biologi Tumbuhan, yang telah memberikan bekal ilmu dan bantuan sehingga penulis dapat menyelesaikan studi dengan baik. Tidak lupa ucapan terima kasih kepada rekan mahasiswa S3 BOT angkatan 2010, rekan kerja Laboratorium Fisiologi dan Genetika Tumbuhan IPB, dan rekan kerja di Laboratorium LapTIAB BPPT. Ungkapan terima kasih juga penulis sampaikan kepada orang tua, adik, Tyas, serta seluruh keluarga atas segala doa, dukungan, dan kasih sayangnya selama penulis menjalani program Doktor di IPB.
Akhir kata, semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
DAFTAR ISI
Bobot Umbi, Protein Umbi, dan Lektin UmbiT. flagelliforme 20 Elektroforegram Protein Umbi Setiap Aksesi Selama Masa Tanam 22 Fraksinasi Protein UmbiT. flagelliformeAksesi Solok Umur 6 Bulan
Setelah Tanam 23
Karakterisasi Lektin 26
Identifikasi Gen Lektin 27
Aktivitas Toksisitas, Antiproliferasi, dan Sitotoksisitas Ekstrak Protein Umbi Umur 6 Bulan Setelah Tanam 30
5 PEMBAHASAN 34
Profil Bobot Umbi, Protein Umbi, dan Lektin UmbiT. flagelliforme 34 Pola Elektroforegram Total Protein Umbi Setiap Aksesi Selama
Masa Tanam 36
Karakteristik Lektin UmbiT. flagelliformeAksesi Solok Umur 6 Bulan
Setelah Tanam 36
Gen Lektin 38
Toksisitas, Antiproliferasi, dan Sitotoksisitas Ekstrak Protein Umbi
Umur 6 Bulan Setelah Tanam 40
6 SIMPULAN DAN SARAN 42
DAFTAR PUSTAKA 43
LAMPIRAN 46
1 Daerah aksesiT.flagelliformeyang digunakan dalam penelitian 12 2 Kadar total protein umbi, aktivitas hemaglutinasi, dan nilai toksisitas
dari ekstraksi protein menggunakan NaCl 25 g umbi T. flagelliforme
umur masa tanam 6 bulan 24
3 Kadar total protein pada proses fraksinasi ekstrak protein umbi aksesi Solok menggunanakan kolom DEAE-Sepharosedan CM-monolitic 25 4 Tabel Tahapan Purifikasi Ekstrak Protein Umbi Aksesi Solok Umur 6
Bulan Tanam 26
5 Hasil BLASTN yang menunjukkan kesamaan tertinggi dari setiap aksesiT. flagelliformedengan basis data di NCBI 28 6 Pensejajaran sekuens basa gen pengkode lektin setiap aksesi T.
flagelliformedengan beberapa tumbuhan lain famili Araceae 28 7 Kadar protein total, aktivitas hemaglutinasi, dan nilai toksisitas esktrak
akuades 15 g umbiT. flagelliformeberumur 6 bulan masa tanam 31 8 Daya hambat ekstrak protein umbi aksesi Bogor dan Solok terhadap sel
MCF-7 dengan berbagai konsentrasi 31 9 Daya proliferasi ekstrak protein umbi aksesi Bogor dan Solok terhadap
DAFTAR GAMBAR
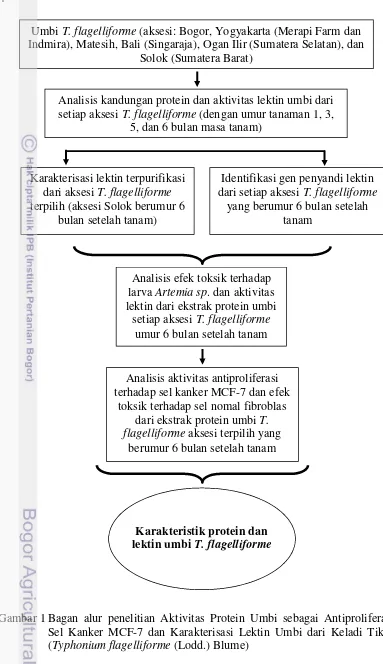
1 Bagan alur penelitian Aktivitas Protein Umbi sebagai Antiproliferasi Sel Kanker MCF-7 dan Karakterisasi Lektin Umbi dari Keladi Tikus
(Typhonium flagelliforme(Lodd.) Blume) 4
2 Typhonium flagelliforme 5
3 Skema aktifasi caspase 8
4 Mekanisme lektin dalam menginduksi terjadinya proses apoptosis pada
sel kanker 9
5 Bagian-bagian ekstraksi protein umbi yang dilakukan pada penelitian 13 6 Peta fisik vektor dan situs pengklonan pGEM®-T Easy 16 7 Bobot umbi setiap aksesi T. flagelliforme dari umur 1 bulan hingga 6
bulan setelah tanam 20
8 Kadar total protein umbi setiap aksesi T. flagelliforme dari umur 1 bulan hingga 6 bulan setelah tanam 21 9 Aktivitas hemaglutinasi lektin umbi setiap aksesi T. flagelliforme dari
umur 1 hingga 6 bulan setelah tanam 22 10 Elektroforegram protein umbi T. flagelliforme (Lodd.) Blume selama
masa tanam 23
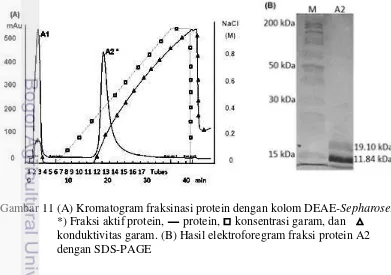
11 Kromatogram dan elektroforegram hasil fraksinasi dengan kolom
DEAE-Sepharose 24
12 Kromatogram dan elektroforegram hasil fraksinasi dengan kolom
CM-monolitic 25
1 Kurva standar larutan protein menggunakan BSA (BovineSerum
Albumin) 47
2 Antiproliferasi ekstrak protein umur 6 bulan setelah tanam dengan ekstraksi menggunakan aquades terhadap sel MCF-7 47 3 Sitotoksiksitas ekstrak protein umur 6 bulan setelah tanam dengan
1 PENDAHULUAN
Latar Belakang
Kanker merupakan masalah kesehatan yang banyak diderita oleh masyarakat dunia. Satu dari empat penderita kanker di Amerika Serikat meninggal setiap tahunnya (Jemal et al. 2010). Kanker termasuk dari sepuluh besar penyakit yang banyak menyebabkan kematian di Indonesia. Kanker payudara dan leher rahim merupakan jenis kanker yang banyak diderita penderita kanker di Indonesia. Berdasarkan data Departemen Kesehatan Republik Indonesia, tahun 2013 terdapat sekitar 347792 penderita kanker dan diantaranya 28850 adalah wanita penderita kanker payudara dan leher rahim stadium IV. Jumlah penderita tersebut terus meningkat setiap tahunnya (Kementrian Kesehatan Republik Indonesia 2014). Oleh karenanya, kanker merupakan penyakit yang sangat serius bagi masyarakat Indonesia sehingga diperlukan penanganan dari berbagai bidang terkait.
Sel kanker memiliki sifat utama, yaitu pertumbuhan sel tidak terhambat secara normal dan dapat menginvasi sel-sel normal lainnya. Sifat tersebut menjadikan sel kanker sangat berbahaya. Sel kanker pada awalnya merupakan sel normal yang tumbuh dan berproliferasi dalam keadaan tidak terkontrol sehingga menjadi tumor atau neoplasma. Tumor tersebut dapat berkembang dan memiliki kemampuan untuk menginvasi jaringan disekitarnya yang disebutmalignant. Pada tahap tersebut sudah dapat disebut sebagai sel kanker dan dapat masuk ke dalam pembuluh darah atau limfa untuk membentuk sel kanker di jaringan lain, tahap ini disebut dengan metastases(Alberts et al. 2008), sehingga diperlukan pengobatan yang dapat mencegah, menghambat pertumbuhan, dan mematikan sel kanker. Pengobatan kanker pada umumnya banyak dilakukan dengan kemo/radioterapi. Saat ini, selain menggunakan obat dan kemo/radioterapi, pengobatan kanker dapat dilakukan dengan menggunakan bahan dari tumbuhan-tumbuhan yang berkhasiat sebagai antikanker (Mohanet al. 2010, Liuet al. 2010).
Tumbuhan yang telah digunakan dalam pengobatan antikanker dan diproduksi oleh industri farmasi adalah mistletoe (Viscum album L.). Ekstrak
mistletoetelah banyak digunakan pada perawatan kanker di negara-negara Eropa. Biasanya diaplikasikan terhadap pasien melalui injeksi subkutan. Efek ekstrak tersebut adalah dapat meningkatkan kelangsungan dan kualitas hidup dari penderita kanker, memperkuat sistem imun tubuh penderita, dan mengurangi gejala dari tumor (Ernst dan CAM-Cancer Consortium 2011). Selain itu, pengobatan kanker menggunakan ekstrak mistletoe yang digabungkan dengan kemo/radioterapi dapat meningkatkan kemampuan pasien dalam melawan dan bertahan terhadap kanker (Horneber et al. 2010). Ekstrak mistletoe mengandung banyak senyawa aktif biologi seperti flavonoid (derivat dari kuarsetin), polipeptida yang bersifat toksik, fenilpropan, lignan, dan lektin (Mistletoe LectinI, II, III). Namun, lektin yang banyak dikaji sebagai molekul antikanker dikarenakan kadarnya yang cukup tinggi dibandingkan molekul lainnya pada mistletoe
(European Medicines Agency, 2013).
memiliki sedikitnya satu domain yang dapat berikatan secara reversible dengan molekul karbohidrat. Domain inilah yang dapat berinteraksi dengan molekul karbohidrat pada membran sel dan ikatan yang terjadi spesifik sehingga lektin merupakan asal kata dari bahasa latin, yaitulagere yang artinya memilih (Damme
et al. 1998). Contohnya lektin dari Phaseolus lunatus dapat mengaglutinasi spesifik golongan darah A dan lektin dari Lotus tetragonolobus dapat
mengaglutinasi spesifik golongan darah O. Ikatan spesifik ini dapat terjadi dikarenakan terdapat interaksi spesifik antara karbohidrat pada permukaan sel dengan lektin (Sharon dan Lis 2004). Lektin dari tumbuhan telah banyak dikaji sebagai antikanker (Abdullaev dan Meija 1997), seperti lektin dari Arisaema tortuosumSchott mampu menghambat proliferasi sel kanker servik SiHa dan usus besar HT29 secara in vitro (Dhuna et al. 2005). Selain itu, Typhonium divaricatum (L.) Decne (keladi tikus) merupakan salah satu tanaman obat tradisional dari Cina yang memiliki aktivitas antikanker. Tanaman ini terdapat di daerah Chengdu (Cina) dan mengandung lektin pada umbinya yang memiliki aktivitas antikanker, yaitu dengan menghambat proliferasi sel kanker prostat Pro-01, payudara Bre-04, dan paru Lu-04 secarain vitro(Luoet al. 2007).
Masyarakat Indonesia telah banyak memanfaatkan tanaman obat sebagai pengobatan alternatif terhadap penyakit kanker, salah satunya adalah keladi tikus (Typhonium sp.). Tumbuhan ini merupakan kelompok dari jenis keladi yang tumbuh tersebar di wilayah Indonesia tetapi tidak dibudidayakan oleh masyarakat dan tidak dapat dikonsumsi. JenisTyphonium flagelliformemerupakan jenis yang banyak digunakan untuk ramuan tradisional pengobatan kanker terutama kanker payudara dengan cara direbus atau dibuat serbuk. Oleh karena memiliki genus yang sama denganT. divaricatum, didugaT. flagelliformememiliki molekul aktif yang sama yang berperan sebagai antikanker, yaitu lektin pada umbinya. Kajian ilmiah mengenaiT. flagelliforme sebagai tanaman obat antikanker belum banyak dilakukan di Indonesia. Selain itu, belum banyak yang mengkaji protein aktif, yaitu lektin dari umbiT. flagelliformeyang tumbuh di wilayah Indonesia.
Perumusan Masalah
Penggunaan T. flagelliforme oleh masyarakat luas sebagai tanaman obat tradisional untuk mengobati penyakit kanker menunjukkan bahwa pentingnya tanaman tersebut di bidang farmasi. Kenyataannya produk obat berbasis tumbuhan tersebut yang beredar di masyarakat adalah dalam bentuk jamu atau obat tradisional yang diproduksi oleh industri rumah tangga, oleh karenanya molekul aktif ekstrak tersebut tidak diketahui dengan pasti, terutama kandungan lektin pada umbi sehingga mekanisme kerja ekstrak tersebut tidak diketahui. Mekanisme tersebut perlu diketahui sehingga dalam penggunaan ekstrak dapat diketahui dosis yang tepat. Selain itu, karakteristik dari senyawa aktif juga perlu diketahui karena informasi ini sangat diperlukan dalam proses pengembangan obat yang berbasis senyawa tersebut.
3
terkarakterisasi senyawa aktif yang berperan sebagai antikanker di dalam ekstrak, serta tidak adanya standar mutu penggunaan tumbuhan untuk dijadikan bahan baku sediaan ekstrak dari T. flagelliforme menjadi dasar dilakukannya penelitian ini.
Tujuan Penelitian
Tujuan umum penelitian ini adalah mengidentifikasi protein umbi dan lektin umbi keladi tikus (T. flagelliforme) yang tumbuh di beberapa wilayah Indonesia. Secara terperinci tujuan khusus penelitian ini adalah sebagai berikut:
1. Mengetahui profil protein umbi dan lektin umbi keladi tikus (T. flagelliforme) yang tumbuh dari beberapa wilayah Indonesia pada masa tanam 1 hingga 6 bulan.
2. Menentukan karakteristik lektin yang terkandung pada umbi keladi tikus. 3. Mengidentifikasi gen penyandi lektin umbi keladi tikus yang tumbuh di
beberapa wilayah Indonesia.
4. Mengkaji aktivitas antikanker dari ekstrak protein umbi terhadap sel kanker MCF-7.
Manfaat dan Kebaruan Penelitian
Manfaat dari penelitian ini adalah dapat memberikan informasi ilmiah mengenai fase pertumbuhan T. flagelliforme yang terkait dengan aktivitas lektin umbi. Selain itu, memberikan informasi tentang keragaman profil protein dan lektin umbi T. flagelliforme yang tumbuh di beberapa wilayah Indonesia. Informasi ini dapat dijadikan dasar pengembangan produk fitofarmaka berbasis lektin sebagai obat antikanker.
Penelitian ini memiliki kebaruan yaitu: (1) kandungan protein umbi dan aktivitas lektin umbi keladi tikus (T. flagelliforme) dari berbagai aksesi wilayah Indonesia, (2) aktivitas antiproliferasi sel kanker MCF-7 dari ekstrak protein umbi keladi tikus, (3) karakteristik lektin dari aksesi terseleksi, yaitu Solok, (4) parsial gen penyandi lektin dari berbagai aksesi keladi tikus.
Ruang Lingkup Penelitian
Gambar 1 Bagan alur penelitian Aktivitas Protein Umbi sebagai Antiproliferasi Sel Kanker MCF-7 dan Karakterisasi Lektin Umbi dari Keladi Tikus (Typhonium flagelliforme(Lodd.) Blume)
UmbiT. flagelliforme(aksesi: Bogor, Yogyakarta (Merapi Farm dan Indmira), Matesih, Bali (Singaraja), Ogan Ilir (Sumatera Selatan), dan
Solok (Sumatera Barat)
Analisis kandungan protein dan aktivitas lektin umbi dari setiap aksesiT. flagelliforme(dengan umur tanaman 1, 3,
5, dan 6 bulan masa tanam)
Karakterisasi lektin terpurifikasi dari aksesiT. flagelliforme
terpilih (aksesi Solok berumur 6 bulan setelah tanam)
Identifikasi gen penyandi lektin dari setiap aksesiT. flagelliforme
yang berumur 6 bulan setelah tanam
Analisis efek toksik terhadap larvaArtemia sp. dan aktivitas lektin dari ekstrak protein umbi
setiap aksesiT. flagelliforme
umur 6 bulan setelah tanam
Analisis aktivitas antiproliferasi terhadap sel kanker MCF-7 dan efek
toksik terhadap sel nomal fibroblas dari ekstrak protein umbiT. flagelliformeaksesi terpilih yang
berumur 6 bulan setelah tanam
5
2 TINJAUAN PUSTAKA
Keladi Tikus
Keladi tikus merupakan tumbuhan yang tersebar luas dari daerah tropis hingga daerah subtropis Asia serta daerah Australia. Tumbuhan ini telah diketahui sampai saat ini terdiri atas 40 spesies. Keladi tikus merupakan tumbuhan herba dan dapat tumbuh mencapai 5-12 cm panjangnya. Tanaman ini memiliki umbi yang tumbuh di bawah permukaan tanah. Daunnya bertangkai membentuk jantung dengan bagian ujung lainnya meruncing serta tepi daun yang rata. Selain itu, daun berwarna hijau dan mengkilap (Wang dan Yang 1996). Batang tumbuhan ini berwarna hijau dan pada pangkal batang berwarna putih. Umbi keladi tikus berwarna cokelat muda dibagian luar dan putih di bagian dalam serta berlendir (Gambar 2) (Syahid 2008). Perkembangbiakan tumbuhan ini dapat dilakukan secara vegetatif dengan pemisahan umbi. Namun, tumbuhan ini tidak dibudidayakan oleh masyarakat (Surachman 2009). Klasifikasi ilmiah dari keladi tikus adalah Spermatophyta, divisi Magnoliophyta, kelas Liliopsida, famili Araceae, subfamily Aroideae, suku Areae, genus Typhonium (Wang dan Yang 1996).
Terdapat 3 spesies Typhonium yang penting sebagai tanaman obat, yaitu T. trilobatum, T. roxburghii, danT. flagelliforme. Secara kekerabatan, T.trilobatum
memiliki kesamaan 63 % dengan T. roxburghii sedangkan T. flagelliforme
memiliki kesamaan 43 % dengan T. trilobatum dan T. roxburghii (Rout 2006). Tumbuhan keladi tikus ini di Indonesia dan di beberapa negara di Asia digunakan sebagai obat tradisional untuk mengobati kanker dan penyakit lainnya. Secara fitokimia, keladi tikus (T. flagelliforme) memiliki kandungan flavonoid dan alkaloid (Nobakht et al. 2010). Secara ilmiah, penelitian menggunakan ekstrak diklorometana keladi tikus (T. flagelliforme) dapat berperan sebagai anti leukemia dan menginduksi terjadinya apoptosis pada sel (Mohan et al. 2010). Selain itu, keladi tikus (T. divaricatum) mengandung lektin yang dapat berfungsi sebagai antivirus dan anti-proliferatif padacell linekanker manusia (Luoet al. 2007).
Kajian-kajian ilmiah tersebut menjadikan keladi tikus merupakan tumbuhan yang penting bagi perkembangan obat antikanker. Kajian ilmiah mengenai keladi tikus sampai saat ini belum banyak dilakukan, terutama kajian mengenai keragaman kandungan dan aktivitas lektin pada keladi tikus (T. flagelliforme) yang tumbuh di Indonesia. Oleh karena itu hal tersebut menarik untuk dikaji lebih lanjut mengenai lektin yang terkandung di keladi tikus yang tumbuh di Indonesia.
Lektin
Lektin dapat disebut sebagai phytohemagglutinin. Lektin merupakan protein non enzim yang biasa disebut sebagai sugar binding protein atau glikoprotein yang bukan dihasilkan dari reaksi imun. Lektin pertama kali ditemukan di tumbuhan yang diberi nama ricin tetapi glikoprotein ini dapat ditemukan pada organisme lainnya seperti bakteri dan mamalia. Lektin pada organisme dapat terikat pada membran atau terlarut pada cairan biologis. Spesifisitas lektin dapat dikelompokkan berdasarkan interaksinya dengan monosakarida atau oligosakarida sederhana. Interaksi tersebut dapat menghambat reaksi aglutinasi yang diinduksi lektin (Goldsteinet al. 1980).
Lektin dapat didefinisikan sebagai protein yang mempunyai sedikitnya satu domain non katalis yang dapat berikatan secara reversible dengan molekul karbohidrat secara spesifik. Berdasarkan definisi tersebut, maka secara struktur lektin terdiri atas 4 jenis, yaitu merolectin, hololectin, chimerolectin, superlectin
(Peumans dan Damme 1995).
Merolectin merupakan lektin yang memiliki satu domain untuk berikatan dengan karbohidrat. Contoh lektin jenis ini adalah hevein dari lateks Hevea brasiliensis (Parijs et al. 1991). Hololectin merupakan lektin yang memiliki sedikitnya dua domain yang identik untuk berikatan dengan karbohidrat secara spesifik. Lektin jenis ini terdapat di banyak jenis tanaman, contohnya adalah concanavalin A. Chimerolectin merupakan jenis lektin yang mempunyai dua domain, yaitu domain yang dapat berikatan dengan karbohidrat dan domain yang memiliki aktivitas biologis lainnya. Dua domain tersebut tidak saling mempengaruhi. Contoh dari lektin jenis ini adalah ricin, dengan domain pertama sebagai tempat berikatan dengan karbohidrat dan domain lainnya memiliki aktivitas toksik. Superlectin merupakan jenis lektin yang hampir sama dengan
chimerolectintetapi memiliki banyak domain identik (Dammeet al. 1998).
Berdasarkan sumber tumbuhannya, lektin dikelompokkan menjadi 7 famili. Famili pertama adalah lektin legum, yaitu lektin yang berasal dari Leguminoseae. Namun tanaman legum dapat memproduksi lektin selain famili lektin legum seperti tipe 2 RIP (Ribosom Inactivating Protein) related lectin. Famili kedua disebutchitin binding lectin, yaitu lektin yang mempunyai sedikitnya satu domain hevein. Famili ketiga adalah tipe 2 RIP (Ribosom Inactivating Protein) related lectin, yaitu lektin yang memiliki aktivitas inaktivasi ribosom. Famili keempat adalah jacalin, yaitu lektin yang berasal dari biji nangka dan yang berasal dari tanaman yang secara evolusi terkait dengan nangka atau memiliki kesamaan struktur termasuk lektin jenis jacalin. Famili kelima adalah lektin amaranthin, yaitu lektin yang berasal dari genus Amaranthus. Famili keenam adalah lektin floem Cucurbitaceae, yaitu lektin yang berasal dari eksudat floem spesies Cucurbitaceae. Famili ketujuh adalah monocot mannose binding lectin(MMBL), yaitu lektin yang berasal dari tumbuhan monokotil dan spesifik berikatan dengan manosa (Dammeet al. 1998).
7
(Typhonium sp.) tergolong famili Araceae, sehingga lektin yang terkandung di tumbuhan tersebut termasuk jenis MMBL. Lektin jenis ini dapat berikatan spesifik dengan manosa, yaitu gula sederhana epimer C-2 dari glukosa. Lektin dari famili Araceae memiliki bobot molekul 12-14 kDa bila dideteksi dengan elektroforesis SDS-PAGE (Dammeet al.1998). Lektin ini pertama kali terungkap pada tahun 1987 (Damme et al. 1987), namun lektin yang dihasilkan dari genus
Typhonium belum banyak dikaji secara ilmiah. Informasi ilmiah lektin genus ini sangat sedikit bila dibandingkan dengan lektin dari famili legume yang telah dikaji secara lengkap beberapa dekade seperti khasiat dan jalur biosintesisnya (Damodaranet al. 2008).
Proses biosintesis lektin pada tumbuhan sama seperti sintesis protein pada umumnya. Perbedaan terdapat setelah proses biosintesis terjadi, yaitu lektin ditranslokasi ke jaringan penyimpan seperti vakuola. Oleh karenanya, lektin berfungsi sebagai protein cadangan bagi tumbuhan (Damme et al. 1998). Contohnya pada umbiTyphonium divaricatum (L.) Decne, terdapat lektin dengan bobot molekul 48 kDa dan stabil pada kisaran temperatur 20-60 °C dan pH 5.6-8.6 (Luoet al. 2007).
Lektin bagi tumbuhan berperan sebagai pelindung dari mikroba patogen, herbivora atau predator. Lektin juga berperan dalam melindungi biji dari predator. Sebagai contoh beberapa biji tanaman legum mengandung lektin sehingga ketika biji tersebut dimakan oleh predator atau herbivora maka lektin tersebut akan berikatan dengan glikoprotein yang berada pada usus halus dan menyebabkan gangguan penyerapan nutrisi (Hans dan Heldt 2005). Selain itu, lektin dapat menggumpalkan sel-sel darah merah dari berbagai jenis hewan. Reaksi tersebut dapat terjadi karena interaksi antara situs-situs pengikatan pada lektin dengan reseptor spesifik glikokonjugat di permukaan membran sel. Oleh karena fungsi lektin pada tumbuhan terdapat kaitan dengan pertahanan dan interaksi tumbuhan dengan lingkungan dibandingkan dengan fungsinya sebagai pertumbuhan dan perkembangan, maka lektin dapat digolongkan pada kelompok metabolit sekunder (Makkar et al. 2007). Kemampuan lektin yang dapat berikatan spesifik dengan senyawa karbohidrat menjadikan lektin dapat diaplikasikan untuk identifikasi sel, kajian mengenai glikoprotein, kajian histokimia, dan kajian sitokimia. Selain itu, lektin juga bersifat mitogenik, yaitu memiliki kemampuan merangsang limfosit ketika proses mitosis (Sharon dan Lis 2004).
Lektin dapat berperan sebagai antikanker dengan mekanisme secara umum melalui proses apoptosis pada sel kanker sehingga pertumbuhan sel kanker terhambat. Contohnya lektin dari tumbuhan legum seperti ConA dan ConBr, mampu menghambat proses proliferasi sel kanker seperti sel HL-60 dan MOLT-4 (Martins et al. 2012). Selain itu, dapat menghambat pertumbuhan sel kanker melanoma A375. Proses tersebut terjadi melalui proses apoptosis yang diinduksi oleh lektin melalui mekanisme caspase (Liuet al. 2009a).
Oleh karena lektin merupakan molekul protein, maka dalam proses karakterisasinya diperlukan lektin yang terpurifikasi. Tahapan purifikasi merupakan proses eksploitasi protein target yang pada penelitian ini protein targetnya adalah lektin. Purifikasi yang baik adalah mendapatkan protein target dalam jumlah yang banyak dengan meminimalkan kehilangan aktifitasnya serta menghilangkan kontaminan (protein lain) secara maksimal (Rosenberg 2005). Purifikasi protein dilakukan menggunakan teknik kromatografi menggunakan kolom kromatografi. Kolom yang digunakan dapat berupa kolom afinitas, penukar ion, atau filtrasi gel. Setelah didapatkan lektin terpurifikasi, karakterisasi lektin diperlukan untuk menentukan sifat-sifat lektin terpurifikasi. Paramameter yang perlu diamati adalah aktivitas lektin terhadap temperatur dan pH. Aktivitas lektin diketahui dari uji hemmagglutinasi. Hal ini dilakukan karena lektin merupakan protein sehingga sangat dipengaruhi oleh temperatur dan pH. Bila temperatur terlalu tinggi akan mendenaturasi protein, bila terlalu rendah akan terjadi inaktivasi protein sehingga aktivitasnya menurun. Nilai pH, akan berpengaruh pada konformasi protein, sehingga pH yang tidak tepat akan menurunkan aktivitas protein (Nelson dan Cox 2008).
Apoptosis
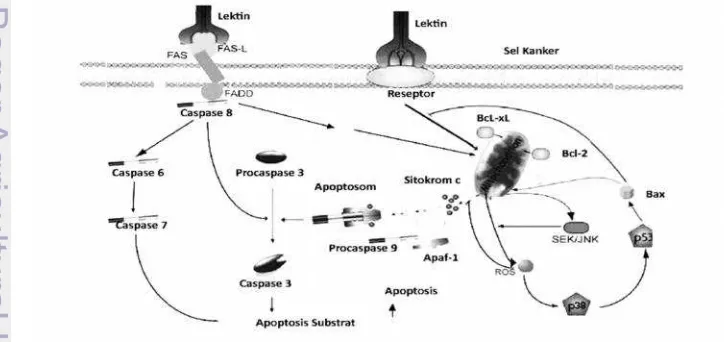
Apoptosis merupakan kematian sel terencana dan tujuannya pada kondisi normal untuk menghilangkan sel yang tidak diinginkan. Karakteristik sel yang mengalami apoptosis adalah terjadi kondensasi sitoplasma dan nukleus, fragmentasi pada DNA, kontraksi sel, terjadi autofagositosis pada sel tersebut, dan tidak teraturnya konformasi membran sel. Secara morfologi, sel yang mengalami apoptosis terdapat kerusakan seperti terbentuknya tonjolan di bagian membran (Hengartner 2000). Caspase merupakan protease yang menginduksi apoptosis pada sel normal dan terdapat di sitosol sebagai procaspase (caspase inaktif). Ketika terdapat sinyal aktivasi caspase, maka aktifnya satu caspase mengaktifkan reaksiirreversiblekaskade caspase (Gambar 3) (Albertset al. 2008).
Aktifasi procaspase
9
Faktor yang dapat mengaktifkan caspase adalah faktor ekstrinsik dan intrinsik. Faktor ekstrinsik merupakan sinyal protein yang dapat berikatan dengan reseptor kematian sel yang terdapat di permukaan sel. Ketika protein ekstraseluler berikatan dengan reseptor tersebut, maka ligand protein ekstraseluler-reseptor membentuk kompleks sinyal induksi kematian (Death Inducing Signaling Complexs) yang dapat merubah procaspase menjadi caspase. Faktor intrinsik melibatkan sitokrom c dari mitokondria. Pelepasan sitokrom c diinduksi oleh sinyal dari luar sel yang bersifat pro-apoptotik. Sitokrom c yang dilepas berikatan dengan adaptor protein aktifator procaspase Apaf1 dan membentuk kompleks sinyal induksi kematian yang merubah procaspase menjadi caspase (Alberts et al. 2008). Lektin dapat menginduksi caspase dengan kedua jalur tersebut (Liu et al. 2010). Contohnya lektin mistletoe dapat menginduksi terjadinya ketidakstabilan permeabilitas membran mitokondria sehingga melepaskan senyawa ROS dan sitokrom c yang menginduksi apoptosis melalui caspase (Seifertet al. 2008).
Mekanisme molekuler lektin dalam menginduksi proses apoptosis pada sel kanker dapat dilakukan dengan banyak jalur. POL (Polygonatum odoratum
Lectin) yang merupakan lektin dari kelompok MMBL dapat menginduksi proses apoptosis melalui jalur reseptor kematian sel dengan meningkatkan protein intraseluler yang terkait dengan kematian sel (Fas-Associated protein Death Domain) sehingga mengaktivasi caspase 8. Selain itu, dengan pemberian POL pada sel kanker, dapat menyebabkan terganggunya potensial transmembran mitokondria sehingga sitokrom c dilepaskan dari mitokondria dan hal tersebut mengaktivasi caspase 9 serta caspase 3. Pemberian POL dengan konsentrasi rendah pada sel kanker pun dapat meningkatkan efek apoptosis dari faktor nekrosis seluler (Liuet al. 2009b). Lain halnya jalur apoptosis yang dinduksi oleh lektin dari P. cyrtonema (PCL). Lektin tersebut menginduksi terekspresinya protein Bax sebagai protein inisiator apoptosis sel dan menghambat kerja protein Bcl-xL yaitu protein yang berfungsi untuk mencegah pelepasan molekul dari mitokondria. PCL juga menginduksi mitokondria untuk menghasilkan senyawa oksigen radikal (Reactive Oxygene Species) sehingga mengaktifkan protein lain yang terkait dengan stres oksidatif sel (Liu et al. 2009c). Oleh karenanya, proses induksi apoptosis oleh lektin banyak melibatkan jalur sinyal seluler sehingga jalur apoptosis sel merupakan mekanisme utama dari lektin sebagai antiproliferasi terhadap sel kanker (Gambar 4).
Aktivitas lektin sebagai antiproliferasi terhadap sel kanker dimodelkan menggunakan uji toksisitas terhadap larva Artemia sp. dengan menggunakan metode BSLT (Brine Shrimp Lethality Test) dan sel kanker pada penelitian ini. Metode BSLT merupakan metode awal yang efesien untuk mengetahui aktivitas suatu senyawa bioaktif atau untuk mengetahui efek toksik suatu ekstrak. Larva
Artemia sp.digunakan pada metode ini karena larva ini adalah hewan sederhana sehingga dapat dianalogikan sebagai sel tunggal dan mudah untuk dikontrol untuk diuji ketahanannya terhadap toksisitas ekstrak senyawa bioaktif tumbuhan (Churiyah 2005). Setelah terkonfirmasi larutan protein yang mengandung lektin memiliki efek toksik pada Artemia sp., pengujian dilanjutkan dengan menggunakan sel kanker, yaitu MCF-7. Efek toksik dari ekstrak dapat terlihat bila ekstrak dapat menghambat proliferasi sel MCF-7. Bila proliferasi sel kanker tidak terjadi penurunan, maka ekstrak protein yang mengandung lektin tidak dapat berfungsi sebagai antikanker atau tidak memiliki aktivitas antikanker pada jenis kanker tersebut (Monkset al. 1991).
Gen Penyandi Lektin
Studi pada lektin tumbuhan menunjukkan bahwa protein tersebut terbagi dalam 7 superfamili berdasarkan sumber tumbuhan penghasil lektin. Legum lektin yang terdapat pada biji tanaman legum merupakan jenis lektin pertama dan telah banyak dikaji dari jenis lektinnya dan gen pengkode lektin tersebut.Phyto-erythro agglutinating (PHA-E) dan Phyto-leuco agglutinating (PHA-L) adalah lektin yang terdapat padaPhaseolus vulgaris. Kedua protein tersebut dikodekan dari gen
dlec1dandlec2. Kedua gen tersebut tidak memiliki intron dan memiliki 2 kodon ATG pada urutan basa 11-14 (Hoffman dan Donaldson 1985). Selain itu, pada tanaman legum diketahui dapat memiliki lebih dari satu jenis lektin. Dolichos biflorus memiliki lektin pada biji dan DB58 (terdapat pada batang dan daun). Lektin pada biji terdeteksi pada tahap pematangan embrio dan tidak terdeteksi pada tahap perkecambahan. Lektin ini tidak terdapat pada organ tanaman dewasa, sedangkan lektin DB58 terdeteksi pada batang dan daun pada tahap perkecambahan. Kedua jenis lektin ini dikodekan oleh dua gen yang berbeda yang tidak mengandung intron tetapi terletak di orientasi transkripsi yang sama (Talbot dan Etzler 1978, Etzleret al. 1984, Haradaet al. 1990).
11
3 BAHAN DAN METODE PENELITIAN
Waktu dan Tempat Penelitian
Analisis total protein umbi, aktivitas lektin umbi, toksisitas dan penanaman
T. flagelliforme dari bulan Februari 2011 hingga Februari 2013 dilakukan di laboratorium Pusat Teknologi Farmasi Medika dan Balai Bioteknologi, Badan Pengkajian dan Penerapan Teknologi, Serpong, Indonesia. Sedangkan analisis identifikasi genetika lektin dilakukan di laboratorium Fisiologi dan Genetika Tumbuhan, Departemen Biologi, FMIPA, IPB dari bulan Maret 2013 hingga Januari 2015.
Bahan Tanaman
Penelitian ini menggunakan umbi segar dari 7 aksesi T. flagelliforme
(Lodd.) Blume yang didapatkan dari berbagai wilayah di Indonesia (Tabel 1). Tanaman tersebut telah diaklimatisasi dan ditumbuhkan di dalam rumah kaca (November 2009 hingga Januari 2011) pada Balai Bioteknologi, Badan Pengkajian dan Penerapan Teknologi, Serpong, Indonesia. Tanaman yang telah teraklimatisasi menjadi tanaman mother stock. Setiap umbi yang digunakan pada penelitian ditanam pada media yang sama dengan menggunakan wadah polybag
yang berbeda dengan tanaman mother stock dan ditanam berkelompok berdasarkan umur masa tanam 1, 3, 5, dan 6 bulan di rumah kaca. Umbi yang digunakan sebagai umbi awal adalah anakan umbi dari umbi utama pada tanaman
mother stocklalu ditanam dan dipanen pada umur tanaman 1, 3, 5, dan 6 bulan.
Tabel 1 Daerah aksesiT.flagelliformeyang digunakan dalam penelitian
Aksesi Lokasi Bogor Jawa Barat Singaraja Bali
Merapi Farm Yogyakarta Indmira Yogyakarta Ogan Ilir Sumatera Selatan Matesih Jawa Tengah Solok Sumatera Barat
Metode
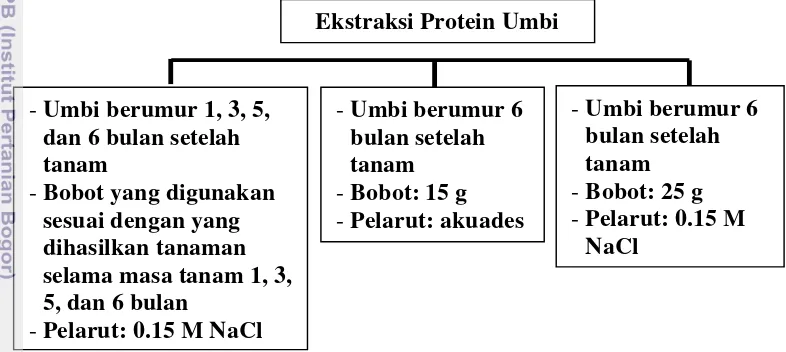
13
dilakukan dari umbi tanaman yang berumur 6 bulan setelah tanam sebanyak 15 g dengan menggunakan pelarut akuades dan ekstrak ini digunakan untuk analisis toksisitas terhadap Artemia sp. serta sel MCF-7. Bagian ketiga dilakukan dari umbi tanaman yang berumur 6 bulan setelah tanam sebanyak 25 g dengan menggunakan pelarut 0.15 M NaCl dan ekstrak ini digunakan untuk fraksinasi protein umbi. Selain itu, umbi yang digunakan untuk 3 ekstraksi tersebut ditanam berbeda kelompok, yaitu kelompok pertama ditanam untuk ekstraksi bagian pertama, kelompok dua ditanam untuk ekstraksi bagian kedua, dan kelompok ketiga ditanam untuk ekstraksi bagian ketiga.
Tahapan ekstraksi diawali dengan membersihkan umbi yang akan digunakan, lalu ditimbang bobotnya. Umbi segar yang sudah dibersihkan lalu diblender dan dicampur dengan pelarut yang volumenya dua kali dari bobot umbi. Setelah direndam semalam pada 4 °C, campuran tersebut disentrifugasi (Hettich Mikro 22R, Germany) dengan kecepatan 5000 rpm selama 30 menit dalam kondisi dingin. Supernatan yang dihasilkan adalah ekstrak kasar protein umbi.
Gambar 5 Bagian-bagian ekstraksi protein umbi yang dilakukan pada penelitian
Uji Kadar Total Protein Metode Bradford. Konsentrasi total protein terlarut diukur kadarnya dengan menggunakan metode Bradford. Protein BSA (Bovine Serum Albumin) digunakan sebagai larutan protein baku. Kurva standar yang digunakan adalah hasil regresi linear dari protein BSA dengan konsentrasi bertingkat yang diukur pada panjang gelombang 595 nm. Konsentrasi protein ekstrak didapatkan dari hasil pengukuran nilai absorbansi larutan pada panjang gelombang 595 nm, lalu diplotkan pada persamaan kurva standar (Bintang 2010). Setiap ekstrak protein umbi yang didapatkan pada penelitian ini dihitung kadar total proteinnya dengan menggunakan metode ini. Perhitungan kadar total protein umbi dilakukan dengan formulasi sebagai berikut:
= konsentrasi total protein (mg/ml) x volume pelarut ekstrak (ml)
Uji Hemaglutinasi. Uji ini dilakukan untuk mengidentifikasi lektin yang terkandung pada protein terlarut. Uji ini dilakukan menggunakan 96-well micro
titer U plate. Eritrosit domba sebanyak 50 µl (2% di dalam phosphate buffer saline pH 7.0) dicampur dengan ekstrak kasar protein umbi dengan berbagai jumlah volume (150, 125, 100, 75, 50, 25, 12.5 µL). Hasil reaksi tersebut dilihat setelah 2 jam inkubasi pada suhu ruang. Aktivitas hemaglutinasi dari reaksi dinyatakan dalam unit, yaitu perbandingan volume eritrosit yang digunakan dengan volume ekstrak ( Wanget al. 2000). Hasil positif reaksi aglutinasi adalah warna merah seragam pada larutan sedangkan hasil negatif aglutinasi adalah warna merah titik di tengah. Setiap larutan protein dari hasil ektraksi dilakukan uji hemaglutinasi untuk mendeteksi kandungan lektin. Perhitungan hemaglutinasi dapat dirumuskan sebagai berikut:
Aktivitas hemaglutinasi = Volume eritrosit Volume larutan protein
Visualisasi Profil Protein dengan SDS-PAGE. Profil protein yang didapatkan dari tiap ekstrak dan hasil fraksinasi divisualisasikan dengan sodium dodecyl sulphate polyacrylamide gel electrophoresis (SDS-PAGE). Gel yang digunakan terdiri dari 4 %stakcing gel dan 12 %separating gel. Sebanyak 17 µl larutan protein di dalam loading dye (1:1) dimasukan ke setiap sumur. Elektroforesis dilakukan dengan mini gel electrophoresis unit dengan voltase stabil pada 165 V selama 45 menit. Pewarnaan pita protein menggunakan
coomassie brilliant blue(Biorad, USA) danunstained protein ladder (Fermentas, USA) digunakan untuk marka bobot molekul protein (Bintang 2010).
Fraksinasi Esktrak Protein Umbi Aksesi Terseleksi dengan Metode Kromatografi. Ekstrak protein umbi yang terseleksi untuk dilakukan fraksinasi adalah ekstrak protein umbi aksesi Solok umur 6 bulan setelah tanam. Ekstrak kasar protein umbi disaring dengan 0.2 µmmicro filter, lalu sebanyak 2 ml filtrat dimasukan ke dalamHiTrapDEAE-Sepharose Fast Flow column(GE Healthcare Life Science, USA) yang sudah diekuilibrasi dengan 20 mM Tris-HCl pH 8.0. Larutan protein tersebut dielusi dengan 30 ml larutan gradien 0-1 M NaCl dan laju alir yang digunakan adalah 1 ml/menit. Larutan buffer dari fraksi aktif pada tahap ini diganti dengan 20 mM buffer asetat pH 4.3 menggunakan HiTrap Desalting column (GE Healthcare Life Science, USA). Setelah itu, larutan protein dimasukan ke dalam CM monolithic column (BIA Separations, Austria) yang sudah diekuilibrasi dengan 20 mM buffer asetat pH 4.3. Larutan protein ini dielusi dengan 30 ml larutan gradien 0-1 M NaCl dan laju alir yang digunakan adalah 2 ml/menit. Fraksi aktif dari tahap ini kemudian diganti larutan buffernya dengan PBS pH 7.2 (Luoet al. 2007 dengan modifikasi).
15
buffer Tris-HCl (pH 8 and 9). Larutan tersebut diinkubasi 30 menit pada suhu ruang dan diuji aktivitas aglutinasinya (Luoet al. 2007 dengan modifikasi).
Isolasi DNA.Metode isolasi DNA ini menggunakan metode dari Doyle dan Doyle (1987) dengan beberapa modifikasi. Bahan tanaman yang digunakan adalah bagian daun dari setiap aksesi T. flagelliforme. Tahap awal dari proses adalah 100 mg daun dipotong dan dimasukan ke dalam microtube ukuran 2 mL. Selanjutnya daun tersebut digerus dengan kondisi direndam pada N2 cair. Setelah halus
ditambahkan dengan 650 µL buffer ekstraksi yang telah diinkubasi pada temperatur 65 °C dan mengandung 2 % PVP (Poly Vinyl Pyrrolidone) serta 2 µL merkaptoetanol. Campuran tersebut diinkubasi pada temperatur 65 °C selama 30 menit dengan setiap 10 menit diaduk. Sebelum ditambah dengan kloroform-isoamilalkohol (24:1) sebanyak satu kali volume, campuran diinkubasi di dalam es selama 5 menit. Campuran tersebut diaduk secara perlahan selama 10 menit dan disentrifugasi dengan kecepatan 10000 rpm selama 15 menit pada temperatur 4 °C. Supernatan yang terbentuk ditambahkan fenol-kloroform-isoamilalkohol (25:24:1) sebanyak satu kali volume dan diaduk secara perlahan selama 10 menit. Setelah itu, disentrifugasi kembali dengan kecepatan 10000 rpm selama 10 menit pada temperatur 4 °C. Supernatan yang dihasilkan ditambahkan 2 M Na-asetat pH 5.2 sebanyak 0.1 volume dan etanol absolut sebanyak 2 kali volume. Larutan diaduk perlahan selama 5 menit dan disimpan semalam pada temperatur -20 °C untuk mengendapkan DNA.
Setelah diendapkan semalam, larutan disentrifugasi dengan kecepatan 10000 rpm selama 10 menit pada temperatur 4 °C. Supernatan yang didapatkan dihilangkan dan endapan yang terbentuk ditambah etanol 70 % sebanyak 500 µL. Kemudian, disentrifugasi dengan kecepatan 10000 rpm selama 5 menit pada temperatur 4 °C. Larutan etanol 70 % dihilangkan dan endapan DNA dikeringkan pada inkubator 37 °C. Setelah kering, ditambahkan 20 µL ddH2O dan 5 µL
RNAse untuk diinkubasi pada temperatur 37 °C selama 10 menit. Setelah itu dilakukan inaktivasi RNAse dengan menginkubasi larutan pada temperatur 70 °C selama 10 menit. DNA yang didapat disimpan pada temperatur -20 °C.
Perancangan primer.Primer yang digunakan pada penelitian ini dirancang berdasarkan basis data (www.ncbi.nlm.nih.gov/) sekuen complete CDS lektin beberapa tumbuhan yang memiliki famili sama dengan T. flagelliforme, yaitu Araceae. Tumbuhan tersebut adalah Pinellia ternata (JF293072.1; EU199445.1),
Remusatia vivipara (EU924066.1), Typhonium divaricatum (EF194099.1),
Pinellia cordata (EF090419.1), Pinellia pedatisecta (AY451853.1), Arisaema lobatum (AY557617.1), dan Arisaema amurense (EU409835.1). Sekuen tersebut dilakukan pensejajaran menggunakan program Bioedit 7 untuk mendapatkan bagianconserve sequence. Hasil pensejajaran digunakan untuk merancang primer dengan menggunakan sekuens basa pada bagian ujung 5' dan 3'. Selanjutnya, sekuen primer yang didapatkan dianalisis kembali dengan BLASTN (www.ncbi.nlm.nih.gov/) untuk mengetahui kesesuaiannya dengan basis data yang telah digunakan dalam perancangan primer.
Analisis Amplikasi DNA dengan Polymerase Chain Reaction (PCR).
Analisis fragmen lektin dari DNA genom dilakukan dengan primer spesifik lektin yang dirancang dari beberapa sekuens CDS (Coding DNA Sequence) dan full length cDNA lektin tanaman famili Araceae. Primer yang digunakan adalah 5'-TCT TCC TCC TCC CGG CCA TC-3' sebagai forward dan 5'-GAG CTC GCC CTT GTG GTT CA-3' sebagai reverse. Reaksi PCR menggunakan kit
KAPA2G™ Fast ReadyMix (2x) (Kapa Biosystems, USA) dengan volume total 25 µl. Komposisi PCR yang digunakan adalah 100 ng DNA template, 10 µM primer forward dan reverse, 1x KAPA2G™ Fast ReadyMix (2x), dan free nuclease watersampai volume total 25 µl. Program PCR yang digunakan adalah pra-denaturasi 95°C, 3 menit; diikuti dengan 35 siklus denaturasi 95°C, 15 detik; penempelan primer 55°C, 15 detik; pemanjangan 72°C, 20 detik; dan diakhiri dengan pasca-PCR 72°C, 10 menit; penyimpanan 4°C, 10 menit. Hasil PCR ini dianalisis lanjut sekuensnya dan divisualisasi kembali dengan elektroforesis.
Penyisipan Fragmen Lektin ke dalam Vektor pGEM®-T Easy. Proses
penyisipan fragmen lektin dengan vektor pGEM®-T Easy menggunakan kloning kit pGEM®-T Easy Vector System (Gambar 6) (Promega, USA). Komposisi
reaksi ligasi yang digunakan adalah 5µl 2X Rapid Ligation Buffer, 1 µl vektor pGEM®-T Easy , 2 µl produk PCR, 1 µl T4 DNA Ligase, dan 1µl free nuclease water. Kemudian, campuran diinkubasi pada suhu 4 °C selama semalam.
17
Introduksi Vektor pGEM®-T Easy ke dalam Bakteri Escherichia coli
DH5α. Proses introduksi vektor pGEM®-T Easy_lektin ke dalam bakteri Escherichia coli DH5α dilakukan mengikuti metode Transform Aid Bacterial Transformation Kit (Thermo Scientific, USA). Bakteri transforman ditumbuhkan dalam media seleksi Luria Agar (LA) yang mengandung 100 ppm ampisilin. Koloni bakteri yang tumbuh diambil untuk PCR koloni dengan tahapan lisis pada awal proses PCR. Kondisi program lisis yaitu 96ºC, 5 menit; 50ºC, 1,5 menit; 96ºC, 1,5 menit; 45ºC, 1,5 menit, 96ºC, 1 menit; 40ºC, 1 menit (PCR di pause
untuk memasukkan mix PCR); kemudian diikuti dengan 35 siklus program PCR dengan menggunakan metode KAPA2G™ Fast ReadyMix (2x) (Kapa Biosystems, USA). Berdasarkan PCR koloni, maka koloni yang positif membawa vektor pGEM®-T Easy_lektin diisolasi menggunakan GeneJET Plasmid Miniprep Kit (Thermo Scientific, USA). Hasil isolasi ini dianalisis lanjut sekuensnya.
Analisis Sekuens. Analisis ini dilakukan untuk mengkonfirmasi bahwa sekuens yang didapatkan merupakan sekuens dari gen lektin umbiT. flagelliforme. Analisis menggunakan BLAST (Basic Local Alignment Search Tool) pada NCBI (National Center for Biotechnology Information) untuk menunjukkan homologinya dengan gen lektin dari tumbuhan lainnya. Sedangkan untuk pensejajaran antara fragmen DNA setiap aksesi dan dengan tumbuhan lainnya menggunakan program BioEdit 7. Analisis dendrogram gen lektin menggunakan program MEGA5 dengan metode maximum parsimony dan bootstrap sebanyak 1000 kali.
Uji Toksisitas Metode BSLT. Ekstrak protein yang didapatkan diuji toksisitas dengan menggunakan metodebrine shrimp lethality test(BSLT). Media pertumbuhan untuk telur larva udang menggunakan air laut buatan menggunakan 38 g garam di dalam 1 l akuades. Ruang untuk inkubasi telur yang digunakan terdapat bagian tanpa dan terkena cahaya. Telur udang Artemia sp. diinkubasi pada bagian tanpa cahaya selama 24 jam pada suhu ruang. Telur yang menetas pada bagian terkena cahaya dipindahkan ke media pertumbuhan yang baru dan diinkubasi kembali dengan terkena cahaya selama 24 jam pada suhu ruang. Setelah itu, 10 larva udang dipindahkan kembali ke tabung uji yang berisi 5 ml media pertumbuhan dan ekstrak kasar protein umbi dengan berbagai konsentrasi (5, 7.5, 10, 15, 20 ppm). Campuran tersebut diinkubasi dengan terkena cahaya selama 24 jam pada suhu ruang. Kemudian, persentase kematian dari udang tersebut diukur pada tiap konsentrasi ekstrak dan diukur nilai LC50 (Meyer et al.
1982)
Uji Antiproliferasi Sel Kanker Metode MTT. Uji ini dilakukan untuk mengevaluasi aktivitas antiproliferasi dari ekstrak protein umbi T. flagelliforme
secarain vitrodengan menggunakan metode MTT (3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide) terhadap sel kanker MCF-7 yang didapatkan dari Pusat Teknologi Farmasi dan Medika, Badan Pengkajian dan Penerapan Teknologi, Indonesia. Sel kanker ditumbuhkan pada media RPMI (Roswell Park Memorial Institute) 1640 yang mengandung 10 % serum fetal bovine (Gibco, USA) dan 1 % penisilin-streptomisin (Gibco, USA) pada inkubator CO2 (5 %
96-well plate dengan konsentrasi sel 5x103 di setiap sumur dan diinkubasi dengan
kondisi yang sama seperti sebelumnya. Berbagai konsentrasi ekstrak protein (6.25, 12.5, 25, 100, 200 ppm) ditambahkan kemudian lalu diinkubasi kembali dengan kondisi yang sama seperti sebelumnya. Selanjutnya, setiap sumur dicuci dengan PBS (Phosphate Buffer Saline) pH 7.0 untuk menghilangkan sel yang mati, lalu ditambahkan 100 µL MTT (0.5 mg/ml di dalam PBS) dan diinkubasi kembali selama 4 jam pada inkubator CO2pada suhu 37 °C. Sebanyak 100 µL SDS 20 %
ditambahkan setelah inkubasi, lalu dilakukan inkubasi kembali pada ruang gelap selama semalam. Sel yang hidup akan mereduksi reagen MTT yang berwarna kuning dengan bantuan suksinat dehidrogenase mitokondria sehingga membentuk molekul formazan yang berwarna ungu (American Type Culture Collection 2011). Endapan formazan yang terbentuk setelah inkubasi diukur absorbansinya pada panjang gelombang 570 nm dan hasil tersebut digunakan untuk mengukur nilai LC50(Luoet al. 2007 dengan modifikasi). Perhitungan daya hambat proliferasi sel
diformulasikan sebagai berikut:
Daya hambat = Absorban sel terkoreksi–Absorban ekstrak terkoreksi x 100% Absorban sel terkoreksi
Uji Sitotoksisitas Terhadap Sel Normal Metode MTT
Uji sitotoksisitas dilakukan untuk mengetahui efek toksik ekstrak protein umbiT. flagelliformeterhadap sel normal atau sel non kanker. Sel yang digunakan adalah sel fibroblas manusia. Sel tersebut didapatkan dari Pusat Teknologi Farmasi dan Medika, Badan Pengkajian dan Penerapan Teknologi, Indonesia. Metode yang digunakan untuk pengujian ini menggunakan metode MTT. Sel fibroblas ditumbuhkan pada media RPMI 1640 yang mengandung 10 % serum fetal bovine (Gibco, USA) dan 1 % penisilin-streptomisin (Gibco, USA) pada inkubator CO2 (5 % CO2) dengan suhu 37 °C selama 48 jam. Setelah itu, sel
ditumbuhkan pada96-well platedengan konsentrasi sel 5x104di setiap sumur dan diinkubasi dengan kondisi yang sama seperti sebelumnya selama 24 jam. Berbagai konsentrasi ekstrak protein (6.25, 12.5, 25, 100, 200 ppm) ditambahkan kemudian lalu diinkubasi kembali dengan kondisi yang sama seperti sebelumnya. Selanjutnya, setiap sumur dicuci dengan PBS pH 7.0 untuk menghilangkan sel yang mati, lalu ditambahkan 100 µL MTT (0.5 mg/ml di dalam PBS) dan diinkubasi kembali selama 4 jam pada inkubator CO2pada suhu 37 °C. Sebanyak
100 µL SDS 20 % ditambahkan setelah inkubasi, lalu dilakukan inkubasi kembali pada ruang gelap selama semalam. Endapan formazan yang terbentuk setelah inkubasi diukur absorbansinya pada panjang gelombang 570 nm dan hasil tersebut digunakan untuk mengukur persentase daya proliferasi ekstrak terhadap sel fibroblas (Luo et al. 2007 dengan modifikasi). Perhitungan daya proliferasi sel diformulasikan sebagai berikut:
19
4 HASIL PENELITIAN
Bobot Umbi, Protein Umbi, dan Lektin UmbiT. flagelliforme
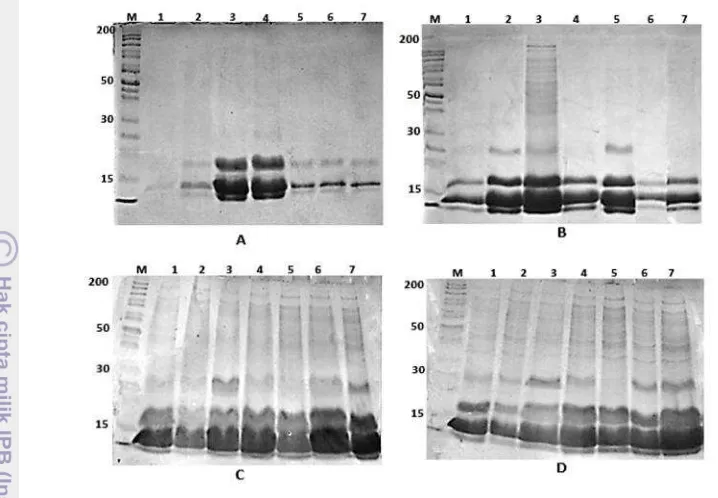
Bagian pertama tahapan penelitian adalah menganalisis bobot, protein, dan lektin umbi dari setiap aksesi T. flagelliforme selama masa tanam. Hal ini dilakukan untuk mengetahui pertumbuhan dan perkembangan umbi dan protein yang terkandung. Aksesi-aksesi dariT. flagelliforme ditumbuhkan di rumah kaca selama periode tanam 1, 3, 5, dan 6 bulan. Hasil pengamatan menunjukkan tidak semua bobot umbi dari setiap aksesi mengalami peningkatan bobot pada masa tanam, terdapat fluktuasi bobot umbi pada beberapa aksesi seperti aksesi Singaraja, Merapi Farm, Indmira, dan Solok. Aksesi Bogor, Ogan Ilir, dan Matesih menunjukan kecenderungan peningkatan bobot umbi pada masa tanam, dari umur 1 hingga 6 bulan setelah tanam. Bobot umbi terendah pada umur 1 bulan setelah tanam dimiliki oleh umbi dari aksesi Ogan ilir, bobotnya seperempat dari bobot umbi tertinggi aksesi Merapi Farm. Bobot umbi tertinggi pada umur 6 bulan setelah tanam dimiliki oleh umbi dari aksesi Singaraja, bobot umbinya lebih tinggi 1.5 kali dari bobot umbi terendah aksesi Solok. Walaupun bobot umbi aksesi Singaraja mengalami fluktuasi pada masa tanam, namun bobot umbi tertingginya terjadi pada umur 6 bulan setelah tanam. Aksesi lainnya, yaitu Merapi Farm, Indmira, dan Solok mengalami kecenderungan penurunan bobot umbi pada umur 6 bulan setelah tanam dari bulan sebelumnya. Kecenderungan Bobot umbi aksesi Merapi Farm tertinggi pada umur 3 bulan setelah tanam, sedangkan aksesi Indmira dan Solok umur 5 bulan setelah tanam (Gambar 7).
21
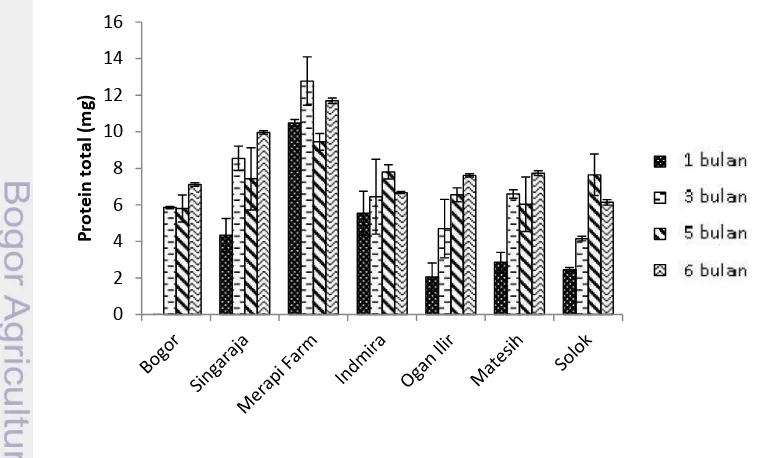
Protein umbi yang telah dipanen dari seluruh aksesi, dihitung kadar total protein umbinya. Hasil menunjukkan hanya aksesi Ogan Ilir kadar total protein umbinya cenderung meningkat secara linier dari umur 1 bulan hingga 6 bulan setelah tanam, sedangkan 5 aksesi yang lain mengalami fluktuasi kadar total protein umbi selama masa tanam. Aksesi Bogor pada umur 1 bulan setelah tanam tidak terdeteksi adanya protein pada umbi. Kadar protein umbi tertinggi pada umur 1 bulan setelah tanam dimiliki oleh aksesi Merapi Farm, kadar tersebut 5 kali lebih tinggi daripada kadar protein umbi terendah aksesi Ogan Ilir. Kadar protein umbi tertinggi pada umur 6 bulan setelah tanam dimiliki oleh aksesi Merapi Farm, kadar tersebut 2 kali lebih tinggi daripada kadar protein umbi terendah aksesi Solok. Aksesi Bogor, Singaraja, Ogan Ilir, dan Matesih cenderung memiliki kadar protein tertinggi pada umur 6 bulan setelah masa tanam dari setiap masing-masing aksesi tersebut. Tiga aksesi lainnya seperti aksesi Merapi Farm, Indmira, dan Solok cenderung mengalami penurunan kadar total protein umbi pada umur 6 bulan setelah tanam. Kecenderungan kadar total protein umbi tertinggi aksesi Merapi Farm terjadi pada umur 3 bulan setelah tanam, aksesi Indmira terjadi pada umur 5 bulan setelah tanam, dan aksesi Solok terjadi pada umur 5 bulan setelah tanam (Gambar 8).
Hasil pengamatan deteksi lektin umbi terdapat 3 aksesi menunjukkan bahwa lektin umbi telah diproduksi dari umur 1 bulan setelah tanam, yaitu aksesi Singaraja, Merapi Farm, dan Indmira. Hal ini ditunjukkan dengan adanya aktivitas hemaglutinasi dari ekstrak protein umbi aksesi tersebut. Lektin pada aksesi lainnya terdeteksi pada umur 3 bulan setelah tanam. Tidak terdapat aksesi yang menunjukkan kecenderungan peningkatan kadar lektin secara linier dari umur 1 bulan hingga 6 bulan setelah tanam. Aksesi Bogor dan Merapi Farm menunjukkan kecenderungan aktivitas hemaglutinasi tertinggi pada umur 6 bulan setelah tanam dari setiap masing-masing aksesi tersebut. Aksesi Indmira, Matesih, dan Solok menunjukkan kecenderungan kadar lektin tertinggi pada umur 5 bulan setelah
tanam dari masing-masing aksesi tersebut. Aksesi Ogan Ilir cenderung menunjukkan kadar lektin tertinggi pada umur tanam 3 bulan, sedangkan aksesi Singaraja menunjukkan aktivitas hemaglutinasi yang cenderung stabil pada umur 1 hingga 5 bulan tanam (Gambar 9).
Gambar 9 Aktivitas hemaglutinasi lektin umbi setiap aksesiT. flagelliforme dari umur 1 hingga 6 bulan setelah tanam. Data pada grafik batang disajikan dengan ± standar deviasi
Elektroforegram Protein Umbi Setiap Aksesi Selama Masa Tanam
23
Gambar 10 Elektroforegram protein umbi T. flagelliforme (Lodd.) Blume selama masa tanam. (A) 1 bulan, (B) 3 bulan, (C) 5 bulan, (D) 6 bulan. M: Markers (kDa), 1: Bogor, 2: Singaraja, 3: Merapi Farm, 4: Indmira, 5: Ogan Ilir, 6: Matesih, 7: Solok
Fraksinasi Protein UmbiT. flagelliformeAksesi Solok Umur 6 Bulan Setelah Tanam
Bagian kedua dari penelitian ini adalah melakukan fraksinasi protein umbiT. flagelliforme. Hasil yang didapatkan dari proses fraksinasi adalah lektin terpurifikasi. Umbi yang digunakan untuk tahapan ini adalah umbi yang berumur 6 bulan setelah tanam, hal ini berdasarkan hasil kajian dari tahap pertama penelitian bahwa terdapat kecenderungan pada umur 6 bulan setelah tanam kadar protein total dan lektin umbi beberapa aksesi dihasilkan secara maksimal. Selain itu, diasumsikan umur 6 bulan setelah tanam kondisi umbi telah cukup dewasa sehingga diharapkan lektin yang terkandung pada umbi cukup banyak. Ekstrak protein umbi dari proses ekstraksi menggunakan 0.15 M NaCl dan dengan jumlah umbi sebanyak 25 g. Ekstrak yang didapatkan dari setiap aksesi T. flagelliforme
diukur kembali kadar total protein umbi, toksisitas, dan aktivitas hemaglutinasi. Hal ini bertujuan untuk menseleksi aksesi yang memiliki kadar lektin yang cukup untuk dilakukan purifikasi lektin sehingga tidak terdapat hambatan dalam proses purifikasi karena kandungan lektin yang rendah. Hasil uji menunjukkan bahwa aksesi Solok memiliki kadar total protein tertinggi dan aksesi Matesih terendah. Efek toksik tertinggi dimiliki oleh aksesi Bogor dengan nilai LC50 terendah