LAMPIRAN 1
DATA BAHAN BAKU
L1.1 KARAKTERISTIK CHOLINE CHLORIDE (ChCl)
Tabel L1.1 Karakteristik Choline Chloride (ChCl) [45]
Spesifikasi Keterangan
Rumus molekul C5H14ClNO
Wujud Serbuk Putih
Berat Molekul 139,62 gr/mol
pH 5,0 – 6,5
Densitas 1,1856 gr/ml
Viskositas 21 mPa*s (20°C)
Melting point 302°C - 305°C
L1.2 KARAKTERISTIK D-GLUKOSA
Tabel L1.2 Karakteristik D-Glukosa [46]
Spesifikasi Keterangan
Rumus molekul C6H12O6
Wujud Serbuk Putih
Berat Molekul 180,0804 gr/mol
pH 5,9
Densitas 1,54 gr/ml
Viskositas -
Melting point 146,1 °C
L1.3 KARAKTERISTIK ETILEN GLIKOL
Tabel L1.3 Karakteristik Etilen Glikol [46]
Spesifikasi Keterangan
Rumus molekul C2H6O2
Wujud Cairan
Berat Molekul 62,07 gr/mol
pH 5,5-7,5
Densitas 1,11 gr/ml
Viskositas 21 cP (20°C)
LAMPIRAN 2
DATA HASIL PENELITIAN
L2.1 DATA HASIL ANALISIS DENSITAS DES
Tabel L2.1 Densitas DES Berbasis D-Glukosa pada Suhu Ruang (30 0C)
Rasio Molar ChCl : D-Glukosa Densitas DES (gr/ml)
1 : 1 1,31895
1,25 : 1 1,29829
1,5 : 1 1,27687
1,75 : 1 1,26640
2 : 1 1,26352
2,25 : 1 1,27988
2,5 : 1 1,29234
Tabel L2.2 Densitas DES Berbasis Etilen Glikol pada Suhu Ruang (30 0C)
Rasio Molar ChCl : Etilen Glikol Densitas DES (gr/ml)
1 : 1 1,28974
1 : 1,25 1,11838
1 : 1,5 1,11723
1 : 1,75 1,11680
1 : 2 1,11576
1 : 2,25 1,11488
L2.2 DATA HASIL ANALISIS pH DES
Tabel L2.3 pH DES Berbasis D-Glukosa pada Suhu Ruang (30 0C)
Rasio Molar ChCl : D-Glukosa pH
1 : 1 6,70
1,25 : 1 6,76
1,5 : 1 6,80
1,75 : 1 6,88
2 : 1 7,05
2,25 : 1 6,96
2,5 : 1 6,91
Tabel L2.4 pH DES Berbasis Etilen Glikol pada Suhu Ruang (30 0C)
Rasio Molar ChCl : Etilen Glikol pH
1 : 1 6,88
1 : 1,25 6,93
1 : 1,5 6,96
1 : 1,75 7,03
1 : 2 7,05
1 : 2,25 7,12
L2.3 DATA HASIL ANALISIS VISKOSITAS DES
Tabel L2.5 Viskositas DES Berbasis D-Glukosa pada Suhu Ruang (30 0C)
Rasio Molar ChCl : D-Glukosa Viskositas (cP)
1 : 1 Tidak dapat diukur
1,25 : 1 Tidak dapat diukur
1,5 : 1 Tidak dapat diukur
1,75 : 1 Tidak dapat diukur
2 : 1 Tidak dapat diukur
2,25 : 1 Tidak dapat diukur
2,5 : 1 Tidak dapat diukur
Tabel L2.6 Viskositas DES Berbasis Etilen Glikol pada Suhu Ruang (30 0C)
Rasio Molar ChCl : Etilen Glikol Viskositas (cP)
1 : 1 Tidak dapat diukur
1 : 1,25 33,0010
1 : 1,5 29,5610
1 : 1,75 28,5343
1 : 2 26,4476
1 : 2,25 22,8490
LAMPIRAN 3
CONTOH PERHITUNGAN
L3.1 PERHITUNGAN KEBUTUHAN ChCl DAN D-GLUKOSA PADA SINTESIS DES BERBASIS D-GLUKOSA
Massa D-Glukosa = 10 gr
Rasio molar ChCl : D-Glukosa = 1:1 (mol/mol)
BM ChCl = 139,62 gr/mol
BM D-Glukosa = 198,17 gr/mol
Perhitungan massa ChCl:
gr 7,04546 ChCl massa , Maka 1 : 1 gr/mol 198,17 gr 10 : gr/mol 139,62 ChCl Massa 1 : 1 Glukosa -D BM Glukosa -D Massa : ChCl BM ChCl Massa 1 : 1 Glukosa -D Mol : ChCl Mol
Untuk rasio molar ChCl:D-Glukosa lainnya sama dengan perhitungan di atas.
L3.2 PERHITUNGAN KEBUTUHAN ChCl DAN ETILEN GLIKOL PADA SINTESIS DES BERBASIS ETILEN GLIKOL
Massa ChCl = 5 gr
Rasio molar ChCl : Etilen Glikol = 1:1 (mol/mol)
BM ChCl = 139,62 gr/mol
BM Etilen Glikol = 62,07 gr/mol
gr 2,2228 Glikol Etilen massa , Maka 1 : 1 gr/mol 198,17 Glikol Etilen Massa : gr/mol 139,62 gr 5 1 : 1 Glikol Etilen BM Glikol Etilen Massa : ChCl BM ChCl Massa 1 : 1 Glukosa -D Mol : ChCl Mol
Perhitungan Volume Etilen Glikol:
ml 2,0025 Glikol Etilen . Vol gr/ml 1,11 gr 2,2228 Glikol Etilen . Vol densitas massa Glikol Etilen l. Vo
Untuk rasio molar ChCl:Etilen Glikol lainnya sama dengan perhitungan di atas.
L3.3 PERHITUNGAN DENSITAS DES PADA SUHU RUANG (30 0C)
Perhitungan densitas untuk DES berbasis D-Glukosa pada rasio molar ChCl:D-Glukosa = 1:1
gr/ml 1,31895 DES densitas , Maka ml 5,5695 gr 7,3459 DES Densitas piknometer volume DES massa DES Densitas gr 7,3459 DES Massa gr 22,8227 DES massa piknometer Massa gr 15,4768 kosong piknomter Massa piknometer volume sampel massa sampel Densitas ml 5,5695 air densitas air massa piknometer Volume
Untuk data lainnya sama dengan perhitungan di atas.
L3.4 PERHITUNGAN VISKOSITAS DES PADA SUHU RUANG (30 0C)
Kalibrasi air :
Viskositas air (30 0C) = 0,8007.10-3 kg/m.s [48]
Waktu alir (t) air = 206 s
(s) alir waktu t gravity spesific s (kg/m.s) viskositas ) (kg/m.s ter viskosime kalibrasi konstanta k : Dimana x t s k 2 1 air densitas air densitas air s air densitas sampel densitas s 2 5 2 6 --3 gr/cm.s 10 . 869 , 38 kg/m.s 3,8869.10 k Maka, s 206 x 1 kg/m.s 0,8007.10 k
Perhitungan viskositas untuk DES berbasis D-Etilen Glikol pada rasio molar ChCl:Etilen Glikol = 1:1,25, yaitu:
Waktu alir rata-rata DES (t) = 7559 s
Densitas DES = 1,11838 gr/ml
12323 , 1 gr/ml 0,99668 gr/ml 11838 , 1 air densitas DES densitas DES
s
cP 33,001 DES , Maka s gr/cm. 0,33001 DES s 7559 x 12323 , 1 x gr.cm.s 38,8869.10 DES x t s k x DES 2 5 -
LAMPIRAN 4
DOKUMENTASI PENELITIAN
L4.1 BAHAN BAKU ChCl
Gambar L4.1 Bahan Baku ChCl
L4.2 BAHAN BAKU D-GLUKOSA
L4.3 BAHAN BAKU ETILEN GLIKOL
Gambar L4.3 Bahan Baku Etilen Glikol
L4.4 PROSES SINTESIS DEEP EUTECTIC SOLVENT (DES)
L4.5 HASIL DEEP EUTECTIC SOLVENT (DES)
Gambar L4.5 Hasil DES yang Diperoleh
L4.6 DEEP EUTECTIC SOLVENT (DES) BERWUJUD COLOURLESS LIQUID
L4.7 DEEP EUTECTIC SOLVENT (DES) BERWUJUD TURBID WHITE LIQUID
Gambar L4.7 DES Berwujud Turbid White Liquid
L4.8 ANALISIS DENSITAS DEEP EUTECTIC SOLVENT (DES)
L4.9 ANALISIS pH DEEP EUTECTIC SOLVENT (DES)
Gambar L4.9 Analisis pH DES
L4.10 ANALISIS VISKOSITAS DEEP EUTECTIC SOLVENT (DES)
DAFTAR PUSTAKA
[1] Pal, Mahi., Rewa Rai, Anita Yadav, Rajesh Khanna, Gary A. Baker, Siddharth Pandey, “Self-Aggregation of Sodium Dodecyl Sulfate Within (Choline Chloride+Urea) Deep Eutectic Solvent”, Langmuir 2014, 30, 13191−13198
[2] Hayyan, Maan., Farouq S. Mjalli, Mohd Ali Hashim, Inas M. AlNashef, “A Novel Technique For Separating Glycerine From Palm Oil-Based Biodiesel Using Ionic Liquids”, Fuel Processing Technology, 91 (2010), 116–120
[3] Radošević, Kristina., Marina Cvjetko Bubalo, Višnje Gaurina Srček, Dijana Grgas, Tibela Landeka Dragičević, Ivana Radojčić Redovniković, “Evaluation Of Toxicity And Biodegradability Of Choline Chloride Based Deep Eutectic Solvents”, Ecotoxicology and Environmental Safety, 112 (2015), 46–53
[4] Bagh, F. S. G., K. Shahbaz, F.S. Mjalli, I.M. AlNashef, M.A. Hashim, “Electrical Conductivity Of Ammonium And Phosphonium Based Deepeutectic Solvents: Measurements And Artificial Intelligence-Based Prediction”, Fluid
Phase Equilibria, 356 (2013), 30–37
[5] Zhang, Qinghua., Karine De Oliveira Vigier, Sebastien Royer and Francois Jerome, “Deep Eutectic Solvents: Syntheses, Properties And Applications”,
Chem. Soc. Rev, 2012, 41, 7108−7146
[6] Santi, Valerio De., Fabio Cardellini, Lucia Brinchi, Raimondo Germani, “Novel Brønsted Acidic Deep Eutectic Solvent As Reaction Media For Esterification Of Carboxylic Acid With Alcohols”, Tetrahedron Letters, 53 (2012), 5151–5155
[8] Yusof, Rizana., Emilia Abdulmalek, Kamaliah Sirat, Mohd Basyaruddin, Abdul Rahman, “Tetrabutylammonium Bromide (TBABr)-Based Deep Eutectic Solvents (DESs) and Their Physical Properties”, Molecules, 2014, 19, 8011-8026
[9] Wu, Sheng-Hong., Alvin R. Caparangab, Rhoda B. Lerona, Meng-Hui Li, “Vapor Pressure Of Aqueous Choline Chloride-Based Deep Eutectic Solvents (Ethaline, Glyceline, Maline And Reline) At 30–70 0C”, Thermochimica Acta, 544 (2012), 1– 5
[10] Shahbaz, K., F.S. Mjalli, M.A. Hashim, I.M. AlNashef, “Eutectic Solvents For The Removal Of Residual Palm Oil-Based Biodiesel Catalyst, Separation and Purification”, Technology, 81 (2011), 216–222
[11] Shahbaz, K., Saeid Baroutian, Farouq Sabri Mjalli, Mohd Ali Hashim, Inas Muen AlNashef, “Prediction Of Glycerol Removal From Biodiesel Using Ammonium And Phosphunium Based Deep Eutectic Solvents Using Artificial Intelligence Techniques”, Chemometrics and Intelligent Laboratory Systems, 118 (2012), 193–199
[12] Zhao, Hua., Cheng Zhang, Tanisha D. Crittle, “Choline-Based Deep Eutectic Solvents For Enzymatic Preparation Of Biodiesel From Soybean Oil”,
Journal of Molecular Catalysis B: Enzymatic, 85– 86 (2013), 243– 247
[13] Gu, Ling., Wei Huang, Shaokun Tang, Songjiang Tian, Xiangwen Zhang, “A Novel Deep Eutectic Solvent For Biodiesel Preparation Using A Homogeneous Base Catalyst”, Chemical Engineering Journal, 259 (2015), 647– 652
[15] Maugeri, Zaira., Pablo DomÍnguez de MarÍa, “Novel choline-chloride-based deep-eutectic-solvents with renewable hydrogen bond donors: levulinic acid and sugar-based polyols”, The Royal Society of Chemistry, 2 (2012), 421–425
[16] Habibi, Emadaldin., Kamal Ghanemi, Mehdi Fallah-Mehrjardi, Ali Dadolahi-Sohrab, “A Novel Digestion Method Based On A Choline Chloride– Oxalic Acid Deep Eutectic Solvent For Determining Cu, Fe, And Zn In Fish Samples”, Analytica Chimica Acta, 762 (2013), 61– 67
[17] Leron, Rhoda B., Meng-Hui Li, “Molar Heat Capasities Of Choline Chloride-Based Deep Eutectic Solvents And Their Binary Mixtures With Water”,
Thermochimica Acta, 530 (2012), 52-57
[18] Tang, Baokun., Kyung Ho Row, “Recent Developments in Deep Eutectic Solvents in Chemical Sciences”, Springer-Verlag Wien,(2013), 402-751
[19] Hayyan, Adeeb., Farouq S. Mjalli, Inas M. AlNashef, Yahya M. Al-Wahaibi, Talal Al-Al-Wahaibi, Mohd Ali Hashim, “Glucose-Based Deep Eutectic Solvents: Physical Properties”, Journal of Molecular Liquids, 178 (2013), 137– 141
[20] Fechete, Ioana., Ye Wang, Jacques C. Vedrine, “The Past, Present And Future Of Heterogeneous Catalysis”, Catalysis Today, 189 (2012), 2– 27
[21] D. J. Cole-Hamilton, R. P. Tooze, Chapter1: “Homogeneous Catalysis–
Advantages And Problems”, Catalyst Separation, Recovery and Recycling, 2006,
1–8
Renewable Energy Storage By Means Of Redox Flow Batteries”, Renewable and
Sustainable Energy Reviews, 30 (2014), 254–270
[23] Bagh, F.S.G., Mohamed Kamel Omar Hadj-Kali, Farouq S. Mjalli, Mohd Ali Hashim, Inas M. AlNashef, “Solubility Of Sodium Chloride In Phosphonium-Based Deep Eutectic Solvents”, Journal of Molecular Liquids, 199 (2014), 344– 351
[24] Hafidz, Ahmad, M. F., Nor Aishah Saidina Amin, “An Overview Of Ionic Liquids As Solvents In Biodiesel Synthesis”, Renewable and Sustainable Energy
Reviews, 16 (2012,) 5770–5786
[25] Muhammad, Nawshad., Yasir A. Elsheikh, Muhammad Ibrahim Abdul Mutalib, Aqeel Ahmed Bazmi, Rahmat Ali Khan, Hidayatullah Khan, Sikander Rafiq, Zakaria Man, Ihsnullah khan, “An Overview Of The Role Of Ionic Liquids In Biodiesel Reactions”, Journal of Industrial And Engineering Chemistry, (2014), JIEC-1888; No. Of Pages 10
[26] Reddy, Eragam Ramamohan., Mukesh Sharma, Jai Prakash Chaudhary, Hetal Bosamiya, Ramavatar Meena, “One-Pot Synthesis Of Biodiesel From High Fatty Acid Jatropha Curcas Oil Using Bio-Based Basic Ionic Liquid As A Catalyst”, Research Articles, Current Science, Vol. 106, No. 10, 25 May 2014
[27] Durand, E., J. Lecomte, P. Villeneuve, “Deep Eutectic Solvents: Synthesis, Application, And Focus On Lipase-Catalyzed Reactions”, Eur. J. Lipid Sci.
Technol, 2013, 115, 379–385
[29] Leron, Rhoda B., Allan N. Soriano, Meng-Hui Li, “Densities and Refractive Indices of The Deep Eutectic Solvents (Choline Chloride + Ethylene Glycol or Glycerol) and Their Aqueous Mixtures at the Temperature Ranging From 298,15 to 333,15 K”, Journal of the Taiwan Institute of Chemical Engineers, 43 (2012), 551–557
[30] Harris, Robert Christopher., “Physical Properties Of Alcohol Based Deep Eutectic Solvents”, University Of Leicester 2008
[31] Hayyan, Adeeb., Mohd Ali Hashim, Maan Hayyan, Farouq S. Mjalli, Inas M. AlNashef, “A New Processing Route For Cleaner Production Of Biodiesel Fuel Using A Choline Chloride Based Deep Eutectic Solvent”, Journal of Cleaner
Production, 65 (2014), 246−251
[32] Wang, Liang., Kai-qiang Zhu, Qun Chen, Ming-yang He, “Facile and Environmentally Friendly Halogenation of Bodipys in Deep Eutectic Solvent”,
Dyes and Pigments, 112 (2015), 274-279
[33] Naser, J., F. Mjalli, B. Jibril, S. Al-Hatmi, Z. Gano, “Potassium Carbonate as a Salt for Deep Eutectic Solvents”, International Journal of Chemical
Engineering and Applications, Vol. 4, No. 3, June 2013
[34] Xu, Kaijia., Yuzhi Wang, Yanhua Huang, Na Li, Qian Wen, “A Green Deep Eutectic Solvent-Based Aqueous Two-Phase System for Protein Extracting”,
Analytica Chimica Acta (2015), ACA 233687 No. of Pages 12
[35] Leron, Rhoda B., Alvin Caparanga, Meng-Hui Li, “Carbon Dioxide Solubility in a Deep Eutectic Solvent Based on Choline Chloride and Urea at T=303.15–343.15 K and Moderate Pressures”, Journal of the Taiwan Institute of
[36] Kathrina R. Siongco, Rhoda B. Leron, Alvin R. Caparang, Meng-Hui Li, “Molar Heat Capacities and Electrical Conductivities of Two Ammonium-Based Deep Eutectic Solvents and Their Aqueous Solutions”, Thermochimica Acta 566 (2013), 50– 56
[37] Yadav, Anita., Jyotsna Rani Kar, Maya Verma, Saeeda Naqvi, Siddharth Pandey, “Densities of Aqueous Mixtures of (Choline Chloride + Ethylene Glycol) and (Choline Chloride + Malonic Acid) Deep Eutectic Solvents in Temperature Range 283,15 to 363,15 K”, Thermochimica Acta (2014), TCA 77085
[38] Garcia, Joaquin., Alvarrez, “Deep Eutectic Solvents: Environmentally Friendly Media for Metal-Catalyzed Organic Reactions, In Green Technologies for the Environment”, Obare, et al.; ACS Symposium Series; American Chemical
Society: Washington, DC, 2014
[39] Hayyan, Maan., Tayeb Aissaoui, Mohd Ali Hasyim, Mahammed AbdulHakim AlSaadi, Adeeb Hayyan, “Triethylene Glycol Based Deep Eutectic Solvents and Their Physical Properties”, Journal of the Taiwan Institute of
Chemical Engineers 000 (2015) 1–7
[40] Shahbaz, K., S.Baroutian, F.S. Mjalli, M.A. Hasyim, I.M. AlNashef, “Densities of Ammonium and Phosphonium Based Deep Eutectic Solvents: Prediction Using Artificial Intelligence and Group Contribution Techniques”,
Thermochimica Acta, 527 (2012), 59– 66
[41] Shahbaz, K., F.S. Mjalli, M.A. Hasyim, I.M. AlNashef, “Prediction Of Deep Eutectic Solvents Densities At Different Temperatures”, Thermochimica Acta, 515 (2011), 67–72
Characterization and Application to the Extraction of Rutin from Sophora japonica”, ACS Sustainable Chemistry & Engineering, 27 Sep 2015
[43] Protsenko, V.S., A.A. Kityk, D.A. Shaiderov, F.J. Danilov, “Effect Of Water Content On Physicochemical Properties And Electrochemical Behavior Of Ionic Liquids Containing Choline Chloride, Ethylene Glycol And Hydrated Nickel Chloride”, Journal of Molecular Liquids. 212 (2015) 716–722
[44] Kow, Koon-Kee., Kamaliah Sirat, “Novel Manganese(II)-Based Deep Eutectic Solvents: Synthesis And Physical Properties Analysis”, Chinese
Chemical Letters xxx (2015) xxx–xxx
[45] Sigma Aldrich, “Choline Chloride”, Chem Alert Report, Singapore, 2015
[46] Merck Millipore, “D-Glucose”, Data Sheet, Germany, 2014
[47] Merck Millipore, “Ethylene Glycol”, Data Sheet, Germany, 2015
BAB III
METODE PENELITIAN
3.1 LOKASI DAN WAKTU PENELITIAN
Penelitian dilakukan di Laboratorium Proses Industri Kimia, Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera utara, Medan. Penelitian ini dilakukan selama lebih kurang 6 bulan.
3.2 BAHAN DAN PERALATAN
3.2.1 Bahan Penelitian
Pada penelitian ini bahan yang digunakan antara lain: 1. Choline Chloride (ChCl)
2. Glukosa (C6H12O6)
3. Etilen glikol ( C2H6O2)
3.2.2 Peralatan Penelitian
Pada penelitian ini peralatan yang digunakan antara lain: 1. Erlenmeyer
2. Magnetic Stirrer
3. Hot Plate
4. Beaker Glass
5. Gelas Ukur 6. Neraca Digital 7. Termometer 8. Corong Gelas 9. Pipet Tetes 10. Stopwatch
11. Piknometer
3.3 RANCANGAN PERCOBAAN SINTESIS DEEP EUTECTIC SOLVENT (DES)
Sintesis deep eutectic solvent (DES) dilakukan dengan variabel tetap berupa kecepatan pengadukan (A), waktu (B), suhu (C) dan jenis garam (D) serta variabel bebas berupa jenis HBD (X1 dan X2) dan rasio molar garam:HBD, yaitu ChCl:glukosa (Y1, Y2, Y3, Y4, Y5, Y6 dan Y7) dan rasio molar ChCl:etilen glikol (Z1, Z2, Z3, Z4, Z5, Z6 dan Z7). Adapun kombinasi perlakuan dapat dilihat pada tabel 3.1 berikut:
Tabel 3.1 Rancangan Percobaan Sintesis Deep Eutectic Solvent (DES) Run Kecepatan Pengadukan (rpm) Waktu (jam) Suhu (0C)
Jenis Garam Jenis HBD Rasio Molar Garam:HBD (Mol) 1
A B C D
X1
Y1
2 Y2
3 Y3
4 Y4
5 Y5
6 Y6
7 Y7
8
X2
Z1
9 Z2
10 Z3
11 Z4
12 Z5
13 Z6
14 Z7
3.4 PROSEDUR PENELITIAN
3.4.1 Proses Sintesis Deep Eutectic Solvent (DES)
1. Bahan baku garam (choline chloride/ChCl) dan HBD (glukosa/etilen glikol) disiapkan dengan rasio molar 1:1
3. Campuran dipanaskan di atas hot plate hingga mencapai suhu reaksi 80 0C dan sambil dihomogenkan menggunakan magnetic stirrer dengan kecepatan pengadukan 400 rpm selama 2 jam
4. Hot plate dimatikan dan deep eutectic solvent (DES) yang diperoleh
didinginkan hingga mencapai suhu kamar
5. Prosedur di atas diulangi untuk variabel proses lainnya seperti yang telah dijelaskan pada rancangan percobaan
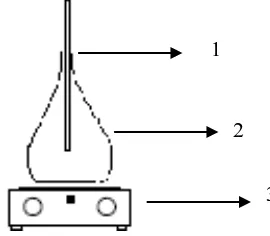
3.4.2 Sketsa Percobaan Proses Sintesis Deep Eutectic Solvent (DES)
Gambar 3.1 Rangkaian Peralatan Sintesis Deep Eutectic Solvent (DES) Keterangan gambar:
1. Termometer 2. Erlenmeyer 3. Hot plate
1
2
3.4.3 Prosedur Analisis
3.4.3.1Analisis Freezing Point Deep Eutectic Solvent (DES)
Pengukuran freezing point DES dilakukan dengan melihat wujud DES pada suhu 30 0C, 20 0C dan 10 0C. DES yang berwujud turbid white liquid pada suhu 30 0C menunjukkan DES memiliki freezing point diatas 30 0C. Sedangkan DES yang berwujud colourless liquid pada suhu 30 0C menunjukkan DES memiliki freezing
point dibawah 30 0C. Akan tetapi untuk memperkecil kisaran nilai freezing point DES dilakukan analisis wujud DES pada suhu 20 0C dan 10 0C. Jika DES berwujud colourless liquid pada 20 0C menunjukkan DES memilki freezing point di bawah 20 0C dan jika DES berwujud colourless liquid pada 10 0C menunjukkan DES memilki freezing point di bawah 10 0C.
3.4.3.2Analisis pH Deep Eutectic Solvent (DES)
Analisis pH dilakukan dengan menggunakan pH meter. pH meter adalah sebuah alat elektronik untuk mengetahui pH suatu larutan secara langsung sehingga dapat diketahui apakah larutan tersebut termasuk asam, basa atau garam. Sebuah pH meter terdiri dari sebuah elektroda yang terhubung ke sebuah alat elektronik yang mengukur dan menampilkan nilai pH. Nilai pH ditunjukkan dengan skala secara sistematis dengan nomor 0-14.
3.4.3.3Analisis Densitas Deep Eutectic Solvent (DES)
Densitas adalah turunan besaran yang menyangkut suatu massa dan volume. Batasannya adalah massa persatuan volume pada temperatur dan tekanan tertentu yang dinyatakan dalam sistem cgs (gr/cm3). Analisis densitas DES dilakukan dengan metode piknometer. Prinsip metode ini didasarkan atas penentuan massa cairan. Untuk itu, dibutuhkan wadah untuk menimbang yang disebut piknometer. Pengukuran harus dilakukan pada suhu tetap dan volume zat cair selalu sama dengan volume piknometer. Dirumuskan:
3.4.3.4Analisis Viskositas Deep Eutectic Solvent (DES)
Analisis viskositas DES dilakukan dengan metode Ostwald. Penetapannya dilakukan dengan mengukur waktu yang diperlukan untuk mengalirkan cairan dalam pipa kapiler dari a ke b. Sejumlah cairan yang akan diukur viskositasnya dimasukkan kedalam viskometer, kemudian cairan dihisap dengan karet penghisap sampai diatas tanda a. Cairan dibiarkan mengalir kebawah dan waktu yang diperlukan dari a ke b dicatat menggunakan stopwatch. Waktu alir dari cairan yang diuji dibandingkan dengan waktu yang dibutuhkan bagi suatu zat yang viskositasnya sudah diketahui (biasanya air).
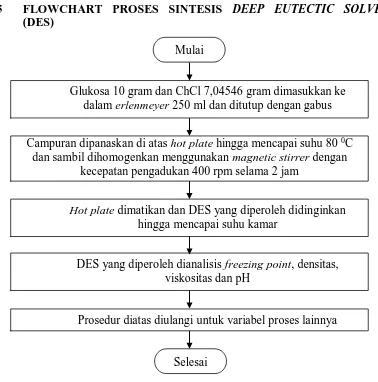
3.5 FLOWCHART PROSES SINTESIS DEEP EUTECTIC SOLVENT (DES)
Gambar 3.2 Flowchart Proses Sintesis Deep Eutectic Solvent (DES) Campuran dipanaskan di atas hot plate hingga mencapai suhu 80 0C
dan sambil dihomogenkan menggunakan magnetic stirrer dengan kecepatan pengadukan 400 rpm selama 2 jam
Mulai
Selesai
Glukosa 10 gram dan ChCl 7,04546 gram dimasukkan ke dalam erlenmeyer 250 ml dan ditutup dengan gabus
Hot plate dimatikan dan DES yang diperoleh didinginkan
hingga mencapai suhu kamar
DES yang diperoleh dianalisis freezing point, densitas, viskositas dan pH
BAB IV
HASIL DAN PEMBAHASAN
4.1 SINTESIS DEEP EUTECTIC SOLVENT (DES)
Dalam penelitian ini, 14 jenis Deep Eutectic Solvent (DES) disintesis dari garam ammonium (ChCl) dan HBD (etilen glikol dan D-glukosa) pada rasio molar yang berbeda. Pada tabel 4.1 ditunjukkan struktur garam dan HBD penyusun DES.
Tabel 4.1 Struktur Garam dan HBD Penyusun DES [18]
Garam HBD
ChCl Etilen Glikol D-Glukosa
Kation Anion
DES diperoleh dengan memanaskan garam ChCl dan HBD D-glukosa/etilen glikol pada rasio molar tertentu secara bersamaan hingga suhu 80 0C dan sambil diaduk menggunakan magnetic stirrer selama 2 jam, lalu setelah proses pemanasan selesai diperoleh cairan bening (colourless liquid) yang disebut DES [19].
Gambar 4.1 Mekanisme Interaksi Hidrogen Bond Acceptor (ChCl) dan Hidrogen
Bond Donor (R-OH) [38] Hidrogen Bond Acceptor (ChCl)
Deep Eutectic Solvent (DES) adalah campuran sederhana dari suatu garam
dan suatu senyawa Hidrogen Bond Donor (HBD) yang keduanya terhubung satu sama lain melalui ikatan hidrogen [15,5]. Dalam gambar 4.1 ditunjukkan mekanisme interaksi antara Hidrogen Bond Acceptor (ChCl) dan Hidrogen Bond
Donor (R-OH). Interaksi antara ChCl dan HBD terjadi melalui ikatan hidrogen
antara anion halida garam dengan pendonor gugus hidrogen [38]. Alasan disebut
Deep Eutectic Solvent (DES) adalah ketika dua komponen dicampur secara
bersamaan dalam rasio yang tepat akan diperoleh titik eutektik campuran. Titik eutektik ini merupakan titik leleh terendah yang dihasilkan dari rasio molar dua komponen tersebut [30].
4.2 KARAKTERISTIK DEEP EUTECTIC SOLVENT (DES)
DES adalah pelarut kimia yang dapat dirancang sesuai dengan penggunaannya. Oleh karena itu, dapat dihasilkan suatu DES dengan karakteristik tertentu [5]. Penelitian yang dilakukan Hayyan, dkk., [19] pada tahun 2013 melaporkan bahwa sifat fisik DES yang berbeda tergantung pada rasio molar garam dan HBD penyusunnya.
Pada penelitian ini berfokus pada pengaruh rasio molar garam ChCl dan HBD (D-glukosa/etilen glikol) dan pengaruh jenis HBD (D-glukosa/etilen glikol) terhadap karakteristik DES pada suhu ruang. Pada sub bab selanjutnya akan dibahas pengaruh rasio molar garam dan HBD dan pengaruh jenis HBD terhadap karakteristik DES yang dihasilkan, yaitu titik beku, densitas, pH dan viskositas pada suhu ruang (30 0C ± 2 0C)
4.2.1 Pengaruh Rasio Molar Garam dan Hidrogen Bond Donor (HBD) terhadap Karakteristik DES
4.2.1.1 Titik Beku
Tabel 4.2 Pengkodean dan Wujud DES Berbasis ChCl/D-Glukosa Rasio Molar
ChCl : D-Glukosa Kode
Wujud DES
30 0C (± 2 0C) 20 0C (± 2 0C) 10 0C (± 2 0C)
1 : 1 DES 1 Bening Keruh Keruh
1,25 : 1 DES 2 Bening Keruh Keruh
1,5 : 1 DES 3 Bening Keruh Keruh
1,75 : 1 DES 4 Bening Bening Keruh
2 : 1 DES 5 Bening Bening Keruh
2,25 : 1 DES 6 Bening Keruh Keruh
2,5 : 1 DES 7 Keruh Keruh Keruh
Tabel 4.3 Pengkodean dan Wujud DES Berbasis ChCl/Etilen Glikol Rasio Molar
ChCl : Etilen Glikol Kode
Wujud DES
30 0C (± 2 0C) 20 0C (± 2 0C) 10 0C (± 2 0C)
1 : 1 DES 8 Keruh Keruh Keruh
1 : 1,25 DES 9 Bening Bening Bening
1 : 1,5 DES 10 Bening Bening Bening
1 : 1,75 DES 11 Bening Bening Bening
1 : 2 DES 12 Bening Bening Bening
1 : 2,25 DES 13 Bening Bening Bening
1 : 2,5 DES 14 Bening Bening Bening
Dari hasil penelitian, setelah proses pemanasan selesai DES 1 sampai DES 14 berwujud cairan bening (colourless liquid), lalu DES yang diperoleh dibiarkan dingin hingga mencapai suhu ruang (30 0C ± 2 0C). Pada suhu ruang semua DES masih berwujud cair walupun ada DES yang wujudnya berubah menjadi lebih kental dan berwarna putih (keruh), yaitu DES 7 dan DES 8, seperti ditunjukkan pada tabel 4.2 dan tabel 4.3. DES yang berwujud cairan bening pada suhu ruang menunjukkan bahwa titik beku DES berada di bawah suhu ruang (30 0C ± 2 0C) karena tidak ada perubahan wujud DES yang terjadi. Sedangkan DES yang berwujud keruh menunjukkan bahwa DES memiliki nilai titik beku di atas suhu ruang (30 0C ± 2 0C) karena pada suhu ruang wujud DES berubah menjadi lebih kental dan berwarna putih.
berwujud cairan bening dan DES 6 dan DES 7 berwujud cairan keruh. Akan tetapi pada suhu 10 0C (± 2 0C) semua DES berwujud cairan keruh. Sehingga dapat disimpulkan bahwa rasio molar terbaik untuk menghasilkan DES berbasis D-Glukosa adalah pada rasio molar ChCl dan D-D-Glukosa 1,75:1 dan 2:1. Hal ini karena pada rasio molar tersebut dihasilkan DES dengan titik beku terendah (< 20 0C). Hal ini sejalan dengan penelitian Hayyan, dkk., [19] pada tahun 2013 yaitu bahwa DES berbasis D-Glukosa pada rasio molar ChCl : D-glukosa = 2:1 diperoleh titik beku terendah, yaitu 15 0C. Jika dibandingkan dengan titik beku ChCl yaitu berkisar 302-305 0C dan titik beku D-Glukosa yaitu sebesar 146,1 0C, titik beku DES berbasis D-Glukosa lebih kecil dari titik beku penyusunnya. Dari tabel 4.3 dapat dilihat bahwa DES 9 hingga DES 14 berwujud cairan bening pada suhu 10 0C (± 2 0C). Sehingga dapat disimpulkan bahwa kecuali pada rasio molar ChCl dan Etilen Glikol 1:1, DES berbasis Etilen Glikol memiliki titik beku yang rendah (<10 0C).
tersebut. Oleh karena itu, campuran berwujud cairan keruh dan titik beku DES tidak semakin menurun melainkan semakin meningkat.
Akan tetapi, pada tabel 4.2 dapat dilihat bahwa pada suhu 20 0C (± 2 0C) DES 1 hingga DES 3 berwujud cairan keruh, DES 4 dan DES 5 tetap berwujud cairan bening dan DES 6 dan DES 7 berwujud cairan keruh. Perubahan wujud pada DES 1 hingga DES 3 menjadi cairan keruh pada suhu 20 0C (± 2 0C) mungkin juga disebabkan oleh adanya gugus hidroksil (-OH) dari HBD D-Glukosa yang berlebih dalam campuran, sehingga ketika suhu semakin turun gugus hidroksil (-OH) dari HBD D-Glukosa yang berlebih menyebabkan DES berwujud cairan keruh. Sedangkan ketika ChCl semakin meningkat pada DES 4 dan DES 5 diperoleh DES tetap berwujud cairan bening, hal ini disebabkan oleh tersedianya anion halida dari garam ChCl untuk membangun ikatan hidrogen dengan gugus hidroksil (-OH) dari HBD D-Glukosa. Akan tetapi, jika anion halida dari garam ChCl juga berlebih maka akan menyebabkan DES berwujud cairan keruh, seperti pada DES 6 dan DES 7.
Sama halnya DES 8 dengan rasio molar ChCl : Etilen Glikol = 1:1 diperoleh DES berwujud cairan keruh sedangkan pada DES 9 sampai DES 14 dengan jumlah ChCl tetap dan jumlah HBD Etilen Glikol semakin meningkat diperoleh DES berwujud cairan bening. Pada kasus DES 8 ini konsentrasi ChCl juga tinggi dibandingkan jumlah HBD Etilen Glikol atau sebaliknya konsentrasi Etilen Glikol rendah dibandingkan dengan ChCl, sehingga terdapat anion halida garam ChCl yang berlebih dalam campuran dan Etilen Glikol tidak memiliki HBD lagi untuk membangun ikatan hidrogen dengan anion halida yang berlebih tersebut. Oleh karena itu, campuran berwujud cairan keruh dan DES memiliki titik beku lebih tinggi dari DES lainnya.
cukup untuk membangun ikatan hidrogen D-Glukosa yang tersedia. Akibatnya, campuran menjadi jenuh dengan D-Glukosa dan tidak ada pengurangan titik beku lebih lanjut yang tercapai. Konsentrasi HBD yang tinggi dibandingkan dengan jumlah ChCl membuat campuran heterogen dan bahkan walaupun dengan pengadukan yang lama dan suhu tinggi, campuran tetap berwujud setengah padat.
Selain itu, dari hasil penelitian pengaruh rasio molar ChCl : D-Glukosa terhadap titik beku yang telah dilakukan, ditemukan bahwa penelitian yang dilakukan sejalan dengan penelitian Hayyan, dkk., [19] pada tahun 2013 mengenai pembuatan DES berbasis ChCl dan golongan sakarida (D-glukosa) sebagai HBD, yaitu bahwa pada suhu ruang DES dengan rasio molar ChCl : D-Glukosa = 1:1; 1,5:1 dan 2:1 berwujud cairan bening (colourless liquid) dan DES dengan rasio molar ChCl : D-Glukosa = 2,5:1 pada suhu ruang menjadi semakin kental dan berwarna putih (keruh). Begitu juga pada pengaruh rasio molar ChCl : Etilen Glikol terhadap titik beku, ditemukan bahwa penelitian yang dilakukan sejalan dengan penelitian Bagh, dkk., [4] dan penelitian Shahbaz, dkk., [40], yaitu bahwa pada rasio molar ChCl : Etilen Glikol = 0,36:0,64; 0,33:0,67 dan 0,28:0,72 diperoleh DES berwujud cairan bening pada suhu ruang dan nilai titik beku DES yang dihasilkan lebih rendah dari suhu ruang. Selain itu, penelitian yang dilakukan juga sejalan dengan penelitian yang dilakukan Shahbaz, dkk., [41], yaitu bahwa pada rasio molar ChCl : Etilen Glikol = 1:2 diperoleh DES berwujud cairan bening pada suhu ruang dan nilai titik beku DES yang dihasilkan lebih rendah dari suhu ruang.
bidang karena memiliki titik beku lebih rendah dari 50 0C seperti DES lainnya [19].
4.2.1.2 Densitas
Nilai densitas diperlukan untuk memahami perilaku suatu zat cair [8]. Pengukuran densitas sangat penting terutama dalam bidang mekanika fluida, perhitungan perpindahan massa dan juga untuk merancang proses kimia [19]. Densitas adalah salah satu sifat fisik penting cairan ionik pada umumnya dan secara khusus pada DES [41]. Data mengenai densitas DES memiliki peran penting dalam aplikasi pelarut ramah lingkungan [40]. Densitas DES biasanya ditentukan secara gravimetri dan rasio molar garam dan HBD penyusun DES memiliki efek yang signifikan pada densitas DES yang dihasilkan [14,8]. Pada gambar 4.2 dan gambar 4.3 ditunjukkan grafik pengaruh rasio molar ChCl : D-Glukosa dan rasio molar ChCl : Etilen Glikol terhadap nilai densitas DES.
Gambar 4.2 Grafik Pengaruh Rasio Molar ChCl : D-Glukosa terhadap Densitas DES
Dari grafik pengaruh rasio molar ChCl : D-Glukosa pada gambar 4.2 ditunjukkan bahwa semua nilai densitas DES berada di atas 1,25 gr/ml. Dimana nilai-nilai ini terletak di antara densitas ChCl dan densitas D-Glukosa pada suhu ruang, yaitu masing-masing 1,1856 gr/ml dan 1,5345 gr/ml. Oleh karena itu, penelitian yang dilakukan sejalan dengan penelitian Shahbaz, dkk., [41] pada
1,25 1,26 1,27 1,28 1,29 1,30 1,31 1,32 1,33
0,75 1,00 1,25 1,50 1,75 2,00 2,25 2,50
Rasio Molar ChCl : D-Glukosa
D
e
n
si
ta
s
(g
r
/m
l)
[image:31.595.136.474.383.595.2]tahun 2011 mengenai pengukuran densitas DES pada fungsi suhu, yaitu bahwa densitas DES terletak di antara densitas garam dan HBD penyusunnya. Dari grafik juga ditunjukkan bahwa nilai densitas DES menurun dari DES 1 sebesar 1,31895 gr/ml hingga DES 5 sebesar 1,26352 gr/ml tetapi meningkat pada DES 6 dan DES 7, yaitu masing-masing sebesar 1,27988 gr/ml dan 1,29234 gr/ml.
Pada sub bab sebelumnya disebutkan bahwa tingginnya konsentrasi garam ChCl dibandingkan konsentrasi HBD menyebabkan adanya anion halida pada garam yang berlebih sehingga titik beku DES meningkat. Dari grafik pada gambar 4.2 dapat dilihat bahwa densitas DES 6 dan DES 7 meningkat. Adanya anion halida yang berlebih dalam campuran menyebabkan campuran berwujud cairan keruh dan hal ini juga menyebabkan massa campuran semakin besar sehingga densitas campuran yang diperoleh juga semakin besar. Oleh karena itu, dapat disimpulkan bahwa adanya anion halida garam yang berlebih dalam campuran akan menyebabkan meningkatnya densitas DES.
Gambar 4.3 Grafik Pengaruh Rasio Molar ChCl : Etilen Glikol terhadap Densitas DES
Dari hasil penelitian pengaruh rasio molar ChCl : Etilen Glikol pada gambar 4.3 diperoleh bahwa semua nilai densitas DES berada di atas 1,11 gr/ml. Nilai ini terletak di antara densitas ChCl dan densitas Etilen Glikol pada suhu ruang, yaitu masing-masing 1,1856 gr/ml dan 1,11 gr/ml. Oleh karena itu, Penelitian yang dilakukan sejalan dengan penelitian Tang, dkk., [14] pada tahun 2015, yaitu bahwa nilai densitas DES lebih tinggi dari densitas air dan juga lebih tinggi dari densitas HBD penyusunnya.
Dari grafik pada gambar 4.3 juga ditunjukkan bahwa nilai densitas DES menurun dari DES 8 hingga DES 14. Nilai densitas tertinggi adalah DES 8 sebesar 1,28974 gr/ml pada rasio molar ChCl : Etilen Glikol = 1 : 1 dan nilai densitas DES semakin menurun seiring dengan meningkatnya jumlah Etilen Glikol. Nilai densitas terendah adalah DES 14 sebesar 1,11473 gr/ml, yaitu pada rasio molar ChCl : Etilen Glikol = 1 : 2,5.
Pada tabel 4.3 dapat dilihat bahwa DES 8 berwujud cairan keruh pada suhu ruang. Begitu juga dengan densitas, DES 8 juga memiliki densitas tertinggi dibandingkan DES lainnya. Hal ini disebabkan oleh adanya anion halida garam ChCl yang berlebih dalam campuran dan HBD dari Etilen Glikol tidak tersedia lagi untuk membangun ikatan hidrogen. Sehingga massa campuran meningkat dan densitas DES juga semakin meningkat. Sedangkan dengan jumlah etilen glikol semakin meningkat diperoleh densitas semakin menurun, hal ini disebabkan oleh
1,10 1,12 1,14 1,16 1,18 1,20 1,22 1,24 1,26 1,28 1,30
0,75 1,00 1,25 1,50 1,75 2,00 2,25 2,50
D e n si tas (gr /m l)
Rasio Molar ChCl : Etilen Glikol
HBD dari Etilen Glikol tersedia untuk membangun ikatan hidrogen dengan anion halida dari ChCl. Selain itu, hal ini dapat dijelaskan dengan nilai densitas Etilen Glikol yang lebih kecil dari densitas ChCl maka dengan jumlah Etilen Glikol yang semakin meningkat akan diperoleh nilai densitas DES yang semakin berkurang [33].
Penelitian yang dilakukan sejalan dengan penelitian yang dilakukan oleh Yusof, dkk., [8] pada tahun 2014 mengenai pembuatan DES dari garam
tetrabutylammonium bromide (TBABr) dengan HBD etilen glikol,
1,3-propanadiol, 1,5-pentanadiol dan gliserol, yaitu bahwa densitas DES dengan HBD berbasis alkohol sebanding dengan densitas DES pada umumnya, kecuali densitas DES dengan HBD berbasis glukosa memiliki densitas lebih tinggi. Hasil penelitian yang diperoleh juga sejalan dengan penelitian Shahbaz, dkk., [40], yaitu bahwa pada rasio molar ChCl : Etilen Glikol = 0,36:0,64; 0,33:0,67 dan 0,28:0,72 diperoleh nilai densitas DES masing-masing 1,1156; 1,1146 dan 1,1141 gr/ml. Nilai densitas ini tidak jauh berbeda dengan nilai densitas DES yang diperoleh dari hasil penelitian. Selain itu, pada penelitian Harris [30] mengenai pembuatan DES dari ChCl dan Etilen Glikol dengan menggunakan % ChCl 0; 5; 10; 15; 20; 25 dan 30 % diperoleh nilai densitas DES berada antara 1,11 - 1,12 gr/ml. Hal ini menunjukkan bahwa nilai densitas DES dari ChCl dan Etilen Glikol berada di sekitar 1,11 gr/ml.
Dari hasil penelitian diperoleh bahwa DES berbasis D-Glukosa memiliki densitas di atas 1,25 gr/ml dan DES berbasis etilen glikol memiliki densitas sekitar 1,11 gr/ml. Jika dibandingkan dengan DES lainnya yang berasal dari garam atau HBD yang berbeda, seperti DES berbasis tetrabutylammonium
bromide (TBABr) sebagai garam dan etilen glikol, 1,3-propanadiol,
± 1,1 gr/ml pada suhu 30 0C [40]. Maka dapat disimpulkan bahwa DES berbasis ChCl dan D-glukosa memiliki nilai densitas yang cenderung lebih tinggi dari DES lainnya dan DES berbasis ChCl dan etilen glikol memiliki nilai densitas cenderung lebih rendah dari DES lainnya.
Dari hasil penelitian disimpulkan bahwa rasio molar ChCl : D-Glukosa dan ChCl : Etilen Glikol sangat mempengaruhi nilai densitas DES. Hal ini sesuai dengan penelitian yang dilakukan oleh Shahbaz, dkk., [40] pada tahun 2012 dan penelitian yang dilakukan oleh Tang, dkk., [14] pada tahun 2015, yaitu bahwa komposisi penyusun DES memiliki pengaruh yang signifikan terhadap densitas DES.
4.2.1.3 pH
[image:35.595.132.480.504.725.2]pH adalah salah satu karakteristik penting dari suatu cairan karena dapat membantu pemilihan jenis pipa yang ingin digunakan untuk bahan konstruksi dan korosi terkait aspek desain. pH juga memiliki pengaruh dalam suatu reaksi terutama bioreaksi [19]. Sifat kimia komponen penyusun DES terutama HBD sangat berpengaruh pada kekuatan asam atau basa DES, sehingga dapat dihasilkan DES dengan pH basa, netral atau asam [5,27]. Berikut adalah grafik pengaruh rasio molar ChCl : D-Glukosa dan ChCl : Etilen Glikol terhadap nilai pH DES pada suhu ruang.
Gambar 4.4 Grafik Pengaruh Rasio Molar ChCl : D-Glukosa terhadap pH DES
6,65 6,70 6,75 6,80 6,85 6,90 6,95 7,00 7,05 7,10
0,75 1,00 1,25 1,50 1,75 2,00 2,25 2,50
Rasio Molar ChCl : D-Glukosa
pH
Dari grafik pengaruh rasio molar ChCl : D-Glukosa terhadap pH pada gambar 4.4 dapat dilihat bahwa nilai pH DES yang diperoleh mengalami peningkatan dari DES 1 hingga DES 5, yaitu 6,70; 6,76; 6,80; 6,88 dan 7,05 tetapi nilai pH menurun pada DES 6 dan DES 7, yaitu masing-masing 6,96 dan 6,91. Seperti halnya pada pembahasan titik beku dan densitas, yaitu adanya anion halida garam ChCl yang berlebih dalam DES menyebabkan titik beku dan densitas semakin meningkat. Begitu juga dengan pH, pada DES 6 dan DES 7 diperoleh pH semakin meningkat. Hal ini juga disebabkan oleh konsentrasi ChCl yang tinggi dibandingkan dengan konsentrasi D-Glukosa, sehingga terdapat anion halida garam ChCl yang berlebih dalam DES yang tidak berikatan dengan HBD D-Glukosa, sehingga pH DES akan menurun mengarah pada pH ChCl yang bebas dalam campuran, dimana ChCl memiliki pH berkisar 5-6,5. Penelitian yang dilakukan sejalan dengan penelitian Hayyan, dkk., [19] mengenai pembuatan DES berbasis ChCl dan D-Glukosa, yaitu pada rasio molar ChCl : D-Glukosa = 1:1; 1,5:1; 2:1 dan 2,5:1 diperoleh nilai pH DES pada suhu 27 0C berada antara 6,7 – 7,3 dan pada rasio molar ChCl:D-Glukosa = 2:1 diperoleh nilai pH DES paling dekat dengan pH 7.
Gambar 4.5 Grafik Pengaruh Rasio Molar ChCl : Etilen Glikol terhadap pH DES Dari grafik pada gambar 4.5 ditunjukkan bahwa nilai pH DES yang diperoleh semakin meningkat seiring dengan meningkatnya jumlah HBD Etilen Glikol, yaitu dari rasio molar 1:1 hingga 1:2,5 diperoleh nilai pH DES masing-masing 6,88; 6,93; 6,96; 7,03; 7,05; 7,12 dan 7,15. pH DES yang diperoleh berada di sekitar pH 7 atau pH netral.
Pada penelitian yang dilakukan oleh Zhao, dkk., [42] pada tahun 2015 mengenai DES berbasis ChCl yang diaplikasikan sebagai pelarut dalam ekstraksi
Rutin (flavonoid) dari Sophora japonica. Pada penelitian dilakukan uji
biokompatibilitas DES sebagai pelarut yang biokompatibel dan biodegradable dengan menggunakan bakteri dan ditemukan bahwa DES dengan HBD berbasis amina-, alkohol dan gula tidak menghambat pertumbuhan bakteri karena DES tersebut memiliki nilai pH berada pada kisaran pH netral dan sebaliknya DES dengan HBD berbasis asam organik menghambat pertumbuhan bakteri terutama disebabkan oleh perubahan pH. Nilai pH DES yang diuji jauh di bawah pH optimal (6,5-7,5) untuk pertumbuhan bakteri. Maka, penelitian yang dilakukan mendukung penelitian Zhao, dkk., [42] yaitu bahwa DES dengan HBD berbasis alkohol (etilen glikol) dan gula (glukosa) memiliki pH pada kisaran pH netral.
Selain itu, pada penelitian diperoleh nilai pH DES ChCl : Etilen Glikol = 1:2 adalah 7,12. Nilai ini tidak jauh berbeda dengan nilai pH yang diperoleh pada penelitian yang dilakukan oleh Protsenko, dkk., [43] pada tahun 2015 yaitu bahwa
6,85 6,90 6,95 7,00 7,05 7,10 7,15 7,20
0,75 1,00 1,25 1,50 1,75 2,00 2,25 2,50
Rasio Molar ChCl : Etilen Glikol
pH
semakin meningkat jumlah air yang ditambahkan pada suatu campuran ionic
liquid ChCl : Etilen Glikol dengan rasio molar 1:2 diperoleh nilai pH semakin
menurun tetapi tetap berada pada kisaran pH netral 6,82-7,62 dan nilai pH DES tanpa penambahan air diperoleh sebesar 7,9. Maka penelitian yang dilakukan sejalan dengan penelitian Protsenko, dkk., [43], Naser, dkk., [33] dan Zhao, dkk., [42], yaitu bahwa sifat garam dan HBD penyusun DES mempengaruhi keasaman atau kebasaan dari DES.
4.2.1.4 Viskositas
Viskositas DES adalah sifat penting yang perlu diketahui [39]. Penelitian mengenai viskositas DES adalah salah satu analisis yang paling penting karena penerapan DES sangat tergantung pada nilai viskositasnya [44]. Mengetahui nilai viskositas DES dapat memudahkan pembuatan DES dengan rasio molar yang optimum yang cocok untuk aplikasi tertentu. Selain itu juga dapat menghemat energi pada proses pembuatan DES [19]. Pengembangan DES dengan viskositas rendah sangat diharapkan karena DES berpotensi sebagia media yang ramah lingkungan [39]. Semakin rendah nilai viskositas DES maka semakin baik DES digunakan sebagai pelarut [44]. Secara umum, DES dengan viskositas tinggi tidak dianjurkan karena memiliki keterbatasan dalam aplikasi yang sebenarnya seperti pada ekstraksi cair-cair dan reaksi elektrokimia [39]. Viskositas sangat dipengaruhi oleh interaksi ikatan hidrogen, van der Waals dan elektrostatik. Berdasarkan pada interaksi antar molekul, viskositas DES tentu lebih tinggi dari beberapa pelarut konvensional lainnya, tetapi mirip dengan viskositas ionic liquid [42]. Viskositas campuran eutektik DES terutama dipengaruhi oleh sifat kimia dari komponen penyusunnya, yaitu garam dan HBD [39].
DES lebih mudah untuk ditangani sehingga dapat digunakan dalam berbagai jenis industri [19].
Viskositas DES yang tinggi disebabkan oleh adanya ikatan hidrogen yang berlebih yang menyebabkan interaksi van der Walls dan interaksi elektrostatik yang berlebih antara kedua komponen sehingga menghasilkan mobilitas lebih rendah pada molekul dalam DES. Hal ini akan mempengaruhi komposisi campuran eutektik DES, seperti karakteristik DES yang dihasilkan akan berbeda [39,44]. Menurut Zhao, dkk., [42] pada tahun 2015, banyaknya jumlah gugus hidroksil pada HBD akan menyebabkan ikatan hidrogen berlebih sehingga meningkatkan gaya tarik menarik antar molekul dan membuat cairan lebih kental. Menurut Yusof, dkk., [8] pada tahun 2014, garam bertindak sebagai jembatan yang menghubungkan kelompok ionik dalam DES. Jumlah garam yang sedikit menyebabkan jaringan antara kelompok dalam DES menjadi jarang sehingga menyebabkan penurunan viskositas. Sedangkan dalam penelitian ini, jumlah garam ChCl semakin meningkat sehingga jaringan antara kelompok dalam DES semakin kuat dan DES yang diperoleh semakin kental (viskositas tinggi).
menghasilkan DES dengan nilai viskositas sebesar 584 cP pada 30 0C, nilai ini jauh lebih rendah dibandingkan nilai viskositas DES ChCl/D-Glukosa yang berada pada kisaran 8.000-12.000 cP pada suhu 25 0C [42,19]. Pada penelitian Maugeri, dkk., [15] pada tahun 2012 juga membahas bagaimana mengurangi nilai viskositas DES berbasis D-Glukosa. Untuk mengurangi nilai viskositas DES berbasis D-Glukosa, Maugeri, dkk., [15] menambahkan gliserol dengan rasio molar ChCl : D-Glukosa : Gliserol = 1 : 0,5 : 0,5 dan diperoleh nilai viskositas DES sebesar 4.430 cP pada 30 0C. Sedangkan DES tanpa penambahan gliserol dengan rasio molar ChCl : D-Glukosa = 1:1 nilai viskositas DES tidak dapat diukur.
[image:40.595.166.490.363.578.2]Selanjutnya, nilai viskositas DES berbasis Etilen Glikol akan dibahas. Berikut adalah grafik pengaruh rasio molar ChCl dan Etilen Glikol terhadap nilai viskositas DES pada suhu ruang.
Gambar 4.6 Grafik Pengaruh Rasio Molar ChCl : Etilen Glikol terhadap Viskositas DES
Pada rasio molar ChCl : Etilen Glikol = 1:1 DES berwujud cairan kental dan keruh, sehingga nilai viskositasnya tidak dapat diukur. Akan tetapi nilai viskositas 6 DES berbasis Etilen Glikol lainnya dapat diukur. Dari grafik pada gambar 4.6 ditunjukkan bahwa nilai viskositas DES yang diperoleh semakin menurun seiring dengan meningkatnya jumlah HBD Etilen Glikol, yaitu dari rasio molar 1:1,25 hingga 1:2,5 diperoleh nilai viskositas DES masing-masing 33,001;
20 22 24 26 28 30 32 34
1,00 1,25 1,50 1,75 2,00 2,25 2,50
Rasio Molar ChCl : Etilen Glikol
V
is
k
o
si
tas
(c
P
)
29,561; 28,534; 26,447; 22,849 dan 22,049 cP. DES berbasis Etilen Glikol merupakan DES dengan nilai viskositas relatif rendah, dimana nilai viskositas DES yang diperoleh berada dibawah 100 cP pada suhu ruang. Sehingga penelitian yang dilakukan sejalan dengan penelitian Zhang, dkk., [Qinghua Zhang 2012] pada tahun 2012 yaitu kecuali DES berbasis ChCl/Etilen Glikol, sebagian besar DES memiliki viskositas yang relatif tinggi (> 100 cP) pada suhu ruang.
Pada penelitian yang dilakukan oleh Yusof, dkk., [8] pada tahun 2014 mengenai pengaruh penambahan jumlah HBD terhadap karakteristik DES dengan jumlah garam (Tetrabutylammonium Bromide) dibuat tetap, diperoleh bahwa penambahan Etilen Glikol yang semakin meningkat dari 66,7% hingga 85,7% menghasilkan DES dengan nilai viskositas semakin menurun. Maka penelitian yang dilakukan sejalan dengan penelitian yang dilakukan Yusof, dkk., [8] pada tahun 2014, yaitu bahwa viskositas menurun seiring dengan meningkatnya jumlah HBD Etilen Glikol. Menurut Yusof, dkk., [8] pada rasio molar garam dan HBD dimana jumlah garam tetap sedangkan jumlah HBD semakin meningkat, garam mungkin bertindak sebagai jembatan yang menghubungkan kelompok ionik lainnya. Jumlah garam yang sedikit menyebabkan jaringan antara kelompok dalam DES menjadi jarang sehingga menyebabkan penurunan viskositas.
gugus hidroksil pada Etilen Glikol karena apabila gugus hidroksil semakin banyak akan menyebabkan ikatan hidrogen berlebih sehingga meningkatkan gaya tarik menarik antar molekul dan membuat cairan lebih kental [42]. Seperti yang diteliti oleh Zhao, dkk., [42] pada tahun 2015 mengenai nilai viskositas DES berbasis ChCl dengan HBD gliserol dan xylitol diperoleh nilai viskositas masing-masing DES 0,177 Pa.s dan 3,867 Pa.s pada 30 0C. Xylitol memiliki dua gugus hidroksil tambahan dibandingkan dengan gliserol yang menyebabkan nilai viskositas DES berbasis Xylitol lebih tinggi dibandingkan DES berbasis gliserol.
Jika dibandingkan dengan DES lainnya yang berasal dari garam atau HBD yang berbeda, seperti DES dari berbasis ChCl dan urea, gliserol dan asam malonat sebagai HBD pada rasio molar yang sama, yaitu 1:2 diperoleh nilai viskositas DES masing-masing 750; 259 dan 1124 cP pada suhu 25 0C [5]. Maka dapat disimpulkan bahwa DES berbasis D-glukosa memiliki nilai viskositas yang cenderung lebih tinggi dari DES lainnya, sedangkan DES berbasis Etilen Glikol memiliki viskositas yang lebih rendah dari DES lainnya dan dari hasil penelitian juga diperoleh nilai viskositas DES berbasis Etilen Glikol relatif rendah dibandingkan viskositas DES berbasis D-glukosa. Hal ini sesuai dengan teori bahwa viskositas DES terutama dipengaruhi oleh sifat kimia dari komponen penyusun DES, yaitu jenis garam amonium dan HBD dan rasio molar garam/HBD [5,8].
4.2.2 Pengaruh Jenis Hidrogen Bond Donor (HBD) terhadap Karakteristik DES
molar ChCl dan HBD yang sama. Pada penelitian ini, HBD yang digunakan adalah D-Glukosa dan Etilen Glikol dan rasio molar ChCl dan HBD yang sama adalah pada rasio molar 1:1.
4.2.2.1 Titik Beku
[image:43.595.107.514.256.315.2]Pada tabel 4.4 ditunjukkan wujud DES pada suhu ruang dan nilai titik beku DES pada rasio molar ChCl/D-Glukosa dan ChCl/Etilen Glikol = 1:1
Tabel 4.4 Wujud dan Titik Beku DES
Jenis DES Wujud Pada Suhu Ruang (30 0C) Titik Beku ChCl : D-Glukosa = 1:1 Cairan bening < 30 0C ChCl : Etilen Glikol = 1:1 Cairan keruh > 30 0C
Dari tabel 4.4 dapat dilihat bahwa pada rasio molar 1:1, DES berbasis D-Glukosa memiliki titik beku lebih rendah dibandingkan DES berbasis Etilen Glikol. Hal ini disebabkan oleh jumlah gugus gugus hidroksil (-OH) pada D-Glukosa lebih banyak dibandingkan pada Etilen Glikol. Sehingga pada rasio molar yang sama, gugus hidroksil dari D-Glukosa lebih banyak membangun ikatan hidrogen dengan anion halida dari garam ChCl. Sedangkan dalam DES berbasis Etilen Glikol terdapat anion halida garam ChCl berlebih sehingga menyebabkan DES berwujud cairan keruh dan memiliki titik beku yang tinggi, yaitu > 30 0C.
Akan tetapi, jika jumlah gugus hidroksil (-OH) HBD berlebih dalam DES, maka juga dapat menyebabkan meningkatnya titik beku DES. Seperti pada penelitian Harris, dkk., [30] pada tahun 2008, DES berbasis ChCl/Erythritol memiliki titik beku lebih rendah dibandingkan DES berbasis ChCl/Xylitol, ChCl/D-Fruktosa dan ChCl/D-Glukosa pada rasio molar 1:1. Dimana Erythritol memiliki 4 gugus hidroksil (-OH), sedangkan Xylitol, D-Fruktosa dan D-Glukosa memiliki 5 gugus hidroksil (-OH).
4.2.2.2 Densitas
[image:44.595.163.518.188.357.2]Pada gambar 4.7 ditunjukkan grafik pengaruh jenis HBD terhadap densitas DES pada suhu ruang, dengan rasio molar ChCl:D-Glukosa dan ChCl:Etilen Glikol yang sama, yaitu 1:1.
Gambar 4.7 Grafik Pengaruh Jenis HBD terhadap Densitas DES
Dari grafik pada gambar 4.7 dapat dilihat bahwa densitas DES berbasis D-Glukosa lebih tinggi dibandingkan DES berbasis Etilen Glikol. Nilai densitas DES berbasis D-Glukosa berada diatas 1,25 gr/ml sedangkan nilai densitas DES berbasis Etilen Glikol berada disekitar 1,11 gr/ml. Hal ini disebabkan oleh jumlah gugus hidroksil (-OH) dalam HBD D-Glukosa lebih banyak dibandingkan dengan HBD Etilen Glikol, dimana terdapat 5 gugus hidroksil (-OH) pada D-Glukosa dan 2 gugus hidroksil (-OH) pada Etilen Glikol [30]. Selain itu, hal ini juga dapat dijelaskan dengan nilai densitas Etilen Glikol yang lebih kecil dari densitas D-Glukosa maka penambahan HBD D-D-Glukosa dan Etilen Glikol pada rasio molar yang sama akan diperoleh densitas Etilen Glikol yang lebih rendah dari densitas DES berbasis D-Glukosa [33].
Penelitian yang dilakukan sejalan dengan penelitian yang dilakukan oleh Harris [30] pada tahun 2008, yaitu pengaruh jumlah gugus hidroksil (-OH) terhadap karakteristik DES dengan menggunakan HBD Gliserol dan Etilen Glikol, dimana terdapat 3 gugus hidroksil OH) pada Gliserol dan 2 gugus hidroksil (-OH) pada Etilen Glikol. Dari hasil penelitian Harris [30] pada rasio molar yang
1,28 1,29 1,30 1,31 1,32
DES ChCl / D-Glukosa DES ChCl / Etiken Glikol
D
e
n
si
tas
(gr
/m
l)
sama diperoleh bahwa DES berbasis Gliserol memiliki nilai densitas lebih tinggi dibandingkan dengan densitas DES berbasis Etilen Glikol.
4.2.2.3 pH
[image:45.595.118.488.242.437.2]Pada gambar 4.8 ditunjukkan grafik pengaruh jenis HBD terhadap pH DES pada suhu ruang, dengan rasio molar ChCl:D-Glukosa dan ChCl:Etilen Glikol yang sama, yaitu 1:1.
Gambar 4.8 Grafik Pengaruh Jenis HBD terhadap pH DES
Dari grafik pada gambar 4.8 dapat dilihat bahwa pH DES berbasis Etilen Glikol dan DES berbasis D-Glukosa berada pada kisaran pH netral, yaitu masing-masing sebesar 6,88 dan 6,70. Hal ini disebkan oleh sifat garam ChCl, HBD D-Glukosa dan Etilen Glikol yang berada pada kisaran pH netral, dimana ChCl memiliki pH berkisar 5-6,5, D-Glukosa memiliki pH berkisar 5,9 dan Etilen Glikol memilki pH berkisar 5,5-7,5. Maka, penelitian yang dilakukan sejalan dengan penelitian Zhao, dkk., [42] yaitu bahwa DES dengan HBD berbasis alkohol (etilen glikol) dan gula (glukosa) memiliki pH pada kisaran pH netral.
4.2.2.4 Viskositas
Pada penelitian ini, nilai viskositas DES berbasis D-Glukosa dan DES berbasis Etilen Glikol pada rasio molar 1:1 tidak bisa diukur. Hal ini disebabkan
6,0 6,2 6,4 6,6 6,8 7,0
DES ChCl / D-Glukosa DES ChCl / Etiken Glikol
pH
karena DES berbasis D-Glukosa pada rasio molar 1:1 berwujud sangat kental pada suhu ruang dan DES berbasis Etilen Glikol berwujud cairan kental dan keruh.
Pada DES berbasis D-Glukosa, banyaknya jumlah gugus hidroksil (-OH) yang tersedia untuk membangun ikatan hidrogen dengan anion halida dari garam ChCl menyebabkan viskositas DES berbasis D-Glukosa tinggi. Hal ini disebabkan oleh jaringan antara kelompok dalam DES semakin kuat sehingga DES yang diperoleh semakin kental (viskositas tinggi) [8].
BAB V
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
Adapun kesimpulan yang dapat diambil dari penelitian yang telah dilakukan adalah:
1. Rasio molar ChCl:D-Glukosa dan ChCl:Etilen Glikol merupakan faktor yang sangat mempengaruhi karakteristik DES.
2. Rasio molar ChCl:D-Glukosa untuk menghasilkan DES dengan titik beku dan densitas terendah adalah pada rasio molar 2:1, jika jumlah ChCl dinaikkan atau diturunkan maka diperoleh titik beku dan densitas DES semakin meningkat.
3. Rasio molar ChCl:Etilen Glikol untuk menghasilkan DES dengan titik beku, densitas dan viskositas terendah adalah pada rasio molar 1:2,5, jika jumlah HBD Etilen Glikol semakin menurun maka diperoleh titik beku, densitas dan viskositas DES semakin meningkat.
4. DES berbasis ChCl/D-Glukosa dan ChCl/Etilen Glikol memiliki pH pada kisaran pH netral.
5. DES berbasis Etilen Glikol memiliki viskositas yang relatif rendah (< 100 cP) pada suhu ruang (30 0C), sedangkan DES berbasis D-Glukosa memiliki viskositas yang tinggi
6. Jenis HBD penyusun DES, yaitu D-Glukosa dan Etilen Glikol mempengaruhi karakteristik DES.
5.2 SARAN
Adapun saran yang dapat diberikan adalah:
1. Peneliti menyarankan untuk menambahkan senyawa lain pada DES berbasis D-Glukosa untuk memperkecil viskositas DES, seperti air atau gliserol. 2. Peneliti menyarankan untuk menganalisis wujud DES berbasis D-Glukosa
3. Peneliti menyarankan untuk memperkecil suhu analisis wujud DES berbasis Etilen Glikol hingga dibawah 0 0C untuk memperkecil kisaran nilai titik beku DES.
BAB II
TINJAUAN PUSTAKA
2.1 INDUSTRI KIMIA DAN PERKEMBANGANNYA
Saat ini, perhatian terhadap industri kimia semakin meningkat karena berkurangnya pasokan bahan baku dan sumber energi serta meningkatnya kepedulian terhadap lingkungan, sehingga terdapat dorongan untuk memperkenalkan pengolahan yang bersih di bidang industri [20]. Dimana, idealnya reaksi kimia dalam industri diharapkan harus memiliki sifat sebagai berikut: (1) menggunakan bahan baku terbarukan; (2) menghasilkan produk tunggal; (3) memiliki efisiensi atom 100 %; (4) beroperasi dalam kondisi ruangan; (5) tidak dipengaruhi oleh adanya udara; (6) tidak menghasilkan limbah atau produk samping; (7) memiliki katalis berumur panjang; (8) memiliki metode pemisahan katalis dari produk yang sederhana dan (9) beroperasi di bawah kondisi aliran kontinyu [21].
Seiring dengan pertumbuhan kegiatan industri, permintaan terhadap energi terbarukan menjadi semakin berkembang karena masalah lingkungan seperti pemanasan global atau hujan asam. Masalah-masalah ini terjadi karena penggunaan bahan bakar fosil yang berlebihan sebagai akibat dari pertumbuhan pesat yang belum pernah terjadi sebelumnya di bidang pertanian, kegiatan rumah tangga dan industri. Oleh karena itu, muncul tanggapan bahwa sumber energi terbarukan memiliki kemungkinan kuat untuk menggantikan bahan bakar fosil di masa depan karena dampak signifikan yang lebih rendah pada lingkungan [22].
dianggap sebagai pelarut hijau karena memiliki sifat ramah lingkungan dan memiliki sifat yang menarik, seperti tekanan uap rendah, volatilitasnya dapat diabaikan, konduktivitas yang tinggi, aktivitas katalitik yang lebih baik, kemampuan pelarutan yang kuat dan memiliki potensi untuk reuse [25,26]. Karena sifat uniknya, ILs secara luas digunakan dalam proses pemisahan kimia, seperti ekstraksi [23].
Namun, sifat ramah lingkungan yang ditunjukkan oleh ILs masih kurang karena ILs masih memiliki beberapa keterbatasan. Akibatnya, ada peneliti yang lebih memilih untuk membeli ILs daripada mensintesis secara lokal. Hal ini menjadi kendala penggunaan ILs sebagai bahan industri kimia yang layak dan praktis [4]. Oleh karena kelemahan-kelemahan yang ditunjukkan ILs tersebut, mendorong beberapa peneliti untuk mengembangkan suatu pelarut dengan tetap mempertahankan sifat ILs, yaitu pelarut dengan biaya rendah dan meminimalkan dampak lingkungan [3].
Dalam beberapa tahun terakhir muncul suatu media baru yang memiliki sifat yang mirip dengan ILs, tetapi memiliki kelebihan dalam hal biaya, dampak lingkungan, dan sintesisnya telah dikembangkan, yaitu Deep Eutectic Solvent (DES) [27]. DES merupakan jenis pelarut yang memiliki sifat fisik dan perilaku yang mirip dengan ILs. DES mampu mengatasi beberapa kelemahan utama dari ILs, seperti mudah dipersiapkan dalam kondisi yang murni, tidak reaktif dengan air, cukup aman dan biodegradable [4,3].
2.2DEEP EUTECTIC SOLVENT (DES)
Deep Eutectic Solvent (DES) adalah pelarut baru seperti ILs, dengan
Gambar 2.1 Diagram Representasi Teori Titik Eutektik Campuran [30]
Sama seperti ILs, DES memiliki titik leleh yang dekat dengan Room
Temperature (RT), volatilitas rendah dan stabilitas yang tinggi. Bagaimanapun
juga DES tidak seperti kebanyakan ILs karena DES bersifat biodegradable, murah, dan sangat mudah untuk disintesis, jauh lebih sederhana dari ILs. Oleh karena itu, dalam beberapa tahun terakhir, jumlah publikasi yang didedikasikan untuk penggunaan DES telah jauh meningkat [27,31]. Banyak penelitian menunjukkan bahwa DES berguna dalam banyak aplikasi karena berpotensi sebagai alternatif pelarut yang ramah lingkungan [23].
DES telah disebut sebagai pelarut ramah lingkungan dalam reaksi organik [32]. Baru-baru ini, berbagai penelitian melaporkan penerapan DES sebagai pelarut dalam pengolahan logam, pemurnian biodiesel, sintesis polimer, solubilisasi obat, transformasi biologis, persiapan karbon nanotube komposit dan bahkan penyerapan CO2. DES juga ditemukan sebagai pelarut baru yang layak untuk fabrikasi permukaan logam dan coating (superhidrofobik film Ni) dan termokromik PVDF film komposit [29]. Selain itu, DES juga telah banyak digunakan dalam bidang biodiesel, yaitu sebagai media dalam reaksi enzimatik untuk produksi biodiesel, untuk penghapusan katalis basa dalam reaksi transesterifikasi seperti kalium hidroksida (KOH) dan pemisahan gliserol dari biodiesel [31].
Melting point of A
Melting point of B Liquid L
Eutectic Point
A + B
A + L B + L
Solid A doped
with B Solid B
2.3SINTESIS DEEP EUTECTIC SOLVENT (DES)
Secara umum, DES telah disintesis dari garam berbasis amonium atau fosfonium. Garam-garam ini digabungkan dalam rasio yang berbeda dengan berbagai jenis donor ikatan hidrogen, seperti alkohol, urea, asam karboksilat (asam oksalat, asam sitrat, asam suksinat atau asam amino), poliol (gliserol, karbohidrat), ester, eter, amida, dan garam logam terhidrasi, seperti klorida, nitrat dan asetat. Namun, garam berbasis kalium tidak digunakan sebagai bahan baku sintesis DES [33,5]. Sintesis DES pada dasarnya adalah sebagai berikut [27]:
1. Ditimbang HBD dan garam ke dalam termos (semua tindakan pencegahan harus diambil untuk mengisolasi campuran dari kelembaban udara karena higroskopisitas tinggi)
2. Dilakukan pemanasan dan pengadukan sampai terbentuk cairan berwarna (biasanya 2 jam pada 60 0C).
Salah satu contoh yang paling eksplisit adalah pencampuran satu mol
choline chloride (ChCl) dan dua mol urea (dengan titik leleh masing-masing 247 0C dan 133 0C) menghasilkan DES yang memiliki titik leleh pada RT (12 0C). Pada titik eutektik, masing-masing ion klorida yang diberikan oleh garam amonium dikomplekskan oleh dua molekul urea. Dimana, rasio molar merupakan variabel yang berhubungan dengan titik eutektik dengan suhu yang sesuai dengan sifat masing-masing komponen. Misalnya, DES berdasarkan rasio equimolar asam dikarboksilat dan garam kationik ChCl, memiliki titik leleh berkisar antara 10 sampai 71 0C. Baru-baru ini, sebuah kelas baru DES berdasarkan garam fosfonium kuaterner telah efektif disintesis dengan donor ikatan hidrogen yang berbeda. Banyak dari DES tersebut memiliki titik leleh lebih rendah dari 100 0C dan perilaku fisiknya mirip dengan garam ammonium penyusunnya, sehingga membuatnya menjadi alternatif baru untuk berbagai aplikasi [27].
2.3.1 Choline Chloride (ChCl)
Choline chloride (ChCl) dengan nama IUPAC 2-hydroxy-N,N,N-trimethylethanaminium chloride atau (2-hydroxyethyl) trimethylammonium chloride adalah salah satu garam amonium yang paling luas digunakan untuk
biomassa [5]. DES berbasis ChCl telah menarik perhatian yang cukup besar di banyak bidang, seperti elektrodeposisi, biokatalitik dan sintesis organik [34]. Selain itu, DES ini juga telah ditemukan memiliki potensi sebagai pelarut ramah lingkungan dalam penyerapan CO2 [35]. Akan tetapi, meskipun sebagian besar DES yang terbuat dari ChCl merupakan jenis ILs, DES tidak dapat dianggap sebagai ILs karena DES tidak seluruhnya terdiri dari jenis ion, DES juga dapat diperoleh dari jenis non-ionik. Selain itu, Dibandingkan dengan ILs tradisional, DES yang berasal dari ChCl memiliki banyak keuntungan, seperti (1) biaya rendah; (2) kurang reaktif dengan air; (3) sintesisnya mudah, yaitu diperoleh hanya dengan mencampurkan dua komponen, sehingga akan melewati semua masalah pemurnian dan pembuangan limbah yang umumnya ditemui pada ILs dan (4) sebagian besar dari DES adalah biodegradable, biocompatible dan tidak beracun, sehingga memperkuat DES menjadi media yang ramah lingkungan [5].
2.3.2 Hydrogen Bond Donor (HBD)
Seperti yang telah dibahas pada sub bab sebelumnya, bahwa DES disintesis dari garam berbasis amonium atau fosfonium yang digabungkan dalam rasio yang berbeda dengan berbagai jenis HBD, seperti alkohol, urea, asam karboksilat (asam oksalat, asam sitrat, asam suksinat atau asam amino), poliol (gliserol, karbohidrat), ester, eter, amida, dan garam logam terhidrasi, seperti klorida, nitrat dan asetat [33,5]. Namun, penggunaan urea, etilen glikol dan gliserol sebagai HBD adalah yang paling banyak karena harganya yang murah dan juga mudah berdifusi [18]. Leron, dkk., [7] pada tahun 2012 melaporkan DES dari ChCl dengan urea, etilen glikol dan gliserol sebagai HBD dan disebutkan bahwa dengan rasio molar yang sama (ChCl : HBD) titik beku DES dari etilen glikol adalah yang paling rendah dibandingkan DES dari urea dan gliserol.
Pada penelitian Hayyan, dkk., [19] pada tahun 2013 dilaporkan sintesis
deep eutectic solvent (DES) untuk digunakan sebagai pelarut dalam industri gula.
(D-glukosa) sebagai donor ikatan hidrogen pada rasio yang berbeda. Selain itu, sifat fisik DES seperti densitas, viskositas, tegangan permukaan, indeks bias, dan pH juga diteliti untuk kemungkinan DES ini dapat digunakan sebagai pelarut baru dalam proses kimia. Hasil penelitian ini melaporkan, DES berbasis ChCl dan glukosa dalam rasio mol berbeda telah berhasil disintesis dan ditemukan bahwa sifat fisik DES tergantung pada rasio molar yang berbeda pada garam dan ikatan donor hidrogen penyusunnya. DES yang diperoleh juga memiliki sifat fisik yang serupa dengan ionic liquids (ILs) pada umumnya, yaitu memiliki viskositas tinggi, densitas dan tegangan permukaan pada suhu kamar, sehingga dianjurkan untuk memanaskan DES jenis ini sebelum pengolahan. Selain itu, DES ini memiliki pH yang hampir netral dengan sensitivitas yang rendah terhadap variasi suhu, sehingga membuat DES jenis ini baik sebagai alternatif baru untuk aplikasi kimia, lingkungan dan biologi. Hasil dari penelitian ini menunjukkan bahwa DES berbasis gula sebagai donor ikatan hidrogen berguna untuk pembelajaran proses
scale-up maupun pengembangan aplikasi DES berbasis gula dalam berbagai
aplikasi indus