TINJAUAN PUSTAKA
KARAKTERISASI SIMPLISIA DAN ISOLASI SENYAWA ANTOSIANIN DARI BUNGA TANAMAN PACAR AIR (Impatiens balsamina Linn.)
BERWARNA MERAH
Oleh:
REKI ANGGRIANI 071524055
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGESAHAN SKRIPSI
KARAKTERISASI SIMPLISIA DAN ISOLASI SENYAWA ANTOSIANIN DARI BUNGA TANAMAN PACAR AIR (Impatiens balsamina Linn.)
BERWARNA MERAH
Diajukan oleh:
REKI ANGGRIANI 071524055
Disetujui oleh:
Pembimbing I Pembimbing II
(Dra. Suwarti Aris, M.Si., Apt.)
NIP.195107231982032001 NIP. 19530403198303 2001 (Dra. Aswita Hafni Lubis, M.Si., Apt)
Medan, Januari 2010 Disahkan oleh:
Dekan Fakultas Farmasi USU
NIP. 19531128 198303 1002
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT atas segala rahmat dan karunianya
sehingga penelitian dan penulisan ini dapat diselesaikan.
Terima kasih yang tak terhingga dan penghargaan yang setinggi-tingginya
penulis sampaikan kepada ayahanda Lainul Puaddi, SE. dan ibunda Eka Adriani
serta adikku Rolix Andian, dan keluarga besarku, terima kasih atas segala do’a, kasih
saying, dorongan moril dan materil kepada penulis selama ini.
Dengan segala ketulusan hati penulis juga menyampaikan terima kasih kepada
ibu Dra. Suwarti Aris, M.Si., Apt, dan ibu Dra Aswita Hafni Lubis, M.Si., Apt.
selaku pembimbing yang telah meluangkan waktunya dalam memberi petunjuk dan
bimbingan kepada penulis dengan penuh kesabaran hingga selesainya penulisan
skripsi ini.
Pada kesempatan ini penulis juga mengucapkan terima kasih kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra., Apt. selaku Dekan Fakultas Farmasi
Universitas Sumatera Utara
2. Ibu Dra. Masfria, M.Si., Apt sebagai dosen wali yang telah banyak
membimbing penulis selama masa perkuliahan hingga selesai.
3. Bapak dan Ibu selaku dosen penguji yang telah memberikan masukkan dan
saran kepada penulis hingga selesainya penulisan skripsi ini.
4. Bapak dan Ibu staf pengajar Fakultas Farmasi USU yang telah mendidik
5. Bapak dan Ibu Staf Laboratorium Obat Tradisional yang telah memberikan
petunjuk dan saran serta fasilitas laboratorium selama penulis melakukan
penelitian.
6. Teman-temanku Desy, kak Fenti, Ulfa, kak Rahma, Reni, Puji, Riza, Lastri,
kak Yayuk, Leli, kak Erni, kak Dwi, bang Tomi, kak bora, serta semua
teman-teman farmasi ekstensi angkatan 2007 yang tidak dapat disebut satu
persatu dan teman-teman kostku Desy, Fatimah, Fatma, Dewi, Devia, Ulfa
kebersamaannya dalam suka-duka, memberi dorongan dan bantuan kepada
penulis.
Penulis menyadari bahwa sepenuhnya penulisan skripsi ini masih jauh dari
kesempurnaan, sehingga penulis mengharapkan kritik dan saran yang bersifat
membangun demi kesempurnaan sripsi ini. Akhir kata penulis berharap semoga
skripsi ini dapat menjadi sumbangan yang bermanfaat bagi ilmu pengetahuan
khususnya dibidang farmasi.
Medan, Februari 2010
Penulis ,
KARAKTERISASI SIMPLISIA DAN ISOLASI SENYAWA ANTOSIANIN DARI BUNGA TANAMAN PACAR AIR (Impatiens balsamina Linn.)
BERWARNA MERAH ABSTRAK
Tumbuhan yang digunakan pada penelitian ini adalah bunga dari tumbuhan
pacar air (Impatiens balsamina Linn) yang bewarna merah, tumbuhan pacar air ini
karakterisasi simplisia nya belum terdapat di buku monografi tumbuhan Materia
Medika Indonesia. Untuk mengetahui karakterisasi dari simplisia dan untuk
mengetahui cara mengisolasi senyawa antosianin yang terdapat didalam bunga dan
menentukan senyawanya melalui spektrofotometri ultraviolet dengan pereaksi geser.
Telah dilakukan karakterisasi simplisia, skrining fitokimia, ekstraksi, isolasi dan
karakterisasi senyawa antosianin dari bunga tumbuhan pacar air (Impatiens
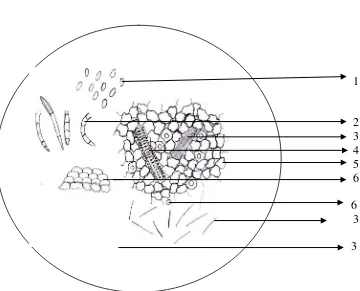
balsamina Linn.) bewarna merah. Hasil pemeriksaan mikroskopik serbuk simplisia
yang spesifik adalah, serbuk sari berbentuk oval, rambut penutup multiseluler,
kalsium oksalat rapida, dan papilla. Hasil karakteristik serbuk simplisia bunga pacar
air merah diperoleh kadar air 9,31%, Kadar sari yang larut dalam air 19,62%, kadar
sari yang larut dalam etanol 12,80%, Kadar abu total 1,14%, dan kadar abu yang
tidak larut dalam asam 0,25%. Hasil skrining fitokimia simplisia menunjukka adanya
flavonoida dan glikosida. Ekstraksi dilakukan secara maserasi menggunakan pelarut
etanol 96% dengan penambahan HCl pekat sebanyak 1% dari pelarut, dilanjutkan
dengan isolasi secara kromatografi kertas preparatif. Hasil isolasi diperoleh isolat
CHARACTERIZATION OF SIMPLISIA AND ISOLATION ANTOSIANIN COMPOUND FROM FLOWER RED PACAR AIR PLANT
(Impatiens balsamina Linn.) ABSTRACT
Plant used in examination is flower red pacar air plant (Impatiens balsamina
Linn), characterization of simplisia pacar air plant is not contained in Materia Medika
Indonesia book. To know the characterization of simplisia and knowing antosianin
isolation methods contained in the flower and determine the compounds throught
ultraviolet spektrofotometri with shift reagent.The characterization of simplisia,
screening fitochemical, extraction, isolation and characterization of antosianin
compound from flower red pacar air plant (Impatiens balsamina Linn.). The
examination of simplisia microscopic specific is pollen oval form, hair multiceluler,
calsium oxalate rapida form, and papilla. The examination of simplisia characteristic
gave the water content value 9,31%, the water soluble extract value 19,62%, the
ethanol soluble extract value 12,80%, the total ash value 1,14%, and the acid
insoluble extract value 0,25%. The result of screening fitochemical show thepresence
of flavonoida an glicosida. Extraction was carried out by maseration with ethanol
96% added HCl concentrated 1% of soluble. Isolation with chromatografi paper
preparative, the result of isolation was obtained PI isolate. PI isolate exhibited a
maximum absorption at 510 nm.
DAFTAR ISI
Halaman
JUDUL………... ... i
HALAMAN PENGESAHAN……… ... ii
ABSTRAK………. ... iii
ABSTRACT……… ... iv
DAFTAR ISI……….. ... v
DAFTAR LAMPIRAN.………... ... viii
DAFTAR TABEL………... x
DAFTAR GAMBAR……….. ... xi
BAB I. PENDAHULUAN……….. ... 1
1.1Latar Belakang………... ... 1
1.2Perumusan Masalah……… ... 3
1.3Hipotesis………... 3
1.4Tujuan Penelitian ………. ... 3
1.5Manfaat Penelitian ... 4
BAB II. TINJAUAN PUSTAKA...5
2.1 Uraian tumbuhan pacar air merah...5
2.2 Uraian Kimia...6
2.3 Ekstraksi...11
2.4 Kromatografi ...
BAB III. METODOLOGI PENELITIAN ………. ……5
3.1 Alat-alat... ………...….5
3.2 Bahan-bahan……… ... ….5
3.3Pembuatan larutan pereaksi……… ... 6
3.3.1 Pereaksi mayer... 6
3.3.2 Pereaksi Natrium Hidroksida ... 6
3.3.3 Pereaksi Bouchardat...6
3.3.4 Pereaksi Dragendroff...6
3.3.5 Pereaksi Besi (III) Klorida 1% (b/v)...7
3.3.6 Pereaksi Asam Klorida 2N...7
3.3.7 Pereaksi Timbal (II) Asetat 0,4 M...7
3.3.8 Pereaksi Molish...7
3.3.9 Pereaksi Aluminium Klorida 5% (b/v)...7
3.3.10 Larutan Kloralhidrat...7
3.4Pengambilan, Identifikasi dan pengolahan sampel...7
3.4.1 Pengambilan Sampel...7
3.4.2 Identifikasi Sampel...8
3.4.3 Pengolahan Sampel...8
3.5Pemeriksaan karateristik simplisia ... 8
3.5.1 Pemeriksaan makroskopik ... 8
3.5.2 Pemeriksaan mikroskopik ... 9
3.5.3 Penetapan kadar air...9
3.5.5 Penetapan kadar sari yang larut dalam etanol ... 10
3.5.6 Penetapan kadar abu total... 10
3.5.7 Penetapan kadar abu yang tidak larut dalam asam ... 11
3.6Penapisan fitokimia serbuk simplisia...11
3.6.1 Pemeriksaan alkaloida ……… ... ………...……..11
3.6.2 Pemeriksaan flavonoida ... ………12
3.6.3 Pemeriksaan saponin ... ……….12
3.6.4 Pemeriksaan tanin ... ……….12
3.6.5 Pemeriksaan glikosida ... ……….13
3.6.6 Pemeriksaan glikosida antrakuinon .. ……….13
3.6.7 Pemeriksan steroida/triterpenoida ... 13
3.7Pembuatan ekstrak ... ………14
3.8 Analisis senyawa antosianin dari ekstrak etanol dengan cara KKt ... 14
3.9 Pemisahan senyawa antosianin dari ekstrak etanol dengan cara KKt preparatif ... 15
3.10 Uji kemurnian dari hasil KKt preparatif ... 16
3.11 Pemisahan senyawa antosianin dari isolat FI secara KKt prefaratif...16
3.12 Uji kemurnian isolat PI dari hasil KKt preparatif...16
3.13 Karakterisasi hasil isolasi ... 17
3.13.1 Karakterisasi isolat dengan Spektrofotometri UV dengan penambahan pereaksi geser...17
5.1 Kesimpulan... ………... 22
5.2 Saran ... ……….22
DAFTAR PUSTAKA ... ………..23
DAFTAR LAMPIRAN
Lampiran Halaman
1. Hasil identifikasi tumbuhan ... ...24
2. Gambar tumbuhan pacar air merah dan simplisia bunga pacar air merah ... . 25
3. Mikroskopik serbuk simplisia bunga pacar air merah ... 26
4. Hasil karakterisasi serbuk simplisia bunga pacar air merah dan skrining fitokimia serbuk simplisia bunga pacar air merah ... 27
5. Perhitungan penetapan kadar air... 28
6 Perhitungan penetapan kadar sari larut dalam air ... 29
7. Perhitungan penetapan kadar sari larut dalam etanol... ...30
8. Perhitungan penetapan kadar abu total ... ...31
9. Perhitungan penetapan kadar yang tidak larut dalam asam ... 32
10. Gambar bagan metode panelitian...33
11. Gambar bagan ekstraksi senyawa antosianin...34
12. Gambar bagan isolasi senyawa antosianin...35
13. Kromatogram ekstrak etanol secara KKt...36
14. Kromatogram KKt preparatif dari ekstrak etanol...37
15. KKt isolat FI...38
16. KKt isolat FII...39
17. Kromatogram KKt preparatif isolat ekstrak etanol...40
20. Kromatogram KKt dua arah dari isolat PI...43
21. Kromatogram KKt dua arah dari isolat PII...44
22. Spektrum uv isolat PI dalam metanol...45
23. Spektrum uv isolat PI dengan penambahan NaOH dibandingkan
dengan spektrum uv isolat PI dalam metanol...46
24. Spektrum uv isolat PI dengan penambahan NaOH dibandingkan
dengan spektrum uv yang diukur setelah 5 menit...47
25. Spektrum uv isolat PI dengan penambahan AlCl3 dibandingkan dengan
Isolat PI dalam metanol...48
26. Spektrum uv isolat PI dengan penambahan AlCl3/HCl dibandingkan
dengan spektrum uv isolat PI dengan penambahan AlCl3...49
27. Spektrum uv isolat PI dengan penambahan Natrium Asetat dibandingkan
DAFTAR TABEL
Tabel Halaman
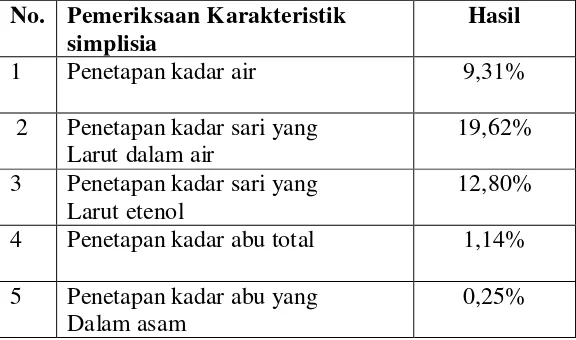
1. Hasil pemeriksaan karakterisasi serbuk simplisia bunga pacar air merah...27
DAFTAR GAMBAR
Gambar Halaman
1. Gambar tumbuhan pacar air merah dan serbuk simplisia bunga pacar air
merah...25
2. Mikroskopik serbuk simplisia bunga pacar air merah...26
3. Bagan metode panelitian...33
4. Bagan ekstraksi senyawa antosianin...34
5. Bagan isolasi senyawa antosianin...35
6. Kromatogram ekstrak etanol secara KKt...36
7. Kromatogram KKt preparatif dari ekstrak etanol...37
8. KKt isolat FI...38
9. KKt isolat FII...39
10. Kromatogram KKt preparatif isolat FI...40
11. KKt isolat PI ...41
12. KKt isolat PII...42
13. Kromatogram KKt dua arah dari isolat Pita I...43
14. Kromatogram KKt dua arah dari isolat Pita II...44
15. Spektrum uv isolat PI dalam metanol...45
16. Spektrum uv isolat PI dengan penambahan NaOH dibandingkan dengan spektrum uv isolat PI dalam metanol...46
17. Spektrum uv isolat PI dengan penambahan NaOH dibandingkan dengan spektrum uv yang diukur setelah 5 menit...47
isolat PI dalam metanol...48
19. Spektrum uv isolat PI dengan penambahan AlCl3/HCl dibandingkan
dengan spektrum uv isolat PI dengan penambahan AlCl3...49
20. Spektrum uv isolat PI dengan penambahan Natrium Asetat
KARAKTERISASI SIMPLISIA DAN ISOLASI SENYAWA ANTOSIANIN DARI BUNGA TANAMAN PACAR AIR (Impatiens balsamina Linn.)
BERWARNA MERAH ABSTRAK
Tumbuhan yang digunakan pada penelitian ini adalah bunga dari tumbuhan
pacar air (Impatiens balsamina Linn) yang bewarna merah, tumbuhan pacar air ini
karakterisasi simplisia nya belum terdapat di buku monografi tumbuhan Materia
Medika Indonesia. Untuk mengetahui karakterisasi dari simplisia dan untuk
mengetahui cara mengisolasi senyawa antosianin yang terdapat didalam bunga dan
menentukan senyawanya melalui spektrofotometri ultraviolet dengan pereaksi geser.
Telah dilakukan karakterisasi simplisia, skrining fitokimia, ekstraksi, isolasi dan
karakterisasi senyawa antosianin dari bunga tumbuhan pacar air (Impatiens
balsamina Linn.) bewarna merah. Hasil pemeriksaan mikroskopik serbuk simplisia
yang spesifik adalah, serbuk sari berbentuk oval, rambut penutup multiseluler,
kalsium oksalat rapida, dan papilla. Hasil karakteristik serbuk simplisia bunga pacar
air merah diperoleh kadar air 9,31%, Kadar sari yang larut dalam air 19,62%, kadar
sari yang larut dalam etanol 12,80%, Kadar abu total 1,14%, dan kadar abu yang
tidak larut dalam asam 0,25%. Hasil skrining fitokimia simplisia menunjukka adanya
flavonoida dan glikosida. Ekstraksi dilakukan secara maserasi menggunakan pelarut
etanol 96% dengan penambahan HCl pekat sebanyak 1% dari pelarut, dilanjutkan
dengan isolasi secara kromatografi kertas preparatif. Hasil isolasi diperoleh isolat
yaitu isolat PI . Isolat PI memberikan absorbansi maksimum 510 nm.
CHARACTERIZATION OF SIMPLISIA AND ISOLATION ANTOSIANIN COMPOUND FROM FLOWER RED PACAR AIR PLANT
(Impatiens balsamina Linn.) ABSTRACT
Plant used in examination is flower red pacar air plant (Impatiens balsamina
Linn), characterization of simplisia pacar air plant is not contained in Materia Medika
Indonesia book. To know the characterization of simplisia and knowing antosianin
isolation methods contained in the flower and determine the compounds throught
ultraviolet spektrofotometri with shift reagent.The characterization of simplisia,
screening fitochemical, extraction, isolation and characterization of antosianin
compound from flower red pacar air plant (Impatiens balsamina Linn.). The
examination of simplisia microscopic specific is pollen oval form, hair multiceluler,
calsium oxalate rapida form, and papilla. The examination of simplisia characteristic
gave the water content value 9,31%, the water soluble extract value 19,62%, the
ethanol soluble extract value 12,80%, the total ash value 1,14%, and the acid
insoluble extract value 0,25%. The result of screening fitochemical show thepresence
of flavonoida an glicosida. Extraction was carried out by maseration with ethanol
96% added HCl concentrated 1% of soluble. Isolation with chromatografi paper
preparative, the result of isolation was obtained PI isolate. PI isolate exhibited a
maximum absorption at 510 nm.
BAB I
PENDAHULUAN
1.1.Latar Belakang
Tumbuhan mengandung berbagai jenis senyawa kimia, mulai dari struktur dan
sifat yang sederhana sampai yang rumit dan unik. Beragam jenis senyawa kimia yang
terkandung dalam tumbuhan akan berhubungan erat dengan khasiat dan manfaat yang
dimiliki. Upaya pencarian tumbuhan berkhasiat obat telah lama dilakukan, baik untuk
mencari senyawa baru ataupun menambah keanekaragaman senyawa yang telah ada.
(Hernani dan Rahardjo, 2004). Seiring dengan perkembangan dunia kedokteran,
tidak dapat dipungkiri bahwa cara pengobatan yang berkembang di masyarakat saat
ini adalah dengan cara alami karena efek samping nya lebih kecil dari pada
pengobatan yang tidak alami. Penelitian ilmiah yang berhasil mengungkapkan
khasiat, manfaat terapi penyakit, mendorong munculnya paradigma baru dalam dunia
kedokteran modern, yaitu back to nature (Mangan, 2003).
Tumbuhan yang digunakan pada penelitian ini adalah bunga dari tumbuhan pacar
air (Impatiens balsamina Linn), tumbuhan pacar air ini merupakan tanaman hias yang
mudah di dapat, warna bunga tumbuhan ini ada beberapa macam yaitu merah, ungu
merah jingga, putih, dll. Bunga yang digunakan pada penelitian ini adalah yang
berwarna merah karena zat warna merah pada bunga pacar air ini adalah pigmen
pigmen bunga merah marak, merah, merah senduduk, dan biru merupakan antosianin
(Harborne, 1987) Kandungan kimia tumbuhan pacar air adalah saponin dan
Antosianin banyak digunakan sebagai pewarna alami pada makanan, kosmetik,
berpotensi sebagai antioksidan, dan anti radang.
Berdasarkan uraian diatas maka peneliti melakukan karakterisasi simplisia dari
bunga pacar air (Impatiens balsaminae Flos) bewarna merah yang belum ada didalam
buku Materia Medika Indonesia, sehingga dapat digunakan sebagai acuan, dengan
melakukan skrining fitokimia dapat diketahui yang terdapat dalam bunga pacar air .
Ekstraksi terhadap simplisia bunga pacar air ini dilakukan secara maserasi, ekstrak
kental yang diperoleh dikromatografi kertas secara kualitatif dan diisolasi dengan
kromatografi kertas preparatif. Isolat yang diperoleh di identifikasi secara
spektrofotometri ultraviolet dengan menggunakan pereaksi geser, dengan demikian
diketahui antosianin yang terdapat didalam bunga tumbuhan pacar air (Impatiens
1.2.Perumusan masalah
Berdasarkan uraian diatas perumusan masalahnya adalah:
a. tanaman pacar air (Impatiens balsamina Linn) merupakan tanaman hias yang
belum ada informasi karakteristiknya dalam buku Materia Medika Indonesia
(MMI).
b. apakah golongan senyawa kimia yang terdapat didalam bunga tanaman pacar air
(Impatiens balsamina Linn.) yang berwarna merah?
c. apakah senyawa hasil isolasi dapat diidentifikasi secara spektrofotometri
ultraviolet menggunakan pereaksi geser (shift reagent).
1.3 Hipotesis penelitian
Hipotesis dari penelitian ini adalah:
a. diduga dengan melakukan karakterisasi simplisia dapat diketahui ciri-ciri bunga
tanaman bunga pacar air (Impatiens balsamina Linn.) berwarna merah.
b. diduga dengan melakukan skrining fitokimia dapat diketahui golongan senyawa
kimia yang terdapat didalam bunga pacar air (Impatiens balsamina Linn.)
berwarna merah
c. diduga senyawa hasil isolasi dapat diidentifikasi secara spektrofotometri ultraviolet
menggunakan pereaksi geser (shift reagent).
1.4 Tujuan penelitian
Tujuan penelitian ini adalah :
a. untuk melakukan karakterisasi serbuk simplisia bunga pacar air (Impatiens
b. untuk mengetahui golongan senyawa kimia yang terdapat didalam bunga
tanaman pacar air (Impatiens balsamina Linn.) bewarna merah.
c. untuk mengidentifikasi senyawa antosianin yang terdapat dalam bunga pacar air
(Impatiens balsamina Linn) yang berwarna merah, dengan cara spektrofotometri
ultraviolet menggunakan pereaksi geser (shift reagent).
1.5 Manfaat penelitian ini adalah : Manfaat penelitian ini adalah:
a. memperoleh informasi tentang karakterisasi dari serbuk simplisia bunga pacar
air (Impatiens balsaminae Flos) berwarna merah.
b. sebagai sumber informasi mengenai kandungan golongan senyawa bunga pacar
air (Impatiens balsamina Linn.) berwarna merah.
c. diperoleh senyawa antosianin dari hasil identifikasi dengan cara spektrofotometri
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
2.1.1 Sistematika Tumbuhan
Sistematika dari tumbuhan bunga pacar air merah (anonim, 2005) adalah
sebagai berikut :
Kingdom : Plantae
Divisi : Magnoliophyta
Klass : Magnoliopsida
Ordo : Ericales
Famili : Balsaminaceae
Genus : Impatiens
Spesies : Impatiens balsamina Linn
2.1.2 Sinonim
Sinonim : Impatiens cornuta Linn, Impatiens hortensis Desf, Impatiens
mutila D.C., Balsamina mutila DC
2.1.3. Nama Daerah
Nama daerah dari bunga pacar air merah : lahine (Nias), pacar banyu
(Jawa), pacar cai (Sunda), paru inai (Sumbar), pacar toya (Belitung) (Hariana, Arief,
2.1.4 Morfologi
Pacar air berasal dari india. Di Indonesia ditanam sebagai tanaman hias,
kadang-kadang ditemukan tumbuh liar. Terna berbatang basah dan tegak ini
mempunyai tinggi 30-80 cm dan bercabang. Daun tunggal, bertangkai pendek.
Helaian daun bentuk lanset memanjang, ujung dan pangkal runcing, tepi bergerigi,
pertulangan menyirip, dan warnanya hijau muda. Bunga keluar dari ketiak daun tanpa
daun penumpu, Bunga bewarna cerah, ada beberapa macam warna. Seperti merah,
merah jingga, ungu, putih, dll. Ada yang “engkel” dan ada yang “dobel”. Buahnya
buah kendaga, bila masak akan membuka menjadi 5 bagian yang terpilin.
2.1.5 Kandungan Kimia dan Efek Farmakologis
Kandungan kimia: Bunga: antosianin yaitu: cyanidin, delphinidin,
pelargonidin, dan malvidin, kaempherol, quercetin; Akar: cyanidin mono glycoside.
Efek farmakologis pacar air diantaranya melancarkan peredaran darah dan
melunakkan masa/benjolan yang keras. Efek farmakologis akar pacar air diantaranya
peluruh haid (emenagog), anti inflamasi (anti radang), rematik, kaku leher, kaku
pinggang, sakit pinggang (lumago), dan lain-lain. Efek farmakologis bunga pacar air
di antaranya peluruh haid, tekanan darah tinggi (hipertensi), pembengkakkan akibat
terpukul (hematoma), bisul (furunculus), rematik sendi, gigitan ular tidak berbisa, dan
radang kulit (dermatitis). Efek farmakologi daun pacar air di antaranya mengobati
keputihan (leucorrhoea), nyeri haid (dysmenorrrhoea), radang usus buntu kronis
(cronic appendicitis), anti radang, tulang patah atau retak (fraktur), radang kulit, dan
(emegog), terlambat haid (amenorrhoeae), mempermudah persalinan (paturifasien),
dan mengobati kanker saluran pencernaan (Hariana, Arief, 2007).
2.2 Uraian Kimia 2.2.1 Flavonoida
Senyawa Favonoida adalah senyawa polifenol yang mempunyai 15 atom
karbon, terdiri dari dua cincin benzena tersubstitusi yang dihubungkan oleh satu
rantai alifatik yang mengandung tiga atom karbon. Kerangka dasar dari struktur
flavonoida adalah sistem C6-C3-C6 (Manitto, 1981;Robinson, 1995;
Sastrohamidjojo, 1996).
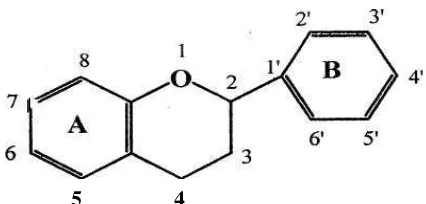
Gambar 1. Kerangka dasar struktur flavonoida
Penggolongan flavonoida dapat dibedakan berdasarkan cincin
heterosiklik-oksigen tambahan dan gugus hidroksil yang tersebar menurut pola
yang berlainan. Cincin A umumnya memiliki karakteristik pola hidroksilasi
floroglusinol atau resorcinol sementara cincin B biasanya katekol atau fenol.
Gugus-gugus hidroksil tersebut merupakan tempat berikatannya berbagai gula yang
meningkatkan kelarutan flavonoida dalam air. Sistem penomoran pada struktur
5 4
Gambar 2. Sistem penomoran pada struktur dasar flavonoida
Cincin A dan oksigen cincin tengah berdasarkan alur biosintesisnya terbentuk
melalui jalur poliketida. Sedangkan cincin B dan tiga atom karbon cincin tengah
menunjukkan flavonoida yang berasal dari jalur sikimat (Manitto, 1981 dan
Salisbury, 1992).
Aglikon flavonoida pada umumnya terdapat dalam berbagai bentuk
struktur molekul dengan beberapa bentuk kombinasi glikosida, sehingga dalam
menganalisis flavonoida lebih baik memeriksa aglikon yang telah dihidrolisis
dibanding dengan bentuk glikosida, karena stukturnya yang rumit dan kompleks.
Modifikasi flavonoida dapat terjadi dengan berbagai tahap dan menghasilkan
penambahan (pengurangan) hidroksilasi, metilasi gugus hidroksil atau inti
flavonoida, metilenasi gugus orto-dihidroksil, dimerisasi (pembentukan
biflavonoida), dan yang terpenting glikosilasi gugus hidroksil (pembentukan
flavonoida O-glikosida) atau inti flavonoida (pembentukan flavonoida
C-glikosida) (Harborne, 1987 dan Markam, 1988).
Menurut Robinson (1995), senyawa golongan flavonoida dapat
diklasifi-kasikan sebagai berikut:
Flavon dan flavonol merupakan senyawa yang paling tersebar luas dari
semua pigmen tumbuhan berwama kuning. Dari segi struktumya, flavon berbeda
dengan flavonol, dimana pada flavonol terdapat gugus keton dan alkohol yakni
gugus keton pada posisi 4 dan hidroksi pada posisi 3 sehingga berpengaruh
terhadap serapan ultraviolet, gerakan kromatogram dan reaksi warnanya.
Sedangkan flavon hanya memiliki gugus keton yakni pada posisi 4 dan umumnya
terdapat sebagai glikosida pada posisi 7-glikosida. Gula yang terikat biasanya
glukosa, galaktosa, dan ramnosa. Aglikon flavonol yang umum dijumpai yaitu
kaemferol dan kuersetin yang berkhasiat sebagai antioksidan pada penyakit
kanker dan antiinflamasi (Harborne, 1987 ; Hemani dan Rahardjo, 2005 ; Miller,
2005 ; Robinson, 1995 dan Sastrohamidjojo, 1996).
Gambar 3. Struktur flavon dan flavonol
2. Isoflavon
Isoflavon merupakan golongan flavonoida yang jumlahnya sangat sedikit, dan
sukar dicirikan karena reaksinya tidak khas dengan pereaksi warna manapun, tetapi
flavon flavonol
beberapa isoflavon berwarna biru muda bila dilihat dibawah sinar ultraviolet
setelah diberi uap amonia (Harborne, 1987).
Menurut Hernani dan Rahardjo (2005), senyawa isoflavon mempunyai
aktivitas sebagai antioksidan yang dapat mengurangi resiko penyakit kanker,
jantung koroner, dan osteoporosis. Senyawa ini mempunyai aktifitas biologis
sebagai penangkap radikal bebas penyebab kanker. Aktifitas biologis senyawa
isoflavon telah diteliti dan menunjukkan bahwa aktifitas isoflavon berkaitan
dengan struktur dan gugus-gugus yang berikatan pada struktur molekulnya.
Adanya gugus OH ganda, gugus OH pada atom C3 ataupun C5 yang berdekatan
dengan gugus C=O pada struktumya berhubungan terhadap aktifitas biologisnya
(Pawiroharsono, 2004)
Gambar 4. Struktur isoflavon
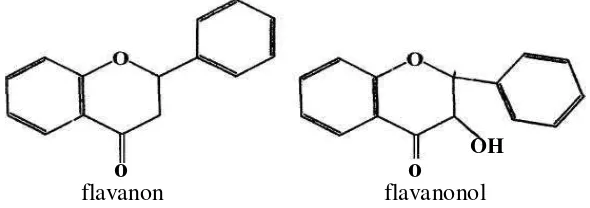
3. Flavanon dan Flavanonol
Kedua senyawa ini terdapat sedikit sekali di alam bila dibandingkan
dengan golongan flavonoida yang lain. Pada struktur flavanon dan flavanonol tidak
dijumpai adanya ikatan rangkap pada posisi 2 dan 3. Perbedaannya terletak pada
adanya gugusan alkohol di posisi 3 pada flavanonol (3-hidroksi flavanon). Glikosida
flavanon (dihidroflavon) yang umum seperti hesperidin dan naringin yang terdapat
pada buah jeruk berkhasiat sebagai antioksidan. Polihidroksi flavanon dapat
dideteksi dengan pereduksi magnesium dalam asam klorida yang memberikan warna
merah atau lembayung. Flavanonol merupakan flavonoida yang kurang dikenal dan
tidak diketahui apakah senyawa ini terdapat sebagai glikosida. Beberapa
senyawanya yang diasetilasi dikenal karena rasanya yang sangat manis (Bruneton,
1995 ; Hernani dan Rahardjo, 2005 ; Robinson, 1995).
flavanon flavanonol
Gambar 5. Struktur flavanon dan flavanonol
4. Antosianin
Antosianin adalah pigmen berwaraa merah, ungu, dan biru yang terdapat
pada seluruh tumbuhan kecuali fungus. Sebagian besar antosianin dalam bentuk
glikosida, biasanya mengikat satu atau dua unit gula seperti glukosa, galaktosa,
ramnosa, dan silosa. Jika monoglikosida, maka bagian gula hanya terikat pada
posisi 3, dan pada posisi 3 dan 5 bila merupakan diglikosida dan bagian
aglikionnya disebut antosianidin. Sebagian besar antosianin berwarna kemerahan
dalam larutan asam, tetapi menjadi ungu dan biru dengan meningkatnya PH yang
akhirnya rusak dalam larutan alkali kuat (Sastrohamidjojo, 1996; Salisbury,
1992).
o
Gambar 6. Struktur antosianin
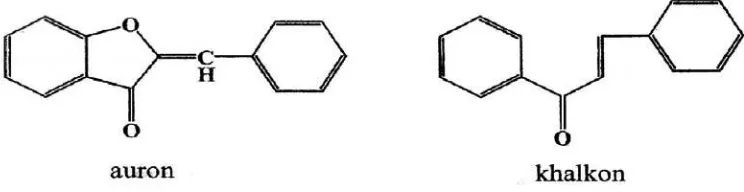
5. Auron dan Khalkon
Auron berupa pigmen kuning yang terdapat pada bunga tertentu dan
Bryofita. Dikenal hanya lima aglikon, tetapi pola hidroksilasinya serupa dengan
pola pada flavonoida lain begitu pula bentuk yang dijumpai adalah bentuk
glikosida dan eter metil. Dalam larutan basa senyawa ini berwarna merah rosa.
Auron ditandai dengan adanya struktur 2-benzilidenekumaranon. Khalkon tidak
mempunyai inti pusat heterosiklik tetapi ditandai oleh adanya 3 rantai karbon
dengan gugus keton dan a,p tidak jenuh (Bruneton, 1995; Robinson, 1995).
Gambar 7. Struktur auron dan khalkon
2.2.2 Glikosida
Glikosida adalah senyawa organik yang bila dihidrolisis akan
menghasilkan satu atau lebih gula yang disebut glikon dan bagian bukan gula
glukosa (Lewis, 1977). Glikosida dihidrolisis dengan cara pendidihan dalam asam
encer dan secara kimia maupun fisiologi, glikosida alam cenderung dibedakan
berdasarkan bagian aglikonnya (Robinson, 1995).
Berdasarkan hubungan ikatan antara glikon dan aglikonnya, glikosida
dapat dibagi menjadi empat (Farnsworth, 1966), yaitu :
1 . O-glikosida, jika ikatan antara glikon dan aglikon dihubungkan oleh atom
O, contohnya: salisin
Salisin
2. S-glikosida, jika ikatan antara glikon dengan aglikon dihubungkan oleh atom
S. contohnya: sinigrin.
3. N-glikosida, jika ikatan antara glikon dengan aglikon dihubungkan oleh atom
4. C-glikosida, jika ikatan antara glikon dengan aglikon dihubungkan oleh atom
C, contohnya: barbaloin.
Bentuk O-glikosida sangat mudah terurai oleh pengaruh asam, basa,
enzim, air, dan panas. Semakin pekat kadar asam atau basa maupun semakin
panas lingkungannya maka glikosida akan semakin mudah dan cepat terhidrolisis.
Gula yang sering berikatan pada glikosida adalah P-D-glukosa. Tetapi ada juga
mengandung gula lain misalnya galaktosa, ramnosa, digitoksosa, dan simarosa.
Glikosida berbentuk kristal atau amorf yang umumnya larut dalam air atau etanol
encer (kecuali pada glikosida resir). Oleh karena itu, umumnya sediaan farmasi
yang mengandung glikosida diberikan dalam bentuk eliksir, ekstrak, tingtur
dengan kadar etanol yang rendah. Secara umum, kegunaan glikosida dalam dunia
pengobatan diantaranya sebagai obat jantung, pencahar, pengiritasi lokal, dan
2.3 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Senyawa
aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam golongan
minyak atsiri, alkaloida, flavonoida, dan lain-lain. Dengan diketahuinya senyawa
aktif ysng dikandung simplisia akan mempermudah pemilihan pelarut dan cara
ekstraksi yang tepat (Ditjen POM, 2000).
Pembagian metode ekstraksi menurut Ditjen POM (2000) yaitu :
A. Cara dingin
1. Maserasi
Maserasi adalah proses penyarian simplisia menggunakan pelarut dengan
perendaman dan beberapa kali pengocokan atau pengadukan pada temperatur
ruangan (kamar). Cairan penyari akan menembus dinding sel dan masuk ke dalam
rongga sel yang mengandung zat aktif yang akan larut, karena adanya perbedaan
kosentrasi larutan zat aktif didalam sel dan diluar sel maka larutan terpekat didesak
keluar. Proses ini berulang sehingga terjadi keseimbangan konsentrasi antara larutan
didalam dan diluar sel.
Maserasi adalah proses penyarian simplisia yang mengandung zat aktif yang
mudah larut dalam cairan penyari. Cairan penyari yang digunakan dapat berupa air,
etanol, metanol, etanol-air atau pelarut lainnya. Remaserasi berarti dilakukan
penambahan pelarut setelah dilakukan penyaringan maserat pertama, dan seterusnya.
Keuntungan cara penyarian dengan maserasi adalah cara pengerjaan dan
2. Perkolasi
Perkolasi adalah cara penyarian yang dilakukan dengan mengalirkan cairan
penyari melalui serbuk simplisia yang telah dibasahi. Proses perkolasi terdiri dari
tahapan pengembang bahan, tahap maserasi antara, tahap perkolasi sebenarnya
(penetesan/penampungan ekstrak), terus menerus sampai diperoleh ekstrak (perkolat).
B. Cara panas
1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur tititk didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya
pendingin balik.
2. Sokletasi
Sokletasi adalah ekstraksi dengan menggunakan pelarut yang pada umumnya
dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dan dan jumlah
pelarut relatif konstan dengan adanya pendingin balik.
3. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur
yang lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada
temperatur 40-500 C.
4. Dekok
2.4 Kromatografi
kromatografi adalah metode pemisahan berdasarkan proses migrasi dari
komponen-komponen senyawa di antara dua fase, yaitu fase diam dan fase gerak.
Fase gerak membawa zat terlarut melalui media sehingga terpisah dari zat terlarut
lainnya yang terelusi lebik awal atau lebih akhir. Umumnya zat terlarut dibawa
melewati media pemisah oleh aliran suatu pelarut berbentuk cairan atau gas yang
disebut eluen. Fase diam dapat bertindak sebagai penjerap, seperti alumina dan silika
gel, atau dapat bertindak melarutkan zat terlarut sehingga terjadi partisi antara fase
diam dan fase gerak. Dalam proses ini suatu lapisan cairan pada penyangga yang inert
berfungsi sebagai fase diam (Ditjen POM, 1995)
2.4.1 Kromatografi Lapis Tipis
Kromatografi Lapis Tipis (KLT) adalah kromatografi adsorbsi dimana
adsorben bertindak sebagai fase diam. Empat macam adsorben yang umum dipakai
ialah silika gel, alumina, kieselguhr, dan selulosa. Zat-zat penyerap ini dibuburkan
dengan air lalu dibuat lapisan tipis yang merata pada lempeng kaca. Plat yang telah
kering dipanaskan/diaktifkan dengan memanaskannya pada suhu kira-kira 1000 C selama 30 menit. Campuran senyawa yang akan dipisahkan terlebih dahulu dilarutkan
dalam pelarut yang mudah menguap lalu ditotolkan pada plat menggunakan pipet
mikro. Kemudian dimasukkan kedalam bejana tertutup rapat berisi larutan
Kromatografi lapis tipis termasuk kromatografi adsorpsi (serapan), dimana
sebagai fase diam digunakan zat padat yang disebut adsorben (penyerap) dan fase
gerak adalah zat cair yang disebut dengan larutan pengembang.
Kromatografi lapis tipis dapat dipakai untuk dua tujuan, yaitu :
1. Sebagai metode untuk mencapai hasil kualitatif, kuantitatif, dan preparatif.
2. Mencari sistem pelarut yang akan dipakai dalam kromatografi kolom
Pemilihan sistem pelrut (fase gerak) pada pengembangan didasarkan atas
prinsip like disolves like berati untuk memisahkan campuran yang bersifat non polar
digunakan sistem pelarut yang non polar dan sebaliknya. Fase gerak yang dipakai
umumnya berupa campuran beberapa pelarut. Proses pengembangan akan lebih baik
bila bejana pengembang telah jenuh dengan uap fase gerak (Adnan, 1997; Gritter,
dkk., 1991).
Jarak pengembangan senyawa pada kromatogram biasanya dinyatakan dengan
harga Rf = jarak perambatan bercak dari titik penotolan
Jarak perambatan pelarut dari titik penotolan
Jarak yang ditempuh oleh tiap bercak dari titik penotolan diukur dari pusat
bercak dengan harga Rf berada antara 0,00-1,00. harga Rf ini sangat berguna untuk
mengidentifikasi suatu senyawa (Eaton, 1989).
Faktor-faktor yang mempengaruhi harga Rf adalah sebagai berikut
(Sastrohamidjojo, 1991) :
1. Struktur kimia senyawa yang dipisahkan
4. Pelarut dan derajat kemurniannya
5. Derajat kejenuhan uap pengembang dalam bejana
6. Teknik percobaan
7. Jumlah cuplikan yang digunakan
8. Suhu
2.4.2 Kromatografi kertas
Kromatografi kertas merupakan partisi dimana fase geraknya adalah air yang
disokong oleh molekul-molekul selulosa dari kertas. Kertas yang digunakan adalah
kertas Whatman No. 1 dan kertas yang lebih tebal Whatman No. 3 biasanya untuk
pemisahan campuran dalam jumlah yang lebih besar karena dapat menampung lebih
banyak cuplikan (Sastrohamidjojo, 1991).
Fase gerak yang digunakan biasanya campuran dari satu komponen organik
yang utama, air dan berbagai tambahan seperti asam-asam, basa atau
pereaksi-pereaksi kompleks dengan tujuan untuk memperbesar kelarutan dari beberapa
senyawa atau untuk mengurangi kelarutan yang lainnya (Sastrohamidjojo, 1991).
Menurut Sastrohamidjojo (1991), kromatografi kertas dapat dikembangkan
dengan cara:
1. Menurun (desendens)
Dilakukan dengan membiarkan fase gerak merambat turun pada kertas
kromatografi. Kertas digantungkan dalam bejana menggunakan batang kaca dan
batang kaca lain menahan ujung atas kertas yang tercelup dalam fase gerak. Setelah
2. Menaik (asendens)
Kertas digantung pada penggantung berbentuk kail yang dipasang pada
penutup bejana kromatografi. Pelarut diletakkan pada bagian bawah dari bejana lalu
ujung bawah kertas dicelupkan ke dalam fase gerak sehingga fase gerak merambat
naik pada kertas.
3. Mendatar
Kertas yang digunakan berbentuk bulat dan ditengahnya diberi lubang tempat
untuk meletakkan sumbu yang terbuat dari gulungan kertas atau benang. Fase gerak
akan naik membasahi kertasdan merambat melingkar memisahkan senyawa yang
ditotolkan.
Kromatografi kertas merupakan metode yang sering digunakan dalam hal
analisis senyawa polar (falvonoida). Untuk tujuan isolasi, hanya memerlukan
sejumlah bahan yang sedikit. Komponen senyawa flavonoida umumnya mudah
dipelajari dengan metode kromatografi karena sifatnya yang menghasilkan warna dan
hubungan sifat kelarutannya. Adapun kelebihan kromatografi kertas yaitu senyawa
flavonoida dapat menghasilkan warna alami dari berbagai komponen senyawa bila
dilihat dibawah sinar ultraviolet yang mudah diamati pada kertas. Kedua tekniknya
mudah dipelajari, memberikan hasil yang cepat dan memerlukan peralatan yang tidak
mahal. Selain itu, metode kromatografi kertas merupakan cara terbaik untuk
mengidentifikasi campuran senyawa flavonoida dengan jumlah yang sedikit
2.5 Spektrofotometri Ultraviolet
Spektrofotometri ultraviolet adalah suatu metode spektrofotometri serapan
dengan cara mengukur radiasi elektromagnetik suatu larutan pada panjang gelombang
tertentu. Spektrum ultraviolet digambarkan sebagai hubungan antara panjang
gelombang (frekuensi serapan) dengan intensitas serapan (transmitansi atau
absorbansi) (Depkes, 1979 dan Sastrohamidjojo, 1985).
Apabila suatu molekul menyerap radiasi ultraviolet, maka didalam molekul
tersebut terjadi perpindahan dan transisi tingkat energi elektron-elektron ikatan di
orbital molekul paling luar daari tingkat energi yang lebih rendah (orbital ikatan π *).
Dalam praktek, spektrofotomeri ultraviolet digunakan terbatas pada sistem-sistem
terkonjugasi. Keuntungan dari serapan ultraviolet adalah selektivitasnya dimana
gugus-gugus yang khas dapat dikenal dalam molekul-molekul yang sangat kompleks
(Noerdin, 1985; Sastrohamidjojo, 1985 dan silverstein, dkk., 1986).
Spektrum ultraviolet dari suatu senyawa biasanya diperoleh dengan
melewatkan cahaya dengan panjang gelombang tertentu (cahaya monokromatis)
melalui larutan encer senyawa tersebut.
Sistem (gugus atom) yang menyebabkan terjadinya absorbsi cahaya disebut
kromofor. Kromofor yang menyebabkan terjadinya transisi σ → σ* ialah senyawa
yang mempunyai elektron pada orbital molekul σ, yaitu molekul organik jenuh yang
tidak mempunyai atom dengan pasangan elektron sunyi. Senyawa yang mempunyai
Kromofor yang menyebabkan terjadinya transisi π → π* ialah senyawa yang
mempunyai transisi π → π* mengabsorbsi cahaya pada panjang gelombang sekitar
200 nm.
Kromofor yang menyebabkan n → π* ialah senyawa yang mempunyai orbital
molekul n, yaitu senyawa yang mengandung atom yang mempunyai pasangan
elektron sunyi. Senyawa yang mempunyai transisi n → π* mengabsorbsi cahaya pada
panjang gelombang 200-400 nm (Creswell, et al., 1982; Geissman, 1977).
Istilah-istilah dalam spektrofotometri ultraviolet menurut Noerdin (1985) dan
silverstein, dkk (1986) yaitu :
1. Khromofor adalah gugus fungsi berupa ikatan tak jenuh yang menyerap radiasi
didaerah ultraviolet dan daerah tampak. Contoh : C=C, C≡C, dan C=O.
2. Auksokrom adalah gugus fungsi dengan ikatan jenuh dan mengandung elektron
tidak berpasangan yang tidak menyerap radiasi pada panjang gelombang yang
lebih besar dari 200 nm tetapi apabila terikat pada gugus khromofor maka akan
merubah panjang gelombang dan intensitas serapan dari khromofor. Contoh :
-OH, -NH2, -Cl.
3. Pergeseran batokromik (pergeseran merah) adalah pergeseran serapan ke arah
pnjang gelombang yang lebih panjang akibat adanya substitusi gugus khromofor
atau pengaruh pelarut.
4. Pergeseran hipsokromik (pergeseran biru) adalah pergeseran ke arah panjang
gelombang yang lebih pendek akibat adanya substitusi gugus khromofor atau
5. efek hiperkromik adalah kenaikan dalam intensitas serapan.
6. Efek hipokromik adalah penurunan dalam intensitas serapan.
Spektroskopi serapan adalah cara yang berguna untuk menganalisis struktur
flavonoida. Cara tersebut digunakan untuk mambantu mengidentifikasi jenis
flavonoida dan menentukan pola oksigenasi. Disamping itu kedudukan gugus
hidroksil fenol bebas pada inti flavonoida dapat ditentukan dengan penambahan
pereaksi geser kedalam larutan cuplikan dan mengamati pergeseran puncak serapan
yang terjadi (Markham, 1988).
Spektrum falvonoida biasanya ditentukan dalam pelarut metanol. Spektrum
khas terdiri atas dua maksimal pada rentang 240-285 nm (pita II) 300-350 (pita I)
(Markham, 1988)
2.5.1 Spektrum Natrium Metoksida
Natrium metoksida adalah merupakan basa kuat yang dapat mengionisasi
hampir semua gugus hidroksil yang terdapat pada inti flavonoida. Spektrum ini
biasanya merupakan petunjuk sidik jari pola hidroksilasi. Degradasi atau
pengurangan kekuatan spektrum setelah waktu tertentu merupakan petunjuk baik
akan adanya gugus yang peka terhadap basa. Pereaksi pengganti natrium metoksida
adalah larutan natrium hidroksida 2M dalam air (Markham, 1988)
2.5.2 Spektrum Natrium Asetat
Natrium asetat adalah basa yang lebih lemah dan hanya menyebabkan
asetat digunakan terutama untuk mendeteksi adanya gugus 7 hidroksil (Markham,
1988).
2.5.3 Spektrum natrium asetat/ asam borat
Menjembatani kedua gugus kedua gugus hidroksil pada gugus orto-dihidroksi
dan digunakan untuk mendeteksinya (Markham, 1988).
2.5.4 Spektrum AlCl3/HCl
Karena membentuk kompleks antara gugus hidroksil dan keton yang
bertetangga dan membentuk kompleks tidak tahan asam dengan gugus
orto-dihidroksil, pereaksi ini dapat digunakan untuk mendeteksi kedua gugus tersebut. Jadi
spektrum AlCl3 merupakan penjumlahan pengaruh semua kompleks terhadap
spektrum, sedangkan spektrum AlCl3/HCl hanya merupakan pengaruh kompleks
hidroksiketo (Markham, 1988).
BAB III
METODE PENELITIAN
Metode penelitian ini adalah metode eksperimental yang meliputi identifikasi
tumbuhan, pengumpulan bahan tumbuhan, pengolahan sampel, karakterisasi
simplisia, pembuatan simplisia skrining fitokimia, pembuatan ekstrak secara
meserasi, isolasi secara kromatografi kertas ,uji kemurnian dan identifikasi senyawa
isolat secara spektrofotometri ultraviolet menggunakan pereaksi geser (shift reagent).
3.1 Alat-alat yang digunakan
Alat-alat yang digunakan pada penelitian ini adalah alat-alat gelas
laboratorium, blender (National), oven listrik (Stork), neraca kasar (Ohaus), neraca
analitik (Mettler tolede), penangas air (Yenaco), krus tang, eksikator, penguap vakum
putar (Buchi 461), mikroskop (Olympus), krus porselin, tanur (Gallenkamp),
seperangkat alat penetapan kadar air, bejana, pipa kapiler, lampu uv, hair dryer, dan
seperangkat alat spektrofotometer ultraviolet (Shimadzu UV-1240).
3.2 Bahan-bahan yang digunakan
Bunga pacar air merah (Impatiens balsamina Linn). Semua bahan-bahan
kimia yang digunakan kecuali dinyatakan lain adalah berkualitas pro analisis
(E.Merck) yaitu etanol (hasil destilasi), air suling, raksa (II) klorida, kalium iodida,
natrium hidroksida, iodium, bismut (III) nitrat, asam asetat glasial, besi (III) klorida,
asam klorida pekat, asam sulfat pekat, timbal (II) asetat, asam nitrat, asam asetat
kloralhidrat, toluen, kertas saring, kertas saring bebas abu Whatman no. 40, kertas
whatman no. 1 dan kertas Whatman no. 3.
3.3 Pembuatan Larutan Pereaksi 3.3.1 Pereaksi Mayer
Sebanyak 2,266 g raksa (II) klorida dilarutkan dalam air suling hingga 100 ml.
Pada wadah lain dilarutkan 50 g kalium iodida dilarutkan dalam 100 ml air suling.
Kemudian 60 ml larutan I dicampurkan dengan 10 ml larutan II dan ditambahkan
dengan air suling hingga 100 ml (MMI, 1989)
3.3.2 Pereaksi Natrium Hidroksida
Sebanyak 8,002 g natrium hidroksida dilarutkan dalam air suling hingga
diperoleh 100 ml larutan (Farmakope Indonesia, 1979)
3.3.3 Pereaksi Bouchardat
Kalium iodida 4 g dilarutkan dalam air suling, ditambahkan dengan iodium
sebanyak 2 g dan dicukupkan dengan air suling hingga 100 ml (MMI, 1989)
3.3.4 Pereaksi Dragendorff
Bismut (II) nitrat sebanyak 0,85 g dilarutkan dalam 10 ml asam asetat glasial.
Lalu di tambahkan dengan 40 ml air suling. Pada wadah yang lain 8 g kalium iodida
dilarutkan dalam 20 ml air suling, masing-masing larutan diambil 5 ml dan
ditambahkan 20 ml asam asetat kemudian dicukupkan dengan air suling hingga 100
3.3.5 Pereaksi Besi (III) Klorida 1% (b/v)
Besi (III) klorida sebanyak 1 g dilarutkan dalam air suling sehingga 100 ml (MMI,
1989).
3.3.6. Pereaksi Asam Klorida 2N
Asam korida pekat sebanyak 17 ml diencerkan dengan air suling hingga 100
ml (Farmakope Indonesia, 1979)
3.3.7 Pereaksi Timbal (II) Asetat 0,4 M
Timbal asetat sebanyak 15,17 g dilarutkan dalam air suling hingga 100 ml
(Materia Medika Indonesia, 1989)
3.3.8 Pereaksi Molish
Alfa naftol sebanyak 3 g dilarutkan dalam asam nitrat 0,5 N secukupnya
hingga diperoleh larutan 100 ml (MMI1989)
3.3.9 Pereaksi Aluminium Klorida 5% (b/v)
Timbang 5 g aluminium klorida, lalu dilarutkan dalam etanol sampai volume
100 ml (Harborne, 1989).
3.3.10 Pereaksi Kloralhidrat
Kloralhidrat dilarutkan dalam aquadest sampai larutan nya jenuh.
3.4 Pengambilan dan Pengolahan Sampel 3.4.1 Pengambilan sampel
Pengambilan sampel dilakukan secara purposif tanpa membandingkannya
dengan daerah lain. Sampel yang digunakan adalah bunga tumbuhan pacar air
depan halaman rumah masyarakat di Kelurahan Siulak deras, Kecamatan Gunung
Kerinci, Kabupaten Kerinci, Propinsi Jambi.
3.4.2 Identifikasi Sampel
Identifikasi tumbuhan dilakukan oleh Balai Penelitian dan Pengembangan
Botani, Puslitbang Biologi – LIPI, Bogor. Hasil identifikasi tumbuhan yang diteliti
adalah Impatiens balsamina Linn, suku Balsaminaceae. Hasil identifikasi dapat
dilihat pada lampiran 1 halaman 24.
3.4.3 Pengolahan Sampel
Bunga pacar air merah yang telah dikumpulkan dibersihkan dari pengotoran
dengan menggunakan air bersih, ditiriskan, ditimbang berat basah nya yaitu 4 kg
hasil kemudian dikeringkan dalam lemari pengering, setelah kering ditimbang
beratnya yaitu 220 g hasil. Sampel dianggap kering bila diremas rapuh, simplisia
selanjutnya diserbuk dengan menggunakan blender.
3.5 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik,
pemeriksaan mikroskopik serbuk simplisia, penetapan kadar air, penetapan kadar sari
yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar
abu total, penetapan kadar abu yang tidak larut dalam asam (MMI, 1989, WHO,
1992).
3.5.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan untuk mengetahui ciri-ciri, bentuk, dan
secara organoleptis dengan cara mengamati bentuk, warna, dan bau. Hasil
pemeriksaan makroskopik dapat dilihat pada lampiran 2 gambar 2 halaman 25.
3.5.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia dengan cara
menaburkan serbuk simplisia diatas kaca objek yang telah ditetesi dengan kloralhidrat
dan ditutup dengan kaca penutup, kemudian dilihat dibawah mikroskop. Dapat dilihat
pada lampiran 3 halaman 26.
3.5.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen).
Cara Kerja:
a. Penjenuhan Toluen
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan kedalam labu alas
bulat, didestilasi selama 2 jam, kemudian toluen didinginkan selama 30 menit dan
volume air pada tabung penerima dibaca dengan ketelitian 0,05.
b. Penetapan kadar air
Sebanyak 5 g serbuk simplisia yang telah ditimbang seksama, dimasukkan
kedalam labu alas, labu dipanaskan hati-hati selama 15 menit. Setelah toluen
mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik sampai sebagian besar air
terdestilasi dinaikkan sampai 4 tetes tiap detik. Setelah semua air terdestilasi, bagian
dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit,
kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan
volume air dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang
diperiksa. Kadar air dihitung dalam persen (WHO, 1992).
3.5.4 Pemeriksaan Kadar sari yang larut dalam air
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24
jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air sampai 1 liter) dalam
labu tersumbat sambil dikocok selama 6 jam pertama, dibiarkan selama 18 jam.
Disaring, sejumlah 20 ml filtrat diuapkan sampai kering, dalam cawan dangkal
berdasarkan rata dan telah ditara dan sisa dipanaskan pada suhu 1050 C sampai bobot tetap. Kadar sari larut dalam air dihitung terhadap bahan yang telah dikeringkan
diudara (MMI, 1989).
3.5.5 Penetapan Kadar Sari yang larut dalam etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24
jam dalam 100 ml etanol 96% dalam labu tersumbat sambil dikocok sesekali selama
6 jam pertama, kemudian dibiarkan selama 18 jam, kemudian disaring cepat untuk
menghindari penguapan etanol, 20 ml filtrat diuapkan sampai kering dalam cawan
dangkal berdasar rata yang telah ditara dan dipanaskan pada suhu 1050 C sampai bobot tetap. Kadar sari dalam etanol dihitung terhadap bahan yang telah dikeringkan
di udara (MMI, 1989).
3.6.6 Penetapan Kadar Abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama dimasukkan
dalam krus porslen yang telah dipijar dan ditara, kemudian diratakan dan dipijarkan
diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di
udara (WHO, 1992).
3.5.7 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu total dididihkan dalam 25 ml
asam klorida 2N selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan,
disaring melalui kertas saring bebas abu kemudian dicuci dengan air panas dalam
krus porslen. Residu dan kertas saring dipijarkan pada suhu 6000 C sampai bobot tetap. Kemudian didinginkan dan ditimbang. Kadar abu tidak larut dalam asam
dihitung terhadap bahan yang dikeringkan di udara (WHO, 1992).
Hasil karakterisasi simplisia dapat dilihat pada lampiran 4 tabel 1 halaman 27
dan perhitungan karakterisasi dapat dilihat pada lampiran 4 lanjutan.
3.6 Penapisan Fitokimia Serbuk Simplisia
Penapisan fitokimia serbuk simplisia meliputi pemeriksaan senyawa golongan
alkaloida, flavonoida, saponin, tanin, glikosida, glikosida antrakuinon, dan
steroid/triterpenoid.
3.6.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam
klorida 2 N dan 9 ml air suling, dipanaskan diatas air selama 2 menit, didinginkan
dan disaring. Filtrat dipakai untuk percobaan berikut:
a. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Mayer, akan
b. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Bouchardat,
akan terbantuk endapan bewarna coklat sampai hitam.
c. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Dragendroff,
akan terbentuk endapan jingga atau coklat jingga.
Alkaloida positif jika terjadi endapan atau kekeruhan paling sedikit dua dari
percobaan diatas (MMI, 1989).
3.6.2 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia ditambahkan dengan 100 ml air panas, di
didihkan selama 5 menit dan disaring dalam keadaan panas, diambil 5 ml filtrat
dimasukkan dalam tabung reaksi, kedalam 5 ml filtrat ditambahkan 0,1 g serbuk
magnesium dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan
dibiarkan memisah. Flavonoid positif jika terjadi warna merah, kuning, atau jingga
pada lapisan amil alkohol (Farnsworth, 1996).
3.6.3 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukkan ke dalam tabung reaksi,
ditambahkan 10 ml air panas, didinginkan kemudian dikocok selama 10 detik, jika
terbantuk busa setinggi 1 sampai 10 cm yang stabil tidak kurang dari 10 menit dan
tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan adanya
saponin (MMI, 1989).
3.6.4 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu disaring,
ml dan ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida 1%, jika terjadi warna
biru atau hijau menunjukkan adanya tanin (MMI, 1989).
3.6.5 Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia disari dengan 30 ml campuran etanol 95%
dengan air suling (7 : 3) dan 10 ml asam sulfat 2 N , di refluk selama 1 jam,
didinginkan dan disaring, pada 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml
timbal (II) asetat 0,4 M, dikocok, diamkan 5 menit lalu disari, filtrat disaring dengan
20 ml campuran isopropanol dan kloroform (2 : 3), dilakukan berulang sebanyak 3
kali. Kumpulkan sari air, uapkan pada temperatur tidak lebih dari 50 C sisanya
dilarutkan dalam 2 ml metanol. Larutan sisa dimasukkan dalam tabung reaksi
selanjutnya diuapkan diatas penangas air, pada sisa ditambahkan 2 ml air dan 5 tetes
larutan pereaksi Molish. Tambahkan hati-hati 2 ml asam sulfat melalui dinding
tabung terbentuk cincin ungu pada batas kedua cairan, menunjukkan adanya glikosida
(MMI, 1989).
3.6.6 Pemeriksaan glikosida antrakinon
Sebanyak 0,2 g serbuk simplisia ditambah 5 ml asam sulfat 2 N, dipanaskan
sebentar, setelah dingin ditambahkan 10 ml benzena, dikocok dan didiamkan.
Lapisan benzen dipisahkan dan disaring. Kocok lapisan benzen dengan 2 ml NaOH 2
N, didiamkan, lapisan NaOH bewarna merah dan lapisan benzen tidak bewarna
menunjukkan adanya antrakinon (MMI, 1989).
3.6.7 Pemeriksaan steroida/ triterpenoida
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml eter selama 2 jam
tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat (pereaksi
Lieberman-Bouchard). Apabila terbantuk warna ungu atau merah yang berubah menjadi biru
hijau menunjukkan adanya steroida/triterpenoida (Harborne, 1987).
Hasil skrining fitokimia dapat dilihat pada lampiran 4 tabel 2 halaman 27.
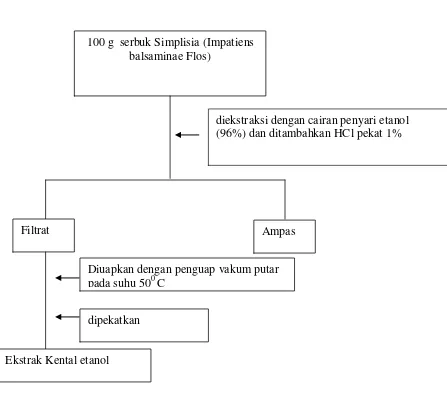
3.7 Pembuatan ekstrak
Pembuatan ekstrak dilakukan secara maserasi dengan menggunakan pelarut
etanol yang mengandung HCl pekat (1% dari jumlah penyari/pelarut). Posedur
pembuatan ekstrak sebagai berikut : Sebanyak 100 mg simplisia direndam di dalam
wadah kaca dengan pelarut yang mengandung HCl pekat (1%. dari jumlah
penyari/pelarut), (2000 ml penyari ditambahkan dengan 20 ml HCl pekat). Rendam
selama 24 jam sambil sekali-kali diaduk, setelah 24 jam maserat disaring, kemudian
di maserasi lagi dengan penambahan pelarut yang mengandung HCl pekat (1% dari
jumlah penyari/pelarut), Ekstraksi telah sempurna ditandai dengan bila hasil saringan
maserat tidak bewarna lagi. Ekstrak yang diperoleh dikumpulkan dan dipekatkan.
Dapat dilihat pada lampiran 6 gambar 6 halaman 34.
3.8 Analisis senyawa antosianin dari ekstrak etanol dengan cara Kromatografi Kertas (KKt)
Terhadap ekstrak etanol dilakukan KKt dengan pengembang BAA yaitu
n-butanol – asam asetat – air (40:10:50) yang diambil lapisan atas yaitu n-n-butanol,
Forestal yaitu asam asetat- air- HCl (30:10:3), dan asam asetat 30% yaitu asam asetat-
kertas digunakan fase gerak asam asetat 30% (asam asetat – air) dengan perbandingan
3:7, fase diam kertas Whatman No. 3 yang berukuran 3 X 27 cm.
Estrak etanol ditotolkan 2 cm dari tepi bawah pada kertas Whatman No. 1
kemudian kertas tersebut dimasukkan kedalam bejana berisi fase gerak yang telah
dijenuhkan. Lalu dikembangkan dengan jarak rambat 23 cm. Kertas diangkat dan
dikeringkan. Hasil disemprot dengan pereaksi AlCl3 dalam etanol dilihat dibawah
sinar ultraviolet. Hasil dapat dilihat pada lampiran 8 gambar 8 halaman 36
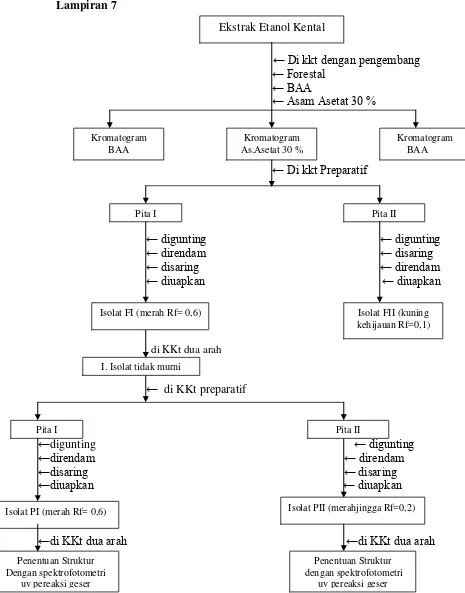
3.9 Pemisahan senyawa antosianin dari ekstrak etanol dengan cara Kromatografi Kertas preparatif
Estrak etanol yang telah diencerkan dilakukan pemisahan secara kromatografi
kertas preparatif (KKt preparatif) dengan fase gerak asam asetat 30% dan fase diam
kertas Whatman No. 3 yang berukuran 15 X 25 cm.
Prosedur Kerja:
Ekstrak etanol yang telah dilarutkan ditotolkan pada kertas Whatman no 3,
kemudian dimasukkan kedalam bejana yang telah jenuh dengan uap fase gerak. Lalu
dikembangkan dengan jarak rambat 23 cm. Kertas diangkat dan dikeringkan. Bagian
tepi kanan di gunting sebagian dan di semprot dengan pereaksi AlCl3 5% dalam
etanol dan dilihat dibawah sinar ultraviolet (UV), bercak yang sesuai diberi tanda dan
diperoleh dua pita yang disebut pita I (FI) dan pita II (FII). Kedua pita digunting
terpisah berupa potongan-potongan kecil direndam dalam metanol selama 24 jam dan
sekali-sekali dikocok, lalu disaring, selanjutnya filtrat dipekatkan hingga diperoleh
3.10 Uji kemurnian dari hasil kromatografi kertas preparatif
Untuk mengetahui kemurnian isolat FI dilakukan kromatografi kertas dua
arah dengan menggunakan pengembang pertama asam asetat 30% dan sebagai
pengembang kedua adalah BAA.
Isolat kental ditotolkan pada kertas Whatman No. 3 berukuran 15 X 15cm,
dimasukkan kedalam bejana berisi pengembang pertama yang telah dijenuhkan.
Kemudian dielusi dengan jarak rambat 12,5 cm. Kertas diangkat dan dikeringkan.
Kertas dielusi kembali dengan menggunakan pengembang kedua dengan arah yang
berbeda jarak rambat 12,5 cm setelah itu kertas diangkat dan dikeringkan, kemudian
diamati dan disemprot dengan pereaksi AlCl3 5% dalam etanol dan dilihat dibawah
lampu ultraviolet. Hasil isolat FI tidak murni karena masih terdapat dua noda,
sehingga dilakukan lagi KKt preparatif dari isolat F1.
3.11 Pemisahan senyawa antosianin dari isolat FI secara Kromatografi Kertas preparatif.
KKt preparatif dari isolat FI cara kerjanya sama dengan KKt preparatif
ekstrak etanol, diperoleh dua isolat yaitu isolat PI warna merah (Rf = 0,6) dan isolat
PII warna merah jingga (Rf = 0,2). Hasil KKt preparatif isolat FI dapat dilihat pada
lampiran 12 gambar 12 halaman 40.
3.12. Uji kemurnian isolat PI dari hasil kromatografi kertas preparatif
Uji kemurnian isolat pada PI dan isolat PII cara kerjanya juga sama dengan uji
kemurnian isolat FI, hasil kromatogram pada KKt dua arah memberikan satu noda
jumlahnya lebih sedikit. Hasil kemurnian isolat PI dapat dilihat pada lampiran 15
gambar 15 halaman 43 dan hasil kemurnian isolat PII dapat dilihat pada lampiran 16
gambar 16 halaman 44.
3.13. Karakterisasi Hasil Isolasi
Karakterisasi senyawa hasil isolasi dilakukan dengan spektrofotometri
ultraviolet
3.13.1 Karakteriasasi Isolat PI dengan Spektrofotometri Ultraviolet dengan Penambahan Pereaksi
1. Isolat PI dilarutkan dalam metanol, dimasukkan kedalam kuvet dan kemudian
diukur absorbansinya pada panjang gelombang 560 – 210 nm. Setelah di ukur
spektrumnya dalam metanol, ditambahkan 3 tetes larutan NaOH 2 M ke dalam
kuvet dan direkam spektrumnya, kemudian direkam kembali setelah 5 menit.
2. Larutan isolat PI ditambahkan enam tetes pereaksi AlCl3 dikocok dan diukur
spektrumnya, selanjutnya ditambahkan 3 tetes HCl dan diukur spektrumnya.
3. Larutan isolat PI ditambahkan serbuk natrium asetat hingga kira-kira 2 mm
BAB IV
HASIL DAN PEMBAHASAN
Hasil identifikasi yang telah dilakukan oleh Pusat Penelitian dan
Pengembangan Biologi Bogor terhadap tumbuhan yang diteliti adalah bunga pacar
air (Impatiens balsamina Linn.) yang bewarna merah, suku Balsaminaceae.
Hasil pemeriksaan makroskopik simplisia bunga pacar air bewarna merah
diperoleh bentuk mengkerut dan bergulung , warna merah keunguan, dan berbau
khas.
Pada pemeriksaan mikroskopik terlihat adanya papila, kristal kalsium oksalat
rapida, rambut penutup multiseluler, serbuk sari berbentuk oval.
Hasil pemeriksaan karakterisasi serbuk simplisia yaitu kadar air simplisia
9,31%, Kadar sari yang larut dalam air 19,62%, kadar sari yang larut dalam etanol
12,80%, Kadar abu total yaitu 1,14%, sedangkan kadar abu yang tidak larut dalam
asam 0,25%.
Hasil skrining fitokimia dari simplisia bunga pacar air (Impatiens balsaminae
Flos.) berwarna merah menunjukkan adanya flavonoida, dan glikosida.
Ekstraksi dilakukan secara maserasi dengan menggunakan pelarut etanol dan
dengan penambahan HCl pekat ( 1% dari pelarut/ penyari), ekstrak kental etanol yang
diperoleh dianalisis secara kromatografi kertas dengan fase gerak yaitu BAA,
Forestal, dan asam asetat 30%, fase diam yaitu kertas whatman no 1 dengan
penampak noda sinar uv 366 nm dan AlCl3 5% diperoleh pemisahan yang baik
dengan sinar uv 366 nm (Rf = 0,22). Menurut Marhkam (1988) senyawa flavonoida
yang memberikan warna merah adalah golongan antosianin.
Terhadap ekstrak kental etanol dilakukan KKt preparatif sebagai fase gerak asam
asetat 30% dan fase diam kertas Whatman no.3, pita-pita dipisahkan berdasarkan
fluoresensinya dibawah lampu uv 366 nm, hasilnya diperoleh 2 pita yaitu F1
berfluoresensi merah (Rf = 0,6); dan F2 berfluoresensi kuning kehijauan (Rf = 0,1)
kemudian terhadap FI dan F2 digunting terpisah berupa potongan kecil, direndam
dalam metanol selama 24 jam, lalu disaring, filtrat dipekatkan hingga diperoleh isolat
kental atau isolat kristal.
Selanjutnya dilakukan uji kemurnian terhadap isolat pita I (FI) secara KKt dua
arah menggunakan pengembang I asam asetat 30% yaitu asam asetat-air (10:30) dan
pengembang II BAA yaitu butanol – asam asetat – air (40:10:50) dengan fase diam
kertas Whatman No. 3 dan penampak bercak AlCl3 5% dalam etanol yang dilihat
dibawah lampu ultraviolet, hasil kromatogram memberikan dua noda, jadi hasilnya
tidak murni.
Terhadap isolat FI dilakukan KKt preparatif sekali lagi dari isolat F1 diperoleh
dua pita yaitu PI bewarna merah, dan PII bewarna merah jingga, selanjutnya
terhadap PI, dan PII digunting terpisah berupa potongan kecil, direndam dalam
metanol selama 24 jam, lalu disaring filtrat dipekatkan hingga diperoleh isolat kental.
Pada pita PI dilakukan KKt kemudian dilihat dibawah sinar ultraviolet dan
penampak bercak AlCl 5% dalam etanol ternyata diperoleh noda tunggal harga Rf
terhadap PII, pada PII diperoleh Rf yang sama (0,2) dan warna noda juga sama
(merah jingga).
Kemudian dilakukan lagi uji kemurnian terhadap isolat PI, dan PII dari hasil
KKt preparatif isolat FI, caranya sama dengan uji kemurnian hasil KKt preparatif
isolat FI. Pemurnian juga dilakukan secara KKt dua arah menggunakan pengembang
I asam asetat 30% asam asetat – air (1:3) dan pengembang II BAA yaitu butanol –
asam asetat – air (4:1:5) dengan fase diam kertas Whatman No. 3 dan penampak
bercak AlCl3 5% dalam etanol dilihat dibawah lampu ultraviolet, hasil kromatogram
memberikan satu noda untuk isolat PI dan isolat PII, analisis secara spektrofotometri
ultraviolet hanya dilakukan terhadap isolat PI, sedangkan terhadap isolat PII tidak
dilanjutkan karena jumlahnya lebih sedikit.
Penafsiran spektrum ultraviolet dilakukan untuk isolat PI, dengan merujuk
pada Markham (1988).
Penafsiran spektrum ultraviolet untuk isolat PI :
1. Hasil spektrum 1 dalam metanol memberikan pita absorpsi maksimum pada pita I
yaitu 506 nm, sedangkan untuk pita II 266 nm. Absorpsi maksimum pada pita I
ini sesuai untuk senyawa antosianin yang panjang gelombang absorpsi
maksimum pada pita I adalah 465-560 nm, dengan demikian diduga senyawa
tersebut adalah senyawa antosianin.
2. Pada spektrum 1 dalam metanol dengan penambahan NaOH dibandingkan
dengan spektrum yang telah diukur setelah 5 menit semuanya terurai, kecuali
3. Pada spektrum isolat dengan penambahan AlCl3/HCl terjadi pergeseran
batokromik bila dibandingkan spektrum metanol. Pergeseran batokromik ini
terjadi pada pita I sebesar 2 nm. Pergesaran batokromik 25-35 nm menunjukkan
gugus o-diOH (dihidroksil). Dengan demikian dijumpai gugus
orto-dihidroksil pada golongan antosianin ini.
4. Hasil spektrum 1 dalam metanol dengan panambahan natrium asetat (NaOAc)
menunjukkan adanya pergeseran batokromik pada pita II sebesar 1 nm jika
dibandingkan dengan spektrum dalam metanol, Jika terjadi pergeseran sebesar
5-20 nm pada pita II, maka terdapat gugus 7-OH pada cincin A, maka pada
senyawa antosianin ini tidak dijumpai adanya gugus 7-OH.
5. Dari hasil penafsiran dapat disimpulkan bahwa isolate yang diperoleh merupakan