KARAKTERISASI SIMPLISIA DAN ISOLASI SENYAWA
TRITERPENOIDA/STEROIDA DARI HERBA SURUHAN
(Peperomiae pellucidae herba)
SKRIPSI
Oleh: PUJI LESTARI NIM 071524051
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI SIMPLISIA DAN ISOLASI SENYAWA
TRITERPENOIDA/STEROIDA DARI HERBA SURUHAN
(Peperomiae pellucidae herba)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
Oleh: PUJI LESTARI NIM 071524051
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KATA PENGANTAR
Puji dan syukur kepada Allah SWT karena kasih sayang dan hidayah-Nya
sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini.
Ucapan terima kasih dan penghargaan yang tulus kepada Ayahanda
Hartono dan Ibunda Rusmiati yang tercinta, adinda Citra Septantris dan adinda
Indah Tusikowaty serta kepada semua keluarga atas perhatian, nasehat dan
dorongan semangat serta dukungan doa yang tiada ternilai harganya.
Dengan segala ketulusan hati penulis juga menyampaikan terima kasih
kepada Ibu Dra. Saleha Salbi, M.Si., Apt., dan Dra. Suwarti Aris, M.Si., Apt.,
yang telah membimbing penulis dengan penuh kesabaran dan tanggung jawab
selama melakukan penelitian hingga selesainya penulisan skripsi ini.
Pada kesempatan ini penulis juga mengucapkan terima kasih kepada:
1. Bapak Dekan Fakultas Farmasi Prof. Dr. Sumadio Hadisahputra, Apt., yang
telah memberikan fasilitas kepada penulis sehingga dapat menyelesaikan
skripsi ini.
2. Bapak Prof. Dr. Jansen Silalahi, Apt., sebagai Dosen wali yang telah banyak
membimbing penulis selama masa perkuliahan.
3. Ibu dan Bapak staf penguji yang telah memberikan petunjuk dan
bimbingannya kepada penulis sehingga penulis dapat menyelesaikan skripsi
ini.
4. Bapak Drs. Panal Sitorus, M.Si., Apt., selaku Kepala Laboratorium
Farmakognosi beserta seluruh staf yang telah mengizinkan penulis
menggunakan fasilitas laboratorium selama penelitian.
5. Bapak/Ibu dosen Fakultas Farmasi USU yang telah memberikan didikan dan
bimbingan selama penulis menuntut ilmu di Fakultas Farmasi USU
6. Kepada teman-teman dan sahabatku serta rekan Farmasi yang tidak dapat
disebutkan satu persatu yang selalu menjadi teman berbagi suka duka,
membantu dan memberi dorongan semangat kepada penulis untuk
Penulis menyadari bahwa tulisan ini masih banyak kekurangan, oleh karena itu
sangat diharapkan kritik dan saran yang bersifat membangun dari pembaca.
Medan, Februari 2010
Penulis,
Puji Lestari
KARAKTERISASI SIMPLISIA DAN ISOLASI SENYAWA TRITERPENOIDA/STEROIDA DARI
HERBA SURUHAN (Peperomiae pellucidae herba)
ABSTRAK
Suruhan (Peperomia pellucida H.B.&K.) adalah tumbuhan gulma yang
banyak dijumpai di tempat lembab, agak terlindung dan memiliki banyak khasiat.
Penelitian ini bertujuan untuk mengetahui karakteristik simplisia dan mengisolasi
senyawa triterpenoida/steroida dari herba suruhan. Metode penelitian meliputi
pengumpulan dan pengolahan sampel, pemeriksaan karateristik simplisia,
pembuatan ekstrak, kromatografi cair vakum (KCV), kromatografi lapis tipis
(KLT) preparatif, uji kemurnian isolat dan identifikasi isolat secara
spektrofotometri ultraviolet (UV) dan spektrofotometri inframerah (IR).
Dilakukan karakterisasi simplisia yang meliputi pemeriksaan makroskopik,
pemeriksaan mikroskopik, kadar sari yang larut dalam air (18,80), kadar sari yang
larut dalam etanol (12,83), kadar abu total (3,85%), kadar abu yang tidak larut
dalam asam (1,17%), dan kadar air (6,66%). Hasil pengamatan makroskopik
terhadap simplisia herba, daun tunggal, berkeriput, rapuh, helai daun berbentuk
jantung, berwarna coklat kehijauan. Pemeriksaan mikroskopik serbuk simplisia
menunjukkan adanya rambut penutup, sel minyak, stomata tipe anomositik, hablur
kalsium oksalat berbentuk prisma dan drusse yang ujung kristalnya runcing dan
tumpul, serbuk sari dan trakea. Ekstraksi dilakukan secara maserasi dengan
menggunakan pelarut n-heksan, dilanjutkan dengan kromatografi lapis tipis
(KLT), kromatografi cair vakum (KCV), dan KLT preparatif.Isolat yang
diperoleh dianalisis secara spektrofotometri UV memberikan absorbansi
maksimum pada panjang gelombang (λ) 223,3 nm menunjukkan adanya gugus kromofor dan hasil spektrofotometri IR diketahui adanya gugus -OH, ikatan C-H
alifatis, gugus C=O, ikatan rangkap C=C, ikatan C-O, gugus CH2, dan gugus
CH3. Hasil analisis isolat menunjukkan bahwa isolat yang diperoleh adalah
senyawa golongan triterpenoida/steroida.
CHARACTERIZATION SIMPLESIA AND ISOLATION OF TRITERPENOID/STEROID COMPOUNDS FROM SURUHAN HERB
(Peperomiae pellucidae herb) ABSTRACT
Suruhan (Peperomia pellucida H.B.&K) is weed abundamtly found in
protected moist area and have many effects. One of chemistry compound is
steroid. This objective of research would be to know characteristics of simplesia
and isolating steroid compounds from suruhan herb. Characterization of simplesia
that cover macroscopic, microscopic, water-soluble extract content,
ethanol-soluble extract content, total ash content, acid-inethanol-soluble ash content and water
content. The macroscopic examination from simplesia herb, single leaf, dwindle,
fragile, leaf in form of tan heart green, brown green colour. The microscopic
examination on simplesia powder indicated that there was the covering hairs, oil
drip, stomata of anosocitic type, prism and druse shape that the end of crystal its
become sharp and blunt, and stone cells. The examination result of simplesia
characteristic indicated water-soluble extract content was 18,80%, ethanol-soluble
extract content was 12,83%, total ash content 3,85%, acid-insoluble ash content
1,17%, and water content 6,66%. Extraction was made through maceration by
using n-hexane solvent, followed by thin layer chromatography, vacuum liquid
chromatography, and KLT preparative. The isolat gained was characterized by
ultraviolet spectrophotometer indicated maximum absorbance in wafelength (λ) 223,3 nm to show the existence of chromophor cluster and the result of infrared
spectrophotometer indicated the existence of OH-cluster, C-H aliphatic bonding,
C=O cluster, double bonding C=C, C=O bonding, CH2 and CH3. The analysis
result of isolat indicating the compound of steroid type.
3.6.4 Pemeriksaan Tanin ... 30
3.6.5. Pemeriksaan Glikosida ... 30
3.6.6 Pemeriksan Antrakuinon ... 31
3.6.7 Pemeriksaan Triterpenoida/Steroida ... 31
3.7 Pembuatan Ekstrak ... 31
3.8 Analisis Ekstrak n-heksan secara KLT ... 32
3.9 Fraksinasi Ekstrak n-heksan secara KLT ... 32
3.10 Analisis KLT secara KCV ... 33
3.11 Isolasi senyawa triterpenoida/steroida hasil fraksinasi secara KLT preparatif ... 33
3.12 Uji kemurnian kristal hasil isolat ... 34
3.13 Identifikasi Isolat ... 35
3.13.1 Identifikasi Isolat secara Spektrofotometri UV ... 35
3.13.2 Identifikasi Isolat secara Spektrofotometri IR ... 35
BAB IV HASIL DAN PEMBAHASAN ... 36
4.1 Pemeriksan Karakteristik Simplisia ... 36
4.2 Isolasi Senyawa Triterpenoida/Steroida ... 36
BAB V KESIMPULAN DAN SARAN ... 40
5.1 Kesimpulan ... 40
5.2 Saran ... 40
DAFTAR PUSTAKA ... 41
DAFTAR LAMPIRAN
Lampiran Halaman
1. Hasil Identifikasi Tumbuhan ... 43
2. Gambar Tumbuhan Suruhan ... 44
3. Gambar Herba Suruhan ... 45
4. Gambar Simplisia Herba Suruhan ... 46
5. Mikroskopik Serbuk Herba Suruhan ... 47
6. Perhitungan Hasil Karakterisasi Pemeriksaan Simplisia ... 48
7. Hasil Karakterisasi Serbuk Herba Suruhan ... 53
8. Bagan Ekstraksi Serbuk Simplisia Herba Suruhan ... 54
9. Kromatogram Ekstrak n-heksan Herba Suruhan ... 55
10. Bagan Isolasi Triterpenoida/Steroida dari Ekstrak n-heksan Herba Suruhan ... 56
11. Kromatogram Hasil KCV Ekstrak n-heksan Herba Suruhan ... 57
12. Kromatogram Hasil KCV Fraksi F2 Ekstrak n-heksan Herba Suruhan .... 58
13. Kromtogram KLT Preparatif Fraksi A2 ... 59
14. Kromatogram KLT Dua Arah Isolat 2 ... 60
15. Spektrum Ultraviolet Isolat 2 ... 61
DAFTAR TABEL
Tabel Halaman
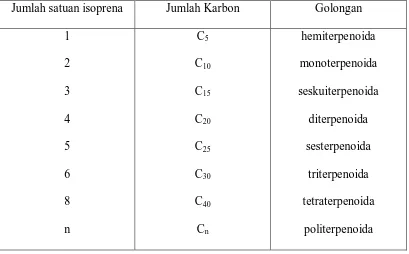
1. Golongan Utama Terpenoid Tumbuhan ... 6
2. Hasil Karakterisasi Serbuk Herba Suruhan ... 53
DAFTAR GAMBAR
Gambar Halaman
1. Struktur dari Beberapa Senyawa Triterpenoida ... 37
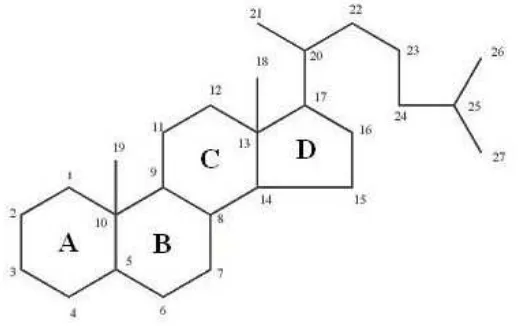
2. Struktur Dasar Steroida dan Sistem Penomorannya ... 37
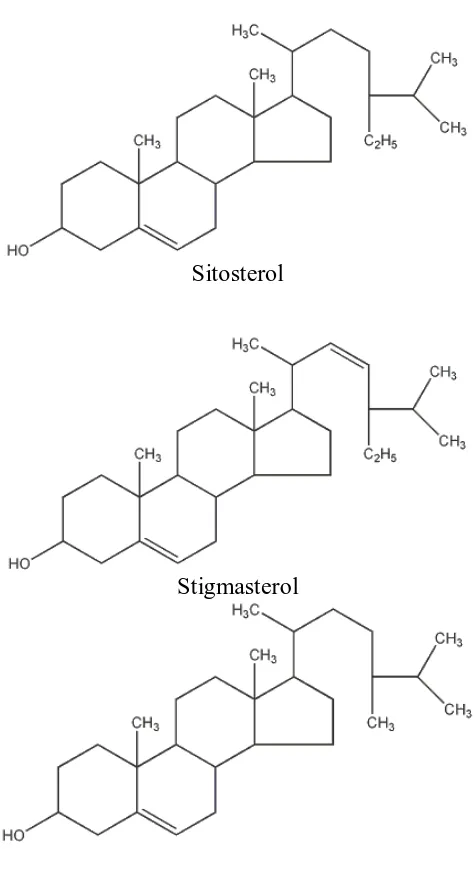
3. Struktur Beberapa Senyawa Fitosterol ... 37
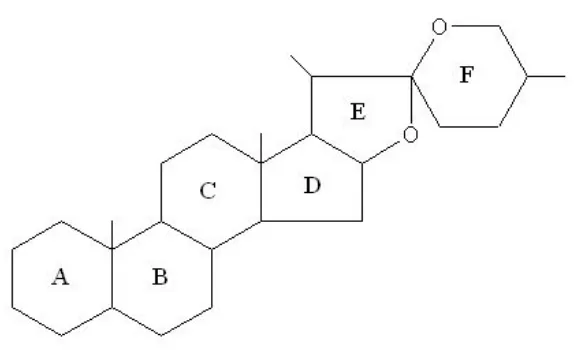
4. Struktur Dasar Spiroketal ... 37
5. Tipe Aglikon dari Glikosida Jantung ... 40
6. Tumbuhan Suruhan ... 37
7. Herba Suruhan ... 38
8. Simplisia Herba Suruhan... 39
9. Mikroskopik Serbuk Herba Suruhan ... 40
10. Bagan Ekstraksi Serbuk Simplisia Herba Suruhan ... 47
11. Kromatogram Ekstrak n-heksan Herba Suruhan ... 48
12. Bagan Isolasi Triterpenodia/Steroid dari Ekstrak n-heksan Herba Suruhan ... 49
13. Kromatogram Hasil KCV Ekstrak n-heksan Herba Suruhan ... 50
14. Kromatogram Hasil KCV Fraksi A2 Ekstrak n-heksan Herba Suruhan ... 51
15.Kromatogram KLT Preparatif Fraksi A2 ...52
16. Kromatogram KLT Dua Arah Isolat 2...53
17.Spektrum Ultraviolet Isolat 2...54
KARAKTERISASI SIMPLISIA DAN ISOLASI SENYAWA TRITERPENOIDA/STEROIDA DARI
HERBA SURUHAN (Peperomiae pellucidae herba)
ABSTRAK
Suruhan (Peperomia pellucida H.B.&K.) adalah tumbuhan gulma yang
banyak dijumpai di tempat lembab, agak terlindung dan memiliki banyak khasiat.
Penelitian ini bertujuan untuk mengetahui karakteristik simplisia dan mengisolasi
senyawa triterpenoida/steroida dari herba suruhan. Metode penelitian meliputi
pengumpulan dan pengolahan sampel, pemeriksaan karateristik simplisia,
pembuatan ekstrak, kromatografi cair vakum (KCV), kromatografi lapis tipis
(KLT) preparatif, uji kemurnian isolat dan identifikasi isolat secara
spektrofotometri ultraviolet (UV) dan spektrofotometri inframerah (IR).
Dilakukan karakterisasi simplisia yang meliputi pemeriksaan makroskopik,
pemeriksaan mikroskopik, kadar sari yang larut dalam air (18,80), kadar sari yang
larut dalam etanol (12,83), kadar abu total (3,85%), kadar abu yang tidak larut
dalam asam (1,17%), dan kadar air (6,66%). Hasil pengamatan makroskopik
terhadap simplisia herba, daun tunggal, berkeriput, rapuh, helai daun berbentuk
jantung, berwarna coklat kehijauan. Pemeriksaan mikroskopik serbuk simplisia
menunjukkan adanya rambut penutup, sel minyak, stomata tipe anomositik, hablur
kalsium oksalat berbentuk prisma dan drusse yang ujung kristalnya runcing dan
tumpul, serbuk sari dan trakea. Ekstraksi dilakukan secara maserasi dengan
menggunakan pelarut n-heksan, dilanjutkan dengan kromatografi lapis tipis
(KLT), kromatografi cair vakum (KCV), dan KLT preparatif.Isolat yang
diperoleh dianalisis secara spektrofotometri UV memberikan absorbansi
maksimum pada panjang gelombang (λ) 223,3 nm menunjukkan adanya gugus kromofor dan hasil spektrofotometri IR diketahui adanya gugus -OH, ikatan C-H
alifatis, gugus C=O, ikatan rangkap C=C, ikatan C-O, gugus CH2, dan gugus
CH3. Hasil analisis isolat menunjukkan bahwa isolat yang diperoleh adalah
senyawa golongan triterpenoida/steroida.
CHARACTERIZATION SIMPLESIA AND ISOLATION OF TRITERPENOID/STEROID COMPOUNDS FROM SURUHAN HERB
(Peperomiae pellucidae herb) ABSTRACT
Suruhan (Peperomia pellucida H.B.&K) is weed abundamtly found in
protected moist area and have many effects. One of chemistry compound is
steroid. This objective of research would be to know characteristics of simplesia
and isolating steroid compounds from suruhan herb. Characterization of simplesia
that cover macroscopic, microscopic, water-soluble extract content,
ethanol-soluble extract content, total ash content, acid-inethanol-soluble ash content and water
content. The macroscopic examination from simplesia herb, single leaf, dwindle,
fragile, leaf in form of tan heart green, brown green colour. The microscopic
examination on simplesia powder indicated that there was the covering hairs, oil
drip, stomata of anosocitic type, prism and druse shape that the end of crystal its
become sharp and blunt, and stone cells. The examination result of simplesia
characteristic indicated water-soluble extract content was 18,80%, ethanol-soluble
extract content was 12,83%, total ash content 3,85%, acid-insoluble ash content
1,17%, and water content 6,66%. Extraction was made through maceration by
using n-hexane solvent, followed by thin layer chromatography, vacuum liquid
chromatography, and KLT preparative. The isolat gained was characterized by
ultraviolet spectrophotometer indicated maximum absorbance in wafelength (λ) 223,3 nm to show the existence of chromophor cluster and the result of infrared
spectrophotometer indicated the existence of OH-cluster, C-H aliphatic bonding,
C=O cluster, double bonding C=C, C=O bonding, CH2 and CH3. The analysis
result of isolat indicating the compound of steroid type.
BAB I PENDAHULUAN 1.1Latar Belakang
Upaya pencarian tumbuhan berkhasiat obat telah lama dilakukan, baik
untuk mencari senyawa baru ataupun menambah keanekaragaman senyawa yang
telah ada. Hasil pencarian dan penelitian tersebut kemudian dilanjutkan dengan
upaya pengisolasian senyawa murni dan turunannya sebagai bahan dasar obat
modern atau pembuatan ekstrak untuk obat fitofarmaka.
Suruhan termasuk tumbuhan gulma yang dapat digunakan sebagai obat
tradisional. Suruhan merupakan tumbuhan liar yang sering di jumpai dan banyak
terdapat di tempat yang lembab, agak terlindung, sela batu, bawah pohon, tebing,
pekarangan dan ladang. Saat ini gulma banyak dilirik dan digunakan oleh para
ahli pengobatan untuk mengobati berbagai penyakit. (Djauhariya, 2004).
Menurut Hembing (2004), suruhan berkhasiat untuk mengatasi nyeri pada
rematik, penyakit asam urat, sakit kepala, sakit perut, abses, bisul, jerawat, radang
kulit, luka terpukul dan luka bakar ringan. Bagian yang digunakan adalah herba.
Menurut hasil penelitian Muhtadi dkk (2004), tentang aktivitas antidiabetes
ekstrak etanol dari herba suruhan (Peperomia pellucida H.B.&K), hasil penapisan
fitokimia dari ekstrak etanol menunjukkan adanya golongan senyawa steroida.
Golongan senyawa triterpenoida/steroida merupakan komponen aktif dari
tumbuhan yang telah digunakan untuk mengobati beberapa penyakit dan
digunakan dalam bidang farmasi untuk pembuatan obat-obat kontrasepsi,
Suruhan memiliki banyak khasiat sebagai obat, namun karakterisasinya
belum ada dan masih sedikit yang meneliti tentang kandungan kimianya.
Berdasarkan hal di atas maka peneliti tertarik untuk melakukan karakterisasi
terhadap simplisia, serta mengisolasi senyawa triterpenoida/steroida dari herba
suruhan dengan cara kromatografi cair vakum (KCV) dan kromatografi lapis tipis
(KLT) preparatif yang dilanjutkan dengan identifikasi senyawa hasil isolasi secara
spekrofotometri UV dan spektrofotometri IR.
1.2Perumusan Masalah
Berdasarkan uraian diatas maka permasalahan pada penelitian ini adalah:
a. apakah karakterisasi simplisia dari herba suruhan perlu dilakukan?
b. apakah senyawa triterpenoida/steroida dari herba suruhan dapat diisolasi
dari ekstrak n-heksan dan isolatnya dapat diidentifikasi secara
spektrofotometri UV dan spektrofotometri IR?
1.3Hipotesis
Berdasarkan perumusan masalah diatas maka hipotesis penelitian ini adalah:
a. karakterisasi simplisia herba suruhan belum ada pada literatur, maka
karakterisasi herba suruhan perlu dilakukan.
b. senyawa triterpenoida/steroida dari herba suruhan dapat diisolasi dari
ekstrak n-heksan dan isolatnya dapat diidentifikasi secara spektrofotometri
UV dan spektrofotometri IR.
1.4Tujuan Penelitian
Adapun tujuan penelitian ini adalah :
a. untuk memperoleh informasi mengenai karakterisasi simplisia dari herba
b. untuk mengetahui senyawa triterpenoida/steroida yang terdapat dalam
herba suruhan dan mengidentifikasi isolat secara spektrofotometri UV dan
spektrofotometri IR.
1.5Manfaat Penelitian
Manfaat penelitian ini adalah untuk menambah informasi tentang herba
BAB II
TINJAUAN PUSTAKA 2.1Uraian Tumbuhan
2.1.1 Sistematika Tumbuhan
Divisi : Spermatophyta
Sub Divisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Piperales
Suku : Piperaceae
Marga : Peperomia
Jenis : Peperomia pellucida H.B.&K
(Djumidi, 1997)
2.1.2 Nama daerah
Nama daerah tumbuhan ini adalah seladaan (Jawa), saladaan (Sunda),
ketumpang ayer (Sumatera), gotu garoko (Maluku) (Dhauhariya, 2004).
2.1.3 Morfologi tumbuhan
Habistus : Herba, tinggi 10-20 cm
Batang : Tegak, lunak hijau muda
Daun : Tunggal, duduk spiral, lonjong,panjang 1-4 cm, lebar 1,5-2 cm,
ujung rncing, pangkal bertoreh, tepi rata, pertulangan melengkung, permukaan
lici, lunak, hijau.
Bunga : Majemuk, bentuk bulir, diujung batang atau di ketiak daun,
panjang bulir 2-3 cm, tangkai lunak, putih kekuningan.
Biji : Bulat, kecil, hitam
Akar : Serabut, putih
(Djumidi, 1997)
2.2Uraian Kimia 2.2.1 Terpenoida
Senyawa terpenoida mencakup sejumlah besar senyawa tumbuhan dan
istilah terpenoida digunakan untuk menunjukkan bahwa secara biosintesis semua
senyawa tumbuhan ini berasal dari senyawa yang sama. Senyawa terpenoida
adalah senyawa yang berasal dari unit-unit isopren CH2=C(CH3)−CH2 dan
kerangka karbonnya dibangun oleh persambungan dua atau lebih satuan C5 ini
melalui kaidah persambungan “kepala dan ekor”. Terpenoida dapat mengandung
dua, tiga atau lebih satuan isopren. Molekul-molekulnya dapat berupa rantai
terbuka atau siklik, dan dapat mengandung gugus hidroksil, gugus karbonil atau
gugus fungsional lainnya.
Terpenoida terdiri atas beberapa macam senyawa berdasarkan jumlah
satuan isoprena yang terdapat dalam senyawa tersebut. Mulai dari komponen
minyak atsiri, yaitu monoterpena dan seskuiterpena (C10 dan C15), diterpena yang
lebih sukar menguap (C20), sampai ke senyawa yang tidak menguap yaitu
triterpenoida (C30), serta pigmen karotenoida (C40). Golongan senyawa
Tabel 1. Golongan terpenoida tumbuhan
Jumlah satuan isoprena Jumlah Karbon Golongan
1
Triterpenoida adalah senyawa yang kerangka karbonnya berasal dari enam
satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C-30 asiklik,
yaitu skualena, senyawa ini tidak berwarna, berbentuk kristal, bertitik leleh tinggi
dan bersifat optis aktif yang umumnya sukar dicirikan karena tak ada kereaktifan
kimianya. Uji yang banyak digunakan untuk uji atau identifikasi triterpenoida
ialah reaksi Lieberman-Burchard (anhidrida asetat – H2SO4 pekat) yang biasanya
menghasilkan warna hijau-biru (Harborne,1987).
Sebagian senyawa triterpenoida juga merupakan komponen aktif dalam
tumbuhan dan telah digunakan untuk penyakit termasuk diabetes, gangguan
menstruasi, gangguan kulit, kerusakan hati dan malaria. Beberapa senyawa
menunjukkan aktivitas antibakteri, antifungi dan ada juga senyawa yang dapat
Triterpenoida dapat dibagi menjadi empat golongan senyawa yaitu
triterpena, steroida, saponin dan glikosida jantung.
a. Triterpena
Triterpena terutama terdapat dalam lapisan malam daun dan dalam buah
yang berfungsi sebagai pelindung untuk menolak serangga dan serangan mikroba.
Pembagian triterpena berdasarkan jumlah cincin yang terdapat dalam struktur
molekulnya adalah:
1. Triterpena asiklik yaitu triterpenoida yang tidak mempunyai cincin
tertutup dalam struktur molekulnya, misalnya skualena.
2. Triterpena trisiklik yaitu triterpenoida yang mempunyai tiga cincin
tertutup dalam struktur molekulnya, misalnya ambrein.
3. Triterpena tetrasiklik yaitu triterpenoida yang mempunyai lima cincin
tertutup pada struktur molekulnya, misalnya lanosterol.
4. Triterpena pentasiklik yaitu triterpenoida yang mempunyai lima cincin
tertutup pada struktur molekulnya, misalnya α-amirin pada buah apel
(Harborne, 1987; Robinson, 1995).
Struktur dari senyawa triterpenoida tersebut dapat dilihat pada gambar 1 berikut
ini.
Lanosterol α-amirin
Gambar 1. Struktur dari beberapa senyawa triterpenoida b. Steroida
Steroida adalah triterpenoida yang kerangka dasarnya adalah cincin
siklopentana perhidrofenantren (Harbourne, 1987). Kerangka dasar dan sistem
penomoran steroida (Robinson, 1995) dapat dilihat pada gambar berikut ini.
Gambar 2. Struktur dasar steroida dan sistem penomorannya
Dahulu steroida dianggap sebagai senyawa satwa tetapi makin banyak senyawa
steroida yang ditemukan dalam jaringan tumbuhan (fitosterol). Tiga senyawa yang
biasa disebut fitosterol terdapat pada hampir setiap tumbuhan tinggi yaitu:
sitosterol, stigmasterol, dan kampesterol (Harbourne, 1987).
Sitosterol
Stigmasterol
Kampesterol
Gambar 3. Struktur beberapa senyawa fitosterol
c. Saponin
Saponin adalah senyawa aktif permukaan yang kuat, menimbulkan busa
jika dikocok dalam air dan pada konsentrasi yang rendah sering menyebabkan
hemolisis daram merah. Mula-mula disebut saponin karena sifatnya yang khas
saponin sangat beracun untuk ikan dan beberapa saponin bekerja sebagai anti
mikroba.
Dikenal dua jenis saponin yaitu glikosida triterpenoida alkohol dan
glikosida steroida yang mempunyai rantai samping spiroketal. Aglikonnya disebut
sapogenin, diperoleh dengan hidrolisis dalam suasana asam atau hidrolisis
memakai enzim (Robinson, 1995)
Inti steroida spiroketal mempunyai struktur berikut:
Gambar 4. Struktur dasar spiroketal d. Glikosida Jantung
Glikosida jantung merupakan senyawa yang mempunyai kemampuan
sebagai pemacu jantung (mempunyai efek menambah daya kontraksi otot
jantung). Struktur dari glikosida jantung ini menyerupai struktur saponin steroida
(Robinson, 1995).
Aglikon dari glikosida jantung merupakan golongan triterpena steroida
yang mempunyai inti siklopentano perhidrofenantrena dan cincin lakton yang
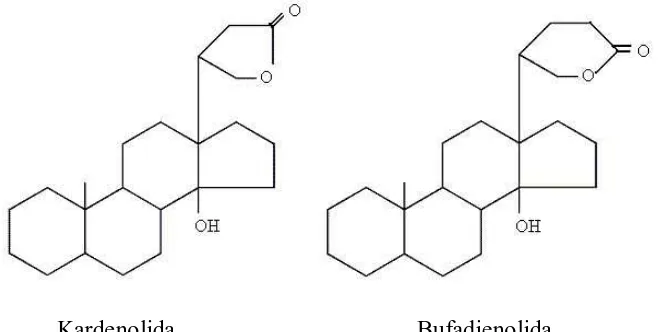
Aglikon yang mempunyai cincin lakton tersebut ada 2 macam yaitu:
1. Kardenolida, berupa steroida dengan atom karbon 23 yang mempunyai
rantai samping cincin lakton pentasiklik dengan sati ikatan rangkap dan
satu buah gugus hidroksil pada C-14 (butirolakton, γ-lakton).
2. Bufadienolida, merupakan steroida dengan atom karbon 24 dengan rantai
samping cincin lakton dan satu buah gugus hidroksil pada C-14
(valerolakton, δ-lakton) (Harborne, 1987; Robinson, 1995).
Tipe-tipe aglikon dari glikosida jantung dapat dilihat pada gambar 5
dibawah ini.
Kardenolida Bufadienolida
Gambar 5. Tipe aglikon dari glikosida jantung 2.3 Ekstraksi
2.3.1 Pengertian
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut. Pengetahuan tentang
golongan senyawa yang dikandung simplisia akan mempermudah proses
2.3.2 Metode-Metode Ekstraksi
Beberapa metode ekstraksi dengan menggunakan pelarut (Ditjen POM,
2000) yaitu:
1. Cara dingin
a. Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman
dalam pelarut sambil dilakukan beberapa kali pengocokan pada temperatur
ruangan (suhu kamar).
Remaserasi berarti proses maserasi yang dilanjutkan dengan pengulangan
penambahan pelarut setelah dilakukan penyaringan maserat pertama dan
seterusnya sampai maserat tersebut jernih.
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai terjadi
penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses
perkolasi terdiri dari tahap pengembangan bahan, tahap perendaman antara, dan
penampungan ekstrak. Untuk menentukan akhir dari pada perkolasi dapat
dilakukan pemeriksaan zat secara kualitatif pada perkolat akhir.
2. Cara panas
a. Refluks
Refluks adalah ekstraksi dengan menggunakan pelarut pada temperatur
titik didihnya selama waktu tertentu dan jumlah pelarut terbatas yang relatif
b. Sokletasi
Sokletasi adalah ekstraksi mengunakan pelarut yang selalu baru, dengan
menggunakan alat soxhlet sehingga terjadi ekstraksi kontinu dengan jumlah
pelarut relatif konstan dengan adanya pendingin balik.
c. Digesti
Digesti adalah maserasi dengan pengadukan yang kontinu pada temperatur
yang lebih tinggi dari temperatur ruangan yang umumnya pada temperatur
40-50°C.
d. Infus
Infus adalah ekstraksi dengan menggunakan pelarut air di mana bejana
infus tercelup dalam penangas air mendidih, pada temperatur 96-98°C selama
15-20 menit.
Dekok adalah infus pada waktu yang lebih dari 30 menit dan
temperaturnya mencapai titik didih air.
2.4Kromatografi
Kromatografi adalah suatu metode pemisahan berdasarkan perbedaan
perpindahan dari komponen-komponen senyawa diantara dua fase yaitu fase
diam, dapat berupa zat cair atau zat padat, dan fase gerak, dapat berupa gas atau
zat cair (Ditjen POM, 1995; Stahl, 1985). Jika fase tetap berupa zat padat maka
cara tersebut dikenal sebagai kromatografi serapan, jika zat cair dikenal sebagai
kromatografi partisi. Karena fase bergerak dapat berupa zat cair dan gas maka ada
empat macam sistem kromatografi (Sastrohamidjojo, 1985) :
1. Fase bergerak zat cair – fase tetap padat (kromatografi serapan):
- Kromatografi penukar ion
2. Fase bergerak gas – fase tetap padat (kromatografi serapan):
- Kromatografi gas padat
3. Fase bergerak zat cair – fase tetap zat cair (kromatografi partisi):
- Kromatografi cair kinerja tinggi
4. Fase bergerak gas – fase tetap zat cair (kromatografi partisi):
- Kromatografi gas cair
- Kromatografi kolom kapiler
Pemisahan dan pemurnian kandungan tumbuhan terutama dilakukan
dnegan mengunakan salah satu atau gabungan dari beberapa teknik tersebut dan
dapat digunakan pada skala mikro maupun makro (Harborne, 1987).
2.4.1 Kromatografi Lapis Tipis
Kromatografi lapis tipis merupakan metode pemisahan yang memerlukan
investasi yang kecil untuk perlengkapan, menggunakan waktu yang singkat serta
pemakaian pelarut dan cuplikan dalam jumlah sedikit. KLT termasuk
kromatografi serapan, dimana sebagai fase diam berupa zat padat yang disebut
adsorben (penyerap) dan fase gerak adalah zat cair yang disebut larutan
pengembang (Gritter dkk., 1991; Stahl, 1985).
Pendeteksian bercak hasil pemisahan dapat dilakukan dengan beberapa
cara, yaitu dengan pengamatan langsung atau dibawah sinar ultraviolet jika
senyawanya berwarna dan pengamatan dengan cahaya biasa atau cahaya
ultraviolet setelah disemprot dengan pereaksi yang membuat bercak tersebut
dengan sinar UV gelombang pendek (254 nm) atau gelombang panjang (366 nm)
(Ditjen POM, 1995; Gritter dkk., 1991).
a. Fase diam (Lapisan Penyerap)
Pada kromatografi lapis tipis, fase diam berupa lapisan tipis yang terdiri
atas bahan padat yang dilapiskan pada permukaan penyangga datar yang biasanya
terbuat dari kaca, tetapi dapat pula terbuat dari plat polimer atau logam. Lapisan
melekat pada permukaan dnegan bantuan bahan pengikat, biasanya kalsium sulfat
atau amilum (pati). Penyerap yang umum dipakai untuk kromatografi lapis tipis
adalah silika gel, alumina, kieselgur, dan selulosa (Gritter dkk, 1991).
Dua sifat yang penting dari fase diam adalah ukuran partikel dan
homogenitasnya, karena adhesi terhadap penyokong sangat tergantung pada kedua
sifat tersebut. Ukuran partikel yang biasa digunakan adalah 1-25 mikron. Partikel
yang butirannya sangat kasar tidak akan memberikan hasil yang memuaskan dan
salah satu cara untuk memperbaiki hasil pemisahan adalah dengan menggunakan
fase diam yang butirannya lebih halus. Butiran yang halus memberikan aliran
pelarut yang lebih lambat dan resolusi yang lebih baik (Sastrohamidjojo, 1985).
b. Fase gerak (Pelarut Pengembang)
Fase gerak ialah medium angkut dan terdiri atas satu atau beberapa
pelarut. Jika diperlukan sistem pelarut multi komponen, harus berupa suatu
campuran sesederhana mungkin yang terdiri atas maksimum tiga komponen
(Stahl, 1985).
Dalam pemisahan senyawa organik selalu menggunakan pelarut campur.
Tujuan menggunakan pelarut campur adalah untuk memperoleh pemisahan
masing-masing pelarut, sehingga dengan demikian akan diperoleh sistem pengembang
yang cocok. Pelarut pengembang yang digunakan dalam kromatografi lapis tipis
antara lain: n-heksana, karbontetraklorida, benzena, kloroform, eter, etil asetat,
piridian, aseton, etanol, metanol dan air (Gritter dkk., 1991; Sudjadi, 1988).
c. Harga Rf
Untuk menggambarkan jarak pengembangan senyawa pada kromatogram
dipakai istilah harga Rf (Stahl, 1985).
Jarak titik pusat bercak dari titik awal Rf =
Jarak garis depan pelarut dari titik awal
Harga Rf beragam mulai dari 0 sampai 1. Faktor-faktor yang mempengaruhi harga
Rf (Sastrohamidjojo, 1985):
a. Struktur kimia dari senyawa yang dipisahkan
b. Sifat penyerap
c. Tebal dan kerataan dari lapisan penyerap
d. Pelarut dan derajat kemurniannya
e. Derajat kejenuhan uap pengembang dalam bejana
f. Teknik percobaan
g. Jumlah cuplikan yang digunakan
h. Temperatur
i. Kesetimbangan
2.4.2 Kromatografi Cair Vakum
Cara ini pertama kali dipublikasikan oleh Coll dkk. Pada tahun 1977
mengisolasi diterpena sembrenoid dari terumbu karang Australia. Kolom
kromatografi dikemas kering dalam keadaan vakum agar diperoleh kerapatan
kemasan maksimum. Vakum dihentikan, pelarut yang kepolarannya rendah
dituangkan ke permukaan penjerap lalu divakumkan lagi. Kolom dihisap sampai
kering dan sekarang siap dipakai.
Sampel, dilarutkan dalam pelarut yang cocok, dimasukkan langsung pada
bagian atas kolom atau pada lapisan pra penyerap dan dihisap perlahan-lahan
kedalam kemasan dengan memvakumkannya. Kolom, dielusi dengan campuran
pelarut yang cocok, mulai dari pelarut yang kepolarannya rendah lalu
kepolarannya ditingkatkan perlahan-lahan, kolom dihisap sampai kering pada
setiap pengumpulan fraksi. Oleh karena itu kromatografi cair vakum
menggunakan tekanan rendah untuk meningkatkan laju aliran fase gerak
(Hostettmann, 1995).
2.4.3 Kromatografi Lapis Tipis Preparatif
Salah satu metode pemisahan yang memerlukan biaya paling murah dan
memakai peralatan sedarhana ialah KLT preparatif. Walaupun KLT preparatif
dapat memisahkan dalam jumlah gram, sebagian besar pemakaian hanya dalam
jumlah miligram. KLT preparatif dilakukan dengan menggunakan lapisan tebal
(sampai 1 mm) sebagai pengganti lapisan penyerap yang tipis (0,10-0,25 mm).
pita-pita sampel yang sudah dipisah dapat diperoleh kembali dengan cara
mengerok penyerap dari plat KLT preparatif yang telah dikembangkan. Demikian
kuatnya lapisan penyerap melekat pada kaca penyokong sehingga memungkinkan
pengembang yang berbeda, dengan terlebih dulu mngeringkan plat sebelum
pengembangan berikutnya (Harborne, 1987).
Fase diam yang paling sering dugunakan biasanya dengan ketebalan 0,5-2
mm dan ukuran plat kromatogram biasanya 20x20 cm. fase diam yang paling
umum dipakai ialah silika gel dan dipakai untuk pemisahan berbagai campuran
senyawa lipofil maupun senyawa hidrofil.
Sampel dilarutkan dalam sedikit pelarut sebelum ditotolkan pada plat KLT
preparatif. Pelarut yang baik ialah pelarut yang mudah menguap (atsiri), karena
jika pelarut kurang atsiri terjadi pelebaran pita. Konsentrasi sampel harus sekitar
5-10%. Sampel ditotolkan berupa pita yang harus ditotolkan sesempit mungkin
karena pemisahan tergantung pada lebar pita. Pemilihan pelarut ditentukan
berdasarkan pemeriksaan pendahuluan memakai KLT analitik. Karena ukuran
partikel penyerap kira-kira sama, pelarut yang dipakai pada KLT analitik dapat
dipakai pada KLT preparatif.
Pengembangan plat KLT preparatif biasanya dilakukan dalam bejana kaca
yang dapat menampung beberapa plat. Bejana dijaga tetap jenuh dengan pelarut
pengembang dengan bantuan sehelai kertas saring yang tecelup ke dalam larutan
pengembang. Keefisienan pemisahan dapat ditingkatkan dengan cara
pengembangan berulang. Harus diperhatikan bahwa semakin lama senyawa
berkontak dengan penyerap maka semakin besar kemungkinan penguraian
(Hostettmann, 1995).
2.5 Spektrofotometri
Spektroskopi adalah studi mengenai interaksi antara cahaya dengan atom
spektroskopi serapandan spektroskopi emisi. Pengelompokkan ini berdasarkan
atas apa yang diukur setelah terjadi interaksi antara radiasi elektromagnetik dan
sampel. Pembagian dapat juga berdasarkan daerah-daerah panjang gelombang
dalam spektrum elektromagnetik. Cara pengukuran yang berasarkan spektroskopi
umumnya dinamakan spektroskopi dan jika sumber energi berupa sinar/cahaya
dan sistem detektor menggunakan sel fotolistrik maka metode pengukuran ini
dinamakan spektrofotometri (Noerdin, 1985).
2.5.1 Spektrofotometri Ultraviolet
Spektrofotometri ultraviolet merupakan suatu teknik analisis berdasarkan
atas pengukuran serapan suatu larutan yang dilalui radiasi monokromatis
ultraviolet. Kegunaan spektrofotometri ini terletak pada kemampuannya
mengukur jumlah ikatan rangkap atau konyugas aromatis di dalam suatu molekul
(Sudjadi, 1983).
Spektrum serapan kandungan tumbuhan dapat diukur dalam larutan yang
sangat encer dengan pembanding blanko pelarut menggunakan spektrofotometer
yang merekam otomatis. Senyawa tan warna diukur pada daerah panjang
gelombang 200-400 nm, senyawa berwarna pada panjang gelombang 400-800
nm.
Pelarut yang banyak digunakan untuk spektrofotometri UV ialah etanol
95% karena kebanyakan golongan senyawa larut dalam pelarut tersebut. Alkohol
absolut komersial harus dihindari karena mengandung benzena yang dapat
menyerap di daerah sinar UV pendek. Pelarut yang sering digunakan ialah air,
dan piridin umumnya harus dihindari karena menyerap kuat di daerah 200-260 nm
(Harbourne, 1987).
2.5.2 Spektrofotometri Inframerah
Spektrum inframerah senyawa tumbuhan dapat diukur dengan
spektrofotometri inframerah yang merekam secara otomatis dalam bentuk larutan
(dalam kloroform, karbontetrakloroida 1-5%), atau bentuk padat yang dicampur
dengan kalium bromida. Daerah pengukuran adalah daerah bilangan gelombang
4000-667 cm-1 atau panjang gelombang 2,5-15 µ m, dan perekaman spektrum
memakan waktu kira-kira 3 menit (Noerdin, 1985).
Daerah pada spektrum inframarah di atas bilangan gelombang 1200 cm-1
menunjukkan pita spektrum atau puncak yang disebabkan oleh getaran ikatan
kimia atau gugus fungsi dalam molekul yang ditelaah. Daerah di bawah 1200 cm-1
menunjukkan pita yang disebabkan oleh getaran seluruh molekul, dan karena
kerumitannya dikenal sebagai daerah sidik jari. Intensitas berbagai pita direkam
secara subjektif pada skala sederhana: kuat (K; strong, s), menengah (M; Medium,
m) atau lemah (L; weak, w).
Kenyataan yang menunjukkan bahwa banyak gugus fungsi dapat
diidentifikasi dengan menggunakan frekuensi getaran khasnya mengakibatkan
spektrofotometri infra merah merupakan cara paling sederhana dan paling
terandalkan dalam menentukan golongan senyawa yang terkandung dalam sebuah
molekul (Harborne, 1987).
Penafsiran spektrum inframerah dari suatu senyawa yang belum diketahui
harus ditujukan pada penentuan ada atau tidaknya beberapa gugus fungsional
umum dilakukan untk memeriksa pita-pita yang penting pada spektrum
inframerah secara berurutan adalah (Pavia et al., 1988):
1. Gugus Karbonil
Gugus C=O memberikan puncak yang kuat pada daerah bilangan gelombag
1820-1660 cm-1.
2. Bila gugus C=O ada, periksalah gugus-gugus berikut (jika C-O tidak ada
langsung ke nomor 3).
Asam : periksalah gugus O-H, merupakan serapan melebar di daerah
3300-2200 cm-1.
Amida : periksalah gugus N-H, merupakan serapan medium di daerah
3500 cm-1, kadang-kadang dengan puncak rangkap.
Ester : periksalah gugus C-O, merupakan serapan medium di daerah
1300-1000 cm-1.
Anhidrida : mempunyai dua serapan C=O di daerah 1810 dan 1760 cm-1.
Aldehida : periksalah gugus C-H, merupakan dua serapan lemah di daerah
2850 dan 2750 cm-1 yaitu di sebelah kanan serapan C-H.
Keton : kemungkinan bila kelima gugus di atas tidak ada.
3. Bila gugus C=O tidak ada
Alkohol atau fenol : periksalah gugus O-H, merupakan senyawa melebar di
daerah 3600-3300 cm-1 yang diikuti adanya serapan
C-O di daerah 1300-1000 cm-1.
Amina : periksalah gugus N-H, yaitu serapan medium di daerah
Eter : Periksalah gugus C-O (tidak adanya O-H), yaitu
serapan medium di daerah 1300-1000 cm-1.
4. Ikatan rangkap dua dan cincin aromatik
- Serapan lemah sampai medium dan tajam C=C di daerah 1650 cm-1.
- Serapan medium sampai kuat dan tajam pada daerah 1650-1450 cm-1 sering
menunjukkan adanya cincin aromatis.
- Buktikan kemungkinan di atas dengan memperhatikan serapan pada daerah
C-H aromatis di sebelah kiri 3000 cm-1, sedangkan C-H alifatis terjadi di
sebelah kana daerah tersebut (2925 cm-1 dan 2850 cm-1).
5. Ikatan rangkap tiga
- Serapan medium dan tajam dari C≡N di daerah 2250 cm-1.
- Serapan lemah dan tajam dari C≡C di daerah 2150 cm-1-1.
6. Gugus nitro
Dua serapan yang kuat di daerah 1600-1500 cm-1 dan 1390-1300 cm-1.
7. Hidrokarbon
- Apabila keenam serapan di atas tidak ada.
- Serapan C-H alifatis di daerah sebelah kanan 3000 cm-1 (yaitu 2925 cm-1
dan 2850 cm-1).
- Serapan yang sangat sederhana di daerah 1450 cm-1 (CH2) dan 1375 cm-1
BAB III
METODOLOGI PENELITIAN
Metode yang digunakan adalah metode deskriktif meliputi pengumpulan
dan pengolahan sampel, penapisan fitokimia, pemeriksaan karateristik, pembuatan
ekstrak, KCV, KLT preparatif, uji kemurnian isolat dan identifikasi isolat secara
spektrofotometri UV dan spektrofotometri IR.
3.1 Alat-alat yang digunakan
Alat-alat yang digunakan pada penelitian ini adalah alat-alat gelas
laboratorium, blender (Panasonic), eksikator, mikroskop (Olympus), seperangkat
alat destilasi, separangkat alat penetapan kadar air, seperangkat alat kromatografi
cair vakum, oven listrik (Stork), elektromantel (EM 2000), hairdryer (Maspion),
neraca analitik (Vibra AJ), neraca kasar (Saherand), penangas air (Yenaco),
seperangkat alat kromatogramrafi lapis tipis (Dessaga), lemari pengering,
spektrofotometer UV (Milton Troy Spectronic 3000 array) dan spektrofometer IR
(IR-Prestige 21).
3.2 Bahan-bahan yang digunakan
Bahan yang digunakan adalah herba suruhan (Peperomiae pellucidae
analisis yaitu n-heksan, etilasetat, etanol, amil alkohol, metanol, eter, isopropanol,
α-naftol, ammonia pekat, besi (III) klorida, iodium, raksa (II) klorida, timbal (II)
asetat, kalium iodine, asam asetat glasial, asam sulfat pekat, asam klorida pekat,
serbuk magnesium, bismuth (III) nitrat, plat pra lapis silika gel GF254, silika gel
60H, kloralhidrat, n-heksan hasil destilasi dan air suling laboratorium.
3.3 Pembuatan larutan pereaksi
Pembuatan pereaksi dilakukan menurut Depkes (1979) yaitu untuk
pereaksi asam klorida 2 N, natrium hidroksida 2 N; menurut Depkes (1989) untuk
pereaksi asam nitrat 0,5 N, besi (III) klorida 1%, Bouchardat, Dragendroff,
Mayer, Molish, timbal (II) asetat 0,4 M, kloralhidrat dan pereaksi
Liebermann-Burchard.
3.3.1 Pereaksi Dragendroff
Sebanyak 0,85 g bismuth (III) nitrat dilarutkan dalam 100 ml asam asetat
glasial, lalu ditambah 40 ml air suling. Pada wadah yang lain dilarutkan 8 g
kalium iodida dilarutkan dalam 20 ml air suling, kemudian kedua larutan
dicampurkan sama banyak dan disimpan dalam botol yang gelap.
3.3.2 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam air secukupnya sampai larut
sempurna. Iodium sebanyak 2 g dilarutkan dalam larutan kalium iodida, lalu
volume dicukupkan hingga 100 ml.
Sebanyak 1,358 g raksa (II) klorida dilarutkan dalam 60 ml air suling.
Pada wadah lain dilarutkan 5 g kalium iodida dalam 10 ml air suling. Kedua
larutan dicampur lalu ditambahkan air suling hingga 100 ml.
3.3.4 Pereaksi Asam Klorida 2 N
Sebanyak 17 ml asam klorida pekat dilarutkan dalam air suling hingga 100
ml.
3.3.5 Pereaksi Besi (III) Klorida 1% (b/v)
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling hingga 100 ml.
3.3.6 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 gram timbal (II) asetat dilarutkan dalam air suling bebas
karbondioksida hingga 100 ml.
3.3.7 Pereaksi Molish
Sebanyak 3 gram α-naftol dilarutkan dalam asam nitrat 0,5 N hingga 100
ml.
3.3.8 Pereaksi Liebermann-Burchard
Sebanyak 5 ml asam asetat anhidrat ditambah 5 ml asam sulfat pekat,
kemudian campuran dimasukkan ke dalam 50 ml etanol. Pengerjaan dilakukan
dalam kondisi dingin dan pereaksi dibuat baru.
3.3.9 Pereaksi natrium hidroksida 2 N
Sebanyak 8,001 gram kristal natrium hidroksida dilarutkan dalam air
suling hingga 100 ml.
3.3.10 Pereaksi asam nitrat 0,5 N
Sebanyak 3,15 ml asam nitrat pekat diencerkan dengan air suling
3.3.11 Pereaksi kloralhidrat
Sebanyak 50 gram kloralhidrat ditimbang, dilarutkan dalam 20 ml air
suling.
3.4 Pengumpulan dan pengolahan sampel 3.4.1 Pengumpulan sampel
Pengumpulan sampel dilakukan secara purposif, yaitu tanpa
membandingkan dengan daerah lain. Sampel yang digunakan adalah herba
suruhan yang diambil di lapangan, di bawah pohon, dan sela batu di sekitar
kampus Universitas Sumatera Utara, kota Medan.
3.4.2 Identifikasi tumbuhan
Identifikasi sampel dilakukan di Pusat Penelitian dan Pengembangan
Biologi LIPI, Bogor. Hasil identifikasi tumbuhan dapat dilihat pada lampiran 1
halaman 43. Gambar tumbuhan suruhan dan herba suruhan dapat dilihat pada
lampiran 2 dan 3 pada halaman 43 dan 45.
3.4.3 Pengolahan sampel
Herba suruhan dibersihkan dari kotoran dengan cara mencuci di bawah air
mengalir hingga bersih dan ditiriskan. Kemudian herba suruhan dikeringkan
dalam lemari pengering pada suhu 40oC. Herba suruhan dianggap kering apabila
sudah rapuh. Selanjutnya disimpan dalam wadah plastik di tempat yang terlindung
dari cahaya sebelum digunakan.
3.5 Pemeriksaan karateristik simplisia
Pemeriksaan karateristik simplisia meliputi pemeriksan makroskopik dan
larut dalam etanol, penetapan kadar abu total, penetapan kadar abu yang tidak
larut dalam asam dan penetapan kadar air (Ditjen POM, 1989; WHO, 1992).
3.5.1 Pemeriksaan makroskopik
Pemeriksan makroskopik dilakukan dengan mengamati bentuk simplisia
yang menjadi karateristiknya. Gambar simplisia herba suruhan dapat dilihat pada
lampiran 4 halaman 46.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap terhadap serbuk simplisia.
Pemeriksaan terhadap serbuk simplisia dilakukan dengan cara menaburkan serbuk
simplisia diatas kaca objek yang telah ditetesi dengan kloralhidrat dan ditutupi
dengan kaca penutup kemudian dilihat di bawah mikroskop. Gambar mikroskopik
dapat dilihat pada lampiran 5 halaman 47.
3.5.3 Penetapan kadar sari yang larut dalam air
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24
jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air suling sampai 1
liter) dalam labu bersumbat sambil berkali-kali dikocok selama 6 jam pertama
kemudian dibiarkan 18 jam lalu disaring. Sejumlah 20 ml filtrat diuapkan hingga
kering dalam cawan penguap berdasar rata yang telah ditara. Sisa dipanaskan pada
suhu 105°C sampai bobot tetap. Kadar sari larut dalam air dihitung dalam persen
terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1989).
Sebanyak 5 g serbuk yang telah dikeringkan diudara dimaserasi selama 24
jam dalam 100 ml etanol 95% dalam labu bersumbat sambil dikocok selama 6 jam
pertama kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk
menghindari penguapan etanol 95%, sejumlah 20 ml filtrat diuapkan sampai
kering dalam cawan penguap berdasar rata yang telah ditara dan sisanya
dipanaskan pada suhu 105°C sampai bobot tetap. Kadar sari larut dalam etanol
dihitung dalam persen terhadap bahan yang telah dikeringkan di udara (Ditjen
POM, 1989).
3.5.5 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama
dimasukkan ke dalam krus porselen yang telah dipijar dan ditara, kemudian
diratakan. Krus dipijarkan perlahan-lahan hingga arang habis kemudian
didinginkan dan ditimbang hingga diperoleh bobot tetap. Kadar abu dihitung
terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1989).
3.5.6 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh pada penetapan kadar abu total dididihkan dalam 25
ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring bebas abu kemudian dicuci dengan
air panas. Residu dan kertas saring dipijar sampai bobot tetap kemudian
dididnginkan dan ditimbang. Kadar abu tidak larut dalam asam dihitung terhadap
bahan yang telah dikeringkan di udara (Ditjen POM, 1989).
Penetapan kadar air dilakukan dengan metode Azeotropi (Destilasi
Toluen). Alat-alat terdiri dari labu alas bulat 500 ml, alat penampung, pendingin,
tabung penyambung, tabung penerima 5 ml.
Cara kerja : Kedalam labu alas bulat dimasukkan 100 ml toluen dan 1 ml air
suling, didestilasi selama 2 jam, toluen didinginkan selama 30 menit dan volume
air didalam tabung penerima dibaca. Kemudian kedalam labu dimasukkan 5 g
serbuk simplisia yang telah ditimbang seksama, lalu dipanaskan hati-hati selama
15 menit, setelah toluen mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik
sampai sebagian air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4
tetes tiap detik. Setelah semua air terdestilasi, bagian bagian dalam pendingin
dibilas dengan toluen, destilasi dilanjutkan selama 5 menit, kemudian tabung
penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen memisah
sempurna, dibaca volume air dengan ketelitian 0,05 ml. Kadar air dihitung dalam
persen (WHO, 1992). Perhitungan karakterisasi simplisia dapat dilihat pada
lampiran 6 halaman 48. Hasil karakterisasi simplisia dapat dilihat pada lampiran 7
halaman 53.
3.6 Penapisan fitokimia serbuk simplisia
Penapisan fitokimia serbuk simplisia meliputi pemeriksaan senyawa
golongan alkaloida, flavonoida, saponin, tanin, glikosida, antrakuinon, dan
triterpenoida/steroida.
3.6.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml
asam klorida 2 N dan 9 ml air suling, dipanaskan diatas penangas air selama 2
a. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Mayer,
akan terbentuk endapan menggumpal berwarna putih atau kuning.
b. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi
Bouchardat, akan terbentuk endapan berwarna coklat sampai hitam.
c. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi
Dragendroff, akan terbentuk endapan warna merah atau jingga.
Alkaloida positif jika terjadi endapan atau kekeruhan paling sedikit dua dari
tiga percobaan diatas (Depkes, 1989).
3.6.2 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia ditambahkan 100 ml air panas, didihkan
selama 5 menit dan disaring dalam keadaan panas, kedalam 5 ml filtrat
ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil
alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika terjadi warna
merah, kuning, jingga pada lapisan amil alkohol (Farnsworth, 1996).
3.6.3. Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukkan ke dalam tabung reaksi,
ditambahkan 10 ml air panas, didinginkan kemudian dikocok selama 10 detik.
Jika terbentuk busa setinggi 1 sampai 10 cm yang stabil tidak kurang dari 10
menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan
adanya saponin (Depkes, 1989).
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu
disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil
sebanyak 2 ml dan ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida 1%.
Jika terjadi warna biru atau kehitaman menunjukkan adanya tanin. (Depkes,
1989).
3.6.5 Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia disari dengan 30 ml campuran etanol 95%
dengan air suling (7:3) dan 10 ml asam sulfat 2 N, direfluks selama 1 jam,
didinginkan dan disaring. Pada 20 ml filtrat ditambahkan 25 ml air suling dan 25
ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat disari
dengan 20 ml campuran isopropanol dan kloroform (2:3) dilakukan berulang
sebanyak 3 kali. Kumpulan sari air diuapkan dan sisanya dilarutkan dalam 2 ml
metanol. Larutan sisa dimasukkan dalam tabung reaksi selanjutnya diuapkan
diatas penangas air, pada sisa ditambahkan 2 ml air dan 5 tetes larutan pereaksi
Molish. Tambahkan hati-hati 2 ml asam sulfat melalui dinding tabung, terbentuk
cincin ungu pada batas kedua cairan menunjukkan adanya glikosida. (Depkes,
1989).
3.6.6 Pemeriksaan antrakuinon
Sebanyak 0,2 g serbuk simplisia ditambah 5 ml asam sulfat 2 N,
dipanaskan sebentar, setelah dingin ditambahkan 10 ml benzena, dikocok dan
didiamkan. Lapisan benzena dipisahkan dan disaring. Kocok lapisan benzena
dengan 2 ml NaOH 2 N, diidamkan. Lapisan air berwarna merah dan lapisan
benzena tidak berwarna menunjukkan adanya antrakuinon (Depkes, 1989).
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml eter selama 2 jam,
disaring. Filtrat diuapkan dalam cawan penguap, dan pada sisanya ditambahkan
10 tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat (pereaksi
Liebermann-Burchard). Apabila terbentuk warna ungu atau merah yang berubah menjadi biru
menunjukkan adanya steroida/triterpenoida (Harborne, 1987). Hasil penapisan
fitokimia serbuk simplisia dapat dilihat pada lampiran 7 halaman 53.
3.7 Pembuatan ekstrak
Pembuatan ekstrak dilakukan dengan cara maserasi menggunakan pelarut
n-heksan.
Cara kerja :
Sebanyak 300 g serbuk simplisia herba suruhan dimasukkan ke dalam
wadah gelas bertutup (maserator) dengan pelarut n-heksan sampai seluruh serbuk
terendam, ditutup dan dibiarkan pada suhu kamar dan terlindung dari cahaya
selama 24 jam sambil sering diaduk. Kemudian disaring hingga di dapat maserat.
Ampas dimaserasi kembali dengan n–heksan menggunakan prosedur yang sama,
maserasi dilakukan sebanyak 3 kali. Seluruh maserat digabung dan dipekatkan
dengan bantuan alat penguap vakum putar pada temperatur tidak lebih dari 40°C.
Bagan pembuatan ekstrak dapat dilihat pada lampiran 8 halaman 54.
3.8Analisis ekstrak n-heksan secara KLT
Terhadap ekstrak n–heksan dilakukan analisis secara KLT menggunakan
fase diam silika gel GF 254 dan fase gerak campuran n-heksan – etilasetat dengan
perbandingan (90:10), (80:20), (70:30), (60:40), dan (50:50). Sebagai penampak
bercak digunakan pereaksi Liebermann-Burchard.
Ekstrak ditotolkan pada plat lapis tipis, kemudian dimasukan ke dalam
chamber yang telah jenuh dengan uap fase gerak. Setelah pengembangan selesai
plat dikeluarkan dan dikeringkan, plat disemprot dengan penampak bercak
Liebermann-Burchard dan dipanaskan di oven pada suhu 105°C selama 15 menit
lalu diamati warna yang terbentuk. Kromatogram ekstrak dapat dilihat pada
lampiran 9 halaman 55.
3.9 Fraksinasi ekstrak n-heksan dengan KCV
Ekstrak n-heksan difraksinasi secara KCV menggunakan pelarut landaian
n-heksan - etilasetat dengan perbandingan (100:0), (90:10), (80:20), (70:30),
(60:40), (50:50), (40:60), (30:70), (20:80), (10:90), (0:100).
Cara kerja:
Sebagai kolom digunakan corong Buchner kaca masir, lalu dimasukkan
silika gel 60 H yang dikemas dalam keadaan kering ke dalam corong. Alat vakum
dihidupkan untuk memperoleh kerapatan yang maksimum. Kemudian cuplikan
yang telah dicampur dengan silika gel 60 H dimasukkan pada bagian atas kolom
yang disebar secara merata, lalu di atasnya diletakkan kertas saring. Alat vakum
dihidupkan kembali. Sampel dielusi dengan pelarut mulai dari kepolaran rendah
lalu kepolaran ditingkatkan perlahan-lahan dan kolom dihisap sampai kering pada
setiap pengumpulan fraksi (Hostettmann, 1986). Bagan isolasi steroida dari
ekstrak n-heksan herba suruhan dapat dilihat pada lampiran 10 halaman 56.
3.10 Analisis KLT hasil KCV
Hasil fraksinasi yang telah dipekatkan tersebut di KLT menggunakan fase
diam plat pra lapis, pengembang n-heksan - etilasetat (90:10) dengan penampak
sama digabungkan. Kromatogram KLT dari fraksi-fraksi hasil KCV dapat dilihat
pada lampiran 11 dan 12 halaman 57-58.
3.11 Isolasi senyawa steroida hasil fraksinasi secara KLT preparatif
Terhadap fraksi A2 yang mengandung bercak berwarna ungu dan merah
ungu dilakukan isolasi secara KLT preparatif. Sebagai penyemprot digunakan
pereaksi penyemprot LiebermanBurchard dan sebagai fase gerak digunakan
n-heksan - etilasetat (90:10) dan fase diam silika gel GF254.
Cara kerja:
Fraksi ditotolkan pada jarak 2 cm dari tepi bawah plat KLT berukuran
20x20 cm yag telah diaktifkan sehingga membentuk pita. Setelah kering plat KLT
dimasukkan kedalam bejana yang telah jenuh dengan uap fase gerak, pengembang
dibiarkan naik membawa komponen yang ada. Setelah mencapai batas
pengembangan plat dikeluarkan dari bejana lalu dikeringkan. Bagian tengah plat
ditutup dengan kaca yang bersih sedangkan pada sisi kanan dan kiri plat
disemprot dengan pereaksi penyemprot Liebermann-Burchard dan dipanaskan
dengan alat pengering. Bagian tengah plat yang sejajar dengan bercak berwarna
ungu dan merah ungu dikerok dan dikumpulkan, direndam dengan metanol satu
malam lalu disaring kemudian pelarutnya diuapkan. Kemudian dilakukan uji
kemurnian dengan KLT terhadap isolat yang diperoleh. Kromatogram dapat
dilihat pada lampiran 13 halaman 59.
3.12 Uji kemurnian kristal hasil isolat
Terhadap isolat dilakukan uji kemurnian dengan KLT dua arah dengan
yaitu kloroform - etilasetat (70:30) dengan fase diam plat pralapis dan pereaksi
penyemprot Liebermann-Burchard.
Cara kerja:
Isolat ditotolkan pada plat pra lapis ukuran 10 x 10 lalu dielusi memakai
fase gerak I yaitu n-heksan - etilasetat (90:10) hingga mencapai batas
pengembangan, kemudian plat dikeluarkan dari dalam bejana dan dikeringkan.
Setelah plat kering dielusi kembali dengan arah yang berbeda 90° memakai fase
gerak II yaitu kloroform - etilasetat (70:30), disemprot dengan memakai pereaksi
penyemprot Liebermann-Burchard, setelah itu plat dipanaskan pada suhu 105°C
selama 10 menit lalu diamati warna yang terbentuk. Kromatogram KLT dua arah
isolat dapat dilihat pada lampiran 14 halaman 60.
3.13 Identifikasi isolat
Identifikasi isolat secara spektrofotometri ultraviolet dan spektrofotometri
inframerah dilakukan di Laboratorium Kimia Organik UGM, Yogyakarta.
3.12.1 Identifikasi isolat secara spektrofotometri UV
Cara kerja:
Isolat hasil isolasi dilarutkan dalam pelarut n-heksan, kemudian
dimasukkan kedalam kuvet yang telah dibilas dengan larutan sampel. Selanjutnya
absorbansi larutan sampel diukur pada panjang gelombang 200-400 nm. Spektrum
ultraviolet isolat dapat dilihat pada lampiran 15 halaman 61.
3.12.2 Identifikasi isolat secara spektrofotometri IR
Cara kerja:
Identifikasi isolat secara spektrofotometri IR dilakukan dengan cara
mixture vibrate, kemudian dicetak menjadi pelet pada tekanan 11,5 ton dan
dimasukkan kedalam spektrofotometer inframerah serta diukur absorbansinya
pada frekuensi 4000-400 cm -1. Spektrum inframerah isolat dapat dilihat pada
lampiran 16 halaman 62.
BAB IV
HASIL DAN PEMBAHASAN 4.1 Pemeriksaan karakteristik simplisia
Hasil identifikasi yang dilakukan oleh Pusat Penelitian dan Pengembangan
Biologi Bogor terhadap tumbuhan yang diteliti adalah suruhan (Peperomia
pellucida H.B. & K.) suku Piperaceae (lihat lampiran 1). Pemeriksaan karateristik
simplisia secara makroskopik yaitu, daun tunggal, berkeriput, rapuh, helai daun
berbentuk jantung, berwarna coklat kehijauan, batang berwarna coklat kehijauan,
buah bulat, kecil, berwarna coklat.
Pada pemeriksaan mikroskopik serbuk simplisia dijumpai adanya rambut
penutup, berkas pembuluh, sel minyak, stomata tipe anomositik, hablur kalsium
oksalat berbentuk persegi dan drusse yang ujung kristalnya runcing dan tumpul,
Hasil pemeriksaan karateristik serbuk simplisia herba suruhan diperoleh
kadar sari yang larut dalam air 18,8%, kadar sari yang larut dalam etanol 12,83%,
kadar abu total 3,85 %, kadar abu yang tidak larut dalam asam 1,17 % dan kadar
air 6,66 %. Hasil penapisan fitokimia serbuk herba suruhan menunjukkan adanya
senyawa golongan flavonoida, glikosida, tanin, dan triterpenoida/steroida.
4.2 Isolasi senyawa triterpenoida/steroida
Ekstraksi dilakukan dengan cara maserasi menggunakan pelarut n-heksan,
hasil maserasi 300 g serbuk simplisia diperoleh ekstrak 7,935 g (2,64%). Analisis
KLT dari ekstrak n-heksan menunjukkan bahwa fase gerak yang paling baik
adalah n-heksan – etilasetat (90:10) karena menghasilkan pemisahan noda yang
baik dan diperoleh 8 noda yang terdiri dari 1 noda berwarna ungu coklat, 3 noda
berwarna ungu, 1 noda berwarna merah ungu, 2 noda berwarna biru ungu dan 1
noda berwarna biru hijau (lihat lampiran 9).
Selanjutnya terhadap ekstrak n-heksan dilakukan fraksinasi secara KCV
untuk memisahkan senyawa-senyawa yang terdapat dalam ekstrak berdasarkan
kepolarannya menggunakan pelarut landaian n-heksan - etilasetat dengan
kepolaran yang semakin meningkat dan fase diam silika gel 60H. Hasil fraksinasi
dilakukan KLT dengan fase gerak n-heksan – etilasetat (90:10) dengan penampak
bercak Liebermann-Burchard. Dari 11 fraksi yang diperoleh fraksi yang
mempunyai pola kromatogram yang sama digabung menjadi satu fraksi yaitu F1,
F2, F3, F4, F5 (fraksi 5 dan 6), F6 (fraksi 7, 8, dan 9), sedangkan fraksi 10 dan 11
tidak menunjukkan adanya noda (lihat lampiran 11). Terhadap fraksi F2
dilanjutkan untuk di KLT preparatif karena pada fraksi F2 menunjukkan noda
Setelah dilakukan KLT preparatif ternyata hasilnya menunjukkan noda yang
terlalu rapat sehingga perlu dilakukan KCV sekali lagi. Hasil KCV diperoleh 11
fraksi yaitu fraksi A1 – A11. Dari 11 fraksi yang diperoleh, fraksi yang
mempunyai pola kromatogram yang sama digabung menjadi satu yaitu FA1, FA2
(A2 dan A3), FA3 (A4, A5, A6), FA4 (A7,A8,A9,A10,A11). Jadi dari 11 fraksi
menjadi 4 fraksi yaitu FA1, FA2, FA3, dan FA4 (lihat lampiran 12).
Terhadap FA2 dilakukan KLT preparatif karena pada FA2 ini
menunjukkan 3 noda yang berwarna ungu dengan Rf = 0,44, Rf = 0,52, Rf =
0,625dan 1 noda yang berwarna merah ungu dengan Rf = 0,77. Sedangkan fraksi
FA1, FA3 dan FA4 tidak menunjukkan noda berwarna ungu dan merah ungu.
Hasil A2 secara KLT preparatif dengan menggunakan plat KLT preparatif
ukuran 20x20 cm, fase gerak n-heksan - etilasetat (90:10). Hasil KLT
menunjukkan tiga pita (lihat lampiran 13), kemudian masing-masing pita dikerok,
direndam dengan metanol, diambil filtrat lalu diuapkan dan diperoleh 3 isolat
yaitu isolat 1, isolat 2 dan isolat 3.
Pada uji kemurnian terhadap isolat 1 terdapat dua noda yang berwarna
merah ungu dan kuning. Pada isolat 2 diperoleh satu noda yang berwarna ungu.
Pada isolat 3 terdapat dua noda yang berwarna ungu dan kuning. Isolat yang akan
diuji adalah isolat 2 karena pada isolat 2 hanya terdapat satu noda sedangkan pada
isolat 1 dan 3 hasil kromatogram menunjukkan lebih dari satu noda. Pada isolat 2
dilakukan uji kemurnian dengan kromatografi lapis tipis dua arah dengan fase
gerak pertama n-heksan - etilasetat (90:10) dan fase gerak kedua kloroform -
etilasetat (80:20) dengan fase diam silika gel GF254. Setelah disemprot dengan
ungu dengan nilai Rf 0,93. Diduga senyawa tersebut adalah senyawa
triterpenoida/steroida.
Hasil spektrofotometri ultraviolet isolat memberikan puncak absorbsi pada
panjang gelombang (λ) 223,3 nm yang menunjukkan adanya gugus kromofor
(lihat lampiran 15). Diduga senyawa tersebut adalah senyawa
triterpenoida/steroida.
Hasil spektrofotometri inframerah isolat menunjukkan adanya ikatan
O-H yang ditunjukkan oleh puncak melebar pada bilangan gelombang 3363,86 cm-1.
Pita pada bilangan gelombang 2924,09 cm-1 bilangan gelombang 2854,85 cm-1
menunjukkan adanya ikatan C-H alifatis yang diperkuat oleh puncak pada
bilangan gelombang 1458,18 cm-1 yang menunjukkan gugus CH2 dan puncak
pada bilangan gelombang 1373,32 cm-1 yang menunjukkan gugus CH3. Puncak
pada bilangan gelombang 1743,65 cm-1 menunjukkan adanya gugus C=O. Pita
pada bilangan gelombang 1157,29 menunjukkan adanya ikatan C-O (lihat
lampiran 16). Dari hasil spektrofotometri IR diduga senyawa tersebut adalah
senyawa triterpenoida/steroida.
Dari data-data yang diperoleh, secara KLT dengan penampak bercak
Liebermann-Burchard, spektrofotometri UV dan spektrofotometri IR maka
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Hasil dari pengamatan makroskopik yaitu, daun tunggal, berkeriput, rapuh,
helai daun berbentuk jantung, berwarna coklat kehijauan, batang berwarna coklat
kehijauan, buah bulat, kecil, berwarna coklat. Hasil pemeriksaan mikroskopik
serbuk simplisia dijumpai adanya rambut penutup, berkas pembuluh, tetes
minyak, stomata tipe anomositik, hablur kalsium oksalat berbentuk persegi dan
drusse yang ujung kristalnya runcing dan tumpul, sel batu, serbuk sari dan trakea.
Karateristik serbuk simplisia suruhan diperoleh kadar sari yang larut dalam air
18,8%, kadar sari yang larut dalam etanol 12,83%, kadar abu total 3,85 %, kadar
abu yang tidak larut dalam asam 1,17% dan kadar air 6,66 %.
Hasil analisis spektrum UV dan spektrum IR menunjukkan bahwa isolat 2
5.2 Saran
Disarankan kepada peneliti selanjutnya untuk menentukan struktur
senyawa triterpenoida/steroida yang terdapat dalam herba suruhan.
DAFTAR PUSTAKA
Carey, F.A. (2008). Organic Chemistry. Seventh Edition. USA: Mc Graw Hill. Page. 554-556
Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Jakarta: Depkes RI. Hal. 748, 891
Ditjen POM. (1989). Materia Medika Indonesia. Edisi V. Jakarta: Depkes RI. Hal. 513-522, 536-541,549-553
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat.
Jakarta : Departemen Kesehatan RI. Hal. 1-11
Djauhariya, E., dan Hernani. (2004). Gulma Berkhasiat Obat. Jakarta : Penebar Swadaya. Hal. 1-5, 86-87
Djumidi, S.H., (1997). Inventaris tanaman Obat Indonesia. Edisi IV. Jakarta : Departemen Kesehatan RI. Hal. 137
Fransworth, N.R.(1966). Biological and Phytochemical Screening of Plants.
Journal of Pharmaceutical Science. Vol. 55(3): 257-259, 263
Gritter, R. J., Bobbitt, J. dan Schwarting, A. E. (1991). Pengantar Kromatografi. Penerjemah: Padmawinata, K. Ed 2. Penerbit ITB. Bandung. Hal. 107-146
Harborne, J. B. (1987). Metode Fitokimia Penuntun Cara Modern Menganalisis
Tumbuhan. Penerjemah: Padmawinata, K dan Soediro, I. Ed. 2. Penerbit
ITB. Bandung. Hal. 48-49, 147-149
Hostettmann, K., Hostettmann, M., dan Marston, A. (1995). Cara Kromatografi
Preparatif : Penggunaan pada Isolasi Senyawa Alam. Penerjemah:
Padmawinata, K., Penerbit ITB. Bandung. Hal. 9-12, 33-34
Mc Murry, J. (2007). Organic Chemistry a Biological Approach. USA: Thomson Books. Page 430-431
Muhtadi, A., Susilawati, Y dan Mulqie, L. (2004). Aktivitas Antidiabetes Ekstrak Etanol Herba Peperomia pellucida (L.) H.B.K. pada Tikus Putih yang Diinduksi Aloksan. Jurnal Farmaka. Fakultas Farmasi Universitas Padjajaran.
Noerdin, D. (1985). Elusidasi Struktur Senyawa Organik dengan Cara
Spektroskopi Ultralembayung dan Inframerah. Bandung : Angkasa. Hal.
38, 106, 111
Robinson, T. (1995). Kandungan Organik Tumbuhan Tinggi. Penerjemah: Padmawinata, K. Penerbit ITB. Bandung. Hal. 139, 152-156
Sastrohamidjojo, H. (1985). Kromatografi. Yogyakarta : Penerbit Liberty. Hal. 1-2, 29-32
Stahl. (1985). Analisis Obat Secara Kromatografi dan Mikroskopik. Penerjemah: Padmawinata, K. dan Soediro. Penerbit ITB. Bandung. Hal. 3-18
Utami, P. (2008). Buku Pintar Tanaman Obat. Cetakan I. Jakarta: Agromedia Pustaka. Hal. 232
Wijayakusuma, H. (2006). Atasi Asam Urat dan Reumatik ala Hembing. Jakarta: Puspa Swara. Hal. 46
Gambar 6. Tumbuhan suruhan (Peperomia pellucida H.B.&K.)
Gambar 7. Herba suruhan (peperomiae pellucidae herba)
Gambar 8. Simplisia herba suruhan (Peperomiae pellucidae herba)