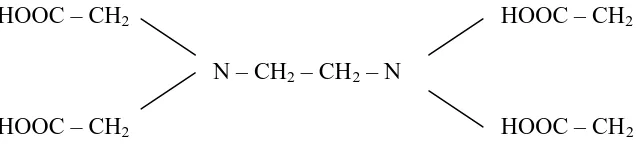ANALISA KADAR KALSIUM OKSIDA (CaO) DAN MAGNESIUM OKSIDA (MgO) PADA PUPUK DOLOMIT DAN KISERIT
SECARA TITRASI KOMPLEKSOMETRI
KARYA ILMIAH
RIZKY ADRIANI 062401037
PROGRAM STUDI DIPLOMA 3 KIMIA ANALIS DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
ANALISA KADAR KALSIUM OKSIDA (CaO) DAN MAGNESIUM OKSIDA (MgO) PADA PUPUK DOLOMIT DAN KISERIT
SECARA METODE TITRASI KOMPLEKSOMETRI
KARYA ILMIAH
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Ahli Madya
RIZKY ADRIANI 062401037
PROGRAM STUDI DIPLOMA 3 KIMIA ANALIS DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : ANALISA KADAR KALSIUM OKSIDA (CaO)
DAN MAGNESIUM OKSIDA (MgO) PADA PUPUK DOLOMIT DAN KISERIT SECARA TITRASI KOMPLEKSOMETRI
Kategori : KARYA ILMIAH
Nama : RIZKY ADRIANI
Nomor Induk Mahasiswa : 062401037
Program Studi : D 3 KIMIA ANALIS
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Juni 2009
Diketahui
Departemen Kimia FMIPA USU
Ketua, Pembimbing,
DR. Rumondang Bulan, MS Prof.Dr.Zul Alfian,M.Sc
PERNYATAAN
ANALISA KADAR KALSIUM OKSIGEN (CaO) DAN MAGNESIUM (MgO) PADA PUPUK DOLOMIT DAN KISERIT SECARA
TITRASI KOMPLEKSOMETRI
KARYA ILMIAH
Saya mengakui bahwa karya ilmiah ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juni 2009
062401037
PENGHARGAAN
Dengan mengucapkan puji dan syukur kehadirat Allah SWT, yang telah
melimpahkan rahmat dan hidayah-Nya sehingga penulis dapa menyelesaikan Karya
Ilmiah ini dengan judul Analisis Kadar Kalsium Oksigen (CaO) Dan Magnesium
Oksigen (MgO) Pada Pupuk Dolomit Dan Kiserit Secara Titrasi Kompleksometri. Dengan kerendahan hati penulis mengucapkan terima kasih kepada semua pihak yang telah membantu penulis dalam menyelesaikan karya ilmiah ini :
1. Bapak Prof. Dr. Zul Alfian, M.Sc selaku dosen pembimbing yang telah
memberikan arahan dan bimbingan serta waktu kepada penulis.
2. Ibu DR.Rumondang Bulan Nst, MS selaku pembimbing Ketua Departemen
Kimia FMIPA USU.
3. Seluruh Dosen, karyawan/ staff Program Studi D 3 Kimia Analis F-MIPA
USU.
4. Orang tua, abang dan adik yang telah memberikan dukungan kepada penulis
baik materi maupun spiritual sehingga penulis dapat menyelesaikan karya
ilmiah ini.
5. Rekan-rekan mahasiswa/I Kimia Analis angkatan 2006 yang tidak dapat
disebutkan satu per satu namanya.
6. Sahabat-sahabat de Nine Ballz (K’Sherly, Rina, Inggit, Isma, Lia, Widy, Ayu
dan Mazda ) yang telah banyak memberikan dukungan kepada penulis.
Akhir kata, penulis mengharapkan semoga karya ilmiah ini berguna bagi para
pembaca dan penulis meyadari masih banyak kekurangan pada penulisan ini, penulis
sangat mengharapkan kritik dan saran yang sifatnya membangun menuju yang lebih
ABSTRAK
ANALYSIS RATE OF CALSIUM OXIGEN (CaO) AND MAGNESIUM OXIGEN (MgO) OF MANURE OF DOLOMITE AND KIESERITE BY
METHOD OF TITRATION COMPLEKSOMETRY
ABSTRACT
DAFTAR ISI
Halaman
PERSETUJUAN... ...i
PERNYATAAN ... ii
PENGHARGAAN ... iii
ABSTRAK ... iv
ABSTRACT...v
DAFTAR ISI ... vi
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ...ix
BAB I. PENDAHULUAN ...1
1.1 Latar Belakang ...1
1.2 Permasalahan ...2
1.3 Tujuan...2
1.4 Manfaat...2
BAB II TINJAUAN PUSTAKA ...3
2.1 Pengertian Pupuk ...3
2.2 Kalsium dan Magnesium...4
2.1.1 Kalsium ...4
2.1.2 Magnesium ...6
2.3 Kapur Karbonat ...8
2.2.1 Kapur Dolomit ...8
2.2.2 Kapur Kalsit...9
2.4 Faktor-faktor yang mempengaruhi ketersediaan Kalsium dan Magnesium...9
2.4.1 Faktor-faktor yang mempengaruhi ketersediaan ion Kalsium...9
2.4.2 Faktor-faktor yang mempengaruhi ketersediaan ion Magnesium ...10
2.6 Gejala Dan Dampak kekurangan Kalsium (CaO)
dan Magnesium (MgO) ...12
2.6.1 Gejala kekurangan Kalsium (CaO) dan Magnesium (MgO) ... 12
2.6.2 Dampak dan kerugian kekurangan Kalsium dan Magnesium ...12
2.7 Titrasi Kompleksometri ...13
2.7.1 EDTA dan Complekson ...13
2.7.2 Indikator Metalokromat ...14
2.7.3 Titrasi Kompleksometri untuk analisa ion Mg2+ dan Ca2+ ...15
2.7.4 Kelebihan Titrasi Kompleksometri ...15
BAB III. METODOLOGI PERCOBAAN ...16
3.1 Penentuan MgO dan CaO dari Pupuk Kiserit dan Dolomit ...16
3.2 Peralatan ...16
3.3 Bahan-bahan ...16
3.4 Prosedur ...17
3.4.1 Preparasi sample ...17
3.4.2 Analisa Kalsium Oksigen (CaO) ...18
3.4.3 Analisa Magnesium Oksigen (MgO) ...18
BAB IV. DATA DAN PEMBAHASAN ...19
4.1 Data dan Hasil Analisa ...19
4.1.1 Data dan Perhitungan CaO dan MgO dari Pupuk Dolomit ...19
4.1.2 Data dan Perhitungan CaO dan MgO dari Pupuk Kiserit ...20
4.2 Pembahasan...22
BAB V. KESIMPULAN DAN SARAN ...24
5.1 Kesimpulan ...24
5.2 Saran ...24
DAFTAR TABEL
Halaman
Tabel 2.1 Kandungan Ca pada berbagai pupuk ...5
Tabel 2.2 Kandungan Mg pada berbagai pupuk ...7
Tabel 4.1.1 Data Kadar Kalsium Oksigen (CaO) dan Magnesium Oksigen (MgO)
dari Pupuk Dolomit...19
Tabel 4.1.2 Data Kadar Kalsium Oksigen (CaO) dan Magnesium Oksigen (MgO)
DAFTAR GAMBAR
Halaman
Gambar 2.1 Struktur EDTA ...13
ABSTRAK
ANALYSIS RATE OF CALSIUM OXIGEN (CaO) AND MAGNESIUM OXIGEN (MgO) OF MANURE OF DOLOMITE AND KIESERITE BY
METHOD OF TITRATION COMPLEKSOMETRY
ABSTRACT
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Tanah adalah media yang dibutuhkan oleh tanaman untuk tumbuh dan berkembang.
Tingkat kesuburan tanah di setiap daerah berbeda-beda. Pemberian pupuk merupakan
salah satu usaha yang dilakukan untuk menjaga dan meningkatkan kesuburan tanah.
Pemupukan ini dapat dilakukan dengan berbagai jenis pupuk, tergantung dari
unsur-unsur hara yang dibutuhkan oleh tanah dan tanaman.
Pupuk merupakan bahan yang terdiri dari unsur organik maupun anorganik
yang berfungsi sebagai salah satu sumber pemasukan unsur hara bagi tanaman, pupuk
juga merupakan kunci kesuburan tanah karena berisi satu atau lebih unsur hara untuk
menggantikan unsur yang terhisab oleh tanaman. Pupuk dapat berasal dari sisa-sisa
tanaman, limbah, atau kotoran hewan yang dapat diubah menjadi bahan-bahan organik
tanah. Sedangkan pupuk yang dibuat dari pabrik disebut pupuk buatan atau pupuk
anorganik.
Salah satu jenis pupuk yang dapat digunakan untuk menjaga dan
meningkatkan tingkat kesuburan tanah adalah pupuk Dolomit. Pupuk dolomit berasal
dari batu-batuan dolomit yang telah dihaluskan. Batu-batuan dolomit ini dihaluskan
sesuai dengan tingkat kehalusannya berdasarkan besar mesh pengayakannya.
Pupuk dolomit yang diproduksi oleh perusahaan menggunakan bahan baku
batu kapur yang memiliki kadar atau presentasi Kalsium (CaO) dan Magnesium
(MgO) yang tinggi, sangat bermanfaat untuk pengapuran tanah masam dan untuk
Magnesium (MgO). Dolomit merupakan solusi utama bagi pertanian, perkebunan, dan
tambak yang tingkat kemasaman tinggi antara lain karena curah hujan yang tinggi,
faktor penggunaan pupuk nitrogen yang berlebihan, asal batuan induk yang memiliki
reaksi masam. Untuk itu pengapuran dan pemupukan dengan pupuk dolomit sangat
tepat untuk mengatasi masalah kemasaman dan miskin hara. Pupuk Kiserit adalah
MgSO4.H2O. Kandungan kiserit murni terdiri dari 25,5 % MgO dan 21,0 % S. Kiserit
berbentuk halus berwarna putih keabuan dan bersifat asam sehingga bila terus
digunakan dapat menyebabkan tanah bereaksi asam.
1.2 Permasalahan
Pada pupuk dolomit dan kiserit banyak terdapat kandungan CaO dan MgO.
Pupuk ini digunakan untuk mengembalikan tingkat kesuburan tanah yang asam.
Permasalahan yang akan saya ambil dalam penyusunan karya ilmiah adalah apakah
kandungan kadar CaO dan MgO pada pupuk dolomit dan kieserit yang akan
digunakan sesuai dengan kebutuhan tanaman.
1.3. Tujuan
Untuk mengetahui dan memahami analisa kadar CaO dan MgO pada pupuk
Dolomit dan Kiserit secara Titrasi Kompleksometri.
1.4 Manfaat
Dengan mengetahui kadar CaO dan MgO dapat diketahui jenis tanaman apa
BAB 2
TINJAUAN PUSTAKA
2.1 PENGERTIAN PUPUK
Pupuk adalah suatu bahan yang digunakan untuk mengubah sifat fisik, kimia atau
biologi tanah sehingga menjadi lebih baik bagi pertumbuhan tanaman. Dalam
pengertian yang khusus, pupuk adalah suatu bahan yang mengandung satu atau lebih
hara tanaman.
Berbicara tentang tanaman tidak akan lepas dari masalah pupuk. Dalam
pertanian modern, penggunaan materi yang berupa pupuk adalah mutlak untuk
memacu tingkat produksi tanaman yang diharapkan.
Seperti telah diketahui bersama bahwa pupuk yang diproduksi dan beredar
dipasaran sangatlah beragam, baik dalam hal jenis, bentuk, ukuran, maupun
kemasannya. Pupuk–pupuk tersebut hampir 90% sudah mampu memenuhi kebutuhan
unsur hara bagi tanaman, dari unsur makro hingga unsur yang berbentuk mikro. Kalau
tindakan pemupukan untuk menambah bahan-bahan yang kurang tidak segera
dilakukan tanaman akan tumbuh kurang sempurna, misalnya menguning, tergantung
pada jenis zat yang kurang.
Menurut hasil penelitian setiap tanaman memerlukan paling sedikit 16 unsur
(ada yang menyebutnya zat) agar pertumbuhannya normal. Dari ke 16 unsur tersebut,
tiga unsur (Carbon, Hidrogen, Oksigen) diperoleh dari udara, sedangkan 13 unsur lagi
tersedia oleh tanah adalah Nitrogen (N), Pospor (P), Kalium (K), Calsium (Ca),
Magnesium (Mg), Sulfur atau Belerang (S), Klor (Cl), Ferum atau Besi (Fe), Mangan
(Mo). Tanah dikatakan subur dan sempurna jika mengandung lengkap unsur-unsur
tersebut diatas.
Ke-13 unsur tersebut sangat terbatas jumlahnya di dalam tanah. Terkadang
tanah pun tidak mengandung unsur-unsur tersebut secara lengkap. Hal ini dapat
diakibatkan karena sudah habis tersedot oleh tanaman saat kita tidak henti-hentinya
bercocok tanam tanpa diimbangi dengan pemupukan. Kalau dilihat dari jumlah yang
disedot tanaman, dari ke-13 unsur tersebut hanya 6 unsur saja yang diambil tanaman
dalah jumlah yang banyak. Unsur yang dibutuhkan dalam jumlah yang banyak
tersebut disebut unsur makro. Ke-6 jenis unsur makro tersebut adalah N, P, K, S, Ca,
dan Mg. (Marsono.2001)
2.2 Kalsium dan Magnesium 2.2.1 Kalsium
Kalsium adalah logam putih perak yang melebur pada 845o C. Kalsium dapat bereaksi
dengan oksigen amfoter dan udara lembab; pada reaksi ini terbentuk kalsium oksida
ataupun hidroksida. Kalsium menguraikan air dengan membentuk kalsium hidroksida.
Kalsium membentuk kation (II), Ca2+, dalam larutan-larutan air. Garam-garamnya
biasanya berupa bubuk putih dan membentuk larutan yang tak berwarna, kecuali bila
anionnya berwarna. (Vogel, 1990)
Unsur kalsium yang diperlukan oleh tanaman tingkat tinggi dalam jumlah
relatif banyak dan diserap dalam bentuk ion Ca2+. Kalsium termasuk unsur hara yang
essensial, unsur ini diserap dalam bentuk Ca2+. Sebagian besar terdapat dalam daun
dalam bentuk kalsium pektat yaitu dalam lamella pada dinding sel. Selain itu terdapat
dan bulu-bulu akar akan terhenti sedangkan bagian-bagian yang telah terbentuk akan
mati dan berwarna coklat kemerah-merahan.
Sumber-sumber Ca2+ terutama terdapat pada batu-batu kapur dan sisa-sisa
tanaman. Ternyata bahwa banyak tanah yang menderita kekurangan Ca2+ sehingga
pada penanaman tanam-tanaman tertentu perlu mendapatkan pengapuran terlebih
dahulu, Kalsium berhubungan rata dengan pembentukan protein dan bagian tanaman
yang aktif juga untuk membentuk dinding sel sehingga berpengaruh pada kesegaran
tanaman. Kalsium ini dapat menetralkan asam dalam tanah. Sumber kalsium yang
paling umum adalah batu kapur, meskipun sisa-sisa tanaman juga mengandung
kalsium. Semakin lama tanah ditanam maka semakin asam sehingga tetap diperlukan
ion Ca untuk mengganti yang diserap tanaman. (Isnaini,M.,2006)
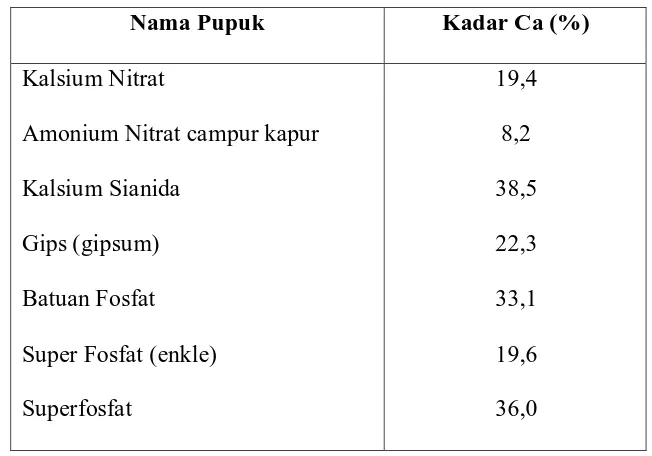
Tabel 2.1 Kandungan Ca Berbagai Pupuk (Rosmarkam,E.2002)
Nama Pupuk Kadar Ca (%)
Kalsium Nitrat
Amonium Nitrat campur kapur
Kalsium Sianida
Gips (gipsum)
Batuan Fosfat
Super Fosfat (enkle)
Superfosfat
19,4
8,2
38,5
22,3
33,1
19,6
2.2.2 Magnesium
Magnesium adalah logam putih yang melebur pada 650o C. Logam ini mudah terbakar
dalam udara atau oksigen dengan mengeluarkan cahaya putih yang cemerlang,
membentuk oksida MgO dan beberapa nitride Mg3N2. Logam ini perlahan-lahan
terurai oleh air pada suhu biasa, tetapi pada titik didih air reaksi berlangsung dengan
cepat. Magnesium Hidroksida, jika tak ada garam ammonium, praktis tak larut.
Magnesium larut dengan mudah dalam asam. Magnesium membentuk kation ekivalen
Mg2+. Oksida, hidroksida, karbonat dan fosfatnya tidak larut sedangkan garam-garam
lainnya larut. (Vogel, 1990)
Magnesium diserap oleh tanaman dalam bentuk ion Mg2+ yang merupakan
usnur penting dalam tanaman sebagai penyusun klorofil. Magnesium juga mempunyai
peranan penting terhadap metabolisme nitrogen. Makin tinggi tanaman menyerap Mg,
maka makin tinggi juga kadar protein dalam akar ataupun bagian atas tanaman.
Kekurangan Mg menyebabkan kadar protein turun dan non-protein naik. Unsur Mg
yang dahulu hanya sebagai pelengkap pupuk lain kini telah menjadi unsur utama pada
pupuk-pupuk tertentu. Hal ini disebabkan fungsi atau peranan Mg pada pertumbuhan
tanaman semakin diperhitungkan.
Pada awalnya yang disebut sebagai pupuk tunggal hanya ada tiga jenis, yaitu
pupuk N, pupuk K, dan pupuk P. Namun , sejalan dengan perkembangan ilmu
pertanian pupuk Mg juga dapat dimasukkan kedalam kelompok pupuk tunggal.
Salah satu jenis pupuk Mg yang mudah dapat ditemukan di toko-toko
pertanian adalah magnesium sulfat (MgSO4.H2O). Di pasaran pupuk ini dikenal
dengan nama kieserite. Bahan utama penyusun pupuk Mg ini adalah brucit atau
Tabel 2.2 Kandungan Mg berbagai Pupuk (Rosmarkam, E. 2002)
Jenis Pupuk Mg Mg(%) Unsur lain
Basic slag 3,4 -
Amonium nitrat campur kapur 4,4 -
Dolomit (MgCO3.Ca CO3) 5-20 20%-45% CaO
Epsom salt (MgSO4).7.H2O 9,6 13% S
Kieserit (MgSO4.H2O). 18,3 22% S
Garam (manure salt) 3,5 Na, Cl
Kalium magnesium sulfat 11,5 22-30% K2O
Magnesia 55,0 -
Magnesium klorida (MgCl2.6H2O) 20,0 -
Magnesiumsulfat anhydrous 33,0 26,5% S
Magnesite 45,0 -
Nitro magnesia 7,0 -
Pupuk magnesium sulfat berbentuk hablur dan berwarna putih keabu-abuan.
Sifat kimianya sukar larut dalam air dan bereaksi asam. Oleh sebab itu, apabila
digunakan secara terus-menerus dapat menyebabkan turunnya pH tanah atau tanah
menjadi masam. (Marsono, 2001)
2.3 Kapur Karbonat: Kalsit dan Dolomit
Kapur karbonat dihasilkan melalui proses penggilingan langsung pada batuan
kapur. Kandungan utama dalam kapur ini adalah kalsium dan magnesium karbonat.
Bila kadar kalsium karbonatnya lebih banyak maka kapur tersebut dinamakan kalsit.
Jenis kapur inilah yang umum digunakan sebagai upaya untuk meningkatkan pH
tanah.
Jumlah kapur yang diberikan tergantung dari derajat keasamannya. Semakin
tinggi derajat keasaman berarti semakin banyak kapur yang harus ditaburkan.
Umumnya tanah-tanah pertanian yang akan ditanami membutuhkan kapur sebanyak
2-4 ton/ha. Meskipun dari pengukuran tanah pertanian menunjukkan pH netral,
sebaiknya pengapuran tetap dilakukan. Hal ini dimaksudkan untuk mem-buffer atau
menahan naiknya keasaman tanah akibat penggunaan pupuk-pupuk kimia.
(Marsono, 2001)
2.3.1 Kapur Dolomit
Berbentuk bubuk berwarna putih kekuningan. Dikenal sebagai bahan untuk
menaikkan pH. Dolomit adalah sumber Ca (30%) dan Mg (19%) yang cukup baik.
Kelarutannya agak rendah dan kualitasnya sangat ditentukan oleh ukuran butiran.
Semakin halus butirannya akan semakin baik kualitasnya.
2.3.2 Kapur Kalsit
Berfungsi untuk meningkatkan pH tanah. Dikenal sebagai kapur pertanian
yang berbentuk bubuk. Warnanya putih dan butirannya halus. Pupuk ini mengandung
2.4 Faktor-Faktor Yang Mempengaruhi Ketersediaan Ion Kalsium dan Magnesium
2.4.1 Faktor-faktor yang mempengaruhi ketersediaan ion Kalsium Ketersediaan Ca2+ bagi pertumbuhan tanaman di tanah dipengaruhi oleh:
a. Pasokan total ion Kalsium dalam tanah
Ketersediaan Kalsium tampaknya bukan merupakan faktor pembatas pertumbuhan
utama kecuali pada tanah asam. Jika tidak ada faktor beracun, kebanyakan tanah asam
kemungkinan dapat memasok Ca2+ secara memadai kebanyakan tanaman.
b. pH tanah atau ion Hidrogen
Pengaruh langsung H+ dalam tanah terhadap pengambilan ion-ion dan terhadap
pertumbuhan tanaman sulit ditentukan, karena pada pH yang tingkat ion H+ nya tinggi
kemungkinan unsur lainnya juga larut dalam pH< 5. Jika tanaman ditumbuhkan dalam
larutan hara, pengaruh negatif dari ion H+ dapat secara jelas ditunjukkan. Serapan
Ca2+ menurun cukup berat pada pH < 5. Pengaruh ion H+ terhadap pertumbuhan dapat
diatasi dengan penambahan Ca2+ mudah larut.
c. Tipe koloid tanah dan tingkat kejenuhan ion Kalsium
Mehlich dan Colwell (1994) menyimpulkan bahwa dalam tanah-tanah mineral
asam, Ca2+ tidak secara merata mudah tersedia untuk tanaman pada kejenuhan basa
yang rendah dan menunjukkan bahwa persen kejenuhan basa lebih penting daripada
Ca2+ total yang ada. Adams (1967) melaporkan bahwa pada tanah lapisan bawah
d. Rasio kation Kalsium terhadap kation Aluminium dan kation lain dalam larutan tanah
Mungkin faktor tunggal yang paling penting yang mempengaruhi ketersediaan
Ca2+ dalam tanah asam adalah tingkat Al3+ yang dapat dipertukarkan atau yang dapat
larut dalam hubungannya dengan Ca2+.
2.4.2 Faktor-faktor yang mempengaruhi ketersediaan ion Magnesium a. Umum
Kondisi yang dapat mengakibatkan perkembangan defisiensi Mg pada
tanaman adalah: tanah asam, berpasir. Tanah asam dengan Mg2+ tersedia rendah
ditingkatkan dengan kapur kalsit takaran tinggi, dan pemberian pupuk-pupuk konsep
takaran tinggi.
b. pH tanah
Serapan Mg2+ oleh tanaman dari larutan hara dipengaruhi oleh konsentrasi ion
H+. Serapan Mg2+ oleh tanaman meningkat dengan meningkatnya pH yang mencapai
pH optimum yaitu pada pH sekitar 5,5. Defisiensi pada tanaman secara umum
berasosiasi dengan nilai pH tanah < 5. Jika tanah bereaksi asam dan ketersediaan
Mg2+ rendah, penggunaan kapur dolomit merupakan pendekatan terbaik dalam
mengoreksi defisiensi Mg2+.
c. Kejenuhan Magnesium
Kejenuhan Mg2+ merupakan suatu ukuran yang lebih baik dari ketersediaan
2.5 Fungsi Kalsium (CaO) dan Magnesium (MgO)
a. Mengoreksi keasaman tanah agar sesuai dengan pH yang diperlukan tanaman,
kolam dan tambak.
b. Menetralisir kejenuhan zat - zat yang meracuni tanah, tanaman, kolam dan
tambak bilamana zat tersebut berlebihan seperti zat Al (aluminium), Fe (zat
besi), Cu (Tembaga).
c. Meningkatkan efektifitas dan efisiensi penyerapan zat - zat hara yang sudah
ada dalam tanah baik yang berasal dari bahan organik maupun pemberian
pupuk lainnya seperti Urea, TSP dan KCl.
d. Menjaga tingkat ketersediaan unsur hara mikro sesuai kebutuhan tanaman.
Artinya dengan Kalsium (CaO) dan Magnesium (MgO) yang cukup unsur
mikropun memadai.
e. Memperbaiki porositas tanah, struktur serta aerasi tanah sekaligus bermanfaat
bagi mikrobiologi dan kimiawi tanah sehingga tanah menjadi gembur, sirkulasi
udara dalam tanah lancar dan menjadikan akar semai bebas bergerak
menghisap unsur hara dari tanah.
f. Aktifator berbagai jenis enzim tanaman, merangsang pembentukan senyawa
lemak dan minyak, serta karbohidrat.
g. Membantu translokasi pati dan distribusi phospor didalam tubuh tanaman.
h. Unsur pembentuk warna daun (klorofil), sehingga tercipta hijau daun yang
2.6 Gejala Dan Dampak kekurangan Kalsium (CaO) dan Magnesium (MgO) 2.6.1 Gejala kekurangan Kalsium (CaO) dan Magnesium (MgO)
a. Pada tanaman penghasil biji-bijian akan menghasilkan biji lemah, keriput, dan
kempes tidak berisi.
b. Kuncup bunga dan buah busuk dan akhirnya akan gugur.
c. Matinya titik tumbuh pada pucuk dan akar tanaman.
d. Tepi daun muda mengalami klorosis lalu menjalar ketulang daun, kuncup
tanaman atau tunas muda mati.
e. Pada daun tua tampak bercak coklat, lalu menguning, mengering lalu mati.
2.6.2 Dampak dan kerugian kekurangan Kalsium dan Magnesium :
a. Kekurangan Kalsium dan Magnesium dalam tanah, menjadikan tanah bereaksi
masam, mengakibatkan unsur hara lain seperti Phospor dan Kalium terikat
sehingga tak terserap oleh tanaman dengan maksimal, pemupukan yang
diberikan kurang efektif dan tidak efisien. produktifitas tanaman menurun
rendah dengan mutu hasil kurang baik. secara ekonomis merugikan karena
pendapatan rendah.
b. Kekurangan Kalsium dan Magnesium akan menaikkan unsur Al (Aluminium),
Fe (zat besi), Mn (mangan), Zn (sen) dan Cu (tembaga), unsur tersebut dalam
jumlah berlebihan akan menjadi racun bagi tanah, mengganggu tanaman,
kolam dan tambak
Denutrisi pada tanaman mengakibatkan daya tahan tanaman terhadap serangan
demikian pula dengan udang, ikan dan rumput laut yang berada pada tanah yang
kekurangan Kalsium dan Magnesium.
(http://pupukdsp.com/pupuk-tanaman/unsur-hara-Kalsium-Magnesium.html)
2.7 Titrasi Kompleksometri 2.7.1 EDTA dan Complekson
Titrasi kompleksometri meliputi reaksi pembentukan ion-ion kompleks
ataupun pembentukan molekul netral yang terdisosiasi dalam larutan. Persyaratan
mendasar terbentuknya kompleks demikian adalah tingkat kelarutan tinggi. Contoh
dari kompleks tersebut adalah kompleks logam dengan EDTA. Demikian juga dengan
titrasi merkuro nitrat dan perak sianida juga dikenal sebagai titrasi kompleksometri.
EDTA dikenal dengan nama Versen, Complexon III, Sequesterene, Nulpon,
Trilon, dan sebagainya. Struktur EDTA adalah sebagai berikut :
HOOC – CH2 HOOC – CH2
N – CH2 – CH2 – N
HOOC – CH2 HOOC – CH2
Gambar 2.1 Struktur EDTA
EDTA adalah suatu ligan yang heksadentat (mempunyai enam buah atom donor
pasangan elektron), yaitu melalui kedua atom N dan keempat atom O (dari OH).
Dalam pembentukan kelat, keenam (tetapi kadang-kadang hanya lima) bersama-sama
mengikat satu ion inti dengan membentuk lima lingkaran kelat; molekul EDTA dilipat
mengelilingi ion logam sedemikian rupa sehingga keenam atom donor terletak pada
2.7.2 Indikator Metalokromat
Sebagian besar titrasi kompleksometri mempergunakan indikator yang
bertindak juga sebagai pengompleks dan tentu saja kompleks logamnya mempunyai
warna yang berbeda dengan pengompleksnya sendiri. Indikator demikian disebut
indikator metalokromat. Indikator jenis ini contohnya adalah; Eriochrome Black T,
Pyrotechol violet, Xylenol orange, Calmagit, Asam Salisilat, Zincon, Murexid, PAN
(1-2-Piridil Azonaftol), Metafalein, dan Calcein Blue. (Underwood,A.L.,1990)
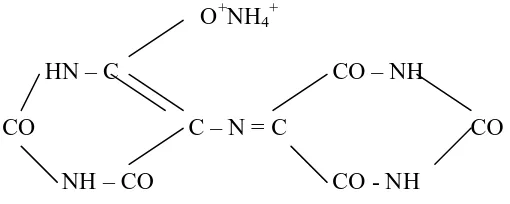
Struktur indikator Murexide dapat terlihat pada gambar berikut :
O+NH4+
HN – C CO – NH
CO C – N = C CO
NH – CO CO - NH
Gambar 2.2 Murexide (pH 6,0 – 13,0)
Titrasi substitusi kompleks juga dapat dilakukan, misalnya penambahan kompleks
Mg(EDTA)2 terhadap garam Ca2+, akan diperoleh Ca(EDTA)2 dan Mg2+ bebas, yang
kemudian dapat membentuk kompleks berwarna dengan EBT yang dititrasi dengan
titran EDTA. (Khopkar,S.M.1990)
2.7.3 Titrasi Kompleksometri untuk analisa ion Mg2+ dan Ca2+
Titrasi langsung dengan EDTA terhadap sedikitnya 25 kation dengan
menggunakan indikator metalokhromatik. Pereaksi pembentukan kompleks seperti
Buffer NH3 – NH4Cl dengan pH 9-10 sering digunakan untuk logam yang membentuk
kompleks dengan amoniak. (Khopkar,S.M.,1990)
Kesalahan total air, kalsium, dan magnesium dapat ditentukan dengan EDTA
dengan menggunakan Eriochrom Black T atau Calmagite. Seperti dikatakan
sebelumnya, kompleks antara Ca2+ dan indikatornya terlalu lemah untuk terjadinya
perubahan warna yang sesuai. Akan tetapi magnesium membentuk kompleks lebih
kuat dengan indikatornya daripada dengan kalsium dan suatu titik akhir yang cocok
diperoleh dengan buffer ammonium dengan pH 10. jika contoh yang dititrasi tidak
mengandung magnesium, beberapa garam magnesium dapat ditambahkan kepada
EDTA sebelum larutan ini distandarisasi. (Underwood,A.L.,1990)
2.7.4 Kelebihan Titrasi Kompleksometri
EDTA stabil, mudah larut dan menunjukkan komposisi kimiawi yang tertentu.
Selektivitas kompleks dapat diatur dengan pengendalian pH, misal Mg2+, Cr3+ Ca2+
dan Ba2+ dapat dititrasi dengan pH 11; Mn2+, Fe3+, Co2+, Ni2+, Zn2+, Cd2+, Al3+, Pb2+,
Cu2+, Ti dan V dapat dititrasi pada pH 1,0-4,0. EDTA sebagai garam natrium, Na2H2Y
sendiri merupakan standar primer sehingga tidak perlu standarisasi lebih lanjut.
Kompleks yang mudah larut dalam air ditemukan. Suatu titik ekuivalen segera
tercapai dalam titrasi demikian dan akhirnya titrasi kompleksomteri dapat digunakan
BAB 3
BAHAN DAN METODE
3.1 Penentuan MgO dan CaO dari Pupuk Kiserit dan Dolomit
Contoh didestruksi dengan HCl pekat. Kation (Mg dan Ca) dititrasi dengan
complexon III akan terikat membentuk kompleks yang stabil. Dengan adanya
penambahan indikator Eriochrom Black T, larutan akan berwarna anggur dan pada
saat semua kation Mg dan Ca telah terikat, maka warna berubah menjadi biru.
Perubahan warna ini merupakan titik akhir titrasi.
3.2 Peralatan
Labu ukur Pyrex
Hot plate
Buret
Pipet volume Pyrex
Erlenmeyer Pyrex
Statif dan klem
Neraca analitis Sortorius
3.3 Bahan-bahan
a. Pupuk Kiserit dan Dolomit
b. HCl(p)
c. Larutan Komplekson III (C10H14N2Na2O2.H2O)
3 gram Komplekson dilarutkan dengan 500 ml akuades lalu dipindahkan
d. Ammonium Buffer pH 10
67,5 gram NH4Cl dilarutkan dengan 200 ml akuades ditambahkan 570 ml
NH4OH lalu dipindahkan kedalam labu ukur 1 liter dan diencerkan dengan
akuades hingga tanda batas.
e. NaOH 4 N
80 gram NaOH dilarutkan dengan 200 ml akuades lalu dipindahkan kedalam
labu ukur 500 ml dan diencerkan dengan akuades hingga tanda batas.
f. Indikator Eriochrom Black T 1%
1 gram Eriochrom ditambah 99 gram NaCl kemudian diencerkan dengan
akuades dalam labu takar 100 ml
g. Indikator Murexid
1 gram murexid ditambah 99 gram NaCl kemudian diencerkan dengan akuades
dalam labu takar 100 ml
h. Akuades
3.4 Prosedur
3.4.1 Preparasi sampel
a. 1 gram sampel dimasukkan kedalam erlenmeyer ditambah 10 ml HCl(p)
b. Dipanaskan sampai mendidih
c. Ditambahkan 100 ml akuades dan dipanaskan kembali selama 30 menit
d. Diangkat dan didinginkan
e. Dipindahkan kedalam labu ukur 500 ml sambil dibilas dengan akuades dan
3.4.2 Analisa Kalsium Oksigen (CaO)
a. Dipipet 10 ml filtrat yang telah dipreparasi dan dimasukkan kedalam
erlenmeyer
b. Ditambahkan 50 ml akuades kemudian ditambahkan 10 ml NaOH 4 N lalu
ditambahkan Indikator Murexid
c. Dititrasi dengan larutan komplekson III sampai warna ungu.
Kadar CaO =
1000 W x F x Fp x a
x 100 %
Dimana :
Fp = Faktor pengencer
F = Faktor CaO
a = Volume pentiter pada analisis CaO
W = Berat sampel
3.4.3 Analisa Magnesium Oksigen (MgO)
a. Dipipet 10 ml filtrat yang telah dipreparasi dan dimasukkan kedalam
erlenmeyer
b. Ditambahkan 10 ml ammonium buffer dan ditambah indikator Eriochrom
Black T dan dititrasi dengan larutan komplekson III sampai berwarna biru.
Kadar MgO =
1000 W x
F x Fp x a) -(b
x 100 %
Dimana :
Fp = Faktor pengencer
F = Faktor MgO
BAB 4
HASIL DAN PEMBAHASAN
4.1. Data Hasil Analisa
4.1.1 Tabel Data Kadar Kalsium Oksigen (CaO) dan Magnesium Oksigen (MgO) dari Pupuk Dolomit
No.Lab Sampel (g) a (ml) b (ml) Kadar CaO (%) Kadar MgO (%)
468 1.0703 10,5 20,5 30,24 20,70
473 1,0705 12,45 21,8 35,84 19,35
592 1,0812 13,8 22,9 39,34 18,65
689 1,1072 11,65 22,5 32,43 21,71
766 1,0986 10,95 20,95 30,72 20,17
a. Perhitungan Kadar Kalsium Oksigen (CaO) Fp = Faktor Pengencer
F = Faktor CaO
a = Volume pentiter pada analisa CaO
W = Berat Sampel
% CaO =
1000 W x
F x Fp x a
x 100 %
= 1000 x 1,0703 0,6165 x 50 x 10,5
x 100 %
= 30,24 %
b. Perhitungan Magnesium Oksigen (MgO) Fp = Faktor pengencer
F = Faktor MgO
b = Volume pentiter pada analisis MgO
a = Volume pentiter pada analisis CaO
%MgO =
1000 W x
F x Fp x a) -(b
x 100 %
= 1000 x 1,0703 0,4432 x 50 x 10,5) -(20,5
x 100 %
= 20,70 %
Data selengkapnya pada tabel 4.1.1
4.1.2 Tabel Data Kadar Kalsium Oksigen (CaO) dan Magnesium Oksigen (MgO) dari Pupuk Kiserit
No. Lab Sampel (g) a (ml) b (ml) Kadar CaO (%) Kadar MgO (%)
462 1,1020 0,2 13,75 0,56 27,24
479 1,1022 0,3 13,7 0,83 27,14
584 1,1072 0,35 14,05 0,97 27,41
672 1,1026 0,2 14,25 0,55 28.23
763 1,1015 0,15 14,85 0,41 29,57
a. Perhitungan Kalsium Oksigen (CaO) Fp = Faktor pengencer
F = Faktor MgO
% CaO =
1000 W x
F x Fp x a
x 100 %
= 1000 x 1,1020 0,6165 x 50 x 0,2
x 100 %
= 0,56 %
Data selengkapnya pada tabel 4.1.2
b. Perhitungan Magnesium Oksigen (MgO) Fp = Faktor pengencer
F = Faktor MgO
b = Volume pentiter pada analisa MgO
a = Volume pentiter pada analisa CaO
%MgO =
1000 W x
F x Fp x a) -(b
x 100 %
= 1000 x 1,1020 0,4432 x 50 x 0,2) -(13,75
x 100 %
= 27,24 %
4.2 Pembahasan
Pemakaian pupuk adalah suatu hal yang sangat penting dalam seluruh kegiatan
yang berbasis tanaman. Pupuk digunakan untuk menyediakan dan meningkatkan
unsur-unsur hara yang terdapat di dalam tanah yang dibutuhkan oleh tanaman. Pupuk
juga dapat mengatur dan menjaga kondisi tanah. Salah satu jenis pupuk yang dapat
digunakan untuk mengatur dan menjaga keadaan tanah agar tidak asam adalah pupuk
Dolomit dan Kiserit. Pupuk dolomit dan kieserit memiliki fungsi yang sama dalam
tanah yaitu untuk menaikkan pH tanah. Perbedaannya terletak pada kelarutannya
dalam air, dimana dolomit memiliki kelarutan yang rendah sedangkan pupuk kieserite
memiliki kelarutan yang lebih cepat didalam air. Pupuk dolomit dan kiserit ditaburkan
ke tanah, atau yang lebih kita kenal dengan pengapuran, untuk meningkatkan pH
tanah dan juga untuk meningkatkan ketersediaan Ca2+ dan Mg2+.
Dengan meningkatkan ketersediaan Ca2+ dan Mg2+ dalam tanah akan
mengakibatkan ketersediaan Mn2+, Fe2+, Fe3+, Al3+ dan H+, yang dapat bersifat racun
bagi tanaman dapat ditekan. Selain itu pupuk ini juga dapat meningkatkan konsentrasi
P, Mo, dan SO42- yang terdapat dalam tanah, meningkatkan keefektifan tanaman untuk
menyerap NH4+ dan NO3-.
Analisis kadar CaO secara titrimetri dilakukan pada pH larutan yang berbeda.
Pada analisa CaO digunakan larutan NaOH 4N, yang bertujuan untuk membuat pH >
12 sedangkan pada analisa MgO digunakan larutan Buffer pH 10 + 0,1 yang
bertujuan untuk menjaga pH larutan pH tetap berada kisaran pH 10 + 0,1. Analisa
CaO dilakukan pada pH > 12, bertujuan untuk mengendapkan seluruh Mg2+ yang
dapat bereaksi dengan EDTA, dan indikator yang cocok pada pH ini adalah indikator
dipertahankan pada kisaran pH 10 + 0,1 dan indikator yang cocok dipergunakan pada
kisaran pH ini adalah indikator EBT.
Besar kadar CaO dan MgO yang diperoleh sesuai dengan ketentuan yang telah
ditetapkan oleh SNI 02 -2804-2005. sSNI kadar CaO dan MgO pada pupuk dolomit
adalah 40% dan 18-22 % sedangkan hasil yang kami peroleh 30,24 % dan 20,70 %.
SNI kadar CaO dan MgO pada pupuk kiserit adalah 27 % dan 0,95 % sedangkan hasil
yang diperoleh adalah 0,56 % dan 27,25 %
Ini menunjukkan pupuk bahwa pupuk ini sesuai dengan ketentuan SNI 02
-2804-2005. Kandungan CaO dan MgO pada pupuk dolomit sering tidak sesuai dengan
ketentuan SNI. Itu dapat terjadi karena batuan dolomit yang dipergunakan tidak baik.
Akan tetapi ketentuan SNI yang telah ditetapkan tidak selamanya dijadikan ukuran
bagi kualitas pupuk yang dihasilkan. Karena pupuk yang berasal dari batuan dolomit
yang berasal dari batuan dolomit pasti berguna bagi tanah walaupun kadar CaO dan
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil analisa yang telah dilakukan diperoleh kadar Kalsium Oksigen
(CaO) dan Magnesium Oksigen (MgO) yang sesuai dengan Standarisasi Nasional
Indonesia (SNI) 02 -2804-2005
5.2 Saran
Pupuk yang disimpan dalam jangka waktu selama 3 bulan hendaknya dilakukan
analisa ulang untuk mengetahui apakah kadar unsur hara yang terkandung masih
DAFTAR PUSTAKA
Engelstad, O.P. 1997. Teknologi Dan Penggunaan Pupuk. Edisi Ke tiga.
Yogyakarta: Gadjah Mada University Press.
Isnaini, M. 2006. Pertanian Organik. Cetakan Pertama. Yogyakarta: Penerbit Kreasi
Wacana.
http://pupukdsp.com/pupuk-tanaman/unsur-hara-Kalsium-Magnesium.html
Khopkar, S.M. 1990. Konsep Dasar Kimia Analitik. Jakarta: UI-Press.
Marsono. 2001. Pupuk Akar. Jakarta: Penebar Swadaya.
Novizan. 2002. Petunjuk Pemupukan Yang Efektif. Jakarta: Agromedia Pustaka.
Rosmarkam, E. 2002. Ilmu Kesuburan Tanah. Yogyakarta: Penerbit Kanisius.
Underwood, A.L. 1990. Analisa Kimia Kuantitatif. Edisi Ke empat. Jakarta: Erlangga.
Vogel. 1990. Buku Teks Analisis Anorganik Kualitatif Makro Dan Semi Mikro. Edisi
Lampiran.1 Pupuk Kiserit, Dolomit dan Dolomit-Lokal
Keterangan Kiserit Dolomit Dolomit-Lokal
Kadar MgO (%)
27 % 18-22% 2,9 – 37,7 %
Hara lain (%) 22 % S 40 % CaO 0,9 – 48 % CaO
0,95 % CaO - 0,04 – 4,21 % Fe2O3
35 – 45 % SiO2 Kelarutan
dalam air
Agak sukar sukar -
Reaksi Agak masam Basa -
Higroskopitas - - -
Kehalusan bervariasi > 95 % (mesh 100)
Bervariasi > 90 % (mesh 80)
-
Ketersediaan mudah mudah mudah
Dosis standar (kg/phn/thn)