UJI KEMAMPUAN KANDIDAT VAKSIN DNA
VIRAL
NERVOUS NECROSIS
DALAM MENGINDUKSI
ANTIBODI PADA IKAN KERAPU TIKUS
(Cromileptes altivelis)
WIWIEN MUKTI ANDRIYANI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
UJI KEMAMPUAN KANDIDAT VAKSIN DNA
VIRAL
NERVOUS NECROSIS
DALAM MENGINDUKSI
ANTIBODI PADA IKAN KERAPU TIKUS
(Cromileptes altivelis)
WIWIEN MUKTI ANDRIYANI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Mikrobiologi Medik
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul : ” UJI KEMAMPUAN KANDIDAT VAKSIN DNA VIRAL NERVOUS NECROSIS DALAM MENGINDUKSI ANTIBODI PADA IKAN KERAPU TIKUS (Cromileptes altivelis)” Adalah benar merupakan hasil karya saya dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2012
Wiwien Mukti Andriyani
ABSTRACT
WIWIEN MUKTI ANDRIYANI. B253100041.Capability Test of Viral Nervous Necrosis DNA Vaccine Candidate in Antibody Induction of Humpback Grouper
(Cromileptes altivelis). Advisors: SRI MURTINI, ALIMUDDIN, and
I WAYAN TEGUH WIBAWAN
Viral nervous necrosis (VNN) is one of the diseases that often infect grouper fish. Two DNA vaccines for VNN, namely pmBA-CP and pJfKer-CP have been constructed. The pmBA- CP construct is controlled by medaka β-actin
(mBA) promoter, while pJfKer-CP by Japanese flounder keratin (JfKer) promoter. This study was aimed to examine the antibody induction of coat protein (CP) DNA vaccinated humpback grouper (Cromileptes altivelis). The research was
divided into three steps, i.e. (1) analysis of the CP VNN using SDS-PAGE and Western blot methods, (2) analysis of CP mRNA expression using reverse transcriptase PCR (RT-PCR) method, and (3) analysis of anti VNN antibody induction of vaccinated fish using enzyme linked immunosorbent assay (ELISA) sandwich method, and VNN challenge test of vaccinated fish. The results of SDS-PAGE showed a specific protein of about 42 kDa from DNA vaccine-injected catfish embryos. By Western blot analysis using a polyclonal antibody produced in this study, the similar size of protein was also obtained in catfish embryos injected by DNA vaccine. This suggests that the polyclonal antibody anti VNN from rabbit immunization with VNN could recognize CP protein from DNA vaccine injected catfish embryos. In subsequent experiment, we used pmBA-CP DNA construct due to the result of CP protein from pmBA-CP injected catfish embryos was higher than that of pJfKer-CP. Humpback grouper juvenile was intramuscularly injected with pmBA-CP in a dose of 12.5 µg per fish, and RT-PCR analysis were performed to detect the present of CP mRNA in the fish muscle extracted at different time post vaccination. The results showed that CP mRNA expression was detected at 24 hours postvaccination. This means that mBA promoter could regulate the expression of CP gene in humpback grouper. Furthermore, the result of ELISA showed higher ratio of S/P using serum from pmBA-CP vaccinated fish than unvaccinated fish (control group) at 21 to 35 days postvaccination. This suggests that DNA vaccination is capable of inducing the antibody anti VNN in humpback grouper. Furthermore, the result of challenge test with VNN virus titer of 103,5 FID50/0,2 ml generated 60% relative percent survival. Thus, pmBA-CP DNA vaccination can be useful to improve the resistance of grouper fish against VNN infection, and support the increasing aquaculture production level.
Key Words: DNA Vaccine, Viral Nervous Necrosis, Humpback grouper,
RINGKASAN
WIWIEN MUKTI ANDRIYANI. B253100041. Uji Kemampuan Kandidat Vaksin DNA Viral Nervous Necrosis Dalam Menginduksi Antibodi Pada Ikan
Kerapu Tikus (Cromileptes altivelis), dibimbing oleh: SRI MURTINI,
ALIMUDDIN, dan I WAYAN TEGUH WIBAWAN
Viral Nervous Necrosis (VNN) merupakan salah satu penyakit yang sering
menyerang ikan kerapu. Infeksi virus VNN telah menyebabkan kematian masal lebih dari 34 spesies ikan laut. Ikan yang terinfeksi menunjukkan perilaku berenang abnormal ( memutar dan menabrak), mengapung dengan perut diatas disebabkan adanya pembengkakan gelembung renang (swim bladder), warna
tubuh lebih gelap, nafsu makan menurun dan lemah. Langkah awal vaksinasi DNA untuk mencegah infeksi virus VNN pada ikan kerapu, telah berhasil dibuat konstruksi vaksin DNA VNN dengan dua promoter berbeda, yaitu pMBA-CP dan pJfKer-CP. Konstruksi pMBA-CP dikendalikan oleh promotor medaka β-aktin
(mBA), sedangkan konstruksi pJfKer-CP dikendalikan promoter gen keratin ikan flounder Jepang (JfKer).
Penelitian ini bertujuan untuk menguji kemampuan vaksin protein kapsid (CP) DNA dalam menginduksi antibodi ikan kerapu tikus (Cromileptes altivelis).
Penelitian ini dibagi dalam tiga tahap, yaitu (1) deteksi ekspresi protein CP VNN menggunakan SDS-PAGE dan metode Western blot, (2) deteksi ekspresi mRNA
CP menggunakan metode reverse transcriptase PCR (RT-PCR), dan (3) deteksi
induksi antibodi anti VNN pada ikan yang divaksinasi menggunakan enzim linked immunosorbent assay (ELISA) metode sandwich, dan uji tantang ikan yang telah
divaksin dengan virus VNN.
rasio S / P yang lebih tinggi pada serum ikan yang divaksinasi dengan pMBA-CP dibandingkan dengan ikan tidak divaksinasi (kontrol) pada 21 sampai 35 hari pascavaksinasi. Hal ini menunjukkan bahwa vaksinasi DNA mampu menginduksi antibodi anti VNN pada kerapu tikus. Hasil uji tantang ikan yang divaksinasi pMBA-CP menggunakan titer virus VNN 103,5 FID50/0,2 ml menghasilkan kelangsungan hidup relatif 60%. Dengan demikian, pMBA-CP vaksinasi DNA dapat berguna untuk meningkatkan kekebalan ikan kerapu terhadap infeksi VNN, dan mendukung peningkatan produksi akuakultur
© Hak cipta milik Institut Pertanian Bogor, tahun 2012
Hak cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
HALAMAN PENGESAHAN
Judul Penelitian : Uji Kemampuan Kandidat Vaksin DNA Viral Nervous Necrosis Dalam Menginduksi Antibodi Pada Ikan Kerapu
Tikus (Cromileptes altivelis)
Nama : Wiwien Mukti Andriyani Nomor Pokok : B253100041
Disetujui: Komisi Pembimbing
Dr. drh. Sri Murtini, M.Si Ketua
Dr. Alimuddin, S.Pi, M.Sc Anggota
Prof. Dr. drh. I W.Teguh Wibawan, MS Anggota
Diketahui:
Ketua Program Studi Mikrobiologi Medik
Prof. Dr. drh. Fachriyan H Pasaribu
Tanggal Ujian
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, Msc.Agr
ii
RIWAYAT HIDUP
Penulis dilahirkan di Klaten pada tanggal 23 Maret 1971 dari ayah Sehono dan ibu Sulastri merupakan putri ketiga dari lima bersaudara.
Penulis menyelesaikan sekolah dasar di SDN I Delanggu dan Sekolah Menengah Tingkat Pertama di SMP Kanisius Hati Kudus Delanggu, Klaten. Tahun 1989 penulis lulus dari SMA Negeri 5 Semarang dan pada tahun yang sama lulus seleksi masuk program Diploma 3, Pendidikan dan Latihan Ahli Usaha Perikanan (Diklat AUP) Departemen Pertanian. Penulis memilih jurusan Akuakultur. Pendidikan sarjana ditempuh di Program studi Budidaya Perikanan, Fakultas Perikanan Universitas Brawijaya, lulus pada tahun 1997. Pada tahun 2010, penulis diterima di Program Studi Mikrobiologi Medik pada Sekolah Pascasarjana IPB. Beasiswa pendidikan pascasarjana diperoleh dari Kementerian Kelautan dan Perikanan Republik Indonesia.
Penulis bekerja sebagai Staf Balai Budidaya Air Payau Situbondo sejak tahun 1999 dan ditempatkan di Laboratorium Kesehatan ikan Dan Lingkungan. Bidang yang menjadi tanggung jawab penulis ialah pengendalian hama dan penyakit ikan (PHPI).
Untuk memenuhi salah satu syarat untuk memperoleh gelar Magister Sains IPB, penulis melakukan penelitian berjudul Uji Kemampuan Kandidat Vaksin DNA Viral Nervous Necrosis Dalam Menginduksi Antibodi Pada Ikan Kerapu
Tikus (Cromileptes altivelis) dibawah bimbingan Dr. drh. Sri Murtini, M.Si,
iii
iii
KATA PENGANTAR
Alhamdulillah, segala puji syukur saya panjatkan kehadirat Allah SWT atas segala karunia dan ridho-NYA, sehingga tesis dengan judul “Uji Kemampuan Kandidat Vaksin DNA Viral Nervous Necrosis Dalam Menginduksi Antibodi Pada Ikan Kerapu Tikus (Cromileptes altivelis)” ini
dapat diselesaikan.
Tesis ini disusun untuk memberikan informasi dasar yang berguna dalam aplikasi vaksin DNA untuk mencegah infeksi virus VNN pada ikan kerapu.
Pada kesempatan ini penulis menyampaikan rasa hormat dan ucapan terima kasih yang sebesar besarnya, kepada :
1. Ibu Dr. drh. Sri Murtini, M.Si., selaku Ketua Komisi Pembimbing. 2. Bapak Dr. Alimuddin, S.Pi, M.Sc., selaku Anggota Komisi Pembimbing. 3. Bapak Prof. Dr. drh. I W.Teguh Wibawan, MS., selaku Anggota Komisi
Pembimbing.
4. Bapak Prof. Dr. drh. Fachriyan H Pasaribu, selaku Penguji Luar Komisi dan Ketua Program Studi Pascasarjana Mikrobiologi Medik.
5. Bapak Ir. Dwi Soeharmanto, MM., selaku Kepala Balai Budidaya Air Payau Situbondo atas bantuan dan kemudahan selama pendidikan dan penelitian. 6. Ibu Gemi Triastutik, S.Pi, M.Si, Jasmadi, S.Pi, Jeni, S.Pi dari Laboratorium
Bioteknologi BBAP Situbondo, atas saran, bantuan dan kerjasama yang baik selama penelitian.
7. Ibu Ir. Yani Lestarai N. MP dan Bapak Bambang Hanggono S.Pi, M.Sc, seluruh staf Laboratorium Kesehatan Ikan dan Lingkungan BBAP Situbondo, atas bantuan dan kerjasama yang baik selama penelitian.
8. Bapak Sugeng H. S.Pi dan Didik Budi N. S.Pi, dan rekan-rekan di pembenihan ikan kerapu BBAP Situbondo, atas bantuan dan kerjasama yang baik selama penelitian.
iv 10.Bapak Dr. drh. Joko Pamungkas, M.Sc dan drh. Diah Iskandriati, Ph.D, dan staf Laboratorium Mikrobiologi PSSP, atas bantuan dan kerjasama yang baik selama penelitian.
11.drh. Christina Retno H., M.Si, dan staf Laboratorium Kesehatan ikan dan Lingkungan BPBAP Jepara, atas bantuan dan kerjasama yang baik selama penelitian.
12.Ana Octavera. S.Pi, M.Si, Bapak Ranta dari Laboratorium Fakultas Perikanan, atas bantuan dan kerjasama yang baik selama penelitian.
13.Selin dari Laboratorium Terpadu, Fakultas Kedokteran Hewan, atas bantuan dan kerjasama yang baik selama penelitian.
14.Ayahanda dan Ibunda serta seluruh keluarga atas segala doa dan kasih sayangnya.
15.Aminah dan rekan-rekan Mikrobiologi Medik, atas dukungan dan sarannya sehingga tesis ini dapat terselesaikan dengan baik.
16.Kepada semua pihak yang telah membantu yang tidak dapat penulis sebutkan satu persatu.
Setiap pekerjaan tidak luput dari kekurangan dan kesalahan. Oleh sebab itu, penulis mengharapkan kritik dan saran sebagai masukan bagi penulis untuk penelitian dan penulisan karya ilmiah di masa yang akan datang . Semoga karya ilmiah ini bermanfaat.
v
v
DAFTAR PUSTAKA
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
Manfaat ... 3
Hipotesis ... 3
TINJAUAN PUSTAKA ... 4
Ikan Kerapu Tikus ... 4
Viral Nervous Necrosis ... 5
Vaksin DNA ... 6
Sistem Kekebalan pada Ikan ... 7
Vaksinasi pada Ikan ... 8
Verifikasi Keberhasilan Vaksinasi pada Vaksin DNA ... 10
BAHAN DAN METODE ... 14
Waktu dan Tempat ... 15
Alur Kerja Penelitian ... 15
Prosedur Penelitian ... 16
Analisis Data ... 228
HASIL DAN PEMBAHASAN ... 25
Isolasi VNN dan Produksi Antibodi Poliklonal... 25
Perbanyakan Vaksin DNA ... 28
Ekspresi Protein CP dari Virus VNN ... 30
Vaksinasi dan Ekspresi mRNA CP... 34
Kemampuan Vaksin DNA CP Menginduksi Antibodi ... 36
vi
KESIMPULAN DAN SARAN ... 40
Kesimpulan ... 40
Saran ... 40
DAFTAR PUSTAKA ... 41
vii
vii
DAFTAR TABEL
Halaman 1. Rancangan vaksinasi dan waktu pengambilan sampel... ………25 2. Rancangan vaksinasi pada deteksi antibodi . ……….27 3. Rancangan uji tantang vaksin DNA VNN ... 27 4. Konsentrasi dan kemurnian DNA pMBA-PCV yang diisolasi
menggunakan kit dan metode konvensional ... .33 5. Konsentrasi protein dari embrio ikan lele setelah mikroinjeksi
dengan vaksin DNA VNN dengan konstruksi berbeda... 35 6. Rerata nilai rasio S/P antibodi serum ikan yang divaksin dengan
vaksin DNA VNN dan yang tidak divaksin ... 43 7. Kelangsungan hidup (SR) dan kelangsungan hidup relatif (RPS)
viii
DAFTAR GAMBAR
Halaman
1. Ikan kerapu tikus ... 4
2. Morfologi virus VNN ... 6
3. Skema produksi vaksin DNA ... 8
4. Jalur sitosolik membangkitkan respon kekebalan seluler ... 9
5. Jalur endositik membangkitkan respon kekebalan humoral ... 10
6. Alur kerja penelitian ... 20
7. Penapisan ikan kerapu tikus terinfeksi virus VNN menggunakan metode PCR ... 29
8. Analisis AGPT ... 31
9. Analisis AGPT serum pasca absorbs dengan filtrate ikan sehat ... 32
10.Verifikasi vaksin DNA pJfKer-PCV dan pMBA-PCV hasil isolasi menggunakan kit dan konvensional ... 34
11. Analisis SDS PAGE dan Western blot protein dari embrio ikan lele yang diinjeksi dengan vaksin DNA ... 36
12. Deteksi keberadaan pMBA-PVC dalam tubuh ikan yang telah diinjeksi dengan vaksin DNA ... 38
13. Deteksi ekspresi mRNA CP VNN dalam tubuh ikan yang telah diinjeksi dengan vaksin DNA ... 39
14. Deteksi ekspresi mRNA CP VNN dalam tubuh ikan yang telah diinjeksi dengan vaksin DNA ... 40
15. Prinsip ELISA sandwich untuk deteksi keberadaan antibodi anti VNN dalam serum ikan kerapu tikus ... 41
ix
ix
DAFTAR LAMPIRAN
PENDAHULUAN
Latar BelakangVaksinasi menggunakan vaksin DNA merupakan terobosan dalam teknik pengebalan untuk melindungi organisme (hewan/manusia) terhadap berbagai agen penyakit. Vaksinasi DNA dilakukan dengan cara memberikan DNA murni (naked DNA) dalam bentuk konstruksi gen untuk membangkitkan
respons kekebalan tubuh. Ekspresi protein antigen dari agen penyebab penyakit di dalam sel individu yang telah divaksinasi mampu merangsang sistem kekebalan tubuh sehingga timbul respons kekebalan humoral maupun seluler yang kuat, dan tahan lama. Beberapa penelitian menunjukkan bahwa vaksinasi menggunakan vaksin DNA efektif menghadapi infeksi virus dan bakteri pada berbagai penyakit seperti infectious hematopoietic necrosis virus (IHNV), viral hemorrhagic septicaemia (VHS) (Hansen et al. 1991; Anderson et al. 1996; Lorenzen et al.
1998; Corbeil et al. 1999; Anderson et al. 2000), Aeromonas veroni(Hernandez et al. 2005),dan Vibrio anguillarum(Rajeshkumar et al. 2007).
Penggunaan vaksin DNA mempunyai berbagai keuntungan, seperti bersifat generik dan sederhana, aman dan tidak menimbulkan resiko terinfeksi penyakit. Vaksin DNA juga memiliki kelebihan seperti halnya vaksin tradisional (killed vaccine) dan yang dilemahkan (attenuated vaccine). Vaksin DNA dapat
diberikan bersama ajuvan molekuler misalnya motif CpG, maupun dalam bentuk vaksin multivalen dengan mencampur beberapa vaksin DNA. Vaksin DNA dapat mengaktifkan sistem kekebalan humoral maupun seluler, memberikan proteksi yang baik bila diberikan pada stadia awal, proteksi dapat diinduksi dalam waktu singkat dan memberikan efek proteksi dalam jangka waktu lama. Teknologi vaksin DNA dapat menyediakan vaksin untuk patogen baru dalam waktu cepat dan biaya rendah. Produk murni vaksin DNA memiliki stabilitas yang tinggi, biaya produksi relatif murah dan mudah diproduksi (Lorenzen et al. 2005).
Viral Nervous Necrosis (VNN) merupakan salah satu virus penyebab
2
dengan diameter 25±30 nm, tidak beramplop, memiliki asam inti berupa RNA untai tunggal. Genom dari virus ini berbentuk ikosahedral yang terdiri dari dua utas RNA; RNA-1 berukuran 3,1 kb menyandikan RNA polimerase yang bertanggung jawab pada replikasi genom, dan RNA-2 berukuran 1,4 kb yang menyandikan protein kapsid (Mori et al. 1992; Comps et al. 1994; Chi et al. 2001;
Banu et al. 2004; Fenner et al. 2006). Genom RNA-2 ini menyandikan protein
yang diduga sebagai protein infektif dari virus VNN (Lin et al. 2007).
Balai Budidaya Air Payau (BBAP) Situbondo bekerjasama dengan Departemen Budidaya Perairan FPIK IPB telah berhasil membuat konstruksi vaksin DNA VNN. Vaksin DNA ini berupa konstruksi cDNA hasil reverse transcription dari RNA2 VNN. Sebagai langkah awal untuk mencegah infeksi
virus VNN pada ikan kerapu, telah dibuat 2 jenis konstruksi vaksin DNA dengan promoter berbeda (Nuraini et al. 2010). Kedua jenis promoter yang digunakan
yaitu promoter gen β-aktin ikan medaka Jepang/MBA (Takagi et al. 1994), dan
promoter gen keratin ikan flounder Jepang/JfKer (Yazawa et al. 2005). Gen
penyandi protein imunogenik VNN yang disambungkan dengan promoter tersebut adalah gen RNA2 (Lin et al. 2007). Vaksin yang telah dikonstruksi tersebut perlu
diketahui kemampuannya dalam menginduksi kekebalan tubuh inang yang divaksin, sehingga dapat dibuktikan kemampuan vaksin DNA VNN ini dalam melindungi ikan kerapu terhadap infeksi virus VNN.
Tujuan
Penelitian ini bertujuan untuk menguji kemampuan kandidat vaksin DNA VNN dalam menginduksi pembentukan antibodi pada ikan kerapu tikus.
Manfaat
Hipotesis
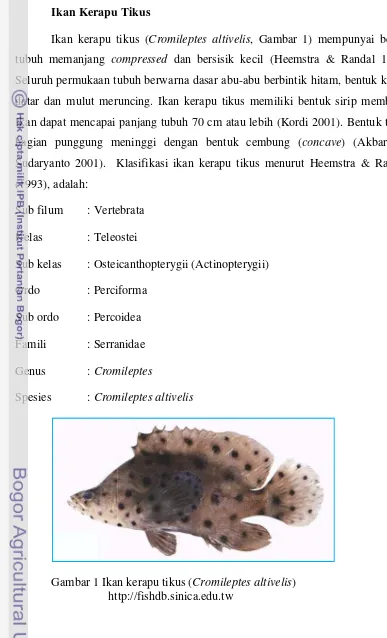
Ikan Kerapu T
Ikan kerapu t tubuh memanjang com
Seluruh permukaan tubu datar dan mulut merunc Ikan dapat mencapai bagian punggung m Sudaryanto 2001). K (1993), adalah:
Sub filum : Verte Kelas : Teleos Sub kelas : Osteic Ordo : Percif Sub ordo : Percoi Famili : Serrani Genus : Crom
Spesies : Crom
Gambar 1 Ikan htt
TINJAUAN PUSTAKA
apu Tikustikus (Cromileptes altivelis, Gambar 1) mem compressed dan bersisik kecil (Heemstra &
tubuh berwarna dasar abu-abu berbintik hitam eruncing. Ikan kerapu tikus memiliki bentuk pai panjang tubuh 70 cm atau lebih (Kordi 2001)
meninggi dengan bentuk cembung (concav
Klasifikasi ikan kerapu tikus menurut Heem
rtebrata leostei teicanthopterygii (Actinopterygii) rciforma rcoidea rranidae omileptes omileptes altivelis
kan kerapu tikus (Cromileptes altivelis)
http://fishdb.sinica.edu.tw
empunyai bentuk & Randal 1993). am, bentuk kepala uk sirip membulat. 2001). Bentuk tubuh
oncave) (Akbar dan
emstra & Randall
Ikan kerapu tikus dapat ditemukan di daerah lautan subtropika dan tropika. Species ini tinggal di daerah karang; karang mati atau karang berlumpur (Heemstra & Randall 1993). Ikan kerapu tikus muda hidup diperairan karang pada kedalaman 0,5-3 meter, dan saat dewasa menuju perairan yang lebih dalam (Tampubolon dan Mulyadi 1989).
Ikan kerapu tikus bersifat hermaprodit protogini, yaitu ikan berjenis kelamin betina pada periode perkembangan mencapai dewasa, dan berubah menjadi jantan saat ikan tumbuh menjadi lebih besar dan bertambah umurnya. Fenomena perubahan tersebut berhubungan erat dengan aktivitas pemijahan, umur, indeks kelamin dan ukuran (Antoro et al. 2004).
Ikan kerapu tikus merupakan salah satu ikan yang memiliki nilai ekonomis tinggi sebab memiliki nilai jual yang tinggi di pasaran dunia. Harga ikan kerapu tikus yang hidup mencapai 100 Dolar US/kg di pasaran China. Permintaan ikan kerapu hidup terus mengalami peningkatan terutama dari negara-negara Singapura, Jepang, Hong Kong, Taiwan, Malaysia dan Amerika Serikat. Dalam tiga dekade terakhir, industri budidaya kerapu berkembang pesat dan jumlah industi budidaya terus mengalami peningkatan di negara Timur Jauh, seperti negar-negara kawasan Asia Tenggara dan Taiwan. Kelemahan budidaya ikan kerapu intensif adalah timbulnya penyakit yang dipicu kondisi stres pada ikan. Permasalahan penyakit disebabkan oleh parasit, bakteri, dan virus pada ikan kerapu dapat menimbulkan kerugian besar bagi pembudidaya (Harikrishnan et al.
2011).
Viral Nervous Necrosis
Penyakit Viral Nervous Necrosis (VNN) atau viral encephalopathy and retinopahty (VER) disebabkan oleh infeksi virus dari genus Betanodavirus.
Infeksi virus VNN telah menyebabkan kematian masal lebih dari 34 spesies ikan laut. Virus ini umumnya menginfeksi ikan dari stadium larva hingga juvenil, meskipun kadang dapat menginfeksi stadium lebih tinggi (Munday et al. 2002;
6
Virus VNN digolongkan dalam genus Betanodavirus, famili Nodaviridae (Banu et al. 2004). Betanodavirus berbentuk ikosahedral, berdiameter 23-25 nm,
tidak beramplop, genomnya terdiri atas 2 untai ganda RNA sense positif. RNA1
berukuran besar (110 kDa) menyandikan RNA-dependent RNA polymerase/RdRp,
dan RNA2 ukuran kecil (40-42 kDa) menyandikan coat protein (Mori et al. 1992;
Comps et al. 1994; Chi et al. 2001; Fenner et al. 2006). Hasil analisis filogenetik
molekuler dan sekunsing nukleotida dari gen protein kapsid dan kesamaan dari RNA2, betanodavirus diklasifikasikan menjadi 4 genotipe: tipe striped jack nervous necrosis virus (SJNNV), tiger puffer nervous necrosis virus (TPNNV), barfin flounder nervous necrosis virus (BFNNV), dan redspotted grouper nervous necrosis virus (RGNNV) (Biacchessi 2011).
Gambar 2 Morfologi Viral Nervous Necrosis yang dideteksi dengan CryoEM (Tang et al. 2002).
Gambar 2 menunjukkan skema bentuk partikel virus VNN yang menginfeksi ikan kerapu jenis malabar diamati dengan cryo electron microscopy.
Penampang virus ditandai dengan warna yang kontras. Warna emas untuk tonjolan kapisd (~ 154-192 Å), warna hijau lapisan dalam kapsid (~ 112-154 Å), dan warna biru adalah RNA (<112 Å). Bentuk ikosahedral bersumbu simetri pada titik 5:3:2 (Tang et al. 2002).
disebabkan adanya pembengkakan gelembung renang (swim bladder), warna
tubuh lebih gelap, nafsu makan menurun dan lemah (Thie´ry et al. 2006). Infeksi
pada ikan umur 2-4 bulan menyebabkan ikan tampak diam/tidur di dasar jaring, sedangkan ikan di atas umur 4 bulan akan terlihat berenang mengambang di atas permukaan air disertai perbesaran gelembung renang (Koesharyani et al. 2006).
Ikan yang terinfeksi VNN memperlihatkan gangguan saraf berupa nekrosis sel dan vakuolisasi pada jaringan saraf pusat (spinal cord), dan retina. Vakuolisasi
pada stadium larva, awalnya terjadi pada tulang belakang, spina (sirip punggung), kerusakan gelembung renang, kemudian otak, dan retina ( Curtis et al. 2001;
Thie´ry et al. 2006).
Vaksin DNA
Vaksin pada ikan dikelompokkan menjadi tiga generasi. Generasi pertama merupakan vaksin konvensional yang terdiri dari jenis vaksin yang dimatikan (killed vaccine), dan vaksin hidup yang dilemahkan (live attenued vaccine).
Generasi kedua adalah vaksin protein rekombinan (recombinant protein vaccine)
dan generasi ketiga adalah vaksin DNA (Hirono 2005 dalam Nuryati 2010). Vaksin DNA mengandung satu atau lebih gen yang memberikan kode sebagian sifat antigenik core protein atau envelope protein suatu virus (Lorenzen et al.
2005).
Vaksin DNA memiliki berbagai kelebihan antara lain, bersifat generik dan sederhana, aman dan tidak menimbulkan resiko terinfeksi penyakit. Vaksin DNA juga memiliki kelebihan seperti halnya vaksin tradisional (killed vaccine)
dan yang dilemahkan (attenuated vaccine), yaitu dapat diberikan bersama ajuvan
memiliki stabilitas y diproduksi (Lorenzen
adjuvant dan boosting
kekebalan humoral da
Gambar 3. Ske (htt
s yang tinggi, biaya produksi relatif mura en et al. 2005). Penggunaan vaksin DNA tida boosting, ekspresi plasmid di sel somatik inang
dan selular (Zheng et al. 2006).
kema produksi vaksin DNA
http://www.pitt.edu/~super7/32011-33001/32171
8
urah dan mudah tidak memerlukan g memicu sistem
Tahap awal melakukan klona gen tertentu dari antigen ekspresi gen yang aka hewan dan menetap di sel (kromosom) (Gam secara langsung mens sintesis diekspresikan pada kondisi ketika Sistem kekebalan m intraseluler dan ekstr antigen eksogenus di membangkitkan respon dalam membangkitka Nuryati 2010). Skem ditunjukkan pada Gam
Gambar 4. Jalur (htt
l memproduksi vaksin DNA adalah mengi gen paling infektif dari patogen (Lorenzen et
en diklon ke plasmid bakteri dengan maksud akan diinsersikan pada sel hewan. Plasmid mas p di nukleus sebagai episom dan tidak berintegr ambar 3). DNA plasmid pada proses metabol ensintesis antigen yang dikodenya. Kode gene kan oleh sel pada lapisan permukaan sel hewan
ka sel terserang virus yang sebenarnya (Lorenz menggunakan dua jalur untuk menyingki kstraseluler. Antigen endogenus diproses di jal
diproses dijalur endositik. Jalur sitosolik be spons kekebalan seluler, sedangkan jalur endos tkan respons kekebalan humoral. (Rawat et
kema mekanisme kekebalan yang diinduksi ole ambar 4 dan 5.
alur sitosolik membangkitkan respons kekebala http://www.pitt.edu/~super7/32011-33001/32171
ngidentifikasi dan
et al. 2005). Gen
ksud meningkatkan asuk ke dalam sel egrasi dalam DNA abolik sel hewan genetik virus hasil an , seperti halnya nzen et al. 2005).
gkirkan antigen jalur sitosolik dan k berperan dalam endositik berperan
et al. 2007 dalam
oleh vaksin DNA
Gambar 5. Ja (htt
Jalur endositik membangkitkan respons keke http://www.pitt.edu/~super7/32011-33001/32171
10
Sistem Kekebalan pada Ikan
Ikan memiliki mekanisme pertahanan diri terhadap patogen, meskipun sistem kekebalan belum selengkap pada vertebrata tingkat tinggi, tetapi jauh lebih berkembang dibandingkan pada invertebrata (Irianto 2005). Sistem kekebalan pada ikan terdiri atas dua, yaitu kekebalan non spesifik (innate/alami), dan
spesifik (acquired/adaptif) yang berperan dalam perlindungan terhadap organisme
patogen dan parasit (Buchtikova et al. 2011). Kekebalan non spesifik meliputi
fisik dan kimiawi, sedangkan kekebalan spesifik, meliputi seluler (stimulasi limposit) dan humoral (immunoglobulin) (Bols et al. 2001dalam Buchtikova et al.
2011). Sebagian besar imunoglobulin pada ikan adalah IgM, saat ini telah dipelajari keberadaan IgD (Hirono dan Aoki 2003), IgZ, dan IgT pada ikan (Savana et al. 2005).
Sistem kekebalan alami ikan yang merupakan sistem pertahanan non spesifik, meliputi barrier mekanik dan kimiawi (mukus, kulit, sisik dan insang). Mukus sebagai pelindung fisik dan kimiawi pada ikan memiliki kemampuan menghambat kolonisasi mikroorganisme pada kulit, insang dan mukosa. Mukus ikan mengandung IgM alami serta lisozim, komplemen, protein komplemen dan protease yang mampu menghancurkan patogen yang menginvansi (Irianto 2005). Sistem kekebalan alami yang utama berupa sel-sel fagositik yang terdiri dari monosit/makrofag dan granulaosit. Monosit bersirkulasi dalam sistem peredaran darah, sedangkan makrofag terikat pada jaringan. Granulosit pada ikan mirip dengan mamalia tersusun atas neutrofil, eusonofil dan basofil, tetapi asidofil dan basofil jumlahnya rendah dan tidak bersirkulasi. Sel-sel fagosit mengenali dan menyingkirkan antigen melalui tiga tahapan, yaitu pelekatan, fagositosis dan digesti. Makrofag dan neutrofil yang teraktivasi akan menghasilkan suatu jenis oksigen dan nitrogen reaktif yang bersifat toksik terhadap bakteri dan parasit (Secombes 1996 dalam Irianto 2005).
Sistem komplemen ikan tersusun atas 30 unsur protein. Secara umum terdapat kemiripan jalur fungsi komplemen pada ikan dengan mamalia yaitu jalur klasik, alternative dan lektin (Buchtikova et al. 2011). Komplemen mempunyai
12
komplemen berperan dalam memproduksi faktor inflamasi, faktor kemotaksis, meningkatkan aktivitas fagositik serta merangsang opsonisasi (Tizard, 1988).
Sistem kekebalan dapatan berfungsi bila ada induksi oleh paparan patogen atau produk-produk yang berasal dari patogen. Tanggap kebal yang ditimbulkan oleh sel T disebut dengan cell mediated response dan sifat kekebalan yang
dihasilkannya tidak spesifik. Tanggap kebal yang dihasilkan oleh sel B disebut dengan humoral immunity dan kekebalannya bersifat spesifik (Tizard 1988).
Mekanisme pembentukan respons kebal dimulai adanya stimulasi patogen/antigen. Aktivasi antigenik terjadi melalui proses fagositosis makrofag yang merupakan pertahanan pertama yang akan menghancurkan antigen dan mengirimkan signal ke sel-sel limfosit. Sel limfosit berpoliferasi membentuk sel T (respons kebal seluler) dan sel B (respons kebal humoral). Sel T berasal dari kelenjar timus dan berperan mengatur kekebalan berperantara sel, sedangkan sel B diduga berasal dari ginjal dan berperan dalam pembentukan antibodi. Dan sirkulasinya (Fujaya 1999). Sel T akan membentuk efektor yang berperan dalam respons pertahanan yang diperantarai sel. Sel efektor berpartisipasi dalam eliminasi benda asing melalui proses fagositosis, sedangkan sel B akan membentuk antibodi dan sel memori terhadap patogen tersebut. Keberadaan sel memori akan mempercepat waktu pembentukan respons sekunder terhadap patogen yang sama (Lamers et al. 1985).
Ginjal ikan teleostei merupakan organ limpoid penting (organ yang memproduksi sel-sel kekebalan). Secara umun ginjal ikan terdiri dari 3 bagian, yaitu anterior, tengah, dan posterior (Irianto 2005). Letak ginjal ikan retroperitoneal di bawah tulang vertebrae. Bagian anterior berfungsi sebagai organ limfomyeloid dan merupakan lokasi yang memiliki hemapoietik tertinggi. Pada ginjal ditemukan adanya limposit mirip sel B dan T, hal ini yang menunjukkan peran ginjal sebagai jaringan limfoid dalam mekanisme pertahanan tubuh. Ginjal bagian posterior berfungsi sebagai organ ekskretori (Fergunson 1989 dalam Irianto 2005).
berdekatan dengan lambung, berwarna merah gelap, dan dibalut jaringan ikat. Pulpa putih banyak mengandung limfosit dan pulpa merah banyak mengandung eritrosit dan melano makrofag center (MMC) yang berperan penting dalam sistem
imun ikan (Irianto 2005; Lamers et al. 1985).
Vaksinasi pada Ikan
Vaksinasi pada ikan dapat dilakukan dengan berbagai metode, yaitu suntikan (injection), melalui pakan (oral), dan perendaman (immersion). Menurut
Ellis (1988) keuntungan vaksinasi menggunakan metode injeksi karena vaksin yang dimasukkan ke dalam tubuh ikan jumlahnya tepat sehingga efektivitasnya terjamin, namun tidak efisien diaplikasikan pada ikan berukuran kecil dan dalam jumlah banyak. Penggunaan metode perendaman tidak menimbulkan cekaman pada ikan, namun jumlah antigen yang dapat diserap oleh ikan tidak dapat dipastikan banyaknya. Vaksinasi melalui pakan dapat diterapkan untuk berbagai ukuran ikan serta tidak menyebabkan cekaman namun keterbatasannya adalah pakan yang dicampur vaksin belum tentu dimakan oleh ikan serta dosis yang diberikan harus tinggi.
Aplikasi pertama teknologi vaksin DNA dilaporkan Lapatra et al. (2001)
berupa vaksin DNA pada ikan salmon untuk menanggulangi IHNV (Infectious Hematopoietic Necrosis Virus) dan diperoleh hasil bahwa pembentukan antibodi
yang protektif dan netralisasi dapat diinduksi oleh plasmid gen glikoprotein (G) dari IHNV. Uji coba selanjutnya dilaporkan oleh Anderson pada penggunaan plasmid gen glikoprotein (G) dari IHNV untuk merangsang respons kebal pada benih ikan rainbow trout (Zheng et al. 2006) serta penggunaan vaksin DNA
secara perendaman maupun suntik untuk ikan rainbow trout ukuran 2-160 gram
(Corbeil et al. 1999).
Penelitian distribusi dan ekspresi vaksin DNA terhadap LCDV pada ikan
Japanese flounder (Paralichthys olivaceus) menunjukkan bahwa vaksin DNA
14
pemberian vaksin DNA pada ikan Japanese flounder telah berhasil mendeteksi
keberadaan antigen dan menimbulkan respons kekebalan tubuh ikan ( Zheng et al.
2006). Vaksin DNA gen glikoprotein untuk penyakit SVCV pada ikan koi di Amerika utara menghasilkan nilai RPS sebesar 50-88%. Penelitian ini membuktikan bahwa vaksin DNA terhadap penyakit SVCV dapat menginduksi antibodi yang bersifat spesifik dan protektif (Emmenegger dan Kurath 2008).
Verifikasi Keberhasilan Vaksinasi pada Vaksin DNA
1.1. Mikroinjeksi
Mikroinjeksi merupakan teknik transfer gen yang umum digunakan pada transgenesis (Kato et al. 2007). Transgenesis merupakan teknik rekayasa genetik
dengan cara mengintroduksi gen pengkode karakter unik yang dapat memberikan nilai tambah bagi organisme target (Alimuddin et al. 2009). Salah satu aplikasi
dari teknologi transgenesis adalah meningkatkan resistensi ikan terhadap serangan patogen atau penyakit, contohnya penyuntikan plasmid yang mengkode glikoprotein infectious hematopoetic necrosis virus (IHNV) menggunakan
promoter Cytomegalovirus (CMV) pada ikan salmon Atlantik, mampu menginduksi antibodi yang protektif secara signifikan setelah 8 minggu dan masih tetap tinggi antibodinya setelah 12 minggu berikutnya (Traxler et al. 1999
dalam Alimuddin et al. 2003); pengujian aktivitas promoter dengan cara
menginjeksikan konstruksi gen ke embrio dan kemudian mengamati ekspresi sementara (transient) dari gen penanda yang digunakan (Alimuddin et al. 2009);
serta studi yang terkait fungsi, proses dan pola ekspresi dari suatu konstruksi gen (Kinoshita dan Ozato 1995).
ikan dapat dipelihara dalam air tanpa suplemen karena untuk perkembangan embrio cukup mengandalkan nutrien dari kuning telur (Durham 2004).
1.2.Analisa Protein
1.2.1. Analisis SDS_PAGE
Protein merupakan molekul yang bersifat amfoter yang mengandung asam dan basa pada sekuen asam amino sehingga muatan protein akan bervariasi berdasarkan pHnya. Elektroforesis mampu memisahkan protein berdasarkan titik isoelektrik dan berat molekul (Hansson 2008). SDS-PAGE (sodium dodecyl sulfate-polyacrilamide gel electrophoresis) merupakan metode cepat dalam
identifikasi protein dan sering digunakan untuk memperkirakan berat molekul serta menentukan komposisi subunit dari suatu protein murni (Deutscher 1992).
Mekanisme kerja SDS-PAGE sama seperti pada elektroforesis, tetapi ditambahkan sodium dodecyl sulphate (SDS) sebelum dilakukan elektroforesis.
SDS merupakan bahan detergen anionik yang akan mendenaturasi protein dan melekat pada molekul yang diuraikan. Satu molekul SDS mampu mengikat dua asam amino. Selanjutnya molekul SDS menutupi permukaan protein dan membentuk muatan negatif dari gugus sulfat pada molekul SDS. Protein akan bermuatan negatif dengan berat jenis yang sama dan hanya dapat dipisahkan berdasar ukurannya (Hames 1998). Protein dengan berat molekul rendah akan bergerak lebih cepat di dalam gel. Berdasarkan prinsip tersebut berat molekul suatu protein dapat diperkirakan dengan memasukkan penanda protein standar yang sudah diketahui berat molekulnya dalam gel yang sama (Ahmed 2005).
Deteksi protein dalam gel dilakukan dengan berbagai macam pewarnaan seperti coomassie blue, silver nitrat, dan amido black (Ahmed 2005). Coomassie blue merupakan pewarna yang cepat dan sering digunakan untuk visualisasi
protein pada gel poliakrilamid (Ahmed 2005; Bonner 2007). Protein dapat terdeteksi oleh coomassie blue apabila konsentrasi sampel protein dalam gel
16
1.2.2. Western Blotting
Western blot merupakan teknik untuk mendeteksi makromolekul (protein spesifik) dari medium gel ke atas membran setelah proses elektroforesis (Sally et al. 1988 dalam Burgess 1995). Teknik ini mampu mendeteksi suatu protein dalam
kombinasinya dengan banyak protein lain, serta memberikan informasi ukuran dan ekspresi protein tersebut. Protein spesifik terdeteksi berdasarkan kemampuan protein tersebut berikatan dengan antibodi. Bloting elektroforesis merupakan teknik yang paling banyak digunakan untuk bloting protein dengan memisahkan protein berdasarkan ukuran polipeptida. Teknik ini cepat, efisiensi pemindahannya tinggi dan beberapa gel dapat dipindahkan dalam waktu yang sama (Towbin et al. 1979; Burnette 1981)
Mekanisme kerja Western blot meliputi proses pemindahan protein dari gel elektroforesis ke nitroselulosa, sehingga protein yang tercetak pada membran dapat dideteksi secara visual atau fluoresensi. Nitroselulose adalah filter yang paling umum digunakan untuk bloting, nitroselulosa lebih fleksibel daripada gel (Beisiegel 1986). Filter ini mempunyai kapasitas mengikat protein sebesar 80 µg/cm2 dan tersedia dengan ukuran pori dari 0,1; 0,2 dan 0,45 µm. Protein dilacak menggunakan antibodi spesifik terhadap protein target.
Deteksi ekspresi protein organisme dapat dilakukan dengan prinsip imunologi menggunakan antibodi primer dan antibodi sekunder yang sudah dikonjugasi dengan enzim. Antibodi terhadap protein yang menjadi tujuan penelitian digunakan sebagai detektor spesifik Penggunaan SDS pada elektroforesis berpengaruh terhadap integritas konfigurasi antigen, yang memungkinkan antibodi tidak mengenal antigen. Penghilangan SDS melalui pencucian dapat mengembalikan konfigurasi protein awal sehingga dapat dikenali oleh antibodi (Tsang et al. 1983).
1.3. ELISA (Enzyme-Linked Immunosorbent Assay)
ELISA digunakan untuk mengidentifikasi dan mengukur antibodi atau antigen. Prinsip dasar ELISA adalah mengukur interaksi antara antigen dengan antibodi menggunakan enzim sebagai indikatornya (Burgess 1995). Keberadaan antibodi menunjukkan adanya paparan antigen dalam tubuh inang yang diperiksa (Tizard 1988).
ELISA tidak langsung adalah konfigurasi sederhana yang digunakan untuk mengukur titer antibodi dan merupakan uji serologik yang cepat, sederhana dan relatif murah (Pardede dan Ginting 1996). Ikatan antigen dan antibodi pada ELISA tidak langsung ada dua macam, yaitu ikatan antigen-antibodi primer dan ikatan antibodi primer-antibodi sekunder. Ikatan antigen-antibodi primer bersifat spesifik, terjadi antara epitop antigen dengan paratop pada rantai Fab antibodi. Antibodi primer tidak berlabel dapat diperoleh dari serum hewan uji. Ikatan antibodi primer-antibodi sekunder bersifat non spesifik, artinya ikatan antara antibodi dan anti-antibodi dapat terjadi pada semua macam antibodi. Antibodi sekunder (konjugat) terikat pada enzim (berlabel enzim). Enzim dapat mengurai substrat yang ditambahkan sehingga terjadi perubahan warna larutan. Kekuatan warna tergantung dari banyaknya substrat yang terurai. Banyaknya substrat yang terurai tergantung dari banyaknya enzim dalam larutan. Kekuatan ini menunjukkan jumlah ikatan antigen-antibodi primer (Burgess 1995).
1.4. PCR (Polymerase Chain Reaction)
Reaksi berantai polimerase atau PCR (Polymerase Chain Reaction)
merupakan metode enzimatis untuk melipatgandakan secara eksponensial suatu sekuen nukleotida tertentu secara in vitro (Yuwono 2006). Terdapat empat
komponen utama pada proses PCR, yaitu (1) DNA cetakan, yaitu fragmen DNA yang akan dilipatgandakan, (2) oligonukleotida primer, yaitu suatu sekuen
18
Proses PCR memerlukan sejumlah siklus untuk mengamplifikasi suatu sekuen DNA spesifik. Setiap siklus terdiri atas tiga tahap, yaitu denaturasi,
annealing (hibridisasi), dan ekstensi (polimerasi). Denaturasi dilakukan pada suhu
90-95°C, sehingga terjadi pemisahan utas ganda DNA menjadi dua utas tunggal. DNA menjadi cetakan (template) tempat penempelan primer dan tempat kerja
DNA polimerase. Pada tahap annealing, suhu diturunkan sampai mencapai
kurang lebih 55°C atau sesuai melting temperature (Tm) dari primer
oligonukleotida untuk penempelan primer oligonukleotida pada sekuen yang komplementer pada molekul DNA cetakan (Glick & Pasternak 2003). Tahap selanjutnya adalah tahap ekstensi yang dilakukan pada suhu 72°C. Suhu ini merupakan suhu optimum untuk kerja enzim Taq DNA polimerase. Pada tahap ini
enzim Taq DNA polimerase mengkatalis reaksi penambahan mononukleotida
pada primer yang sesuai dengan utas DNA komplemen yang berada di sebelahnya (Erlich 1989).
Metode umum dalam penganalisaan produk reaksi PCR adalah elektroforesis gel agarosa yang bertujuan menganalisis komposisi dan kualitas dari sampel asam nukleat. Untuk itu diperlukan kalibrasi terhadap gel dengan penanda (marker) standar yang mengandung fragmen dari ukuran DNA yang
diketahui ukurannya (Dale dan Schantz 2002; Yuwono 2005). Pewarna etidium bromida dapat digunakan untuk menduga jumlah DNA (atau RNA) sampel hasil elektroforesis. Etidium bromida memiliki struktur cincin datar yang mampu menumpuk (stack) di antara basa-basa dalam asam nukleat; atau sebagai intercalation. Pewarna dapat dideteksi melalui pendaran spektrum merah-oranye,
BAHAN DAN METODE
Waktu dan TempatPenelitian dilaksanakan mulai bulan Desember 2011 – Juni 2012. Pengujian kemampuan vaksin menginduksi pembentukan antibodi pada ikan kerapu dilakukan Laboratorium Kesehatan Ikan dan Lingkungan dan Laboratorium Bioteknologi BBAP Situbondo. Pengujian pembentukan protein imunogenik CP pada ikan lele dilakukan di Laboratorium Genetika Balai Besar Pengembangan Budidaya Air Tawar (BBPBAT) Sukabumi. Pembuatan antibodi poliklonal, analisis Western blot, dan uji presipitasi pada gel agarosa dilakukan di Laboratorium Mikrobiologi Pusat Studi Satwa Primata (PSSP) dan Laboratorium Terpadu, Departemen Ilmu Penyakit Hewan dan Kesmavet, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
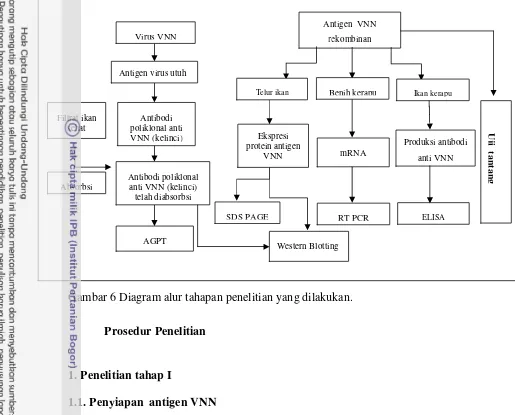
Alur Kerja Penelitian
Penelitian dibagi ke dalam 3 tahap. Alur kerja dan analisis penelitian ini di uraikan pada Gambar 2.
Penelitian tahap I
1. Penyiapan antigen VNN
2. Penyiapan plasmid rekombinan 3. Produksi antibodi poliklonal
4. Deteksi ekspresi protein CP (coat protein) dari virus VNN
Penelitian tahap II
1. Vaksinasi
2. Isolasi RNA total
3. Deteksi mRNA dengan metode RT PCR Penelitian tahap III
1. Deteksi kemampuan pembentukan antibodi vaksin DNA 2. Uji tantang dengan virus VNN
20
Gambar 6 Diagram alur tahapan penelitian yang dilakukan.
Prosedur Penelitian
1. Penelitian tahap I
1.1. Penyiapan antigen VNN
Virus VNN diperoleh dari ikan kerapu yang terinfeksi VNN, ikan-ikan kerapu tersebut diperoleh dari perairan Situbondo. Keberadaan virus VNN pada ikan kerapu diperiksa dengan metode PCR. Otak dan retina mata ikan kerapu yang terinfeksi VNN diambil menggunakan pinset steril. Sekitar 1 g organ otak/retina mata ikan dimasukkan ke dalam tube dan digerus menggunakan pellet pestle sampai halus dan ditambahkan bufer fosfat salin (PBS) sampai volume 1
mL (pengenceran 1:1). Suspensi dihomogenasi menggunakan vorteks dan selanjutnya disentrifugasi dengan kecepatan 3000 g selama 10-15 menit. Supernatan dipindahkan pada tube baru dan disentrifugasi kembali dengan kecepatan 27000 g selama 20-30 menit. Supernatan yang dihasilkan disaring menggunakan filter ukuran 0,22 µm. Filtrat yang dihasilkan dapat digunakan untuk reinfeksi atau disimpan pada -20oC hingga akan digunakan (OIE 2003). Absorbsi
Filtrat ikan sehat
RT PCR Antigen VNN
rekombinan ELISA Produksi antibodi anti VNN Western Blotting SDS PAGE AGPT Antibodi poliklonal anti
VNN (kelinci) Ekspresi
protein antigen VNN Telur ikan Antigen virus utuh
Virus VNN
Benih kerapu
Antibodi poliklonal anti VNN (kelinci)
1.2. Penyiapan plasmid rekombinan 1.2.1. Pembiakan bakteri rekombinan
Pembiakan bakteri yang memproduksi plasmid konstruksi vaksin DNA dilakukan dengan menginokulasikan 1 ose bakteri Escherichia coli DH5α pada
media 2xYT steril (16 g trypton, 10 g yeast extract, 5 g NaCl, 1000 mL akuades)
(Nuryati et al. 2010). Bakteri diinkubasi dan dikocok menggunakan shaker
dengan kecepatan 250 rpm selama 17-18 jam pada suhu 37ºC.
1.2.2. Isolasi Plasmid
Isolasi plasmid dilakukan sesuai protokol illustra plasmidPrep Mini Spin
Kit ,dari GE Healthcare. Bakteri diendapkan menggunakan sentifugasi dengan
kecepatan 16000 g selama 30 detik. Pelet bakteri diresuspensi dengan menambahkan lysis buffer tipe 7 sebanyak 175 µL, kemudian ke dalam suspensi
tersebut ditambahkan 175 µL lysis buffer tipe 8, dan 175 µL lysis buffer tipe 9,
serta dilakukan pencampuran secara perlahan. Suspensi tersebut selanjutnya disentrifugasi dengan kecepatan 16000 g selama 4 menit. Supernatan dipindahkan ke dalam plasmid mini column dan disentrifugasi pada 16000 g selama 30 detik,
dan cairan yang diperoleh dalam collection tube dibuang. Selanjutnya, ke dalam plasmid mini column ditambahkan 400 µL lysis buffer tipe 9, kemudian dikocok
dengan perlahan dan disentrifugasi kembali pada kecepatan 16000 g selama 30 detik, dan cairan yang tertampung pada collection tube dibuang. Bufer pencuci
tipe 1 selanjutnya ditambahkan sebanyak 400 µL dan disentrifugasi kembali pada 16000 g selama 1 menit. Cairan dalam collection tube dibuang beserta
tabungnya. Plasmid mini column dipindahkan ke tabung yang baru dan
ditambahkan 100 µL elution buffer tipe 4, kemudian didiamkan selama 30 detik
pada suhu ruang. Plasmid mini column kemudian disentrifugasi dengan kecepatan
22
1.2.3. Produksi antibodi poliklonal
Produksi antibodi poliklonal anti VNN dilakukan menggunakan 1 ekor kelinci New Zealand bobot 3 kg. Hewan coba diimunisasi dengan suspensi virus VNN. Pada imunisasi pertama dilakukan dengan dosis 33,5 µg/ kg bobot badan pada rute subcutan (SC) menggunakan suspensi virus yang diemulsi dalam Freund’s adjuvant complete. Pada minggu ke-4 dilakukan imunisasi kedua
mengunakan suspensi virus dan dosis yang sama, tetapi filtrat virus diemulsi dengan Freund’s adjuvant incomplete, selanjutnya pada minggu ke-7 kelinci
diimunisasi kembali. Dua minggu setelah imunisasi ketiga hewan coba diambil darahnya dari vena auricularis (telinga). Darah diinkubasi pada suhu ruang
selama 1 jam kemudian diinkubasi dalam suhu 4ºC selama semalam hingga tampak adanya serum dalam syringe. Serum dipisahkan dari bekuan darah dan diuji keberadaan antibodinya terhadap VNN dengan uji agar gel presipitasi (agar gel presipitation test/AGPT). Hasil uji AGPT dinyatakan positif terbentuk
antibodi bila ditemukan garis presipitasi antara sumuran antigen dengan serum yang diuji. Kelinci yang telah membentuk antibodi terhadap VNN selanjutnya akan diambil darahnya untuk dipanen serum sebanyak-banyaknya. Serum yang diperoleh selanjutnya akan diabsorbsi dengan supernatan dari suspensi mata dan otak ikan kerapu sehat (diuji dengan PCR tidak terinfeksi VNN) untuk menetralkan antibodi anti protein ikan yang mungkin terbentuk, karena suspensi antigen suspensi virus awalnya diperoleh dari suspensi ikan sakit.
1.2.4. Deteksi ekspresi protein CP dari virus VNN
a. Mikroinjeksi embrio ikan lele
Deteksi ekspresi protein CP dilakukan menggunakan embrio ikan lele dengan pertimbangan kemudahan dalam memperoleh induk ikan matang kelamin dan induksi ovulasi. Embrio ikan lele diperoleh melalui pemijahan buatan di BBPBAT Sukabumi. Plasmid konstruksi vaksin DNA diinjeksi menggunakan mikromanipulator ke telur ikan lele untuk memproduksi protein CP VNN. Mikroinjeksi dilakukan mengikuti metode Gusrina et al. (2009), Larutan plasmid
DNA murni yang akan diinjeksikan ke telur ikan lele masing-masing mengandung konstruksi plasmid pJfKer-PCV dan pmBA-PCV konsentrasi 50 ng/µL dengan pelarut 1 M KCl, dan selanjutnya larutan DNA sebanyak 10 µl dimasukkan ke dalam jarum mikroinjeksi dan kemudian dipasang pada mikromanipulator. Embrio ikan diatur dalam plate agarose (konsentrasi 2%) yang dibuat cekungan
pada bagian tengahnya, berfungsi sebagai tempat meletakkan telur dan memudahkan proses injeksi. Proses mikroinjeksi dilakukan di bawah mikroskop. Larutan DNA diinjeksikan ke dalam blastodisk embrio, fase pembelahan 1 sampai 2 sel.
b. Analisis ekspresi protein CP VNN
Ekspresi protein CP VNN dideteksi mengunakan metode SDS-PAGE dilanjutkan dengan Western Blotting.
b.1. Isolasi protein CP VNN
24
b.2. Deteksi protein CP VNN dengan metode SDS-PAGE
Protein CP VNN berdasarkan penelitian Lee et al. (2002), Huang et al.
(2007), Lin et al. (2007) berukuran sekitar 42 kDa. Keberadaan protein CP VNN
dideteksi menggunakan metode SDS-PAGE sesuai Laemmli (1970).
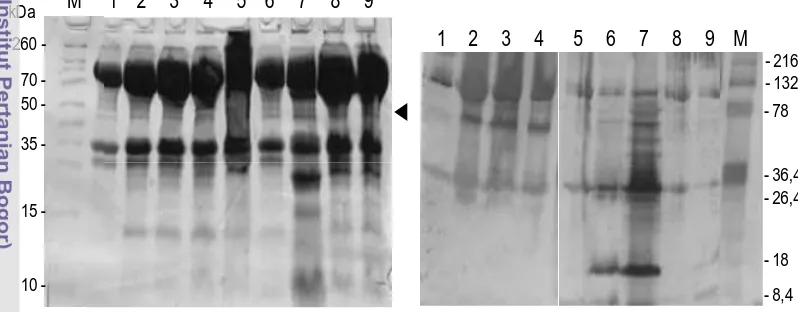
Sebanyak 20 µl sampel dengan konsentrasi 10 µg/mL dari masing-masing waktu pengambilan ditambahkan dengan 5 µL bufer sampel ditangas 95ºC selama 2 menit. Sampel yang telah ditangas dimasukkan ke dalam sumuran gel elektroforesis yang terdiri dari gel pengumpul (konsentrasi 4%) dan gel pemisah (konsentrasi 7,5%-17,5%). Gel dilarikan dalam alat elektoforesis pada arus tegangan 160 Volt selama 60 menit. Setelah elektroforesis berakhir, gel direndam dalam pewarna coomassie brilian blue R-250 selama 3 jam pada suhu ruang
sambil diagitasi perlahan. Pewarna yang tidak terikat pada protein dihilangkan dengan merendam gel pada larutan pemucat metanol 25% dan asam asetat 12% sampai gel berwarna bening dan pita-pita protein yang terbentuk terlihat jelas. Mobilitas relatif protein pada telur dihitung dengan membandingkan jarak migrasi protein, yaitu dihitung dari garis awal gel pemisah sampai dengan ujung protein dan dibandingkan dengan jarak migrasi protein penanda (marker). Tertranslasinya
protein CP VNN dilihat dari munculnya pita protein sebesar 42 kDa. b.3. Analisis Western blotting
Protein telur yang telah dielektroforesis dengan teknik SDS-PAGE selanjutnya dipindahkan ke membran nitroselulosa menggunakan Transblot
(Biorad). Membran nitroselulose diinkubasi dalam 5% larutan blocking selama 60
menit kemudian direndam dalam larutan serum kelinci anti VNN (pengenceran 1:50 (800 µL antibodi primer : 20 mL larutan blocking) serta diinkubasikan
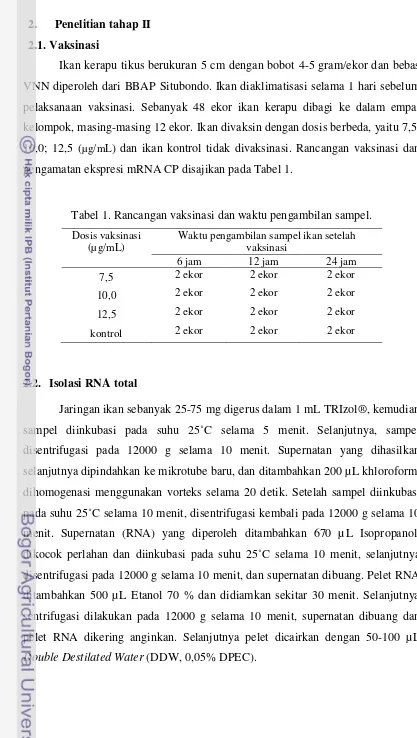
2. Penelitian tahap II 2.1. Vaksinasi
[image:42.595.90.507.68.806.2]Ikan kerapu tikus berukuran 5 cm dengan bobot 4-5 gram/ekor dan bebas VNN diperoleh dari BBAP Situbondo. Ikan diaklimatisasi selama 1 hari sebelum pelaksanaan vaksinasi. Sebanyak 48 ekor ikan kerapu dibagi ke dalam empat kelompok, masing-masing 12 ekor. Ikan divaksin dengan dosis berbeda, yaitu 7,5; 10,0; 12,5 (µg/mL) dan ikan kontrol tidak divaksinasi. Rancangan vaksinasi dan pengamatan ekspresi mRNA CP disajikan pada Tabel 1.
Tabel 1. Rancangan vaksinasi dan waktu pengambilan sampel.
Dosis vaksinasi
(µg/mL) Waktu pengambilan sampel ikan setelah vaksinasi
6 jam 12 jam 24 jam
7,5 2 ekor 2 ekor 2 ekor
10,0 2 ekor 2 ekor 2 ekor
12,5 2 ekor 2 ekor 2 ekor
kontrol 2 ekor 2 ekor 2 ekor
2.2. Isolasi RNA total
Jaringan ikan sebanyak 25-75 mg digerus dalam 1 mL TRIzol®, kemudian sampel diinkubasi pada suhu 25˚C selama 5 menit. Selanjutnya, sampel disentrifugasi pada 12000 g selama 10 menit. Supernatan yang dihasilkan selanjutnya dipindahkan ke mikrotube baru, dan ditambahkan 200 µL khloroform, dihomogenasi menggunakan vorteks selama 20 detik. Setelah sampel diinkubasi pada suhu 25˚C selama 10 menit, disentrifugasi kembali pada 12000 g selama 10 menit. Supernatan (RNA) yang diperoleh ditambahkan 670 µL Isopropanol, dikocok perlahan dan diinkubasi pada suhu 25˚C selama 10 menit, selanjutnya disentrifugasi pada 12000 g selama 10 menit, dan supernatan dibuang. Pelet RNA ditambahkan 500 µL Etanol 70 % dan didiamkan sekitar 30 menit. Selanjutnya sentrifugasi dilakukan pada 12000 g selama 10 menit, supernatan dibuang dan pelet RNA dikering anginkan. Selanjutnya pelet dicairkan dengan 50-100 µL
26
2.3. Deteksi mRNA dengan metode RT PCR
Deteksi mRNA dilakukan dengan Reverse Transkriptase PCR (RT-PCR)
menggunakan primer Foward 5′
-ATGGTACGCAAAGGTGAGAAGAAATTG-3′ dan Primer Reverse 5’-TTAGTTTTCCGAGTCAACCCTGGTGCAC-3’
pada ukuran fragmen DNA target PCR 1000 bp ( Nuraini et al. 2010). Deteksi
mRNA dilakukan pula dengan Primer Foward
5-CTGCTGTCTCCGATTTCACACAC-3 dan Primer Reverse
5-ATGTCTGGGACGTCCAACAATGG-3 dengan ukuran fragmen DNA target PCR 200 bp. Kontrol internal digunakan gen beta-aktin kerapu tikus dengan urutan basa Foward 5-ATGGTACGCAAAGGTGAGAAGAAATTG-3 dan Reverse 5-CTGGGAGATTCTCGACATACC-3. Konsentrasi primer yang digunakan adalah 10 pmol. Reaksi dan program PCR yang digunakan mengikuti metode Nuraini et al. (2010). Hasil PCR disparasi menggunakan elektroforesis
pada gel agarosa 1%. Berdasarkan pengamatan hasil deteksi mRNA ini selanjutnya dipilih dosis yang tepat untuk vaksinasi pada uji tahap III.
3. TAHAP III
3.1. Deteksi kemampuan pembentukan antibodi vaksin DNA
Rancangan vaksinasi dan pengamatan antibodi disajikan pada Tabel 2. Sebanyak 70 ekor ikan kerapu ukuran panjang 8-10 cm dibagi dalam dua kelompok, masing-masing 35 ekor. Kelompok pertama divaksinasi sesuai dosis hasil uji tahap II dan kelompok kedua tidak divaksinasi. Sebelum vaksinasi dan 1, 7, 14, 21, 28 dan 35 hari setelah vaksinasi, darah diambil dari masing-masing lima ekor ikan untuk diamati serumnya. Serum dari masing-masing kelompok diperiksa keberadaan antibodi anti VNN-nya dengan uji Enzyme Linked Imunnosorbent Assay (ELISA) sandwich. Sebagai kontrol negatif digunakan PBS,
S/P sampel = (Rerata absorbansi sampel)-(rerata absorbansi kontrol negatif) (Rerata absorbansi kontrol positif)-(rerata absorbansi kontrol negatif)
Tabel 2. Rancangan vaksinasi pada deteksi antibodi
Perlakuan Waktu pengambilan sampel darah (hari)
0 1 7 14 21 28 35
Vaksinasi 5 ekor 5 ekor 5 ekor 5 ekor 5 ekor 5 ekor 5 ekor
Non vaksinasi 5 ekor 5 ekor 5 ekor 5 ekor 5 ekor 5 ekor 5 ekor
3.2. Uji tantang vaksin DNA VNN
Rancangan vaksinasi dan pengamatan antibodi disajikan pada Tabel 4. Pengujian ini menggunakan ikan kerapu tikus ukuran 13-15 cm. Jumlah ikan yang digunakan berjumlah 50 ekor yang dibagi dalam 5 kelompok. Perlakuan vaksinasi menggunakan dosis terbaik pada tahap III. Ikan yang diuji tantang dicatat mortalitasnya setiap hari. Persentase mortalitas dihitung dari masing masing perlakuan vaksinasi dan dibandingkan dengan kontrol (Ellis 1988; Corbeil
et al.1999; Nuryati 2010). Perhitungan relative percent survival (RPS) dilakukan
dengan rumus:
RPS = (1 – (% mortalitas ikan perlakuan ke-n (Mn) ) X 100 % mortalitas ikan kontrol (Mo)
Tabel 3. Rancangan uji tantang vaksin DNA VNN
Perlakuan
ulangan
1 2
Kontrol negatif (non vaksinasi+non PBS) 5 ekor 5 ekor
Kontrol negatif (non vaksinasi+PBS) 5 ekor 5 ekor
Kontrol positif (non vaksinasi+VNN) 5 ekor 5 ekor
Vaksinasi 12,5µg/ekor (+PBS) 5 ekor 5 ekor
[image:44.595.123.479.579.751.2]28
Analisis Data
HASIL DAN PEMBAHASAN
Isolasi VNN dan Produksi Antibodi Poliklonal
Penelitian diawali dengan isolasi virus VNN pada ikan kerapu tikus yang terinfeksi VNN asal dari perairan Situbondo. Ciri khas ikan yang terinfeksi VNN menunjukkan warna tubuh yang lebih gelap, kehilangan keseimbangan, lemah dan kehilangan nafsu makan. Secara umum, gejala klinis ikan terinfeksi VNN menurut Munday et al. (1992) adanya lesi pada otak dan retina ikan, abnormalitas
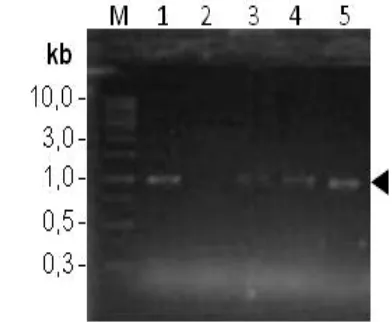
berenang (gerakan tanpa koordinasi), dan perubahan warna menjadi lebih gelap. Keberadaan virus VNN pada ikan dideteksi menggunakan PCR. Analisa PCR dari 4 sampel ikan kerapu tikus terdapat satu sampel (baris 1) yang terdeteksi VNN dengan tingkat serangan sedang. Produk PCR menunjukkan pita DNA pada 289 bp dan 479 bp sesuai standard kit IO2000 (Gambar 7). Standard positif 102
dengan jumlah 200 copi DNA menunjukkan sampel terinfeksi VNN tingkat serangan sedang dan ditandaidengan keberadaan pita di 289 bp dan atau 479 bp (Anonimous 2002).
Gambar 7. Penapisan ikan kerapu tikus terinfeksi virus VNN menggunakan metode PCR. (1) sampel positif VNN, (2, 3, dan 4) sampel negatif VNN, (5) kontrol positif, dan (6) kontrol negatif. (M) marker DNA.
Hasil isolasi virus dari retina mata dan otak ikan yang terinfeksi VNN diperoleh filtrat VNN sebanyak 1 mL dengan konsentrasi protein berkisar 298-371 µg/mL. Filtrat VNN tersebut memenuhi syarat sebagai antigen yang imunogenik berdasarkan Goidl et al. (1968) dan Harboe et al. (1973) bahwa Ab
⊳848 bp ⊳630 bp
⊳333 bp 479 bp
289 bp
30
poliklonal pada kelinci dapat diinduksi dengan penyuntikan antigen sebanyak 25-50 µg//kg bobot badan. Menurut Tizard (1988) Suatu senyawa dapat menginduksi antibodi ditentukan oleh sifat antigenisitasnya, antara lain limitasi fisikokimiawi (ukuran molekul yang besar, kompleksitas susunan kimiawi, keteruraian/kelarutan tinggi dalam tubuh, dapat digradasi oleh mikro dan makrofag) dan derajat keterasingannya tinggi.
Pada produksi antibodi poliklonal anti VNN, kelinci diimunisasi dengan suspensi virus VNN dosis 33,5 µg/ kg bobot badan sebanyak 3 kali dengan rute
subcutan (SC). Keberadaan antibodi terhadap VNN diuji dengan agar gel
presipitasi (agar gel presipitation test/AGPT). Pada hari ke-3 pasca imunisasi
ketiga, serum kelinci belum menunjukkan reaksi positif terhadap antigen VNN (Gambar 8A). Hal ini diduga karena konsentrasi antibodi dalam serum kelinci masih rendah. Menurut Tizard (1988) bahwa antibodi minimal dalam serum yang mampu dideteksi menggunakan uji AGPT adalah 30 µg/mL
Kelinci menunjukkan reaksi positif terbentuk antibodi setelah 1-2 minggu pasca imunisasi ketiga. Menurut Baratawidjaja (2006), imunisasi berulang dengan selang waktu tertentu dapat meningkatkan respon imun suatu individu. Tizard (1988) juga menyatakan bahwa penyuntikan antigen kedua (booster) akan dapat
meningkatkan antibodi. Setelah diberikan booster pertama.
Gambar 8. Analisi hari se vaksina
Serum kelinci poliklonal diperoleh suatu imunogen spesi multiple yaitu mampu berbeda pada antigen. R reaksi silang karena e yang secara struktur yang dikenali oleh ant antibodi poliklonal suspensi protein mata
Absorbsi dila Verifikasi ikan kerapu PCR. Netralisasi ser antara antibodi anti pr (1988) menjelaskan ba kombinasi reaktan da yang berupa aglutina padat dan cair bila potensial zeta atau menyebabkan partike
sis AGPT. (A) 3 hari setelah vaksinasi ketiga setelah vaksinasi ketiga, dan (C) 14 hari
inasi ketiga.
nci yang dihasilkan merupakan antibodi polikl h dengan cara melakukan imunisasi terhadap pesifik (Zola 1987). Antibodi poliklonal mempun
pu menangkap sejumlah epitop (antigen det
gen. Reaktivitas multiple antibodi poliklonal dapa na epitop yang sama dimiliki antigen yang berb
ur memiliki kemiripan dengan epitop dasar ( h antibodi (Smith 1995). Reaksi silang dari reakt
l dihilangkan dengan cara absobsi serum ata dan otak ikan kerapu sehat yang bebas infeks dilakukan untuk menetralkan antibodi terhada
rapu sehat yang bebas virus VNN dilakukan serum yang dilakukan merupakan reaksi serol nti protein ikan dengan partikel antigen (protei
n bahwa reaksi aglutinasi terjadi dalam dua n dan dilanjutkan fase agregasi kompleks antig inasi. Aglutinasi merupakan proses perlekatan la partikel-partikel tersebut saling bersentuha
u muatan negatif pada permukaan partikel ikel stabil dan aglutinasi tidak terjadi. Namun
tiga, (B) 7 ari setelah
poliklonal. Antibodi dap hewan dengan punyai reaktivitas
determinant) yang
dapat menimbulkan berbeda atau epitop r (priming epitop)
eaktivitas multiple kelinci dengan eksi VNN.
dari permukaan imono potensial zeta sehingga
Serum yang te nya dengan uji AGP menetralkan antibodi presipitasi pada uji s Roitt dan Delves (2001) sekunder sebagai aki kompleks antibodi-ant
Gambar 9. A ika
Perbanyakan
Perbanyakan b Nuryati et al. (2010)
manipulasi gen karena vector cloning karena kecil, sirkuler, yang b dan gen penanda seleks
copy yang tinggi (high c
Hasil kultur ba DNA diisolasi dar
imonoglobulin yang melapisi partikel pada ngga partikel menjadi rapat dan aglutinasi terjadi
telah diabsobsi kembali diuji keberadaan anti PT. Hasil uji menunjukkan bahwa perlakuan bodi anti VNN, hal ini terlihat dari tetap terbe
i serum terabsorbsi dengan antigen virus VN 2001) menjelaskan bahwa garis presipitasi m akibat interaksi primer antara antibodi dan a
antigen dipengaruhi konsentrasi relatif antibodi
. Analisis AGPT serum pasca absorbsi denga ikan sehat
an vaksin DNA
n bakteri Escherichia coli DH5α dilakukan m
2010). Bakteri E. coli umum digunakan da
rena jumlah dan ragam vectornya tinggi. Keun ena Plasmid E. coli merupakan DNA ekstrak
bereplikasi secara independen, mempunyai s leksi. Plasmid E. coli merupakan jenis plasmid high copy number) (Brown 1986)
ur bakteri E. coli mencapai 2,9-3,1x109 sel/mL.
dari bakteri menggunakan dua metode
32
dat menetralisasi jadi.
ntibodi anti VNN-kuan absorbsi tidak
terbentuknya garis NN (Gambar 9). merupakan reaksi n antigen. Ukuran bodi dan antigen.
ngan filtrat
n menurut metode dalam percobaan eunggulan sebagai rakromosom yang i situs penyisipan, id dengan jumlah
menggunakan kit illustra plasmidPrep Mini Spin (GE Healthcare), dan metode
konvensional (Sambrook et al. 2001). Hasil isolasi plasmid menggunakan metode
konvensional (72 µg/mL kultur) lebih tinggi dibanding menggunakan kit (6
µg/mL kultur). Pada pengukuran kualitas dan kuantitas DNA plasmid menggunakan genquant pada panjang gelombang 260 nm menunjukkan bahwa
konsentrasi DNA menggunakan metode konvensional (120,6 µg/mL) lebih tinggi dibandingkan menggunakan kit (1,3 µg/mL). Tingkat kemurnian DNA plasmid hasil isolasi menggunakan metode konvensional juga lebih tinggi daripada dengan kit (Tabel 4).
Tabel 4. Konsentrasi dan kemurnian vaksin DNA pmBA-PCV yang diisolasi menggunakan kit dan metode konvensional
Rendahnya konsentrasi DNA yang dihasilkan kit disebabkan karena kit mempunyai batasan maksimum dalam mengisolasi plasmid meskipun volume kultur bakteri dalam jumlah banyak. Satu kolom kit tidak dapat mengisolasi plasmit lebih dari kapasitasnya. Batasan maksimum dari kit illustra plasmidPrep Mini Spin yaitu 9 µg plasmit dalam 1,5 mL kultur bakteri, sedangkan
menggunakan metode konvensional dapat disesuaikan dengan banyaknya kultur bakteri pembawa plasmid yang akan diisolasi. Berdasarkan hasil penelitian tersebut, diperoleh efisiensi produksi vaksin DNA VNN. Dengan demikian metode konvensional berpotensi besar untuk digunakan dalam penyediaan vaksin DNA.
Keberadaan vaksin DNA selanjutnya dikonfirmasi menggunakan metode PCR. Verifikasi dilakukan untuk memastikan bahwa hasil isolasi masih tetap mengandung vaksin DNA VNN. Hasil pemisahan produk PCR dengan elektroforesis pada gel agarosa 1% menunjukkan munculnya pita dengan ukuran sekitar 1 kb pada semua plasmid hasil isolasi (Gambar 10). Ini membuktikan
Metode Konsentrasi (µg/mL)
Kemurnian
(%)
Kit 1,3 76
34
bahwa masing-masing plasmid dari kedua konstruksi vaksin tersebut mengandung DNA VNN.
Gambar 10. Verifikasi vaksin DNA pJfKer-PCV dan pMBA-PCV hasil isolasi menggunakan kit dan konvensional. (M) marker DNA, (1) kontrol negatif, (2) plamid pJfKer-PCV isolasi dengan kit, (3) plamid pJfKer-pJfKer-PCV isolasi dengan konvensional, (4) plamid pmBA-PCV isolasi dengan kit, (5) plamid pmBA-PCV isolasi dengan konvensional, dan (7) kontrol negatif. Tanda kepala panah menunjukkan posisi fragmen DNA VNN.
Ekspresi protein PCV dari virus VNN
Metode mikroinjeksi digunakan untuk mentransfer plasmid DNA VNN pada embrio ikan lele. Menurut Hackett (1993) metode mikroinjeksi adalah teknik transfer gen yang paling sering digunakan pada ikan. Sesuai Gusrina et al.
(2009) gen asing dimasukkan ke dalam embrio ikan dengan menggunakan injektor berdiameter sangat kecil (5-7 µm). Larutan plasmid DNA VNN diinjeksikan ke telur ikan lele sebanyak 10µL dan masing-masing mengandung konstruksi plasmid pJfKer-PCV dan pmBA-PCV konsentrasi 50 ng/µL. Larutan DNA diinjeksikan satu persatu pada telur lele yang telah dibuahi untuk memastikan DNA masuk kedalam sel. Injeksi DNA dilakukan ke dalam blastodisk embrio ikan lele pada fase 1 atau 2 sel karena pada saat sel membelah, maka semua sel turunannya akan membawa gen tersebut.
Pada setiap jam koleksi diambil 30 embrio ikan lele yang telah diinjeksi plasmid pJfKer-CP dan pMBA-CP. Embrio ikan lele selanjutnya diestraksi dan
10,0
6,0
3,0
1,0
0,5
0,3
-kb
M 1 2 3 4 5 6 M
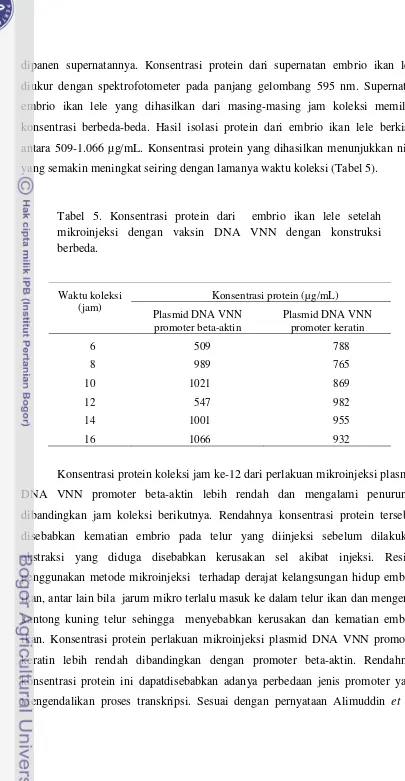
[image:51.595.167.419.140.289.2]dipanen supernatannya. Konsentrasi protein dari supernatan embrio ikan lele diukur dengan spektrofotometer pada panjang gelombang 595 nm. Supernatan embrio ikan lele yang dihasilkan dari masing-masing jam koleksi memiliki konsentrasi berbeda-beda. Hasil isolasi protein dari embrio ikan lele berkisar antara 509-1.066 µg/mL. Konsentrasi protein yang dihasilkan menunjukkan nilai yang semakin meningkat seiring dengan lamanya waktu koleksi (Tabel 5).
Tabel 5. Konsentrasi protein dari embrio ikan lele setelah mikroinjeksi dengan vaksin DNA VNN dengan konstruksi berbeda.
Waktu koleksi
(jam) Plasmid DNA VNN