EVALUASI PEMBERIAN PROBIOTIK MULTISPESIES
MELALUI MEDIA BUDI DAYA IKAN LELE DUMBO (
Clarias
gariepinus
) UNTUK PENCEGAHAN PENYAKIT
MOTILE
AEROMONADS SEPTICEMIA
HILMA PUTRI FIDYANDINI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Evaluasi pemberian probiotik multispesies melalui media budi daya ikan lele dumbo (Clarias gariepinus) untuk pencegahan penyakit Motile Aeromonads Septicemia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Hilma Putri Fidyandini
RINGKASAN
HILMA PUTRI FIDYANDINI. Evaluasi pemberian probiotik multispesies melalui media budi daya ikan lele dumbo (Clarias gariepinus) untuk pencegahan penyakit Motile Aeromonads Septicemia. Dibimbing oleh MUNTI YUHANA dan ANGELA MARIANA LUSIASTUTI.
Salah satu penyakit yang sering menyebabkan kematian ikan lele dumbo dan menyebabkan kegagalan panen adalah penyakit MAS (Motile Aeromonads Septicemia) yang disebabkan oleh infeksi bakteri Aeromonas hydrophila. Untuk mengatasi situasi ini perlu dilakukan upaya pencegahan dan pengendalian penyakit. Salah satu cara yang aman dan ramah lingkungan untuk mengontrol penyakit di lingkungan budi daya dan dapat diterima di akuakultur adalah dengan menggunakan prob iotik melalui media pemeliharaan. Pemberian bakteri probiotik ke dalam media pemeliharaan bertujuan untuk meningkatkan kesehatan ikan sebagai inang dengan cara menekan populasi bakteri patogen, meningkatkan kualitas perairan atau membantu mendegradasi limbah organik. Efektifitas probiotik dipengaruhi oleh komposisi probiotik dan konsentrasi yang digunakan.
Penelitian ini telah dilaksanakan pada bulan September 2014 sampai Januari 2015 di Instalasi Penelitian dan Pengembangan Pengendalian Penyakit Ikan (IP4I), Balai Penelitian dan Pengembangan Budidaya Air Tawar (BPPBAT), Depok. Penelitian ini terdiri dari 3 tahap yaitu: penyiapan kultur sel probiotik dan patogen, uji in vitro (pemberian penanda resistensi antibiotik dan uji kultur bersama) dan uji in vivo. Parameter yang diamati selama penelitian adalah tingkat kelangsungan hidup, laju pertumbuhan spesifik, rasio konversi pakan, kadar hematokrit, diferensial leukosit, respiratory burst activity, aktivitas lisozim, monitoring populasi sel bakteri dan kualitas air. Penelitian terdiri dari 6 perlakuan dengan 3 ulangan yaitu (A) penambahan bakteri dalam media dengan komposisi AH26 NAR 103 CFU/mL, probiotik ND2 CefR 105 CFU/mL dan P23 CipR 105 CFU/mL ; (B) penambahan bakteri dalam media dengan komposisi AH26 NAR 103 CFU/mL, probiotik ND2 CefR 103 CFU/mL dan L1k TetR 103 CFU/mL; (C) penambahan bakteri dalam media dengan komposisi AH26 NAR 103 CFU/mL, probiotik P23 CipR 104 CFU/mL dan L1k TetR 104 CFU/mL; (D) penambahan bakteri dalam media dengan komposisi AH26 NAR103 CFU/mL, probiotik, ND2 CefR 105 CFU/mL, P23 CipR 105 CFU/mL dan L1k TetR 105 CFU/mL; (K+) penambahan AH26 NAR 103 CFU/mL dalam media dan tanpa penambahan probiotik sebagai kontrol positif; (K-) tanpa penambahan probiotik dan tanpa AH26 NARpada media sebagai kontrol negatif.
Hasil penelitian menunjukkan kombinasi antara probiotik ND2 CefR 103 CFU/mL dan L1k TetR 103 CFU/mL dapat menekan pertumbuhan A.
masing-masing 103 CFU/mL dapat menekan populasi sel A. hydrophila sampai 40% dibandingkan kontrol positif dan dapat meningkatkan kelangsungan hidup, laju pertumbuhan spesifik, respons imun dan menurunkan rasio konversi pakan ikan lele dumbo.
SUMMARY
HILMA PUTRI FIDYANDINI. Evaluation of Multispecies Probiotics Addition in the Culture Medium of African Catfish (Clarias gariepinus) to Prevent the Motile Aeromonads Septicemia Disease. Supervised by MUNTI YUHANA and ANGELA MARIANA LUSIASTUTI.
One of infections disease that often led the mortality of catfish and resulted in harvest failure is MAS (Motile Aeromonads Septicemia) disease caused by the infection of Aeromonas hydrophila. To avoid this disease, the prevention and control is very crucial. An environmentally friendly approach acceptable in aquaculture is the use of probiotics. By giving probiotic bacterium in the culture medium is to increase the host fish health by reducing the population of pathogenic, improving water quality or helping the degrade of organic waste. The effectiveness of probiotics application is influenced by probiotic compositions and concentrations.
This research was conducted from September 2014 up to January 2015 in Research Installation for Fish Health Control, Research and Development of Freshwater Aquaculture, Depok.This research consisted of three steps: preparation of probiotic cell culture and pathogenic strain , in vitro test ( giving the antibiotic resistance marker and co-culture) and in vivo tests. The parameters observed during this research were survival rate, specific growth rate, feed conversion ratio, the level of hematocrit, differential leukocyte, respiratory burst activity, lysozyme activity, monitoring of bacterial cell populations and water quality. This research was consisted of 6 treatments with 3 replications, namely (A) addition of bacteria in the medium with a composition of AH26 NAR 103 CFU/mL, probiotics ND2 CefR 105 CFU/mL and P23 CipR 105 CFU/mL; (B) addition of bacteria in the medium with the composition of AH26 NAR 103 CFU/mL, probiotics ND2 CefR 103 CFU/mL and L1k TetR 103CFU / mL; (C) addition of bacteria in the medium with the composition of AH26 NAR 103 CFU/mL, probiotics P23 CipR 104 CFU/mL and L1k TetR 104 CFU/mL; (D) addition of bacteria in the medium with the composition of AH26 NAR 103 CFU/mL, probiotics, ND2 CefR 105 CFU/mL, P23 CipR 105 CFU/mL and L1k TetR 105 CFU/mL; (K +) addition of AH26 NAR 103 CFU/mL in media and without the addition of probiotics as positive control; (K-) Without the addition of probiotics and without AH26 NAR in the media as negative control.
The results showed that the combination between probiotics ND2 CefR 103 CFU/mL and L1k TetR 103 CFU/mL can supressed the growth of A.hydrophila up to 40% and improved the immune response (hematocrit level, differential leukocyte, respiratory burst activity and lysozyme activity). The combination treatment also showed the highests survival rate was 89,33±4,62%, the specific growth rate was 1,75±0,08% and the lowest feed conversion ratio was 1,33±0,1. By giving multispecies probiotic with combination probiotic of Bacillus subtilis
positive control and increased the survival rate, specific growth rate, immune response and decreased feed conversion ratio of catfish.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
EVALUASI PEMBERIAN PROBIOTIK MULTISPESIES
MELALUI MEDIA BUDI DAYA IKAN LELE DUMBO (
Clarias
gariepinus
) UNTUK PENCEGAHAN PENYAKIT
MOTILE
AEROMONADS SEPTICEMIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah dengan judul Evaluasi Pemberian Probiotik Multispesies melalui Media Budi Daya Ikan Lele Dumbo (Clarias gariepinus) untuk Pencegahan Penyakit Motile Aeromonads Septicemia dapat diselesaikan dengan baik. Ucapan terimakasih diberikan kepada :
1. Dr Munti Yuhana, SPi MSi dan Dr Drh Angela Mariana Lusiastuti, MSi selaku pembimbing atas waktu, kesabaran, kebijaksanaan, serta bimbingan dan arahan yang selalu diberikan hingga tesis ini dapat diselesaikan.
2. Dr Sri Nuryati, SPi MSi selaku penguji luar komisi yang telah memberikan saran dan masukan untuk kesempurnaan tesis ini.
3. Dr Ir Mia Setiawati, MSi sebagai Komisi Program Studi Ilmu Akuakultur yang telah banyak memberikan bantuan selama menempuh pendidikan di Institut Pertanian Bogor.
4. Seluruh jajaran pimpinan, peneliti, teknisi, administrasi dan rekan-rekan di IP4I Balai Penelitian dan Pengembangan Budidaya Air Tawar Bogor atas segala bantuan dan fasilitas yang diberikan.
5. Direktorat Jendral Pendidikan Tinggi yang telah memberikan Beasiswa selama mengikuti pendidikan S2.
6. Balai Penelitian dan Pengembangan Budidaya Air Tawar Bogor yang telah memberikan dana penelitian.
7. Ayahanda Syaiful Anam, SKM dan Ibunda Siti Aminah, SPd MPd Bapak Mertua Yoyon Sumaryono, SPd dan Ibu Mertua Anik Rohmawati, SP yang telah memberikan cinta dan kasih sayang, doa serta semangat yang tak pernah henti. Kakak dan adik Yufrida Khairani, AmdKeb, Vidi Ardianto, Isma Dewi Nurrosyidah, keponakan Dastan Kenzie Atharizz Rashdan serta seluruh keluarga besar yang selalu memberikan do`a, dukungan dan semangat.
8. Suami drg Alif Chandra Aryono atas kasih sayang, pengertian, dukungan, kesabaran, pengorbanan, dan doa yang diberikan. Sumber inspirasi dan semangat Athaya Nafeeza Alfidyandra yang selalu menemani selama studi.
9. Teman-teman Akuakultur 2012 (Faisal), Akuakultur 2013 (Putri, Dwi, Mbak Novi, Kurnia, Andre, Wildan dan Fazril) yang selalu membantu selama di Bogor.
10.Semua pihak yang tidak dapat disebut satu persatu yang telah memberikan segala doa dan bantuan baik moril maupun materil.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
2 METODE 3
Waktu dan Tempat Penelitian 3
Prosedur Penelitian 3
Penyiapan Kultur Sel Probiotik dan Patogen 3
Pemberian Penanda Resistensi Antibitik 3
Uji Kultur Bersama 4
Uji In vivo 5
Desain Penelitian 5
Parameter Uji 5
Analisis Data 8
3 HASIL DAN PEMBAHASAN 8
Hasil 8
Uji Kultur Bersama 8
Tingkat Kelangsungan Hidup 9
Laju Pertumbuhan Spesifik 9
Rasio Konversi Pakan 10
Kadar Hematokrit 11
Diferensial Leukosit 11
Respiratory Burst Activity 13
Aktivitas Lisozim 14
Monitoring Populasi Sel Bakteri 14
Parameter Kualitas Air 15
Pembahasan 16
4 SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
DAFTAR PUSTAKA 20
LAMPIRAN 24
DAFTAR TABEL
1 Kombinasi perlakuan uji penghambatan bakteri probiotik terhadap AH
NAR secara in vitro 4
2 Hasil perhitungan konsentrasi sel dari uji kultur bersama probiotik
multisepesies terhadap AH26NAR 8
3 Kisaran hasil pengukuran kualitas air selama penelitian 16
DAFTAR GAMBAR
4 Kadar hematokrit pada ikan lele dumbo (C. gariepinus) yang diinfeksi AH26 NAR dan dipelihara pada media yang mengandung probiotik
3 Pengukuran Respiratory Burst activity 24
1 PENDAHULUAN
Latar Belakang
Teknologi budi daya ikan lele dumbo (Clarias gariepinus) yang digunakan di Indonesia adalah sistem budi daya intensif dengan padat tebar yang tinggi dengan pemberian pakan tambahan yang optimal. Sama seperti usaha budi daya perikanan lainnya, masalah utama dalam budi daya ikan lele dumbo adalah serangan penyakit. Kematian ikan lele dumbo dan kegagalan panen akan dialami jika serangan penyakit tidak segera ditanggulangi, untuk menghindari keadaan ini, perlu dilakukan upaya pencegahan dan penanggulangan penyakit secara tepat.
Salah satu penyakit yang sering menyebabkan kematian ikan lele dumbo adalah penyakit MAS (Motile Aeromonads Septicemia) yang disebabkan oleh infeksi bakteri Aeromonas hydrophila. A. hydrophila
merupakan bakteri Gram negatif, berbentuk batang, tidak berspora, bersifat katalase dan oksidase positif, bergerak dengan flagela, dan termasuk bakteri anaerobik fakultatif (Erdem et al. 2011). A. hydrophila termasuk dalam bakteri patogen oportunistik dan merupakan mikroflora normal dalam perairan. Hal ini sesuai dengan hasil penelitian Uddin dan Al-Harbi (2010) yang menyatakan bahwa A. hydrophila merupakan bakteri patogen yang mendominasi jenis bakteri pada air kolam budi daya ikan lele dumbo sebesar 25%, Vibrio cholerae 11,61% dan Streptococcus sp. 4,46%. Uddin dan Al-Harbi (2012) juga menyebutkan bahwa A. hydrophila juga mendominasi jenis bakteri pada air kolam budi daya polikultur ikan lele dumbo dan ikan mas yaitu sebesar 29,93%, sedangkan
Streptococcus sp. sebesar 2,72% dan S. putrefaciens sebesar 12,25%.
Upaya untuk mencegah ikan agar tidak terserang penyakit adalah dengan meningkatkan daya tahan tubuh ikan atau dengan mengontrol lingkungan budi daya. Pengendalian lingkungan budi daya dapat dilakukan dengan cara penambahan probiotik melalui media pemeliharaan. Pemberian bakteri probiotik ke dalam media pemeliharaan bertujuan untuk meningkatkan kesehatan ikan sebagai inang dengan cara menekan populasi bakteri patogen, meningkatkan kualitas perairan atau membantu mendegradasi limbah organik (Irianto 2005).
2
Pemberian bakteri probiotik Staphylococcus lentus L1k melalui pakan telah diteliti oleh Hasibuan (2013) dan Santoso (2013). Hasil penelitian Hasibuan (2013) menunjukkan bahwa penggunaan probiotik L1k dan kombinasi probiotik multispesies L1k dengan NB21b dapat meningkatkan respons imun dan dapat mengurangi tingkat kematian ikan nila akibat infeksi Streptococcus agalactiae
serta pemberian probiotik L1k pada ikan nila melalui pakan menunjukkan
Survival Rate (SR) sebesar 100%, sedangkan perlakuan kombinasi multispesies L1k dengan NB21b menunjukkan SR sebesar 95,56%. Pemberian probiotik
Bacillus subtilis ND2 dengan dosis 109 CFU/mL melalui media pemeliharaan ikan nila menunjukkan SR sebesar 51,67% (Wijaya 2011). Pemberian probiotik
Bacillus cereus P23 melalui media pemeliharaan juga telah diteliti oleh Haditomo (2011) yang menunjukkan bahwa pemberian probiotik sebesar 106 CFU/mL dapat mempertahankan SR ikan mas sebesar 100%.
Fyzul et al. (2007) menyatakan bahwa Bacillus subtilis AB1 efektif sebagai probiotik untuk menghambat infeksi Aeromonas sp. pada rainbow trout. Hasil penelitian Ravi et al. (2007) menyebutkan bahwa probiotik dari jenis
Paenibacillus sp., Bacillus cereus dan P. polymyxa yang diaplikasikan lewat air dapat menghambat pertumbuhan Vibrio pada larva udang windu (Penaeus monodon). Penelitian mengenai aplikasi probiotik multispesiessebagai biokontrol patogen pada budi daya ikan lele dumbo (Clarias gariepinus) belum banyak dilakukan, sehingga penelitian ini bertujuan untuk mengetahui pengaruh penambahan probiotik untuk meningkatkan kinerja budi daya, serta menentukan kombinasi probiotik multispesies yang efektif untuk menekan populasi A. hydrophila pada media budi daya ikan lele dumbo.
Perumusan Masalah
Kontrol jumlah bakteri dalam lingkungan perairan diperlukan untuk menekan jumlah bakteri dalam perairan, terutama yang bersifat patogen. Salah satu cara untuk mengontrol jenis bakteri dalam perairan yaitu dengan menggunakan probiotik sebagaimana konsep probiotik sebagai agen biokontrol lingkungan. Manipulasi terhadap populasi mikroba yang berada di perairan guna pencegahan sebelum terjadinya serangan bakteri yang bersifat mematikan perlu dilakukan sebagaimana konsep probiotik sebagai biokontrol.
Penggunaan probiotik sebagai biokontrol ini diharapkan dapat menurunkan jumlah bakteri patogen dalam perairan terutama A. hydrophila, sehingga kondisi perairan budi daya berada dalam kondisi optimal. Dengan optimalisasi pemberian probiotik yang tepat sebelum terjadi peningkatan kepadatan A. hydrophila yang dapat memicu timbulnya serangan penyakit pada ikan di media budi daya, maka besar kemungkinan untuk menekan kerugian akibat serangan Motile Aeromonads Septicemia dan meningkatkan keuntungan usaha budi daya perikanan.
Tujuan Penelitian
3
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi mengenai kombinasi probiotik multispesies untuk menekan pertumbuhan A. hydrophila dan menjadi alternatif pemecahan masalah penyakit Motile Aeromonads Septicemia
pada budi daya ikan lele dumbo secara aman dan ramah lingkungan.
2
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini telah dilaksanakan pada bulan September 2014 sampai Januari 2015 di Instalasi Penelitian dan Pengembangan Pengendalian Penyakit Ikan (IP4I), Balai Penelitian dan Pengembangan Budidaya Air Tawar (BPPBAT), Depok.
Metode
Penyiapan Kultur Sel Probiotik dan Patogen
Probiotik yang digunakan dalam penelitian ini adalah probiotik Bacillus subtilis (ND2), Bacillus cereus (P23)dan Staphylococcus lentus (L1k), sedangkan patogen yang digunakan adalah A. hydrophila (AH26). Isolat ND2, P23 dan AH26 merupakan koleksi dari Balai Penelitian dan Pengembangan Budidaya Air Tawar Bogor, sedangkan isolat L1k merupakan koleksi Laboratorium Kesehatan Ikan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Kultur sel probiotik dilakukan dengan cara mengambil koloni kemudian dikultur dalam media Tryptone Soya Agar (TSA) dan diinkubasi selama 24 jam pada suhu 28oC. Probiotik yang telah dikultur pada media TSA diinokulasikan ke dalam media cair
Tryptone Soya Broth (TSB) 10 mL, diinkubasi selama 24 jam pada suhu 28 oC. Kultur sel patogen A. hydrophila AH26, dilakukan dengan menggunakan media selektif yaitu Rimler Shotts (RS). A. hydrophila yang tumbuh pada media RS diinokulasikan ke media TSA dan diinkubasi selama 24 jam di dalam inkubator pada suhu 28 oC. A. hydrophila yang telah di kultur pada media TSA dipindah dan diinokulasikan ke dalam media cair TSB 10 mL dan diinkubasi selama 24 jam pada suhu 28 oC.
Uji in vitro
Pemberian Penanda Resistensi Antibiotik
masing-4
masing isolat di kultur kedalam TSB yang mengandung antibiotik dengan dosis masing-masing 100 µg/mL, kemudian ditumbuhkan pada media TSA yang mengandung antibiotik dengan dosis yang sama dan dilakukan Total Plate Count
(TPC) pada semua isolat bakteri dan ditentukan dengan metode cawan sebar menurut Madigan et al. (2011).
Uji Kultur Bersama
Uji kultur bersama dilakukan untuk mengetahui potensi kombinasi bakteri probiotik ND2 CefR, P23 CipR, L1k TetR dalam menghambat pertumbuhan bakteri patogen AH26 NAR. Setiap kombinasi bakteri pada perlakuan A, B, C dan D diinokulasikan pada media TSB (Bernard et al. 2013), perlakuan E hanya menginokulasikan AH26 NAR pada media TSB sebagai kontrol dan diinkubasi selama 24 jam pada suhu 28 °C. Penghitungan bakteri dilakukan dengan metode hitungan cawan (Madigan et al. 2011). Media yang digunakan pada perlakuan A sampai E berupa media RS yang merupakan media selektif untuk A. hydrophila.
Perlakuan F, G, H diinokulasikan pada media TSA menggunakan metode dual culture dengan menggunakan kertas cakramuntuk mengetahui aktivitas gabungan antar bakteri probiotik bersifat antagonis atau sinergis (Kalaiselvi dan Panneerselvam 2011). Kombinasi perlakuan pada uji kultur bersama secara in vitro dapat dilihat pada Tabel 1.
Tabel 1 Kombinasi perlakuan uji penghambatan bakteri probiotik terhadap AH26 NAR secara in vitro
Perlakuan Probiotik (CFU/mL) Bakteri AH26 NAR
(CFU/mL)
5
Uji in vivo
Uji in vivo ini merupakan aplikasi, setelah mendapatkan hasil konsentrasi terbaik masing-masing probiotik dengan AH26 NAR secara in vitro, selanjutnya diimplementasikan secara in vivo. Sebelum dilakukan uji in vivo, dilakukan uji
Postulat Koch terlebih dahulu. Uji Postulat Koch dilakukan untuk mengetahui sifat patogen dari isolat bakteri dan meningkatkan patogenitas (Madigan et al.
2011) dalam hal ini adalah isolat AH26 NAR yang diujikan pada ikan lele dumbo. Ikan lele dumbo yang digunakan berukuran 3-4 cm dengan berat 2-3 gram dipelihara dalam akuarium berukuran 56x39x34 cm3, diisi air dengan volume 30 liter dengan padat tebar 10 ekor. Isolat AH26 NAR (106CFU/mL) diinjeksikan ke ikan uji dengan volume 0,1 mL/ekor. Pengamatan gejala klinis dilakukan selama 24 jam.
Desain Penelitian
Ikan lele dumbo yang digunakan memiliki berat 1,97±0,7 gram/ekor dipelihara dalam akuarium berukuran 56x39x34 cm3, diisi air dengan volume 30 liter dengan padat tebar 25 ekor. Konsentrasi yang diberikan pada uji in vivo
merupakan hasil konsentrasi terbaik kombinasi probiotik dengan AH26 NAR secara in vitro melalui uji kultur bersama. Pemberian probiotik dilakukan setiap hari selama 28 hari. Probiotik dan patogen diberikan pada media pemeliharaan. Perlakuan yang diberikan pada uji in vivo yaitu:
(A) penambahan bakteri dalam media dengan komposisi AH26 NAR 103 CFU/mL, probiotik ND2 CefR 105 CFU/mL dan P23 CipR 105 CFU/mL;
(B) penambahan bakteri dalam media dengan komposisi AH26 NAR 103 CFU/mL,
probiotik ND2 CefR 103 CFU/mL dan L1k TetR 103 CFU/mL;
(C) penambahan bakteri dalam media dengan komposisi AH26 NAR 103 CFU/mL, probiotik P23 CipR 104 CFU/mL dan L1k TetR 104 CFU/mL;
(D) penambahan bakteri dalam media dengan komposisi AH26 NAR 103 CFU/mL, probiotik, ND2 CefR 105 CFU/mL, P23 CipR 105 CFU/mL dan L1k TetR 105 CFU/mL;
(K+) penambahan AH26 NAR 103 CFU/mL dalam media dan tanpa penambahan probiotik sebagai kontrol positif;
(K-) tanpa penambahan probiotik dan tanpa AH26 NAR pada media sebagai kontrol negatif.
Parameter Uji
Parameter uji dalam penelitian ini meliputi parameter kinerja budi daya antara lain parameter tingkat kelangsungan hidup (Effendi 2002), laju pertumbuhan spesifik (Huisman 1987), rasio konversi pakan (Takeuchi 1988). Parameter sistem imun yang meliputi kadar hematokrit (Anderson dan Siwicki 1995), diferensial leukosit (Blaxhall dan Daisley 1973), respiratory burst activity
6
Tingkat Kelangsungan Hidup
Kelangsungan hidup/Survival Rate (SR) dihitung berdasarkan Effendi (2002) yaitu:
Keterangan :
SR = Tingkat kelangsungan hidup (%)
Nt = Jumlah ikan yang hidup pada akhir pengamatan (ekor) No = Jumlah ikan yang hidup pada awal uji tantang (ekor)
Laju pertumbuhan spesifik
Ikan diukur bobotnya pada awal dan akhir masa pemeliharaan. Laju pertumbuhan spesifik (Specific Growth Rate/SGR) dihitung dengan menggunakan rumus (Huisman, 1987):
Rasio konversi pakan dihitung dengan menggunakan rumus berdasarkan Takeuchi (1988):
Kadar hematoktit diperiksa menurut Anderson dan Siwicki (1995) menggunakan tabung mikro hematokrit kemudian dihitung dengan persamaan:
Keterangan:
He : Kadar hematokrit (%)
a : bagian darah yang mengendap (mm)
7
Diferensial Leukosit
Pengamatan diferensial leukosit menggunakan metode Blaxhall dan Daisley (1973) dengan mengamati preparat ulas darah yang diwarnai dengan pewarna Giemsa. Pengamatan dan penghitungan masing-masing jenis sel yaitu monosit, neutrofil dan limfosit dilakukan hingga jumlah semua mencapai 100, dan hasilnya dinyatakan dalam % .
Respiratory Burst Activity
Uji respiratory burst activity menggunakan reagen Nitro Blue Tetrazolium (NBT) berdasarkan metode Secombes (1990). Darah dari ikan sampel diambil sebanyak 50 µl dimasukkan dalam microplate, diinkubasi selama 1 jam suhu 37oC, kemudian supernatan dibuang dan dicuci PBS 50 µl sebanyak 3 kali, ditambahkan 50 µl NBT 0,2% diinkubasi selama 1 jam suhu 37oC. Fiksasi metanol 100% (50 µl) 2-3 menit lalu dibilas dengan metanol 30% (50 µl) 3 kali dan dikering udarakan, kemudian ditambah KOH 60 µl + DMSO 70 µl dan pengecekkan optical density (ELISA Reader 540nm).
Aktivitas Lisozim
Aktivitas lisozim diuji menggunakan serum ikan lele menggunakan metode Ellis (1990) yang dapat dirumuskan sebagai berikut:
Aktivitas lisozim (UI/mL/menit) =[((OD30m– OD60m) x 1000) x (1/ s)]/t Keterangan:
1000 = Konversi hasil absorbansi (OD) menjadi unit internasional (UI) t = waktu (menit)
s = jumlah serum (ml)
OD30m = Pembacaan densitas optikal menit ke -30 OD60m = Pembacaan densitas optikal menit ke -60
Monitoring Populasi Sel Bakteri
Media yang digunakan untuk menghitung total bakteri adalah media TSA, RS untuk menghitung total bakteri A. hydrophila,dan TSA+NA 100μg/mL untuk menghitung total bakteri AH26 NAR, TSA+Cef 100μg/mL untuk menghitung
8
Analisis Data
Rancangan perlakuan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan 6 perlakuan, dan masing-masing perlakuan diulang sebanyak 3 kali. Data tingkat kelangsungan hidup, laju pertumbuhan spesifik, rasio konversi pakan, kadar hematokrit, diferensial leukosit, Respiratory Burst avtivity dan aktivitas lisozim dianalisis menggunakan ANOVA dengan selang kepercayaan 95%, dan dilanjutkan dengan uji jarak berganda Duncan untuk menentukan jenis perlakuan yang paling baik. Hasil monitoring populasi sel bakteri dalam air dan parameter kualitas air dianalisis secara deskriptif dengan menggunakan tabel dan grafik.
3 HASIL DAN PEMBAHASAN Hasil
Uji Kultur Bersama
Tabel 2 Hasil perhitungan konsentrasi sel dari uji kultur bersama probiotik multispesies terhadap AH26NAR
Perlakuan
Probiotik (CFU/mL) Bakteri AH26NAR (CFU/mL)
Sinergis/
* : kepadatan AH26NAR yang diinokulasikan awal inkubasi
** : kepadatan AH26NARyang tumbuh pada media RS setelah 24 jam inkubasi
9 Tabel 2 merupakan hasil uji kultur bersama probiotik terhadap AH26NAR. Hasil uji bakteri probiotik terhadap AH26 NAR secara in vitro menunjukkan kombinasi isolat probiotik ND2 CefR dan P23 CipR dengan kepadatan masing-masing 105 CFU/mL, kombinasi isolat probiotik ND2 CefR dan L1k TetR dengan kepadatan masing-masing 103 CFU/mL, kombinasi isolat probiotik P23 CipR dan L1k TetR dengan kepadatan masing-masing 104 CFU/mL dan kombinasi isolat probiotik ND2 CefR, P23 CipR dan L1k TetR dengan kepadatan masing-masing 105 CFU/mL mampu menghambat populasi AH26 NAR. Uji dual culture antar masing-masing probiotik menunjukkan bahwa ketiga probiotik tersebut bersifat sinergis, dengan demikian kedua isolat probiotik dapat digunakan secara bersamaan untuk menghambat pertumbuhan A. hydrophila.
Tingkat Kelangsungan Hidup/Survival Rate (SR)
Gambar 1 menunjukkan tingkat kelangsungan hidup ikan lele dumbo selama 28 hari perlakuan. Perlakuan B menunjukkan tingkat kelangsungan hidup yang tertinggi yaitu sebesar 89,33±4,62 dan berbeda nyata (P<0,05) dengan kontrol positif dan kontrol negatif yaitu masing-masing sebesar 54,67±6,11 dan 73,33±6,11. Perlakuan A menunjukkan SR sebesar 78,67±6,11 , perlakuan C sebesar 80±4,00 dan D sebesar 68±4,00.
Keterangan :
(K+) Kontrol positif; (K-) Kontrol negatif; (A) perlakuan probiotik ND2 CefR 105 CFU/mL dan
P23 CipR 105 CFU/mL; (B) perlakuan probiotik ND2 CefR 103 CFU/mL dan L1k TetR 103
CFU/mL; (C) perlakuan probiotik P23 CipR 104 CFU/mL dan L1k TetR 104 CFU/mL; (D)
perlakuan probiotik ND2 CefR 105 CFU/mL, P23 CipR 105 CFU/mL dan L1k TetR 105 CFU/mL.
Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05).
Gambar 1 Tingkat kelangsungan hidup ikan lele dumbo (Clarias gariepinus) yang diinfeksi AH26 NAR dan dipelihara pada media mengandung probiotik multispesies
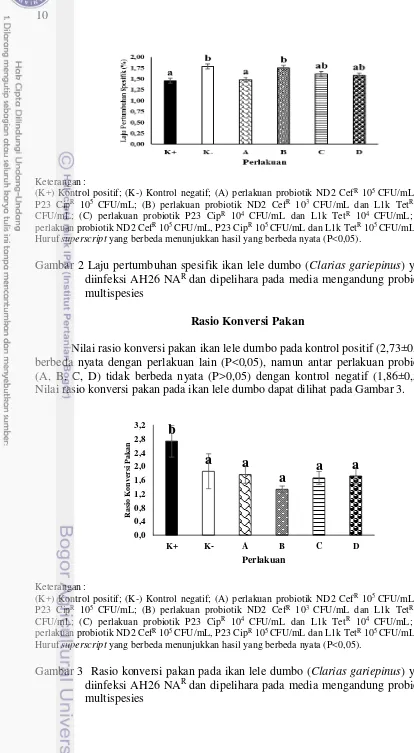
Laju pertumbuhan spesifik
10
Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05).
Gambar 2 Laju pertumbuhan spesifik ikan lele dumbo (Clarias gariepinus) yang diinfeksi AH26 NAR dan dipelihara pada media mengandung probiotik multispesies
Rasio Konversi Pakan
Nilai rasio konversi pakan ikan lele dumbo pada kontrol positif (2,73±0,46) berbeda nyata dengan perlakuan lain (P<0,05), namun antar perlakuan probiotik (A, B, C, D) tidak berbeda nyata (P>0,05) dengan kontrol negatif (1,86±0,51). Nilai rasio konversi pakan pada ikan lele dumbo dapat dilihat pada Gambar 3.
b
Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05).
11
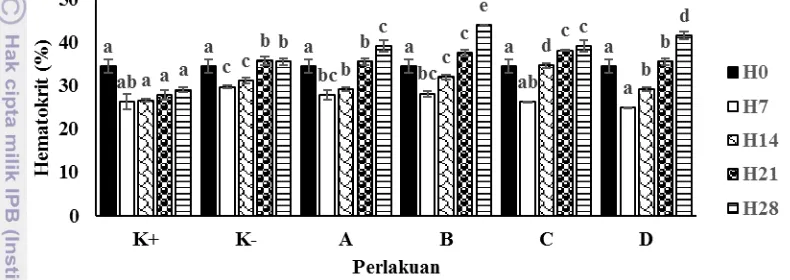
Kadar Hematokrit
Nilai hematokrit pada awal penelitian menunjukkan hasil yang sama yaitu sebesar 34,45±1,58. Penurunan nilai hematokrit terjadi pada hari ke 7 dan mulai terjadi kenaikan pada hari ke 14. Pada hari ke 28 nilai hematokrit perlakuan B (44,00±0,00) berbeda nyata (P<0,05) dengan semua perlakuan terutama dengan kontrol positif (28,99±0,59). Kadar hematokrit pada ikan lele dumbo dapat dilihat pada Gambar 4.
Keterangan :
(K+) Kontrol positif; (K-) Kontrol negatif; (A) perlakuan probiotik ND2 CefR 105 CFU/mL dan
P23 CipR 105 CFU/mL; (B) perlakuan probiotik ND2 CefR 103 CFU/mL dan L1k TetR 103
CFU/mL; (C) perlakuan probiotik P23 CipR 104 CFU/mL dan L1k TetR 104 CFU/mL; (D)
perlakuan probiotik ND2 CefR 105 CFU/mL, P23 CipR 105 CFU/mL dan L1k TetR 105 CFU/mL.
Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata berdasarkan hari (H) pengambilan sampel (P<0,05).
Gambar 4 Kadar hematokrit pada ikan lele dumbo (Clarias gariepinus) yang diinfeksi AH26 NAR dan dipelihara pada media mengandung probiotik multispesies
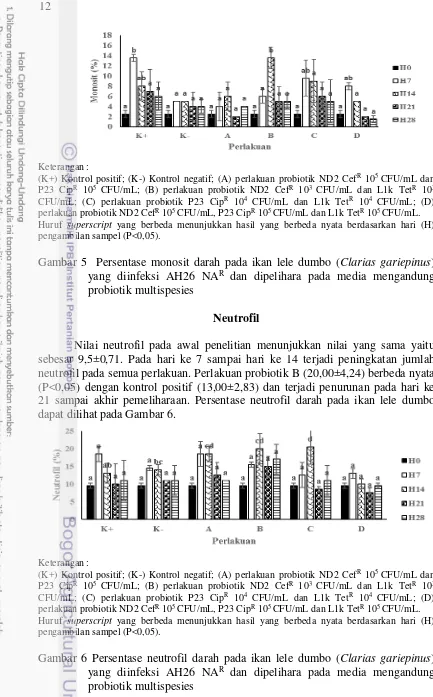
Diferensial Leukosit Monosit
12
Keterangan :
(K+) Kontrol positif; (K-) Kontrol negatif; (A) perlakuan probiotik ND2 CefR 105 CFU/mL dan
P23 CipR 105 CFU/mL; (B) perlakuan probiotik ND2 CefR 103 CFU/mL dan L1k TetR 103
CFU/mL; (C) perlakuan probiotik P23 CipR 104 CFU/mL dan L1k TetR 104 CFU/mL; (D)
perlakuan probiotik ND2 CefR 105 CFU/mL, P23 CipR 105 CFU/mL dan L1k TetR 105 CFU/mL.
Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata berdasarkan hari (H) pengambilan sampel (P<0,05).
Gambar 5 Persentase monosit darah pada ikan lele dumbo (Clarias gariepinus) yang diinfeksi AH26 NAR dan dipelihara pada media mengandung probiotik multispesies
Neutrofil
Nilai neutrofil pada awal penelitian menunjukkan nilai yang sama yaitu sebesar 9,5±0,71. Pada hari ke 7 sampai hari ke 14 terjadi peningkatan jumlah neutrofil pada semua perlakuan. Perlakuan probiotik B (20,00±4,24) berbeda nyata (P<0,05) dengan kontrol positif (13,00±2,83) dan terjadi penurunan pada hari ke 21 sampai akhir pemeliharaan. Persentase neutrofil darah pada ikan lele dumbo dapat dilihat pada Gambar 6.
Keterangan :
(K+) Kontrol positif; (K-) Kontrol negatif; (A) perlakuan probiotik ND2 CefR 105 CFU/mL dan
P23 CipR 105 CFU/mL; (B) perlakuan probiotik ND2 CefR 103 CFU/mL dan L1k TetR 103
CFU/mL; (C) perlakuan probiotik P23 CipR 104 CFU/mL dan L1k TetR 104 CFU/mL; (D)
perlakuan probiotik ND2 CefR 105 CFU/mL, P23 CipR 105 CFU/mL dan L1k TetR 105 CFU/mL.
Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata berdasarkan hari (H) pengambilan sampel (P<0,05).
13
Limfosit
Nilai limfosit pada awal penelitian menunjukkan nilai yang sama pada semua perlakuan yaitu sebesar 88±1,41. Penurunan jumlah limfosit terjadi pada hari ke 7 dan berangsur naik setelah 14 hari pemberian probiotik sampai akhir pemeliharaan dengan nilai 83±8,49 (K+), 85±2,83 (K-), 85±0,00 (A), 78±2,83 (B), 84±8,49 (C), 89±1,41 (D) Persentase limfosit darah pada ikan lele dumbo dapat dilihat pada Gambar 7.
Keterangan :
(K+) Kontrol positif; (K-) Kontrol negatif; (A) perlakuan probiotik ND2 CefR 105 CFU/mL dan
P23 CipR 105 CFU/mL; (B) perlakuan probiotik ND2 CefR 103 CFU/mL dan L1k TetR 103
CFU/mL; (C) perlakuan probiotik P23 CipR 104 CFU/mL dan L1k TetR 104 CFU/mL; (D)
perlakuan probiotik ND2 CefR 105 CFU/mL, P23 CipR 105 CFU/mL dan L1k TetR 105 CFU/mL.
Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata berdasarkan hari (H) pengambilan sampel (P<0,05).
Gambar 7 Persentase limfosit darah pada ikan lele dumbo (Clarias gariepinus) yang diinfeksi AH26 NAR dan dipelihara pada media mengandung probiotik multispesies
Respiratory Burst Activity
Nilai Respiratory burst activity setelah 14 hari pemberian probiotik antar perlakuan menunjukkan hasil yang berbeda nyata (P<0.05). Perlakuan probiotik B menunjukkan nilai Respiratory burst activity tertinggi (0.072±0.00%) dan terendah pada kontrol positif (0.061±0.00%). Nilai Respiratory burst activity ikan lele dumbo dapat dilihat pada Gambar 8.
Keterangan :
(K+) Kontrol positif; (K-) Kontrol negatif; (A) perlakuan probiotik ND2 CefR 105 CFU/mL dan
P23 CipR 105 CFU/mL; (B) perlakuan probiotik ND2 CefR 103 CFU/mL dan L1k TetR 103
CFU/mL; (C) perlakuan probiotik P23 CipR 104 CFU/mL dan L1k TetR 104 CFU/mL; (D)
perlakuan probiotik ND2 CefR 105 CFU/mL, P23 CipR 105 CFU/mL dan L1k TetR 105 CFU/mL.
Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata berdasarkan hari (H) pengambilan sampel (P<0,05).
14
Aktivitas Lisozim
Nilai aktivitas lisozim antar perlakuan menunjukkan hasil yang berbeda nyata (P<0.05). Penurunan aktivitas lisozim terjadi pada hari ke 7 dan mulai meningkat setelah 7 hari pemberian perlakuan probiotik. Nilai aktivitas lisozim pada kontrol negatif cenderung stabil. Nilai aktivitas lisozim pada ikan lele dumbo dapat dilihat pada Gambar 9.
Keterangan :
(K+) Kontrol positif; (K-) Kontrol negatif; (A) perlakuan probiotik ND2 CefR 105 CFU/mL dan
P23 CipR 105 CFU/mL; (B) perlakuan probiotik ND2 CefR 103 CFU/mL dan L1k TetR 103
CFU/mL; (C) perlakuan probiotik P23 CipR 104 CFU/mL dan L1k TetR 104 CFU/mL; (D)
perlakuan probiotik ND2 CefR 105 CFU/mL, P23 CipR 105 CFU/mL dan L1k TetR 105 CFU/mL.
Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata berdasarkan hari (H) pengambilan sampel (P<0,05).
Gambar 9 Aktivitas Lisozim pada ikan lele dumbo (Clarias gariepinus) yang diinfeksi AH26 NAR dan dipelihara pada media mengandung probiotik multispesies
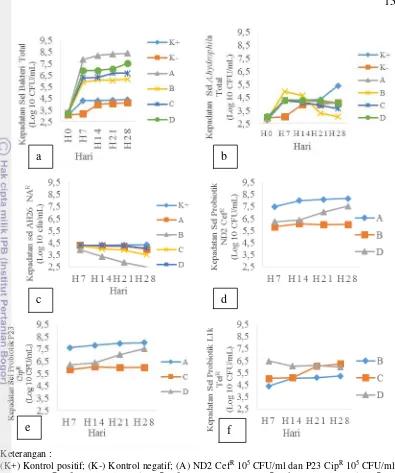
Monitoring Populasi Sel Bakteri
Kepadatan sel bakteri total pada media pemeliharaan sampai akhir perlakuan menunjukkan nilai tertinggi pada perlakuan probiotik A (108 CFU/mL) diikuti perlakuan D (107 CFU/mL), C (105 CFU/mL), B (105 CFU/mL) dan kontrol positif (105 CFU/mL) dan kepadatan sel bakteri total terendah pada kontrol negatif (104 CFU/mL). Kepadatan sel A. hydrophila total sampai akhir penelitian menunjukkan jumlah kepadatan sel A. hydrophila total tertinggi pada kontrol positif (105 CFU/mL), diikuti kepadatan sel A. hydrophila total yang sama pada kontrol negatif, perlakuan probiotik A, C dan D (104 CFU/mL), A. hydrophila total pada perlakuan B menunjukkan pola penurunan dari kepadatan 104 CFU/mL pada hari ke 7 menjadi 103 CFU/mL pada akhir penelitian, sedangkan pada kontrol positif dan kontrol negatif kepadatan sel A. hydrophila
15
Keterangan :
(K+) Kontrol positif; (K-) Kontrol negatif; (A) ND2 CefR 105 CFU/ml dan P23 CipR 105 CFU/ml;
(B) ND2 CefR 103 CFU/ml dan L1k TetR 103 CFU/ml; (C) P23 CipR 104 CFU/ml dan L1k TetR 104
CFU/ml; (D) ND2 CefR 105 CFU/ml, P23 CipR 105 CFU/ml dan L1k TetR 105 CFU/ml. H (hari ke-)
Gambar 10 Kepadatan sel bakteri total (a), kepadatan sel AH total (b), kepadatan sel AH26 NAR (c), kepadatan sel probiotik ND2 CefR (d), kepadatan sel probiotik P23 CipR (e), kepadatan sel probiotik L1k TetR (f) pada media pemeliharaan ikan lele dumbo
Parameter Kualitas Air
Parameter kualitas air yang diamati selama penelitian adalah suhu, pH, DO dan amonia yang diukur pada hari ke 0, 7, 14, 21 dan 28. Menurut SNI 01-6484.5.2002, hasil pengukuran menunjukkan kualitas air pada kategori layak untuk pemeliharaan ikan lele dumbo. Data hasil pengukuran disajikan pada Tabel 3.
b
d
e f
16
Berdasarkan nilai tingkat kelangsungan hidup diketahui bahwa perlakuan pemberian kombinasi probiotik ND2 CefR dan L1k TetR menunjukkan tingkat kelangsungan hidup yang paling tinggi yaitu sebesar 89,33±4,62 yang berbeda nyata (P<0,05) dengan perlakuan lainnya, kecuali dengan perlakuan C 80±4,00. Tingkat kelangsungan hidup paling rendah pada perlakuan kontrol positif yaitu sebesar 54,67±6,11. Tingginya tingkat kelangsungan hidup pada perlakuan B diduga seiring dengan menurunnya jumlah populasi sel A. hydrophila setelah pemberian probiotik sehingga dapat mengurangi tingkat stres pada ikan lele dumbo. Stres pada ikan menyebabkan penurunan pertumbuhan, tingkah laku yang abnormal, penurunan sistem imun ikan dan resistensi terhadap penyakit (Lupatsch
et al. 2009). B. subtilis menghasilkan beberapa zat antimikroba atau produk yang dapat menghambat A. hydrophila antara lain bakteriosin, subtilin, koagulin dan antibiotik surfaktan, iturins dan basilin (Balcazar et al. 2004). Hasil penelitian Septi (2014) menunjukkan bahwa pemberian bakteri L1k 104 CFU/mL dalam media pemeliharaan memberikan kelangsungan hidup dan laju pertumbuhan harian paling tinggi pada ikan lele dumbo. Menurut hasil penelitian Santoso (2013) probiotik L1k memberikan efek menguntungkan pada inang dengan memperbaiki komposisi indigenous microflora sehingga memberikan dampak kelangsungan hidup yang tinggi pada ikan nila sebagai inang. Tingginya tingkat kelangsungan hidup diduga bahwa seiring dengan menurunnya jumlah bakteri A. hydrophila dalam media budi daya setelah pemberian kedua bakteri probiotik tersebut.
17 masuk dalam tubuh ikan yang berasal dari pakan akan sebagian besar digunakan untuk metabolisme, sebagian lagi digunakan untuk pertumbuhan dan sisanya dibuang dalam bentuk feses.
Rasio konversi pakan ikan lele dumbo selama penelitian menunjukkan pada kontrol positif (2,73±0,46) berbeda nyata dengan perlakuan lain (P<0,05), namun antar perlakuan probiotik (A, B, C, D) tidak berbeda nyata (P>0,05) dengan kontrol negatif (1,86±0,51). Effendi (2002) menyatakan bahwa semakin kecil nilai konversi pakan maka semakin efektif pakan yang diberikan. Semakin efektif pakan yang diberikan, akan semakin tinggi nutrien pakan yang tercerna dan semakin besar kemungkinan nutrien tersebut dimanfaatkan oleh ikan untuk pertumbuhannya dan menurunkan porsi nutrien yang akan terbuang ke lingkungan. Hasil penelitian menunjukkan nilai konversi pakan terkecil pada perlakuan probiotik ND2 CefR dan L1k TetR (1,33±0,1) dan terbesar pada kontrol positif. Hal ini sesuai dengan penelitian Santoso (2013) yang menunjukkan pemberian probiotik proteolitik L1k dapat menurunkan nilai konversi pakan pada ikan nila. Pemberian bakteri proteolitik L1k yang memproduksi enzim protease dalam pakan dapat berperan dalam proses pencernaan dengan memecah ikatan peptida menjadi berbagai asam amino kompleks yang mendukung untuk laju pertumbuhan ikan (Firdaus 2012). Menurut Irianto dan Austin (2002), Bacillus sp. dapat meningkatkan penggunaan pakan dengan menghasilkan enzim protease, lipase dan amilase sehingga memberikan dampak positif terhadap pertumbuhan dan kelangsungan hidup.
Kadar hematokrit menunjukkan penurunan pada hari ke 7 dan berangsur naik pada hari ke 28 di mana nilai tertinggi terdapat pada perlakuan B dengan nilai 44±0,00 yang berbeda nyata dengan kontrol positif 28,99±0,59 (P<0,05). Penurunan nilai hematokrit ini diduga karena adanya infeksi yang disebabkan bakteri A. hydrophila di mana bakteri ini mengeluarkan produk ekstraseluler antara lain aerolisin dan hemolisin yang berkaitan dengan tingkat virulensi dari bakteri tersebut (Yousr et al. 2007). Aerolisin dan hemolisin menunjukkan aktivitas hemolisis terhadap eritrosit secara in vitro (Chirila et al. 2008) dan in vivo (Kumar dan Ramulu 2013). Nilai hematokrit pada ikan lele dumbo sehat berkisar antara 30,8% - 45,5% (Bastiawan dkk 2001). Nilai hematokrit yang rendah menunjukkan ikan mengalami anemia. Meningkatnya jumlah hematokrit diduga karena efek dari pemberian probiotik. Hal ini sesuai dengan penelitian Mocanu et al. (2010) yang menyatakan bahwa probiotik dari jenis Bacillus licheniformis dan Bacillus subtilis dapat meningkatkan nilai hematokrit ikan rainbow trout (Oncorhynchus mykiss Walbaum).
18
perlakuan kontrol positif cenderung stabil dari awal sampai akhir penelitian. Pada perlakuan probiotik jumlah monosit dalam darah mengalami penurunan setelah 14 hari pemberian probiotik. Sel monosit merupakan sel yang berumur pendek, dan perannya akan segera digantikan oleh sistem imun spesifik. Salinas et al. (2005) menyebutkan bahwa pemberian Bacillus subtilis melalui pakan pada ikan gilthead seabream dapat meningkatkan aktivitas fagositosis.
Jumlah neutrofil berangsur meningkat pada hari ke-7, meningkatnya jumlah neutrofil diduga karena ikan menunjukkan respons adanya patogen A. hydrophilla, karena pada saat trerjadi infeksi jumlah neutrofil dalam darah meningkat. Penurunan neutrofil terjadi setelah hari ke-14 sampai akhir penelitian. Hal ini diduga bahwa ikan tidak memerlukan neutrofil dan telah membentuk antibodi dalam tubuhnya, sehingga jumlah neutrofil dalam darah menjadi berkurang dan digantikan sistem imun spesifik olehlimfosit. Menurut Chinabut et al. (1991), neutrofil berfungsi untuk melawan penyakit bersama-sama dengan eosinofil yang disebabkan oleh organisme mikroseluler seperti bakteri dan virus. Sedangkan menurut Brown (2000), peningkatan produksi neutrofil terjadi secara bersamaan dengan kerja neutrofil menuju jaringan daerah infeksi.
Persentase limfosit mengalami penurunan sampai hari ke-7, selanjutnya mengalami kenaikan sampai hari ke-28 pada semua perlakuan, kecuali kontrol negatif yang cenderung stabil. Jumlah limfosit sebelum pemberian probiotik memiliki hasil yang tidak berbeda nyata (P>0,05) pada semua perlakuan. Pada perlakuan probiotik jumlah limfosit dalam darah mengalami peningkatan setelah 14 hari pemberian probiotik. Pada hari ke-21 sampai akhir pemeliharaan nilai limfosit meningkat hal ini dikarenakan limfosit sebagai respon imun spesifik menggantikan peran sistem imun non spesifik oleh monosit dan neutrofil. Fujaya (2004) menyatakan limfosit bukanlah sel yang melakukan aktifitas fagositosis, tetapi memegang peranan penting dalam pembentukan antibodi. Magnadottir (2010) menyatakan bahwa respon imun spesifik oleh limfosit bekerja lebih lambat dibandingkan respon imun non spesifik oleh makrofag.
Aktivitas respiratory burst mengalami peningkatan pada hari ke-7 dan menurun pada hari ke-28. Nilai tertinggi terdapat pada perlakuan B dengan nilai 0,072±0,00 OD dan berbeda nyata (P<0,05) dibandingkan dengan kontrol positif sebesar 0,061±0,00 OD. Produksi oksigen radikal dari fagositosis dalam darah dapat dilihat dengan pewarnaan nitroblue tetrazolium (NBT). Menurut Irianto (2005) NBT akan direduksi oleh formazan pada reaksi dengan radikal oksigen yang diproduksi dari neutrofil dan monosit. Nilai NBT semakin tinggi menunjukkan bahwa produksi radikal oksigen bebas pada aktivitas respiratory burst semakin besar. Peningkatan produksi radikal bebas ini digunakan untuk melawan patogen. Ikan memiliki mekanisme membunuh sel-sel fagosit melalui oksigen bebas dalam vakuola lisosom yang mampu meningkatkan permeabilitas sel bakteri sehingga bisa menyebabkan masuknya substansi dan cairan dalam sel bakteri yang kemungkinan bisa menyebabkan plasmolisis.
19 perlakuan A (54,94±2,44) diikuti perlakuan C (42,33±016) dan B (35,00±2,67) yang berbeda nyata (P<0,05) dengan kontrol positif (30,06±1,65).
Kepadatan sel bakteri total sampai akhir perlakuan menunjukkan nilai tertinggi pada perlakuan probiotik A (108 CFU/mL) diikuti perlakuan D (107 CFU/mL), C, B dan kontrol positif (105 CFU/mL) dan total kepadatan sel bakteri terendah pada kontrol negatif (104 CFU/mL). Populasi A. hydrophila pada seluruh perlakuan terdeteksi pada awal pengamatan. Hal ini menunjukkan bahwa bakteri
A. hydrophila merupakan bakteri oportunistik yang dapat ditemukan pada lingkungan perairan (Sharma et al. 2009). Kepadatan sel A. hydrophila total sampai akhir penelitian menunjukkan jumlah tertinggi pada kontrol positif (105 CFU/mL) diikuti kepadatan sel yang sama pada kontrol negatif, perlakuan probiotik A, C dan D (104 CFU/mL), perlakuan B menunjukkan pola penurunan dari kepadatan 104 CFU/mL pad hari ke-7 menjadi 103 CFU/mL pada akhir penelitian, sedangkan pada kontrol positif dan kontrol negatif kepadatan sel bakteri A. hydrophila total cenderung meningkat. Menurut Balcazar et al. 2004, B. subtilis menghasilkan zat antimikroba yang berdampak negatif terhadap A. hydrophila. Total bakteri probiotik ND2 CefR, P23 CipR, L1k TetR, menunjukkan peningkatan sampai akhir penelitian, hal ini dikarenakan pemberian probiotik setiap hari dan menunjukkan bahwa probiotik mampu hidup dan bertahan pada media pemeliharaan. Uddin dan Al-Harbi (2012) menyatakan bahwa jumlah bakteri dalam kolam budi daya tergantung salinitas, suhu, oksigen terlarut, pH, dan total padatan terlarut.
Defoirt et al. (2010) menyatakan bahwa Bacillus anthracis, Bacillus cereus, Bacillus subtilis, dan Bacillus thuringiensis menghasilkan senyawa acyl homoserine lactonase yang dapat mencegah terjadinya quorum sensing dari A. hydrophila, A. salmonicida, Edwardsiella tarda, dan Vibrio salmonicida.
Menurunnya jumlah A. hydrophila diiringi dengan meningkatnya jumlah bakteri probiotik selama pemeliharaan karena bakteri probiotik berkompetisi dengan bakteri patogen dalam mendapatkan ruang dan nutrisi sehingga dapat menghambat pertumbuhan patogen. Sorokulova et al. (2007) menyatakan bahwa probiotik dari golongan Bacillus telah banyak diaplikasikan untuk kepentingan bioteknologi termasuk jenis enzim dan asam amino yang dihasilkan serta produksi antibiotik untuk pengendalian patogen. Stapylococcus lentus merupakan bakteri heterotrof non patogenik, penambahan bakteri heterotrof non patogenik pada media pemeliharaan diduga mampu meningkatkan populasi bakteri total.
Menurut SNI 01-6484.5.2002 (2002) kualitas air selama pemeliharaan menunjukkan kategori layak untuk budi daya ikan lele dumbo. Kandungan amonia pada kontrol positif, kontrol negatif dan perlakuan A cenderung meningkat selama pemeliharaan, nilai amonia tertinggi terdapat pada perlakuan kontrol positif yaitu 0,01 ppm pada akhir penelitian. Sedangkan pada perlakuan B, C dan D nilai amonia cenderung menurun sampai akhir penelitian dengan konsentrasi amonia terendah pada perlakuan B dan D sebesar 0,0001 ppm. Hal ini diduga karena efek pemberian probiotik L1k pada media pemeliharaan. Menurut Sekar et al. (2012),
Stapylococcus lentus merupakan strain bakteri yang biasa digunakan dalam
bioremediasi limbah industri dan detoksifikasi xenobiotik. Kemampuan
20
Sebagai agen biokontrol, probiotik berperan sebagai musuh alami yang mencegah kerusakan yang disebabkan oleh mikroorganisme merugikan sampai batas yang dapat ditoleransi (Nayak 2011). Pemberian bakteri probiotik dalam media pemeliharaan dapat mempengaruhi jumlah komposisi bakteri dalam media terutama bakteri patogen. Sebagai agen bioremediasi, Bacillus sp. dan
Staphylococcus lentus berperan dalam memperbaiki kualitas air dan mengurangi senyawa tidak menguntungkan. Penambahan probiotik melalui media budi daya dapat memainkan peran yang signifikan dalam dekomposisi bahan organik, pengurangan nitrogen dan fosfor serta pengendalian amonia, nitrit dan hidrogen sulfida (Boyd 1999). Nayak (2010) menyebutkan bahwa probiotik dapat meningkatkan ketahanan inang terhadap patogen melalui peningkatan sistem imun nonspesifik. Kondisi di mana jumlah bakteri patogen menurun dan sistem imun ikan yang baik serta didukung parameter kualitas air budi daya yang layak untuk pemeliharaan maka akan berdampak pada meningkatnya kinerja budi daya antara lain meningkatkan kelangsungan hidup, laju pertumbuhan spesifik dan menurunkan rasio konversi pakan (Irianto dan Austin 2002).
4 SIMPULAN DAN SARAN Simpulan
Pemberian probiotik multispesies, kombinasi Bacillus subtilis ND2 dan
Staphylococcus lentus L1k melalui media budi daya ikan lele dumbo dapat menekan populasi sel Aeromonas hydrophila sampai 40% dengan tingkat kelangsungan hidup ikan lele dumbo mencapai 89,33%.
Saran
Perlu dilakukan penelitian lebih lanjut mengenai frekuensi pemberian probiotik melalui media pemeliharaan untuk menghambat pertumbuhan patogen
Aeromonas hydrophila.
Daftar Pustaka
Anderson DP, Siwicki AK. 1995. Basic haematology and serology for fish health programs. In M. Shariff, J.R. Authur , R.P. Subasinghe. (Ed) Diseases in Asian Aquaculture II, Fish Health Section, Asian Fisheries Society. Philippines: 185-202.
Balcazar JL, de-Blas I, Ruiz-Zarzuela I, Vendrell D, Muzquiz JL. 2004.
Probiotics: a tool for the future of fish and shellfish health management. Journal of Aquaculture in the Tropics 19: 239–242.
Bastiawan D, Wahid A, Alifudin M, Agustiawan. 2001. Gambaran darah lele dumbo (Clarias spp.) yang diinfeksi cendawan Aphanomyces sp. pada pH yang berbeda.Jurnal Penelitian Indonesia 3: 44-47.
Bernard VH, Nurhidayu A, Ina-Salwany MY, Abdelhadi Y. 2013. Bacillus cereus: JAQ04 strain as a potential probiotic for red tilapia; Oreochromis
21 Blaxhall PC, Daisley KW. 1973. Routine haematologycal methods for use with
fish blood. Journal of Fish Biology. 5: 577 – 581.
Boyd CE, Massaut L. 1999. Risks associated with the use of chemicals in pond aquaculture. Aquaculture Engineering 20:113-132.
Brown EM. 2000. Darah dan sumsum tulang. Histologi Veteriner. Penerjemah: R. Hartono. Jakarta: UI Press. Hal:108-143.
Chinabut S, Limsuwan C, Sawat PK. 1991. Histology of the Walking Catfish
Clarias batrachus. Thailand: Department of Fisheries. 96
Chirila F, Fit N, Nadas G, Negrea O, Ranga, R. 2008. Isolation and characterization of an Aeromonas hydrophila strain in a Carp (Cyprinus carpio) toxemia focus. Veterinary Medicine 65: 244-247.
Defoirdt T, Thanh LD, Delsen BV, Schryver PD, Sorgeloos P, Boon N, Bossier P. 2010. N-acylhomoserine lactone-degrading Bacillus strains isolated from aquaculture animals. Aquaculture 311: 258-260.
Effendi MI. 2002. Biologi Perikanan. Yayasan Pustaka Nusantara. Bogor.
Ellis AE. 1990. Lysozyme assays. In: Techniques in fish immunology. Stolen J. S., Fletcher T. C., Anderson D. P., Robertsen B. S., Van Miswinkel W. B. (eds), SOS Publications, air Haven, N. 101-103.
Erdem B, Kariptas E, Cil E, Isik K. 2011. Biochemical identification and numerical taxonomy of Aeromonas spp. isolated from food samples in Turkey. Turkey Journal of Biology. 35: 463-472.
Esteban MA. 2012. An overview of the immunological defense in fish skin [review article]. International Scholarly Research Network Immunology.
2012: 1-29.
Firdaus R. 2012. Seleksi bakteri kandidat probiotik untuk penghambatan patogen
Streptococcus agalactiae tipe non-hemolitik pada ikan nila Oreochromis niloticus secara in vitro dan in vivo. [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Fu C, Li, Hu W, Wang Y, Zhu W. 2007. Growth and energy budget of F2 ‘all
-fish’ growth hormone gene transgenic common Carp. Journal of Fish
Biology 70: 347-361.
Fujaya Y. 2004. Fisiologi Ikan: Dasar Pengembangan Teknologi Perikanan. Rineka Cipta. Jakarta.
Fuller R. 1992. History and development of probiotics in probiotics the Scientifiec basis. Chapman & Hall. London, New York, Tokyo, Melbourne, Madras.1-8.
Fyzul AN, Al-Harbi AH, Austin B. 2007. Development in the use of probiotics for disease control in aquaculture. Aquaculture 431. 1-11.
Haditomo AHC. 2011. Pemberian probiotik pada media budidaya untuk pengendalian A. hydrophila pada ikan mas (Cyprinus carpio). [Tesis]. Bogor: Institut Pertanian Bogor.
Hasibuan UR. 2013. Aplikasi probiotik amilolitik Nb21b dan proteolitik L1k melalui pakan untuk pengendalian Streptococcosis pada ikan nila
Oreochromis niloticus. [Skripsi]. Bogor: Institut Pertanian Bogor.
Huisman EA. 1987. Principles of Fish Production. Departement of Fish Culture and Fisheries, Wageningen Agricultural University, Nedherland.
22
Irianto A. 2005. Patologi Ikan Teleostei. Gadjah Mada University Press. Yogyakarta.
Irianto A, Austin B. 2002. Review probiotics in aquaculture. Journal Fish Diseases 25: 633.
Kalaiselvi S, Panneerselvam A. 2011. Invitro assessment of antagonistic activity of Trichoderma sp. against Sarocladium oryzae causing sheath rot disease in paddy. International Journal of Applied Biology and Pharmaceutical Technology. 2 (1): 179-183.
Kumar MP, Ramulu KS. 2013. Haematological changes in Pangasius hypophthalmus infected with Aeromonas hydrophila. International Journal of Food, Agriculture and Veterinary Sciences 3: 70-75.
Lupatsch I, Santos GA, Schrama JW, Verreth JAJ. 2009. Effect of stocking density and feeding level on energy expenditure and stress responsiveness in European sea bass Dicentrarchus labrax. Aquaculture 298: 245-250.
Madigan MT, Martinko JM, Stahl DA, Clark DP. 2011. Brock Biology of Microorganisms. 13th ed. San Francisco (USA): Pearson Education Inc. Magnadottir B. 2010. Immunological control of fish disease [review]. Marine
Biotechnology. 12: 361-379.
Mocanu M, Cristea V, Dediu L, Bocioc E, Grecu RI, Ion S, Vasilean I. 2010. The effect of probiotic diet on growth and hematology parameters of rainbow trout (Oncorhynchus mykiss, Walbaum 1792). Lucrari Stiintifice-Sera Zootheniie 59: 258-263.
Nayak SK. 2010. Probiotic and immunity: A fish perspective. Fish and shellfish immunology 29:1-14.
Nayak SK. 2011. Biology of eukaryotic probiotics. In Liong, M.T (Ed). Textbook of biology, genetics and health aspects, probiotics. London: Springer. 29-55. Ravi AV, Musthafa KS, Jegathammbal G, Kathiresan K, Pandian SK. 2007. Screening and evaluation of probiotics as a biocontrol agent against pathogenic vibrios in marine aquaculture. Applied Microbiology 45: 219-223.
Salinas I, Cuesta A, Esteban MA, Meseguer J. 2005. Dietary administration of
Lactobacillus delbrueckii and Bacillus subtilis, single or combined, on
gilthead seabream cellular innate mmune responses. Fish & Shellfish
Immunology 19:67-77.
Santoso RA. 2013. Aplikasi berbagai dosis bakteri proteolitik L1k dalam pakan untuk pengendalian Streptococcosis pada ikan nila Oreochromis niloticus
dengan metode kohabitasi. [Skripsi]. Bogor: Institut Pertanian Bogor.
Secombes SJ. 1990. Isolation of Salmonid macrophage and analysis of their Killing activity. In Stolen, D.P. Fletcher, B.S. Anderson, M.V. and W.B. Winkel (Ed). Techniques in Fish Immunology. USA. SOS Publication: 137-152.
Sekar S, Surianarayanan M, Perinkulam RD, Bhuvanesh KS, Phani K, Asit BM. 2012. The metabolic advantage of choline lactate in growth media: an experimental analysis with Staphylococcus lentus. Applied Biochemistry and Biotechnology. 169: 380–392
Septi NA. 2014. Respons imun dan dinamika mikroba dalam budidaya ikan lele
23 Sharma I, Kumar A, Pramanik AK. 2009. Review of technique on isolation and identification of Aeromonads from food of animal and fish origin. Assam University Journal of Science and Technology: Biologycal Sciences. 4(1): 73-85.
Sorokulova IB, Pinchuk IV, Denayrolles M, Osipova IG, Huang JM, Cutting SM, Urdaci MC. 2007. The safety of two Bacillus probiotic strain for human use.
Digestive Diseases and Sciences 53: 954-963.
[SNI] Standar Nasional Indonesia. (2002). Ikan Lele Dumbo (Clarias gariepinus) Bagian 5 : Produksi Kelas Pembesaran di Kolam. SNI : 01-6484.5-2002. Badan Standardisasi Nasional. 1-9.
Takeuchi 1988. Laboratory Work-Chemical Evaluation of Dietary Nutriens. P.179 233, in Watanabe (Ed) Fish Nutrition and Mariculture. Kanagawa International Fisheries Training. Japan International Cooperation Agency. Japan.
Uddin N, Al-Harbi AH. 2010 Bacterial population of African catfish, Clarias gariepinus (Burchell 1822) cultured in earthen ponds. Journal of Applied Aquaculture 22:187–193
Uddin N, Al-Harbi AH. 2012. Bacterial Flora of Polycultured Common Carp (Cyprinus carpio) and African Catfish (Clarias gariepinus). International Aquatic Research. 4(10): 1-9.
Veersamy R, Min LS, Mohanraj, Pauline R, Sivadasan S, Varghese C, Rajak H, dan Marimuthu K. 2014. Effect of aqueous extract of Polygonum minus leaf on the immunity and survival of African catfish (Clarias gariepinus).
Journal of Coastlife Medicine 2 (3): 209 – 213.
Wijaya A. 2011. Pengaruh pemberian bakteri probiotik (Bacillus sp.) pada media pemeliharaan terhadap kelangsungan hidup benih ikan nila (Oreochromis niloticus) yang terinfeksi Streptococcus agalactiae. [Skripsi]. Jatinagor: Universitas Padjajaran.
24
LAMPIRAN
Lampiran 1 Pengukuran kadar hematokrit
Darah dihisap dengan menggunakan tabung mikrohematokrit dengan sistem kapiler. Setelah kira-kira mencapai kurang lebih ¾ bagian tabung, ditutup dengan bahan penutup (critoseal). tabung kapiler yang berisi darah kemudian disentrifuge
dengan kecepatan putaran 1500 rpm selama 5 menit. Pengukuran dilakukan dengan membandingkan bagian darah yang mengendap dengan seluruh bagian darah yang ada dalam tabung mikrohematokrit.
Lampiran 2 Penghitungan diferensial leukosit
Pengamatan diferensial leukosit dilakukan dengan mengamati preparat ulas darah yang diwarnai dengan pewarna Giemsa di bawah mikroskop. Pembuatan preparat ulas darah dilakukan dengan menempatkan setetes darah pada gelas obyek, dibuat preparat ulas dan dibiarkan kering udara kemudian diwarnai. Terlebih dahulu dilakukan fiksasi dengan merendam preparat yang telah kering ke dalam metanol selama 5 menit, kemudian dikeringkan dalam udara, setelah itu dimasukkan ke dalam larutan Giemsa 10% selama 30 menit. Setelah diwarnai, preparat dikeringkan dan siap untuk diamati di bawah mikroskop dengan perbesaran 1000 x. Pengamatan dan penghitungan masing-masing jenis sel dilakukan hingga jumlah semua jenis sel mencapai 100.
Lampiran 3 Pengukuran Respiratory Burst Activity
Darah dari ikan sampel diambil sebanyak 50 µl dimasukkan dalam microplate, diinkubasi selama 1 jam suhu 37oC, kemudian supernatan dibuang dan dicuci PBS 50 µl sebanyak 3 kali, ditambahkan 50 µl NBT 0,2% diinkubasi selama 1 jam suhu 37oC. Fiksasi metanol 100% (50 µl) 2-3 menit lalu dibilas dengan metanol 30% (50 µl) 3 kali dan dikering udarakan, kemudian ditambah KOH 60 µl + DMSO 70 µl dan pengecekkan optical density (ELISA Reader 540nm).
Lampiran 4 Pengukuran Aktivitas Lisozim
25
RIWAYAT HIDUP
Penulis dilahirkan di Sidoarjo pada tanggal 28 Januari 1990 dari Bapak Syaiful Anam dan Ibu Siti Aminah. Penulis merupakan putri kedua dari tiga bersaudara.
Tahun 2008 penulis lulus dari Sekolah Menengah Atas Negeri 1 Krian dan melanjutkan pendidikan Strata satu di Program Studi Budidaya Perairan, Fakultas Perikanan dan Kelautan, Universitas Airlangga. Tahun 2012 penulis telah menyelesaikan program sarjana dan pada tahun yang sama penulis bekerja di Pembenihan Udang Vanamei PT. Perahu Mas Makmur Situbondo. Tahun 2013 penulis melanjutkan studi di Program Studi Ilmu Akuakultur, Sekolah Pasca Sarjana, Institut Pertanian Bogor melalui Beasiswa Pendidikan Pascasarjana Dalam Negeri yang diberikan oleh Direktorat Jendral Pendidikan Tinggi (DIKTI) Kementrian Pendidikan dan Kebudayaan (KEMENDIKBUD).
Penulis telah mempresentasikan hasil penelitian yang berjudul “Evaluasi
Pemberian Probiotik Multispesies melalui Media Budi Daya Ikan Lele Dumbo (Clarias gariepinus) untuk Pencegahan Penyakit Motile Aeromonads Septicemia”
pada seminar hasil Sekolah Pascasarjana IPB. Artikel yang berjudul ”Evaluasi
Pemberian Probiotik Multispesies melalui Media Budi Daya Ikan Lele Dumbo (Clarias gariepinus) untuk Pencegahan Penyakit Motile Aeromonads Septicemia”