KORELASI POPULASI
Klebsiella
DAN JUMLAH KOPI GEN
PENYANDI KOBALT-PREKORIN-5A-DEASILASE (
cbiG
)
PADA TEMPE
ANALEKTA TIARA PERDANA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Korelasi Populasi
Klebsiella dan Jumlah Kopi Gen Penyandi Kobalt-Prekorin-5A-Deasilase (cbiG) pada Tempe adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Analekta Tiara Perdana
RINGKASAN
ANALEKTA TIARA PERDANA. Korelasi Populasi Klebsiella dan Jumlah Kopi Gen Penyandi Kobalt-Prekorin-5A-Deasilase (cbiG)pada Tempe. Dibimbing oleh ANTONIUS SUWANTO dan LILIS NURAIDA.
Klebsiella pneumoniae sebagai anggota dari famili Enterobacteriaceae
merupakan salah satu mikrob yang penting dalam menghasilkan vitamin B12 pada tempe. Gen cbiG adalah salah satu gen penting pensintesis vitamin B12 yang mengkodekan kobalt-prekorin-5A-deasilase dan gen ini dimiliki oleh Klebsiella
penghasil vitamin B12. Real Time Quantitative Polymerase Chain Reaction
(qPCR) digunakan untuk mendeteksi dan mengkuantifikasi keberadaan mikrob, sekuen DNA tertentu, ekspresi gen dan lain sebagainya. Suatu sekuen DNA diamplifikasi, kemudian produk hasil amplifikasi dianalisis dan dikuantifikasi dalam waktu yang bersamaan secara real time. Korelasi antara jumlah populasi
Klebsiella pada tempe dan kopi gen cbiG dilakukan menggunakan qPCR. Penelitian ini dilakukan untuk mengevaluasi korelasi jumlah populasi Klebsiella
pada tempe dan jumlah kopi gen cbiG sebagai indikator produksi vitamin B12 pada tempe dengan tingkat kematangan berbeda (24, 48 dan 72 jam).
Sampel tempe diambil dari pengrajin tempe Empang (EMP) dan Warung Jambu (WJB) di Bogor setelah fermentasi tempe selesai (36 jam) kemudian disimpan selama 24, 48 dan 72 jam pada suhu ruang. Kuantifikasi Klebsiella dari tempe dilakukan menggunakan metode pengenceran dan diinokulasikan pada
Eosin Methylene Blue Agar (EMBA) menggunakan metode cawan sebar. Isolat
Klebsiella yang tumbuh pada EMBA dihitung dan dilakukan uji aktivitas degradasi sitrat pada Simmons’ Citrate Agar (SCA). DNA total diekstraksi dari tempe EMP dan WJB dan digunakan sebagai cetakan (template) DNA untuk mengamplifikasi gen cbiG menggunakan dua pasang primer spesifik Klebsiella, cbiG-Fdan cbiG-R dengan gen target 755 bp, serta cbiG-Fnew2 dan cbiG-Rnew2 dengan gen target 250 bp. Ekstrak DNA tempe EMP dan WJB juga digunakan sebagai cetakan untuk mengkuantifikasi kopi gen cbiG menggunakan primer cbiG -Fnew2dan cbiG-Rnew2 melalui qPCR.
Seluruh isolat Klebsiella dari tempe EMP dan WJB menunjukkan karakteristik khusus Klebsiella, yaitu berbentuk bulat, mukoid dan berwarna ungu di bagian tengah koloni pada EMBA. Klebsiella juga mampu mendegradasi sitrat yang terlihat melalui perubahan warna dari hijau menjadi biru pada SCA. Jumlah populasi Klebsiella meningkat berdasarkan tingkat kematangan tempe. Tempe umur 24 jam memiliki jumlah populasi Klebsiella yang lebih rendah dibandingkan tempe umur 48 jam, begitu pula tempe umur 48 jam memiliki jumlah populasi
Klebsiella yang lebih rendah dibandingkan tempe umur 72 jam. DNA genom setiap sampel tempe berhasil diisolasi dan gen cbiG juga berhasil diamplifikasi menggunakan PCR. Pita hasil PCR memiliki intensitas yang beragam. Intensitas pita tersebut meningkat berdasarkan tingkat kematangan tempe yang menunjukkan bahwa tempe umur 72 jam memiliki gen cbiG yang paling tinggi dibandingkan dengan tempe umur 48 dan 24 jam. Hasil kuantifikasi kopi gen
populasi Klebsiella berkorelasi dengan jumlah kopi gen cbiG yang meningkat berdasarkan tingkat kematangan tempe tersebut.
SUMMARY
ANALEKTA TIARA PERDANA. Correlation of Klebsiella Population and Copy Numbers of Cobalt-Precorrin-5A-Deacylase Gene (cbiG) in Tempeh. Supervised by ANTONIUS SUWANTO and LILIS NURAIDA.
Klebsiella pneumoniae a member of Enterobacteriaceae family is one of major vitamin B12 producing bacteria in tempeh. cbiG gene is one of vitamin B12 essential biosynthetic gene which encodes cobalt-precorrin-5A-deacylase and it belongs to vitamin B12 producing Klebsiella. Real Time Quantitative Polymerase Chain Reaction (qPCR) was commonly used to detect and quantify the existence of certain microbes, DNA sequences, gene expressions etc. Those DNA sequences were amplified then the amplification products will be analyzed and quantified simultaneously. Correlation between Klebsiella population in tempeh and copy numbers of cbiG gene were studied employing qPCR. The aim of this study was to evaluate correlation between the numbers of Klebsiella population in tempeh and copy numbers of cbiG gene as an indicator of vitamin B12 production during different stages of tempeh maturation (24, 48 and 72 hours).
Tempeh samples were taken from Empang (EMP) and Warung Jambu (WJB) tempeh producers in Bogor after the tempeh fermentation had completed (36 hours) and stored for 24, 48 and 72 hours at room temperature. Quantification of Klebsiella from tempeh was carried out by dilution method and inoculated on Eosin Methylene Blue Agar (EMBA) using spread plate method. Klebsiella
isolates which grow on EMBA were counted and tested for citrate degrading activities on Simmons’ Citrate Agar (SCA). Total DNA was extracted from EMP and WJB tempeh and used as DNA templates to amplify cbiG gene employing two sets of K. pneumoniae specific primers, cbiG-F and cbiG-R with target gene of approximately 755 bp amplicon, then cbiG-Fnew2 and cbiG-Rnew2 with target gene of approximately 250 bp amplicon. DNA extracts of EMP and WJB tempeh were also used as templates to quantify copy numbers of cbiG gene employing cbiG -Fnew2 and cbiG-Rnew2 primers by qPCR.
All Klebsiella isolates from EMP and WJB tempeh showed specific characteristics of Klebsiella that were round shape, mucoid and purple color in the center of the colony on EMBA. Klebsiella were also able to degrade citrate with color change of SCA from green into blue color. Numbers of Klebsiella
population were increased based on the stages of tempeh maturation. 24 hours tempeh contained lower numbers of Klebsiella population than 48 hours tempeh and also 48 hours tempeh contained lower numbers of Klebsiella population than 72 hours tempeh. Each genomic DNA of tempeh samples was extracted successfully and cbiG gene was amplified well using PCR. Bands of PCR result had various intensities which indicate numbers of cbiG gene. The band intensities increased based on the stages of tempeh maturation, such that 72 hours tempeh had highest number of cbiG gene than 48 or 24 hours tempeh. Result of cbiG gene copy numbers quantification employing qPCR indicated that copy numbers of
showed that numbers of Klebsiella population were correlated with copy number of cbiG gene that increased based on the stages of tempeh maturation.
Keywords: cbiG gene,K. pneumoniae, qPCR, Tempeh, Vitamin B12.
©
Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
KORELASI POPULASI
Klebsiella
DAN JUMLAH KOPI GEN
PENYANDI KOBALT-PREKORIN-5A-DEASILASE (
cbiG
)
PADA TEMPE
ANALEKTA TIARA PERDANA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan dari bulan Maret sampai dengan Desember 2014 ini ialah vitamin B12 pada tempe, dengan judul Korelasi Populasi
Klebsiella dan Jumlah Kopi Gen Penyandi Kobalt-Prekorin-5A-Deasilase (cbiG) pada Tempe.
Terima kasih penulis ucapkan kepada Bapak Prof Dr Ir Antonius Suwanto, MSc dan Ibu Prof Dr Ir Lilis Nuraida, MSc selaku pembimbing yang telah memberikan nasehat, saran, motivasi, waktu luang untuk konsultasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Prof Dr Ir Made Astawan, MS dan Prof Dr Anja Meryandini, MS selaku Ketua Program Studi Mikrobiologi IPB, yang telah memberikan masukan pada saat ujian sidang tesis untuk membuat karya ilmiah ini menjadi lebih baik. Kepada DIKTI melalui Beasiswa Unggulan 2012/2013 terima kasih atas kepercayaannya untuk memberikan beasiswa kuliah selama menempuh pendidikan pascasarjana di IPB, dan dana DIPA IPB 2014 atas nama Prof Dr Ir Antonius Suwanto, MSc dengan kode mak: 2013.089.521219 sehingga penelitian yang penulis lakukan dapat terlaksana dengan baik.
Penulis juga ingin menyampaikan terima kasih kepada Dr Susan Soka, MSc yang telah membantu mengurus segala keperluan di Laboratorium. Seluruh staf teknisi di Laboratorium Universitas Katolik Atma Jaya yang telah membantu penulis selama melakukan penelitian serta ucapan terima kasih kepada Mba A’yun, Mba Allia, Kak Cidy dan Kak Evelin sebagai partner selama penelitian. Kepada Ketua Prodi Biologi (Bioteknologi) Universitas Al Azhar Indonesia Dr Nita Noriko, MS serta dosen-dosen Arif Pambudi, MSi, Dr Dewi Elfidasari, Dr Hidayat Yorianta, Riris L. Puspitasari, M.Si, Dr Taufik Wisnu dan Dr Yunus Effendi, terima kasih atas dukungan, saran dan izin kerja selama penulis menyelesaikan pendidikan.
Ucapan terima kasih penulis sampaikan juga kepada orang tua, Bapak M. Sahudin dan Ibu Sriyanti serta adik, Belia Perwitasari Maharani dan Arjuna Kemal Pasha. Di samping itu, penulis juga mengucapkan terima kasih kepada seseorang terdekat dan terkasih serta sahabat-sahabat tersayang Bio8, Mikrotropisian Genges, Mikrotropisian 2014 atas segala doa, dukungan serta kasih sayang yang telah diberikan. Tak lupa kepada seluruh keluarga, rekan-rekan dan sahabat yang tidak dapat disebutkan satu per satu yang telah membantu selama penulis menyelesaikan pendidikan, terima kasih. Semoga karya ilmiah ini dapat bermanfaat bagi kemajuan ilmu pengetahuan selanjutnya.
Bogor, Agustus 2015
DAFTAR ISI
Real Time Quantitative Polymerase Chain Reaction (qPCR) 6
METODE 8
Jumlah Klebsiella pada Tempe 11
DAFTAR GAMBAR
1 Struktur vitamin B12 dan struktur parsial vitamin B12 5 2 Jalur biosisntesis adenosilkobalamin dan kofaktor tetrapirol lain pada
bakteri 6
3 Kurva hasil qPCR 7
4 Tahapan kerja penelitian 8
5 Koloni Klebsiella 12
6 Jumlah Klebsiella pada tempe EMP dan WJB umur 24, 48 dan 72 jam 13
7 Hasil ekstraksi DNA genom 15
8 Hasil amplifikasi menggunakan primer cbiG-F dan cbiG-R 16 9 Hasil amplifikasi menggunakan primer cbiG-Fnew2 dan cbiG- Rnew2 16 10 Jalur biosintesis kobalamin pada bakteri enterik 17 11 Jumlah kopi gen cbiG pada tempe EMP dan WJB umur 24, 48 dan 72
jam 18
12 Korelasi antara jumlah Klebsiella dan jumlah kopi gen cbiG (R2 > 0.804) 19
DAFTAR LAMPIRAN
1 Gambar metode pembuatan tempe EMP dan WJB 24
2 Komposisi media 24
3 Tabel data kuantifikasi Klebsiella 25
4 Tabel hasil nano drop 26
5 Gambar kurva standar qPCR 26
PENDAHULUAN
Latar Belakang
Tempe merupakan makanan tradisional khas Indonesia yang dibuat menggunakan kultur campuran Rhizopus spp., terutama Rhizopus oligosporus, R. oryzae, R. arhizus, R. stolonifer dan R. microspores. Pembuatan tempe dilakukan dalam empat tahap, yaitu perendaman, perebusan, penginokulasian mikrob dan penyimpanan (inkubasi) pada suhu ruang. Keempat tahap pembuatan tempe ini mengalami modifikasi dari satu daerah ke daerah lain, dan dari satu produsen ke produsen lain, sehingga menghasilkan berbagai macam variasi tempe di Indonesia (Astuti et al. 2000).
Tempe memiliki rasa dan tekstur yang menarik, daya cerna yang sangat tinggi, serta beberapa efek positif terhadap kesehatan seperti mengurangi risiko penyakit jantung, stroke, osteoporosis, kanker, kelainan pencernaan, serta gejala-gejala menopause (Babu et al. 2009). Tempe juga kaya akan nutrisi dan substansi aktif seperti protein dan nitrogen terlarut, asam amino dan asam lemak bebas, isoflavon, serta vitamin B12 (Astuti et al. 2000). Kandungan vitamin B pada tempe, khususnya vitamin B12 bersifat sangat unik. Kedelai sebagai bahan baku fermentasi tempe tidak mengandung vitamin B12, sedangkan tempe sebagai hasil fermentasi kedelai mengandung vitamin B12.
Vitamin B12 dapat diperoleh dari sumber makanan hewani (daging, susu, telur, ikan) dan tidak dapat diperoleh dari sumber makanan nabati. Beberapa makanan fermentasi seperti tempe mengandung vitamin B12 sehingga dapat dijadikan sebagai salah satu sumber vitamin B12, terutama bagi para vegetarian (O’leary dan Samman 2010). Vitamin ini disintesis oleh Citrobacter freundii dan
K. pneumoniae saat fermentasi (Keuth dan Bisping 1994). K. pneumoniae
merupakan produsen terbaik dari vitamin B12 aktif jika dibandingkan dengan galur kapang dan bakteri lain yang diisolasi dari sampel air rendaman dan tempe Indonesia (Keuth dan Bisping 1993).
Keberadaan bakteri penghasil vitamin B12, terutama K. pneumoniae telah dipelajari secara ekstensif. Okada (1989) melakukan isolasi dan identifikasi bakteri penghasil vitamin B12 pada tempe Bogor. Sebagian besar bakteri penghasil vitamin B12 diidentifikasi sebagai K. pneumoniae, selain itu juga ditemukan
K. terrigena atau K. planticola dan K. pneumoniae sub. ozaenae sp. Berdasarkan analisis sekuen 16S rRNA, K. pneumoniae dan Klebsiella sp. merupakan bakteri dominan yang terdapat pada tempe (Barus et al. 2008) yang secara genetik berbeda dengan isolat medis (Ayu et al. 2014)
Keberadaan K. pneumoniae juga dapat dideteksi melalui keberadaan gen pensintesis vitamin B12 itu sendiri. Salah satu gen penting pensintesis vitamin B12 adalah gen cbiG sebagai penyandi kobalt-prekorin-5A-deasilase. Gen cbiG
2
kuantifikasi E.coli O157:H7 pada makanan dan sampel klinis, juga pada sampel lingkungan (Ibekwe dan Grieve 2003).
Perumusan Masalah
Fermentasi tempe merupakan suatu proses yang sangat kompleks dan melibatkan berbagai macam mikrob. Berdasarkan penelitian sebelumnya, selain kapang sebagai mikrob utama, mikrob lain seperti famili Enterobacteriaceae, bakteri asam laktat (BAL) dan spora bakteri turut berperan dalam menentukan kualitas akhir tempe. Terdapat penelitian yang melaporkan bahwa K. pneumoniae
merupakan penghasil vitamin B12 pada tempe, sehingga informasi jumlah
K. pneumoniae diperlukan sebagai dasar penentuan jumlah gen pensintesis vitamin B12. Oleh karena itu, penelitian ini akan menjawab: 1) berapakah jumlah
Klebsiella sebagai bakteri penghasil vitamin B12 pada tempe; 2) berapakah jumlah kopi gen cbiG selaku gen pensintesis vitamin B12 pada tempe; dan 3) bagaimanakah korelasi antara jumlah Klebsiella dan kopi gen cbiG pada tempe.
Tujuan Penelitian
Penelitian ini dilakukan untuk mengevaluasi korelasi jumlah populasi
Klebsiella dan jumlah kopi gen cbiG sebagai indikator produksi vitamin B12 pada tempe dengan tingkat kematangan yang berbeda (24, 48 dan 72 jam).
Manfaat Penelitian
Penelitian ini memberikan informasi mengenai korelasi jumlah Klebsiella
dan kopi gen cbiG pada tempe dengan tingkat kematangan yang berbeda (24, 48 dan 72 jam). Korelasi ini diharapkan dapat menjadi rujukan bagi para konsumen dalam menentukan masa simpan dan waktu konsumsi tempe.
Ruang Lingkup Penelitian
Penelitian meliputi pengambilan sampel tempe, isolasi Klebsiella, isolasi DNA genom tempe, amplifikasi gen cbiG dan kuantifikasi gen cbiG pada tempe dengan tingkat kematangan yang berbeda (24, 48 dan 72 jam).
Hipotesis
3
TINJAUAN PUSTAKA
Tempe
Tempe merupakan produk fermentasi kedelai yang dibuat dan dikonsumsi oleh masyarakat Jawa Tengah menggunakan spesies Rhizopus sejak tahun 1700-an. Tempe yang berasal dari kacang kedelai merupakan salah satu jenis tempe yang paling populer, sehingga istilah tempe merujuk kepada tempe kedelai
tersebut. Produsen tempe di Indonesia tidak menggunakan kultur murni
R. oligosporus dalam fermentasi tempe, tetapi menggunakan kultur campuran
Rhizopus spp. (Astuti et al. 2000). Kultur campuran tersebut kemudian disimpan selama 24 jam hingga menghasilkan produk bertekstur kompak dengan rasa kacang-kacangan dan tekstur yang kenyal seperti jamur (Babu et al. 2009).
Kapang merupakan mikrob penting yang berperan dalam fermentasi tempe, namun dua kelompok bakteri lain yaitu kelompok bakteri penghasil asam laktat dan kelompok bakteri penghasil vitamin B12 juga berperan dalam proses tersebut. Biji kedelai awalnya dimasak di dalam drum, kemudian direndam di dalam air selama satu malam. Pada fase ini, kelompok bakteri penghasil asam laktat bekerja menurunkan pH menjadi kurang dari 4. Penurunan pH sangat penting untuk tahap fermentasi selanjutnya, karena pH yang rendah dapat mencegah pertumbuhan bakteri yang tidak diinginkan dan meningkatkan pertumbuhan kapang. Kapang tersebut akan menghasilkan enzim yang dapat mendekomposisi protein kedelai, kemudian melepaskan amonia yang dapat meningkatkan pH. Hal ini mengundang bakteri lain yang menyukai pH netral dan beberapa di antara mereka merupakan kelompok bakteri penghasil vitamin B12 (Okada 1989).
Fermentasi kedelai menjadi tempe merupakan suatu dinamika dari berbagai komposisi mikrobiologi secara berkelanjutan hingga menghasilkan enzim dan senyawa bioaktif. Proses ini juga dapat memperbaiki kualitas organoleptik dan nilai nutrisi dari suatu bahan makanan. Kandungan protein pada tempe cukup tinggi (40-50% berat kering) sehingga dapat digunakan sebagai pengganti daging atau ikan. Protease, lipase, serta berbagai macam karbohidrat juga diproduksi pada saat fermentasi. Substansi tersebut memungkinkan terjadinya degradasi makromolekul menjadi substansi yang lebih rendah berat molekulnya sehingga dihasilkan tempe dengan tekstur, rasa dan aroma yang diinginkan (Nout dan Kiers 2005).
Klebsiella pada Tempe
Rasa yang menarik serta tekstur yang lembut, membuat tempe disukai oleh berbagai kalangan, bahkan di Amerika dan Eropa (Iljas et al. 1973). Rhizopus
4
ini termasuk ke dalam bakteri Gram negatif, berbentuk batang serta tidak sensitif terhadap senyawa antibakteri yang diproduksi oleh kapang selama fermentasi (Liem et al. 1977).
Okada (1989) mengevaluasi produktivitas vitamin B12 pada berbagai macam mikrob hasil isolasi dari tempe Bogor. Isolat nomor 22 sebagai penghasil vitamin B12 tertinggi yaitu 1350 ng/(sel dalam 5 mL kultur) atau setara dengan 0.27 mg/L diidentifikasi sebagai K. pneumoniae. Keuth dan Bisping (1993) menginvestigasi bakteri yang berperan dalam pembentukan vitamin B12. Sejumlah 16 isolat dari 37 isolat dapat tumbuh dengan baik pada media tanpa vitamin B12 dan diidentifikasi sebagai Enterobacteriaceae, terutama Enterobacter spp.,
C. freundii dan K. pneumoniae. K. pneumoniae merupakan galur bakteri yang menghasilkan vitamin B12 dalam jumlah besar, selain C. freundii.
Studi asosiasi antara bakteri dengan kapang pada saat fermentasi tempe menunjukkan bahwa K. pneumoniae berkontribusi pada saat fermentasi dengan jumlah mencapai 106-107 CFU/g (Mulyowidarso et al. 1989). Barus et al. (2008) menemukan bahwa jumlah Enterobacteriaceae mencapai 103-104 CFU/mL dan
K. pneumoniae merupakan salah satu bakteri dominan pada tempe. Ayu et al. (2014) berhasil mengidentifikasi sejumlah isolat bakteri sebagai K. pneumoniae
dan berdasarkan Enterobacterial Repetitive Intergenic Consensus-Polymerase Chain Reaction (ERIC-PCR), isolat tersebut berbeda secara genetis dengan
K. pneumoniae patogen dan isolat medis K. pneumoniae.
Vitamin B12 pada Tempe
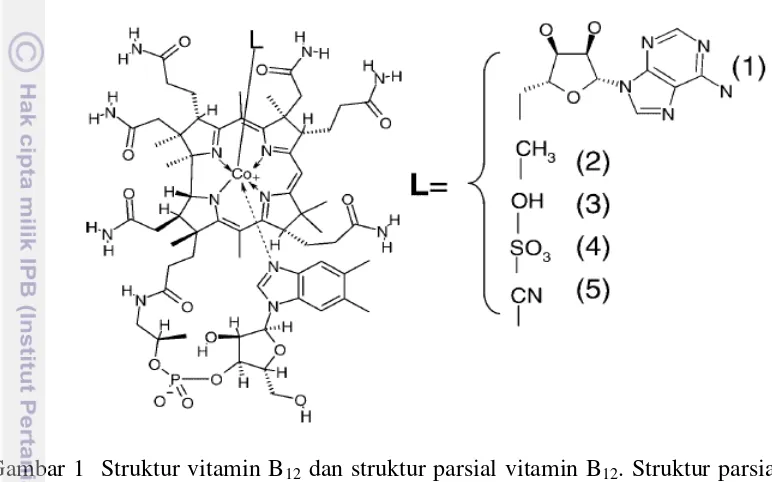
Vitamin B12 adalah vitamin terkompleks dengan berat molekul terbesar. Istilah vitamin B12 biasanya terbatas pada sianokobalamin, padahal vitamin B12 secara luas menggambarkan kobalamin. Kobalamin merupakan istilah yang digunakan untuk kelompok senyawa yang mengandung kobalt (korinoid) dengan
ligan aksial bawah berupa kobalt yang berikatan dengan nukleotida (5,6-dimetilbenzimidazol), serta ligan atas yang menjadi pembeda antara
masing-masing jenis kobalamin (Gambar 1) (Watanabe 2007). Jenis atau bentuk kobalamin tersebut meliputi siano-, metil-, deoksiadenosil-, dan hidroksi-kobalamin (O’leary dan Samman 2010).
Bentuk sianokobalamin digunakan pada sebagian besar suplemen dan akan
diubah menjadi bentuk koenzim kobalamin (metilokobalamin dan 5’-deoksiadenosilkobalamin) di dalam tubuh manusia (Watanabe 2007). Koenzim
ini dibutuhkan oleh metilmalonil-KoA mutase (MMCM) untuk mengubah metilmalonil-KoA menjadi suksinil-KoA dan metionin sintase (METH) untuk mensintesis purin dan pirimidin (O’leary dan Samman 2010).
5 (1-2.5), dan makanan turunan susu (0.3-2.4). Vitamin ini sayangnya tidak ditemukan pada bahan makanan nabati secara alami. Rumput laut dan jamur dilaporkan mengandung analog vitamin B12, namun tidak aktif dalam tubuh manusia. Beberapa makanan yang terkontaminasi atau terfermentasi oleh bakteri seperti tempe dilaporkan mengandung vitamin B12 (O’leary dan Samman 2010), namun kedelai sebagai bahan baku pembuat tempe dilaporkan tidak mengandung vitamin B12 (Liem et al. 1977).
Gambar 1 Struktur vitamin B12 dan struktur parsial vitamin B12. Struktur parsial vitamin B12 hanya menunjukkan bagian molekul yang membedakan antara masing-masing vitamin B12, (1) 5’deoksiadenosilkobalamin, (2) metilokobalamin, (3) hidroksikobalamin, (4) sulfitokobalamin, (5) sianokobalamin
Beberapa hasil analisis mikrobiologi menunjukkan kadar vitamin B12 yang berbeda pada setiap sampel tempe Indonesia, yaitu 4 ng/g (Liem et al. 1977), 46 ng/g (Okada 1989) dan 1.8-41.4 ng/g (Areekul et al. 1990). Konsentrasi vitamin B12 dapat diukur melalui berbagai macam metode. Prinsip metode tersebut pada dasarnya tergantung pada struktur molekuler dari vitamin B12 itu sendiri dan reaksinya dengan substansi lain. Beberapa metode yang pernah digunakan adalah metode mikrobiologi, spektrofotometri, Electroluminescent
(ECL), Inductive-Coupled Plasma-Mass Spectrometry (ICP-MS), Atomic Absorption Spectroscopy, Radioimmunoassay (RIA), High Performance Liquid Chromatography (HPLC) dan Capillary Electrophoresis (CE). Pemilihan metode dalam mengukur konsentrasi vitamin B12 dilakukan berdasarkan jenis sampel, tujuan pengujian, waktu, biaya, sensitivitas dan spesifisitas (Karmi et al. 2011).
6
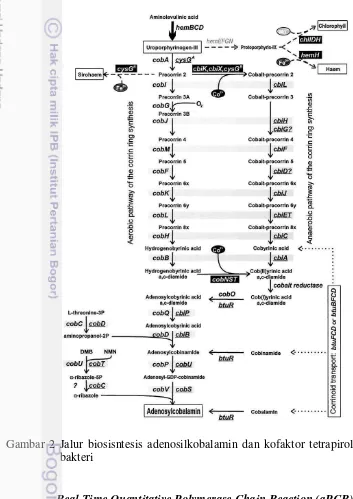
enterik yang dapat mensintesis kobalamin. Faktor penting yang mempengaruhi produksi kobalamin pada bakteri enterik adalah penambahan kobalt eksogenus. Jalur biosintesis kobalamin pada bakteri dapat terjadi secara anaerobik dan aerobik dengan perbedaan pada waktu insersi kobalt (Gambar 2) (Rodionov et al. 2003). Gen cbiG merupakan salah satu gen penting dalam sintesis vitamin B12.
cbiG sebagai penyandi kobalt-prekorin-5A-deasilase berfungsi mengkatalisis pembukaan cincin lakton dan ekstrusi dua potongan karbon (deasilasi) (Roessner dan Scott 2006).
Gambar 2 Jalur biosisntesis adenosilkobalamin dan kofaktor tetrapirol lain pada bakteri
Real Time Quantitative Polymerase Chain Reaction (qPCR)
7 gen (kopi gen). qPCR memungkinkan banyak percobaan yang tidak dapat dilakukan melalui PCR konvensional, selain itu qPCR juga tidak memerlukan penanganan sampel akhir (post-PCR sample handling) (Heid et al. 2015). Reporter berpendar (fluorescent reporter) yang dapat berikatan dengan produk PCR dibutuhkan dalam rekasi qPCR. Reporter ini menghasilkan fluoresensi jika sudah berikatan dengan produk PCR yang dihasilkan sebagai refleksi dari jumlah produk PCR (Kubista et al. 2006).
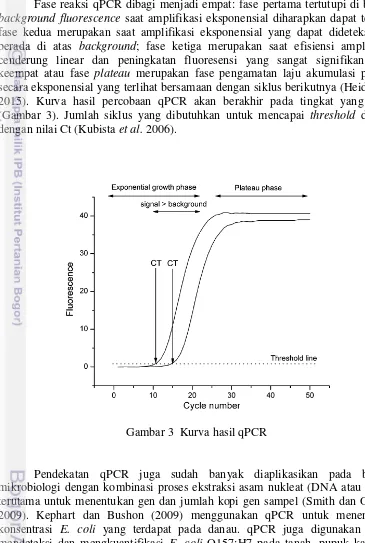
Fase reaksi qPCR dibagi menjadi empat: fase pertama tertutupi di bawah
background fluorescence saat amplifikasi eksponensial diharapkan dapat terjadi; fase kedua merupakan saat amplifikasi eksponensial yang dapat dideteksi dan berada di atas background; fase ketiga merupakan saat efisiensi amplifikasi cenderung linear dan peningkatan fluoresensi yang sangat signifikan; fase keempat atau fase plateau merupakan fase pengamatan laju akumulasi produk secara eksponensial yang terlihat bersamaan dengan siklus berikutnya (Heid et al.
2015). Kurva hasil percobaan qPCR akan berakhir pada tingkat yang sama (Gambar 3). Jumlah siklus yang dibutuhkan untuk mencapai threshold disebut dengan nilai Ct (Kubista et al. 2006).
Gambar 3 Kurva hasil qPCR
8
METODE
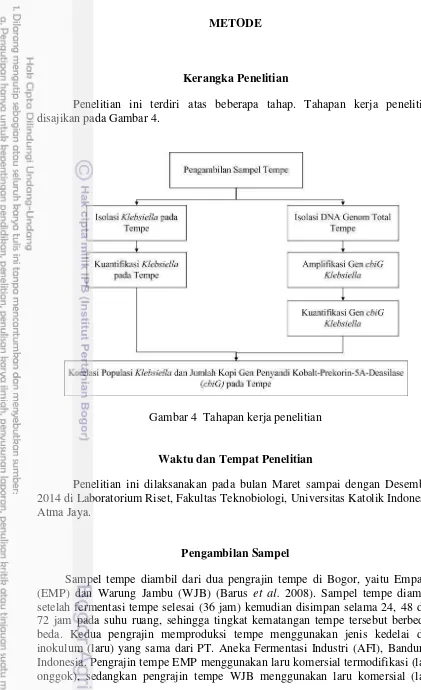
Kerangka Penelitian
Penelitian ini terdiri atas beberapa tahap. Tahapan kerja penelitian disajikan pada Gambar 4.
Gambar 4 Tahapan kerja penelitian
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Maret sampai dengan Desember 2014 di Laboratorium Riset, Fakultas Teknobiologi, Universitas Katolik Indonesia Atma Jaya.
Pengambilan Sampel
9 Raprima). Proses pembuatan tempe EMP dilakukan menggunakan metode pengolahan tempe Pekalongan dengan satu kali perebusan, sedangkan tempe WJB menggunakan metode pengolahan tempe Malang dengan dua kali perebusan. Karakteristik masing-masing sampel tempe dapat dilihat pada Tabel 1.
Tabel 1 Karakteristik sampel tempe
Tempe Umur Penampakan Karakteristik
10
diencerkan berseri. Suspensi tempe sejumlah 100 µL dari setiap pengenceran dipipet ke dalam cawan petri steril berisi EMBA (Difco) kemudian diinkubasi pada 37 0C selama 24 jam untuk menentukan jumlah sel total Klebsiella. Koloni berwarna ungu dan berbentuk mukoid yang tumbuh pada agar EMBA kemudian dianalisis lebih lanjut dengan menginokulasikan koloni tersebut pada SCA (Difco) dan diinkubasi pada 37 0C selama 24 jam. Klebsiella dapat mengubah warna SCA dari hijau menjadi biru sebagai hasil positif dari bakteri pendegradasi sitrat. Setiap pengujian dilakukan dengan tiga pengulangan.
Ekstraksi DNA
Sampel tempe sejumlah 25 g dihomogenisasi dalam 100 mL NaCl 0.85% (b/v) selama 1 menit menggunakan Variable Speed Laboratory Blender (Waring Laboratory and Sciences, Torrington). Suspensi tempe yang dihasilkan selanjutnya diambil sebanyak 9 mL dan disentrifugasi menggunakan Sorvall Legend RT (Thermo Scientific) dengan kecepatan 800xg selama 1 menit. Supernatannya diambil untuk disentrifugasi kembali dengan kecepatan 1300xg selama 5 menit (Seumahu et al. 2012). Pelet yang diperoleh selanjutnya dicuci dengan larutan Tris-EDTA (TE) pH 8.0 dan disentrifugasi lagi pada 1300xg selama 5 menit. Supernatan kemudian dibuang dan selanjutnya pelet siap diekstraksi dengan menggunakan Wizard® Genomic DNA Purification Kit (Promega). Total DNA genom dari tempe yang telah diekstraksi kemudian diverifikasi dengan elektroforesis pada 1% (b/v) gel agarosa (Bioline). Hasil ekstraksi DNA tersebut dihitung konsentrasinya menggunakan
NanodropTM 2000/2000c Spectrophotometers (Thermo Scientific) kemudian konsentrasinya disamakan.
Amplifikasi Gen cbiG
Gen cbiG diamplifikasi dari hasil ekstraksi DNA menggunakan primer spesifik gen cbiG dari K. pneumoniae yaitu cbiG-F (TGCTGCCGCTCACCTGCTAC) dan cbiG-R (GCAACCCCGGCTCGTTTGC), serta cbiG-Fnew2 (GAATACCGTAAAGCCTGAATCC) dan cbiG-Rnew2 (GCTGGCAAAGCCGCCGTTGAAG) (Alvin 2014). Amplifikasi DNA dilakukan menggunakan Polymerase Chain Reaction (PCR) T1-thermocycler (Biometra) dengan volume reaksi total 25 µL, yang berisi 2 µL template DNA, 12.5 µL GoTaqGreen® Master Mix (Promega), 1 µL primer forward dan reverse
11
Kuantifikasi Gen cbiG
Kurva standar dikonstruksi dengan melakukan pengenceran sepuluh kali pada DNA genom tempe WJB yang selanjutnya disebut sebagai standar. Konsentrasi DNA masing-masing standar dianggap sebagai jumlah kopi gen standar tersebut, kemudian reaksi qPCR dilakukan untuk mendapatkan threshold cycle value (nilai Ct). Nilai Ct tersebut selanjutnya dibandingkan dengan log
nuclease free water yang dimasukkan ke dalam 96-well thin wall PCR plate dan ditutup dengan seal. Reaksi qPCR dilakukan menggunakan IQ5 Real Time PCR Detection System (Biorad) dengan kondisi predenaturasi pada 94 0C selama 5 menit, diikuti dengan 35 siklus amplifikasi dengan tahap denaturasi pada 94 0C selama 30 detik, penempelan primer pada 60 0C selama 30 detik (Alvin 2014).
HASIL DAN PEMBAHASAN
Jumlah Klebsiella pada Tempe
Klebsiella berhasil diisolasi dari tempe EMP dan WJB menggunakan EMBA dan SCA. Koloni Klebsiella berbentuk mukoid dan bulat serta berwarna ungu di bagian tengah pada EMBA (Gambar 5a) dan menghasilkan warna biru pada SCA (Gambar 5b). Seluruh isolat Klebsiella dari tempe EMP dan WJB menunjukkan karakteristik khusus Klebsiella. Klebsiella dapat diidentifikasi menggunakan EMBA berdasarkan koloni yang berbentuk mukoid dan bulat serta berwarna ungu di bagian tengah. Identifikasi bakteri dari famili
Enterobacteriaceae dilakukan menggunakan EMBA karena media ini merupakan media selektif dan diferensial (Madigan dan Martiniko 2006). EMBA disebut media selektif karena media ini dapat menghambat pertumbuhan bakteri Gram positif. Kandungan laktosa pada EMBA dapat digunakan untuk membedakan bakteri yang dapat memfermentasikan laktosa sehingga media ini disebut sebagai media diferensiasi. Bakteri yang dapat memfermentasikan laktosa pada EMBA akan membentuk koloni dengan inti berwarna gelap, sedangkan bakteri lain tidak berwarna. Pewarna yang terdapat pada EMBA, yaitu eosin Y dan methylene blue
12
alkali sehingga bromotiol biru pada media akan mengubah warna SCA dari hijau menjadi biru sebagai karakter khusus Klebsiella sp. (Ayu et al. 2014).
(a) (b) dengan jumlah 6-7 log CFU/g. K. pneumoniae berperan dalam fermentasi tempe bersama dengan spesies dari famili Enterobacteriaceae lain, seperti C. diversus, Enterobacter agglomerans, Enterobacter cloacae, dan K. osaenae. Keberadaan bakteri ini diprediksi berasosiasi dengan proses perendaman kedelai, karena proses ini memungkinkan adanya pertumbuhan mikrob. Mikrob tersebut dapat memanfaatkan nutrisi yang terlarut dalam air rendaman sebagai substrat untuk pertumbuhan. Komposisi mikrob pada tempe ditentukan oleh berbagai faktor ekologi, seperti proses asidifikasi oleh BAL selama tahap perendaman, efek letal saat proses pemasakan, kontaminasi saat proses pendinginan, komposisi dan kesegaran inokulum, kondisi inkubasi, kondisi penyimpanan dan lain sebagainya (Nout dan Kiers 2005). Sebagian besar galur Klebsiella membutuhkan ion amonium atau nitrat sebagai sumber nitrogen dan karbon. Selain itu, beberapa isolat Klebsiella membutuhkan arginin atau adenin atau keduanya dan urasil sebagai faktor tumbuh (Brisse et al. 2006). Menurut Astuti et al. (2000), protein terlarut, kandungan nitrogen dan asam amino bebas mengalami peningkatan pada tempe, sehingga dapat digunakan sebagai sumber nitrogen untuk pertumbuhan
Klebsiella.
13 dibandingkan bubuk tempe semangit/overripe tempe (umur 72 jam). Tempe semangit juga memiliki intensitas rasa dan aroma yang lebih kuat serta warna yang lebih gelap dibandingkan dengan tempe segar. Batas masa simpan tempe adalah sekitar 3 hari (72 jam), setelah masa itu tempe tidak cocok lagi untuk dikonsumsi yang ditandai dengan tekstur yang terlalu lembek, warna lebih gelap dan berbau menyengat atau disebut tempe bosok (Puteri et al. 2015). Tempe jenis ini biasa digunakan sebagai bumbu dan bahan masakan (Andriani et al. 2014).
Gambar 6 Jumlah Klebsiella pada tempe EMP dan WJB umur 24, 48 dan 72 jam
Keberadaan Klebsiella pada penelitian ini dievaluasi dari dua sampel tempe di Bogor, yaitu tempe EMP dan WJB. Jumlah populasi Klebsiella pada tempe EMP lebih tinggi jika dibandingkan dengan WJB (Gambar 6). Hal ini sejalan dengan penelitian Barus et al. (2008) bahwa jumlah Enterobacteriaceae
pada tempe EMP segar lebih tinggi yaitu sekitar 8 log CFU/mL dibandingkan dengan tempe WJB yaitu sekitar 5 log CFU/mL. K. pneumoniae merupakan salah satu bakteri dominan pada tempe EMP dan Klebsiella sp. pada tempe WJB. Ayu
et al. (2014) telah mengisolasi 58 isolat bakteri dari tempe EMP dan WJB. Berdasarkan analisis gen 16S rRNA, K. pneumoniae teridentifikasi pada 13 isolat dari tempe EMP dan 10 isolat dari tempe WJB.
Tempe EMP dan WJB memiliki perbedaan pada metode pembuatan dan laru yang digunakan. Pengrajin tempe EMP menggunakan laru onggok, sedangkan pengrajin tempe WJB menggunakan laru Raprima. Laru onggok merupakan laru komersial termodifikasi yang dibuat dengan mencampurkan laru komersial dengan onggok. Proses pencampuran ini berkontribusi pada peningkatan jumlah Klebsiella pada tempe EMP, sehingga jumlah bakteri ini pada tempe EMP lebih tinggi dibandingkan dengan tempe WJB. Jumlah
14
penurunan jumlah Klebsiella pada tempe WJB. A’yun (2015) juga melaporkan bahwa proses perebusan dapat menurunkan jumlah Enterobacteriaceae, kecuali spesies bakteri resisten panas (Mulyowidarso et al. 1989).
Tempe sebagai makanan fermentasi tradisional Indonesia sebagian besar diproduksi oleh industri rumah tangga berskala kecil mencapai lebih dari 100,000 pengrajin yang tersebar di seluruh provinsi Indonesia (Astuti et al. 2000). Konsumsi tempe mengalami peningkatan tidak hanya di Indonesia, tetapi juga di negara lain. Hal ini terjadi karena kandungan nutrisi yang terkandung dalam tempe sangat lengkap, seperti protein, asam amino esensial, kalsium, asam lemak esensial, vitamin B, isoflavon, asam folat dan lain sebagainya (Babu et al. 2009). Selain kandungan nutrisi tempe yang sangat lengkap, tempe juga memiliki rasa dan tekstur yang menarik serta mudah untuk dicerna. Karakteristik tempe tersebut dapat terbentuk melalui proses fermentasi berupa dinamika berbagai komposisi mikrob. Fermentasi tidak hanya bertujuan untuk pengawetan makanan, tetapi juga dapat memodifikasi organoleptik dari suatu makanan dan peningkatan nilai nutrisi (Nout dan Kiers 2005).
Produksi tempe berbeda dari pengrajin satu ke pengrajin yang lain serta dipengaruhi oleh berbagai macam faktor. Proses pembuatan tempe tidak hanya melibatkan Rhizopus spp. sebagai mikrob utama, tetapi juga melibatkan mikrob lain seperti bakteri. Proses pembuatan tempe melalui fermentasi terdiri dari dua tahap, yaitu fermentasi oleh aktivitas bakteri dan kapang. Fermentasi oleh aktivitas bakteri terjadi selama proses perendaman kedelai, sedangkan fermentasi oleh aktivitas kapang terjadi setelah proses inokulasi Rhizopus spp. (Kustyawati 2009). Mikrob penting yang berperan dalam proses fermentasi tempe, terdiri atas kapang, serta dua kelompok bakteri yaitu kelompok bakteri penghasil asam laktat dan kelompok bakteri penghasil vitamin B12 (Okada 1989).
Keberadaan berbagai macam mikrob pada tempe dikarenakan oleh proses pembuatan tempe di Indonesia masih bersifat konvensional dan dalam kondisi yang tidak terkontrol. Pertumbuhan bakteri diawali oleh kelompok bakteri penghasil asam laktat, yaitu pada tahap perendaman kedelai yang ditandai dengan perubahan air rendaman menjadi lebih kental. Sejumlah BAL terdeteksi dalam air rendaman tersebut yang menyebabkan pH air menjadi kurang dari 4. Penurunan pH tersebut berperan penting dalam proses fermentasi oleh Rhizopus spp. yang juga dapat mencegah pertumbuhan bakteri yang tidak diinginkan. Saat pertumbuhan kapang terjadi, pH akan mengalami peningkatan dari 4 menjadi 6-6.5 atau mendekati pH netral. Kelompok bakteri penghasil vitamin B12 yang menyukai pH netral akan mengalami pertumbuhan dan menambahkan vitamin B12 ke dalam tempe. Jumlah vitamin B12 pada tempe dipengaruhi oleh tingkat kesegaran tempe (freshness). Tempe segar mengandung vitamin B12 yang lebih sedikit dibandingkan dengan tempe yang disimpan lebih lama (Okada 1989).
Keuth dan Bisping (1993) mengisolasi kapang dan bakteri dari tempe dan air rendaman untuk menentukan peran dari masing-masing mikrob tersebut dalam pembentukan vitamin. Vitamin B12 merupakan vitamin khas tempe yang tidak dapat diproduksi oleh kapang. Sejumlah 37 isolat bakteri dapat tumbuh pada media tanpa vitamin B12 yang menunjukkan bahwa bakteri ini dapat menghasilkan vitamin B12. Isolat bakteri tersebut diidentifikasi sebagai Enterobacteriaceae, yaitu Enterobacter spp., C. freundii dan K. pneumoniae. K. pneumoniae
15 tempe dipengaruhi oleh suhu fermentasi, penambahan kobalt dan 5,6-dimetilbenzimidazol (Keuth dan Bisping 1994). Jumlah populasi Klebsiella
sebagai bakteri penghasil vitamin B12 yang cukup tinggi menunjukkan kandungan vitamin B12 pada tempe EMP dan WJB secara kualitatif.
Amplifikasi Gen cbiG
DNA genom tempe EMP dan WJB berhasil diekstraksi menggunakan
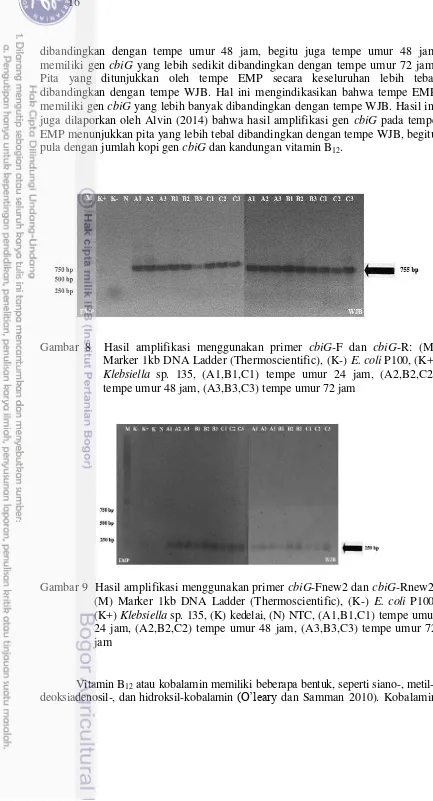
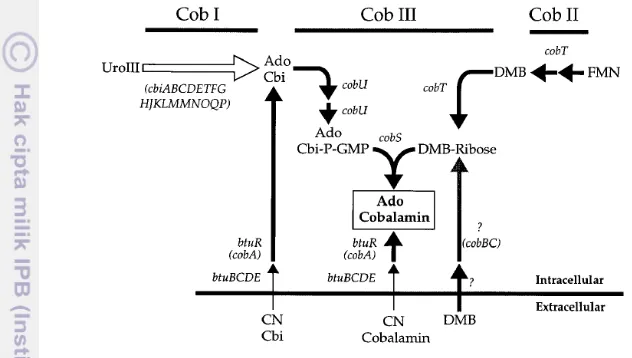
Wizard® Genomic DNA Purification Kit (Promega) (Gambar 7). Ekstrak DNA genom tempe EMP dan WJB digunakan sebagai cetakan (template) untuk amplifikasi gen cbiG. Amplifikasi gen cbiG menunjukkan bahwa setiap sampel tempe berhasil teramplifikasi menggunakan primer cbiG-F dan cbiG-R dengan gen target ±755 bp (Gambar 8) serta cbiG-Fnew2 dan cbiG-Rnew2 dengan gen target ±250 bp (Gambar 9). Gambar 8 dan 9 menunjukkan bahwa E. coli P100 sebagai kontrol negatif tidak mempunyai gen cbiG, sedangkan Klebsiella sp. 135 hasil isolasi dari tempe Indonesia sebagai kontrol positif mempunyai gen cbiG yang ditunjukkan dengan pita berukuran ±755 dan ±250 bp.
Gambar 7 Hasil ekstraksi DNA genom: (M) Marker 1kb DNA Ladder (Thermoscientific), (A1,B1,C1) tempe umur 24 jam, (A2,B2,C2) tempe umur 48 jam, (A3,B3,C3) tempe umur 72 jam
16
dibandingkan dengan tempe umur 48 jam, begitu juga tempe umur 48 jam memiliki gen cbiG yang lebih sedikit dibandingkan dengan tempe umur 72 jam. Pita yang ditunjukkan oleh tempe EMP secara keseluruhan lebih tebal dibandingkan dengan tempe WJB. Hal ini mengindikasikan bahwa tempe EMP memiliki gen cbiG yang lebih banyak dibandingkan dengan tempe WJB. Hasil ini juga dilaporkan oleh Alvin (2014) bahwa hasil amplifikasi gen cbiG pada tempe EMP menunjukkan pita yang lebih tebal dibandingkan dengan tempe WJB, begitu pula dengan jumlah kopi gen cbiG dan kandungan vitamin B12.
Gambar 8 Hasil amplifikasi menggunakan primer cbiG-F dan cbiG-R: (M) Marker 1kb DNA Ladder (Thermoscientific), (K-) E. coli P100, (K+)
Klebsiella sp. 135, (A1,B1,C1) tempe umur 24 jam, (A2,B2,C2) tempe umur 48 jam, (A3,B3,C3) tempe umur 72 jam
Gambar 9 Hasil amplifikasi menggunakan primer cbiG-Fnew2 dan cbiG-Rnew2: (M) Marker 1kb DNA Ladder (Thermoscientific), (K-) E. coli P100, (K+) Klebsiella sp. 135, (K) kedelai, (N) NTC, (A1,B1,C1) tempe umur 24 jam, (A2,B2,C2) tempe umur 48 jam, (A3,B3,C3) tempe umur 72 jam
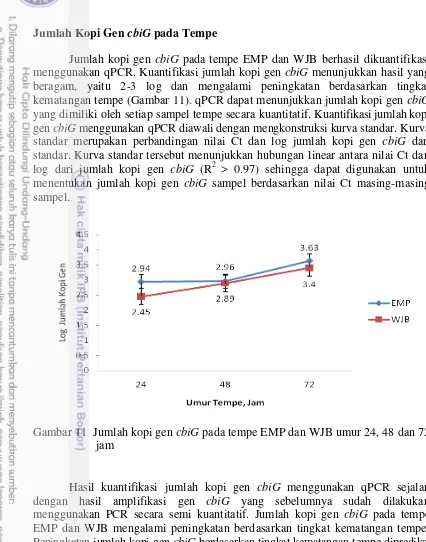
17 sebagaimana kobinamida merupakan turunan dari uroforfirinogen III sebagai prekursor pada sintesis heme, siroheme, dan klorofil. Bagian I dari jalur biosintesis kobalamin (Cob I) merupakan proses konversi uroforfirinogen II menjadi kobinamida. Bagian II (Cob II) merupakan proses biosintesis dimetilbenzimidazol (DMB). Bagian III (Cob III) merupakan proses pengikatan kobinamida, DMB, dan grup fosforibosil dari nikotinat mononukleotida secara kovalen (Gambar 10) (Lawrence dan Roth 1995).
Gambar 10 Jalur biosintesis kobalamin pada bakteri enterik. Singkatan: Ado, adenosil; Cbi, kobinamida; CN, siano; FMN, flavin mononukleotida; UroIII, uroforfirinogen III
Vitamin B12 hanya disintesis oleh beberapa bakteri dan arkea dan membutuhkan lebih dari 30 gen. Sebagian besar spesies bakteri enterik dapat mensintesis kobalamin baik dalam kondisi aerobik maupun anaerobik. Spesies
Klebsiella memproduksi kobalamin pada kondisi anaerobik melalui ketiga jalur biosintesis kobalamin (Cob I, II, dan III) (Lawrence dan Roth 1996). Lawrence and Roth (1995) melaporkan bahwa E. coli memproduksi kobalamin hanya melalui dua jalur biosintesis kobalamin, yaitu Cob II dan Cob III tanpa melalui Cob I. Cob I sebagai bagian I dari jalur biosintesis kobalamin dikodekan oleh gen
cbiABCDETFGHIJKLMNOQP. Oleh karena itu, keberadaan Klebsiella pada penelitian ini ditandai oleh keberadaan gen cbiG yang tidak dimiliki oleh E.coli.
Jalur sintesis vitamin B12 dapat dilakukan secara aerobik maupun anaerobik. Gen pengkode enzim yang berkontribusi pada biosintesis secara aerobik ditandai dengan awalan cob, sedangkan anaerobik ditandai dengan awalan
18
Jumlah Kopi Gen cbiG pada Tempe
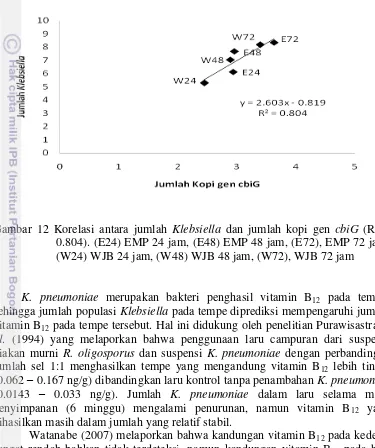
Jumlah kopi gen cbiG pada tempe EMP dan WJB berhasil dikuantifikasi menggunakan qPCR. Kuantifikasi jumlah kopi gen cbiG menunjukkan hasil yang beragam, yaitu 2-3 log dan mengalami peningkatan berdasarkan tingkat kematangan tempe (Gambar 11). qPCR dapat menunjukkan jumlah kopi gen cbiG
yang dimiliki oleh setiap sampel tempe secara kuantitatif. Kuantifikasi jumlah kopi gen cbiG menggunakan qPCR diawali dengan mengkonstruksi kurva standar. Kurva standar merupakan perbandingan nilai Ct dan log jumlah kopi gen cbiG dari standar. Kurva standar tersebut menunjukkan hubungan linear antara nilai Ct dan log dari jumlah kopi gen cbiG (R2 > 0.97) sehingga dapat digunakan untuk menentukan jumlah kopi gen cbiG sampel berdasarkan nilai Ct masing-masing sampel.
Gambar 11 Jumlah kopi gen cbiG pada tempe EMP dan WJB umur 24, 48 dan 72 jam
Hasil kuantifikasi jumlah kopi gen cbiG menggunakan qPCR sejalan dengan hasil amplifikasi gen cbiG yang sebelumnya sudah dilakukan menggunakan PCR secara semi kuantitatif. Jumlah kopi gen cbiG pada tempe EMP dan WJB mengalami peningkatan berdasarkan tingkat kematangan tempe. Peningkatan jumlah kopi gen cbiG berdasarkan tingkat kematangan tempe diprediksi berkorelasi dengan jumlah populasi Klebsiella. Korelasi antara jumlah Klebsiella
dan jumlah gen cbiG disajikan pada Gambar 12 yang menunjukkan terdapat hubungan linear antara jumlah Klebsiella dan jumlah kopi gen cbiG pada setiap umur tempe (R2 > 0.804).
Tempe EMP memiliki jumlah kopi gen cbiG yang lebih tinggi jika dibandingkan dengan WJB. Alvin (2014) juga menemukan bahwa log jumlah kopi gen cbiG untuk tempe EMP secara umum lebih tinggi yaitu 1.983 dibandingkan dengan tempe WJB yaitu 0.392. Jumlah Klebsiella dan jumlah kopi gen cbiG
19 jumlah kopi gen cbiG. Hal ini mengindikasikan bahwa dari banyak Klebsiella, hanya beberapa yang memiliki gen cbiG sebagai indikator dari gen pensintesis vitamin B12 yang dimiliki oleh Klebsiella. qPCR menghasilkan deteksi otomatis dan kuantifikasi dari produk gen sampel tertentu. Oberst et al. (1998) melaporkan bahwa qPCR telah digunakan untuk deteksi dan kuantifikasi E.coli O157:H7 pada makanan dan sampel klinis, juga pada sampel lingkungan (Ibekwe dan Grieve 2003).
Gambar 12 Korelasi antara jumlah Klebsiella dan jumlah kopi gen cbiG (R2 > 0.804). (E24) EMP 24 jam, (E48) EMP 48 jam, (E72), EMP 72 jam, (W24) WJB 24 jam, (W48) WJB 48 jam, (W72), WJB 72 jam
K. pneumoniae merupakan bakteri penghasil vitamin B12 pada tempe, sehingga jumlah populasi Klebsiella pada tempe diprediksi mempengaruhi jumlah vitamin B12 pada tempe tersebut. Hal ini didukung oleh penelitian Purawisastra et
al. (1994) yang melaporkan bahwa penggunaan laru campuran dari suspensi biakan murni R. oligosporus dan suspensi K. pneumoniae dengan perbandingan jumlah sel 1:1 menghasilkan tempe yang mengandung vitamin B12 lebih tinggi (0.062 – 0.167 ng/g) dibandingkan laru kontrol tanpa penambahan K. pneumoniae
(0.0143 – 0.033 ng/g). Jumlah K. pneumoniae dalam laru selama masa penyimpanan (6 minggu) mengalami penurunan, namun vitamin B12 yang dihasilkan masih dalam jumlah yang relatif stabil.
20
sedangkan tempe WJB 1.5 ng/g. Jumlah kandungan vitamin B12 ini menunjukkan korelasi linear dengan log jumlah kopi gen cbiG. Keberadaan Klebsiella selaku bakteri penghasil vitamin B12 dan gen cbiG selaku gen pensintesis vitamin B12 pada tempe diprediksi memiliki korelasi linear dengan jumlah vitamin B12 pada tempe tersebut. Kandungan vitamin B12 pada tempe tergolong lebih rendah jika dibandingkan dengan hati, sehingga memerlukan penanganan khusus pada sampel dan referensi standar (Abano dan Dadzie 2014).
SIMPULAN DAN SARAN
Simpulan
Jumlah populasi bakteri penghasil vitamin B12 yaitu Klebsiella telah berhasil dikuantifikasi dan meningkat berdasarkan tingkat kematangan tempe pada masa penyimpanan (24, 48 dan 72 jam). Jumlah Klebsiella mencapai 5-6 log CFU/g untuk tempe umur 24 jam, 7 log CFU/g untuk tempe umur 48 jam dan 8 log CFU/g untuk tempe umur 72 jam. Jumlah kopi gen cbiG selaku gen pensintesis vitamin B12 telah berhasil dikuantifikasi menggunakan qPCR yang meningkat berdasarkan tingkat kematangan tempe (24, 48 dan 72 jam). Tempe EMP memiliki jumlah Klebsiella dan jumlah kopi gen cbiG yang lebih tinggi dibandingkan dengan tempe WJB. Terdapat korelasi linear antara jumlah
Klebsiella dan jumlah kopi gen cbiG pada sampel tempe EMP dan WJB (R2 > 0.804), akan tetapi korelasi dua hal tersebut dengan jumlah vitamin B12 belum diketahui.
Saran
Korelasi antara jumlah populasi Klebsiella selaku bakteri penghasil vitamin B12 pada tempe dan jumlah kopi gen cbiG sebagai penanda produksi vitamin B12 pada tempe memerlukan pengulangan dan pengoptimalan kondisi qPCR, sehingga jumlah kopi gen cbiG dapat dikuantifikasi dengan tepat dan akurat. Korelasi antara kedua hal tersebut dengan jumlah vitamin B12 juga perlu dilakukan untuk memperkuat hasil yang didapatkan pada penelitian ini.
DAFTAR PUSTAKA
Abano EE, Dadzie RG. 2014. Simultaneous detection of water-soluble vitamins using the High Performance Liquid Chromatography (HPLC)- a review.
21 Alvin C. 2014. Correlation between vitamin B12 concentration in tempe and copy number of cbiG gene of Klebsiella pneumoniae [Tesis]. Jakarta (ID): Universitas Katolik Indonesia Atma Jaya.
Andriani M, Baskoro K, Nurhartadi E. 2014. Studies on physicochemical and sensory characteristics of overripe tempeh flour as food seasoning. Acad Res Int. 5:36-45.
Areekul S, Pattanamatum S, Cheeramakara C, Churdchue K, Nitayapabskoon S, Chongsanguan M. 1990. The source and content of vitamin B12 in the tempehs. J Med Assoc Thai. 73:152-156.
Astuti M, Meliala A, Dalais FS, Wahlqvist ML. 2000. Tempe, a nutritious and healthy food from Indonesia. Asia Pac J Clin Nutr. 9:322–325.
Ayu E, Suwanto A, Barus T. 2014. Klebsiella pneumoniae from Indonesian tempeh were genetically different from that of pathogenic isolates. J Microbiol Indones. 8:9-15.
A’yun Q. 2015. Profil genetic Escherichia coli yang diisolasi dari tempe berdasarkan Enterobacterial Repetitive Intergenic Consensus Polymerase Chain Reaction (ERIC-PCR) [Tesis]. Bogor (ID): Institut Pertanian Bogor. Babu PD, Bhakyaraj R, Vidhyalakshmi R. 2009. A low cost nutritious food
“tempeh”-a review. World J Dairy Food Sci. 4:22-27.
Barus T, Suwanto A, Wahyudi AT, Wijaya H. 2008. Role of bacteria in tempe bitter taste formation: microbiological and molecular biological analysis based on 16S rRNA gene. J Microbiol Indones. 2:17-21.
Bor MV, von Castel-Roberts KM, Kauwell GP, Stabler SP, Allen RH, Maneval DR, Bailey LB, Nexo E. 2010. Daily intake of 4 to 7 microgram dietary vitamin B12 is associated with steady concentrations of vitamin B12-related biomarkers in a healthy young population. Am J Clin Nutr. 91:571-577. Brisse S, Grimont F, Grimont PAD. 2006. The genus Klebsiella. Prokaryotes.
6:159-196.
Hassanein TR, Prabawati EK, Puteri MDPTG. 2015. Analysis of chemical and microbial changes during storage of overripe tempeh powder as seasoning material. Int J Sci Eng. 2:131-134.
Heid CA, Stevens J, Livak KJ, Williams PM. 2015. Real time quantitative PCR.
Genome Res. 6:986-994.
Ibekwe AM, Grieve CM. 2003. Detection and quantification of Escherichia coli
O157:H7 in environmental samples by real-time PCR. J Appl Microbiol. Polymerase Chain Reaction (qPCR) to Determine Escherichia coli Concentrations at Two Lake Erie Beaches. Virginia (US): Northeast Ohio Regional Sewer District.
22
Keuth S, Bisping B. 1994. Vitamin B12 production by Citrobacter freundii or
Klebsiella pneumoniae during tempeh fermentation and proof of enterotoxin absence by PCR. Appl Environ Microbiol. 60:1496-1499. Kubista M, Andrade JM, Bengtsson M, Forootan A, Jonak J, Lind K, Sindelka R,
Sjoback R, Sjogreen B, Strombom L, Stahlberg A, Zoric N. 2006. The real-time polymerase chain reaction. Mol Aspects Med. 27:95-125.
Kustyawati ME. 2009. Kajian peran yeast dalam pembuatan tempe. AGRITECH. 2:64-70.
Lawrence JG, Roth JR. 1995. The cobalamin (coenzyme B12) biosynthetic genes of Escherichia coli. J Bacteriol. 177:6371-6380.
Lawrence JG, Roth JR. 1996. Evolution of coenzyme B12 synthesis among enteric bacteria: evidence for loss and reaquisition of a multigene comlplex.
Genetics. 142:11-24.
Leininger DJ, Roberson JR, Elvinger F. 2001. Use of eosin methylene blue agar to differentiate Escherichia coli from other gram-negative mastitis pathogens. J Vet Diagn Invest. 13:273-275.
Liem ITH, Steinkratus KH, Cronk TC. 1977. Production of vitamin B12 in tempeh, a fermented soybean. Appl Environ Microbiol. 34:773-776.
Madigan MT, Martinko JM. 2006. Biology of Microorganism. 13th ed. New Jersey (US): Prentice Hall.
Martens JH, Barg H, Warren MJ, Jahn D. 2002. Microbial production of vitamin B12. Appl Microbiol Biotechnol. 58:275-285.
Maysella. 2010. Isolation and genetic diversity analysis of Klebsiellapneumoniae
in tempe based on 16S rRNA encoding gene [Tesis]. Jakarta (ID): Universitas Katolik Indonesia Atma Jaya.
Mulyowidarso RK, Fleet GH, Buckle KA. 1989. The microbial ecology of soybean soaking for tempe production. J Appl Bacteriol. 8:35-46.
Mulyowidarso RK, Fleet GH, Buckle KA. 1990. Association of bacteria with the fungal fermentation of soybean tempe. J Appl Bacteriol. 68:43-47.
Nout MJR, Kiers JL. 2005. Tempe fermentation, innovation, and functionality: update into the third millennium. J Appl Microbiol. 98:789-805.
Nurdini AL, Nuraida L, Suwanto A, Suliantari. 2015. Microbial growth dynamics during tempe fermentation in two different home industries. Int Food Res J. 22:1668-1674.
Oberst RD, Hays MP, Bohra IK, Phebus RK, Yamashiro CT, Paszko-Kolva C, Flood SJA, Gillespie JR. 1998. PCR-based DNA amplification and presumptive detection of Escherichia coli O157:H7 with an internal fluorogenic probe and the 5’nuclease assay. Appl Environ Microbiol. 64:3389-3396.
Okada N. 1989. Role of microorganism in tempe manufacture. Isolation vitamin B12 producing bacteria. JARQ. 22:310–316.
O’leary F, Samman S. 2010. Vitamin B12 in health and disease. Nutrients. 2:299-316.
23 Puteri MDPTG, Hassanein TR, Prabawati EK, Wijaya CH, Mutukumira AN. 2015. Sensory characteristics of seasoning powders from overripe tempeh, a solid state fermented soybean. Procedia Chem. 14:263-269.
Rodionov DA, Vitreschak AG, Mironov AA, Gelfand MS. 2003. Comparative genomics of the vitamin B12 metabolism and regulation in prokaryotes. J
Biol Chem. 278:41148-41159.
Roessner CA, Scott AI. 2006. Fine-tuning our knowledge of the anaerobic route to cobalamin (vitamin B12). J Bacteriol. 21:7331-7334.
Seumahu CA, Suwanto A, Rusmana I, Solihin DD. 2012. Comparison of DNA extraction methods for microbiological community analysis in Indonesian tempeh employing amplified ribosomal intergenic spacer analysis.
HAYATI J Biosci. 19:93-98.
Smith CJ, Osborn AM. 2009. Advantages and limitations of quantitative PCR (Q-PCR)-based approaches in microbial ecology. FEMS Microbiol Ecol. 67:6-20.
Watanabe F. 2007. Vitamin B12 sources and bioavailability. Exp Biol Med.
24
LAMPIRAN
Lampiran 1 Gambar metode pembuatan tempe EMP dan WJB
Lampiran 2 Komposisi media
1. Media Eosin Methylene Blue Agar/EMBA – 10 g gelatin
25 Lampiran 3 Tabel data kuantifikasi Klebsiella
26
Lampiran 4 Tabel hasil nano drop
Tempe Konsentrasi DNA (ng) Kemurnian DNA (260/280)
27 Lampiran 6 Tabel data kuantifikasi gen cbiG
Jenis Rata-rata Ct
Rata-rata Log Jumlah Kopi Gen
Standar 21.9 1
Standar 25.08 0
Standar 27.28 -1
Standar 28.78 -2
29
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 27 Maret 1991 sebagai anak pertama dari tiga bersaudara, dengan ayah bernama M. Sahudin dan ibu bernama Sriyanti. Pada tahun 2008, penulis lulus dari SMA Negeri 78 Jakarta dan pada tahun yang sama diterima di Jurusan Biologi (Bioteknologi), Fakultas Sains dan Teknologi, Universitas Al Azhar Indonesia melalui Jalur Beasiswa Korporat, lulus pada tahun 2012. Pada tahun yang sama, penulis diterima di Program Studi Mikrobiologi (MIK) pada Program Pascasarjana IPB dengan beasiswa studi calon dosen (Beasiswa Unggulan) dari Direktorat Pendidikan Tinggi (DIKTI) tahun 2012.
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains (M.Si), penulis melakukan penelitian dengan judul “Korelasi Populasi Klebsiella dan Jumlah Kopi Gen Penyandi Kobalt-Prekorin-5A-Deasilase (cbiG) pada Tempe”. Penelitian ini dibimbing oleh Prof Dr Ir Antonius Suwanto, MSc dan Prof Dr Ir Lilis Nuraida, MSc. Artikel penelitian ini sedang dalam proses publikasi di jurnal