DIFERENSIASI EMBRYONIC STEM CELLS MENCIT
MENJADI NEURON MENGGUNAKAN
CONDITIONED MEDIUM
RIRIS LINDIAWATI PUSPITASARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN ORISINALITAS
Dengan ini saya menyatakan bahwa tesis Diferensiasi Embryonic Stem Cells Mencit menjadi Neuron menggunakan Conditioned Medium adalah karya saya dengan arahan dari komisi pembimbing. Sumber informasi yang berasal atau dikutip dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka.
Bogor, Agustus 2009
ABSTRAK
RIRIS LINDIAWATI PUSPITASARI. Diferensiasi Embryonic Stem Cells Mencit menjadi Neuron menggunakan Conditioned Medium. Dibimbing oleh ARIEF BOEDIONO dan FERRY SANDRA
Embryonic stem cells (ESCs) merupakan sel pluripoten yang mampu untuk berproliferasi dan berdiferensiasi menjadi berbagai tipe sel penyusun tubuh. Potensi tersebut telah diyakini sangat bermanfaat dalam pengobatan penyakit degeneratif. Kemampuannya untuk berdiferensiasi hingga saat ini masih terus dikaji. Penelitian ini dilakukan untuk mempelajari tingkat diferensiasi ESCs menjadi neuron secara in vitro dengan menggunakan conditioned medium (CM) tanpa melalui pembentukan embryoid bodies (EB). ESCs mencit dikultur dalam medium dengan penambahan 20 ng/ml Leukemia inhibitory factor (LIF) selama 8 hari hingga terbentuk outgrowth. CM berasal dari supernatan kultur primer sel syaraf. Digunakan 2 konsentrasi CM yaitu 1x-CM (CM tidak dikonsetratkan) dan 10x-CM (CM dikonsentratkan hingga 10 kali). ESCs dikultur dalam petri yang telah dilapisi gelatin selama 7 hari hingga berdiferensiasi. Ekspresi nestin diketahui melalui metode 2 steps reversed transcript polymerase chain reaction (RT-PCR). Hasil penelitian menunjukkan bahwa penambahan 10x-CM ke dalam medium mampu menginduksi pertumbuhan neural-like cells (NLC) dengan persentase sebesar 8.83 ± 3.06. Hasil PCR memperlihatkan adanya perbedaan ekspresi gen nestin pada tiap sampel. Sementara itu, medium dengan penambahan 1x-CM belum mampu menginduksi terbentuknya NLC. Dengan demikian, penambahan CM yang dikonsentratkan hingga 10 kali dapat mengarahkan perkembangan ESCs mencit menjadi NLC tanpa melalui pembentukan EB.
ABSTRACT
RIRIS LINDIAWATI PUSPITASARI. Conditioned medium induced neural differentiation of mouse embryonic stem cells. Under direction of ARIEF BOEDIONO and FERRY SANDRA
Embryonic stem cells (ESCs) are pluripotent cells having capability in extensive proliferation while maintaining their potential to differentiate into various cells. Therapeutic potential of these cells is promising, however there is still insufficient ability in inducing the differentiation. In this study we examined the effect of conditioned medium that contained many inducing factors in direct differentiation of mouse ESCs (mESC) into neural cells without embryoid bodies formation. Mouse ESCs were cultivated in culture with supplementation of 20 ng/ml Leukemia inhibitory factor (LIF) to form outgrowth within 8 days. Mouse ESCs were induced with neural-cells-primary-culture-conditioned-medium. We used two concentrations of conditioned medium (CM), 1x-CM and 10x-CM. The mESCs were cultured on gelatin coated dishes in both of treatments for 7 days to differentiate. The expressions of nestin were analyzed by two steps RT-PCR. Based on result, 10x-CM increased the percentage of neural-like cells outgrowth 8.83 ± 3.06 and also nestin level expression. Mean while the treatment with 1x-CM gave no neural morphology at all. In conclusion, 10x-1x-CM had effect on neural differentiation from mESCs.
RINGKASAN
RIRIS LINDIAWATI PUSPITASARI. Diferensiasi Embryonic Stem Cells Mencit menjadi Neuron menggunakan Conditioned Medium. Dibimbing oleh ARIEF BOEDIONO dan FERRY SANDRA
Stem cell atau yang juga dikenal dengan istilah sel punca, merupakan sel yang dapat berproliferasi dengan mempertahankan sifat tidak terdiferensiasi. Sel punca diprediksi memegang kunci untuk pengobatan beberapa penyakit degeneratif yang pada saat ini tidak dapat disembuhkan dengan pengobatan konvensional, misalnya pada penyakit Alzheimer, Parkinson, diabetes dan jantung. Salah satu jenis sel punca yang telah banyak diteliti adalah Embryonic Stem Cell (ESC). ESC dihasilkan dari inner cell mass (ICM) yang terdapat pada embrio blastosis. ESC memiliki beberapa karakter diantaranya dapat dipertahankan untuk tetap tidak berdiferensiasi secara in vitro dan dalam kondisi tertentu dapat berdiferensiasi menjadi berbagai tipe sel yang menyusun tubuh.
Propagasi ESC untuk dapat berdiferensiasi menjadi sel tipe tertentu dipengaruhi oleh beberapa faktor yang diregulasi oleh mediator pertumbuhan yang sesuai. Secara in vitro, ESC dapat diarahkan perkembangannya menjadi sel neuron dan sel glia. Interaksi antara sel-sel dan kondisi lingkungan mikro dapat mempengaruhi diferensiasi ESC ataupun sel-sel prekursor baik secara in vitro maupun in vivo. Selain itu, pengarahan ESC menggunakan conditioned medium (CM) juga memungkinkan dikarenakan CM dapat menyediakan faktor-faktor penginduksi neuron. CM merupakan medium yang dikoleksi dari kultur primer sel tertentu setelah dikultur selama beberapa hari.
Conditioned medium dari kultur primer sel syaraf mengandung sejumlah faktor pertumbuhan antara lain nerve growth factor (NGF), glial derived-neurotrophic factor (GDNF), nestin, dan glial fibrillary acidic protein (GFAP). Pada umumnya tahapan untuk mendiferensiasikan ESCs adalah melalui pembentukan embryoid bodies (EB) terlebih dahulu. EB merupakan agregat sel yang terdiri atas sel-sel ektodermal, mesodermal, dan endodermal. Metode diferensiasi ESC mencit menjadi sel neuron dengan menggunakan CM secara tunggal dan tanpa melalui tahapan EB belum dilaporkan. Oleh karena itu tujuan penelitian ini adalah untuk mempelajari pengaruh penggunaan CM dari kultur primer sel syaraf secara tunggal (tanpa penambahan GF eksternal), terhadap tingkat pengarahan ESC mencit menjadi sel neuron.
Penelitian ini menggunakan inner cell mass (ICM) dari blastosis mencit sebagai sumber ESCs. ICM yang berhasil dikoleksi kemudian dikultur dalam medium ESCs dengan penambahan 20 ng/ml LIF. ICM dikultur pada petri yang telah dilapisi gelatin. Penggunaan LIF dimaksudkan agar ESCs tidak berdiferensiasi. Setelah 8 hari, koloni ESCs dikultur dalam medium diferensiasi sebagai perlakuan. Perlakuan yang digunakan adalah 2 konsentrasi CMyaitu CM yang belum dikonsentratkan (1x-CM) dan CM yang telah dikonsentratkan hingga sepuluh kali (10x-CM). Konsentrasinya berturut-turut adalah 490 μg/ml dan 2615
pembentukan koloni primer, outgrowth, dan tingkat diferensiasi ESC menjadi sel neuron. Data hasil perkembangan ICM dijelaskan secara deskriptif. Isolasi RNA total dilakukan pada hari ke-7. Kemampuan ekspresi gen nestin (penanda untuk sel progenitor neuron) dilihat berdasarkan hasil two steps reversed transcript-polymerase chain reaction (RT-PCR).
Keseluruhan blastosis yang diperoleh berjumlah sekitar 400 embrio. Dengan memberikan kondisi kultur yang sama maka terlihat adanya sejumlah perkembangan dari embrio. Kemampuan ICM untuk melekat ke dasar petri (attachment rate) adalah 73.5 ± 2.52% dan 72.5 ± 4.43%. Attachment rate diobservasi pada 24 dan 48 jam setelah penanaman. ICM yang melekat selanjutnya akan tumbuh dan berkembang membentuk koloni primer. Perkembangan koloni primer ditandai dengan bertambahnya diameter koloni seiring bertambahnya hari pengamatan. Hingga hari ke-8, koloni primer yang terbentuk yaitu 66 ± 7.66% dan 67 ± 5.29%. Pada koloni primer, stem cell tumbuh dan berkembang membentuk multilayer. Selain itu juga terlihat adanya pertumbuhan sel ke arah samping koloni atau outgrowth. Sebanyak 66 ± 7.66% dan 66 ± 4.90% koloni dapat berkembang membentuk outgrowth.
Pada tahap diferensiasi, sel neuron yang tumbuh diidentifikasi sebagai neural-like cells (NLC) dikarenakan pengujian lanjutan seperti imunositokimia untuk menentukan tipe atau jenis sel yang tumbuh tidak dilakukan. Secara visual, NLC tumbuh di area tepi dari koloni dan beberapa sel memiliki neurit yang saling berhubungan satu dengan lainnya. Hasil penelitian menunjukkan bahwa pada sampel dengan penambahan 1x-CM tidak menunjukkan adanya pertumbuhan NLC. Hal yang berbeda tampak pada sampel dengan penambahan 10x-CM. Sebanyak 8.83 ± 3.06% NLC teramati di bagian outgrowth, sehingga dapat dikatakan bahwa penambahan 10x-CM lebih mampu menginduksi terbentuknya NLC dari mESC. Kemampuan tersebut dikarenakan CM yang telah dikonsentratkan hingga sepuluh kali memiliki kandungan faktor-faktor yang berperan optimal untuk mengarahkan perkembangan mESC menjadi NLC. Lebih lanjut, conditioned medium dari kultur primer syaraf mengandung sejumlah faktor yang penting bagi perkembangan ESC menjadi sel neuron seperti nerve growth factor (NGF), glial derived-neurotrophic factor (GDNF), fibroblast growth factor-2 (FGF-2), dan glial fibrillary acidic protein (GFAP).
Isolasi RNA total dari tiap sampel dilakukan setelah kultur diferensiasi berusia 7 hari. Hasil isolasi memperlihatkan bahwa RNA total dari tiap sampel terdapat pada kisaran 29.80 ng/μl hingga 90.40 ng/μl. Sebagai kontrol positif terhadap nestin adalah jaringan otak yang memiliki RNA total dengan konsentrasi 90.40 ng/μl. Setelah RNA total didapat maka dilakukan konversi ke cDNA. Untuk mendeteksi ekspresi dari gen target, sebelumnya dilakukan optimasi terhadap primer agar didapatkan hasil pembacaan pita tunggal dan spesifik. Berdasarkan hasil PCR, dapat dikatakan bahwa pemilihan primer sudah cukup spesifik sehingga produk yang dinilai intensitasnya menghasilkan pita tunggal sebesar 327 bp untuk nestin.
didokumentasikan dengan G-box, maka dilakukan kuantitasi hasil pita-pita bacaannya. Pada sampel dengan penambahan 10x-CM, rasio nestin terhadap beta aktin berkisar pada 0.08083 hingga 0.20318. Sedangkan pada kontrol positif yaitu jaringan otak memiliki nilai rasio 0.69848. Apabila dibandingkan antara nilai rasio nestin/beta aktin dengan jumlah koloni yang berdiferensiasi pada sampel maka didapat nilai rasio ekspresi per koloni berkisar pada 0.04.
Berdasarkan penelitian dapat disimpulkan bahwa conditioned medium yang dikonsentratkan hingga sepuluh kali (10x-CM) dapat menunjang diferensiasi ESC mencit menjadi neural-like cells. Selain itu diferensiasi ESC mencit menjadi NLC dapat dilakukan tanpa melalui pembentukan embryoid bodies.
© Hak cipta milik Institut Pertanian Bogor, tahun 2009 Hak cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebut sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
DIFERENSIASI EMBRYONIC STEM CELLS MENCIT
MENJADI NEURON MENGGUNAKAN
CONDITIONED MEDIUM
RIRIS LINDIAWATI PUSPITASARI
Tesis
Sebagai salah satu syarat memperoleh gelar Magister Sains pada
Program Studi Sains Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul tesis : Diferensiasi Embryonic Stem Cells Mencit menjadi Neuron menggunakan Conditioned Medium
Nama : Riris Lindiawati Puspitasari NRP : B151060051
Disetujui
Komisi Pembimbing
Prof. drh. Arief Boediono, Ph.D Ferry Sandra, DDS, Ph.D, LFIBA, CIPM
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Sains Veteriner
Dr. drh. Bambang Pontjo P., M.S. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
PRAKATA
Alhamdulillah, segala puji untuk Allah SWT atas berkat, rahmat, izin, dan pertolongan-Nya sehingga penelitian dan penulisan tesis ini dapat diselesaikan.
Terima kasih sebesar-besarnya penulis haturkan kepada:
1. Prof. drh. Arief Boediono, Ph.D selaku ketua komisi pembimbing, untuk waktu, dedikasi pemikiran, dan dukungan moral untuk penulis dalam
menyelesaikan proses akademis di Program Studi Sains Veteriner Sekolah Pascasarjana IPB.
2. Ferry Sandra, DDS, Ph.D, LFIBA, CIPM selaku anggota komisi pembimbing untuk waktu, dedikasi pemikiran, dukungan moral dan
material dalam menempuh proses akademis di Program Studi Sains Veteriner Sekolah Pascasarjana IPB.
3. dr. Boenjamin Setiawan, Ph.D yang telah membuka jalan dan motivasi bagi penulis untuk melanjutkan studi ke jenjang yang lebih tinggi.
4. Ahmad R. Utomo, Ph.D selaku peneliti di Stem Cell and Cancer Institute yang dengan suka rela turut memberikan solusi dalam proses pengerjaan
penelitian.
5. Dr. Novik Nurhidayat selaku peneliti di Pusat Penelitian Biologi LIPI yang dengan suka rela bersedia memberikan solusi demi terselesaikannya penelitian ini.
6. Dr. drh. Hj. Ita Djuwita, M.Phil selaku kepala Laboratorium Embriologi dan Terpadu FKH IPB yang telah memberikan kesempatan dan menyumbangkan pemikiran kepada penulis selama proses penelitian. 7. Staf pengajar, staf administrasi, dan rekan-rekan di Laboratorium
Embriologi untuk bimbingan dan kerjasamanya dalam keseluruhan proses
akademis.
8. Rekan-rekan di Stem Cell and Cancer Institute atas dukungan selama penulis menyelesaikan studi di FKH IPB.
9. Keluarga dan sahabat, pendamping dan motivator terbaik di setiap
Akhir kata semoga tesis yang berjudul “Diferensiasi embryonic stem cells mencit menjadi neuron menggunakan conditioned medium” ini dapat bermanfaat bagi pengembangan ilmu pengetahuan.
Bogor, Agustus 2009
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 7 Mei 1979 sebagai anak bungsu dari pasangan Sukamto dan Asmijati. Pendidikan sarjana ditempuh di Jurusan Biologi FMIPA Universitas Indonesia, lulus pada tahun 2004. Pada tahun 2006, penulis berkesempatan melanjutkan studi ke program magister pada Program Studi Sains Veteriner Sekolah Pascasarjana IPB.
Penulis bekerja sebagai Research Assistant di Stem Cell and Cancer Institute Jakarta sejak tahun 2006. Penulis tergabung dalam divisi Cancer.
Selama menyelesaikan studi, penulis menjadi anggota Asosiasi Sel Punca Indonesia. Sebuah artikel telah diterbitkan dengan judul Kultur embryonic stem cell menjadi sel neuron dengan medium bebas serum, pada jurnal Cermin Dunia
DAFTAR ISI
Pengukuran RNA total dengan spektrofotometer……… 16
Konversi RNA total menjadi cDNA……… 17
Reaksi Polymerase Chain Reaction (PCR)……….. 17
Visualisasi hasil dengan gel elektroforesis dan G-box……… 18
Analisis hasil digital G-box……….. 18
Potensi 10x-CM dalam Diferensiasi mESC Mencit menjadi Neuron 33
KESIMPULAN DAN SARAN………... 34
DAFTAR TABEL
Halaman
DAFTAR GAMBAR
Halaman
1. Potongan sagital otak mencit dengan area neurogenesis………. 9
2. Skema perkembangan neural stem cell……… 10
3. Perkembangan sel syaraf dalam kultur………. 22
4. Hasil pengukuran konsentrasi CM……… 24
5. Perkembangan ICM selama kultur ESC………... 25
6. Beberapa neural-like cells yang teramati……….. 29
7. Hasil gel elektroforesis sampel 10x-CM………. 31
DAFTAR SINGKATAN
ESC Embryonic Stem Cell ICM Inner Cell Mass CM Conditioned Medium NPC Neural Progenitor Cell mESC Mouse Embryonic Stem Cell
bFGF basic Fibrolast Growth Factor NGF Nerve Growth Factor
GDNF Glial Derived-Neurotrophic Factor GFAP Glial Fibrillary Acidic Protein EGF Epidermal Growth Factor
ASC Adult Stem Cell
HSC Hematopoietic Stem Cell MSC Mesenchymal Stem Cell CNS Central Nervous System
EB Embryoid Bodies
SVZ Subventricular Zone
OB Olfactory Bulb
NSC Neural Stem Cell PNS Peripheral Nervous System
NMWL Nominal Molecular Weight Limit
PMSG Pregnant Mare’s Serum Gonadotrophin hCG human Chorionic Gonadotrophin DMEM Dulbecco’s Modified Eagle’s Medium FBS Fetal Bovine Serum
LIF Leukemia Inhibitory Factor
RT-PCR Reversed-Transcript Polymerase Chain Reaction AMV Avian Myeloblastosis Virus
1
PENDAHULUAN
Latar Belakang
Stem cell atau yang juga dikenal dengan istilah sel punca, merupakan sel yang dapat berproliferasi dengan mempertahankan sifat tidak terdiferensiasi. Dengan stimulasi sinyal-sinyal tertentu, stem cell dapat dipicu untuk berubah menjadi jenis sel yang lain. Istilah stem cell tidak terbatas pada sel yang berasal dari embrio. Jaringan dewasa, termasuk sumsum tulang, plasenta maupun darah
tali pusat dapat menjadi sumber alternatif stem cell. Stem cell diprediksi memegang kunci untuk pengobatan beberapa penyakit degeneratif yang pada saat ini tidak dapat disembuhkan dengan pengobatan konvensional, misalnya pada penyakit degeneratif seperti Alzheimer, Parkinson, diabetes dan jantung. Beberapa pengobatan yang tersedia untuk penyakit tersebut cenderung panjang dan
umumnya tidak dapat menyembuhkan penyakit tersebut. Hal tersebut mendorong peneliti untuk mengusahakan kemungkinan-kemungkinan perbaikan fungsi organ secara lebih spesifik, elegan, dan tidak invasif misalnya dengan menggunakan stem cell (Mattson et al 2002 dan Atmosukarto 2005).
Salah satu jenis stem cell yang telah banyak diteliti adalah embryonic stem
cell (ESC). Embryonic stem cell dihasilkan dari inner cell mass (ICM) yang terdapat pada blastosis dan memiliki beberapa karakter diantaranya dapat dipertahankan untuk tetap tidak berdiferensiasi secara in vitro, serta dalam kondisi tertentu dapat berdiferensiasi menjadi berbagai tipe sel yang menyusun tubuh.
Aplikasi ESC untuk terapi penyakit neurodegeneratif terbukti bermanfaat meskipun masih dalam tahap penelitian pada hewan coba.
Propagasi ESC untuk dapat berdiferensiasi menjadi sel tipe tertentu dipengaruhi oleh beberapa faktor yang diregulasi oleh mediator pertumbuhan yang sesuai. Secara in vitro, ESC dapat diarahkan perkembangannya menjadi sel
2 CM mengandung faktor-faktor penginduksi neuron sebagai hasil sekresi dari kultur primer. CM merupakan medium yang dikoleksi dari kultur primer sel tertentu setelah dikultur selama beberapa hari. Ding dan Schultz (2004)
menambahkan bahwa stem cell fate ditentukan oleh regulator intrinsik dan lingkungan ekstraseluler (microenvironment). Konsep pentingnya peranan microenvironment dikemukakan oleh Shihabuddin et al (2000) yang menyatakan bahwa neural progenitor cell (NPC) yang ditransplantasikan ke area yang sedang mengalami neurogenesis mampu berdiferensiasi menjadi neuron yang fungsional.
Berbagai riset telah dilakukan untuk menggali lebih dalam mengenai penggunaan CM. Dengan melakukan purifikasi protein yang terkandung di dalam CM, maka diharapkan spektrum protein yang ada menjadi lebih sempit sehingga protein target dapat terdeteksi. Salah satu metode awal untuk melakukan purifikasi protein yang terkandung dalam CM yaitu dengan melakukan pemekatan, misalnya
dengan menggunakan Centricon plus 20® (Sipione et al 2006 dan Lin et al 2008). Centricon plus 20® menerapkan prinsip ultrafiltrasi, sehingga hanya protein berberat molekul lebih dari 10 kDa yang akan tertahan. Dasar pemilihan Centricon dengan cut off 10 kDa adalah bahwa sejumlah faktor yang berkontribusi
terhadap diferensiasi mouse ESC (mESC) menjadi neuron memiliki berat molekul bervariasi antara lain basic fibrolast growth factor (bFGF) (17 kDa), FGF-2 (18-24 kDa) (Giordano et al 1991), nerve growth factor (NGF) (26 kDa) (Kitazawa dan Shimizu 2005), glial derived-neurotrophic factor (GDNF) (50 kDa) (Hoefen et al 2004 dan Yue et al 2006), dan glial fibrillary acidic protein (GFAP) (55
kDa) (Moghadasali et al 2007). Dengan demikian, diharapkan faktor-faktor tersebut yang tertahan setelah dilakukan proses pemekatan.
Sejauh ini, penggunaan CM sebagai faktor untuk mendiferensiasikan stem cell umumnya dikombinasikan dengan penggunaan growth factor eksternal antara lain epidermalgrowthfactor (EGF) (Zhang et al 2006) dan bFGF (Moghadasali et
3 melalui tahapan EB belum dilaporkan. Oleh sebab itu perlu adanya studi yang mengkaji metode alternatif untuk mendiferensiasikan mESC menjadi neuron.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mempelajari pengaruh penggunaan CM dari kultur primer sel syaraf secara tunggal (tanpa penambahan GF eksternal), terhadap tingkat pengarahan ESC mencit menjadi neuron.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menyumbangkan informasi mengenai pengembangan metode diferensiasi ESC mencit menjadi sel-neuron. Selain itu
4
TINJAUAN PUSTAKA
Stem Cell
Stem cell atau stem cell, diprediksi memegang kunci untuk pengobatan beberapa penyakit yang pada saat ini tidak dapat disembuhkan dengan pengobatan konvensional. Berkat kemajuan medis yang sifatnya preventif dan terapetik, umur rata-rata masyarakat modern pun cenderung meningkat. Hal ini mendorong munculnya penyakit degeneratif seperti Alzheimer, Parkinson, diabetes dan
penyakit jantung yang menjadi beban sangat besar dalam sistem kesehatan (Mattson et al 2002). Beberapa pengobatan yang tersedia untuk penyakit tersebut dirasakan belum optimal. Pengobatan yang ada umumnya bersifat mengelola kondisi pasien demi memperbaiki kualitas hidupnya. Kondisi yang diderita tetap harus dimonitor untuk jangka waktu panjang, sehingga pada akhirnya akan
menjadi beban finansial yang berat. Hal tersebut mendorong peneliti untuk mencari alternatif metode pengobatan dengan menggunakan stem cell (Atmosukarto 2005).
Selama bertahun-tahun para peneliti mencari dan mencoba memahami mengapa sebagian sel dan organ tubuh manusia mampu memperbaiki diri
sedangkan sel dan organ lainnya tidak. Saat ini pencarian tersebut difokuskan pada bidang stem cell. Stem cell merupakan hasil penelitian dasar di bidang biologi yang diperkirakan dapat membawa terobosan yang besar di bidang kedokteran. Stem cell adalah jenis sel khusus yang memiliki kemampuan
membentuk ulang dirinya dan pada saat bersamaan dengan pacuan yang tepat mampu membentuk diri menjadi sel yang terspesialisasi (NIH 2001). Sel-sel tersebut merupakan kumpulan sel yang dapat ditemukan pada semua tahap perkembangan mulai dari masa embrio preimplantasi hingga masa dewasa. Terdapat dua kelompok utama stem cell menurut sumbernya yaitu yang diisolasi
dari inner cell mass embrio dan yang diisolasi dari berbagai jaringan dewasa (Denham et al 2007).
5 bagian inner cell mass (ICM) dari blastosis mencit. Sel-sel tersebut merupakan sel-sel yang belum berdiferensiasi, dapat berproliferasi selama periode yang tak terbatas dalam kultur, dan dapat diinduksi untuk berdiferensiasi menjadi berbagai
tipe sel dengan fungsi khusus sehingga bersifat pluripoten. Sementara itu penggunaan ESC dalam dunia klinis sampai saat ini belum dapat tercapai mengingat kontroversi etis masih melingkupinya. Namun demikian tidak menutup kesempatan bagi ESC untuk dikembangkan lebih dalam mengingat sifatnya yang khas tersebut (Setiawan 2006).
Stem cell dari jaringan dewasa (adult stem cell) dapat memperbanyak diri, tetapi mempunyai kemampuan diferensiasi yang terbatas. Jenis sel ini hanya dapat berdiferensiasi menjadi jenis sel tertentu; karena itu sifat ASC adalah multipoten. Terdapat berbagai sumber yang dapat dimanfaatkan sebagai sumber ASC diantaranya adalah sumsum tulang dan jaringan fetomaternal seperti darah tali
pusat, matriks tali pusat, serta plasenta. Subset stem cell yang diketahui terkandung di dalamnya antara lain hematopoietic stem cells (HSC), bone marrow stromal cells, dan mesenchymal stem cells (MSC). Beberapa riset telah dilakukan untuk membuktikan manfaatnya sebagai sarana terapi berbasis sel seperti pada
pasien-pasien keganasan hematologi, stroke, maupun terapi infark miokard (Guckin et al 2005).
Saat ini, aplikasi ESC dalam terapi beberapa penyakit telah banyak dikembangkan. Transplantasi ESC untuk terapi pada manusia masih menghadapi persoalan. Hal tersebut dikarenakan adanya persoalan reaksi penolakan imun
antara resipien dengan donor yang tidak dekat kekerabatannya dan masalah etika ketika harus menggunakan embrio dari manusia. Keadaan itulah yang mendasari mengapa transplantasi ESC untuk terapi penyakit masih menggunakan hewan model (Matahine dan Boediono 2006).
Telah dikemukakan bahwa ESC memiliki kemampuan untuk
6 nervous system (CNS) injury (Liu et al 2000) dan Parkinson (Bjorklund et al 2002). Pada penelitian tersebut terungkap bahwa resipien mampu menunjukkan perbaikan fungsional pada sistem koordinasinya.
Diferensiasi Embryonic Stem Cells
Stem cell memiliki beberapa sifat dasar yang menjadi ciri-ciri dari stem cell. Pertama, sel ini dapat bertambah banyak dengan cepat, tanpa mengalami perubahan morfologis termasuk pada kariotipnya (jumlah kromosomnya) dan dapat dipertahankan dalam keadaan ‘tidak terdiferensiasi’ untuk jangka waktu
yang lama. Kedua, stem cell yang telah dikultur dapat dikembalikan dengan mikroinjeksi ke dalam blastosis resipien dan berkontribusi pada perkembangan embrio hasil penggabungan sel dari dua sumber yang berbeda itu. Embrio yang dihasilkan dinamakan chimaera (Bryja et al 2006).
Berdasarkan karakter yang dimiliki, ESC dapat diarahkan perkembangannya
menjadi tiga lapisan embrional yaitu mesoderm, endoderm, dan ektoderm. Berbagai penelitian telah dilakukan guna mengembangkan metode diferensiasi ESC menjadi tipe sel yang lain, termasuk neuron. Metode tersebut antara lain melalui pembentukan embryoid bodies (EB). Embryoid bodies merupakan sekumpulan atau agregat sel yang pertumbuhannya dapat mengarah pada sel-sel
ektodermal, endodermal, dan mesodermal. Metode yang kedua adalah kokultur ESC dengan sel stroma. Sel stroma dapat menyediakan berbagai faktor yang dibutuhkan untuk berdiferensiasi. Metode yang ketiga yaitu mengkultur ESC secara monolayer dengan menggunakan protein sebagai matriks ekstraseluler (Hoefen et al 2004, Keller 2005). Ketiga metode tersebut telah banyak
dikembangkan guna mendapatkan metode yang dapat diaplikasikan untuk tujuan terapi. Sementara itu, pada proses diferensiasi sering kali dibutuhkan kondisi in vitro yang terukur, salah satunya dengan menggunakan medium bebas serum. Hal tersebut dikarenakan serum memiliki berbagai macam senyawa seperti protein,
hormon, dan growth factor (Puspitasari et al 2008).
7 agregat sel tersebut memiliki kemampuan untuk mengekspresikan perkembangan embriogenesis. Kumpulan sel ini memiliki karakter seluler dari tiga lapis germinal yaitu ektodermal, mesodermal, dan endodermal. Pada kondisi tertentu EB dapat
berkembang membentuk suatu tipe sel dengan memberikan sinyal yang tepat dan juga dipengaruhi oleh interaksi antar sel (Bhattacharya et al 2005).
Dengan mempertimbangkan aspek efisiensi dari metode untuk mendiferensiasikan ESC, beberapa peneliti telah memperkenalkan metode yang lebih simpel dengan hasil yang cukup baik. Metode tersebut adalah
mendiferensiasikan ESC tanpa melalui pembentukan EB. Hal yang mendasarinya adalah EB memiliki sejumlah sel yang heterogen dengan kompleksitas seluler yang tinggi sehingga perlu dilakukan purifikasi. Metode yang digunakan yaitu dengan menumbuhkan ESC yang akan diarahkan perkembangannya secara monolayer (Conti et al 2005).
Metode tanpa pembentukan EB telah diterapkan pada diferensiasi mESC menjadi neuron. Motohashi et al 2007 menjelaskan bahwa mESC yang ditumbuhkan dalam sistem kultur monolayer dengan stimulasi sinyal dari retinoic acid mampu meningkatkan populasi sel prekursor neural secara signifikan. Koloni
sel yang terbentuk mengekspresikan marker molekuler untuk neuron (beta Tubulin III) dan sel glia (GFAP). Sementara itu, metode monolayer juga diaplikasikan pada kultur neural stem cells yang disertai induksi dari EGF dan bFGF menghasilkan outgrowth sel-sel yang positif mengekspresikan nestin dan GFAP (Walton et al 2006). Dengan demikian terlihat bahwa metode monolayer
yang dikombinasikan dengan penambahan senyawa penginduksi dapat diterapkan untuk mendiferensiasikan stem cell menjadi neuron.
Conditioned Medium
Teknik diferensiasi menggunakan faktor penginduksi saat ini telah banyak diaplikasikan oleh berbagai kelompok riset stem cell. Dengan menilik kembali
8 Salah satu teknik pengarahan adalah dengan mengaplikasikan suatu senyawa penginduksi misalnya conditioned medium (CM), yang bertindak sebagai penyedia microenvironment bagi kultur. Conditioned medium merupakan medium
yang dikoleksi dari suatu kultur primer dan mengandung sejumlah komponen hasil sekresi kultur primer tersebut. Beberapa peneliti mengemukakan bahwa CM mengandung sejumlah faktor yang dapat menginduksi diferensiasi ESC. ESC yang dikultur dalam medium bebas serum dengan penambahan CM dapat berkembang menjadi sel-sel progenitor neuron, neuron, maupun sel-sel glia
(Bentz et al 2006).
Eksplorasi mengenai pengaplikasian CM guna pengarahan stem cell menjadi neuron saat ini telah memberikan berbagai hasil. Hasil tersebut nantinya diharapkan dapat berkontribusi untuk menjawab berbagai permasalahan transplantasi stem cell. Dengan meninjau kembali bahwa CM terdiri atas
komponen yang bermanfaat besar bagi pengembangan metode kultur, maka saat ini telah dicoba untuk menguraikan komponen CM itu sendiri. Berbagai metode telah dilakukan guna mendapatkan profil protein penyusun CM (Timmers et al 2007). Dengan demikian dapat diperoleh protein-protein yang menjadi kandidat
dalam diferensiasi stem cell menjadi neuron. CM yang digunakan dapat berasal dari kultur neural stem cell (Zhang et al 2006), dorsal root ganglia dan sel astrosit serta glia (Moghadasali et al 2007).
Neural Stem Cell
Pada otak mamalia terdapat tiga area yang mengalami neurogenesis yaitu
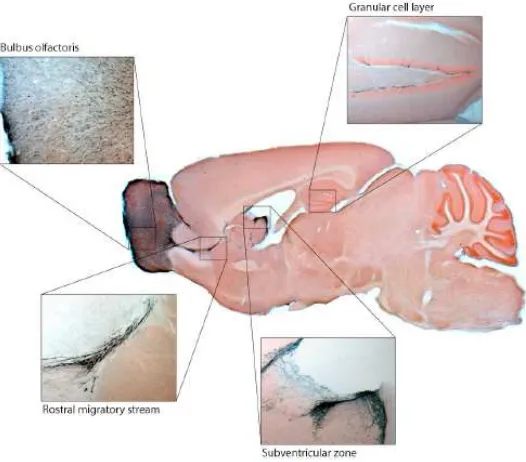
9 Gambar 1. Area neurogenesis pada otak mencit yaitu subventricular zone,
olfactory bulb, dan lapisan sel granular hippokampus (Doetsch et al 1997)
Beberapa subtipe sel teridentifikasi berada di area SVZ dan memiliki peranan tertentu. Subtipe astrocyte-like cells atau stem cells tipe B memberikan
ekspresi positif terhadap penanda GFAP. Sel glia radial mampu berdiferensiasi menjadi neural precursor cells. Neural stem cells (NSC) membelah secara asimetris menghasilkan astrocyte-like cells dan sel prekursor (Tipe C). Selanjutnya sejumlah sel tipe B dan tipe C membentuk semacam saluran sehingga neuroblast bermigrasi menuju sub ventricular zone. Neuroblast yang bermigrasi
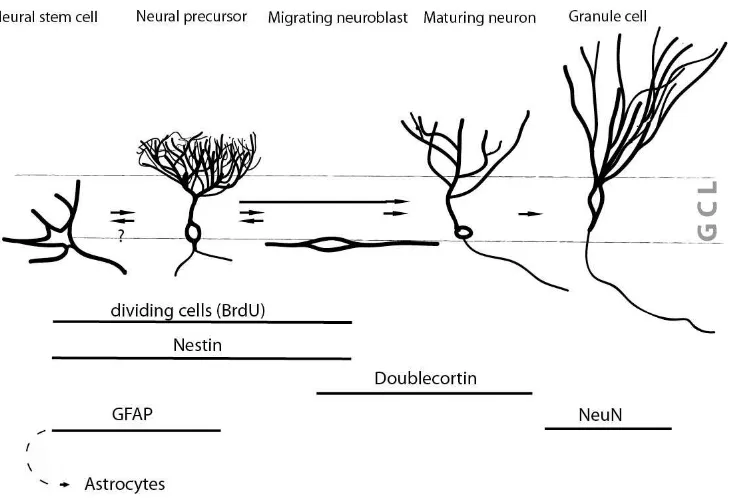
merupakan hasil diferensiasi sel tipe C dan dinamakan sel tipe A. Neuroblast membelah hingga terintegrasi sebagai sel granular di area OB. Sementara itu, sel-neuron yang matur mengisi area korteks. Selanjutnya stem cells di lapisan sub granular menghasilkan sejumlah sel prekursor (Gambar 2). Kemudian neuroblast bermigrasi menuju lapisan sel granular dan memiliki dendrit di lapisan molekuler
10 Gambar 2. Skema perkembangan neural stem cell dapat diidentifikasi dengan
menggunakan sejumlah penanda yang spesifik (Cleary et al 2006)
Pada umumnya diferensiasi stem cell menjadi neuron mengkonfirmasi adanya penanda neural progenitor cell (NPC) yaitu nestin. Nestin mengkode protein filamen intermedit tipe VI. Filamen intermedit diketahui terlibat dalam pengaturan morfologi bipolar dan kinetika sel prekursor (Kang et al 2007).
Secara struktural, nestin memiliki domain N terminal terpendek dan domain C terminal terpanjang diantara protein filamen intermedit lainnya. Nestin merupakan molekul besar dengan terminal memiliki lebih dari 500 residu. Pada manusia, nestin mengkode protein dengan 1618 asam amino. Nestin sebagai protein filamen intermedit terlibat dalam pembelahan sel selama tahap perkembangan awal dari CNS, peripheral nervous system (PNS), dan sel
myogenic. Selama diferensiasi, nestin mengalami down regulasi dan ekspresinya tergantikan oleh protein filamen intermedit tissue spesific. Ketika berlangsung neurogenesis dan gliogenesis, nestin digantikan oleh filamen intermedit spesifik sel yaitu neurofilamen dan GFAP. Selain itu, ekspresi nestin juga muncul pada
11 pembahasan detil mengenai fungsi dan regulasi nestin masih kurang. Informasi lain menyatakan bahwa regulasi nestin bergantung pada siklus sel (cell cycle-dependent). Ekspresinya meningkat ketika sel berada pada fase G1-S yaitu NPC
mengalami pemanjangan dari dendrit. Selanjutnya ekspresi akan menurun pada fase G2-M yaitu saat NPC bermitosis. Fosforilasi upstream faktor transkripsi POU kelas III (Pou3f2) menurunkan aktivitas ikatan terhadap elemen enhancer nestin sehingga transkripsi nestin menurun pada fase G2-M. Perlu diketahui bahwa nestin merupakan gen target dari faktor transkripsi SOX-POU dimana
12
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dimulai sejak September 2007 dan dilanjutkan hingga Mei 2009. Penelitian diselenggarakan di Laboratorium Embriologi Departemen Anatomi
Fisiologi dan Farmakologi, Fakultas Kedokteran Hewan Institut Pertanian Bogor; serta Laboratorium Stem Cell, Stem Cell and Cancer Institute, Jakarta.
Rancangan Percobaan
Rancangan percobaan adalah Rancangan Acak Lengkap (RAL) dengan 4 kali pengulangan. Sebagai perlakuan adalah 2 konsentrasi conditioned medium yaitu CM yang belum dikonsentratkan (1x-CM) dan CM yang telah dikonsentratkan hingga 10 kali (10x-CM). Volume yang digunakan yaitu 5% (untuk 10x-CM) dan 50% (untuk 1x-CM).
Metode Penelitian
Kultur primer sel syaraf
Kultur primer sel syaraf dilakukan sesuai petunjuk dari Bentz et al (2006) dan Zhang et al (2006) dengan sedikit modifikasi. Bagian hemisfer serebri mencit
usia 2 hari diisolasi dalam larutan Dulbecco’s phosphate buffered saline (DPBS) (Gibco, USA) yang mengandung CaCl22H2O 0.89 mM (Merck), MgSO47H2O 0.49 mM (Merck), Penicillin 50 U/ml, Streptomycin 50 mg/ml (Sigma, USA), dan fetal bovine serum (FBS) (Gibco, USA) 1%. Kemudian dengan menggunakan pipet Pasteur didapatkan suspensi sel. Suspensi sel dibiarkan mengendap selama 1
menit, kemudian supernatan ditampung ke dalam tabung dan disentrifus dengan kecepatan 200 g selama 1 menit. Setelah pelet didapat, kemudian sel dikultur. Medium kultur yang digunakan adalah Dulbecco’s Modified Eagle’s Medium (DMEM) highglucose (Sigma, USA) yang telah ditambahkan nonessential amino
acids (NEAA) 1 % (Sigma, USA), Penicillin 50 U/ml, Streptomycin 50 mg/ml, β
13 penelitian pendahuluan, setelah hari ke-4 akan terlihat adanya pertumbuhan neuron bipolar dan neural progenitor cell (NPC). Selain itu, juga terlihat adanya pertumbuhan sel-sel fibroblas. Kemudian sel-sel astrosit akan teramati ketika
periode kultur diperpanjang. Sel akan mengalami konfluensi setelah 12 hari kultur.
Pembuatan Conditioned Medium (CM)
Pembuatan CM yang dikonsentratkan dan pengukuran konsentrasinya
dilakukan menurut petunjuk Sandra et al (2005). Pada hari ke-8, medium kultur primer syaraf diganti dengan medium kultur tanpa penambahan FBS dan diinkubasi. Setelah 48 jam, medium dikoleksi dari tiap flask untuk kemudian dikonsentratkan dan dilakukan pengukuran konsentrasi protein. Medium yang
telah dikoleksi kemudian ditampung dan dikonsentratkan hingga 10 kali dengan menggunakan Centricon plus 20® (10K NMWL, UFC2 LGC02, Milipore, USA), untuk selanjutnya disentrifus pada 4000 g; 4 0C selama 10 menit. Dengan tipe membran Centricon plus 20® yaitu 10K nominal molecular weight limit (NMWL), maka protein yang tertahan memiliki berat molekul lebih dari 10 kDa,
yang kemudian akan diukur konsentrasinya. Konsentrasi protein diukur baik terhadap CM yang dikonsentratkan maupun yang tidak. Pengukuran konsentrasi dilakukan dengan menggunakan Quick Start Bradford Protein Assay (500-0201, Bio-Rad, USA). Selanjutnya, pembacaan nilai absorbansi dari larutan standar dan
2 macam sampel CM dilakukan dengan menggunakan Microplate Reader pada
= 595 nm, sehingga didapatkan konsentrasi proteinnya adalah 490 μg/ml (untuk 1x-CM) dan 2615 μg/ml (untuk 10x-CM). Kedua macam CM yang telah dikoleksi disimpan pada suhu -80 0C.
Superovulasi mencit dan koleksi blastosis
Superovulasi dilakukan menurut petunjuk Nagy et al (2003). Mencit betina galur ddy yang berumur 8-12 minggu disuperovulasi dengan penyuntikan hormon Pregnant Mare’s Serum Gonadotrophin (PMSG, Folligon, Intervet, Holland)
14 IU/ekor secara intraperitoneal. Setelah penyuntikan hCG, mencit betina dikawinkan dengan pejantan dengan perbandingan jantan:betina = 1:1. Mencit betina yang telah dikawini pejantan dicirikan oleh adanya sumbat vagina pada 18
jam pasca hCG dan dianggap sebagai hari pertama kebuntingan. Mencit betina dikorbankan pada 96-98 jam pasca hCG dengan cara cervicalis dislocation. Blastosis diperoleh dengan cara membilas (flushing) kedua kornua uterus dengan menggunakan spuit 1 cc (Terumo, Philippines) yang berisi medium DPBS yang telah ditambahkan FBS 1%. Selanjutnya embrio dicuci di dalam larutan DPBS,
kemudian dipindahkan ke dalam medium kultur dan diinkubasi pada 37 0C; 5% CO2. Medium kultur yang digunakan adalah DMEM high glucose yang
ditambahkan NEAA 1%, Penicillin 50 U/ml, Streptomycin 50 mg/ml, 0.1 mM β
-mercaptoethanol, dan FBS 10%.
Isolasi Inner Cell Mass (ICM)
Isolasi ICM dilakukan menurut petunjuk Nagy et al (2003) dengan beberapa modifikasi. Blastosis yang terkoleksi dihilangkan zona pelusidanya dengan enzim pronase 0.25% (Sigma, USA) selama 5 menit, kemudian blastosis dipindahkan ke
dalam medium DPBS + FBS 1% untuk menghentikan pronase. Selanjutnya blastosis tanpa zona dicuci dalam DPBS tanpa serum sebanyak dua kali dan dilanjutkan di cuci dalam DMEM tanpa serum. Isolasi ICM dilakukan dengan metode immunosurgery. Blastosis diinkubasi dalam rabbit anti mouse serum 25% (Sigma, USA) selama 20 menit. Selanjutnya blastosis diinkubasi dalam guinea pig
complement 25% (Sigma, USA) selama 20 menit. Untuk mendapatkan metode immunosurgery yang optimal, maka dilakukan optimasi inkubasi serum dan komplemen terlebih dahulu, sehingga sel-sel trofoblas dapat terlisiskan tanpa merusak ICM. Setelah ICM didapat, selanjutnya dipindahkan ke dalam medium DMEM kultur.
Kultur mouse Embryonic Stem Cell (mESC)
Kultur mESC dilakukan menurut petunjuk dari Zhang et al (2006). ICM yang telah diisolasi dikultur dalam medium ESC yaitu DMEM highglucose yang
15 mercaptoethanol 0.1 mM, FBS 10%, dan mouse leukemia inhibitory factor 20 ng/ml (LIF) (Sigma). ICM dikultur di dalam petri 3.5 cm (Nunc, Denmark) yang telah dilapisi gelatin 0.1%, sebanyak 50 koloni ICM tiap petri. ICM diinkubasi
pada 37 0C; 5% CO2 dan medium diganti setiap 2 hari. Perkembangan koloni primer diobservasi untuk mendapatkan informasi mengenai kemampuan proliferasi dari ICM.
Diferensiasi mESC menjadi neuron dengan Conditioned Medium
Pada hari ke-8 kultur, koloni primer yang telah berproliferasi diganti mediumnya dengan medium perlakuan yaitu 50% untuk 1x-CM dan 5% untuk
10x-CM, yang telah ditambahkan ke dalam medium fresh untuk kultur yaitu DMEM high glucose, NEAA 1%, Penicillin 50 U/ml, Streptomycin 50 mg/ml,
dan β-mercaptoethanol 0.1 mM. Medium perlakuan diganti setiap 2 hari dan
dikultur selama 7 hari. Setelah 7 hari, kultur sel siap untuk diisolasi RNA totalnya.
Isolasi RNA total
Prosedur isolasi RNA total dari kultur sel dan hemisfer serebri menggunakan Tripure (Roche Applied Science, Basel, Switzeerland) sesuai petunjuk dari produsen. Untuk kultur sel, sebelumnya dilakukan pembilasan menggunakan PBS dingin sebanyak 2 kali untuk menghilangkan sisa medium kultur. Selanjutnya dapat dilanjutkan tahap homogenisasi.
1. Homogenisasi
Sebanyak 100 mg hemisfer serebri mencit usia 2 hari diambil. Jaringan dihancurkan dengan menumbuk dengan mortar dan pestle, dalam 1 ml
Tripure. Untuk kultur sel, setelah dibilas dengan PBS dingin, sel dihancurkan menggunakan cell scraper dalam 1 ml Tripure untuk tiap sampel. Setelah jaringan dan sel terhancurkan dengan homogen, homogenate ditransfer ke dalam tube 1.5 ml dan ditutup dengan rapat, dan digoyang dalam greytory shaker selama 5 menit dalam suhu 15-25 0C untuk mendisosiasi kompleks
16 2. Separasi berdasarkan fase
Ke dalam homogenat ditambahkan 200 μl kloroform dan ditutup dengan rapat kemudian dikocok kuat-kuat dengan tangan selama 15 detik, diinkubasi dalam
suhu ruang selama 4 menit. Sampel disentrifugasi pada 12000 g selama 11 menit pada 2-8 0C. Setelah sentrifugasi, campuran sampel terseparasi menjadi tiga fase. RNA terdapat pada fase aqueus di bagian paling atas.
3. Presipitasi RNA
Fase aqueus (cairan bening) pada bagian teratas dipindahkan ke dalam tabung
baru. Volume larutan ini sekitar 300 μl. RNA dipresipitasi menggunakan isopropil alkohol dengan perbandingan 1:1, didiamkan dalam suhu ruang selama 10 menit kemudian disentrifugasi dalam suhu 2-8 0C pada 12000 g selama 11 menit. RNA akan terpresipitasi membentuk pelet putih di dasar tabung, lalu supernatan dibuang.
4. Pencucian RNA
Pelet RNA dicuci dengan etanol 75% sebanyak 1 ml. Setelah divorteks, larutan disentrifugasi dalam suhu 2-8 0C pada 8000 g selama 15 menit.
5. Pelarutan RNA
Pada akhir dari prosedur ini, etanol dibuang dan RNA dikeringkan secara perlahan dengan teknik air dry selama 10 menit. RNA dilarutkan dengan elution buffer sebanyak 50-100 μl dalam pemanas bersuhu 55-60 0C. Setelah diambil sebanyak 5 μl untuk pengukuran dengan spektrofotometer, RNA kemudian disimpan dalam suhu -80 0C. Prosedur isolasi ini tidak
menggunakan DNAse.
Pengukuran RNA total yang didapat dengan spektrofotometer
RNA yang didapat dari proses isolasi dijaga integritasnya dengan sesedikit mungkin melakukan freezing dan thawing. Untuk itu sebelum dimasukkan freezer, 5 μl aliquot dari RNA total yang diisolasi diukur dengan spektrofotometer pada panjang gelombang 260 nm, dengan pengenceran sebanyak 20 kali,
17 memiliki rasio A260/A280 > 1,8 digunakan untuk konversi ke complementary DNA (cDNA).
Pengenceran yang dipakai adalah 20 kali sehingga konsentrasi RNA total
dapat dihitung dengan rumus berikut:
Konsentrasi RNA =
konsentrasi A260 nm x faktor konversi x pengenceran x 1 ng/ μl
Konversi RNA total menjadi cDNA
Penelitian ini menggunakan metode two step reversed-transcript polymerase chain reaction (RT-PCR) dimana RNA yang didapat dari isolasi terlebih dulu diubah menjadi cDNA dalam proses reversed transcript. RNA dikonversi menjadi cDNA menggunakan enzim transkriptor kit avian
myeloblastosis virus (AMV) sesuai petunjuk produsen (Promega, Wisconsin, IL). Sebanyak 10-50 ng/μl RNA total ditambah dengan 2 μl primer random hexamer dengan konsentrasi 600 unit/μl dan 9 μl air. Campuran diinkubasi selama 10 menit dalam suhu 65 0C. Enzim ini merupakan produk gen dari RNA genom virus AMV. Bentuk yang aktif secara enzimatis merupakan subunit α, ββ, dan αβ.
Bentuk αβ merupakan subunit paling aktif memiliki aktivitas RNA-directed DNA polymerase.
Kemudian ditambahkan ke dalam setiap tube sebanyak 7 μl campuran yang
terdiri dari buffer AMV 5x, RNAse inhibitor 20 unit, dNTP 20 mM, dan enzim AMV reverse transcriptor sebanyak 10 unit, menghasilkan volume akhir sebanyak 20 μl. Campuran ini diinkubasi selama 1 jam dalam suhu 42 0C.
Reaksi Polymerase Chain Reaction (PCR)
Reaksi PCR dijalankan menggunakan PCR Go-taq Flexi sesuai petunjuk
18 Sekuens primer untuk nestin diperoleh dari publikasi Zhang et al tahun 2006 yang telah dikonfirmasi dengan Blast dari National Institute of Health (NIH). Sekuens nestin adalah 5’-GGAGTGTCGCTTAGAGGTGC-3’ (forward),
5’-TCCAGAAAGCCAAGAGAAGC-3’ (reverse) (327 bp). Sedangkan sekuens beta aktin adalah 5’-GAGAAGATCTGGCACCACACCT-3’ (forward), dan 5’-CAGGATTCCATACCCAAGAACC-3’ (reverse) (580 bp).
Reaksi PCR yang dilakukan adalah 94 0C selama 5 menit dilanjutkan 94 0C selama 30 detik, 60 0C selama 30 detik, 72 0C selama 30 detik, dan 72 0C selama 4
menit. Keseluruhan reaksi PCR dijalankan sebanyak 30 siklus.
Visualisasi hasil dengan gel elektroforesis dan gel documentation system G-box (Syngene, UK)
Produk PCR diseparasi dalam 2% gel agarose dengan elektroforesis. Elektroforesis dijalankan pada voltase 50 volt selama 30 menit dilanjutkan 100
volt selama 30 menit. Hasilnya segera difoto dengan G-box gel documentation system. Setting yang digunakan adalah G-box cheluminescence menggunakan laminator ultraviolet untuk sampel yang mengandung etidium bromida, dengan resolusi 400 dpi.
Analisis hasil digital G-box
Data yang diperoleh dari pembacaan genetools (Syngene, UK) untuk nestin
dirasiokan terhadap data yang terbaca dari beta aktin menghasilkan data pengukuran semikuantitatif. Hanya produk PCR dengan pita tunggal dan sesuai untuk estimasi berat molekul produk sekitar 300 bp yang dianalisis.
Densitometer kemudian mengukur intensitas cahaya masing-masing pita yang terbaca dari gel untuk setiap gen beta aktin dan nestin. Metode pengukuran semikuantitatif ekspresi nestin dirasiokan terhadap housekeeping gene beta aktin. Dengan demikian hasil pembacaannya merupakan unit rasio ekspresi gen nestin
19
Analisis Data
Data yang diperolah dari hasil pembacaan dengan G-box untuk masing-masing pita ekspresi nestin dirasiokan terhadap data yang terbaca dari betaaktin,
20
HASIL DAN PEMBAHASAN
Penelitian ini merupakan studi awal bagi metode alternatif kultur diferensiasi ESC mencit menjadi neuron secara in vitro, yang akan digunakan untuk kepentingan penelitian yang pada akhirnya akan bermuara untuk
kepentingan terapi degeneratif. Penelitian ini menggunakan conditioned medium dari kultur primer sel syaraf yang diyakini dapat menginduksi berkembangnya mESC menjadi neuron. Neuron yang terinduksi akan mengekspresikan nestin sebagai penanda molekuler bagi sel-sel progenitor neuron. Sebanyak 4 set sampel dari tiap perlakuan 10x-CM dan 1x-CM dikumpulkan untuk dianalisis
pertumbuhan dan perkembangannya serta level ekspresi nestin dengan beta aktin sebagai kontrol pembanding. Metode pengukuran yang dipakai adalah semikuantitatif dengan 2 steps RT-PCR.
Beta aktin sebagai protein sitoskeleton diketahui bersifat relatif stabil dan secara umum berada dalam level konstan pada semua sel. Beta aktin digunakan
sebagai kontrol prosedur teknis yaitu kontrol internal untuk kesalahan percobaan. Beta aktin terkonservasi dalam sel dan berfungsi dalam motilitas, struktur, dan integritas sel. Beberapa sumber menyatakan bahwa beta aktin terekspresi secara konstan pada semua sel tanpa pemberian perlakuan tertentu sebelumnya (Kouadjo
et al 2007).
Kultur Primer Sel Syaraf
Kultur primer sel syaraf digunakan sebagai sumber untuk mendapatkan conditioned medium. Sumber eksplan yang digunakan adalah hemisfer serebri
mencit yang berusia 2 hari. Bagian hemisfer serebri tersebut merupakan sumber dari berbagai tipe sel syaraf yang memiliki karakter multipoten, sehingga diharapkan porsi sel-sel progenitor masih tinggi. Dengan menggunakan metode monolayer, maka selain pertumbuhan dari sel-sel neurogenic juga terlihat
perkembangan dari sel-sel non neurogenic seperti sel fibroblas (Walton et al 2006).
Selama penelitian, karakter dari kultur primer sel syaraf yang teramati
21 petri setelah 24 jam. Pada beberapa hari kemudian terlihat adanya pertumbuhan soma dan neurit sebagai ciri khas dari neuron serta terkadang membentuk koneksi antar akson dari sel yang lain. Untuk menentukan dengan pasti tipe sel yang
berkembang pada kultur primer sel syaraf dapat dikonfirmasi dengan uji imunohistokimia, namun saat penelitian metode ini tidak dilakukan. Sementara itu, ketika dilakukan tripsinasi untuk subkultur ternyata viabilitas sel menjadi turun dan sel-sel yang tumbuh memiliki morfologi yang abnormal. Apabila periode kultur diperpanjang maka maturasi neuron terlihat dengan adanya
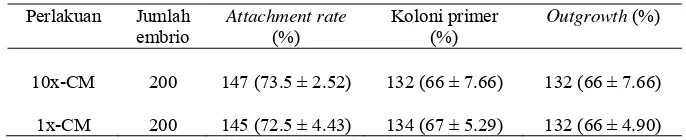
22 Gambar 3 Perkembangan sel syaraf dalam kultur setelah: (A) 24 jam, (B) 2 hari, (C) 4 hari, (D) 6 hari, (E, F) 8 hari. Panah putih (neurit); panah hitam
(soma). Skala bar 5 μm (A, B, C); 9 μm (D, E); 8 μm (F)
A B
C D
23 Secara in vivo, perkembangan neuron ditandai dengan adanya soma dan
neurit. Tingkat maturasi sel syaraf salah satunya ditentukan oleh jumlah neurit. Pada neuron bipolar memiliki soma berbentuk oval dan satu penjuluran akson serta dendrit, sedangkan pada neuron multipolar memiliki satu akson dan dendrit yang berkembang dari soma. Dengan adanya dendrit dan akson maka memungkinkan bagi neuron untuk saling berhubungan satu satu dengan yang lain
melalui mekanisme sinapsis. Sinapsis dapat terbentuk melalui hubungan antara akson dengan akson, akson dengan dendrit, dan akson dengan soma (Akers dan Denbow 2008).
Conditioned Medium
Contioned medium adalah medium kultur yang telah digunakan sebagian oleh suatu sel. Conditioned medium mengandung sejumlah faktor yang disekresikan oleh kultur sel tersebut. Faktor-faktor tersebut diyakini dapat
mendukung pertumbuhan dan perkembangan sel yang dikultur. Pada umumnya, CM digunakan dengan mencampurnya dengan fresh medium kultur. Beberapa riset melakukan purifikasi terhadap faktor-faktor yang terkandung di dalam CM, dengan maksud agar didapatkan spektrum protein yang mengandung protein target. Telah diketahui sebelumnya bahwa CM yang berasal dari kultur primer sel
syaraf mengandung sejumlah komponen penting seperti growth factor (faktor pertumbuhan) antara lain NGF (nerve growth factor), GDNF (glial derived-neurotrophic factor), dan GFAP (glial fibrillary acidic protein) (Xu et al 2005).
Conditioned medium yang dikoleksi dari kultur primer setelah inkubasi selama 48 jam, kemudian dilakukan proses pemekatan menggunakan Centricon plus 20®. Centricon plus 20® menerapkan prinsip ultrafiltrasi yang akan menyebabkan hanya protein berberat molekul lebih dari 10 kDa yang tertahan.
Selanjutnya dilakukan pengukuran konsentrasi terhadap konsentrat hasil pemekatan dan CM tanpa pemekatan. Hasilnya adalah 2615 μg/ml (untuk 10x-CM) dan 490 μg/ml (untuk 1x-CM). 10x-CM merupakan CM hasil pemekatan sedangkan 1x-CM merupakan CM tanpa pemekatan. Dengan kata lain, 10x-CM mengandung sejumlah concentrated protein dengan berat molekul lebih dari 10
24 Sedangkan 1x-CM merupakan CM yang mengandung sejumlah crude protein. Berikut merupakan hasil pengukuran konsentrasi CM dengan Biorad Protein Assay.
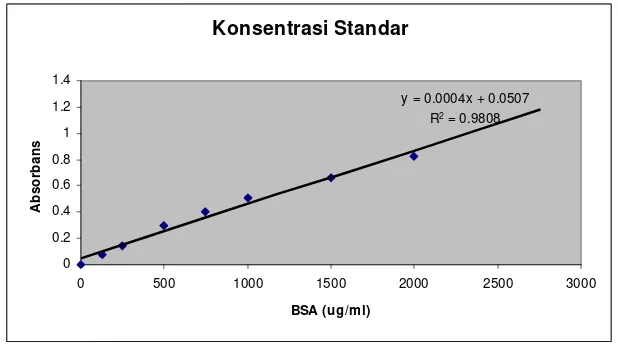
Gambar 4 Hasil pengukuran konsentrasi CM
Dengan memasukkan nilai absorbansi kedua macam CM yaitu 1,469 (10x-CM) dan 0,619 (1x-CM) pada persamaan tersebut, maka didapat nilai konsentrasinya adalah 2615 μg/ml (untuk 10x-CM) dan 490
μg/ml (untuk 1x-CM)
Dengan meninjau kembali pada spesifikasi dari Centricon plus 20®, maka penggunaan Centricon menjadi krusial. Centricon memiliki membran ultracel
regenerated cellulose yang bersifat low binding terhadap molekul protein. Sehingga diharapkan protein yang hilang dapat diminimalisir. Di lain pihak, beberapa studi mengemukakan bahwa penggunaan Centricon dapat menyebabkan terjadinya protein loss akibat adanya sejumlah molekul protein yang masih menempel pada dinding Centricon, sehingga tidak seluruhnya dapat terkoleksi
sebagai konsentrat. Namun demikian, beberapa riset menyatakan bahwa Centricon tetap dapat digunakan dalam melakukan proses pemekatan sampel protein.
Konsentrasi Standar
0 500 1000 1500 2000 2500 3000
25
Kultur ESC mencit
Kultur ESC dilakukan menurut petunjuk dari Zhang et al 2006 dengan sedikit modifikasi. Inner cell mass yang berhasil diisolasi secara immunosurgery
dikultur dengan pemberian LIF 20 ng/ml selama 8 hari dalam petri yang telah dilapisi gelatin. Selama penelitian terlihat adanya pertumbuhan dan perkembangan dari sel-sel ICM. Hal tersebut ditandai dengan mulai melekatnya koloni ICM pada dasar petri setelah 24 jam kultur (Gambar 5). Perlekatan menandakan bahwa sel mampu berinteraksi dengan kondisi kultur yang diberikan dan viabilitas sel itu
sendiri.
26 Selama kultur, ternyata pemberian LIF mampu mendukung perkembangan sel tetap dalam tahap undifferentiated. LIF merupakan anggota interleukin-6 (IL-6) cytokine family yang berperan dalam mempertahankan pluripotensi dan self
renewal ESC mencit. LIF menstimulasi ESC mencit melalui gp130 yang berfungsi sebagai heterodimer bersama dengan LIF receptor. Aktivasi gp310 menyebabkan teraktivasinya janus associated tyrosine kinase (JAK) dan signal transducer and activation of transcription 3 (STAT3). STAT3 selanjutnya masuk ke dalam nukleus dan menyebabkan ekspresi gen c-Myc, Oct4 atau Tbx3 yang
berperan dalam mempertahankan pluripotensi dan self renewal ESC. Bukti terakhir menunjukkan bahwa Oct4 selalu diekspresikan eksklusif di semua ESC (Pesche dan Scholer 2001).
Secara umum, terlihat bahwa ICM yang dikultur mampu berkembang dalam medium ESC yang didapat dari 4 kali pengulangan (Tabel 1). Keseluruhan blastosis yang diperoleh dibagi ke dalam 2 kelompok, tiap kelompok terdiri atas 200 embrio. Kondisi kultur yang diberikan kepada kedua kelompok tersebut
adalah sama. Dari 200 blastosis yang berhasil dikoleksi kemudian dilakukan immunosurgery, ada sebagian embrio yang belum mampu berkembang dalam kondisi kultur yang diberikan.
Tabel 1 Perkembangan ICM dalam kultur Perlakuan Jumlah
Kemampuan ICM untuk melekat ke dasar petri (attachment rate) pada
kedua kelompok berturut-turut adalah 73.5 ± 2.52% dan 72.5 ± 4.43%. Attachment rate diobservasi pada 24 dan 48 jam setelah penanaman. ICM yang melekat selanjutnya akan tumbuh dan berkembang membentuk koloni primer. Perkembangan koloni primer ditandai dengan bertambahnya diameter koloni
27 stem cell tumbuh dan berkembang membentuk multilayer. Selain itu juga terlihat adanya pertumbuhan sel ke arah samping koloni atau outgrowth. Sebanyak 66 ± 7.66% dan 66 ± 4.90% koloni dapat berkembang membentuk outgrowth.
Secara keseluruhan, persentase perkembangan ICM dalam kultur yang diperoleh selama penelitian apabila dibandingkan dengan hasil perkembangan kultur ICM oleh peneliti-peneliti sebelumnya yaitu masih rendah. Salah satu
faktor yang mungkin menjadi penyebabnya adalah para peneliti sebelumnya menggunakan feeder layer, sedangkan pada penelitian ini tidak menggunakan feeder layer. Feeder layer menyediakan lingkungan kultur yang mampu mendukung perkembangan ICM. Pada kultur ESC, sel-sel fibroblas umum digunakan sebagai feeder layer karena diyakini memproduksi sejumlah agen
mitogen yang dapat menunjang perkembangan ICM serta adanya kontak langsung juga berefek positif (Joo 2001).
Diferensiasi ESC Mencit menjadi Neuron
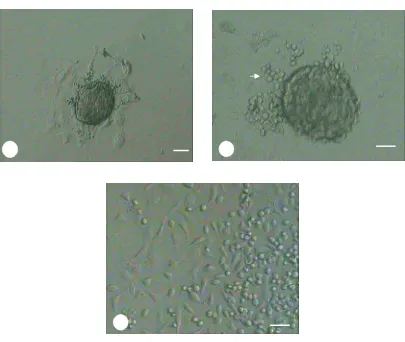
Diferensiasi ESC menjadi neuron dilakukan setelah hari ke-8 kultur. Pada saat itu telah terlihat adanya outgrowth dari koloni primer. Observasi terhadap kultur diferensiasi dilaksanakan selama 7 hari. Selama pengamatan, terlihat adanya beberapa sel yang memiliki morfologi seperti neuron (neural-like cells)
atau NLC yaitu adanya pertumbuhan neurit. Fenomena yang tampak selama proses kultur diferensiasi adalah pertumbuhan NLC cenderung di area outgrowth dengan kepadatan sel yang relatif rendah. Selain itu beberapa NLC memiliki neurit yang membentuk anastomosa dengan sel lainnya. Neuron yang tumbuh diidentifikasi sebagai neural-like cells (NLC) dikarenakan pewarnaan spesifik
28 Tabel 2 Karakter koloni yang berdiferensiasi
Perlakuan Sampel Outgrowth Koloni dengan
NLC (%) NLC
Dari koloni yang berdiferensiasi terdapat < 50 NLC (+) dan 50 – 200 NLC (++); ta = tidak ada
Berdasarkan Tabel 2, terlihat bahwa pada sampel dengan penambahan 1x-CM tidak menunjukkan adanya pertumbuhan NLC. Hal yang berbeda tampak pada sampel dengan penambahan 10x-CM. Sebanyak 8.83 ± 3.06% NLC teramati di bagian outgrowth, sehingga dapat dikatakan bahwa penambahan 10x-CM lebih mampu menginduksi terbentuknya NLC dari mESC. Kemampuan tersebut
dikarenakan CM yang telah dikonsentratkan hingga 10 kali diduga mengandung sejumlah komponen protein yang dapat dijadikan kandidat untuk mengarahkan perkembangan mESC menjadi NLC. Hal senada juga dikemukakan oleh Fukuda et al (2006) dan Moghadasali et al (2007) bahwa conditioned medium dari kultur
primer syaraf mengandung sejumlah faktor yang penting bagi perkembangan ESC menjadi neuron seperti FGF-2, NGF, GDNF, dan GFAP. Namun demikian, apabila dibandingkan dengan riset-riset sebelumnya persentase NLC yang berkembang masih sangat rendah. Faktor yang mungkin menjadi penyebabnya adalah kemungkinan belum optimalnya kandungan dari CM yang digunakan
29 selama 8 hari telah memiliki neuron yang matang sehingga porsi untuk NPC rendah.
Perkembangan NLC pada tiap sampel memiliki sedikit perbedaan. Secara
visual, NLC cenderung mudah terlihat dikarenakan tumbuh di area outgrowth, memiliki soma dan neurit. Selanjutnya NLC dapat dikelompokkan menjadi 2 kelompok berdasarkan jumlahnya pada tiap sampel. Berdasarkan Tabel 2 terlihat bahwa jumlah NLC dari tiap sampel bervariasi. Pada sampel A01, A03, dan A04 memiliki NLC lebih sedikit dibanding sampel A02. Perbedaan tersebut
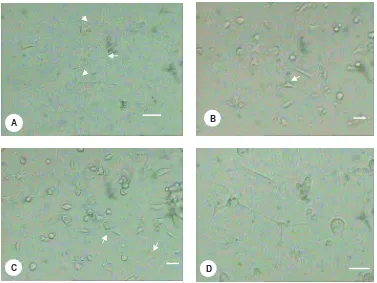
kemungkinan disebabkan oleh faktor kondisi fisiologis dari sampel. Sandra et al 2005 menyatakan bahwa setiap sel memiliki kemampuan untuk merespon terhadap stimulus yang diberikan berbeda. Dugaan tersebutlah yang mendasari perbedaan tersebut. Sementara itu, pada perlakuan 1x-CM tidak tampak adanya perkembangan NLC. Berikut merupakan gambaran NLC yang teramati.
Gambar 6 Beberapa neural-like cells yang teramati pada hari ke-7 Skala bar 5 μm (A, B, C) dan 7 μm (D)
A B
30 Berdasarkan hasil penelitian, terlihat bahwa CM berperan besar dalam diferensiasi mESC menjadi neuron. Berbagai riset membuktikan bahwa sejumlah komponen penting dalam CM ikut berkontribusi. Sebagai contoh, FGF-2 dan EGF
berperan untuk meregulasi diferensiasi NPC menjadi neuron dan astrosit (Bjorklund et al 2002), bFGF berkontribusi dalam neurit outgrowth, GDNF mampu mendukung perkembangan neuron dopamine (Hoefen et al 2004), serta NGF dapat menginduksi perkembangan mESC menjadi neuron (Kitazawa dan Shimizu 2005).
Ekspresi nestin
Isolasi RNA total dari tiap sampel dilakukan setelah kultur diferensiasi berusia 7 hari (Pachernik et al 2002). Berdasarkan Tabel 3 terlihat bahwa RNA
total yang berhasil diisolasi dari tiap sampel terdapat pada kisaran 29.80 ng/μl hingga 90.40 ng/μl. Sebagai kontrol positif terhadap nestin adalah jaringan otak yang memiliki RNA total dengan konsentrasi 90.40 ng/μl. Setelah RNA total didapat maka dilakukan konversi ke cDNA. Namun demikian, selama penelitian tidak dilakukan penyesuaian atau penyamaan konsentrasi awal RNA yang akan
dikonversi, sehingga hasil pembacaan PCR dari keseluruhan koloni sel pada tiap sampel.
Tabel 3 Hasil isolasi RNA total dari sampel
31 Untuk mendeteksi ekspresi dari gen target, sebelumnya dilakukan optimasi terhadap primer agar didapatkan hasil pembacaan pita tunggal dan spesifik.
Berdasarkan hasil PCR, dapat dikatakan bahwa pemilihan primer sudah cukup spesifik sehingga produk yang dinilai intensitasnya (pita sebesar 327 bp untuk nestin) hanya mencerminkan hasil amplifikasi RNA, dan bebas dari kontaminasi DNA genomik.
Hasil PCR mengkonfirmasi bahwa sampel dengan penambahan 1x-CM
tidak menghasilkan pita ekspresi nestin. Sedangkan pada sampel dengan penambahan 10x-CM terlihat bahwa nestin terekspresi dengan intensitas pita yang bervariasi (Gambar 7).
Gambar 7 Hasil gel elektroforesis sampel 10x-CM.
Pita hasil PCR berturut-turut adalah sampel A01 (1), A02 (2), A03 (3), A04 (4), jaringan otak (5), dan size marker 100 bp (6)
Nestin merupakan penanda molekuler awal yang digunakan untuk mendeteksi adanya neural progenitor cell (NPC). Perbedaan level ekspresinya
bergantung dari jumlah sel progenitor pada tiap sampel. Sebagai kontrol 1 2 3 4 5 6
300 bp
nestin
400 bp 327 bp
beta aktin
32 pembanding digunakan beta aktin. Setelah setiap gel didokumentasikan dengan G-box, maka dilakukan kuantitasi hasil pita-pita bacaannya. Hasil pengukuran untuk masing-masing sampel dapat dilihat pada Tabel 4.
Tabel 4 Hasil rasio ekspresi nestin terhadap beta aktin pada sampel 10x-CM
Nama
otak 26878599 384811474 0.69848
Berdasarkan Tabel 4 terlihat bahwa hasil pembacaan beta aktin memiliki
lebar variasi yang mirip untuk setiap sampel, sehingga dapat dikatakan bahwa adanya kemiripan jumlah ekspresi beta aktin pada setiap sampel. Sedangkan untuk rasionya sendiri memiliki kisaran antara 0.08 sampai 0.69. Pada sampel dengan penambahan 10x-CM, sampel A02 memiliki nilai rasio nestin terhadap beta aktin tertinggi yaitu 0.20318 dan yang terendah adalah sampel A03 yaitu
0.08083. Sedangkan pada kontrol positif yaitu jaringan otak memiliki nilai rasio 0.69848. Apabila dibandingkan dengan kontrol positif maka nilai rasio dari tiap sampel dengan penambahan 10x-CM sudah sesuai yaitu nilainya lebih kecil.
Informasi lain yang dapat diangkat bahwa rasio ekspresi nestin/beta aktin
dari tiap sampel memiliki kemiripan dan memiliki korelasi dengan jumlah koloni yang berdiferensiasi. Apabila dibandingkan antara nilai rasio nestin/beta aktin dengan jumlah koloni yang berdiferensiasi maka didapat nilai rasio ekspresi per koloni adalah berkisar 0.04 (pada semua sampel). Namun demikian, nilai rasio tersebut belum dapat dikatakan sebagai faktor utama ekspresi nestin dikarenakan
33
Potensi 10x-CM dalam Diferensiasi mESC Mencit menjadi Neuron
Berdasarkan hasil-hasil penelitian didapatkan bahwa 10x-CM dapat menginduksi mESC menjadi NLC. Hal tersebut dikarenakan 10x-CM memiliki komponen protein yang berperan penting untuk diferensiasi seperti yang telah dijelaskan sebelumnya. Dengan menggunakan Centricon plus 20® maka sejumlah protein dengan berat molekul di atas 10 kDa yang terkoleksi. Namun demikian,
untuk menentukan faktor penginduksi atau protein mana yang memang berperan untuk mendiferensiasikan mESC menjadi NLC dalam penelitian ini masih belum dapat diinformasikan. Hal tersebut dikarenakan pengujian untuk mengidentifikasi profil protein dalam 10x-CM belum dilakukan. Lin et al 2008 juga menyatakan bahwa protein loss kemungkinan besar terjadi pada proses pemekatan
menggunakan sistem filter, namun metode pemekatan sampel menggunakan sistem filter cukup reliable untuk diterapkan. Dengan menggunakan metode pemekatan ini maka didapatkan bagian konsentrat dan filtrat. Untuk menguji adanya protein loss maka filtrat perlu dikaji lebih lanjut. Filtrat ditengarai juga
34
KESIMPULAN DAN SARAN
Kesimpulan
1. Conditioned medium yang dikonsentratkan hingga 10 kali (10x-CM) dapat menunjang diferensiasi ESC mencit menjadi neural-like cells.
2. Penambahan 10x-CM ke dalam medium diferensiasi sebanyak 5% mampu mendukung perkembangan ESC mencit menjadi NLC.
3. Diferensiasi ESC mencit menjadi NLC dapat dilakukan tanpa melalui
pembentukan embryoid bodies.
4. Teknik deteksi ekspresi gen dengan two steps RT-PCR diikuti analisis semikuantitatif dengan densitometer terbukti dapat dipakai untuk mendeteksi perbedaan tingkat ekspresi nestin pada tiap sampel.
Saran
1. Perlu dilakukan pengecekan terhadap faktor penginduksi yang dihasilkan
pada hari ke berapa selama kultur primer syaraf.
2. Perlu adanya identifikasi kandungan protein dalam conditioned medium dengan menggunakan teknik yang lebih spesifik.
3. Dapat dilakukan penambahan periode kultur agar terlihat adanya pertumbuhan tipe neuron yang lain
4. Dapat dipertimbangkan untuk melakukan konfirmasi terhadap sel-sel yang berdiferensiasi dengan menggunakan penanda molekuler lainnya.
5. Sangat dianjurkan untuk melakukan uji imunositokimia guna mendapatkan informasi yang lebih mendukung.
6. Disarankan untuk melakukan penelitian lanjutan terhadap pemisahan
35
DAFTAR PUSTAKA
Akers RM, Denbow DM. 2008. Anatomy and physiology of domestic animals. 1st Edition. Iowa: Blackwell Publishing. p.205-209.
Atmosukarto I. 2005. Penelitian berbasis stem cell: Harapan dan kontroversinya. Biotrends. 1:11-16.
Bentz K, Molcanyi M, Heb S, Schneider A, et al. 2006. Neural differentiation of embryonic ctem cells is induced by signaling from non-neural niche cells. Cell Physiol. Biochem. 18:275-286.
Bhattacharya B, Cai J, Luo Y, Miura T, et al. 2005. Comparison of the gene expression profile of undifferentiated human embryonic stem cell lines and differentiating embryoid bodies. BMC Dev. Biol. 5:22-38.
Bjorklund LM, Pernaute RS, Chung S, et al. 2002. Embryonic stem cells develop into functional dopaminergic neurons after transplantation in Parkinson rat model. Proc. Natl. Acad. Sci. USA. 99:2344-2349.
Bouhon IA, Kato H, Chandran S, Allen N. 2005. Neural differentiation of mouse embryonic stem cells in chemically defined medium. Brain Res. Bull. 68:62-75.
Bryja V, Bonilla S, Cajanek L, a Parish CL, et al. 2006. An efficient method for the derivation of mouse embryonic stem cells. Stem Cells. 24:844-849.
Cleary MA, Uboha N, Picciotto MR, Beech RD. 2006. Expression of ezrin in glial tubes in adult subventricular zone and rostral migratory stream. J. Neurosci. 143:851-861.
Conti L, Pollard SM, Gorba T, Reitano E, et al. 2005. Niche independent symmetrical self renewal of a mammalian tissue stem cell. Plos Biol. 3:283-296.
Denham M, Conley BJ, Olsson F, Gulluyan L, Cole T. 2007. A murine respiratory inducing niche displays variable efficiency across human and mouse embryonic stem cell species. Am. J. Physiol. Lung Cell Mol. Physiol., in press.
Ding S, Schultz PG. 2004. A role for chemistry in stem cell biology. Nat. Biotechnol. 22:833-840.