KERENTANAN
Plutella xylostella
DARI KEJAJAR DIENG,
KABUPATEN WONOSOBO, JAWA TENGAH TERHADAP
LIMA JENIS INSEKTISIDA KOMERSIAL DAN
EKSTRAK BUAH
Piper aduncum
WIRATHAZIA ENBYA LAVITRI CHENTA
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul “Kerentanan Plutella xylostella dari Kejajar Dieng, Kabupaten Wonosobo, Jawa Tengah terhadap Lima Jenis Insektisida Komersial dan Ekstrak Buah Piper aduncum”adalah benar karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
Wirathazia Enbya Lavitri Chenta
ABSTRAK
WIRATHAZIA ENBYA LAVITRI CHENTA. Kerentanan Plutella xylostella dari Kejajar Dieng, Kabupaten Wonosobo, Jawa Tengah terhadap Lima Jenis Insektisida Komersial dan Ekstrak Buah Piper aduncum. Dibimbing oleh DJOKO PRIJONO.
Plutella xylostella merupakan hama penting pada tanaman famili Brassicaceae yang dapat menurunkan hasil panen secara nyata. Petani umumnya mengendalikan hama tersebut dengan menggunakan insektisida sintetik secara intensif. Namun, cara pengendalian tersebut dapat menimbulkan berbagai dampak negatif termasuk resistensi hama sasaran. Penelitian ini bertujuan menentukan kerentanan larva P. xylostella yang berasal dari Desa Kejajar, Kecamatan Kejajar Dieng, Kabupaten Wonosobo, Jawa Tengah terhadap lima jenis insektisida komersial, yaitu deltametrin, emamektin benzoat, klorantraniliprol, profenofos dan spinetoram, serta ekstrak buah Piper aduncum sebagai insektisida nabati untuk alternatif pengendalian. Insektisida komersial dan ekstrak P. aduncum
diujikan pada larva instar 2 menggunakan metode celup daun dengan pemberian daun pakan perlakuan selama 48 jam. Pengamatan mortalitas serangga uji dilakukan pada 24, 48, 72, dan 96 jam setelah perlakuan (JSP). Berdasarkan LC95
pada 96 JSP, deltametrin dan profenofos memiliki tingkat toksisitas yang rendah terhadap larva P. xylostella dengan LC95 masing-masing 2030 dan 8462 mg b.a./L.
LC95 tersebut 203 dan 11.3 kali lebih tinggi daripada konsentrasi anjuran
masing-masing insektisida. Larva P. xylostella masih rentan terhadap 3 jenis insektisida komersial yang lain dan ekstrak buah P. aduncum. LC95 emamektin benzoat,
klorantraniliprol, dan spinetoram masing-masing 2.59, 23.07, dan 0.90 mg b.a./L. LC95 tersebut berturut-turut 3.86, 1.73, dan 13.33 kali lebih rendah daripada
konsentrasi anjuran masing-masing. LC95 ekstrak P. aduncum (2288.39 mg
ekstrak/L) lebih rendah daripada LC95 profenofos tetapi lebih tinggi daripada LC95
empat jenis insektisida komersial yang lain, sementara LC50 ekstrak P. aduncum
lebih rendah daripada LC95 deltametrin dan profenofos. Dengan demikian, P.
xylostella asal Kejajar Dieng, Kabupaten Wonosobo, Jawa Tengah tidak rentan terhadap deltametrin dan profenofos namun masih rentan terhadap emamektin benzoat, klorantraniliprol, dan spinetoram. Sementara itu, ekstrak buah P. aduncum dapat digunakan sebagai insektisida alternatif untuk mengendalikan P. xylostella. Pada perlakuan dengan 3 taraf konsentrasi terendah, perlakuan insektisida uji dapat mematikan larva P. xylostella tetapi tidak menghambat pembentukan pupa dan imago secara nyata pada larva yang bertahan hidup.
ABSTRACT
WIRATHAZIA ENBYA LAVITRI CHENTA. Susceptibility of Plutella xylostella from Kejajar Dieng District, Wonosobo Regency, Central Java to Five Commercial Insecticides and Piper aduncum Fruit Extract. Supervised by DJOKO PRIJONO.
Plutella xylostella is an important pest of Brassicaceae vegetable crops that can reduce crop production significantly. In general, farmers use syntethic insecticides intensively to control the pest. However, this control tactic has some negative impacts including resistance in target pests. This study was conducted to determine the susceptibility of P. xylostella from Kejajar Dieng District, Wonosobo Regency, Central Java to five commercial insecticides, i.e. chloranthraniliprole, deltamethrin, emamectin benzoate, profenofos, and spinetoram, as well as Piper aduncum fruit extract as a botanical insecticide for alternative control means. The commercial insecticides and P. aduncum extract were tested against second-instar larvae P. xylostella with a leaf-dip feeding method in which the feeding treatment was given for 48 hours. Larval mortality was counted at 24, 48, 72, and 96 hours after treatment (HAT) and larval mortality data was analyzed with a probit method. Based on LC95 at 96 HAT, deltamethrin
and profenofos had low toxicity on P. xylostella larvae. LC95 of these insecticides
were 2030 and 8462 mg a.i./L, respectively, which were 203 and 11.3-fold higher than their respective recommended field rates. Meanwhile, P. xylostella larvae were still susceptible to the other three commercial insecticides and P. aduncum
extract. LC95 of chlorantraniliprole, emamectin benzoate, and spinetoram were
23.07, 2.59, and 0.90 mg a.i./L, respectively, which were 1.73, 3.86, and 13.33-fold lower than their respective recommended field rates. On the other hand LC95
of P. aduncum extract (2288.39 mg/L) was lower than that of profenofos but was higher than that of the other four commercial insecticides. Meanwhile, LC50 of P.
aduncum extract was much lower than that of deltamethrin and profenofos. Thus,
P. xylostella from Kejajar Dieng District were not susceptible to deltamethrin and profenofos but still susceptible to the other three commercial insecticides. In addition, P. aduncum extract can be used as an alternative insecticide for the control of P. xylostella. In the treatment with three lowest concentrations, all test insecticides could kill P. xylostella larvae but did not inhibit pupation and adult emergence significantly in the surviving larvae.
© Hak Cipta milik IPB, tahun 2014 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
KERENTANAN
Plutella xylostella
DARI KEJAJAR DIENG,
KABUPATEN WONOSOBO, JAWA TENGAH TERHADAP
LIMA JENIS INSEKTISIDA KOMERSIAL DAN
EKSTRAK BUAH
Piper aduncum
WIRATHAZIA ENBYA LAVITRI CHENTA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Kerentanan Plutella xylostella dari Kejajar Dieng, Kabupaten Wonosobo, Jawa Tengah lterhadap Lima Jenis Insektisida Komersial dan Ekstrak Buah Piper aduncum
Nama Mahasiswa : Wirathazia Enbya Lavitri Chenta NIM : A34100010
Disetujui oleh
Ir. Djoko Prijono, MAgrSc. Dosen Pembimbing
Diketahui oleh
Dr. Ir. Abdjad Asih Nawangsih, MSi. Ketua Departemen Proteksi Tanaman
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan tugas akhir yang
berjudul “Kerentanan Plutella xylostella dari Kejajar Dieng, Kabupaten Wonosobo, Jawa Tengah lterhadap Lima Jenis Insektisida Komersial dan Ekstrak Buah Piper aduncum”, sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman, Institut Pertanian Bogor. Penelitian ini dilaksanakan di Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman dari Desember 2013 sampai April 2014 yang dibiayai sebagian oleh Program Kreativitas Mahasiswa, Direktorat Jenderal Pendidikan Tinggi, Kementerian Pendidikan dan Kebudayaan.
Terima kasih penulis ucapkan kepada kedua orang tua penulis Ayah Djaka Sudibja dan Ibu Eny Purwati serta adik penulis Wiradizta Enbya Putra Bagaskara atas doa yang senantiasa dipanjatkan dan semangat yang selalu diberikan. Ucapan terima kasih juga penulis sampaikan kepada Ir. Djoko Prijono, MAgrSc. selaku dosen pembimbing yang telah banyak memberikan ilmu, arahan, motivasi, dan bimbingan selama ini. Terima kasih penulis sampaikan kepada Dr. Ir. Abdul Munif, MSc. selaku dosen penguji tamu yang telah memberikan saran serta semangat. Terima kasih juga penulis sampaikan kepada Dr. Ir. Gede Suastika, MSc. selaku dosen pembimbing akademik yang telah banyak memberikan bimbingan dan motivasi selama penulis menyelesaikan studi di Departemen Proteksi Tanaman.
Terima kasih kepada sahabat dan rekan-rekan di Laboratorium Fisiologi dan Toksikologi Serangga, khususnya Masaidah Cardi, SP., Aulia Rakhman, Trijanti A. Widinni Asnan, SP., Gracia Mediana, SP., Annisa Nurfajrina, SP., Muhammad Sigit Susanto, SP., Eka Candra Lina, MSi., serta Bp. Agus Sudrajat atas kerja sama, saran, dan semangat yang senantiasa diberikan.
Terima kasih kepada sahabat seperjuangan Winar Nur Aisyah Fatimah, Sheilla Amanda, Gita Sri Lestari, Dian Novitasari, Widi Astuti, Endah Wahyuni, Hagia Sophia Khairani, SP., dan Rizky Marcheria Ardiyanti atas bantuan, dukungan, saran, dan semangat yang diberikan. Terima kasih kepada seluruh teman-teman Proteksi Tanaman 47, seluruh adik serta kakak tingkat yang tidak dapat disebutkan satu per satu atas persahabatan dan kebersamaannya selama ini.
Penulis berharap semoga hasil penelitian ini dapat bermanfaat bagi kita semua.
Bogor, Juli 2014
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN x
PENDAHULUAN 1
Latar Belakang 3
Tujuan Penelitian 3
Manfaat Penelitian 3
BAHAN DAN METODE 4
Tempat dan Waktu Pelaksanaan 4 Perbanyakan Tanaman Pakan P. xylostella 4
Perbanyakan Serangga Uji 4
Penyiapan Insektisida Uji 4 Ekstraksi Buah Piper aduncum 5
Uji Toksisitas 5
HASIL DAN PEMBAHASAN 7
Toksisitas Insektisida Uji terhadap Larva P. xylostella 7 Pengaruh Insektisida Uji terhadap Perkembangan Larva P. xylostella 13
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 16
LAMPIRAN 19
DAFTAR TABEL
1 Toksisitas lima jenis insektisida komersial dan ekstrak buah P. aduncum
tehadap larva P. xylostella 11 2 Persentase pupa dan imago P. xylostella yang terbentuk dari larva yang
bertahan hidup pada perlakuan dengan lima jenis insektisida komersial
dan ekstrak buah P. aduncum 13
DAFTAR GAMBAR
1 Struktur kimia dilapiol 2 2 Perkembangan tingkat mortalitas larva P. xylostella asal Kejajar Dieng
pada perlakuan dengan deltametrin, emamektin benzoat,
klorantra-niliprol, profenofos, spinetoram, dan ekstrak buah P. aduncum 8 3 A: daun kubis yang menunjukkan gejala fitotoksisitas berupa bercak
nekrosis akibat perlakuan dengan deltametrin 1500 mg b.a./L; (B) daun kubis yang tidak menunjukkan gejala fistotoksisitas setelah diberi
2
DAFTAR LAMPIRAN
1 Peta lokasi pengambilan serangga P. xylostella 20 2 Kondisi lahan kubis tempat pengambilan serangga P. xylostella 21 3 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan
deltametrin 21
4 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan
emamektin benzoat 21
5 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan
klorantraniliprol 22
6 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan
profenofos 22
7 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan
spinetoram 22
8 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan P.
aduncum 23
9 Mortalitas larva P. xylostella pada perlakuan uji lanjutan deltametrin 23 10 Mortalitas larva P. xylostella pada perlakuan uji lanjutan emamektin
benzoat 23
11 Mortalitas larva P. xylostella pada perlakuan uji lanjutan
klorantraniliprol 24
12 Mortalitas larva P. xylostella pada perlakuan uji lanjutan profenofos 24 13 Mortalitas larva P. xylostella pada perlakuan uji lanjutan spinetoram 24 14 Mortalitas larva P. xylostella pada perlakuan uji lanjutan ekstrak buah
PENDAHULUAN
Latar Belakang
Salah satu hama penting pada tanaman kubis dan tanaman kubis-kubisan lainnya (famili Brassicaceae) ialah Plutella xylostella (L.) (Lepidoptera: Yponomeutidae). Hama tersebut menyerang tanaman inang sejak awal pertumbuhan hingga menjelang panen. Serangan P. xylostella yang berat pada tanaman kubis, terutama pada musim kemarau, dapat menggagalkan panen (Sastrosiswojo 1987).
Dalam upaya mengatasi masalah hama tanaman kubis, petani umumnya menekankan pada pengendalian menggunakan insektisida sintetik. Insektisida umumnya digunakan secara intensif, baik secara tunggal maupun dalam bentuk campuran beberapa jenis insektisida, dengan konsentrasi penyemprotan melebihi rekomendasi dan interval penyemprotan yang pendek, yaitu 1-2 kali/minggu (Sastrosiswojo 1991). Penggunaan insektisida yang intensif tersebut dapat menimbulkan berbagai dampak negatif termasuk terjadinya resistensi hama P. xylostella terhadap insektisida yang sering digunakan (Sastrosiswojo 1987).
Beberapa insektisida komersial yang sering digunakan petani kubis untuk mengendalikan hama P. xylostella ialah deltametrin (piretroid), emamektin benzoat (turunan avermektin), klorantraniliprol (diamida antranilat), dan profenofos (organofosfat). Beberapa petani bahkan sudah menggunakan insektisida berbahan aktif spinetoram (turunan spinosad) yang di Indonesia sebenarnya belum terdaftar untuk mengendalikan hama P. xylostella.
Deltametrin merupakan insektisida racun saraf dari golongan piretroid dengan cara kerja menunda penutupan saluran ion natrium pada akson saraf (Yu 2008). Emamektin benzoat merupakan turunan semisintetik dari avarmektin B1a
dan B1b (makrolida) yang berasal dari aktinomiset tanah Streptomyces avermitilis
(Pitterna 2007). Insektisida tersebut bekerja sebagai racun saraf yang mengaktifkan pembukaan saluran ion klorida pada sel saraf sehingga mengakibatkan kelumpuhan dan kematian serangga (Casida dan Durkin 2013). Klorantraniliprol merupakan insektisida agonis reseptor rianodin dari golongan diamida antranilat dengan cara kerja mengganggu saraf otot melalui pengaktifan reseptor rianodin (Cordova et al. 2006). Profenofos merupakan insektisida dari golongan organofosfat yang menghambat kerja enzim asetilkolinesterase (Casida dan Durkin 2013). Spinetoram merupakan campuran analog semisintetik dari spinosin J dan spinosin L (dari aktinomiset Saccharopolyspora spinosa) (Crouse
et al. 2007). Spinosin bekerja sebagai agonis reseptor asetilkolin yang menimbulkan impuls saraf secara terus-menerus sehingga akan terjadi gejala hipereksitasi, kejang-kejang, kelumpuhan, dan kematian (Salgado dan Sparks 2010).
Resistensi hama P. xylostella terhadap insektisida piretroid dan organofosfat sudah sering diteliti. Resistensi hama tersebut terhadap insektisida piretroid dan organofofat telah dilaporkan di beberapa negara seperti Australia, Tiongkok, India, Nikaragua, Pakistan, Filipina, Afrika Selatan, dan Korea Selatan (Furlong
et al. 2013). Di Indonesia, P. xylostella strain Lembang dilaporkan resisten terhadap asefat, triazofos, dan deltametrin (Sastrosiswojo et al. 1989). Moekasan
2
terhadap deltametrin dan profenofos, demikian pula dengan P. xylostella dari Lembang dan Pangalengan (Kabupaten Bandung) yang dilaporkan resisten terhadap deltametrin dan profenofos. P. xylostella dari daerah Lembang, Pangalengan, Garut, dan Buleleng juga dilaporkan oleh Udiarto dan Setiawati (2007) resisten terhadap deltametrin dan profenofos serta P. xylostella asal Lembang, Pangalengan, dan Garut dilaporkan resisten terhadap abamektin.
Insektisida emamektin benzoat, klorantraniliprol, dan spinetoram merupakan insektisida yang relatif baru. Wang dan Wu (2012) melaporkan bahwa
P. xylostella dari Provinsi Guangdong, Tiongkok resisten terhadap klorantraniliprol dengan LC50 berkisar dari 2.6 sampai 2000 kali lipat lebih tinggi
daripada LC50 strain rentan. Di Filipina dan Thailand, P. xylostella dilaporkan
resisten terhadap klorantraniliprol dengan LC50 sebesar 200 kali lipat
dibandingkan dengan strain rentan (Troczka et al. 2012). Berbeda dengan insektisida klorantraniliprol, kasus resistensi P. xylostella terhadap emamektin benzoat dan spinetoram belum banyak dilaporkan.
Untuk mengatasi resistensi P. xylostella terhadap insektisida kimia berbahan aktif tunggal, penggunaan insektisida nabati dapat digunakan sebagai salah satu alternatif pengendalian. Insektisida nabati memiliki beberapa kelebihan termasuk aman terhadap lingkungan (Prakash dan Rao 1997; Dadang dan Prijono 2008). Salah satu bahan tumbuhan yang berpotensi digunakan sebagai sumber insektisida nabati ialah buah sirih hutan, Piper aduncum L. (Piperaceae) (Bernard et al. 1995; Hasyim 2011).
Dilapiol (Gambar 1) merupakan komponen utama ekstrak etanol daun sirih hutan, yang pada perlakuan konsentrasi 0.1 ppm menyebabkan kematian larva nyamuk Aedes atropalpus sebesar 92% (Bernard et al. 1995). Hasyim (2011) melaporkan bahwa komponen utama dalam fraksi aktif dari ekstrak n-heksana buah sirih hutan adalah dilapiol dengan area puncak pada kromatogram berdasarkan analisis dengan kromatografi gas sebesar 68.8%. Nailufar (2011) serta Syahroni dan Prijono (2013) melaporkan bahwa ekstrak etil asetat buah sirih hutan memiliki aktivitas insektisida yang kuat terhadap larva Crocidolomia pavonana dengan LC95 masing-masing sebesar 0.32% dan 0.30%. Aktivitas
insektisida ekstrak buah sirih hutan terhadap larva P. xylostella belum pernah dilaporkan.
Dilapiol memiliki gugus metilendioksifenil (MDF) yang merupakan ciri khas dari senyawa yang bersifat sinergis. Senyawa yang memiliki gugus MDF dapat menghambat aktivitas enzim polysubstrate monooxygenase (PSMO) yang merupakan senyawa pertahanan biokimia yang dapat menurunkan tingkat racun senyawa tertentu di dalam sel. Terhambatnya enzim PSMO mengakibatkan terjadinya penumpukan senyawa yang bersifat racun di dalam tubuh serangga yang akhirnya dapat menyebabkan kematian (Bernard et al. 1995; Scott et al.
3
Gambar 1 Struktur kimia dilapiol. Sumber: Bernard et al. (1995).
Tujuan Penelitian
Penelitian ini bertujuan menentukan kerentanan larva P. xylostella asal Kecamatan Kejajar Dieng, Kabupaten Wonosobo, Jawa Tengah terhadap insektisida komersial berbahan aktif deltametrin, emamektin benzoat, klorantraniliprol, profenofos, dan spinetoram, serta ekstrak buah sirih hutan. Sebagai data penunjang juga diamati persentase pembentukan pupa dan imago dari larva P. xylostella yang bertahan hidup pada perlakuan dengan insektisida uji pada 3 taraf konsentrasi terendah.
Manfaat Penelitian
BAHAN DAN METODE
Tempat dan Waktu Pelaksanaan
Penelitian dilaksanakan di Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB) dari Desember 2013 sampai April 2014.
Perbanyakan Tanaman Pakan P. xylostella
Daun kubis (Brassica olerace L. var. capitata) cv. KK Cross digunakan sebagai pakan larva P. xylostella dan sebagai medium perlakuan pada uji toksisitas. Tanaman kubis diperbanyak sesuai dengan keperluan pakan serangga uji. Benih kubis disemai pada nampan dengan lubang tanam sebanyak 50 lubang menggunakan media semai campuran tanah, kompos Super Metan, dan 4 butir pupuk majemuk Dekastar (NPK 13-13-13+TE) per lubang tanam. Bibit yang berumur 4 minggu atau memiliki 4 helai daun dipindahkan ke polybag kapasitas 5 L yang diisi campuran tanah dan pupuk kandang dengan perbandingan 3:1 (v/v). Pada setiap polybag ditanam satu bibit tanaman kubis. Setelah berumur 4 minggu, tanaman dipupuk NPK dengan dosis ± 1 g per polybag. Tanaman kubis yang telah berumur 2 bulan digunakan sebagai pakan larva P. xylostella dan sebagai medium perlakuan (Abizar dan Prijono 2010). Sebagai tempat peneluran oleh imago P. xylostella digunakan bibit tanaman sawi yang berumur 3 hari. Benih sawi disemai dalam pot kapasitas 1 L dengan medium tanah. Satu pot diisi 0.8 g benih sawi. Bibit sawi berumur 3 hari digunakan sebagai tempat peletakan telur oleh imago P. xylostella.
Perbanyakan Serangga Uji
Serangga P. xylostella yang digunakan dalam penelitian diambil dari Desa Kejajar, Kecamatan Kejajar Dieng, Kabupaten Wonosobo, Provinsi Jawa Tengah pada tanggal 25 Desember 2013 dan 10 Maret 2014. Lokasi pengambilan contoh terletak pada koordinat 7°15’2.10” LS dan 109°57’15.90” BT (Lampiran 1). Serangga tersebut diperbanyak di Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman, IPB. Imago P. xylostella dipelihara dalam kurungan kasa berbingkai besi (50 cm x 50 cm x 50 cm) dan diberi pakan larutan madu 10% yang diserapkan pada segumpal kapas yang digantungkan di dalam kurungan. Bibit sawi yang berumur 3 hari diletakkan di dalam kurungan sebagai tempat peletakan telur oleh imago P. xylostella. Kelompok telur pada daun sawi dikumpulkan setiap hari. Setelah telur menetas, larva dipindahkan ke dalam wadah plastik (35 cm x 26 cm x 6 cm) berjendela kasa yang dialasi kertas stensil dan diletakkan daun kubis bebas pestisida sebagai pakannya.(Cardi 2014). Larva P. xylostella instar II dari generasi II digunakan untuk pengujian.
Penyiapan Insektisida Uji
5
Sebagai sumber ekstrak digunakan buah P. aduncum yang diperoleh dari lingkungan kampus IPB, Darmaga Bogor.
Ekstraksi Buah Piper aduncum
Buah P. aduncum dikeringanginkan selama 1 minggu kemudian dipotong kecil-kecil dan digiling menggunakan blender hingga menjadi serbuk. Serbuk buah P. aduncum diayak menggunakan pengayak kawat kasa berjalinan 0.5 mm. Serbuk buah P. aduncum sebanyak 200 g direndam dalam 1600 ml etil asetat selama 24 jam dan diulang sebanyak 3 kali (Nailufar 2011). Hasil rendaman disaring dengan corong kaca beralaskan kertas saring Whatman No. 41. Hasil saringan diuapkan dengan menggunakan rotary evaporator pada suhu 50 ºC dengan tekanan 240 mbar. Etil asetat hasil penguapan yang diperoleh digunakan kembali untuk membilas residu pada perendaman bahan tumbuhan. Ekstrak P. aduncum yang diperoleh berbentuk bahan pekat yang berwarna cokelat. Ekstrak tersebut disimpan di dalam lemari es pada suhu ± 4 °C hingga digunakan untuk pengujian (Syahroni dan Prijono 2013).
Uji Toksisitas
Pengujian toksisitas insektisida uji terhadap larva P. xylostella dilakukan dalam dua tahapan, yaitu uji pendahuluan dan uji lanjutan. Pengujian dilakukan dengan metode celup daun yang merupakan aplikasi insektisida pada daun pakan (Dadang dan Prijono 2008). Pada uji pendahuluan, insektisida komersial berbahan aktif deltametrin, emamektin benzoat, klorantraniliprol, profenofos, dan spinetoram masing-masing diuji pada konsentrasi formulasi 0.2%, 0.1% dan 0.05% (v/v). Larutan pengencer yang digunakan adalah akuades yang mengandung 0.2 ml/L bahan perekat Agristick (b.a. alkilaril poliglikol eter 400 g/L).
Pada uji ekstrak P. aduncum, sediaan ekstrak P. aduncum disiapkan dengan mencampurkan ekstrak tersebut dengan pelarut metanol dan pengemulsi Tween 80 (konsentrasi akhir masing-masing 1% dan 0.2%) lalu ditambah akuades hingga volume tertentu sesuai dengan konsentrasi pengujian. Campuran selanjutnya dikocok dengan pengocok ultrasonik agar ekstrak tersuspensikan secara merata di dalam air.
Pada setiap perlakuan, daun kubis dipotong 4 cm x 4 cm lalu dicelupkan satu per satu dalam sediaan insektisida komersial dan sediaan ekstrak P. aduncum
yang telah disiapkan. Satu potongan daun kubis diletakkan dalam cawan petri yang dialasi tisu, kemudian ke dalam setiap cawan dimasukkan 10 larva P. xylostella. Larva dibiarkan makan daun perlakuan atau daun kontrol selama 2 x 24 jam, kemudian ditambahkan daun tanpa perlakuan sampai hari ke-4. Jumlah larva yang mati dicatat setiap hari dari 24 jam sampai 96 jam setelah perlakuan (JSP). Setiap perlakuan diulang sebanyak 3 kali.
6
Metode perlakuan dan pengamatan pada uji lanjutan sama seperti pada uji pendahuluan, tetapi setiap perlakuan pada uji lanjutan diulang 5 kali. Data mortalitas kumulatif pada 48 dan 96 JSP diolah dengan analisis probit menggunakan program POLO-PC (LeOra Software 1987). LC95 setiap insektisida
komersial yang diuji dibandingkan dengan konsentrasi anjuran yang tertera pada label produk insektisida untuk memastikan keefektifan insektisida yang diuji terhadap larva P. xylostella.
7
HASIL DAN PEMBAHASAN
Toksisitas Insektisida Uji terhadap Larva P. xylostella
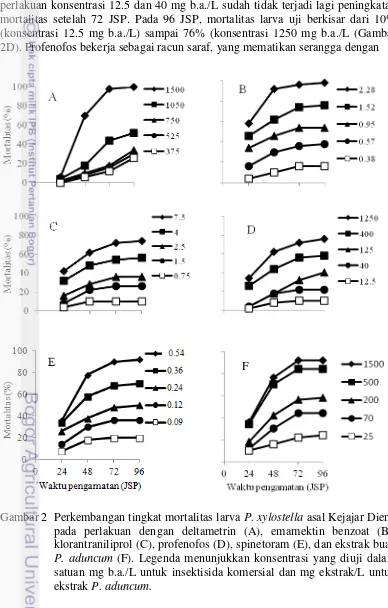
Hasil penelitian menunjukkan bahwa mortalitas larva P. xylostella akibat perlakuan dengan insektisida komersial berbahan aktif deltametrin, emamektin benzoat, klorantraniliprol, profenofos, dan spinetoram secara umum mengalami peningkatan seiring pertambahan waktu dan peningkatan konsentrasi insektisida (Gambar 2). Peningkatan mortalitas larva tertinggi secara umum terjadi pada 48 JSP (jam setelah perlakuan) dan melandai pada 96 JSP.
Mortalitas larva P. xylostella akibat perlakuan dengan deltametrin 375–1500 mg b.a./L masih rendah pada 24 JSP yaitu kurang dari 7%. Peningkatan terjadi pada 48, 72, dan 96 JSP seiring dengan semakin besarnya konsentrasi. Peningkatan secara nyata terjadi pada 48 dan 72 JSP, sedangkan pada 96 JSP tidak terlalu nyata. Pada 96 JSP mortalitas larva uji berkisar dari 26% (perlakuan konsentrasi 375 mg b.a./L) sampai 100% (perlakuan konsentrasi 1500 mg b.a./L) (Gambar 2A). Kematian larva P. xylostella pada perlakuan dengan deltametrin disebabkan oleh cara kerja insektisida tersebut sebagai racun saraf yang menunda penutupan saluran ion natrium pada akson saraf sehingga mengganggu transmisi impuls saraf dan mengakibatkan gejala hipereksitasi, kejang-kejang, kelumpuhan, dan kematian serangga (Yu 2008).
Perlakuan dengan emamektin benzoat pada konsentrasi tertinggi (2.28 mg b.a./L) sudah mengakibatkan mortalitas larva P. xylostella lebih dari 50% pada 24 JSP. Peningkatan mortalitas larva P. xylostella terus terjadi pada 48, 72, dan 96 JSP kecuali pada konsentrasi 0.38 dan 0.95 mg b.a./L yang tidak terjadi lagi peningkatan mortalitas larva setelah 72 JSP (Gambar 2B). Pada 96 JSP, mortalitas larva pada konsentrasi terendah (0.38 mg b.a./L) sebesar 16%, sedangkan pada konsentrasi tertinggi (2.28 mg b.a./L) sebesar 98%. Aktivitas insektisida emamektin benzoat yang kuat terhadap larva P. xylostella menunjukkan bahwa bagian sasaran dalam tubuh larva P. xylostella masih peka terhadap insektisida tersebut. Emamektin benzoat merupakan turunan semisintetik dari avarmektin B1a
dan B1b yang diisolasi dari fermentasi aktinomiset tanah Streptomyces avermitilis
(Pitterna 2007). Insektisida tersebut bekerja sebagai racun saraf yang membuka saluran ion klorida pada membran pascasinapsis sel saraf sehingga terjadi peningkatan pemasukan ion klorida ke dalam sel saraf yang selanjutnya mengakibatkan kelumpuhan dan kematian serangga (Casida dan Durkin 2013).
8
retikulum sarkoplasma. Akibatnya persediaan ion kalsium di dalam sel otot berkurang sehingga terjadi gangguan pada pengaturan kontraksi otot yang selanjutnya mengakibatkan kelumpuhan otot dan kematian serangga (Cordova et al. 2006).
Pola peningkatan mortalitas larva P. xylostella akibat perlakuan profenofos 12.5-1250 mg b.a./L serupa dengan perlakuan klorantraniliprol 0.75-7.5 mg b.a./L, yaitu mortalitas meningkat secara bertahap dari 24 sampai 96 JSP. Pada perlakuan konsentrasi 12.5 dan 40 mg b.a./L sudah tidak terjadi lagi peningkatan mortalitas setelah 72 JSP. Pada 96 JSP, mortalitas larva uji berkisar dari 10% (konsentrasi 12.5 mg b.a./L) sampai 76% (konsentrasi 1250 mg b.a./L (Gambar 2D). Profenofos bekerja sebagai racun saraf, yang mematikan serangga dengan
Gambar 2 Perkembangan tingkat mortalitas larva P. xylostella asal Kejajar Dieng pada perlakuan dengan deltametrin (A), emamektin benzoat (B), klorantraniliprol (C), profenofos (D), spinetoram (E), dan ekstrak buah
P. aduncum (F). Legenda menunjukkan konsentrasi yang diuji dalam satuan mg b.a./L untuk insektisida komersial dan mg ekstrak/L untuk ekstrak P. aduncum.
9
menghambat kerja enzim asetilkolinesterase dalam sinapsis sistem saraf pusat serangga. Penghambatan tersebut mengakibatkan asetilkolin tetap berikatan dengan reseptornya dan mengakibatkan saluran ion Na+ pada membran pascasinapsis tetap terbuka sehingga terjadi perangsangan berlebihan, kejang-kejang, kelumpuhan, dan kematian serangga (Yu 2008; Casida dan Durkin 2013). Tingkat mortalitas serangga uji akibat perlakuan spinetoram secara umum meningkat dari 24 sampai 96 JSP. Peningkatan mortalitas tertinggi terjadi pada 48 JSP yaitu sebesar 10-42%. Pada rentang waktu 48-96 JSP, mortalitas larva P. xylostella masih meningkat namun dengan peningkatan mortalitas yang lebih rendah yaitu kurang dari 13% (Gambar 2E). Perlakuan dengan konsentrasi terendah (0.09 mg b.a./L) menyebabkan mortalitas larva sebesar 20% pada 96 JSP, sedangkan pada konsentrasi tertinggi (0.54 mg b.a./L) mortalitas larva sebesar 92%. Kematian larva P. xylostella disebabkan oleh spinetoram yang bekerja sebagai racun saraf yaitu dengan mengaktifkan reseptor asetilkolin sehingga saluran ion Na+ pada membran pascasinapsis menjadi terbuka dan menimbulkan rangsangan yang terus menerus. Hal tersebut menyebabkan gejala hipereksitasi, kejang-kejang, lumpuh, dan akhirnya serangga mati (Shimokawatoko 2012). Spinetoram merupakan campuran analog semisintetik dari spinosin J dan spinosin L yang diisolasi dari fermentasi aktinomiset
Saccharopolyspora spinosa) (Crouse et al. 2007).
Seperti perkembangan mortalitas larva pada perlakuan dengan lima jenis insektisida komersial yang telah dijelaskan sebelumnya, mortalitas larva akibat perlakuan dengan ekstrak P. aduncum 25-1500 mg ekstrak/L meningkat seiring bertambahnya waktu dan semakin besarnya konsentrasi ekstrak. Pada 24 JSP mortalitas larva masih rendah. Peningkatan mortalitas larva secara tajam terjadi pada 48 dan 72 JSP kemudian melandai pada 96 JSP. Pada 48 JSP, peningkatan mortalitas larva sebesar 6-40%, kemudian meningkat pada 72 JSP sebesar 6-16%. Mortalitas larva pada 96 JSP berkisar dari 24% pada perlakuan konsentrasi terendah (25 mg ekstrak/L) sampai 92% pada perlakuan konsentrasi tertinggi (1500 mg ekstrak/L) (Gambar 2F). Senyawa aktif utama yang bersifat insektisida dari ekstrak buah sirih hutan ialah dilapiol (Hasyim 2011). Senyawa tersebut bukan merupakan racun saraf, tetapi lebih bersifat sebagai racun metabolik (Bernard et al. 1995). Dilapiol dapat menghambat proses oksidasi di dalam sel yang dikatalisis oleh enzim polysubstrate monooxygenase (PSMO). Proses oksidasi tersebut umumnya terjadi pada senyawa yang bersifat racun di dalam sel yang mengakibatkan penurunan daya racun senyawa tersebut. Terhambatnya aktivitas enzim PMSO dapat mengakibatkan terjadinya penumpukan senyawa beracun di dalam sel yang selanjutnya dapat mengakibatkan kematian sel dan lambat laun mengakibatkan kematian serangga (Bernard et al. 1995; Scott et al.
2008).
Berdasarkan hasil analisis probit data mortalitas larva, LC50 deltametrin
pada 48 JSP, yaitu 1443.54 mg b.a./L, menurun menjadi 872.51 mg b.a./L pada 96 JSP, demikian pula dengan LC95 insektisida tersebut yang menurun dari 4666.60
mg b.a./L pada 48 JSP menjadi 2030.01 mg b.a./L pada 96 JSP (Tabel 1). Penurunan nilai LC50 dan LC95 yang tajam tersebut disebabkan oleh peningkatan
10
mortalitas larva menunjukkan bahwa insektisida makin toksik sehingga nilai LC50
dan LC95 insektisida tersebut makin kecil.
Nilai LC95 deltametrin pada 96 JSP (2030.01 mg b.a./L) 203 kali lebih tinggi
daripada konsentrasi anjuran yang tertera pada label produk insektisida tersebut, yaitu 10 mg b.a./L. Dengan asumsi kadar bahan aktif deltametrin sesuai dengan yang tertera label produk insektisida tersebut (insektisida tidak palsu) dan insektisida tersebut semula efektif terhadap strain rentan P. xylostella, dapat dikemukakan bahwa hama P. xylostella asal Kejajar Dieng sudah resisten terhadap deltametrin sehingga insektisida tersebut tidak efektif lagi digunakan untuk mengendalikan hama P. xylostella. Perlakuan dengan deltametrin pada konsentrasi 1500 mg b.a./L menyebabkan peracunan pada tanaman kubis (fitotoksik) berupa bercak nekrosis (Gambar 3A), sedangkan ekstrak buah P. aduncum 5000 mg ekstrak/L tidak fitotoksik pada tanaman kubis (Gambar 3B).
Gambar 3 A: Daun kubis yang menunjukkan gejala fitotoksisitas berupa bercak nekrosis akibat perlakuan dengan deltametrin 1500 mg b.a./L;
(B): daun kubis yang tidak menunjukkan gejala fistotoksisitas setelah diberi perlakuan dengan ekstrak P. aduncum 5000 mg ekstrak/L.
Gambar 4 Daun kubis yang tidak diberi perlakuan insektisida (kontrol) B
11
Tabel 1 Toksisitas lima jenis insektisida komersial dan ekstrak buah P. aduncum terhadap larva P. xylostella
Insektisida
Konsentrasi anjuran (mg b.a./l)
Waktu pengamatan
(JSP)a
b ± GBb LC50 (SK 95%)
(mg b.a./L)b
LC95 (SK 95%)
(mg b.a./L)b
Deltametrin 10 48 3.23 ± 0.49 1443.54 (-) 4666.60 (-)
96 4.48 ± 0.82 872.51 (-) 2030.01 (-)
Emamektin benzoat
10 48 3.04 ± 0.37 1.01 (0.74-1.39) 3.51 (2.19-12.06)
96 3.24 ± 0.38 0.81 (0.59-1.06) 2.59 (1.74-6.80)
Klorantraniliprol 40 48 1.69 ± 0.29 4.97 (3.84-7.33) 46.39 (22.50-193.51)
96 2.08 ± 0.31 3.74 (3.04-4.78) 23.07 (13.98-56.59)
Profenofos 750 48 1.19 ± 0.24 799.92 (507.24-1634.69) 19179.00 (5989.14-262781.64)
96 1.16 ± 0.17 321.38 (214.23-510.56) 8462.30 (3469.90-41145.28)
Spinetoram 12 48 2.09 ± 0.33 0.28 (0.23-0.36) 1.74 (1.06-4.36)
96 2.58 ± 0.34 0.21 (0.14-0.29) 0.90 (0.53-3.77)
Ekstrak buah P.
aduncum
- 48 1.01 ± 0.14 240.03 (163.25-362.58)c 10214.00 (4078.28-49579.65)c
96 1.21 ± 0.16 100.31 (68.16-139.68)c 2288.39 (1226.04-6185.35)c
a
JSP: jam setelah perlakuan. ba: intersep. b: kemiringan garis regresi. GB: galat baku, SK: selang kepercayaan. cSatuan ekstrak P. aduncum yaitu mg/l.
1
12
Seperti pada perlakuan deltametrin, LC50 dan LC95 empat jenis insektisida
komersial lainnya, yaitu emamektin benzoat, klorantraniliprol, profenofos, dan spinetoram, serta ekstrak buah P. xylostella pada 96 JSP lebih kecil dibandingkan dengan LC50 dan LC95 pada 48 JSP (Tabel 1). Penurunan LC50 dan LC95 tersebut
proporsional dengan peningkatan mortalitas larva dari 48 JSP ke 96 JSP (Gambar 1). LC95 profenofos pada 96 JSP 11.28 kali lebih tinggi daripada konsentrasi
anjurannya, sedangkan LC95 emamektin benzoat dan klorantraniliprol (2.59 dan
23.07 mg b.a./L) masing-masing 3.86 dan 1.73 kali lebih rendah daripada konsentrasi anjuran yang tertera pada label produk insektisida masing-masing. Seperti halnya deltametrin, dengan asumsi kadar bahan aktif profenofos sesuai dengan yang tertera pada label produk insektisida tersebut (insektisida tidak palsu) dan insektisida tersebut semula efektif terhadap strain rentan P. xylostella, dapat dikemukakan bahwa hama P. xylostella asal Kejajar Dieng sudah resisten terhadap profenofos sehingga insektisida tersebut tidak efektif lagi digunakan untuk mengendalikan hama P. xylostella. Sementara itu, emamektin benzoat dan klorantraniliprol masih efektif terhadap larva P.xylostella asal Kejajar Dieng.
Spinetoram belum terdaftar di Indonesia untuk mengendalikan hama P. xylostella pada tanaman kubis. Insektisida dengan bahan aktif yang sejenis dengan senyawa induk spinetoram, yaitu spinosad, terdaftar di Indonesia untuk mengendalikan hama P. xylostella dengan konsentrasi anjuran 12 mg b.a./L. LC95
spinetoram 13.33 kali lebih rendah daripada daripada konsentrasi anjuran spinosad. Dengan demikian insektisida berbahan aktif spinetoram dapat digunakan untuk mengendalikan hama P. xylostella karena spinetoram telah dilaporkan lebih toksik daripada spinosad terhadap beberapa jenis hama, termasuk
P. xylostella (Shimokawatoko et al. 2002).
Nilai LC50 dan LC95 pada 96 JSP untuk ekstrak buah P. aduncum
masing-masing 100.31 dan 2288.39 mg ekstrak/L (Tabel 1). LC95 ekstrak tersebut 3.69
lebih rendah daripada LC95 profenofos sehingga ekstrak buah P. aduncum
berpotensi untuk digunakan sebagai alternatif pengendalian hama P. xylostella
yang resisten terhadap profenofos. Sementara itu, LC95 ekstrak buah P. aduncum
1.13 kali lebih tinggi daripada LC95 deltametrin, namun LC50-nya 8.69 kali lebih
rendah daripada LC50 deltametrin. Di lapangan, ekstrak buah P. aduncum dapat
digunakan pada konsentrasi yang tidak terlalu tinggi, misal pada konsentrasi sekitar LC50 (100.31 mg ekstrak/L), dengan harapan ekstrak tersebut tidak
beracun terhadap musuh alami hama sehingga sisa populasi larva P. xylostella
yang tidak mati akibat perlakuan ekstrak P. aduncum dapat dikendalikan oleh musuh alami utama P. xylostella, yaitu parasitoid Diadegma semiclausum.
Tingkat parasitisasi larva P. xylostella oleh D. semiclausum relatif tinggi, bahkan di beberapa daerah mencapai lebih dari 80% (Sastrosiswojo 1987). Dengan demikian, ekstrak buah P. aduncum dapat digunakan sebagai salah satu alternatif untuk mengendalikan hama P. xylostella.
13
terhadap deltametrin dan profenofos. Untuk memastikan hasil penelitian tersebut perlu dilakukan pengujian dengan menggunakan strain rentan P. xylostella dan analisis kadar bahan aktif terhadap formulasi insektisida yang digunakan. Baik pada peneliti ini maupun peneliti ini maupun penelitian Moekasan et al. (2004) tidak disertakan srain P. xylostella yang telah dipastikan rentan terhadap deltametrin dan profenofos. Saat ini di Indonesia tidak ada lembaga yang memiliki strain rentan P. xylostella
Salah satu cara untuk mengatasi resistensi hama terhadap insektisida ialah melakukan pergiliran (rotasi) penggunaan insektisida dengan menggunakan insektisida yang memiliki cara kerja yang berbeda untuk menurunkan tekanan seleksi oleh insektisida tertentu (Denholm et al. 1998). Ketiadaan perlakuan insektisida dengan cara kerja tertentu memberi peluang bagi individu rentan untuk bertahan hidup dan menghasilkan keturunan sehingga pada generasi berikutnya proporsi individu rentan bertambah dan tingkat resistensi menurun. Dua insektisida yang digunakan dalam penelitian ini, yaitu deltametrin dan profenofos, sebaiknya dihindari penggunaannya karena LC95 masing-masing jauh lebih tinggi
daripada konsentrasi anjuran masing-masing. Penggunaan insektisida pada konsentrasi tinggi dapat berdampak lebih buruk terhadap musuh alami hama tersebut. Sementara itu, bila diperlukan insektisida berbahan aktif emamektin benzoat, klorantraniliprol, dan spinetoram yang memiliki cara kerja yang berbeda dapat digunakan dalam sistem rotasi dan memerhatikan sistem PHT kubis. Ekstrak buah P. aduncum juga dapat dimasukkan dalam sistem rotasi insektisida tersebut.
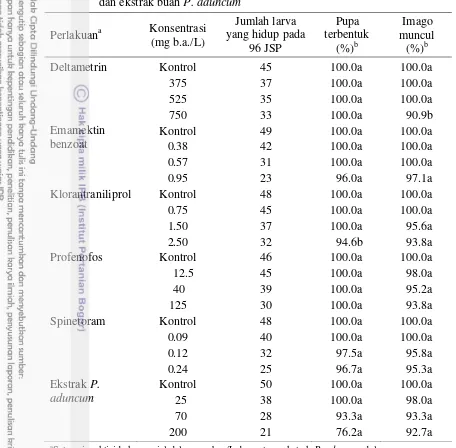
Pengaruh Insektisida Uji terhadap Perkembangan Larva P. xylostella Selain pengamatan mortalitas, dilakukan pula pengamatan persentase jumlah pupa dan imago P. xylostella yang terbentuk, yang dimaksudkan untuk mengetahui pengaruh insektisida yang digunakan terhadap penghambatan perkembangan larva P. xylostella. Pengamatan dilakukan pada semua perlakuan hanya pada 3 taraf konsentrasi terendah dan kontrol.
Hasil pengujian menunjukkan bahwa semua perlakuan insektisida uji pada 3 taraf konsentrasi terendah tidak berpengaruh nyata terhadap pembentukan pupa dan kemunculan imago dari larva P. xylostella yang bertahan hidup pada 96 JSP, kecuali perlakuan deltametrin pada konsentrasi 750 mg b.a./L yang menghambat kemunculan imago dan perlakuan klorantraniliprol pada konsentrasi 2.50 mg b.a./L yang menghambat pembentukan pupa. Perbedaan tersebut kemungkinan disebabkan oleh masih terdapatnya residu insektisida di dalam tubuh serangga uji pada saat daun perlakuan sudah diganti dengan daun tanpa perlakuan. Tidak terdapatnya pengaruh yang nyata terhadap perkembangan larva P. xylostella
menjadi pupa dan imago menunjukkan bahwa pengaruh insektisida hanya terjadi pada larva yang diberi makan daun perlakuan dan setelah larva diberi daun pakan perlakuan, residu insektisida uji yang tertinggal di dalam tubuh larva P. xylostella
tidak cukup untuk menimbulkan penghambatan perkembangan larva P. xylostella
14
Tabel 2 Persentase pupa dan imago P. xylostella yang terbentuk dari larva yang bertahan hidup pada perlakuan dengan lima jenis insektisida komersial dan ekstrak buah P. aduncum Klorantraniliprol Kontrol 48 100.0a 100.0a 0.75 45 100.0a 100.0a
15
SIMPULAN DAN SARAN
Simpulan
Larva P. xylostella asal Kecamatan Kejajar Dieng, Kabupaten Wonosobo, Jawa Tengah tidak rentan terhadap deltametrin dan profenofos dengan LC95
masing-masing 203 dan 11.3 kali lebih tinggi daripada konsentrasi anjurannya tetapi masih rentan terhadap emamektin benzoat, klorantraniliprol, dan spinetoram dengan LC95 masing-masing 3.86, 1.73, dan 13.33 kali lebih rendah daripada
konsentrasi anjuran masing-masing insektisida tersebut. Ekstrak buah P. aduncum
dapat digunakan sebagai alternatif untuk mengendalikan hama P. xylostella
karena dapat mengakibatkan kematian larva P. xylostella sebesar 50% pada konsentrasi yang sangat rendah (sekitar 0.01%). Pada perlakuan dengan 3 taraf konsentrasi terendah, perlakuan insektisida uji dapat mematikan larva P. xylostella tetapi tidak menghambat pembentukan pupa dan imago secara nyata pada larva yang bertahan hidup.
Saran
16
DAFTAR PUSTAKA
Abizar M, Prijono D. 2010. Aktivitas insektisida ekstrak daun dan biji Tephrosia vogelii J.D. Hooker (Leguminosae) dan ekstrak buah Piper cubeba L. (Piperaceae) terhadap larva Crocidolomia pavonana (F.) (Lepidoptera: Crambidae). JHPT Trop. 10(1):1-12.
Bernard CB, Krishnamurty HG, Chauret D, Durst T, Philogene BJR, Vindas PS, Hasbun C, Poveda L, Roman LS, Arnason JT. 1995. Insecticidal defenses of Piperaceae from the Neotropics. J Chem Ecol. 21(6):801-814.
Cardi M. 2014. Kerentanan Plutella xylostella dari Garut, Jawa Barat, terhadap lima jenis insektisida komersial dan ekstrak Tephrosia vogelii [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Casida JE, Durkin KA. 2013. Neuroactive insecticides: target, selectivity, resistance, and secondary effects. Annu Rev Entomol. 58:99-117. doi:10.1146/annurev-ento-120811-153645.
Cordova D, Benner EA, Sacher MD, Rauh JJ, Sopa JS, Lahm GP, Selby TP, Stevenson TM, Flexner L, Gutteridge S et al. 2006. Anthranilic diamides: A new class of insecticides with a novel mode of action, ryanodine receptor activation. Pestic Biochem Physiol. 84(3):196-214.
Crouse GD, Dripps JE, Orr N, Sparks TC, Waldron C. 2007. DE-175 (spinetoram), a new semi-synthetic spinosyn in development. Di dalam: Krämer W, Schirmer U, editor. Modern Crop Protection Compounds. Weinheim (DE): Wiley-VCH. hlm 1013-1031.
Dadang, Prijono D. 2008. Insektisida Nabati: Prinsip, Pemanfaatan, dan Pengem-bangan. Bogor (ID): Departemen Proteksi Tanaman, Institut Pertanian Bogor.
Denholm I, Horowitz RA, Cahill M, Ishaaya I. 1998. Management of resistance to novel insecticides. Di dalam: Ishaaya I, Degheele D, editor. Insecticides with Novel Modes of Action. New York (US): Springer-Verlag. hlm 339-341. Furlong MJ, Wright DJ, Dosdall LM. 2013. Diamondback moth ecology and
management: problems, progress and prospects. Annu Rev Entomol. 58:517-541.
Hasyim DM. 2011. Potensi buah sirih hutan (Piper aduncum) sebagai insektisida botani terhadap larva Crocidolomia pavonana [tesis]. Bogor (ID): Institut Pertanian Bogor.
LeOra Software. 1987. POLO-PC User’s Guide. Petaluma (US): LeOraSoftware. Moekasan TK, Sastrosiswojo S, Rukmana T, Susanto H, Purnamasari IS, Kurnia
A. 2004. Status resistensi lima strain Plutella xylostella L. terhadap formulasi fipronil, deltametrin, profenofos, abamektin, dan Bacillus thuringiensis. J Hort. 14(2):84-90.
Nailufar N. 2011. Aktivitas insektisida ekstrak daun Tephrosia vogelii
(Leguminosae) dan buah Piper aduncum (Piperaceae) terhadap larva
Crocidolomia pavonana [skripsi]. Bogor (ID): Institut Pertanian Bogor. Pitterna T. 2007. Chloride channel activators/new natural products (avermectins
17
Prakash A, Rao J. 1997. Botanical Pesticides in Agriculture. Boca Raton (US): CRC Press.
Salgado VL, Sparks TC. 2010. The spinosyns: chemistry, biochemistry, mode of action, and resistance. Di dalam: Gilbert L, Gill S, editor. Insect Control: Biological and Synthetic Agents. San Diego (US): Academic Press. hlm 207-243.
SAS Institute. 2002-2003. SAS 9.1 TS Level 1M3. Cary (US): SAS Institute. Sastrosiswojo S. 1987. Perpaduan pengendalian secara hayati dan kimiawi hama
ulat daun kubis (Plutella xylostella L; Lepidoptera: Yponomeutidae) pada tanaman kubis [disertasi]. Bandung (ID): Universitas Padjadjaran.
Sastrosiswojo S. 1991. Field evaluation of Bacillus thuringiensis and several types of chemical insecticides alone and in binary mixtures against cabbage leaf-eating caterpillars. Bul Penel Hort. 20(4):23-38.
Sastrosiswojo S, Koestoni T, Sukwilda A. 1989. Status resistensi Plutella xylostella L. strain Lembang terhadap beberapa jenis insektisida golongan organofosfat, piretroid sintetik, dan benzil urea. Bul Pene Hort. 18(1):85-93. Scott IM, Jensen HR, Philogene BJR, Arnason JT. 2008. A review of Piper spp. (Piperaceae) phytochemistry, insecticidal activity, and mode of action.
Phytochem Rev. 7:65-75.
Shimokawatoko Y, Sato N, Yamaguchi T, Tanaka H. 2012. Development of the Novel Insecticide Spinetoram. Tokyo (JP): Sumitomo Chemical.
Syahroni YY, Prijono D. 2013. Aktivitas insektisida ekstrak buah Piper aduncum
L. (Piperaceae) dan Sapindus rarak DC. (Sapindaceae) serta campurannya terhadap larva Crocidolomia pavonana (F.) (Lepidoptera: Crambidae). J Entomol Indones. 10(2013):39-50. doi: 10.5994/jei.10.1.39.
Troczka B, Zimmer CT, Elias J, Schorn C, Bass C, Davies TGE, Field LM, Williamson MS, Slater R, Nauen R. 2012. Resistance to diamide insecticides in diamondback moth, Plutella xylostella (Lepidoptera: Plutellidae) is associated with a mutation in the membrane-spanning domain of the ryanodine receptor. Insect Biochem Mol Biol. 42(11):873-880.
Udiarto BK, Setiawati W. 2007. Suseptibilitas dan kuantifikasi resistensi 4 strain
Plutella xylostella L. terhadap beberapa insektisida. J Hort. 17(3):277-284. Wang X, Wu Y. 2012. High level of resistance to chlorantraniliprole evolved in
field populations of Plutella xylostella. J Econ Entomol. 105(3):1019-1023. doi: 10.1603/ECI2095.
19
20
Lampiran 1 Peta lokasi pengambilan serangga P. xylostella
7°15’2.10” LS dan 109°57’15.90” BT
Kabupaten Wonosobo, Jawa Tengah Desa Kejajar
21
Lampiran 2 Kondisi lahan kubis tempat pengambilan serangga P. xylostella
Lampiran 3 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan deltametrin
Konsentrasi formulasi (%, v/v)
Mortalitas kumulatif (%) pada JSPa
24 48 72 96
1 0 6.7 10.0 16.7
2.5 3.3 6.7 16.7 33.3
5 6.7 76.7 86.7 90.0
a
JSP = jam setelah perlakuan. Jumlah serangga uji adalah 10 larva instar II x 3 ulangan untuk setiap perlakuan. Larva diberi makan daun perlakuan selama 2 x 24 jam.
Lampiran 4 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan emamektin benzoat
Konsentrasi formulasi (%, v/v)
Mortalitas kumulatif (%) pada JSPa
24 48 72 96
0.05b 50.0 96.7 100.0 100.0 0.1c 70.0 100.0 100.0 100.0 0.2c 90.0 100.0 100.0 100.0 0.0025c 10.0 30.0 40.0 40.0 0.005c 10.0 30.0 50.0 50.0 0.01b 10.0 70.0 90.0 96.7 0.025d 30.0 95.0 95.0 95.0
a
22
Lampiran 5 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan klorantraniliprol serangga uji pada konsentrasi tersebut adalah 10 larva instar II x 3 ulangan. cJumlah serangga uji pada konsentrasi tersebut adalah 10 larva instar II x 4 ulangan. dJumlah serangga uji pada konsentrasi tersebut adalah 10 larva instar II x 1 ulangan.
Lampiran 6 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan profenofos
Konsentrasi formulasi (%, v/v)
Mortalitas kumulatif (%) pada n JSPa
24 48 72 96
0.05 36.7 56.7 63.3 63.3
0.1 63.3 83.3 83.3 83.3
0.2 70.0 86.7 86.7 86.7
Catatan kaki seperti pada Lampiran 2.
Lampiran 7 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan spinetoram
Konsentrasi formulasi (%, v/v)
Mortalitas kumulatif (%) pada n JSPa
23
Lampiran 8 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan ekstrak buah P. aduncum
Konsentrasi ekstrak (%, w/v)
Mortalitas kumulatif (%) pada n JSPa
24 48 72 96
Catatan kaki seperti pada Lampiran 2.
Lampiran 9 Mortalitas larva P. xylostella pada perlakuan uji lanjutan deltametrin
Konsentrasi (mg b.a./L)
Mortalitas kumulatif (%) pada n JSPa
24 48 72 96
JSP = jam setelah perlakuan. Jumlah serangga uji pada awal perlakuan adalah 10 larva instar II x 5 ulangan untuk semua perlakuan. Larva diberi makan daun perlakuan selama 2 x 24 jam.
Lampiran 10 Mortalitas larva P. xylostella pada perlakuan uji lanjutan emamektin benzoat
Konsentrasi (mg b.a./L)
Mortalitas kumulatif (%) pada n JSPa
24 48 72 96
24
Lampiran 11 Mortalitas larva P. xylostella pada perlakuan uji lanjutan klorantraniliprol
Konsentrasi (mg b.a./L)
Mortalitas kumulatif (%) pada n JSPa
24 48 72 96
Catatan kaki seperti pada Lampiran 8.
Lampiran 12 Mortalitas larva P. xylostella pada perlakuan uji lanjutan profenofos Konsentrasi
(mg b.a./L)
Mortalitas kumulatif (%) pada n JSPa
24 48 72 96
Catatan kaki seperti pada Lampiran 8.
Lampiran 13 Mortalitas larva P. xylostella pada perlakuan uji lanjutan spinetoram Konsentrasi
(mg b.a./L)
Mortalitas kumulatif (%) pada n JSPa
24 48 72 96
25
Lampiran 14 Mortalitas larva P. xylostella pada perlakuan uji lanjutan ekstrak buah P. aduncum
Konsentrasi (mg ekstrak/L)
Mortalitas kumulatif (%) pada n JSPa
24 48 72 96
25 10.0 16.0 22.0 24.0 70 12.0 30.0 44.0 44.0 200 18.0 42.0 56.0 58.0 500 34.0 70.0 84.0 84.0 1500 36.0 76.0 92.0 92.0
26
RIWAYAT HIDUP
Penulis dilahirkan di Grobogan, Jawa Tengah pada tanggal 3 April 1992 sebagai anak pertama dari dua bersaudara dari pasangan Bapak Djaka Sudibja dan Ibu Eni Purwati. Penulis menyelesaikan pendidikan sekolah menengah atas di SMA Negeri 1 Jepara pada tahun 2010 dan pada tahun yang sama penulis diterima sebagai mahasiswa Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama masa perkuliahan penulis aktif dalam beberapa organisasi seperti Himpunan Mahasiswa Proteksi Tanaman, Bina Desa BEM KM, dan Organisasi Mahasiswa Daerah (OMDA). Penulis juga mengikuti beberapa pelatihan, seminar yang diadakan IPB, serta kepanitiaan pada acara kampus di antaranya acara NPV (National Plant Protection Event), Gebyar Nusantara, dan Migratoria. Pada tahun 2012 penulis tergabung dalam grup vokal Proteksi Tanaman (Protection Voice)