KARAKTERISASI AHL-LAKTONASE Bacillus thuringiensis
SGT3g DAN UJI ANTI QUORUM SENSING
TERHADAP PATOGENISITAS Dickeya dadantii
PADA Phalaenopsis
PUTRI EKA SARI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Karakterisasi AHL-Laktonase Bacillus thuringiensis SGT3g dan Uji Anti Quorum Sensing terhadap Patogenisitas Dickeya dadantii pada Phalaenopsis adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor
RINGKASAN
PUTRI EKA SARI. Karakterisasi AHL-Laktonase Bacillus thuringiensis SGT3g dan Uji Anti Quorum Sensing terhadap Patogenisitas Dickeya dadantii pada Phalaenopsis. Dibimbing oleh IMAN RUSMANA dan ALINA AKHDIYA.
Dickeya dadantii merupakan salah satu bakteri fitopatogen tanaman penyebab penyakit busuk lunak pada anggrek. Bakteri tersebut menggunakan proses quorum sensing dalam mengaktifkan faktor virulensinya. D. dadantii menggunakan N-acyl homoserine lactone (AHL) sebagai sinyal dalam mengkordinasikan ekspresi enzim pektinolitik yang digunakan untuk mendegradasi dinding sel tanaman. Akumulasi sinyal AHL dapat dicegah oleh AHL-laktonase sehingga faktor virulensi tidak dapat diekspresikan. Tujuan dari penelitian ini adalah mengetahui karakteristik enzim AHL-laktonase Bacillus thuringiensis SGT3g serta untuk menguji aktivitas penghambatan virulensi fitopatogen D. dadantii pada anggrek Phalaenopsis ekanagasaki.
B. thuringiensis SGT3g menghasilkan enzim AHL-laktonase ekstraseluler dan intraseluler yang mampu menghidrolisis AHL. Aktivitas AHL-laktonase ekstraseluler dan intraseluler ditunjukkan dengan terbentuknya zona quorum quenching terhadap Chromobacterium violaceum sebesar 7.25 mm dan 10 mm berturut-turut untuk enzim ekstraseluler dan intraseluler. Enzim ekstraseluler berhasil mengendap pada penambahan amonium sulfat dengan konsentrasi 70% (b/v). Aktivitas AHL-laktonase hasil dialisis meningkat 1.45 kali dibandingkan dengan presipitatnya. Konsentrasi protein enzim AHL-laktonase hasil dialisis sebesar 0.683 mg/mL sedangkan presipitat sebesar 0.916 mg/mL. Presipitat enzim
ekstraseluler dikarakterisasi berdasarkan pH dan suhu. AHL-laktonase B. thuringiensis SGT3g memiliki kisaran pH dan suhu yang luas. Aktivitas
optimum presipitat laktonase berada pada pH 5-8. Aktivitas optimum AHL-laktonase dicapai pada suhu 30 ºC. AHL-AHL-laktonase masih aktif pada suhu 40-90 °C setelah diinkubasi selama 30 menit.
Gejala busuk lunak pada daun anggrek hibrida Phalaenopsis yang
diinokulasikan dengan B. thuringiensis SGT3g sebelum diinfeksi dengan D. dadantii mengalami penurunan gejala sebesar 50% setelah 24 jam inkubasi.
Sebaliknya daun anggrek yang hanya diinfeksi dengan D. dadantii mengalami gejala busuk lunak yang lebih parah (100%). Penghambatan proses quorum sensing D. dadantii pada daun Phalaenopsis tersebut dikonfirmasikan dari hasil
perhitungan populasi sel D. dadantii pada kontrol positif dan perlakuan B. thurungiensis SGT3g+D. dadantii yaitu berturut-turut sebanyak 1.01 x 109 dan
3.96 x 108. Hal tersebut mengindikasikan bahwa proses penghambatan munculnya gejala busuk lunak yang terjadi pada daun anggrek tersebut bukan mekanisme antibiosis melainkan proses quorum quenching. Penelitian ini memberikan informasi potensi aplikasi B. thuringiensis tidak hanya dapat dimanfaatkan sebagai agen bioinsektisida tetapi juga sebagai agen pengendali penyakit tanaman berbasis anti quorum sensing.
SUMMARY
PUTRI EKA SARI. Characterization of AHL-lactonase from Bacillus thuringiensis SGT3g and Its Anti Quorum Sensing Bioassay Against Dickeya dadantii Pathogenicity on Phalaenopsis. Supervised by IMAN RUSMANA and ALINA AKHDIYA.
Dickeya dadantii is a plant pathogenic bacterium that causes soft rot disease in orchids. The bacterium uses quorum sensing mechanism to activate their virulent factor genes. D. dadantii or Erwinia chrysanthemi uses N-acyl homoserine lactones (AHL) signal to control expression of pectinolytic enzyme needed for degradation of the host plant’s cell wall. AHL-lactonase is used to prevent the accumulation of AHL signal. The aims of this study are to determine AHL-lactonase characteristics of B. thuringiensis SGT3g and to test its inhibitory activity on virulence factor of D. dadantii in Phalaenopsis ekanagasaki.
B. thuringiensis SGT3g produced AHL-lactonase enzyme both extracellular and intracellular that were able to hydrolyze AHL. Extracellular and intracellular AHL-lactonase activites were indicated by non-purple zone formation of Chromobacterium violaceum around a paper disc. The non-purple zone formed by the crude extract of extracellular and intracellular enzymes was 7.25 mm and 10 mm in diameter respectively. The optimum concentration of ammonium sulfate to precipitate the enzymes was 70% (w/v). After dialysis, the activity of AHL-lactonase was increased 1.45 times than that of precipitated enzyme. The protein concentration of AHL-lactonase after dialysis was 0.683 mg/mL, while the precipitate was 0.916 mg/mL. The precipitate of extracellular enzyme was characterized its optimum pH and temperature. AHL-lactonase of B. thuringiensis SGT3g had a wide range of pH and temperature. The optimum activity of precipitated AHL-lactonase was at pH 5-8. The highest AHL-lactonase activity was at 30 ºC, however after 30 minutes incubation at 40-90 ºC the enzyme was still active. So that these result are the first report of the high thermotolerant AHL-lactonase produced by Bacillus spp. quenching process. These results confirmed that B. thuringiensis well known as bioinsecticides agent, also has a great potential to be developed as biocontrol agent for plant pathogenic bacteria due to its it anti quorum sensing mechanisms. Keyword : AHL degradation, Bacillus thuringiensis, Dickeya dadantii, Quorum
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
KARAKTERISASI AHL-LAKTONASE Bacillus thuringiensis
SGT3g DAN UJI ANTI QUORUM SENSING
TERHADAP PATOGENISITAS Dickeya dadantii
PADA Phalaenopsis
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2014 hingga September 2015 ini ialah Karakterisasi AHL-Laktonase Bacillus thuringiensis SGT3g dan Uji Anti Quorum Sensing terhadap Patogenisitas Dickeya dadantii pada Phalaenopsis.
Terima kasih penulis ucapkan kepada Dr Ir Iman Rusmana, MSi sebagai ketua komisi pembimbing dan Dr Alina Akhdiya, MSi selaku anggota komisi pembimbing yang telah memberikan bimbingan, petunjuk, motivasi dan arahan dalam penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Dr Ir Abdjad Asih Nawangsih, MSi dan Prof Dr Anja Meryandini, MSi selaku Ketua Program Studi Mikrobiologi IPB, yang telah memberikan motivasi selama studi dan masukan pada saat ujian sidang tesis. Terima kasih kepada DIKTI melalui Beasiswa BPPDN (Beasiswa Program Pascasarjana Dalam Negeri) 2013/2014 atas kepercayaannya untuk memberikan beasiswa kuliah selama menempuh pendidikan pascasarjana di IPB.
Ungkapan terima kasih juga disampaikan kepada ayahanda Dr Muhammad Japar, MSi, ibunda Siti Nursari, SPd, adinda Hana Nurina, SSos, M. Amin Zakaria, M. Yahya Mahendra dan Aditya Tirta Nugraha, SPd serta seluruh keluarga saya atas segala doa, dukungan, dan kasih sayangnya. Penulis juga mengucapkan terima kasih kepada Ibu Heni dan Bapak Jaka selaku staf Laboratorium Mikrobiologi IPB, Kak Susi, Kak Mey, Kak Daya, Gaby, Ciko, Bang Risky, Kak Sipri, Taruna serta seluruh teman-teman di Laboratorium Mikrobiologi IPB, atas dukungan, motivasi, dan bantuannya selama penelitian ini. Ucapan terima kasih juga penulis ucapkan kepada seluruh dosen dan staf Departemen Biologi IPB atas ilmu, arahan, dan semangat yang diberikan selama menempuh pendidikan Magister. Terima kasih untuk teman-teman seperjuangan di Pascasarjana Mikrobiologi IPB angkatan 2013 serta seluruh pihak yang telah memberikan doa dan dukungannya, penulis ucapkan terima kasih.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
TINJAUAN PUSTAKA 3
Quorum Sensing 3
N-Acyl Homoserine Lactones (AHL) 4
AHL-laktonase 5
Dickeya dadantii 6
METODE 6 Bahan 6 Kerangka Penelitian 7
Waktu dan Tempat Penelitian 8 Persiapan Enzim Kasar 8
Uji Aktivitas AHL-laktonase terhadap C. violaceum 8 Pembuatan Kurva Pertumbuhan Bacillus thuringiensis SGT3g 8
Pemekatan Enzim dan Karakterisasi Enzim 9
Pengukuran Kadar Protein 9
Uji Penghambatan Quorum Sensing Dickeya dadantii pada tanaman Anggrek Hibrida Phalaenopsis ekanagasaki 10
HASIL DAN PEMBAHASAN 12 Hasil 12 Aktivitas Enzim Kasar AHL-Laktonase B. thuringiensis SGT3g 12
Kurva Pertumbuhan SGT3g 13
Pemekatan Enzim 13
Karakteristik Enzim AHL-Laktonase B. thuringiensis SGT3g 15
Isolat Bakteri Penyebab Busuk Lunak dan Virulensinya 16
Penghambatan Quorum Sensing 17
Identifikasi Gen 16S rRNA Isolat Bakteri Fitopatogen 19
Pembahasan 20
SIMPULAN 23
LAMPIRAN 28 RIWAYAT HIDUP 30
DAFTAR TABEL
1 Aktivitas enzim kasar AHL-laktonase Bacillus thuringiensis SGT3g dalam menghambat pembentukan violacein Chromobacterium
violaceum 12
2 Aktivitas relatif enzim AHL-laktonase B. thuringiensis SGT3g pada
proses pemekatan 16
3 Perbandingan jumlah sel Dickeya dadantii pada daun 24 jam setelah
inokulasi 18
DAFTAR GAMBAR
1 Struktur Molekul N-Acyl Homoserine Lactone 4
2 Mekanisme kerja AHL-Laktonase 5
3 Diagram alir penelitian 7
4 Aktivitas QQ terhadap C. violaceum yang disebabkan oleh AHL-laktonase B. thuringiensis SGT3g dari (A) ekstraseluler, dan (B)
intraseluler 13
5 Kurva Pertumbuhan B. thuringiensis SGT3g pada media LB yang
diinkubasi pada suhu ruang 13
6 Kadar protein hasil pemekatan enzim menggunakan amonium sulfat 14 7 Indeks QQ ekstrak kasar AHL-laktonase Bacillus thuringiensis SGT3g
terhadap C. violaceum 14
8 Perbandingan antara indeks QQ enzim intraseluler dan ekstraseluler
terhadap C. violaceum 15
9 Aktivitas relatif AHL-laktonase pada berbagai macam pH dan suhu 15 10 Aktivitas relatif enzim AHL-laktonase B. thuringiensis SGT3g hasil
pengendapan dan dialisis 16
11 Gejala busuk lunak pada daun anggrek yang diinokulasikan isolat D (a), isolat C3 (b) dan isolat C1 (c) 24 jam setelah inokulasi 17 12 Gejala busuk daun Phalaenopsis yang disebabkan oleh Dickeya
dadantii 24 jam setelah inokulasi (a) daun yang hanya diinnfeksikan D. dadantii (kontrol positif) dan (b) daun yang diinokulasikan B.
thuringiensis SGT3g dan D. dadantii 18
13 Diameter gejala busuk pada daun anggrek hibrida Phalaenopsis
ekanagasaki 24 jam setelah inokulasi 19
14 Hasil elektroforesis amplifikasi gen 16S rRNA Isolat C1 19 15 Konstruksi pohon filogenetik Isolat C1 berdasarkan 16S rRNA terhadap
DAFTAR LAMPIRAN
1 Metode pengukuran kadar protein 28
PENDAHULUAN
Latar Belakang
Mekanisme komunikasi di antara sel-sel bakteri disebut quorum sensing (QS). Proses tersebut melibatkan sebuah molekul sinyal berupa autoinduser. Saat proses QS berlangsung, autoinduser disekresikan ke lingkungan kemudian terakumulasi, dikenali dan diserap kembali ke dalam sel (Fuqua et al. 1994; Czajkowski et al. 2009; Sakr et al. 2013). Autoinduser yang mencapai konsentrasi tertentu akan membentuk kompleks dengan protein regulator pengaktivasi transkripsi yang akan mengatur pembentukan biofilm, faktor virulensi, bioluminescence dan produksi antibiotik. Jadi QS dapat diartikan sebagai pengaturan ekspresi gen yang bergantung pada jumlah populasi bakteri dan akumulasi autoindusernya (Dong et al. 2007).
Bakteri patogen tanaman menggunakan proses quorum sensing dalam mengaktifkan faktor virulensinya. Dickeya dadantii atau Erwinia chrysantemi (Samson et al. 2005) menggunakan sinyal N-Acyl Homoserine Lactones (AHL) dalam melakukan aktivitas pektinolitik yang digunakan saat mendegradasi dinding sel tanaman (Dong et al. 2000; Barnard et al. 2007). Bakteri tersebut tergolong ke dalam Enterobacteriaceae, agen penyebab penyakit busuk lunak pada anggrek, kubis, dan wortel di Indonesia maupun di negara lain (Rukmana 2000, McMillan et al. 2007, Muharram et al. 2012). Sinyal AHL berperan dalam proses pembentukan faktor virulensi D. dadantii dalam produksi enzim Plant Cell-Wall Degrading Enzyme (PCWDE) termasuk pektinase dan selulase (Barnard et al. 2007; Muharram et al. 2012).
Proses QS dapat dikendalikan dengan cara mencegah terjadinya akumulasi sinyal AHL di lingkungan sel (Chen et al. 2013; Ghani et al. 2014). Enzim AHL-laktonase merupakan enzim yang termasuk ke dalam molekul degradator yang dapat merusak proses QS melalui hidrolisis cincin lakton pada sinyal AHL. AHL-laktonase mendegradasi dengan cara menghidrolisis cincin lakton tanpa mempengaruhi struktur dari molekul sinyal AHL. Penggunaan enzim AHL-laktonase memiliki kelebihan yaitu tidak mempengaruhi pertumbuhan bakteri patogen, sehingga dapat menghindari tekanan seleksi yang dapat menghasilkan generasi patogen yang lebih resisten terhadap antibiotik (Choudhary & Dannert 2010; Dong et al. 2004).
2
Afiah (2011) berhasil mengisolasi Bacillus thuringiensis SGT3g yang menghasilkan enzim AHL-laktonase. Aktivitas enzim AHL-laktonase telah diuji menggunakan bakteri biosensor Chromobacterium violaceum. Stabilitas AHL-laktonase yang diproduksi oleh isolat B. thuringiensis SGT3g penting untuk diketahui, sehingga karakterisasi enzim AHL-laktonase perlu dilakukan. Oleh karena itu penelitian ini bertujuan untuk mengkarakterisasi enzim AHL-laktonase B. thuringiensis SGT3g serta mengetahui efektivitas penghambatan virulensi fitopatogen D. dadantii.
Perumusan Masalah
Dickeya dadantii menyebabkan penyakit busuk lunak pada anggrek, kubis, kentang dan wortel dengan menggunakan mekanisme QS untuk mengekspresikan gen penyandi faktor virulensinya. Bacillus thuringiensis SGT3g penghasil enzim laktonase berhasil diisolasi dari tanah asal lahan pertanian Jawa. AHL-laktonase merupakan enzim yang dapat menghentikan proses QS pada bakteri patogen. B. thuringiensis SGT3g berpotensi sebagai agens biokontrol D. dadantii karena memiliki kemampuan dalam mendegradasi sinyal AHL dari D. dadantii.
Tujuan Penelitian
Penelitian ini bertujuan mengkarakterisasi enzim AHL-Laktonase Bacillus thuringiensis SGT3g serta mengetahui aktivitasnya dalam menghambat patogensitas Dickeya dadantii.
Manfaat Penelitian
Hasil penelitian ini dapat digunakan sebagai acuan mengenai potensi B. thuringiensis SGT3g sebagai agen anti-QS yang berguna untuk mengendalikan virulensi bakteri fitopatogen D. dadantii.
Ruang Lingkup Penelitian
3
TINJAUAN PUSTAKA
Quorum Sensing
Bakteri melakukan komunikasi dengan bakteri lainnya menggunakan molekul sinyal. Mekanisme komunikasi pada bakteri melibatkan proses produksi, pelepasan, pengenalan, dan respon terhadap molekul kecil yang disebut autoinduser (AI). Proses ini disebut quorum sensing (QS), memungkinkan bakteri memantau bakteri lain di lingkungan dan mengubah perilaku dalam komunitas. Kebanyakan proses QS tidak dapat terjadi jika bakteri dalam kondisi individu, tetapi menjadi bermanfaat ketika bakteri berada dalam kepadatan populasi sel yang tinggi. Bakteri mendeteksi akumulasi AI pada konsentrasi tertentu dan akan membentuk kompleks dengan protein regulator pengaktivasi transkripsi. Proses QS meregulasi ekspresi gen pembentukan biofilm, faktor virulen, bioluminescence, dan antibiotik. Berdasarkan penjelasan di atas QS dapat diartikan sebagai regulasi ekspresi gen bakteri yang bergantung pada jumlah populasi bakteri dan akumulasi autoindusernya (Dong et al. 2001; Chen et al. 2010).
Autoinduser yang diproduksi oleh sel-sel bakteri akan mempengaruhi proses transkripsi gen target pada saat mencapai “quorum” tertentu. Bakteri Gram positif dan Gram negatif memiliki AI yang berbeda. Bakteri Gram negatif yang pertama kali ditemukan melakukan proses QS adalah bakteri laut Vibrio fischeri dalam pembentukan bioluminescence (Nealson & Hastings 1979). V. fischeri mengkolonisasi cumi-cumi Euprymna scolopes pada organ cahaya (Visick et al. 2000). Bakteri tersebut tumbuh hingga mencapai kepadatan sel tinggi dan menginduksi ekspresi gen yang dibutuhkan untuk bioluminescence. Dua protein , LuxI dan LuxR, mengontrol ekspresi operon luciferase (luxICDABE) yang dibutuhkan untuk produksi cahaya. LuxI adalah autoinduser sintase, yang memproduksi autoinduser acyl-homoserine lactone (AHL) berupa 3O6C-homoserine lactone dan LuxR adalah reseptor autoinduser atau aktivator transkripsi DNA-Binding (Engebrecht et al. 1983). AHL berdifusi secara bebas ke dalam dan ke luar sel dan konsentrasinya akan meningkat sejalan dengan tingginya kepadatan sel (Kaplan & Greenberg 1985). Ketika sinyal mencapai konsentrasi yang cukup, maka akan berikatan dengan LuxR dan pembentukan kompleks ini mengaktifkan transkripsi operon yang mengkode luciferase (Stevens et al. 1994). Selain V. fischeri bakteri Gram negatif melakukan proses quorum sensing dengan menggunakan sinyal berupa senyawa N-acyl homoserine lactones (AHL) yang berperan penting dalam menginduksi ekspresi gen virulen pada beberapa spesies patogen tanaman diantaranya ialah Erwinia carotovora penyebab penyakit busuk lunak (Dong et al. 2001).
4
mengekspresikan protein yang memicu penempelan dan kolonisasi, sedangkan pada saat kepadatan sel tinggi, bakteri menekan hal tersebut dan menginisiasi sekresi toksin dan protease (Lyon & Novick 2004).
N-Acyl Homoserine Lactones (AHL)
Sinyal N-acyl homoserine lactones (AHL) (Gambar 1) dimanfaatkan oleh bakteri Gram negatif dalam melakukan proses QS. Senyawa ini tersusun atas homoserin lakton dan rantai samping asil lemak (Czajkowski & Jafra 2009). Rantai samping asil mengandung asam lemak rantai panjang yang berbeda-beda (4-18 karbon), tingkat kejenuhan, dan keberadaan hydroxy-, oxo-, atau tidak ada substituen pada posisi C3 (Swift et al. 1997).
Proses sintesis AHL membutuhkan dua komponen yaitu S-adenosylmethionine (SAM) dan acyl-acyl carrier protein (acyl-ACP). Mekanisme
quorum sensing yang melibatkan AHL pertama kali ditemukan pada bakteri laut
Vibrio fischeri, dalam pembentukan bioluminescene. Pada level molekular, tersusun aktivitas dan kolaborasi dari dua komponen. Pertama, AHL sintase yang bertanggung jawab untuk sintesis molekul sinyal secara konstitutif. Kedua, protein regulator yang memicu transkripsi gen target ketika berikatan dengan AHL. Pengikatan AHL membutuhkan perubahan tiga dimensi dari protein regulator dan pada waktu yang tepat memungkinkan berinteraksi dengan daerah DNA spesifik kemudian transkripsi gen target menjadi aktif (Hanzelka & Greenberg 1996).
5
AHL-Laktonase
Proses QS dapat dihambat dengan cara mencegah terjadinya akumulasi sinyal AHL di lingkungan. Senyawa AHL-laktonase termasuk ke dalam senyawa degradator yang dapat merusak proses QS melalui hidrolisis cincin homoserin lakton pada sinyal AHL (Dong et al. 2007). AHL-laktonase mendegradasi dengan cara menghidrolisis cincin lakton tanpa mempengaruhi struktur dari molekul tersebut (Dong et al. 2000).
Beberapa spesies bakteri memproduksi AHL-laktonase di antaranya
Acinetobacter sp., Arthrobacter sp., Agrobacterium tumefaciens, dan Bacillus sp. AHL-laktonase pertama kali diidentifikasi merupakan enzim yang dikode oleh gen aiiA yang berasal dari Bacillus sp. 240B1. AHL-laktonase menghidrolisis ikatan ester pada cincin lakton yang menghasilkan acyl homoserine sehingga AHL menjadi non-aktif.
Karakteristik AHL-laktonase sudah banyak diketahui dari masing-masing spesies. Salah satu contoh yaitu Bacillus weihenstephanensis P65 dapat mendegradasi AHL dengan optimal pada kisaran pH 6-9. Aktivitas AHL-laktonase dari isolat tersebut tidak terhambat oleh ion-ion divalen Ca2+, Mg2+ , Fe2+ dan EDTA pada konsentrasi 1 mM dan 10 mM (Sakr et al. 2013). Studi yang dilakukan Cao et al. (2012) menjelaskan isolat Bacillus sp. AI96 memiliki aktvitas degradasi 3-oxo-C8-HSL pada pH 8 ketika suhu 30 ⁰C. Bacillus sp.
240B1 yang memproduksi AHL-laktonase mampu menekan virulensi bakteri patogen Erwinia carotovora melalui bentuk baru dari antagonisme mikroba, yaitu melalui proses gangguan sinyal menggunakan AHL-laktonase.
6
Dickeya dadantii
Bakteri Erwinia chrysanthemi merupakan bakeri Gram negatif termasuk golongan Enterobacteriaceae penyebab penyakit busuk lunak pada tanaman sukulen seperti anggrek, kubis, dan wortel (Parent et al. 1996; Muharram et al. 2012). Seiring dengan perkembangan dari biologi molekuler, spesies
Erwinia chrysanthemi penyebab busuk lunak telah diusulkan perubahan nama
spesies berdasarkan Samson et al. (2005) menjadi Dickeya dadantii (sinonim
E. chrysanthemi), Pectobacterium carotovorum sub sp. carotovorum (sinonim
E. carotovora sub sp. carotovora), dan Pectobacterium carotovorum sub sp.
atrosepticum (sinonim E. carotovora sub sp. atroseptica). Patogen-patogen tersebut pada umumnya menyebabkan gejala busuk lunak pada jaringan tanaman.
Setiap patogen memiliki sifat yang unik dan cara khusus dalam melakukan regulasi patogenisitasnya. Bakteri patogen pada umunya melakukan proses komunikasi antar sel, begitupula dengan strain Dickeya dadantii memproduksi sinyal 3-oxo-C6-HSL dalam melakukan proses quorum sensing. Karakter utama dari bakteri penyebab penyakit busuk lunak ini yaitu memiliki kemampuan dalam memproduksi enzim pendegradasi dinding sel dalam jumlah besar ( Hugouvieux-Cotte-Pattat et al. 1996; Crepinet al. 2012; Nasser et al. 2013).
Sinyal AHL berperan dalam proses pembentukan faktor virulensi D. dadantii dalam produksi enzim Plant Cell-Wall Degrading Enzyme (PCWDE).
D. dadantii mensintesis pektin metilesterase, pektat liase, pektin liase, poligalakturonase, selulase, protease dan fosfolipase. Pektinase dan selulase disekresikan keluar sel melalui sistem sekresi (Muharram et al. 2012). Enzim tersebut bekerja dengan cara mengganggu integritas sel inang dan dapat memicu pembusukan. Perkembangan gejala penyakit yang disebabkan oleh fitopatogen ini tergantung pada agresivitas strain bakteri dan kerentanan tanaman inang, tetapi juga pada kondisi lingkungan, di antaranya suhu dan kelembapan (Liu et al. 2008).
METODE
Bahan
7
Kerangka Penelitian
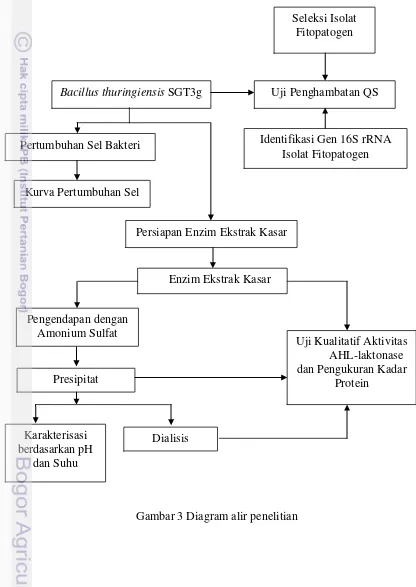
Prosedur penelitian yang dilakukan diantaranya yaitu produksi enzim ekstrak kasar, uji aktivitas AHL-laktonase. Tahapan selanjutnya karakterisasi enzim meliputi pada berbagai macam suhu dan pH, serta dilakukan pengujian penghambatan quorum sensing D. dadantii pada tanaman anggrek hibrida Phalaenopsis ekanagasaki (Gambar 3).
Gambar 3 Diagram alir penelitian Bacillus thuringiensis SGT3g
Kurva Pertumbuhan Sel Pertumbuhan Sel Bakteri
Seleksi Isolat Fitopatogen
Uji Penghambatan QS
Identifikasi Gen 16S rRNA Isolat Fitopatogen
Karakterisasi berdasarkan pH
dan Suhu
Uji Kualitatif Aktivitas AHL-laktonase dan Pengukuran Kadar
Protein Enzim Ekstrak Kasar
Pengendapan dengan Amonium Sulfat
Presipitat
Persiapan Enzim Ekstrak Kasar
8
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan September 2014 sampai dengan September 2015, bertempat di Laboratorium Mikrobiologi Fakultas Matematika dan Ilmu Pengetahuan Alam IPB.
Penyiapan Enzim Kasar
Sebanyak 1-2 lup B. thuringiensis SGT3g diinokulasikan ke dalam 50 mL media LB kemudian diinkubasi pada inkubator berpenggoyang dengan kecepatan
100 rpm selama 5-6 jam pada suhu ruang hingga OD 0.6-0.8. Kultur B. thuringiensis SGT3g diambil sebanyak 2 mL untuk diinokulasikan ke dalam
200 mL media LB yang baru kemudian diinkubasi menggunakan inkubator berpenggoyang dengan kecepatan 150 rpm selama 9 jam. Kultur B. thuringiensis SGT3g disentrifugasi (High-Speed Refrigerated Centrifuged Himac CR 21G, US) pada kecepatan 9800 x g, dan supernatannya digunakan sebagai enzim ekstraseluler. Pelet sel diresuspensi menggunakan Phospate Saline Buffer (PBS) pH 7.4 kemudian disentrifugasi (Centrifuge Hermle, Germany) pada suhu 4 ºC dengan kecepatan 6000 rpm selama 10 menit. Supernatan sel dibuang, sedangkan pelet selnya diresuspensikan kembali dengan buffer yang sama kemudian dilakukan pelisisan sel menggunakan sonikator (SONIPREP 150, UK) 5 kali masing-masing selama 2 menit secara diskontinyu. Debris sel dipisahkan dengan cara disentrifugasi (Centrifuge Hermle, Germany) pada kecepatan 12500 x g selama 15 menit pada suhu 4 ºC. Supernatan yang diperoleh digunakan sebagai enzim intraseluler (Dong et al. 2002; Cao et al. 2012).
Uji Aktivitas AHL-Laktonase terhadap C. violaceum
Aktivitas AHL laktonase terhadap C. violaceum diuji menggunakan metode disc diffusion assay (Fitriyah et al. 2014). Sebanyak 80 µ L enzim kasar diteteskan pada paper disc steril 8 mm yang diletakkan pada permukaan media cawan Luria Bertani Agar (LBA) semi padat (0.8% agar) yang telah diinokulasi dengan 1% (b/v) kultur cair C. violaceum (108 CFU/mL). Cawan tersebut kemudian diinkubasi pada suhu ruang selama 24 jam. Zona quorum quenching (tidak berwarna ungu) yang terbentuk di sekitar paper disc diamati dan diukur diameternya.
Pembuatan Kurva Pertumbuhan B. thuringiensis SGT3g
9 spektrofotometer (Genesys 20, US) pada panjang gelombang 600 nm setiap 3 jam selama 27 jam atau sampai tercapai fase stasioner.
Pemekatan dan Karakterisasi Enzim
Pemekatan enzim AHL-laktonase dilakukan menggunakan amonium sulfat pada tingkat saturasi 40-80% (Scopes 1994). Tingkat saturasi yang menghasilkan aktivitas quorum quenching tertinggi dipilih untuk mengendapkan enzim ekstraseluler dan intraseluler. Endapan hasil pemekatan dilarutkan dalam buffer fosfat 0.1 M pH 7. Proses dialisis dilakukan menggunakan kantong dialisis berdiameter 15 mm dengan ukuran pori (Molecular Weight Cut Off) 12400 Dalton (Sigma D0405). Sebelum digunakan kantong dialisis dipersiapkan terlebih dahulu sesuai dengan prosedur yang telah ditentukan oleh produsennya. Membran dicuci dengan air mengalir selama 3-4 jam. Selanjutnya untuk menghilangkan residu sulfur kantong dialisis direbus dalam larutan natrium sulfit 0.3% (b/v) pada suhu 80 °C selama 1 menit. Kantong dialisis kemudian dicuci dengan air panas (60 °C) selama 2 menit, diikuti dengan tahap pengasaman dalam larutan asam sulfat 0.2% (b/v), dan terakhir dicuci kembali dengan air panas. Enzim hasil pengendapan dilarutkan ke dalam larutan 1 mL 50 mM buffer sitrat pH 5,0. Enzim dimasukkan ke dalam kantong dialisis, diikat kedua ujungnya kemudian didialisis dalam buffer sitrat 12.5 mM. Selama dialisis, buffer perendam diaduk dengan pengaduk magnetik. Proses dialisis dilakukan selama semalam dan buffer sitrat 12.5 mM diganti setelah jam ke-3 dan jam ke-7. Setelah dialisis dilakukan pengujian aktivitas relatif AHL-laktonase dan pengukuran kadar protein.
Enzim hasil presipitasi dikarakterisasi rentang pH (4.0-10.0) dan suhu yang berbeda. Buffer yang digunakan untuk karakterisasi rentang pH (4.0-10.0) adalah sebagai berikut: 0.1 M buffer sitrat (pH 4.0-6.0), 0.1 M buffer fosfat (pH 7.0-8.0) dan 0.1 M buffer glisin-NaOH (pH 9.0-10.0). Suhu optimum ditentukan pada kisaran suhu 20 °C hingga 90 °C dengan interval suhu 10 °C sebagaimana yang dilakukan oleh Cao et al. (2012).
Pengukuran Kadar Protein
Pengukuran kadar protein dilakukan mengikuti metode Standard Assay Bradford (1976). Reagen Bradford dibuat dengan cara, sebanyak 50 mg Coomassie Brilliant Blue G-250 dilarutkan di dalam 25 mL 95% etanol. Asam ortofosfat 85% ditambahkan ke dalam larutan tersebut kemudian diencerkan dengan akuades hingga 500 mL, dan terakhir disaring dengan kertas saring Whatman No.1.
10
supernatan, hasil pengendapan dan protein tersisa yang tidak tersendapkan, serta hasil dialisis.
Uji Penghambatan Quorum Sensing Bakteri Fitopatogen pada Anggrek Hibrida Phalaenopsisekanagasaki oleh B. thuringiensis SGT3g
Seleksi Bakteri Penyebab Busuk Lunak
Sebanyak tiga isolat bakteri penyebab busuk lunak yang diisolasi dari wortel (isolat C1 dan C3) dan kentang (isolat D) busuk diseleksi kemampuannya dalam menyebabkan gejala busuk lunak. Ketiga isolat tersebut ditumbuhkan pada media LB cair selama 24 jam. Sebanyak 1 mL kultur masing-masing isolat diinokulasikan secara terpisah menggunakan syringe tanpa jarum masing-masing
sebanyak 5 titik pada permukaan atas daun anggrek hibrida Phalaenopsis ekanagasaki. Daun anggrek yang telah diinokulasi disungkup
selama 24 jam dan diamati gejala busuk lunak yang terbentuk. Perlakuan ini dilakukan sebanyak 2 ulangan. Isolat yang menyebabkan pembusukan paling parah dipilih untuk uji penghambatan QS.
Uji Penghambatan Quorum SensingD. dadantii secara In-planta
Tanaman anggrek yang digunakan merupakan anggrek hibrida Phalaenopsis ekanagasaki yang diperoleh dari Kebun Raya Bogor. Daun anggrek dioles menggunakan kuas dengan 3 mL kultur Bacillus thuringiensis SGT3g yang memiliki kerapatan 108-109 CFU/mL. Setelah permukaan daun kering masing-masing daun disungkup menggunakan plastik dan diinkubasi selama 24 jam. Daun anggrek kemudian ditusuk dengan jarum suntik secara diagonal sebanyak 8 tusukan untuk masing-masing daun. Daun yang sudah ditusuk ditetes 5 µL kultur isolat C1 yang memiliki kerapatan 108-109 CFU/mL. Sebagai kontrol positif daun hanya diinfeksi dengan kultur isolat C1, sedangkan sebagai kontrol negatif daun hanya dioles dengan kultur B. thuringiensis SGT3g. Tanaman yang sudah diinokulasi kemudian disungkup menggunakan kantong plastik selama 24 jam. Pengamatan dilakukan setelah 24 jam inkubasi dengan peubah yang diamati meliputi peluang terjadinya penyakit (jumlah titik yang menunjukkan gejala dibagi dengan jumlah titik inokulasi) dan perkembangan gejala penyakit (diameter gejala).
11
Isolasi DNA dan Amplifikasi Gen 16S rRNA Isolat Bakteri Fitopatogen
Isolat bakteri fitopatogen yang paling virulen (Isolat C1) diisolasi DNA-nya dengan menggunakan kit ekstraksi Genomic DNA Mini Kit (Blood/Cultured Cell) dari Geneaid (Geneaid Biotech Ltd, Taiwan). Sebanyak 6 mL kultur bakteri fitopatogen umur 18 jam disentrifugasi pada kecepatan 14000 x g selama 1 menit. Supernatan dibuang sedangkan pelet selnya diresuspensi dengan 200 µL buffer GT selanjutnya diinkubasi selama 5 menit pada suhu ruang. Sel dilisis dengan menambahkan 200 µL buffer GB kemudian dihomogenkan dengan cara divorteks sebentar dan diinkubasi selama 10 menit pada suhu 60 ºC sambil dibolak balik setiap 3 menit. Selanjutnya ditambahkan sebanyak 200 µ L etanol absolut. Campuran tersebut dimasukkan ke dalam kolom GD yang telah dipasang pada tabung mikro, selanjutnya disentrifugasi selama 2 menit pada kecepatan 14000 x g. Pencucian dilakukan dengan menambahkan 400 µL larutan W1 ke dalam kolom GD kemudian disentrifugasi selama 30 detik pada kecepatan 14000 x g. Cairan yang terkumpul dalam tabung koleksi dibuang sebelum kolom dicuci lagi dengan 600 µL larutan pencuci yang telah ditambahkan etanol absolut. Tabung mikro selanjutnya disentrifugasi selama 3 menit pada kecepatan 14000 x g hingga tidak ada lagi cairan pencuci pada tabung kolektor.
Kolom GD dipindahkan ke tabung mikro baru kemudian dilakukan elusi DNA dengan cara menambahkan 50 µL larutan elusi ke bagian tengah matriks kolom GD lalu diinkubasi selama 15 menit sampai larutan pengelusi terserap. Tabung mikro disentrifugasi kembali selama 1 menit pada kecepatan 14000 x g untuk mengelusi DNA-nya. DNA hasil isolasi diukur kemurnian dan konsentrasinya dengan menggunakan perangkat Nanodrop 2000 (Thermo Scientific, Wilington, DE, USA) di Laboratorium Institut Pertanian Bogor Culture Collection (IPBCC). Sampel DNA dengan kemurnian DNA sekitar 1.8-2 selanjutnya digunakan sebagai template untuk amplifikasi gen 16S rRNA secara in vitro.
Amplifikasi gen 16S rRNA dilakukan dengan menggunakan primer 63f (5’ –CAG GCC TAA CAC ATG CAA GTC-3’) dan primer 1387r (5’ –GGG CGG WGT GTA CAA GGC-3’) (Marchesi et al. 1998). Proses PCR berlangsung dengan volume 10 µL yang mengandung 5 µL KAPA 2G robust, Hotstart readymix, 0.1 µL masing-masing primer (10 pmol), 1 µL (0.37 ng/µL) cetakan DNA dan 3.8 µL air bebas nuklease. Gradien suhu yang digunakan selama PCR antara lain pra-denaturasi selama 4 menit pada suhu 94 ºC, denaturasi selama 30 detik pada suhu 94 ºC, penempelan primer selama 30 detik pada suhu 55 ºC, ekstensi selama 1 menit pada suhu 72 ºC dan pasca ekstensi selama 7 menit pada suhu 72 ºC.
12
Sekuensing Gen 16S rRNA Isolat Bakteri Fitopatogen dan Analisis Bioinformatik dan Konstruksi Pohon Filogenetik
Hasil amplifikasi gen 16S rRNA dari isolat C1 disekuensing menggunakan DNA sekuenser ABI PRISM 3100 di Perusahaan Jasa Sekuensing First Base (Malaysia). Sekuen nukleotida yang diperoleh dikoreksi menggunakan BioEdit Sequence Alignment Editor kemudian dibandingkan dengan database pada GenBank (NCBI) menggunakan program BLAST (http://www.ncbi.nlm.nih.gov/). Konstruksi pohon filogenetik dilakukan menggunakan program MEGA 6 (Molecular Evolutionary Genetics Analysis, Version 6).
HASIL DAN PEMBAHASAN
Hasil
Aktivitas Enzim Kasar AHL-Laktonase B. thuringiensis SGT3g
Berdasarkan hasil uji kualitatif, aktivitas enzim AHL-laktonase terdeteksi
pada bagian supernatan kultur dan supernatan hasil sonikasi pellet sel B. thuringiensis (Tabel 1). Aktivitas enzim tersebut ditunjukkan dengan
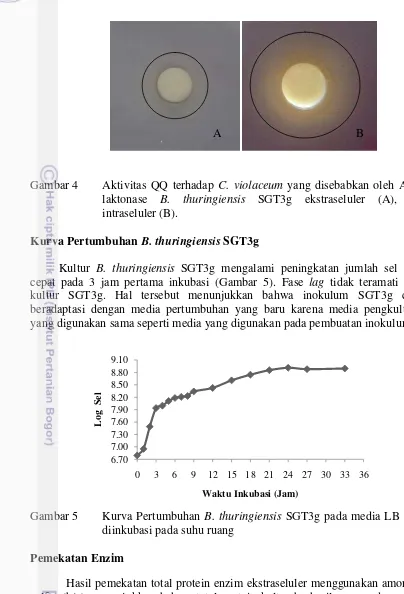
terbentuknya zona tidak ungu disekitar paper disc yang merupakan zona quorum quenching (QQ) terhadap C. violaceum (Gambar 4). AHL-laktonase intraseluler menunjukkan aktivitas yang lebih tinggi dibandingkan dengan AHL-laktonase ekstraseluler. Nilai diameter zona QQ AHL-laktonase intraseluler yang terbentuk sebesar 10 mm sedangkan diameter zona QQ AHL-laktonase ekstraseluler sebesar 7.25 mm.
Tabel 1 Aktivitas enzim kasar AHL-laktonase Bacillus thuringiensis SGT3g dalam menghambat pembentukan violacein Chromobacterium violaceum
Sumber Enzim Diameter QQ (mm)
Supernatan Kultur 7.25
13
6.70 7.00 7.30 7.60 7.90 8.20 8.50 8.80 9.10
0 3 6 9 12 15 18 21 24 27 30 33 36
L
o
g
Sel
Waktu Inkubasi (Jam)
Gambar 4 Aktivitas QQ terhadap C. violaceum yang disebabkan oleh AHL-laktonase B. thuringiensis SGT3g ekstraseluler (A), dan intraseluler (B).
Kurva Pertumbuhan B. thuringiensis SGT3g
Kultur B. thuringiensis SGT3g mengalami peningkatan jumlah sel yang cepat pada 3 jam pertama inkubasi (Gambar 5). Fase lag tidak teramati pada kultur SGT3g. Hal tersebut menunjukkan bahwa inokulum SGT3g cepat beradaptasi dengan media pertumbuhan yang baru karena media pengkulturan yang digunakan sama seperti media yang digunakan pada pembuatan inokulum.
Gambar 5 Kurva Pertumbuhan B. thuringiensis SGT3g pada media LB yang diinkubasi pada suhu ruang
Pemekatan Enzim
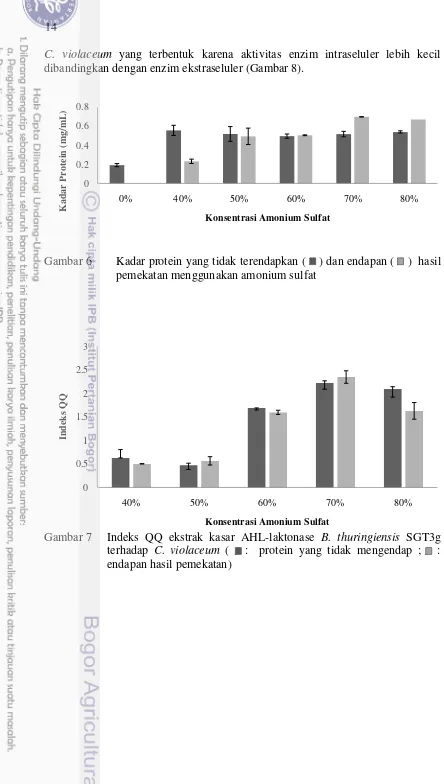
Hasil pemekatan total protein enzim ekstraseluler menggunakan amonium sulfat (b/v) menunjukkan bahwa total protein kultur berhasil mengendap secara maksimal pada konsentrasi amonium sulfat 70%. Data kadar protein (Gambar 6) dan indeks QQ terhadap C. violaceum (Gambar 7) menunjukkan bahwa tingkat saturasi optimum untuk proses pengendapan enzim AHL-laktonase ekstraseluler tercapai pada konsentrasi amonium sulfat 70%. Berdasarkan hasil tersebut, pemekatan enzim intraseluler juga dilakukan pada konsentrasi amonium sulfat yang sama. Jika dibandingkan dengan enzim ektraseluler, indeks QQ terhadap
14
C. violaceum yang terbentuk karena aktivitas enzim intraseluler lebih kecil dibandingkan dengan enzim ekstraseluler (Gambar 8).
Gambar 6 Kadar protein yang tidak terendapkan ( ) dan endapan ( ) hasil pemekatan menggunakan amonium sulfat
15
Gambar 8 Perbandingan antara indeks QQ enzim intraseluler dan ekstraseluler terhadap C. violaceum ( : protein yang tidak mengendap, : endapan)
Karakteristik Enzim AHL-Laktonase B. thuringiensis SGT3g
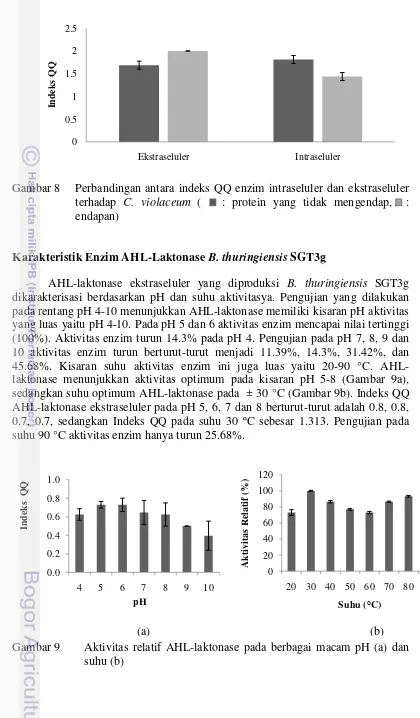
AHL-laktonase ekstraseluler yang diproduksi B. thuringiensis SGT3g dikarakterisasi berdasarkan pH dan suhu aktivitasya. Pengujian yang dilakukan pada rentang pH 4-10 menunjukkan AHL-laktonase memiliki kisaran pH aktivitas yang luas yaitu pH 4-10. Pada pH 5 dan 6 aktivitas enzim mencapai nilai tertinggi (100%). Aktivitas enzim turun 14.3% pada pH 4. Pengujian pada pH 7, 8, 9 dan 10 aktivitas enzim turun berturut-turut menjadi 11.39%, 14.3%, 31.42%, dan 45.68%. Kisaran suhu aktivitas enzim ini juga luas yaitu 20-90 °C. AHL-laktonase menunjukkan aktivitas optimum pada kisaran pH 5-8 (Gambar 9a), sedangkan suhu optimum AHL-laktonase pada ± 30 °C (Gambar 9b). Indeks QQ AHL-laktonase ekstraseluler pada pH 5, 6, 7 dan 8 berturut-turut adalah 0.8, 0.8, 0.7, 0.7, sedangkan Indeks QQ pada suhu 30 ºC sebesar 1.313. Pengujian pada suhu 90 °C aktivitas enzim hanya turun 25.68%.
16
Tabel 2 Aktivitas relatif enzim AHL-laktonase B. thuringiensis SGT3g setelah proses pemekatan
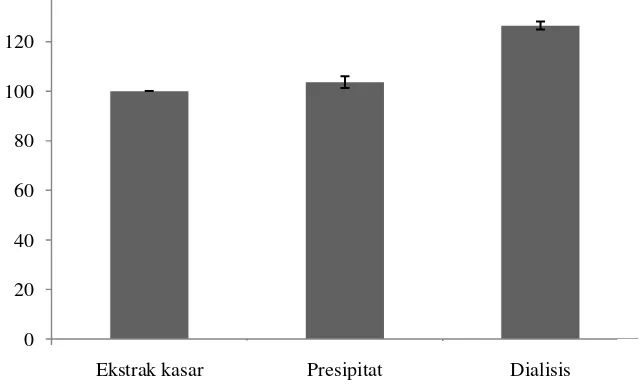
Semakin tinggi tingkat kemurnian relatif suatu enzim semakin tinggi pula aktivitas enzimnya. Walaupun hasil pengukuran kadar protein AHL-laktonase hasil dialisis lebih kecil dibandingkan dengan kadar protein hasil presipitasi (Tabel 2), aktivitas AHL-laktonase hasil dialisis lebih tinggi dibandingkan dengan hasil presipitasi dan enzim kasarnya (Gambar 10). Sebelum dipekatkan aktivitas enzim kasar (IQQ) mencapai 0.812 dengan kadar protein 0.583 mg/mL setelah diendapkan aktivitasnya menjadi 0.969 (103.6%) dengan kadar protein 0.916 mg/mL dan setelah dialisis aktivitas enzim menjadi 1.406 (126.4%) dengan kadar protein 0.683 mg/mL.
Gambar 10 Aktivitas relatif enzim AHL-laktonase B. thuringiensis SGT3g ekstraseluler sebelum dan sesudah pemekatan serta hasil dialisis
17
Aktivitas Penghambatan Quorum sensing Bakteri Fitopatogen pada Anggrek Hibrida Phalaenopsisekanagasaki oleh B. thuringiensis SGT3g
Isolat Bakteri Penyebab Busuk Lunak dan Virulensinya
Hasil pengamatan terhadap daun anggrek setelah 24 jam diinfeksi isolat fitopatogen menunjukkan masing-masing daun mengalami gejala busuk lunak dengan tingkat kebusukan yang berbeda. Daun anggrek yang diinokulasi dengan isolat C1 mengalami gejala busuk paling parah dibandingkan dengan daun yang diinokulasi dengan dua isolat patogen lainnya (Gambar 11b). Gejala busuk paling ringan terdapat pada daun anggrek yang diinokulasi dengan isolat D (Gambar 11a). Berdasarkan hasil pengujian tiga isolat tersebut maka isolat C1 dipilih sebagai bakteri fitopatogen yang digunakan selanjutnya untuk pengujian penghambatan quorum sensing pada percobaan In-planta.
Gambar 11 Gejala busuk lunak pada daun anggrek setelah 24 jam diinokulasi dengan isolat fitopatogen D (A), isolat C3 (B) dan isolat C1 (C)
Penghambatan Quorum Sensing
Daun yang dioles B. thuringiensis SGT3g (kontrol negatif) tidak mengalami gejala busuk sedangkan daun yang diinfeksi dengan D. dadantii tanpa dioles B. thuringensis SGT3g (kontrol positif) menunjukkan adanya gejala busuk lunak yang parah setelah 24 jam diinfeksi fitopatogen. Daun yang telah diinokulasi dengan B. thuringiensis SGT3g menunjukkan gejala busuk yang lebih ringan dibandingkan dengan kontrol positifnya. Peluang terjadinya gejala busuk pada daun yang diinokulasi dengan B. thuringiensis SGT3g sebesar 50% sedangkan pada kontrol positif sebesar 100% (Gambar 12). Diameter gejala busuk pada daun yang diinokulasikan B. thuringiensis SGT3g sebesar 3.28 mm sedangkan pada kontrol positif sebesar 16.3 mm (Gambar 13). Gejala busuk pada daun yang diinokulasi dengan B. thuringiensis SGT3g lebih ringan dikarenakan adanya aktivitas AHL-laktonase yang menghambat proses quorum sensing patogen D. dadantii. Jumlah sel D. dadantii pada Tabel 3 menunjukkan bahwa
18
jumlah sel D. dadantii pada perlakuan B. thuringiensis SGT3g dan D. dadantii tidak berbeda jauh dengan kontrol positifnya.
Gambar 12 Tampilan daun Phalaenopsis ekanagasaki setelah 24 jam diinfeksi dengan isolat fitopatogen C1 (A) dan daun yang diinokulasikan B. thuringiensis SGT3g sebelum diinfeksi dengan isolat fitopatogen C1 (B)
Tabel 3 Perbandingan jumlah sel Dickeya dadantii pada daun Phalaenopsis ekanagasaki setelah 24 jam inokulasi
Perlakuan pada daun Populasi sel D. dadantii
pada daun yang diinfeksi (CFU/g daun) Inokulum D. dadantii 1.12 x 109 ± SE 1.49 x 108 Kontrol Positif (daun yang diinfeksi
D. dadantii)
1.01 x 109 ± SE 2.9 x 107 Perlakuan (daun yang diinokulasi B.
thuringiensis SGT3g dan diinfeksi D. dadantii)
3.96 x 108 ± SE 3.41 x 107
19
Gambar 13 Diameter gejala busuk pada daun anggrek hibrida Phalaenopsis ekanagasaki setelah 24 jam inokulasi isolat fitopatogen C1
Identifikasi Isolat Bakteri Fitopatogen Berdasarkan Gen 16S rRNA
Hasil amplifikasi gen 16S rRNA isolat fitopatogen C1 menggunakan primer 63f dan 1387r (Marchesi et al. 1998) menghasilkan satu amplikon berukuran sekitar 1300 pb (Gambar 14). Isolat C1 mempunyai kekerabatan yang dekat dengan Dickeya dadantii galur CFBP 1269 dengan tingkat kemiripan 93%. Analisis pohon filogenetik menunjukkan isolat C1 berkerabat dekat dengan Pectobacerium carotovorum, D. dianthicola, dan D. dadantii sub. sp. dieffenbachiae (Gambar 15).
20
Gambar 15 Konstruksi pohon filogenetik Isolat C1 berdasarkan 16S rRNA terhadap beberapa bakteri fitopatogen
Pembahasan
Bacillus thuringiensis SGT3g menghasilkan enzim AHL-laktonase ekstraseluler dan intraseluler yang mampu menghidrolisis substrat AHL. AHL-laktonase yang dieksresikan oleh bakteri ini dapat mendegradasi sinyal AHL yang ditunjukkan dengan adanya zona tidak berwarna ungu di sekitar paper disc. Hal ini menunjukkan pada zona tidak ungu tersebut tidak terjadi sintesis violacein yang disebabkan rusaknya sinyal AHL. Senyawa AHL diproduksi oleh Chromobacterium violaceum dan dibutuhkan untuk mengkordinasikan ekspresi gen penyandi violacein pada populasi bakteri tersebut (McClean et al. 1997). Degradasi senyawa sinyal tersebut oleh AHL-laktonase yang dihasilkan B. thuringiensis SGT3g menyebabkan kegagalan proses kordinasi sehingga sel-sel C. violaceum tidak mampu memproduksi violacein walaupun populasi bakteri tersebut sudah mencapi quorum. Selain C. violaceum, bakteri-bakteri Gram negatif penyebab busuk lunak juga menggunakan sinyal tersebut untuk melakukan proses QS. Bakteri D. dadantii C1 menggunakan AHL dalam memproduksi enzim-enzim pendegradasi dinding sel tanaman.
Sebagian besar publikasi tentang hasil penelitian AHL-laktonase menunjukkan bahwa enzim ini diproduksi secara intraseluler (Dong et al. 2000; Cao et al. 2012; Tang et al. 2015). Cao et al. (2012) melaporkan bahwa AHL-laktonase yang diproduksi Bacillus sp. AI96 terdeteksi sebagai enzim intraseluler, demikian juga AHL-laktonase dari Bacillus sp. 240B1 yang ditemukan oleh Dong et al. (2000). Selain dari genus Bacillus, AHL-laktonase juga dihasilkan secara intraseluler oleh Geobacillus caldoxylosilyticus YS-8 (Seo et al. 2011). Namun berdasarkan hasil penelitian Tang et al. (2015) enzim AHL-laktonase juga ditemukan sebagai enzim ekstraseluler pada bakteri Muricauda olearia. Bakteri itu merupakan bakteri laut yang termasuk dalam Flavobacteriaceae. Berdasarkan
Isolat C1
NR_041921.1|:62-1054 Dickeya dadantii strain CFBP 1269 NR_041922.1|:75-1067 Dickeya dianthicola strain CFBP 1200
NR_118134.1|:72-1064 Dickeya dadantii subsp. dieffenbachiae strain LMG 25992 NR_118227.1|:92-1084 Pectobacterium carotovorum strain CFBP2046 NR_117738.2|:84-1076 Erwinia chrysanthemi strain DSM 4610
AB680317.1| Erwinia amylovora strain: NBRC 12687 FJ611839.1| Pantoea agglomerans strain LMG 1286
21 literature yang tersedia saat ini, maka hasil penelitian ini merupakan laporan pertama tentang AHL-laktonase ekstraseluler dari B. thuringiensis.
Pemekatan protein enzim dapat dilakukan dengan penambahan amonium sulfat. Penambahan amonium sulfat ke dalam larutan yang mengandung protein menyebabkan molekul air pada sisi polar protein berinteraksi dengan ion sulfat. Akibatnya jumlah molekul air yang berinteraksi dengan protein berkurang. Ketika protein tidak berikatan dengan molekul air maka protein tersebut akan mengendap (Scopes 1994). Proses ini menyebabkan konsentrasi protein semakin pekat sehingga aktivitas enzim semakin meningkat. Selain itu proses pemekatan menurunkan kadar protein yang bukan target sehingga dapat meningkatkan kemurnian dan aktivitas enzim. Proses pengendapan dilakukan pada suhu rendah (4 °C) sehingga protein akan mengendap tanpa terdenaturasi (Scopes 1994; Ahmed 2005).
Enzim AHL-laktonase ekstraseluler dari B. thuringiensis mengendap pada konsentrasi amonium sulfat 70% (b/v). Aktivitas enzim intraseluler yang diendapkan dengan konsentrasi amonium sulfat yang sama menunjukkan aktivitas yang lebih kecil dibandingkan dengan aktivitas enzim ekstraseluler. Pengendapan enzim ekstraseluer dapat meningkatkan indeks QQ terhadap C. violaceum sebesar 1.2 kali dibandingkan dengan enzim ekstrak kasar. Hasil pengendapan AHL-laktonase B. thuringiensis SGT3g jauh lebih rendah dibandingkan dengan AHL-laktonase Geobacillus caldoxylosilyticus YS-8 yang diendapkan dengan konsentrasi amonium sulfat 40-60% (b/v). Aktivitas enzim spesifik meningkat 3.15 kali lebih besar dibandingkan ektrak kasar (Seo et al. 2011). Hasil penelitian Chen et al. (2010) melaporkan bahwa protein aiiA Bacillus sp. B546 rekombinan yang diekspresikan pada Pichia pastoris diendapkan dengan konsentrasi amonium sulfat sebesar 80%, sedangkan Bacillus sp. RM1 dimurnikan menggunakan amonium sulfat dengan konsentrasi 30-80% (Mukherji & Prabhune 2015). Perbedaan konsentrasi amonium sulfat dalam mengendapkan protein dipengaruhi oleh beberapa faktor diantaranya adalah sifat hidrofobisitas protein tersebut serta gugus polar dan non polar dari protein yang akan diendapkan (Scopes 1994).
22
molekul protein aiiA rekombinan dari bakteri G. caldoxylosilyticus YS-8 berukuran 32 kDa (Seo et al. 2011). Berat molekul aiiA AHL-laktonase rekombinan B. thuringiensis SGT3g hasil karakterisasi yang dilakukan oleh Asmarani (2015) menunjukkan berat molekul 28.77 kDa. Oleh karena itu pada penelitian ini proses dialisis dilakukan menggunakan membran yang berukuran 12.4 kDa sehingga protein yang berukuran di atas 12.4 kDa tetap berada di dalam membran dialisis sedangkan protein yang ukurannya kurang dari 12.4 kDa akan keluar melalui kantong dialisis.
AHL-laktonase B. thuringiensis SGT3g memiliki kisaran pH dan suhu yang luas. Aktivitas optimum presipitat AHL-laktonase berada pada pH 5-8. Data tersebut menjelaskan bahwa AHL-laktonase tersebut aktif pada pH netral dan pada pH yang cenderung asam. AHL-laktonase yang diproduksi oleh Bacillus maupun bakteri penghasil AHL-laktonase lainnya pada umunya aktif pada pH netral dan basa (Chen et al. 2010; Seo et al. 2011; Cao et al. 2012; Sakr et al. 2013; Tang et al. 2015). Berdasarkan Cao et al. (2012) dan Sakr et al. (2014) AHL-laktonase dari Bacillus sp. AI96 dan B. weihenstephanensis P65 memiliki kisaran pH aktivitas antara 6-9. Sejauh pengetahuan penulis belum ada publikasi yang menyebutkan AHL-laktonase dari bakteri yang aktif pada pH asam. Kondisi asam dapat memicu terjadinya re-laktonasi cincin AHL yang sudah terbuka (Dong et al. 2001; Chen et al. 2013; Ghani et al. 2014). Hal tersebut berbeda dengan hasil penelitian ini yang menunjukkan rentang pH optimum AHL-laktonase B. thuringiensis SGT3g yang cukup lebar yaitu pH 5-8. Rentah pH aktivitas yang
luas ini merupakan salah satu kelebihan dari karakter AHL-laktonase B. thuringiensis SGT3g.
Pada umunya aktivitas enzim AHL-laktonase berada pada kisaran 37 - 45°C (Wang et al. 2004). Menurut Chen et al. (2010) dan Tang et al. (2015) enzim laktonase merupakan enzim yang tidak tahan terhadap panas. AHL-laktonase dari Bacillus sp. AI96 memiliki kisaran suhu 20-30 °C (Cao et al. 2012), sedangkan untuk Bacillus weihenstephanensis P65 memiliki kisaran aktivitas pada suhu 50 °C (Sakr et al. 2013). Suhu aktivitas AHL-laktonase B. thuringiensis tertinggi yang pernah dilaporkan adalah pada suhu 70 °C (Sakr et al. 2014). Berdasarkan percobaan yang dilakukan aktivitas optimum AHL-laktonase B. thuringiensis SGT3g dicapai pada suhu 30 ºC. AHL-laktonase ini masih menunjukkan adanya aktivitas relatif yang cukup besar (93%) setelah diinkubasi selama 30 menit pada suhu 90 °C. Hal ini menunjukkan bahwa enzim pendegradasi AHL B. thuringiensis SGT3g ini bersifat cukup toleran terhadap panas (termotoleran).
Identifikasi patogen dilakukan berdasarkan gen 16S rRNA. Gen 16S rRNA merupakan komponen ribosom prokariot subunit 30S, yang umum digunakan untuk identifikasi molekuler, menentukan kekerabatan serta analisis filogenetik yang berasal dari suatu ekosistem (Madigan et al. 2011). Hasil identifikasi secara molekuler berdasarkan gen 16S rRNA isolat fitopatogen C1 berkerabat dekat dengan D. dadantii dengan tingkat kemiripan 93%, query cover 100% dan e. value 0.0. Selain D. dadantii penyakit busuk lunak juga dapat disebabkan oleh P. chrysanthemi, D. dianthicola, D. dieffenbachiae dan D. zeae (Samson et al. 2005).
23 B. thuringiensis SGT3g sebelum diinfeksi dengan D. dadantii C1 mengalami penurunan gejala sebesar 50% setelah 24 jam inkubasi. Sedangkan daun anggrek yang hanya diinfeksi dengan bakteri D. dadantii C1 mengalami gejala busuk yang sangat parah dibandingkan dengan daun anggrek perlakuan. Hal tersebut mengindikasikan bahwa B. thuringiensis SGT3g berhasil melemahkan virulensi dari D. dadantii C1 dalam menyebabkan gejala busuk pada daun anggrek hibrida Phalaenopsis ekanagasaki.
Mekanisme pengendalian bakteri fitopatogen oleh agen biokontrol antara lain melalui proses antibiosis, kompetisi, parasitisme, dan quorum quenching (Mitchell 1973; Fravel 1988; Waters & Bassler 2005). Proses antibiosis oleh agen biokontrol akan menghasilkan senyawa yang bersifat bakterisidal atau mikrobisidal sehingga akan membunuh dan menurunkan jumlah bakteri patogen secara drastis (Mitchell 1973). Hasil perhitungan populasi sel D. dadantii C1 pada daun yang hanya diinfeksi fitopatogen tidak jauh berbeda dengan perlakuan B. thuringiensis SGT3g dan D. dadantii C1 (Tabel 3). Hasil ini mengindikasikan bahwa proses penghambatan patogenisitas D. dadantii C1 yang terjadi pada daun anggrek hibrida Phalaenopsis bukan antibiosis melainkan proses quorum quenching. B. thuringiensis SGT3g memproduksi AHL-laktonase yang berperan penting dalam pencegahan infeksi oleh D. dadantii. Keberhasilan penghambatan quorum sensing patogenisitas E. carotovora oleh B. thuringiensis juga pernah dilaporkan oleh Dong et al. (2004). Selain melalui aplikasi bakteri penghasil AHL-laktonase secara langsung, penghambatan quorum sensing patogen penyebab busuk lunak juga dapat dilakukan dengan cara mengintegrasikan gen aiiA penyandi AHL-laktonase ke genom tanaman. Tanaman transgenik tahan
busuk lunak yang telah berhasil dirakit menggunakan gen aiiA dari B. thuringiensis antara lain tembakau (Dong et al. 2001), sawi putih (Dong et al.
2002), dan suweg (Ban et al. 2009).
B. thuringiensis SGT3g adalah bakteri yang potensial untuk dikembangkan sebagai agen biokontrol dan sumber gen untuk rekayasa genetika tanaman maupun mikroba. Penelitian ini merupakan langkah awal dalam pemanfaatan B. thuringiensis indigenus sebagai agen biokontrol untuk bakteri patogen melalui pendekatan quorum sensing. Biokontrol menggunakan mikroorganisme untuk menekan penyakit tanaman merupakan pilihan alternatif
yang lebih baik dibandingkan dengan menggunakan senyawa kimia. B. thuringiensis merupakan salah satu biopestisida yang sukses untuk
mengendalikan serangga dan patogen yang bersifat ramah lingkungan. Bakteri ini memiliki aktivititas biosida dengan menggunakan kristal protein dalam mengendalikan hama serangga (Emmert & Handelsman 1999). Penelitian ini dan studi lebih lanjut dapat mengembangkan B. thuringiensis sebagai agen pengendali faktor virulensi D. dadantii pada tanaman anggrek Phalaenopsis ekanagasaki.
SIMPULAN
24
yang sudah dipublikasikan sebelumnya. Aktivitas AHL-laktonase berkisar pada pH 5-8 dan suhu 30 °C. Enzim hasil dialisis memiliki aktivitas tertinggi yang ditunjukkan dengan indeks QQ terhadap Chromobacterium violaceum sebesar 1.406, sedangkan presipitat sebesar 0.969 dan ekstrak kasar sebesar 0.812. Bakteri penghasil AHL-laktonase ini mampu mengurangi gejala busuk yang disebabkan oleh Dickeya dadantii C1 pada daun anggrek setelah inkubasi 24 jam. Hal ini menunjukkan bahwa bakteri ini berpotensi besar untuk dijadikan sebagai biokontrol untuk mengendalikan penyakit busuk lunak pada Phalaenopsis ekanagasaki.
DAFTAR PUSTAKA
Afiah TSN. 2011. Isolasi dan Karakterisasi Bakteri Penghasil Acyl Homoserine Lactonase (AHL-Laktonase) Asal Lahan Pertanian di Jawa [skripsi]. Bogor (ID). Institut Pertanian Bogor.
Ahmed H. 2005. Principles and Reaction of Protein Extraction, Purification, and Characterization. Florida (US): CRC Press LC.
Ansaldi M, Marolt D, Stebe T, Mandic-Mules I, Dubnau D. 2002. Specific activation of the Bacillus quorum-sensing systems by isoprenylated pheromone variants. Mol Microbiol. 44: 1561-1573.
Asmarani A. 2015. Kloning dan Ekspresi Gen Penyandi Asil Homoserin Lakton Laktonase dari Bacillus cereus INT1c dan Bacillus thuringiensis SGT3g [tesis]. Bogor (ID). Institut Pertanian Bogor.
Ban H, Chai X, Lin Y, Zhou Y, Peng D, Zhou Y, Zou Y, Yu Z, Sun M. 2009. Transgenic Amorphophallus konjac expressing synthesized acyl-homoserine lactonase (aiiA) gene exhibit enhanced resistance to soft rot disease. Plant Cell Reports. 28: 1847-1855.
Bradford MM. 1976. A Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72:248-254.
Barnard AML, Bowden SD, Burr T, Coulthurst SJ, Monson RE, Salmond GPC. 2007. Quorum sensing, virulence and secondary metabolite production in plant soft-rotting bacteria. Phil Trans R Soc B. 362:1165-1183.
Cao Y, He S, Zhou Z, Zhang M, Mao W, Zhang H, Yao B. 2012. Orally administered thermostable N-acyl homoserine lactonase from Bacillus sp. -strain AI96 attenuates Aeromonas Hydrophyla inspection in Zebrafish. Appl Environ Microbiol. 78: 1899-1908.
Ceprin A, Beury-Cirou A, Barbey C, Farmer C, Helias V, Jean-Francois B, Faure D, Latour X. 2012. N-acyl homoserine lactones in diverse Pectobacterium and Dickeya plant pathogens: Diversity, abundance, and involvement in virulence. Sensors. 12:3484-3497.
25 reduce Aeromonas hydrophyla mortality in aquaculture. Microb Cell Factories. 39: 1-10.
Chen F, Gao Y, Chen X, Yu Z, Li X. 2013. Quorum quenching enzymes and their application in degrading signal molecules to block quorum sensing-dependent infection. Int J Mol Sci. 14:17477-17500.
Choudhary S, Dannert CS. 2010. Application of quorum sensing in biotechnology. Appl Microbiol Biotechnol. 86: 1267-1279.
Czajkowski R, Jafra S. 2009. Quenching of acyl-homoserine lactone dependent quorum sensing by enzymatic disruption of signal molecules. Acta Biochimica Polonica. 5: 1-16.
Dong YH, Xu JL, Li XC, Zhang LH. 2000. aiiA, a novel enzyme inactivates acyl-homoserine-lactone quorum-sensing signal and attenuates the virulence of Erwinia carotovora. Proc Natl Acad Sci. 97: 3526-3531.
Dong YH, Wang LH, Xu JL, Zhang HB, Zhang XF, Zhang LH. 2001. Quenching quorum-sensing-dependent bacterial infection by an N-acyl homoserine lactonase. Nature. 411: 813-817.
Dong YH, Gusti AR, Zhang Q, Xu JL, Zhang LH. 2002. Identification of quorum-quenching N-acyl homoserine lactones from Bacillus species. Appl Environ Microbiol. 68: 1754-1759.
Dong YH, Zhang XF, Xu JL, Zhang LH. 2004. Insecticidal Bacillus thuringiensis silences Erwinia carotovora virulence by a new form of microbial antagonism, signal interference. Appl Environ Microbiol. 70:954-960. Dong YH, Wang LH, Zhang LH. 2007. Quorum-quenching microbial infections:
mechanisms and implications. Phil Trans R Soc B. 362:1201-1211.
Emmert EAB, Handelsman J. 1999. Biocontrol of plant disease: a (Gram-) positive perspective. FEMS Microbiol Lett. 171:1-9.
Engebrecht J, Nealson K, Silverman M. 1983. Bacterial bioluminescence: Isolation and genetic analysis of functions from Vibrio fischeri. Cell. 32: 773-781.
Fitriyah D, Wahyudi AT, Rusmana I. 2014. Characterization of bacteria producing acyl homoserine lactone (AHL) lactonase from agricultural lands. Adv Environ Biol.9: 140-148.
Fravel DR. 1988. Role of antibiosis in the biocontrol of plant diseases. Ann Rev Phytopathol. 26: 75-91.
Fuqua WC, Winans SC. Greenberg EP. 1994. Quorum sensing in bacteria: the LuxR-LuxI family of cell density-responsive transcriptional regulators. J Bacteriol. 176: 269-275.
Ghani NA, Norizan SNM, Chan XY, Yin WF, Chan KG. 2014. Labrenzia sp. BM1: A quorum quenching bacterium that degrades N-acyl homoserine lactones via lactonase activity. Sensors. 14:11760-11769.
Hanzelka BL, Greenberg EP. 1996. Quorum sensing in Vibrio fischeri: Evidence that S-Adenosylmethionine is the amino acid substrate for autoinducers synthesis. J Bacteriol. 178: 5291-5294.
26
Kaplan HB, Greenberg EP. 1985. Diffusion of autoinduser is involved in regulation of the Vibrio fischeri luminescence system. J Bacteriol. 163: 1210-1214.
Liu H, Coulthurst SJ, Pritchard L, Hedley PE, Ravensdale M, Humphris S, Burr T, Takle G, Bruberg MB, Birch PRJ, et al. 2008. Quorum sensing coordinates brute force and stealth modes of infection in the plant pathogen Pectobacterium atrosepticum. Plos Pathogens 6: 1-11.
Lyon GJ, Novick RP. 2004. Peptide signaling in Staphylococcus aureus and other Gram-positive bacteria. Peptides. 25: 1389-1403.
Madigan MT, Martinko JM, Clark DP. 2011. Biology of Microorganisms 13th edition. San Fransisco (US). Pearson Education, Inc.
McClean KH, Winson MK, Fish L, Taylor A, Chhabra SR, Camara M, Daykin M, Lamb JH, Swift S, Bycroft BW, et al. 1997. Quorum sensing and Chormobacterium violaceum: exploitation of violacein production and inhibition for the detection of N-acylhomoserine lactones. Microbiology 143:3703-3711.
McMillan RT, Palmateer A, Vendrame W. 2007. Effect of rouging on Erwinia soft rot in commercial production with two Phalaenopsis plants per pot. Proc Fla Hort Soc. 120: 3553-355.
Mitchell JE. 1973. The mechanisms of biological control of plant diseases. Soil Biol Biochem. 5: 721-728.
Muharram A, Indrasti R, Hanudin. 2012. Occurrence of Dickeya dadantii the causal agent of bacterial soft rot on orchids in DKI Jakarta and west Java Indonesia. Crop Environ. 3: 37-44.
Mukherji R, Prabhune A. 2015. Enzyme purification and kinetic characterization of AHL-lactonase from Bacillus sp. RM1 a novel and otent quorum quencher isolated from Fenugreek root nodule rhizosphere. Int J Curr Microbiol App Sc. 4: 909-924.
Nakayama J, Cao Y, Horii T, Sakuda S, Akkermans ADL, Vos WM, Nagasawa H. 2001. Gelatinase biosynthesis-activating pheromone: a peptide lactone that mediates a quorum sensing in Enterococcus faecalis. Mol Microbiol. 41: 145-154.
Nasser W, Dorel C, Wawrzyniak J, Van Gijsegem F, Groleau MC, Deziel E, Reverchon S. 2013. Vfm a new quorum sensing system controls the virulence of Dickeya dadantii. Environ Microbiol. 15: 865-880.
Nealson KH, Hastings JW. 1979. Bacterial bioluminescence: Its control and ecological significance. Microbiol Rev. 43: 496-518.
Parent JG, Lacroix M, Page D, Vezina L. 1996. Identification of Erwinia carotovora from soft rot diseased plants by Random Amplified Polymorphic DNA (RAPD) Analysis. Plant Dis. 80: 494-499.
Park SY, Lee SJ, Oh TK, Oh JW, Koo BT, Yum DY, Lee JK. 2003. AhlD, an N-acylhomoserine lactonase in Arthrobacter sp., and predicted homologues in other bacteria. Microbiol. 149: 1541-1550.
Park SY, Hwang BJ, Shin MH, Kim JA, Kim HK, Lee JK. 2006. N-acylhomoserine lactonase-producing Rhodococcus spp. with different AHL-degrading activities. FEMS Microbiol Lett. 261: 102-108.
27 Sakr MM, Aboshanab KMA, Aboulwafa MM, Hassouna NAH. 2013. Characterization and complete sequence of lactonase enzyme from Bacillus weihenstephanensis isolate P65 with potential activity against acyl homoserine lactone signal molecules. Biomed Research Int. 2013:1-10.
Sakr MM, Aboulwafa MM, Aboshanab KMA, Hassouna NAH. 2014. Screening and preliminary characterization of quorum quenching acivities of soil
Bacillus isolates against acyl homoserine lactose of clinically isolate
Pseudomonas aeruginosa. Mal J Microbiol. 10:80-91.
Samson R, Legendre JB, Christen R, Fischer-Le Saux M, Achouk W, Gardan L. 2005. Transfer of Pectobacterium chrysanthemi (Burkholder et al. 1953) Brenner et al. 1973 and Brenneria paradisiaca to the genus Dickeya gen.. nov. as Dickeya chrysanthemi comb. nov. and Dickeya paradisiaca comb. nov. and delineation of four novel species, Dickeya dadantii sp. nov.,
Dickeya dianthicola sp. nov., Dickeya dieffenbachiae sp. nov. and Dickeya zeae sp. nov. Int J System Evol Microbiol. 55: 1415-1427.
Scopes RK. 1994. Protein Purification, Principles and Practice. Edisi Ke-3. New York (US): Springer-Verlag.
Seo MJ, Lee BS, Pyun YR, Park H. 2011. Isolation and characterization of
N-acylhomoserine lactonase from thermophilic bacterium, Geobacillus caldoxylosilyticus YS-8. Biosci Biotechnol Biochem. 75:1-7.
Stevens AM, Dolan KM, Greenberg EP. 1994. Synergistic binding of the Vibrio fischeri LuxR transcriptional activator domain and RNA polymerase to the
lux promoter region. Proc Natl Acad Sci. 91: 12619-12623.
Swift S, Karlyshev AV, Fish L, Durant EL, Winson MK, Chhabra SR, Williams P, Macintyre S, Stewart GSAB. 1997. Quorum sensing in Aeromonas hydrophyla and Aeromonas salmonicida: Identification of the LuxRI homologs AhyRI and AsaRI and their cognate N-acylhomoserine lactone signal molecules. J Bacteriol. 179: 5271-5281.
Tang K, Su Y, Brackman G, Cui F, Zhang Y, Shi X, Coenye T, Zhang XH. 2015. MomL, a novel marine-derived N-acyl homoserine lactonase from
Muricauda olearia. Appl Environ Microbiol. 81:774-782.
Visick KL, Foster J, Doino J, McFall-Ngai M, Ruby EG. 2000. Vobrio fischeri lux genes play an important role in colonization and development of the host light organ. J Bacteriol. 182: 4578-4586.
Wang LH, Weng LX, Dong YH, Zhang LH. 2004. Specificity and enzyme kinetics of the quorum quenching N-acyl homoserine lactone lactonase (AHL lactonase). J Biol Chem. 279: 13645-13651.
Waters CM, Bassler BL. 2005. Quorum sensing: cell-to-cell communication in bacteria. Ann Rev Cell Dev. 21: 319-346.
28
Lampiran 1 Metode pengukuran kadar protein (Bradford 1976)
Pereaksi Blanko (µL) Standar (µL) Sampel (µL)
Standar protein (BSA)
- 50 -
Akuades 50 - -
Enzim - - 50
Reagenss Bradford 2500 2500 2500
Campuran dihomogenkan dengan vortex
Diamkan 10-20’
Absorbansi diukur pada λ 595 nm
Kurva Standar Bovine Serum Albumin
Konsentrasi BSA (mg/mL)
Absorbansi (595 nm)
U.1 U.2 Rata-rata
0 0 0 0
0.1 0.045 0.015 0.03
0.2 0.101 0.103 0.102
0.3 0.161 0.157 0.159
0.4 0.18 0.169 0.174
0.5 0.278 0.294 0.286
0.6 0.562 0.500 0.531
0.7 0.510 0.373 0.441
0.8 0.531 0.408 0.469
0.9 0.520 0.509 0.514
29
Lampiran 2 Sekuen gen 16S rRNA isolat bakteri patogen C1