PEMANFAATAN KITOSAN DARI CANGKANG UDANG
SEBAGAI MATRIKS PENYANGGA
PADA IMOBILISASI ENZIM PROTEASE
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh:
Venol Ferdiansyah
CO3400001
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PEMANFAATAN KITOSAN DARI CANGKANG UDANG
SEBAGAI MATRIKS PENYANGGA
PADA IMOBILISASI ENZIM PROTEASE
Oleh:
Venol Ferdiansyah
C03400001
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul : PEMANFAATAN KITOSAN DARI CANGKANG
UDANG SEBAGAI MATRIKS PENYANGGA PADA
IMOBILISASI ENZIM PROTEASE
Nama mahasiswa : Venol Ferdiansyah
NRP : C03400001
Menyetujui,
Pembimbing I Pembimbing II
Ir.Sri Purwaningsih, M.Si. Dra. Pipih Suptijah, MBA
NIP. 131 878 935 NIP. 131 476 638
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Dr. Ir. Kadarwan Soewardi
NIP. 131 805 031
KATA PENGANTAR
Puji Syukur penulis panjatkan kehadirat Allah SWT atas rahmat kesehatan
dan kesempatan yang dilimpahkan-Nya sehingga penulis dapat menyelesaikan
skripsi ini dengan baik. Doa keselamatan penulis panjatkan pula pada pembawa
risalah kebenaran, nabi Muhammad SAW beserta segenap keluarga, sahabat dan
seluruh manusia yang mengikuti ajarannya sampai akhir jaman.
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana
Perikanan dan Ilmu Kelautan pada Fakultas Perikanan dan Ilmu Kelautan, Institut
Pertanian Bogor. Skripsi ini merupakan studi tentang “Pemanfaatan Kitosan dari
Cangkang Udang sebagai Matriks Penyangga pada Imobilisasi Enzim Protease”
Pada kesempatan ini, penulis ingin mengucapkan terimakasih kepada:
1.
Ibu Ir. Sri Purwaningsih, M.Si dan Ibu Dra. Pipih Suptijah, MBA selaku
dosen pembimbing, yang telah memberikan arahan dan bimbingan selama
penulisan skripsi.
2.
Ibu Tati Nurhayati, S.Pi, MS yang telah banyak memberikan bimbingan dan
saran selama penelitian serta ibu Dra. Ella Salamah, M.Si atas segala
kritikan dan saran yang telah diberikan demi perbaikan skripsi ini.
3.
Papa, Mama, Bang Fanda, adik-adikku tercinta Harry, Arief, Fajrin, Danu
dan seluruh keluarga besarku di Padang atas doa, nasehat, kasih sayang,
semangat dan inspirasi kepada penulis.
4.
Pak Gandhi dan Ibu Emma selaku staf laboratorium biokimia dan
mikrobiologi Departemen Teknologi Hasil Perairan serta Mbak Lina staf
laboratorium Pengembangbiakan ikan dan Rekayasa genetika atas
kemudahan dan bantuan yang telah diberikan selama penulis melakukan
penelitian.
Penulis menyadari masih banyak kekurangan dalam penyusunan skripsi ini,
namun penulis berharap skripsi ini dapat memberikan manfaat dan sumbangan
yang berarti bagi dunia pendidikan.
Bogor, Oktober 2005
RIWAYAT HIDUP
Penulis bernama lengkap Venol Ferdiansyah.
Dilahirkan di Meulaboh pada tanggal 16 Januari 1982.
Penulis adalah putra dari pasangan Bapak Asli, M dan Ibu
Nurbaity, M. Anak kedua dari enam bersaudara. Penulis
menyelesaikan pendidikan dasar di SDN 10 Tapaktuan
pada tahun 1994, kemudian di kota yang sama pada tahun
1994 penulis melanjutkan pendidikan lanjutan pada SLTP
Negeri 2 Tapaktuan dan lulus pada tahun 1997.
Pada tahun yang sama, penulis melanjutkan pendidikan ke SMU Negeri 1
Tapaktuan dan lulus pada tahun 2000. Penulis diterima menjadi mahasiswa IPB
melalui Jalur Undangan Seleksi Masuk IPB (USMI) pada tahun 2000 dan diterima
di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama masa pendidikan di IPB, penulis pernah aktif menjadi asisten mata
kuliah Toksikologi dan Kimia Industri 2004-2005, menjadi Ketua Departemen
Humas Himpunan Mahasiswa Hasil Perikanan (HIMASILKAN) 2001-2002 dan
aktif sebagai panitia maupun peserta berbagai kegiatan seminar dan pelatihan.
Tahun 2005 penulis meraih prestasi poster terbaik dalam Lomba Program
Kreatifitas Mahasiswa bidang penelitian pada Pekan Ilmiah Nasional ke XVIII di
Padang.
Sebagai salah satu syarat untuk memperoleh gelar sarjana pada Departemen
Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut
Pertanian Bogor, penulis melakukan penelitian dengan judul Pemanfaatan Kitosan
dari Cangkang Udang sebagai Matriks Penyangga pada Imobilisasi Enzim
Protease di bawah bimbingan Ibu Ir. Sri Purwaningsih, M.Si dan Ibu
RINGKASAN
Venol Ferdiansyah. C03400001. Pemanfaatan Kitosan dari Cangkang Udang Sebagai Matriks Penyangga pada Imobilisasi Enzim Protease. Dibimbing oleh SRI PURWANINGSIH dan PIPIH SUPTIJAH.
Udang sebagai salah satu komoditas andalan sektor perikanan, setiap tahunnya mengalami peningkatan produksi. Proses pembekuan udang untuk ekspor, menghasilkan limbah sekitar 60-70%. Limbah cangkang udang tersebut dapat diolah menjadi kitosan. Kitosan dijadikan sebagai alternatif pilihan pengganti matriks penyangga pada imobilisasi enzim karena kitosan memiliki beberapa keunggulan dibandingkan matriks sintetik lainnya. Keunggulan kitosan yaitu, bentuk fisiknya dapat diubah (serpihan, manik-manik berpori, gel, fiber, membran), biodegradasi, murah, mudah penanganannya, memiliki afinitas yang tinggi pada protein dan non toksik
Tujuan penelitian ini adalah untuk memanfaatkan dan mengetahui kemampuan kitosan sebagai matriks penyangga pada imobilisasi enzim protease. Penelitian dilakukan dalam dua tahap yaitu penelitian pendahuluan berupa pembuatan kitosan dan mengukur mutu kitosan yang dihasilkan, meliputi kadar air, kadar abu, kadar nitrogen, viskositas dan derajat deasetilasi. Penelitian utama yaitu imobilisasi enzim protease menggunakan metode Stanley et al. (1975) dengan berbagai perlakuan kitosan (0 g; 0,1 g; 0,2 g; 0,3 g; 0,4 g; 0,5 g; 0,6 g; 0,7 g; 0,8 g; 0,9 g dan 1 g) dan dilanjutkan dengan uji kualitatif untuk mengukur aktivitas enzim dan aktivitas spesifik enzim imobil. Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan dua kali ulangan.
Kitosan yang dihasilkan pada penelitian telah memenuhi standar mutu kitosan yang ditetapkan oleh PROTAN Jepang. Parameter mutu kitosan meliputi, kadar abu sebesar 0%, kadar air 7%, kadar nitrogen 4,93%, derajat deasetilasi 95,3% dan viskositas sebesar 39,5%. Hasil analisis data terhadap aktivitas enzim papain imobil, diperoleh ada satu perlakuan kitosan yang memberi pengaruh berbeda nyata terhadap aktivitas enzim imobil yaitu perlakuan 1 g kitosan, sedangkan pada enzim bromelin imobil tidak ada perlakuan kitosan yang memberikan pengaruh berbeda nyata.
Aktivitas enzim papain imobil terkecil diperoleh pada perlakuan 0,6 g kitosan yaitu sebesar 0,0113 U/ml/menit dan aktivitas tertinggi sebesar 0,0190 U/ml/menit pada perlakuan 1 g kitosan. Aktivitas enzim bromelin imobil tertinggi juga diperoleh pada perlakuan 1 g kitosan yaitu 0,0108 U/ml/menit, sedangkan aktivitas terkecilnya diperoleh pada perlakuan 0,1 g kitosan dengan aktivitas 0,0011 U/ml/menit.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR... viii
DAFTAR LAMPIRAN ... ix
1. PENDAHULUAN 1.1. Latar Belakang ... 1
1.2. Tujuan Penelitian ... 3
1.3. Waktu dan Tempat ... 3
2. TINJAUAN PUSTAKA 2.1. Kitosan ... 4
2.1.1. Sumber kitin dan kitosan ... 4
2.1.2. Sifat fisiko kimia kitosan... 4
2.1.3. Ekstraksi kitosan... 6
2.1.4. Pemanfaatan kitosan... 8
2.2. Enzim ... 10
2.3. Enzim Proteolitik ... 11
2.3.1. Enzim papain ... 12
2.3.2. Enzim bromelin ... 15
2.4. Imobilisasi Enzim ... 18
2.4.1. Definisi, sejarah dan metode ... 18
2.4.2. Imobilisasi enzim dengan metode pengikatan silang ... 19
2.4.3. Kitosan sebagai matriks imobilisasi enzim... 21
3. METODOLOGI 3.1. Bahan dan Alat ... 23
3.2. Metode Penelitian ... 23
3.2.1. Pembuatan kitosan... 23
3.2.2. Imobilisasi enzim ... 24
3.3. Metode Analisis... 27
3.3.1. Kadar air (AOAC 1995) ... 27
3.3.2. Kadar abu (AOAC 1995)... 27
3.3.3. Kadar protein (AOAC 1995) ... 28
3.3.4. Derajat deasetilasi (diacu dalam Suptijah et al. 1992) ... 28
3.3.5. Viskositas (Sophanodora, Benjakula 1993)... 29
3.3.6. Penentuan aktivitas protease (Bergmeyer, Grassl 1983) ... 29
3.3.7. Analisis konsentrasi protein protease kasar (Bradford 1976) ... 31
3.4. Rancangan Percobaan... 31
3.4.1. Perlakuan ... 31
3.4.2. Rancangan ... 32
3.4.3. Hipotesis... 32
4.2. Imobilisasi Enzim ... 37
4.3. Aktivitas Enzim ... 39
4.3.1. Enzim papain... 39
4.3.2. Enzim bromelin ... 44
4.4. Aktivitas Spesifik Enzim ... 47
4.4.1. Enzim papain... 47
4.4.2. Enzim bromelin ... 49
5. KESIMPULAN DAN SARAN 5.1. Kesimpulan ... 53
5.2. Saran ... 54
DAFTAR PUSTAKA... 55
LAMPIRAN ... 61
DAFTAR TABEL
No Halaman 1. Syarat-syarat kitosan komersial... 62. Aplikasi kitin, kitosan dan turunannya dalam industri makanan ... 10
3. Penggolongan enzim secara internasional berdasarkan reaksi yang dikatalisisnya ... 11
4. Kandungan bromelin dalam tanaman nenas ... 16
5. Prosedur pengukuran aktivitas protease ... 30
6. Komposisi larutan standar metode Bradford ... 31
DAFTAR GAMBAR
No Halaman
1. Struktur molekul kitin ... 5
2. Struktur molekul kitosan ... 5
3. Reaksi demineralisasi ... 7
4. Struktur enzim papain ... 13
5. Diagram klasifikasi proses imobilisasi enzim ... 20
6. Skema proses ekstraksi kitosan ... 25
7. Skema imobilisasi enzim metode Stanley et al.(1975)... 26
8. Kitin dan kitosan dari cangkang udang ... 37
9. Enzim papain dan bromelin terimobil ... 38
10. Histogram hubungan perlakuan kitosan terhadap aktivitas enzim papain imobil ... 40
11. Mekanisme pembentukan ikatan silang... 41
13. Histogram hubungan perlakuan kitosan terhadap aktivitas spesifik enzim papain
imobil ... 48
14. Histogram hubungan perlakuan kitosan terhadap aktivitas spesifik enzim Bromelin imobil ... 51
DAFTAR LAMPIRAN
No Halaman 1. Pembuatan Pereaksi untuk Uji Aktivitas Protease... 612. Pembuatan Larutan Bradford ... 62
3. Skema Penentuan Konsentrasi Protein... 62
4. Data Pengukuran Aktivitas Protease ... 63
5. Data Pengukuran Protein Enzim ... 65
6. Kurva Kalibrasi untuk Pengujian Protein... 66
7. Data Analisis Hubungan Perlakuan Kitosan dengan Aktivitas Enzim. ... 67
8. Data Mentah Uji Mutu Kitosan ... 70
9. Spektrum Kitosan ... 71
10. Hasil Pengujian Aktivitas Protease Berbagai Perlakuan ... 72
11. Hasil Uji Normalitas dan Homogenitas... 73
1.
PENDAHULUAN
1.1. Latar Belakang
Udang merupakan salah satu komoditi penting perikanan yang pada saat ini mengalami peningkatan produksi terutama dari hasil budidaya. Udang sebagai komoditas andalan sektor perikanan umumnya diekspor dalam bentuk beku. Produksi udang ini setiap tahunnya mengalami peningkatan. Potensi udang di Indonesia rata-rata meningkat sebesar 7,4% per tahun dan sampai pada tahun 2001 produksi udang nasional mencapai 633.681 ton (Prasetyo 2003).
Proses pembekuan udang untuk ekspor, 60-70 persen dari berat udang menjadi limbah dan jika diasumsikan laju peningkatan produksi udang Indonesia per tahun tetap, maka pada tahun 2005 potensi udang diperkirakan sebesar 821.250 ton dan dari produksi ini diperkirakan akan dihasilkan limbah udang sebesar 533.812 ton. Limbah tersebut berupa cangkang yang mudah sekali busuk sehingga dapat menimbulkan pencemaran lingkungan. Limbah udang ini juga bersifat bulky atau menyita ruangan, sehingga memerlukan tempat yang cukup luas dan tertutup penampungannya. Permasalahan limbah cangkang udang ini perlu mendapat perhatian yang serius, sehingga diharapkan tidak sampai menimbulkan dampak yang negatif bagi lingkungan (Prasetyo 2003).
Pemanfaatan limbah cangkang udang saat ini hanya terbatas untuk pakan ternak saja. Salah satu cara pemanfaatan cangkang udang bernilai ekonomis adalah mengubah cangkang udang menjadi zat kitin-kitosan. Cangkang udang mengandung zat kitin sebesar 40-60% (Angka, Suhartono 2000). Kitin dan kitosan ini mempunyai struktur kimia yang unik sehingga telah banyak diaplikasikan pada berbagai bidang. Kitin dan kitosan telah diaplikasikan pada berbagai bidang industri seperti industri farmasi, industri pangan, pertanian, tekstil, membran, bioteknologi, kosmetik dan industri kertas.
Kitosan merupakan polimer polikationik turunan dari kitin yang diperoleh melalui proses deasetilasi dengan menggunakan alkali kuat. Knorr (1982) menyatakan bahwa kitosan adalah polimer dari 2-deoksi 2-amino glukosa yaitu kitin yang terdeasetilasi. Kitosan memiliki gugus asetil yang sangat rendah bila dibandingkan dengan kitin. Gugus asetil yang rendah ini akan semakin meningkatkan interaksi antar ion dan ikatan hidrogen dari kitosan. Menurut Shahidi et al. (1999) kitosan juga memiliki 3 (tiga) tipe gugus fungsi yang reaktif, yaitu sebuah gugus amino, gugus hidroksil primer dan gugus sekunder pada posisi C-2, C-3 dan C-6 secara berurutan.
Salah satu bidang yang selalu menarik untuk diteliti adalah aplikasi kitosan pada bidang bioteknologi. Anonim (2004) menyatakan bahwa kitosan telah digunakan dalam pemisahan protein, kromatografi, pelindung sel, imobilisasi enzim dan sel, serta elektroda glukosa. Penggunaan kitin sebagai matriks penyangga pada imobilisasi enzim telah banyak dikaji oleh kalangan ilmuwan dibandingkan dengan kitosan.
enzim dapat digunakan secara berkesinambungan, reaksi dapat dikendalikan serta nilai ekonomis yang dapat diperoleh (Frense et al. 1996 diacu dalam Pereira 2003). Berbagai macam metode imobilisasi enzim dapat digunakan, tergantung perbedaan sudut komplesitas dan efisiensi (Malcata et al. 1990 diacu dalam Pereira 2003)
Salah satu metode imobilisasi enzim adalah dengan pengikatan silang (crosslinked) menggunakan matriks penyangga. Matriks yang digunakan selama ini seperti silika dan polimer sintetik mempunyai harga yang mahal, oleh karena itu banyak dicari alternatif pengganti matriks yang murah seperti CaCO3, kitin dan kitosan. Alternatif matriks pengganti yang banyak dipilih
oleh para ilmuwan dan pengusaha adalah kitin dan kitosan, hal ini karena kitin jumlahnya lebih melimpah dan keberadaannya terbesar kedua di alam setelah selulosa (Krajewska 1991 diacu dalam Pereira 2003). Kitin dan kitosan memiliki beberapa keunggulan jika digunakan sebagai matriks imobil, antara lain: bentuk fisiknya dapat diubah (serpihan, manik-manik berpori, gel, fiber, membran), biodegradasi, murah, mudah penanganannya, memiliki afinitas yang tinggi pada protein dan non toksik (Felse, Panda 1999 diacu dalam Pereira 2003). Stanley et al. (1975) menambahkan bahwa kitin dan kitosan mempunyai struktur yang keras, inert, dan densitas kamba (bulky) yang rendah.
Kelebihan kitosan inilah yang dapat digunakan sebagai matriks penyangga pada imobilisasi enzim. Kitosan diharapkan dapat mengikat enzim bebas dan mampu menjaga stabilitas aktivitas katalitik enzim dengan lebih baik. Enzim protease merupakan salah satu enzim yang telah banyak diaplikasikan dalam industri pangan sebagai katalisator. Proses imobilisasi enzim ini diharapkan memberikan beberapa keuntungan penggunaan enzim terimobil dibandingkan dengan enzim bebasnya.
Berdasarkan hal tersebut maka pemanfaatan kitosan dari cangkang udang sebagai matriks penyangga pada imobilisasi enzim diharapkan dapat meningkatkan nilai ekonomis limbah dan mampu menghasilkan enzim terimobilisasi dengan karakteristik yang lebih baik.
1.2. Tujuan Penelitian
Tujuan dilakukannya penelitian ini adalah untuk memanfaatkan dan mengetahui kemampuan kitosan sebagai matriks penyangga pada imobilisasi enzim protease melalui metode pengikatan silang (cross-linking).
1.3. Waktu dan Tempat
2. TINJAUAN PUSTAKA
2.1. Kitosan
Kitosan adalah poliglukosamin yang dihasilkan dari kitin dengan proses
deasetilasi menggunakan suhu tinggi dan alkali berkonsentrasi tinggi
(Ockerman 1992). Kitosan yang disebut juga dengan ß-1,4-2
amino-2-dioksi-D-glukosa merupakan turunan kitin melalui proses deasetilasi (Bough 1975).
2.1.1. Sumber kitin dan kitosan
Kitin dan kitosan merupakan senyawa golongan karbohidrat yang dihasilkan
dari limbah laut, khususnya golongan udang, kepiting, ketam dan kerang
(Angka, Suhartono 2000). Kitin adalah substan organik kedua yang paling
banyak ditemukan di alam setelah selulosa, terdapat dalam berbagai spesies
binatang (Suptijah
et al
. 1992). Menurut Knorr (1982), kitin merupakan
komponen organik penting penyusun kerangka krustacea, insekta dan moluska
serta penyusun dinding sel mikroba.
Knorr (1984) menyebutkan bahwa kitin dapat ditemukan pada limbah udang
dan rajungan masing-masing sebesar 14-27% dan 13-15% (berat kering)
tergantung dari jenis spesies dan faktor lain. Penelitian lain menyatakan,
kandungan kitin pada limbah udang dan rajungan sebesar 20-30%
(Johnson, Peniston 1982).
Menurut Knorr (1984), bahwa dari sekian banyak sumber kitosan hanya
kulit udang dan rajungan yang sudah dimanfaatkan secara komersial.
Purwatiningsih (1992) menyatakan bahwa kulit udang lebih mudah didapatkan
dibanding sumber kitin yang lain dan tersedia dalam jumlah yang besar sebagai
hasil industri pengolahan udang yang banyak terdapat di Indonesia.
2.1.2. Sifat fisiko kimia kitosan
Kitosan merupakan produk deasetilasi kitin dengan menggunakan basa kuat.
Menurut Knorr (1982), kitosan adalah polimer dari 2-deoksi-2-amino glukosa
yaitu kitin yang terdeasetilasi yang mempunyai ikatan (1-4)
â
. Besarnya gugus
asetil yang hilang dari polimer kitin akan semakin memperkuat interaksi antar ion
dan ikatan hidrogen dari kitosan. Struktur molekul kitin dan kitosan dapat dilihat
NH2 OH OH H H H H H O CH2OH NH2 OH OH H H H H H O CH2OH O NH2COCH3 OH OH H H H H H O CH2OH NH2COCH3 OH OH H H H H H O CH2OH O
Gambar 1. Struktur molekul kitin (Sandford, Hutchings 1987)
Gambar 2. Struktur molekul kitosan (Sandford, Hutchings 1987)
Kitosan berbentuk spesifik dan mengandung gugus amino dalam rantai
karbonnya. Gugus amino ini menyebabkan kitosan bermuatan positif yang
berlawanan dengan polisakarida lainnya (Ornum 1992). Kitosan merupakan
polielektrolit netral pada pH asam. Bahan-bahan seperti protein, anion
polisakarida dan asam nukleat yang bermuatan negatif akan berinteraksi kuat
dengan kitosan membentuk ion netral (Sandford 1989). Shahidi
et al.
(1999)
menyatakan kitosan memiliki 3 (tiga) tipe gugus fungsi yang reaktif, yaitu sebuah
gugus amino, gugus hidroksil primer dan gugus sekunder pada posisi C-2, C-3
dan C-6 secara berurutan.
Menurut Knorr (1982) bobot molekul kitosan sekitar 1,036 x 10
5Dalton.
Berat molekul kitosan tergantung dari degradasi yang terjadi pada saat proses
pembuatan kitosan. Kumar (2000) menambahkan bahwa sifat dan kelarutan
kitosan dipengaruhi oleh bobot molekul dan derajat deasetilasi yang beragam
Kitosan dapat larut dalam beberapa larutan asam organik tetapi tidak larut
dalam pelarut organik. Kitosan tidak larut dalam air, larutan basa kuat dan larutan
yang mengandung konsentrasi ion hidrogen di atas pH 6,5, tetapi kitosan dapat
larut dalam asam hidroklorat dan asam nitrat pada konsentrasi 0,15-1,1% dan
tidak larut pada konsentrasi asam 10%. Kitosan juga tidak larut dalam asam
sulfur tetapi larut sebagian pada asam ortofosfat dengan konsentrasi 0,5%
(Ornum 1992). Menurut Knorr (1982) pelarut kitosan yang umum digunakan
adalah asam asetat dengan konsentrasi 1-2%.
Mutu kitosan yang diperdagangkan secara komersial tergantung pada
penggunaannya, misalnya pada penanganan limbah diperlukan kitosan dengan
kemurnian yang rendah, sedangkan jika untuk obat-obatan diperlukan kitosan
dengan kemurnian yang tinggi. Mutu kitosan tersebut dipengaruhi oleh beberapa
parameter yaitu kadar air, kadar abu, kelarutan, derajat deastilasi, viskositas dan
bobot molekul (Bastaman 1989
diacu dalam
Suptijah
et al.
1992).
Karakteristik kitosan berdasarkan standar mutu yang ditetapkan
Protan
Laboratories
dapat dilihat pada Tabel 1.
Tabel 1. Syarat- syarat kitosan komersial
Parameter
Nilai
Ukuran partikel
Kadar air
Kadar abu
Warna larutan
Derajat deasetilasi
Viskositas (Cp)
1.
rendah
2.
sedang
3.
tinggi
4.
ekstra tinggi
Serpihan sampai serbuk
< 10 %
< 2 %
jernih
> 70%
< 200 cps
200 - 799 cps
800 - 2000 cps
> 2000 cps
Sumber : Protan Laboratories diacu dalam Suptijah et al. (1992)
2.1.3.
Ekstraksi kitosan
Kitosan diperoleh dari kitin melalui proses deasetilasi. Ekstraksi kitin dari
kulit udang dilakukan dua tahap, yaitu tahap pemisahan mineral (demineralisasi)
dan
pemisahan protein (deproteinasi) yang dilanjutkan dengan pemutihan
a. Proses demineralisasi
Demineralisasi yaitu penghilangan mineral yang terdapat dalam bahan yang
mengandung kitin. Penghilangkan mineral tersebut terutama kandungan
kalsiumnya dilakukan dengan penambahan asam seperti asam klorida (HCl), asam
sulfat (H
2SO
4), dan asam sulfit (H
2SO
3) (Karmas 1982). Proses demineralisasi
berdasarkan pada metode Suptijah
et al.
(1992) adalah dengan menggunakan HCl
1,5 N dengan perbandingan 1:7 (b/v) untuk bahan dan larutan HCl dengan
pemanasan pada suhu 90
oC selama 1 jam.
Pemisahan mineral bertujuan untuk menghilangkan senyawa organik yang
ada pada limbah tersebut. Besarnya kandungan mineral yang dihilangkan, maka
akan menghasilkan kitin yang semakin baik. Kulit udang umumnya mengandung
30-50 % mineral (Angka, Suhartono 2000). Mineral utama yang terdapat pada
udang yaitu kalsium dalam bentuk CaCO
3dan sedikit Ca
3(PO4)
2.Senyawa
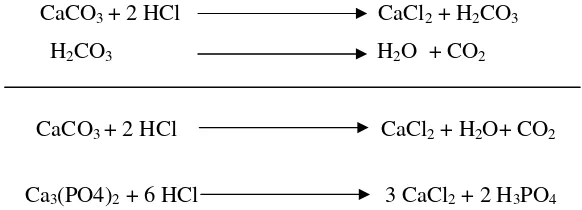
kalsium akan bereaksi dengan HCl menghasilkan kalsium klorida, asam karbonat
dan asam fosfat yang larut dalam air pada saat demineralisasi. Reaksinya dapat
dilihat pada Gambar 3.
CaCO
3+ 2 HCl CaCl
2+ H
2CO
3H
2CO
3H
2O + CO
2CaCO
3+ 2 HCl CaCl
2+ H
2O+ CO
2Ca
3(PO4)
2+ 6 HCl 3 CaCl
2+ 2 H
3PO
4Gambar 3. Reaksi demineralisasi (Bastaman 1989)
Proses demineralisasi menyebabkan terjadinya reaksi kimia antara asam
klorida (HCl) dengan kalsium (CaCO
3dan Ca
3(PO4)
2), menghasilkan kalsium
klorida yang akan mengendap apabila pH ditingkatkan dan mudah dipisahkan
dengan proses penyaringan.
Proses demineralisasi akan berlangsung sempurna dengan mengusahakan
agar konsentrasi asam yang digunakan serendah mungkin dan disertai pengadukan
panas yang homogen sehingga asam yang digunakan tersebut dapat bereaksi
sempurna dengan bahan baku yang digunakan (Karmas 1982).
b. Proses deproteinasi
Proses deproteinasi bertujuan menghilangkan protein dari limbah udang
tersebut. Protein ini dapat mencapai 30-40% berat bahan organik kulit udang
(Angka, Suhartono 2000). Keefektifan proses tersebut bergantung dari kekuatan
larutan basa dan tingginya suhu yang digunakan. Penggunaan larutan NaOH 3,5%
dengan pemanasan 90
oC selama 1 jam dapat dilakukan sebagai alternatif
deproteinasi dengan perbandingan limbah udang yang kering dan larutan sebesar
1:10 (Suptijah
et al
. 1992). Selama proses, larutan alkali akan masuk ke
celah-celah limbah udang untuk memutuskan ikatan antara kitin dan protein.
Purwatiningsih (1992) menyatakan bahwa Ion Na
+akan mengikat ujung rantai
protein menjadi Na-proteinat yang selanjutnya dapat dipisahkan kembali dengan
menurunkan pH karena terjadi pengendapan natrium. Produk akhir dari proses
demineralisasi dan deproteinasi tersebut adalah kitin.
c. Proses deasetilasi
Pembuatan kitosan yaitu dengan cara penghilangan gugus asetil (-COCH
3)
(deasetilasi) dari kitin yang dilakukan dengan menggunakan larutan NaOH pekat
(50%) dengan perbandingan 1:20 selama 1 jam pada suhu 120-140
oC
(Suptijah
et al.
1992). Suhu yang tinggi (140
oC) dan konsentrasi NaOH yang
tinggi (50%) berkaitan dengan ikatan kuat antara atom nitrogen pada gugus amin
dengan gugus asetil. Banyaknya gugus asetil yang hilang dari polimer kitin, maka
akan semakin meningkatkan interaksi antar ion dan ikatan hidrogen dari kitosan
(Ornum 1992). Terjadi reaksi antara NaOH dengan gugus N-asetil pada kitin
(rantai C-2) yang akan menghasilkan Na-asetat dan substitusi gugus asetil dengan
gugus amina (-NH
2) selama berlangsungnya proses ini.
2.1.4. Pemanfaatan kitosan
Menurut Knorr (1982), kitosan mempunyai gugus amino bebas sebagai
polikationik, pengkelat dan pembentuk dispersi dalam larutan asam asetat.
Karakteristik kitosan sebagai polielektrolit dapat digunakan untuk bahan
Kitin dan kitosan telah dimanfaatkan dalam berbagai keperluan industri
seperti industri kertas dan tekstil sebagai zat aditif, industri pembungkus makanan
berupa film khusus, industri metalurgi sebagai absorban untuk ion-ion metal,
industri kulit untuk perekat, photografi, industri cat sebagai koagulan, pensuspensi
dan flokulasi, serta industri makanan sebagai aditif dan penghasil protein sel
tunggal (Suptijah
et al.
1992).
Kitosan digunakan sebagai pelapis benih yang akan ditanam sehingga
terhindar dari jamur tanah pada bidang pertanian. Kitosan juga diaplikasikan pada
bidang peternakan sebagai pemisah (
separation
) spermatozoa yang mobil
(bergerak) dan non mobil (tidak bergerak) dari babi jantan dan lembu jantan serta
dapat digunakan sebagai bahan tambahan ransum bagi ayam petelur dan dapat
meningkatkan produksi sampai 8,8% (Brzeski 1987).
Kitosan dalam bidang pangan dapat digunakan sebagai pengental atau
pembentuk gel yang baik, pengikat, penstabil dan pembentuk tekstur karena
adanya kandungan senyawa komplek
Microcrystalin Chitin
(MCC). Kitosan juga
digunakan sebagai bahan penyaring yang efektif terhadap zat yang tidak
diinginkan seperti tanin pada kopi (Brzeski 1987) dan menurut Knorr (1984)
kitosan juga dapat digunakan untuk memurnikan anggur, bir dan juice.
Kitosan juga telah dimanfaatkan dalam berbagai bidang kesehatan antara
lain sebagai bahan anti kolesterol, bahan pembungkus kapsul karena memiliki
kemampuan untuk melepas obat ke dalam tubuh secara terkontrol dan sebagai
bahan anti tumor karena kitosan mempunyai sifat antibakterial dan antikoagulan
dalam darah serta dapat menggumpalkan sel-sel leukemia. Kitosan juga dapat
digunakan sebagai pengganti tulang rawan, pengganti saluran darah (baik arteri
maupun vena) serta untuk bahan pembuat membran ginjal buatan (Brzeski 1987).
Hasil penelitian Anonim (2003) melaporkan bahwa kitosan telah diaplikasikan
sebagai benang operasi. Menurut Begin dan Marie (1999), kitosan juga dapat
digunakan sebagai bahan dasar pengemas berupa film. Aplikasi kitin dan kitosan
Tabel 2. Aplikasi kitin, kitosan dan turunannya dalam industri makanan
Aplikasi
Contoh
Antimikroba
Bakterisidal, fungisidal, pengukur kontaminasi jamur
pada komoditi pertanian.
Industri
Edible Film
Mengatur perpindahan uap antara makanan dan
lingkungan sekitar, menahan pelepasan zat-zat
antimikroba, menahan pelepasan zat-zat antioksidan,
menahan pelepasan zat-zat nutrisi, flavor dan obat,
mereduksi tekanan parsial oksigen, mengontrol
pernafasan, pengatur suhu; menahan kegiatan browning
enzimatis pada buah, dan mengembalikan tekanan
osmosis membran.
Bahan Aditif
Mempertahankan flavor alami, bahan pengontrol
pengemulsi,
food nimetic
, bahan pengental, stabilizer dan
penstabil warna.
Sifat Nutrisi
Sebagai serat diet, penurun kolesterol, persediaan dan
tambahan makanan ikan, mereduksi penyerapan lemak,
memproduksi protein sel tunggal, bahan antigrastitis
(radang lambung), dan sebagai bahan makanan bayi.
Pengolahan Limbah
Makanan Padat
Flokulan dan pemecah agar.
Pemurnian Air
Memisahkan ion-ion logam, pestisida dan penjernihan.
Sumber : Shahidi et al. (1999)
2.2. Enzim
Kata enzim diperkenalkan oleh Kuhne pada tahun 1878 untuk suatu zat
yang bekerja pada suatu substrat. Kata enzim berasal dari bahasa Yunani yang
berarti di dalam sel. Kuhne menjelaskan bahwa enzim bukan suatu sel tetapi
terdapat di dalam sel. Enzim sulit didefinisikan secara tepat, definisi yang
dikemukakan adalah enzim merupakan protein yang mempunyai daya katalistik
karena aktivitas spesifiknya (Dixon, Webb 1979).
Enzim secara biokimia merupakan suatu kelompok protein yang berperan
sangat penting dalam proses aktivitas biologis. Tugasnya sebagai katalisator di
dalam sel dan bersifat khas. Kerja enzim pada umumnya mempercepat reaksi
dengan cara menurunkan energi aktivasi (Lehninger 1993).
Klasifikasi enzim didasarkan pada jenis reaksi yang dikatalisnya, seperti
macam reaksi yang dikatalis dan akhiran -ase (Muchtadi
et al
. 1992). Adapun
keenam golongan enzim tersebut dan reaksi yang dikatalisisnya dapat dilihat pada
Tabel 3.
Tabel 3. Penggolongan enzim secara internasional berdasarkan reaksi yang
dikatalisisnya
No Kelas utama
Jenis reaksi yang dikatalisis
1. Oksidoreduktase Pemindahan elektron
2. Transferase
Reaksi pemindahan gugus fungsional
3. Hidrolase
Reaksi hidrolisis (pemindahan gugus fungsional ke
air)
4. Liase
Penambahan gugus ke ikatan ganda atau sebaliknya
5. Isomerase
Pemindahan gugus di dalam molekul menghasilkan
isomer
6. Ligase
Pembentukan ikatan C-C, C-S, C-O dan C-N oleh
reaksi kondensasi yang berkaitan dengan penguraian
ATP
Sumber: Lehninger (1993)
2.3. Enzim Proteolitik
Enzim proteolitik adalah enzim yang dapat menguraikan atau memecahkan
protein. Protease termasuk ke dalam kelas utama enzim hidrolase yang
mengkatalisis reaksi-reaksi hidrolisis (Dixon, Webb 1979)
Enzim proteolitik atau protease mempunyai dua pengertian, yaitu proteinase
yang mengkatalisis hidrolisis molekul protein menjadi fragmen-fragmen yang
lebih sederhana, dan peptidase yang menghidrolisis fragmen polipeptida menjadi
asam amino. Enzim proteolitik yang berasal dari mikroorganisme adalah protease
yang mengandung proteinase dan peptidase (Frazier, Westhoff 1983).
Berdasarkan sumbernya, enzim proteolitik diklasifikasikan kedalam enzim
yang berasal dari hewan, tumbuhan dan mikroorganisme (Suhartono 1989).
Enzim proteolitik berdasarkan sisi aktifnya diklasifikasikan menjadi empat
golongan (Hartley 1960
diacu dalam
Winarno 1995) yaitu:
1)
Proteolitik serin, mempunyai residu pada sisi aktifnya dan secara spesifik
dihambat oleh DIFP (diisopropilfosfofluridat) dan turunan organofosforis
lainnya. Enzim ini semuanya bersifat endopeptidase. Enzim yang termasuk
2)
Proteolitik thiol atau disebut proteolitik sulfhidril, keaktifannya tergantung
pada residu SH pada sisi aktifnya. Enzim ini dihambat oleh senyawa
oksidator dan logam berat. Enzim yang termasuk golongan ini adalah papain,
bromelin dan fisin.
3)
Proteolitik metal, yaitu enzim yang keaktifannya tergantung pada adanya
metal, biasanya terdapat hubungan stokiometrik, yaitu 1 mol metal per mol
enzim. Metal tersebut dapat terdiri dari Mg, Zn, Co, Fe, Hg, Ni dan lain
sebagainya. Enzim ini dihambat oleh
Ethylene Diamini Tetra Acetic Acid
(EDTA) yang dapat mengkelat logam sehingga keaktifan enzim akan
berkurang. Contoh enzim yang termasuk golongan ini adalah
karboksipeptidase A dan beberapa aminopeptidase.
4)
Proteolitik asam, yaitu enzim yang pada lokasi aktifnya terdapat dua gugus
karboksil. Keaktifannya dapat dihambat oleh p-bromofenasilibromida. Enzim
yang termasuk golongan ini adalah pepsin, renin dan protease kapang. Enzim
ini hanya aktif pada pH rendah.
2.3.1. Enzim papain
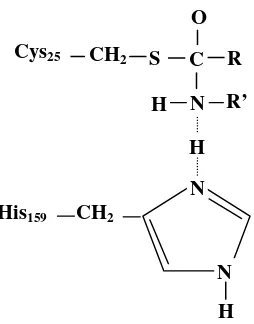
Papain (EC.3.4.22.2) merupakan enzim proteolitik hasil isolasi dari
penyadapan getah buah pepaya (
Carica papaya
L.). Getah pepaya mengandung
sebanyak 10% papain, 45% kimopapain dan lisozim sebesar 20%
(Winarno 1995).
Berdasarkan sifat-sifat kimianya, papain digolongkan sebagai protease
sulfhidril (Muchtadi
et al
. 1992). Papain tersusun atas 212 residu asam amino
dengan sistein-25 tempat gugus aktif thiol (-SH) essensial, yang membentuk
sebuah rantai peptida tunggal dengan bobot molekul 21.000 - 23.000 g/mol.
Rantai ikatan tersebut tersusun atas arginin, lisin, leusin, dan glisin
(Harrison
et al.
1997). Sisi aktif yang terdapat di dalam molekul papain terdiri
atas gugus histidin dan sistein yang selama katalisis berlangsung, sisi aktif
tersebut berfungsi sebagai ion zwitter (Wong 1989
diacu dalam
Budiman 2003).
Struktur enzim papain dapat dilihat pada Gambar 4.
Berdasarkan klasifikasi
the international union of biochemistry
, papain
termasuk enzim hidrolase yang mengkatalisis reaksi hidrolisis suatu substrat
hidrolisis yang berlangsung pada sisi-sisi aktif papain. Pemisahan gugus-gugus
amida yang terdapat di dalam protein tersebut berlangsung melalui pemutusan
ikatan peptida (Wong 1989
diacu dalam
Budiman 2003). Enzim ini mempunyai
aktivitas katalitik sebagai proteinase dan sanggup menghidrolisis peptida.
Berdasarkan sifat-sifat kimia dari lokasi aktif, papain termasuk protease sulfhidril,
karena bagian aktif papain adalah gugus –SH (Reed 1975).
Gambar 4. Struktur enzim papain (Anonim 2003)
Aktivitas enzim papain cukup spesifik karena papain hanya dapat
mengkatalisis proses hidrolisis dengan baik pada kondisi pH serta suhu dalam
kisaran waktu tertentu. Papain mempunyai pH optimum 7,2 pada substrat BAEE
(benzoil arginil etil ester), pH 6,5 pada substrat kasein, pH 7,0 pada albumin dan
pH 5,0 pada gelatin (Muchtadi
et al.
1992). Suhu optimal papain sendiri adalah
50-60
oC.
Papain relatif tahan terhadap suhu, bila dibandingkan dengan enzim
proteolitik lainnya seperti bromelin dan lisin (Winarno 1995). Papain biasanya
aktif pada nilai pH antara 5,0 hingga 7,0 dengan titik isoelektrik 8,75. Keaktifan
papain berkurang hingga 20% apabila dipanaskan pada suhu 75
oC selama
30 menit dan 50% pada pemanasan menggunakan suhu 76
oC hingga 85
oC
selama 56 menit pada pH 7,0. Papain akan cepat menjadi inaktif pada suhu tinggi
dengan pH asam (<4) dan pada pH yang sangat asam (<2) inaktivasi terjadi
sangat cepat walaupun suhu 25
oC. Aktivitas papain masih dapat dipertahankan
apabila enzim tersebut distabilkan dalam bentuk kristal melalui penambahan
HN
N
H CH2
His159
C25 CH2
O
Cys25 S C R
senyawa EDTA, sistein dan dimerkaptopropanol dengan kondisi penyimpanan
pada suhu 5
oC selama 6 - 12 bulan (EDC 1999
diacu dalam
Budiman 2003)
Papain mengandung 212 asam amino dalam suatu rantai polipeptida dan
berikatan silang dengan tiga jembatan disulfida (Kalk 1975). Berbagai jenis asam
amino ikut menyusun struktur protein papain kecuali metionin. Tidak terdapatnya
metionin dalam rantai polipeptida diduga karena komponen sulfur sebagian besar
berada dalam bentuk asam amino sistein (Glazer, Smith 1971
diacu dalam
Muchtadi
et al.
1992). Papain memiliki 6 gugus sulfhidril, tetapi hanya dua
gugus sulfhidril yang aktif. Gugus suflhidril ini mengandung unsur sulfur sekitar
1,2%.
Papain biasanya diperdagangkan dalam bentuk kristal kasar, amorf dan
granula, berwarna putih sampai coklat muda, ada juga yang putih keabuan dan
bersifat higroskopis. Kristal yang masih baru berbentuk jarum dan setelah
disimpan beberapa bulan pada suhu rendah akan berbentuk hexagonal.
Penyimpanan harus dilindungi dari udara lembab dan disimpan pada tempat yang
dingin (Arief 1975
diacu dalam
Ary 2002). Papain kasar mempunyai sifat yang
agak sukar larut dalam air, mudah terurai dan tidak larut dalam beberapa pelarut
organik seperti alkohol, aseton, eter dan beberapa pelarut lemak lainnya
(Daryono, Muhidin 1974).
Papain sebagai enzim proteolitik dapat digunakan untuk menghasilkan
beberapa produk. Papain banyak digunakan di dalam industri pangan sebagai
pengempuk daging, konsentrat protein dan hidrolisat protein. Papain juga dapat
digunakan untuk menurunkan viskositas bahan. Anonim (2003) menyatakan
papain dimanfaatkan untuk mencegah deformasi luka pada kornea mata dan
pembersih lensa mata dalam bidang kesehatan. Papain berfungsi juga untuk
menggumpalkan susu didalam industri pembuatan keju, membuang sisa-sisa serat
kain pada industri detergen serta bahan aktif dalam pembuatan krim pembersih
kulit (Suhartono 1991). Keefektifan enzim papain ini dipengaruhi oleh :
1)
Konsentrasi enzim
Enzim papain mempunyai kemampuan untuk melunakkan daging dan
menghidrolisis ikatan peptida dari protein. Tingginya konsentrasi enzim yang
(Girindra 1993). Konsentrasi enzim yang berlebihan akan menyebabkan proses
tersebut menjadi tidak efisien. Derajat kemurnian enzim papain yang tinggi,
mempunyai hubungan linear dengan jumlah enzim dan taraf aktivitas
(Lehninger 1993).
2) Suhu
Reaksi yang dikatalisis oleh enzim sangat peka terhadap suhu. Enzim
sebagai protein akan mengalami denaturasi pada suhu yang tinggi sehingga
mengakibatkan daya kerja enzim tersebut menurun (Girindra 1993). Enzim akan
semakin aktif apabila suhu dinaikkan (sampai suhu optimumnya), tetapi bila suhu
tersebut terus dinaikkan maka laju kerusakan enzim akan melampaui reaksi
katalisis enzim sehingga menyebabkan reaksi tidak efisien (Winarno 1987).
3) pH
Enzim menunjukkan aktivitas maksimum pada suatu kisaran pH yang
disebut pH optimum (Winarno 1995). Setiap enzim memiliki selang pH tertentu
untuk dapat melakukan aktivitasnya. Enzim akan mengalami denaturasi dan
mengakibatkan kehilangan aktivitasnya apabila enzim bekerja di bawah atau di
atas selang pH tersebut. Derajat keasaman (pH) sangat berpengaruh terhadap
aktivitas enzim, karena sifat ionik gugus karboksil dan gugus amino mudah
dipengaruhi oleh pH. pH ini juga menyebabkan daerah katalitik dan konformasi
enzim menjadi berubah (Lehninger 1993).
4) Pengaruh Inhibitor (faktor penghambat)
Inhibitor adalah suatu senyawa atau gugus senyawa yang menghambat
aktivtas enzim. Enzim sangat peka terhadap senyawa atau gugus senyawa yang
diikatnya (Girindra 1993). Enzim papain sangat sensitif terhadap logam. Adanya
logam akan merusak gugus sulfhidril yang merupakan gugus katalitik enzim
papain. Keaktifan enzim papain akan hilang bila direaksikan dengan oksidator.
2.3.2. Enzim bromelin
Enzim bromelin (EC.3.4.22.4) merupakan enzim yang diperoleh dari
tanaman famili Bromeliceae. Enzim bromelin banyak digunakan dalam proses
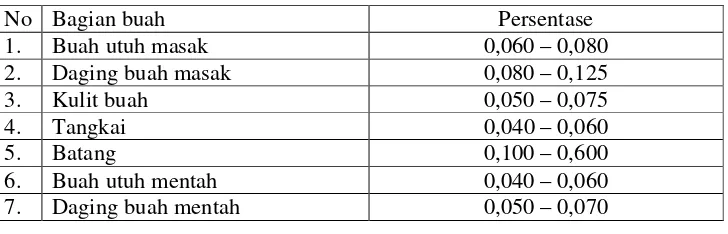
Kandungan bromelin dalam tanaman nanas terletak pada buah, tangkai,
kulit, daun dan batang (hati), dengan jumlah yang berbeda-beda pada setiap
tempatnya, seperti terlihat pada Tabel 4.
Tabel 4. Kandungan bromelin dalam tanaman nanas
No Bagian buah
Persentase
1. Buah utuh masak
0,060 – 0,080
2. Daging buah masak
0,080 – 0,125
3. Kulit buah
0,050 – 0,075
4. Tangkai
0,040 – 0,060
5. Batang
0,100 – 0,600
6. Buah utuh mentah
0,040 – 0,060
7. Daging buah mentah
0,050 – 0,070
Sumber: Omar et al. (1978) diacu dalam Pohan (2002)
Enzim bromelin dapat diektraksi dari batang nanas yang disebut
stem nanas
atau dapat pula diekstraksi dari buah yang disebut
bromelin bras
(
Fruit bromelin
)
dengan nomor klasifikasi EC.3.42.4 dan EC.3.42.5. Kedua enzim ini diperoleh
dengan cara mengekstraksi buah nanas (Indrawati
et al.
1983). Bromelin batang
dapat dipisahkan atas lima komponen proteolitik aktif yang berbeda dalam
komposisi asam aminonya, dimana gugus asam amino ujung adalah valin sedang
bagian ujung dari gugus karboksi adalah glysin.
Enzim bromelin merupakan protein sederhana yang mempunyai berat
molekul 31.000 dengan titik isoelektrik pada pH 4,6 dan pH optimumnya adalah 8
(Indrawati
et al.
1983). Bromelin yang terdapat dibatang nenas memiliki bobot
molekul 28.000 dengan titik isoelektrik 9,6 dan pH optimum 5-6
(Suhartono 1991). Bromelin batang termasuk golongan glikoprotein yaitu
mengandung satu bagian oligosakarida pada tiap molekul yang berikatan secara
kovalen dengan rantai polipeptida enzim tersebut.
Konsentrasi dan aktifitas enzim bromelin selama tingkat pertumbuhan dan
pematangan buah ternyata berbeda-beda. Buah nanas yang matang hijau ternyata
memiliki kadar protease yang lebih kecil daripada yang matang sempurna
(Ball
et al
.
diacu dalam
Gortner, Singeleton 1965). Buah nanas yang matang,
kadar proteasenya lebih rendah daripada buah yang matang sempurna
Keaktifan bromelin dipengaruhi oleh kematangan buah, pH suhu
lingkungan, konsentrasi enzim dan lama proses, aktivitas air (a
w) serta adanya
inhibitor. Aktivitas bromelin akan menurun bila buah nanas semakin matang.
Hal tersebut berhubungan dengan semakin banyaknya asam yang terbentuk
sehingga menurunkan pH bahan menjadi 3,0-3,5. Penurunan pH sampai dibawah
titik isoelektrik pada buah yang matang akan menyebabkan enzim hilang karena
selain adanya denaturasi, pH juga mempengaruhi sifat ionik gugus karboksil dan
gugus asam amino.
Aktivitas enzim bromelin optimum pada pH 6,5 dimana enzim ini
mempunyai konformasi yang mantap dan juga mempunyai aktivitas yang
maksimum. Derajat keasaman yang terlalu tinggi atau rendah akan menyebabkan
terjadinya denaturasi protein sehingga menurunkan kecepatan katalisisnya. Enzim
yang bermuatan negatif (E-) akan terprotonisasi dan muatan negatifnya hilang
pada pH rendah. Reaksi yang terjadi adalah E
-+ H
+EH. pH tinggi
menyebabkan gugus fungsional SH
+akan terionisasi dan muatan positifnya
hilang, reaksinya adalah SH
+S + H
+. Rendahnya konsentrasi efektif E
+dan SH
+ini menyebabkan kecepatan katalisis enzim akan menurun
(Harper 1973
diacu dalam
Indrawati
et al.
1983).
Suhu optimum untuk enzim bromelin adalah 50
oC, di atas dan di bawah
suhu tersebut keaktifan enzim menjadi lebih rendah. Energi kinetik molekul
substrat dan enzim cukup rendah pada suhu yang berada di bawah optimal,
sehingga kemungkinan substrat dan enzim untuk bereaksi kecil serta kecepatan
reaksi menjadi rendah (Tokkong 1979
diacu dalam
Indrawati
et al.
1983).
Suhu optimum suatu enzim sangat dipengaruhi oleh kemurnian enzim
tersebut (Harrow, Mazur 1971
diacu dalam
Heryani 1998). Menurut
Susanto (1987) aktivitas enzim bromelin terimobilisasi yang dihasilkan memiliki
suhu, pH dan waktu inkubasi yang sama dengan enzim bebas yaitu suhu 55
oC,
pH 7,2 dan waktu inkubasi 10 menit.
Kecepatan katalisis akan semakin meningkat dengan meningkatnya
konsentrasi enzim. Tingginya konsentrasi enzim, akan mempengaruhi banyaknya
substrat yang ditransformasi. Lamanya waktu kerja enzim juga mempengaruhi
reaksi. Kokro (1987) menyatakan aktivitas enzim akan semakin tinggi dengan
semakin tingginya nilai a
w. Kerja enzim bromelin juga dipengaruhi oleh adanya
inhibitor seperti senyawa oksidator dan ion logam berat yang akan mengikat grup
thiolnya (Muchtadi
et al
. 1992).
2.4. Imobilisasi Enzim
Enzim merupakan biokatalis yang mempunyai aktivitas spesifik dan bekerja
secara efisien. Penggunaan enzim lebih menguntungkan dibandingkan dengan
sel bebas. Enzim tidak memerlukan media yang kompleks, tidak membutuhkan
aerasi dan kondisi steril serta lebih sedikit limbah yang dihasilkan. Enzim juga
memiliki beberapa kelemahan seperti sulitnya ekstraksi enzim dan sulitnya
pemisahan enzim dari produk. Upaya untuk mengatasi hal tersebut adalah dengan
mengembangkan teknik imobilisasi enzim.
2.4.1. Definisi, sejarah dan metode
Enzim terimobilisasi didefinisikan sebagai enzim yang secara spesifik
ditempatkan dalam suatu ruang tertentu dengan tetap memiliki aktivitas
katalitiknya dan dapat digunakan secara berulang atau secara terus-menerus
(Chibata 1978). Imobilisasi enzim adalah usaha untuk memisahkan antara enzim
dengan produk selama reaksi dengan menggunakan sistem dua fase, satu fase
mengandung enzim dan fase lainnya mengandung produk, sehingga tidak terjadi
saling kontaminasi antara enzim dan produk (Chaplin, Buckle 1990).
Imobilisasi merupakan suatu modifikasi untuk meniru keadaan asalnya di
alam yang diyakini berada dalam keadaan terikat pada membran atau
partikel-partikel dalam sel. Tujuan utama mengimobilisasi enzim adalah untuk
mempekerjakan enzim yang dapat memberikan proses katalitik yang
berkesinambungan (Zaborsky 1973).
Teknik imobilisasi enzim pertama kali dilakukan oleh Nelson dan Griffin
pada tahun 1916 (Muchtadi
et al.
1992,
Chibata 1978) Nelson dan Griffin
mengimobilisasi enzim interfase dari khamir dengan cara adsorpsi pada arang
aktif (Chibata 1978).
Percobaan pertama untuk mengimobilisasi enzim dengan tujuan untuk
memperbaiki sifat-sifat enzim dilakukan oleh Grubhover dan Scheleith pada tahun
ribonuklease dengan menggunakan
diazotized
poliaminopolystirene resin
(Chibata 1978).
Penggunaan enzim terimobilisasi akan memberikan beberapa keuntungan
(Messing 1975
diacu dalam
Smith 1990) yaitu:
1)
enzim dapat digunakan secara berulang;
2)
proses dapat dihentikan secara cepat dengan mengeluarkan enzim dari
larutan substrat;
3)
kestabilan enzim dapat diperbaiki;
4)
larutan hasil proses tidak terkontaminasi oleh enzim;
5)
dapat digunakan untuk tujuan analisis yang melibatkan enzim.
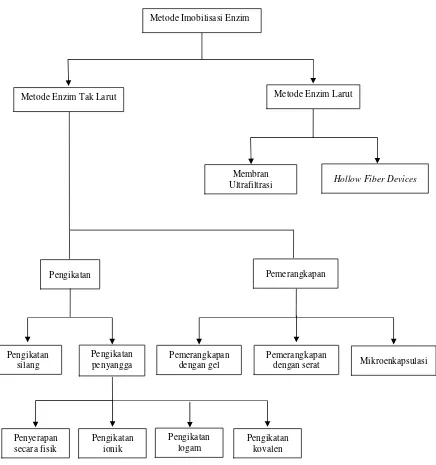
Imobilisasi enzim dapat dilakukan secara fisik, kimia atau kombinasi
keduanya. Metode imobilisasi terbagi atas tiga kelompok yaitu metode
pengikatan pada penyangga (
carrier binding
), metode pengikatan silang
(
crosslinking
) dan metode pemerangkapan (
entrapping
) (Chibata 1978).
Klasifikasi imobilisasi berdasarkan proses disajikan pada Gambar 5
(Gemeiner 1992).
Metode pengikatan pada penyangga mengikat enzim pada matriks tidak
larut dalam air. Imobilisasi enzim dengan cara ini harus memperhatikan matriks
yang digunakan serta metode pengikatannya seperti adsorpsi fisik, gaya
elektrostatik serta ikatan kovalen. Metode pengikatan silang didasarkan pada
pembentukan ikatan intermolekuler/kovalen antar molekul enzim dengan
menggunakan pereaksi multi atau bifungsional sehingga menghasilkan jaringan
protein tiga dimensi yang stabil dan tidak larut dalam air. Metode pemerangkapan
didasarkan pada penempatan enzim dalam kisi dari suatu polimer atau dalam
membran semi permiabel seperti mikrokapsul (Chibata 1978).
2.4.2. Imobilisasi enzim dengan metode pengikatan silang
Metode pengikatan silang didasarkan pada pembentukan ikatan kovalen
antara molekul-molekul enzim oleh pereaksi bi- atau multifungsional sehingga
menghasilkan jaringan protein tiga dimensi yang stabil dan tidak larut dalam air.
Gugus fungsional yang ikut dalam reaksi ini adalah
á
-amino pada asam amino
terminal, gugus
º
-amino dari lisin, gugus fenolik dari tirosin, gugus sulfhidril dari
Gambar 5. Diagram klasifikasi proses imobilisasi enzim (Gemeiner 1992)
Pereaksi yang digunakan dalam metode ini harus mempunyai dua gugus
fungsional yang sama atau dua atau lebih gugus fungsional yang berbeda
(pereaksi heterobi- atau heteromultifungsional) (Kennedy 1985). Pereaksi
bifungsional yang telah banyak digunakan untuk mengimobilisasi enzim adalah
glutaraldehid (Chibata 1978).
Metode Enzim Tak LarutMetode Imobilisasi Enzim
Metode Enzim Larut
Membran
Ultrafiltrasi Hollow Fiber Devices
Pengikatan Pemerangkapan
Pengikatan silang
Pengikatan penyangga
Pemerangkapan dengan gel
Pemerangkapan
dengan serat Mikroenkapsulasi
Penyerapan secara fisik
Pengikatan kovalen Pengikatan
logam Pengikatan
Pereaksi glutaraldehid pada mulanya digunakan sebagai intermolekuler
’
crosslingking agent
’ untuk menghasilkan jaringan protein tiga dimensi yang
stabil dan bersifat tidak larut air. Glutaraldehid lebih banyak digunakan sebagai
pereaksi bifungsional untuk mengimobilisasi enzim pada saat ini
(Goldstein, Mannecke 1976).
Glutaraldehid dapat bereaksi dengan polimer yang mengandung gugus
amino primer menghasilkan matriks yang mempunyai gugus fungsi aldehid
(Goldstein, Manecke 1976). Glutaraldehid bereaksi dengan gugus amino dari
protein matriks kitin sehingga terjadi ikatan diantara keduanya
(Finn 1967
diacu dalam
Heryani 1998).
Konsentrasi glutaraldehid yang digunakan harus dipertimbangkan karena
sifat glutaraldehid, seperti pereaksi aldehid lainnya dapat menghambat aktifitas
enzim karena dapat bereaksi dengan gugus sulfhidril pada sisi aktif enzim
(Goldstein, Mannecke 1976). Matriks yang sering digunakan adalah kitin atau
kitosan karena keduanya mempunyai gugus fungsional sehingga dapat bereaksi
dengan glutaraldehid.
2.4.3. Kitosan sebagai matriks imobilisasi enzim
Kitin mempunyai struktur yang berpori demikian juga dengan kitosan.
Keuntungan dari matriks berpori adalah luasnya permukaan ikatan, serta
perlindungan enzim dalam porinya terhadap kerusakan fisik oleh lingkungan
(Messing 1975
diacu dalam
Smith 1990). Ukuran pori matriks juga perlu
diperhatikan. Ukuran pori yang kecil dapat menyulitkan masuknya enzim yang
berukuran besar serta kemungkinan hambatan difusi substrat makro molekul
cukup besar untuk bereaksi dengan enzim, sehingga akan berakibat pada turunnya
aktivitas enzim.
Kitin dan kitosan memiliki beberapa keunggulan jika digunakan sebagai
matriks penyangga yaitu, antara lain: bentuk fisiknya dapat diubah (serpihan,
manik-manik berpori, gel, fiber, membran), biodegradasi, murah, mudah
penanganannya, memiliki afinitas yang tinggi pada protein dan non toksik
Kitosan mempunyai gugus fungsional yaitu gugus amino sehingga
mempunyai derajat reaksi kimia yang tinggi (Johnson, Peniston 1982). Kitosan
akan bermuatan positif dalam larutan karena adanya gugus amin yang dapat
mengikat ion positif (Muzzarelli 1985). Menurut Mckay
et al
. (1987) kitosan
tidak larut dalam air, larutan alkali pada pH di atas 6,5 dan pelarut organik, tetapi
larut dengan cepat dalam asam organik encer seperti asam formiat, asam asetat,
asam sitrat dan asam mineral lain kecuali sulfur.
Menurut Knorr (1984) kitosan mampu mengikat air dan minyak karena
mempunyai gugus polar dan non polar. Jumlah air yang dapat diikat kitosan
sekitar 325-440 (w/w). Kemampuan pengikatan tersebut yang membuat kitosan
3.
METODOLOGI
3.1. Bahan dan Alat
Bahan yang digunakan dalam penelitian ini terdiri dari enzim papain dan
enzim bromelin komersial, glutaraldehid (Sigma) serta kulit udang sebagai bahan
baku pembuatan kitosan yang diperoleh dari daerah Muara Baru, Jakarta Utara.
Bahan kimia yang digunakan pada pembuatan matriks kitosan adalah NaOH, HCl
dan akuades. Bahan kimia yang digunakan untuk uji aktivitas protease antara lain
larutan NaOH 1 M, buffer borat (0,01 M) pH 8, kasein (2% b/v), larutan tirosin
standar 5 mM, larutan TCA (0,1 M), Na
2CO
3(0,4 M), folin ciocalteau.
Bahan-bahan kimia yang digunakan untuk uji protein protease kasar antara lain Bovine
Serum Albumin (BSA) sebagai standar protein,
coomasie brilliant blue
G-250,
asam fosfat 85% dan etanol 95%.
Alat yang digunakan selama penelitian terdiri dari botol film, tabung reaksi,
erlenmeyer, gelas piala,
beaker glass
, inkubator, spektrofotometer, sentrifuse,
pipet mikro, pipet volumetrik, bulp,
alumunium foil
, timbangan analitik,
vortex
,
autoklaf, refrigerator dan kompor elektrik.
3.2. Metode Penelitian
Penelitian dilakukan dalam dua tahap yaitu penelitian pendahuluan dan
dilanjutkan dengan penelitian utama. Penelitian pendahuluan bertujuan membuat
matriks kitosan dari cangkang udang dan dilanjutkan dengan mengukur kadar
proksimat, derajat deasetilasi dan viskositas dari kitosan yang dihasilkan.
Penelitian utama adalah proses imobilisasi enzim protease dengan menggunakan
matriks kitosan berdasarkan metode Stanley
et al
. (1975) yang kemudian
dilanjutkan dengan menguji aktivitas protease, uji protein dari enzim bebas dan
enzim terimobil.
3.2.1. Pembuatan kitosan
Proses pembuatan kitosan secara garis besar terdiri dari tiga tahap yaitu
demineralisasi, deproteinasi dan deasetilasi. Pertama-tama limbah udang dicuci,
langsung dikeringkan dan kemudian dihancurkan. Proses berikutnya adalah
demineralisasi dengan melarutkan cangkang udang ke dalam HCl 1 N dengan
dengan menggunakan akuades hingga pH netral. Proses deproteinasi dilakukan
dengan menambahkan NaOH 3,5 N dengan perbandingan 1:10 pada suhu 90
oC
selama 1 jam, kemudian dilakukan pencucian menggunakan akuades dan disaring.
Proses ini menghasilkan kitin. Kitin yang diperoleh, kemudian dideasetilasi
menggunakan NaOH 50 % dengan perbandingan 1:20 pada suhu 140
oC selama
2 jam, kemudian dipisahkan dan dicuci dengan akuades hingga pH netral,
selanjutnya dijemur dan akhirnya terbentuklah kitosan dalam bentuk serbuk.
Diagram proses pembuatan kitosan dapat dilihat pada Gambar 6.
3.2.2. Imobilisasi enzim
Imobilisasi Enzim dilakukan berdasarkan metode Stanley
et al.
(1975)
dengan modifikasi buffer. Imobilisasi enzim dilakukan dengan menggunakan
pereaksi glutaraldehid dan 2 jenis enzim protease serta matriks kitosan dengan
berbagai perlakuan.
Imobilisasi enzim dilakukan dengan cara mencampurkan 2 ml larutan enzim
(b/v) pada berbagai perlakuan kitosan yang telah ditambahkan 2 ml buffer borat
pH 8. Campuran diaduk biasa dan disimpan selama 15 menit pada suhu 4-5
oC.
Campuran kemudian ditambahkan glutaraldehid konsentrasi 1% hingga total
konsentrasi dalam campuran adalah 0,1%. Campuran dibiarkan pada suhu ruang
selama 30 menit, untuk selanjutnya disimpan pada refrigerator selama 18 jam.
Enzim terimobil selanjutnya dicuci dengan akuades selama 30 menit dan
kemudian direndam dalam larutan NaCl 3 M selama 2 jam, selanjutnya dicuci
kembali dengan akuades selama 30 menit. Proses pencucian terakhir ini akan
menghasilkan enzim terimobil semi basah. Enzim terimobil dapat dikeringkan
Gambar 6. Skema proses ekstraksi kitosan (Suptijah
et al.
1992)
PencucianPengeringan
Penghancuran dengan blender
Penyaringan dan pencucian
Demineralisasi 90 oC, 1 jam HCl 1 N 1:7
Bahan baku
Penyaringan dan pencucian
Pencucian
Pengeringan Deproteinasi
NaOH 3,5% 1:10 90 oC, 1 jam
Deasetilasi (N-asetil-kitin+NaOH)
NaOH 50% 1:20 120-140 oC, 1 jam
Gambar 7. Skema imobilisasi enzim metode Stanley
et al
. (1975)
Pengadukan biasa sampai rata
Penyimpanan dalam refrigerator selama 15 menit
Glutaraldehid 1% ditambahkan hingga total
konsentrasi dalam campuran 0,1%
Dibiarkan pada suhu kamar selama 30 menit
Penyimpanan dalam refrigerator selama 15 jam
Pencucian dengan akuades selama 30 menit
Pencucian dengan akuades selama 30 menit
Perendaman dalam larutan NaCl 3 M selama 2 jam
Pengeringan dengan freeze dryer selama 8, 5 jam
Enzim terimobilisasi kering
Enzim terimobilisasi semi basah
2 ml larutan enzim + 2 ml larutan buffer borat pH 83.3. Metode Analisis
Kitosan yang telah dihasilkan pada penelitian pendahuluan diuji mutunya.
Uji mutu kitosan ini meliputi uji kadar air, kadar abu, kadar nitrogen, derajat
deasetilasi dan uji viskositas. Kitosan yang telah diuji mutunya kemudian
diaplikasikan sebagai matriks penyangga proses imobilisasi enzim pada
penelitian utama. Enzim terimobil dianalisis secara kualitatif yang meliputi uji
aktivitas enzim dan uji protein untuk menentukan aktivitas spesifik enzim
terimobil.
3.3.1.
Kadar air (AOAC 1995)
Penentuan kadar air didasarkan pada perbedaan berat contoh sebelum dan
sesudah dikeringkan. Cawan porselin kosong dikeringkan pada suhu 105
oC
selama 1 jam, kemudian cawan tersebut didinginkan dalam desikator dan
ditimbang beratnya (A gram). Cawan yang telah ditimbang tersebut diisi
dengan sampel sebanyak 5 gram dan ditimbang beratnya (B gram). Cawan yang
sudah berisi sampel tersebut dimasukkan ke dalam oven bersuhu 105
oC sampai
beratnya konstan. Kadar air dihitung berdasarkan persamaan:
Kadar air (%) =
(
B
-
A
)
×
100
%
contoh
berat
Keterangan : A = berat cawan + contoh kering (g)
B = berat cawan + contoh basah (g)
3.3.2.
Kadar abu (AOAC 1995)
Cawan dibersihkan dan dikeringkan dalam oven selama 30 menit pada suhu
105
oC, lalu didinginkan dalam desikator dan ditimbang. Sampel sebanyak 1 g
ditimbang lalu dimasukkan ke dalam cawan, kemudian dibakar diatas kompor
listrik sampai tidak berasap lagi dan selanjutnya dimasukkan dalam tanur
pengabuan dengan suhu 650
oC selama 5 jam. Cawan didinginkan dalam desikator
dan kemudian ditimbang. Kadar abu ditentukan dengan rumus:
Kadar abu (%) =
berat
abu
×
100
%
sampel
3.3.3.
Kadar protein (AOAC 1995)
Sampel 0,5 g dimasukkan ke dalam labu kjeldahl 50 ml, lalu ditambahkan
kjeltab dan 2,5 ml H
2SO
4pekat. Contoh didestruksi sampai cairan berwarna hijau
bening. Campuran tersebut dibiarkan sampai dingin, kemudian dipindahkan ke
alat destilasi. Labu Kjeldal yang telah digunakan dicuci dengan akuades. Air
cucian tersebut dimasukkan ke dalam alat destilasi dan ditambahkan 10 ml NaOH
pekat sampai berwarna coklat kehitaman, lalu didestilasi. Hasil destilasi
ditampung dalam erlenmeyer 125 ml yang berisi 5 ml H
3BO
3dan indikator
metilen blue, lalu dititrasi dengan larutan HCl 0,02 N sampai berubah menjadi
warna pink. Larutan blanko dianalisis seperti contoh. Kadar protein dihitung
dengan persamaan di bawah ini:
Kadar Nitrogen (%) =
(
−
)
×
×
14
,
007
×
100
%
sampel
mg
HCl
N
blanko
ml
HCl
ml
3.3.4.
Derajat deasetilasi (
diacu dalam
Suptijah
et al.
1992)
Kitosan sebanyak 2 gram dilarutkan dalam 200 ml asam asetat 2%.
Larutan tersebut dikeringkan dalam suhu kamar di atas “
glass plate
”, kemudian
ditambahkan sodium hidroksida 1 N untuk menetralkan asam asetat yang telah
ditambahkan sebelumnya dan dicuci dengan air bersih. Derajat deasetilasi
diukur dengan spektrofotometer inframerah IR-408.
Pengukuran derajat
deasetilasi berdasarkan kurva yang tergambar oleh spektrofotometer. Puncak
tertinggi (P
o) dan puncak terendah (P) dicatat dan diukur dengan garis dasar
yang dipilih. Nisbah absorbansi dihitung dengan rumus:
A =
P
Po
Log
dimana : P
o= Jarak antara garis dasar dengan garis singgung antara dua
puncak tertinggi dengan panjang gelombang 1.655 cm
-1atau 3.450 cm
-'
P = Jarak antara garis dasar dengan lembah terendah dengan
panjang gelombang 1.655 cm
-1atau 3.450 cm
-1Perbandingan absorbansi pada 1.655 cm
-1dengan absorbansi 3.450 cm
-1pada puncak yang berhubungan dengan nilai persen N-deasetilasi dapat dihitung
dengan rumus:
% N-deasetilasi =
×
×
100
%
33
.
1
1
450 . 3 655 . 1A
A
3.3.5. Viskositas (Sophanodora, Benjakula 1993)
Kitosan sebanyak 2 gram dilarutkan dalam 200 ml asam asetat 2 %.
Larutan kitosan ini kemudian diukur nilai viskositasnya dengan menggunakan
viskosimeter rotari model BM. Rotari yang digunakan adalah rotari no 2 dengan
menggunakan kecepatan putaran 60 rpm.
Nilai viskositas dinyatakan dalam satuan centipoise (cps). Viskositas
dihitung dangan menggunakan rumus :
Viskositas (cP) = Nilai terukur
x
(Konstanta R-2, V 60 rpm)
Nilai konstanta rotari no 2 pada putaran 60 rpm adalah 5.
3.3.6.
Penentuan aktivitas protease (Bergmeyer, Grassl 1983)
Menurut prosedur pengukuran aktivitas enzim ini, pereaksi trikloroasetat
(TCA) digunakan untuk mengendapkan sisa protein substrat yang tidak sempat
terurai. Pereaksi folin digunakan untuk memberikan warna yang dapat dipantau
dengan spektrofotometer sinar tampak.
Prosedur pengukuran aktivitas enzim protease ini secara berurutan terdiri
atas tiga tahap. Setiap sampel memerlukan tabung reaksi masing-masing untuk
blanko, standar dan sampel. Pembuatan pereaksi yang digunakan pada uji ini
dapat dilihat pada Lampiran 1.
Tahap pertama, ke dalam ketiga tabung reaksi masing-masing dimasukkan
0,25 ml buffer borat 0,01 M dengan pH 8, substrat kasein 0,25 ml. 0,05 ml
campuran enzim dimasukkan ke dalam tabung sampel, sedangkan pada tabung
standar dimasukkan 0,05 ml larutan standar (5mmol/l). Akuades sebanyak 0,05
ml dimasukkan sebagai larutan blanko. Ketiga tabung selanjutnya diinkubasi pada
suhu 50
oC (suhu optimum bromelin) atau 55
oC (suhu optimum papain) selama
10 menit.
Tahap kedua dilakukan setelah inkubasi pertama. Setiap tabung ditambah
campuran enzim sebanyak 0,05 ml, sedangkan pada tabung sampel ditambah
akuades 0,05 ml. Keseluruhan tabung reaksi diinkubasi kembali selama 50
oC
selama 10 menit yang selanjutnya disentrifuse pada 5000 rpm selama 10 menit.
Tahap ketiga dilakukan dengan mengambil 0,375 ml filtrat hasil sentrifuse.
Masing-masing ditambah dengan 1,25 ml larutan Na
2CO
3(0,4 M) dan folin
0,25 ml. Tabung sampel, standar dan blanko diinkubasi kembali pada 50
oC
selama 20 menit, kemudian dilakukan pengukuran absorbansi pada panjang
gelombang 578 nm. Prosedur dapat dilihat pada Tabel 5. Pengukuran nilai
aktivitas enzim protease dapat dihitung dengan rumus sebagai berikut :
T
1
P
A
-A
A
-A
U
bl st bl sp×
×
=
Keterangan :
U = unit aktivitas dalam IU (Internasional Unit) per menit
A
sp= nilai absorbansi sampel
A
bl= nilai absorbansi blanko
A
st= nilai absorbansi standar (tirosin)
P = faktor pengenceran
[image:39.612.133.512.465.694.2]T = waktu inkubasi (menit)
Tabel 5. Prosedur pengukuran aktivitas protease
No
Pereaksi
Sampel
(ml)
Blanko
(ml)
Standar
(ml)
1
Bufer borat (0,01 M pH 8)
0,25
0,25
0,25
2
Substrat kasein 2% pH 8
0,25
0,25
0,25
3
Enzim (2 mmol/l)
0,05
-
-
4
Tirosin standar
-
-
0,05
5
Air suling
-
0,05
-
6
Inkubasi pada suhu 50
oC selama 10 menit
7
TCA (0,2 M)
0,5
0,5
0,5
8
Air suling
0,05
-
-
9
Enzim (2mmol/l)
-
0,05
0,05
10
Inkubasi pada suhu 50
oC selama 10 menit, sentrifuse 10000 rpm
11 Filtrat
0,375
0,375
0,375
12 Na
2CO
31,25
1,25
1,25
13 Pereaksi folin (1:2)
0,25
0,25
0,25
3.3.7.
Analisis konsentrasi pr