93 © Kimia ITS – HKI Jatim
Akta Kimindo Vol. 2 No. 2 April 2007: 93 – 98 AKTA KIMIA
INDONESIA
Pemakaian Kitosan Limbah Udang Windu sebagai Matriks Pendukung
pada Imobilisasi Papain
‡Sari Edi Cahyaningrum*, Rudiana Agustini dan Nuniek Herdyastuti Jurusan Kimia, FMIPA, Universitas Negeri Surabaya,
Gd. C-3, Kampus UNESA Ketintang, Surabaya.
ABSTRAK
Telah dilakukan imobilisasi papain (EC.3.4.22.2) pada kitosan dari limbah udang dengan metode adsorpsi dan metode carrier crossling menggunakan kation magnesium sebagai agen bifungsional. Proses adsorpsi magnesium pada kitosan dilakukan pada pH 7, dengan waktu interaksi 2 jam. Proses imobilisasi papain pada matriks kitosan dilakukan pada pH 7, konsentrasi papain 20 mg/mL dengan waktu interaksi 12 jam. Papain imobil menunjukkan karakteristik yang berbeda bila dibandingkan dengan papain yang tidak diimobilisasi. Stabilitas termal papain imobil relatif lebih tinggi bila dibanding papain bebas. Papain imobil mampu digunakan secara berulang sebanyak 6 kali.
Kata kunci : Kitosan, imobilisasi, papain ABSTRACT
Papain (EC.3.4.22.2) was immobilized on chitosan isolated from shell waste by adsorption and subsequent cross-linking method with magnesium bifungsional reagent. Adsorption of magnesium on chitosan was conducted at pH optimum 7 with contact time 2 hours. Immobilization of papain on chitosan matrix was carried out at pH 7, papain concentration 20 mg/ml and contact time 12 hours. Characteristics of immobilized papain were different from non immobilized papain. Thermal stability of immobilized papain was relatively higher than non immobilized papain. The immobilized papain can be used for six cycles.
Keywords : Chitosan, immobilization, papain.
PENDAHULUAN
Kemajuan bidang bioteknologi dan industri, memungkinkan dilakukannya berbagai upaya untuk memanfaatkan proses-proses enzimatis. Enzim mempunyai sifat yang potensial untuk dimanfaatkan, antara lain daya katalitiknya yang besar dan spesifitasnya terhadap substrat dari reaksi yang dikatalisisnya (Lehninger, 1999).
Pada industri yang menggunakan enzim tersebut, 59% enzim yang digunakan adalah kelompok protease, dimana salah satunya adalah papain. Papain dapat menghidrolisa ikatan peptida pada residu asam α-amino seperti tirosin, lisin, glutamin, histidin dan glisin. Papain merupakan protease sulfihidril, yang mempunyai residu sulfihidril (SH) pada situs aktifnya.
Pada proses dan analisa yang melibatkan enzim, umumnya menggunakan cara bath yaitu mereaksikan substrat dengan enzim yang sudah dilarutkan dalam air, sehingga enzim bercampur dengan substrat (Sarah, 2001; Agustini, 2001). Cara ini memiliki kelemahan karena enzim hanya digunakan sekali pakai. Secara teknis sangat sulit untuk memisahkan enzim dan produk dan mendapatkan kembali enzim yang aktif diakhir reaksi. Umumnya setelah reaksi selesai, enzim diinaktifkan dengan pemanasan, pengubahan pH, atau cara lain yang dapat menyebabkan enzim terdenaturasi (Chibata,1978).
Salah satu cara mengatasi kelemahan dalam penggunaan enzim tersebut adalah melalui imobilisasi enzim yaitu mengikatkan enzim pada bahan pendukung yang tidak larut air. Enzim dapat membentuk ikatan ionik, kovalen, ikatan silang atau terjebak pada bahan pendukung. Pada saat digunakan, enzim imobil dapat berfungsi sebagai katalis tanpa ikut terlarut ‡ Makalah ini disajikan pada Seminar Nasional Kimia VIII,
di Surabaya 8 Agustus 2006
* Corresponding author Phone : 8298761-; Fax :
dalam substrat (Darwis dan Sukara, 1990). Setelah proses selesai, enzim imobil dapat dipisahkan dari produk dan diperoleh kembali, sehingga enzim imobil dapat dipakai berulangkali Beberapa matriks pendukung yang dapat digunakan pada proses imobilisasi enzim antara lain bentonit, sheparose, gelatin dan kitosan. Pada penelitian ini digunakan kitosan sebagai matriks pendukung pada imobilisasi papain.
Kitosan merupakan hasil deasetilasi kitin, sedangkan kitin dapat diisolasi dari serangga dan jamur, kerangka dan cangkang hewan golongan Artropoda, Molusca, Nematoda, dan
Crustacea. Pada penelitian ini kitin diisolasi dari
cangkang udang. Pada industri pengolahan udang disamping menghasilkan produk utama berupa udang bersih juga menghasilkan limbah, berupa cangkang udang yang sangat potensial sebagai pencemar lingkungan. Limbah udang dapat mencapai 30% sampai 40% dari berat udang. Limbah cangkang udang ini masih mengandung protein, karbohidrat dan mineral. Jika dibuang begitu saja, akan mengalami denaturasi protein dan hidrolisis secara alami. Proses tersebut menghasilkan bau busuk, meningkatkan BOD air, sehingga menurunkan kualitas air (Indra, 1994 ). Sebagai matriks pendukung pada proses imobilisasi enzim, kitosan mempunyai beberapa keuntungan karena mudah didapat, prosedur isolasinya mudah, tidak beracun dan tidak membahayakan. Kitosan mempunyai beberapa sifat yang menguntungkan antara lain
hydrophilicity, biocompatibility, biodegradability,
sifat anti bakteri dan mempunyai afinitas yang besar terhadap enzim (Sun, 1994). Kitosan merupakan polimer alam yang dapat berikatan secara crosslink apabila ditambahkan cosslinked
agent misalnya glutaraldehid, glioksal atau kation
Cu2+ ( Sarah, 2001). Proses imobilisasi enzim
dengan kitosan yang telah mengalami crosslinked disebut sebagai imobilisasi tipe pengikatan carrier
–crosslinked. Pada penelitian ini cosslinked agent
yang digunakan adalah kation magnesium(II). ALAT DAN BAHAN
Alat
Seperangkat alat refluks, seperangkat alat untuk analisa Kjeldhal, Spektrofotometer IR merk Shimadzu FTIR –8010PC, AAS merk Perkin Elmer, pH-meter merk Orion model 710A, shaker , sentrifus merk Fischer scientific dengan kecepatan maksimum 3500 rpm, Spektrofotometer UV-vis Lamda bio 20, Perkin Elmer.
Bahan
Cangkang udang windu (diambil dari industri pengolahan udang di Sidoarjo).
Bahan–bahan kimia yang diperoleh di pasaran komersial dengan kemurnian p.a antara lain : NaOH, HCl, , MgCl2, Na2CO3, bahan buffer,
papain ,BSA, reagen Bradford, tirosin, TCA, reagen folin, kasein dan air bidestilasi bebas ion.
PROSEDUR PENELITIAN
Preparasi dan Karakterisasi Kitosan
Kitosan dipreparasi dengan metode yang dikembangkan No(1989) melalui deproteinasi, demineralisasi dan deasetilasi. Karakterisasi gugus fungsi kitosan dan % Deasetilasi dianalisa dengan metode spektroskopi IR.
Adsorpsi Kation Magnesium Pada Kitosan
Larutan magnesium diinteraksikan dengan 100 mg kitosan pada pH, waktu interaksi dan konsentrasi larutan dibuat bervariasi. Hasilnya dianalisa pada pH optimum, laju dan kapasitas adsorpsinya.
Imobilisasi Papain Pada Matriks
Sebanyak 100 mg matriks kitosan diinteraksikan dengan 5 mL papain 20 mg/ml, pH 7, selama 12 jam. Setelah interaksi kemudian disentrifus pada 3500 rpm selama 10 menit. Endapan selanjutnya diuji aktivitasnya.
Uji Aktivitas Papain
Sebanyak 2,5 mL buffer pospat pH 6,5; 0,05 M ditambah 0,5 mL kasein dimasukkan ke dalam tabung sentrifus. Pada tabung lain dimasukkan enzim papain 0,25 mL. Keduanya dipreinkubasi pada suhu 55 0C selama 10 menit.
Setelah preinkubasi, enzim papain dimasukkan dalam tabung yang berisi buffer dan kasein, kemudian diinkubasi pada suhu 55 0C selama 10
menit. Setelah inkubasi, reaksi dihentikan dengan ditambah 1 mL TCA 10 %, didinginkan selama 10 menit, kemudian disentrifus pada 3000 rpm selama 10 menit. Filtrat dianalisa dengan cara: 2 mL filtrat ditambah 4 mL Na2CO3 ditambah 1 mL
reagen folin, diamkan selama 10 menit, selanjutnya dianalisa dengan Spektrofotometer UV-vis pada panjang gelombang 650 nm.
HASIL DAN PEMBAHASAN
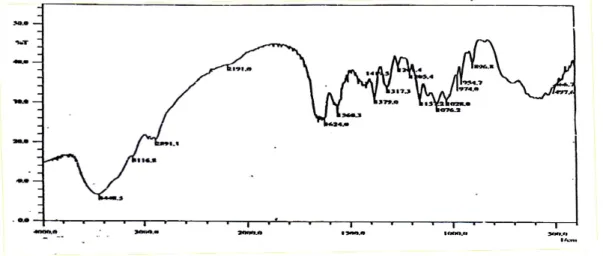
Hasil isolasi kitin dari cangkang udang dikarakterisasi gugus fungsinya dengan FTIR Shimazu 8201. Data spektra ditunjukkan pada Gambar 1 dan 2. Dari kedua gambar tampak pita serapan pada bilangan gelombang 3448,5 cm-1
yang berasal dari vibrasi ulur –OH dan pita serapan 2891,7 cm-1 yang berasal dari vibrasi
ulur C-O. Pada Gambar 1, muncul serapan pada 1580,5 cm-1 yang berasal dari vibrasi tekuk N-H
yang diperkuat oleh pita 3100,0 cm-1 sebagai
indikasi adanya gugus amina (-NH2) yang telah
terbentuk saat deproteinasi. Pada Gambar 2, terjadi perubahan intensitas pada pita serapan 1580,3 cm-1 yang berasal dari vibrasi tekuk N-H
yang diperkuat oleh pita serapan 3116,8 cm-1
menunjukkan keberadaan amina (-NH2) pada
95 © Kimia ITS – HKI Jatim
dibandingkan dengan kitin. Spektra IR hasil identifikasi gugus fungsional kitin, dan kitosan dapat digunakan untuk menentukan persentase deasetilasi.
Gambar 1. Spektra IR Kitin
Hasil perhitungan persentase deasetilasi dapat digunakan untuk membedakan senyawa tersebut kitin atau kitosan. Hasil perhitungan derajat deasetilasi dengan metode base line untuk kitin 53,96%, sedangkan untuk kitosan diperoleh hasil 84,80 % .
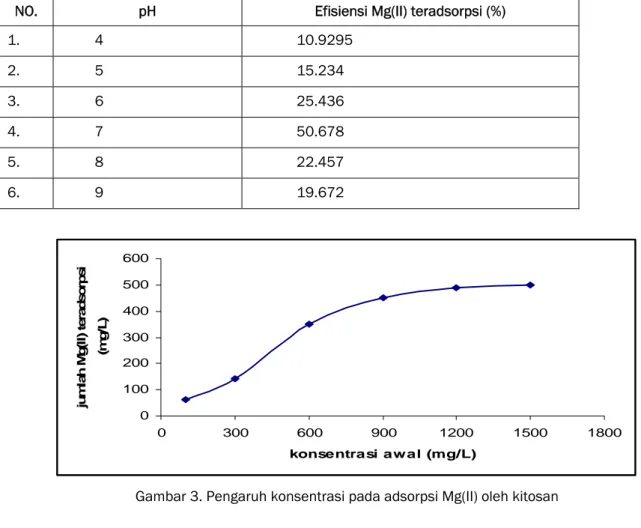
ADSORPSI KATION MAGNESIUM PADA KITOSAN Hasil adsorpsi kation Magesium oleh kitosan untuk menentukan pH optimum pada tabel 1 menunjukkan bahwa adsorpsi kation Mg(II) meningkat pada pH 4-7, kemudian menurun pada pH 8. Adanya protonasi pada
gugus –NH2 menyebabkan melimpahnya ion H+ ,
sehingga terjadi persaingan pengikatan antara gugus –NH2 kitosan dengan Mg(II) dan H+ . Hal ini
menyebabkan adsorpsi pada pH 4 rendah. Pada pH 8 adsorpsi rendah karena sebagian kation Mg(II) telah mengendap menjadi Mg(OH)2
disamping itu juga karena adanya persaingan dengan ion Na untuk berikatan dengan gugus – NH2 kitosan.
Hasil adsorpsi ion logam Cd(II) oleh kitosan pada variasi konsentrasi ditampilkan pada Gambar 3, yang secara umum menunjukkan adsorpsi ion logam Mg(II) pada kitosan memiliki kecenderungan mengalami peningkatan jumlah logam teradsorpsi hingga konsentrasi awal 300 mg/L. Pada konsentrasi awal 600 mg/L kenaikan konsentrasi logam tidak disertai kenaikan adsorpsi ion logam Mg(II) secara signifikan. Pada konsentrasi 900 mg/L diperkirakan situs aktif kitosan telah jenuh oleh ion logam dan kitosan telah mencapai kapasitas adsorpsinya. Dari data yang diperoleh dapat disimpulkan bahwa adsorpsi ion logam Mg(II) pada kitosan mengikuti pola adsorpsi isoterm Langmuir. Menurut teori isoterm Langmuir, adsorpsi diperkirakan terjadi pada lapisan tunggal. Pada saat adsorbat memenuhi lapisan, molekul yang terserap tak akan melebihi jumlah situs aktif pada permukaan adsorben. Perhitungan kapasitas adsorpsi, konstanta kesetimbangan adsorpsi Mg(II) didapatkan kapasitas adsorpsi sebesar 3,4673.10-4 mol/g,
konstanta kesetimbangan adsorpsi sebesar 2853.
Tabel 1.Pengaruh pH terhadap adsorpsi Mg(II) oleh kitosan
NO. pH Efisiensi Mg(II) teradsorpsi (%)
1. 4 10.9295 2. 5 15.234 3. 6 25.436 4. 7 50.678 5. 8 22.457 6. 9 19.672 0 100 200 300 400 500 600 0 300 600 900 1200 1500 1800 konsentrasi awal (mg/L) ju m la h M g (I I) t e ra d s o rp s i (m g/ L)
Gambar 3. Pengaruh konsentrasi pada adsorpsi Mg(II) oleh kitosan
0 100 200 300 400 500 0 30 60 90 120 150 w aktu (menit) ju ml ah Mg( II ) t e rads or ps i ( m g/ L )
Gambar 4, Pengaruh waktu pada adsorpsi Mg(II) oleh kitosan
Data pengaruh waktu terhadap adsorpsi Mg(II) pada kitosan disajikan pada Gambar 4. Data menunjukkan bahwa secara umum adsorpsi Mg(II) pada kitosan di atas mula-mula berlangsung relatif cepat. Pada 30 menit pertama adsorpsi meningkat tajam, penambahan waktu berikutnya ada sedikit peningkatan jumlah logam yang teradsorpsi dan setelah berlangsung cukup
lama laju adsorpsi relatif konstan. Pada tahap ini proses adsorpsi diperkirakan telah mencapai kesetimbangan. Dari data tersebut dapat diperkirakan bahwa tahap kesetimbangan tercapai setelah adsorpsi berlangsung selama 60 menit dan penambahan waktu adsorpsi ternyata tidak memberikan kenaikan laju adsorpsi yang signifikan.
97 © Kimia ITS – HKI Jatim
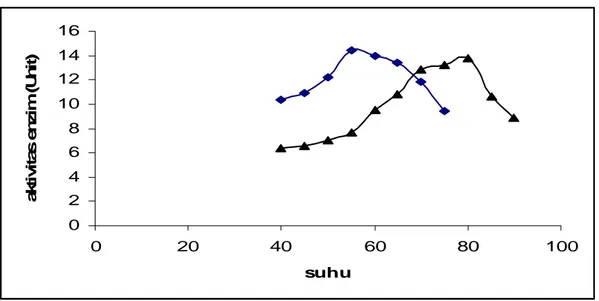
0 2 4 6 8 10 12 14 16 0 20 40 60 80 100 suhu a k ti v ita s e n zi m (U n it)
Gambar 5. Suhu optimum papain ( ■ ) papain bebas; ( ▲ ) papain imobil
IMOBILISASI PAPAIN PADA KITOSAN DAN UJI AKTIVITAS PAPAIN IMOBIL
Hasil imobilisasi papain pada kitosan menghasilkan 44,67 % papain dapat terimobil pada kitosan. Uji aktivitas pada papain imobil menunjukkan bahwa papain imobil mempunyai suhu optimum 80 oC, sedangkan papain bebas 55 0C. Hal tersebut menunjukkan bahwa matriks
mampu melindungi papain terhadap panas sehingga mampu bertahan pada suhu yang tinggi. Dengan demikian papain imobil mempunyai range kerja yang tinggi sehingga hal ini sangat menguntungkan pada proses-proses di industri.
Pada pemakaian berulang papain imobil mampu digunakan sebanyak 6 kali, dan pada penggunaan ke 6 aktivitas katalitiknya masih 25-30 % , papain bebas hanya sekali pakai karena papain tercampur dengan produk sehingga dilakukan proses perusakan untuk memisahkan dengan produk. Pada aplikasinya hal tersebut sangat tidak ekonomis mengingat papain mahal harganya. Enzim imobil yang dihasilkan dengan cara imobilisasi tipe carrier–crosslinked mempunyai beberapa keuntungan antara lain: tidak mudah larut, tahan terhadap panas dan penurunan aktifitas relatif kecil (Chibata,1978 , Kiling,2001).
KESIMPULAN
1. Kation Mg(II) teradsorpsi maksimum oleh kitosan pada pH 7, kesetimbangan terjadi pada konsentrasi awal 900 mg/L dan waktu interaksi 120 menit.
2. Imobilisasi papain pada kitosan menghasilkan enzim papain imobil yang mempunyai suhu optimum 80 0C dan mampu
digunakan secara berulang sebanyak 6 kali.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih yang sebesar-besarnya atas dukungan dana penelitian Proyek Peningkatan Penelitian Perguruan Tinggi DP2M-DIKTI melalui Penelitian Hibah Bersaing XIV dengan No. kontrak 020/SP3/PP/DP2M/II/2006 tanggal 1 Februari 2006.
DAFTAR PUSTAKA
Agustini, 2003. Karakteristik Imobilisasi Karakterisasi Imobilisasi Protease Mikroorganisme Thermofilik Isolat CG-10 Yang Hidup Di Air Panas Cangar Jawa Timur Dengan Matriks Pendukung Bentonit
Disertasi, UNAIR.
Cahyaningrum, S.E., 2003. Isolasi dan Karakterisasi Kitosan Cangkang Udang Windu , Jurnal Hayati, Vol 2.
Cahyaningrum, S.E., 2003. Kinetika Adsorpsi Kation Nikel Oleh Kitosan. Media MIPA,
UNESA.
Cahyaningrum, S.E., 2005 Pemanfaatan Limbah Cangkang Udang Windu Sebagai Penyerap Kation Kadmium Dalam medium Air . Indon.
Journal Chem Vol .2.
Chibata,I. 1978. Immobilixe Enzymes Research
and Development. Kodansha LTD, Tokyo,
Johan and Wiley and Sons, New York.
Darwis dan Sukara, 1990. Penuntun Praktikum
Isolasi, Purifikasi dan Karakterisasi Enzim.
IPB. Bogor.
Indra., Akhlus, S., 1993. Hidrolisis Khitin Menjadi
Khitosan serta Aplikasinya Sebagai Pendukung Padat, Jurusan Kimia FMIPA ITS ,
Lehninger AL. 1990. Dasar-dasar Biokimia , terjemahan Maggy Thenawidjaya. Jaharta, Penerbit Erlangga..
H, K, No.., Meyer,S.P. 1989., Isolation and Characteization of Chitin From Crawfish Shell Waste, J.Agric.Food. Chem, 37,575-579. Sarah, A., 2001. Immobilization and Stabilization
of Papain on Chelating Sepharose, Electronic
J. Biotechology. Catolica de Velparaaiso
Chile.
Sun S. and Tu Si. 1999. Immobilization of Horseradish Peroxidase in Cross-linked Phylloilicates: Condition and Characterizations. Biotechnol Appl. Biochem.