PENGUJIAN LAPANG INOKULUM CENDAWAN MIKORIZA
ARBUSKULA TERHADAP PERTUMBUHAN DAN
PRODUKTIVITAS Brachiaria humidicola
(Rendle) Scweick
SKRIPSI YANTI FITRIYATI
PROGRAM STUDI NUTRISI DAN MAKANAN TERNAK FAKULTAS PETERNAKAN
RINGKASAN
YANTI FITRIYATI. D24102054. 2006. Pengujian Lapang Inokulum Cendawan Mikoriza Arbuskula (CMA) terhadap Pertumbuhan dan Produktivitas Brachiaria humidicola (Rendle) Schweick. Skripsi. Program Studi Nutrisi dan Makanan Ternak. Fakultas Peternakan. Institut Pertanian Bogor.
Pembimbing Utama : Dr. Ir. Panca Dewi M. H. K. S., M. Si Pembimbing Anggota : Ir. M Agus Setiana, MS
Produksi massal mikoriza skala laboratorium telah dilakukan dengan menggunakan tanaman inang Setaria splendida (SS) dan Sorghum bicolor (SB) pada media tanam tanah (T), pasir (P) dan zeolit (Z). Produksi cendawan mikoriza arbuskula (CMA) yang paling baik yaitu dengan menggunakan tanaman inang
Sorghum bicolor dengan media tanam zeolit. Namun pengujian lapang inokulum hasil produksi massal skala laboratorium belum dilakukan. Penelitian ini bertujuan untuk mengetahui pengaruh pemberian inokulum mikoriza hasil produksi massal skala laboratorium terhadap pertumbuhan dan produktivitas rumput Brachiaria humidicola (Rendle) Schweick dalam skala lapang. Inokulum yang digunakan yaitu media tanam berikut akar tanaman.
Penelitian ini dilaksanakan pada bulan Mei 2005 sampai dengan Februari 2006 bertempat di Laboratorium Lapang Agrostologi dan Laboratorium Agrostologi, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor serta Laboratorium Bioteknologi Hutan dan Lingkungan, Pusat Penelitian Sumber Daya Hayati dan Bioteknologi, Institut Pertanian Bogor. Teknik pelaksanaannya meliputi penanaman dan pemeliharaan, pemanenan dan analisa laboratorium untuk menghitung persentase infeksi akar dan jumlah spora. Peubah yang diamati antara lain pertambahan panjang stolon, pertambahan jumlah stolon, berat kering tajuk, persentase infeksi akar serta jumlah spora.
Percobaaan menggunakan rancangan acak lengkap (RAL) tujuh perlakuan dengan tiga ulangan. Perlakuan antara lain dengan membedakan sumber inokulum yang digunakan. Perlakuannya antara lain TSS, TSB, PSS, PSB, ZSS, ZSB, dan kontrol (tanpa pemberian inokulum). Pengaruh perlakuan dianalisa dengan sidik ragam (ANOVA) dan jika terdapat perbedaan terhadap perlakuan dilakukan uji lanjut Duncan. Hasil penelitian menunjukkan semua inokulum CMA yang digunakan memberikan pengaruh yang sama dalam peningkatan produksi hijauan pakan ternak. Hasil penelitian menunjukkan bahwa pengaruh perlakuan nyata (P<0,05) terhadap pertambahan panjang stolon pada panen ke-2. Perlakuan TSS nyata lebih rendah dibanding perlakuan lainnya. Namun untuk pertambahan panjang stolon panen I, pertambahan jumlah stolon panen I dan II, bahan kering tajuk panen I dan II, persentase infeksi akar panen I dan II, jumlah spora tidak berpengaruh nyata.
ABSTRACT
Field Testing of Arbuscular Mycorrhiza
Fungi Inoculums to Growth and
Productivity of
Brachiaria humidicola
(Rendle) Schweick
Fitriyati, F., P.D.M.H. Karti, and M.A. Setiana
Mycorrhizas are mutuality symbioses between certain groups of soil fungi and plant root systems. Mass arbuscular mycorrhizal fungi were produced in laboratory scale. Arbuscular mycorrhiza fungi were produced by using host plant
Setaria splendida and Sorghum bicolor on growth media latosol, sand and zeolit. The aim of the experiment was to evaluate the effect of mycorrhiza inoculums application as a product of laboratory scale to the production of Brachiaria humidicola in field scale. This experiment used Completely Randomized Design with 7 treatments and 3 replications. The data were analysis with Analysis of Variance (ANOVA) and for the significant differences were further tested by Duncan range test. Variables measured were stolon length gain, stolon numbers gain, shoot dry weight, root infection percentage, and spore number. The result showed that stolon length gain in the second harvest, was significant (p<0.05).There was not significant effect of treatments to stolon length gain in the first harvest, stolon numbers gain, shoot dry weight, root infection percentage, and spore number.
PENGUJIAN LAPANG INOKULUM CENDAWAN MIKORIZA
ARBUSKULA TERHADAP PERTUMBUHAN DAN
PRODUKTIVITAS
Brachiaria humidicola
(Rendle) Scweick
YANTI FITRIYATI D24102054
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan
pada Fakultas Peternakan Institut Pertanian Bogor
PROGRAM STUDI NUTRISI DAN MAKANAN TERNAK FAKULTAS PETERNAKAN
PENGUJIAN LAPANG INOKULUM CENDAWAN MIKORIZA
ARBUSKULA TERHADAP PERTUMBUHAN DAN
PRODUKTIVITAS
Brachiaria humidicola
(Rendle) Scweick
Oleh :
YANTI FITRIYATI D4102054
Skripsi ini telah disetujui dan disidangkan dihadapan Komisi Ujian Lisan pada Tanggal 12 Juni 2006
Pembimbing Utama Pembimbing Anggota
Dr. Ir. Panca Dewi M.H.K.S., M.Si. Ir. M. Agus Setiana, MS. NIP. 131 672 157 NIP. 131 473 998
Dekan Fakultas Peternakan Institut Pertanian Bogor
RIWAYAT HIDUP
Penulis dilahirkan di Pekalongan pada tanggal 31 Januari 1984. Penulis adalah anak ketujuh dari tujuh bersaudara dari pasangan Bapak A. Busyaeri dan Ibu Masturoh.
Pendidikan dasar diselesaikan pada tahun 1996 di MIM Delegtukang, Wiradesa. Pendidikan lanjutan tingkat pertama diselesaikan pada tahun 1999 di SLTP N I Wiradesa, Pekalongan. Pendidikan lanjutan menengah umum diselesaikan pada tahun 2002 di SMU N I Pekalongan.
KATA PENGANTAR
Bismillahirrohmanirrohim,
Alhamdulillah, segala puji syukur penulis panjatkan kehadiran Allah SWT atas segala nikmat, rahmat serta hidayah-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul ‘Pengujian Lapang Inokulum Cendawan Mikoriza Arbuskula terhadap Pertumbuhan dan Produktivitas Brachiaria humidicola (Rendle) Scweick. Skripsi ini ditulis berdasarkan penelitian dari bulan Mei 2005 sampai Februari 2006. di Laboratorium Lapang Agrostologi, Laboratorium Agrostologi. Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor, serta Laboratorium Bioteknologi Hutan dan Lingkungan, Pusat Penelitian Sumber Daya Hayati dan Bioteknologi, Institut Pertanian Bogor.
Ketersedian hijauan khususnya rumput masih sangat rendah baik dari segi kualitas maupun kuantitasnya. Kesuburan tanah untuk lahan penanaman rumput masih rendah, sehingga kandungan unsur hara didalam tanah belum mampu mencukupi kebutuhan tanaman dengan baik. Seiring kemajuan bioteknologi telah berhasil ditemukan mikroorganisme yang mempunyai peran positip dalam memperbaiki lahan-lahan miskin hara dan menstimulasi pertumbuhan. Salah satunya dengan menggunakan cendawan yaitu cendawan mikoriza arbuskula
Produksi massal CMA skala laboratorium telah dilakukan dengan menggunakan tanaman inang Setaria splendida Stapf dan Sorghum bicolor (L) Moench pada media tanam zeolit, pasir, serta tanah latosol. Inokulum yang dihasilkan akan diujicobakan pada skala lapang. Inokulum yang digunakan berupa akar tanaman inang dan media tanam berupa tanah, pasir dan zeolit.
Penulis mengharapkan skripsi ini dapat bermanfaat untuk kalangan akademis sebagai sumber referensi. Penulis juga mengucapkan terima kasih atas saran dan masukan dari berbagai pihak demi kesempurnaan skripsi ini.
Bogor, Juni 2006
DAFTAR ISI
Cendawan Mikoriza Arbuskula (CMA) ... 4
Inokulum CMA ... 6
Brachiaria humidicola (Rendle) Scweick ... 9
Setaria splendida Stapf ... 9
Sorghum bicolor (L) Moench ... 10
Persiapan Inokulum……… 13
Persiapan Bedengan ... 14
Penanaman dan Pemeliharaan... 14
Pemanenan... 14
Pengamatan Umum ... 15
Rekapitulasi Analisis Ragam... 16
Pertambahan Panjang Stolon... 16
Pertambahan Jumlah Stolon ... 18
Berat Kering Tajuk ... 19
Persentase Infeksi Akar ... 21
Jumlah Spora ... 23
KESIMPULAN DAN SARAN...26
Kesimpulan... 26
Saran ... 26
UCAPAN TERIMA KASIH ... 27
DAFTAR PUSTAKA ... 28
LAMPIRAN ... 31
DAFTAR TABEL
Nomor Halaman
1. Rekapitulasi Analisis Ragam ... 16
2. Rataan Pertambahan Panjang Stolon ... 17
3. Rataan Pertambahan Jumlah Stolon ... 19
4. Rataan Berat Kering Tajuk ... 20
5. Rataan Persentase Infeksi Akar ... 22
6. Rataan Jumlah Spora ... 24
DAFTAR GAMBAR
Nomor Halaman
1. Proses Infeksi Akar oleh Cendawan Mikoriza Arbuskula... 16
2. Perlakuan Kontrol dan Perlakuan Z.SB.2 ... 5
3. Akar yang Tidak Terinfeksi oleh Mikoriza ... 22
DAFTAR LAMPIRAN
Nomor Halaman
1. Analisis Ragam Pertambahan Panjang Stolon Panen I ... 32
2. Analisis Ragam Pertambahan Panjang Stolon Panen II ... 32
3. Analisis Ragam Pertambahan Jumlah Stolon Panen I ... 32
4. Analisis Ragam Pertambahan Jumlah Stolon Panen II... 32
5. Analisis Ragam Berat Kering Tajuk Panen I... 32
6. Analisis Ragam Berat Kering Tajuk Panen II ... 32
7. Analisis Ragam Persentase Infeksi Akar Panen I ... 33
8. Analisis Ragam Persentase Infeksi Akar Panen II ... 33
9. Analisis Ragam Jumlah Spora ... 33
10. Uji Lanjut Duncan Pertambahan Panjang Stolon Panen I ... 33
11. Data Klimatologi... 34
PENDAHULUAN Latar Belakang
Permintaan hewan ternak yang semakin meningkat dari tahun ke tahun tidak lepas hanya untuk memenuhi kebutuhan manusia. Pakan hijauan merupakan salah satu sumber bahan pakan utama khususnya ternak ruminansia. Hijauan digunakan untuk memenuhi kebutuhan zat gizi khususnya energi dan serat kasar. Ternak ruminansia mengkonsumsi hijauan lebih dari 60 % pakan yang dikonsumsi
Ketersedian hijauan khususnya rumput masih sangat rendah baik dari segi kualitas maupun kuantitasnya. Rendahnya ketersedian rumput dipengaruhi oleh kesuburan lahan dan kondisi iklim. Kesuburan tanah untuk lahan penanaman rumput masih rendah, sehingga kandungan unsur hara dalam tanah belum mampu mencukupi kebutuhan tanaman dengan baik.
Umumnya tanah di Indonesia merupakan tanah yang miskin unsur hara makro terutama unsur P, sedangkan unsur hara lainnya seperti Al, Mn dan Fe berlebih sehingga menyebabkan pH tanah rendah. Seiring kemajuan bioteknologi telah berhasil ditemukan mikroorganisme yang mempunyai peran positip dalam memperbaiki lahan-lahan miskin hara dan menstimulasi pertumbuhan. Salah satunya adalah cendawan mikoriza arbuskula.
Mikoriza merupakan suatu hubungan simbiosis mutualisme antara cendawan (mykes) dan perakaran (rhiza) tumbuhan tingkat tinggi. Cendawan tidak merusak atau membunuh tanaman inang namun memberikan sumbangan mineral fosfor kepada tanaman dan sebaliknya cendawan memperoleh karbohidrat dari tanaman inang (Imas et al., 1989).
Peranan mikoriza sebagai pupuk hayati telah terbukti dan dikembangkan secara luas pada tanaman pangan, tanaman pakan dan kehutanan. Kusumawati (2005) memproduksi massal Cendawan Mikoriza arbuskula (CMA) skala laboratorium dengan menggunakan tanaman inang Setaria splendida Stapf dan
Sorghum bicolor (L) Moench pada media tanam zeolit, pasir, serta tanah latosol. Inokulum yang dihasilkan diujicobakan pada penanaman Brachiaria humidicola
Perumusan Masalah
Cendawan mikoriza arbuskula (CMA) merupakan biofertilizer yang dapat meningkatkan produktivitas dan kualitas tanaman umumnya pada daerah yang kurang subur. Dalam skala laboratorium,produksi CMA yang paling bagus yaitu dengan menggunakan tanaman inang Sorghum bicolor (L) Moench dengan media tanam zeolit. Semua CMA produksi skala laboratorium akan diujicobakan dalam skala lapang yaitu dengan mengetahui pertumbuhan dan produktivitas dari rumput
Brachiaria humidicola (Rendle) Scweick pada tanah latosol. Sebagai pembandingnya digunakan kontrol yaitu perlakuan tanpa pemberian inokulum.
Tujuan
Tujuan penelitian ini untuk mengetahui mengetahui pengaruh pemberian inokulum mikoriza hasil produksi massal skala laboratorium terhadap pertumbuhan dan produktivitas rumput Brachiaria humidicola (Rendle) Scweick dalam skala lapang.
TINJAUAN PUSTAKA Mikoriza
Mikoriza merupakan suatu bentuk hubungan simbiosis mutualisme antara cendawan (mykes) dan perakaran (rhiza) tumbuhan tinggi. Adanya bentuk asosiasi antara cendawan mikoriza dan akar, sebenarnya adalah suatu bentuk ‘parasitism’ dimana cendawan menyerang sistem perakaran, tetapi tidak sebagaimana halnya parasit yang berbahaya (patogen). Dalam hal ini cendawan tidak merusak atau membunuh tanaman inang (host) dan sebaliknya cendawan dapat memperoleh karbohidrat dan faktor pertumbuhan lainnya dari tanaman inang. (Imas et al.,1989).
Menurut Islami dan Utomo (1995) mikoriza dapat dikelompokkan menjadi empat kelas yaitu:
1. Asosiasi antara Basidiomycetes dan Ascomycetes dengan tanaman pohon 2. Asosiasi antara Basidiomycetes dengan tanaman anggrek
3. Asosisasi antara sekelompok cendawan dengan tanaman ericales
4. Asosiasi antara cendawan yang termasuk genus endogone (ascomycetes atau phycomycetes) dengan beberapa tanaman tingkat tinggi.
Sedangkan menurut Imas, et al (1989) mikoriza berdasarkan struktur tubuhnya dan cara infeksi terhadap tanaman inang, mikoriza dapat dikelompokkan dalam tiga golongan yaitu:
1.Ektomikoriza
Beberapa karakteristik yang dapat dilihat pada ektomikoriza antara lain: a) akar yang kena infeksi biasanya membesar dan bercabang serta rambut-rambut akar tidak ditemukan, b) dalam suatu penampang melintang nampak permukaan akar ditutupi seluruhnya oleh miselia yang biasa disebut dengan “fungal sheath” (mantel), c) beberapa hifa yang menjorok keluar yang disebut sebagai ‘rhizomorphs’, berfungsi sebagai alat yang efektif untuk penyrapan unsure hara dan air, d) Hifa tidak menyerang (masuk) sel tetapi hanya berkembang diantara dinding-dinding sel jaringan korteks.
2 Endomikoriza
setebal mantel ektomikoriza, c) hifa menyerang (masuk) kedalam individu sel jaringan kortek, d) adanya struktur khusus berbentuk oval yang disebut ‘vesicles’ dan system percabangan hifa yang disebut ‘arbuscules’
3. Ektendomikoriza
Ektendomikoriza merupakan suatu bentuk intermediate antara ekto dan endomikoriza. Ciri-cri ektendomikoriza antara lain: a) adanya selubung tipis berupa jaringan hartig, b) terdapat hifa tebal intraseluler yang menggelembung, c) kadang-kadang selubung tersebut hilang, d) hifa dapat menginfeksi dinding sel kortek dan juga sel-sel korteknya.
Menurut Setiadi (1989) beberapa manfaat yang dapat diperoleh oleh tanaman inang dari adanya asosiasi mikoriza sebagai berikut:
1. Meningkatkan penyerapan unsur hara
Tanaman yang bermikoriza biasanya tumbuh lebih baik daripada yang tidak bermikoriza. Salah satu sebab untuk hal ini ialah bahwa mikoriza secara efektif dapat meningkatkan penyerapan unsur hara makro dan beberapa unsur mikro. 2. Meningkatkan ketahan terhadap kekeringan.
Tanaman yang bermikoriza biasanya lebih tahan terhadap kering daripada yang tidak bermikoriza. Kekeringan yang menyebabkan rusaknya jaringan korteks, kemudian matinya perakaran pengaruhnya tidak akan permanen pada akar yang bermikoriza.
3. Tahan terhadap serangan patogen akar
Mikoriza dapat berfungsi sebagai pelindung biologis bagi terjadinya infeksi patogen akar.
4. Dapat memproduksi hormon dan zat pengatur tumbuh
Cendawan mikoriza dapat memberikan hormon seperti auksin, sitokinin, dan giberelin, juga zat pengatur tumbuh seperti vitamin kepada inangnya.
Cendawan Mikoriza Arbuskula (CMA)
Setiadi (1989) menyatakan bahwa cendawan mikoriza arbuskula merupakan suatu tipe mikoriza yang infeksinya terjadi didalam sel, sehingga sering disebut endomikoriza. Secara taksonomi cendawan arbuskula mikoriza (CMA) termasuk kedalam kelas Zygomycetes, ordo Glomales yang mempunyai 2 sub ordo yaitu
dengan genus Glomus dan Sclerocytis dan famili Acaulosporaceae dengan genus
Acaulospora dan Enthrospora.
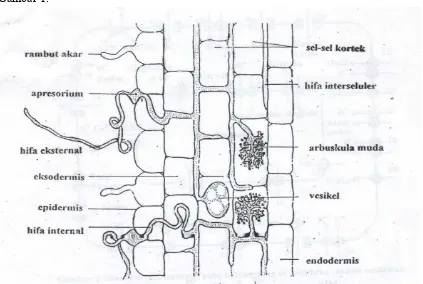
CMA dapat menginfeksi sistem perakaran tanaman inang akan memproduksi jalinan hifa secara internsif sehingga tanaman bermikoriza mampu meningkatkan kapasitasnya dalam menyerap unsur hara dan air. Kemampuan CMA dalam memperbaiki status nutrisi tanaman tersebut pada saat ini dapat untuk mengganti sebagian kebutuhan pupuk yang diperlukan oleh tanaman pada tanah-tanah yang bermasalah. (Sieverding, 1991). Proses infeksi akar oleh CMA dapat dilihat pada Gambar 1.
Inokulum CMA
Gambar 1 Proses Infeksi Akar oleh Cendawan Mikoriza Arbuskula
Menurut Gunawan (1993) perkembangan mikoriza arbuskula dapat dibagi dalam dua fase miselium:
propagul-propagul CMA dari daerah rizosfer ke permukaan akar. Penetrasi ini didahului oleh pembentukan apresorium akar atau hifa yang digunakan untuk melekatkan diri pada inang-inangnya.
b) Miselium internal yang ada dalam akar tanaman yang bermikoriza, terdiri atas hifa tidak bercabang yang intraseluler, hifa interseluler, hifa intraselular yang bercabang-cabang seperti pohon kecil (arbuskula), hifa membengkak atau menjadi bulat memanjang (vesikula) dan hifa yang melingkar-lingkar (hifa gelung). Setelah pembentukan apresorium, selanjutnya hifa akan menembus sel-sel kortek akar melalui sel-sel epidermis atau rambut akar. Masuknya hifa dapat secara interselular atau intraselular.
Inokulum CMA
Sumber inokulum CMA yang biasa dipakai adalah spora, akar yang terinfeksi cendawan nikoriza dan potongan hifa cendawan mikoriza. Potongan akar yang terinfeksi dan potongan hifa membentuk koloni lebih cepat namun keduanya mempunyai kemampuan hidup yang lebih kecil bila dibandingkan dengan spora. (Smith dan Read, 1997).
Potongan akar yang terinfeksi dapat dijadikan sebagai sumber inokulum yamg penting tetapi secara biologi bila dibandingkan dengan spora maka spora lebih bagus. Hal ini karena spora mempunyai dinding yang tebal dan resisten serta mengandung ribuan nukleat, lipid, dan karbohidrat sehingga dapat menyesuaikan diri. Potongan akar dapat digunakan sebagai inisiasi kolonisasi. Potongan akar juga mendukung pertumbuhan kembali hifa interseluler. Spora merupakan sumber inokulum yang utama dan hanya propagul ini yang dapat dijadikan sebagai bahan untuk mengidentifikasi jenis spora. (Smith dan Read, 1997)
Media Tanam
Dalam pemilihan jenis medium yang digunakan, perlu dipikirkan tambahan hara yang harus diberikan untuk menjamin pertumbuhan tanaman. Jika tanaman menderita karena kekahatan hara, maka perkembangan CMA didalam akar dan pembentukan sporanya juga akan terhambat. Maka penambahan larutan hara dan P tersedia harus diberikan secara teratur dan cermat (Gunawan, 1993).
relatif ringan, berpori, mempunyai KTK tinggi dan tidak patogen serta tidak toksik dan mudah tersedia. Media padat yang digunakan antara lain pasir kali, pasir kuarsa, serta zeolit.
Tanah latosol
Menurut Hardjowigeno (1995) tanah latosol memiliki lapisan solum tanah yang tebal sampai sangat tebal yaitu 130 cm sampai 5 m bahkan lebih, sedangkan batas horizon tidak begitu jelas. Warnanya merah, coklat sampai kekuningan dengan kandungan bahan organik berkisar antara 3 – 9 %, tapi biasanya 5 %, dengan pH agak masam. Tekstur seluruh solum umumya liat.
Tanah latosol mempunyai sifat fisik yang kurang baik, miskin unsur hara dengan derajat keasaman yang relatif rendah. Ciri-ciri tersebut merupakan faktor pembatas paling utama bagi pertumbuhan tanaman karena dapat mempengaruhi aktivitas mikroorganisme pengurai, meningkatkan senyawa beracun dan menggangu keseimbangan unsur hara dalam tanah. (Fatchullah, 1995).
Tanah latosol adalah jenis tanah dengan kadar liat lebih besar dicirikan oleh terjadinya penimbunan liat maksimum dan sifat ortoksik, berbentuk remah hingga gumpal namun gembur, warna tanah seragam engan batas horizon kabur, umumnya memiliki epipedon umbrik dan horizon kambik.
Ketersedian unsur hara makro terutama P dan mikro yang rendah pada tanah latosol akibat pengikatan Al dan Fe dapat meningkatkan perkembangan cendawan mikoriza arbuskula. Menurut Gunawan (1993) faktor kritis pada tanah ialah pada ketersedian unsur hara P dan unsur mikro, dan juga fungsinya sebagai penyangga netral untuk memperantai ketersedian unsur-unsur hara.
Pasir
Pasir merupakan suatu fraksi berukuran 0,05-2,0 mm dan berdasarkan sistem USDA dibedakan atas pasir yang sangat halus, halus, sedang, kasar, dan sngat kasar. Komponen terbesar pasir terdiri dari partikel kuarsa sangat resisten terhadap pelapukan dan mengandung mineral-mineral seperti felspar dan mika yang menjadi elemen esensial bagi tanaman yang bersifat esensial. (Hardjowigeno,1995)
Pasir memiliki kapasitas tukar kation yang tinggi dan aerasi yang lebih baik dibandingkan tanah sehingga dapat digunakan sebagai media pertumbuhan tanaman. (Hardjowigeno,1995). Islami dan Utomo (1995) menyatakan bahwa mikoriza dapat berkembang baik apabila tidak ada hambatan aerasi. Oleh karena itu mikoriza akan dapat berkembang lebih baik pada tanah berpasir dibandingkan pada tanah berliat atau gambut.
Zeolit
Zeolit merupakan mineral dari golongan silikat, tetapi berbeda dengan mineral lain dari golongan silikat seperti feldspar dan kuarsa, mempunyai struktur berongga sehingga bobot isinya lebih rendah. Pemanfaatan zeolit didasarkan atas sifat-sifat zeolit, antara lain memiliki KTK yang tinggi, kemampuan menjerap amonium, menjerap air berongga dan ringan. Tingginya KTK serta selektifitas adsorbsi terhadap amonium, zeolit dapat dimanfaatkan untuk mengefisienkan penggunaan pupuk nitrogen baik pupuk urea maupun pupuk amonium sulfat. (Anonim, 2006).
Zeolit mempunyai struktur berongga yang biasanya diisi oleh air dan kation yang bisa dipertukarkan dan memiliki ukuran pori tertentu, oleh sebab itu zeolit dapat dimanfaatkan sebagai penyaring molukuler, penukar ion, penyerap bahan dan katalisator. Dibidang peternakan zeolit digunakan untuk penggemukan ternak, kesehatan kandang, penambahan ketahanan terhadap penyakit dan penyerapan kontaminan (Sutarti, 1994)
Tanaman Inang
Keberhasilan produksi inokulum sangat bergantung pada tanaman inang yang digunakan. Tanaman inang harus dapat tumbuh dengan baik pada lingkungan tumbuhnya dan merupakan inang yang cocok untuk spesies CMA yang akan diproduksi. Tanaman inang terpilih harus dapat tumbuh cepat dan menghasilkan banyak akar. (Gunawan, 1993).
Banyak inang yang digunakan untuk memproduksi inokulum antara lain
Brachiaria humidicola (Rendle) Schweick
Brachiaria humidicola merupakan tanaman perenial, perkembangan vegetatif dengan stolon yang begitu cepat sehingga bila ditanam di lapangan segera membentuk hamparan. Batang yang berkembang dapat mencapai tinggi 20 – 60 cm. Mempunyai resistensi yang tinggi terhadap invalsi gulma tetapi kurang cocok bila dilakukan tanaman campuran dengan leguminosa (Jayadi, 1991).
Brachiaria humidicola merupakan rumput yang palatable dengan konsentrasi N yang rendah, selama musim tumbuh (0,6-1,0 %). Rumput ini toleran terhadap naungan dan drainase jelek. Biasanya digunakan sebagai hijauan pada pastura permanen dan untuk kontrol erosi. Dapat ditanam dengan menggunkan benih yaitu 2-8 kg/ha tergantung kualitas benih, atau secara vegetatif dengan menggunakan potongan stolon.(Mannetje dan Jones, 1992). Toleran terhadap daerah kering serta produksi tetap bagus (Skerman dan Riverous, 1990).
Setaria splendida (Stapf)
Setaria spelendida terkenal dengan sebutan rumput lampung atau setaria gajah. Berasal dari daerah afrika tropika. Relatif tahan terhadap genangan air bila dibandingkan dengan Setaria anceps. Adaptasi tanah dari yang berpasir sampai liat, namun paling baik memberikan produksi adalah pada tanah lempung berliat. (Jayadi, 1991)
Rumput setaria merupakan jenis rumput perenial. Rumput ini tumbuh membentuk rumpun seperti varietas sereceae tetapi lebih tinggi dan lebih kasar. Tinggi rumput dapat mencapai 1,5 – 3,5 m dengan daun lebar dari sereceae. Panjang daun mencapai 70 cm dengan lebar daun 12-20 mm. Malai lebih panjang berwarna coklat tua dan bulir dikelilingi oleh bulu kasar (Bogdan, 1977).
Sorghum bicolor (L) Moench
Menurut Widodo (2002) Sorghum bicolor (L) Moench memiliki klasifikasi sebagai berikut: Divisi: Angiospermae, klas: monocotyledone, ordo: Glumiflorae, famili: Graminae, genus: sorghum dan spesies: bicolor.
Sorghum mempunyai kelebihan mampu tunmbuh didaerah yang curah hujannya rendah atau kadar air tanahnya tidak memungkinkan untuk ditanami gandum maupun padi. Tanaman ini mempunyai daya adaptasi yang tinggi trerhadap kekeringan bila dibandingkan tanaman lainnya (Rismunandar, 1989)
Sorghum tidak toleran terhadap genangan, tetapi akan tetap bertahan sementara jika air menggenang. Kadar garam yang cukup tinggi dalam tanah dapat menghambat germinasi benih, dan untuk tanaman muda bisa layu. (Skerman dan Riverous, 1990).
METODE Lokasi dan Waktu
Penelitian ini dilaksanakan di Laboratorium Lapang Agrostologi dan Laboratorium Agrostologi, Program Studi Nutrisi dan Makanan Ternak, Fakultas Peternakan, Institut Pertanian Bogor untuk penanaman dan pemeliharaan, analisis berat kering tajuk serta analisis persentase infeksi akar. Penghitungan jumlah spora dilaksanakan di Laboratorium Bioteknologi Hutan dan Lingkungan, Pusat Penelitian Sumber Daya Hayati dan Bioteknologi, Institut Pertanian Bogor. Penelitian berlangsung dari bulan Mei 2005 sampai Februari 2006.
Materi
Materi yang digunakan selama penanaman ini meliputi bahan tanam pols
Brachiaria humidicola (Rendle) Scweick , inokulum mikoriza dari tanaman inang
Setaria splendida (Stapf) dan Sorghum bicolor (L) Moench dengan media tanam pasir, tanah, dan zeolit., serta pupuk KCL, urea dan SP36. Peralatan yang digunakan yaitu cangkul, timbangan, penggaris, selang air, oven. Bahan yang digunakan untuk pewarnaan akar adalah KOH 2.5 %, HCL 2 %, aquades, serta larutan staning. Sedang peralatan yang digunakan antara lain tabung film, gelas objek beserta kaca penutup, pinset, gelas ukur, mikroskop, serta kamera digital. Bahan yang digunakan untuk menghitung jumlah spora antara lain sampel tanah, larutan sukrosa 60 %. Peralatan yang digunakan antara lain timbangan, alat penyaring (shieving), tabung sentrifuse, sentrifuse, cawan petri, gelas ukur, mikroskop.
Rancangan Perlakuan
Rancangan percobaaan yang digunakan adalah rancangan acak lengkap (RAL) dengan 7 perlakuan dengan 3 ulangan. Perlakuan yang digunakan antara lain:
TSS : Inokulum CMA tanah-S. splendida
TSB : Inokulum CMA tanah-S. bicolor
PSS : Inokulum CMA pasir-S. Splendida
PSB : Inokulum CMA pasir-S. bicolor
ZSS : Inokulum CMA zeolit-S. splendida
K : Kontrol (tanpa inokulum CMA)
Model matematika yang digunakan dalam penelitian ini adalah: Xij = μ + αi + εij
Data yang diperoleh dianalisis dengan menggunakan analisis sidik ragam (ANOVA) dan jika memberikan hasil yang berbeda nyata maka dilanjutkan dengan uji Duncan. (Steel dan Torrie, 1993)
Peubah-peubah
1. Pertambahan panjang stolon (cm)
Panjang stolon rumput Brachiaria humidicola (Rendle) Scweick diukur dengan mengambil 4 sampel dari masing-masing petak dan diukur setiap minggu selama periode penanaman. Pertambahan panjang stolon diperoleh dari selisih panjang stolon minggu terakhir dengan minggu sebelumnya.
2. Pertambahan jumlah stolon (stolon)
Jumlah stolon dihitung dengan mengambil 4 sampel dari masing- masing petak dan dihitung setiap minggu selama periode penanaman. Pertambahan jumlah stolon diperoleh dari selisih panjang stolon minggu terakhir dengan minggu sebelumnya.
3. Berat kering tajuk (gram)
Hasil panen dari rumput Brachiaria humidicola (Rendle) Scweick dihitung berat segar tajuk dari masing-masing perlakuan. Untuk berat kering tajuk diambil sampel sebanyak 100 gram dan dihitung berat setelah dioven pada suhu 70o C selama 48 jam.
Persentase BK Tajuk: Berat kering tajuk x Berat segar tajuk
4. Persentase infeksi akar
Penghitungan persentase jumlah akar yang terinfeksi oleh CMA dilakukan teknik pewarnaan akar (Phyllip dan Hayman, 1970 yang dimodifikasi oleh teknik Koske dan Gemma, 1989). Pewarnaan akar dilakukan dengan pencucian akar terlebih dahulu kemudian dipotong-potong dan dimasukkan kedalam tabung, ditambahkan KOH 2.5 % dan tutup tabung tersebut, biarkan sampai akar berwarna kuning jernih. Bila akar berwarna kuning jernih, KOH 2.5 % dibuang dan dicuci kembali dibawah air mengalir dan ditambahkan HCl 2 % hingga terendam, biarkan selama 24 jam. HCl dibuang dan masukkan larutan staining, biarkan selama 24 jam. Untuk menghitung infeksi akar, potongan akar dengan panjang 1 cm sebanyak 5 buah, diletakkan di gelas preparat dan tutup dengan cover glass. Penghitungan jumlah akar yang terinfeksi dengan menggunakan mikroskop compound dengan perbesaran 10 x 10.
Persentase infeksi akar : Jumlah akar yang terinfeksi x 100 % Total akar yang diamati
5 Jumlah Spora
Menurut Gerdeman dan Nicolson (1963) penghitungan jumlah spora dapat dilakukan dengan mengisolasi terlebih dahulu melalui metode penyaringan basah. Isolasi spora dilakukan dengan cara menimbang 50 g tanah, tambahkan air dan aduk, kemudian diamkan hingga membentuk suspensi. Suspensi tersebut dituangkan kedalam saringan bertingkat, ulangi sebanyak 3 kali. Tanah yang terendam pada saringan 45 μm dimasukkan kedalam tabung sentrifuse, tambahkan sukrosa 60 % dan disentrifuse dengan kecepatan 2500 rpm selama 5 menit. Supernatan ( jangan sampai endapannya terbawa) ditampung dengan saringan 45
μm, kemudian dibilas dengan aquades agar sukrosanya hilang, dan dimasukkan
kedalam cawan petri. Jumlah spora dihitung dengan menggunakan mikroskop.
Prosedur Persiapan Inokulum
akar dan media tanam. Setiap tanaman ditambahkan inokulum sebanyak 100 gram (4 ton/ha tanah percobaan). Selang waktu antara produksi inokulum dengan penggunaannya dalam skala lapang sekitar 5 bulan.
Persiapan Bedengan
Sebelum di tanam, bedengan telah disediakan sebelumnya. Lokasi bedengan dipilih tempat yang terbuka untuk mendapatkan intensitas radiasi matahari yang cukup. Tanah bedengan digemburkan dan dibuat lebih tinggi sekitar 10 cm dari tanah sekelilingnya. Setiap bedengan berukuran 2x2 m2. Saluran irigasi dibuat setiap bedengan dengan lebar 40 cm dan kedalaman sekitar 15 cm. Lahan tersebut diberi pupuk dengan cara disebar. Pupuk yang digunakan antara lain SP36, KCl dengan dosis 40 gram/petak (100 kg/ha tanah percobaan), serta urea dengan dosis 80 gram/petak (200 kg/ha tanah percobaan). Pupuk urea diberikan satu minggu setelah masa tanam.
Penanaman dan Pemeliharaan
Setiap petak lahan dibuat lubang sebanyak 16 lubang dengan jarak 50 cm. Setiap lubang ini akan ditambahkan inokulum sebanyak 100 gram dan akan ditanami pols Brachiari humidicola. Pemeliharaan tanaman dilakukan dengan penyiraman bedengan setiap pagi hari dan penyiangan dilakukan apabila terdapat invansi gulma pada bedengan. Selain itu setiap minggunya dilakukan penghitungan jumlah stolon dan panjang stolon.
Pemanenan
HASIL DAN PEMBAHASAN Pengamatan umum
Penanaman Brachiaria humidicola (Rendle) Scweick dilakukan dari bulan Juni sampai September 2005. Suhu harian rata-rata selama pemeliharaan sekitar 26,84 0C dan kelembaban nisbi 79,75 % (Stasiun Klimatologi, 2005). Pada minggu pertama, sebagian besar Brachiaria humidicola (Rendle) Scweick dapat tumbuh dengan baik. Namun ada beberapa rumput yang mengalami kematian sebelum dilakukan pengamatan sehingga dilakukan penyulaman. Setelah dilakukan penyulaman Brachiaria humidicola (Rendle) Scweick tumbuh dengan normal.
Minggu ketiga setelah masa tanam, semua rumput Brachiaria humidicola
(Rendle) Scweick sudah terlihat pertumbuhan dan pertambahan stolon. Pertumbuhan paling cepat Brachiaria humidicola (Rendle) Scweick berlangsung pada minggu kelima setelah penanama. Hal ini ditandai dengan banyaknya stolon yang tumbuh hingga menutupi permukaan tanah percobaan. Pada minggu keenam, tujuh dan delapan pertumbuhan agak terhambat. Hal ini disebabkan kapasitas lahan untuk penanaman rumput kurang mencukupi untuk persebaran stolon.
Rumput Brachiaria humidicola (Rendle) Scweick perlakuan kontrol (tanpa pemberian inokulum) memperlihatkan pertumbuhan yang sama dengan yang ditambahkan inokulum CMA. Hal ini dapat dilihat dari panjang stolon dan jumlah stolonnya. Gambar Brachiaria humidicola (Rendle) Scweick dapat dilihat pada Gambar 2.
(a) (b)
Rekapitulasi Analisis Ragam
Rekapitulasi analisis ragam produktivitas dari rumput Brachiaria humidicola
(Rendle) Scweick yang ditambahkan inokulum mikoriza ditumbuhkan pada media tanah, pasir, dan zeolit dengan tanaman inang Setaria splendida Stapf dan Sorghum bicolor (L) Moench ditunjukkan pada Tabel 1.
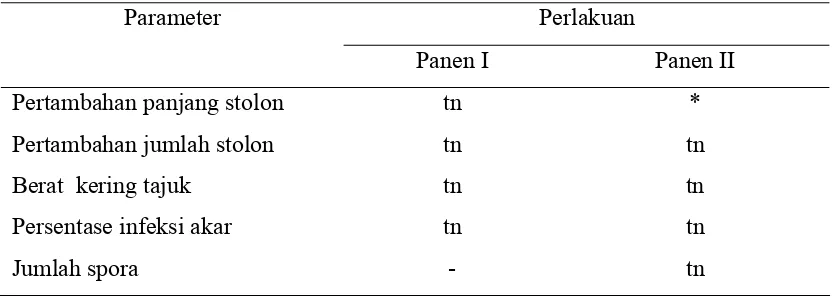
Tabel 1. Rekapitulasi Analisis Ragam
Parameter Perlakuan Panen I Panen II
Pertambahan panjang stolon tn * Pertambahan jumlah stolon tn tn Berat kering tajuk tn tn Persentase infeksi akar tn tn
Jumlah spora - tn
tn = tidak berbeda nyata * = berbeda nyata (p<0.05)
Pengaruh perlakuan terhadap pertambahan panjang stolon untuk panen I tidak nyata sedangkan untuk panen II nyata (p<0.05). Pengaruh perlakuan terhadap jumlah stolon, berat kering tajuk, persentase infeksi akar, serta jumlah spora tidak berpengaruh nyata (p>0.05).
Pertambahan Panjang Stolon
Pertumbuhan tanaman dapat dilihat dari ukuran tanaman yang dapat dijadikan ciri pertumbuhan, salah satunya dengan mengetahui pertambahan panjang stolonnya. Hasil analisis ragam pengaruh perlakuan terhadap pertambahan panjang stolon
Brachiaria humidicola dapat dilihat pada Tabel 2.
Dalam proses fotosintesis, terjadi penangkapan energi matahari yang dirubah menjadi energi kimia. Dalam hal ini CO2 dan air dirubah manjadi karbohidrat sederhana dan O2 dilepaskan ke atmosfer. Karbohidrat yang dihasilkan diubah menjadi lipid, asam nukleat, protein, dan molekul organik lainnya melalui proses metabolisme. Selanjutnya ditransformasikan pada seluruh bagian tanaman yang meliputi akar, batang dan daun serta membentuk jaringan baru dan sistem organ lainnya.
Smith dan Read (1997) menyatakan bahwa CMA sangat tergantung pada pengiriman karbon dari hasil fotosintesis inangnya yang secara kuantitatif antara 4 – 20 % digunakan oleh CMA untuk pertumbuhan vegetatif struktur reproduksi serta respirasi untuk membantu pertumbuhan termasuk penyerapan nutrisi. Apabila hasil fotosintesis yang diproduksi sedikit dan mikoriza menyerap karbohidrat tersebut maka pertumbuhan rumput akan terganggu.
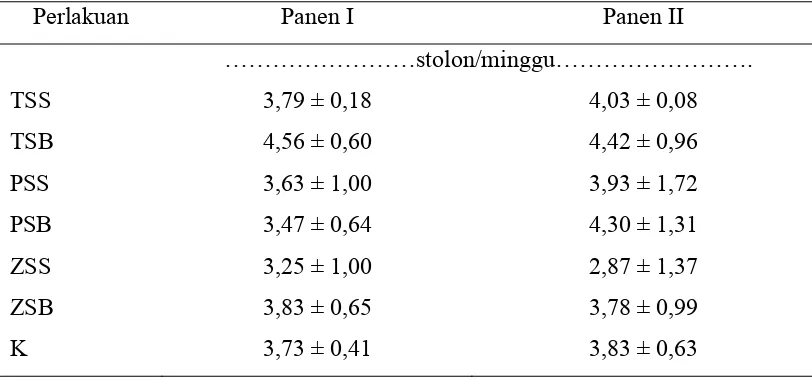
Tabel 2. Rataan Pertambahan Panjang Stolon
Perlakuan Panen I Panen II
Keterangan: superskrip yang berbeda pada kolom yang sama menunjukkan berbeda nyata (p<0.05).
Perlakuan memberikan pengaruh yang nyata (P<0.05) terhadap pertambahan panjang stolon panen II. Berdasarkan uji lanjut Duncan, pertambahan panjang stolon untuk TSS nyata (p<0,05) lebih rendah dari perlakuan lainnya yaitu sebesar 11,67 cm, sedangkan untuk perlakuan TSB, PSS, PSB, ZSS, ZSB dan kontrol tidak berbeda.
terjadi persaingan antara mikoriza yang diintroduksikan dengan mikoriza endogenus dalam perebutan karbohidrat sebagai sumber bahan pangan. Dalam hal ini mikoriza endogenus yang ada dalam tanah lebih dominanan peranannya.
Pertambahan panjang stolon untuk panen II lebih rendah. Hal ini disebabkan kapasitas lahan yang ada kurang mencukupi untuk persebarannya, sehingga pertumbuhannnya terhambat. Perlakuan TSS mengalami penurunan panjang stolon yang paling besar yaitu sekitar 35,84 %, sedangkan perlakuan PSB penurunan panjang stolon yang paling rendah yaitu 2,44 %.
Menurut Islami dan Utomo (1995) mikoriza akan berkembang dengan baik apabila tidak ada hambatan aerasi. Oleh karena itu mikoriza akan dapat berkembang lebih baik pada tanah yang berpasir dibandingkan pada tanah berliat atau gambut. Untuk dapat berkembang dengan baik mikoriza memerlukan ketersedian bahan organik yang cukup. Ketersedian hara terutama nitrogen dan fosfat yang rendah akan mendorong pertumbuhan mikoriza. Sebaliknya kandungan hara yang terlalu rendah atau terlalu tinggi menghambat pertumbuhan mikoriza
Pertambahan Jumlah Stolon
Rumput Brachiaria humidicola (Rendle) Scweick merupakan tanaman yang berkembangbiak secara vegetatif dengan menggunakan stolon. Rataan pertambahan jumlah stolon dapat dilihat pada Tabel 3. Perlakuan tidak berpengaruh terhadap pertambahan jumlah stolon panen I maupun panen II. Pertambahan jumlah stolon untuk panen I berkisar antara 3,25 sampai 4,56 stolon/minggu sedangkan untuk panen II berkisar antara 2,87 sampai 4,42 stolon/minggu (Tabel 3).
meningkatkan eksplorasi akar ke tanah guna penyerapan hara. Selain itu hifa-hifa cendawan mampu mempercepat gerakan-gerakan ion-ion hara ke permukaan akar (Gunawan, 1993).
Menurut Gunawan (1993) mekanisme transfer ion ke akar terjadi terutama melalui aliran masa dan difusi yang bergantung pada pergerakan ion di dalam tanah. Pada kondisi hara yang memadai, ion-ion NO3-, SO4- dan Ca++ sebagian besar bergerak ke akar melalui aliran masa dan serapan ion ini ditentukan oleh kapasitas serapan akar atau mikoriza. Pada ion-ion yang sukar bergerak seperti H2PO4-, NH4+, Zn++ bergerak ke akar melalui proses difusi, sehingga ion yang diserap oleh tanaman bergantung pada gerakan ion tersebut menuju permukaan akar.
Tabel 3. Rataan Pertambahan Jumlah Stolon
Perlakuan Panen I Panen II
Berat kering merupakan salah satu peubah yang digunakan untuk mengetahui tingkat pertumbuhan dan produktivitas suatu tanaman. Menurut Salisbury dan Ross (1992) masa kering lebih banyak digunakan untuk mengukur pertumbuhan dan produktivitas tanaman karena kandungan airnya tidak terlalu beragam. Rataan produksi bahan kering total Brachiaria humidicola (Rendle) Scweick dapat dilihat pada Tabel 4.
kering tajuk untuk panen II lebih besar dibanding panen I. Hal ini disebabkan rumput
Brachiaria humidicola mempunyai kemampuan regrowth yang bagus setelah terjadi pemangkasan.
Tabel 4. Rataan Berat Kering Tajuk
Perlakuan Panen I Panen II
Mikoriza belum mampu meningkatkan berat kering tajuk baik panen I maupun panen II. Perlakuan kontrol tidak menunjukkan perbedaan dengan perlakuan penambahan mikoriza. Hal ini diduga karena adanya mikoriza endogen yang ada dalam perlakuan kontrol, yang sama efektifnya dalam peningkatan produktivitas
Brachiaria humidicola. Ini dibuktikan dengan tingginya tingkat infeksi akar pada perlakuan kontrol.
Menurut Thompson (1994) ada tiga faktor utama yang menentukan keberhasilan introduksi CMA dilapang yaitu ketergantungan tanaman terhadap mikoriza, status nutrisi tanah dan potensi inokulum CMA. Disamping itu juga kepadatan populasi CMA endogenus. Keberhasilan inokulasi CMA dalam meningkatkan pertumbuhan tanaman dilapang pada tanah tidak steril masih diragukan apakah disebabkan karena pengaruh CMA saja atau merupakan efek kumulatif dari inokulum CMA dan CMA endogenus. Meskipun telah dilakukan inokulasi CMA, namun tidak dapat menjamin bahwa hanya inokulum CMA tersebut yang mengkoloni akar tanaman, karena dilapang terdapat bermacam-macam populasi CMA endogenus.
Brachiaria humidicola (Rendle) Scweick akan mencapai puncak produksi bahan kering jika masa penanaman kurang lebih satu tahun (7 periode tanam). Waktu yang singkat ini diduga CMA masih berorientasi dalam peningkatan volume akar tanaman. Smith dan Smith (1995) menyatakan bahwa hifa mempunyai area permukaan lebih besar sesudah 63 hari.
Persentase Infeksi Akar
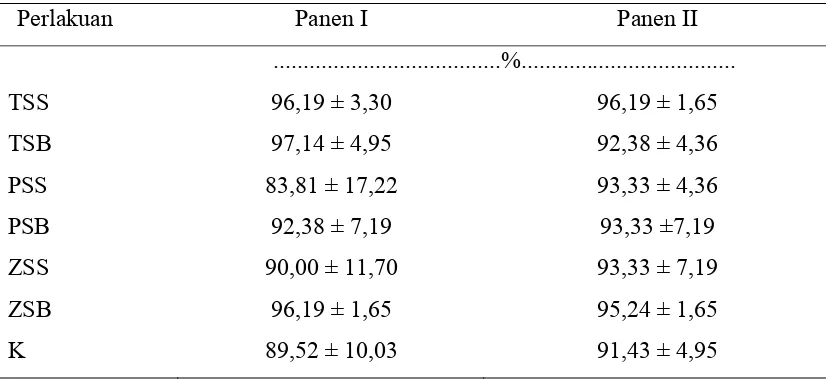
Proses infeksi CMA diawali oleh adanya propagul yang infektif dapat berupa hifa, fragmen hifa akar, dan spora (Smith dan Read, 1997). Spora cendawan mikoriza arbuskula maupun potongan akar yang dikolonisasi oleh CMA merupakan propagul yang efektif untuk awal kolonisasi pada inangnya, meskipun kemampuan bertahan hidupnya didalam tanah sangat bergantung pada propagul yang dibentuk. (Gunawan, 1993). Berdasarkan Tabel 5, hasil analisis ragam menunjukkan bahwa persentase infeksi akar untuk panen I dan II tidak berbeda nyata. Secara keseluruhan semua perlakuan terinfeksi dengan baik oleh mikoriza. Menurut Setiadi et al., (1992) bahwa persentase infeksi akar sebanyak 75-100 % termasuk kelas 5 dalam klasifikasi banyaknya akar yang terinfeksi oleh mikoriza. Ditemukannya akar yang terinfeksi mikoriza pada perlakuan kontrol diduga Brachiaria humidicola (Rendle) Scweick terinfeksi oleh mikoriza endogenus yang terdapat dalam tanah. Terjadinya infeksi oleh mikoriza endogenus dimungkinkan karena penelitian dilaksanakan dalam skala lapang sehingga tanah yang digunakan tidak mengalami sterilisasi terlebih dahulu.
Tabel 5. Rataan Persentase Infeksi Akar
Tingkat infeksi yang tinggi belum mampu meningkatkan pertumbuhan dan produktivitas Brachiaria humidicola (Rendle) Scweick. Menurut Sieverding (1991) tingkat infeksi CMA yang tinggi pada suatu tanaman, tidak selalu diiringi dengan keefektifan yang tinggi dalam absorbsi hara. Perbedaan keefektifan beberapa jenis isolat CMA dalam meningkatkan penyerapan hara, antara lain dipengaruhi oleh tingkat penyebaran hifa yang sempurna didalam tanah, kemampuan membentuk koloni yang luas, efisiensi absorbsi hara terutama fosfor dari dalam tanah, dan kecepatan waktu dalam transportasi hara melalui hifa menuju tanaman (Bagyaraj, 1992).
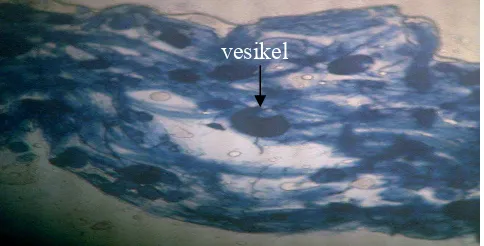
Pengamatan infeksi akar menunjukkan adanya struktur hifa dan vesikula, sedangkan arbuskula tidak ditemukan. Tidak ditemukannya arbuskula dikarenakan siklus arbuskula yang relatif pendek berkisar 4-6 hari, setelah itu arbuskula mengalami degenerasi kemudian dicerna oleh tanaman inang (Ismiyati, 2003). Selain itu akar yang diambil sudah agak tua, dimana menurut Brundrett (!991) hifa CMA tanpa arbuskula sering dijumpai pada akar-akar yang lebih tua. Gambar 3 menunjukkan akar Brachiaria humidicola (Rendle) Scweick yang tidak terinfeksi CMA serta Gambar 4 menunjukkan akar yang terinfeksi.
Gambar 3. Akar yang tidak terinfeksi oleh mikoriza
vesikel
Menurut Kusumawati (2005) infeksi akar nyata lebih tinggi dihasilkan dari perlakuan zeolit dengan tanaman inang Sorghum bicolor yaitu sebesar 99,31 %. Tanaman sorghum biasanya digunakan sebagai tanaman inang untuk produksi massal (Setiadi, 1992). Namun dalam penelitian ini inokulum mikoriza yang digunakan belum berpengaruh nyata terhadap presentase infeksi akar Brachiaria humidicola
(Rendle) Scweick. Fakuara (1988) menyatakan bahwa intensitas infeksi CMA dipengaruhi oleh beberapa faktor antara lain pemupukan dan nutrisi tanaman, pestisida, intensitas cahaya, musim, kelembaban tanah, pH tanah, kepatadatan inokulum, dan kerentanan tanaman.
Faktor pemupukan diduga sebagai faktor yang mempengaruhi intensitas infeksi. Tanah yang digunakan dalam percobaan ini diduga sudah subur sehingga penambahan pupuk terutama pupuk P kurang efektif. Kelebihan P akan mengurangi kolonisasi CMA dan produksi sporanya. Jika produksi inokulum dilakukan dengan menggunakan medium tumbuh tanah maka penambahan P tidak diperlukan (Gunawan, 1993). Untuk itu perlu dilakukan penelitian lagi dengan menggunakan dosis pupuk P yang berbeda.
Menurut Sieverding (1991) menyatakan bahwa faktor-faktor yang mempengaruhi efisiensi penyerapan hara oleh cendawan mikoriza arbuskula adalah: 1) konsentrasi P larutan tanah, konsentrasi P larutan yang tinggi karena tingkat ketersedian P tanah yang memang sudah tinggi atau pemberian pupuk P dalam dosis yang cukup tinggi sebelum terjadi kolonisasi dapat menghambat perkecambahan spora dan pertumbuhan hifa cendawan mikoriza arbuskula. 2). Jenis tanaman, kebanyakan tanaman mikotropik dapat dikolonisasi oleh kebanyakan jenis cendawan mikoriza arbuskula.
Jumlah Spora
Penghitungan jumlah spora dilakukan untuk mengetahui seberapa tinggi mikoriza dapat berkembangbiak pada kondisi media dan dengan jenis inang yang ada. Pengaruh perlakuan terhadap jumlah spora dapat dilihat pada Tabel 6. Berdasarkan Tabel 6 bahwa perlakuan tidak berpengaruh nyata terhadap jumlah spora.
disebabkan adanya makroorganisme lain yang hidup rizosfer. Hal ini bisa terjadi mengingat penelitian dilaksanakan di lapang. Interaksi CMA dan makroorganisme dapat mengurangi jumlah spora.
Tabel 6. Jumlah Spora (spora/50 g tanah)
Perlakuan Rataan
Hasil penelitian Kusumawati (2005) jumlah spora tertinggi dihasilkan pada media zeolit dengan tanaman inang Setaria splendida yaitu sebesar 3803.5 spora/50 g media, hal ini menunjukkan bahwa dalam satu gram zeolit terdapat 76,07 spora. Dalam penelitian ini jumlah sporanya berkisar antara 13-24 spora/50 g media. Menurut Setiadi et al., (1992) jumlah spora yang baik dalam 1 gram tanah adalah 30-50 spora. Rendahnya jumlah spora diduga banyak spora yang mengalami dormansi dan mati akibat dimakan oleh mikroorganisme lain seperti nematoda.
Spora CMA mengandung lipid dan karbohidrat dan dapat berperan sebagai sumber makanan bagi nematoda.nematoda dapat mengurangi potensi CMA dengan memakan hifa eksternal (Linderman, 1992). CMA tidak akan mengkoloni akar yang sudah terinfeksi nematoda dan sebaliknya nematoda jarang menginfeksi akar yang sudah dikoloni oleh CMA (Ingham, 1988).
Selain itu spora yang ditemukan juga sudah tidak utuh lagi. Sebagian spora kemungkinan mengalami dormansi. Dormansi ini mengakibatkan kurang efektifnya CMA dalam menginfeksi tanaman inang. Menurut Gunawan (1993) terjadinya dormansi kemungkinan spora CMA belum masak.
pengambilan sampel tanah disimpan selama 2 bulan sebelum pengamatan. Menurut Aryanto (2003) penyimpanan tanah selama 3 bulan menyebabkan hasil yang bervariasi terhadap jumlah spora. Dengan adanya penyimpanan selama 3 bulan ini CMA masih bisa menginfeksi akar tanaman inang, salah satunya ditunjukkan dengan jumlah spora yang dihasilkan.
KESIMPULAN DAN SARAN Kesimpulan
Berdasarkan hasil yang diperoleh dapat disimpulkan bahwa secara keseluruhan tidak ditemukan inokulum cendawan mikoriza arbuskula yang spesifik untuk meningkatkan pertumbuhan dan produktivitas Brachiaria humidicola (Rendle) Scweick. Perlakuan kontrol (tanpa inokulum) juga memberikan pengaruh yang sama terhadap pertumbuhan dan produktivitas Brachiaria humidicola (Rendle) Scweick.
Saran
UCAPAN TERIMA KASIH Bismillahirrahmanirrahiim
Puji syukur penulis panjatkan kehadirat Allah SWT dengan karunia dan rahmat-Nya yang telah melimpahkan nikmat tak terhingga dan dengan pertolongan-Nya, skripsi ini dapat diselesaikan.
Penulis mengucapkan terima kasih kepada kedua orang tua dan kakak-kakakku yang telah membantu baik materi, motivasi, doa serta kasih sayang yang tiada henti diberikannya. Juga kepada Dr. Ir Panca Dewi, M. H. K, MSi. dan Ir M. Agus Setiana, MS yang telah membimbing, mengarahkan, dan membantu penyusunan usulan proposal hingga tahap akhir penulisan skripsi ini. Selain itu ucapan terima kasih kepada Dr. Ir. Dewi Apriastuti, MS, Dr Ir Toto Toharmat, MSc, Dr Ir Tantan R Wiradarya, MSc yang telah menguji, mengkritik, memberikan sumbangan pemikiran serta masukan dalam penulisan skripsi ini.
Penulis mengucapkan terima kasih kepada Staf Laboratorium Agrostologi dan Staf Laboratorium Bioteknologi Hutan dan Lingkungan IPB yang telah membantu selama penelitian. Tak lupa kepada rekan-rekan seperjuangan Arin, Dian, Tanti, Agus yang telah membantu selama penelitian. Kepada Ryan yang tak henti-hentinya memberikan perhatian, semangat serta doa. Rekan-rekan INMT’39 Widi, Fitri, Yuli, Oky, ’Polaris’, KEPAL-D yang telah memberikan semangat serta bantuan selama penelitian. Kepada teman-teman Wisma Blobo, Diah, Endang, Delia, Santi, Dian, Yanti yang telah memberikan semangat, keceriaan dan persahabatan yang sangat berarti.
Terakhir penulis mengucapkan terima kaih banyak kepada civitas akademik Fakultas Peternakan IPB. Semoga skripsi ini bermanfaat bagi yang membacanya.
Bogor, Juni 2006
DAFTAR PUSTAKA
Anonim. 2006. Pemanfaatan zeoprima untuk efisiensi pemupukan dan peningkatan hasil pertanian. http://www.zeoprima.ip.com//. [10 Februari 2006]
Aryanto, A. T. 2003. Keragaman hayati cendawan mikoriza arbuskula pada rizosfer tanaman makanan ternak lokal potensial (lombokan, pakis, bakauan, pakis burung dn sasendok) di lahan gambut. Skripsi. Fakultas Peternakan. Institut Pertanian Bogor. Bogor
Bagyaraj, D. J. 1992. Vesicular-arbuscular mycorrhiza: application in agriculture In: tecniques for mycorrhiza research. Dalam: J. R. Norris, D Read and A. K. Varma. Techniques for Mycorrhizal Research. P. 819-833. Academic Press. London.
Bogdan, A. V. 1977. Tropical Pasture and Fodder Plants. Whiscable Litho Ltd Kent
Brundrett, M. 1991. Mycorrhizas in nature ecosystem. Adv. Ecol. Res. Vol. 21:171-313
Fakuara, M. Y. 1988. Mikoriza, Teori dan Kegunaan dalam Praktek. Pusat Antar Universitas. IPB. Bogor.
Fatchullah, D. 1995. Pengaruh dosis dan waktu pemberian kapur terhadap pertumbuhan serta hasil tanaman tomat pada tanah latosol subang. Prosiding Seminar Ilmiah Nasional Komoditi Sayuran. Balai Pengembangan Dan Penelitian Tanaman Sayuran. Bandung.
Flegman, A. W. And A.T. George. 1975. Soil and Other Growth Media. The Macmillan Press.
Gunawan, A. W. 1993. Mikoriza Arbuskula. Pusat Antar Universitas. Institut Pertanian Bogor. Bogor.
Gerderman, J. W. dan J. M. Nicolson. 1963. Spore of micorrhizal endogene species extracted from soil by wet sieving and decanting. Trans. Brit. Mycol. Soc. Vol. 46: 234-244
Hardjowigeno, S. 1995. Ilmu Tanah. Edisi Keempat. Akademi Pressindo. Jakarta.
Imas, T., R. S. Hadioetomo, A. W. Gunawan dan Y. Setiadi. 1989. Mikrobiologi Tanah II. Pusat Antar Universitas Bioteknologi. IPB. Bogor.
Ingham, R.E. 1998. Interactions Between Nematodes and Vesicular – Arbuscular Mycorrhizae. Agriculture Ecosistem and Environment. Vol. 24:169-182.
Ismiyati, U. 2003. Biodervisitas cendawan mikoriza arbuskula pada rizosfer tanaman makanan ternak introduksi dan lokal potensial di lahan gambut Kalimantan tengah. Skripsi. Fakultas Peternakan. Institut Pertanian Bogor. Bogor
Jayadi, S. 1991. Tanaman Makanan Ternak Tropika. Fakultas Peternakan. Institut Pertanian Bogor. Bogor
Koske, R. E. Dan J. H. Gemma. 1989. A modified procedure for staning roots to detect vesicular arbuscular micorrhizal. Mycol Res. Vol. 92 (4): 486-505.
Kusumawati, R. 2005. Produksi massal cendawan mikoriza arbuskula pada media tanah, pasir, zeolit dengan tanaman inang Setaria splendida Stapf dan
Sorghum bicolor (L) Moench. Skripsi. Fakultas Peternakan. IPB. Bogor
Linderman, P. G. 1992. Vesicular-arbuscular mycorrhizae and soil microbial interactions in sustainable agriculture. ASA Special Publications. Vol. 54:45-70
Mannetje, L.t and R. M. Jones. 1992. Plant Resources Of South East Asia Forages. Porsea Bogor. Indonesia
Parakkasi, A. 1995. Ilmu Nutrisi dan Makanan Ternak Ruminan. Universitas Indonesia Press. Jakarta
Phillips, J. M. dan D. S. Hayman. 1970. Improved procedures for claring root and staning parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Soc. Vol 55: 158-160
Rismunandar.1989. Shorghum Tanaman Serba Guna. PT Sinar Baru. Bandung
Salisbury, F. B. dan C. W. Ross. 1992. Fisiologi Tumbuhan. Jilid 3. ITB. Bandung.
Setiadi, Y. 1989. Pemanfaatan Mikroorganisme dalam Kehutanan. PAU-Bioteknologi Institut Pertanian Bogor. Bogor
Setiadi, Y., I. Mansyur, S. W. Budi dan Achmad. 1992. Petunjuk Laboratorium= Mikrobiologi Tanah Hutan. Pusat Antar Universitas Bioteknologi. IPB. Bogor.
Setiadi, Y dan Faiqah, N. 2004. Teknik produksi inokulum CMA dan pemanfaatannya sebagai pupuk biologis. Makalah disampaikan dalam “Workshop Teknologi Produksi Mikoriza Sebagai Pupuk Biologis”. Lembang 22 -23 Juli 2004.
Skerman, P.J. and F Riverous. 1990. Food and Agriculture. Organization of The United Nations. Rome
Smith, S.E. and D.J. Read. 1997. Mrcorrhizal Symbiosis. Academic Press. London.
Smith, F. A. Dan S. E. Smith. 1995. Nutrient transfer in vesicular-arbuscular mycorrhizal: A new model based on the distribution of ATP uses on fungal and plant membranes. Biotropia. Vol. 8: 1-10
Stasiun Klimatologi. 2005. Data klimatologi. Bogor
Steel, R.G.D. and J.H. Torrie. 1993. Prinsip dan Prosedur Statistika Suatu Pendekatan Biometrik. Edisi ke-3. Terjemahan: Bambang Sumantri. PT. Gramedia Pustaka Utama. Jakarta.
Sutarti, M. R. 1994. Zeolit. Pusat Dokumentasi dan Informasi Ilmiah. Lembaga Ilmu Pengetahuan Indonesia. Jakarta
Thompson, L. M. And F. R. Troeh. 1994. Soils and Soil Fertility. 4th. McGraw-Hill Book Company. New York
Wachjar, A., Y. Setiadi, dan N. Yunike. 2002. Pengaruh inokulasi dua species cendawan mikoriza arbuskula dan pemupukan fosfor terhadap pertumbuhan dan serapan fosfor tajuk bibit kelapa sawit (Elaeis guineensis Jacq.). Buletin Agronomi. Vol. 30 (3) : 69-74
Lampiran 1. Sidik Ragam Pertambahan Panjang Stolon Panen I
Sumber Keragaman db JK KT Fhit F0,05 Perlakuan 6 6,06568287 1,010947 0,767321 2,847727 Eror 14 18.,44502315 1,317502
Total 20 24,51070602 1,225535
Lampiran 2. Sidik Ragam Pertambahan Panjang Stolon Panen II
Sumber Keragaman db JK KT Fhit F0,05 Perlakuan 6 51,8985119 8,649752 3,316956* 2,847727 Eror 14 36,50833333 2,607738
Total 20 88,40684524 4,420342 Keterangan: * berbeda nyata (F<0,05)
La,mpiran 3. Sidik Ragam Pertambahan Jumlah Stolon Panen I
Sumber Keragaman db JK KT F hit F0,05 Perlakuan 6 3,001937831 0,500323 1,026221 2,847727 Eror 14 6,825548148 0,487539
Total 20 9,827485979 0,491374
Lampiran 4. Sidik Ragam Pertambahan Jumlah Stolon Panen II
Sumber Keragaman db JK KT F Hit F0,05 Perlakuan 6 4,587380952 0,764563 0,603206 2,847727
Eror 14 17,745 1,2675
Total 20 22,33238095 1,116619
Lampiran 5. Sidik Ragam Berat Kering Tajuk Panen I
Sumber Keragaman db JK KT F Hit F0.05 Perlakuan 6 243064,9337 40510,82 2,648503 2,847727 Eror 14 214140,3917 15295,74 Total 20 457205,3255 22860,27
Lampiran 6. Sidik Ragam Berat Kering Tajuk Panen II
Lampiran 7. Sidik Ragam Persentase Infeksi Akar Panen I
Sumber Keragaman db JK KT Fhit F0,05 Perlakuan 6 416,3536 69,39227 0,778546 2,847727 Eror 14 1247,828667 89,13062
Total 20 1664,182267 83,20911
Lampiran 8. Sidik Ragam Persentase Infeksi Akar panen II
Sumber Keragaman db JK KT Fhit F0,05 Perlakuan 6 47,42431429 7,904052 0,322587 2,847727 Eror 14 343,0288 24,50206
Total 20 390,4531143 19,52266
Lampiran 9. Sidik Ragam Jumlah Spora
Sumber Keragaman db JK KT Fhit F0,05 Perlakuan 6 301,1428571 50,19048 0,831886 2,847727 Eror 14 844,6666667 60,33333 Total 20 1145,809524 57,29048
Lampiran 10. Uji Lanjut Duncan Pertambahan Panjang Stolon Panen I
Perlakuan Rataan Superskrip
TSS 11,67 B
TSB 15,07 A
PSS 16,83 A
PSB 16,42 A
ZSS 15,35 A
ZSB 14,53 A
Lampiran 11 Data Klimatologi Tahun 2005
Bulan
Temperatur
Lembab Nisbi
Curah Hujan
Temperatur Tanah Berumput
waktu Pengamatan Waktu Pengamatan
07.00 13.00 18.00
07.00 13.00 18.00 07.00 13.00 18.00 5 cm 10 cm 20 cm 5 cm 10 cm 20 cm 5 cm 10 cm 20 cm
Juni 23,1 30,5 26,7 96 69 86 682 26,3 27,0 28,2 29,3 28,1 28,2 29,2 28,6 28,4
Juli 22,4 30,8 26,9 94 62 82 215 26,4 27,3 28,4 29,3 28,1 28,3 29,5 28,8 28,5
Agustus 22,5 30,8 27,0 93 60 80 163 27,2 28,0 29,2 29,9 28,8 29,0 30,1 29,5 29,1
September 23,1 31,3 27,0 94 61 80 320 27,3 28,2 29,3 30,5 29,1 29,4 30,2 29,8 29,5
Oktober 23,3 31,1 26,4 94 63 85 351 27,6 28,3 29,6 30,8 29,5 29,6 29,3 28,9 28,7
Rataan 22,9 30,9 26,8 94,2 63 82,5 346,3 27,0 27,0 28,2 29,3 28,1 28,2 29,2 28,6 28,4
K 2 P.SS 2 P. SB 1 Z. SB 1 Z. SB 2 P. SS 3 Z. SS 2 Z. SB 3 P. SB 3 P. SB 2
Z.SS 1 K 3 K 1 T. SB 3 T. SB 2 T. SS 2 Z. SS 3 T. SB 1 P. SS 1 T. SS 3 T. SS 1
Keterangan:
Penelitian dengan 7 perlakuan dan 3 ulangan
T. SS : Inokulum dengan media tanam tanah dan tanaman inang Setaria splendida (Stapf) T. SB: Inokulum dengan media tanam tanah dan tanaman inang Sorghum bicolor (L) Moench P. SS : Inokulum dengan media tanam pasir dan tanaman inang Setaria splendida (Stapf) P. SB : Inokulum dengan media tanam pasir dan tanaman inang Sorghum bicolor (L) Moench Z. SS : Inokulum dengan media tanam zeolit dan tanaman inang Setaria splendida (Stapf) Z. SB : Inokulum dengan media tanam zeolit dan tanaman inang Sorghum bicolor (L) Moench K : Kontrol (tanpa inokulum)
PENGUJIAN LAPANG INOKULUM CENDAWAN MIKORIZA
ARBUSKULA TERHADAP PERTUMBUHAN DAN
PRODUKTIVITAS Brachiaria humidicola
(Rendle) Scweick
SKRIPSI YANTI FITRIYATI
PROGRAM STUDI NUTRISI DAN MAKANAN TERNAK FAKULTAS PETERNAKAN
RINGKASAN
YANTI FITRIYATI. D24102054. 2006. Pengujian Lapang Inokulum Cendawan Mikoriza Arbuskula (CMA) terhadap Pertumbuhan dan Produktivitas Brachiaria humidicola (Rendle) Schweick. Skripsi. Program Studi Nutrisi dan Makanan Ternak. Fakultas Peternakan. Institut Pertanian Bogor.
Pembimbing Utama : Dr. Ir. Panca Dewi M. H. K. S., M. Si Pembimbing Anggota : Ir. M Agus Setiana, MS
Produksi massal mikoriza skala laboratorium telah dilakukan dengan menggunakan tanaman inang Setaria splendida (SS) dan Sorghum bicolor (SB) pada media tanam tanah (T), pasir (P) dan zeolit (Z). Produksi cendawan mikoriza arbuskula (CMA) yang paling baik yaitu dengan menggunakan tanaman inang
Sorghum bicolor dengan media tanam zeolit. Namun pengujian lapang inokulum hasil produksi massal skala laboratorium belum dilakukan. Penelitian ini bertujuan untuk mengetahui pengaruh pemberian inokulum mikoriza hasil produksi massal skala laboratorium terhadap pertumbuhan dan produktivitas rumput Brachiaria humidicola (Rendle) Schweick dalam skala lapang. Inokulum yang digunakan yaitu media tanam berikut akar tanaman.
Penelitian ini dilaksanakan pada bulan Mei 2005 sampai dengan Februari 2006 bertempat di Laboratorium Lapang Agrostologi dan Laboratorium Agrostologi, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor serta Laboratorium Bioteknologi Hutan dan Lingkungan, Pusat Penelitian Sumber Daya Hayati dan Bioteknologi, Institut Pertanian Bogor. Teknik pelaksanaannya meliputi penanaman dan pemeliharaan, pemanenan dan analisa laboratorium untuk menghitung persentase infeksi akar dan jumlah spora. Peubah yang diamati antara lain pertambahan panjang stolon, pertambahan jumlah stolon, berat kering tajuk, persentase infeksi akar serta jumlah spora.
Percobaaan menggunakan rancangan acak lengkap (RAL) tujuh perlakuan dengan tiga ulangan. Perlakuan antara lain dengan membedakan sumber inokulum yang digunakan. Perlakuannya antara lain TSS, TSB, PSS, PSB, ZSS, ZSB, dan kontrol (tanpa pemberian inokulum). Pengaruh perlakuan dianalisa dengan sidik ragam (ANOVA) dan jika terdapat perbedaan terhadap perlakuan dilakukan uji lanjut Duncan. Hasil penelitian menunjukkan semua inokulum CMA yang digunakan memberikan pengaruh yang sama dalam peningkatan produksi hijauan pakan ternak. Hasil penelitian menunjukkan bahwa pengaruh perlakuan nyata (P<0,05) terhadap pertambahan panjang stolon pada panen ke-2. Perlakuan TSS nyata lebih rendah dibanding perlakuan lainnya. Namun untuk pertambahan panjang stolon panen I, pertambahan jumlah stolon panen I dan II, bahan kering tajuk panen I dan II, persentase infeksi akar panen I dan II, jumlah spora tidak berpengaruh nyata.
ABSTRACT
Field Testing of Arbuscular Mycorrhiza
Fungi Inoculums to Growth and
Productivity of
Brachiaria humidicola
(Rendle) Schweick
Fitriyati, F., P.D.M.H. Karti, and M.A. Setiana
Mycorrhizas are mutuality symbioses between certain groups of soil fungi and plant root systems. Mass arbuscular mycorrhizal fungi were produced in laboratory scale. Arbuscular mycorrhiza fungi were produced by using host plant
Setaria splendida and Sorghum bicolor on growth media latosol, sand and zeolit. The aim of the experiment was to evaluate the effect of mycorrhiza inoculums application as a product of laboratory scale to the production of Brachiaria humidicola in field scale. This experiment used Completely Randomized Design with 7 treatments and 3 replications. The data were analysis with Analysis of Variance (ANOVA) and for the significant differences were further tested by Duncan range test. Variables measured were stolon length gain, stolon numbers gain, shoot dry weight, root infection percentage, and spore number. The result showed that stolon length gain in the second harvest, was significant (p<0.05).There was not significant effect of treatments to stolon length gain in the first harvest, stolon numbers gain, shoot dry weight, root infection percentage, and spore number.
PENGUJIAN LAPANG INOKULUM CENDAWAN MIKORIZA
ARBUSKULA TERHADAP PERTUMBUHAN DAN
PRODUKTIVITAS
Brachiaria humidicola
(Rendle) Scweick
YANTI FITRIYATI D24102054
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan
pada Fakultas Peternakan Institut Pertanian Bogor
PROGRAM STUDI NUTRISI DAN MAKANAN TERNAK FAKULTAS PETERNAKAN
PENGUJIAN LAPANG INOKULUM CENDAWAN MIKORIZA
ARBUSKULA TERHADAP PERTUMBUHAN DAN
PRODUKTIVITAS
Brachiaria humidicola
(Rendle) Scweick
Oleh :
YANTI FITRIYATI D4102054
Skripsi ini telah disetujui dan disidangkan dihadapan Komisi Ujian Lisan pada Tanggal 12 Juni 2006
Pembimbing Utama Pembimbing Anggota
Dr. Ir. Panca Dewi M.H.K.S., M.Si. Ir. M. Agus Setiana, MS. NIP. 131 672 157 NIP. 131 473 998
Dekan Fakultas Peternakan Institut Pertanian Bogor
RIWAYAT HIDUP
Penulis dilahirkan di Pekalongan pada tanggal 31 Januari 1984. Penulis adalah anak ketujuh dari tujuh bersaudara dari pasangan Bapak A. Busyaeri dan Ibu Masturoh.
Pendidikan dasar diselesaikan pada tahun 1996 di MIM Delegtukang, Wiradesa. Pendidikan lanjutan tingkat pertama diselesaikan pada tahun 1999 di SLTP N I Wiradesa, Pekalongan. Pendidikan lanjutan menengah umum diselesaikan pada tahun 2002 di SMU N I Pekalongan.
KATA PENGANTAR
Bismillahirrohmanirrohim,
Alhamdulillah, segala puji syukur penulis panjatkan kehadiran Allah SWT atas segala nikmat, rahmat serta hidayah-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul ‘Pengujian Lapang Inokulum Cendawan Mikoriza Arbuskula terhadap Pertumbuhan dan Produktivitas Brachiaria humidicola (Rendle) Scweick. Skripsi ini ditulis berdasarkan penelitian dari bulan Mei 2005 sampai Februari 2006. di Laboratorium Lapang Agrostologi, Laboratorium Agrostologi. Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor, serta Laboratorium Bioteknologi Hutan dan Lingkungan, Pusat Penelitian Sumber Daya Hayati dan Bioteknologi, Institut Pertanian Bogor.
Ketersedian hijauan khususnya rumput masih sangat rendah baik dari segi kualitas maupun kuantitasnya. Kesuburan tanah untuk lahan penanaman rumput masih rendah, sehingga kandungan unsur hara didalam tanah belum mampu mencukupi kebutuhan tanaman dengan baik. Seiring kemajuan bioteknologi telah berhasil ditemukan mikroorganisme yang mempunyai peran positip dalam memperbaiki lahan-lahan miskin hara dan menstimulasi pertumbuhan. Salah satunya dengan menggunakan cendawan yaitu cendawan mikoriza arbuskula
Produksi massal CMA skala laboratorium telah dilakukan dengan menggunakan tanaman inang Setaria splendida Stapf dan Sorghum bicolor (L) Moench pada media tanam zeolit, pasir, serta tanah latosol. Inokulum yang dihasilkan akan diujicobakan pada skala lapang. Inokulum yang digunakan berupa akar tanaman inang dan media tanam berupa tanah, pasir dan zeolit.
Penulis mengharapkan skripsi ini dapat bermanfaat untuk kalangan akademis sebagai sumber referensi. Penulis juga mengucapkan terima kasih atas saran dan masukan dari berbagai pihak demi kesempurnaan skripsi ini.
Bogor, Juni 2006
DAFTAR ISI
Cendawan Mikoriza Arbuskula (CMA) ... 4
Inokulum CMA ... 6
Brachiaria humidicola (Rendle) Scweick ... 9
Setaria splendida Stapf ... 9
Sorghum bicolor (L) Moench ... 10
Persiapan Inokulum……… 13
Persiapan Bedengan ... 14
Penanaman dan Pemeliharaan... 14
Pemanenan... 14
Pengamatan Umum ... 15
Rekapitulasi Analisis Ragam... 16
Pertambahan Panjang Stolon... 16
Pertambahan Jumlah Stolon ... 18
Berat Kering Tajuk ... 19
Persentase Infeksi Akar ... 21
Jumlah Spora ... 23
KESIMPULAN DAN SARAN...26
Kesimpulan... 26
Saran ... 26
UCAPAN TERIMA KASIH ... 27
DAFTAR PUSTAKA ... 28
LAMPIRAN ... 31
DAFTAR TABEL
Nomor Halaman
1. Rekapitulasi Analisis Ragam ... 16
2. Rataan Pertambahan Panjang Stolon ... 17
3. Rataan Pertambahan Jumlah Stolon ... 19
4. Rataan Berat Kering Tajuk ... 20
5. Rataan Persentase Infeksi Akar ... 22
6. Rataan Jumlah Spora ... 24