ABSTRAK
SIRA STEPHANANDRA. Isolat Bakteri
Shigella
sp. dan Leukosit dari
Anak-Anak Penderita Diare di Puskesmas Sindang Barang. Dibimbing oleh SRI
BUDIARTI dan TRI HERU WIDARTO.
Diare merupakan salah satu masalah kesehatan di Indonesia dan negara
berkembang lainnya.
Shigella
merupakan bakteri patogen kedua yang paling
sering dideteksi pada penderita diare.
Penelitian ini bertujuan mengisolasi dan
mengidentifikasi bakteri
Shigella
serta mengetahui jumlah leukosit dari anak-anak
penderita diare di Puskesmas Sindang Barang. Sampel feses diambil dengan
teknik
rectal swab
. Sampel darah diambil dari jari. Isolasi
Shigella
dengan
Salmonella-Shigella
agar. Penghitungan leukosit dengan metode Simmon. Uji
biokimia dilakukan, yaitu uji MR-VP, indol, sitrat, fermentasi glukosa, H
2S, dan
urea. Dari 100 sampel, didapat 13 isolat yang diduga sebagai
Shigella
. Uji
biokimia dilakukan terhadap 13 isolat. Setelah uji biokimia diperoleh 9 isolat
Shigella
. Persentase
Shigella
yang didapatkan sebesar 9%. Jumlah leukosit yang
diperoleh bervariasi dari leukopenia hingga normal.
ABSTRACT
SIRA STEPHANANDRA. Isolates of
Shigella
Bacteria and Leukocytes from
Children with Diarrhea in Sindang Barang Health Center. Under direction of SRI
BUDIARTI and TRI HERU WIDARTO.
Diarrhea is one of the health problems in Indonesia and other developing
countries.
Shigella
is the second most frequently detected pathogenic bacteria in
patients with diarrhea. This research was conducted to isolate and identify the
Shigella
bacteria and to discover leukocytes count from children with diarrhea in
Sindang Barang health center. Feces samples were obtained with rectal swab.
PENDAHULUAN
Latar BelakangDiare merupakan salah satu masalah kesehatan dan penyebab kematian anak-anak di negara berkembang (Gunduz et al. 2007; Qureishi et al. 2008) termasuk Indonesia (Hendrawati et al. 2005).
Diare adalah pengeluaran feses >200g/hari yang bersifat encer atau berair sebanyak ≥ tiga kali sehari (Eppy 2009). Diare dapat disebabkan oleh bakteri, virus, dan protozoa (Tortora et al. 2007). Salah satu bakteri penyebab diare dan bakteri patogen kedua yang paling sering dideteksi pada penderita diare adalah Shigella (Eppy 2009; Tjaniadi et al. 2003). Kasus diare yang disebabkan oleh Shigella di Mesir antara tahun 1986-1993 sebesar 30% (Wasfy et al. 2000), di Tunisia sebesar 4% (Al-Gallas et al. 2007), di Turki sebesar 1.6% (Gunduz et al. 2007), dan di Indonesia sebesar 5%, yang diteliti dari tahun 1998-1999 ( Subekti 2001).
Shigella merupakan bakteri gram negatif, anaerob fakultatif, berbentuk batang, nonmotil, dan tidak membentuk kapsul, memiliki uji indol yang bervariasi, uji Metil Red (MR) positif, uji Voges-Proskauer (VP) dan Simmons sitrat negatif, tidak memproduksi H2S, uji urease negatif, dapat
memfermentasi gula dan beberapa strain menghasilkan gas CO2 (Qureishi et al. 2008;
Bergey & Holt 1994). Terdapat empat spesies Shigella penyebab diare yaitu S. boydii, S. dysenteriae, S. flexneri, dan S. sonnei (Qureishi et al. 2008; Talukder et al. 2007; Subekti et al. 2001). Shigella dapat diisolasi dari feses pasien penderita diare, makanan yang tercemar, dan lalat rumah (Walters et al. 1954; Ugbogu et al. 2006).
Shigella menginfeksi manusia melalui jalur fecal-oral, dapat menginvasi mukosa usus serta berkembang biak dalam sel epitel hingga menyebabkan kematian sel. Kematian sel epitel menyebabkan Shigella bermigrasi ke sel di sekitarnya dan melakukan mekanisme yang sama sehingga menyebabkan rusaknya jaringan epitel usus (Finlay & Falkow 1989; Eppy 2009; Fontaine et al. 1998).
Infeksi dapat menyebabkan kenaikan jumlah leukosit. Leukosit merupakan sel darah yang berfungsi sebagai pertahanan tubuh untuk membantu melawan infeksi yang masuk kedalam tubuh (Tortora et al. 2007). Data profil kesehatan Indonesia tahun 2008 memperlihatkan terjadinya Kasus Luar Biasa (KLB) diare di 15 provinsi dengan jumlah penderita sebanyak 8 443 orang dan jumlah kematian sebanyak 209 orang. Kasus diare di
kota Bogor pada tahun 2007 sebanyak 23 416 kasus (DEPKES 2009). Publikasi mengenai diare yang disebabkan oleh Shigella di Indonesia tidak banyak ditemui terutama kasus yang terjadi pada anak-anak. Umumnya masyarakat lebih memilih membawa anak yang sakit ke puskesmas karena biaya yang lebih murah dari rumah sakit.
TujuanPenelitian
Penelitian bertujuan mengisolasi dan mengidentifikasi bakteri Shigella serta mengetahui jumlah leukosit dari anak-anak penderita diare di Puskesmas Sindang Barang.
METODE
Waktu dan Tempat PenelitianPenelitian dilaksanakan pada bulan Februari 2010 hingga Oktober 2010. Pengambilan sampel dilakukan di Puskesmas Sindang Barang. Isolasi bakteri dilakukan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB, Dramaga, Bogor. Penghitungan sel darah putih dilakukan di Laboratorium Biosistematika dan Ekologi Hewan, Departemen Biologi, FMIPA IPB, Dramaga, Bogor.
Probandus
Sampel feses dan darah diambil dari 100 pasien anak-anak penderita diare usia 2 bulan sampai 11 tahun.
Pengambilan Sampel
1. Sampel feses
Sampel feses diperoleh melalui teknik rectal swab (Adkins & Santiago 1987) menggunakan cutton bud steril dari 100 anak penderita diare di ruang Laboratorium Puskesmas Sindang Barang. Cotton bud kemudian dimasukkan ke dalam larutan Phosfat Buffer Saline (PBS) steril dan selanjutnya dibawa ke Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB, Dramaga, Bogor untuk dilakukan isolasi.
2. Sampel darah
PENDAHULUAN
Latar BelakangDiare merupakan salah satu masalah kesehatan dan penyebab kematian anak-anak di negara berkembang (Gunduz et al. 2007; Qureishi et al. 2008) termasuk Indonesia (Hendrawati et al. 2005).
Diare adalah pengeluaran feses >200g/hari yang bersifat encer atau berair sebanyak ≥ tiga kali sehari (Eppy 2009). Diare dapat disebabkan oleh bakteri, virus, dan protozoa (Tortora et al. 2007). Salah satu bakteri penyebab diare dan bakteri patogen kedua yang paling sering dideteksi pada penderita diare adalah Shigella (Eppy 2009; Tjaniadi et al. 2003). Kasus diare yang disebabkan oleh Shigella di Mesir antara tahun 1986-1993 sebesar 30% (Wasfy et al. 2000), di Tunisia sebesar 4% (Al-Gallas et al. 2007), di Turki sebesar 1.6% (Gunduz et al. 2007), dan di Indonesia sebesar 5%, yang diteliti dari tahun 1998-1999 ( Subekti 2001).
Shigella merupakan bakteri gram negatif, anaerob fakultatif, berbentuk batang, nonmotil, dan tidak membentuk kapsul, memiliki uji indol yang bervariasi, uji Metil Red (MR) positif, uji Voges-Proskauer (VP) dan Simmons sitrat negatif, tidak memproduksi H2S, uji urease negatif, dapat
memfermentasi gula dan beberapa strain menghasilkan gas CO2 (Qureishi et al. 2008;
Bergey & Holt 1994). Terdapat empat spesies Shigella penyebab diare yaitu S. boydii, S. dysenteriae, S. flexneri, dan S. sonnei (Qureishi et al. 2008; Talukder et al. 2007; Subekti et al. 2001). Shigella dapat diisolasi dari feses pasien penderita diare, makanan yang tercemar, dan lalat rumah (Walters et al. 1954; Ugbogu et al. 2006).
Shigella menginfeksi manusia melalui jalur fecal-oral, dapat menginvasi mukosa usus serta berkembang biak dalam sel epitel hingga menyebabkan kematian sel. Kematian sel epitel menyebabkan Shigella bermigrasi ke sel di sekitarnya dan melakukan mekanisme yang sama sehingga menyebabkan rusaknya jaringan epitel usus (Finlay & Falkow 1989; Eppy 2009; Fontaine et al. 1998).
Infeksi dapat menyebabkan kenaikan jumlah leukosit. Leukosit merupakan sel darah yang berfungsi sebagai pertahanan tubuh untuk membantu melawan infeksi yang masuk kedalam tubuh (Tortora et al. 2007). Data profil kesehatan Indonesia tahun 2008 memperlihatkan terjadinya Kasus Luar Biasa (KLB) diare di 15 provinsi dengan jumlah penderita sebanyak 8 443 orang dan jumlah kematian sebanyak 209 orang. Kasus diare di
kota Bogor pada tahun 2007 sebanyak 23 416 kasus (DEPKES 2009). Publikasi mengenai diare yang disebabkan oleh Shigella di Indonesia tidak banyak ditemui terutama kasus yang terjadi pada anak-anak. Umumnya masyarakat lebih memilih membawa anak yang sakit ke puskesmas karena biaya yang lebih murah dari rumah sakit.
TujuanPenelitian
Penelitian bertujuan mengisolasi dan mengidentifikasi bakteri Shigella serta mengetahui jumlah leukosit dari anak-anak penderita diare di Puskesmas Sindang Barang.
METODE
Waktu dan Tempat PenelitianPenelitian dilaksanakan pada bulan Februari 2010 hingga Oktober 2010. Pengambilan sampel dilakukan di Puskesmas Sindang Barang. Isolasi bakteri dilakukan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB, Dramaga, Bogor. Penghitungan sel darah putih dilakukan di Laboratorium Biosistematika dan Ekologi Hewan, Departemen Biologi, FMIPA IPB, Dramaga, Bogor.
Probandus
Sampel feses dan darah diambil dari 100 pasien anak-anak penderita diare usia 2 bulan sampai 11 tahun.
Pengambilan Sampel
1. Sampel feses
Sampel feses diperoleh melalui teknik rectal swab (Adkins & Santiago 1987) menggunakan cutton bud steril dari 100 anak penderita diare di ruang Laboratorium Puskesmas Sindang Barang. Cotton bud kemudian dimasukkan ke dalam larutan Phosfat Buffer Saline (PBS) steril dan selanjutnya dibawa ke Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB, Dramaga, Bogor untuk dilakukan isolasi.
2. Sampel darah
FMIPA IPB, Dramaga, Bogor untuk penghitungan jumlah leukosit.
Isolasi Bakteri
Sampel feses dari larutan PBS masing-masing disebar sebanyak dua ulangan pada media cawan Salmonella-Shigella agar (Criterion). Sampel diinkubasi menggunakan inkubator (Gemmyco IN-010) selama 24 jam pada suhu 37 oC. Koloni yang memberikan penampakan kusam atau tidak berwarna diambil dan dilakukan pemurnian dengan metode cawan kuadran. Koloni yang telah murni selanjutnya disimpan pada media Salmonella-Shigella agar (SSA) miring.
Penghitungan Leukosit
Darah dikeluarkan dari dalam hematokrit dan ditempatkan dalam tabung eppendorf. Darah diambil menggunakan pipet Thoma sampai batas 0.5. Setelah itu larutan pengencer dipipet sampai batas 11. Pipet dikocok membentuk gerakan angka delapan selama 12 kali untuk mencampurkan darah dengan larutan Turk. Darah diteteskan ke hemasitometer dan ditutup dengan kaca penutup. Leukosit dihitung pada empat kotak terbesar yang terletak di tiap sudut hemasitometer. Leukosit kemudian dihitung menggunakan rumus:
V = plt
V = (1)(1)(1/10) mm3
V untuk 4 kotak = (4)(1/10) mm3 = 0.4 mm3 Faktor pengenceran = 1/20
Σ leukosit ml-1 = (Σ leukosit hitungan) / [(0.4 mm3 )(1/20)] (Simmon 1976)
Identifikasi Bakteri
Pewarnaan gram dilakukan pada koloni yang diduga Shigella. Satu lup akuades steril diambil dan disebar ke permukaan kaca objek. Setelah itu diambil satu lup bakteri yang berumur 18 jam dan disebar di kaca objek. Olesan bakteri dibiarkan kering udara dan setelah itu dilakukan fiksasi panas. Olesan bakteri kemudian diwarnai dengan perwarna ungu kristal selama 1 menit. Kelebihan zat warna dibilas dengan akuades, dilanjutkan dengan pemberian iodium gram selama 2 menit, lalu dibilas lagi dengan akuades dan dilakukan pemucatan dengan alkohol 95%. Setelah itu, olesan diwarnai dengan safranin selama 30 detik lalu dibilas dengan akuades. Setelah kering, olesan bakteri dilihat di bawah mikroskop dengan perbesaran 1000x, kemudian dilanjutkan dengan uji biokimia.
1. Uji Indol
Uji indole mengunakan media tripton 1% (Oxoid). Sebanyak satu lup koloni Shigella dimasukkan ke dalam kaldu tripton dan diinkubasi selama 24 jam pada suhu 37 oC. Hasil uji dapat diketahui dengan meneteskan reagen Kovac.
2. Uji MR-VP
Sebanyak satu lup koloni Shigella dimasukkan ke dalam kaldu MR-VP (Difco) dan diinkubasi (Gemmyco IN-010) selama 24 jam untuk uji MR dan 5 hari untuk uji VP pada suhu 37 oC. Uji MR diuji dengan meneteskan 10 tetes indikator merah metil ke dalam kaldu MR/VP. Uji VP dilakukan dengan meneteskan 10 tetes α-naphtol 5% dan 10 tetes larutan KOH 40%, dikocok dan dilihat perubahan warna yang terjadi.
3. Uji urease
Sebanyak satu lup koloni Shigella dimasukkan ke dalam kaldu urease (Difco) dan diinkubasi selama 5 hari dengan pengamatan setiap hari pada suhu 37 oC. 4. Uji Simmon sitrat
Sebanyak satu lup koloni Shigella digoreskan dan ditusukkan pada media Simmon sitrat. Inkubasi dilakukan selama 24 jam pada suhu 37 oC.
5. Uji fermentasi karbohidrat dan H2S pada
Triple Sugar Iron Agar (TSIA)
Sebanyak satu lup koloni Shigella digoreskan dan ditusukkan pada media TSIA (Difco). Inkubasi dilakukan selama 24 jam pada suhu 37 oC.
6. Uji fermentasi glukosa
Sebanyak satu lup koloni Shigella dimasukkan ke dalam larutan glukosa 0.2% steril yang telah diberi Bromthymol Blue (BTB) sebagai indikator pH. Inkubasi selama 1-10 hari (Hall et al 1972) pada suhu 37 oC.
HASIL
Seratus sampel feses diperoleh dari anak-anak penderita diare di ruang Laboratorium Puskesmas Sindang Barang. Penderita diare berasal dari lima kelurahan, yaitu Sindang Barang, Bubulak, Situ Gede, Marga Jaya, dan Balumbang Jaya. Hasil isolasi feses pada media SSA didapatkan 13 isolat dengan penampakan koloni bening yang diduga sebagai koloni Shigella (Gambar 1).
2
FMIPA IPB, Dramaga, Bogor untuk penghitungan jumlah leukosit.
Isolasi Bakteri
Sampel feses dari larutan PBS masing-masing disebar sebanyak dua ulangan pada media cawan Salmonella-Shigella agar (Criterion). Sampel diinkubasi menggunakan inkubator (Gemmyco IN-010) selama 24 jam pada suhu 37 oC. Koloni yang memberikan penampakan kusam atau tidak berwarna diambil dan dilakukan pemurnian dengan metode cawan kuadran. Koloni yang telah murni selanjutnya disimpan pada media Salmonella-Shigella agar (SSA) miring.
Penghitungan Leukosit
Darah dikeluarkan dari dalam hematokrit dan ditempatkan dalam tabung eppendorf. Darah diambil menggunakan pipet Thoma sampai batas 0.5. Setelah itu larutan pengencer dipipet sampai batas 11. Pipet dikocok membentuk gerakan angka delapan selama 12 kali untuk mencampurkan darah dengan larutan Turk. Darah diteteskan ke hemasitometer dan ditutup dengan kaca penutup. Leukosit dihitung pada empat kotak terbesar yang terletak di tiap sudut hemasitometer. Leukosit kemudian dihitung menggunakan rumus:
V = plt
V = (1)(1)(1/10) mm3
V untuk 4 kotak = (4)(1/10) mm3 = 0.4 mm3 Faktor pengenceran = 1/20
Σ leukosit ml-1 = (Σ leukosit hitungan) / [(0.4 mm3 )(1/20)] (Simmon 1976)
Identifikasi Bakteri
Pewarnaan gram dilakukan pada koloni yang diduga Shigella. Satu lup akuades steril diambil dan disebar ke permukaan kaca objek. Setelah itu diambil satu lup bakteri yang berumur 18 jam dan disebar di kaca objek. Olesan bakteri dibiarkan kering udara dan setelah itu dilakukan fiksasi panas. Olesan bakteri kemudian diwarnai dengan perwarna ungu kristal selama 1 menit. Kelebihan zat warna dibilas dengan akuades, dilanjutkan dengan pemberian iodium gram selama 2 menit, lalu dibilas lagi dengan akuades dan dilakukan pemucatan dengan alkohol 95%. Setelah itu, olesan diwarnai dengan safranin selama 30 detik lalu dibilas dengan akuades. Setelah kering, olesan bakteri dilihat di bawah mikroskop dengan perbesaran 1000x, kemudian dilanjutkan dengan uji biokimia.
1. Uji Indol
Uji indole mengunakan media tripton 1% (Oxoid). Sebanyak satu lup koloni Shigella dimasukkan ke dalam kaldu tripton dan diinkubasi selama 24 jam pada suhu 37 oC. Hasil uji dapat diketahui dengan meneteskan reagen Kovac.
2. Uji MR-VP
Sebanyak satu lup koloni Shigella dimasukkan ke dalam kaldu MR-VP (Difco) dan diinkubasi (Gemmyco IN-010) selama 24 jam untuk uji MR dan 5 hari untuk uji VP pada suhu 37 oC. Uji MR diuji dengan meneteskan 10 tetes indikator merah metil ke dalam kaldu MR/VP. Uji VP dilakukan dengan meneteskan 10 tetes α-naphtol 5% dan 10 tetes larutan KOH 40%, dikocok dan dilihat perubahan warna yang terjadi.
3. Uji urease
Sebanyak satu lup koloni Shigella dimasukkan ke dalam kaldu urease (Difco) dan diinkubasi selama 5 hari dengan pengamatan setiap hari pada suhu 37 oC. 4. Uji Simmon sitrat
Sebanyak satu lup koloni Shigella digoreskan dan ditusukkan pada media Simmon sitrat. Inkubasi dilakukan selama 24 jam pada suhu 37 oC.
5. Uji fermentasi karbohidrat dan H2S pada
Triple Sugar Iron Agar (TSIA)
Sebanyak satu lup koloni Shigella digoreskan dan ditusukkan pada media TSIA (Difco). Inkubasi dilakukan selama 24 jam pada suhu 37 oC.
6. Uji fermentasi glukosa
Sebanyak satu lup koloni Shigella dimasukkan ke dalam larutan glukosa 0.2% steril yang telah diberi Bromthymol Blue (BTB) sebagai indikator pH. Inkubasi selama 1-10 hari (Hall et al 1972) pada suhu 37 oC.
HASIL
Seratus sampel feses diperoleh dari anak-anak penderita diare di ruang Laboratorium Puskesmas Sindang Barang. Penderita diare berasal dari lima kelurahan, yaitu Sindang Barang, Bubulak, Situ Gede, Marga Jaya, dan Balumbang Jaya. Hasil isolasi feses pada media SSA didapatkan 13 isolat dengan penampakan koloni bening yang diduga sebagai koloni Shigella (Gambar 1).
Gambar 1 Penampakan koloni yang diduga sebagai Shigella pada media SSA. Koloni-koloni yang dicurigai sebagai Shigella diwarnai dengan pewarnaan gram dan menunjukkan ciri bakteri gram negatif (Gambar 2). Hasil uji biokimia dapat dilihat pada Tabel 1. Hasil positif uji MR (Metil Red) (Gambar 3) dan VP (Voges-Proskauer) (Gambar 4) ditandai dengan perubahan warna media menjadi merah. Hasil uji H2S negatif
ditandai dengan tidak adanya perubahan warna menjadi hitam pada media TSIA (Gambar 5). Uji sitrat positif ditandai dengan berubahnya warna media menjadi biru (Gambar 6). Uji indole positif ditandai dengan adanya cincin merah setelah diberi reagen kovac (Gambar 7). Uji glukosa positif ditandai dengan berubahnya warna media menjadi kuning, adanya gas dapat dilihat di dalam tabung durham (Gambar 8). Uji Urea positif ditandai dengan berubahnya warna media menjadi merah keunguan (Gambar 9).
Gambar 2 Pewarnaan gram Shigella (Perbesaran 1000x).
Gambar 3 Uji MR Shigella a) Hasil negatif b) Hasil positif.
Gambar 4 Uji VP Shigella a) Hasil negatif b) Hasil positif.
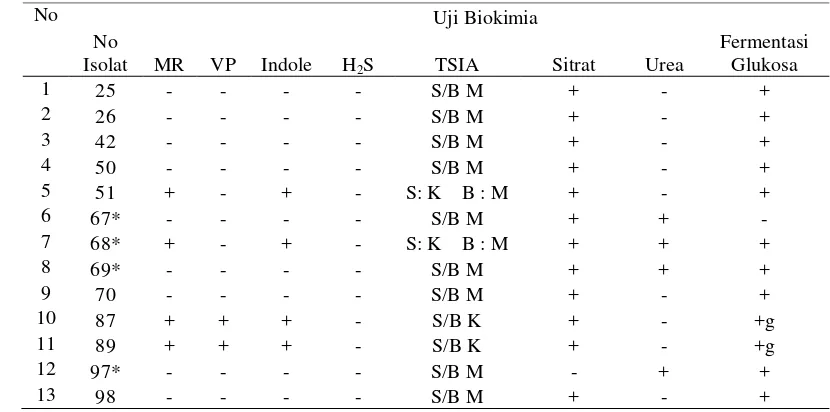
No No Isolat
Uji Biokimia
MR VP Indole H2S TSIA Sitrat Urea
Fermentasi Glukosa
1 25 - - - - S/B M + - +
2 26 - - - - S/B M + - +
3 42 - - - - S/B M + - +
4 50 - - - - S/B M + - +
5 51 + - + - S: K B : M + - +
6 67* - - - - S/B M + + -
7 68* + - + - S: K B : M + + +
8 69* - - - - S/B M + + +
9 70 - - - - S/B M + - +
10 87 + + + - S/B K + - +g
11 89 + + + - S/B K + - +g
12 97* - - - - S/B M - + +
13 98 - - - - S/B M + - +
Tabel 1 Hasil uji biokimia isolat bening pada media SSA
4
Gambar 5 Uji H2S Shigella pada agar TSIA
dengan uji H2S negatif a) dapat
memfermentasi glukosa, laktosa dan/atau sukrosa b) tidak ada reaksi fermentasi c) dapat memfermentasi glukosa.
Gambar 6 Uji sitrat Shigella pada media simmon sitrat a) Hasil positif
b) Hasil negatif.
Gambar 7 Uji indole Shigella pada media tripton 1% a) Hasil negatif b) Hasil positif.
Gambar 8 Uji fermentasi glukosa Shigella a) Hasil positif b) Hasil negatif c) Hasil positif dengan gas.
Gambar 9 Uji urease Shigella pada media urea a) Hasil negatif b) Hasil positif.
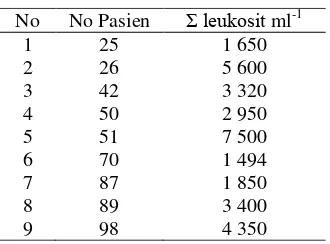
Hasil perhitungan jumlah leukosit bervariasi dari leukopenia hingga normal. Keadaan pasien dapat dilihat pada Tabel 2 dan hasil penghitungan leukosit dapat dilihat pada Tabel 3.
No
No Pasien
Keadaan Pasien
Umur Gender Tipe diare Demam
1 25 2 tahun L Cair -
2 26 8 tahun L Berlendir +
3 42 10 tahun L Cair -
4 50 10 bulan L Cair +
5 51 1 tahun 2 bulan L Cair -
6 70 3 tahun 3 bulan L Cair +
7 87 3 tahun P Cair +
8 89 1 tahun 6 bulan L Berlendir -
9 98 1 tahun 6 bulan P Cair -
Tabel 2 Keadaan pasien yang pada fesesnya terdapat Shigella
PEMBAHASAN
Koloni yang bersifat laktosa negatif akan memberikan penampakan koloni tidak berwarna pada media SSA. Koloni yang dapat memfermentasi laktosa akan memberikan penampakan koloni berwarna merah, hal itu disebabkan oleh fermentasi laktosa yang menghasilkan asam dan dengan adanya indikator neutral red akan memberikan warna merah pada koloni (Cherry 1961).
Uji MR dan uji VP menggunakan media yang sama yaitu kaldu glukosa. Fermentasi asam campuran dilihat dengan uji MR. Fermentasi asam campuran menyebabkan pH media menjadi asam. Merah metil merupakan indikator yang akan berwarna merah pada keadaan asam. Hasil positif uji MR diperlihatkan dengan berubahnya warna media menjadi merah ketika ditetesi indikator merah metil (Winn et al. 2005). Shigella memiliki hasil MR positif, namun dari uji biokimia hanya ditemukan dua dari isolat yang memiliki hasil uji MR positif. Walupun begitu, Dodd dan Jones (1982) melaporkan bahwa terdapat spesies dari Shigella yang menunjukkan hasil uji MR negatif, yaitu S. flexneri.
Uji VP merupakan uji untuk mendeteksi pembentukan 2,3 butanadiol secara tidak langsung. Senyawa acetoin (acetil methyl carbinol) merupakan senyawa prekursor bagi 2,3 butanadiol. Penambahan KOH menyebabkan berubahnya acetoin menjadi diasetil. Diasetil akan membentuk suatu kompleks berwarna merah ketika ditambahkan α-naphtol. Warna merah ini menunjukkan hasil positif. Bakteri yang membentuk 2,3 butanadiol menghasilkan sedikit asam campuran yang jumlahnya tidak cukup untuk mengubah pH media menjadi asam (Winn et al. 2005).
Indol merupakan salah satu produk hasil metabolisme triptopan. Bakteri yang memiliki enzim triptopanase dapat memecah triptopan menjadi indol, asam piruvat, dan ammonia (Gooder & Happold 1953; Karim et al. 1981). Produksi indol dapat dilihat dari munculnya warna merah setelah penambahkan reagen yang mengandung p-dimetilaminobenzaldehid (Winn et al. 2005). Reed (1942) melaporkan beberapa bakteri genus Clostridium dapat membentuk indol dan dengan cepat memecah kembali indol yang dihasilkan sehingga didapat hasil negatif semu.
Agar miring TSI memberikan empat macam pola reaksi. Pola reaksi pertama berupa warna merah pada slant (bagian miring agar) dan butt (bagian dasar agar) yang menunjukkan tidak ada reaksi fermentasi glukosa. Pola reaksi kedua berupa warna merah pada slant dan warna kuning pada butt yang menunjukkan terjadinya fermentasi glukosa. Pola reaksi ketiga slant dan butt berwarna kuning yang menunjukkan fermentasi glukosa, laktosa, dan/atau sukrosa. Pola reaksi keempat adanya warna hitam yang menandakan terjadinya pembentukan gas H2S
(Madigan et al. 2009). Isolat 87 dan 89 menghasilkan warna kuning pada seluruh bagian agar hal ini menandakan dapat difermentasikannya glukosa, laktosa, dan/atau sukrosa. Shigella dysenteriae 1 dan S. sonnei dapat memfermentasi laktosa secara lambat (Ito et al. 1991). Uji H2S dilakukan untuk
mengetahui dihasilkannya gas H2S oleh
bakteri. Produksi gas ini ditandai dengan berubahnya warna media menjadi hitam. Gas H2S yang bereaksi dengan FeSO4 akan
membentuk FeS yang berwarna hitam (Winn et al 2005).
Hasil positif uji fermentasi glukosa ditandai dengan adanya perubahan warna media menggunakan indikator bromthymol blue (BTB) dari biru ke jingga. Hal ini terjadi karena bakteri menurunkan pH media sebagai akibat dari terjadinya fermentasi glukosa (Gubash et al. 1988). Shigella pada umumnya memfermentasi glukosa tanpa menghasilkan gas namun S. flexneri 6, S. boydii 13 dan 14 dan S. dysenteriae 3 menghasilkan gas (Germani & Sansonetti 2006).
Media Simmon sitrat digunakan untuk menguji kemampuan bakteri memanfaatkan sodium sitrat sebagai sumber karbon dan ammonium fosfat sebagai sumber nitrogen. Media ini menggunakan BTB sebagai indikator pH. Perubahan warna media menjadi biru menunjukkan perubahan pH media menjadi basa dan uji sitrat positif. Karbon dan No No Pasien Σ leukosit ml-1
1 25 1 650
2 26 5 600
3 42 3 320
4 50 2 950
5 51 7 500
6 70 1 494
7 87 1 850
8 89 3 400
9 98 4 350
6
nitrogen yang berasal dari dinding sel bakteri dalam jumlah yang cukup dapat memberikan hasil positif palsu. Hal ini dapat terjadi pada penggoresan inokulum yang terlalu banyak (Winn et al. 2005). Asagi et al. (1980) melaporkan sifat sitrat positif dapat ditranferkan kepada Shigella yaitu S. sonnei dan S. flexneri yang tadinya memiliki sifat sitrat negatif.
Uji urease menggunakan media kaldu urea dengan indikator merah fenol yang akan berwarna keunguan pada kondisi basa. Bakteri yang memiliki enzim urease dapat menghidrolisis urea menjadi ammonia dan menyebabkan suasana basa (Goh et al. 1994). Buffer fosfat terkandung di dalam kaldu urea yang mempertahankan pH 6.8 sehingga dibutuhkan ammonia dalam jumlah besar untuk menaikkan pH media. Shigella memiliki hasil uji urease negatif (Dodd & Jones 1982) sehingga dapat dikatakan bahwa isolat 67, 68, 69, dan 97 bukan Shigella. Pernah dilakukan identifikasi menggunakan kit (Microbact) pada isolat 68. Hasil yang diperoleh setelah data dianalisis dengan program Microbact adalah Providencia rettgeri.
Dua tipe diare yang diamati dari pasien yaitu cair dan berlendir. Manifestasi tipe diare oleh Shigella bervariasi mulai dari diare yang bersifat cair hingga diare yang mengandung darah (Katz 2004). Frekuensi kejadian diare, dalam pengamatan ini lebih tinggi pada laki-laki daripada perempuan. Wilunda dan Panza (2009) pernah melaporkan hal yang sama. Dari tiga belas pasien, lima diantaranya mengalami demam. Shigella diketahui memiliki kemampuan untuk masuk ke dalam sel dan menyebar antar sel membuat sel mengeluarkan interleukin-8 yang memicu terjadinya inflamasi. Reaksi inflamasi ini juga disebabkan oleh polymorphonuclear leukocyte (PMN) yang mengganggu hubungan antar sel sehingga Shigella dapat masuk ke bagian basolateral sel yang memudahkan kolonisasi. Shigella pada akhirnya dibunuh oleh PMN (Cersini et al. 2003; Mandic-Mulec et al. 1997). Kotloff et al. (2000) melakukan penelitian menggunakan mutasi S. flexneri yang diinokulasikan pada probandus, beberapa probandus tidak mengalami demam. Pasien dalam penelitian ini yang tidak demam kemungkinan terinfeksi oleh Shigella yang telah bermutasi.
Perhitungan leukosit memperlihatkan hasil yang bervariasi dari leukopenia hingga normal, nilai kisaran normal leukosit adalah 5000-10000 leukosit ml-1 (Simmons 1976).
Fried et al. (1981) juga pernah melaporkan hal yang sama. Malnutrisi dapat menjadi penyebab turunnya jumlah leukosit. Nassar et al. (2009) melaporkan bahwa pada anak yang menderita kekurangan protein dan energi menyebabkan terganggunya fungsi imun tubuh sehingga tubuh tidak dapat menghadapi infeksi.
SIMPULAN DAN SARAN
SimpulanPersentase Shigella yang didapatkan dari 100 anak penderita diare sebesar 9%. Sembilan isolat Shigella dapat memfermentasi glukosa dan dua di antaranya menghasilkan gas CO2, tidak ada yang dapat menghidrolisis
urea, dapat menggunakan Natrium sitrat sebagai sumber karbon, tidak menghasilkan H2S, tiga dapat menghasilkan indol, dua dapat
menghasilkan asetoin, dan tiga menghasilkan asam campuran. Jumlah leukosit yang didapat bervariasi dari leukopenia hingga normal.
Saran
Perlu dilakukan pengujian serotipe agar diketahui spesies dari isolat Shigella yang telah diisolasi dari anak-anak penderita diare.
DAFTAR PUSTAKA
Adkins HJ, Santiago LT. 1987. Increase of enteric pathogens by use of both stool and rectal swab specimens. Am Soc Microbiol 25 (1): 158-159.
Al-Gallas, Bahri O, Bouratbeen A, Assian Ben Haasen, Ridha Ben Aissa. 2007. Etiology of acute diarrhea in children and adults in Tunis, Tunisia, with emphasis on diarrheagenic Escherichia coli: prevalence, phenotyping, and molecular epidemologi. Am J Trop Med Hyg 77: 571-582.
Asagi M, Ishiguro N, Oka C, Sato G, Terakado N. 1980. Characterization of utilizing (Cit) ability of citrate-positive Escherichia coli variants: stability and transferability of citrate utilization among Escherichia coli, Shigella, and Salmonella strains. Jpn J Vet Sci 42:407-415.
Bergey DH, Holt JG. 1994. Bergey’s Manual Of Determinative Bacteriology. USA: Lippincott Williams & Wilkins.
nitrogen yang berasal dari dinding sel bakteri dalam jumlah yang cukup dapat memberikan hasil positif palsu. Hal ini dapat terjadi pada penggoresan inokulum yang terlalu banyak (Winn et al. 2005). Asagi et al. (1980) melaporkan sifat sitrat positif dapat ditranferkan kepada Shigella yaitu S. sonnei dan S. flexneri yang tadinya memiliki sifat sitrat negatif.
Uji urease menggunakan media kaldu urea dengan indikator merah fenol yang akan berwarna keunguan pada kondisi basa. Bakteri yang memiliki enzim urease dapat menghidrolisis urea menjadi ammonia dan menyebabkan suasana basa (Goh et al. 1994). Buffer fosfat terkandung di dalam kaldu urea yang mempertahankan pH 6.8 sehingga dibutuhkan ammonia dalam jumlah besar untuk menaikkan pH media. Shigella memiliki hasil uji urease negatif (Dodd & Jones 1982) sehingga dapat dikatakan bahwa isolat 67, 68, 69, dan 97 bukan Shigella. Pernah dilakukan identifikasi menggunakan kit (Microbact) pada isolat 68. Hasil yang diperoleh setelah data dianalisis dengan program Microbact adalah Providencia rettgeri.
Dua tipe diare yang diamati dari pasien yaitu cair dan berlendir. Manifestasi tipe diare oleh Shigella bervariasi mulai dari diare yang bersifat cair hingga diare yang mengandung darah (Katz 2004). Frekuensi kejadian diare, dalam pengamatan ini lebih tinggi pada laki-laki daripada perempuan. Wilunda dan Panza (2009) pernah melaporkan hal yang sama. Dari tiga belas pasien, lima diantaranya mengalami demam. Shigella diketahui memiliki kemampuan untuk masuk ke dalam sel dan menyebar antar sel membuat sel mengeluarkan interleukin-8 yang memicu terjadinya inflamasi. Reaksi inflamasi ini juga disebabkan oleh polymorphonuclear leukocyte (PMN) yang mengganggu hubungan antar sel sehingga Shigella dapat masuk ke bagian basolateral sel yang memudahkan kolonisasi. Shigella pada akhirnya dibunuh oleh PMN (Cersini et al. 2003; Mandic-Mulec et al. 1997). Kotloff et al. (2000) melakukan penelitian menggunakan mutasi S. flexneri yang diinokulasikan pada probandus, beberapa probandus tidak mengalami demam. Pasien dalam penelitian ini yang tidak demam kemungkinan terinfeksi oleh Shigella yang telah bermutasi.
Perhitungan leukosit memperlihatkan hasil yang bervariasi dari leukopenia hingga normal, nilai kisaran normal leukosit adalah 5000-10000 leukosit ml-1 (Simmons 1976).
Fried et al. (1981) juga pernah melaporkan hal yang sama. Malnutrisi dapat menjadi penyebab turunnya jumlah leukosit. Nassar et al. (2009) melaporkan bahwa pada anak yang menderita kekurangan protein dan energi menyebabkan terganggunya fungsi imun tubuh sehingga tubuh tidak dapat menghadapi infeksi.
SIMPULAN DAN SARAN
SimpulanPersentase Shigella yang didapatkan dari 100 anak penderita diare sebesar 9%. Sembilan isolat Shigella dapat memfermentasi glukosa dan dua di antaranya menghasilkan gas CO2, tidak ada yang dapat menghidrolisis
urea, dapat menggunakan Natrium sitrat sebagai sumber karbon, tidak menghasilkan H2S, tiga dapat menghasilkan indol, dua dapat
menghasilkan asetoin, dan tiga menghasilkan asam campuran. Jumlah leukosit yang didapat bervariasi dari leukopenia hingga normal.
Saran
Perlu dilakukan pengujian serotipe agar diketahui spesies dari isolat Shigella yang telah diisolasi dari anak-anak penderita diare.
DAFTAR PUSTAKA
Adkins HJ, Santiago LT. 1987. Increase of enteric pathogens by use of both stool and rectal swab specimens. Am Soc Microbiol 25 (1): 158-159.
Al-Gallas, Bahri O, Bouratbeen A, Assian Ben Haasen, Ridha Ben Aissa. 2007. Etiology of acute diarrhea in children and adults in Tunis, Tunisia, with emphasis on diarrheagenic Escherichia coli: prevalence, phenotyping, and molecular epidemologi. Am J Trop Med Hyg 77: 571-582.
Asagi M, Ishiguro N, Oka C, Sato G, Terakado N. 1980. Characterization of utilizing (Cit) ability of citrate-positive Escherichia coli variants: stability and transferability of citrate utilization among Escherichia coli, Shigella, and Salmonella strains. Jpn J Vet Sci 42:407-415.
Bergey DH, Holt JG. 1994. Bergey’s Manual Of Determinative Bacteriology. USA: Lippincott Williams & Wilkins.
ISOLAT BAKTERI Shigella DAN LEUKOSIT DARI ANAK-ANAK
PENDERITA DIARE DI PUSKESMAS SINDANG BARANG
SIRA STEPHANANDRA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
nitrogen yang berasal dari dinding sel bakteri dalam jumlah yang cukup dapat memberikan hasil positif palsu. Hal ini dapat terjadi pada penggoresan inokulum yang terlalu banyak (Winn et al. 2005). Asagi et al. (1980) melaporkan sifat sitrat positif dapat ditranferkan kepada Shigella yaitu S. sonnei dan S. flexneri yang tadinya memiliki sifat sitrat negatif.
Uji urease menggunakan media kaldu urea dengan indikator merah fenol yang akan berwarna keunguan pada kondisi basa. Bakteri yang memiliki enzim urease dapat menghidrolisis urea menjadi ammonia dan menyebabkan suasana basa (Goh et al. 1994). Buffer fosfat terkandung di dalam kaldu urea yang mempertahankan pH 6.8 sehingga dibutuhkan ammonia dalam jumlah besar untuk menaikkan pH media. Shigella memiliki hasil uji urease negatif (Dodd & Jones 1982) sehingga dapat dikatakan bahwa isolat 67, 68, 69, dan 97 bukan Shigella. Pernah dilakukan identifikasi menggunakan kit (Microbact) pada isolat 68. Hasil yang diperoleh setelah data dianalisis dengan program Microbact adalah Providencia rettgeri.
Dua tipe diare yang diamati dari pasien yaitu cair dan berlendir. Manifestasi tipe diare oleh Shigella bervariasi mulai dari diare yang bersifat cair hingga diare yang mengandung darah (Katz 2004). Frekuensi kejadian diare, dalam pengamatan ini lebih tinggi pada laki-laki daripada perempuan. Wilunda dan Panza (2009) pernah melaporkan hal yang sama. Dari tiga belas pasien, lima diantaranya mengalami demam. Shigella diketahui memiliki kemampuan untuk masuk ke dalam sel dan menyebar antar sel membuat sel mengeluarkan interleukin-8 yang memicu terjadinya inflamasi. Reaksi inflamasi ini juga disebabkan oleh polymorphonuclear leukocyte (PMN) yang mengganggu hubungan antar sel sehingga Shigella dapat masuk ke bagian basolateral sel yang memudahkan kolonisasi. Shigella pada akhirnya dibunuh oleh PMN (Cersini et al. 2003; Mandic-Mulec et al. 1997). Kotloff et al. (2000) melakukan penelitian menggunakan mutasi S. flexneri yang diinokulasikan pada probandus, beberapa probandus tidak mengalami demam. Pasien dalam penelitian ini yang tidak demam kemungkinan terinfeksi oleh Shigella yang telah bermutasi.
Perhitungan leukosit memperlihatkan hasil yang bervariasi dari leukopenia hingga normal, nilai kisaran normal leukosit adalah 5000-10000 leukosit ml-1 (Simmons 1976).
Fried et al. (1981) juga pernah melaporkan hal yang sama. Malnutrisi dapat menjadi penyebab turunnya jumlah leukosit. Nassar et al. (2009) melaporkan bahwa pada anak yang menderita kekurangan protein dan energi menyebabkan terganggunya fungsi imun tubuh sehingga tubuh tidak dapat menghadapi infeksi.
SIMPULAN DAN SARAN
SimpulanPersentase Shigella yang didapatkan dari 100 anak penderita diare sebesar 9%. Sembilan isolat Shigella dapat memfermentasi glukosa dan dua di antaranya menghasilkan gas CO2, tidak ada yang dapat menghidrolisis
urea, dapat menggunakan Natrium sitrat sebagai sumber karbon, tidak menghasilkan H2S, tiga dapat menghasilkan indol, dua dapat
menghasilkan asetoin, dan tiga menghasilkan asam campuran. Jumlah leukosit yang didapat bervariasi dari leukopenia hingga normal.
Saran
Perlu dilakukan pengujian serotipe agar diketahui spesies dari isolat Shigella yang telah diisolasi dari anak-anak penderita diare.
DAFTAR PUSTAKA
Adkins HJ, Santiago LT. 1987. Increase of enteric pathogens by use of both stool and rectal swab specimens. Am Soc Microbiol 25 (1): 158-159.
Al-Gallas, Bahri O, Bouratbeen A, Assian Ben Haasen, Ridha Ben Aissa. 2007. Etiology of acute diarrhea in children and adults in Tunis, Tunisia, with emphasis on diarrheagenic Escherichia coli: prevalence, phenotyping, and molecular epidemologi. Am J Trop Med Hyg 77: 571-582.
Asagi M, Ishiguro N, Oka C, Sato G, Terakado N. 1980. Characterization of utilizing (Cit) ability of citrate-positive Escherichia coli variants: stability and transferability of citrate utilization among Escherichia coli, Shigella, and Salmonella strains. Jpn J Vet Sci 42:407-415.
Bergey DH, Holt JG. 1994. Bergey’s Manual Of Determinative Bacteriology. USA: Lippincott Williams & Wilkins.
7
Cherry WB, Thomason BM, Pomales-Lebron A, Ewing WH. Rapid presumptive identification of Enteropathogenic Escherichia coli in faecal smears by means of fluorescent antibody. Bull Org mond Sante Bull Wld Hlth Org 25: 159-171.
[Depkes] Departemen Kesehatan. 2009. Profil Kesehatan Indonesia 2008. Jakarta: Departemen Kesehatan RI.
Dodd CER, Jones D.1982. A numerical taxonomi study of the genus Shigella. J General Microbiol 128: 1933-1957. Eppy. 2009. Diare Akut. Medicinus 22: 91-98. Finlay BB, Falkow S. 1984. Common themes in microbial pathogenicity. Microbiol Review 53: 210-230.
Fried D, Maytal J, Hanukoglu A. 1981. The differential leukocyte count in shigellosis. Infection 10(1):13-14.
Fontaine A, Arondel J, Sansonetti PJ. 1998. Role of shiga toxin in the pathogenesis of bacillary dysentery, studied by using a tox mutant of Shigella dysenteriae 1. Infect Immun. 56: 3099-3109.
Germani Y dan Sansonetti PJ. The Genus Shigella. Di dalam: Dworkin M, Falkow S, Rosenberg E, Schleifer KH, Stackebrandt E, editor. 2006. The Prokaryotes. Ed ke-3 Vol 6. Singapore: Springer. hlm 99-122.
Goh KL, Parasakhi N, Peh SC, Puthucheary SD, Wong NW. 1994. The rapid urease test in the diagnosis of Helicobacter pylori infection. Singap Med J 35:161-162.
Gooder H, Happold FC. 1954. The tryptophanase-tryptophan reaction. The nature of the enzyme-coenzym-substrate complex. Biochem J 57: 369-374
Gubash SM, Anand CM, Stokeman M. 1988. Inhibition of Escherichia coli serotype O157:H7 by bromthymol blue. J Clin Microbiol 26:2248-2249.
Gunduz T et al. 2007. Microbiological investigation of stool in patients with acute diarrhea. Res J Med Sci 1(2): 84-87. Hall CT, Webb CD, Papageorge C. 1972. Use of an oxidation-fermentation medium in the identification of yeast. HSMHA Health Reports 87(2): 172-176
Hendrawati LD, Firmansyah A, Darwis D. 2005. Macronutrient malabsorption in acute diarrhea: prevalence and affecting factors. Paediatrica Indones 45(9-10): 207-210.
Ito H et al. 1991. Possible mechanisms underlying the slow lactose fermentation phenotype in Shigella spp. App Environ Microbiol 57(10): 2912-2917.
Karim MR, Hussain Qadri SM, Flournoy DJ. 1981. A rapid method for the detection of tryptophanase in anaerobic bacteria. A van Leeuw 47 : 499-507.
Katz DE et al. 2004. Two studies evaluating the safety and immunogenicity of a live, attenuates Shigella flexneri 2avaccine (SC602) and excretion of vaccine organism in North America volunteers. Infect Immun. 72(2):923-930.
Kotloff KL et al. 2000. Shigella flexneri 2a strain CVD 1207, with specific deletions in virG, sen, set, and guaBA, is highly attenuated in humans. Infect Immun 68: 1034-1039.
Madigan MT, Martinko JM, Dunlap PV, Clark DP. 2009. Biology of Microorganism. Ed ke-12. San Fransisco: Pearson Education, Inc.
Mandic-Mulec I, Weiss J, Zychlinsky A. 1997. Shigella flexneri is trapped in polymorphonuclear leukocyte vacuoles and efficiently killed. Infect Immun 65(1): 110-115.
Nassar MF, El-Batrawy, Nagy NM. 2009. CD95 expression in white blood cells of malnourish infants during hospitalization and catch-up growth. Estrn Mediterran Health J 15: 574-583.
Qureishi MI et al. 2008. Antimicrobial resistance of Shigella spp. isolated from diarrheal patiens in Zahedan. Acta Med Iranica 46: 413-416.
Reed RW. 1942. Nitrate, nitrite, and indole reactions of gas gangrene anaerobes. J Bacteriol 44: 425–431.
Simmons A. 1976. Technical Hematology. Ed ke-2. Toronto: J.B. Lippincott Co. Subekti D et al. 2001. Shigella spp.
surveillance in Indonesia: the emergence or reemergence of S. dysenteriae. Emerging Infect Disease 7:137-140. Talukder KA et al. 2007. A novel serovar of
Shigella dysenteriae from patiens with diarrhoea in Bangladesh. J Med Microbiol 56: 654-658.
Tjaniadi P et al. 2003. Antimicrobial resistance of bacterial pathogens associated with diarrheal patients in Indonesia. Am J Trop Med Hyg 68:666-670.
Ugbogu OC, Nwachukwu NC, dan Ogbuagu UN. 2006. Isolation of Salmonella and Shigella from house flies (Musca domestica I.) in Uturu, Nigeria. African J Biotechnol 5: 1090-1091.
Walters EW, Cooper ML, dan Keller HM. 1954. The detection microscopically of colonies of Shigella in stool cultures. J Bacteriol 67: 247-251.
Wasfy MO et al. 2000. Isolatioin and antibiotic susceptibility of Salmonella, Shigella, and Campylobacter from acute enteric infection in Egypt. J Health Popul Nutr 18(1):33-38.
Wilunda C, Panza A. 2009. Factors associated with diarrhea among children less than 5 years old in Thailand: a secondary analysis of Thailand multiple indicator cluster survey 2006. J Health Res 23: 17-22.
ISOLAT BAKTERI Shigella DAN LEUKOSIT DARI ANAK-ANAK
PENDERITA DIARE DI PUSKESMAS SINDANG BARANG
SIRA STEPHANANDRA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Anak Penderita Diare di Puskesmas Sindang Barang. Dibimbing oleh SRI
BUDIARTI dan TRI HERU WIDARTO.
Diare merupakan salah satu masalah kesehatan di Indonesia dan negara
berkembang lainnya.
Shigella
merupakan bakteri patogen kedua yang paling
sering dideteksi pada penderita diare.
Penelitian ini bertujuan mengisolasi dan
mengidentifikasi bakteri
Shigella
serta mengetahui jumlah leukosit dari anak-anak
penderita diare di Puskesmas Sindang Barang. Sampel feses diambil dengan
teknik
rectal swab
. Sampel darah diambil dari jari. Isolasi
Shigella
dengan
Salmonella-Shigella
agar. Penghitungan leukosit dengan metode Simmon. Uji
biokimia dilakukan, yaitu uji MR-VP, indol, sitrat, fermentasi glukosa, H
2S, dan
urea. Dari 100 sampel, didapat 13 isolat yang diduga sebagai
Shigella
. Uji
biokimia dilakukan terhadap 13 isolat. Setelah uji biokimia diperoleh 9 isolat
Shigella
. Persentase
Shigella
yang didapatkan sebesar 9%. Jumlah leukosit yang
diperoleh bervariasi dari leukopenia hingga normal.
ABSTRACT
SIRA STEPHANANDRA. Isolates of
Shigella
Bacteria and Leukocytes from
Children with Diarrhea in Sindang Barang Health Center. Under direction of SRI
BUDIARTI and TRI HERU WIDARTO.
Diarrhea is one of the health problems in Indonesia and other developing
countries.
Shigella
is the second most frequently detected pathogenic bacteria in
patients with diarrhea. This research was conducted to isolate and identify the
Shigella
bacteria and to discover leukocytes count from children with diarrhea in
Sindang Barang health center. Feces samples were obtained with rectal swab.
ISOLAT BAKTERI Shigella DAN LEUKOSIT DARI ANAK-ANAK
PENDERITA DIARE DI PUSKESMAS SINDANG BARANG
SIRA STEPHANANDRA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Puskesmas Sindang Barang
Nama : Sira Stephanandra
NIM : G34061236
Menyetujui
Pembimbing I Pembimbing II
Dr. Sri Budiarti Ir. Tri Heru Widarto, M.Sc
NIP. 19580813 199303 2 001 NIP. 19620513 198703 1 002
Mengetahui
Ketua Departemen Biologi
Dr. Ence Darmo Jaya Supena, M.S.
NIP. 19641002 198903 1 002
PRAKATA
Puji syukur penulis panjatkan pada Tuhan YME atas berkah-Nya sehingga
penulis dapat menyelesaikan skripsi yang berjudul Isolat Bakteri
Shigella
dan
Leukosit dari Anak-Anak Penderita Diare di Puskesmas Sindang Barang.
Penulis mengucapkan terima kasih kepada Dr. Sri Budiarti atas bimbingan,
nasihat, dan motivasi yang diberikan selama penelitian dan penulisan skripsi, serta
pendanaan dalam penelitian ini. Ucapan terima kasih kepada Ir. Tri Heru
Widarto, M.Sc atas bimbingan dan saran kepada penulis sehingga skripsi ini
berhasil disusun.
Terima kasih kepada kepala Puskesmas Sindang Barang dr. Erna Nuraena yang
telah memberikan izin pengambilan sampel di puskesmas dan kepada Dian
Sapriani Mahbub, AmdAK dalam membantu pengambilan sampel.
Terima kasih kepada kedua orang tua yang telah memberikan dukungan dan
doa. Ucapan terima kasih kepada Tari, Ega, dan Firda sebagai rekan dalam
penelitian ini dan kepada Bu Heni dan Pak Jaka yang telah membantu penulis
selama penelitian.
Semoga skripsi ini bermanfaat.
Bogor, Desember 2010
Penulis dilahirkan di Bandung pada 16 Juni 1988, dari ayah Ir. Panogu Silaban
dan Ibu Dra. Maria Albertina Kooswinarsiningsih, dan merupakan anak pertama
dari dua bersaudara.
Tahun 2006 penulis lulus dari SMA Charitas, Jakarta Selatan dan pada tahun
yang sama lulus masuk IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru
(SPMB). Penulis memilih mayor Biologi, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
PENDAHULUAN
Latar Belakang ... ... 1
Tujuan Penelitian ... ... 1
METODE
Waktu dan Tempat Penelitian ... ... 1
Probandus ... ... 1
Pengambilan Sampel ... ... 1
Isolasi ... ... 2
Penghitungan Leukosit ... ... 2
Identifikasi ... ... 2
HASIL ... ... 2
PEMBAHASAN... ... 5
SIMPULAN DAN SARAN
Simpulan ... ... 6
Saran ... ... 6
DAFTAR PUSTAKA ... ... 6
DAFTAR TABEL
Halaman
1 Hasil uji biokimia
isolat bening pada media SSA ………
...
3
2 Keadaan pasien yang pada fesesnya terdapat
Shigella
...
4
3 Jumlah leukosit pasien yang pada fesesnya terdapat
Shigella
...
5
DAFTAR GAMBAR
Halaman
1 Penampakan koloni yang diduga sebagai
Shigella
pada media SSA ...
3
2 Pewarnaan gram
Shigella
(Perbesaran 1000x) ...
3
3 Uji MR
Shigella
a) Hasil negatif b) Hasil positif ...
3
4 Uji VP
Shigella
a) Hasil negatif b) Hasil positif ...
3
5 Uji H2S
Shigella
pada agar TSIA dengan uji H2S negatif a) Dapat
memfermentasi glukosa, laktosa dan/atau sukrosa b) Tidak ada reaksi
fermentasi c) Dapat memfermentasi glukosa ...
4
6 Uji sitrat
Shigella
pada media simmon sitrat a) Hasil positif b) Hasil
negatif ...
4
7 Uji indole
Shigella
pada media tripton 1% a) Hasil negatif b) Hasil
positif ...
4
8 Uji fermentasi glukosa
Shigella
a) Hasil positif b) Hasil negatif c) Hasil
positif dengan gas ...
4
PENDAHULUAN
Latar BelakangDiare merupakan salah satu masalah kesehatan dan penyebab kematian anak-anak di negara berkembang (Gunduz et al. 2007; Qureishi et al. 2008) termasuk Indonesia (Hendrawati et al. 2005).
Diare adalah pengeluaran feses >200g/hari yang bersifat encer atau berair sebanyak ≥ tiga kali sehari (Eppy 2009). Diare dapat disebabkan oleh bakteri, virus, dan protozoa (Tortora et al. 2007). Salah satu bakteri penyebab diare dan bakteri patogen kedua yang paling sering dideteksi pada penderita diare adalah Shigella (Eppy 2009; Tjaniadi et al. 2003). Kasus diare yang disebabkan oleh Shigella di Mesir antara tahun 1986-1993 sebesar 30% (Wasfy et al. 2000), di Tunisia sebesar 4% (Al-Gallas et al. 2007), di Turki sebesar 1.6% (Gunduz et al. 2007), dan di Indonesia sebesar 5%, yang diteliti dari tahun 1998-1999 ( Subekti 2001).
Shigella merupakan bakteri gram negatif, anaerob fakultatif, berbentuk batang, nonmotil, dan tidak membentuk kapsul, memiliki uji indol yang bervariasi, uji Metil Red (MR) positif, uji Voges-Proskauer (VP) dan Simmons sitrat negatif, tidak memproduksi H2S, uji urease negatif, dapat
memfermentasi gula dan beberapa strain menghasilkan gas CO2 (Qureishi et al. 2008;
Bergey & Holt 1994). Terdapat empat spesies Shigella penyebab diare yaitu S. boydii, S. dysenteriae, S. flexneri, dan S. sonnei (Qureishi et al. 2008; Talukder et al. 2007; Subekti et al. 2001). Shigella dapat diisolasi dari feses pasien penderita diare, makanan yang tercemar, dan lalat rumah (Walters et al. 1954; Ugbogu et al. 2006).
Shigella menginfeksi manusia melalui jalur fecal-oral, dapat menginvasi mukosa usus serta berkembang biak dalam sel epitel hingga menyebabkan kematian sel. Kematian sel epitel menyebabkan Shigella bermigrasi ke sel di sekitarnya dan melakukan mekanisme yang sama sehingga menyebabkan rusaknya jaringan epitel usus (Finlay & Falkow 1989; Eppy 2009; Fontaine et al. 1998).
Infeksi dapat menyebabkan kenaikan jumlah leukosit. Leukosit merupakan sel darah yang berfungsi sebagai pertahanan tubuh untuk membantu melawan infeksi yang masuk kedalam tubuh (Tortora et al. 2007). Data profil kesehatan Indonesia tahun 2008 memperlihatkan terjadinya Kasus Luar Biasa (KLB) diare di 15 provinsi dengan jumlah penderita sebanyak 8 443 orang dan jumlah kematian sebanyak 209 orang. Kasus diare di
kota Bogor pada tahun 2007 sebanyak 23 416 kasus (DEPKES 2009). Publikasi mengenai diare yang disebabkan oleh Shigella di Indonesia tidak banyak ditemui terutama kasus yang terjadi pada anak-anak. Umumnya masyarakat lebih memilih membawa anak yang sakit ke puskesmas karena biaya yang lebih murah dari rumah sakit.
TujuanPenelitian
Penelitian bertujuan mengisolasi dan mengidentifikasi bakteri Shigella serta mengetahui jumlah leukosit dari anak-anak penderita diare di Puskesmas Sindang Barang.
METODE
Waktu dan Tempat PenelitianPenelitian dilaksanakan pada bulan Februari 2010 hingga Oktober 2010. Pengambilan sampel dilakukan di Puskesmas Sindang Barang. Isolasi bakteri dilakukan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB, Dramaga, Bogor. Penghitungan sel darah putih dilakukan di Laboratorium Biosistematika dan Ekologi Hewan, Departemen Biologi, FMIPA IPB, Dramaga, Bogor.
Probandus
Sampel feses dan darah diambil dari 100 pasien anak-anak penderita diare usia 2 bulan sampai 11 tahun.
Pengambilan Sampel
1. Sampel feses
Sampel feses diperoleh melalui teknik rectal swab (Adkins & Santiago 1987) menggunakan cutton bud steril dari 100 anak penderita diare di ruang Laboratorium Puskesmas Sindang Barang. Cotton bud kemudian dimasukkan ke dalam larutan Phosfat Buffer Saline (PBS) steril dan selanjutnya dibawa ke Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB, Dramaga, Bogor untuk dilakukan isolasi.
2. Sampel darah
FMIPA IPB, Dramaga, Bogor untuk penghitungan jumlah leukosit.
Isolasi Bakteri
Sampel feses dari larutan PBS masing-masing disebar sebanyak dua ulangan pada media cawan Salmonella-Shigella agar (Criterion). Sampel diinkubasi menggunakan inkubator (Gemmyco IN-010) selama 24 jam pada suhu 37 oC. Koloni yang memberikan penampakan kusam atau tidak berwarna diambil dan dilakukan pemurnian dengan metode cawan kuadran. Koloni yang telah murni selanjutnya disimpan pada media Salmonella-Shigella agar (SSA) miring.
Penghitungan Leukosit
Darah dikeluarkan dari dalam hematokrit dan ditempatkan dalam tabung eppendorf. Darah diambil menggunakan pipet Thoma sampai batas 0.5. Setelah itu larutan pengencer dipipet sampai batas 11. Pipet dikocok membentuk gerakan angka delapan selama 12 kali untuk mencampurkan darah dengan larutan Turk. Darah diteteskan ke hemasitometer dan ditutup dengan kaca penutup. Leukosit dihitung pada empat kotak terbesar yang terletak di tiap sudut hemasitometer. Leukosit kemudian dihitung menggunakan rumus:
V = plt
V = (1)(1)(1/10) mm3
V untuk 4 kotak = (4)(1/10) mm3 = 0.4 mm3 Faktor pengenceran = 1/20
Σ leukosit ml-1 = (Σ leukosit hitungan) / [(0.4 mm3 )(1/20)] (Simmon 1976)
Identifikasi Bakteri
Pewarnaan gram dilakukan pada koloni yang diduga Shigella. Satu lup akuades steril diambil dan disebar ke permukaan kaca objek. Setelah itu diambil satu lup bakteri yang berumur 18 jam dan disebar di kaca objek. Olesan bakteri dibiarkan kering udara dan setelah itu dilakukan fiksasi panas. Olesan bakteri kemudian diwarnai dengan perwarna ungu kristal selama 1 menit. Kelebihan zat warna dibilas dengan akuades, dilanjutkan dengan pemberian iodium gram selama 2 menit, lalu dibilas lagi dengan akuades dan dilakukan pemucatan dengan alkohol 95%. Setelah itu, olesan diwarnai dengan safranin selama 30 detik lalu dibilas dengan akuades. Setelah kering, olesan bakteri dilihat di bawah mikroskop dengan perbesaran 1000x, kemudian dilanjutkan dengan uji biokimia.
1. Uji Indol
Uji indole mengunakan media tripton 1% (Oxoid). Sebanyak satu lup koloni Shigella dimasukkan ke dalam kaldu tripton dan diinkubasi selama 24 jam pada suhu 37 oC. Hasil uji dapat diketahui dengan meneteskan reagen Kovac.
2. Uji MR-VP
Sebanyak satu lup koloni Shigella dimasukkan ke dalam kaldu MR-VP (Difco) dan diinkubasi (Gemmyco IN-010) selama 24 jam untuk uji MR dan 5 hari untuk uji VP pada suhu 37 oC. Uji MR diuji dengan meneteskan 10 tetes indikator merah metil ke dalam kaldu MR/VP. Uji VP dilakukan dengan meneteskan 10 tetes α-naphtol 5% dan 10 tetes larutan KOH 40%, dikocok dan dilihat perubahan warna yang terjadi.
3. Uji urease
Sebanyak satu lup koloni Shigella dimasukkan ke dalam kaldu urease (Difco) dan diinkubasi selama 5 hari dengan pengamatan setiap hari pada suhu 37 oC. 4. Uji Simmon sitrat
Sebanyak satu lup koloni Shigella digoreskan dan ditusukkan pada media Simmon sitrat. Inkubasi dilakukan selama 24 jam pada suhu 37 oC.
5. Uji fermentasi karbohidrat dan H2S pada
Triple Sugar Iron Agar (TSIA)
Sebanyak satu lup koloni Shigella digoreskan dan ditusukkan pada media TSIA (Difco). Inkubasi dilakukan selama 24 jam pada suhu 37 oC.
6. Uji fermentasi glukosa
Sebanyak satu lup koloni Shigella dimasukkan ke dalam larutan glukosa 0.2% steril yang telah diberi Bromthymol Blue (BTB) sebagai indikator pH. Inkubasi selama 1-10 hari (Hall et al 1972) pada suhu 37 oC.
HASIL
Seratus sampel feses diperoleh dari anak-anak penderita diare di ruang Laboratorium Puskesmas Sindang Barang. Penderita diare berasal dari lima kelurahan, yaitu Sindang Barang, Bubulak, Situ Gede, Marga Jaya, dan Balumbang Jaya. Hasil isolasi feses pada media SSA didapatkan 13 isolat dengan penampakan koloni bening yang diduga sebagai koloni Shigella (Gambar 1).
3
Gambar 1 Penampakan koloni yang diduga sebagai Shigella pada media SSA. Koloni-koloni yang dicurigai sebagai Shigella diwarnai dengan pewarnaan gram dan menunjukkan ciri bakteri gram negatif (Gambar 2). Hasil uji biokimia dapat dilihat pada Tabel 1. Hasil positif uji MR (Metil Red) (Gambar 3) dan VP (Voges-Proskauer) (Gambar 4) ditandai dengan perubahan warna media menjadi merah. Hasil uji H2S negatif
ditandai dengan tidak adanya perubahan warna menjadi hitam pada media TSIA (Gambar 5). Uji sitrat positif ditandai dengan berubahnya warna media menjadi biru (Gambar 6). Uji indole positif ditandai dengan adanya cincin merah setelah diberi reagen kovac (Gambar 7). Uji glukosa positif ditandai dengan berubahnya warna media menjadi kuning, adanya gas dapat dilihat di dalam tabung durham (Gambar 8). Uji Urea positif ditandai dengan berubahnya warna media menjadi merah keunguan (Gambar 9).
Gambar 2 Pewarnaan gram Shigella (Perbesaran 1000x).
Gambar 3 Uji MR Shigella a) Hasil negatif b) Hasil positif.
Gambar 4 Uji VP Shigella a) Hasil negatif b) Hasil positif.
No No Isolat
Uji Biokimia
MR VP Indole H2S TSIA Sitrat Urea
Fermentasi Glukosa
1 25 - - - - S/B M + - +
2 26 - - - - S/B M + - +
3 42 - - - - S/B M + - +
4 50 - - - - S/B M + - +
5 51 + - + - S: K B : M + - +
6 67* - - - - S/B M + + -
7 68* + - + - S: K B : M + + +
8 69* - - - - S/B M + + +
9 70 - - - - S/B M + - +
10 87 + + + - S/B K + - +g
11 89 + + + - S/B K + - +g
12 97* - - - - S/B M - + +
13 98 - - - - S/B M + - +
Tabel 1 Hasil uji biokimia isolat bening pada media SSA
Gambar 5 Uji H2S Shigella pada agar TSIA
dengan uji H2S negatif a) dapat
memfermentasi glukosa, laktosa dan/atau sukrosa b) tidak ada reaksi fermentasi c) dapat memfermentasi glukosa.
Gambar 6 Uji sitrat Shigella pada media simmon sitrat a) Hasil positif
b) Hasil negatif.
Gambar 7 Uji indole Shigella pada media tripton 1% a) Hasil negatif b) Hasil positif.
Gambar 8 Uji fermentasi glukosa Shigella a) Hasil positif b) Hasil negatif c) Hasil positif dengan gas.
Gambar 9 Uji urease Shigella pada media urea a) Hasil negatif b) Hasil positif.
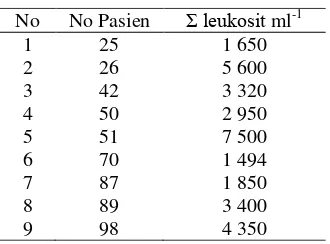
Hasil perhitungan jumlah leukosit bervariasi dari leukopenia hingga normal. Keadaan pasien dapat dilihat pada Tabel 2 dan hasil penghitungan leukosit dapat dilihat pada Tabel 3.
No
No Pasien
Keadaan Pasien
Umur Gender Tipe diare Demam
1 25 2 tahun L Cair -
2 26 8 tahun L Berlendir +
3 42 10 tahun L Cair -
4 50 10 bulan L Cair +
5 51 1 tahun 2 bulan L Cair -
6 70 3 tahun 3 bulan L Cair +
7 87 3 tahun P Cair +
8 89 1 tahun 6 bulan L Berlendir -
9 98 1 tahun 6 bulan P Cair -
Tabel 2 Keadaan pasien yang pada fesesnya terdapat Shigella
5
PEMBAHASAN
Koloni yang bersifat laktosa negatif akan memberikan penampakan koloni tidak berwarna pada media SSA. Koloni yang dapat memfermentasi laktosa akan memberikan penampakan koloni berwarna merah, hal itu disebabkan oleh fermentasi laktosa yang menghasilkan asam dan dengan adanya indikator neutral red akan memberikan warna merah pada koloni (Cherry 1961).
Uji MR dan uji VP menggunakan media yang sama yaitu kaldu glukosa. Fermentasi asam campuran dilihat dengan uji MR. Fermentasi asam campuran menyebabkan pH media menjadi asam. Merah metil merupakan indikator yang akan berwarna merah pada keadaan asam. Hasil positif uji MR diperlihatkan dengan berubahnya warna media menjadi merah ketika ditetesi indikator merah metil (Winn et al. 2005). Shigella memiliki hasil MR positif, namun dari uji biokimia hanya ditemukan dua dari isolat yang memiliki hasil uji MR positif. Walupun begitu, Dodd dan Jones (1982) melaporkan bahwa terdapat spesies dari Shigella yang menunjukkan hasil uji MR negatif, yaitu S. flexneri.
Uji VP merupakan uji untuk mendeteksi pembentukan 2,3 butanadiol secara tidak langsung. Senyawa acetoin (acetil methyl carbinol) merupakan senyawa prekursor bagi 2,3 butanadiol. Penambahan KOH menyebabkan berubahnya acetoin menjadi diasetil. Diasetil akan membentuk suatu kompleks berwarna merah ketika ditambahkan α-naphtol. Warna merah ini menunjukkan hasil positif. Bakteri yang membentuk 2,3 butanadiol menghasilkan sedikit asam campuran yang jumlahnya tidak cukup untuk mengubah pH media menjadi asam (Winn et al. 2005).
Indol merupakan salah satu produk hasil metabolisme triptopan. Bakteri yang memiliki enzim triptopanase dapat memecah triptopan menjadi indol, asam piruvat, dan ammonia (Gooder & Happold 1953; Karim et al. 1981). Produksi indol dapat dilihat dari munculnya warna merah setelah penambahkan reagen yang mengandung p-dimetilaminobenzaldehid (Winn et al. 2005). Reed (1942) melaporkan beberapa bakteri genus Clostridium dapat membentuk indol dan dengan cepat memecah kembali indol yang dihasilkan sehingga didapat hasil negatif semu.
Agar miring TSI memberikan empat macam pola reaksi. Pola reaksi pertama berupa warna merah pada slant (bagian miring agar) dan butt (bagian dasar agar) yang menunjukkan tidak ada reaksi fermentasi glukosa. Pola reaksi kedua berupa warna merah pada slant dan warna kuning pada butt yang menunjukkan terjadinya fermentasi glukosa. Pola reaksi ketiga slant dan butt berwarna kuning yang menunjukkan fermentasi glukosa, laktosa, dan/atau sukrosa. Pola reaksi keempat adanya warna hitam yang menandakan terjadinya pembentukan gas H2S
(Madigan et al. 2009). Isolat 87 dan 89 menghasilkan warna kuning pada seluruh bagian agar hal ini menandakan dapat difermentasikannya glukosa, laktosa, dan/atau sukrosa. Shigella dysenteriae 1 dan S. sonnei dapat memfermentasi laktosa secara lambat (Ito et al. 1991). Uji H2S dilakukan untuk
mengetahui dihasilkannya gas H2S oleh
bakteri. Produksi gas ini ditandai dengan berubahnya warna media menjadi hitam. Gas H2S yang bereaksi dengan FeSO4 akan
membentuk FeS yang berwarna hitam (Winn et al 2005).
Hasil positif uji fermentasi glukosa ditandai dengan adanya perubahan warna media menggunakan indikator bromthymol blue (BTB) dari biru ke jingga. Hal ini terjadi karena bakteri menurunkan pH media sebagai akibat dari terjadinya fermentasi glukosa (Gubash et al. 1988). Shigella pada umumnya memfermentasi glukosa tanpa menghasilkan gas namun S. flexneri 6, S. boydii 13 dan 14 dan S. dysenteriae 3 menghasilkan gas (Germani & Sansonetti 2006).
Media Simmon sitrat digunakan untuk menguji kemampuan bakteri memanfaatkan sodium sitrat sebagai sumber karbon dan ammonium fosfat sebagai sumber nitrogen. Media ini menggunakan BTB sebagai indikator pH. Perubahan warna media menjadi biru menunjukkan perubahan pH media menjadi basa dan uji sitrat positif. Karbon dan No No Pasien Σ leukosit ml-1
1 25 1 650
2 26 5 600
3 42 3 320
4 50 2 950
5 51 7 500
6 70 1 494
7 87 1 850
8 89 3 400
9 98 4 350
nitrogen yang berasal dari dinding sel bakteri dalam jumlah yang cukup dapat memberikan hasil positif palsu. Hal ini dapat terjadi pada penggoresan inokulum yang terlalu banyak (Winn et al. 2005). Asagi et al. (1980) melaporkan sifat sitrat positif dapat ditranferkan kepada Shigella yaitu S. sonnei dan S. flexneri yang tadinya memiliki sifat sitrat negatif.
Uji urease menggunakan media kaldu urea dengan indikator merah fenol yang akan berwarna keunguan pada kondisi basa. Bakteri yang memiliki enzim urease dapat menghidrolisis urea menjadi ammonia dan menyebabkan suasana basa (Goh et al. 1994). Buffer fosfat terkandung di dalam kaldu urea yang mempertahankan pH 6.8 sehingga dibutuhkan ammonia dalam jumlah besar untuk menaikkan pH media. Shigella memiliki hasil uji urease negatif (Dodd & Jones 1982) sehingga dapat dikatakan bahwa isolat 67, 68, 69, dan 97 bukan Shigella. Pernah dilakukan identifikasi menggunakan kit (Microbact) pada isolat 68. Hasil yang diperoleh setelah data dianalisis dengan program Microbact adalah Providencia rettgeri.
Dua tipe diare yang diamati dari pasien yaitu cair dan berlendir. Manifestasi tipe diare oleh Shigella bervariasi mulai dari diare yang bersifat cair hingga diare yang mengandung darah (Katz 2004). Frekuensi kejadian diare, dalam pengamatan ini lebih tinggi pada laki-laki daripada perempuan. Wilunda dan Panza (2009) pernah melaporkan hal yang sama. Dari tiga belas pasien, lima diantaranya mengalami demam. Shigella diketahui memiliki kemampuan untuk masuk ke dalam sel dan menyebar antar sel membuat sel mengeluarkan interleukin-8 yang memicu terjadinya inflamasi. Reaksi inflamasi ini juga disebabkan oleh polymorphonuclear leukocyte (PMN) yang mengganggu hubungan antar sel sehingga Shigella dapat masuk ke bagian basolateral sel yang memudahkan kolonisasi. Shigella pada akhirnya dibunuh oleh PMN (Cersini et al. 2003; Mandic-Mulec et al. 1997). Kotloff et al. (2000) melakukan penelitian menggunakan mutasi S. flexneri yang diinokulasikan pada probandus, beberapa probandus tidak mengalami demam. Pasien dalam penelitian ini yang tidak demam kemungkinan terinfeksi oleh Shigella yang telah bermutasi.
Perhitungan leukosit memperlihatkan hasil yang bervariasi dari leukopenia hingga normal, nilai kisaran normal leukosit adalah 5000-10000 leukosit ml-1 (Simmons 1976).
Fried