KERAGAMAN GENETIK PISANG
Musa balbisiana
Colla
DI INDONESIA MENGGUNAKAN PENANDA
AMPLIFIED FRAGMENT LENGTH POLYMORPHISM
(AFLP)
FAJARUDIN AHMAD
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Keragaman Genetik Pisang Musa balbisiana Colla Di Indonesia Menggunakan Penanda Amplified Fragment Length Polymorphism (AFLP) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir thesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
FAJARUDIN AHMAD. Keragaman Genetik Pisang Musa balbisiana Colla di Indonesia Menggunakan Penanda Amplified Fragment Length Polymorphism
(AFLP). Dibimbing oleh RITA MEGIA dan YUYU SURYASARI POERBA. Indonesia merupakan salah satu pusat dari keragaman genetik keluarga pisang, terutama dari jenis Musa acuminata Colla (genom AA). Selain M. acuminata juga dapat ditemui jenis lain yaitu Musa balbisiana Colla (genom BB) yang dikenal dengan nama lokal Pisang Klutuk atau Pisang Batu. Musa balbisiana
perlu dipelajari lebih dalam karena pisang ini mempunyai potensi ketahanan terhadap serangan beberapa hama dan penyakit serta dapat tumbuh di lahan kering.
Studi keragaman genetik M. balbisiana secara molekuler belum banyak dilakukan di Indonesia. Oleh karena itu penelitian ini bertujuan mempelajari hal tersebut menggunakan penanda Amplified Fragment Length Polymorphism
(AFLP).
Lima belas aksesi M. balbisiana budidaya dan 6 aksesi M. balbisiana liar yang digunakan dalam penelitian ini berasal dari Kebun Plasma Nutfah Pisang Cibinong Science Center (CSC) Pusat Penelitian Biologi-LIPI, Kebun Raya Bogor dan hasil eksplorasi di kawasan sekitar Bogor, Sumatera Barat, Sulawesi Selatan dan Sulawesi Utara. Metode CTAB digunakan dalam ekstraksi DNA total dari daun. Dua puluh enam pasang primer selektif AFLP digunakan dalam analisis AFLP dan pewarna non-radiokatif digunakan untuk visualisasi pita AFLP diatas lampu UV. Aplikasi Densitograf ATTO CS Analyzer Ver. 2.08c digunakan untuk penentuan kemunculan dan ukuran pita. Aplikasi NTSYS 2.02 digunakan untuk menghitung indeks disimilaritas Nei dan LI (1979) dan analisis klaster. Aplikasi Minitab 14 digunakan untuk Analisis Komponen Utama (KU).
Dari 26 pasang primer selektif AFLP yang digunakan, 22 pasang primer menghasilkan pita yang jelas untuk analisis keragaman genetik. Total pita yang dihasilkan adalah 485 pita dengan ukuran 51-3206 bp. Rentang jumlah pita tiap pasangan primer berkisar antara 11-31 pita. Primer nomor 13 (E-AGC/M-CAC) menghasilkan jumlah pita paling banyak, sedangkan pasangan primer nomor 11 (E-ACT/M-CTC) menghasilkan pita yang paling sedikit.
Polimorfisme dari total pita AFLP adalah sebesar 46.18% dengan rentang polimorfisme tiap pasangan primer antara 0-80%. Tingkat polimorfisme paling tinggi dihasilkan oleh pasangan primer nomor 7 (E-ACA/M-CTG), sedangkan paling rendah oleh pasangan primer nomor 19 (E-AGG/M-CTT).
Indeks disimilaritas Nei dan Li (1979) berdasarkan pita AFLP berkisar antara 0.014-0.152, hal ini menunjukkan bahwa keragaman genetik pada 21 aksesi
M. balbisiana adalah 13.8%. Keragaman genetik M. balbisiana liar sebesar 12.9%, lebih tinggi dibandingkan keragaman genetik M. balbisiana budidaya sebesar 11.5%.
Aksesi penyusun dari klaster I adalah dua aksesi Klutuk Wulung-Jawa Barat. Penyusun dari klaster II masing-masing dua aksesi Klutuk-Jogja, Klutuk Sukun-Jogja, Cau Manggala-Jawa Barat, Klutuk Wulung-Jogja, Klutuk Hitam-Jawa Barat, Unti Batu-Sulawesi Selatan, Pisang Pataga-Sulawesi Utara dan M. balbisiana var liukiuensis (Matsum.) Hakkinen-Jepang serta satu aksesi Klutuk-Jawa Barat. Klaster III terdiri atas dua aksesi Pisang Roti-Sumatera Barat.
Terdapat 17 pita AFLP yang paling berperan dalam pengelompokan 21 aksesi menjadi tiga kelompok. Pita tersebut adalah tiga pita AFLP berdasarkan KU I dan 14 pita AFLP berdasarkan KU II.
SUMMARY
FAJARUDIN AHMAD. Genetic diversity of Musa balbisiana Colla in Indonesia Using AFLP Marker. Supervised by RITA MEGIA and YUYU SURYASARI ability to grow well in dry condition.
Molecular genetic diversity studies of M. balbisiana in Indonesia had not much been done. Therefore the aim of this research is to study genetic diversity of the banana using Amplified Fragment Length Polymorphism (AFLP).
Fifteen accessions of cultivated M. balbisiana and 16 accessions of wild M. balbisiana were used for this study. Materials were collected from Banana Germ Plasm collections Cibinong Science Center Research Center for Biology-LIPI, Bogor Botanical Garden, Bogor, West Sumatera, South Sulawesi and North Sulawesi. CTAB method was used to extract total DNA of leaves. Twenty six pairs of AFLP selective primers were used for analysis and non-radioactive dye was used for visualization of AFLP bands above UV light. Densitograf ATTO CS Analyzer Ver 2.08 application was applied to determine the appearance and size of AFLP bands. NTSYS 2.02 application was utilized to calculate dissimilarity index of Nei and Li (1979) and cluster analysis. Minitab 14 application was used to perform Principal Component Analysis (PCA).
The result showed that 22 pairs of 26 pairs of AFLP selective primers produced clear bands for genetic diversity analysis. A total 485 bands with 51-3206 bp in size were produced by these primers pairs. Range of bands number per primers pairs was 11-31 bands. Primer pair number 13 (E-AGC/M-CAC) created the most number of bands and primer pair number 11 (E-ACT/M-CTC) generated the least number of bands.
Polymorphism level of total AFLP band was 46.18% with range of polymorphism level was 0-80% for each primer pair. The highest level of polymorphism was generated by primer pair number 7 (E-ACA/M-CTG), while the lowest was produced by primer pair number 19 (E-AGG/M-CTT).
Based on AFLP bands, dissimilarity index of Nei and Li (1979) were 0.014-0.152. This result indicated that genetic diversity of the 21 accessions of M. balbisiana was 13.8%. The genetic diversity of wild M. balbisiana (12.9%) higher than genetic diversity of cultivated M. balbisiana (11.5%).
Cluster analysis based on UPGMA could not seperate wild M. balbisiana
and cultivated M. balbisiana in different clusters. The similarity coefficient 0.89 of dendrogram formed three clusters. The cluster pattern was similar to the grouping pattern in PCA plot, which formed three groups.
liukiuensis (Matsum.) Hakkinen-Japan and an accession Klutuk-West Java. Cluster III has two accessions of Pisang Roti-West Sumatera.
There were 17 AFLP bands that have the most important role in grouping of 21 accessions into three groups, i. e. three bands based on first principal component and 14 bands based on second principal component.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Tumbuhan
KERAGAMAN GENETIK PISANG
Musa balbisiana
Colla
DI INDONESIA MENGGUNAKAN PENANDA
AMPLIFIED FRAGMENT LENGTH POLYMORPHISM
(AFLP)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Keragaman Genetik Pisang Musa balbisiana Colla di Indonesia Menggunakan Penanda Amplified Fragment Length Polymorphism
(AFLP)
Nama : Fajarudin Ahmad
NIM : G353100161
Disetujui oleh Komisi Pembimbing
Dr Rita Megia, DEA Ketua
Dr Yuyu Suryasari Poerba, MSc Anggota
Diketahui oleh
Ketua Program Studi Biologi Tumbuhan
Dr Ir Miftahudin, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Tema yang saya pilih dalam penelitian ini adalah tentang keragaman genetik dengan judul ―Keragaman Genetik Pisang Musa balbisiana Colla Di Indonesia Menggunakan Penanda Amplified Fragment Length Polymorphism (AFLP)‖. Penelitian ini dapat dilaksanakan atas bantuan beasiswa Karyasiswa Ristek 2010 dan ditunjang oleh beberapa kegiatan penelitian di Pusat Penelitian Biologi yaitu, Program Kompetitif LIPI Sub-Program Domestikasi dan Pemanfaatan Terukur dengan Judul Eksplorasi dan Pemanfaatan Musa acuminata Liar Sebagai Tetua Jantan Dalam Pemuliaan Pisang Triploid Tahan Fusarium, Program DIPA 2012 Plasma Nutfah Umbi-umbian dan Buah-buahan dan Program Peningkatan Kompetensi Peneliti dan Perekayasa Ristek 2012.
Terima kasih penulis ucapkan kepada Ibu Dr Rita Megia dan Ibu Dr Yuyu Suryasari Poerba yang telah memberikan saran dan bimbingan. Penulis ucapkan terima kasih kepada Ibu Dr Utut Widyastuti, MSi selaku dosen penguji atas saran dan masukannya. Juga saya berikan banyak penghargaan kepada Bapak Dr Ahmad Farajallah dari Departemen Biologi, Ibu Dr Kusumadewi Sri Yulita, Ibu Dr Himmah Rustiami dan Ibu Dr Lina Juswara dari Pusat Penelitian Biologi LIPI yang telah memberi saran dalam pengerjaan penelitian. Ungkapan terima kasih juga disampaikan kepada Herlina, Dian serta staff Laboratorium Genetika Tumbuhan Pusat Penelitian Biologi LIPI, juga Ibu Retno beserta staff Laboratorium Terpadu Departemen Biologi FMIPA IPB yang banyak memberikan bantuan teknik.
Pihak-pihak yang secara tidak langsung berhubungan dengan penelitian ini tetapi banyak berjasa, yaitu keluargaku tercinta, istri dan anak-anakku yang sabar mencurahkan kasih sayangnya. Terima kasih kepada kedua orang tua saya di Jogja yang selalu mendoakan keberhasilan dan kemudahan bagi penulis.
Semoga karya ilmiah ini memberikan manfaat bagi keilmuan dan mendorong bagi kemajuan pengetahuan Indonesia.
Bogor, April 2013
DAFTAR ISI
Amplified Fragment Length Polymorphism (AFLP) 3 METODE
Pita AFLP berdasarkan pengelompokan varietas/kultivar M. balbisiana dari asal/lokasi yang sama
DAFTAR TABEL
1 Dua puluh satu aksesi Musa balbisiana Colla yang digunakan dalam studi keragaman genetik
2 Dua puluh enam primer selektif yang digunakan untuk analisis AFLP 3 Jumlah pita, tingkat polimorfisme dan rentang ukuran pita tiap
pasangan primer AFLP dari 21 aksesi Musa balbisiana
4 Jumlah pita dan tingkat polimorfisme pita AFLP dari tiap populasi
Musa balbisiana berdasar 22 pasang primer AFLP
5 Indeks disimilaritas (Nei dan Li 1979) pada 21 aksesi Musa balbisiana berdasarkan total pita (485 pita) yang dihasilkan dari 22 pasang primer AFLP
6 Pita AFLP yang berperan dalam pembentukan kelompok dalam plot Analisis Komponen Utama berdasarkan nilai mutlak tertinggi Komponen Utama I dan II dari 485 pita AFLP pada 21 aksesi Musa balbisiana
1 Beberapa karakter utama morfologi Musa balbisiana Colla
2 Keragaman warna batang semu dan bentuk buah Musa balbisiana di Indonesia
3 Kawasan pusat keragaman Musa balbisiana
4 Dendrogram 21 aksesi M. balbisiana berdasarkan koefisien Nei dan Li (1979) menggunakan analisis klaster UPGMA dari 485 pita AFLP 5 Plot dua dimensi Analisis Komponen Utama 21 aksesi Musa
balbisiana berdasarkan 485 pita AFLP
4
1 Pita AFLP hasil dari pasangan primer 5 (E-AGG/M-CTA)
2 Contoh kurva standar spline ukuran pita AFLP pada gel elektroforesis pasangan primer nomor 5 (E-AGG/M-CTA) (Lampiran 1) berdasarkan jarak migrasi pita marka DNA 100 bp plus 3 Contoh ukuran pita AFLP aksesi KS-JG1 hasil amplifikasi dengan
pasangan primer nomor 5 (E-AGG/M-CTA) berdasarkan interpolasi jarak migrasi 14 pita marka pada kurva standar spline (Lampiran 2) 4 Persentase proporsi keragaman 20 Komponen Utama berdasarkan
485 pita AFLP pada 21 aksesi Musa balbisiana
28
28
1
PENDAHULUAN
Latar Belakang
Keragaman genetik tanaman yang sekarang dijumpai adalah gabungan dari proses adaptasi lingkungan dan domestikasi yang berjalan lama. Keragaman genetik pisang yang tinggi di Indonesia memberikan nilai positif dengan tersedianya sumber daya genetik yang melimpah untuk memenuhi kebutuhan pangan yang terjaga.
Pisang merupakan salah satu komoditas yang penting tidak hanya di Indonesia tetapi juga di dunia. Produksi pisang dunia mencapai 106.5 juta ton dengan produksi di Indonesia mencapai 6.1 juta ton pada tahun 2011 (FAO 2011). Ancaman hama dan penyakit dari tanaman pisang sama tingginya dengan produksi pisang dunia yang tinggi. Habitat tumbuh pisang didaerah tropis sampai subtropis mempermudah berbagai penyakit berkembang. Ancaman ini tentu saja akan mengganggu produksi dan pengembangan pisang dimasa depan. Penyakit yang biasa menyerang tanaman pisang adalah jamur, bakteri dan virus. Penyakit yang disebabkan oleh jamur lebih mudah ditemukan dan menyebar, misalnya Sigatoka (yellow dan black) dan layu Fusarium. Serangan bakteri memunculkan penyakit layu Xanthomonas, penyakit darah (blood disease) dan Moko. Disamping itu serangan virus yang umum dijumpai pada pisang adalah penyakit
bunchy top disease (Blomme et al. 2011).
Musa acuminata Colla (genom A) dan Musa balbisiana Colla (genom B) merupakan nenek moyang dari pisang-pisang yang dikonsumsi saat ini. Kombinasi dari kedua jenis pisang ini membentuk berbagai macam hibrid (Simmonds dan Shepperd 1955). Kombinasi dari sesama atau antar dua genom tersebut menghasilkan berbagai kultivar tanaman pisang budidaya dengan ploidi diploid (AA, AB), triploid (AAA, AAB, ABB, BBB) dan tetraploid (AAAA, AAAB, ABBB). Pisang yang dikonsumsi saat ini didominasi oleh pisang triploid (2n=3x=33) sedikit yang diploid dan tetraploid (Heslop-Horrison dan Schwarzacher 2007). Musa acuminata memberikan sumbangan genom A yang berhubungan dengan cita rasa buah, sedangkan M. balbisiana sendiri memberi sumbangan berupa genom B yang berhubungan dengan kandungan pati, ketahanan berbagai penyakit jamur daun dan virus (banana streak badnavirus, BSV) serta habitus tanaman yang kekar (Swennen dan Vuylsteke 1990; Hohn et al. 2008).
Musa balbisiana secara alami menghasilkan biji, walaupun demikian perbanyakan dan persebaran dari M. balbisiana budidaya oleh manusia dilakukan secara vegetatif. Kondisi tersebut menyebabkan keragaman pada M. balbisiana
budidaya cenderung tidak tinggi. Tidak demikian dengan M. balbisiana liar misalnya yang ada di Filipina, menunjukkan variasi secara morfologi pada habitus, buah dan bunga (Sotto dan Rabara 2000). Keragaman ini memberikan gambaran akan potensi yang dimiliki oleh jenis pisang ini untuk dikembangkan sebagai bahan pemuliaan tanaman pisang.
2
akan memicu adaptasi yang bersifat sementara atau permanen. Penggunaan marka morfologi harus memperhatikan kondisi lingkungan dari objek yang diamati. Berbeda dengan marka morfologi, marka molekuler tidak dipengaruhi oleh faktor lingkungan. Oleh karena itu marka molekuler bisa digunakan sebagai alat untuk mempelajari perbedaan dan perubahan genetik antar waktu atau lokasi dari suatu tingkat taksa atau populasi (Perrier et al. 2009). Beberapa penelitian yang menggunakan marka molekuler untuk mempelajari keragaman genetik M. balbisiana telah dilakukan, yaitu studi keragaman genetik M. balbisiana di India dengan marka Random Amplified of Polymorphism DNA (RAPD) (Uma et al. 2006), di China menggunakan marka AFLP (Wang et al. 2007) dan di Thailand dipelajari variasi dari genom B dari jenis pisang ini dengan Suppression Substractive Hybridization (SSH) dan PCR-Restiction Fragment Length Polymorphism (PCR-RFLP) (Arjcharoen et al. 2010).
Informasi tentang keragaman genetik dari M. balbisiana di Indonesia masih belum banyak. Oleh karena itu studi yang lebih dalam perlu dilakukan untuk memperkaya informasi tentang M. balbisiana di Indonesia. Informasi keragaman genetik penting sebagai landasan pemanfaatan dan pengembangan pisang ini di masa datang.
Salah satu cara untuk memperoleh informasi keragaman genetik adalah dengan mempelajari karakter molekuler dengan menggunakan marka Amplified Fragment Lenght Polymorphism (AFLP). Marka ini merupakan salah satu marka yang penting karena telah banyak digunakan dalam berbagai studi keragaman genetik. Sebagai salah satu marka molekuler yang bersifat dominan, AFLP merupakan marka molekuler yang memiliki reprodusibilitas tinggi.
Studi keragaman genetik AFLP menghasilkan lebih banyak set data dibandingkan marka RAPD, Inter-simple Sequence Repeat (ISSR) dan mikrosatelit. Metode ini juga memiliki kelebihan lain apabila dibandingkan dengan RFLP yaitu teknik pengerjaannya lebih sederhana dengan biaya yang relatif lebih murah (Blears et al. 1998).
Tujuan Penelitian
Tujuan dari penelitian ini adalah mempelajari keragaman genetik M. balbisiana Colla di Indonesia dengan menggunakan penanda AFLP.
2
TINJAUAN PUSTAKA
Taksonomi Musa balbisiana
Secara taksonomi M. balbisiana diklasifikasikan dalam suku Musaceae
dengan marga Musa. Dalam marga Musa sendiri terdapat lima seksi, yaitu
Dalam World Checklist of Selected Plant Families (WCSP 2012) M. balbisiana disebutkan terdapat tujuh varietas yaitu var. andamica DB Singh, var.
bakeri (Hook.f.) Hakkinen, var brachycarpa (Backer) Hakkinen, var
dechangensis (J.L.Liu dan M.G.Liu) Hakkinen, var vittata (Hook.) M.R.Almeida, var liukiuensis (Matsum.) Hakkinen, dan var balbisiana Colla.
Di Indonesia M. balbisiana dikenal dengan beberapa nama lokal/kultivar, yaitu: Pisang Batu atau Pisang Klutuk (Jawa Tengah) (Rukmana 1999), Unti Batu (Sulawesi Selatan) dan Cau Manggala/Batu (Jawa Barat). Di India dikenal dengan nama Bhimkol dan Elavazhai (Uma 2006), serta di Filipina dikenal dengan nama Abuhon (Valmayor et al. 2000) dan di Thailand dikenal dengan nama Kluai Tani (Chamchalow dan Silayoi 1984).
Morfologi M. balbisiana
Ciri morfologi utama M. balbisiana adalah perawakan tanaman yang besar yang mencapai 7 meter dibandingkan M. acuminata yang memilki perawakan 3-6 meter (Gambar 1a), braktea yang membuka terangkat tetapi tidak menggulung (Gambar 1b), braktea bagian dalam berwarna merah terang tanpa adanya gradasi (Gambar 1c), ovul terdiri atas empat baris tidak teratur pada tiap lokus (Gambar 1d), celah tangkai daun menutup tanpa sayap dan memeluk batang (Gambar 1e), warna kepala putik putih gading atau kuning pucat sampai merah pucat (Gambar 1f), tepala bunga jantan terdapat variasi warna merah muda (Gambar 1g) dan tepal bebas bunga jantan jarang berkerut (Gambar 1h). Selain karakter di atas terdapat karakter penting dari M. balbisiana yaitu memiliki batang semu berwarna hijau dengan sedikit bercak atau tanpa bercak, batang, tangkai tandan tidak berbulu, rasio panjang-lebar braktea lebih dari 0.3, bentuk braktea oval lebar dengan ujung tumpul, warna braktea bagian luarnya berwarna coklat keunguan dan bekas braktea yang lepas kurang jelas (Simmonds dan Shepherd 1955).
Musa balbisiana merupakan pisang yang secara alami menghasilkan biji atau tidak bersifat partenokarpik. Walaupun demikian di Filipina dilaporkan ditemukan M. balbisiana triploid (BBB) dengan buah partenokarpik walaupun masih perlu konfirmasi tentang substansi genomnya (Uma et al. 2011).
4
a b
c d e
f g h
Gambar 1 Beberapa karakter utama morfologi Musa balbisiana
Perawakan yang besar M. balbisiana kultivar Klutuk-Jogja (panah biru) dibandingkan dengan M. acuminata Pisang Mas (panah berwarna merah) (a), tandan buah dengan braktea yang membuka (b), warna braktea bagian dalam (c), penampang melintang buah (d), celah tangkai daun (e), warna kepala putik putih (f), tepal (g), tepal bebas (h)
a b
c d e
Gambar 2 Keragaman warna batang semu dan bentuk buah Musa balbisiana di Indonesia. Klutuk Wulung memiliki warna ungu kehitaman (a) dan Klutuk memiliki warna hijau (b), buah Pisang Pataga memiliki tangkai pendek, (c) buah Pisang Roti berbentuk bulat dengan tangkai pendek (d), buah Pisang Klutuk memiliki tangkai yang panjang (e).
Persebaran M. balbisiana
6
Gambar 3 Kawasan pusat keragaman Musa balbisiana
(dalam area kurva) (Jones 2000)
Indonesia merupakan salah satu kawasan Asia Tenggara yang bukan merupakan pusat dari keragaman M. balbisiana. Walaupun demikian di wilayah Indonesia misalnya di pulau Jawa, Sulawesi atau Sumatera bisa ditemukan jenis pisang ini sebagai tanaman pekarangan (Ochsee 1931). Keberadaan M. balbisiana
di kawasan Indonesia kemungkinan besar dibawa masuk oleh manusia dari kawasan pusat asal M. balbisiana. Hipotesa ini dibuktikan oleh studi arkeobotani yang menunjukkan peninggalan biji M. balbisiana dikawasan Asia Tenggara berasal dari lapisan tanah yang lebih muda dibandingkan biji yang ditemukan dikawasan Asia Selatan sebagai pusat asalnya (de Langhe 2009).
Keunggulan M. balbisiana
Musa balbisiana penting untuk dipelajari karena memiliki beberapa keunggulan. Keunggulan yang pertama adalah genom B dari pisang diketahui berhubungan dalam hal sifat ketahanan terhadap beberapa penyakit pada pisang. Pisang ini memiliki resistensi terhadap penyakit bercak daun (leaf spot) misalnya Sigatoka (Mycosphaerella musicola R. Leach ex J.L. Mulder), Cordana and Septoria leaf spot, jamur karat dan serangan bakteri (Erwinia spp.) (Uma 2006). Selain itu pisang ini juga memiliki toleransi terhadap serangan kumbang penggerek (Odoiporus longicollis Marshall, G.A.K., Cosmopolites sordidus
(Germar) (Uma 2006). Disamping penyakit di atas, pisang ini memiliki ketahanan terhadap virus yaitu terhadap serangan banana streak badnavirus (BSV) (Swennen dan Vuylsteke 1990; Hohn et al. 2008).
Keunggulan lain dari M. balbisiana adalah mampu tumbuh baik di daerah marginal maupun daerah dengan kondisi iklim yang kering (Valmayor et al. 1991), serta ketahanan terhadap suhu dingin (Wang et al. 2007).
pemuliaan pisang untuk merakit tanaman yang tahan terhadap terpaan angin sehingga tidak mudah roboh karena batang patah.
Masyarakat Asia biasa memanfaatkan daun M. balbisiana sebagai pembungkus atau alas makan. Manfaat lainnya adalah bunga jantan (jantung) dari pisang ini dimanfaatkan sebagai sayur untuk bahan masakan (Uma 2006).
Karakterisasi Molekuler
Perbedaan M. acuminata dengan M. balbisiana berdasarkan Simmond dan Shepherd (1955) adalah perbedaan 15 karakter morfologi diantara dua jenis pisang anggota Eumusa ini. Tiap karakter diberi bobot penilaian (skor) sehingga tiap rentang nilai tertentu bisa digunakan untuk pengelompokkan pisang berdasarkan ploidi dan genomnya.
Karakter umum morfologi pada pisang yang telah dikenal terdapat 121 karakter (IPGRI 1996). Karakter tersebut meliputi ukuran tanaman, warna batang semu, variasi warna pigmentasi pada batang dan daun, ukuran/ratio daun, bentuk tandan, bentuk dan ukuran buah dan karakter-karakter detil pada pembungaan. Karakter morfologi merupakan karakter yang penting untuk diketahui, tetapi memiliki kekurangan yaitu karakter yang teramati bisa berbeda pada varietas/kultivar pisang yang sama, perbedaan ini terjadi karena dipengaruhi kondisi lingkungan yang berbeda.
Berbeda dengan karakter morfologi yang terkadang bersifat plastis karena faktor lingkungan, karakter molekuler berupa protein atau DNA lebih stabil terhadap perubahan lingkungan. Karena pertimbangan ini, karakter molekuler sangat baik untuk studi keragaman dan perubahan genetik pada suatu tingkat taksa tertentu juga antar populasi pada lokasi atau waktu yang berbeda (Perrier et al. 2009).
Marka molekuler yang umum digunakan dalam studi keragaman genetik ada dua macam yaitu berdasarkan protein dan DNA. Salah satu marka molekuler yang berdasarkan protein adalah isozim. Penggunaan marka molekuler seperti isozim memiliki kekurangan yaitu ekspresi gen penyandi protein bisa berbeda pada jaringan yang berbeda dan waktu yang berbeda (Staub et al. 1996).
Marka molekuler yang berdasarkan DNA antara lain adalah Restriction Fragment Length Polymorphism (RFLP), Random Amplified Polymorphic DNA
(RAPD) (Williams et al. 1990), minisatelit dan mikrosatelit (Kaemmer et al. 1992), Diversity Arrays Technology (DArT) (Amorim et al. 2009) dan Amplified Fragment Length Polymorphism (AFLP) (Vos et al. 1995). Marka molekuler berdasarkan DNA memiliki kelebihan yaitu karakter DNA di jaringan apapun akan sama pada semua kurun pertumbuhannya.
8
tetapi memiliki kekurangan pada tingkat produksi pita yang kurang konsisten apabila diulang di laboratorium yang berbeda, karena kondisi laboratorium yang berbeda satu dengan yang lain (Mondini et al. 2009).
Amplified Fragment Length Polymorphism (AFLP)
Marka molekuler yang digunakan pada penelitian ini adalah Amplified Fragment Length Polymorphism (AFLP). Marka ini merupakan marka yang bersifat dominan. Dibandingkan penggunaan marka RAPD, AFLP memiliki tingkat reprodusibilitas yang lebih tinggi. Selain dari segi set data yang dihasilkan lebih banyak dibandingkan mikrosatelit (Vos et al 1995). Metode AFLP ini lebih sederhana dalam hal teknik pengerjaannya dan relatif lebih murah dibandingkan metode RFLP (Blears et al. 1998).
Di Indonesia, marka AFLP dilaporkan digunakan pada analisis genetik
Phytoptora palmivora (Purwantara dan Umayah 2010), analisis abnormalitas pada klon kelapa sawit hasil kultur jaringan (Yuniastuti et al. 2005), kekerabatan pada jahe (Wahyuni et al. 2003) dan keragaman genetik pada klon karet (Nurhaimi-Haris et al. 2003), sedangkan pada pisang belum pernah dilaporkan.
Marka AFLP sudah digunakan dalam penelitian dengan objek M. balbisiana yaitu genetika populasi pisang ini di Cina (Wang et al. 2007). Marka ini juga digunakan dalam studi taksonomi, misalnya dalam hal pemisahan taksa pada tingkat subspesies Musa acuminata (subsp. microcarpa, subsp. malaccensis
dan subsp. truncata) (Wong et al. 2001). AFLP telah banyak digunakan dalam studi keragaman genetik seperti penelitian keragaman genetik dan hubungan kekerabatan 39 aksesi dari empat seksi utama pada marga Musa (Ude 2002), hubungan kekerabatan pisang dataran tinggi (Tugume et al. 2002) dan melihat variasi genetik pada tujuh kultivar pisang dengan berbagai genom (Opara et al.
2010). Pada studi grup pisang dengan genom AAA marka ini dapat memisahkan sampai tingkat sub grup dan menunjukkan pita spesifik untuk tiap kultivar dari tiap sub grup (El Khishin et al. 2009).
3
METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan Mei 2011 sampai Oktober 2012. Kegiatan penelitian dilakukan di Laboratorium Genetika Tumbuhan, Pusat Penelitian Biologi-LIPI dan Laboratorium Terpadu Departemen Biologi FMIPA-IPB.
Bahan
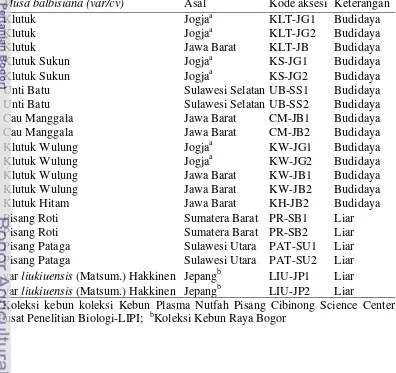
Dua puluh satu aksesi Musa balbisiana yang digunakan sebagai bahan ekstraksi DNA total dalam penelitian ini berasal dari koleksi Kebun Plasma Nutfah Pisang Cibinong Science Center Pusat Penelitian Biologi-LIPI, Kebun Raya Bogor dan hasil eksplorasi di kawasan sekitar Bogor, Sumatera Barat, Sulawesi Selatan dan Sulawesi Utara (Tabel 1).
Tabel 1 Dua puluh satu aksesi Musa balbisiana yang digunakan dalam studi keragaman genetik
Musa balbisiana (var/cv) Asal Kode aksesi Keterangan
Klutuk Jogjaa KLT-JG1 Budidaya
Klutuk Jogjaa KLT-JG2 Budidaya
Klutuk Jawa Barat KLT-JB Budidaya
Klutuk Sukun Jogjaa KS-JG1 Budidaya
Klutuk Sukun Jogjaa KS-JG2 Budidaya
Unti Batu Sulawesi Selatan UB-SS1 Budidaya
Unti Batu Sulawesi Selatan UB-SS2 Budidaya
Cau Manggala Jawa Barat CM-JB1 Budidaya
Cau Manggala Jawa Barat CM-JB2 Budidaya
Klutuk Wulung Jogjaa KW-JG1 Budidaya
Klutuk Wulung Jogjaa KW-JG2 Budidaya
Klutuk Wulung Jawa Barat KW-JB1 Budidaya
Klutuk Wulung Jawa Barat KW-JB2 Budidaya
Klutuk Hitam Jawa Barat KH-JB2 Budidaya
Pisang Roti Sumatera Barat PR-SB1 Liar
Pisang Roti Sumatera Barat PR-SB2 Liar
Pisang Pataga Sulawesi Utara PAT-SU1 Liar
Pisang Pataga Sulawesi Utara PAT-SU2 Liar
var liukiuensis (Matsum.) Hakkinen Jepangb LIU-JP1 Liar var liukiuensis (Matsum.) Hakkinen Jepangb LIU-JP2 Liar
a
10
Ekstraksi DNA Total
Metode Cetyltrimetylammoniumbromide (CTAB) (Delaporta et al. 1983; Syamkumar et al. 2003) yang telah dimodifikasi yaitu penambahan
Polyvinylpirrolidone (PVP) dan β-merkaptoetanol digunakan untuk ekstraksi DNA total.
Sampel daun muda segar sebanyak 0.2 g atau sampel daun kering sebanyak 0.02 g dari tiap aksesi digerus menggunakan mortar dengan ditambahkan 0.1 g PVP, kemudian ditambahkan buffer ekstraksi dengan komposisi 4% CTAB (b/v), 0.1 M Tris, 0.05 M Ethylenediaminetetraacetic Acid
(EDTA), 0.5 M NaCl dan 0.2 % β-mercaptoethanol. Hasil ekstraksi di atas kemudian dipurifikasi menggunakan 10 mg/ml RNAse dan selanjutnya dipurifikasi kembali dengan Phenol Chloroform Isoamil Alcohol (PCI; 25:24:1). Kadar dan kemurniannya diukur menggunakan spektrofotometer.
Analisis AFLP
Kit AFLP Analysis System I(Invitrogen) digunakan untuk analisis AFLP berdasarkan metode Vos et al. (1995) yang dimodifikasi, yaitu tidak menggunakan label radioaktif tetapi menggunakan pewarna Gel RedTM (Biotium). Tahap-tahap proses AFLP terdiri atas tiga tahap utama.
Tahap pertama dari proses AFLP adalah restriksi. Setiap reaksi restriksi digunakan komposisi sebagai berikut 14 ng/μl DNA sampel ditambahkan 2.5 unit/μl Eco-RI/Mse I dalam buffer 10 mM Tris-HCl, 50 mM NaCl, 0.1 mM EDTA, 1 mM DTT, 0.1 mg/ml BSA dan 0.1% Triton® X-100 dan diinkubasi pada suhu 37oC selama 2 jam. Hasil dari restriksi total DNA ini kemudian ditambahkan adaptor Eco RI/Mse I yang memiliki struktur sebagai berikut:
Adaptor Eco-RI
5-CTCGTAGACTGCGTACC
CATCTGACGCATGGTTAA-5
Adaptor Mse-I
5-GACGATGAGTCCTGAG TACTCAGGACTCAT-5
Komposisi tiap reaksi utuk proses ligasi adalah sebagai berikut 0.4 mM ATP, 10 mM Tris-HCl (pH 7.5), 10 mM Mg-acetate, 50 mM K-acetate, 4 u/ml T4 DNA ligase, 1 mM DTT, 50 mM KCl kemudian diinkubasi pada suhu 20oC selama 2 jam.
diikuti 24 siklus dengan kondisi sebagai berikut denaturasi pada suhu 94°C selama 30 detik, penempelan primer pada suhu 56°C selama 60 detik dan pemanjangan pada suhu 72°C selama 60 detik. Proses PCR diakhiri dengan pemanjangan akhir pada suhu 72oC selama 2 menit.
Setelah langkah praselektif amplifikasi kemudian dilanjutkan langkah selektif amplifikasi menggunakan 26 pasang primer selektif AFLP yang disarikan dari beberapa artikel penelitian yang telah dilakukan sebelumnya (Tabel 2).
Komposisi tahap selektif amplifikasi ini adalah DNA hasil praselektif amplifikasi yang diencerkan 1:50, 2.78 ng primer Eco RI+NNN/Mse I+NNN, 20 mM Tris-HCl (pH 8.4), 1.5 mM MgCl2, 50 mM KCl dan 0,5 μ/ml Taq polymerase. Kemudian masuk tahap PCR dengan kondisi sebagai berikut, pradenaturasi dengan suhu 94oC selama 4 menit, lalu diikuti siklus pertama yaitu denaturasi pada suhu 94°C selama 30 detik, penempelan primer pada suhu 65°C selama 30 detik dan pemanjangan pada suhu 72°C selama 60 detik, kemudian dilanjutkan dengan mengurangi suhu penempelan primer sebesar 0.7°C tiap siklus sepanjang 12 siklus dan diikuti 23 siklus dengan kondisi denaturasi pada suhu 94°C selama 30 detik, penempelan primer pada suhu 56°C selama 30 detik dan pemanjangan pada suhu 72°C selama 60 detik, selanjutnya diakhiri dengan pemanjangan akhir pada suhu 72oC selama 2 menit.
Tahap ketiga adalah visualisasi pita AFLP dari produk PCR selektif amplifikasi. Gel akrilamid 3.5% dengan peralatan vertical minigel electrophoresis ATTO digunakan sebagai media elektroforesis hasil selektif amplifikasi. Gel dibuat dengan mencampur 0.7 g polyacrylamide, 0.035 g bis-acrylamide, 8.74 ml larutan TBE (10.78 g/L Tris, 5.5 g/L Boric acid, 0.74 g/L EDTA), 75 µl
ammonium persulfat (APS) 10% (b/v) dan 15 µl tetramethylethylenediamine
(TEMED). Campuran tersebut dimasukkan dalam plat kaca dan dipasang sisir untuk mencetak sumuran, kemudian didiamkan selama 30 menit hingga membeku. Plat kaca yang berisi gel tersebut kemudian dipasang pada peralatan elektroforesis dan dimasukkan dalam tabung elektroforesis. Kemudian ditambahkan larutan TBE pada tabung yang terdapat sumuran gel sebanyak 100 ml dan pada tabung diluar sumuran gel sebanyak 700 ml. Sebanyak 10 µl produk PCR selektif amplifikasi ditambah 2 ul loading dye (10 mM Tris-HCl pH 7.6, 0.03% bromophenol blue, 0.03% xylene cyanol, 60% gliserol, 60 mM EDTA) kemudian dimasukkan dalam sumuran gel. Elektroforesis dilakukan pada beda potensial 85 volt selama 80 menit. Kemudian gel direndam dalam larutan pewarna Gel RedTM (Biotium) selama 30 menit. Di atas UV transiluminator gel diambil gambarnya menggunakan ATTO gel documentation.
Analisis Data
12
Tabel 2 Dua puluh enam primer selektif yang digunakan untuk analisis AFLP Primer Urutan basa (5' —3')
Aplikasi NTSYS 2.02 digunakan untuk perhitungan nilai disimilaritas dan analisis klaster (Rohlf 1993). Indeks similaritas dihitung berdasarkan koefisien Nei dan Li (1979) dalam perhitungan Similarity of Qualitative Data (SYMQUAL).
Analisis klaster dibuat dengan perhitungan Sequential Aglomerative Heirarchical and Nested (SAHN) berdasarkan un-weighted pair group method with aritmatical averages (UPGMA) dari indeks similaritas Nei dan Li (1979). Hasil dari analisis klaster disajikan dalam bentuk dendrogram.
Pita penciri aksesi M. balbisiana untuk suatu klaster pada dendrogram similaritas di identifikasi dengan cara rekapitulasi pita AFLP dengan bantuan aplikasi Microsoft Exel.
4
HASIL DAN PEMBAHASAN
Pita AFLP yang dihasilkan dari 21 aksesi M. balbisiana menggunakan penanda AFLP
Dua puluh dua pasang primer AFLP dari 26 pasang primer yang digunakan menghasilkan pola pita AFLP yang jelas. Contoh gambar pita AFLP dalam gel akrilamid dari hasil amplifikasi pasangan primer nomor 5 (E-AGG/M-CTA) disajikan dalam Lampiran 1. Ukuran tiap pita AFLP dari 22 pasang primer AFLP berkisar antara 51-3206 bp yang diperhitungan dengan kurva spline marka DNA 100 bp plus berdasarkan jarak rambat pita AFLP pada aplikasi densitograf.
Kurva spline digunakan untuk interpolasi ukuran pita karena lebih akurat dibandingkan menggunakan kurva linier (Gariepy et al. 1986). Pola migrasi pita AFLP dalam gel elektroforesis tidak linier walaupun sudah dikonversi dalam nilai log, sehingga kesalahan perkiraan ukuran pita AFLP dengan grafik linier akan lebih besar dibandingkan kurva spline. Contoh kurva spline dari marka DNA 100 bp plus pada elektroforesis hasil AFLP pasangan primer nomor 5 (E-AGG/M-CTA) disajikan dalam Lampiran 2 dan hasil interpolasi kurva tersebut pada pita AFLP aksesi KS-JG1 disajikan dalam Lampiran 3.
Jumlah pita AFLP hasil deteksi dengan aplikasi densitograf dari 22 pasangan primer adalah sebanyak 485 pita AFLP (Tabel 3). Rata-rata pita AFLP yang dihasilkan tiap pasangan primer adalah 22.1 pita. Pita terbanyak dihasilkan oleh pasangan primer nomor 13 (E-AGC/M-CAC) yaitu 31 pita, sedangkan paling sedikit dihasilkan oleh primer pasangan primer nomor 11 (E-ACT/M-CTC) yaitu 14 pita (Tabel 3). Perbedaan jumlah pita yang dihasilkan tiap pasangan primer karena adanya perbedaan kombinasi tiga buah basa yang berdekatan dengan ujung fragmen DNA hasil pemotongan enzim restriksi, sehingga tiap pasangan primer akan mengamplifikasi fragmen DNA yang berbeda dengan pasangan primer yang lain.
Jumlah pita polimorfik pada tiap pasangan primer terhadap 21 aksesi M. balbisiana berkisar antara 0-20 pita. Pita polimorfik paling banyak dihasilkan oleh pasangan primer nomor 2 (E-AAG/M-CTA) dan pita polimorfik paling sedikit dihasilkan oleh pasangan primer nomor 19 (E-AGG/M-CTT).
Persentase pita polimorfik pada tiap pasangan primer terhadap 21 aksesi
M. balbisiana berkisar antara 0-80% dengan rata-rata pita polimorfik dari 22 pasangan primer adalah 46.2%. Persentase pita AFLP polimorfik paling tinggi dihasilkan oleh pasangan primer nomor 7 (E-ACA/M-CTG), paling rendah dihasilkan oleh pasangan primer nomor 19 (E-AGG/M-CTT). Persentase pita polimorfik tidak ditentukan oleh jumlah pita polimorfik yang dihasilkan oleh suatu pasangan primer. Primer nomor 2 (E-AAG/M-CTA) menghasilkan pita polimorfik paling banyak tetapi tingkat polimorfismenya bukan yang paling tinggi yaitu 68.9%. Pita polimorfik pada pasangan primer nomor 7 (E-ACA/M-CTG) hanya 12, tetapi karena jumlah pita AFLP pada primer ini sebanyak 15 pita sehingga persentase polimorfismenya paling tinggi.
14
DNA dengan ujung ‗3 TCC dan ujung ‗5 GAA hasil pemotongan enzim restriksi
Eco-RI dan Mse-I pada genom dari 21 aksesi M. balbisiana memiliki panjang yang sama.
Tabel 3 Jumlah pita, tingkat polimorfisme dan rentang ukuran pita tiap pasangan primer AFLP dari 21 aksesi Musa balbisiana
No
Persentase rata-rata pita AFLP polimorfik yang dihasilkan tiap pasangan primer AFLP pada penelitian ini lebih tinggi dari penelitian Ude et al. (2002) yang menggunakan sampel dari berbagai seksi Musa yaitu sebesar 32.5%. Akan tetapi persentase rata-rata pita polimorfik tiap primer pada penelitian ini lebih rendah dari pada hasil penelitian keragaman genetik M. acuminata di Malaysia yaitu 93% (Wong et al. 2001), 11 kultivar pisang dari Mesir yaitu 91.6% (El-Khishin et al. 2009) dan 7 kultivar di Oman dengan 12 pasang primer yaitu 92.5% (Opara et al. 2010).
enzim restriksi memiliki tingkat komplemen yang rendah dengan pasangan primer digunakan. Penggunaan primer lain mungkin akan menghasilkan polimorfisme yang lebih tinggi atau primer pada penelitian Ude et al. (2002) apabila digunakan pada sampel pisang yang lain juga mungkin akan menghasilkan jumlah pita yang berbeda.
Persentase polimorfisme pita AFLP dalam penelitian penelitian El-Khishin
et al. (2009) dan Opara et al. (2010) lebih tinggi dari pada dalam penelitian ini. Kemungkinan karena penggunaan pisang kultivar dalam penelitian mereka. Pisang kultivar memiliki genotipe kombinasi dari M. acuminata atau M. balbisiana (Simmonds dan Shepperd 1955), sehingga struktur genotipenya lebih heterogen. Oleh karena itu, kemungkinan situs potong dalam genom pisang kultivar lebih bervariasi. Posisi titik potong enzim restriksi yang lebih bervariasi akan menghasilkan fragmen DNA dengan ukuran lebih beragam (Vos et al. 1995), dengan demikian polimorfisme pita AFLP menjadi tinggi.
Pita AFLP berdasarkan varietas/kultivar M. balbisiana dari asal/lokasi yang sama
Penggabungan aksesi M. balbisiana dengan nama varietas/kultivar dan asal/lokasi yang sama pada penelitian ini dianggap sebagai populasi, kecuali untuk kultivar Klutuk-Jawa Barat karena hanya terdiri atas satu aksesi. Jumlah pita AFLP dari tiap populasi adalah berbeda. Populasi Klutuk Sukun-Jogja memiliki jumlah pita AFLP yang paling banyak yaitu 452 pita, sedangkan paling sedikit dimiliki oleh populasi Pisang Roti-Sumatera Barat dengan 389 pita (Tabel 4). Semakin banyak situs restriksi pada suatu genom maka semakin banyak pita AFLP yang dihasilkan (Vos et al. 1995). Klutuk Sukun-Jogja memiliki pita AFLP paling banyak, berarti situs restriksi Eco-RI dan Mse-I pada kultivar ini adalah yang paling banyak dibandingkan M. balbisiana yang lain dalam penelitian ini.
Tiap populasi M. balbisiana menunjukkan adanya pita AFLP polimorfik. Polimorfisme pita AFLP dalam satu populasi M. balbisiana menunjukkan adanya keragaman pada satu kultivar/varietas dari asal/lokasi yang sama. Persentase polimorfisme pita AFLP kultivar M. balbisiana paling tinggi dimiliki oleh populasi Klutuk Wulung-Jawa Barat yaitu 13.1%, sedangkan paling rendah dimiliki populasi Klutuk-Jogja yaitu 2.7 % (Tabel 4).
Persentase polimorfisme pita AFLP pada populasi Klutuk Wulung-Jawa Barat yang paling tinggi menunjukkan keragaman genetik dari populasi ini paling tinggi dibandingkan populasi lain. Bahkan persentase polimorfisme pita AFLP populasi Klutuk Wulung-Jawa Barat yang merupakan M. balbisiana budidaya lebih tinggi dari pada tiga populasi M. balbisiana liar. Tiga populasi M. balbisiana liar tersebut adalah Pisang Roti-Sumatera Barat dengan persentase polimorfisme 12%, Pisang Pataga-Sulawesi Utara dengan persentase polimorfisme 4.4% dan M. balbisiana var liukiuensis-Jepang dengan persentase polimorfisme 8.1%.
16
dari Kecamatan Mangunreja Kabupaten Garut, sedangkan populasi kultivar/varietas M. balbisiana yang lain diambil dari rumpun yang berdekatan di tiap wilayah. Faktor adaptasi terhadap lingkungan yang berbeda mungkin menyebabkan keragaman karena terjadi mutasi somatik atau sudah terjadi rekombinasi karena perkawinan (Wong et al. 2007).
Dalam penelitian ini jumlah aksesi yang sedikit (dua aksesi tiap populasi) belum menggambarkan keragaman yang sebenarnya dari tiap populasi. Sebagai contoh Wang et al. (2007) menggunakan 12-15 individu untuk tiap populasi untuk mengetahui keragaman dalam populasi dan antar populasi pada M. balbisiana di China.
Tabel 4 Jumlah pita dan tingkat polimorfisme pita AFLP dari tiap populasi
Musa balbisiana berdasarkan 22 pasang primer AFLP Populasi M. balbisianaa Jumlah pita Jumlah pita
polimorfik
Unti Batu-Sulawesi Selatan 421 29 6.9
Cau Manggala-Jawa Barat 436 22 5
Klutuk Wulung-Jogja 437 19 4.3
Klutuk Wulung-Jawa Barat 390 51 13,1
Klutuk Hitam-Jawa Barat 436 23 5.3
Pisang Roti-Sumatera Barat 389 48 12
Pisang Pataga-Sulawesi Utara 431 19 4.4
var liukiuensis-Jepang 422 34 8.1
a
Tiap varietas/kultivar terdiri atas dua aksesi; b hanya terdiri atas satu aksesi Jumlah pita polimorfik pada 10 populasi M. balbisiana tidak berbanding lurus dengan jumlah pita AFLP yang dihasilkan. Populasi Klutuk Sukun-Jogja menghasilkan pita AFLP terbanyak tetapi tidak memiliki jumlah pita polimorfik yang terbanyak (15 pita polimorfik). Populasi Pisang Roti-Sumatera Barat yang memiliki pita AFLP paling sedikit memiliki pita polimorfik bukan yang terendah (48 pita polimorfik). Banyaknya jumlah pita AFLP yang dihasilkan oleh suatu populasi bukan merupakan dasar tingginya jumlah pita polimorfik yang dihasilkan. Variasi panjang nukleotida yang diapit dua situs restriksi yang digunakan dalam analisis AFLP pada aksesi-aksesi anggota suatu populasi yang menentukan tingkat polimorfisme pita AFLP.
Analisis klaster 21 aksesi M. balbisiana berdasarkan total pita AFLP (485 pita) yang dihasilkan dari 22 pasang primer AFLP
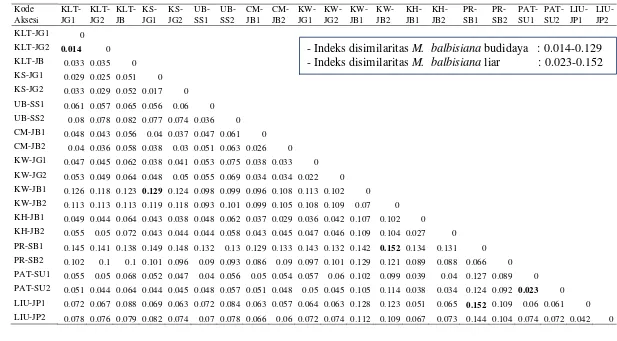
nilai disimilaritas tertinggi adalah antara aksesi PR-SB1 dengan KW-JB2 dan antara PR-SB1 dengan LIU-JP1.
KLT-JG1 dan KLT-JG2 memiliki nilai indeks disimilaritas terendah karena dua aksesi ini merupakan varietas yang sama dan dari satu tempat asal yang diperbanyak secara vegetatif. Aksesi PR-SB1 dengan KW-JB2 dan PR-SB1 dengan LIU-JP1 memiliki indeks disimilaritas tertinggi karena ketiga aksesi ini merupakan kultivar/varietas M. balbisiana yang berlainan dan juga kemungkinan karena secara geografis berasal dari tempat yang berbeda. PR-SB1 merupakan aksesi M. balbisiana dari Sumatera Barat sedangkan KW-JB1 berasal dari Jawa Barat dan LIU-JP1 berasal dari Jepang.
Kultivar/varietas M. balbisiana dalam penelitian ini apabila didasarkan pada keberadaannya ditanam oleh manusia atau tidak, dapat dibagi dalam dua kategori yaitu M. balbisiana budidaya yang terdiri atas 15 aksesi dan M. balbisiana liar yang terdiri atas enam aksesi (Tabel 1). Keragaman genetik antar
M. balbisiana budidaya sebesar 11.5% dengan indeks disimilaritas Nei dan Li (1979) berkisar antara 0.014-0.129 dan keragaman genetik antar aksesi M. balbisiana liar 12.9% dengan indeks disimilaritas Nei dan Li (1979) berkisar antara 0.023-0.152 (Tabel 5). Salah satu faktor penyebab M. balbisiana liar memiliki keragaman genetik lebih tinggi, kemungkinan karena pisang ini juga tumbuh dari biji. Musa. balbisiana budidaya juga memiliki kemampuan membentuk biji dan bisa tumbuh, tetapi campur tangan manusia dalam perbanyakan secara vegetatif lebih dominan.
Keragaman genetik 21 aksesi M. balbisiana berdasarkan penanda AFLP pada penelitian ini lebih rendah apabila dibandingkan keragaman genetik 16 aksesi M. balbisiana di India dengan marka RAPD yaitu 32% (Uma 2006). Tiga puluh empat primer RAPD yang digunakan Uma (2006), sebanyak 4 primer RAPD menghasilkan pita polimorfik dengan nilai disimilaritas antara 0-0.32. India merupakan salah satu pusat persebaran dan keragaman dari M. balbisiana,
sehingga kemungkinan secara genetik M. balbisiana India lebih beragam dibandingkan M. balbisiana di Indonesia.
Analisis klaster tidak dapat memisahkan aksesi M. balbisiana liar dengan
M. balbisiana budidaya dalam klaster berbeda. Rekapitulasi pita AFLP menunjukkan bahwa kelompok M. balbisiana liar dan M. balbisiana budidaya tidak memiliki pita AFLP penciri, sehingga hal inilah yang menyebabkan terbentuk pola klaster tersebut (Gambar 4).
Tidak adanya pita AFLP penciri pada M. balbisiana liar atau M. balbisiana budidaya mungkin karena telah terjadinya perkawinan antara kedua kategori pisang ini, sehingga karakter pita AFLP yang muncul tidak spesifik pada
Tabel 5 Indeks disimilaritas (Nei dan Li 1979) pada 21 aksesi Musa balbisiana berdasarkan total pita (485 pita) yang dihasilkan dari 22 pasang primer AFLP
Kode
Coefficient
0.88 0.89 0.90 0.91 0.92 0.93 0.94 0.95 0.96 0.97 0.98 0.99 1.00
1
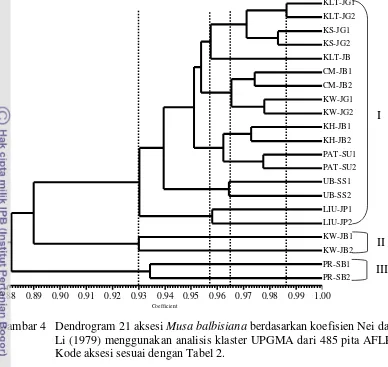
Gambar 4 Dendrogram 21 aksesi Musa balbisiana berdasarkan koefisien Nei dan Li (1979) menggunakan analisis klaster UPGMA dari 485 pita AFLP. Kode aksesi sesuai dengan Tabel 2.
Pada koefisien similaritas 0.93 di dalam dendrogram similaritas terbentuk tiga klaster (Gambar 4). Klaster I terdiri atas aksesi KLT-JG1, KLT-JG2, KLT-JB, KS-JG1, KS-JG2, UB-SS1, UB-SS2, CM-JB1, CM-JB2, KW-JG1, KW-JG2, KH-JB1, KH-JB2, PAT-SU1, PAT-SU2, LIU-JP1 dan LIU-JP2, klaster II terdiri atas KW-JB1 dan KW-JB2 dan klaster III terdiri atas aksesi PR-SB1 dan PR-SB2 (Gambar 4).
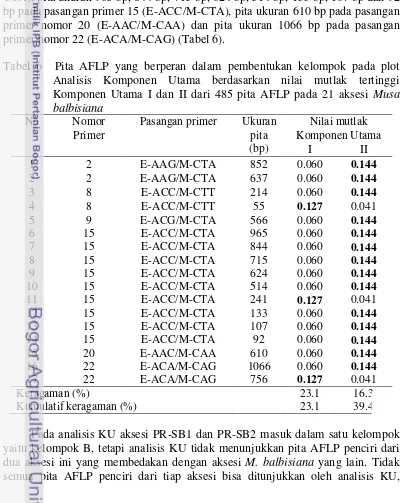
Rekapitulasi pita AFLP menunjukkan bahwa pada klaster II yang terdiri atas KW-JB1 dan KW-JB2 didapatkan 14 pita AFLP penciri. Pita penciri tersebut adalah satu pita yang hanya dimiliki aksesi KW-JB1 dan KW-JB2 yaitu ukuran 852 bp pada pasangan primer 2 (E-AAG/M-CTA) dan 13 pita AFLP yang tidak dimiliki aksesi KW-JB1 dan KW-JB2 tetapi dimiliki oleh aksesi M. balbisiana
lain. Sebanyak 13 pita yang tidak dimiliki oleh aksesi KW-JB1 dan KW-JB2 adalah pita ukuran 637 bp pada pasangan primer 2 (E-AAG/M-CTA), pita ukuran 214 bp pada pasangan primer 8 (E-ACC/M-CTT), pita ukuran 566 pada pasangan primer 9 (E-ACG/M-CTA), pita ukuran 965 bp, 844 bp, 715 bp, 624 bp, 514 bp, 133 bp, 107 bp dan 92 bp pada pasangan primer 15 (E-ACC/M-CTA), pita ukuran 610 bp pada pasangan primer nomor 20 (E-AAC/M-CAA) dan pita ukuran 1066 bp pada pasangan primer nomor 22 (E-ACA/M-CAG).
20
balbisiana yang lain, sehingga terbentuk klaster III. Empat belas pita AFLP tersebut adalah pita yang tidak dimiliki aksesi PR-SB1 dan PR-SB2 tetapi dimiliki oleh aksesi lain. Pita-pita tersebut adalah pita ukuran 734 bp, 541 bp dan 451 bp pada pasangan primer nomor 3 (E-ACG/M-CAA), pita ukuran 857 bp pada pasangan primer nomor 4 (E-AGC/M-CTT), pita ukuran 377 bp pada pasangan primer nomor 8 (E-ACC/M-CTT), pita ukuran 1200 bp pada pasangan primer nomor 12 (E-ACT/M-CTG), pita ukuran 600 bp pada pasangan primer nomor 14 AGC/M-CTT), pita ukuran 737 bp pada pasangan primer nomor 17 (E-ACT/M-CAT), pita ukuran 969 bp dan 929 bp pada pasangan primer nomor 18 ((E-ACC/M-CAT) dan pita ukuran 1308 bp, 1154 bp, 965 bp dan 306 bp pada pasangan primer nomor 21 (E-AAG/M-CAC).
Aksesi KLT-JG1, KLT-JG2, KS-JG1, KS-JG2 dan KLT-JB pada koefisien similaritas 0.957 membentuk satu sub klaster (Gambar 4). Lima aksesi ini tidak memiliki pita penciri yang membedakan dengan aksesi yang lain, tetapi membentuk satu sub klaster karena berdasarkan rekapitulasi pita AFLP memiliki 402 pita yang sama. Pengelompokkan tersebut selaras dengan karakter morfologi pisang tersebut yang sangat mirip, yaitu morfologi kultivar Klutuk dan Klutuk Sukun ini memiliki kemiripan dengan morfologi salah satu varietas M. balbisiana
yaitu M. balbisiana var. balbisiana Colla (Hakkinen M 22 Oktober 2011, komunikasi pribadi). Dengan demikian kemungkinan kultivar Klutuk dan Klutuk Sukun secara penamaan adalah sinonim.
Empat aksesi kultivar Klutuk Wulung yaitu KW-JG1, KW-JG2, KW-JB1 dan KW-JB2 tidak membentuk satu klaster. KW-JG1 dan KW-JG2 membentuk satu sub klaster dengan CM-JB1 dan CM-JB2 pada koefisien similaritas 0.965, sedangkan KW-JB1 dan KW-JB2 membentuk satu klaster tersendiri pada koefisien similaritas 0.93. Aksesi KW-JG1, KW-JG2, KW-JB1 dan KW-JB2 memiliki penamaan yang sama yaitu Klutuk Wulung dan morfologi yang mirip berupa pseudostem berwarna ungu kehitaman. Kultivar yang memiliki penamaan atau morfologi yang sama mungkin memiliki genotipe yang berbeda (Loh et al. 2000). Perbedaan genotipe keempat aksesi Klutuk Wulung diatas terjadi mungkin karena ada persilangan dengan M. balbisiana yang lain, mutasi somatik atau faktor adaptasi yang menyebabkan keragaman genetik (Wang et al. 2007).
Dendrogram hasil analisis klaster dengan UPGMA berdasarkan indeks similaritas Nei dan Li (1979) tidak menunjukkan adanya aksesi M. balbisiana
yang membentuk satu klaster pada koefisien similaritas 1.00 (Gambar 4). Keadaan ini menunjukkan tidak adanya aksesi yang identik secara genetik pada 21 aksesi
M. balbisiana, walaupun memiliki nama dan asal yang sama. Satu faktor penting yang menyebabkan keragaman genetik pada pisang adalah genom pisang memiliki transposon yang melimpah dan lebih dari sepertiga open reading frame
Analisis Komponen Utama Pita AFLP
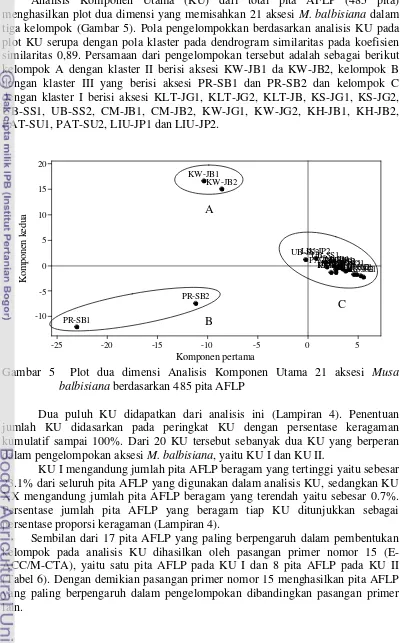
Analisis Komponen Utama (KU) dari total pita AFLP (485 pita) menghasilkan plot dua dimensi yang memisahkan 21 aksesi M. balbisiana dalam tiga kelompok (Gambar 5). Pola pengelompokkan berdasarkan analisis KU pada plot KU serupa dengan pola klaster pada dendrogram similaritas pada koefisien similaritas 0,89. Persamaan dari pengelompokan tersebut adalah sebagai berikut kelompok A dengan klaster II berisi aksesi KW-JB1 da KW-JB2, kelompok B balbisiana berdasarkan 485 pita AFLP
Dua puluh KU didapatkan dari analisis ini (Lampiran 4). Penentuan jumlah KU didasarkan pada peringkat KU dengan persentase keragaman kumulatif sampai 100%. Dari 20 KU tersebut sebanyak dua KU yang berperan dalam pengelompokan aksesi M. balbisiana, yaitu KU I dan KU II.
22
KU I merupakan komponen yang memisahkan kelompok A dan B dengan kelompok C. Dalam KU I terdapat tiga pita AFLP yang memiliki nilai mutlak tertinggi sebesar 0.127 yaitu pita ukuran 55 bp pada pasangan primer 8 (E-ACC/M-CTT), pita ukuran 241 bp pada pasangan primer 15 (E-ACC/M-CTA) dan pita ukuran 756 bp pada pasangan primer 22 (E-ACA/M-CAG) (Tabel 6). Ketiga pita AFLP ini tidak dimiliki oleh aksesi KW-JB1, KW-JB2, PR-SB1 dasn PR-SB2 tetapi dimiliki oleh aksesi M. balbisiana yang lain.
KU II berperan dalam pengelompokan kelompok A yang terdiri atas aksesi KW-JB1 dan KW-JB-2 dalam satu kelompok pada plot analisis KU. Pada KU ini terdapat 14 pita AFLP yang memiliki nilai mutlak tertinggi sebesar 0.144 yaitu pita ukuran 852 bp pada pasangan primer 2 (E-AAG/M-CTA), pita ukuran 637 bp pada pasangan primer 2 (E-AAG/M-CTA), pita ukuran 214 bp pada pasangan primer 8 (E-ACC/M-CTT), pita ukuran 566 pada pasangan primer 9 (E-ACG/M-CTA), pita ukuran 965 bp, 844 bp, 715 bp, 624 bp, 514 bp, 133 bp, 107 bp dan 92 bp pada pasangan primer 15 (E-ACC/M-CTA), pita ukuran 610 bp pada pasangan primer nomor 20 (E-AAC/M-CAA) dan pita ukuran 1066 bp pada pasangan primer nomor 22 (E-ACA/M-CAG) (Tabel 6).
Tabel 6 Pita AFLP yang berperan dalam pembentukan kelompok pada plot Analisis Komponen Utama berdasarkan nilai mutlak tertinggi Komponen Utama I dan II dari 485 pita AFLP pada 21 aksesi Musa
Kumulatif keragaman (%) 23.1 39.4
karena prinsip analisis ini adalah meringkas data dengan mencari faktor utama dalam pengelompokan aksesi dengan ciri yang sama. Dalam analisis KU variabel dikelompokkan berdasarkan persentase keragaman yang paling besar sampai yang paling kecil, sehingga akan ada variabel yang diabaikan karena mempunyai proporsi yang kecil dalam pengelompokan (Sneath dan Sokal 1973).
Analisis KU menunjukkan pita penciri dari aksesi KW-JB1 dan KW-JB2 yaitu 14 pita AFLP. Keempat belas pita AFLP penciri yang ditunjukkan oleh analisis KU bagi dua aksesi ini sama dengan pita penciri yang didapat dari rekapitulasi pita AFLP. Dengan demikian pita AFLP yang dijadikan dasar dalam pengelompokan pada analisis KU dan pembentukan klaster pada dendrogram similaritas dari aksesi KW-JB1 dan KW-JB2 adalah sama.
Metode SAHN berdasarkan UPGMA akan menghasilkan pengelompokan (klaster) dengan resolusi yang lebih tinggi dibandingkan pengelompokan pada analisis KU. Analisis KU kurang baik untuk memisahkan kelompok aksesi dengan kekerabatan yang dekat (Sneath dan Sokal 1973). Sebagai contoh pada koefisien similaritas 0.986 (Gambar 4) dalam dendrogram similaritas berdasarkan UPGMA bisa memperlihatkan terbentuknya satu sub klaster yang beranggotakan aksesi KLT-JG1 dan KLT-JG2 walaupun memiliki perbedaan karakter yang kecil dengan indeks disimilaritas 0.014, sedangkan pada analisis KU dua aksesi ini sulit terlihat pengelompokannya karena menjadi satu kelompok bersama 15 aksesi M. balbisiana yang lain.
Satu kemudahan yang diperoleh dari analisis KU adalah karakter terpenting dalam pengelompokan secara mudah dan otomatis bisa didapat dari data yang digunakan. Kelebihan ini tidak didapat pada metode SAHN berdasarkan UPGMA.
5
SIMPULAN
Analisis keragaman genetik dari 21 aksesi M. balbisiana berdasarkan 22 pasang primer AFLP menghasilkan 485 pita AFLP dengan 46.18% merupakan pita polimorfik. Ukuran pita AFLP yang dihasilkan bervariasi antara 51-3206 bp. Pasangan primer nomor 13 (E-AGC/M-CAC) menghasilkan pita AFLP paling banyak yaitu 31 pita, sedangkan paling sedikit dihasilkan oleh pasangan primer nomor 11 (E-ACT/M-CTC) yaitu 14 pita. Tiap pasangan primer rata-rata menghasilkan 22.1 pita AFLP.
Keragaman genetik 21 aksesi M. balbisiana berdasarkan penanda AFLP sebesar 13.8% dengan indeks disimilaritas koefisien Nei dan Li (1979) berkisar antara 0.014-0.152. Keragaman genetik M. balbisiana budidaya adalah 11.5% lebih rendah dari pada M. balbisiana liar yaitu 12.9%.
Analisis klaster UPGMA menggunakan koefisien similaritas Nei dan Li (1979) dari 485 pita AFLP tidak bisa memisahkan M. balbisiana budidaya dan
PAT-24
SU2, LIU-JP1 dan LIU-JP2. Aksesi anggota klaster II pada dendrogram similaritas sama dengan aksesi anggota kelompok A pada plot analisis KU yaitu KW-JB1 dan KW-JB2. Aksesi anggota klaster III pada dendrogram similaritas sama dengan aksesi anggota kelompok A pada plot analisis KU yaitu PR-SB1 dan PR-SB2.
Pita penciri pada pembentukan tiga kelompok pada plot analisis KU berdasarkan KU I dan II sebanyak 17 pita AFLP. Tiga pita penciri yang pertama berperan dalam pengelompokan PR-SB1, PR-SB2, KW-JB1 dan KW-JB2. Empat belas pita AFLP berperan dalam pengelompokan KW-JB1 dan KW-JB2, merupakan pita penciri yang membedakan kedua aksesi ini dengan 19 aksesi M. balbisiana lain.
Analisis KU tidak bisa menunjukkan pita penciri bagi aksesi PR-SB1 dan PR-SB2, walaupun berdasarkan rekapitulasi pita AFLP terdapat 14 pita AFLP penciri yang membedakan dua aksesi ini dengan aksesi M. balbisiana lain.
DAFTAR PUSTAKA
Amorim EP, Vilarinhos AD, Cohen KO, Amorim VBO, dos Santos-Serejo JA, Silva SO, Pestana KN, dos Santos VJ, Paes NS, Monte DC, dos Reis RV. 2009. Genetic diversity of carotenoid rich bananas evaluated by DArT.
Genet Mol Biol. 32:96-103
Arjcharoen A, Silayoi B, Wanichkul K, Apisitwanich S. 2010. Variation of B
Genome in Musa accessions and their new identifications. Kasetsart J (Nat Sci). 44 : 392-400
Blears M, De Grandis SA, Lee H, Trevors JT. 1998. Amplified fragment length polymorphism (AFLP): a review of the procedure and its applications. J Indust Microbiol Biotechnol. 21:99-114
Blomme G, Eden-Green S, Mustaffa M, Nwauzoma B, Thangavelu R. 2011. Major disease of banana. Di dalam: Pillay M, Tenkuano A, editor. Banana Progress and Chalanges. Boca Raton (US): CRC Pr. hlm 86
Chamchalow N, Silayoi B. 1984. Banana Germplasm in Thailand. IBPGR Regional Office for Southeast Asia, FAO/RAPA, Bangkok (TH) [Internet]. [diunduh 2012 Des 31]. Tersedia pada http://anchan.lib.ku.ac.th/kukr/ handle/003/1570.
de Langhe E. 2009. Relevance of banana seeds in archaeology. Ethno Res Appl. 7: 271-281.
Delaporta SL, Wood J, Hiks JB. 1983. A plant DNA minipreparation, Version II.
Plant Mol Biol Rep 4: 19-21
El-Khishin DA, Belatus EL, El-Hamid AA, Radwan KH. 2009. Molecular Characterization of Banana Cultivars (Musa spp) from Egypt Using AFLP.
Res J Agric Biol Sci. 5:272-279
Gariepy CE, Lomax MI, Grossman LI. 1986. SPLINT: a cubic interpolation program for analysis of fragment size in one-dimensional electrophoresis gels. Nuc Ac Res. 14(1):575-581
Hakkinen M, Wallace R. 2011. Genetic resources for banana improvement. Di dalam:. Pillay M, Tenkuano A, editor. Banana Progress and Chalanges. Boca Raton (US): CRC Pr. hlm 42
Heslop-Horrison JS, Schwarzacher T. 2007. Domestication, genomic and the future for banana. Ann Bot 100:1073-1084
Hohn T, Richert-Poggeler KR, Staginnus C, Harper G, Schwarzacher T, Teo CH, Teycheney P, Iskra-Caruana M, Hull R. 2008. Evolution of integrated plant viruses. Di dalam: Roossinck M, editor. Plant virus evolution. Heidelberg: Springer. hlm 58-81
[IPGRI] International Plant Genetic Resources Institute. 1996. Descriptor for banana (Musa spp). Montpellier: IPGRI-INIBAP/CIRAD.
Jones DR. 2000. Disease of Banana, Abaca and Enset. London (GB): CABI Pub. Kaemmer D et al. 1997. Molecular breeding in the genus Musa: a strong case for
STMS marker technology. Euphytica. 96:49-63
Loh JP, Kiew R, Set O, Gan LH, Gan Y. 2000. Amplified fragment length polymorphism fingerprinting of 16 banana cultivars (Musa cvs.). Mol Phylogen Evol. 17:360-366
Minitab Inc. 2003. Meet Minitab Release 14. (US): Minitab Inc.
Mondini L, Noorani A, Pagnotta MA. 2009. Review Assessing plant genetic diversity by molecular tools. Diversity 1:19-35. doi:10.3390/d1010019 Nei M, Li WH. 1979. Mathematical model for studying genetic variation in terms
of restriction endonucleases. Proc Natl Acad Sci. 76:5269-5273
Nurhaimi-Haris, Aswidinnoor H, Toruan-Mathius N, Purwantara A. 2003. Kemiripan genetik klon karet (Hevea brasiliensis Muell. Arg.) berdasarkan metode amplified fragment length polymorphisms (AFLP). Menara Perkebunan. 71(1): 1-15
Ochsee JJ. 1931. Vegetables of the Dutch East Indies (Edible tubers, bulbs, rhizomes and spices included). Java (ID): Archipel Drukkerij. hlm 511-513 [OECD] Organisation for Economic Co-operation and Development. 2010.
Banana and Plaintains (Musa spp.). In Safety of Transgenic Organism: OECD Consensus Document. OECD pub. 4:86
Opara UL, Jacobson D, Al-Saady NA. 2010. Analysis of genetic diversity in banana cultivars (Musa cvs.) from the South of Oman using AFLP markers and classification by phylogenetic, hierarchical clustering and principal component analyses. J Zhejiang Uni 11:332-341
Purwantara A, Umayah A. 2010. Analisis keragaman genetik Phytophthora palmivora dari tanaman kakao di Indonesia menggunakan AFLP. Menara Perkebunan 79(2): 58-66
Perrier X, Bakry F, Cerreel F, Jenny C, Horry J, Lebot V, Hippolyte I. 2009. Combining biological approaches to shed light on the evolution of edible bananas. Ethno Res App 7:199-216
Rohlf FJ. 1993. NTSYS-pc Numerical taxonomy and multivariate analysis, Ver. 1.80. NY (US): Appl Biostatist
26
Simmonds NW, Shepherd K. 1955. The taxonomy and origins of cultivated bananas. Linnean Society. Botl J, 55: 302-312
Sneath PHA, Sokal RR. 1973. Numerical Taxonomy, the Principles and Practice of Numerical Classification. San Fransisco (US): WH Freeman and Co. hlm 245-247
Sotto RC, Rabara RC. 2000. Morphological diversity of Musa balbisiana Colla in the Philippines. Infomusa. 9:28-30
Staub JE, Serquen FC, Gupta M. 1996. Genetic markers, map construction, and their application in plant breeeding. Hort Sci. 31: 729-740.
Syamkumar S, Lowarence B, Sasikumar B. 2003. Isolation and amplification of DNA from rhizomes of tumiric and ginger. Plant Mol Bio Rep. 212: 171 a-171e.
Swennen R, Vuylsteke D. 1990. Aspects of plantain breeding at IITA. Di dalam: Fullerton RA, Stova RD, editor. Sigatoka leaf spot diseases of bananas. Proceedings of an international workshop; San Jose, 28 Mar-1 Apr 1989. Montpellier: INIBAP. hlm 252-266.
Tugume AK, Lubega GW, Rubaihayo PR. 2002. Genetic diversity of East African Highland bananas using AFLP. Infomusa. 11(2): 28-32
Ude G, Pillay M, Nwakanma D, Tenkouano A. 2002. Analysis of genetic diversity and sectional relationships in Musa using AFLP markers. Theor Appl Genet. 104:1239–1245
Uma S. 2006. Farmers’ knowledge of wild Musa in India. FAO
Uma S, Siva SA, Saraswathi MS, Manickavasagam M, Durai P, Selvarajan R, Sathiamoorthy. 2006. Variation and intraspesific relationship in Indian wild
Musa balbisiana (BB) population an evidenced by random amplified polymorphic DNA. Gen Res Crop Evol. 53:349-355
Uma S, Saraswathi MS, Pillay M. 2011. Evolution and genetic Relationship in Banana and plantain. Di dalam:. Pillay M, Tenkuano A, editor. Banana Progress and Chalanges. Boca Raton (US): CRC Pr. hlm 26.
Valmayor RV, Silayoi B, Jamaluddin SH, Kusumo S, Espino RRC, Pascua OC. 1991.Banana classification and commercial cultivars in Southeast Asia. Info Bull 24:22
Valmayor RV. Jamaluddin SH, Silayoi B, Kusumo S, Danh LD, Pascua OC, Espino RRC. 2000. Banana Cultivar Names and Synonyms in Southeast Asia. International Network for the Improvement of Banana and Plaintain-Asia and the Pacific Office, Los Banos (PHI)
Vos P et al. 1995. AFLP: a new technique for DNA fingerprinting. Nucl Acids
Williams JG, Kubelik AR, Livak KJ, Rafalsky JA, Tingev SV. 1990. DNA polymorphism amplified by arbitrary primers are useful as genetic markers.
Nucleic Acids Res. 18:6531-6535
Wong C, Kiew R, Loh JP, Gan LH, Set O, Lee SK, Lum S, Gan YY. 2001. Genetic Diversity of the Wild Banana Musa acuminata Colla in Malaysia as evidenced by AFLP. Ann Bot. 88: 1017-1025
Wongniam S, Somana J, Swangpol S, Seelanan, Chareonsap P, Chadchawan S, Jenjittikul. 2010. Genetic diversity and species-specific PCR-Based markers from AFLP analyses of Thai bananas. Biochem Syst Ecol. 38:416-427 Yu KF, van Deynze A, Pauls KP. 1993. Random Amplified Polymorphic DNA
(RAPD) analyses. Di dalam: Glick BR, Thompson JE, editor. Methods in Plant Molecular Biology and Biotechnology. Boca Raton (US): CRC Press: hlm 287
Yuniastuti E, Setiamihardja R, Karmana MH, Toruan-Mathius N. 2005. Analisis AFLP pada abnormalitas klon-klon kelapa sawit (Elaeis guineensis jacq.)
hasil kultur jaringan yang berbuah normal dan abnormal. Agrosains. 7 (1): 7-12
LAMPIRAN
Lampiran 1 Pita AFLP hasil dari pasangan primer 5 (E-AGG/M-CTA)
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21
Lajur M: Marka DNA 100 bp plus, 1: KLT-JG1, 2: KS-JG1, 3: PR-SB1, 4: UB-SS1, 5: KW-JG1, 6: KW-JB1, 7: CM-JB1, 8: LIU-JP1, 9: KH-JB1, 10: PAT-SU1, 11: KLT-JG2, 12: KS-JG2, 13: PR-SB2, 14: UB-SS2, 15: KW-JG2, 16: CM-JB2, 17: KW-JB2, 18: KLT-JB, 19: LIU-JP2, 20: KH-JB2, 21: PAT-SU2.
100 bp –
1000 bp –
2000 bp –
3000 bp –
1500 bp –
1200 bp –
900 bp –
800 bp –
700 bp –
600 bp –
500 bp –
400 bp –
300 bp –
28
Lampiran 2 Kurva standar spline ukuran pita AFLP pada gel elektroforesis pasangan primer nomor 5 (E-AGG/M-CTA) (Lampiran 1) berdasarkan jarak migrasi pita marka DNA 100 bp plus
Keterangan: Kurva standar spline dibuat berdasarkan jarak migrasi 14 pita dari marka DNA 100 bp plus yaitu pita P1-P14 dengan ukuran 100-3000 bp, sehingga terbentuk 14 titik koordinat sebagai acuan pembentukan kurva untuk interpolasi ukuran pita sampel pada satu gel yang sama.