SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk
mencapai gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH
ERLIA ANGGRAINY SIANIPAR
030804053
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
TERBALIK (EVERTED SAC) JEJUNUM KELINCI
Oleh :
ERLIA ANGGRAINY SIANIPAR
NIM : 030804053
Dipertahankan dihadapan Panitia Penguji Skripsi
Fakultas Farmasi Universitas Sumatera Utara
Pada tanggal, November 2007
Pembimbing I Panitia Penguji
(Prof. Dr. M. T. Simanjuntak, MSc., Apt.) (Prof. Dr. Sumadio Hadisahputra, Apt)
NIP 130 809 699 NIP 131 283 716
Pembimbing II (Prof. Dr. M. T. Simanjuntak, MSc., Apt.)
NIP 130 809 699
(Drs. Kasmirul Ramlan S., MS., Apt.) (Dr. Edy Suwarso, SU, Apt.)
NIP 131 283 722 NIP 130 935 887
(Drs. Syafruddin, MS., Apt. ) NIP 130 535 834
FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA
Dekan,
absorpsi tablet furosemida generik pada jejunum kelinci. Percobaan ini dilakukan
dengan metode kantung terbalik jejunum kelinci, memakai alat Crane dan Wilson
yang telah dimodifikasi. Konsentrasi tablet furosemida generik yang digunakan
adalah 0,001 M, 0,002 M dan 0,003 M dengan media larutan dapar fosfat pH 6,0
isotonis. Kadar furosemida yang terabsorpsi diperiksa dalam larutan dapar fosfat
dengan menggunakan spektrofotometer ultraviolet pada panjang gelombang 277,0 nm
dan data yang diperoleh dianalisis dengan menggunakan uji statistik Analysis of
Variance (ANOVA).
Hasil penelitian menunjukkan bahwa laju absorpsi tablet furosemida generik
dipengaruhi oleh perbedaan konsentrasi. Laju absorpsi pada konsentrasi 0,003 M
(4,0604 mcg/ml.menit) lebih besar dibandingkan dengan konsentrasi 0,001 M
(3,8338 mcg/ml.menit) dan 0,002 M (1,8750 mcg/ml.menit). Pada konsentrasi 0,003
mM menit ke- 40 tercapai konsentrasi puncak (C
maks) sebesar 0,8509 mcg/ml, pada
konsentrasi 0,001 M menit ke- 5 tercapai konsentrasi puncak (C
maks) sebesar 1,4211
mcg/ml dan pada konsentrasi 0,002 M menit ke- 15 tercapai konsentrasi puncak
(C
maks) sebesar 0,3670 mcg/ml, namun laju absorpsi pada ketiga konsentrasi
furosemide tablet at rabbit’s jejunum had been researched. This experiment was done
with everted sac of rabbit’s jejunum, used Crane and Wilson apparatus which have
been modified. The concentration of generic furosemide tablet were 0.001 M, 0.002
M and 0.003 M in buffer phosphate at pH 6.0 isotonis medium. Determination of
absorpted furosemide which was checked in buffer phosphate isotonic solution by
using ultraviolet spectrophotometer at wavelength 277.0 nm and obtained data was
analyzed by using statistical test of Analysis of Variance (ANOVA).
The result of the research showed that the absorption of generic furosemide
tablet was influenced by concentration difference. Absorption rate of furosemide of
concentration 0.003 M (4.0604 mcg/ml.menit) was higher compared to concentration
0.001 M (3.8338 mcg/ml.menit) and 0.002 M 1.8750 mcg/ml.menit). The maximum
concentration (C
max) of concentration 0.003 M at 40
thminutes was 0.8509 mcg/ml,
maximum concentration (C
max) of concentration 0.001 M at 5
thminutes was 1.4211
mcg/ml and maximum concentration (C
max) of concentration 0.002 M at 15
thminutes
penulisan skripsi yang berjudul “ Pengaruh Perbedaan Konsentrasi Terhadap Laju
Absorpsi Tablet Furosemida Generik pada Kantung Terbalik (Everted sac)
Jejunum Kelinci” ini dengan baik.
Penulis mempersembahkan terimakasih dan rasa hormat yang
sebesar-besarnya kepada Ayahanda B. Sianipar dan Ibunda N. br. Tampubolon tercinta
serta saudara-saudaraku yang kusayangi (Chrisman Sianipar, Robin Frengky
Sianipar, dan Andriando Fridolin Sianipar) yang penuh kesabaran dan kasih
sayang serta telah memberikan bantuan moril, materil, dan doa yang tiada
hentinya selama kuliah hingga penyelesaian skripsi ini.
Atas segala bimbingan, bantuan, serta fasilitas yang tidak ternilai selama
penulis melaksanakan penelitian hingga selesainya penulisan skripsi ini, maka
penulis mengucapkan terima kasih yang sebesar-besarnya kepada :
1.
Bapak Prof. Dr. M. T. Simanjuntak, MSc., Apt. dan Bapak Drs. Kasmirul
Ramlan Sinaga, MS., Apt. yang telah banyak memberikan bimbingan dan
perhatiannya kepada penulis selama penelitian hingga selesainya
penyusunan skripsi ini.
2.
Bapak Prof. Dr. Sumadio Hadisahputra, Apt. selaku Dekan Fakultas
Farmasi yang telah menyediakan fasilitas kepada penulis selama menuntut
ilmu di Fakultas Farmasi
3.
Bapak Drs. Syahrial Yoenoes, SU., Apt. selaku Dosen Penasehat
Akademik yang telah memberikan motivasi dan bimbingan selama penulis
melaksanakan perkuliahan.
6.
Teman-teman Fakultas Farmasi yang tidak dapat disebutkan satu persatu
atas dukungan dan kebersamaan selama perkuliahan hingga penyelesaian
skripsi ini.
Semoga Tuhan Yang Maha Kuasa memberikan berkat dan balasan yang
berlipat ganda atas semua bantuan yang telah diberikan kepada penulis.
Akhirnya penulis berharap semoga skripsi ini dapat menjadi sumbangan
yang bermanfaat bagi ilmu pengetahuan pada umumnya dan ilmu farmasi pada
khususnya.
Medan, November 2007
Penulis,
LEMBAR PENGESAHAN ...
iii
KATA PENGANTAR ...
iv
ABSTRAK ...
vi
ABSTRACT ...
vii
DAFTAR ISI ...
viii
DAFTAR TABEL ...
xii
DAFTAR GAMBAR ...
xiii
DAFTAR LAMPIRAN ...
xiv
BAB I. PENDAHULUAN ...
1
1.1 Latar Belakang ...
1
1.2 Perumusan Masalah ...
3
1.3 Hipotesis ...
4
1.4 Tujuan Penelitian ...
4
BAB II. TINJAUAN PUSTAKA ...
5
2.1 Uraian Bahan ...
5
2.2 Farmakologi ...
6
2.2.1 Cara Kerja ...
6
2.2.2 Farmakokinetika ...
6
2.2.3 Efek Samping ...
6
2.4 Faktor-Faktor dalam Bioavailabilitas Obat ...
9
2.5 Struktur Membran Sel ...
10
2.6 Cara Penembusan Obat Melalui Membran Biologis ...
11
2.7 Usus Halus ...
17
2.8 Metode Kantung Terbalik ...
19
2.9 Kinetika Laju Absorpsi ...
20
BAB III. METODOLOGI PENELITIAN ...
23
3.1 Alat ...
23
3.2 Bahan ...
23
3.3 Hewan Percobaan ...
23
3.4 Pembuatan Pereaksi...
23
3.4.1 Larutan Air Bebas Karbondioksida ...
23
3.4.2 Larutan Kalium Dihidrogenfosfat 0,2 M ...
24
3.4.3 Larutan NaOH 0,1 N………..
24
3.4.4 Larutan NaOH 0,2 N………..
24
3.4.5 Larutan Dapar Fosfat pH 6,0 Isotonis..………..
24
3.4.6 Larutan Etanol Netral...
24
3.4.7 Larutan Indikator Fenolftalein... 24
3.5 Prosedur ...
24
3.5.4 Penentuan Panjang Gelombang Maksimum Furosemida
dalam Larutan Dapar Fosfat pH 6,0 Isotonis ...
25
3.5.5 Pembuatan Kurva Kalibrasi Furosemida dalam
Larutan Dapar Fosfat pH 6,0 Isotonis ...
25
3.5.6 Pembuatan Larutan Obat dari Tablet Furosemida
Generik dengan Konsentrasi 0,01 M dalam Larutan
Dapar Fosfat pH 6,0 Isotonis ...
26
3.5.7 Pembuatan Larutan Obat dari Tablet Furosemida
Generik dengan Konsentrasi 0,001 Mm, 0,002 M dan
0,003 M ...
26
3.5.8 Penentuan Pola Penembusan Membran ...
26
3.5.8.1 Pembuatan Jejunum Terbalik (Everted sac)
Kelinci ...
26
3.5.8.2 Penentuan Penembusan Membran Jejunum
Terbalik Kelinci ...
27
3.5.9 Analisis Data ...
28
BAB IV. HASIL DAN PEMBAHASAN ...
29
4.1 Penentuan Normalitas NaOH ...
29
Dapar Fosfat pH 6,0 Isotonis ...
30
4.5 Pengaruh Perbedaan Konsentrasi Terhadap Konsentrasi
Kumulatif Larutan Tablet Furosemida Generik yang
Terabsorpsi pada Kantung Terbalik (Everted sac)
Jejunum Kelinci ...
30
4.6 Pengaruh Perbedaan Konsentrasi Terhadap Absorpsi Tablet
Furosemida Generik pada Kantung Terbalik Jejunum Kelinci 35
BAB V. KESIMPULAN DAN SARAN ...
38
5.1 Kesimpulan ...
38
5.2 Saran ...
38
pada Interval Waktu Tertentu dalam mcg/ml...
30
Tabel 2. Data Laju Absorpsi Tablet Furosemida Generik pada
Berbagai Konsentrasi ( mcg/ml menit) ...
32
Tabel 3. Data Perbandingan harga AUC (Area Under The Curve)
Tablet Furosemida Generik pada Berbagai Konsentrasi
dalam mcg.menit/ml ...
33
Tabel 4. Data harga AUC (Area Under Curve) Furosemida Baku
dengan Konsentrasi 0,002 M pada PH 6,0 Jejunum Terbalik
Kelinci dalam mcg.menit/ml ...
34
Tabel 5. Data Variasi Konsentrasi pada Uptake 15 Menit dari Tablet
Gambar 2. Proses Laju Bioavailabilita Obat ...
9
Gambar 3. Struktur Membran Sel ...
11
Gambar 4. Difusi Pasif Melalui Pori ...
12
Gambar 5. Difusi dengan Fasilitas ...
14
Gambar 6. Sistem Pengangkutan Aktif ...
16
Gambar 7. Sistem Pengangkutan Secara Pinositosis ...
16
Gambar 8. Skema Usus Halus dengan Villi dan Perfusinya ...
18
Gambar 9. Grafik Konsentrasi Kumulatif terhadap Waktu dari 0,001 M,
0,002 M dan 0,003 M Tablet Furosemida Generik ...
32
Gambar 10. Grafik Michaelis Menten dari Absorpsi Tablet Furosemida
Generik pada Kantung Terbalik (Everted sac) Jejunum
Kelinci ...
36
Lampiran 2. Contoh Perhitungan Kadar Furosemida Baku...
44
Lampiran 3. Flowsheet Pembuatan Larutan Induk Baku Furosemida
dalam Dapar Fosfat pH 6,0 Isotonis ...
46
Lampiran 4.
Flowsheet Penentuan λ Maksimum Furosemida dalam
Dapar Fosfat pH 6,0 Isotonis ...
47
Lampiran 5. Penentuan Kurva Serapan Furosemida Baku dalam
Larutan Dapar Fosfat pH 6,0 Isotonis ...
48
Lampiran 6. Flowsheet Pembuatan Kurva Kalibrasi Furosemida dalam
Dapar Fosfat pH 6,0 Isotonis ...
49
Lampiran 7. Penentuan Persamaan Garis Regresi dan Kurva
Kalibrasi Furosemida Baku dalam Larutan Dapar Fosfat
pH 6,0 isotonis ...
50
Lampiran 8. Flowsheet Pembuatan Jejunum Terbalik (Everted sac)
Kelinci ...
52
Lampiran 9. Flowsheet Penentuan Pola Penembusan Membran Oleh
Konsentrasi dalam mcg/ml ...
54
Lampiran 11. Contoh perhitungan Penentuan Harga Konsentrasi
Kumulatif Tablet Furosemida Generik dalam Cairan
Serosa Kantung Terbalik (Everted sac) Jejunum Kelinci
pada Berbagai Konsentrasi dalam mcg/ml ...
55
Lampiran 12. Contoh Perhitungan Penentuan Harga AUC (Area Under
The Curve) Tablet Furosemida Generik pada Berbagai
Konsentrasi dalam mcg.menit/ml...
56
Lampiran 13. Data Absorbansi Tablet Furosemida Generik dalam Cairan
Serosa Kantung Terbalik (Everted sac) jejunum Kelinci
pada Berbagai Konsentrasi ...
57
Lampiran 14. Data Konsentrasi Tablet Furosemida Generik dalam Cairan
Serosa Kantung Terbalik (Everted sac) jejunum Kelinci
pada Berbagai Konsentrasi dalam mcg/ml ...
60
Lampiran 15. Data Konsentrasi Tablet Furosemida Generik dalam Cairan
Serosa Kantung Terbalik (Everted sac) Jejunum Kelinci
ada Berbagai Konsentrasi dalam 10
-3M ...
61
Lampiran 16. Data Konsentrasi Kumulatif Tablet Furosemida Generik
dalam Cairan Serosa Kantung Terbalik (Everted sac)
Lampiran 18. Perhitungan Analysis of Variance (ANOVA) Konsentrasi
Kumulatif Tablet Furosemida Generik pada Kantung
erbalik (Everted sac) Jejunum kelinci dengan Berbagai
Konsentrasi ...
64
Lampiran 19. Perhitungan Analysis of Variance (ANOVA) dan Least
Significant Difference (LSD) terhadap Area Under Curve
(AUC) Tablet Furosemida Generik pada Kantung
Terbalik (Everted sac) Jejunum kelinci dengan
Berbagai Konsentrasi ...
65
Lampiran 20. Gambar Grafik Log Konsentrasi Kumulatif Terhadap Waktu
dari 0,001 M, 0,002 M dan 0,003 M Tablet Furosemida
Generik dengan Menggunakan Orde Satu ...
66
Lampiran 21. Gambar Grafik Konsentrasi Kumulatif Terhadap Akar Waktu
dari 0,001 M, 0,002 M dan 0,003 M Tablet Furosemida
Generik dengan Menggunakan Orde Higuchi ...
67
absorpsi tablet furosemida generik pada jejunum kelinci. Percobaan ini dilakukan
dengan metode kantung terbalik jejunum kelinci, memakai alat Crane
dan
Wilson
yang telah dimodifikasi. Konsentrasi tablet furosemida generik yang digunakan
adalah 0,001 M, 0,002 M dan 0,003 M dengan media larutan dapar fosfat pH 6,0
isotonis. Kadar furosemida yang terabsorpsi diperiksa dalam larutan dapar fosfat
dengan menggunakan spektrofotometer ultraviolet pada panjang gelombang 277,0 nm
dan data yang diperoleh dianalisis dengan menggunakan uji statistik Analysis of
Variance (ANOVA).
Hasil penelitian menunjukkan bahwa laju absorpsi tablet furosemida generik
dipengaruhi oleh perbedaan konsentrasi. Laju absorpsi pada konsentrasi 0,003 M
(4,0604 mcg/ml.menit) lebih besar dibandingkan dengan konsentrasi 0,001 M
(3,8338 mcg/ml.menit) dan 0,002 M (1,8750 mcg/ml.menit). Pada konsentrasi 0,003
mM menit ke- 40 tercapai konsentrasi puncak (C
maks) sebesar 0,8509 mcg/ml, pada
konsentrasi 0,001 M menit ke- 5 tercapai konsentrasi puncak (C
maks) sebesar 1,4211
mcg/ml dan pada konsentrasi 0,002 M menit ke- 15 tercapai konsentrasi puncak
(C
maks) sebesar 0,3670 mcg/ml, namun laju absorpsi pada ketiga konsentrasi
furosemide tablet at rabbit’s jejunum had been researched. This experiment was done
with everted sac of rabbit’s jejunum, used Crane and Wilson apparatus which have
been modified. The concentration of generic furosemide tablet were 0.001 M, 0.002
M and 0.003 M in buffer phosphate at pH 6.0 isotonis medium. Determination of
absorpted furosemide which was checked in buffer phosphate isotonic solution by
using ultraviolet spectrophotometer at wavelength 277.0 nm and obtained data was
analyzed by using statistical test of Analysis of Variance (ANOVA).
The result of the research showed that the absorption of generic furosemide
tablet was influenced by concentration difference. Absorption rate of furosemide of
concentration 0.003 M (4.0604 mcg/ml.menit) was higher compared to concentration
0.001 M (3.8338 mcg/ml.menit) and 0.002 M 1.8750 mcg/ml.menit). The maximum
concentration (C
max) of concentration 0.003 M at 40
thminutes was 0.8509 mcg/ml,
maximum concentration (C
max) of concentration 0.001 M at 5
thminutes was 1.4211
mcg/ml and maximum concentration (C
max) of concentration 0.002 M at 15
thminutes
BAB I
PENDAHULUAN
1.1
Latar Belakang
Absorpsi obat mengharuskan molekul-molekul obat berada dalam bentuk
larutan pada tempat absorpsi. Disolusi dari bentuk-bentuk sediaan padat dalam
cairan-cairan saluran cerna merupakan syarat untuk menyampaikan suatu obat ke
sirkulasi sistemik setelah pemberian oral (Lachman, dkk, 1991).
Umumnya absorpsi obat pada saluran cerna terjadi secara difusi pasif
sehingga untuk dapat diabsorpsi, obat harus larut dalam cairan pencernaan.
Absorpsi sistemik suatu obat dari tempat ekstravaskular dipengaruhi oleh
sifat-sifat anatomik dan fisiologik tempat absorpsi, serta sifat-sifat-sifat-sifat fisikokimia obat
tersebut (Shargel dan Yu, 1999). Obat-obat yang diabsorpsi oleh difusi pasif, yang
menunjukkan kelarutan dalam air rendah, cenderung memiliki laju absorpsi oral
lebih lambat daripada yang menunjukkan kelarutan dalam air yang tinggi
(Lachman, dkk, 1991).
1.
Molekul (senyawa) ditranspor dari daerah yang mempunyai perbedaan
potensial kimia yang rendah menuju yang lebih tinggi.
2.
Hasil metabolisme senyawa akan mengganggu transpor.
3.
Kecepatan transpor akan mengalami penjenuhan apabila konsentrasi dari
senyawa meningkat.
4.
Sistem transpor umumnya memperlihatkan struktur kimia spesifik.
5.
Senyawa kimia dengan struktur yang hampir sama akan bekerja sebagai
kompetitif inhibitor (Gennaro, 2000).
Metode kantung terbalik merupakan teknik in vitro yang mudah dan cepat
dilaksanakan serta dapat ditemukan seluruh tipe sel dan lapisan mukosa sehingga
mencerminkan proses/lingkungan sebenarnya saat obat mengalami proses
absorpsi di usus (Barthe, et al, 1999).
Metode kantung terbalik (everted sac) baik digunakan untuk menentukan
absorpsi pada tempat yang berbeda pada usus halus. Hal ini sangat berguna untuk
mengestimasi
first-pass metabolism dari obat dalam sel epithelial intestinal
(Chowhan, and Amaro, 1977).
furosemida dalam rentang pH 1,9 - 3,9 menunjukkan bahwa semakin tinggi pH
semakin lambat laju penguraian, yang memperlihatkan bahwa furosemida
terhidrolisis karena katalisis ion hidrogen spesifik. Tanjung (2001), telah meneliti
tentang uji bioekivalensi terhadap tablet furosemida generik dan nama dagang
yang menunjukkan bahwa tidak ditemukan perbedaan yang bermakna secara
statistika antara produk generik dan nama dagang.
Siregar (2006), meneliti pengaruh perbedaan pH terhadap laju absorpsi
furosemida pada duodenum kelinci, menunjukkan bahwa laju absorpsi furosemida
lebih cepat pada pH 5,8 dibandingkan pH 6,0. Matondang (2006), telah meneliti
tentang pengaruh perbedaan pH terhadap absorpsi furosemida pada jejunum
kelinci memperlihatkan bahwa laju absorpsi pada pH 6,0 > pH 7,0 > pH 6,6.
Selanjutnya Panggabean (2006), telah meneliti tentang pengaruh perbedaan pH
terhadap absorpsi furosemida pada ileum kelinci, menyatakan bahwa laju absorpsi
pada pH 7,0 lebih cepat daripada pH 7,6 dan pH 8,0; serta absorpsi furosemida
pada intestine kelinci paling tinggi dalam jejunum pada pH 6,0.
Berdasarkan hal-hal tersebut di atas peneliti tertarik untuk meneliti
pengaruh konsentrasi terhadap laju absorpsi furosemida yang dilakukan pada
jejunum terbalik kelinci dengan tablet furosemida generik sebagai model.
1.2
Perumusan masalah
Berdasarkan latar belakang di atas, maka yang menjadi perumusan masalah
dalam penelitian ini adalah:
b.
Bagaimana efek perbedaan konsentrasi terhadap laju absorbsi tablet
furosemida generik pada kantung terbalik (Everted sac) jejunum kelinci?
1.3
Hipotesis
Berdasarkan perumusan masalah di atas, maka yang menjadi hipotesis
dalam penelitian ini adalah:
a.
Ada pengaruh perbedaan konsentrasi terhadap laju absorpsi tablet
furosemida generik pada kantung terbalik (Everted sac) jejunum kelinci.
b.
Perbedaan konsentrasi akan mempengaruhi laju absorpsi tablet furosemida
generik pada kantung terbalik (Everted sac) jejunum kelinci.
1.4
Tujuan
Berdasarkan hipotesis di atas, maka yang menjadi tujuan dalam penelitian
ini adalah:
a.
Untuk mengetahui pengaruh perbedaan konsentrasi terhadap laju absorpsi
tablet furosemida generik pada kantung terbalik (Everted sac) jejunum
kelinci.
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Bahan
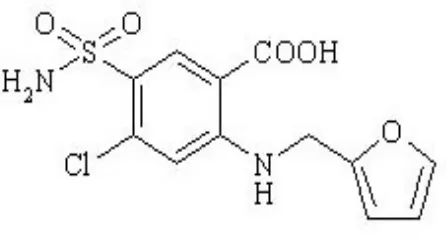
Gambar 1. Rumus Bangun Furosemida
Nama kimia
: Asam 4-kloro-N-furfuril-5-sulfamoilantranilat
Rumus molekul
: C
12H
11ClN
2O
5Berat molekul
: 330,74
S
Pemerian
: Serbuk hablur, putih sampai hampir kuning; tidak berbau.
Kelarutan
: Praktis tidak larut dalam air; mudah larut dalam aseton,
dalam dimetilformamida dan dalam larutan alkali
hidroksida; larut dalam metanol; agak sukar larut dalam
etanol; sukar larut dalam eter; sangat sukar larut dalam
kloroform
2.2 Farmakologi
2.2.1 Cara Kerja
Furosemida adalah suatu derivat asam antranilat yang efektif sebagai
diuretik. Efek kerjanya cepat dan dalam waktu yang singkat. Mekanisme kerja
furosemid adalah menghambat penyerapan kembali natrium oleh sel tubuli ginjal.
Furosemida meningkatkan pengeluaran air, natrium, klorida, kalium dan tidak
mempengaruhi tekanan darah yang normal. Pada penggunaan oral, furosemida
diabsorpsi sebagian secara cepat dan diekskresikan bersama urin dan feses
(Lukmanto,2003)
2.2.2 Farmakokinetika
Awal kerja obat terjadi dalam 0,5-1 jam setelah pemberian oral, dengan
masa kerja yang relatif pendek ± 6-8 jam. Absorpsi furosemida dalam saluran
cerna cepat, ketersediaan hayatinya 60-69 % pada subyek normal, dan ± 91-99 %
obat terikat oleh plasma protein. Kadar darah maksimal dicapai 0,5-2 jam setelah
pemberian secara oral, dengan waktu paruh biologis ± 2 jam (Siswandono,1995).
Resorpsinya dari usus hanya lebih kurang 50%, t ½ plasmanya 30-60
menit. Ekskresinya melalui kemih secara utuh, pada dosis tinggi juga lewat
empedu ( Tjay dan Kirana, 2002).
2.2.3 Efek Samping
Secara umum, pada injeksi intra vena terlalu cepat dan jarang terjadi
ketulian (reversible) dan hipotensi. Dapat juga terjadi hipokaliemia reversibel
(Tjay dan Kirana, 2002).
2.2.4 Penggunaan Klinik
Furosemida dapat digunakan untuk pengobatan hipertensi ringan dan
sedang, karena dapat menurunkan tekanan darah (Siswandono,1995).
2.2.5 Sediaan dan Posologi
Furosemida tersedia dalam bentuk tablet 20, 40, 80 mg dan preparat
suntikan. Umumnya pasien membutuhkan kurang dari 600 mg/hari. Dosis anak 2
mg/kg BB, bila perlu dapat ditingkatkan menjadi 6 mg/kg BB (Ganiswara,1995).
2.2.6 Klasifikasi Furosemida Berdasarkan Biofarmasi
Furosemida memiliki nilai kelarutan 0,01 mg/ml, C log P 1,9 dan log P
0,74 serta nilai pKa 3,9. Berdasarkan nilai log P, maka furosemida digolongkan
kepada kelas ke 4, yaitu sebagai obat yang memiliki kelarutan rendah dan
permeabilitas rendah sesuai dengan Biopharmaceutics Classification System
(BCS) (Anonim, 2002).
2.3 Absorpsi Obat melalui Saluran Cerna
Absorpsi obat didefinisikan sebagai penetrasi suatu obat melewati
membran tempat pemberian (site of application), dan obat tersebut berada dalam
bentuk yang tidak mengalami perubahan (Syukri,2002).
a.
Bentuk Sediaan
Bentuk sediaan terutama berpengaruh terhadap kecepatan absorpsi obat,
yang secara tidak langsung dapat mempengaruhi intensitas respons biologis obat.
Bentuk sediaan pil, tablet, kapsul, suspensi, emulsi, serbuk, dan larutan, proses
absorpsi obat memerlukan waktu yang berbeda-beda dan jumlah ketersediaan
hayati kemungkinan juga berlainan.
Ukuran partikel bentuk sediaan juga mempengaruhi absorpsi obat. Makin
kecil ukuran partikel, luas permukaan yang bersinggungan dengan pelarut makin
besar sehingga kecepatan melarut obat makin besar.
Adanya bahan-bahan tambahan atau bahan pembantu, seperti bahan
pengisi, pelicin, penghancur, pembasah dan emulgator, dapat mempengaruhi
waktu hancur dan melarut obat, yang akhirnya berpengaruh terhadap kecepatan
absorpsi obat.
b.
Sifat Kimia Fisika Obat
Bentuk asam, basa, ester, garam, kompleks atau hidrat dari bahan obat
dapat mempengaruhi kelarutan dan proses absorpsi obat. Selain itu bentuk kristal
atau polimorf, kelarutan dalam lemak/air dan derajat ionisasai juga mempengaruhi
proses absorpsi obat.
c.
Faktor Biologis
lambung dan waktu transit dalam usus, serta banyaknya buluh darah pada tempat
absorpsi.
d.
Faktor Lain-lain
Faktor lain-lain yang berpengaruh terhadap proses absorpsi obat antara
lain adalah umur, diet (makanan), adanya interaksi obat dengan senyawa lain dan
adanya penyakit tertentu (Siswandono, 2000).
2.4 Faktor-Faktor dalam Bioavailabilitas Obat
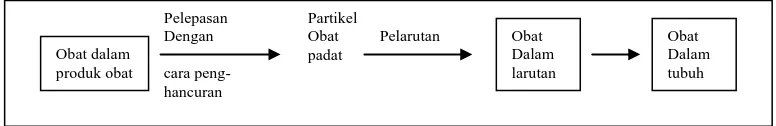
Pada umumnya produk obat mengalami absorpsi sistemik melalui suatu
rangkaian proses (Gambar 2). Proses tersebut meliputi disintegrasi produk obat
yang diikuti pelepasan obat, pelarutan obat dalam media ‘aqueous’, dan absorpsi
melewati membran sel menuju sirkulasi sistemik.
Untuk obat-obat yang mempunyai kelarutan kecil dalam air, laju pelarutan
sering kali merupakan tahap yang paling lambat, oleh karena itu mengakibatkan
terjadinya efek penentu kecepatan terhadap bioavailabilitas obat. Tetapi
sebaliknya untuk obat yang mempunyai kelarutan besar dalam air, laju
pelarutannya cepat sedangkan laju lintas atau tembus obat lewat membran
merupakan tahap paling lambat atau merupakan tahapan penentu kecepatan.
Gambar 2. Proses laju bioavailabilitas obat
(Shargel,1988)
Pelepasan Partikel
Dengan Obat Pelarutan Absorpsi padat
cara peng- hancuran Obat dalam
produk obat
Obat Dalam larutan
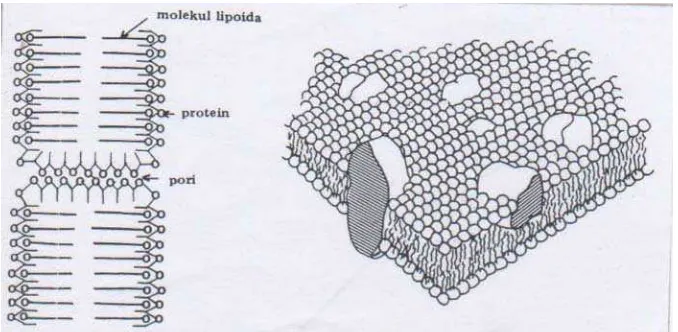
2.5 Struktur Membran Sel
Penelitian Dawson dan Danielli (1936-1943) serta Stein dan Danielli
(1956) mengemukakan suatu lembaran lipida protein sebagai model membran.
Model membran tersebut terdiri dari dua basal lipida monomolekular (yang terdiri
dari fosfolipida, tetapi juga kolesterol) yang kutub hidrofobnya menghadap ke
bagian dalam, dan kutub hidrofilnya merupakan basal protein berada di fasa
berair. Dua kutub hidrofil mengandung protein dan ujung fosfolipid yang polar
(salah satu diantaranya yang berada pada permukaan luar mempunyai lapisan
protein globular) mengelilingi daerah pusat hidrofob. Tetapi tampaknya susunan
statis tersebut bukan merupakan protein dan lipida dalam membran seluler yang
hidup.
Gambar 3. Stuktur Membran Sel
2.6
Cara Penembusan Obat Melalui Membran Biologis
Pada umumnya obat menembus membran biologis secara difusi.
Mekanisme difusi dipengaruhi oleh struktur kimia, sifat fisika kimia obat dan sifat
membran biologis.
Cara penembusan obat ke dalam membran biologis dibagi atas :
1.
Difusi pasif
Penembusan membran biologis secara difusi pasif dibedakan menjadi tiga,
yaitu difusi pasif melalui pori (cara penyaringan), difusi pasif dengan cara melarut
dalam lemak penyusun membran dan difusi pasif dengan fasilitas.
a.
Difusi Pasif Melalui Pori
untuk senyawa yang bulat, atau lebih kecil dari 400 jika molekulnya terdiri
atas rantai panjang (Aiache, dkk, 1993)
Gambar 4. Difusi Pasif Melalui Pori
b.
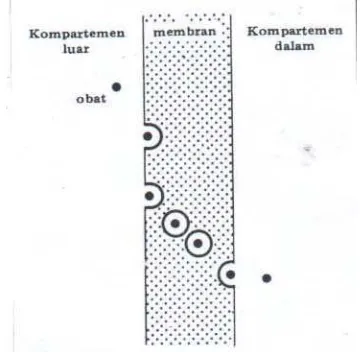
Difusi Pasif dengan Cara Melarut pada Lemak Penyusun Membran
Penembusan terjadi karena adanya perbedaan konsentrasi atau
elektrokimia tanpa memerlukan energi, sehingga mencapai keseimbangan di
kedua sisi membran.
Bila molekul semakin larut lemak, maka koefisien partisinya semakin
besar dan difusi transmembran terjadi lebih mudah. Kebanyakan zat aktif
merupakan basa atau asam organik, maka dalam keadaan terlarut sebagian
molekul berada dalam bentuk terionkan dan sebagian dalam bentuk tak
terionkan. Hanya fraksi zat aktif yang terionkan dan larut dalam lemak yang
dapat melalui membran dengan cara difusi pasif.
tak terionkan (satu-satunya yang bergantung pada konsentrasi), serta derajat
ionisasi molekul.
c.
Difusi Pasif dengan Fasilitas
Beberapa bahan obat dapat melewati membran sel karena ada tekanan
osmosa, yang disebabkan adanya perbedaan kadar antar membran,
pengangkutan ini berlangsung dari daerah dengan kadar tinggi ke daerah
dengan kadar yang lebih rendah dan berhenti setelah mencapai
kesetimbangan, gerakan ini tidak memiliki energi dan terjadi secara spontan.
Diduga molekul obat membentuk kompleks dengan suatu molekul
pembawa dalam membran, yang bersifat mudah larut dalam lemak, sehingga
dengan mudah bergerak menembus membran. Pada sisi membran yang lain
kompleks akan terurai melepas molekul obat dan molekul pembawa bebas
kembali ke tempat semula.
Gambar 5. Difusi dengan Fasilitas
Hukum difusi Fick :
)
(
C
1C
2S
e
KxD
dt
dQ
−
=
Keterangan :
dt
dQ
= laju pelintasan zat aktif melalui membran
K
= koefisien partisi membran biologik / cairan pelarutan
D
= koefisien difusi molekul zat aktif melintasi membran
S
= permukaan membran yang kontak dengan pelarutan
e
= tebal membran
C
1-C
2Dari persamaan tersebut, dapat dilihat hal-hal yang berpengaruh pada
penyerapan zat aktif. Dengan demikian, dapat dikatakan bahwa laju penyerapan
berbanding lurus dengan perbedaan konsentrasi di kedua sisi membran (C
= perbedaan konsentrasi di kedua sisi membran
1
-C
2).2. Transpor Aktif
Pada transpor aktif diperlukan adanya pembawa. Pembawa ini merupakan
suatu bagian dari membran, berupa enzim atau paling tidak senyawa protein
dengan molekul yang dapat membentuk kompleks pada permukaan membran.
Kompleks tersebut melintasi membran dan selanjutnya molekul dibebaskan pada
permukaan lainnya, lalu pembawa kembali menuju permukaan asalnya (transpor
selalu terjadi dalam arah tertentu, pada bagian usus perjalanan terjadi dari mukosa
menuju serosa).
Sistem transpor aktif bersifat jenuh, artinya jika semua molekul pembawa
telah digunakan maka kapasitas maksimalnya tercapai. Sistem ini menunjukkan
adanya suatu kekhususan untuk setiap molekul atau suatu kelompok molekul.
Oleh sebab itu dapat terjadi persaingan beberapa molekul yang berafinitas sama
pada pembawa tertentu, dan molekul yang mempunyai afinitas tinggi dapat
menghambat kompetisi transpor dari molekul yang afinitasnya lebih rendah.
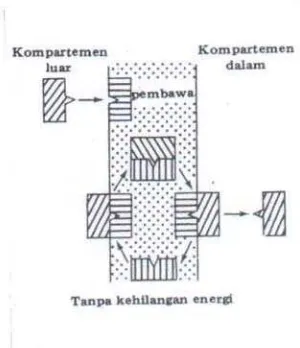
Gambar 6. Sistem Pengangkutan Aktif
3.
Pinositosis
Pinositosis merupakan tipe khas pengangkutan aktif dari obat yang
mempunyai ukuran molekul besar dan misel-misel seperti lemak, amilum,
gliserin, vitamin A,D,E dan K. Pengangkutan ini digambarkan seperti sistem
fagositosis pada bakteri (Siswandono, 1995).
Gambar 7. Sistem Pengangkutan Secara Pinositosis
[image:33.595.221.401.435.611.2]lipid membran sel mempunyai daya afinitas yang lebih tinggi terhadap bentuk
obat yang larut dalam lipid. Obat asam lemah dan basa lemah mungkin berada
dalam keadaan tak terion pada harga pH dari fasa berair pada bagian eksternal dan
internal membran. Selama bentuk tak terion dari obat lebih mudah larut dalam
lipid dari pada bentuk terion, bentuk tak terion larut ke dalam membran dan
seterusnya maka difusi akan lebih cepat dari pada bentuk terion (Wolf,1994).
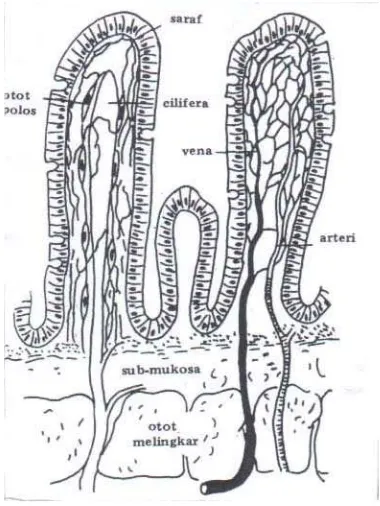
2.7
Usus Halus
Karakteristik anatomi dan fisiologi usus (dengan makrovilli dan
mikrovillinya) lebih menguntungkan untuk penyerapan obat, seperti halnya juga
penyerapan zat makanan.
Pentingnya permukaan penyerapan terutama karena banyaknya
lipatan-lipatan mukosa usus yang berupa valvula conniventes atau lipatan-lipatan kerckring, yang
terutama banyak terdapat di daerah duodenum dan jejunum. Di daerah tersebut
villi-villi usus tertutup oleh epitel bagaikan sikat yang terdiri dari bulu-bulu halus
(mikrovilli) dan mempunyai aktivitas yang kuat. Adanya anyaman kapiler darah
dan getah bening pada setiap lipatan memungkinkan terjadinya penyerapan yang
besar. Gerakan usus dan gerakan villi usus di sepanjang saluran cerna akan
mendorong terjadinya penembusan menuju pembuluh darah. Keadaan pH serta
tebal dinding yang beragam di setiap bagian usus menyebabkan perbedaan
penembusan yang cukup besar pada molekul zat aktif terutama molekul asam
yang penyerapannya dipengaruhi oleh pH lambung.
Difusi pasif berkaitan dengan sejumlah senyawa yang larut lemak atau
fraksi-fraski tak terionkan yang larut lemak.
Difusi pasif terutama terjadi pada bagian pertama usus halus, karena
konsentrasi obat-obat yang tinggi dalam liang usus akan meningkatkan gradien
difusi, hal yang sama terjadi pula pada bagian usus sebelah bawah dan pada
penyerapan susjacent.
[image:35.595.216.406.388.641.2]Transpor aktif juga berperan di usus halus dan di sini terjadi persaingan
terhadap pembawa yang sama atau terjadi penjenuhan sistem transpor yang dapat
membatasi pelintasan membran. Pinositosis juga berperan terutama di ileum
terhadap molekul-molekul yang tidak larut (Aiache, dkk, 1993).
2.8
Metode Kantung Terbalik (
Everted sac
)
Preformulasi melibatkan sejumlah pemeriksaan untuk menghasilkan
informasi yang bermanfaat untuk tahap formulasi selanjutnya meliputi kestabilan
fisikokimia dan kecocokan dosis obat secara biofarmasi.
Penelitian awal biofarmasi dari senyawa obat juga dilakukan selama
preformulasi. Uji-uji ini didesain untuk menelusuri karakteristik ketersediaan
senyawa obat secara in vitro. Hasil penelitian ini mengkontribusikan suatu produk
sediaan obat yang efektif, rasional, aman, dan ekonomis.
Suatu teknik dengan menggunakan everted intestinal sac dapat digunakan
dalam mengevaluasi karakteristik absorpsi dari zat obat (Ansel,1989).
Dalam persiapannya, teknik everted sac menggunakan bagian dari intestin,
disayat dari bagian omentum dan sirkulasi mesenterikum. Intestin ini dibalik
sehingga permukaannya berada pada bagian luar dan ujung dari bagian ini diikat,
larutan buffer dimasukkan melalui kateter pada bagian lainnya, dan bagian luar
usus direndam dalam larutan berisis obat dengan suhu 37
oC, dialiri oksigen 95%
dan CO
2Everted sac merupakan teknik yang sederhana yang menghadirkan
kerumitan yang lebih sedikit bila dibandingkan dengan pengujian konsentrasi obat
secara in vivo.
50%. Kedua bagian, baik serosa maupun mukosa dapat dijadikan sampel
untuk analisis.
mesenterikum dan kehadiran obat secara total pada bagian dalam kantung pada
difusi melalui serosa.
Selain metode everted sac, terdapat beberapa metode lain yang juga dapat
digunakan untuk melakukan percobaan secara in vitro pada usus halus antara lain:
•
Everted Intestinal Ring
Metode ini hampir serupa dengan metode everted sac, namun pada metode
ini usus halus dibagi secara horisontal menjadi bentuk cincin-cincin yang
berukuran 2-5 mm. Cincin-cincin ini dibenamkan tanpa pemberian
oksigen, larutan obat dikontrol oleh temperatur. Konsentrasi obat yang
ditentukan antara cincin-cincin dan media. Kebaikan dan keburukan dari
metode ini sama besarnya dengan metode everted sac. Secara teknis
metode ini lebih mudah dilakukan dibandingkan dengan metode everted
sac, tetapi pengambilan dari permukaan mukosa dan serosa dapat terjadi.
•
Isolated Mucosal Strips
(Swarbrick, and Boylan, 1992)
2.9
Kinetika Laju Absorpsi
a.
Orde reaksi
•
Reaksi orde nol
Laju peruraian obat secara matematis dapat digambarkan sebagai berikut :
Laju pengurangan konsentrasi =
k
dt
dCa
=
−
Bila data dari suatu studi stabilitas mengikuti reaksi orde nol, grafik x
(jumlah yang bereaksi) versus t (waktu) merupakan garis lurus dengan
kelandaian menyamai k. Nilai k menyatakan jumlah obat yang terurai per
satuan waktu, dan titik potong garis pada waktu nol sama dengan
konstanta.
jumlah
yang bereaksi
(x)
Waktu (t)
•
Reaksi ode pertama
Laju pengurangan konsentrasi = -
dt
dCa
= k Ca
Dengan memakai persamaan tersebut untuk reaksi orde pertama dihasilkan
garis lurus bila dibuat grafik logaritma konsentrasi Ca terhadap waktu.
Kecepatan atau konstanta laju reaksi, k, dapat dihitung dari kelandaian
garis dikalikan 2,303.
% obat yang
tersisa
b. Persamaan Michaelis Menten
V =
]
[
]
[
C
K
C
V
m maks+
+ Kd [C]
Dimana;
V
= Kecepatan absorpsi awal (mcg/ml.menit)
V
maksK
= Kecepatan absorpsi maksimum (mcg/ml.menit)
m
[C]
= Konsentrasi (M)
= Tetapan Michaelis Mentens (M)
Kd
= Koefisien Difusi
(Inui, et al, 1988)
3. Lineweaver Burk
Kurva hubungan konsentrasi [C] dan kecepatan absorpsi [V] yang
dikemukakan oleh Michaelis mentens dapat diubah ke dalam kurva garis lurus
apabila digunakan harga resiproknya (1/V dan 1/C). Persamaannya adalah:
1/v =
maks m V KC
1
+
maksV
1
Bentuk kurva:
1/v 1/Vmaks1/Km 1/C
BAB III
METODOLOGI PENELITIAN
3.1 Alat
Alat-alat yang digunakan adalah alat permeasi in vitro Crane dan Wilson
(modifikasi), spektrofotometer UV-visibel (Shimadzu), neraca analitik (Metler
Toledo), termostat, pH meter (Hanna), stop watch, termometer, tabung oksigen
dan regulator, gelas ukur, pipet volume, maat pipet, tabung reaksi, labu takar,
gelas beaker, kapas, sarung tangan, kotak untuk kelinci, botol aquadest, satu set
alat bedah, dan alat lain yang dibutuhkan.
3.2 Bahan
Bahan yang digunakan adalah furosemida baku (Arandy laboratoris),
eter p.a., natrium hidroksida p.a. (E Merck), Kalium dihidrogen fosfat p.a.
(E.Merck), Natrium Klorida p.a. (E.Merck), NaCl fisiologis, aquadest, jejunum
kelinci.
3.3 Hewan Percobaan
Hewan yang digunakan adalah kelinci jantan dengan berat 1,5 - 2 kg.
3.4 Pembuatan Pereaksi
3.4.1 Larutan Air Bebas Karbondioksida
3.4.2 Larutan Kalium Dihidogenfosfat 0,2 M
Dilarutkan sejumlah 27,218 g kalium dihidrogenfosfat P dalam air bebas
karbondioksida P secukupnya hingga 1000 ml (Depkes RI, 1979).
3.4.3 Larutan NaOH 0,1 N
Dilarutkan sejumlah 4,001 g natrium hidroksida secukupnya hingga
1000 ml (Depkes RI,1979).
3.4.4 Larutan NaOH 0,2 N
Dilarutkan sejumlah 8,001 g natrium hidroksida secukupnya hingga
1000 ml (Depkes RI, 1979).
3.4.5 Larutan Dapar Fosfat pH 6,0 Isotonis
Dicampur 50,0 ml kalium dihidrogenfosfat 0,2 M dengan 5,6 ml natrium
hidroksida 0,2 N dan 1,24 g NaCl, kemudian dicukupkan dengan air bebas
karbondioksida P hingga 200 ml (Depkes RI, 1979).
3.4.6 Larutan Etanol Netral
Pada sejumlah etanol (95%) P ditambahkan 0,5 ml larutan fenolftalein P
dan natrium hidroksida 0,02 N atau 0,1 N secukupnya hingga larutan berwarna
merah jambu. Etanol netral P harus dibuat baru (Depkes RI, 1979).
3.4.7 Larutan Indikator Fenolftalein
Dilarutkan 1 g fenolftalein P dalam 100 ml etanol P (Ditjen POM, 1995).
3.5 Prosedur
3.5.1 Pembakuan Larutan NaOH 0,1 N
dilarutkan dalam 15 ml air bebas karbondioksida P. Ditambahkan 2 tetes
fenolftalein LP dan titrasi dengan larutan natrium hidroksida hingga terjadi warna
merah muda yang mantap (Ditjen POM, 1995).
3.5.2 Penetapan Kadar Furosemida Baku
Ditimbang seksama lebih kurang 600 mg, dilarutkan dalam 50 ml etanol
yang telah ditambah 3 tetes fenolftalein LP, dan sebelumnya telah dinetralkan
dengan natrium hidroksida 0,1 N. Dititrasi dengan natrium hidroksida 0,1 N
sampai titik akhir berwarna merah muda (Ditjen POM, 1995).
3.5.3 Pembuatan Larutan Induk Baku Furosemida Dalam Larutan Dapar
Fosfat pH 6,0 Isotonis
Ditimbang seksama 50,0 mg furosemida yang telah dikeringkan pada suhu
105
o3.5.4 Penentuan Panjang Gelombang Maksimum Furosemida Dalam
Larutan Dapar Fosfat pH 6,0 Isotonis
C selama 3 jam. Kemudian dipindahkan secara kuantitatif ke dalam labu
tentukur 100 ml dilarutkan dengan NaOH 0,1 N sampai serbuk larut lalu
dicukupkan dengan larutan dapar fosfat pH 6,0 isotonis hingga garis tanda.
Dari larutan induk baku dipipet 0,75 ml, dimasukkan ke dalam labu
tentukur 50 ml, dicukupkan dengan larutan dapar fosfat pH 6,0 isotonis sampai
garis tanda. Diukur panjang gelombang maksimum.
3.5.5 Pembuatan Kurva Kalibrasi Furosemida Dalam Dapar Fosfat pH 6,0
Isotonis
dalam labu tentukur 50 ml dan dicukupkan dengan larutan dapar fosfat pH 6,0
isotonis sampai garis tanda. Diukur pada panjang gelombang maksimum.
3.5.6
Pembuatan Larutan Obat Dari Tablet Furosemida Generik Dengan
Konsentrasi 0,01 M Dalam Larutan Dapar Fosfat pH 6,0 Isotonis
Ditimbang sejumlah serbuk dari tablet furosemida generik setara dengan
826,850 mg. Lalu serbuk dilarutkan dengan NaOH 0,1 N. Kemudian dipindahkan
ke dalam labu tentukur 250 ml, dicukupkan dengan larutan dapar fosfat pH 6,0
isotonis hingga garis tanda.
3.5.7
Pembuatan Larutan Obat Dari Tablet Furosemida Generik Dengan
Konsentrasi 0,001 M, 0,002 M dan 0,003 M
Dari larutan tablet furosemid generik 0,01 M dipipet masing-masing
25 ml, 50 ml, dan 75 ml atau setara dengan konsentrasi 0,001 M, 0,002 M dan
0,003 M, lalu dimasukkan dalam labu tentukur 250 ml, dicukupkan dengan
larutan dapar fosfat pH 6,0 isotonis sampai garis tanda.
3.5.8 Penentuan Pola Penembusan Membran Oleh Furosemida
3.5.8.1 Pembuatan Jejunum Terbalik (
Everted sac
) Kelinci
Hewan percobaan berupa kelinci jantan dengan berat antara 1,5 – 2 kg,
dipuasakan selama 20 – 24 jam. Setelah kelinci tersebut dianestesi dengan eter,
kemudian dilakukan pembedahan pada bagian perut tetapi jangan sampai
mengenai tulang dada. Seluruh usus dikeluarkan dan dibersihkan bagian dalamnya
dari kotoran dan bagian luar dari jaringan yang mengikat, pembuluh darah halus,
dan sebagainya dengan bantuan pinset dan gunting. Kemudian usus diikat pada
jarak
±
25 cm dari pylorus (ujung lambung) dan bagian ini merupakan duodenum.
lalu diikat dengan benang, bagian atas digunakan untuk pemeriksaan laju
absorpsi kontrol dan bagian bawah digunakan sebagai pemeriksaan laju absorpsi
sampel. Lamanya usus digunakan dalam percobaan dihitung sejak usus dipisahkan
dari pilorus. Kemudian setiap bagian dipotong tetapi salah satu ujungnya tetap
terikat. Lalu dimasukkan ke dalam larutan NaCl dingin didiamkan beberapa
menit, kemudian diangkat dan dibalik dengan menggunakan batang pengaduk
berpenampang 2 mm. Lalu dijepit pada bagian yang ada ikatan dan dilepaskan
dengan pinset dari batang pengaduk, dicelupkan ke dalam larutan NaCl dingin
(Sinaga, 1995; Kooshapur and Chaiden, 1999).
3.5.8.2 Penentuan Penembusan Membran Jejunum Terbalik Kelinci
Jejunum terbalik kelinci dengan panjang efektif masing-masing 7 cm diikat
pada kanula dan masing-masing diisi dengan cairan serosa 2 ml ke dalamnya
berupa larutan dapar fosfat pH 6,0 isotonis yang tidak mengandung bahan obat.
Jejunum terbalik bagian atas yang digunakan sebagai kontrol, dimasukkan ke
dalam tabung berisi 75 ml cairan mukosa yang mengandung larutan buffer posfat
pH 6,0 isotonis yang tidak mengandung bahan obat. Sedangkan untuk jejunum
terbalik bagian bawah yang digunakan sebagai percobaan, dimasukkan ke dalam
tabung berisi 75 ml cairan mukosa yang mengandung bahan obat furosemida
dengan konsentrasi 0,001 M. Selanjutnya dimasukkan termostat dengan
temperatur 37
±
0,5
oC. Selama berlangsung percobaan dijaga agar seluruh bagian
Pada menit 5, 10, 15, 20, 30, 35, 40, 45 cairan serosa diambil ± 1 ml melalui
kanula dan selanjutnya dipipet 0,5 ml diencerkan dengan larutan fisiologis pH 6,0
isotonis hingga 25 ml. Dimasukkan kembali sebanyak 1 ml untuk setiap
pengambilan cairan serosa. Serapan larutan yang diperiksa, diukur panjang
gelombang maksimum yaitu 277,0 nm dengan spektrofotometer ultraviolet.
Dilakukan cara yang sama dengan cara diatas untuk konsentrasi 0,002 M dan
0,003 M (Sinaga, 1995; Kooshapur and Chaiden, 1999).
3.5.9 Analisis Data
Untuk mengetahui pengaruh perbedaan konsentrasi terhadap laju absorpsi
tablet furosemida generik, dilakukan pengujian dalam dapar fosfat pH 6,0 isotonis
pada temperatur 37 ± 0,5
oKetergantungan konsentrasi terhadap laju absorpsi tablet furosemida
generik pada kantung terbalik (everted sac) usus halus dihitung dengan persamaan
Michaelis menten.
C sehingga diperoleh data konsentrasi kumulatif dan
laju absorpsi furosemida pada berbagai konsentrasi. Data hasil perhitungan diuji
dengan menggunakan
Analysis of Variance
(ANOVA) program SPSS dengan
taraf kepercayaan
95% (α
= 0,05).
Untuk mengetahui harga kecepatan absorpsi maksimum (V
maks),
konstanta Michaelis (K
m), dilakukan dengan menggunakan Lineweaver-Burk
BAB IV
HASIL DAN PEMBAHASAN
4.1 Penentuan Normalitas NaOH
Untuk mengetahui normalitas NaOH maka dilakukan pembakuan degan
menggunakan lebih kurang 150 mg kalium biftalat P yang sebelumnya telah
dihaluskan dan dikeringkan pada suhu 120
o4.2 Penetapan Kadar Furosemida Baku
C selama 2 jam, dan dilarutkan dalam
15 ml air bebas karbondioksida P. Ditambahkan 2 tetes fenolftalein LP dan
dititrasi dengan larutan natrium hidroksida hingga terjadi warna merah muda yang
mantap. Normalitas NaOH yang diperoleh adalah sebesar 0,0918 N. Hasil dapat
dilihat pada lampiran 2 halaman 44.
Penetapan kadar furosemida baku dilakukan secara titrasi semi bebas air
yaitu denagn menggunakan NaOH 0,1 N sebagai pentiter dan indikator
fenolftalein sehingga diperoleh kadar furosemida baku sebesar 99,3276 %. Hasil
dapat dilihat pada lampiran 2 halaman 45.
4.3 Penentuan Panjang Gelombang Maksimum Furosemida Dalam Larutan
Dapar Fosfat pH 6,0 Isotonis
4.4 Pembuatan Kurva Kalibrasi Furosemida Dalam Dapar Fosfat pH 6,0
Isotonis
Untuk menentukan kurva kalibrasi dari furosemida baku dalam larutan
dapar fosfat pH 6,0 isotonis dilakukan pengukuran absorbansi dari larutan induk
furosemida pada konsentrasi 2,0; 2,5; 3,0; 3,5; 5,5; 7,5; 9,5 dan 11,5 mcg/ml
sehingga diperoleh absorbansi dari masing-masing konsentrasi. Hasil dapat dilihat
pada Lampiran 6 dan 7, halaman 49 - 51.
4.5 Pengaruh Perbedaan Konsentrasi Terhadap Konsentrasi Kumulatif
Larutan Tablet Furosemida Generik Yang Terabsorpsi Pada Kantung
Terbalik (
Everted sac
) Jejunum Kelinci
Untuk mengetahui pengaruh perbedaan konsentrasi terhadap absorpsi
kumulatif larutan tablet furosemida generik, dilakukan pengujian dalam larutan
dapar fosfat pH 6,0 isotonis pada temperatur 37 ± 0,5
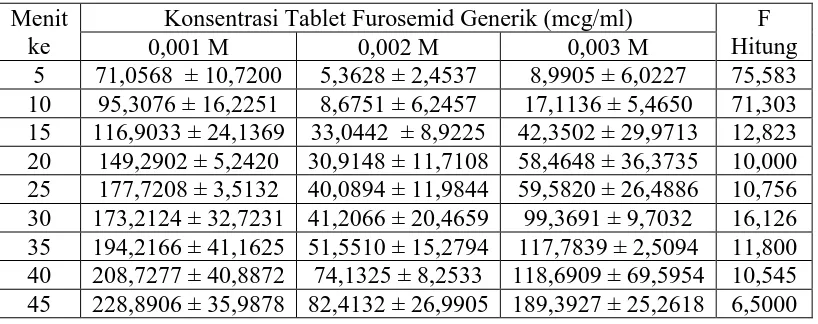
oTabel 1. Data Konsentrasi Kumulatif Tablet Furosemida Generik pada
Interval Waktu Tertentu dalam mcg/ml
C dengan hasil seperti yang
terlihat pada Tabel 1.
Menit
ke
Konsentrasi Tablet Furosemid Generik (mcg/ml)
F
Hitung
0,001 M
0,002 M
0,003 M
5
71,0568 ± 10,7200
5,3628 ± 2,4537
8,9905 ± 6,0227
75,583
10
95,3076 ± 16,2251
8,6751 ± 6,2457
17,1136 ± 5,4650
71,303
15
116,9033 ± 24,1369 33,0442 ± 8,9225
42,3502 ± 29,9713
12,823
20
149,2902 ± 5,2420
30,9148 ± 11,7108
58,4648 ± 36,3735
10,000
25
177,7208 ± 3,5132
40,0894 ± 11,9844
59,5820 ± 26,4886
10,756
30
173,2124 ± 32,7231 41,2066 ± 20,4659
99,3691 ± 9,7032
16,126
35
194,2166 ± 41,1625 51,5510 ± 15,2794
117,7839 ± 2,5094
11,800
40
208,7277 ± 40,8872
74,1325 ± 8,2533
118,6909 ± 69,5954 10,545
45
228,8906 ± 35,9878 82,4132 ± 26,9905 189,3927 ± 25,2618 6,5000
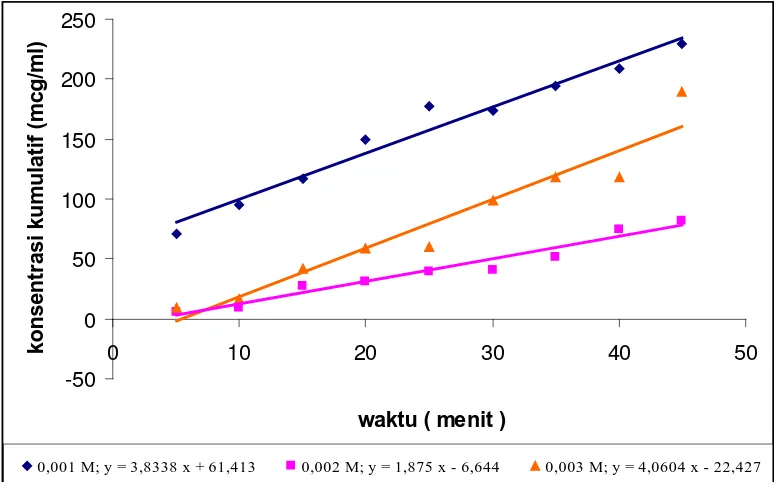
[image:47.595.109.518.498.660.2](Sudjana, 1992). Hal ini menunjukkan bahwa konsentrasi kumulatif tablet
furosemida yang terabsorpsi dalam larutan dapar fosfat pada berbagai konsentrasi
menunjukkan perbedaan yang signifikan sehingga dapat disimpulkan bahwa
konsentrasi kumulatif furosemida yang terabsorpsi dalam larutan dapar fosfat
pH 6,0 isotonis pada konsentrasi 0,001 M (228,8906. ± 35,9878 mcg/ml) >
konsentrasi 0,003 M (189,3927 ± 25,2618 mcg/ml) > konsentrasi 0,002 M
(82,4132 ± 26,9905 mcg/ml).
-50 0 50 100 150 200 250
0 10 20 30 40 50
waktu ( menit )
k
ons
e
nt
ra
s
i k
um
ula
tif
(
m
c
g/m
l)
0,001 M; y = 3,8338 x + 61,413 0,002 M; y = 1,875 x - 6,644 0,003 M; y = 4,0604 x - 22,427
Gambar 9. Grafik Konsentrasi Kumulatif Terhadap Waktu dari 0,001 M,
0,002 M dan 0,003 M Tablet Furosemida Generik
Gambar 9 menunjukkan slope masing-masing konsentrasi dari persamaan
garisnya di mana laju absorpsi adalah merupakan slope, yakni laju absorpsi
mengacu kepada orde reaksi nol, dimana dc/dt = k, laju absorpsi ditunjukkan pada
Tabel 2.
Tabel 2. Data Laju Absorpsi Tablet Furosemida Generik pada Berbagai
Konsentrasi (mcg/ml.menit)
Konsentrasi
0,001 M
0,002 M
0,003 M
Laju Absorpsi
3,8338
1,8750
4,0604
[image:49.595.117.506.116.357.2]menjelaskan bahwa kemungkinan mekanisme permeasi tidak hanya difusi pasif
saja, tetapi juga bekerja sistem transpor yang lain sehingga dapat disimpulkan
dalam hal ini bahwa konsentrasi mempengaruhi laju absorpsi dari tablet
furosemida generik.
Berdasarkan hal di atas, maka dilakukan penentuan harga AUC (Area
Under The Curve) tablet furosemida generik pada berbagai konsentrasi untuk
[image:50.595.106.523.374.529.2]mengetahui perbedaan jumlah furosemida yang terabsorpsi, yang dapat dilihat
pada Tabel 3.
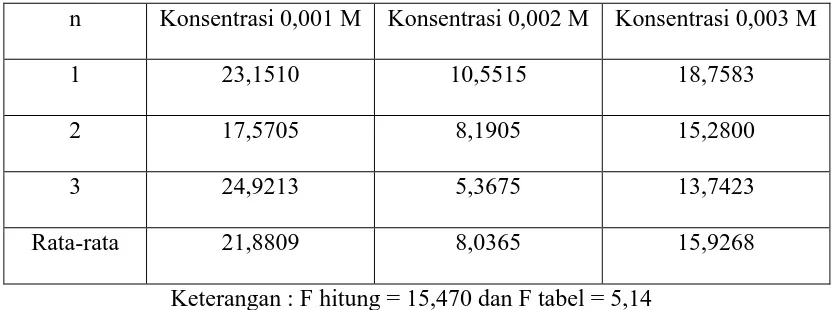
Tabel 3. Data Perbandingan Harga AUC (
Area Under The Curve
)
Furosemida pada Berbagai Konsentrasi dalam mcg.menit/ml
n
Konsentrasi 0,001 M Konsentrasi 0,002 M Konsentrasi 0,003 M
1
23,1510
10,5515
18,7583
2
17,5705
8,1905
15,2800
3
24,9213
5,3675
13,7423
Rata-rata
21,8809
8,0365
15,9268
Keterangan : F hitung = 15,470 dan F tabel = 5,14
Dari Tabel 3 terlihat bahwa harga AUC furosemida pada konsentrasi
0,001 M lebih besar dari pada harga AUC furosemida pada konsentrasi 0,002 M
dan 0,003 M.
bahwa jumlah furosemida yang terabsorpsi melalui membran jejunum terbalik
pada konsentrasi 0,001 M > 0,003 M > 0,002 M.
[image:51.595.211.435.306.423.2]Pada Tabel 4 ditampilkan data harga AUC pada furosemida baku dengan
konsentrasi 0,002 M sebagai perbandingan dengan harga AUC pada tablet
furosemida generik.
Tabel 4. Data Harga AUC (
Area Under The Curve
) Furosemida Baku
dengan Konsentrasi 0,002 M pada pH 6,0 Jejunum Terbalik Kelinci
dalam mcg.menit/ml.
n
Harga AUC
1
13,2675
2
11,7496
3
10,4411
4
10,4492
5
12,2063
6
10,1119
Rata-rata
11,3709
Dari Tabel 3 dan Tabel 4 terlihat bahwa harga AUC furosemida baku lebih
besar dari pada tablet furosemida generik pada konsentrasi 0,002 M yaitu sebesar
11,3709 mcg.menit/ml dan 8,0365 mcg.menit/ml. Hal ini kemungkinan
disebabkan oleh faktor formulasi dan pengaruh komponen bahan tambahan
sebagai bahan penyusun dari sediaan tablet sehingga jumlah obat yang terabsopsi
menjadi rendah.
4.6 Pengaruh Perbedaan Konsentrasi Terhadap Absorpsi Tablet Furosemida
Generik pada Kantung Terbalik Jejunum Kelinci
Untuk mengetahui pengaruh perbedaan konsentrasi terhadap absorpsi dari
tablet furosemida generik, dilakukan dengan menggunakan persamaan Michaelis
menten menggunakan data Tabel 5 seperti yang terlihat pada Gambar 10.
Persamaan Michaelis Mentens:
V =
]
[
]
[
C
K
C
V
m maks
+
+ Kd [C]
Dimana;
V
= Kecepatan absorpsi awal (mcg/ml/menit)
V
maksK
= Kecepatan absorpsi maksimum (mcg/ml/menit)
m
[C]
= Konsentrasi (M)
= Tetapan Michaelis Mentens (M)
(Inui, et al, 1977)
Tabel 5. Data Variasi Konsentrasi pada
Uptake
15 Menit dari Tablet
Furosemida Generik
C
(10
-3Absorpsi (V)
(mcg/ml/15 menit)
M)
SD
1/C
(1/10
-31/V
M)
(1/mcg/ml/15 menit)
1/SD
1
0,29340,1971
1,0000
3,4083 5,07362
0,3670
0,1405
0,5000
2,7248 7,11740.0 0.2 0.4 0.6 0.8 1.0 1.2
0 0.5 1 1.5 2 2.5 3 3.5
C (10-3 M)
K
ecep
at
an
A
b
so
rp
si
(
m
cg
/m
l/
15 m
en
it
[image:53.595.133.495.116.360.2])
Gambar 10. Grafik Michaelis Menten dari Absorpsi Tablet Furosemida
Generik Pada Kantung Terbalik (
Everted sac
) Jejunum Kelinci
Gambar 10. memperlihatkan adanya ketergantungan kosentrasi terhadap
absorpsi dari tablet furosemida generik Dan untuk mengetahui nilai konstanta
Michaelis Menten (K
m) dan kecepatan maksimum (V
maks) terhadap laju absorpsi
dari tablet furosemida generik dengan konsentrasi 0,001 M, 0,002 M dan 0,003 M
pada suhu ± 37
oC dan pH 6,0 isotonis, dihitung dengan memakai kurva
Lineweaver burk plot menggunakan data pada Tabel 5 dan Gambar 11 sehingga
diperoleh hasil kecepatan maksimum (V
maks) adalah 0,8198 mcg/ml/15 menit
dan konstanta Michaelis (K
m) dalah 1,8690.10
-3M. Sehingga dapat dinyatakan
y = 2.2798x + 1.2198 R2 = 0.8524 -6.0
-4.0 -2.0 0.0 2.0 4.0 6.0 8.0 10.0 12.0
-1.0 -0.5 0.0 0.5 1.0 1.5
1/C (1/10-3 M)
1/
V
(
1/
(m
cg
/m
l/
15 m
en
it
)
Keterangan : Temperatur : ± 37
on = 3
[image:54.595.135.499.115.408.2]C
pH = 6,0 isotonis
Gambar 11. Kurva
Lineweaver – Burk
Dari Absorpsi Tablet Furosemida
Generik Pada Kantung Terbalik (
Everted sac
) Jejunum Kelinci
Salah satu kelemahan dari metode everted sac intestine adalah terjadinya
ikatan protein dengan obat yang mengakibatkan jumlah zat yang diabsorbsi lebih
besar dari yang sebenarnya. Ikatan protein obat dapat saja terjadi pada mukosa
dan pada serosa, maka untuk memperoleh data yang lebih rinci sebaiknya
dilakukan dengan metode intestinal mucosa homogenated dan dengan
menggunakan alat penentuan kadar yang lebih sensitif yaitu KCKT.
1/Vmaks = 1,2198
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Laju absorpsi tablet furosemida generik pada kantung terbalik (Everted sac)
jejunum kelinci dipengaruhi oleh perbedaan konsentrasi.
b. Pada konsentrasi 0,003 M (4,0604 mcg/ml.menit) laju absorpsi tablet
furosemida generik lebih besar dibandingkan dengan konsentrasi 0,001 M
(3,8338 mcg/ml.menit) dan 0,002 M (1,8750 mcg/ml.menit). Pada
konsentrasi 0,003 M menit ke- 40 tercapai konsentrasi puncak (C
maks)
sebesar 0,8509 mcg/ml, pada konsentrasi 0,001 M menit ke- 5 tercapai
konsentrasi puncak (C
maks) sebesar 1,4211 mcg/ml dan pada konsentrasi
0,002 M menit ke- 15 tercapai konsentrasi puncak (C
maks5.2 Saran
) sebesar
0,3670 mcg/ml . Kemudian harga AUC pada konsentrasi 0,001 M ( 21,8809
mcg.menit/ml) lebih tinggi daripada konsentrasi 0,002 M ( 8,0365
mcg.menit/ml) dan konsentrasi 0,003 M ( 15,9268 mcg.menit/ml) yang
berbeda signi
fikan (α < 0,05), dengan menggu
nakan uji statistik ANOVA
dan LSD dengan nilai F hitung (15,470) > F tabel (5,14).
DAFTAR PUSTAKA
Aiache, J.M, Devissaguet, J., and Guyot-herman, A.M. (1993).
Farmasetika
Biofarmasi . Penerjemah : Widji Soerartri. Dr. Airlangga University Press.
Surabaya. hal. 32-42, 178-179 dan 247-248.
Anonim. Online 2002. WHO: List of Essential Drugs. 12
thed. revised April.
Ansel, C.H. (1989). Bentuk Sediaan Farmasi. Penerjemah: Farida Ibrahim.
Cetakan I. Edisi IV. Universitas Indonesia Press. Jakarta. hal. 112.
Armstrong, Frank B. (1995). Buku Ajar Biokimia. Cetakan I. Edisi ketiga.
Penerbit Buku Kedokteran EGC. Jakarta. hal. 105-107.
Barthe, L., Woodley, J., and Houin, G. (1999). Gastrointestinal Absorption of
Drugs : Methods and Studies. Fundamental and Clinical Pharmacology.
13: p. 154-168
Chowhan, Z.T., and Amaro, A.A (1977). Everted rat intestinal sacs as an in vitro
model for assessing absorptivity of new drugs. Journal of Pharmaceutical
Sciences 66. p. 1249-1253.
Connors, K.A. (1986). Chemical Stability of Pharmaceuticals. Second Edition.
John Wiley and Sons. New York. p. 474-475
Depkes RI. (1979). Farmakope Indonesia. Edisi III. Departemen Kesehatan RI.
Jakarta. hal. 262,648,672, 674,746 dan 755.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Departemen Kesehatan RI.
Jakarta. hal. 400-401.
Ganiswara, G.S. (1995). Farmakologi dan Terapi. Edisis IV. Universitas
Indonesia Press. Jakarta. hal. 4 dan 389-391.
Gennaro, A. R. (2000).
Remington : The Science and Practice of Pharmacy.
Volume II. International Student Edition. p. 1116.
Joshita, D. (1991). Laju Peruraian Furosemida Dalam Suasana Asam. Master
theses from Publisher.
Kooshapur, H., and Chaiden, M. (1999). Intestinal Transport of Human Insulin in
Rat. Medical Journal of Islamic Academic of Sciences. Vol 12. No.1.
Lachman, L., Lieberman, H. A., and Kanig, J. L. (1991). Teori dan Praktek
Farmasi Industri I dan III. Edisi III. Universitas Indonesia Press. Jakarta.
Hal. 482, 1516-1521
Lukmanto, H. (2003). Informasi Akurat Produk Farmasi di Indonesia. Edisi II.
Penerbit Buku Kedokteran EGC. Jakarta. hal. 588
Matondang, H. (2006).
Pengaruh pH Terhadap Laju Absorpsi Furosemida Pada
Jejunum Terbalik (Everted sac) Kelinci. Skripsi Departemen Farmasi
FMIPA USU. Medan.
Panggabean, J.I. (2006).
Pengaruh Perbedaan pH Terhadap Laju Absorpsi
Furosemida Pada Kantung Terbalik (Everted sac) Ileum Kelinci. Skripsi
Departemen Farmasi FMIPA USU. Medan.
Rowland, M., and Tozer, T. N. (1980).
Clinical Pharmacokinetics. Lea and
Febiger. Philadelphia. p. 16-17.
Shargel, L., and Yu, A.B.C. (1999). Biofarmasetika dan Farmakokinetika
Terapan. Edisi II. Airlangga University Press. Surabaya. hal. 85-94
Sinaga, K.R. (1995). Peningkatan Pelarutan dan Absorpsi Teofilina Berdasarkan
Pembentukan Dispersi Padat. Departemen Farmasi FMIPA USU Medan.
Siregar, M.K., (2006).
Pengaruh Perbedaan pH Terhadap Laju Absorpsi
Furosemida Pada Kantung Terbalik (Everted sac) Duodenum Kelinci.
Skripsi Departemen Farmasi FMIPA USU. Medan.
Siswandono, M.S. (1995). Kimia Medisinal. Cetakan I. Airlangga University
Press. Surabaya. hal. 222 dan 463.
Siswandono, M.S. (2000). Kimia Medisinal. Cetakan 2. Airlangga University
Press. Surabaya. hal. 127-130.
Sudjana. (1993). Pengantar Statistik. Gadjah Mada University Press. Surabaya.
hal.262 dan 312.
Syukri, Y. (2002). Biofarmasetika. Penerbit UII Press. Yogyakarta. Hal : 12-15.
Tamai, I., Ling, H. Y., Simanjuntak, M. T., Nishikido, J., and Tsuji, A. (1987).
Stereospecific Absorption and Degradation of Cephalexin. Journal
Pharmacy and Pharmacology. Vol 40. Page. 320-324.
Tjay, T. H., dan Kirana R. (2002). Obat-Obat Penting. Cetakan Kedua. Edisi
Kelima. PT Elexmedia Komputindo. Jakarta. Hal. 492.
Tanjung, D. (2001). Uji bioekivalensi Tablet Furosemida Generik dan Nama
Dagang. Skripsi Jurusan Farmasi FMIPA USU Medan.
Wolf, M.E. (1994). Asas-asas Kimia Medisinal. Edisi keempat. Gadjah Mada
University Press. Yogyakarta.
Lampiran 1.
Flowsheet Rancangan Percobaan
Furosemida
Sifat Fisikokimia
Serbuk hablur berwarna putih s/d kekuningan dan tidak berbau Praktis tidak larut dalam air pKa 3,9
Log P 0,74
Kelarutan 0,01 (mg/ml) Panjang gelombang 275 nm Titik lebur 206oC
Penelitian yang telah dilakukan antara lain :
1. Laju Penguraian Furosemida Dalam Suasana Asam (Joshita D.,1991) 2. Uji Bioekivalensi Tablet Furosemida Generik dan Nama Dagang
(Doharni Tanjung,2001)
3. Pengaruh Perbedaan pH Terhadap Laju Absorpsi Furosemida pada Duodenum Terbalik (Everted sac) Kelinci (Siregar,2006) 4. Pengaruh Perbedaan pH Terhadap Laju Absorpsi Furosemida pada
Jejunum Terbalik (Everted sac) Kelinci (Matondang,2006) 5. Pengaruh Perbedaan pH Terhadap Laju Absorpsi Furosemida pada
Ileum Terbalik (Everted sac) Kelinci (Panggabean, 2006)
absorpsi furosemida pada intestine kelinci paling tinggi dalam jejunum pada pH 6,0. Proses absorpsi yang terjadi selain difusi pasif kemungkinan juga terjadi mekanisme absorpsi lain
Faktor yang mempengaruhi transpor aktif antara lain :
1. Molekul (senyawa) ditranspor dari daerah yang mempunyai perbedaan potensial kimia yang rendah menuju yang lebih tinggi.
2. Hasil metabolisme senyawa akan mengganggu transpor.
3. Kecepatan transpor akan mengalami penjenuhan apabila konsentrasi dari senyawa meningkat. 4. Sistem transpor umumnya memperlihatkan struktur kimia spesifik.
5. Senyawa kimia dengan struktur yang hampir sama akan bekerja sebagai kompetitif inhibitor.
Pengaruh Perbedaan Konsentrasi Terhadap Laju Absorpsi Tablet Furosemida Generik Pada Jejunum Terbalik (Everted sac) Kelinci
Dilakukan melalui proses Uptake
Variasi waktu dan Konsentrasi tetap Variasi Konsentrasi dan Waktu tetap
Diukur secara Spektrofotometri UV (277,0 nm)
Diperoleh hasil V maks dan Km melalui Kurva Lineweaver -Burk
Diukur secara Spektrofotometri UV (277,0 nm)
Diperoleh Hasil AUC, C maks, dan t maks
Lampiran 2. Contoh Perhitungan Kadar Furosemida Baku
1. Pembakuan NaOH 0,1 N
No
Berat Kalium Biftalat (mg)
Volume Titrasi(ml)
1.
151
8,00
2.
152
7,95
3.
152
8,15
Perhitungan :
N
=
Biftalat
VxBEKalium
ftalat
mgKaliumBi
N
12
,
204
00
,
8
151
x
=
= 0,0924 N
N2
= 0,0936 N
N3
= 0,0913 N
Dihitung harga N
rata-rataNr
dan deviasi (d)
1
N
N
N
093
,
0
2
0936
,
0
0924
,
0
2
2
1
=
+
=
+
=
d
1100
%
0
,
6451
%
1
1
1
=
−
x
Nr
Nr
N
=
Nr
2= 0,0918 N dengan d
2Nr
= 0,5988 %
3
= 0,0924 N dengan d
3Maka, normalitas NaOH adalah harga N
= 1,24 %
rata-rata
dengan deviasi terkecil yaitu d
2=
2. Penetapan Kadar Furosemida Baku
No.
Berat Sampel (mg)
Volume titrasi (ml)
1.
606
19,75
2.
607
19,85
3.
605
19,80
Contoh Perhitungan :
Kadar (K) =
x
100
%
l
beratsampe
VxNxBE
K
1100
%
606
74
,
330
0918
,
0
75
,
19
x
Nx
mlx
=
= 98,9518 %
K2 = 99,2890 %
K3 = 99,3663 %
Dihitung harga K
rata-rataKr
dan deviasi (d)
1
99
,
1204
%
2
%
2890
,
99
%
9518
,
99
2
2
1
=
+
=
+
K
K
=
d
1100
%
0
,
1701
%
1
1
1
=
−
x
Kr
Kr
K
=
Kr
2= 99,1590 % dengan d
2Kr
= 0,2090 %
3
= 99,3276 % dengan d
3Maka, kadar furosemida baku adalah harga K
= 0,0389 %
rata-rata
dengan deviasi terkecil yaitu
Lampiran 3.
Flowsheet Pembuatan Larutan Induk Baku Furosemida dalam
Dapar Fosfat pH 6,0 Isotonis
Furosemida baku
Larutan Induk Baku Konsentrasi 500 mcg/ml
Dikeringkan pada suhu 105°C selama
3 jam
Ditimbang seksama 50,0 mg
Dimasukkan secara kuantitatif kedalam
labu tentukur 100 ml.
Ditambah tetes demi tetes NaOH 0,1 N
sampai serbuk larut.
Lampiran 4.
Flowsheet P
enentuan λ Maksimum Furosemida d
alam Dapar
Fosfat pH 6,0 Isotonis
Larutan Induk Baku
Panjang Gelombang
maksimum
Dipipet 0,75 ml
Lampiran 6.
Flowsheet Pembuatan Kurva Kalibrasi Furosemida Baku dalam
Dapa