PENGARUH MEDIA DASAR DAN KONSENTRASI 2-iP
PADA PERTUMBUHAN STEK MIKRO
TANAMAN ZAITUN (
Olea europaea
L.)
YURIKA DWI ANGGRAINY
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pengaruh Media Dasar dan Konsentrasi 2-iP pada Pertumbuhan Stek Mikro Tanaman Zaitun (Olea europaea L.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
YURIKA DWI ANGGRAINY. Pengaruh Media Dasar dan Konsentrasi 2-iP pada Pertumbuhan Stek Mikro Tanaman Zaitun (Olea europaea L.). Dibimbing oleh DIAH RATNADEWI dan ENCE DARMO JAYA SUPENA.
Zaitun (Olea europaea L.) adalah tanaman yang dapat tumbuh di banyak jenis tanah dan kondisi lingkungan serta mudah dalam perawatannya. Permintaan buah dan minyak zaitun di Indonesia cukup tinggi. Namun, budidaya zaitun di Indonesia masih sedikit karena pembibitan masih dilakukan secara tradisional. Teknik kultur jaringan menjadi alternatif dalam memproduksi bibit secara masal dalam waktu yang relatif singkat. Tujuan penelitian ini untuk mengetahui media dasar dan konsentrasi zat pengatur tumbuh 2-iP yang paling efektif untuk menumbuhkan tunas aksilar tanaman zaitun pada stek mikro secara in vitro. Tanaman diambil dari lapang kemudian disterilisasi dengan empat metode sterilisasi, selanjutnya ditanam di media Murashige and Skoog (MS) selama dua minggu fase pra-perlakuan. Kultur hidup yang didapatkan dari perlakuan sterilisasi dipindahkan ke media dasar perlakuan berupa Woody Plant (WP) dan Driver Kuniyuki for Walnut (DKW) dengan penambahan 2-iP pada konsentrasi 0, 1, 2, dan 4 ppm pada masing-masing media. Hasil penelitian menunjukkan bahwa media WP tanpa 2-iP merupakan media yang lebih efektif untuk pertumbuhan dan perkembangan tunas aksilar zaitun secara in vitro daripada media lainnya dan sterilisasi dengan penambahan biosida Plant Preservative Mixture (PPM) 0.02 % ke dalam media merupakan metode sterilisasi yang paling efektif.
Kata kunci: Olea europaea, stek mikro, 2-iP, mediaDKW, mediaWP ABSTRACT
YURIKA DWI ANGGRAINY. The Influence of Basic Medium and 2-iP Concentration on the Growth of Micro Cutting of Olive Plants (Olea europaea L.). Supervised by DIAH RATNADEWI and ENCE DARMO JAYA SUPENA.
Olive (Olea europaea L.) is a plant that can grow in many types of soil and environmental conditions as well as easy to maintain. The demand for fruit and olive oil is high. However, cultivation of olive in Indonesia is still limited and treated traditionally. Tissue culture techniques can be an alternative in producing seeds in large amount and in shorter time. The purpose of this study is to find the most effective basic medium and concentration of 2-iP for growing axillary bud of olive (Olea europaea L.) in vitro on the micro cutting. Olive explants were taken from the field and were sterilized with four sterilization methods. It was then planted in Murashige and Skoog (MS) media for two weeks that served as pre-treatment phase. The culture which survived from sterilization was moved to the basic media of Woody Plant (WP) and Driver Kuniyuki for Walnut (DKW) enriched with 2-iP at the concentration of 0, 1, 2, 4 ppm in each medium. The results of this study showed that WP medium without 2-iP was the most effective medium for in vitro growth and development of olive bud than the others and the sterilization with the addition of 0.02 % Plant Preservative Mixture (PPM) biocide in the medium was the most effective sterilization method.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
PENGARUH MEDIA DASAR DAN KONSENTRASI 2-iP
PADA PERTUMBUHAN STEK MIKRO
TANAMAN ZAITUN (
Olea europaea
L.)
YURIKA DWI ANGGRAINY
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2014 hingga Desember 2014 ini ialah kultur jaringan tanaman zaitun, dengan judul Pengaruh Media Dasar dan Konsentrasi 2-iP pada Pertumbuhan Stek Mikro Tanaman Zaitun (Olea europaea L.). Penelitian dilaksanakan di laboratorium penelitian Kultur Jaringan Tanaman Departemen Biologi, FMIPA IPB.
Terima kasih penulis ucapkan kepada Ibu Prof Dr Ir Diah Ratnadewi, DEA, Bapak Dr Ir Ence Darmo Jaya Supena, MSi, dan Bapak Dr. Berry Juliandi, MSi atas bimbingan, saran, dan ilmu yang bermanfaat selama melaksanakan penelitian dan penulisan karya ilmiah. Terima kasih penulis ucapkan kepada Abah, Ibu, kedua saudara dan keluarga atas segala doa dan dukungan yang telah diberikan. Di samping itu, penghargaan penulis sampaikan kepada Pak Hamka, Pak Faiz, dan Mbak Nuris selaku staf Start Up Center, Depok, Ibu Ucu, Mbak Dewi, Pak Kusmayadi dan Pak Asep selaku laboran di Kultur Jaringan Tanaman Departemen Biologi yang telah membantu selama penelitian. Ungkapan terima kasih juga disampaikan kepada Arif yang telah memberikan kasih sayangnya serta Efah, Nita, Hanin, Devi, Siti, Lia, Amel, Fia dan teman-teman Biologi 47 lainnya atas semangat dan kebersamaannya.
Semoga karya ilmiah ini dapat memberikan informasi yang berguna dan bermanfaat bagi perkembangan ilmu pengetahuan.
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
METODE 2
Waktu dan Tempat 2
Bahan dan Alat 2
Metode Penelitian 2
HASIL DAN PEMBAHASAN 3
Metode Sterilisasi 3
Induksi Tunas 5
SIMPULAN 9
DAFTAR PUSTAKA 9
LAMPIRAN 11
DAFTAR TABEL
Perbandingan prosedur metode sterilisasi pada kultur zaitun 3 Persentase kultur hidup dalam media praperlakuan berdasarkan metode
sterilisasi 4
Pertumbuhan tunas aksilar kultur zaitun minggu ke-8 6
Pertumbuhan daun kultur zaitun minggu ke-8 7
Pertumbuhan kalus bawah kultur zaitun minggu ke-8 8
DAFTAR GAMBAR
Kondisi kultur dalam media ½ MS tanpa ZPT setelah perlakuan
sterilisasi 4
Pertumbuhan tunas pada kultur induksi tunas stek mikro zaitun 6 Pertumbuhan kalus pada kultur induksi tunas stek mikro zaitun 8
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Zaitun (Olea europaea L.) adalah tanaman yang dapat tumbuh di banyak jenis tanah dan kondisi lingkungan serta mudah dalam perawatannya. Daerah Mediteranian merupakan lingkungan yang baik untuk pertumbuhan zaitun. Daerah ini menjadi pemasok zaitun hingga 95 % kebutuhan dunia. Buah zaitun dapat dikonsumsi secara langsung sebagai penyedap makanan, dan dapat diperas sehingga menghasilkan minyak. Minyak zaitun digunakan sebagai pengawet makanan, obat herbal dan bahan kosmetik (Wasito 2008). Selain itu, kayu pohon zaitun memiliki nilai seni dan dapat digunakan dalam pekerjaan konstruksi bangunan (Rugini et al. 2005).
Indonesia merupakan salah satu negara dengan permintaan tinggi akan buah dan minyak zaitun. Namun, budidaya tanaman zaitun di Indonesia masih sedikit karena pembibitan masih dilakukan secara tradisional. Cara tradisional yang digunakan yaitu stek dan pencangkokan yang diketahui masih kurang efektif dan membutuhkan waktu yang lama. Selain itu bibit tanaman zaitun sensitif terhadap perubahan lingkungan sehingga harus berhati-hati dalam pembibitannya. Penyediaan bibit yang sulit ini membuat Indonesia harus mengimpor bibit dari negara lain (Laoli dan Yohana 2012).
Teknik kultur jaringan menjadi alternatif dalam memproduksi bibit tanaman yang dapat dilakukan secara masal dalam waktu singkat. Selain itu, teknik kultur jaringan menjadi sarana reproduksi tanaman yang superior secara genetik dengan cara vegetatif (George dan Sherrington 1984). Stek mikro merupakan salah satu cara perkembangbiakan vegetatif yang dilakukan secara in vitro. Beberapa media yang pernah digunakan untuk kultur in vitro tanaman zaitun, yaitu Olive Medium (OM) (Roussos dan Pontikis 2002; Rugini et al. 2005; Sghir et al. 2005; Chaari-Rkhis et al. 2011), Driver Kuniyuki for Walnut (DKW) (Revilla et al. 1996; Roussos dan Pontikis 2002), Woody Plant Medium (WP) (Roussos dan Pontikis 2002) dan media Murashige and Skoog (MS) (Rugini et al. 2005; Chaari-Rkhis et al. 2011).
Setiap varietas tanaman zaitun membutuhkan media dasar dan zat pengatur tumbuh (ZPT) yang berbeda untuk pembiakan serta pertumbuhannya (Rugini 1984; Revilla et al. 1996). Oleh karena itu, penelitian ini perlu dilakukan untuk mendapatkan metode yang sesuai dalam perbanyakan tanaman zaitun terutama varietas Picudo yang akan digunakan. Metode yang sesuai dapat dilihat dari pengaruh konsentrasi sitokinin 2-iP yang diberikan dan media dasar yang digunakan yaitu WP dan DKW. Media WP digunakan karena merupakan media yang baik untuk tanaman berkayu (Lloyd dan Mc. Cown 1981) dan media DKW digunakan karena memiliki komposisi garam mineral yang lebih kompleks.
Tujuan Penelitian
2
METODE
Waktu dan Tempat
Penelitian dilaksanakan di Laboratorium Penelitian Kultur Jaringan Tanaman Departemen Biologi, FMIPA IPB pada bulan Januari hingga Desember 2014.
Bahan dan Alat
Bahan tanaman yang digunakan dalam penelitian ini adalah tanaman zaitun asal Spanyol varietas Picudo dengan ciri daun lebar dan panjang serta sisi atas daun berwarna hijau tua. Varietas ini dapat beradaptasi dengan tanah berkapur dan mampu bertahan dari kelebihan kelembaban dan kekeringan (Aparicio et al. 2014). Tanaman diambil langsung dari kebun Start Up Center, Depok. Batang tanaman zaitun dipotong 15 cm dari pucuk tunas apikal, kemudian dipotong 1 cm dengan satu nodus sebagai eksplan.
Bahan untuk media yang digunakan yaitu media MS (Murashige dan Skoog 1962), media DKW (Driver dan Kuniyuki 1984) dan media WP (Lloyd dan Mc. Cown 1981), ZPT 2-isopentenyl adenine (2-iP), sumber gula berupa sukrosa, biosida Plant Preservative Mixture (PPM), Agrept, Dithane-M45, alkohol 70 %, bayclin yang mengandung bahan aktif natrium hipoklorit (NaOCl 5.25 %), dan kloramfenikol.
Alat yang digunakan yaitu Laminar air flow cabinet (LAFC), autoklaf, cawan petri, botol kultur, alat diseksi, dan kamera digital.
Metode Penelitian Persiapan Bahan dan Sterilisasi Eksplan
3 Tabel 1 Perbandingan prosedur metode sterilisasi pada kultur zaitun
Bahan sterilan Metode 1 Metode 2 Metode 3 Metode 4
Eksplan yang tidak terkontaminasi dari percobaan metode sterilisasi 4 ditanam dalam botol kultur dengan perlakuan percobaan induksi tunas. Percobaan dilakukan secara faktorial (2x4) yang terdiri dari dua faktor. Faktor pertama adalah media dasar DKW dan WP, faktor kedua adalah ZPT 2-iP dengan konsentrasi 0, 1, 2, dan 4 ppm. Percobaan terdiri dari 8 satuan percobaan dengan 13 kali ulangan, 1 eksplan per botol kultur. Kultur dipelihara dengan pencahayaan 800-1000 lux selama 16 jam/hari, dan suhu ruangan inkubasi 25 ± 2º C.
Pengamatan dan Pengolahan Data
Pengamatan yang dilakukan yaitu, persentase kontaminasi, persentase kultur hidup, jumlah ruas dan panjang tunas aksilar, jumlah daun dan panjang daun, serta diameter kalus bagian bawah stek. Pengamatan dilakukan selama delapan minggu. Data dianalisis dengan uji Analysis of Variance (ANOVA) dengan selang kepercayaan 5 % dan apabila hasilnya berbeda nyata dilanjutkan dengan Uji
Duncan’s Multiple Range Test (DMRT).
HASIL DAN PEMBAHASAN
Metode Sterilisasi
4
Tabel 2 Persentase kultur hidup dalam media praperlakuan berdasarkan metode sterilisasi
Metode Total kultur (botol)*
Kultur hidup (botol)
Kultur mati/kontaminasi
(botol) Persentase hidup (%)
1 82 26 56 31.7
2 38 6 32 15.8
3 59 21 38 35.6
4 17 16** 1 94.1
Metode 1 : sterilisasi standar, Metode 2 : sterilisasi standar + HgCl2 0.1 %, Metode 3 : sterilisasi standar + kloramfenikol 500 mg/l, Metode 4 : sterilisasi standar + PPM 0.02 % dalam media, *terdapat 6-8 eksplan/botol, **digunakan dalam induksi tunas
Gambar 1 menunjukkan hasil yang didapatkan dari percobaan metode sterilisasi yang telah dilakukan pada fase pra-perlakuan. Gambar 1a merupakan kultur yang hidup dan Gambar 1b merupakan kultur yang mengalami kematian dan pencoklatan.
(a) (b)
Gambar 1 Kondisi kultur dalam media ½ MS tanpa ZPT setelah perlakuan sterilisasi, 2 MST; (a) kultur hidup, (b) kultur mati. Skala gambar (a) dan (b) 1 cm
Kultur yang mati disebabkan oleh kontaminasi mikroba, seperti bakteri dan/atau cendawan. Kultur yang terkontaminasi bakteri dicirikan dengan media berair dan membentuk gumpalan putih di media. Kultur yang terkontaminasi cendawan dicirikan dengan terbentuknya hifa putih pada eksplan. Selain disebabkan oleh kontaminasi mikroba, kultur yang mati juga dapat disebabkan oleh sifat sterilan yang terlalu kuat, yaitu HgCl2, dan kloramfenikol.
5 Kloramfenikol bekerja pada spektrum luas, efektif terhadap bakteri gram positif maupun gram negatif. Mekanisme kerja kloramfenikol melalui penghambatan terhadap biosintesis protein pada siklus pemanjangan rantai asam amino, yaitu dengan menghambat pembentukan ikatan peptida. Antibiotika ini mampu mengikat subunit ribosom 50-S sel mikroba target, akibatnya terjadi hambatan pembentukan ikatan peptida dan biosintesis protein. Kloramfenikol umumnya bersifat bakteriostatik, namun pada konsentrasi tinggi dapat bersifat bakterisid terhadap bakteri-bakteri tertentu (Susanti et al. 2009). Namun, penggunaan kloramfenikol dalam sterilisasi masih kurang efektif karena masih ada bakteri yang kembali muncul pada beberapa kultur. Bakteri yang kembali muncul menyebabkan kematian eksplan.
Penambahan biosida PPM dalam media pada percobaan ini sangat efektif menekan kontaminasi dengan tanpa menyebabkan kematian pada eksplan. Plant Preservative Mixture merupakan salah satu biosida berspektrum luas yang efektif mencegah atau mengurangi kontaminasi mikroba pada kultur jaringan tanaman. Biosida PPM dapat membunuh sel bakteri dan cendawan, mencegah pertumbuhan spora dan pada konsentrasi tinggi dapat mengurangi kontaminasi oleh mikroba endogen pada eksplan. Bahan aktif biosida PPM dapat terserap oleh dinding sel bakteri atau cendawan dan menghambat aktivitas enzim dalam siklus metabolisme utama, seperti siklus asam sitrat dan rantai transpor elektron. Biosida PPM juga dapat menghambat transpor monosakarida dan asam amino dari media ke sel bakteri atau cendawan (Niedz 1998). Biosida PPM dapat ditambahkan secara rutin pada media kultur jaringan untuk mengontrol kontaminasi bakteri dan cendawan yang juga berasal dari udara dan air secara efektif (Niedz 1998).
Pengaruh biosida PPM pada regenerasi tanaman bergantung pada spesies tanaman dan konsentrasi PPM yang ditambahkan. Penambahan biosida PPM pernah dilakukan pada kultur in vitro beberapa tanaman lainnya, seperti melon, petunia, dan tembakau untuk mengurangi ataupun mencegah kontaminasi yang disebabkan oleh bakteri dan cendawan (Compton dan Koch 2001). Konsentrasi biosida PPM yang diberikan pada media kultur akan mempengaruhi pembentukan dan jumlah tunas eksplan, seperti pada tanaman krisan yang tidak mengalami pertumbuhan tunas akibat penambahan biosida PPM (George dan Tripepi 2001). Beberapa tanaman hanya membutuhkan biosida PPM konsentrasi rendah (0.5-1 ml/l) untuk mengurangi atau mencegah kontaminasi (Compton dan Koch 2001; George dan Tripepi 2001; Rihan et al. 2012).
Induksi Tunas
Pertumbuhan stek mikro zaitun diawali dengan pertumbuhan tunas dari mata tunas (nodus) aksilar (Gambar 2a) kemudian memanjang membentuk ruas-ruas baru yang diikuti dengan pertumbuhan daun (Gambar 2b).
6
penelitian ini menunjukkan pemberian konsentrasi 2-iP yang tinggi tidak memberikan pengaruh terhadap pertumbuhan tunas aksilar, hal ini karena ketersediaan sitokinin endogen sudah mencukupi dan konsentrasi 2-iP secara eksogen terlalu tinggi sehingga pertumbuhan tunas aksilar menjadi terhambat (Lestari 2011). WP 1 memiliki rata-rata jumlah ruas terbanyak yaitu 2.3 (Tabel 3). Perlakuan WP 2 memiliki rata-rata panjang tunas aksilar tertinggi yaitu 3.9 mm (Tabel 3). Jumlah kultur untuk setiap perlakuan pada minggu pertama adalah 13.
(a) (b)
Gambar 2 Pertumbuhan tunas pada kultur induksi tunas stek mikro zaitun (a) pertumbuhan tunas pada WP 0 ppm, 1 MST ; (b) pertumbuhan tunas berdaun pada WP 0 ppm, 7 MST. Skala gambar (a) dan (b) 1 cm
Tabel 3 Pertumbuhan tunas aksilar kultur zaitun minggu ke-8
Perlakuan menunjukkan tidak ada kultur yang tumbuh atau hidup
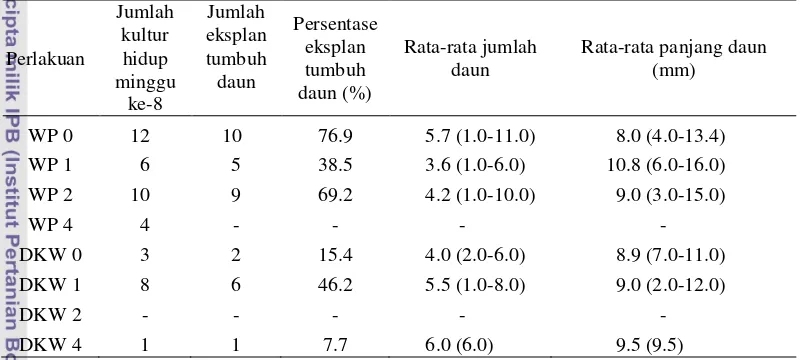
7 kegunaan dari sitokinin yaitu mendorong perluasan daun (Gaspar et al. 1996) sehingga perlakuan dengan konsentrasi 2-iP yang tidak terlalu tinggi sudah baik dalam perluasan daun.
Pada 78 kultur dari total kultur (75 %) terdapat kalus putih di bagian tunas aksilar (Tabel 5 dan Gambar 3a). Kalus muncul rata-rata pada minggu pertama setelah tanam diduga karena adanya pelukaan pada saat pemotongan daun sebelum penanaman. Keberadaan kalus ini untuk sebagian kultur tidak mempengaruhi pertumbuhan tunas aksilar tetapi untuk yang lainnya dapat menekan pertumbuhan tunas yang menyebabkan tunas menjadi coklat dan tidak berkembang.
Tabel 4 Pertumbuhan daun kultur zaitun minggu ke-8
Perlakuan menunjukkan tidak ada kultur yang tumbuh atau hidup
Selain itu, pertumbuhan kalus di bagian bawah stek juga terjadi pada semua perlakuan, kecuali DKW 2. Walaupun di perlakuan lain juga mengalami pertumbuhan kalus bawah pada stek, namun rata-rata diameter kalus terbesar dijumpai pada perlakuan WP dan DKW dengan konsentrasi 2-iP 4 ppm. Perlakuan WP dan DKW tanpa 2-iP memiliki ukuran diameter kalus paling kecil. (Tabel 5 dan Gambar 3b).
8
Kultur yang mengalami pencoklatan banyak dijumpai di perlakuan dengan kandungan ZPT 2-iP tinggi yaitu 4 ppm (WP dan DKW). Menurut Santoso dan Fatimah (2003), pencoklatan merupakan suatu karakter munculnya warna coklat atau hitam yang sering menyebabkan penghambatan pertumbuhan dan perkembangan eksplan. Pencoklatan ini terjadi akibat adanya pengaruh fisik atau biokimia (memar, pengupasan, pemotongan, serangan penyakit, atau kondisi lain yang tidak normal). Gejala pencoklatan umumnya merupakan tanda-tanda kemunduran fisiologi eksplan dan sering berakhir pada kematian eksplan.
Tabel 5 Pertumbuhan kalus bawah kultur zaitun minggu ke-8
Perlakuan menunjukkan tidak ada kultur yang tumbuh atau hidup
(a) (b)
9 memiliki kandungan tembaga (CuSO4) yang cukup tinggi sebagai hara mikro sedangkan media WP tidak mengandung tembaga.
Secara umum, dapat dikatakan bahwa walaupun persentase kultur yang menumbuhkan tunas aksilar cukup tinggi, untuk tujuan multiplikasi tunas masih belum memenuhi. Hal ini dikarenakan tunas hanya tumbuh dari mata tunas, tidak terdapat pertumbuhan tunas adventif. Selain itu, jumlah ruas yang dihasilkan sedikit karena ukuran tunas aksilar sangat pendek sehingga belum memungkinkan untuk mendapatkan stek generasi kedua. Pertumbuhan tunas aksilar juga sangat bervariasi yang ditunjukkan dengan data interval jumlah ruas (Tabel 3), jumlah daun dan panjang daun (Tabel 4).
SIMPULAN
Berdasarkan media yang digunakan, media WP tanpa ZPT 2-iP (0 ppm) menunjukkan hasil yang lebih baik dalam menginduksi tunas aksilar dan pertumbuhan daun walaupun belum dapat digunakan untuk multiplikasi tunas selanjutnya. Metode sterilisasi yang paling efektif dalam sterilisasi eksplan zaitun adalah metode 4, yaitu metode standar dengan penambahan biosida PPM 0.02 % dalam media.
DAFTAR PUSTAKA
Aparicio C, Urrestarazu M, Cordovilla MDP. 2014. Comparative physiological of salinity effects in six olive genotype. Hort Science 49 (7) : 901-904.
Chaari-Rkhis A, Maalej M, Drira N, Standardi A. 2011. Micropropagation of olive tree Olea europaea L.’Oueslati’. Turk J Agric For 35 : 403-412.
Compton ME, Koch JM. 2001. Influence of plant preservative mixture (PPM)™ on
adventitious organogenesis in melon, petunia, and tobacco. In vitro Cell 37 : 259-261.
Driver JA, Kuniyuki AH. 1984. In vitro propagation of paradox walnut rootstock. Hort Science 19 (4) : 507-509.
Gaspar T, Kevers C, Penel C, Greppin H, Reid DM, Thorpe TA. 1996. Plant hormones and plant growth regulator in plant tissue culture. In vitro Cell 32 : 272-289.
George EF, Sherrington PD. 1984. Plant Propagation by Tissue Culture. England (GB): Eastern Pr.
George MW, Tripepi RR. 2001. Plant preservative mixture™ can affect shoot regeneration from leaf explants of chrysanthemum, European birch, and rodhodendron. Hort Science 36 (4) : 768–769.
Hidayat Y. 2008. Keefektifan bahan sterilisasi dalam pengendalian kontaminasi pada pertumbuhan kultur zigotik Surian (Toona sinensis Roem). Wana Mukti For Res J 6 (1) : 35-44.
10
Lerch K. 1981. Tyrosinase kinetics: A semi-quantitative model of the mechanism of oxidation of monohydric and dihydric phenolic substrates. In Sigel H. (Ed.). Metal Ions in Biology System. New York (US): Marcel Dekker Inc. Lestari EG. 2011. Peranan zat pengatur tumbuh dalam perbanyakan tanaman
melalui kultur jaringan. J Agro Biogen 7 (1) : 63-68.
Lloyd G, Mc Cown B. 1981. Commercially feasible micropropagation of mountain laurel, Kalmia latifolia by use of shoot tip culture. Comb Proc Intl Plant Prop Soc 30: 421-427.
Murashige T, Skoog F. 1962. A revised medium for rapid growth and bio assasys with tobacco tissue culture. Physiol Plant 15: 473.
Niedz RP. 1998. Using isothiazolone biocides to control microbial and fungal contaminants in plant tissue cultures. Hortechnology 8 (4) : 598-601. Pauling L. 1955. College Chemistry. San Francisco (US) : WH Freeman.
Pelczar MJ, Chan ECS. 1988. Dasar-Dasar Mikrobiologi 2. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah. Jakarta (ID) : UI Pr. Terjemahan dari : Microbiology.
Pierik RLM. 1987. In Vitro Culture of Higher Plants. Netherlands (NL): Martinus Nijhoff Publ.
Purnamaningsih R. 2002. Regenerasi tanaman melalui embriogenesis somatik dan beberapa gen yang mengendalikannya. Bul Agro Bio 5(2) : 51-58.
Revilla MA, Pacheco J, Casares A, Rodriguez R. 1996. In vitro reinvigoration of mature olive trees (Olea europaea L.) through micrografting. In Vitro Cell & Dev Biol-Plant 32: 257-261.
Rihan HZ, Al-Issawi M, Al-Swedi F, Fuller MP. 2012. The effect of using PPM (plant preservative mixture) on the development of cauliflower microshoots and the quality of artificial seed produced. Hort Science 141 : 47–52 Roussos PA, Pontikis CA. 2002. In vitro propagation of olive (Olea europaea L.)
cv. Koroneiki. Plant Growth Reg 37 : 295-304.
Rugini E. 1984. In vitro propagation of some olive (Olea europaea sativa L.) cultivars with different root ability, and medium development using analytical data from developing shoots and embryos. Hort Science. 24 : 123-134.
Rugini E, Mencuccini M, Biasi R, Altamura MM. 2005. Olive (Olea europaea L.). Netherlands (NL): Springer.
Salisbury FB, Ross W. 1995. Plant Physiology. California (US): Wadsworth Publ. Santoso, Fatimah N. 2003. Kultur Jaringan Tanaman. Malang (ID): UMM Press. Sghir S, Chatelet P, Ouazzani N, Dosba F, Belkoura I. 2005. Micropropagation of
eight morrocan and french olive cultivars. Hort Science 40 (1) : 193-196. Susanti M, Isnaeni, Poedjiarti S. 2009. Validasi metode bioautografi untuk
determinasi kloramfenikol. J Kedokt Indones 1 (1) : 15-24.
Wasito H. 2008. Meningkatkan peran perguruan tinggi melalui pengembangan obat tradisional. Mimbar 26 (2) : 117-127.
11 Lampiran 1 Komposisi media dasar
Garam Mineral MS
mg/l
DKW mg/l
WP mg/l Hara makro
KNO3 1900 - -
NH4NO3 1650 1416 400
CaCl2.2H2O 440 112.5 96
MgSO4.7H2O 370 361.49 370
KH2PO4 170 265 170
K2SO4 - 1550 -
Ca(NO3)2.4H2O - 1367 57.6
FeSO4.7H2O 27.85 33.8 27.8
Na2EDTA.2H2O 37.25 45.5 37.3
Hara mikro
MnSO4.H2O 16.9 33.5 22.3
H3BO3 6.2 4.8 6.2
ZnSO4.7H2O 8.6 17 8.6
Na2MoO4.2H2O 0.25 0.39 0.25
CuSO4.5H2O 0.025 0.25 -
CoCl2.6H2O 0.025 - -
KI 0.83 - -
Vitamin
Tiamin-HCl 0.1 2 1
Piridoksin-HCl 0.5 - 0.5
Asam nikotianat 0.5 1 0.5
Myo-inositol 100 - 100
Asam amino
Glisin 2 2 -
Biotin - - 0.05
Asam folat - - 0.5
12
RIWAYAT HIDUP
Penulis dilahirkan di kota Palembang pada tanggal 25 Agustus 1992 yang merupakan putri kedua dari pasangan Bapak Rusman, ST dan Ibu Yuhana. Penulis lulus dari SMA Negeri 3 Palembang pada tahun 2010 dan melanjutkan pendidikan S1 di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
Semasa studi penulis pernah menjadi asisten Fisiologi Tumbuhan Dasar dan Kultur Jaringan Tanaman tahun 2014. Penulis melaksanakan Studi Lapangan tahun 2012 di Taman Nasional Gunung Gede Pangrango (TNGGP) dan kawasan Kebun Raya Cibodas, Jawa Barat dengan judul Persebaran Paku Sayur di Kawasan Gunung Gede Pangrango, yang dibimbing oleh Drs Hilda Akmal, MSi. Penulis juga berperan aktif menjadi bendahara dan anggota organisasi mahasiswa daerah Ikatan Keluarga Mahasiswa Bumi Sriwijaya pada tahun 2011-2014. Selain itu, berperan aktif juga dalam divisi Biosains, Himpunan Mahasiswa Biologi pada tahun 2011-2012 dan 2011-2012-2013 dan menjadi panitia pada beberapa acara di IPB.